PRODUODOPA infuusioneste, liuos 240 mg/ml+12 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Vaikuttavat aineet ja niiden määrät
1 ml sisältää 240 mg foslevodopaa ja 12 mg foskarbidopaa.
10 ml sisältää 2 400 mg foslevodopaa ja 120 mg foskarbidopaa.
Foslevodopa ja foskarbidopa ovat aihiolääkkeitä, ja 1 ml infuusioneste, liuosta vastaa noin 170 mg levodopaa ja noin 9 mg karbidopaa.
Apuaine, jonka vaikutus tunnetaan
Yksi millilitra Produodopaa sisältää noin 1,84 mmol (42,4 mg) natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Edennyt, levodopaan reagoiva Parkinsonin tauti, johon liittyy vaikeita motorisia tilanvaihteluja ja hyperkinesiaa tai dyskinesiaa, eivätkä saatavilla olevat Parkinsonin taudin lääkkeiden yhdistelmät tuota tyydyttäviä tuloksia.
Annostus ja antotapa
Annostus
Produodopa annetaan jatkuvana infuusiona ihon alle 24 tuntia vuorokaudessa.
Suositeltu Produodopa-infuusion aloitusnopeus määritetään muuntamalla levodopan päiväaikainen saanti levodopaekvivalenteiksi (LE), ja kasvattamalla sitä siten, että se vastaa 24 tunnin antoa (ks. kohta Hoidon aloittaminen). Annosta voidaan säätää ja tavoitteena on saavuttaa kliininen vaste, jolla maksimoidaan toiminnallinen on-aika ja minimoidaan off-vaiheiden kestoa ja määrää sekä on-vaiheita hankalan dyskinesian kanssa. Foslevodopan suurin suositeltu päiväannos on 6 000 mg (tai 25 ml Produodopaa, joka vastaa noin 4 260 mg levodopan vuorokausiannosta).
Produodopa korvaa levodopalääkkeet ja COMT (katekoli-O-metyylitransferaasi) -estäjät. Muihin luokkiin kuuluvia Parkinsonin taudin lääkkeitä voidaan tarvittaessa käyttää samanaikaisesti.
Hoidon aloittaminen
Produodopa-hoitoa saamaan valittujen potilaiden on pystyttävä ymmärtämään, miten antojärjestelmä toimii, ja pystyttävä käyttämään sitä joko itsenäisesti tai hoitavan henkilön avustuksella.
Potilas on koulutettava Produodopan ja antojärjestelmän käyttöön (ks. kohta Antotapa) ennen Produodopa-hoidon aloittamista ja tarvittaessa myös hoidon aloittamisen jälkeen.
Produodopa-hoidon aloittaminen jakautuu kolmeen vaiheeseen.
- Vaihe 1: Laske LE potilaan valveilla ollessa käyttämien levodopaa sisältävien lääkevalmisteiden perusteella.
- Vaihe 2: Määritä Produodopan infuusionopeus tunnissa.
- Vaihe 3: Määritä latausannos.
Vaihe 1: Laske LE potilaan valveilla ollessa käyttämien levodopaa sisältävien lääkevalmisteiden perusteella.
Kaikkien valveilla ollessa (tavallisesti 16 h/vrk) käytettyjen, levodopaa sisältävien lääkevalmisteiden levodopa muunnetaan levodopaekvivalenteiksi (LE) käyttämällä oikeaa muuntokerrointa (ks. taulukko 1), ja laskemalla ne sitten yhteen. Laskuissa otetaan huomioon vain levodopa ja COMT-estäjät. Laskuissa ei huomioida tarvittaessa käytettävää nopeavaikutteista levodopaa eikä muita Parkinsonin taudin lääkkeitä tai hoitoja eikä muulloin kuin valveilla ollessa otettavia lääkkeitä (esimerkiksi öisin otettava annos). Jos COMT-estäjä otetaan 24 tunnin aikana, LE-summa muunnetaan taulukon 1 korjauskertoimella COMT-estäjän annoksesta riippumatta.
Taulukko 1. Levodopaekvivalenttien (LE) laskeminen
| Levodopan lääkemuoto | Muuntokerroin |
| Välittömästi lääkettä vapauttavat muodot, mukaan lukien enteraalisesti annettava suspensio | 1 |
| Hitaasti tai hallitusti lääkettä vapauttavat muodot, depottabletita | 0,75 |
Mikäli käytössä on COMT-estäjä, edellisten perusteella laskettu LE-summa kerrotaan kertoimella 1,33a | |
a LD/CD/COMT-estäjä-yhdistelmävalmisteiden levodopan katsotaan olevan välittömästi vapautuvaa, ja se lisätään muista levodopalähteistä saatujen levodopaekvivalenttien summaan, ennen kuin summa kerrotaan COMT-estäjien korjauskertoimella (toisin sanoen yksittäistä levodopaekvivalenttia ei kerrota COMT-korjauskertoimella). CD = karbidopa, LD = levodopa, COMT = katekoli-O-metyylitransferaasi, LE = levodopaekvivalentit. | |
Vaihe 2: Määritä Produodopan infuusionopeus tunnissa.
Katso Produodopa-infuusion suositeltu aloitusnopeus taulukosta 2 vaiheessa 1 laskettujen levodopaekvivalenttien (LE) perusteella.
Taulukossa 2 esitetty Produodopan infuusionopeus tunnissa perustuu potilaan LE-saantiin tyypillisenä 16 tunnin valveillaoloaikana (LE16).
Jos vaiheessa 1 määritetty LE perustuu valveillaoloaikaan, joka on lyhyempi tai pidempi kuin 16 tuntia, LE on määritettävä vastaamaan 16 tunnin ajanjaksoa. LE määritetään vastaamaan 16 tunnin ajanjaksoa jakamalla vaiheessa 1 laskettu LE potilaalle tyypillisellä valveillaolotuntien määrällä ja kertomalla saatu tulos 16:lla. Tämän jälkeen Produodopa-infuusion suositeltu aloitusnopeus voidaan katsoa taulukosta 2. Vaihtoehtoisesti infuusion aloitusnopeus tunnissa voidaan laskea taulukon 2 alapuolella annetulla kaavalla, jossa X on potilaan valveillaolotuntien määrä vuorokaudessa.
Tässä vaiheessa määritetty infuusionopeus tunnissa asetetaan infuusion vakionopeudeksi pumpun asetuksia määritettäessä (katso lisätietoja pumpun käyttöohjeista).
Taulukko 2. Produodopa-infuusion suositeltu aloitusnopeus tunnissa
| LE16 (Kaikkien 16 tunnin valveillaoloaikana suun kautta otettavien LD-lääkevalmisteiden perusteella laskettu LE) | Produodopa-infuusion suositeltu aloitusnopeus tunnissa (ml/h)a ympärivuorokautisesti (24 h) annettuna |
| < 400 | 0,15 |
| 400–499 | 0,15–0,17 |
| 500–599 | 0,17–0,20 |
| 600–699 | 0,20–0,24 |
| 700–799 | 0,24–0,27 |
| 800–899 | 0,27–0,30 |
| 900–999 | 0,30–0,34 |
| 1 000–1 099 | 0,34–0,37 |
| 1 100–1 199 | 0,37–0,40 |
| 1 200–1 299 | 0,40–0,44 |
| 1 300–1 399 | 0,44–0,47 |
| 1 400–1 499 | 0,47–0,51 |
| 1 500–1 599 | 0,51–0,54 |
| 1 600–1 699 | 0,54–0,57 |
| 1 700–1 799 | 0,57–0,61 |
| 1 800–1 899 | 0,61–0,64 |
| 1 900–1 999 | 0,64–0,68 |
| 2 000–2 099 | 0,68–0,71 |
| 2 100–2 199 | 0,71–0,74 |
| 2 200–2 299 | 0,74–0,78 |
| 2 300–2 399 | 0,78–0,81 |
| 2 400–2 499 | 0,81–0,84 |
| 2 500–2 599 | 0,84–0,88 |
| 2 600–2 699 | 0,88–0,91 |
| 2 700–2 799 | 0,91–0,94 |
| 2 800–2 899 | 0,94–0,98 |
| 2 900–2 999 | 0,98–1,01 |
| 3 000–3 099 | 1,01–1,04 |
| > 3 100 | 1,04 |
a Infuusionopeus tunnissa lasketaan seuraavan kaavan mukaisesti, missä X on LE:n laskemisessa käytetty potilaan valveillaolotuntien määrä (esimerkiksi edellä olevassa taulukossa X = 16). Infuusionopeus tunnissa (ml/h) = [(LE ∙ 0,92 ∙ 1,41) ∕ 240] ∕ X Produodopa-infuusion suositellun aloitusnopeuden laskukaava perustuu seuraaviin oletuksiin:
LE = levodopaekvivalentit, LD = levodopa. | |
Vaihe 3: Määritä latausannos.
Jos Produodopa-hoito aloitetaan off-vaiheessa (tai jos pumppu on ollut pois käytöstä yli 3 tuntia), potilaan oireet saadaan nopeasti hallintaan antamalla latausannos välittömästi ennen jatkuvan infuusion aloittamista. Latausannos voidaan antaa joko käyttäen pumppua tai antamalla potilaalle peroraalisia välittömästi lääkeainetta vapauttavia karbidopa-levodopa-tabletteja.
Taulukossa 3 on pumppuun ohjelmoitava (katso lisätietoja pumpun käyttöohjeista) suositeltu Produodopa-latausannos (ml) ja sitä vastaava välittömästi lääkeainetta vapauttava levodopa-annos (mg) riippumatta samanaikaisesti annetusta dopadekarboksylaasin periferaalisesta inhibiittorista (esimerkiksi karbidopa ja benseratsidi).
Taulukko 3. Suositellun Produodopa-latausannoksen määrittäminen
| Pumppuun ohjelmoitava suositeltu latausannos (ml) | Arvioitu vastaava levodopa-annos (mg) |
| 0,6 | 100 |
| 0,9–1,2 | 150–200 |
| 1,5–1,8 | 250–300 |
| 2,0 | 350 |
| 0,1 ml Produodopaa sisältää 24 mg foslevodopaa (vastaa noin 17 mg levodopaa). Pumpulla annettava latausannos voi olla 0,1–3,0 ml, ja annos voidaan säätää 0,1 millilitran välein. | |
Optimointi ja ylläpito
Terveydenhuollon ammattilainen säätää infuusion aloitusnopeuden (ml/h) sellaiseksi, että saavutetaan mahdollisimman hyvä kliininen vaste. Infuusionopeus (ml/h) pidetään tasaisena koko 24 tunnin mittaisen vuorokausi-infuusion ajan. Tarvittaessa terveydenhuollon ammattilainen voi ohjelmoida ja ottaa käyttöön kaksi vaihtoehtoista infuusionopeutta (hidas/nopea). Infuusionopeuden säätöväli on 0,01 ml/h (vastaa noin 1,7 mg levodopaa tunnissa) eikä nopeus saa ylittää 1,04 ml/h (eli levodopan vuorokausiannos noin 4 260 mg (foslevodopan vuorokausiannos noin 6 000 mg)). Pumpun annosasetusten käyttörajoitukset estävät potilasta muuttamasta valmiiksi ohjelmoituja virtausnopeuksia ja lisäannostoiminnon asetuksia.
Terveydenhuollon ammattilaisen harkinnan mukaan Produodopaa voidaan käyttää monoterapiana tai tarvittaessa samanaikaisesti muiden Parkinson-lääkkeiden kanssa. Produodopa-infuusion aikana voidaan harkita, että muiden samanaikaisten Parkinson-lääkkeiden käyttöä vähennetään ja Produodopa-annosta säädetään vastaavasti. Produodopan käyttöä samanaikaisesti muiden levodopaa sisältävien tai synaptisen dopamiinin määrää merkittävästi säätelevien lääkevalmisteiden (esimerkiksi COMT-estäjät) kanssa ei ole tutkittu.
Vaihtoehtoiset virtausnopeudet
Pumppuun voi ohjelmoida potilaan käytettäväksi kaksi vaihtoehtoista infuusionopeutta (hidas/nopea). Terveydenhuollon ammattilainen ohjelmoi ja ottaa käyttöön vaihtoehtoiset infuusionopeudet, ja potilas voi valita näistä kahdesta nopeudesta paremmin aktiivisuustasoaan vastaavan nopeuden, esimerkiksi pienentää annosta yöksi tai lisätä annosta pitkään kestävän intensiivisemmän rasituksen ajaksi (katso lisätietoja pumpun käyttöohjeista).
Lisäannostoiminto
Jos terveydenhuollon ammattilainen on ottanut lisäannostoiminnon käyttöön, potilas voi annostella itse lisäannoksen jatkuvan infuusion aikana esiintyvän akuutin off-vaiheen oireiden lievittämiseksi. Lisäannoksen määräksi voi valita yhden viidestä vaihtoehdosta (ks. taulukko 4). Lisäannostoimintoa voi käyttää korkeintaan kerran tunnissa. Jos potilas tarvitsee 24 tunnin hoitojakson aikana viisi tai useampia lisäannoksia, on harkittava vakioinfuusionopeuden muuttamista. Terveydenhuollon ammattilainen voi ottaa tämän toiminnon käyttöön ja määrittää myös lisäannosten minimivälin. Potilas ei voi säätää näitä asetuksia (katso lisätietoja lisäannostoiminnon ohjelmoimisesta pumpun käyttöohjeesta).
Taulukko 4. Produodopan lisäannos
| Produodopa-annos (ml) | Levodopaekvivalentit (mg) |
| 0,10 | 17 |
| 0,15 | 25,5 |
| 0,20 | 34 |
| 0,25 | 42,5 |
| 0,30 | 51 |
Antotapa
Produodopa annetaan ihon alle, mieluiten vatsan alueelle, vähintään 5 cm:n etäisyydellä navasta. Käytä tuotteen valmistelussa ja antamisessa aseptista tekniikkaa. Infuusiosetti (jatkuvan infuusion kanyyli) saa olla samassa paikassa enintään 3 vuorokautta. Vaihda infuusiokanyylin kohta ja infuusiosetti vähintään kolmen vuorokauden välein. Uuden infuusiokohdan pitäisi olla vähintään 2,5 cm:n etäisyydellä edellisen 12 vuorokauden aikana käytetyistä kohdista. Produodopa-infuusiota ei saa antaa kohtaan, joka on arka, mustelmilla, punoittava tai tuntuu kosketettaessa kovalta. Produodopan annostelussa saa käyttää ainoastaan Vyafuser-pumppua (katso lisätietoja pumpun käyttöohjeista) käyttäen hyväksyttyjä steriilejä, kertakäyttöisiä infuusiotarvikkeita (ruisku, infuusiosetti ja injektiopullon adapteri). Potilas on koulutettava Produodopan ja antojärjestelmän (pumppu, injektionestepullo, injektiopullon adapteri, ruisku, infuusiosetti, kantotarvike, ladattava akku ja akkulaturi) käyttöön ennen Produodopa-hoidon aloittamista ja tarvittaessa myös hoidon aloittamisen jälkeen.
Farmakokineettisessä vaihtovuoroisessa tutkimuksessa saatiin vatsaan verrattuna lähes vastaava levodopa- ja karbidopa-altistus, kun Produodopaa annettiin käsivarteen tai reiteen (ks. kohta Farmakokinetiikka Imeytyminen). Pitkän aikavälin turvallisuutta ja tehoa ei ole arvioitu käsivarteen tai reiteen annettuna.
Lääkevalmisteen säilytys- ja käsittelyohjeet ovat kohdassa Säilytys. Injektiopullot ovat kertakäyttöisiä. Kun injektiopullon sisältö on siirretty ruiskuun, ruiskun sisältö on annettava 24 tunnin aikana. Käytetyt injektiopullot ja ruiskut hävitetään paikallisten säädösten mukaisesti. Ruiskut on hävitettävä terveydenhuollon ammattilaisen ohjeen mukaisesti siinäkin tapauksessa, että ruiskussa olisi vielä valmistetta jäljellä (ks. kohta Erityiset varotoimet hävittämiselle).
Hoidon keskeyttäminen
Produodopa-hoidon äkillistä keskeyttämistä tai annoksen nopeaa pienentämistä ilman vaihtoehtoisen dopaminergisen hoidon antamista pitäisi mahdollisuuksien mukaan välttää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Produodopan hetkellinen keskeyttäminen, esimerkiksi siksi aikaa, kun potilas käy suihkussa, ei edellytä toimenpiteitä. Jos hoito keskeytetään yli 1 tunnin ajaksi, infuusiosetti (infuusioletku ja kanyyli) on vaihdettava ja asetettava uuteen infuusiokohtaan. Jos infuusio on keskeytetty yli 3 tunnin ajaksi, potilas voi lievittää oireita nopeasti annostelemalla latausannoksen itse, mikäli terveydenhuollon ammattilainen on ottanut kyseisen toiminnon käyttöön.
Jos Produodopa-hoito keskeytetään pitkäksi aikaa (yli 24 tunniksi) tai lopetetaan, terveydenhuollon ammattilainen määrittää soveltuvan vaihtoehtoisen dopaminergisen hoidon (esimerkiksi suun kautta otettava levodopa/karbidopa). Produodopa-hoitoa voidaan jatkaa milloin tahansa noudattamalla hoidon aloittamisesta annettuja ohjeita (ks. kohta Annostus ja antotapa Hoidon aloittaminen).
Erityisryhmät
Produodopan farmakokinetiikkaa ei ole arvioitu erityisryhmillä. Produodopa on tarkoitettu Parkinsonin tautia sairastavien potilaiden hoitoon, joita hoidetaan suun kautta otettavalla vakiintuneella levodopa-annoksella. Eroja levodopa-altistuksessa peroraalisen ja ihon alle annon välillä ei pidetä kliinisesti merkittävinä, koska Produodopan määrä optimoidaan potilaalle hoidon alkaessa. Tästä syystä kovarianttivaikutuksilla ei odoteta olevan vaikutusta kliiniseen tehoon tai turvallisuuteen. Lisätietoja levodopan ja karbidopan farmakokinetiikasta erityisryhmissä on kohdassa Farmakokinetiikka.
Vasta-aiheet
Produodopaa ei saa käyttää potilailla, joilla on:
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
- ahdaskulmaglaukooma
- vaikea sydämen vajaatoiminta
- akuutti aivohalvaus
- vaikeita sydämen rytmihäiriöitä
- epäselektiivisten MAO:n estäjien ja selektiivisten MAO-A:n estäjien samanaikainen käyttö Produodopan kanssa on vasta-aiheista. Näiden MAO:n estäjien käyttö tulee lopettaa vähintään kaksi viikkoa ennen Produodopa-hoidon aloitusta. Produodopaa voidaan annostella samanaikaisesti selektiivisten MAO-B:n estäjien kanssa (esim. selegiliinihydrokloridi) valmistajan suosittelemalla annoksella (ks. kohta Yhteisvaikutukset)
- tilat, joissa adrenergisten lääkkeiden käyttö on vasta-aiheista, esim. feokromosytooma, hypertyreoosi, Cushingin oireyhtymä.
Koska levodopa voi aktivoida melanooman, Produodopaa ei pidä antaa potilaille, joilla on epäilyttäviä diagnosoimattomia iholeesioita tai tautihistoriassa melanooma.
Varoitukset ja käyttöön liittyvät varotoimet
Produodopaa koskevat varoitukset ja varotoimet
Useat alla olevista varoituksista ja varotoimista koskevat yleisesti levodopaa ja siten myös Produodopaa.
- Produodopaa ei suositella lääkeaineiden aiheuttamien ekstrapyramidaalioireiden hoitoon.
- Produodopa-hoitoa tulisi antaa varoen potilaille, joilla on vaikea sydän- ja verisuonitauti tai keuhkosairaus, keuhkoastma, munuais- tai maksasairaus tai endokrinologinen sairaus tai aiempi ulkustauti tai kouristuksia.
- Potilaiden, joilla on ollut sydäninfarkti ja on edelleen sydämen eteissolmukkeeseen liittyviä tai kammioperäisiä rytmihäiriöitä, sydämen toimintaa pitäisi seurata erityisen huolellisesti hoidon alussa annosmäärityksen ajan.
- Kaikkia Produodopa-hoitoa saavia potilaita tulisi seurata huolellisesti mielialamuutosten, masennuksen ja siihen liittyvän itsemurhavaaran ja muiden vakavien mielialahäiriöiden varalta. Varovaisuutta on noudatettava hoidettaessa potilaita, joilla on tai on ollut psykoosi. Hallusinaatioiden esiintyminen voi olla yleisempää potilailla, jotka ovat käyttäneet dopamiiniagonistia ja/tai muuta dopaminergista levodopaa sisältävää lääkettä, Produodopa mukaan lukien. Hoidon uudelleenarviointi on suositeltavaa, jos tällaisia oireita esiintyy.
- Psykoosilääkkeitä, jotka salpaavat dopamiinireseptoreita (erityisesti D2-reseptoriantagonistit), tulisi antaa hyvin varovaisesti samanaikaisesti Produodopan kanssa ja potilasta tulee seurata huolellisesti antiparkinsonismivaikutuksen heikkenemisen ja Parkinsonin taudin oireiden pahenemisen varalta (ks. kohta Yhteisvaikutukset).
- Produodopaa voidaan antaa varoen potilaille, joilla on krooninen avokulmaglaukooma, jos silmänpaine on hyvässä hallinnassa ja potilaan silmänpaineen muutoksia seurataan huolellisesti hoidon aikana.
- Produodopa voi aiheuttaa ortostaattista hypotensiota. Tämän vuoksi Produodopaa on annettava varoen potilaille, jotka käyttävät muita lääkkeitä, jotka voivat aiheuttaa ortostaattista hypotensiota (ks. kohta Yhteisvaikutukset).
- Levodopan käyttöön on liittynyt uneliaisuutta ja äkillisiä nukahtamisia potilailla, joilla on Parkinsonin tauti. Varovaisuus on siksi tarpeen ajettaessa autoa tai käytettäessä koneita (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
- Parkinsonin taudin lääkityksen äkillisen lopettamisen yhteydessä on havaittu neuroleptioireyhtymää muistuttava oireisto, johon liittyy lihasjäykkyys, kohonnut kehon lämpötila, mielialanvaihtelut (esim. agitaatio, sekavuustila, syvä tajuttomuus) ja seerumin kreatiinikinaasipitoisuuden suureneminen. Parkinsonin tautia sairastavilla potilailla on harvoin havaittu rabdomyolyysia neuroleptioireyhtymän seurauksena tai vaikeaa dyskinesiaa. Tästä syystä erityisesti psykoosilääkkeitä käyttäviä potilaita on tarkkailtava huolellisesti, jos levodopa/karbidopayhdistelmän annosta pienennetään äkillisesti tai hoito lopetetaan. Neuroleptioireyhtymää ja rabdomyolyysia ei ole raportoitu esiintyneen Produodopan käytön yhteydessä.
- Potilaita pitää seurata säännöllisesti impulssikontrollihäiriöiden kehittymisen varalta. Potilaiden ja heidän läheistensä / hoitajien on hyvä tietää, että impulssikontrollihäiriöihin liittyviä käytösoireita (kuten pelihimo, lisääntynyt libido ja hyperseksuaalisuus, pakonomainen tuhlaaminen tai ostelu, ahmiminen ja pakonomainen syöminen) voi esiintyä potilailla, jotka ovat käyttäneet dopamiiniagonistia ja/tai muuta dopaminergista levodopaa sisältävää lääkettä, Produodopa mukaan lukien. Hoidon uudelleenarviointi on suositeltavaa, jos tällaisia oireita esiintyy.
- Epidemiologisten tutkimusten mukaan Parkinsonin tautia sairastavilla potilailla on muuta väestöä korkeampi melanoomariski. On epäselvää, onko riski kohonnut itse Parkinsonin taudin vai muiden tekijöiden, kuten Parkinsonin tautiin käytettävien lääkkeiden seurauksena. Näin ollen potilaita ja heidän läheisiään / hoitajia suositellaan tarkkailemaan ihon muutoksia säännöllisesti, kun Produodopaa käytetään mihin tahansa käyttöaiheeseen. Ideaalitilanteessa ihotutkimukset olisi hyvä suorittaa määräajoin asianmukaisesti koulutetun henkilön (esim. ihotautilääkäri) toimesta.
- Dopamiinin säätelyhäiriöön liittyvä oireyhtymä (dopamiinidysregulaatio-oireyhtymä, DDS) on joillakin levodopa-karbidopahoitoa saaneilla potilailla todettu riippuvuushäiriö, joka johtaa valmisteen liialliseen käyttöön. Ennen hoidon aloittamista potilaita ja heistä huolehtivia henkilöitä on varoitettava mahdollisesta DDS:n kehittymisen riskistä.
- Produodopan annosta voidaan joutua pienentämään, jotta vältytään levodopan aiheuttamalta dyskinesialta.
- Produodopan pitkäaikaisessa käytössä suositellaan maksan, hematopoieesin, verenkiertoelimistön ja munuaisten toiminnan tutkimista säännöllisin väliajoin.
- Produodopa sisältää foskarbidopan hajoamistuotetta, hydratsiinia, joka saattaa olla genotoksinen ja todennäköisesti karsinogeeninen. Produodopan mediaani päivittäinen annos on noin 2 541 mg/vrk foslevodopaa ja 127 mg/vrk foskarbidopaa. Suositeltava päivittäinen enimmäisannos on 6 000 mg foslevodopaa ja 300 mg foskarbidopaa. Tällöin mediaani hydratsiinialtistus on 0,2 mg/vrk ja enintään 0,5 mg/vrk. Tämän hydratsiinialtistuksen kliinistä merkitystä ei tiedetä.
- Jos potilaalla on vaikeuksia antojärjestelmän käytössä, komplikaatioita voi esiintyä. Tällaisissa tapauksissa hoitajan (esim. sairaanhoitajan, lähihoitajan tai läheisen) on avustettava potilasta.
- Bradykinesian yllättävä tai asteittainen paheneminen voi viitata laitteen tukkeutumiseen mistä tahansa syystä, joka on selvitettävä.
- Polyneuropatiaa on raportoitu esiintyneen potilailla, jotka ovat saaneet levodopaa/karbidopaa sisältäviä valmisteita. Ennen hoidon aloittamista sekä määräajoin sen jälkeen on arvioitava, onko potilaalla ollut polyneuropatia, merkkejä siitä tai tunnettuja riskitekijöitä.
- Produodopaa saavilla potilailla on todettu infuusiokohdan tapahtumia (ks. kohta Haittavaikutukset). Riskin pienentämiseksi suositellaan noudattamaan lääkkeen käytössä aseptista tekniikkaa ja vaihtelemaan infuusiokohtaa usein. Potilailla, joilla raportoitiin kliinisissä tutkimuksissa infuusiokohdan reaktioita, todettiin myös infuusiokohdan tulehduksia. Tästä syystä suositellaan seuraamaan infuusiokohtaa huolellisesti vakavien reaktioiden ja tulehdusten varalta.
Produodopa sisältää natriumia
Yksi millilitra Produodopaa sisältää 42,4 mg (noin 1,84 mmol) natriumia, joka vastaa 2,1 % WHO:n suosittelemasta natriumin enimmäisvuorokausiannoksesta. Tämän lääkkeen suurin vuorokausiannos sisältää 54 % WHO:n suosittelemasta natriumin enimmäisvuorokausiannoksesta.
Produodopa sisältää runsaasti natriumia. Tämä on huomioitava erityisesti, jos potilas noudattaa vähäsuolaista ruokavaliota.
Yhteisvaikutukset
Produodopalla ei ole tehty interaktiotutkimuksia. Alla luetellut yhteisvaikutukset tunnetaan levodopa/karbidopayhdistelmien käytöstä yleisesti.
Produodopan ja seuraavien lääkkeiden yhteiskäytössä on noudatettava varovaisuutta:
Verenpainelääkkeet
Oireista posturaalista hypotensiota on esiintynyt, kun levodopan ja dekarboksylaasi-inhibiittorin yhdistelmä on lisätty verenpainelääkkeitä saavien potilaiden hoito-ohjelmaan. Verenpainelääkkeen annostusta voidaan joutua muuttamaan.
Masennuslääkkeet
Joissakin harvinaisissa tapauksissa trisyklisten masennuslääkkeiden (esimerkiksi amoksapiini ja trimipramiini) ja karbidopa/levodopavalmisteiden samanaikaiseen käyttöön on liittynyt haittavaikutuksia, mukaan lukien hypertensiota ja dyskinesiaa.
COMT-estäjät (esimerkiksi tolkaponi, entakaponi ja opikaponi)
COMT (katekoli-O-metyylitransferaasi) -estäjän ja Produodopan samanaikainen käyttö voi suurentaa levodopan biologista hyötyosuutta. Produodopa-annoksen muuttaminen voi olla tarpeen.
Muut lääkevalmisteet
Dopamiinireseptoriantagonistit (jotkut psykoosilääkkeet, esim. fentiatsiinit, butyrofenonit ja risperidoni sekä antiemeetit esim. metoklopramidi), bentsodiatsepiinit, isoniatsidi, fenytoiini ja papaveriini voivat heikentää levodopan tehoa. Potilaita, jotka ottavat näitä lääkkeitä samanaikaisesti Produodopan kanssa, pitäisi seurata huolellisesti terapeuttisen vasteen heikkenemisen varalta.
MAO:n estäjät ovat vasta-aiheisia Produodopan kanssa selektiivisiä MAO-B:n estäjiä (esim. selegiliinihydrokloridi) lukuun ottamatta. Produodopa-annosta tulee mahdollisesti pienentää, jos selektiivinen MAO-B:n estäjä lisätään potilaan hoitoon.
Selegiliinin ja levodopa/karbidopavalmisteen samanaikaiseen käyttöön voi liittyä vakavaa ortostaattista hypotensiota.
Amantadiinilla on synergistinen vaikutus levodopan kanssa ja se voi lisätä levodopan aiheuttamia haittavaikutuksia. Produodopa-annoksen muuttaminen voi olla tarpeen.
Sympatomimeetit (esimerkiksi adrenergiset lääkkeet, joita ovat mm. salbutamoli, fenyyliefriini, isoprenaliini ja dobutamiini mutta eivät rajoitu vain näihin) voivat lisätä levodopan kardiovaskulaarisia haittavaikutuksia.
Foskarbidopa on tunnistettu mahdolliseksi CYP1A2:n indusoriksi in vitro. Varovaisuutta on noudatettava käytettäessä samanaikaisesti Produodopaa ja herkkiä CYP1A2:n substraatteja (esim. fluvoksamiini, klotsapiini, kofeiini, teofylliini, duloksetiini ja melatoniini). Tämän löydöksen kliinistä merkitystä ei ole arvioitu kliinisissä lääkeaineinteraktiotutkimuksissa (DDI-tutkimuksissa).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja Produodopan käytöstä raskaana oleville naisille. Levodopalla ja karbidopalla tehdyissä eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Produodopan käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä, paitsi jos hyödyt äidille ovat suuremmat kuin mahdolliset riskit sikiölle.
Imetys
Levodopa ja mahdollisesti levodopan metaboliitit erittyvät ihmisen rintamaitoon. On näyttöä, että maidon eritys vähenee levodopahoidon aikana.
Ei tiedetä, erittyvätkö karbidopa tai sen metaboliitit ihmisen rintamaitoon. Eläinkokeissa karbidopan on todettu erittyvän rintamaitoon.
Ei ole olemassa riittävästi tietoa Produodopan tai sen metaboliittien vaikutuksista vastasyntyneisiin/imeväisiin. Rintaruokinta on lopetettava Produodopa-hoidon ajaksi.
Hedelmällisyys
Rotilla tehdyissä lisääntymistutkimuksissa levodopalla/karbidopalla ei havaittu olevan hedelmällisyyteen liittyviä vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Produodopalla voi olla huomattava vaikutus ajokykyyn ja koneidenkäyttökykyyn. Levodopa ja karbidopa voivat aiheuttaa huimausta ja ortostaattista hypotensiota. Varovaisuus on tästä syystä tarpeen autoa ajettaessa tai koneita käytettäessä. Jos Produodopaa saavalla potilaalla esiintyy uneliaisuutta ja/tai äkillisiä nukahtamiskohtauksia, tulee häntä neuvoa pidättäytymään autolla ajamisesta tai sellaisista toimista, joissa valppauden heikentyminen saattaa aiheuttaa vakavien vammojen tai kuoleman riskin potilaalle itselleen tai muille (esim. koneiden käyttö), kunnes tällaiset toistuvat kohtaukset ja uneliaisuus ovat hävinneet (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitetut haittavaikutukset (≥ 10 %) kaikissa vaiheen 3 tutkimuksissa Produodopalle altistuneilla potilailla olivat infuusiokohdan tapahtumat (infuusiokohdan punoitus, infuusiokohdan ihonalaisen sidekudoksen tulehdus, infuusiokohdan kyhmy, infuusiokohdan kipu, infuusiokohdan turvotus, infuusiokohdan reaktio ja infuusiokohdan infektio), hallusinaatiot, kaatuminen ja ahdistuneisuus.
Haittavaikutustaulukko
Taulukossa 5 on lueteltu syy-yhteydestä riippumatta MedDRA-elinjärjestelmäluokittain haittavaikutukset, joita on raportoitu kaikissa vaiheen 3 tutkimuksissa, joissa potilaat ovat altistuneet Produodopalle (379 potilasta, joiden kokonaisaltistus oli 414,3 henkilövuotta, 230 tutkittavaa, joiden altistus kesti ≥ 6 kuukautta, 204 tutkittavaa, joiden altistus kesti ≥ 12 kuukautta) tai tieto suoleen annettavasta Duodopa-geelistä perustuen esiintyvyyteen annetun hoidon aikana. Haittavaikutusten esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000).
Taulukko 5. Haittavaikutustaulukko
Elinjärjestelmä | Esiintyvyys | Haittavaikutus |
Infektiot | Hyvin yleinen | Infuusiokohdan ihonalaisen sidekudoksen tulehdus Infuusiokohdan infektio Virtsatieinfektiob |
Yleinena | Infuusiokohdan absessi | |
Veri ja imukudos | Yleinen | Anemiab |
Melko harvinainen | Leukopeniab Trombosytopeniab | |
Immuunijärjestelmä | Tuntematon | Anafylaktinen reaktiob,e |
Aineenvaihdunta ja ravitsemus | Yleinen | Ruokahalun heikentyminen |
Psyykkiset häiriöt | Hyvin yleinen | Ahdistuneisuus Masennus Hallusinaatiotc |
Yleinen | Epänormaalit unetb Agitaatiob Sekavuustila Harhaluulot Impulssikontrollin häiriöt Unettomuus Paranoia Psykoottiset häiriöt Nukahtamiskohtauksetb Unihäiriöb Itsemurha-ajatukset | |
Melko harvinainen | Toteutunut itsemurhab Dementiab Ajan ja paikan tajun hämärtyminenb Dopamiinin säätelyhäiriöön liittyvä oireyhtymä Euforinen mielialab Pelkob Lisääntynyt libidob Painajaisetb Itsemurhayritysb | |
Harvinainen | Poikkeava ajattelub | |
Hermosto | Yleinen | Kognition häiriöt Huimaus Asentohuimaus Dyskinesia Dystonia Päänsärky Tuntoaistin heikentyneisyys On-off-episodit Parestesia Polyneuropatiad Uneliaisuus Synkopee Vapinab |
Melko harvinainen | Ataksiab Kouristuksetb Kävelyhäiriöb | |
Silmät | Melko harvinainen | Ahdaskulmaglaukoomab Luomikouristusb Kaksoiskuvatb Iskeeminen optikusneuropatiab Näön hämärtyminenb |
Sydän | Yleinen | Epäsäännöllinen sydämen rytmib |
Melko harvinainen | Palpitaatio | |
Verisuonisto | Yleinen | Hypertensio Hypotensio Ortostaattinen hypotensio |
Melko harvinainen | Laskimotulehdusb | |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus Suunielun kipub |
Melko harvinainen | Dysfoniab | |
Harvinainen | Poikkeava hengitysb | |
Ruoansulatuselimistö | Yleinen | Vatsan pingottuminenb Vatsakipu Ummetus Ripuli Suun kuivuminen Makuhäiriöb Dyspepsiab Nielemishäiriöb Ilmavaivatb Pahoinvointi Oksentelu |
Melko harvinainen | Lisääntynyt syljeneritysb | |
Harvinainen | Narskutusb Syljen värjäytyminenb Kielikipub Hikkab | |
Iho ja ihonalainen kudos | Yleinen | Kontakti-ihottumab Liikahikoilub Kutina Ihottuma |
Melko harvinainen | Hiustenlähtöb Punoitusb Nokkosihottumab | |
Harvinainen | Hien värjäytyminenb Melanoomab | |
Luusto, lihakset ja sidekudos | Yleinen | Lihasspasmit Niskakipub |
Munuaiset ja virtsatiet | Yleinen | Virtsainkontinenssi Virtsaumpi |
Melko harvinainen | Kromaturiab | |
Harvinainen | Priapismib | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Infuusiokohdan eryteema Infuusiokohdan reaktio Infuusiokohdan kyhmy Infuusiokohdan turvotus Infuusiokohdan kipu |
Yleinena | Voimattomuus Uupumus Infuusiokohdan mustelma Infuusiokohdan kesiminen Infuusiokohdan ekstravasaatio Infuusiokohdan hematooma Infuusiokohdan verenvuoto Infuusiokohdan kovettuma Infuusiokohdan inflammaatio Infuusiokohdan ärtyminen Infuusiokohdan muhkura Infuusiokohdan näppylä Infuusiokohdan kutina Infuusiokohdan ihottuma Infuusiokohdan turvotus Pahoinvointi Perifeerinen turvotus Kipub | |
Melko harvinainen | Rintakipub | |
Tutkimukset | Yleinen | Aminohappopitoisuuden nousu (metyylimalonihapon pitoisuuden nousu)b Veren homokysteiinin pitoisuuden nousub B6-vitamiinin puutos B12-vitamiinin puutosb Painon lasku Painon nousub |
Vammat, myrkytykset ja hoitokomplikaatiot | Hyvin yleinen | Kaatuminen |
a Infuusiokohdan tapahtumiin kuuluvat yleiset haittavaikutukset lueteltu, jos ≥ 2 %. b Nämä haittavaikutukset tunnistettiin suoleen annettavalla Duodopa-geelillä lääkkeeseen liittyneiksi tapahtumiksi. Kyseisiä tapahtumia ei kuitenkaan pidetty Produodopan haittavaikutuksina. c Hallusinaatioihin kuuluvat hallusinaatiot, näköhallusinaatiot, kuulohallusinaatiot, hajuhallusinaatiot, kosketusaistiin liittyvät hallusinaatiot ja sekatyyppiset hallusinaatiot. d Polyneuropatioihin kuuluvat perifeerinen neuropatia, polyneuropatia, heikentynyt värinäaisti, perifeerinen sensorinen neuropatia, tuntohäiriö ja tunnottomuus. e Perustuu markkinoille tulon jälkeisiin tietoihin. | ||
Valikoitujen haittavaikutusten kuvaus
Infuusiokohdan tapahtumat
Vaiheen 3 tutkimuksissa yleisimmät Produodopaan liittyvät haittatapahtumat olivat infuusiokohdan reaktiot (77,6 %, N = 294) ja infuusiokohdan infektiot (41,4 %, N = 157). Ihon alle annettavan infuusion yhteydessä yleisesti havaittuja infuusiokohdan tapahtumia, kuten infuusiokohdan reaktioita ja infektioita, todettiin myös Produodopan kliinisissä tutkimuksissa. Suurin osa infuusiokohdan tapahtumista olivat ei-vakavia, olivat vaikeusasteeltaan lieviä tai keskivaikeita, ja ne paranivat spontaanisti tai esimerkiksi antibioottihoidolla ja/tai puhkaisemalla ja tyhjentämällä eritteet. Kolmella potilaalla infuusiokohdan infektio johti sairaalahoitoa vaatineeseen sepsikseen. Infuusiokohdan mahdollisia ihomuutoksia on seurattava mahdollisten infektioiden varalta, esimerkiksi ihon punoitus yhdistettynä kuumotukseen, turvotukseen, kipuun ja värin muuttumiseen ihoa painettaessa. Lääkkeen käytössä on noudatettava aseptista tekniikkaa, ja mikäli ihomuutoksia havaitaan, infuusiokohtaa on vaihdettava useammin kuin kolmen vuorokauden välein käyttäen aina uutta infuusiosettiä. Uuden infuusiokohdan on oltava vähintään 2,5 cm:n etäisyydellä edellisen 12 vuorokauden aikana käytetyistä kohdista.
Laboratorioarvot: Seuraavia poikkeavia laboratorioarvoja on raportoitu levodopa/karbidopahoidon yhteydessä, joten ne on huomioitava hoidettaessa potilaita Produodopalla: kohonnut ureatyppi, alkalinen fosfataasi, S-ASAT, S-ALAT, LDH, bilirubiini, verensokeri, kreatiniini, virtsahappo ja positiivinen Coombsin koe, hemoglobiinin ja hematokriitin lasku. Leukosyyttejä, bakteereja ja verta on raportoitu esiintyneen virtsassa. Levodopa/karbidopa ja täten Produodopa voi aiheuttaa virheellisesti positiivisen tuloksen liuskamenetelmällä tehdyssä ketonuriamäärityksessä: virtsanäytteen keittäminen ei muuta tulosta. Glukoosioksidaasimenetelmien käyttö voi antaa virheellisen negatiivisen tuloksen glukosuriamäärityksessä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA.
Yliannostus
Produodopan yliannostustilanteessa infuusio keskeytetään välittömästi. Produodopan akuutin yliannostuksen hoito on samanlainen kuin levodopan akuutin yliannostuksen hoito; pyridoksiini ei kuitenkaan ole tehokas mitätöimään Produodopan vaikutuksia. EKG-seuranta on aloitettava ja potilasta on tarkkailtava huolellisesti mahdollisten rytmihäiriöiden kehittymisen varalta. Tarpeen vaatiessa on annettava sopivaa rytmihäiriöhoitoa. Potilasta on tarkkailtava myös hypotension varalta. On myös otettava huomioon mahdollisuus, että potilas on ottanut Produodopan lisäksi muita lääkkeitä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Parkinsonismilääkkeet, foslevodopa ja dekarboksylaasin estäjä, ATC-koodi: N04BA07
Vaikutusmekanismi
Produodopa (foslevodopa/foskarbidopa) 240 mg/12 mg millilitrassa infuusionestettä on levodopamonofosfaattia ja karbidopamonofosfaattia (suhde 20:1) sisältävä aihiolääkeyhdistelmä, joka on tarkoitettu annettavaksi ihon alle jatkuvana infuusiona 24 tuntia/vrk edenneessä Parkinsonin taudissa, kun potilaan oireet eivät ole lievittyneet riittävästi nykyisellä lääkehoidolla. Foslevodopa ja foskarbidopa muuttuvat levodopaksi ja karbidopaksi in vivo. Levodopa lievittää Parkinsonin taudin oireita siten, että se muuttuu dekarboksylaation kautta dopamiiniksi aivoissa. Karbidopa, joka ei läpäise veri-aivoestettä, estää levodopan dekarboksylaatiota dopamiiniksi aivojen ulkopuolella, jolloin enemmän levodopaa jää kuljetettavaksi aivoihin ja muutettavaksi dopamiiniksi.
Farmakodynaamiset vaikutukset
Levodopan Cmax, AUC ja näiden vaihtelun määrä olivat samankaltaisia käytettäessä ihon alle annettavaa Produodopaa ja suoleen annettavaa Duodopaa, mikä tukee valmisteiden tehon samankaltaisuutta. Koska Produodopalla saavutetaan samat levodopapitoisuudet kuin Duodopalla, myös Produodopa vähentää motorisia tilanvaihteluita ja pidentää on-aikaa edennyttä Parkinsonin tautia sairastavilla potilailla, jotka reagoivat levodopahoitoon. Motoriset tilanvaihtelut ja hyperkinesia tai dyskinesia vähenevät, koska levodopan plasmapitoisuudet säilyvät vakaina yksilöllisen terapeuttisen ikkunan rajoissa. Motorisiin tilanvaihteluihin (on-vaihe) kohdistuva hoitovaikutus saavutetaan usein jo ensimmäisenä hoitopäivänä.
Kliininen teho ja turvallisuus
Tutkimukset suoleen annettavalla Duodopa-geelillä
Suoleen annettavan Duodopa-geelin teho vahvistettiin kahdessa tutkimusasetelmaltaan identtisessä 12 viikon pituisessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, kahdella lumeella ja rinnakkaisryhmissä toteutetussa aktiivikontrolloidussa monikeskustutkimuksessa, joissa suoleen annettavan Duodopa-geelin tehoa, turvallisuutta ja siedettävyyttä verrattiin 100/25 mg levodopa/karbidopatabletteihin. Tutkimuksiin osallistui edennyttä Parkinsonin tautia sairastavia potilaita, jotka reagoivat levodopahoitoon ja joilla oli sitkeitä motorisia tilanvaihteluita optimoidusta peroraalisesta levodopa/karbidopalääkityksestä ja muusta saatavilla olevasta optimoidusta Parkinson-lääkityksestä huolimatta. Mukaan otettiin yhteensä 71 potilasta. Tutkimusten tulokset yhdistettiin ja niistä tehtiin yhteinen analyysi.
Ensisijainen tehon päätetapahtuma oli Parkinson’s Disease Diary -päiväkirjan (PD-päiväkirjan) tietoihin perustuva vakioidun off-ajan muutos lähtötilanteesta päätetapahtumaan. Analyyseissä käytettiin tuoreinta havaintoa (Last Observation Carried Forward, LOCF). Pienimmän neliösumman keskiarvojen ero oli Duodopa-ryhmässä tilastollisesti merkitsevästi parempi (taulukko 6).
Ensisijaista päätetapahtumaa koskevia tuloksia tuki myös toistomittausten sekamallin (MMRM) analyysi, jossa arvioitiin muutosta lähtötilanteen ja kunkin lähtötilanteen jälkeisen tutkimuskäynnin välillä. Tässä off-ajan analyysissä todettiin, että Duodopa-ryhmän potilaiden tilanne parani viikon 4 kohdalla tilastollisesti merkitsevästi enemmän kuin aktiivista vertailuvalmistetta saaneiden tilanne ja että tulosten paranema oli tilastollisesti merkitsevä viikoilla 8, 10 ja 12.
Off-ajan muutoksen lisäksi todettiin, että ilman hankalia dyskinesioita vietetyn päivittäisen vakioidun on-ajan keskiarvon kohdalla pienimmän neliösumman keskiarvoissa oli tilastollisesti merkitsevä ero, kun ryhmää, joka sai Duodopa-geeliä suoleen annettuna, verrattiin aktiivista vertailuvalmistetta saaneeseen ryhmään PD-päiväkirjan tietojen pohjalta. Lähtötilanteen arvot kirjattiin kolme päivää ennen satunnaistamista ja 28 päivää peroraalisen hoidon standardoinnin jälkeen.
Taulukko 6. Off-ajan ja ilman hankalia dyskinesioita vietetyn on-ajan muutos lähtötilanteesta päätetapahtumaan
| Hoitoryhmä | N | Lähtötilanteen keskiarvo (SD) (h) | Päätetapahtuman keskiarvo (SD) (h) | Muutoksen (h) pienimmän neliösumman keskiarvo (SE) | Eron (h) pienimmän neliösumman keskiarvo (SE) | p-arvo |
| Ensisijainen muuttuja: off-aika | ||||||
| Aktiivinen vertailuvalmistea | 31 | 6,90 (2,06) | 4,95 (2,04) | -2,14 (0,66) | ||
| Duodopa-geeli suoleen | 35 | 6,32 (1,72) | 3,05 (2,52) | -4,04 (0,65) | -1,91 (0,57) | 0,0015 |
| Tärkein toissijainen muuttuja: on-aika ilman hankalia dyskinesioita | ||||||
| Aktiivinen vertailuvalmiste | 31 | 8,04 (2,09) | 9,92 (2,62) | 2,24 (0,76) | ||
| Duodopa-geeli suoleen | 35 | 8,70 (2,01) | 11,95 (2,67) | 4,11 (0,75) | 1,86 (0,65) | 0,0059 |
SD = keskihajonta; SE = keskivirhe a. Aktiivinen vertailuvalmiste, suun kautta otettavat 100/25 mg levodopa/karbidopatabletit (Sinemet-tabletit kapselissa) | ||||||
Kun muut toissijaiset tehon päätetapahtumat analysoitiin hierarkkisessa testausjärjestyksessä, todettiin, että Duodopa-geeli suoleen tuotti tilastollisesti merkitsevästi paremmat tulokset kuin peroraalinen levodopa/karbidopahoito, kun mittareina käytettiin Parkinson’s Disease Questionnaire ‑lomakkeen (PDQ-39) Summary Index ‑yhteispisteitä (mittaa Parkinsonin tautiin liittyvää elämänlaatua), lääkärin yleisarviopisteitä (Clinical Global Impression, CGI-I) ja Unified Parkinson’s Disease Rating Scale ‑mittarin (UPDRS) osan II pisteitä (päivittäistoiminnot). PDQ-39 Summary Index ‑yhteispisteet pienenivät Duodopa-geeliä suoleen saaneiden ryhmässä 10,9 pistettä lähtötilanteesta viikolla 12. Muissa toissijaisissa päätetapahtumissa (UPDRS-mittarin osan III pisteet, EQ-5D (EuroQol 5-dimensions Questionnaire) Summary Index ‑lomakkeen yhteispisteet ja ZBI (Zarit Burden Interview) ‑kokonaispisteet) ei tapahtunut hierarkkisen testauksen mukaan tilastollisesti merkitsevää muutosta.
Duodopa-hoidon pitkäaikaisturvallisuutta ja siedettävyyttä arvioitiin avoimessa, yhden hoitohaaran vaiheen 3 monikeskustutkimuksessa, joka kesti 12 kuukautta ja johon osallistui 354 potilasta. Tutkimuspopulaationa olivat edennyttä Parkinsonin tautia sairastavat, levodopaan reagoivat potilaat, joilla oli motorisia tilanvaihteluita, vaikka saatavilla oleva Parkinson-lääkitys oli optimoitu. Päivittäisen vakioidun off-ajan keskiarvo lyheni 4,44 tuntia lähtötilanteen ja päätetapahtuman välillä (lähtötilanteessa 6,77 h, päätetapahtuman kohdalla 2,32 h), ja on-aika ilman hankalia dyskinesioita lisääntyi vastaavasti 4,8 tuntia.
Suoleen annetun Duodopa-geelin vaikutusta dyskinesiaan verrattuna optimoituun lääkehoitoon arvioitiin avoimessa satunnaistetussa vaiheen 3 monikeskustutkimuksessa, joka kesti 12 viikkoa ja johon osallistui 61 potilasta. Tutkimuspopulaationa olivat edennyttä Parkinsonin tautia sairastavat, levodopaan reagoivat potilaat, joilla oli motorisia tilanvaihteluita, joita ei pystytty riittävän hyvin hallitsemaan optimoidulla lääkehoidolla, ja joiden yhteisen dyskinesian arviointiluokituksen (UDysRS, Unified Dyskinesia Rating Scale) kokonaispistemäärä oli lähtötilanteessa ≥ 30. UDysRS-kokonaispistemäärän muutos (ensisijainen tehon päätetapahtuma) lähtötilanteesta viikkoon 12 mennessä osoitti tilastollisesti merkitsevän pienimmän neliösumman keskiarvojen eron (–15,05; p-arvo < 0,0001) Duodopa-hoitoa saaneen ryhmän hyväksi optimoitua lääkehoitoa saaneeseen ryhmään verrattuna. Kun toissijaiset tehon päätetapahtumat analysoitiin ennalta määritetyssä testausjärjestyksessä, todettiin, että Duodopa tuotti tilastollisesti merkitsevästi paremmat tulokset verrattuna optimoituun lääkehoitoon PD-päiväkirjan pohjalta arvioidussa on-ajassa ilman vaikeaa dyskinesiaa, Parkinson’s Disease Questionnaire-8 ‑lomakkeen (PDQ-8) Summary Index -yhteispisteissä, lääkärin arviossa potilaan voinnin muutoksesta (Clinical Global Impression Change, CGI-C) ja UPDRS-mittarin osan II pisteissä, sekä PD-päiväkirjan pohjalta arvioidussa off-ajassa. UPDRS-mittarin osan III pisteissä ei havaittu tilastollisesti merkitsevää eroa.
Produodopa-tutkimukset
Produodopa on levodopamonofosfaattia ja karbidopamonofosfaattia (20:1) sisältävä aihiolääkeyhdistelmä, joka on tarkoitettu annettavaksi ihon alle jatkuvana infuusiona 24 tuntia/vrk. Levodopan Cmax ja AUC olivat samankaltaiset käytettäessä ihon alle annettavaa Produodopaa ja suoleen annettavaa Duodopaa, mikä tukee valmisteiden tehon samankaltaisuutta. Tutkimuksessa todettiin vakaa levodopa-altistus: Produodopalla vaihtelu oli 0,262 ja Duodopalla 0,404.
Kun Produodopaa annettiin terveille vapaaehtoisille, levodopan vakaa tila saavutettiin nopeasti, pääsääntöisesti 2 tunnissa, ja se säilyi koko infuusiojakson ajan. Kuvassa 1 on esitetty levodopa-altistus 24 tunnin Produodopa-infuusion jälkeen.
Kuva 1. Levodopa-altistus (keskiarvo) 24 tunnin Produodopa-infuusion aikana
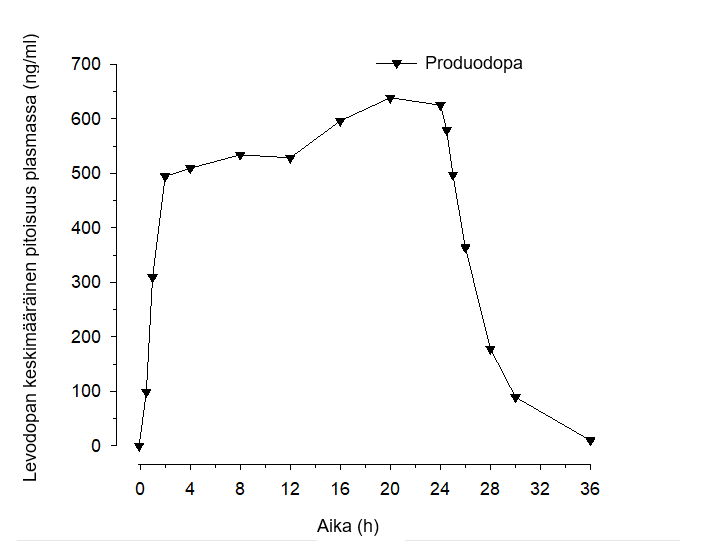
PK-vertailututkimuksessa todettiin, että levodopa-altistus oli samankaltainen, kun potilaille annettiin Produodopaa tai Duodopaa 24 tunnin ajan.
Produodopan vaikutusta edennyttä Parkinsonin tautia sairastavilla potilailla arvioitiin 12 viikon pituisessa vaiheen 3 kaksoissokkoutetussa, kahdella lumeella toteutetussa, satunnaistetussa, aktiivikontrolloidussa monikeskustutkimuksessa. Yhteensä 145 potilasta satunnaistettiin suhteessa 1:1, ja 141 potilasta sai joko Produodopaa jatkuvana infuusiona ihon alle 24 tuntia/vrk sekä lumelääkekapseleita suun kautta (N = 74) tai lumelääkeliuosta jatkuvana infuusiona ihon alle 24 tuntia/vrk sekä karbidopa-levodopaa kapseloituina lääkettä välittömästi vapauttavina tabletteina suun kautta (N = 67).
Tutkimuspopulaationa olivat levodopaan reagoivaa Parkinsonin tautia sairastavat potilaat, joiden motorisia tilanvaihteluita ei pystytty hallitsemaan riittävän hyvin potilaiden nykyisillä lääkityksillä ja joiden off-aika vuorokaudessa oli PD-päiväkirjan perusteella vähintään 2,5 tuntia.
Produodopa tuotti tilastollisesti merkitseviä parannuksia lähtötilanteesta viikolle 12 on-ajassa ilman vaikeaa dyskinesiaa sekä off-ajassa verrattuna välittömästi vapautuvaa karbidopa-levodopaa suun kautta saaneiden ryhmään (taulukko 7). Muissa toissijaisissa päätetapahtumissa, motoristen oireiden vaikutuksessa päivittäiseen elämään, aamuisessa akinesiassa, unessa ja elämänlaadun mittareissa ei tapahtunut tilastollisesti merkitsevää muutosta hierarkkisen testausmenettelyn perusteella.
Taulukko 7. Muutos lähtötilanteesta päätetapahtumaan ensisijaisessa ja tärkeimmissä toissijaisissa päätetapahtumissa
| Hoitoryhmä | N | Lähtötilanteen keskiarvo (SD) | Keskimääräinen muutos lähtötilanteesta päätetapahtumaan (SD) | Muutoksen pienimmän neliösumman keskiarvo | Eron pienimmän neliösumman keskiarvo | P-arvo (95 %:n luottamusväli) |
| Ensisijainen päätetapahtuma | ||||||
| On-aika ilman vaikeaa dyskinesiaa (tuntia)a | ||||||
| Suun kautta annettu välittömästi vapautuva karbidopa-levodopab | 67 | 9,49 (2,62) | 0,85 (3,46) | 0,97 | ||
| Produodopa | 73 | 9,20 (2,42) | 3,36 (3,62) | 2,72 | 1,75 | 0,0083 (0,46, 3,05) |
| Toissijainen päätetapahtuma | ||||||
| Off-aika (tuntia)a | ||||||
| Suun kautta annettu välittömästi vapautuva karbidopa-levodopab | 67 | 5,91 (1,88) | -0,93 (3,31) | -0,96 | ||
| Produodopa | 73 | 6,34 (2,27) | -3,41 (3,76) | -2,75 | -1,79 | 0,0054 (-3,03, -0,54) |
SD = keskihajonta a Parkinson’s Disease Diary -päiväkirjan (PD-päiväkirjan) perusteella. b Suun kautta annetut välittömästi lääkettä vapauttavat karbidopa-levodopatabletit. | ||||||
Yhteensä 110 potilasta oli mukana tutkimuksessa loppuun saakka. Välittömästi vapautuvaa karbidopa-levodopaa suun kautta saaneiden ryhmässä 7,5 % potilaista (N = 5) ja Produodopa-ryhmässä 35,1 % potilaista (N = 26) keskeytti tutkimukseen osallistumisen ennenaikaisesti kaksoissokkoutetun hoitojakson aikana. Yleisin keskeyttämisen syy Produodopa-ryhmässä oli haittatapahtumat (18,9 %, N = 14). Yhtä potilasta Produodopa-ryhmän 74 potilaasta ei sisällytetty analyysiin, koska tutkittavalla ei ollut tehomallin edellyttämiä asianmukaisia lähtötilanteen tietoja (N = 73 taulukossa 7). Lisäksi suoritettiin J2R-herkkyysanalyysi, jonka tarkoitus oli arvioida pääanalyysin tuloksia konservatiivisemman oletuksen pohjalta. J2R-herkkyysanalyysin tulokset olivat yhdenmukaisia pääanalyysin tulosten kanssa.
Ihon alle jatkuvana infuusiona 24 tuntia/vrk annetun Produodopa-hoidon turvallisuutta ja siedettävyyttä arvioitiin avoimessa, yhden hoitohaaran vaiheen 3 tutkimuksessa, joka kesti 52 viikkoa ja johon osallistui 244 potilasta. Tutkimuspopulaationa olivat Parkinsonin tautia sairastavat potilaat, jotka reagoivat levodopahoitoon ja joilla oli motorisia oireita nykyisestä hoidosta huolimatta ja joiden off-aika vuorokaudessa oli PD-päiväkirjan perusteella vähintään 2,5 tuntia. Yhteensä 137 potilasta oli mukana tutkimuksessa loppuun saakka. Yleisimmät keskeyttämisen syyt olivat haittatapahtumat (26 %) ja suostumuksen peruminen (16 %). Haittatapahtumia, joita raportoitiin ≥ 10 %:lla tutkittavista, olivat infuusiokohdan tapahtumat, hallusinaatiot, kaatuminen, ahdistuneisuus ja huimaus. Yleisimmät Produodopaan liittyvät haittatapahtumat olivat ei-vakavia, vaikeusasteeltaan lieviä tai keskivaikeita ja korjautuvia infuusiokohdan tapahtumia. Tähän tutkimukseen perustuva yhteenveto Produodopan turvallisuusprofiilista on kohdassa Haittavaikutukset (ks. kohta Haittavaikutukset).
Pediatriset potilaat
Produodopan turvallisuutta alle 18 vuoden ikäisten hoidossa ei ole varmistettu, eikä sen käyttöä suositella alle 18‑vuotiaille potilaille.
Farmakokinetiikka
Imeytyminen
Produodopa annetaan suoraan ihon alle, mistä se imeytyy nopeasti ja muuttuu levodopaksi ja karbidopaksi. Vaiheen 1 tutkimuksessa terveillä vapaaehtoisilla levodopaa ja karbidopaa havaittiin plasmassa 30 minuutin kuluttua ensimmäisessä farmakokineettisessä näytteenottokohdassa. Vakaa tila saavutettiin useimmilla tutkittavilla 2 tunnin kuluessa, kun Produodopan antamista jatkuvana infuusiona jatkettiin latausannoksen jälkeen.
Produodopan imeytymistä eri kohdista tutkittiin vaihtovuoroisessa tutkimuksessa, jossa Produodopaa annettiin terveille vapaaehtoisille ihon alle joko vatsaan, käsivarteen tai reiteen. Tutkimuksen farmakokineettisessä analyysissä osoitettiin, että levodopa- ja karbidopa-altistus oli lähes identtistä kaikissa kolmessa kohdassa, eli eri kohtiin ihon alle annetun Produodopan imeytyminen on todennäköisesti samankaltaista eri kohdissa.
Produodopa ohittaa suoliston ja siksi ruoka ei vaikuta levodopan/karbidopan imeytymiseen tai altistukseen.
Jakautuminen
Levodopan jakautumistilavuus on suhteellisen pieni. Levodopa jakautuu punasoluihin ja plasmaan noin suhteessa 1. Levodopan proteiiniinsitoutumisaste plasmassa on mitätön (< 10 %). Suurten, neutraalien aminohappojen kuljetusmekanismi kuljettaa levodopan aivoihin.
Karbidopa sitoutuu noin 36-prosenttisesti plasman proteiineihin. Karbidopa ei läpäise veri-aivoestettä.
Sekä foslevodopan että foskarbidopan proteiiniinsitoutumisaste plasmassa on alhainen (24–26 %).
Biotransformaatio ja eliminaatio
Alkaliset fosfataasit muuttavat foslevodopa- ja foskarbidopa-aihiolääkkeet nopeasti levodopaksi ja karbidopaksi. Levodopa metaboloituu lähinnä aromaattisen aminohappo-dekarboksylaasin (AAAD) ja COMT-entsyymien kautta. Muita metaboliareittejä ovat transaminaatio ja hapettuminen. Jos entsyymitoimintaa estäviä aineita ei anneta samanaikaisesti, levodopan AAAD-välitteinen dekarboksylaatio dopamiiniksi on sen tärkein entsymaattinen metaboliareitti. Levodopan COMT-välitteinen O-metylaatio johtaa 3-O-metyylidopan muodostukseen. Kun levodopa annetaan karbidopan kanssa, levodopan eliminaation puoliintumisaika on noin 1,5 h.
Karbidopa metaboloituu kahdeksi päämetaboliitiksi (α-metyyli-3-metoksi-4-hydroksifenyylipropioni-happo ja α-metyyli-3,4-dihydroksifenyylipropionihappo). Nämä kaksi metaboliittia erittyvät lähinnä virtsaan joko muuttumattomina tai glukuronidikonjugaatteina. Noin 30 % virtsaan erittyvästä kokonaismäärästä erittyy muuttumattoman karbidopan muodossa. Karbidopan eliminaation puoliintumisaika on noin 2 tuntia.
Erityisryhmät
Produodopa on tarkoitettu Parkinsonin tautia sairastavien potilaiden hoitoon, joita hoidetaan suun kautta otettavalla vakiintuneella levodopa-annoksella, ja Produodopan annos optimoidaan potilaalle hoidon alkaessa.
Iäkkäät potilaat
Iän vaikutusta levodopan farmakokinetiikkaan Produodopa-infuusion jälkeen ei ole arvioitu erikseen. Levodopalla tehtyjen tutkimusten mukaan levodopan puhdistuma hidastuu jonkin verran iän karttuessa.
Munuaisten tai maksan vajaatoiminta
Produodopan farmakokinetiikkaa ei ole tutkittu munuaisten ja/tai maksan vajaatoimintaa sairastavilla potilailla.
Odotettavissa oleva päivittäinen fosforisaanti suurimmalla suositellulla foslevodopan/foskarbidopan kliinisellä annoksella (foslevodopa/foskarbidopa 6 000/300 mg/vrk) on noin 700 mg, mikä alittaa selkeästi Yhdysvaltain tiedeakatemian (United States National Academy of Sciences) ravinnosta saatavan määrän suositusalueen ylärajan 3 000 mg/vrk. Produodopan farmakokinetiikasta ja turvallisuudesta dialyysia vaativaa loppuvaiheen munuaissairautta sairastavilla potilailla ei kuitenkaan ole tietoa. Siksi on noudatettava varovaisuutta annettaessa Produodopaa dialyysihoitoa saaville loppuvaiheen munuaissairauspotilaille, koska munuaisten kyky eliminoida fosfaattia on heikentynyt.
Paino
Painon vaikutusta levodopan farmakokinetiikkaan Produodopa-infuusion jälkeen ei ole arvioitu erikseen. Aikaisemmissa levodopa-tutkimuksissa on osoitettu, että paino lisää jakautumistilavuutta ja voi pienentää levodopa-altistusta.
Sukupuoli tai etninen tausta
Produodopan antamisen jälkeen karbidopa- ja levodopa-altistus oli sekä japanilaisilla että han-kiinalaisilla tutkittavilla verrattavissa valkoihoisten tutkittavien altistukseen.
Sukupuolen vaikutusta levodopan farmakokinetiikkaan Produodopa-infuusion jälkeen ei ole arvioitu erikseen. Sukupuolen vaikutusta levodopan farmakokinetiikkaan on arvioitu, ja tutkimusten mukaan levodopa-altistuksessa ei ole sukupuolten välillä kliinisesti merkittäviä eroja. Produodopa-annoksen jälkeinen levodopa-altistus oli naisilla noin 18 % suurempi, kun painon vaikutus huomioitiin. Tulos perustuu AUC-arvoon.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Lisääntymistoksisuustutkimuksissa sekä levodopa että levodopan ja karbidopan yhdistelmä on aiheuttanut viskeraalisia ja skeletaalisia epämuodostumia kaneilla.
Hydratsiini on foskarbidopan hajoamistuote. Eläinkokeissa hydratsiinilla osoitettiin olevan merkittävää systeemistä toksisuutta, erityisesti jos altistus tapahtui hengittämällä. Näissä tutkimuksissa todettiin, että hydratsiini on maksatoksinen, sillä on keskushermostotoksisuutta (vaikka tätä ei ole todettu suun kautta annettavan lääkityksen yhteydessä), ja se on sekä genotoksinen että karsinogeeninen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmaseuttiset tiedot
Apuaineet
Natriumhydroksidi 10N (pH:n säätämiseen)
Väkevä suolahappo (pH:n säätämiseen)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamattomana: 20 kuukautta.
Avaamisen jälkeen: Käytettävä välittömästi. Valmiste on käytettävä 24 tunnin kuluessa siitä, kun se on siirretty injektiopullosta ruiskuun.
Säilytys
Säilytä ja kuljeta kylmässä (2 °C – 8 °C). Ei saa jäätyä.
Säilytä injektiopullot ulkopakkauksessa, etteivät ne mene rikki.
Voidaan säilyttää huoneenlämmössä enintään 30 °C:ssa yhden enintään 28 päivän pituisen jakson ajan. Kun injektiopulloa on säilytetty huoneenlämmössä, sitä ei saa enää uudelleen laittaa jääkaappiin. Merkitse pakkaukseen päivämäärä, jolloin Produodopa otettiin jääkaapista ensimmäisen kerran.
Lääkevalmisteen säilytysolosuhteet ensimmäisen avaamisen jälkeen, ks. kohta Kestoaika.
Lääkevalmisteen on oltava huoneenlämpöistä ennen infuusiota. Jos valmistetta on säilytetty jääkaapissa, injektiopullo otetaan huoneenlämpöön ja sen annetaan lämmetä suoralta auringonvalolta suojattuna 30 minuutin ajan. Jääkaapissa säilytettyä valmistetta (injektiopullossa tai ruiskussa) ei saa lämmittää millään muulla tavoin kuin antamalla sen lämmetä huoneenlämmössä. Sitä ei saa lämmittää esimerkiksi mikroaaltouunissa tai lämpimässä vedessä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PRODUODOPA infuusioneste, liuos
240 mg/ml+12 mg/ml (L:ei) 7 x 10 ml (679,74 €)
PF-selosteen tieto
Kokonaismäärä 10 ml tyypin I kirkkaassa, värittömässä lasisessa injektiopullossa, joka on suljettu harmaalla kumitulpalla, alumiinisella suojakorkilla ja turkoosilla muovisella repäisykorkilla, toimitetaan 7 injektiopullon pakkauksessa.
Käytettäväksi hyväksytyt steriilit, kertakäyttöiset infuusiotarvikkeet (ruisku, infuusiosetti ja injektiopullon adapteri) toimitetaan erikseen.
Vyafuser-pumppu toimitetaan erikseen.
Valmisteen kuvaus:
Produodopa on kirkas tai hieman läpikuultava liuos lasisessa injektiopullossa. Liuoksessa ei saa olla hiukkasia. Produodopan väri voi vaihdella värittömästä keltaiseen ja ruskeaan, ja siinä saattaa olla violetin tai punaisen sävyjä. Värivaihtelu on normaalia eikä vaikuta tuotteen laatuun. Liuoksen väri saattaa tummentua sen jälkeen, kun injektiopullon tulppa on läpäisty tai liuoksen ollessa ruiskussa.
Liuoksen pH on noin 7,4. Osmolaliteetti on noin 2 200–2 500 mOsmol/kg, mutta voi olla enimmillään jopa 2 700 mOsmol/kg.
Käyttö- ja käsittelyohjeet
Injektiopullot ovat kertakäyttöisiä. Kun valmiste annetaan, injektiopullon sisältö siirretään kokonaan ruiskuun. Liuosta ei saa laimentaa eikä ruiskuun saa lisätä muita liuoksia. Hävitä injektiopullo sen jälkeen, kun lääkevalmiste on siirretty ruiskuun.
Avattua injektiopulloa ei saa käyttää uudelleen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Hävitä injektiopullo, ellei valmistetta ole käytetty ja sitä on säilytetty huoneenlämmössä 28 päivän ajanjakson ajan.
Hävitä ruisku ja ruiskussa mahdollisesti jäljellä oleva käyttämätön lääkevalmiste, kun valmiste on ollut ruiskussa 24 tunnin ajan. Valmistetta ei saa käyttää samasta injektiopullosta tai samasta ruiskusta enää 24 tunnin jälkeen.
Yhteenveto käyttöohjeista on pakkausselosteessa.
Korvattavuus
PRODUODOPA infuusioneste, liuos
240 mg/ml+12 mg/ml 7 x 10 ml
- Ylempi erityiskorvaus (100 %). Parkinsonin tauti ja siihen verrattavat liikehäiriöt (110).
- Peruskorvaus (40 %).
ATC-koodi
N04BA07
Valmisteyhteenvedon muuttamispäivämäärä
17.11.2023
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
