TREPOSA infuusioneste, liuos 1 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Lääkäri
Koulutus terveydenhuollon ammattilaisille laskimonsisäisen treprostiniilin turvallisesta käsittelystä ja katetriperäisten verenkierron infektioiden ehkäisemisestä
Treposaan liittyvä, erityistä seurantaa edellyttävä tapahtuma – verenkierron infektio
Potilas
Infuusiojärjestelmän käyttö: Treposan antamiseen laskimoon
Yleinen
Laskimonsisäistä Treposaa saavan potilaan kyselykaavake
Vaikuttavat aineet ja niiden määrät
Yksi ml sisältää 1 mg treprostiniilia treprostiniilinatriumina.
Yksi 10 ml liuosta sisältävä injektiopullo sisältää 10 mg treprostiniilia treprostiniilinatriumina.
Apuaine, jonka vaikutus tunnetaan:
natrium: enintään 36,8 mg (1,6 mmol) 10 ml:n injektiopulloa kohden
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos
Kliiniset tiedot
Käyttöaiheet
Idiopaattisen tai perinnöllisen pulmonaalihypertension (PAH) hoito rasituksensiedon parantamiseksi ja taudin oireiden lievittämiseksi potilailla, joiden taudin vaikeusaste on luokiteltu New York Heart Association (NYHA) ‑luokituksen toiminnalliseen luokkaan III.
Ehto
Hoito tulee aloittaa ja sen tulee tapahtua ainoastaan pulmonaaliverenpaineen hoitoon perehtyneen lääkärin määräyksestä ja seurannassa. Hoito aloitetaan lääkärin tarkassa valvonnassa paikassa, jossa voidaan antaa tehohoitoa.
Annostus ja antotapa
Treposa annetaan jatkuvana ihon alle annettavana tai laskimonsisäisenä infuusiona. Keskuslaskimokatetrien pitkäaikaiskäyttöön liittyvien riskien vuoksi, vakavat verenkierron infektiot mukaan lukien, (laimentamaton) ihonalainen infuusio on suositeltavin antotapa. Jatkuvaa laskimonsisäistä infuusiota tulee käyttää vain niille potilaille, joiden tila on stabiloitu ihonalaisen treprostiniili-infuusion avulla ja joille kehittyy sietokyvyttömyys ihonalaista antoreittiä kohtaan ja joiden kohdalla kyseisiä riskejä pidetään hyväksyttävinä.
Hoito tulee aloittaa ja sen tulee tapahtua ainoastaan pulmonaalihypertension hoitoon perehtyneen lääkärin määräyksestä ja seurannassa.
Aikuiset
Prostasykliinihoidon aloittaminen ensimmäistä kertaa
Hoito aloitetaan lääkärin tarkassa valvonnassa paikassa, jossa voidaan antaa tehohoitoa.
Aloitukseen suositeltu infuusionopeus on 1,25 ng/kg/min. Jos tämä aloitusannostus on huonosti siedetty, infuusionopeudeksi vähennetään 0,625 ng/kg/min.
Annoksen muutokset
Infuusionopeutta lisätään lääkärin valvonnassa 1,25 ng:n/kg/min lisäyksinä viikkoa kohden neljän ensimmäisen hoitoviikon aikana ja sen jälkeen 2,5 ng/kg/min viikossa.
Annostusta muutetaan yksilöllisesti ja lääkärin valvonnassa sellaisen ylläpitoannostuksen löytämiseksi, jolla oireet lievenevät ja jonka potilas sietää.
Hoidon teho säilyi tärkeimmissä 12 viikon tutkimuksissa ainoastaan, jos annosta nostettiin keskimäärin 3–4 kertaa kuukaudessa. Jatkuvien annostuksen muuttamisten tarkoituksena on saavuttaa annos, joka lievittää pulmonaalihypertension oireita ja minimoi treprostiniilin liialliset farmakologiset vaikutukset.
Haittavaikutukset, kuten punehtuminen, päänsärky, hypotensio, pahoinvointi, oksentelu ja ripuli, ovat tavallisesti annetusta treprostiniiliannoksesta riippuvaisia. Ne saattavat hävitä hoidon edetessä, mutta jos ne jatkuvat tai potilas ei siedä niitä, infuusionopeutta voidaan vähentää niiden voimakkuuden vähentämiseksi.
Kliinisten tutkimusten seurantavaiheissa keskimääräiset annokset 12 kuukauden jälkeen olivat 26 ng/kg/min, 24 kuukauden jälkeen 36 ng/kg/min ja 48 kuukauden jälkeen 42 ng/kg/min.
Lihavilla potilailla (joiden paino on ≥ 30 % yli ihannepainon) alkuannoksen ja sitä seuraavien annoslisäysten tulee perustua ihannepainoon.
Treprostiniilihoidon äkillinen keskeyttäminen tai nopeasti tehtävät annostuksen huomattavat pienennykset voivat aiheuttaa rebound-ilmiönä pulmonaalihypertension pahenemisen. Sen vuoksi on suositeltavaa välttää treprostiniilihoidon keskeyttämistä ja käynnistää infuusio mahdollisimman pian uudelleen äkillisen vahingossa tapahtuneen annoksen pienennyksen tai annostelun keskeytyksen jälkeen. Lääketieteellisen koulutuksen saaneen hoitohenkilökunnan tulee valita paras vaihtoehto treprostiniili-infuusion uudelleenaloitukseen tapauskohtaisesti. Useimmissa tapauksissa treprostiniili-infuusio voidaan aloittaa uudelleen muutaman tunnin keskeytyksen jälkeen samalla annostelunopeudella. Pitempiaikainen keskeytys voi edellyttää treprostiniiliannoksen uudelleentitrausta.
Iäkkäät potilaat
Treprostiniililla tehdyissä kliinisissä tutkimuksissa ei ollut mukana riittävästi 65‑vuotiaita ja sitä vanhempia potilaita, jotta olisi voitu määrittää, onko hoitovaste heillä erilainen verrattuina nuorempiin potilaisiin. Populaatiofarmakokinetiikka-analyysissa treprostiniilin puhdistuma plasmasta oli 20 % alhaisempi. Yleisesti tulee noudattaa varovaisuutta, kun valitaan annosta iäkkäälle potilaalle, ja tulee ottaa huomioon iäkkäillä useammin esiintyvä heikentynyt maksan, munuaisten tai sydämen toiminta, samanaikainen muu sairaus tai muu lääkehoito.
Pediatriset potilaat
Käytöstä alle 18‑vuotiaille potilaille on vähän tietoa. Käytettävissä olevien kliinisten tutkimusten perusteella ei voida arvioida, voidaanko aikuisille suositellun annostusohjelman tehoa ja turvallisuutta yleistää lasten ja nuorten hoitoon.
Riskipopulaatiot
Heikentynyt maksan toiminta
Plasman treprostiniilialtistus (AUC, pitoisuus-aikakäyrän alle jäävä pinta-ala plasmassa) suurenee lievässä maksan vajaatoiminnassa (Child-Pugh-luokka A) 260 % ja keskivaikeassa maksan vajaatoiminnassa (Child-Pugh-luokka B) 510 %. Treprostiniilin puhdistuma plasmasta väheni jopa 80 % lievää tai keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla. Sen vuoksi maksan vajaatoimintaa sairastavia potilaita hoidettaessa kehotetaan noudattamaan varovaisuutta systeemisen altistuksen suurenemisriskin vuoksi, koska se voi heikentää hoidon siedettävyyttä ja johtaa annosriippuvaisten haittavaikutusten lisääntymiseen.
Treprostiniilin aloitusannos tulee pienentää annokseen 0,625 ng/kg/min, ja annostuksen lisäykset on tehtävä varovaisesti.
Heikentynyt munuaisten toiminta
Munuaisten vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa. Treprostiniili ei poistu elimistöstä dialyysillä (ks. kohta Farmakokinetiikka).
Siirtyminen laskimonsisäiseen epoprostenolihoitoon
Kun potilaan tila edellyttää siirtymistä laskimoon annettavaan epoprostenolihoitoon, siirtymävaiheen on tapahduttava lääkärin tarkassa valvonnassa. Ohjaavana tietona voi olla hyvä huomioida seuraava siirtymävaiheen hoito-ohjelmaehdotus. Treprostiniili-infuusiota pienennetään ensin hitaasti 2,5 ng/kg/min. Kun uusi treprostiniiliannostus on ollut käytössä vähintään 1 tunnin ajan, epoprostenolihoito voidaan aloittaa enintään annostuksella 2 ng/kg/min. Tämän jälkeen treprostiniiliannosta pienennetään vähintään 2 tunnin väliajoin ja samaan aikaan epoprostenoliannostusta lisätään vähitellen sen jälkeen, kun aloitusannostus on ollut käytössä vähintään yhden tunnin ajan.
Antotapa
Anto jatkuvana ihonalaisena infuusiona
Treposa annetaan jatkuvana ihonalaisena infuusiona subkutaanikatetrin kautta mukana kannettavan infuusiopumpun avulla.
Jotta voidaan välttää mahdolliset keskeytykset lääkkeen annossa, potilaalla on oltava varalla toinen infuusiopumppu ja ihonalaiseen antoon tarkoitettuja infuusiotarvikkeita saatavilla siltä varalta, että antolaitteissa ilmenee tahaton toimintahäiriö.
Laimentamattoman Treposa-valmisteen ihonalaiseen antoon käytettävän mukana kannettavan infuusiopumpun tulee olla ominaisuuksiltaan:
1) pieni ja kevyt
2) infuusionopeuden säädettävyys noin 0,002 ml:n/tunti lisäyksinä
3) varustettu tukkeuman, akun tyhjentymisen, ohjelmavirheen ja moottorin toimintahäiriön hälyttimellä
4) tarkkuus ±6 % ohjelmoidusta antonopeudesta
5) ylipainetoimintainen (jatkuva tai jaksoittainen).
Säiliön materiaalina tulee olla polypropeeni tai lasi.
Potilaille on opetettava erittäin tarkkaan pumpun käyttö ja ohjelmointi sekä infuusiojärjestelmän kytkeminen ja huolto.
Infuusioletkun huuhteleminen sen ollessa kytkettynä potilaaseen voi johtaa tahattomaan yliannostukseen.
Infuusionopeudet ∇ (ml/h) lasketaan seuraavalla laskukaavalla:
∇ (ml/h) = D (ng/kg/min) x W (kg) x 0,00006/treprostiniilipitoisuus (mg/ml)]
D = määrätty annostus ng/kg/min
W = potilaan paino kilogrammoina
Treposa on saatavana pitoisuuksina 1, 2,5, 5 ja 10 mg/ml.
Ihonalainen Treposa-infuusio annetaan laimentamatta lasketulla nopeudella (ml/h), joka perustuu potilaalle määrättyyn annokseen (ng/kg/min), hänen painoonsa (kg) ja injektiopullossa olevan Treposa-valmisteen vahvuuteen (mg/ml). Käytön aikana yksittäisen laimentamattoman Treposa-säiliön (ruiskun) anto saa kestää enintään 14 päivää 37 °C:n lämpötilassa. Ihonalaisen infuusion nopeus lasketaan seuraavan kaavan mukaan:
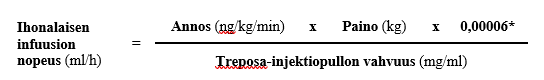
* Muuntokerroin 0,00006 = 60 min/h x 0,000001 mg/ng
Seuraavassa onihonalaista infuusiotakoskevia esimerkkilaskelmia:
Esimerkki 1:
Jos 60 kg painavalle potilaalle käytetään suositeltua aloitusannosta 1,25 ng/kg/min Treposa-injektiopullon sisältämää valmistetta, jonka vahvuus on 1 mg/ml, infuusionopeus lasketaan seuraavasti:

Esimerkki 2:
Jos 65 kg painavalle potilaalle käytetään suositeltua aloitusannosta 40 ng/kg/min Treposa-injektiopullon sisältämää valmistetta, jonka vahvuus on 5 mg/ml, infuusionopeus lasketaan seuraavasti:

Taulukossa 1 on ohjeet ihonalaisen Treposa 1 mg/ml ‑infuusion antonopeudesta eripainoisille potilaille; suurin annos 42,5 ng/kg/min.
Taulukko 1:
| Ihonalaiseen annosteluun tarkoitetun pumpun infuusionopeusasetukset (ml/h) Treposa-valmisteen antoa varten, kun treprostiniilin vahvuus on 1 mg/ml | ||||||||||||||||
| Potilaan paino (kg) | ||||||||||||||||
| Annos (ng/kg/min) | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
| 1,25 | 0,002 | 0,002 | 0,003 | 0,003 | 0,003 | 0,004 | 0,004 | 0,005 | 0,005 | 0,005 | 0,006 | 0,006 | 0,006 | 0,007 | 0,007 | 0,008 |
| 2,5 | 0,004 | 0,005 | 0,005 | 0,006 | 0,007 | 0,008 | 0,008 | 0,009 | 0,010 | 0,011 | 0,011 | 0,012 | 0,013 | 0,014 | 0,014 | 0,015 |
| 3,75 | 0,006 | 0,007 | 0,008 | 0,009 | 0,010 | 0,011 | 0,012 | 0,014 | 0,015 | 0,016 | 0,017 | 0,018 | 0,019 | 0,020 | 0,021 | 0,023 |
| 5 | 0,008 | 0,009 | 0,011 | 0,012 | 0,014 | 0,015 | 0,017 | 0,018 | 0,020 | 0,021 | 0,023 | 0,024 | 0,026 | 0,027 | 0,029 | 0,030 |
| 6,25 | 0,009 | 0,011 | 0,013 | 0,015 | 0,017 | 0,019 | 0,021 | 0,023 | 0,024 | 0,026 | 0,028 | 0,030 | 0,032 | 0,034 | 0,036 | 0,038 |
| 7,5 | 0,011 | 0,014 | 0,016 | 0,018 | 0,020 | 0,023 | 0,025 | 0,027 | 0,029 | 0,032 | 0,034 | 0,036 | 0,038 | 0,041 | 0,043 | 0,045 |
| 8,75 | 0,013 | 0,016 | 0,018 | 0,021 | 0,024 | 0,026 | 0,029 | 0,032 | 0,034 | 0,037 | 0,039 | 0,042 | 0,045 | 0,047 | 0,050 | 0,053 |
| 10 | 0,015 | 0,018 | 0,021 | 0,024 | 0,027 | 0,030 | 0,033 | 0,036 | 0,039 | 0,042 | 0,045 | 0,048 | 0,051 | 0,054 | 0,057 | 0,060 |
| 11,25 | 0,017 | 0,020 | 0,024 | 0,027 | 0,030 | 0,034 | 0,037 | 0,041 | 0,044 | 0,047 | 0,051 | 0,054 | 0,057 | 0,061 | 0,064 | 0,068 |
| 12,5 | 0,019 | 0,023 | 0,026 | 0,030 | 0,034 | 0,038 | 0,041 | 0,045 | 0,049 | 0,053 | 0,056 | 0,060 | 0,064 | 0,068 | 0,071 | 0,075 |
| 13,75 | 0,021 | 0,025 | 0,029 | 0,033 | 0,037 | 0,041 | 0,045 | 0,050 | 0,054 | 0,058 | 0,062 | 0,066 | 0,070 | 0,074 | 0,078 | 0,083 |
| 15 | 0,023 | 0,027 | 0,032 | 0,036 | 0,041 | 0,045 | 0,050 | 0,054 | 0,059 | 0,063 | 0,068 | 0,072 | 0,077 | 0,081 | 0,086 | 0,090 |
| 16,25 | 0,024 | 0,029 | 0,034 | 0,039 | 0,044 | 0,049 | 0,054 | 0,059 | 0,063 | 0,068 | 0,073 | 0,078 | 0,083 | 0,088 | 0,093 | 0,098 |
| 17,5 | 0,026 | 0,032 | 0,037 | 0,042 | 0,047 | 0,053 | 0,058 | 0,063 | 0,068 | 0,074 | 0,079 | 0,084 | 0,089 | 0,095 | 0,100 | 0,105 |
| 18,75 | 0,028 | 0,034 | 0,039 | 0,045 | 0,051 | 0,056 | 0,062 | 0,068 | 0,073 | 0,079 | 0,084 | 0,090 | 0,096 | 0,101 | 0,107 | 0,113 |
| 20 | 0,030 | 0,036 | 0,042 | 0,048 | 0,054 | 0,060 | 0,066 | 0,072 | 0,078 | 0,084 | 0,090 | 0,096 | 0,102 | 0,108 | 0,114 | 0,120 |
| 21,25 | 0,032 | 0,038 | 0,045 | 0,051 | 0,057 | 0,064 | 0,070 | 0,077 | 0,083 | 0,089 | 0,096 | 0,102 | 0,108 | 0,115 | 0,121 | 0,128 |
| 22,5 | 0,034 | 0,041 | 0,047 | 0,054 | 0,061 | 0,068 | 0,074 | 0,081 | 0,088 | 0,095 | 0,101 | 0,108 | 0,115 | 0,122 | 0,128 | 0,135 |
| 23,75 | 0,036 | 0,043 | 0,050 | 0,057 | 0,064 | 0,071 | 0,078 | 0,086 | 0,093 | 0,100 | 0,107 | 0,114 | 0,121 | 0,128 | 0,135 | 0,143 |
| 25 | 0,038 | 0,045 | 0,053 | 0,060 | 0,068 | 0,075 | 0,083 | 0,090 | 0,098 | 0,105 | 0,113 | 0,120 | 0,128 | 0,135 | 0,143 | 0,150 |
| 27,5 | 0,041 | 0,050 | 0,058 | 0,066 | 0,074 | 0,083 | 0,091 | 0,099 | 0,107 | 0,116 | 0,124 | 0,132 | 0,140 | 0,149 | 0,157 | 0,165 |
| 30 | 0,045 | 0,054 | 0,063 | 0,072 | 0,081 | 0,090 | 0,099 | 0,108 | 0,117 | 0,126 | 0,135 | 0,144 | 0,153 | 0,162 | 0,171 | 0,180 |
| 32,5 | 0,049 | 0,059 | 0,068 | 0,078 | 0,088 | 0,098 | 0,107 | 0,117 | 0,127 | 0,137 | 0,146 | 0,156 | 0,166 | 0,176 | 0,185 | 0,195 |
| 35 | 0,053 | 0,063 | 0,074 | 0,084 | 0,095 | 0,105 | 0,116 | 0,126 | 0,137 | 0,147 | 0,158 | 0,168 | 0,179 | 0,189 | 0,200 | 0,210 |
| 37,5 | 0,056 | 0,068 | 0,079 | 0,090 | 0,101 | 0,113 | 0,124 | 0,135 | 0,147 | 0,158 | 0,169 | 0,180 | 0,191 | 0,203 | 0,214 | 0,225 |
| 40 | 0,060 | 0,072 | 0,084 | 0,096 | 0,108 | 0,120 | 0,132 | 0,144 | 0,156 | 0,168 | 0,180 | 0,192 | 0,204 | 0,216 | 0,228 | 0,240 |
| 42,5 | 0,064 | 0,077 | 0,089 | 0,102 | 0,115 | 0,128 | 0,140 | 0,153 | 0,166 | 0,179 | 0,191 | 0,204 | 0,217 | 0,230 | 0,242 | 0,255 |
Anto jatkuvana laskimonsisäisenä infuusiona ulkoisen mukana kannettavan pumpun avulla
Treposa annetaan jatkuvana laskimonsisäisenä infuusiona keskuslaskimokatetrin kautta ulkoisen mukana kannettavan infuusiopumpun avulla. Se voidaan antaa myös väliaikaisesti mieluimmin suureen laskimoon asennetun perifeerisen laskimokatetrin kautta. Pitempään kuin muutamia tunteja kestävään perifeeriseen infuusioon voi liittyä kohonnut laskimontukkotulehduksen riski (ks. kohta Haittavaikutukset).
Lääkkeen annon mahdollisten keskeytysten välttämiseksi potilaalla on oltava käytössään varainfuusiopumppu ja infuusiotarvikkeita annostelulaitteiston toimintahäiriöiden varalta.
Yleisesti ottaen laimennetun Treposa-valmisteen laskimonsisäiseen antoon käytettävän ulkoisen mukana kannettavan infuusiopumpun tulee olla ominaisuuksiltaan:
1) pieni ja kevyt
2) infuusionopeuden säädettävyys noin 0,05 ml:n/tunti lisäyksinä. Tyypillinen infuusionopeus 0,4–2 ml/tunti.
3) varustettu tukkeuman / lääkkeen annon keskeytymisen, akun tyhjentymisen, ohjelmavirheen ja moottorin toimintahäiriön hälyttimellä
4) tarkkuus ±6 % ohjelmoidusta tuntiannoksesta tai parempi
5) ylipainetoimintainen. Säiliön materiaalina tulee olla polyvinyylikloridi, polypropeeni tai lasi.
Treposa laimennetaan joko steriilillä injektionesteisiin käytettävällä vedellä tai 0,9‑prosenttisella (paino/tilavuus) natriumkloridi-injektioliuoksella. Se annetaan laskimonsisäisesti jatkuvana infuusiona, joko kirurgisesti asennetun keskuslaskimokatetrin tai väliaikaisesti perifeerisen laskimokanyylin kautta laskimonsisäiseen lääkkeen annosteluun tarkoitetun infuusiopumpun avulla.
Sopivaa ulkoista mukana kannettavaa infuusiopumppua ja ‑säiliötä käytettäessä valitaan ensin ennalta määritetty laskimonsisäisen infuusion nopeus, jotta saavutetaan halutun mittainen infuusion kesto. Laimennetun Treposa-infuusion enimmäiskesto on 24 tuntia (ks. kohta Kestoaika).
Laskimonsisäiseen infuusioon käytettävien infuusiojärjestelmien säiliön tilavuus on yleensä 20, 50 tai 100 ml. Vaadittavan laskimonsisäisen infuusion nopeuden (ml/h) sekä potilaan annoksen (ng/kg/min) ja painon (kg) määrityksen jälkeen voidaan laskea laimennetun laskimonsisäisesti annettavan treprostiniilin pitoisuus (mg/ml) seuraavan kaavan mukaan:
Vaihe 1
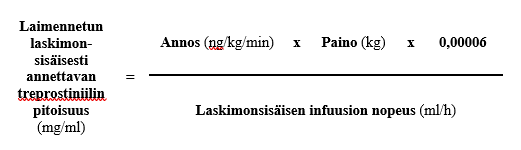
Säiliön koon edellyttämä Treposa-valmisteen määrä tarvittavan laskimonsisäisesti annettavan laimennetun treprostiniilipitoisuuden saavuttamiseksi voidaan tällöin laskea seuraavan kaavan mukaan:
Vaihe 2

Säiliöön lisätään laskelman mukainen määrä Treposa-valmistetta sekä riittävä määrä laimennusainetta (steriiliä injektionesteisiin käytettävää vettä tai 0,9‑prosenttista natriumkloridi-injektioliuosta), jotta saavutetaan haluttu kokonaistilavuus säiliössä.
Seuraavassa onlaskimonsisäistä infuusiotakoskevia esimerkkilaskelmia:
Esimerkki 3:
Jos 60 kg painavalle henkilölle käytetään annosta 5 ng/kg/min ja ennalta määritetty laskimonsisäisen infuusion nopeus on 1 ml/h ja säiliön tilavuus on 50 ml, laimennetun laskimonsisäisesti annosteltavan treprostiniililiuoksen pitoisuus lasketaan seuraavasti:
Vaihe 1
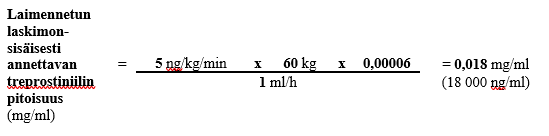
0,018 mg:n/ml laimennetun treprostiniilin kokonaispitoisuuden ja 50 ml:n kokonaistilavuuden edellyttämä Treposa-valmisteen määrä (kun käytetyn injektiopullon vahvuus on 1 mg/ml) lasketaan seuraavasti:
Vaihe 2
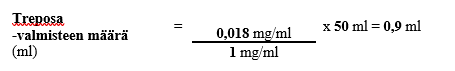
Esimerkin 3 mukaisen henkilön tarvitsema laimennetun laskimonsisäisesti annettavan treprostiniilin pitoisuus saataisiin siis lisäämällä sopivaan säiliöön 0,9 millilitraa Treposa-injektiopullon sisältämää valmistetta, jonka vahvuus on 1 mg/ml, sekä riittävä määrä laimennusainetta, jotta kokonaistilavuudeksi säiliössä saadaan 50 ml liuosta. Esimerkin mukaisessa tilanteessa pumpun infuusionopeudeksi asetettaisiin 1 ml/h.
Esimerkki 4:
Jos 75 kg painavalle henkilölle käytetään annosta 30 ng/kg/min ja ennalta määritetty laskimonsisäisen infuusion nopeus on 2 ml/h ja säiliön tilavuus on 100 ml, laimennetun laskimonsisäisesti annosteltavan treprostiniililiuoksen pitoisuus lasketaan seuraavasti:
Vaihe 1
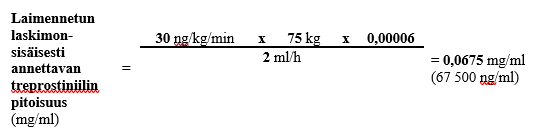
0,0675 mg:n/ml laimennetun treprostiniilin kokonaispitoisuuden ja 100 ml:n kokonaistilavuuden edellyttämä Treposa-valmisteen määrä (kun käytetyn injektiopullon vahvuus on 2,5 mg/ml) lasketaan seuraavasti:
Vaihe 2
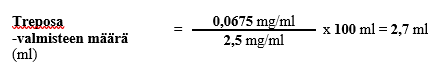
Esimerkin 4 mukaisen henkilön tarvitsema laimennetun laskimonsisäisesti annettavan treprostiniilin pitoisuus saataisiin siis lisäämällä sopivaan säiliöön 2,7 millilitraa Treposa-valmistetta, jonka vahvuus on 2,5 mg/ml, sekä riittävä määrä laimennusainetta, jotta kokonaistilavuudeksi säiliössä saadaan 100 ml liuosta. Esimerkin mukaisessa tilanteessa pumpun infuusionopeudeksi asetettaisiin 2 ml/h.
Taulukossa 2 on ohjeet Treposa-valmisteen (vahvuus 1 mg/ml) tilavuudesta (millilitroina) valmistettaessa laimennoksia säiliöihin, joiden tilavuus on 20 ml, 50 ml tai 100 ml (jolloin vastaava infuusionopeus on 0,4, 1 tai 2 ml/h), eripainoisille potilaille; suurin annos 42,5 ng/kg/min.
Taulukko 2:
Treposa 1,0 mg/ml -valmisteen tilavuus (ml), joka laimennetaan lääkesäiliöihin tai ruiskuihin 20 ml:n (0,4 ml:n/h infuusionopeus), 50 ml:n (1 ml:n/h infuusionopeus), 100 ml:n lääkesäiliö (2 ml:n/h infuusionopeus) | ||||||||||||||||
Annos (ng/ kg/ min) | Potilaan paino (kg) | |||||||||||||||
| 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 | |
| 1,25 | 0,094 | 0,113 | 0,131 | 0,150 | 0,169 | 0,188 | 0,206 | 0,225 | 0,244 | 0,263 | 0,281 | 0,300 | 0,319 | 0,338 | 0,356 | 0,375 |
| 2,5 | 0,188 | 0,225 | 0,263 | 0,300 | 0,338 | 0,375 | 0,413 | 0,450 | 0,488 | 0,525 | 0,563 | 0,600 | 0,638 | 0,675 | 0,713 | 0,750 |
| 3,75 | 0,281 | 0,338 | 0,394 | 0,450 | 0,506 | 0,563 | 0,619 | 0,675 | 0,731 | 0,788 | 0,844 | 0,900 | 0,956 | 1,013 | 1,069 | 1,125 |
| 5 | 0,375 | 0,450 | 0,525 | 0,600 | 0,675 | 0,750 | 0,825 | 0,900 | 0,975 | 1,050 | 1,125 | 1,200 | 1,275 | 1,350 | 1,425 | 1,500 |
| 6,25 | 0,469 | 0,563 | 0,656 | 0,750 | 0,844 | 0,938 | 1,031 | 1,125 | 1,219 | 1,313 | 1,406 | 1,500 | 1,594 | 1,688 | 1,781 | 1,875 |
| 7,5 | 0,563 | 0,675 | 0,788 | 0,900 | 1,013 | 1,125 | 1,238 | 1,350 | 1,463 | 1,575 | 1,688 | 1,800 | 1,913 | 2,025 | 2,138 | 2,250 |
| 8,75 | 0,656 | 0,788 | 0,919 | 1,050 | 1,181 | 1,313 | 1,444 | 1,575 | 1,706 | 1,838 | 1,969 | 2,100 | 2,231 | 2,363 | 2,494 | 2,625 |
| 10 | 0,750 | 0,900 | 1,050 | 1,200 | 1,350 | 1,500 | 1,650 | 1,800 | 1,950 | 2,100 | 2,250 | 2,400 | 2,550 | 2,700 | 2,850 | 3,000 |
| 11,25 | 0,844 | 1,013 | 1,181 | 1,350 | 1,519 | 1,688 | 1,856 | 2,025 | 2,194 | 2,363 | 2,531 | 2,700 | 2,869 | 3,038 | 3,206 | 3,375 |
| 12,5 | 0,938 | 1,125 | 1,313 | 1,500 | 1,688 | 1,875 | 2,063 | 2,250 | 2,438 | 2,625 | 2,813 | 3,000 | 3,188 | 3,375 | 3,563 | 3,750 |
| 13,75 | 1,031 | 1,238 | 1,444 | 1,650 | 1,856 | 2,063 | 2,269 | 2,475 | 2,681 | 2,888 | 3,094 | 3,300 | 3,506 | 3,713 | 3,919 | 4,125 |
| 15 | 1,125 | 1,350 | 1,575 | 1,800 | 2,025 | 2,250 | 2,475 | 2,700 | 2,925 | 3,150 | 3,375 | 3,600 | 3,825 | 4,050 | 4,275 | 4,500 |
| 16,25 | 1,219 | 1,463 | 1,706 | 1,950 | 2,194 | 2,438 | 2,681 | 2,925 | 3,169 | 3,413 | 3,656 | 3,900 | 4,144 | 4,388 | 4,631 | 4,875 |
| 17,5 | 1,313 | 1,575 | 1,838 | 2,100 | 2,363 | 2,625 | 2,888 | 3,150 | 3,413 | 3,675 | 3,938 | 4,200 | 4,463 | 4,725 | 4,988 | 5,250 |
| 18,75 | 1,406 | 1,688 | 1,969 | 2,250 | 2,531 | 2,813 | 3,094 | 3,375 | 3,656 | 3,938 | 4,219 | 4,500 | 4,781 | 5,063 | 5,344 | 5,625 |
| 20 | 1,500 | 1,800 | 2,100 | 2,400 | 2,700 | 3,000 | 3,300 | 3,600 | 3,900 | 4,200 | 4,500 | 4,800 | 5,100 | 5,400 | 5,700 | 6,000 |
| 21,25 | 1,594 | 1,913 | 2,231 | 2,550 | 2,869 | 3,188 | 3,506 | 3,825 | 4,144 | 4,463 | 4,781 | 5,100 | 5,419 | 5,738 | 6,056 | 6,375 |
| 22,5 | 1,688 | 2,025 | 2,363 | 2,700 | 3,038 | 3,375 | 3,713 | 4,050 | 4,388 | 4,725 | 5,063 | 5,400 | 5,738 | 6,075 | 6,413 | 6,750 |
| 23,75 | 1,781 | 2,138 | 2,494 | 2,850 | 3,206 | 3,563 | 3,919 | 4,275 | 4,631 | 4,988 | 5,344 | 5,700 | 6,056 | 6,413 | 6,769 | 7,125 |
| 25 | 1,875 | 2,250 | 2,625 | 3,000 | 3,375 | 3,750 | 4,125 | 4,500 | 4,875 | 5,250 | 5,625 | 6,000 | 6,375 | 6,750 | 7,125 | 7,500 |
| 27,5 | 2,063 | 2,475 | 2,888 | 3,300 | 3,713 | 4,125 | 4,538 | 4,950 | 5,363 | 5,775 | 6,188 | 6,600 | 7,013 | 7,425 | 7,838 | 8,250 |
| 30 | 2,250 | 2,700 | 3,150 | 3,600 | 4,050 | 4,500 | 4,950 | 5,400 | 5,850 | 6,300 | 6,750 | 7,200 | 7,650 | 8,100 | 8,550 | 9,000 |
| 32,5 | 2,438 | 2,925 | 3,413 | 3,900 | 4,388 | 4,875 | 5,363 | 5,850 | 6,338 | 6,825 | 7,313 | 7,800 | 8,288 | 8,775 | 9,263 | 9,750 |
| 35 | 2,625 | 3,150 | 3,675 | 4,200 | 4,725 | 5,250 | 5,775 | 6,300 | 6,825 | 7,350 | 7,875 | 8,400 | 8,925 | 9,450 | 9,975 | 10,500 |
| 37,5 | 2,813 | 3,375 | 3,938 | 4,500 | 5,063 | 5,625 | 6,188 | 6,750 | 7,313 | 7,875 | 8,438 | 9,000 | 9,563 | 10,125 | 10,688 | 11,250 |
| 40 | 3,000 | 3,600 | 4,200 | 4,800 | 5,400 | 6,000 | 6,600 | 7,200 | 7,800 | 8,400 | 9,000 | 9,600 | 10,200 | 10,800 | 11,400 | 12,000 |
| 42,5 | 3,188 | 3,825 | 4,463 | 5,100 | 5,738 | 6,375 | 7,013 | 7,650 | 8,288 | 8,925 | 9,563 | 10,200 | 10,838 | 11,475 | 12,113 | 12,750 |
Jatkuvaa laskimonsisäistä infuusiohoitoa ulkoisen mukana kannettavan pumpun avulla saavien potilaiden opastus
Hoidosta vastaavan henkilökunnan on varmistettava, että potilas on saanut kaiken asianmukaisen opastuksen ja osaa käyttää valittua infuusiolaitetta. Henkilökohtaista opastusta ja valvontaa tulee jatkaa, kunnes potilaan arvioidaan pystyvän vaihtamaan infuusion, muuttamaan infuusionopeutta/annosta ohjeen mukaan sekä selviytymään tavallisista laitteen hälytyksistä. Potilaalle tulee neuvoa treprostiniili-infuusiosäiliön käyttöön ja infuusiolaitteen letkujen ja liitäntöjen valmisteluun liittyvä asianmukainen aseptinen tekniikka. Potilaalle on annettava joko pumpun valmistajan tai hoitavan lääkärin erikseen laatimat kirjalliset ohjeet. Ohjeisiin tulee sisältyä lääkkeen normaalin annostelun edellyttämät toimet, ohjeet tukkeutumien ja muiden pumppuun liittyvien hälytysten varalta, sekä tiedot siitä, keneen tulee ottaa yhteyttä hätätilanteessa.
Katetriin liittyvän verenkierron infektioriskin minimointi ulkoista mukana kannettavaa pumppua käytettäessä
Seuraaviin seikkoihin tulee kiinnittää erityistä huomiota katetriin liittyvien verenkierron infektioiden riskin minimoimiseksi potilailla, jotka saavat treprostiniili-infuusiohoitoa laskimonsisäisesti käyttämällä ulkoista mukana kannettavaa pumppua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ohjeistus noudattaa tämänhetkisiä hoitosuosituksia, jotka tähtäävät katetreihin liittyvien verenkierron infektioiden torjuntaan, ja se käsittää seuraavaa:
Yleiset periaatteet
- Sellaisen kalvosimella varustetun ja tunneloidun keskuslaskimokatetrin käyttö, jossa on mahdollisimman vähän portteja.
- Keskuslaskimokatetrin asennus steriiliä tekniikkaa noudattaen.
- Asianmukaisen käsihygienian ja aseptisen tekniikan noudattaminen katetrin asennuksen, vaihdon, käytön ja korjauksen yhteydessä sekä katetrin sisäänvientikohtaa tutkittaessa ja/tai siihen sidettä laitettaessa.
- Katetrin sisäänvientikohta tulee peittää steriilillä harsotaitoksella (joka vaihdetaan joka toinen päivä) tai steriilillä läpinäkyvällä puoliläpäisevällä siteellä (joka vaihdetaan vähintään kerran viikossa).
- Side tulee vaihtaa, mikäli se kastuu, löystyy tai likaantuu, sekä aina katetrin sisäänvientikohdan tutkimuksen jälkeen.
- Paikallisesti käytettäviä antibioottisalvoja ja ‑voiteita ei tule käyttää, koska ne voivat edistää sieni-infektioiden ja antibioottiresistenttien bakteerien kasvua.
Laimennetun Treposa-liuoksen käytön kesto
- Laimennettu valmiste tulee käyttää 24 tunnin kuluessa.
0,2 mikrometrin suodattimen käyttö infuusiojärjestelmässä
- Infuusioletkun ja katetrin kannan välillä on oltava 0,2 mikrometrin suodatin, joka vaihdetaan 24 tunnin välein infuusiosäiliön vaihdon yhteydessä.
Lisäksi katetrin kannan hoitoon liittyy kaksi muuta suositusta, joilla voi olla tärkeä merkitys veden kautta välittyvien gramnegatiivisten bakteerien aiheuttamien verenkierron infektioiden ehkäisemiseksi. Näitä toimenpiteitä ovat:
Umpikantainen katetri, jossa on jaettu väliseinä
- Umpikantaisen katetrin käytöllä (jossa on mieluummin jaettu väliseinä kuin mekaaninen venttiili) varmistetaan, että katetrin luumen pysyy suljettuna aina infuusiojärjestelmän ollessa irrotettuna. Tämä estää mikrobikontaminaatiolle altistumisen riskin.
- Umpikantainen katetri, jossa on jaettu väliseinä, tulee vaihtaa 7 päivän välein.
Infuusiojärjestelmän luer lock ‑yhteenliitännät
Veden kautta kulkeutuvien gramnegatiivisten bakteerien kontaminaation riski todennäköisesti kasvaa, mikäli järjestelmän luer lock ‑yhteenliitäntä on märkä joko infuusioletkun tai umpikantaisen katetrin vaihdon aikana.
Sen vuoksi
- uimista ja katetrin kannassa olevan infuusiojärjestelmän upottamista veteen tulee välttää.
- umpikantaista katetria vaihdettaessa luer lock ‑liitännän kierteissä ei tulisi näkyä lainkaan vettä.
- infuusioletku tulee irrottaa umpinaisesta katetrin kannasta ainoastaan 24 tunnin välein vaihdon aikana.
Jatkuvan laskimoinfuusion antaminen Treposa-valmisteen laskimonsisäiseen antoon tarkoitetulla kehoon täysin implantoitavalla pumpulla
Treposa-valmiste voidaan antaa jatkuvana laskimonsisäisenä infuusiona keskuslaskimokatetrin kautta käyttämällä Treposa-valmisteen laskimonsisäiseen antoon tarkoitettua kirurgisesti asetettavaa kehoon täysin implantoitavaa infuusiopumppua, jossa on hälytin (integroituna tukkeutuman ja akun tyhjentymisen hälytykset) ja sisäinen 0,22 mikrom:n suodatin verenkierron infektioriskin vähentämiseksi. Implantoitavia vakiovirtausnopeuspumppuja on saatavana eri säiliötilavuuksina ja malleina, jotka sopivat yksilöllisen infuusioannoksen antoon ja joiden avulla vältetään ali- ja yliannostustilanteet. Välikalvon käyttöiän on oltava vähintään 500 pistosta täyttöportin ja 250 pistosta katetrin osalta.
Noudata tarkasti pumpun valmistajan laatimassa käyttöoppaassa mainittuja pumpun valmistelua, implantointia, seurantaa ja uudelleentäyttöä koskevia ohjeita.
Saatavissa olevien säilyvyyttä koskevien kokeellisten tietojen perusteella on suositeltavaa käyttää implantoitavan pumpun säiliön täyttämiseen suurempaa pitoisuutta kuin 0,5 mg/ml, jos se on mahdollista (ks. kohta Kestoaika). Täydelliset tiedot painoon ja pumpun ominaisuuksiin perustuvia laskelmia varten ovat pumpun valmistajan laatimassa käyttöoppaassa.
Jatkuva laskimonsisäinen infuusio implantoitavalla pumpulla on rajattava sellaisten valikoitujen potilaiden hoitoon, jotka sietävät itse toimenpiteen ja joiden on jo osoitettu sietävän treprostiniilia, joiden tila on stabiili treprostiniili-infuusiohoidossa ja jotka eivät enää siedä tai eivät sovellu käyttämään ulkoista pumppua tai kieltäytyvät lääkkeen antamisesta ihon alle tai laskimoon ulkoisella pumpulla.
Aloitusannos implantoitavalla pumpulla on sama kuin vakioannos ulkoisella infuusiopumpulla antotapojen vaihtamishetkellä. Implantoitavaa pumppua ei ole tarkoitettu aloitusannoksen säätämiseen.
Vain pätevät infuusiojärjestelmän toimintaan ja käyttöön koulutuksen saaneet lääkärit saavat implantoida infuusiopumpun.
Pumpun saa täyttää uudelleen vain sairaalassa ja vain ne pätevät terveydenhuollon ammattilaiset, jotka ovat saaneet koulutuksen infuusiojärjestelmän toimintaan ja sen käyttöön valmistajan laatiman käyttöoppaan ohjeiden mukaisesti ja joilla on valmius hoitaa pumppua ympäröivään ihonalaiskudokseen tahattomasti annetusta treprostiniili-injektiosta tai treprostoniilivuodosta mahdollisesti aiheutuvia komplikaatioita.
Implantoitavien vakiovirtausnopeusinfuusiopumppujen käytössä saattaa esiintyä infuusionopeuden poikkeamia käytön aikana. Implantoidun pumpun turvallinen kliininen käyttö varmistetaan siten, että pumpun käyttöön perehtynyt terveydenhuollon ammattilainen vertaa todellista kliinistä virtausnopeutta jokaisella uudelleentäyttökerralla mitattuun pumpussa jäljellä olevaan lääkemäärään. Asianmukaiset toimenpiteet on varmistettava jokaisella uudelleentäyttökerralla pumpun valmistajan laatimasta käyttöoppaasta.
Potilasta on kehotettava ottamaan tukkeutumahälytyksen yhteydessä välittömästi yhteyttä hoitoyksikköön sairaalassa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille
- Laskimoja ahtauttavaan tautiin liittyvä pulmonaalihypertensio
- Vaikeasta sydämen vasemman kammion toimintahäiriöstä johtuva sydämen kongestiivinen vajaatoiminta
- Vaikea maksan vajaatoiminta (Child-Pugh-luokka C)
- Aktiivinen maha-suolikanavan haavauma, kallonsisäinen verenvuoto, vamma tai muu verenvuotosairaus
- Synnynnäinen tai hankinnainen läppävika, johon liittyy kliinisesti merkittävä pulmonaalihypertensiosta riippumaton sydänlihaksen toimintahäiriö
- Vaikea sepelvaltimotauti tai epävakaa rintakipu; sydäninfarkti kuluneiden kuuden kuukauden aikana; kompensoitumaton sydämen vajaatoiminta, jos potilas ei ole tarkassa lääkärin seurannassa; vaikeat rytmihäiriöt; aivoverisuonitapahtumat (esim. TIA, aivohalvaus) kuluneiden kolmen kuukauden aikana.
Varoitukset ja käyttöön liittyvät varotoimet
Päätettäessä treprostiniilihoidon aloittamisesta tulee huomioida, että jatkuvaa infuusiota on hyvin todennäköisesti jatkettava pitkäkestoisesti. Näin ollen potilaan kyky hyväksyä kestokatetri ja infuusiopumppu sekä kyky huolehtia niistä on arvioitava tarkoin.
Treprostiniili on vahva keuhkojen ja systeemisen verenkierron verisuonia laajentava lääkeaine. Henkilöillä, joilla systeeminen valtimopaine on matala, treprostiniilihoito voi lisätä systeemisen hypotension vaaraa. Hoitoa ei suositella annettavaksi potilaille, joiden systolinen valtimopaine on alle 85 mmHg.
On suositeltavaa, että systeemistä verenpainetta ja sydämen sykettä tarkkaillaan annostuksen muutosten aikana ja neuvotaan lopettamaan infuusio, jos hypotensio-oireita ilmenee, tai jos systolinen verenpaine on 85 mmHg tai matalampi.
Treprostiniilihoidon äkillinen keskeyttäminen tai nopeasti tehtävät annostuksen huomattavat pienennykset voivat aiheuttaa rebound-ilmiönä pulmonaalihypertension pahenemisen (ks. kohta Annostus ja antotapa).
Jos potilaalla ilmenee keuhkopöhö treprostiniilihoidon aikana, keuhkolaskimoita ahtauttavan taudin mahdollisuus on otettava huomioon. Hoito tulee keskeyttää.
Lihavilla potilailla (painoindeksi yli 30 kg/m2) treprostiniili poistuu elimistöstä hitaammin.
Ihon alle annettavan treprostiniilihoidon hyötyä vaikeampaa pulmonaalihypertensiota (NYHA-luokituksen toiminnallinen luokka IV) sairastavien hoidossa ei ole osoitettu.
Treprostiniilihoidon tehon ja turvallisuuden suhdetta ei ole tutkittu sydämen vasemmalta oikealle suuntautuvaan oikovirtaukseen, porttilaskimon hypertensioon tai HIV‑infektioon liittyvän pulmonaalihypertension yhteydessä.
Maksan vajaatoimintaa sairastavien potilaiden annostuksessa on oltava varovainen (ks. kohta Annostus ja antotapa).
Varovaisuutta kehotetaan noudattamaan sellaisissa tiloissa, joissa treprostiniili saattaa aiheuttaa lisääntyneen vuotoriskin ehkäisemällä verihiutaleiden aggregaatiota.
Tämä lääkevalmiste sisältää enintään 36,8 mg natriumia per 10 ml:n injektiopullo, joka vastaa 1,8 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Sytokromi P450 (CYP)2C8 ‑entsyymin estäjän (esim. gemfibrotsiilin) samanaikainen antaminen voi lisätä treprostiniilialtistusta (sekä Cmax‑ että AUC‑arvoja). Lisääntynyt altistus lisää todennäköisesti treprostiniilin antamiseen liittyviä haittatapahtumia. Treprostiniilin annostuksen pienentämistä on harkittava (ks. kohta Yhteisvaikutukset).
CYP2C8-entsyymin indusoijan (esim. rifampisiinin) samanaikainen antaminen voi vähentää treprostiniilialtistusta. Vähentynyt altistus vähentää todennäköisesti kliinistä tehokkuutta. Treprostiniilin annostuksen suurentamista on harkittava (ks. kohta Yhteisvaikutukset).
Laskimonsisäiseen lääkkeenantojärjestelmään liittyvät haittatapahtumat
Laskimonsisäistä treprostiniili-infuusiohoitoa saavilla potilailla on raportoitu keskuslaskimokatetriin liittyviä verenkierron infektioita ja sepsistä. Nämä riskit ovat yhdistettävissä lääkkeenantojärjestelmään. Yhdysvaltain tartuntatautiviraston CDC:n retrospektiivisessä tutkimuksessa oli mukana seitsemän Yhdysvalloissa sijaitsevaa tutkimuskeskusta, joissa annettiin laskimonsisäistä treprostiniilihoitoa pulmonaalihypertension hoitoon käyttämällä ulkoista mukana kannettavaa pumppua. Tutkimuksessa todettiin katetreihin liittyvien verenkierron infektioiden ilmaantuvuudeksi 1,10 tapahtumaa 1 000:ta katetripäivää kohti. Kliinikoiden tulee olla tietoisia erilaisista gramnegatiivisista ja grampositiivisista mikrobeista, jotka voivat keskuslaskimokatetrin pitkäaikaiskäytössä aiheuttaa potilaille infektioita. Jatkuva ihonalainen hoito laimentamattomalla Treposa-valmisteella on sen vuoksi suositeltava antotapa.
Infektioriski, mukaan lukien verenkierron infektioriski, on merkittävästi pienempi kehoon täysin implantoidun pumpun kuin ulkoisen mukana kannettavan pumpun käytössä.
Hoidosta vastaavan henkilökunnan on varmistettava, että potilas on saanut kaiken asianmukaisen opastuksen ja osaa käyttää valittua infuusiolaitteistoa (ks. kohta Annostus ja antotapa).
Yhteisvaikutukset
Huomioitavat yhteisvaikutukset
+ Diureetit, verenpainelääkkeet tai muut vasodilatoivat valmisteet
Treprostiniilin samanaikainen käyttö diureettien, verenpainelääkkeiden tai muiden vasodilatoivien valmisteiden kanssa lisää systeemisen hypotension vaaraa.
+ Verihiutaleiden aggregaatiota estävät lääkkeet, mukaan lukien tulehduskipulääkkeet ja antikoagulantit
Treprostiniili saattaa estää verihiutaleiden toimintaa. Treprostiniilin samanaikainen käyttö verihiutaleiden aggregaatiota estävien lääkeaineiden kanssa saattaa lisätä verenvuotovaaraa. Näitä valmisteita ovat mm. tulehduskipulääkkeet (NSAIDit), typpioksidin luovuttajat ja antikoagulantit. Antikoagulantteja käyttävien potilaiden valvonnasta tulee huolehtia tarkoin tällaisten hoitojen tavanomaisten lääketieteellisten seurantasuositusten mukaisesti. Samanaikaista muiden verihiutaleiden toimintaa ehkäisevien valmisteiden käyttöä tulee välttää potilailla, jotka käyttävät antikoagulantteja. Jatkuva ihonalainen treprostiniili-infuusio ei vaikuttanut varfariinin yksittäisannoksen (25 mg) farmakodynamiikkaan tai farmakokinetiikkaan. Treprostiniilin ja typpioksidin luovuttajien samanaikaisen käytön aiheuttamista verenvuotoriskiä lisäävistä mahdollisista yhteisvaikutuksista ei ole saatavilla tietoa.
+ Furosemidi
Furosemidihoitoa saavilla potilailla treprostiniilin puhdistuma plasmasta saattaa olla hieman pienentynyt. Tämä yhteisvaikutus johtuu todennäköisesti joistakin kummallekin yhdisteelle yhteisistä metaboliaominaisuuksista (karboksylaattiryhmän glukuronidikonjugaatio).
+ Sytokromi P450 (CYP)2C8 -entsyymin indusoijat/estäjät
Gemfibrotsiili – Ihmisten farmakokineettiset tutkimukset suun kautta otettavalla treprostiniilidiolamiinilla osoittivat, että sytokromi P450 (CYP)2C8 ‑entsyymin estäjän, gemfibrotsiilin, samanaikainen antaminen kaksinkertaistaa treprostiniilialtistuksen (sekä Cmax‑ että AUC‑arvot). Ei ole määritetty, muuttavatko CYP2C8:n estäjät parenteraalisesti (ihon alle tai laskimoon) annettavan treprostiniilin turvallisuutta ja tehoa. Jos CYP2C8:n estäjä (esim. gemfibrotsiili, trimetopriimi ja deferasiroksi) lisätään potilaan lääkitykseen tai poistetaan potilaan lääkityksestä lääkkeen titrausjakson jälkeen, treprostiniilin annoksen säätämistä on harkittava.
Rifampisiini – Ihmisten farmakokineettiset tutkimukset suun kautta otettavalla treprostiniilidiolamiinilla osoittavat, että CYP2C8-entsyymin indusoijan, rifampisiinin, samanaikainen antaminen vähentää treprostiniilialtistusta (noin 20 %). Ei ole määritetty, muuttaako rifampisiini parenteraalisesti (ihon alle tai laskimoon) annettavan treprostiniilin turvallisuutta ja tehoa. Jos rifampisiini lisätään potilaan lääkitykseen tai poistetaan potilaan lääkityksestä lääkkeen titrausjakson jälkeen, treprostiniilin annoksen säätämistä on harkittava.
CYP2C8:n indusoijat (esim. fenytoiini, karbamatsepiini, fenobarbitaali ja mäkikuisma) voivat vähentää treprostiniilialtistusta. Jos CYP2C8:n indusoija lisätään potilaan lääkitykseen tai poistetaan potilaan lääkityksestä lääkkeen titrausjakson jälkeen, treprostiniilin annoksen säätämistä on harkittava.
+ Bosentaani
Bosentaanilla (250 mg/vrk) ja treprostiniilidiolamiinilla (suun kautta 2 mg/vrk) suoritetussa ihmisiä koskevassa farmakokineettisessä tutkimuksessa ei havaittu treprostiniilin ja bosentaanin välisiä farmakokineettisiä yhteisvaikutuksia.
+ Sildenafiili
Sildenafiililla (60 mg/vrk) ja treprostiniilidiolamiinilla (suun kautta 2 mg/vrk) suoritetussa ihmisiä koskevassa farmakokineettisessä tutkimuksessa ei havaittu treprostiniilin ja sildenafiilin välisiä farmakokineettisiä yhteisvaikutuksia.
Raskaus ja imetys
Raskaus
Ei ole olemassa riittäviä tietoja treprostiniilin käytöstä raskaana oleville naisille. Ei ole tehty riittäviä eläinkokeita raskauteen kohdistuvien vaikutusten selvittämiseksi (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista ihmiselle aiheutuvaa riskiä ei tunneta. Treprostiniilia tulee käyttää raskauden aikana ainoastaan, jos mahdollinen hyöty äidille oikeuttaa sikiölle aiheutuvan mahdollisen riskin.
Naiset, jotka voivat tulla raskaaksi
Treprostiniilihoidon aikana suositellaan raskaudenehkäisyä.
Imetys
Ei tiedetä, erittyykö treprostiniili ihmisen rintamaitoon. Imettäviä, treprostiniilihoitoa saavia naisia on kehotettava lopettamaan imettäminen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Hoidon aloittamiseen tai annostuksen muutoksiin saattaa liittyä haittavaikutuksia, kuten oireista systeemistä hypotensiota tai heitehuimausta, jotka voivat heikentää ajokykyä ja koneiden käyttökykyä.
Haittavaikutukset
Lumekontrolloiduissa tutkimuksissa ja markkinoille tulon jälkeen havaitut treprostiniilin haittavaikutukset on lueteltu esiintymistiheyden mukaan seuraavan käytännön mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutustaulukko
Elinjärjestelmän luokka | Haittavaikutus | Yleisyysluokka |
Hermosto | Päänsärky | Hyvin yleinen |
Heitehuimaus | Yleinen | |
Verisuonisto | Vasodilataatio, punehtuminen | Hyvin yleinen |
Hypotensio | Yleinen | |
Verenvuototapahtuma§ | Yleinen | |
Tromboflebiitti* | Tuntematon | |
Ruoansulatuselimistö | Ripuli, pahoinvointi | Hyvin yleinen |
Oksentelu | Yleinen | |
Iho ja ihonalainen kudos | Ihottuma | Hyvin yleinen |
Kutina | Yleinen | |
Yleistyneet ihottumat (luonteeltaan makulaarisia tai papulaarisia) | Tuntematon | |
Luusto, lihakset ja sidekudos | Leukakipu | Hyvin yleinen |
Lihaskipu, nivelkipu | Yleinen | |
Raajakipu | Yleinen | |
Luukipu | Tuntematon | |
Yleisoireet ja antopaikassa todettavat haitat | Infuusiokohdan kipu, infuusiokohdan reaktio, verenvuoto tai hematooma | Hyvin yleinen |
Turvotus | Yleinen | |
Veri ja imukudos | Trombosytopenia | Tuntematon |
Infektiot | Keskuslaskimokatetriin liittyvä verenkierron infektio, sepsis, bakteremia** | Tuntematon |
Infuusiokohdan infektio, infuusiokohdan ihonalainen absessi | Tuntematon | |
Selluliitti | Tuntematon | |
Sydän | Sydämen suureen minuuttitilavuuteen liittyvä vajaatoiminta | Tuntematon |
* Perifeeriseen laskimoinfuusioon liittyviä tromboflebiittitapauksia on raportoitu.
** Hengenvaarallisia ja kuolemaan johtaneita tapauksia on raportoitu.
§ Katso kohta ”Valikoitujen haittatapahtumien kuvaus”
Valikoitujen haittatapahtumien kuvaus
Verenvuototapahtumat
Verenvuototapahtumat olivat yleisiä, kuten oli odotettua potilasryhmässä, josta suuri osa sai antikoagulanttihoitoa. Koska treprostiniililla on vaikutuksia verihiutaleiden aggregaatioon, se saattaa lisätä verenvuotovaaraa; kontrolloiduissa kliinisissä tutkimuksissa havaittiin nenäverenvuotojen ja maha-suolikanavan verenvuotojen (mukaan lukien maha-suolikanavan, peräsuolen ja ikenien verenvuotojen ja veriulosteen) ilmaantuvuuden lisääntymistä. Myös veriysköksiä, verioksennuksia ja verivirtsaisuutta raportoitiin, mutta niiden esiintymistiheys oli sama tai harvempi kuin lumelääkettä saaneen ryhmän.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Treprostiniilin yliannostuksen oireet ovat samankaltaisia kuin annostuksen suurentamista todennäköisesti rajoittavat vaikutukset. Näitä ovat punehtuminen, päänsärky, hypotensio, pahoinvointi, oksentelu ja ripuli. Yliannostusoireiden ilmetessä potilaan on oireiden vaikeusasteen mukaan välittömästi joko pienennettävä treprostiniiliannostaan tai keskeytettävä hoito siihen saakka, kunnes yliannostusoireet väistyvät. Uudelleenannostelu on aloitettava varovaisesti lääkärin valvonnassa ja potilasta on seurattava tarkkaan epätoivottujen oireiden uusiutumisen varalta.
Tunnettua antidoottia ei ole.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: AGGREGAATION ESTÄJÄT LUKUUN OTTAMATTA HEPARIINIA
ATC-koodi: B01AC21
Vaikutusmekanismi:
Treprostiniili on prostasykliinianalogi.
Sillä on suora verisuonia laajentava vaikutus keuhkojen ja elimistön valtimoverenkierrossa, ja se estää verihiutaleiden aggregaatiota.
Eläimillä tällaiset verisuonia laajentavat vaikutukset vähentävät oikean ja vasemman kammion jälkikuormitusta ja lisäävät sydämen minuuttitilavuutta ja iskutilavuutta. Treprostiniilin vaikutus eläinten sydämen sykkeeseen vaihtelee annostuksen mukaan. Merkittäviä sydämen johtumiseen kohdistuvia vaikutuksia ei ole havaittu.
Tiedot tehosta pulmonaalihypertensiota sairastavilla aikuisilla:
Ihonalaisesti annosteltua treprostiniilia koskevat tutkimukset
Jatkuvana ihonalaisena infuusiona annetulla treprostiniililla on tehty kaksi vaiheen III satunnaistettua, kaksoissokkoutettua lumelääkekontrolloitua kliinistä tutkimusta vakaassa tilassa olevaa pulmonaalihypertensiota sairastavilla potilailla. Näihin kahteen tutkimukseen osallistui yhteensä 469 aikuista: 270 sairasti idiopaattista tai perinnöllistä pulmonaalihypertensiota (treprostiniiliryhmä = 134 potilasta, lumelääkeryhmä = 136 potilasta), 90 potilasta sairasti sidekudossairauteen (pääasiassa skleroderma) liittyvää pulmonaalihypertensiota (treprostiniiliryhmä = 41 potilasta, lumelääkeryhmä = 49 potilasta), ja 109 potilasta sairasti synnynnäisestä sydänsairaudesta johtuvaa vasemmalta oikealle suuntautuvaan oikovirtaukseen liittyvää pulmonaalihypertensiota (treprostiniili = 58 potilasta, lumelääke = 51 potilasta). Alkutilanteessa 6 minuutin kävelytestin keskimääräinen tulos oli 326 ± 5 metriä treprostiniilia ihonalaisena infuusiona saaneessa ryhmässä ja 327 ± 6 metriä lumelääkettä saaneessa ryhmässä. Kummankin verrattavana olevan hoidon annostusta lisättiin asteittain tutkimuksen aikana pulmonaalihypertension oireiden ja hoidon kliinisen siedettävyyden perusteella. 12 viikon jälkeen saavutettu annostus oli keskimäärin 9,3 ng/kg/min treprostiniiliryhmässä ja 19,1 ng/kg/min lumelääkeryhmässä. 12 viikon hoidon jälkeen 6 minuutin kävelytestin keskimääräinen muutos verrattuna alkutilanteeseen oli kummankin tutkimuksen kokonaispopulaatiosta laskettuna −2 metriä ± 6,61 metriä treprostiniilia saaneilla potilailla ja −21,8 metriä ± 6,18 metriä lumelääkeryhmässä. Nämä tulokset kuvastivat hoidon keskimääräistä tehoa 6 minuutin kävelytestin tuloksella 19,7 metriä (p = 0,0064) verrattuna lumelääkkeeseen kummankin tutkimuksen kokonaispopulaation osalta. Keskimääräiset muutokset verrattuna alkutilanteen hemodynaamisiin muuttujiin (keskimääräinen keuhkovaltimopaine [PAPm], oikea eteispaine [RAP], keuhkoverenkierron vastus [PVR], sydämen minuutti-indeksi [CI] ja laskimoiden happikyllästeisyys [SvO2]) osoittivat treprostiniilin paremmuuden verrattuna lumelääkkeeseen. Pulmonaalihypertension merkit ja oireet (pyörtyminen, huimaus, rintakipu, väsymys ja hengenahdistus) lievittyivät tilastollisesti merkitsevästi (p < 0,0001). Lisäksi treprostiniilihoitoa saaneiden potilaiden hengenahdistusta ja väsymystä mittaava luokitus ja Borgin hengenahdistusta mittaava pisteytys paranivat 12 viikon jälkeen (p < 0,0001). Treprostiniilille vasteen saaneiden tutkittavien määräksi osoitettiin 15,9 % (37/233) ja lumelääkkeelle vasteen saaneiden tutkittavien määräksi osoitettiin 3,4 % (8/236) analyysissa, jossa yhdistettiin seuraavat kriteerit: fyysisen suorituskyvyn (6 minuutin kävelytesti) paraneminen vähintään 10 % 12 viikon jälkeen alkutilanteeseen verrattuna, NYHA-luokituksessa vähintään yhden luokan paraneminen 12 viikon jälkeen alkutilanteeseen verrattuna ja pulmonaalihypertension pahenemisen pysähtyminen, sekä se, ettei kummankaan tutkimuksen kokonaispopulaatiossa ilmoitettu kuolemia ennen viikkoa 12. Kokonaispopulaation alaryhmäanalyysi osoitti treprostiniilin hoitovaikutuksen olevan tilastollisesti merkitsevä verrattuna lumelääkkeeseen 6 minuutin kävelytestissä niiden tutkittavien alaryhmässä, joilla oli idiopaattinen tai perinnöllinen pulmonaalihypertensio (p = 0,043), mutta ei niiden tutkittavien alaryhmässä, joilla oli sklerodermaan tai synnynnäiseen sydänsairauteen liittyvä pulmonaalihypertensio.
Havaittu vaikutus ensisijaiseen päätetapahtumaan (ts. muutos 6 minuutin kävelytestissä 12 viikon hoidon jälkeen) oli pienempi kuin aiemmissa vertailututkimuksissa bosentaanilla, iloprostilla ja epoprostenolilla.
Treprostiniilin ja epoprostenolin laskimoon annettavien infuusioiden suoraa vertailevaa tutkimusta ei ole tehty.
Pulmonaalihypertensiota sairastavilla lapsilla ei ole tehty erityisiä tutkimuksia.
Kliinisistä tutkimuksista, joissa pulmonaalihypertensiota sairastavilla potilailla käytettäisiin aktiivista lääkettä vertailuaineena, ei ole tietoja.
Farmakokinetiikka
Ihmisellä vakaan tilan pitoisuus plasmassa saavutetaan tavallisesti 15–18 tunnin kuluessa joko ihon alle tai laskimonsisäisesti annettavan treprostiniili-infuusion aloittamisesta. Plasman vakaan tilan treprostiniilipitoisuudet ovat annosriippuvaisia infuusiona nopeudella 2,5–125 ng/kg/min annettuna.
Ihonalaisesti ja laskimoon annetut treprostiniiliannokset olivat vakaassa tilassa bioekvivalentteja annoksen ollessa 10 ng/kg/min.
Eliminaation keskimääräinen näennäinen puoliintumisaika ihonalaisen annon jälkeen oli 1,32–1,42 tuntia yli 6 tunnin infuusioiden jälkeen, 4,61 tuntia yli 72 tunnin infuusioiden jälkeen, ja 2,93 tuntia vähintään 3 viikkoa kestäneiden infuusioiden jälkeen. Treprostiniilin keskimääräinen jakautumistilavuus oli 1,11–1,22 l/kg ja puhdistuma plasmasta 586,2–646,9 ml/kg/h. Lihavilla potilailla (painoindeksi > 30 kg/m2) puhdistuma on pienentynyt.
Terveillä vapaaehtoisilla 14C‑leimatulla radioaktiivisella treprostiniililla tehdyssä tutkimuksessa ihonalaisesti annetusta radioaktiivisesta annoksesta havaittiin 78,6 % virtsassa ja 13,4 % ulosteissa 224 tunnin mittaisen jakson aikana. Mitään yksittäistä pääasiallista metaboliittia ei todettu. Virtsassa havaittiin viisi metaboliittia, joiden määrä vaihteli 10,2:sta 15,5 %:iin annetusta annoksesta. Nämä viisi metaboliittia yhdessä käsittivät kaikkiaan 64,4 %. Näistä kolme on muodostunut 3‑hydroksyylioktyyli-sivuketjun hapettumisen tuotteena, yksi on glukuronidikonjugaattijohdos (treprostiniiliglukuronidi) ja yksi on tunnistamaton. Vain 3,7 % annoksesta mitattiin virtsasta muuttumattomana kanta-aineena.
Seitsemän päivän mittaisessa 14 terveellä vapaaehtoisella tehdyssä pitkäkestoisessa farmakokineettisessä tutkimuksessa, jossa treprostiniilia annettiin ihonalaisena infuusiona 2,5–15 ng/kg/min, treprostiniilin vakaan tilan pitoisuudet plasmassa saavuttivat huippupitoisuuden kaksi kertaa (klo 1.00 yöllä ja klo 10.00 aamulla) sekä alimman pitoisuuden kaksi kertaa (klo 7.00 aamulla ja klo 16.00 iltapäivällä). Huippupitoisuudet olivat noin 20–30 % suuremmat kuin alimmat pitoisuudet.
In vitro ‑tutkimuksessa osoitettiin, että treprostiniili ei estä ihmisen maksan mikrosomaalisia sytokromi P450 ‑isoentsyymejä (CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ja CYP3A).
Treprostiniilihoito ei myöskään vaikuttanut indusoivasti maksan mikrosomaaliseen proteiiniin, P450‑sytokromin kokonaissisältöön (CYP) tai CYP1A‑, CYP2B‑ ja CYP3A‑isoentsyymien aktiivisuuteen.
Parasetamolilla (4 g/vrk) ja varfariinilla (25 mg/vrk) on tehty lääkkeiden yhteisvaikutustutkimuksia terveillä tutkittavilla. Näissä tutkimuksissa eivät osoitettu kliinisesti merkittävää farmakokineettistä vaikutusta treprostiniiliin farmakokinetiikkaan. Varfariinilla tehdyssä tutkimuksessa ei todettu ilmeistä farmakodynaamista tai farmakokineettistä yhteisvaikutusta treprostiniilin ja varfariinin välillä.
Treprostiniilin metabolia liittyy pääasiassa CYP2C8:aan.
Erityisryhmät
Heikentynyt maksan toiminta:
Porttilaskimon hypertensioon liittyvää pulmonaalihypertensiota ja lievää (n = 4) tai keskivaikeaa (n = 5) maksan vajaatoimintaa sairastavilla potilailla treprostiniilihoito ihonalaisesti annoksella 10 ng/kg/min 150 minuutin ajan tuotti AUC0–24 h‑arvon, joka oli 260–510 % korkeampi terveisiin tutkittaviin verrattuna. Maksan vajaatoimintaa sairastavilla potilailla puhdistuma heikkeni jopa 80 % verrattuna terveisiin aikuisiin (ks. kohta Annostus ja antotapa).
Heikentynyt munuaisten toiminta:
Vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla, jotka tarvitsivat dialyysihoitoa (n = 8), suun kautta ennen dialyysia ja sen jälkeen annetun 1 mg:n treprostiniilikerta-annoksen jälkeinen AUC0-inf-arvo ei poikennut merkittävästi terveiden tutkittavien arvosta.
Prekliiniset tiedot turvallisuudesta
13 ja 26 viikon pituisissa eläinkokeissa jatkuvat ihonalaiset treprostiniilinatriuminfuusiot aiheuttivat infuusiokohdan reaktioita rotille ja koirille (turvotusta/punoitusta, patteja/turpoamista, kipua/kosketusarkuutta). Koirilla todettiin vaikeita kliinisiä vaikutuksia (hypoaktiivisuus, oksentelu, löysä uloste ja infuusiokohdan turvotus) ja kuolemantapauksia (liittyen suolentuppeumiin ja peräsuolen esiinluiskahdukseen) niillä eläimillä, jotka saivat hoitoa ≥ 300 ng/kg/min. Näillä eläimillä mitattu keskimääräinen plasman vakaan tilan treprostiniilipitoisuus oli 7,85 ng/ml. Tämän tasoiset plasman pitoisuudet ihmisillä voidaan saavuttaa, kun treprostiniili-infuusioita annetaan annoksilla > 50 ng/kg/min.
Koska jatkuvasti riittävää treprostiniilialtistusta ei ole osoitettu millään annostuksella rotilla tehdyissä lisääntymistoksisuustutkimuksissa, nämä tutkimukset saattavat olla riittämättömiä koskien mahdollisia vaikutuksia hedelmällisyyteen sekä sikiön syntymää edeltävään ja syntymän jälkeiseen kehitykseen.
Pitkäaikaisia eläinkokeita treprostiniilin karsinogeenisuuden arvioimista varten ei ole toteutettu. In vitro‑ ja in vivo ‑genotoksisuustutkimuksissa treprostiniililla ei osoitettu olevan mutageenisia tai klastogeenisia vaikutuksia.
Yhteenvetona voidaan todeta, että farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta sekä lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Natriumsitraatti
Kloorivetyhappo, konsentraatti pH:n säätämiseen
Metakresoli
Natriumhydroksidi
Natriumkloridi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, injektionesteisiin käytettävää steriiliä vettä tai 0,9-prosenttista (w/v) natriumkloridi-injektioliuosta lukuun ottamatta (ks. kohta Käyttö- ja käsittelyohjeet).
Kestoaika
Myyntipakkauksessa olevan lääkevalmisteen kestoaika: 3 vuotta
Kestoaika injektiopullon ensimmäisen avaamisen jälkeen: 30 vuorokautta 30 °C:ssa
Kestoaika jatkuvan ihonalaisen infuusion aikana
Ihonalaisena infuusiona annettavaa laimentamatonta treprostiniilia sisältävän yksittäisen polypropeeni‑ tai lasisäiliön (ruiskun) on osoitettu pysyvän käytön aikana kemiallisesti, fysikaalisesti ja mikrobiologisesti stabiilina enintään 14 päivää 37 °C:ssa. Muut käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla.
Kestoaika jatkuvan laskimonsisäisen infuusion aikana käytettäessä ulkoista mukana kannettavaa pumppua
Laskimonsisäisenä infuusiona annettavaa laimennettua treprostiniililiuosta sisältävän yksittäisen polyvinyylikloridi‑, polypropeeni‑ tai lasisäiliön (ruiskun) on osoitettu pysyvän käytön aikana kemiallisesti, fysikaalisesti ja mikrobiologisesti stabiilina enintään 24 tuntia 37 °C:ssa (jopa niin alhaisella kuin 0,004 mg:n/ml vahvuudella). Verenkierron infektioriskin minimoimiseksi laimennettu treprostiniili tulee käyttää 24 tunnin kuluessa. Muut käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla.
Kestoaika laskimonsisäisen annon aikana käytettäessä implantoitavaa pumppua, joka on tarkoitettu Treposa-valmisteen laskimonsisäiseen antoon
Laskimoon infuusiona annettavan laimennetun tai laimentamattoman Treposa-liuoksen on osoitettu pysyvän implantoitavassa pumpussa käytön aikana kemiallisesti, fysikaalisesti ja mikrobiologisesti stabiilina enintään 30 päivän ajan 37 °C:ssa 0,5 mg/ml:n pitoisuutena (alin pitoisuus). Muut säilytysajat ja ‑olosuhteet käytön aikana ovat käyttäjän vastuulla.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita (käytönaikaiset säilytysajat ja ‑olosuhteet, ks. kohta Kestoaika).
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TREPOSA infuusioneste, liuos
1 mg/ml (L:ei) 10 ml (731,45 €)
PF-selosteen tieto
10 millilitraa 10 ml:n tyypin I kirkkaasta lasista valmistetussa injektiopullossa, joka on sinetöity teflonpäällysteisellä kumitulpalla ja varustettu keltaisella korkilla; yhden injektiopullon pakkaus.
Valmisteen kuvaus:
Kirkas, väritön tai hieman kellertävä isotoninen liuos, jossa ei ole näkyviä hiukkasia ja jonka pH‑arvo on 6,0–7,2.
Käyttö- ja käsittelyohjeet
Treposa-valmistetta käytetään laimentamattomana, mikäli se annetaan jatkuvana ihonalaisena infuusiona (ks. kohta Annostus ja antotapa).
Mikäli Treposa annetaan jatkuvana laskimonsisäisenä infuusiona, se tuleelaimentaa steriilillä injektionesteisiin käytettävällä vedellä tai 0,9‑prosenttisella (paino/tilavuus) natriumkloridi-injektionesteellä (ks. kohta Annostus ja antotapa).
Mikäli Treposa-liuos annetaan jatkuvana laskimonsisäisenä infuusiona kirurgisesti asetetun implantoitavan pumpun avulla, se tulee laimentaa 0,9-prosenttisella (paino/tilavuus) natriumkloridi-injektionesteellä (ks. kohta Annostus ja antotapa).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TREPOSA infuusioneste, liuos
1 mg/ml 10 ml
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Treprostiniili: Vaikeahoitoisen pulmonaalihypertension hoito erityisin edellytyksin (334).
ATC-koodi
B01AC21
Valmisteyhteenvedon muuttamispäivämäärä
17.10.2023
Yhteystiedot
Leopold-Ungar-Platz 2
1190 Wien
Austria
+43 1 503 72 440
office@aoporphan.com
