GLIOLAN jauhe oraaliliuosta varten 30 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Terveydenhuollon ammattilainen
Vaikuttavat aineet ja niiden määrät
Yksi pullo sisältää 1,17 g 5‑aminolevuliinihappoa (5‑ALA), vastaten 1,5 g 5‑aminolevuliinihappo-hydrokloridia (5‑ALA HCl).
Yksi ml käyttökuntoon saatettua liuosta sisältää 23,4 mg 5‑ALA:a, vastaten 30 mg 5‑ALA HCl:ia.
Lääkemuoto
Jauhe oraaliliuosta varten.
Kliiniset tiedot
Käyttöaiheet
Gliolan on tarkoitettu käytettäväksi aikuisten malignin gliooman (WHO:n luokitukset III ja IV) pahanlaatuisen kudoksen visualisointiin leikkauksen aikana.
Ehto
Tätä lääkevalmistetta saavat käyttää ainoastaan kokeneet neurokirurgit, jotka ovat perehtyneet malignien glioomien kirurgiaan, ja joilla on perusteelliset tiedot aivojen toimintaan liittyvästä rakenteesta, ja jotka ovat suorittaneet fluoresenssilla ohjatun kirurgian koulutuskurssin.
Annostus ja antotapa
Tätä lääkevalmistetta saavat käyttää ainoastaan kokeneet neurokirurgit, jotka ovat perehtyneet malignien glioomien kirurgiaan, ja joilla on perusteelliset tiedot aivojen toimintaan liittyvästä rakenteesta, ja jotka ovat suorittaneet fluoresenssilla ohjatun kirurgian koulutuskurssin.
Annostus
Suositeltu annos on 20 mg 5‑ALA HCl:ia painokiloa kohti.
Yksittäistä potilasta varten tarkoitetun annoksen saavuttamiseksi tarvittavien pullojen lukumäärä voidaan määrittää alla esitetyn yhtälön mukaisesti (pyöristettynä lähimpään kokonaiseen pulloon):
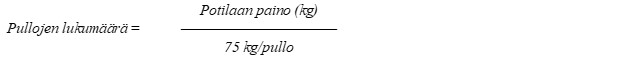
Yksittäistä potilasta varten tarkoitetun annoksen saavuttamiseksi tarvittava antotilavuus voidaan laskea alla esitetyn yhtälön mukaisesti:
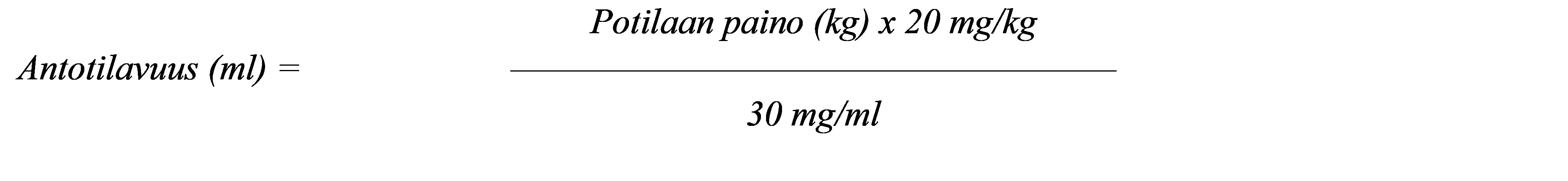
Munuaisten tai maksan vajaatoiminta
Tutkimuksia ei ole tehty potilailla, joilla on kliinisesti merkittävä maksan tai munuaisten vajaatoiminta. Tästä syystä lääkevalmistetta tulee käyttää varoen näillä potilailla.
Iäkkäät
Ei ole erityisiä ohjeita koskien käyttöä sellaisille iäkkäille potilaille, joiden elintoiminnot ovat normaaleja.
Pediatriset potilaat
Gliolanin turvallisuutta ja tehoa 0–18‑vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Liuos tulee antaa suun kautta kolme tuntia (vaihteluväli 2–4 tuntia) ennen anestesiaa. 5‑ALA:n käyttöön muissa kuin kliinisissä tutkimuksissa käytetyissä olosuhteissa liittyy määrittelemätön riski.
Jos leikkausta lykätään yli 12 tunnilla, leikkaus on siirrettävä seuraavaan päivään tai myöhempään. Toinen annos tätä lääkettä voidaan ottaa 2–4 tuntia ennen anestesiaa.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai porfyriineille.
- Akuutit tai kroonistyyppiset porfyriat.
- Raskaus (ks. kohdat Raskaus ja imetys ja Prekliiniset tiedot turvallisuudesta).
Varoitukset ja käyttöön liittyvät varotoimet
5‑ALA:n indusoima aivokudoksen fluoresenssi ei anna tietoja kudoksen neurologisista toiminnoista. Tästä syystä fluoresoidun kudoksen resektiota tulee harkita huolellisesti ottaen huomioon fluoresoidun kudoksen neurologinen toiminta.
Erityistä varovaisuutta tulee noudattaa potilailla, joiden kasvain on jonkin tärkeän neurologisen toiminnon välittömässä läheisyydessä ja joilla on aikaisempia fokaalisia puutoksia (esim. afasia, näköhäiriöitä ja pareesi), jotka eivät ole parantuneet kortikosteroidihoidolla. Näillä potilailla on havaittu suurempi riski saada kriittisiä neurologisia puutoksia, jotka aiheutuvat fluoresenssilla ohjatusta resektioista. Vähintään 1 cm turvaetäisyys aivokuoren toiminnallisista alueista ja aivokuoren alaisista rakenteista tulee säilyttää fluoresoinnin asteesta riippumatta.
Turvaetäisyyden säilyttämiseksi kaikilla niillä potilailla, joiden kasvaimen sijainti on lähellä tärkeän neurologisen toiminnon aluetta, tulee joko pre- tai intraoperatiivisesti huolehtia toimenpiteistä, joilla kyseinen toiminto paikannetaan kasvaimeen nähden.
Väärät negatiiviset ja väärät positiiviset tulokset ovat mahdollisia, kun 5‑ALA:a käytetään malignin gliooman leikkauksenaikaiseen visualisointiin. Ei-fluoresoiva kudos leikkausalueella ei poissulje kasvaimen olemassaoloa glioomapotilailla. Toisaalta fluoresointia saattaa esiintyä alueilla, joissa on poikkeavaa aivokudosta (kuten reaktiivisia astrosyyttejä, atyyppisiä soluja), nekroottista kudosta, tulehdusta, infektioita (kuten sieni- tai bakteeri-infektioita tai märkäpesäkkeitä), keskushermoston lymfooma tai muun tyyppisten kasvainten metastaaseja.
Tämän lääkevalmisteen ottamisen jälkeen silmien ja ihon altistusta voimakkaille valonlähteille (esim. leikkauksen valaistus, suora auringonvalo tai kirkas keskitetty valo sisätiloissa) tulee välttää 24 tunnin ajan.
Muiden mahdollisesti fototoksisten aineiden (esim. tetrasykliinit, sulfonamidit, fluorokinolonit, hyperisiini-uutteet) samanaikaista käyttöä tulee välttää (ks. myös kohta Prekliiniset tiedot turvallisuudesta).
Muiden mahdollisesti maksatoksisten valmisteiden käyttöä tulee välttää 24 tunnin sisällä lääkevalmisteen ottamisen jälkeen.
Potilailla, joilla on aikaisempi kardiovaskulaarinen tauti, tätä lääkevalmistetta tulee käyttää varoen, koska kirjallisuudessa esiintyneet raportit ovat osoittaneet systolisen ja diastolisen verenpaineen, keuhkovaltimon systolisen ja diastolisen paineen kuin myös keuhkojen vaskulaarisen vastuksen vähenemistä.
Yhteisvaikutukset
Potilaita ei tule altistaa millekään valoherkistävälle aineelle 2 viikkoon Gliolanin antamisen jälkeen.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja 5‑ALA:n käytöstä raskaana oleville naisille. Muutamissa rajoitetuissa eläinkokeissa on havaittu 5‑ALA:n lisääntymistoksisuutta, kun se on altistettu valolle (ks. kohta Prekliiniset tiedot turvallisuudesta). Tämän vuoksi Gliolanin käyttöä ei suositella raskauden aikana.
Imetys
Ei tiedetä, erittyykö 5‑ALA tai sen metaboliitti protoporfyriini IX (PPIX) ihmisen rintamaitoon. 5‑ALA:n tai PPIX:n imeytymistä maitoon ei ole tutkittu koe-eläimillä. Rintaruokinta on keskeytettävä 24 tunnin ajaksi tällä lääkevalmisteella tapahtuneen hoidon jälkeen.
Hedelmällisyys
Ei ole saatavilla tietoja 5‑ALA:n vaikutuksesta hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei merkityksellinen. Itse hoidolla on haitallinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Tällä fluoresenssilla ohjatun gliooman resektioon tarkoitetulla lääkevalmisteella havaitut haittavaikutukset on jaettu seuraavaan kahteen luokkaan:
- Välittömät reaktiot, jotka tapahtuvat lääkeaineen oraalisen annostuksen jälkeen ennen anestesiaa (= vaikuttavalle aineelle ominaiset haittavaikutukset)
- 5‑ALA:n, anestesian ja kasvaimen resektion yhteisvaikutukset (= toimenpiteelle ominaiset haittavaikutukset).
Vakavimpia haittavaikutuksia ovat anemia, trombosytopenia, leukosytoosi, neurologiset häiriöt ja tromboembolia. Muita usein havaittuja haittavaikutuksia ovat oksentelu, pahoinvointi ja kohonneet veren bilirubiini, alaniiniaminotransferaasi, aspartaattiaminotransferaasi, gamma-glutamyylitransferaasi ja veren amylaasi.
Taulukoitu haittavaikutusten yhteenveto
Hyvin yleinen (≥ 1/10)
Yleinen (≥ 1/100, < 1/10)
Melko harvinainen (≥ 1/1 000, < 1/100)
Harvinainen (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen (< 1/10 000)
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Aineelle ominaiset haittavaikutukset:
Sydän | Melko harvinainen: | hypotensio |
Ruoansulatuselimistö | Melko harvinainen: | pahoinvointi |
Iho ja ihonalainen kudos | Melko harvinainen: | valoherkkyysreaktio, valoihottuma |
Toimenpiteeseen liittyvät haittavaikutukset:
Toimenpiteeseen liittyvien neurologisten haittavaikutusten laajuus ja esiintyvyys riippuu aivokasvaimen sijainnista ja sen kasvainkudoksen resektioasteesta, joka sijaitsee aivojen toiminnallisilla alueilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Veri ja imukudos | Hyvin yleinen: | anemia, trombosytopen, leukosytoosis |
Hermosto | Yleinen: | neurologiset häiriöt (esim. hemipareesi, afasia, kouristukset, hemianopsia) |
| Melko harvinainen: | aivoedeema | |
Hyvin harvinainen: | hypestesia | |
Sydän | Melko harvinainen: | hypotensio |
Verisuonisto | Yleinen: | tromboembolia |
Ruoansulatuselimistö | Yleinen: | oksentelu, pahoinvointi |
Hyvin harvinainen: | ripuli | |
Maksa ja sappi | Hyvin yleinen: | kohonnut veren bilirubiini, kohonnut alaniiniaminotransferaasi, kohonnut aspartaattiaminotransferaasi, kohonnut gamma-glutamyylitransferaasi, kohonnut veren amylaasi |
Eräiden haittavaikutusten kuvaus
Yhden haaran tutkimuksessa, johon osallistui 21 tervettä vapaaehtoista miestä, ihon eryteema voitiin saada aikaan suoralla altistuksella UVA-valolle korkeintaan 24 tuntia oraalisen 20 mg/painokilo 5‑ALA HCl:n annostuksen jälkeen. Mahdollisesti lääkkeestä johtuvana haittavaikutuksena raportoitiin pahoinvointia yhdellä vapaaehtoisella 21:stä miehestä.
Toisessa yhden keskuksen tutkimuksessa 21 potilasta, joilla oli maligni gliooma, saivat 0,2; 2 tai 20 mg 5‑ALA HCl:ia painokiloa kohti ja tätä seurasi fluoresenssilla ohjattu kasvaimen resektio. Ainoa tässä tutkimuksessa raportoitu haittavaikutus oli yksi lievä auringonpolttamatapaus, joka esiintyi suurimmalla annoksella hoidetulla potilaalla.
Yhden haaran tutkimuksessa, johon osallistui 36 malignista glioomasta kärsivää potilasta, lääkkeeseen liittyviä haittavaikutuksia raportoitiin 4:llä potilaalla (lievä ripuli yhdellä potilaalla, keskivaikea hypestesia yhdellä potilaalla, keskivaikeita vilunväristyksiä yhdellä potilaalla, ja valtimoiden hypotensio 30 minuuttia 5‑ALA:n annostelun jälkeen yhdellä potilaalla). Kaikille potilaille lääkevalmiste annettiin annoksella 20 mg/painokilo, ja jokaiselle suoritettiin fluoresenssilla ohjattu resektio. Seuranta-aika oli 28 päivää.
Vertailevassa, sokkouttamattomassa vaiheen III tutkimuksessa (MC‑ALS.3/GLI) malignista glioomasta kärsivää 201 potilasta saivat 5‑ALA HCl:ia annoksella 20 mg/painokilo, ja 176 potilaalle näistä suoritettiin fluoresenssilla ohjattu resektio, jota seurasi sädehoito. 173 potilaalle suoritettiin normaali resektio ilman lääkevalmisteen annostelua ja sitä seurasi sädehoito. Seuranta-aika oli vähintään 180 päivää annostelun jälkeen. Haittavaikutuksia, jotka voivat mahdollisesti liittyä lääkkeeseen, raportoitiin 2/201 (1,0 prosentilla) potilaalla: lievä oksentelu 48 tuntia kirurgian jälkeen, ja lievä valoherkkyys 48 tuntia tutkimuksen kokeellisen kirurgian jälkeen. Toinen potilas sai vahingossa lääkevalmisteen yliannoksen (3 000 mg sen sijaan että olisi saanut 1 580 mg). Tällä potilaalla raportoitua hengityksen vajaatoimintaa hoidettiin soveltamalla ventilaatiota ja se parani täysin. Ilmeisempi ohimenevä maksaentsyymien kohoaminen ilman kliinisiä oireita havaittiin potilailla, joita oli hoidettu 5‑ALA:lla. Huippuarvo esiintyi 7–14 päivän välisenä aikana annostuksen jälkeen. Havaittiin kohonneita amylaasi-, kokonaisbilirubiini- ja leukosyyttiarvoja, mutta alentuneita trombosyytti- ja erytrosyyttiarvoja, mutta erot eivät kuitenkaan olleet tilastollisesti merkittäviä eri hoitoryhmien välillä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisessä tutkimuksessa annettiin sydän- ja verisuonitaudista kärsivälle 63‑vuotiaalle potilaalle vahingossa 5‑ALA HCl:n yliannos (3 000 mg sen sijaan että olisi annettu 1 580 mg). Leikkauksen aikana potilaalle kehittyi hengityksen vajaatoimintaa, jota hoidettiin soveltamalla ventilaatiota. Leikkauksen jälkeen potilaalla esiintyi myös kasvojen eryteema. Todettiin, että potilas oli altistettu suuremmalle määrälle valoa kuin tutkimuksessa oli sallittua. Hengityksen vajaatoiminta ja kasvojen eryteema paranivat täysin.
Yliannostustapauksessa tulee potilaalle suorittaa tarpeen mukaan tukitoimia, joihin kuuluu riittävä suojaus vahvoilta valonlähteiltä (esim. suoralta auringonvalolta).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset aineet, fotodynaamisessa hoidossa käytettävät herkistimet, ATC‑koodi: L01XD04
Vaikutusmekanismi
5‑ALA on hemin luonnollinen biokemiallinen esiaste, joka metaboloituu entsymaattisten reaktioiden sarjana muodostaen fluoresoivia porfyriineja, erityisesti PPIX:ää. 5‑ALA:n synteesiä säätelee vapaan hemin solunsisäinen varasto negatiivisen takaisinsyöttömekanismin kautta. Liiallisen eksogeenisen 5‑ALA:n antaminen estää negatiivisen palautesäätelyn ja tällöin PPIX:ää kertyy kohdekudokseen. PPIX:n fluoresenssia (fotodynaamista vaikutusta) näkyvässä valossa tietyissä kohdekudoksissa voidaan käyttää fotodynaamisen diagnoosin apuna.
Farmakodynaamiset vaikutukset
Systeeminen 5‑ALA:n annostus aiheuttaa solun porfyriinimetabolian ylikuormituksen ja PPIX:n kumuloitumisen erilaisissa epiteeli- ja syöpäkudoksissa. Malignin gliooman kudoksen (WHO:n luokitukset III ja IV, esim. glioblastooma, gliosarkooma tai anaplastinen astrosytooma) on myös osoitettu syntetisoivan ja kumuloivan porfyriineja vasteena 5‑ALA:n annostukseen. PPIX:n pitoisuus valkoisessa aineessa on huomattavasti alhaisempi kuin aivokuoressa ja kasvaimessa. Vaikutusta voi myös esiintyä kasvainta ympäröivässä kudoksessa ja normaaleissa aivoissa. 5‑ALA:n aiheuttama PPIX:n muodostuminen on kuitenkin huomattavasti suurempaa pahanlaatuisessa kudoksessa kuin normaaleissa aivoissa.
Sen sijaan alemman luokituksen kasvaimissa (WHO:n luokitukset I ja II, esim. oligodendrogliooma) fluoresenssia vaikuttavan aineen annostuksen jälkeen ei havaittu. Medulloblastoomia tai aivojen metastaaseja koskevat tulokset olivat epäjohdonmukaisia tai niissä ei ollut lainkaan fluoresenssia.
PPIX:n kumuloituminen WHO:n luokituksien III ja IV pahanlaatuisiin kasvaimiin voi selittyä kasvaimen suuremman 5‑ALA:n kudokseenottokyvyn tai sellaisten muuttuneiden entsyymi ekspressioprofiilien tai aktiivisuuksien kautta (esim. ferrokelataasi), jotka liittyvät hemoglobiinin biosynteesiin kasvainsoluissa. Suurempi 5‑ALA:n kudokseenottokyky voi selittyä veri-aivoesteen häiriöillä, lisääntyneellä neovaskularisaatiolla, ja membraanitransporttereiden liiallisella ekspressiolla glioomakudoksessa.
Sinisellä valolla (λ = 400–410 nm) tapahtuneen virityksen jälkeen PPIX on vahvasti fluoresoiva (huippu aallonpituudella λ = 635 nm). Tämä voidaan nähdä (visualisoida) tavanomaisella neurokirurgisella mikroskoopilla, johon on tehty tarvittavat modifikaatiot.
Fluoresenssin emissio voidaan luokitella voimakkaaksi (kiinteäksi) punaiseksi fluoresenssiksi (vastaa olennaista, kiinteää kasvainkudosta) ja heikoksi vaaleanpunaiseksi fluoresenssiksi (vastaa infiltroituvia kasvainsoluja), kun taas normaali aivokudos, josta suurentuneet PPIX-pitoisuudet puuttuvat, heijastaa violetinsinistä valoa ja näkyy sinisenä.
Kliininen teho ja turvallisuus
Vaiheen I/II tutkimuksessa, johon osallistui 21 potilasta, havaittiin annos-tehokkuussuhde annostasojen ja kasvaimen ytimessä esiintyvän fluoresenssin määrän ja laadun välillä: suuremmat annokset 5‑ALA:a paransivat kasvaimen ytimessä fluoresenssin laatua ja määrää verrattuna kasvaimen ytimen rajaamiseen normaalissa valkoisessa valaistuksessa monotonisella, ei-alenevalla tavalla. Suurimman annoksen (20 mg/painokilo) havaittiin olevan kaikkein tehokkain.
Positiivisen ennustearvon kudoksen fluoresenssille havaittiin olevan 84,8 % (90 % CI: 70,7 %‑93,8 %). Tämä arvo määritettiin prosentteina potilaista, joilla kaikissa heikon ja vahvan fluoresenssin alueilta otetuissa biopsioissa kasvainsolujen tunnistus oli positiivinen. Positiivinen vahvan fluoresenssin ennustearvo oli suurempi (100,0 %; 90 % CI: 91,1 %‑100,0 %) kuin heikon fluoresenssin (83,3 %; 90 % CI: 68,1 %‑93,2 %). Tulokset perustuivat vaiheen II tutkimukseen, johon osallistui 33 potilasta, jotka saivat 5‑ALA HCl:ia annoksella 20 mg/painokilo.
Aikaansaatua fluoresenssia käytettiin leikkauksen aikaisena malignin glioomakudoksen merkkiaineena, jotta näiden kasvainten leikkaustulos paranisi.
Vaiheen III tutkimuksessa oli 349 potilasta, joilla arveltiin olevan sellainen maligni gliooma, joka voitaisiin resekoida kokonaan kontrastia parantamalla. Potilaat satunnaistettiin fluoresenssilla ohjattuun resektioon 5‑ALA HCl:n annon jälkeen annoksella 20 mg/painokilo tai tavalliseen valkoisella valolla suoritettuun resektioon. Kontrastilla paremmin näkyvän kasvaimen resektio suoritettiin 64 prosentilla potilaista koeryhmässä verrattuna 38 %:iin kontrolliryhmässä (p < 0,0001).
20,5 % potilaista, joita hoidettiin 5‑ALA:lla ja 11 % potilaista, joille suoritettiin tavanomainen leikkaus, oli elossa kuuden kuukauden tutkimuskäynnin aikaan ilman kasvaimen etenemistä. Ero on tilastollisesti merkitsevä käytettäessä ChiSquare-testiä (p = 0,015).
Elossaoloaika ei lisääntynyt merkittävästi tässä tutkimuksessa; tosin tutkimusta ei ollut mitoitettu tällaisen eron esille tuomiseen.
Farmakokinetiikka
Yleiset ominaisuudet
Tällä lääkevalmisteella on hyvä liukoisuus vesiliuoksiin. Nauttimisen jälkeen 5‑ALA ei itsessään ole fluoresoiva. Tuumorikudoksessa (ks. kohta Farmakodynamiikka) se metaboloituu solunsisäisesti fluoresoiviksi porfyriineiksi, pääasiallisesti PPIX:ksi.
Imeytyminen
5‑ALA juomaliuoksena imeytyy nopeasti ja täydellisesti, ja 5‑ALA:n huippupitoisuudet plasmassa saavutetaan 0,5–2 tuntia oraalisen annoksen 20 mg/painokilo antamisen jälkeen. Plasmapitoisuudet palaavat perustason arvoihin 24 tuntia oraalisen annoksen 20 mg/painokilo antamisen jälkeen. Ruoan vaikutusta ei ole tutkittu, koska tämä lääkevalmiste annetaan yleensä tyhjään vatsaan ennen anestesiaa.
Jakautuminen ja biotransformaatio
5‑ALA:n vastaanottavat valikoivasti maksa, munuaiset, endoteelit ja iho kuin myös malignit glioomat (WHO:n luokitukset III ja IV), ja se metaboloituu fluoresoivaksi PPIX:ksi. Neljä tuntia oraalisen annoksen 20 mg 5‑ALA HCl:ia/painokilo antamisen jälkeen saavutetaan maksimi PPIX-pitoisuus plasmassa. PPIX:n plasmapitoisuudet pienenevät nopeasti seuraavan 20 tunnin aikana eivätkä ne ole enää havaittavissa 48 tunnin kuluttua annosta. Suositellulla oraalisella 20 mg/painokilo annoksella kasvaimen fluoresenssin suhteet verrattuna normaaleihin aivoihin ovat yleensä suuria, ja antavat selvän kontrastin, jonka avulla kasvainkudos voidaan nähdä violetinsinisessä valossa vähintään 9 tunnin ajan.
Kasvainkudoksen lisäksi raportoitiin aivokammion suonipunoksen (choroid plexus) heikkoa fluoresenssia. 5‑ALA:a vastaanottavat ja metaboloivat PPIX:ksi myös muut kudokset, esim. maksa, munuaiset tai iho (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). 5‑ALA:n sitoutumisesta plasman proteiineihin ei ole tietoa.
Eliminaatio
5‑ALA eliminoituu nopeasti terminaalisen puoliintumisajan ollessa 1–3 tuntia. Noin 30 % oraalisesti annostellusta 20 mg/painokilon annoksesta erittyy muuttumattomana virtsaan 12 tunnin sisällä.
Lineaarisuus/ei‑lineaarisuus
5‑ALA:n AUC0-inf.-arvojen välillä ja erisuuruisten tämän lääkevalmisteen oraalisten annosten välillä esiintyy suhteellisuutta.
Munuaisten tai maksan vajaatoiminta
5‑ALA:n farmakokinetiikkaa ei ole tutkittu potilailla, joilla on munuaisten tai maksan vajaatoiminta.
Prekliiniset tiedot turvallisuudesta
Yleisiä farmakologista turvallisuutta koskevia tutkimuksia tehtiin hiirellä, rotalla ja koiralla valolta suojatussa ympäristössä. 5‑ALA:n antaminen ei vaikuta ruoansulatuselimistön ja keskushermoston toimintaan. Vähäistä natriureesin kohoamista ei voida sulkea pois.
Suurten 5‑ALA:n kerta-annosten anto hiirille tai rotille johtaa ei-spesifisiin löydöksiin intoleranssista ilman makroskooppisia poikkeavuuksia tai merkkejä viivästyneestä toksisuudesta. Rotilla ja koirille suoritetut toistuvan annoksen toksisuustutkimukset osoittivat annoksesta riippuvia haittareaktioita, jotka vaikuttivat muutoksiin sappitiehyen histologiassa (ei-palautuvia 14 päivän toipumisjakson aikana), ohimenevää transaminaasiarvojen, LDH-pitoisuuden, kokonaisbilirubiinin, kokonaiskolesterolin, kreatiniinin ja urean nousua sekä oksentelun lisääntymistä (ainoastaan koirilla). Systeemisen toksisuuden merkkejä (kardiovaskulaariset ja hengitysparametrit) esiintyi suuremmilla annoksilla anestesiassa olevalla koiralla: suonensisäisellä annoksella 45 mg/kg elopainoa havaittiin perifeerisen valtimoverenpaineen ja systolisen vasemman kammion paineen vähäistä laskua. Viisi minuuttia antamisen jälkeen saavutettiin uudelleen perustason arvot. Havaittujen kardiovaskulaaristen vaikutusten ajatellaan liittyvän suonensisäiseen antoreittiin.
5‑ALA‑hoidon jälkeen havaittu fototoksisuus in vitro ja in vivo liittyy ilmeisen läheisesti annoksesta ja ajasta riippuvaan PPIX:n synteesin induktioon säteilytetyissä soluissa tai kudoksissa. Talirauhassolujen tuhoutumista, fokaalista epidermaalista nekroosia ohimenevän akuutin tulehduksen kanssa ja diffuuseja reaktiivisia muutoksia keratinosyyteissä kuin myös ohimenevää verinahan turvotusta ja tulehtumista on havaittu. Valolle altistettu iho parani täydellisesti lukuun ottamatta pysyvää karvatuppien lukumäärän vähenemistä. Tästä johtuen yleisiä silmiä ja ihoa valolta suojaavia toimenpiteitä suositellaan ainakin 24 tunnin ajaksi tämän lääkevalmisteen antamisen jälkeen.
Keskeisiä tutkimuksia 5‑ALA:n lisääntymis- ja kehittymiskäyttäytymisestä ei ole tehty. 5‑ALA:n indusoima porfyriinisynteesi saattaa kuitenkin johtaa embryotoksiseen aktiviteettiin hiirellä, rotalla ja kanan alkioilla ainoastaan olosuhteissa, joissa tapahtuu samanaikaisesti altistus suoralle auringonvalolle. Tästä syystä tätä lääkevalmistetta ei tule antaa raskaana oleville naisille. Liian suuri kerta-annoshoito 5‑ALA:lla sitä vastoin heikensi koirasten fertiliteettiä kahden viikon ajaksi annostuksen jälkeen.
Suurin osa pimeässä suoritetuista genotoksisuustutkimuksista ei osoita 5‑ALA:lla olevan genotoksista potentiaalia. Yhdiste voi mahdollisesti indusoida fotogenotoksisuutta hoidon jälkeisen säteilytykselle tai valonsäteille altistuksen jälkeen, mikä ilmeisesti on yhteydessä porfyriinisynteesin induktioon.
Pitkäaikaisia in vivo karsinogeenisuustutkimuksia ei ole tehty. Ottaen kuitenkin huomioon käyttöaiheen, yhteen oraaliseen kerta-annoshoitoon 5‑ALA:lla ei ehkä liity mitään vakavan karsinogeenisuusriskin mahdollisuutta.
Farmaseuttiset tiedot
Apuaineet
Ei ole.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton pullo
4 vuotta.
Käyttökuntoon saatettu liuos
Käyttökuntoon saatettu liuos on fysikaalis-kemiallisesti stabiili 24 tunnin ajan 25 ºC lämpötilassa.
Säilytys
Pidä pullo ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GLIOLAN jauhe oraaliliuosta varten
30 mg/ml (L:ei) 1,5 g (1270,20 €)
PF-selosteen tieto
Väritön tyypin I lasinen pullo, jossa butyylikumista valmistettu tulppa. Sisältää 1,5 g jauhetta liuotettavaksi 50 ml:aan juomakelpoista vettä.
Pakkauskoot: 1, 2 ja 10 pulloa
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Jauhe on valkoinen tai melkein valkoinen kakku.
Käyttö- ja käsittelyohjeet
Oraaliliuos valmistetaan liuottamalla yhden pullon sisältämä jauhemäärä 50 ml:aan juomakelpoista vettä. Yksi pullo Gliolan 30 mg/ml jauhetta oraaliliuosta varten liuotettuna 50 ml:aan juomavettä vastaa 1 500 mg:n 5‑aminolevuliinihappo‑hydrokloridi- (5‑ALA HCl) kokonaisannosta. Käyttökuntoon saatettu liuos on kirkasta ja väritöntä tai hieman kellertävää nestettä.
Gliolan on tarkoitettu vain kertakäyttöön ja kaikki jäljelle jäänyt sisältö tulee hävittää ensimmäisen käyttökerran jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
GLIOLAN jauhe oraaliliuosta varten
30 mg/ml 1,5 g
- Ei korvausta.
ATC-koodi
L01XD04
Valmisteyhteenvedon muuttamispäivämäärä
15.07.2024
Yhteystiedot
Spektri Business Park, Metsänneidonkuja 4
02130 Espoo
010 420 4000
www.medac.fi
info@medac.fi
