ABRYSVO injektiokuiva-aine ja liuotin, liuosta varten
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Käyttökuntoon saattamisen jälkeen yksi annos (0,5 ml) sisältää:
RSV-alaryhmä A:n stabiloitu prefuusio-F‑antigeeni1,2 60 mikrogrammaa
RSV-alaryhmä B:n stabiloitu prefuusio-F‑antigeeni1,2 60 mikrogrammaa
(RSV-antigeenit)
1 glykoproteiini F, joka on stabiloitu fuusioitumista edeltävään konformaatioon
2 tuotettu kiinanhamsterin munasarjasoluissa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Abrysvo on tarkoitettu:
- Suojaamaan imeväistä passiivisesti RS-viruksen (respiratory syncytial virus, RSV) aiheuttamaa alahengitystieinfektiota vastaan syntymästä 6 kuukauden ikään asti immunisoimalla äiti raskauden aikana. Ks. kohdat Annostus ja antotapa ja Farmakodynamiikka.
- Aktiiviseen immunisaatioon 18 vuotta täyttäneille ja sitä vanhemmille henkilöille RS-viruksen aiheuttaman alahengitystieinfektion ehkäisemiseksi.
Rokotteen käytön tulee perustua virallisesti hyväksyttyihin suosituksiin.
Annostus ja antotapa
Annostus
Raskaana olevat henkilöt
Valmistetta annetaan yksi 0,5 ml:n annos raskausviikkojen 24–36 aikana (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
18 vuotta täyttäneet ja sitä vanhemmat henkilöt
Valmistetta annetaan yksi 0,5 ml:n annos.
Lisärokotteen antamisen tarvetta ei ole selvitetty.
Immuunipuutteiset henkilöt
Valmistetta annetaan yksi 0,5 ml:n annos. Toisen annoksen tarvetta ei ole osoitettu (ks. kohta Farmakodynamiikka).
Pediatriset potilaat
Abrysvo-rokotteen turvallisuutta ja tehoa lapsilla (vastasyntyneistä alle 18-vuotiaisiin) ei ole vielä varmistettu. Raskaana olevista nuorista ja heille syntyneistä lapsista on vain vähän tietoja (ks. kohta Farmakodynamiikka).
Antotapa
Abrysvo annetaan injektiona olkavarren hartialihakseen.
Rokotetta ei saa sekoittaa muiden rokotteiden tai lääkevalmisteiden kanssa.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ja käsittelemisestä ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys ja anafylaksia
Asianmukaisen lääketieteellisen hoidon ja valvonnan on aina oltava helposti saatavilla siltä varalta, että rokotuksen jälkeen ilmenee anafylaktinen tapahtuma.
Pelkoon liittyvät reaktiot
Pelkoon liittyviä reaktioita, kuten vasovagaalisia reaktioita (pyörtymistä), hyperventilaatiota tai stressiin liittyviä reaktioita saattaa ilmetä rokotuksen yhteydessä psyykkisperäisinä reaktioina neulanpistokseen. On tärkeää noudattaa varotoimia pyörtymiseen liittyvien vammojen välttämiseksi.
Samanaikainen sairaus
Rokotusta on siirrettävä myöhemmäksi, jos henkilöllä on akuutti kuumetauti. Rokotusta ei kuitenkaan pidä siirtää lievän infektion, kuten nuhakuumeen, vuoksi.
Trombosytopenia ja hyytymishäiriöt
Abrysvo-rokotteen antamisessa henkilöille, joilla on trombosytopenia tai hyytymishäiriö, on noudatettava varovaisuutta, sillä lihakseen annon jälkeen heillä voi esiintyä verenvuotoa ja mustelmia.
Immuunipuutteiset henkilöt
Turvallisuutta ja immunogeenisuutta on arvioitu immuunipuutteisilla henkilöillä, immunosuppressiivista hoitoa saavat henkilöt mukaan lukien (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). Abrysvo-rokotteen teho saattaa olla vähäisempi henkilöillä, joilla immuunivaste on heikentynyt.
Raskaana olevat henkilöt ennen 24. raskausviikkoa
Abrysvo-rokotetta ei ole tutkittu raskaana olevilla henkilöillä ennen 24. raskausviikkoa. Koska imeväisten suoja RS-virusta vastaan riippuu äidiltä peräisin olevien vasta-aineiden siirtymisestä istukan kautta, Abrysvo-rokote tulee antaa raskausviikkojen 24 ja 36 välillä (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Rokotteen tehokkuuteen liittyvät rajoitukset
Kuten kaikkien rokotteiden kohdalla, rokotteen anto ei välttämättä saa aikaan suojaavaa immuunivastetta.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Abrysvo sisältää polysorbaatti 80:tä. Polysorbaatti 80 saattaa aiheuttaa yliherkkyysreaktioita.
Yhteisvaikutukset
Abrysvo-rokote voidaan antaa samanaikaisesti
- kausi-influenssarokotteiden kanssa, kun annetaan joko adjuvantoituja tavanomaisia rokotteita tai adjuvantoimattomia suuriannoksisia rokotteita
- COVID‑19‑mRNA-rokotteiden kanssa, kun samanaikaisesti annetaan tai ei anneta adjuvantoimattomia suuriannoksisia influenssarokotteita.
Abrysvo-rokotteen ja jäykkäkouristus-, kurkkumätä- ja soluttoman hinkuyskärokotteen (Tdap) antoväliksi suositellaan vähintään kahta viikkoa. Turvallisuushuolia ei ilmennyt, kun Abrysvo annettiin Tdap-rokotteen kanssa samanaikaisesti terveille naisille, jotka eivät olleet raskaana. Immuunivasteet RSV-A- ja RSV-B-tyyppejä, kurkkumätää ja jäykkäkouristusta vastaan olivat samanveroiset (non-inferior) samanaikaisessa annossa verrattuna antoon eri aikaan. Hinkuyskäkomponentin immuunivaste oli kuitenkin matalampi samanaikaisesti annettuna verrattuna eriaikaiseen antoon ja sen osalta samanveroisuuden (non-inferiority) kriteerit eivät täyttyneet. Löydöksen kliinistä merkitystä ei tunneta.
Raskaus ja imetys
Raskaus
Raskaana olevista naisista saatavissa olevat tiedot (yli 4 000 altistuneesta) eivät viittaa epämuodostumia aiheuttavaan tai fetaaliseen/neonataaliseen toksisuuteen.
Eläimillä tehdyissä Abrysvo-tutkimuksissa ei ole havaittu suoria eikä epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaiheen 3 tutkimuksessa (Tutkimus 1) äidillä 1 kuukauden kuluessa rokotuksesta raportoidut haittatapahtumat olivat Abrysvo-ryhmässä (14 %) samankaltaisia kuin lumeryhmässä (13 %).
Imeväisikäisillä (ikä enintään 24 kuukautta) ei havaittu turvallisuutta koskevia signaaleja. Imeväisikäisillä 1 kuukauden kuluessa syntymästä raportoitujen haittatapahtumien ilmaantuvuudet olivat Abrysvo-ryhmässä (38 %) samankaltaiset kuin lumeryhmässä (35 %). Vakavia syntymään ja/tai synnytykseen liittyviä seurauksia arvioitiin Abrysvo-ryhmässä lumeryhmään verrattuna, ja niitä olivat mm. ennenaikainen synnytys (207 [6 %] Abrysvo-ryhmässä ja 172 [5 %] lumeryhmässä), pieni syntymäpaino (186 [5 %] Abrysvo-ryhmässä ja 158 [4 %] lumeryhmässä) ja synnynnäiset poikkeavuudet (205 [6 %] Abrysvo-ryhmässä ja 245 [7 %] lumeryhmässä).
Imetys
Ei tiedetä, erittyykö Abrysvo ihmisillä äidinmaitoon. Abrysvo-rokotteen ei ole osoitettu vaikuttavan haitallisesti rokotuksen saaneiden naisten imettämiin vauvoihin.
Hedelmällisyys
Tietoja Abrysvo-rokotteen vaikutuksesta ihmisten hedelmällisyyteen ei ole saatavilla.
Eläinkokeissa ei ole ilmennyt suoria tai epäsuoria haittavaikutuksia naaraiden hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Abrysvo-rokotteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Raskaana olevat henkilöt
Raskausviikoilla 24–36 raskaana olevilla naisilla yleisimmin raportoituja haittavaikutuksia olivat rokotteen pistoskohdan kipu (41 %), päänsärky (31 %) ja lihassärky (27 %). Suurin osa raskaana olevilla tutkittavilla havaituista paikallisista ja systeemisistä reaktioista oli vaikeusasteeltaan lieviä tai kohtalaisia, ja ne menivät ohi 2–3 päivässä.
18 vuotta täyttäneet ja sitä vanhemmat henkilöt
18 vuotta täyttäneillä ja sitä vanhemmilla henkilöillä yleisimmin raportoidut haittavaikutukset olivat väsymys (23 %), päänsärky (20 %), rokotteen pistoskohdan kipu (19 %) ja lihassärky (16 %). Suurin osa reaktioista oli vaikeusasteeltaan lieviä tai kohtalaisia, ja ne menivät ohi 1–2 päivässä.
Haittavaikutustaulukko
Abrysvo-rokotteen kerta-annoksen antamisen turvallisuutta raskausviikoilla 24–36 raskaana oleville naisille (n = 3 698) ja 18 vuotta täyttäneille ja sitä vanhemmille henkilöille (n = 20 275) arvioitiin kliinisissä tutkimuksissa.
Haittavaikutukset on lueteltu seuraavien yleisyysluokkien mukaan:
Hyvin yleinen (≥ 1/10);
Yleinen (≥ 1/100, < 1/10);
Melko harvinainen (≥ 1/1 000, < 1/100);
Harvinainen (≥ 1/10 000, < 1/1 000);
Hyvin harvinainen (< 1/10 000);
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on lueteltu elinjärjestelmän mukaan ja vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1 Abrysvo-rokotteen antamisen jälkeen ilmenneet haittavaikutukset
| Elinjärjestelmäluokitus | Lääkkeen haittavaikutukset: ≤ 49-vuotiaat raskaana olevat henkilöt | Lääkkeen haittavaikutukset: ≥ 18-vuotiaat henkilöt |
| Veri ja imukudos | ||
| Lymfadenopatia | Harvinainen | Harvinainen |
| Immuunijärjestelmä | ||
| Anafylaksia | Hyvin harvinainen | |
| Yliherkkyysreaktiot (sisältäen ihottuman ja nokkosihottuman) | Harvinainen | Harvinainen |
| Hermosto | ||
| Päänsärky | Hyvin yleinen | Hyvin yleinen |
| Guillain-Barrén oireyhtymä | Hyvin harvinainen | |
| Luusto, lihakset ja sidekudos | ||
| Lihassärky | Hyvin yleinen | Hyvin yleinen |
| Nivelsärky | Yleinen | |
| Yleisoireet ja antopaikassa todettavat haitat | ||
| Väsymys | Hyvin yleinen | |
| Rokotteen pistoskohdan kipu | Hyvin yleinen | Hyvin yleinen |
| Rokotteen pistoskohdan punoitus | Yleinen | Yleinen |
| Rokotteen pistoskohdan turvotus | Yleinen | Yleinen |
| Kuume | Melko harvinainen | |
| Rokotteen pistoskohdan kutina | Harvinainen | |
| Rokotteen pistoskohdan mustelma | Harvinainen | |
| Rokotteen pistoskohdan hematooma | Harvinainen | |
Erityisryhmät
18 vuotta täyttäneet ja sitä vanhemmat immuunipuutteiset henkilöt
Reaktogeenisuus vastasi Abrysvon tunnettua profiilia. Odottamattomia turvallisuutta koskevia löydöksiä ei todettu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Koska käyttövalmis Abrysvo-rokote on kerta-annoksinen, yliannostus on epätodennäköistä.
Abrysvo-rokotteen yliannostukseen ei ole spesifistä hoitoa. Yliannostustapauksessa henkilöä on tarkkailtava ja oireenmukaista hoitoa on annettava tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Rokotteet, muut virusrokotteet; ATC-koodi: J07BX05
Vaikutusmekanismi
Abrysvo sisältää kahta yhdistelmä-DNA-tekniikalla valmistettua, stabiloitua RS-viruksen (respiratory syncytial virus, RSV) prefuusio-F‑proteiiniantigeenia, jotka edustavat RSV-alaryhmiä A ja B. Prefuusio-F‑proteiini on RSV-infektiota estävien neutraloivien vasta-aineiden ensisijainen kohde. Lihakseen annon jälkeen prefuusio-F‑proteiiniantigeenit saavat aikaan immuunivasteen, joka suojaa RS-virukseen liittyvältä alahengitystieinfektiolta.
Abrysvo-rokotteen raskausviikolla 24–36 saaneista äideistä istukan kautta siirtyneet RS-viruksen neutraloivat vasta-aineet suojaavat rokotteen saaneille äideille syntyneitä imeväisiä RS-viruksen aiheuttamaa alahengitystieinfektiota vastaan. Abrysvo-rokotteen saaneet 18 vuotta täyttäneet ja sitä vanhemmat aikuiset saavat aktiivisesta immunisaatiosta suojaa RS-virusta vastaan.
Kliininen teho
Raskausaikana aktiivisesti immunisoiduille henkilöille syntyneet imeväiset syntymästä 6 kuukauden ikään
Tutkimus 1 oli vaiheen 3 satunnaistettu (1:1), kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus, jossa arvioitiin yhden Abrysvo-annoksen tehoa raskausviikkojen 24 ja 36 välillä rokotetuille henkilöille syntyneillä imeväisillä RS-viruksen aiheuttaman alahengitystieinfektion ehkäisyssä. Tarvetta antaa lisärokoteannos myöhempien raskauksien aikana ei ole selvitetty.
RS-viruksen aiheuttaman alahengitystieinfektion määritelmä oli lääkärikäynti infektion vuoksi henkilöillä, joilla oli RT-PCR (käänteiskopioijaentsyymin avulla tapahtuva polymeraasiketjureaktio) ‑testillä vahvistettu RS-virusinfektio ja vähintään yksi seuraavista hengitystieoireista: tiheä hengitys, alhainen happisaturaatio (SpO2 < 95 %) tai rintakehän sisäänvetäytyminen. Vaikean RS-viruksen aiheuttaman alahengitystieinfektion määritelmä oli RS-virukseen liittyvä alahengitystieinfektio, joka täytti lisäksi vähintään yhden seuraavista kriteereistä: erittäin tiheä hengitys, alhainen happisaturaatio (SpO2 < 93 %), happihoidon antaminen suurivirtauksisen nenäkanyylin kautta (high-flow nasal cannula, HFNC) tai mekaaninen ventilaatio, potilaan ottaminen teho-osastolle yli neljän tunnin ajaksi ja/tai reagoimattomuus ärsykkeisiin / tajuttomuus.
Tässä tutkimuksessa 3 711 raskaana olevaa henkilöä, joiden yksisikiöisessä raskaudessa ei ollut ilmennyt komplikaatioita, satunnaistettiin Abrysvo-ryhmään ja 3 709 lumeryhmään.
Rokotteen teho (VE) määriteltiin päätetapahtuman suhteellisen riskin pienenemisenä Abrysvo-ryhmässä verrattuna lumeryhmän imeväisillä, jotka syntyivät määrätyn intervention saaneille raskaana olleille henkilöille. Primaarianalyysissa oli kaksi rinnakkain arvioitua ensisijaista tehon päätetapahtumaa: vaikea RSV-positiivinen lääkärikäyntiin johtanut alahengitystieinfektio ja RSV-positiivinen lääkärikäyntiin johtanut alahengitystieinfektio 90, 120, 150 tai 180 vuorokauden kuluessa syntymästä.
Abrysvo-rokotteen saaneista raskaana olleista naisista 65 % oli valkoihoisia, 20 % tummaihoisia tai afroamerikkalaisia ja 29 % latinalaisamerikkalaisia. Iän mediaani oli 29 vuotta (vaihteluväli 16–45 vuotta); 0,2 % tutkittavista oli alle 18-vuotiaita ja 4,3 % alle 20-vuotiaita. Rokotteen antohetkellä gestaatioiän mediaani oli 31 viikkoa ja 2 päivää (vaihteluväli 24 viikkoa ja 0 päivää – 36 viikkoa ja 4 päivää). Lapsen syntyessä gestaatioiän mediaani oli 39 viikkoa ja 1 päivä (vaihteluväli 27 viikkoa ja 3 päivää – 43 viikkoa ja 6 päivää).
Rokotteen teho on esitetty taulukoissa 2 ja 3.
Taulukko 2 Abrysvo-rokotteen teho RS-viruksen aiheuttaman vakavan, lääkärikäyntiin johtavan alahengitystieinfektion ehkäisyssä aktiivisesti immunisoitujen äitien vastasyntyneillä 6 kuukauden ikään saakka – Tutkimus 1
| Ajanjakso | Abrysvo Tapausten lkm N = 3 495 | Lumevalmiste Tapausten lkm N = 3 480 | Rokotteen teho (%) (luottamusväli)a |
| 90 vrk | 6 | 33 | 81,8 (40,6; 96,3) |
| 120 vrk | 12 | 46 | 73,9 (45,6; 88,8) |
| 150 vrk | 16 | 55 | 70,9 (44,5; 85,9) |
| 180 vrk | 19 | 62 | 69,4 (44,3; 84,1) |
a 99,5 %:n luottamusväli 90 vuorokauden ajanjaksolla; 97,58 %:n luottamusväli sitä pidemmillä ajanjaksoilla
Taulukko 3 Abrysvo-rokotteen teho RS-viruksen aiheuttaman lääkärikäyntiin johtavan alahengitystieinfektion ehkäisyssä aktiivisesti immunisoitujen äitien vastasyntyneillä 6 kuukauden ikään saakka – Tutkimus 1
| Ajanjakso | Abrysvo Tapausten lkm N = 3 495 | Lumevalmiste Tapausten lkm N = 3 480 | Rokotteen teho (%) (luottamusväli)a |
| 90 vrk | 24 | 56 | 57,1 (14,7; 79,8) |
| 120 vrk | 35 | 81 | 56,8 (31,2; 73,5) |
| 150 vrk | 47 | 99 | 52,5 (28,7; 68,9) |
| 180 vrk | 57 | 117 | 51,3 (29,4; 66,8) |
a 99,5 %:n luottamusväli 90 vuorokauden ajanjaksolla; 97,58 %:n luottamusväli sitä pidemmillä ajanjaksoilla
Post-hoc-analyysi tehtiin rokotteen tehosta raskausviikon mukaan. Rokotteen teho 180 päivän kuluessa ilmenevän lääkärin hoitaman vaikean alahengitystieinfektion ehkäisyssä oli raskauden alkuvaiheessa (24 – < 30 viikkoa) rokotetuilla naisilla 57,2 % (95 %:n luottamusväli 10,4; 80,9) ja raskauden myöhemmässä vaiheessa soveltuvassa aikaikkunassa (30–36 viikkoa) rokotuksen saaneilla naisilla 78,1 % (95 %:n luottamusväli 52,1; 91,2). Rokotteen teho 180 päivän kuluessa ilmenevän lääkärin hoitaman alahengitystieinfektion ehkäisyssä oli raskauden alkuvaiheessa (24 – < 30 viikkoa) rokotetuilla naisilla 30,9 % (95 %:n luottamusväli ‑14,4; 58,9) ja raskauden myöhemmässä vaiheessa soveltuvassa aikaikkunassa (30–36 viikkoa) rokotetuilla naisilla 62,4 % (95 %:n luottamusväli 41,6; 76,4).
60 vuotta täyttäneiden ja sitä vanhempien henkilöiden aktiivinen immunisaatio
Tutkimus 2 oli vaiheen 3 satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus, jossa arvioitiin Abrysvo-valmisteen tehoa RS-viruksen aiheuttaman alahengitystieinfektion ehkäisyssä 60 vuotta täyttäneillä ja sitä vanhemmilla henkilöillä.
RS-viruksen aiheuttaman alahengitystieinfektion määritelmä oli RT‑PCR-testillä vahvistettu RS-viruksen aiheuttama sairaus, johon liittyy 7 vuorokauden kuluessa oireiden alkamisesta vähintään kaksi tai useampi tai kolme tai useampi seuraavista, pidempään kuin yhden vuorokauden kestävistä hengityselinoireista: alkanut tai voimistunut yskä, hengityksen vinkuminen, limannousu, hengenahdistus tai tiheä hengitys (≥ 25 hengityskertaa/min tai hengityksen tihentyminen 15 % levossa mitatusta lähtötilanteesta).
Tutkittavat satunnaistettiin (1:1) saamaan Abrysvo-rokotetta (n = 18 487) tai lumevalmistetta (n = 18 479). Tutkittavat jaoteltiin iän mukaan 60–69-vuotiaisiin (63 %), 70–79-vuotiaisiin (32 %) ja ≥ 80-vuotiaisiin (5 %). Henkilöt, joilla oli vakaassa tilassa olevia kroonisia perussairauksia, soveltuivat tutkimukseen ja tutkittavista 52 %:lla oli vähintään yksi ennalta tiedossa oleva sairaus; 16 %:lla tutkimukseen rekisteröidyistä oli vakaassa tilassa oleva krooninen sydän- tai keuhkosairaus, kuten astma (9 %), keuhkoahtaumatauti (7 %) tai sydämen vajaatoiminta (2 %). Immuunipuutteiset henkilöt eivät soveltuneet tutkimukseen.
Ensisijainen tavoite oli arvioida rokotteen tehoa ensimmäisen RS-virukseen liittyvän alahengitystieinfektioepisodin suhteellisen riskin pienenemisenä Abrysvo-ryhmässä lumeryhmään verrattuna ensimmäisen RS-viruskauden aikana.
Abrysvo-rokotetta saaneista tutkittavista 51 % oli miehiä ja 80 % valkoihoisia, 12 % tummaihoisia tai afroamerikkalaisia ja 42 % latinalaisamerikkalaisia. Tutkittavien iän mediaani oli 67 vuotta (vaihteluväli 59–95 vuotta).
Ensimmäisen RS-viruskauden lopussa tehty analyysi osoitti, että Abrysvo vähensi tilastollisesti merkitsevästi RS-virukseen liittyviä alahengitystieinfektiotapauksia, joihin liittyy vähintään kaksi tai vähintään kolme oiretta.
Tiedot rokotteen tehosta ensimmäisen RS-viruskauden päättyessä (seuranta-ajan mediaani 7,4 kuukautta) on esitetty taulukossa 4.
Taulukko 4 Abrysvo-rokotteen teho RS-virusinfektion ehkäisyssä; aktiivinen immunisaatio ≥ 60-vuotiailla henkilöillä – Tutkimus 2
| Tehon päätetapahtuma | Abrysvo | Lumevalmiste | Rokotteen teho (%) (95 %:n luottamusväli) | |||
| N | n | N | n | |||
| Ensimmäinen RS-virukseen liittyvä alahengitystieinfektio-episodi, ≥ 2 oirettaa | Yhteensä | 18 058 | 15 | 18 076 | 43 | 65,1 (35,9; 82,0) |
| Ikä 60–69 vuotta | 11 305 | 10 | 11 351 | 25 | 60,0 (13,8; 82,9) | |
| Ikä 70–79 vuotta | 5 750 | 4 | 5 742 | 12 | 66,7 (‑10,0; 92,2) | |
| ≥ 1 merkittävä perussairaus | 9 377 | 8 | 9 432 | 22 | 63,6 (15,2; 86,0) | |
| Ensimmäinen RS-virukseen liittyvä alahengitystieinfektio-episodi, ≥ 3 oirettab | Yhteensä | 18 058 | 2 | 18 076 | 18 | 88,9 (53,6; 98,7) |
| Ikä 60–69 vuotta | 11 305 | 2 | 11 351 | 11 | 81,8 (16,7; 98,0) | |
| Ikä 70–79 vuotta | 5 750 | 0 | 5 742 | 4 | 100 (‑51,5; 100,0) | |
| ≥ 1 merkittävä perussairaus | 9 377 | 2 | 9 432 | 11 | 81,8 (16,7; 98,0) | |
N = tutkittavien lukumäärä; n = tapausten lukumäärä
a Eksploratiivisessa analyysissä RSV-alaryhmässä A (Abrysvo n = 3, lumevalmiste n = 16) rokotteen teho oli 81,3 % (luottamusväli 34,5; 96,5); ja RSV-alaryhmässä B (Abrysvo n = 12, lumevalmiste n = 26) rokotteen teho oli 53,8 % (luottamusväli 5,2; 78,8).
b Eksploratiivisessa analyysissä RSV-alaryhmässä A (Abrysvo n = 1, lumevalmiste n = 5) rokotteen teho oli 80,0 % (luottamusväli 78,7; 99,6); ja RSV-alaryhmässä B (Abrysvo n = 1, lumevalmiste n = 12) rokotteen teho oli 91,7 % (luottamusväli 43,7; 99,8).
Rokotteen tehosta iältään 80 vuotta täyttäneiden ja sitä vanhempien tutkittavien alaryhmässä (995 tutkittavaa Abrysvo-ryhmässä ja 981 tutkittavaa lumeryhmässä) ei voitu tehdä päätelmiä, koska kertyneiden tapausten kokonaismäärä oli pieni (7 RS-viruksen aiheuttamaa alahengitystieinfektiotapausta, joihin liittyi vähintään kaksi oiretta, ja 3 RS-viruksen aiheuttamaa alahengitystieinfektiotapausta, joihin liittyi vähintään kolme oiretta).
Teho RS-virukseen liittyvää alahengitystieinfektiota vastaan 60 vuotta täyttäneillä ja sitä vanhemmilla tutkittavilla kahden RS-viruskauden aikana
Kahden RS-viruskauden aikaisen seuranta-ajan mediaanin ollessa 16,4 kuukautta rokotteen teho niitä RS-viruksen aiheuttamia alahengitystieinfektioita vastaan, joihin liittyi vähintään kaksi oiretta, oli 58,8 % (95 %:n luottamusväli 43,0; 70,6, 54 tapausta Abrysvo-ryhmässä ja 131 tapausta lumeryhmässä) ja niitä RS-viruksen aiheuttamia alahengitystieinfektioita vastaan, joihin liittyi vähintään kolme oiretta, se oli 81,5 % (95 %:n luottamusväli 63,3; 91,6, 10 tapausta Abrysvo-ryhmässä ja 54 tapausta lumeryhmässä). Rokotteen teho RSV-A-tyypin aiheuttamaa RS-virukseen liittyvää alahengitystieinfektiota vastaan oli 66,3 % (95 %:n luottamusväli 47,2; 79,0) ja RSV-B-tyypin aiheuttamaa RS-virukseen liittyvää alahengitystieinfektiota vastaan 50,0 % (95 %:n luottamusväli 18,5; 70,0) tapauksissa, joihin liittyi vähintään kaksi alahengitystieinfektion oiretta. Rokotteen teho RSV-A-tyypin aiheuttamaa RS-virukseen liittyvää alahengitystieinfektiota vastaan oli 80,6 % (95 %:n luottamusväli 52,9; 93,4) ja RSV-B-tyypin aiheuttamaa RS-virukseen liittyvää alahengitystieinfektiota vastaan 86,4 % (95 %:n luottamusväli 54,6; 97,4) tapauksissa, joihin liittyi vähintään kolme alahengitystieinfektion oiretta.
Iän ja merkittävän perussairauden mukaiset alaryhmäanalyysit rokotteen tehosta olivat kahden RS-viruskauden aikana yhdenmukaiset ensimmäisen RS-viruskauden lopun tehon kanssa, ja ne tukivat rokotteen yhdenmukaista tehoa eri ikä- ja riskiryhmissä.
Immunogeenisuus 18–59-vuotiailla henkilöillä
Tutkimus 3 oli vaiheen 3 satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus, jossa arvioitiin Abrysvo-valmisteen turvallisuutta ja immunogeenisuutta 18–59-vuotiailla henkilöillä, joilla RS-viruksen aiheuttaman vaikean alahengitystieinfektion kehittymisen riskin katsottiin olevan suuri. Tutkimukseen 3 otettiin mukaan henkilöitä, joilla oli kroonisia keuhkosairauksia (mukaan lukien astma), sydän- ja verisuonisairauksia (pois lukien isoloitunut systolinen hypertensio) tai munuais-, maksa- tai aineenvaihduntasairauksia (mukaan lukien diabetes ja kilpirauhasen liikatoiminta/vajaatoiminta) tai neurologisia tai hematologisia sairauksia. Tutkittavat satunnaistettiin (2:1) saamaan kerta-annos Abrysvo-valmistetta (n = 437) tai lumevalmistetta (n = 217).
Tutkimuksessa 3 Abrysvo-valmistetta saaneiden ja lumevalmistetta saaneiden tutkittavien demografiset ominaisuudet olivat iän ja etnisyyden osalta samankaltaiset. Viisikymmentäkolme prosenttia (53 %) oli 18–49-vuotiaita ja 47 % oli 50–59-vuotiaita. Rokotetta saaneiden ja lumevalmistetta saaneiden ryhmät olivat samankaltaiset sen suhteen, että tutkittavilla oli vähintään yksi ennalta määritetty sairaus; 53 %:lla oli ≥ 1 krooninen keuhkosairaus, 8 %:lla ≥ 1 sydän- ja verisuonisairaus, 42 %:lla diabetes ja 31 %:lla ≥ 1 muu sairaus (maksa- tai munuaissairaus tai neurologinen tai hematologinen sairaus tai muu aineenvaihduntasairaus).
Rokotteen teho 18–59-vuotiailla henkilöillä on päätelty vertaamalla immuunivasteita havaittuihin immuunivasteisiin (immunobridging) tutkimuksessa 2, jossa rokotteen teho osoitettiin 60 vuotta täyttäneillä ja sitä vanhemmilla henkilöillä. Suuren riskin ryhmään kuuluvat 18–59-vuotiaat henkilöt täyttivät vähintään samanveroisuuden kriteerit (non-inferiority) vertailussa satunnaisesti valikoituun immunogeenisuutta koskevaan alaryhmään (ulkoinen verrokkiryhmä), jossa oli mukana tutkimukseen 2 osallistuneita ≥ 60-vuotiaita henkilöitä, mikä todettiin RS-virusta neutraloivia geometrisiä keskitittereitä koskevan suhteen kaksitahoisen 95 %:n luottamusvälin alarajojen > 0,667 (1,5-kertainen samanveroisuuden marginaaliin nähden) perusteella ja serovasteprosenttien eron kaksitahoisen 95 %:n luottamusvälin alarajojen perusteella, jotka olivat RS-viruksen sekä A‑tyypin että B‑tyypin osalta > –10 %.
Taulukko 5 Mallin mukaan korjattujen RS-virusta neutraloiviengeometristen keskititterien vertailu 1 kuukauden kuluttua Abrysvo-rokotteen antamisesta: suuren riskin 18–59-vuotiaat (tutkimus 3) vs. 60 vuotta täyttäneet ja sitä vanhemmat (tutkimus 2)
| Tutkimuksen 3 suuren riskin 18–59-vuotiaat | Tutkimuksen 2 ≥ 60-vuotiaat | ANCOVA-vertailu | |||
| RSV-alaryhmät | n | Korjattu geometrinen keskititteri (95 %:n luottamusväli) | n | Korjattu geometrinen keskititteri (95 %:n luottamusväli) | Korjattu geometristen keskiarvojen suhde (95 %:n luottamusväli) |
| A | 435 | 41 097 (37 986; 44 463) | 408 | 26 225 (24 143; 28 486) | 1,57 (1,396; 1,759) |
| B | 437 | 37 416 (34 278; 40 842) | 408 | 24 680 (22 504; 27 065) | 1,52 (1,333; 1,725) |
Taulukko 6 RS-virusta neutraloivien titterien serovasteprosenttien vertailu 1 kuukauden kuluttua Abrysvo-rokotteen antamisesta: suuren riskin 18–59-vuotiaat (tutkimus 3) vs. 60 vuotta täyttäneet ja sitä vanhemmat (tutkimus 2)
| Tutkimuksen 3 suuren riskin 18–59-vuotiaat | Tutkimuksen 2 ≥ 60-vuotiaat | Vertailu | |||
| RSV-alaryhmät | n/N (%) | 95 %:n luottamusväli | n/N (%) | 95 %:n luottamusväli | Ero (95 %:n luottamusväli) |
| A | 405/435 (93) | 90,3; 95,3 | 359/408 (88) | 84,4; 91,0 | 5,1 (1,2; 9,2) |
| B | 408/437 (93) | 90,6; 95,5 | 347/408 (85) | 81,2; 88,4 | 8,3 (4,2; 12,6) |
Immunogeenisuus 18 vuotta täyttäneillä ja sitä vanhemmilla immuunipuutteisilla henkilöillä
Tutkimus 4 (C3671023‑tutkimuksen alatutkimus B) oli vaiheen 3 yksihaarainen, avoin monikeskustutkimus, jossa arvioitiin Abrysvon turvallisuutta ja immunogeenisuutta 18 vuotta täyttäneillä ja sitä vanhemmilla immuunipuutteisilla henkilöillä. Tutkittavilla oli anamneesissa vähintään kolme kuukautta ennen tutkimukseen ottamista tehty kiinteän elimen (munuaisen, maksan, keuhkon tai sydämen) siirto tai loppuvaiheen munuaissairaus, johon tutkittava sai hemodialyysihoitoa, tai tulehduksellisia autoimmuunisairauksia, joihin tutkittava sai immuunivastetta aktiivisesti muuntavaa hoitoa, tai pitkälle edennyt ei‑pienisoluinen keuhkosyöpä, johon tutkittava sai immuunivastetta aktiivisesti muuntavaa hoitoa. Tutkittavat saivat kaksi Abrysvo-annosta yhden kuukauden välein.
18 vuotta täyttäneillä ja sitä vanhemmilla tutkittavilla, joilla oli immuunipuutosta aiheuttavia sairauksia (n = 188), yksi Abrysvo-annos riitti tuottamaan voimakkaan, lähtötasoon nähden noin 8–9‑kertaisen, RS‑viruksen A- ja B-tyyppejä neutraloivan vasteen. Vaste ei voimistunut enempää, kun toinen Abrysvo-annos annettiin yhden kuukauden kuluttua ensimmäisestä annoksesta.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Abrysvo-valmisteen käytöstä RS-viruksen aiheuttaman alahengitystieinfektion ehkäisemiseen 2 – < 18-vuotiailla lapsilla (ks. kohdasta Annostus ja antotapa ohjeet käytöstä lapsilla).
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine
Trometamoli
Trometamolihydrokloridi
Sakkaroosi
Mannitoli (E421)
Polysorbaatti 80 (E433)
Natriumkloridi
Kloorivetyhappo (pH:n säätöön)
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
4 vuotta
Avaamaton injektiopullo säilyy 5 vuorokautta 8 –30 ºC:n lämpötilassa. Tämän säilyvyysajan päättyessä Abrysvo on käytettävä tai hävitettävä. Nämä tiedot on tarkoitettu ohjeiksi terveydenhuollon ammattilaisille vain tilapäisten lämpötilavaihteluiden varalta.
Käyttökuntoon saattamisen jälkeen
Abrysvo pitää antaa heti käyttökuntoon saattamisen jälkeen tai 4 tunnin kuluessa siitä, jos valmistetta on säilytetty 15–30 ºC:ssa. Ei saa jäätyä.
Käytönaikaiseksi kemialliseksi ja fysikaaliseksi säilyvyydeksi on osoitettu 4 tuntia 15–30 ºC:ssa. Mikrobiologiselta kannalta valmiste pitää käyttää välittömästi. Jos sitä ei käytetä välittömästi, käytönaikaiset säilytysajat ja käyttöä edeltävät säilytysolosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2 ºC – 8 ºC).
Ei saa jäätyä. Hävitettävä, jos pakkaus on jäätynyt.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ABRYSVO injektiokuiva-aine ja liuotin, liuosta varten
1 annos (1 injektiopullon liitin, 1 neula) (228,93 €)
PF-selosteen tieto
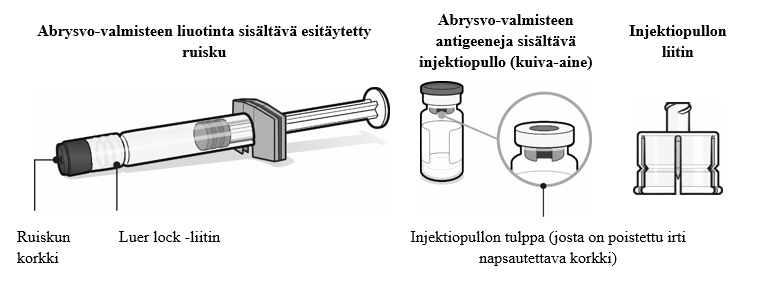
Abrysvo-valmisteen antigeenit (kuiva-aine) sisältävä injektiopullo ja liuottimen sisältävä esitäytetty ruisku
Kuiva-aine yhtä annosta varten injektiopullossa (tyypin 1 lasia tai vastaavaa), jossa on tulppa (synteettistä bromobutyylikumia tai synteettistä klorobutyylikumia) ja irti napsautettava korkki.
Liuotin yhtä annosta varten esitäytetyssä ruiskussa (tyypin 1 lasia), jossa on tulppa (synteettistä klorobutyylikumia) ja kärjessä korkki (synteettistä isopreeniä / bromobutyylisekoitekumia).
Injektiopullon liitin
Abrysvo-valmisteen antigeenit (kuiva-aine) sisältävä injektiopullo ja liuottimen sisältävä injektiopullo
Kuiva-aine yhtä annosta varten injektiopullossa (tyypin 1 lasia tai vastaavaa), jossa on tulppa (synteettistä bromobutyylikumia tai synteettistä klorobutyylikumia) ja irti napsautettava korkki.
Liuotin yhtä annosta varten injektiopullossa (tyypin 1 lasia tai vastaavaa), jossa on tulppa (bromobutyylikumia) ja irti napsautettava korkki.
Pakkauskoot
Pakkaus, jossa on 1 kuiva-ainetta sisältävä injektiopullo (antigeenit), 1 liuotinta sisältävä esitäytetty ruisku, 1 injektiopullon liitin sekä 1 neula tai ei neulaa (1 annoksen pakkaus).
Pakkaus, jossa on 5 kuiva-ainetta sisältävää injektiopulloa (antigeenit), 5 liuotinta sisältävää esitäytettyä ruiskua, 5 injektiopullon liitintä sekä 5 neulaa tai ei neuloja (5 annoksen pakkaus).
Pakkaus, jossa on 10 kuiva-ainetta sisältävää injektiopulloa (antigeenit), 10 liuotinta sisältävää esitäytettyä ruiskua, 10 injektiopullon liitintä sekä 10 neulaa tai ei neuloja (10 annoksen pakkaus).
Pakkaus, jossa on 5 kuiva-ainetta sisältävää injektiopulloa (antigeenit) ja 5 liuotinta sisältävää injektiopulloa (5 annoksen pakkaus).
Pakkaus, jossa on 10 kuiva-ainetta sisältävää injektiopulloa (antigeenit) ja 10 liuotinta sisältävää injektiopulloa (10 annoksen pakkaus).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine on valkoista.
Liuotin on kirkasta, väritöntä nestettä.
Käyttö- ja käsittelyohjeet
Abrysvo-valmisteen antigeenit (kuiva-aineen) sisältävän injektiopullon, liuottimen sisältävän esitäytetyn ruiskun ja injektiopullon liittimen käyttö
Abrysvo on saatettava käyttökuntoon ennen antoa lisäämällä liuottimen sisältävän esitäytetyn ruiskun koko sisältö injektiopullon liittimen avulla kuiva-aineen sisältävään injektiopulloon.
Abrysvo-rokote saatetaan käyttökuntoon vain valmisteen mukana toimitetulla liuottimella.
Valmistautuminen pistoksen antamiseen
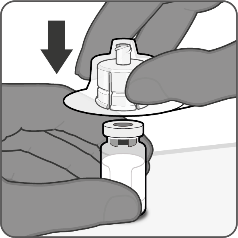 | Vaihe 1. Kiinnitä injektiopullon liitin
|
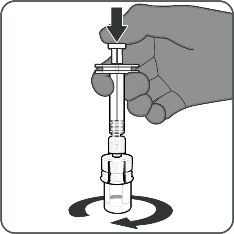 | Vaihe 2. Saata kuiva-ainekomponentti (antigeenit) käyttökuntoon Abrysvo-rokotteen valmistamiseksi
|
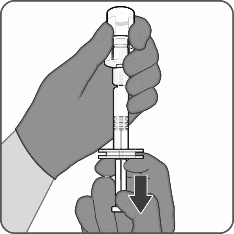 | Vaihe 3. Vedä käyttökuntoon saatettu rokote ruiskuun
|
Käyttökuntoon saatettu rokote on kirkas ja väritön liuos. Tarkista rokote ennen pistoksen antoa silmämääräisesti, ettei siinä ole suuria hiukkasia eikä värimuutoksia. Jos havaitset suuria hiukkasia tai värimuutoksia, rokotetta ei saa käyttää.
Abrysvo-valmisteen antigeenit (kuiva-aine) sisältävän injektiopullon ja liuottimen sisältävän injektiopullon käyttö
Abrysvo-valmisteen antigeenit (kuiva-aineen) sisältävän injektiopullon sisältö saatetaan käyttökuntoon vain Abrysvo-pakkauksen sisältämällä injektiopullon liuottimella.
Injektion annon valmistelu
- Vedä steriiliä neulaa ja steriiliä ruiskua käyttämällä liuottimen sisältävän injektiopullon koko sisältö ruiskuun ja injisoi ruiskun koko sisältö kuiva-aineen sisältävään injektiopulloon.
- Pyörittele injektiopulloa varovasti pyörivällä liikkeellä, kunnes kuiva-aine on liuennut täysin. Älä ravista.
- Vedä käyttökuntoon saatetun rokotteen sisältävästä injektiopullosta 0,5 ml.
Käyttökuntoon saatettu rokote on kirkas ja väritön liuos. Tarkista rokote ennen antoa silmämääräisesti, ettei siinä ole suuria hiukkasia eikä värimuutoksia. Jos havaitset suuria hiukkasia tai värimuutoksia, rokotetta ei saa käyttää.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ABRYSVO injektiokuiva-aine ja liuotin, liuosta varten
1 annos
- Ei korvausta.
ATC-koodi
J07BX05
Valmisteyhteenvedon muuttamispäivämäärä
04.09.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
