VAZKEPA kapseli, pehmeä 998 mg
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää 998 mg ikosapenttietyyliä.
Apuaineet, joiden vaikutus tunnetaan
Yksi kapseli sisältää 30 mg maltitolia (E 965 ii), 83 mg sorbitolia (E 420 ii) sekä soijalesitiiniä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kapseli, pehmeä (kapseli).
Kliiniset tiedot
Käyttöaiheet
Vazkepa on tarkoitettu sydän- ja verisuonitapahtumien riskin vähentämiseen aikuisille statiinihoitoa saaville potilaille, joilla on suuri sydän- ja verisuonitautien riski ja joiden triglyseridipitoisuus on koholla (≥ 150 mg/dl [≥ 1,7 mmol/l]) ja joilla on
- varmistettu sydän- ja verisuonitauti tai
- diabetes ja vähintään yksi muu sydän- ja verisuonitautien riskitekijä.
Tutkimustiedot, mukaan lukien sydämen ja verisuonten riskitekijät, sekä tulokset vaikutuksista sydän- ja verisuonitapahtumiin, ks. kohta Farmakodynamiikka.
Annostus ja antotapa
Annostus
Suositeltu suun kautta otettava vuorokausiannos on 4 kapselia: kaksi 998 mg:n kapselia kaksi kertaa päivässä.
Jos annos jää ottamatta, potilaan pitää ottaa se heti muistaessaan. Jos yksi vuorokausiannos jää ottamatta, seuraavaa annosta ei kuitenkaan pidä kaksinkertaistaa.
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (≥ 65-vuotiaille) (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen pienentämistä ei suositella (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen pienentämistä ei suositella (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää ikosapenttietyyliä < 18 vuoden ikäisille lapsille sydän- ja verisuonitapahtumien riskin vähentämiseen statiinihoitoa saavilla potilailla, joilla on suuri sydän- ja verisuonitautien riski ja kohonnut triglyseridipitoisuus sekä muita sydän- ja verisuonitautien riskitekijöitä.
Antotapa
Suun kautta.
Vazkepa pitää ottaa aterian yhteydessä tai aterian jälkeen.
Potilaita pitää neuvoa nielemään kapselit kokonaisina rikkomatta, murskaamatta, liuottamatta ja pureskelematta niitä, jotta varmistetaan koko aiotun annoksen saaminen.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, soijalle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Kala- ja/tai äyriäisallergiat
Ikosapenttietyyliä saadaan kalaöljystä. Ei tiedetä, onko kalalle ja/tai äyriäisille allergisilla potilailla muita suurempi ikosapenttietyylistä aiheutuvien allergisten reaktioiden riski. Ikosapenttietyylin käytössä pitää olla varovainen, jos potilaan tiedetään olevan yliherkkä kalalle ja/tai äyriäisille.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavien potilaiden alaniiniaminotransferaasi- (ALAT) ja aspartaattiaminotransferaasipitoisuutta (ASAT) pitää seurata siten kuin kliinisesti on aiheellista ennen hoidon aloittamista ja asianmukaisin väliajoin hoidon aikana (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Eteisvärinä tai ‑lepatus
Ikosapenttietyyliin liittyi kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa suurentunut sairaalahoitoa vaativan eteisvärinän tai ‑lepatuksen riski. Eteisvärinän ilmaantuvuus oli suurempi potilailla, joilla oli aiemmin ollut eteisvärinää tai ‑lepatusta (ks. kohta Haittavaikutukset). Potilaita, etenkin niitä, joiden anamneesissa on oleellisia sairauksia, pitää seurata eteisvärinän tai eteislepatuksen kliinisten oireiden havaitsemiseksi (esim. hengenahdistus, sydämentykytys, pyörtyminen/huimaus, epämukavat tuntemukset rintakehässä, verenpaineen muutos tai epäsäännöllinen syke). Sydänsähkökäyrä pitää tutkia, jos se on kliinisesti aiheellista.
Verenvuodot
Ikosapenttietyylihoitoon on liittynyt suurentunut verenvuotojen ilmaantuvuus. Kun ikosapenttietyyliä annetaan samanaikaisesti antitromboottisten lääkeaineiden kanssa, asianmukaisia laboratoriotutkimuksia voidaan harkita, jos hoidon aikana ilmenee verenvuotoon viittaavia kliinisiä oireita, kuten ruhjevammoja, nenäverenvuotoa, verivirtsaisuutta tai ruoansulatuskanavan verenvuotoa. Potilaita on kehotettava ilmoittamaan välittömästi lääkärille kaikista verenvuodon oireista ja löydöksistä (ks. kohta Haittavaikutukset).
Apuaineet, joiden vaikutus tunnetaan
Maltitoli (E965 ii)
Tämä lääkevalmiste sisältää 30 mg maltitolia per kapseli.
Potilaiden, joilla on harvinainen perinnöllinen fruktoosi-intoleranssi, ei pidä käyttää tätä lääkettä.
Sorbitoli (E420 ii)
Tämä lääkevalmiste sisältää 83 mg sorbitolia per kapseli. Sorbitolia (tai fruktoosia) sisältävien muiden valmisteiden samanaikaisen annon sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava.
Suun kautta otettavien lääkevalmisteiden sorbitoli saattaa vaikuttaa muiden suun kautta otettavien lääkkeiden biologiseen hyötyosuuteen.
Potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI) ei saa antaa tätä lääkevalmistetta.
Soijalesitiini
Tämä lääkevalmiste sisältää soijalesitiiniä. Soijalle tai maapähkinälle allergiset potilaat eivät saa käyttää tätä lääkevalmistetta.
Yhteisvaikutukset
Ikosapenttietyyliä tutkittiin annoksina neljä 998 mg:n kapselia/vrk seuraavien lääkevalmisteiden kanssa, jotka ovat tyypillisiä sytokromi P450 ‑entsyymien substraatteja: omepratsoli, rosiglitatsoni, varfariini ja atorvastatiini. Yhteisvaikutuksia ei havaittu.
Ikosapenttietyylin kanssa samanaikaisesti antitromboottisia lääkeaineita eli trombosyyttien estäjiä, mukaan lukien asetyylisalisyylihappoa, ja/tai veren hyytymistä estäviä lääkeaineita käyttävillä potilailla saattaa olla tavanomaista suurempi verenvuotojen riski, joten heitä pitää seurata säännöllisin väliajoin.
Raskaus ja imetys
Raskaus
Ikosapenttietyylin käytöstä raskaana oleville naisille on vain vähän tietoja. Eläimillä tehdyissä tutkimuksissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi Vazkepa-valmisteen käyttöä on suositeltavaa välttää raskauden aikana, ellei hoidosta saatavan hyödyn katsota olevan riskejä suurempi.
Imetys
Ei tiedetä, erittyykö ikosapenttietyyli ihmisillä äidinmaitoon. Kirjallisuustutkimukset ovat osoittaneet, että aktiivinen metaboliitti eikosapentaeenihappo (EPA) erittyy ihmisillä äidinmaitoon äidin ruokavalioon korreloivina pitoisuuksina. Saatavissa olevat toksikologiset tiedot rotista ovat osoittaneet, että ikosapenttietyyli erittyy maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Vazkepa-hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ikosapenttietyylin käyttöön liittyviä ihmisen hedelmällisyyttä koskevia tietoja ei ole olemassa. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Vazkepa-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin raportoituja ikosapenttietyyliin liittyneitä haittavaikutuksia ovat verenvuodot (11,8 %), raajojen turvotus (7,8 %), eteisvärinä (5,8 %), ummetus (5,4 %), luuston ja lihasten kipu (4,3 %), kihti (4,3 %) ja ihottuma (3,0 %).
Haittavaikutustaulukko
Haittavaikutukset on lueteltu alla ja luokiteltu esiintymistiheyden ja MedDRA-elinjärjestelmäluokan mukaan kaikkien saatavilla olevien kliinisten interventio- ja non-interventiotutkimusten sekä spontaanien ilmoitusten perusteella. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin esiintymistiheysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1. Haittavaikutukset
| MedDRA-elinjärjestelmän luokka | Haittavaikutus | Esiintymistiheys |
|---|---|---|
| Immuunijärjestelmä | Yliherkkyys | Melko harvinainen |
| Nielun turvotus | Tuntematon | |
| Aineenvaihdunta ja ravitsemus | Kihti | Yleinen |
| Hermosto | Makuhäiriöt1 | Melko harvinainen |
| Sydän | Eteisvärinä tai ‑lepatus2 | Yleinen |
| Verisuonisto | Verenvuodot2 | Hyvin yleinen |
| Ruoansulatuselimistö | Ummetus2 | Yleinen |
| Röyhtäily | Yleinen | |
| Iho ja ihonalainen kudos | Ihottuma | Yleinen |
| Luusto, lihakset ja sidekudos | Luuston ja lihasten kipu | Yleinen |
| Yleisoireet ja antopaikassa todettavat haitat | Raajojen turvotus | Yleinen |
1 Makuhäiriöt kuvaavat ”sananmukaista” termiä: kalanmaku
2 Ks. "Valikoitujen haittavaikutusten kuvaus"
Valikoitujen haittavaikutusten kuvaus
Verenvuodot
Verenvuotoja esiintyi lumekontrolloidussa sydän- ja verisuonitapahtumien hoitotuloksia koskeneessa tutkimuksessa 11,8 %:lla ikosapenttietyyliä saaneista tutkittavista verrattuna 9,9 %:iin lumevalmistetta saaneista tutkittavista. Vakavia verenvuototapahtumia raportoitiin yleisemmin ikosapenttietyyliä kuin lumevalmistetta saaneilla potilailla, kun näitä valmisteita annettiin yhdistelmänä samanaikaisen antitromboottisen lääkityksen kanssa (3,4 % vs. 2,6 %). Tutkittavilla, jotka eivät käyttäneet samanaikaisesti antikoagulantteja/antitromboottisia lääkeaineita, esiintyvyys oli kuitenkin sama (0,2 %) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ikosapenttietyylin käytön yhteydessä yleisimmin havaittuja verenvuototapahtumia olivat maha-suolikanavan verenvuodot (3,1 %), ruhjevammat (2,5 %), verivirtsaisuus (1,9 %) ja nenäverenvuoto (1,5 %).
Eteisvärinä/‑lepatus
Eteisvärinää tai eteislepatusta todettiin lumekontrolloidussa sydän- ja verisuonitapahtumien hoitotuloksia koskeneessa tutkimuksessa 5,8 %:lla ikosapenttietyyliä saaneista tutkittavista verrattuna 4,5 %:iin lumevalmistetta saaneista tutkittavista. Sairaalahoitoa 24 tuntia tai pidempään vaatinutta eteisvärinää tai eteislepatusta todettiin 3 %:lla ikosapenttietyyliä saaneista tutkittavista verrattuna 2 %:iin lumevalmistetta saaneista tutkittavista. Eteisvärinää ja eteislepatusta raportoitiin yleisemmin ikosapenttietyyliä saaneilla kuin lumevalmistetta saaneilla tutkittavilla, joilla oli aiemmin ollut eteisvärinää tai eteislepatusta (12,5 % vs. 6.3 %) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ummetus
Ummetusta esiintyi lumekontrolloidussa sydän- ja verisuonitapahtumien hoitotuloksia koskeneessa tutkimuksessa 5,4 %:lla ikosapenttietyyliä saaneista tutkittavista verrattuna 3,6 %:iin lumevalmistetta saaneista tutkittavista. Vakava ummetus oli ikosapenttietyyliä saaneilla tutkittavilla (0,1 %) ja lumevalmistetta saaneilla tutkittavilla (0,2 %) harvinaisempaa. Ummetuksen suhteellista ilmaantuvuutta on tässä tutkimuksessa voinut sekoittaa lumevalmisteen laksatiivinen jäännösvaikutus, joka johtui terapeuttista pienemmästä kevyen mineraaliöljyn annoksesta (4 ml).
Seuraavat haittavaikutukset on tunnistettu ikosapenttietyylin maailmanlaajuisessa käytössä myyntiluvan myöntämisen jälkeen. Koska näitä haittoja on ilmoitettu vapaaehtoisesti potilasjoukossa, jonka kokoa ei tiedetä, yleensä ei ole mahdollista arvioida luotettavasti niiden esiintyvyyttä tai varmistaa syy-yhteyttä lääkkeelle altistumiseen: suurentunut veren triglyseridipitoisuus, nivelsärky, ripuli, epämukavat tuntemukset vatsassa ja raajakipu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ikosapenttietyyliyliannokseen ei ole spesifistä hoitoa. Yliannostustapauksessa potilasta on hoidettava oireenmukaisesti ja aloitettava tarvittaessa tukitoimenpiteet.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Lipidejä muuntavat lääkeaineet, muut lipidejä muuntavat lääkeaineet, ATC-koodi: C10AX06
Vaikutusmekanismi
Ikosapenttietyyli on omega-3-rasvahapon, eikosapentaeenihapon (EPA), stabiili etyyliesteri. Sydän- ja verisuonitapahtumien vähenemiseen liittyviä ikosapenttietyylin vaikutusmekanismeja ei tunneta täysin. Mekanismeihin todennäköisesti liittyy monia tekijöitä, kuten parantunut lipoproteiiniprofiili ja siihen liittyvä runsaasti triglyseridiä sisältävien lipoproteiinien väheneminen, tulehdusta vähentävät vaikutukset ja antioksidanttivaikutus, vähentynyt makrofagien kertyminen, parantunut endoteelin toiminta, lisääntynyt sidekudoskaton paksuus/stabiilius ja trombosyyttien kokkaroitumista estävät vaikutukset. Jokainen näistä mekanismeista voi vaikuttaa hyödyllisesti ateroskleroottisen plakin kehittymiseen, etenemiseen ja stabiloitumiseen sekä plakin repeytymisen seurauksiin. Prekliiniset ja kliiniset tutkimukset tukevat EPA:n tällaisia hyötyjä. EPA:n systeemiset ja paikalliset tulehdusta vähentävät vaikutukset saattavat johtua tulehdusta edistävän arakidonihapon syrjäytymisestä, mikä ohjaa kataboliaa eikosanoideista (kaksi kaksoissidosta sisältävät prostaglandiinit ja tromboksaanit sekä neljä kaksoissidosta sisältävät leukotrieenit) ei-tulehduksellisiin tai tulehdusta hillitseviin välittäjäaineisiin. Yksittäisten löydösten suoraa kliinistä merkitystä ei kuitenkaan tunneta.
Farmakodynaamiset vaikutukset
Ikosapenttietyyli parantaa lipoproteiiniprofiilia siten, että se estää kolesterolia, rasvahappoja ja triglyseridejä syntetisoivia entsyymejä, lisää rasvahappojen beetaoksidaatiota ja vähentää mikrosomaalista kuljettajaproteiinia (MTP) ja siten vähentää maksassa triglyseridin ja VLDL-kolesterolin synteesiä ja vapautumista. Ikosapenttietyyli myös lisää lipoproteiinilipaasin ilmentymistä, mikä lisää triglyseridin poistumista verenkierrossa olevista VLDL-kolesteroli- ja kylomikronipartikkeleista. Potilailla, joiden triglyseridipitoisuus on koholla, ikosapenttietyyli pienentää triglyseridien, VLDL-kolesterolin, jäännöshiukkasten (remnant lipoprotein) kolesterolin ja tulehdusmerkkiaineiden, kuten C-reaktiivisen proteiinin, pitoisuutta. Triglyseridien vähenemisellä näyttää kuitenkin olevan vain vähäinen osuus ikosapenttietyylin sydän- ja verisuonitapahtumien riskiä vähentävässä vaikutuksessa.
Kliininen teho ja turvallisuus
REDUCE-IT oli monikansallinen, kaksoissokkoutettu, satunnaistettu, lumekontrolloitu, tapahtumaohjattu tutkimus, johon otettiin mukaan 8 179 (4 089 ikosapenttietyylihoitoon, 4 090 lumehoitoon) statiinihoitoa saanutta aikuista potilasta, joiden LDL-kolesterolipitoisuus oli > 1,03 mmol/l (40 mg/dl), mutta ≤ 2,59 mmol/l (100 mg/dl), ja joiden triglyseridipitoisuus oli kohtalaisesti koholla (≥ 1,53 mmol/l, mutta < 5,64 mmol/l [≥ 135 mg/dl, mutta < 500 mg/dl], mikä mitattiin potilaiden seulonnassa eli ennen tutkimukseen mukaan tuloa tehdyllä potilaan soveltuvuutta tutkimukseen selvittäneellä käynnillä) ja joko varmistettu sydän- ja verisuonitauti (70,7 %) tai diabetes ja muita sydän- ja verisuonitautien riskitekijöitä (29,3 %). Potilaan varmistetuksi sydän- ja verisuonitaudiksi määriteltiin vähintään 45 vuoden ikä ja aiempi dokumentoitu sepelvaltimotauti, aivoverisuoni- tai kaulavaltimotauti tai perifeeristen valtimoiden tauti. Muiksi riskiryhmien potilaiksi määriteltiin vähintään 50 vuoden ikäiset ja lääkehoitoa vaativaa diabetesta sairastavat, joilla on vähintään yksi muu riskitekijä (eli korkea verenpaine tai verenpainelääkkeen käyttö, ikä vähintään 55 vuotta (miehet) tai vähintään 65 vuotta (naiset), pieni HDL-kolesterolipitoisuus, tupakointi, kohonnut erittäin herkän C-reaktiivisen proteiinin pitoisuus, munuaisten vajaatoiminta, mikro- tai makroalbuminuria, retinopatia tai pienentynyt nilkka-olkavarsipainesuhde). Potilaat ohjattiin satunnaisesti suhteessa 1:1 joko ikosapenttietyyli- tai lumehoitoon (neljä kapselia päivässä). Seuranta-ajan mediaani oli 4,9 vuotta. Potilaista kaikkiaan 99,8 %:lla elintoimintoja seurattiin tutkimuksen loppuun tai potilaan kuolemaan saakka.
Lähtötilanteessa potilaiden ominaisuudet olivat tasapainossa ryhmien kesken. Iän mediaani lähtötilanteessa oli 64 vuotta (vaihteluväli: 44–92 vuotta), 46 % oli vähintään 65-vuotiaita ja 28,8 % oli naisia. Tutkimusjoukosta 90,2 % oli valkoihoisia, 5,5 % oli aasialaisia, 4,2 % oli tunnistettu etniseltä taustaltaan latinalaisamerikkalaisiksi ja 1,9 % oli mustaihoisia. Potilaiden aiempia sydän- ja verisuonitautien diagnooseja olivat 46,7 %:lla aiempi sydäninfarkti, 9,2 %:lla oireinen perifeerinen valtimotauti ja 6,1 %:lla aiemmin havaitsematon aivohalvaus tai TIA-kohtaus. Valikoituja muita riskitekijöitä lähtötilanteessa olivat korkea verenpaine (86,6 %), diabetes mellitus (0,7 %:lla tyyppi 1; 57,8 %:lla tyyppi 2), eGFR < 60 ml/min/1,73 m2 (22,2 %), kongestiivinen sydämen vajaatoiminta (17,7 %) ja päivittäinen tupakointi (15,2 %). Useimmat potilaat käyttivät lähtötilanteessa kohtalaisen tehokasta (63 %) tai tehokasta (31 %) statiinihoitoa. Suurin osa potilaista käytti lähtötilanteessa vähintään yhtä muuta sydän- ja verisuonitautien hoitoon käytettävää lääkevalmistetta, mukaan lukien trombosyyttien estäjiä ja/tai antitromboottista lääkevalmistetta (85,5 %), beetasalpaajia (70,7 %), verenpainelääkkeitä (95,2%), angiotensiinikonvertaasin estäjiä (ACE:n estäjiä) (51,9 %) tai angiotensiinireseptorin salpaajia (26,9 %); 77,5 % käytti ACE:n estäjää tai angiotensiinireseptorin salpaajaa. Tutkimussuunnitelmassa suljettiin pois PCSK9:n estäjiä käyttävät potilaat. Lipidipitoisuutta pienentävää lääkitystä stabiilina peruslääkityksenä käyttävillä LDL-kolesterolin mediaani (Q1, Q3) oli lähtötilanteessa 1,9 [1,6; 2,3] mmol/l (75 [62; 89] mg/dl); keskiarvo (keskihajonta) oli 2 (0,5) mmol/l (76,2 [20,3] mg/dl). Lipidipitoisuutta pienentävää lääkitystä stabiilina peruslääkityksenä käyttävillä triglyseridien paastoarvon mediaani (Q1, Q3) oli 2,4 [2; 3,1] mmol/l (216 [176; 272,5] mg/dl); keskiarvo (keskihajonta) oli 2,6 (0,9) mmol/l (233,2 [80,1] mg/dl).
Ikosapenttietyyli vähensi merkittävästi ensisijaisten yhdistettyjen päätetapahtumien riskiä (aika ensimmäiseen sydän- ja verisuoniperäiseen kuolemaan, sydäninfarkti, aivohalvaukseen, sepelvaltimoiden revaskularisaatioon tai sairaalahoitoon epästabiilin angina pectoriksen vuoksi; p < 0,0001) ja keskeisten toissijaisten yhdistettyjen päätetapahtumien riskiä (aika ensimmäiseen sydän- ja verisuoniperäiseen kuolemaan, sydäninfarktiin tai aivohalvaukseen; p < 0,0001). Tehon ensisijaisten ja toissijaisten päätetapahtumien tulokset esitetään taulukossa 2. Keskeisen toissijaisen yhdistettyjen päätetapahtumien kumulatiivisen ilmaantuvuuden Kaplan–Meierin estimaatit esitetään aikajanalla kuvassa 1.
Taulukko 2. Ikosapenttietyylin vaikutus ensimmäisen sydän- ja verisuonitapahtuman ilmaantumiseen kuluneeseen aikaan REDUCE-IT-tutkimuksessa potilailla, joiden triglyseridipitoisuus on koholla ja joilla on sydän- ja verisuonitauti tai diabetes ja muita riskitekijöitä
| Ikosapenttietyyli | Lumevalmiste | Ikosapenttietyyli vs lumevalmiste | |
| N = 4 089 n (%) | N = 4 090 n (%) | Riskisuhde (95 %:n luottamusväli) | |
| Ensisijainen yhdistetty päätetapahtuma | |||
| Sydän- ja verisuoniperäinen kuolema, sydäninfarkti, aivohalvaus, sepelvaltimon revaskularisaatio, sairaalahoito epästabiilin angina pectoriksen vuoksi (viisikohtainen MACE*-tapahtuma) | 705 (17,2) | 901 (22) | 0,75 (0,68; 0,83) |
| Keskeinen toissijainen yhdistetty päätetapahtuma | |||
| Sydän- ja verisuoniperäinen kuolema, sydäninfarkti, aivohalvaus (kolmekohtainen MACE*-tapahtuma) | 459 (11,2) | 606 (14,8) | 0,74 (0,65; 0,83) |
| Muut toissijaiset päätetapahtumat | |||
| Sydän- ja verisuoniperäinen kuolema1 | 174 (4,3) | 213 (5.2) | 0,80 (0,66; 0,98) |
| Mistä tahansa syystä aiheutunut kuolema2 | 274 (6,7) | 310 (7,6) | 0,87 (0,74; 1,02) |
| Kuolemaan johtanut tai johtamaton sydäninfarkti | 250 (6,1) | 355 (8,7) | 0,69 (0,58; 0,81) |
| Kuolemaan johtanut tai johtamaton aivohalvaus | 98 (2,4) | 134 (3,3) | 0,72 (0,55; 0,93) |
| Välitön tai kiireellinen sepelvaltimon revaskularisaatio | 216 (5,3) | 321 (7,8) | 0,65 (0,55; 0.78) |
| Sepelvaltimon revaskularisaatio3 | 376 (9,2) | 544 (13,3) | 0,66 (0,58; 0,76) |
| Sairaalahoito epästabiilin angina pectoriksen vuoksi4 | 108 (2,6) | 157 (3,8) | 0,68 (0,53; 0,87) |
1 Sydän- ja verisuoniperäinen kuolema käsittää todetut sydän- ja verisuoniperäiset kuolemat sekä kuolemat, joiden syytä ei selvitetty.
2 Mistä tahansa syystä aiheutunut kuolema tai kokonaiskuolleisuus ei ole osa ensisijaista yhdistettyä päätetapahtumaa eikä keskeistä toissijaista yhdistettyä päätetapahtumaa.
3 Ennalta määritelty yhdistetty toissijainen päätetapahtuma käsittää välittömän tai kiireellisen revaskularisaation (p < 0,0001); sepelvaltimon revaskularisaatiot sisältyvät kaikkiin revaskularisaatioihin ja määriteltiin ennalta kolmassijaiseksi päätetapahtumaksi.
4 Määritelty invasiivisella/ei-invasiivisella tutkimuksella sydänlihaksen iskemian aiheuttamaksi ja kiireellistä sairaalahoitoa vaativaksi.
* MACE = vakava sydän- ja verisuonihaittatapahtuma (major adverse cardiovascular event)
Kuva 1. REDUCE-IT-tutkimuksen keskeisen toissijaisen yhdistetyn päätetapahtuman ilmaantuvuuden Kaplan–Meierin estimaatit
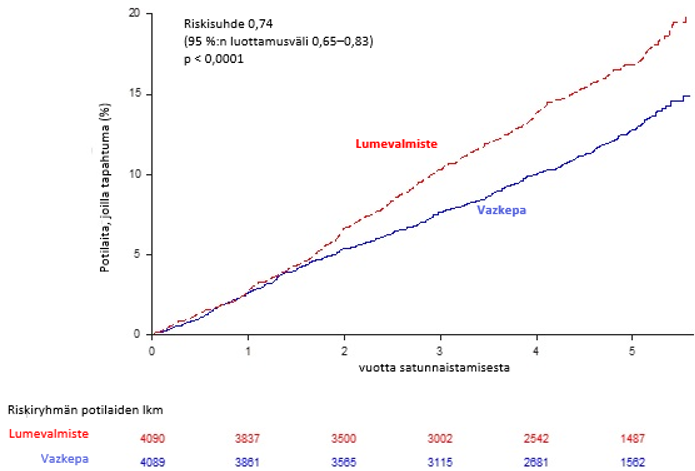
Keskeinen toissijainen yhdistetty päätetapahtuma käsitti sydän- ja verisuoniperäisen kuoleman, sydäninfarktin tai aivohalvauksen (kolmekohtainen MACE-tapahtuma)
Triglyseridi- ja LDL-kolesteroliarvojen mediaani oli lähtötilanteessa samankaltainen ikosapenttietyyliryhmässä ja lumeryhmässä. Triglyseridipitoisuuden muutoksen mediaani lähtötilanteesta 1 vuoteen saakka oli ikosapenttietyyliryhmässä -0,4 mmol/l (-39 mg/dl, -18 %) ja lumeryhmässä 0,1 mmol/l (5 mg/dl, 2 %). LDL-kolesterolipitoisuuden muutoksen mediaani lähtötilanteesta 1 vuoteen saakka oli ikosapenttietyyliryhmässä 0,1 mmol/l (2 mg/dl, 3 %) ja lumeryhmässä 0,2 mmol/l (7 mg/dl, 10 %). Ikosapenttietyylihoidon sydän- ja verisuonitautien hoitotulosta koskevan tehon ennalta määritellyt analyysit REDUCE-IT-tutkimuksessa osoittivat, että lähtötilanteen tai tutkimuksen aikana saavutettujen triglyseridi- tai LDL-kolesterolipitoisuuksien perusteella triglyseridi- tai LDL-kolesterolivasteen ja sydän- ja verisuonitautia koskevan tehon välillä ei ollut korrelaatiota tai korrelaatio oli vähäinen. Ks. lisätietoja vaikutusmekanismista kohdasta Farmakodynamiikka.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset ikosapenttietyylin käytöstä hypertriglyseridemian hoidossa ja sydän- ja verisuonitapahtumien riskin vähentämisessä kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Suun kautta otettu ikosapenttietyyli de-esteröityy imeytymisprosessin aikana, ja aktiivinen metaboliitti EPA imeytyy ohutsuolesta ja siirtyy systeemiseen verenkiertoon pääasiassa imusuoniston rintatiehyen kautta. EPA:n huippupitoisuus plasmassa saavutettiin noin 5 tuntia suun kautta otettujen ikosapenttietyyliannosten jälkeen.
Ikosapenttietyyliä annettiin kaikissa kliinisissä tutkimuksissa aterian yhteydessä tai jälkeen; ruokailun vaikutusta ei tutkittu (ks. kohta Annostus ja antotapa).
Jakautuminen
EPA:n keskimääräinen jakautumistilavuus vakaassa tilassa on noin 88 litraa. Valtaosa plasmassa kiertävästä EPA:sta inkorporoituu fosfolipideihin, triglyserideihin ja kolesteryyliestereihin, ja < 1 % on esteröitymättömänä rasvahappona. Yli 99 % esteröitymättömästä EPA:sta sitoutuu plasman proteiineihin.
Biotransformaatio ja eliminaatio
EPA metaboloituu pääasiassa maksassa beetaoksidaation kautta samalla tavoin kuin ruokavalion rasvahapot. Beetaoksidaatio pilkkoo EPA:n pitkät hiiliketjut asetyylikoentsyymi A:ksi, joka muuntuu Krebsin kierrossa energiaksi. Sytokromi P450 ‑välitteinen metabolia on EPA:n eliminaation vähäisempi reitti. EPA:n kokonaispuhdistuma plasmasta on vakaassa tilassa 684 ml/h. EPA:n eliminaation puoliintumisaika (t½) plasmassa on noin 89 tuntia. Ikosapenttietyyli ei erity munuaisten kautta.
Farmakokineettiset/farmakodynaamiset suhteet
Triglyseridipitoisuus / väheneminen hypertriglyseridemiassa
Kahdessa faasin III tutkimuksessa havaittiin, että EPA:n pitoisuuden plasmassa tai veren punasoluissa ja triglyseridipitoisuuden pienenemisen välillä on lineaarinen suhde.
Sydän- ja verisuonitapahtumien riskin väheneminen
Ensisijaisen (viisikohtaisen) ja keskeisen toissijaisen (kolmekohtaisen) MACE-päätetapahtumien analyysit viittaavat siihen, että hoidonaikaiset lipoproteiinipitoisuuden muutokset vaikuttivat vähän sydän- ja verisuonitapahtumien riskin vähenemiseen, kun taas hoidonaikaiset vakaan tilan EPA-pitoisuudet seerumissa vastasivat valtaosasta REDUCE-IT-tutkimuksessa havaitusta suhteellisen riskin pienenemisestä. Seerumin EPA-pitoisuus oli lähtötilanteessa 26 mikrog/ml; vertailussa potilaisiin, joiden hoidonaikainen vakaan tilan EPA-pitoisuus seerumissa oli alle 100 mikrog/ml, niiden potilaiden sydän- ja verisuonitapahtumien riski, joiden EPA-pitoisuus hoidon aikana oli ≥ 175 mikrog/ml, oli > 50 % pienempi.
Munuaisten tai maksan vajaatoiminta
Ikosapenttietyylin farmakokinetiikkaa ei ole tutkittu munuaisten tai maksan vajaatoimintaa sairastavilla potilailla. Ikosapenttietyylillä tehdyssä hyvin kontrolloidussa sydän- ja verisuonitapahtumien hoitotuloksia koskeneessa tutkimuksessa maksan tai munuaisten vajaatoimintaa sairastavien potilaiden annosta ei tarvinnut rutiiniluonteisesti muuttaa.
Muut erityisryhmät
Iäkkäät
Ikosapenttietyylin farmakokinetiikkaa ei ole tutkittu iäkkäillä potilailla (≥ 65-vuotiailla). Ikosapenttietyylillä tehdyissä hyvin kontrolloiduissa kliinisissä tutkimuksissa iäkkäiden potilaiden annosta ei tarvinnut rutiiniluonteisesti muuttaa.
Pediatriset potilaat
Ikosapenttietyylin farmakokinetiikkaa ei ole tutkittu pediatrisilla tutkittavilla.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Lisääntymistä ja kehitystä koskeneissa tutkimuksissa käytetyistä suurimmista annoksista ei havaittu aiheutuneen haittavaikutuksia rotille tai kaniineille, kun annos oli noin 6–8-kertainen ihmisen vastaavaan annokseen verrattuna kehon pinta-alan perusteella. Rotan alkioilla ja sikiöillä tehdyssä tutkimuksessa ei havaittu haittavaikutuksia, kun altistukset olivat 6,9-kertaiset kliiniseen altistukseen verrattuna (AUC-arvon perusteella).
Eläinkokeet osoittavat, että ikosapenttietyyli läpäisee istukan ja että sitä on sikiön plasmassa.
Eläinkokeet osoittavat, että ikosapenttietyyli erittyy maitoon.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
All-rac-α-tokoferoli
Kapselin kuori
Liivate
Glyseroli
Nestemäinen maltitoli (E 965 ii)
Nestemäinen sorbitoli (kiteytymätön) (E 420 ii)
Puhdistettu vesi
Soijalesitiini
Painoväri
Titaanidioksidi
Propyleeniglykoli
Hypromelloosi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Säilytä alle 30 °C.
Purkki
Pidä purkki tiiviisti suljettuna. Herkkä kosteudelle.
Läpipainopakkaus
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VAZKEPA kapseli, pehmeä
998 mg (L:ei) 120 kpl (211,85 €), 360 kpl (3x120) (591,71 €)
PF-selosteen tieto
Purkki
Suurtiheyksinen polyeteenipurkki (HDPE), jossa polypropeeninen induktiosinetöity turvasuljin ja joka sisältää 120 pehmeää kapselia.
Pakkauskoko: pahvikotelo sisältää yhden purkin tai kolme purkkia.
Läpipainopakkaus
Yksittäispakattu PVC/PCTFE/Al-läpipainopakkaus, jossa 4 x 2 pehmeää kapselia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Pitkänomainen pehmeä kapseli, jonka koko on 25 x 10 mm, jossa on valkoisella painovärillä merkintä ”IPE” ja jossa on vaaleankeltaisen tai meripihkanruskean kuoren sisällä väritöntä tai vaaleankeltaista nestettä.
Käyttö- ja käsittelyohjeet
Miten purkki avataan
Paina kierrekorkki alas ja käännä sitä vastapäivään.
Hävittäminen
Ei erityisvaatimuksia hävittämisen suhteen.
Korvattavuus
VAZKEPA kapseli, pehmeä
998 mg 120 kpl, 360 kpl
- Alempi erityiskorvaus (65 %). Ikosapenttietyyli: Sydän- ja verisuonitapahtumien riskin vähentämiseen statiinihoitoa saaville aikuisille erityisin edellytyksin (258).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Ikosapenttietyyli: Sydän- ja verisuonitapahtumien riskin vähentämiseen statiinihoitoa saaville aikuisille erityisin edellytyksin (3077).
ATC-koodi
C10AX06
Valmisteyhteenvedon muuttamispäivämäärä
15.01.2026
Yhteystiedot
Berzelius väg 8
171 65 Solna
Sverige
+46 8 545 802 30
www.recordati.com
