NERLYNX tabletti, kalvopäällysteinen 40 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Tarkoitettu tukemaan Nerlynx-hoitoa.
Terveydenhuollon ammattilainen
Ripulin hoito
Yleinen
Tietoa ripulin hoidosta Nerlynx-hoidon aikana.
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää neratinibimaleaattia määrän, joka vastaa 40 mg:aa neratinibia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Nerlynx on tarkoitettu jatkettuun liitännäishoitoon varhaisvaiheen hormonireseptoripositiivista rintasyöpää sairastaville aikuispotilaille, joiden kasvaimet yli-ilmentävät HER2:ta tai joiden kasvaimissa on HER2-geenin monistuma, kun trastutsumabiin perustuvan liitännäishoidon loppuun saattamisesta on alle vuosi.
Ehto
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Annostus ja antotapa
Nerlynx-hoito on aloitettava ja toteutettavasyöpälääkkeiden käyttöön perehtyneen lääkärin valvonnassa.
Annostus
Nerlynxin suositeltu annos on 240 mg (kuusi 40 mg:n tablettia) suun kautta kerran vuorokaudessa. Hoitoa jatketaan vuoden ajan. Nerlynx otetaan ruoan kanssa, mieluiten aamuisin. Potilaan on aloitettava hoito vuoden kuluessa trastutsumabihoidon päättymisestä.
Annoksen muuttaminen haittavaikutusten vuoksi
Nerlynx-annoksen muuttamista suositellaan potilaskohtaisen turvallisuuden ja sietokyvyn mukaan. Joidenkin haittavaikutusten hoito saattaa edellyttää annostelun keskeyttämistä ja/tai annoksen pienentämistä, kuten taulukoissa 1, 2, 3 ja 4 on esitetty.
Nerlynx-hoito on lopetettava seuraavissa tapauksissa:
- hoitoon liittyvä toksisuus ei lievene vaikeusasteelle 0–1
- toksisuus viivästyttää hoitoa yli kolme viikkoa tai
- potilas ei siedä 120 mg:n päiväannosta.
Myös muut kliiniset tilanteet (esim. sietämättömät toksisuudet ja pitkään jatkuvat vaikeusasteen 2 haittavaikutukset) saattavat johtaa annoksen pienentämiseen kliinisesti tarkoituksenmukaisella tavalla.
Taulukko 1: Nerlynx-annoksen muuttaminen haittavaikutusten vuoksi
Annostaso | Nerlynx-annos |
Suositeltu aloitusannos | 240 mg/vrk |
Ensimmäinen annoksen pienennys | 200 mg/vrk |
Toinen annoksen pienennys | 160 mg/vrk |
Kolmas annoksen pienennys | 120 mg/vrk |
Taulukko 2: Nerlynx-annoksen muuttaminen ja yleisten toksisuuksien hoito*
Toksisuuden vaikeusaste† | Toimet |
Vaikeusaste 3 | Nerlynx-hoito on keskeytettävä, kunnes vaikeusaste on ≤ 1 tai lähtötasolla kolmen viikon kuluessa hoidon lopettamisesta. Sitten Nerlynx-hoitoa jatketaan seuraavaksi alemmalla annostasolla. Jos vaikeusasteen 3 toksisuus ei lievene kolmen viikon kuluessa, Nerlynx-hoito on lopetettava pysyvästi. |
Vaikeusaste 4 | Nerlynx-hoito on lopetettava pysyvästi. |
* Ripulin ja maksatoksisuuden hoito-ohjeet ovat taulukoissa 3 ja 4
† CTCAE-luokituksen versio 4.0
Annoksen muuttaminen ripulin vuoksi
Ripulin hoito edellyttää ripulilääkkeiden oikeaa käyttöä, ruokavalion muutosta sekä Nerlynx-annoksen asianmukaista muuttamista. Ohjeet Nerlynx-annoksen muuttamisesta ripulin vuoksi ovat taulukossa 3.
Taulukko 3: Annoksen muuttaminen ripulin vuoksi
Ripulin vaikeusaste* | Toimet |
|
|
|
|
|
|
|
|
* CTCAE-luokituksen versio 4.0
† Komplisoituneita piirteitä ovat kuivuminen, kuume, hypotensio, munuaisten vajaatoiminta sekä asteen 3 tai 4 neutropenia
‡ Parhaasta mahdollisesta lääkehoidosta huolimatta
Annoksen muuttaminen maksatotoksisuuden vuoksi
Ohjeet Nerlynx-annoksen muuttamisesta maksatoksisuuden vuoksi ovat taulukossa 4. (Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 4: Annoksen muuttaminen maksatoksisuuden vuoksi
Maksatoksisuuden vaikeusaste* | Toimet |
|
|
|
|
ULN = normaaliarvojen yläraja, ALAT = alaniiniaminotransferaasi
* CTCAE-luokituksen versio 4.0
Annoksen jääminen väliin
Väliin jääneitä annoksia ei saa korvata. Hoitoa jatketaan seuraavalla päiväannoksella aikataulun mukaisesti (ks. kohta Yliannostus).
Greippi ja granaattiomena
Neratinibin samanaikaista käyttöä greippien tai granaattiomenoiden/greippimehun tai granaattiomenamehun kanssa ei suositella (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
CYP3A4-/Pgp-estäjät
Jos estäjän käyttö on välttämätöntä, Nerlynx-annos pienennetään tasolle:
- 40 mg (yksi 40 mg:n tabletti) kerran päivässä vahvan CYP3A4-/Pgp-estäjän käytön yhteydessä.
- 40 mg (yksi tabletti) kerran päivässä keskivahvan CYP3A4/Pgp-estäjän käytön yhteydessä. Jos annos on hyvin siedetty, nostetaan se tasolle 80 mg ainakin yhden viikon ajaksi, sitten tasolle 120 mg ainakin yhden viikon ajaksi ja tasolle 160 mg enimmäisvuorokausiannoksena. Potilasta on tarkkailtava huolellisesti erityisesti ruuansulatuskanavaan kohdistuvien vaikutusten, mukaan lukien ripuli ja maksatoksisuus, varalta.
Kun vahvan tai keskivahvan CYP3A4-/Pgp-estäjän käyttö lopetetaan, jatketaan edellisellä Nerlynx-annoksella 240 mg (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakokinetiikka).
H2-reseptorin antagonistit ja haponestolääkkeet
Jos H2-reseptorin antagonisteja käytetään, Nerlynx tulee ottaa vähintään 2 tuntia ennen tai 10 tuntia H2-reseptorin antagonistin ottamisen jälkeen. Nerlynx-annoksen ja haponestolääkkeen ottamisen välillä on oltava vähintään 3 tuntia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakokinetiikka)
Erityisryhmät
Munuaisten vajaatoimintaa sairastavat potilaat
Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä tai keskivaikea munuaisten vajaatoiminta. Nerlynxiä ei ole tutkittu potilailla, joilla on vaikea munuaisten vajaatoiminta, mukaan lukien dialyysihoitoa saavat potilaat. Vaikeaa munuaisten vajaatoimintaa sairastavien tai dialyysihoitoa saavien potilaiden hoitoa ei suositella (ks. kohta Farmakokinetiikka).
Maksan vajaatoimintaa sairastavat potilaat
Annosta ei ole tarpeen muuttaa potilailla, joilla on Child-Pughin luokan A tai B (lievä tai kohtalainen) maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Iäkkäät potilaat
Annosta ei ole tarpeen muuttaa. 85-vuotiaista ja sitä vanhemmista potilaista ei ole tietoja.
Pediatriset potilaat
Nerlynxille ei ole mitään aiheellista käyttötarkoitusta pediatrisilla potilailla rintasyövän hoidossa.
Antotapa
Nerlynx otetaan suun kautta. Tabletit on nielaistava kokonaisina mieluiten veden kera. Tabletteja ei saa murskata tai liuottaa. Tabletit otetaan ruoan kanssa, mieluiten aamuisin (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Käyttö yhdessä seuraavien vahvojen sytokromin P450 CYP3A4:n tai P-glykoproteiinin (Pgp) isoformin induktorien kanssa, kuten (ks. kohdat Yhteisvaikutukset ja Farmakokinetiikka):
- karbamatsepiini ja fenytoiini (epilepsialääkkeitä)
- mäkikuisma (Hypericum perforatum) (kasvirohdosvalmiste)
- rifampisiini (mykobakteerilääke).
Vaikea maksan vajaatoiminta (Child-Pughin luokka C) (ks. kohta Farmakokinetiikka).
Varoitukset ja käyttöön liittyvät varotoimet
Ripuli
Ripulia on ilmoitettu Nerlynx-hoidon aikana (ks. kohdat Annostus ja antotapa ja Haittavaikutukset). Ripuli saattaa olla vaikeaa, ja siihen saattaa liittyä kuivumista.
Ripuli ilmenee yleensä ensimmäisen tai toisen Nerlynx-hoitoviikon aikana, ja se saattaa uusiutua.
Potilaita on neuvottava aloittamaan ripulia ehkäisevä lääkitys seuraavan Nerlynx-annoksen yhteydessä ja käyttämään ripulilääkettä säännöllisesti Nerlynx-hoidon ensimmäisten 1–2 kuukauden aikana. Annosta säädetään, kunnes ulostamiskertojen määrä on 1–2 päivässä.
Iäkkäät potilaat
Iäkkäillä (≥ 65-vuotialla) potilailla on suurentunut munuaisten vajaatoiminnan ja kuivumisen riski. Näitä saattaa ilmetä ripulin komplikaatioina, ja iäkkäitä potilaita on tarkkailtava huolellisesti.
Potilaat, joilla on merkittävä krooninen maha-suolikanavan sairaus
Avaintutkimukseen ei osallistunut merkittävää kroonista maha-suolikanavan sairautta sairastavia potilaita, joiden pääoireena oli ripuli, joten näitä potilaita on tarkkailtava huolellisesti.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla on suurentunut kuivumiseen liittyvien komplikaatioiden riski ripulin yhteydessä, joten näitä potilaita on tarkkailtava huolellisesti (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Maksan toiminta
Maksatoksisuutta on ilmoitettu Nerlynx-hoitoa saaneilla potilailla. Maksan toimintakokeita, kuten alaniiniaminotransferaasia (ALAT), aspartaattiaminotransferaasia (ASAT) ja kokonaisbilirubiinia, on seurattava viikolla 1 ja sen jälkeen kerran kuussa ensimmäisen kolmen kuukauden ajan ja sitten kuuden viikon välein niin kauan kuin hoito jatkuu tai se on kliinisesti aiheellista (ks. kohta Annostus ja antotapa).
Maksan toimintakokeiden mahdolliset muutokset on arvioitava potilailla, joilla on laskimonsisäistä nestehoitoa edellyttävä vaikeusasteen ≥ 3 ripuli tai mitä tahansa maksatoksisuuden oireita, kuten pahenevaa väsymystä, pahoinvointia, oksentelua, keltaisuutta, vatsan oikeassa yläneljänneksessä tuntuvaa kipua tai arkuutta, kuumetta, ihottumaa tai eosinofiliaa. Myös bilirubiinifraktiot ja protrombiiniaika on tutkittava osana maksatoksisuuden arviointia.
Vasemman kammion toiminta
HER2-reseptorin estoon on liitetty vasemman kammion toimintahäiriöitä. Nerlynxiä ei ole tutkittu potilailla, joilla vasemman kammion ejektiofraktio (LVEF) on alle normaalirajan tai joilla on ollut aiemmin merkittäviä sydäntapahtumia. Jos potilaalla on tunnettuja sydäntautien riskitekijöitä, tee sydänvalvonta, LVEF:n arviointi mukaan lukien, jos se on kliinisesti tarpeen.
Protonipumpun estäjät, H2-reseptorin antagonistit ja haponestolääkkeet
Maha-suolikanavan pH-arvoa nostavat lääkehoidot saattavat heikentää neratinibin imeytymistä vähentäen siten systeemistä altistusta sille. Protonipumpun estäjien samanaikaista käyttöä ei suositella (ks. kohdat Yhteisvaikutukset ja Farmakokinetiikka).
H2-reseptorin antagonistien ja haponestolääkkeiden yhteydessä tiettyjä lääkkeen ottamiselle asetettuja ehtoja tulee noudattaa (ks. kohdat Annostus ja antotapa, Yhteisvaikutukset ja Farmakokinetiikka).
Raskaus
Neratinibi voi vaurioittaa sikiötä, jos sitä annetaan raskaana oleville naisille (ks. kohta Raskaus ja imetys).
Iho ja ihonalainen kudos
Nerlynxin käyttöön liittyy ihon ja ihonalaisen kudoksen sairauksia. Potilaita, joilla on oireilevia ihon ja ihonalaisen kudoksen sairauksia, on tarkkailtava huolellisesti (ks. kohta Haittavaikutukset).
Samanaikainen hoito CYP3A4- ja Pgp-estäjillä
Samanaikaista hoitoa vahvoilla tai keskivahvoilla CYP3A4- ja Pgp-estäjillä ei suositella, sillä ne suurentavat neratinibille altistumisen riskiä. Jos estäjän käyttö on välttämätöntä, Nerlynx-annosta tulee muuttaa (ks. kohdat Annostus ja antotapa, Yhteisvaikutukset ja Farmakokinetiikka).
Greippi ja granaattiomena
Greippimehu/granaattiomenamehu saattaa estää CYP3A4:n ja/tai Pgp:n toimintaa, eikä sitä saa juoda Nerlynx-hoidon aikana (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset).
Samanaikainen hoito keskivahvoilla CYP3A4- ja Pgp-induktoreilla
Samanaikaista hoitoa keskivahvoilla CYP3A4- ja Pgp-induktoreilla ei suositella, sillä se saattaa johtaa neratinibin tehon heikentymiseen (ks. kohdat Yhteisvaikutukset ja Farmakokinetiikka).
Samanaikainen hoito Pgp-substraateilla
Potilaita, joita hoidetaan samanaikaisesti lääkeaineilla, joilla on kapea terapeuttinen ikkuna ja joiden imeytymiseen liittyy Pgp-kuljettajaproteiineja maha-suolikanavassa, tulee tarkkailla huolellisesti (ks. kohdat Yhteisvaikutukset ja Farmakokinetiikka).
Yhteisvaikutukset
Muiden aineiden vaikutukset neratinibiin
Neratinibi metaboloituu pääasiassa CYP3A4:n kautta ja on Pgp-substraatti.
CYP3A4-/Pgp-induktorit
Kliininen tutkimus on osoittanut, että vahvojen CYP3A4-/Pgp-induktoreiden samanaikainen käyttö vähensi merkittävästi neratinibille altistumista. Sen vuoksi neratinibin samanaikainen käyttö vahvojen CYP3A4-/Pgp-induktoreiden kanssa on vasta-aiheista (esimerkkejä vahvoista induktoreista: fenytoiini, karbamatsepiini, rifampisiini tai mäkikuismaa sisältävät kasvirohdosvalmisteet). Neratinibin samanaikaista käyttöä keskivahvojen CYP3A4-/Pgp-induktoreiden kanssa ei suositella, sillä se saattaa myös johtaa tehon heikentymiseen (esimerkkejä keskivahvoista induktoreista: bosentaani, efavirentsiini, etraviriini, fenobarbitaali, primidoni, deksametasoni) (ks. kohdat Vasta-aiheet ja Farmakokinetiikka).
CYP3A4-/Pgp-estäjät
Kliininen tutkimus ja malleihin perustuvat ennustukset ovat osoittaneet, että vahvojen tai keskivahvojen CYP3A4-/Pgp-estäjien samanaikainen käyttö lisäsi merkittävästi systeemistä altistusta neratinibille. Sen vuoksi neratinibin samanaikaista käyttöä vahvojen tai keskivahvojen CYP3A4-/Pgp-estäjien kanssa ei suositella (esimerkkejä vahvoista estäjistä: atatsanaviiri, indinaviiri, nefatsodoni, nelfinaviiri, ritonaviiri, sakinaviiri, lopinaviiri, ketokonatsoli, itrakonatsoli, klaritromysiini, troleandomysiini, vorikonatsoli ja kobisistaatti; esimerkkejä keskivahvoista estäjistä: siprofloksasiini, syklosporiini, diltiatseemi, flukonatsoli, erytromysiini, fluvoksamiini ja verapamiili). Jos estäjän käyttö on välttämätöntä, Nerlynx-annosta tulee muuttaa (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Greippien ja granaattiomenoiden tai greippimehun/granaattiomenamehun nauttimista on vältettävä, sillä ne saattavat nostaa neratinibin pitoisuutta plasmassa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Protonipumpun estäjät, H2-reseptorin antagonistit ja haponestolääkkeet
pH-arvo vaikuttaa neratinibin in vitro liukoisuuteen. Mahalaukun pH-arvoa nostavien aineiden samanaikainen käyttö saattaa heikentää neratinibin imeytymistä vähentäen siten systeemistä altistusta sille. Protonipumpun estäjien samanaikaista käyttöä ei suositella (esim. omepratsoli tai lansopratsoli) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Nerlynx tulee ottaa vähintään 2 tuntia ennen tai 10 tuntia H2-reseptorin antagonistin ottamisen jälkeen (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Nerlynx-annoksen ja haponestolääkkeen ottamisen välillä on oltava vähintään kolme tuntia (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Ripulilääke loperamidi
Kliininen tutkimus on osoittanut, ettei koehenkilöiden neratinibille altistumisessa ollut kliinisesti merkittävää eroa, mikäli loperamidia otettiin samanaikaisesti tai ei (ks. kohta Farmakokinetiikka).
Neratinibin vaikutus muihin aineisiin
Hormonaaliset ehkäisyvalmisteet
Ei vielä tiedetä, heikentääkö Nerlynx systeemisesti vaikuttavien hormonaalisten ehkäisyvalmisteiden tehoa. Siksi systeemisesti vaikuttavia hormonaalisia ehkäisyvalmisteita käyttävien naisten on käytettävä lisäksi estemenetelmää (ks. kohta Raskaus ja imetys).
P-glykoproteiinieffluksikuljettaja
In vitro -kokeet osoittivat, että neratinibi on P-glykoproteiinin (Pgp) effluksikuljettajien estäjä. Tämä on vahvistettu kliinisellä tutkimuksella, jossa digoksiinia käytettiin koesubstraattina ja jonka tuloksena digoksiinin Cmax-arvo nousi 54 % ja AUC-arvo 32 %. Tämä voi olla kliinisesti merkittävää potilaille, joita hoidetaan samanaikaisesti lääkeaineilla, joilla on kapea terapeuttinen ikkuna ja joiden imeytymiseen liittyy Pgp-kuljettajaproteiineja maha-suolikanavassa (esim. digoksiini, kolkisiini, dabigatraani, fenytoiini, statiinit, syklosporiini, everolimuusi, sirolimuusi, takrolimuusi). Heitä on tarkkailtava huolellisesti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Rintasyövän resistenssiproteiinin effluksikuljettaja
In vitro -kokeet viittaavat siihen, että neratinibi saattaa olla rintasyövän resistenssiproteiinin (BCRP) estäjä suolistossa saavutettavilla pitoisuuksilla. Kliinistä tutkimusta BCRP:n substraateilla ei ole tehty. Koska neratinibin samanaikainen käyttö yhdessä BCRP:n substraattien kanssa voi johtaa niiden suurentuneeseen altistukseen, potilaita, joita hoidetaan BCRP:n substraateilla (esim. rosuvastatiinilla, sulfasalatsiinilla ja irinotekaanilla), on tarkkailtava huolellisesti (ks. kohta Farmakokinetiikka).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / naisten ja miesten ehkäisy
Eläimillä tehtyjen löydösten perusteella neratinibi voi vaurioittaa sikiötä, jos sitä annetaan raskaana oleville naisille. Naisten on vältettävä raskaaksi tulemista Nerlynx-hoidon aikana ja kuukausi hoidon päättymisen jälkeen. Siksi naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä Nerlynx-hoidon aikana ja kuukausi hoidon päättymisen jälkeen.
Ei vielä tiedetä, heikentääkö neratinibi systeemisesti vaikuttavien hormonaalisten ehkäisyvalmisteiden tehoa. Siksi systeemisesti vaikuttavia hormonaalisia ehkäisyvalmisteita käyttävien naisten on käytettävä lisäksi estemenetelmää.
Miesten on käytettävä estemenetelmää hoidon aikana ja kolme kuukautta hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja Nerlynxin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu alkio- ja sikiökuolleisuutta ja sikiön rakenteellisia epämuodostumia (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta. Nerlynxiä ei pidä käyttää raskauden aikana, ellei raskaana olevan potilaan kliininen tilanne edellytä hoitoa neratinibilla.
Jos neratinibia käytetään raskauden aikana tai jos potilas tulee raskaaksi Nerlynxin käytön aikana, potilaalle on kerrottava mahdollisesta sikiöön kohdistuvasta riskistä.
Imetys
Ei tiedetä, erittyykö neratinibi ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Nerlynx-hoito ottaen huomioon rintaruokinnasta aiheutuva hyöty lapselle ja Nerlynx-hoidon merkitys äidille.
Hedelmällisyys
Hedelmällisyyskokeita naisilla tai miehillä ei ole tehty. Merkittäviä muutoksia uros- ja naarasrottien hedelmällisyysparametreissa ei havaittu, kun annostus oli enintään 12 mg/kg/vrk (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nerlynx-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Neratinibin haittavaikutuksina on ilmoitettu väsymystä, huimausta, kuivumista ja pyörtymistä. Potilaan kliininen tila on huomioitava arvioitaessa potilaan kykyä suorittaa arviointikykyä tai motorisia tai kognitiivisia taitoja vaativia tehtäviä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset vaikeusasteesta riippumatta olivat ripuli (93,6 %), pahoinvointi (42,5 %), väsymys (27,3 %), oksentelu (26,8 %), vatsakipu (22,7 %), ihottuma (15,4 %), heikentynyt ruokahalu (13,7 %), ylävatsakipu (13,2 %), suutulehdus (11,2 %) ja lihaskouristukset (10,0 %).
Yleisimmät vaikeusasteen 3–4 haittavaikutukset olivat ripuli (vaikeusaste 3, 36,9 % ja vaikeusaste 4, 0,2 %) sekä oksentelu (vaikeusaste 3, 3,4 % ja vaikeusaste 4, 0,1 %).
Vakaviksi ilmoitettuja haittavaikutuksia olivat ripuli (1,9 %), oksentelu (1,3 %), kuivuminen (1,1 %), pahoinvointi (0,5 %), alaniiniaminotransferaasiarvon nousu (0,4 %), aspartaattiaminotransferaasiarvon nousu (0,4 %), vatsakipu (0,3 %), väsymys (0,3 %) ja heikentynyt ruokahalu (0,2 %).
Taulukko haittavaikutuksista
Seuraavassa taulukossa on lueteltu haittavaikutukset, jotka havaittiin neratinibin käytön yhteydessä arvioitaessa 1 710 potilaan yhdistettyjä tietoja.
Yleisyys on luokiteltu MedDRAn yleisyysluokituksen ja elinluokitustietokannan mukaisesti:
Hyvin yleinen (≥ 1/10)
Yleinen (≥ 1/100, < 1/10)
Melko harvinainen (≥ 1/1 000, < 1/100)
Harvinainen (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen (< 1/10 000)
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 5: Nerlynxin aiheuttamat haittavaikutukset rintasyövän monoterapiatutkimuksissa
Elinluokka | Yleisyys | Haittavaikutus |
Infektiot | Yleinen | Virtsatieinfektio |
Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Heikentynyt ruokahalu |
Yleinen | Kuivuminen | |
Hermosto | Yleinen | Pyörtyminen |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Nenäverenvuoto |
Ruoansulatuselimistö | Hyvin yleinen | Ripuli, oksentelu, pahoinvointi, vatsakipu, ylävatsakipu ja suutulehdus1 |
Yleinen | Vatsan pingottuminen, kuiva suu ja ylävatsavaivat | |
Maksa ja sappi | Yleinen | Alaniiniaminotransferaasiarvon nousu ja aspartaattiaminotransferaasiarvon nousu |
Melko harvinainen | Veren bilirubiinipitoisuuden nousu | |
Iho ja ihonalainen kudos | Hyvin yleinen | Ihottuma2 |
Yleinen | Kynsisairaus3, ihon uurteet ja kuiva iho | |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihaskouristukset |
Munuaiset ja virtsatiet | Yleinen | Veren kreatiniiniarvon nousu |
Melko harvinainen | Munuaisten vajaatoiminta | |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Väsymys |
Tutkimukset | Yleinen | Painon lasku |
1 Mukaan lukien suutulehdus, aftainen suutulehdus, suun haavaumat, suun limakalvon rakkulat ja limakalvotulehdus. 2 Mukaan lukien ihottuma, punoittava ihottuma, follikulaarinen ihottuma, yleistynyt ihottuma, kutiava ihottuma ja märkärakkulainen ihottuma. 3 Mukaan lukien kynsisairaus, kynnenvierustulehdus, kynsien katkeilu ja kynsien värjääntyminen. | ||
Tiettyjen haittavaikutusten kuvaus
Ripuli
Niistä 1 660 potilaasta, jotka saivat Nerlynxia monoterapiana ilman estolääkitystä loperamidilla, 94,6 prosentilla ilmeni vähintään yksi ripuliepisodi. Vaikeusasteen 3 ripulia ilmoitettiin 37,5 prosentilla Nerlynxiä saaneista potilaista. 0,2 prosentilla potilaista oli ripuli, jonka vaikeusasteeksi luokiteltiin 4. 1,9 prosenttia Nerlynxiä saaneista potilaista joutui ripulin vuoksi sairaalaan.
Ripuli ilmeni yleensä ensimmäisen kuukauden aikana. 83,6 prosenttia ilmoitti tätä toksisuutta ensimmäisellä viikolla, 46,9 prosenttia toisella viikolla, 40,2 prosenttia kolmannella viikolla ja 43,2 prosenttia neljännellä viikolla (mediaani aika taudin ensimmäiseen puhkeamiseen oli 2 vuorokautta).
Minkä tahansa vaikeusasteen yhden ripuliepisodin mediaanikesto oli 2 vuorokautta. Minkä tahansa vaikeusasteen ripulin kumulatiivinen mediaanikesto oli 59 vuorokautta ja vaikeusasteen 3 ripulin kumulatiivinen mediaanikesto oli 5 vuorokautta.
Ripuli oli myös yleisin hoidon keskeyttämiseen johtanut haittavaikutus: 14,4 prosenttia Nerlynx-hoitoa saaneista potilaista, jotka eivät saaneet estolääkitystä loperamidilla, keskeytti hoidon ripulin vuoksi. Annosta pienennettiin 24,7 prosentilla Nerlynx-hoitoa saaneista potilaista.
Ihottuma
Nerlynxia monoterapiana saaneilla ihottumaa esiintyi 16,7 prosentilla potilaista. Vaikeusasteen 1 ihottuman esiintymistiheys oli 13,3 prosenttia ja vaikeusasteen 2 ihottuman 2,9 prosenttia. 0,4 prosentilla Nerlynx-hoitoa saaneista potilaista esiintyi vaikeusasteen 3 ihottumaa.
Kynsisairaudet
Nerlynx-monoterapiaryhmässä kynsimuutoksia esiintyi 7,8 prosentilla potilaista. Vaikeusasteen 1 kynsimuutosten esiintymistiheys oli 6,2 prosenttia ja vaikeusasteen 2 kynsimuutosten 1,4 prosenttia. 0,2 prosentilla Nerlynx-hoitoa saaneista potilaista esiintyi vaikeusasteen 3 kynsimuutoksia.
Sekä ihottuma että kynsimuutokset johtivat hoidon keskeyttämiseen 0,6 prosentilla Nerlynx-hoitoa saaneista potilaista.
Maksatoksisuus
Vaiheen III avaintutkimuksessa ExteNET (3004) maksaan liittyviä haittavaikutuksia ilmoitettiin useammin Nerlynx-ryhmässä (12,4 %) kuin lumeryhmässä (6,6 %). Syinä olivat pääasiassa alaniiniaminotransferaasiarvon (ALAT) nousu (8,5 % vs. 3,2 %), aspartaattiaminotransferaasiarvon (ASAT) nousu (7,4 % vs. 3,3 %) ja veren alkalisen fosfataasin arvon nousu (2,1 % vs. 1,1 %). Vaikeusasteen 3 haittavaikutuksia ilmoitettiin 1,6 prosentilla Nerlynx-hoitoa saaneista ja 0,5 prosentilla lumelääkettä saaneista, vaikeusasteen 4 haittavaikutuksia puolestaan 0,2 prosentilla Nerlynx-hoitoa saaneista ja 0,1 prosentilla lumelääkettä saaneista. Vaikeusasteen 3 ALAT-arvon nousua ilmoitettiin 1,1 prosentilla Nerlynx-hoitoa saaneista ja 0,2 prosentilla lumelääkettä saaneista, vaikeusasteen 4 ALAT-arvon nousua puolestaan 0,2 prosentilla Nerlynx-hoitoa saaneista ja 0,0 prosentilla lumelääkettä saaneista. Vaikeusasteen 3 ASAT-arvon nousua ilmoitettiin 0,5 prosentilla Nerlynx-hoitoa saaneista ja 0,3 prosentilla lumelääkettä saaneista, vaikeusasteen 4 ASAT-arvon nousua puolestaan 0,2 prosentilla Nerlynx-hoitoa saaneista ja 0,0 prosentilla lumelääkettä saaneista. Vaikeusasteen 3 tai 4 haittavaikutuksista veren bilirubiiniarvon nousuja ei esiintynyt.
Muut erityispotilasryhmät
Iäkkäät potilaat
Vaiheen III avaintutkimuksessa ExteNET (3004) potilaiden keskimääräinen ikä oli 52 vuotta Nerlynx-ryhmässä. 1 236 potilasta oli < 65 vuotta ja 172 potilasta oli ≥ 65 vuotta, ja jälkimmäisistä 25 oli vähintään 75 vuotta.
Hoidon keskeyttäminen haittavaikutusten vuoksi oli ≥ 65-vuotiaiden ryhmässä yleisempää kuin < 65-vuotiaiden ryhmässä. Nerlynx-ryhmässä keskeyttämisosuus ensimmäisessä ryhmässä oli 44,8 prosenttia ja jälkimmäisessä ryhmässä 25,2 prosenttia.
Vakavien haittavaikutusten ilmaantuvuus oli Nerlynx-ryhmässä 7,0 prosenttia ja lumeryhmässä 5,7 prosenttia (< 65-vuotiaat) sekä Nerlynx-ryhmässä 9,9 prosenttia ja lumeryhmässä 8,1 prosenttia (≥ 65-vuotiaat). Yleisimmin ≥ 65-vuotiaiden ryhmässä ilmoitettuja haittavaikutuksia olivat oksentelu (2,3 %), ripuli (1,7 %), kuivuminen (1,2 %) ja munuaisten vajaatoiminta (1,2 %).
Hoidon aikana ilmenevien haittavaikutusten, jotka johtivat sairaalahoitoon, osuus Nerlynx-hoitoa saaneilla potilailla oli 6,3 prosenttia ja lumelääkettä saaneilla potilailla 4,9 prosenttia < 65-vuotiaiden ryhmässä ja 8,7 prosenttia vs. 8,1 prosenttia ≥ 65-vuotiaiden ryhmässä.
Rodun vaikutus
Vaiheen III avaintutkimuksessa ExteNET (3004) elinluokkaan iho ja ihonalainen kudos kuuluvat hoidon aikana ilmenevät haittavaikutukset olivat Nerlynx-hoitoa saaneilla aasialaisilla potilailla yleisempiä (56,4 %) kuin valkoihoisilla potilailla (34,5 %), mutta esiintymistiheydet olivat lähellä toisiaan lumelääkettä saaneilla potilailla (24,9 % vs. 22,8 %). Nerlynx-monoterapiana saaneen 1 710 potilaan yhdistetyt turvallisuustiedot osoittivat, että ihotoksisuus oli yleisempää aasialaisilla potilailla (57,1 %) kuin valkoihoisilla (34,6 %).
Yhdistettyjen turvallisuustietojen analyysin mukaan valtaosa elinluokkaan iho ja ihonalainen kudos kuuluvista hoidon aikana ilmenevistä haittavaikutuksista aasialaisilla potilailla oli vaikeusasteeltaan 1 (43,3 %) tai 2 (12,3 %). Valkoihoisilla potilailla vaikeusasteen 1 tapahtumien yleisyys oli 25,6 prosenttia ja vaikeusasteen 2 yleisyys 7,8 prosenttia. Vaikeusasteen 3 tapahtumat olivat lähes yhtä yleisiä aasialaisilla potilailla (1,6 %) ja valkoihoisilla potilailla (1,0 %). Elinluokkaan iho ja ihonalainen kudos kuuluvien vakavien haittavaikutusten yleisyydessä ei ollut eroa aasialaisten ja valkoihoisten potilaiden alaryhmän välillä. Yleisimmät elinluokkaan iho ja ihonalainen kudos kuuluvat hoidon aikana ilmenevät haittavaikutukset, joita esiintyi yleisemmin aasialaisilla kuin valkoihoisilla potilailla, olivat ihottuma (29,4 % vs. 13,5 %), käsi-jalkaoireyhtymä (9,9 % vs. 1,0 %) sekä aknetyyppinen ihottuma (6,0 % vs. 1,0 %).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Erityistä vastalääkettä ei ole olemassa, eikä ole tiedossa, onko hemodialyysistä hyötyä Nerlynx-hoidon yliannostuksen hoidossa. Jos potilas saa yliannostuksen, valmisteen anto on lopetettava ja on ryhdyttävä yleisiin hoitoa tukeviin toimiin.
Kliinisissä tutkimuksissa yleisimmät yliannostukseen liittyvät haittavaikutukset olivat ripuli, johon saattoi liittyä pahoinvointia, sekä oksentelu ja kuivuminen.
Annoksennostotutkimuksessa terveille vapaaehtoisille annettiin suun kautta kerta-annoksena enintään 800 mg Nerlynxiä. Maha-suolikanavan sairauksien (ripuli, vatsakipu, pahoinvointi ja oksentelu) yleisyys ja vakavuus vaikutti olevan annossidonnainen. Yli 800 mg:n Nerlynx-kerta-annoksia ei ole annettu kliinisissä tutkimuksissa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset aineet, proteiinikinaasin estäjät, ATC-koodi: L01EH02
Vaikutusmekanismi
Neratinibi on irreversiibeli ERBB-reseptorin tyrosiinikinaasin estäjä, joka estää mitogeenisen kasvutekijän signaalitransduktion kovalenttisellä suuren affiniteetin sitoutumisella seuraavien kolmen epidermaalisen kasvutekijän reseptorin (EGRF) ATP:n sitoutumiskohtaan: EGFR (ERBB1), HER2 (ERBB2) ja HER4 (ERBB4) tai niiden aktiiviset heterodimeerit, HER3 (ERBB3). Tuloksena on näiden kasvua edistävien reittien pysyvä esto rintasyövissä, jotkat yli-ilmentävät HER2:ta tai joissa on HER2-geenin monistuma tai HER2:n mutaatio. Neratinibi sitoutuu HER2-reseptoriin, vähentää EGFR:n ja HER2:n autofosforylaatiota MAPK- ja AKT-signaalireittejä alavirtaan sekä saattaa estää kasvainsolujen lisääntymistä in vitro. Neratinibi esti EGFR:tä ja/tai HER2:tä ilmentäviä karsinoomasolulinjoja siten, että IC50 < 100 nM.
Kliininen teho ja turvallisuus
Vaiheen III avaintutkimuksessa ExteNET (3004), joka oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus, 2 840 naista, joilla oli (paikallisella määrityksellä vahvistettu) varhaisvaiheen HER2-positiivinen rintasyöpä ja jotka olivat saaneet aikaisemmin liitännäishoitoa trastutsumabilla, satunnaistettiin suhteessa 1:1 saamaan Nerlynxiä tai lumelääkettä päivittäin vuoden ajan. Hoitoaieryhmässä (ITT) mediaani-ikä oli 52 vuotta (59,9 % oli ≥ 50-vuotiaita, 12,3 % oli ≥ 65‑vuotiaita). Ryhmästä 81,0 prosenttia oli valkoihoisia, 2,6 prosenttia mustaihoisia tai afroamerikkalaisia, 13,6 prosenttia aasialaisia ja 2,9 prosenttia muita rotuja. Lähtötilanteessa 57,7 prosentilla oli hormonireseptoripositiivinen sairaus (ER-positiivinen ja/tai PgR-positiivinen), 27,2 prosentilla syöpä ei ollut levinnyt imusolmukkeisiin, 41,5 prosentilla syöpä oli levinnyt 1–3 imusolmukkeeseen ja 29,4 prosentilla vähintään neljään imusolmukkeeseen. Noin 10 prosentilla potilaista oli asteen I kasvaimia, noin 40 prosentilla oli asteen II kasvaimia ja noin 30 prosentilla asteen III kasvaimia. Mediaaniaika viimeisen trastutsumabiliitännäishoidon ja satunnaistamisen välillä oli 4,5 kuukautta.
Tutkimuksen ensisijainen päätetapahtuma oli tautivapaa elinaika invasiivisen syövän suhteen (iDFS). Toissijaisia päätetapahtumia olivat tauditon elossaoloaika (DFS), mukaan lukien duktaalinen in situ ‑karsinooma (DCIS), aika kaukoetäpesäkkeiden ilmaantumiseen (time to distant recurrence, TTDR), etäpesäkkeetön elossaoloaika (distant disease-free survival, DDFS) sekä uusiutumisen keskushermostossa ja kokonaiselossaolon (OS) kumulatiivinen ilmaantuvuus.
Kaksi vuotta satunnaistamisen jälkeen tehty tutkimuksen ensisijainen analyysi osoitti, että Nerlynx pienensi invasiivisen taudin uusiutumisen ja kuoleman riskiä merkitsevästi eli 33 prosenttia (riskitiheyssuhde HR = 0,67, 95 %:n luottamusväli [0,49, 0,91], kaksisuuntainen p = 0,011) ITT-ryhmässä.
Taulukko 6: Ensisijaiset 2 vuoden tehon tulokset – ITT- ja hormonireseptoripositiiviset ryhmät, jotka olivat lopettaneet trastutsumabihoidon alle vuosi sitten
Muuttuja | Arvioitu 2 vuoden tapahtumattomien jaksojen yleisyys1 (%) | Riskitiheyssuhde (95 %:n luottamusväli)2 | P-arvo3 | |
ITT-potilaat | ||||
Nerlynx (N = 1 420) | Lumelääke (N = 1 420) | |||
Tauditon elossaolo invasiivisen syövän suhteen | 94,2 | 91,9 | 0,67 (0,49, 0,91) | 0,011 |
Tauditon elossaolo, mukaan lukien duktaalinen in situ -karsinooma | 94,2 | 91,3 | 0,62 (0,46, 0,84) | 0,002 |
Kaukoetäpesäkkeetön elossaolo | 95,3 | 94,0 | 0,75 (0,53, 1,06) | 0,110 |
Aika kaukoetäpesäkkeiden uusiutumiseen | 95,5 | 94,2 | 0,74 (0,52, 1,06) | 0,102 |
Uusiutuminen keskushermostossa | 0,92 | 1,16 | – | 0,586 |
Hormonireseptoripositiivinen ryhmä, joka lopetti trastutsumabihoidon alle vuosi sitten | ||||
Nerlynx (N = 671) | Lumelääke (N = 668) | Riskitiheyssuhde (95 %:n luottamusväli)4 | P-arvo5 | |
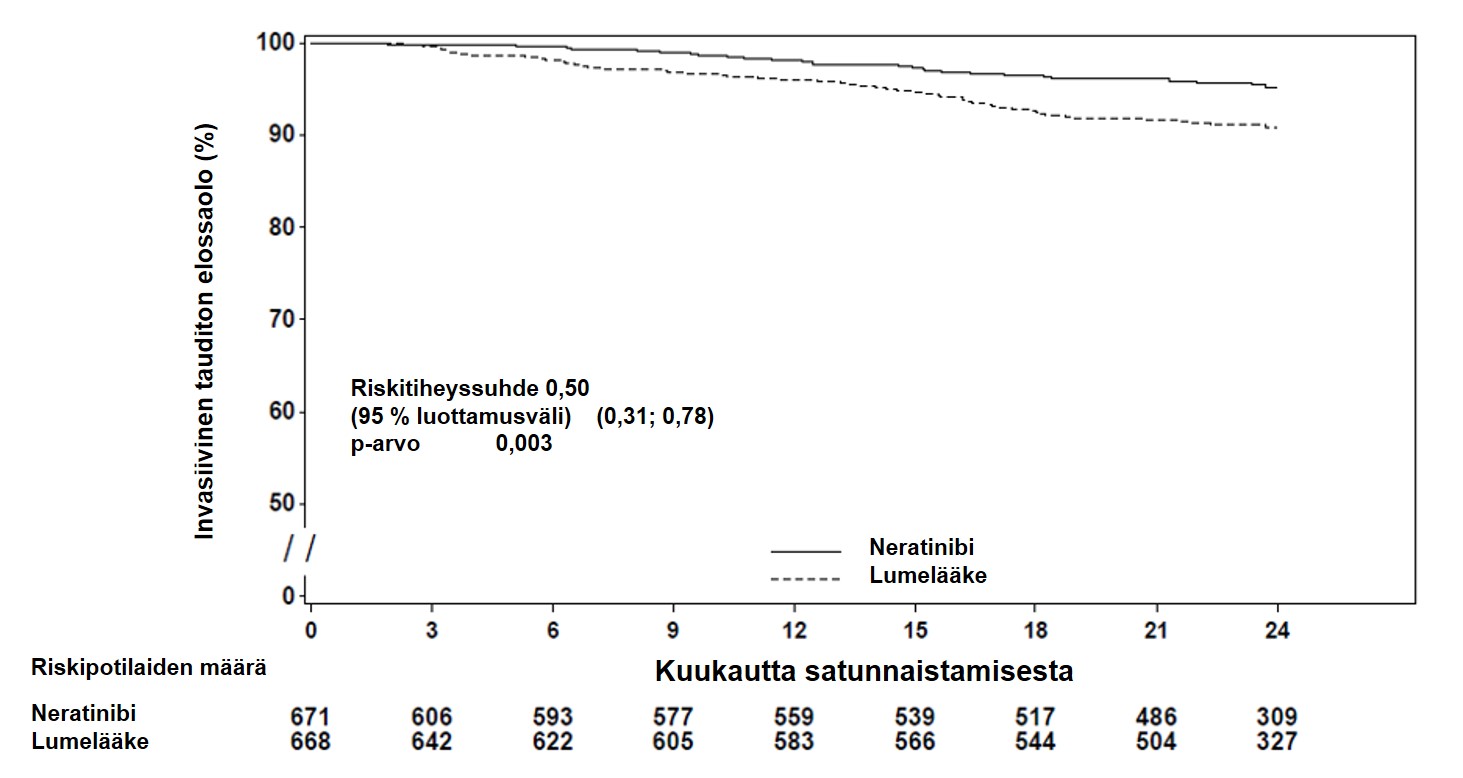
Tauditon elossaolo invasiivisen syövän suhteen | 95,3 | 90,9 | 0,50 (0,31, 0,78) | 0,003 |
Tauditon elossaolo, mukaan lukien duktaalinen in situ -karsinooma | 95,3 | 90,1 | 0,45 (0,28, 0,71) | < 0,001 |
Kaukoetäpesäkkeetön elossaolo | 96,1 | 93,0 | 0,53 (0,31, 0,88) | 0,015 |
Aika kaukoetäpesäkkeiden uusiutumiseen | 96,3 | 93,3 | 0,53 (0,30, 0,89) | 0,018 |
Uusiutuminen keskushermostossa | 0,34 | 1,01 | – | 0,189 |
1 Tapahtumattomien jaksojen yleisyys (event-free rate) kaikissa päätetapahtumissa, lukuun ottamatta uusiutumista keskushermostossa, jonka osalta on ilmoitettu kumulatiivinen ilmaantuvuus.
2 Stratifioitu Coxin suhteellisten riskitiheyksien malli
3 Stratifioitu kaksisuuntainen logrank-testi kaikissa päätetapahtumissa, lukuun ottamatta uusiutumista keskushermostossa, johon sovellettiin Grayn menetelmää.
4 Stratifioitumaton Coxin suhteellisten riskitiheyksien malli
5 Stratifioitumaton kaksisuuntainen logrank-testi kaikissa päätetapahtumissa, lukuun ottamatta uusiutumista keskushermostossa, johon sovellettiin Grayn menetelmää.
Kuva 1:Invasiivisen taudittoman elossaolon Kaplan–Meierin käyrä – hormonireseptoripositiivinen ryhmä, joka oli lopettanut trastutsumabihoidon alle vuosi sitten
Nerlynxin suhteellinen hoidollinen hyöty ennalta määritellyissä alaryhmissä hormonireseptoripositiivisilla potilailla, jotka olivat lopettaneet trastutsumabihoidon alle vuosi sitten, on esitetty kuvassa 2.
Kuva 2:Hormonireseptoripositiiviset potilaat, jotka olivat lopettaneet trastutsumabihoidon alle vuosi sitten, invasiivinen tauditon elossaolo alaryhmittäin
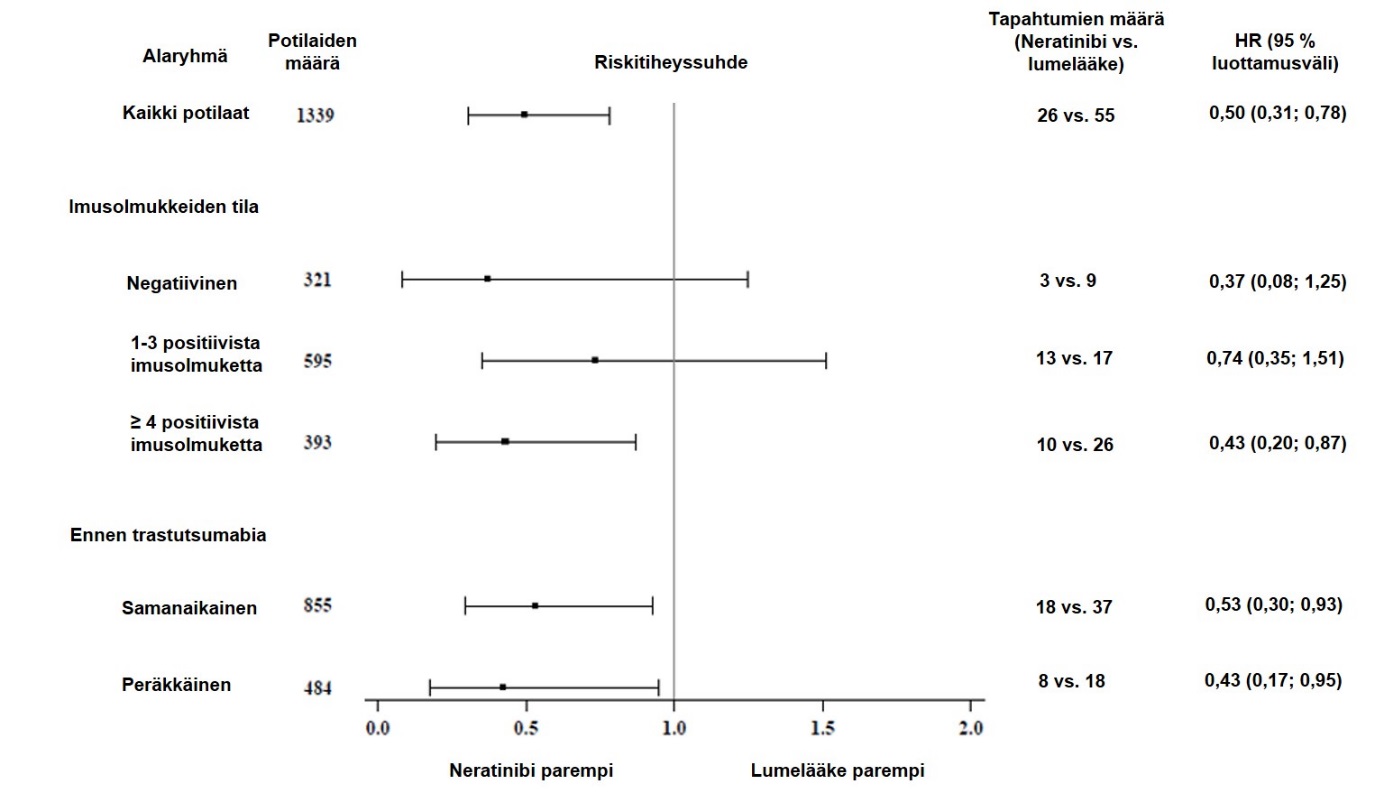
Huomaa: Tuloksia potilailla (n = 30), joiden imusolmukkeiden tila oli tuntematon, ei näytetä, koska riskitiheyssuhdetta ei kyetty määrittämään.
Riippumatta trastutsumabihoidosta kuluneesta ajasta hormonireseptorinegatiivisilla potilailla taudittoman elossaolon riskitiheyssuhde invasiivisen syövän suhteen oli 2 vuoden kohdalla 0,94 (95 %:n luottamusväli [0,61, 1,46]). Tehoa ei ole osoitettu tässä ryhmässä.
Noin 75 prosenttia potilaista antoi uuden suostumuksen jatkettuun seurantaan, joka kesti yli 24 kuukautta. Puuttuvia tietoja sisältävät havainnot poistettiin viimeisenä arviointipäivänä. Nerlynxin hoidollinen hyöty lumelääkkeeseen verrattuna oli säilynyt viiden vuoden kohdalla, mutta vaikutuksen suuruutta ei pystytty arvioimaan luotettavasti.
Kokonaiselossaolon mediaaniseuranta-aika oli 8,06 vuotta ITT-ryhmässä, 8,03 vuotta neratinibiryhmässä ja 8,10 vuotta lumelääkeryhmässä. Yhteensä 1542 (54,3 %) potilasta seurattiin elossaolon suhteen vähintään 8 vuoden ajan; 746 (52,5 %) neratinibiryhmässä ja 796 (56,1 %) lumelääkeryhmässä. Kuolemantapausten määrä oli 264 (9,3 %), joista 127 (8,9 %) oli neratinibihoitoa saaneessa potilaryhmässä ja 137 (9,6 %) lumelääkehoitoa saaneessa potilasryhmässä.
Kokonaiselossaolo ei eronnut tilastollisesti merkitsevästi Nerlynx- ja lumelääkeryhmien välillä [HR 0,96 (95 %:n luottamusväli: 0,75, 1,22)] ITT-ryhmässä 8,06 vuoden mediaaniseuranta-ajan kohdalla.
Hormonireseptoripositiivisilla potilailla, jotka olivat lopettaneet trastutsumabihoidon alle vuosi sitten, mediaaniseuranta-aika oli 8,0 vuotta neratinibiryhmässä ja 8,1 vuotta lumelääkeryhmässä. Yhteensä 1 399 (47,1 %) potilasta seurattiin elossaolon suhteen vähintään 8 vuoden ajan; 671 (23,6 %) neratinibiryhmässä ja 668 (23,5 %) lumelääkeryhmässä. Tässä alaryhmässä kuolemantapausten määrä oli 55 (8,2 %) neratinibihoitoa saaneessa potilasryhmässä ja 68 (10,2 %) lumelääkehoitoa saaneessa potilasryhmässä [HR 0,83 (95 %:n luottamusväli: 0,58, 1,18)].
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset kaikissa pediatrisissa potilasryhmissä rintasyövän hoidossa.
Farmakokinetiikka
Massatasapainoa suun kautta annetun neratinibin 200 mg:n kerta-annoksen jälkeen tutkittiin kuudella terveellä koehenkilöllä.
Imeytyminen
Kun neratinibia annettiin 240 mg suun kautta, imeytyminen oli hidasta ja neratinibin huippupitoisuus plasmassa saavutettiin noin seitsemän tunnin kuluttua lääkkeen annosta. Ruoan kanssa otettuna neratinibin 240 mg kerta-annoksenjälkeen Cmax-arvo oli noin 17 prosenttia ja AUC-arvoa noin 13 prosenttia suurempi verrattuna lääkkeen antoon paastotilassa. Rasvapitoisen aterian kanssa otettuna neratinibin 240 mg:n kerta-annosksen jälkeen sekä Cmax-arvo että AUC-arvo oli noin 100 prosenttia suurempi. Massabalanssitutkimuksessa muuttumattoman neratinibin ja metaboliittien kokonaissaanto (virtsa ja ulosteet) osoittaa, että neratibinin imeytynyt osuus on vähintään 10 % ja todennäköisesti enemmän kuin 20 %. Lisäksi malleihin perustuvat ennustukset viittaavat siihen, että kaiken kaikkiaan suolistosta imeytyvä osuus (fa) on 26 %.
pH-arvo vaikuttaa neratinibin in vitro liukoisuuteen. Maha-suolikanavan pH-arvoa nostavat lääkehoidot saattavat heikentää neratinibin imeytymistä vähentäen siten systeemistä altistusta sille.
Jakautuminen
Neratinibin sitoutuminen ihmisen plasmaproteiineihin, mukaan lukien kovalenttinen sitoutuminen ihmisen seerumin albumiiniin (HSA), oli yli 98 prosenttia ja riippumaton testatusta neratinibipitoisuudesta. Neratinibi sitoutui pääasiallisesti HSA:han ja ihmisen happamaan alfa-1-glykoproteiiniin (AAG). Pääasiallisen metaboliitin (M6) sitoutuminen ihmisen plasmaproteiineihin oli yli 99 prosenttia ja riippumaton testatusta M6:n pitoisuudesta.
In vitro ‑kokeet osoittivat, että neratinibi on P-glykoproteiinin (Pgp) (ks. kohdat Annostus ja antotapa, Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) ja BCRP:n substraatti. In vitro -kokeet osoittivat, että neratinibi ja sen pääasiallinen metaboliitti M6 eivät ole maksan soluunoton kuljettajien OATP1B1*1a ja OATP1B3 substraatteja kliinisesti merkittävällä pitoisuudella.
Biotransformaatio
Neratinibi metaboloituu pääasiassa maksan mikrosomeissa CYP3A4:n kautta ja vähemmässä määrin flaviinimono-oksygenaasin (FMO) kautta.
Pääasiallisen metaboliitin profilointi ihmisen plasmassa viittaa siihen, että suun kautta annostelun jälkeen neratinibi metaboloituu oksidatiivisesti CYP3A4:n kautta. Kiertäviä metaboliitteja ovat neratinibi-pyridiini-n-oksidi (M3), N-desmetyyli-neratinibi (M6), neratinibi-dimetyyliamiini-n-oksidi (M7) sekä erittäin vähäisiä määriä hydroksyyli-neratinibi-n-oksidia ja neratinibi-bis-n-oksidia (M11). Neratinibi on huomattavin komponentti plasmassa, ja yksikään kiertävistä metaboliiteista (M2, M3, M6, M7 ja M11) ei ylitä 8 prosenttia neratinibin ja metaboliittien kokonaisaltistuksesta neratinibin suun kautta annon jälkeen. Neratinibin metaboliiteilla M3, M6, M7 ja M11 osoitettiin olevan neratinibia vastaava vaikutus sekä in vitro entsyymipohjaisissa (sitoutumismääritykset) että solupohjaisissa määrityksissä soluissa, jotka ilmensivät ERBB1:tä, ERBB2:ta (HER2) ja ERBB4:ää.
Vakaan tilan altistusten perusteella neratinibi välittää valtaosan sen farmakologisesta aktiivisuudesta (73 %), metaboliitille M6 altistuminen käsittää siitä 20 %, metaboliitille M3 altistuminen 6 % sekä metaboliiteille M7 ja M11 altistuminen merkityksettömän osan (< 1 %).
Eliminaatio
Neratinibin kerta-annosten annon jälkeen neratinibin keskimääräinen ilmeinen puoliintumisaika plasmassa oli potilailla 17 tuntia.
Neratinibi erittyy pääasiassa ulosteen mukana
Kun annettiin 240 mg:n kerta-annos radioaktiivisesti merkittyä neratinibia oraaliliuoksena, annetusta annoksesta 95,5 prosenttia löytyi ulosteesta ja 0,96 prosenttia virtsasta.
Erittyminen oli nopeaa ja täydellistä. Suurin osa annoksesta saatiin talteen ulosteessa 48 tunnissa ja 96,5 % kokonaisradioaktiivisuudesta saatiin talteen ulosteessa ja virtsassa 8 päivän kuluttua.
Muuttumaton neratinibi oli kaikista runsaimmin ulosteessa ja virtsassa esiintyvä muoto käsittäen 62,1 % ulosteessa ja virtsassa talteen kerätystä kokonaisannoksesta. Ulosteessa runsaimmin esiintyvät metaboliitit olivat M6 (19,7 % annetusta annoksesta) sekä M2, M3 ja M7, joiden kaikkien osuus oli alle 10 % annetusta annoksesta.
Lääkeinteraktiot
CYP3A4-/Pgp-induktorin vaikutus neratinibiin
Kun annettiin samanaikaisesti 240 mg neratinibia ja toistuvia 600 mg:n annoksia rifampisiinia, joka on vahva CYP3A4-/Pgp-induktori, altistukset neratinibille vähenivät merkittävästi (Cmax-arvo väheni 76 prosenttia ja AUC-arvo 87 prosenttia) verrattuna neratinibin antoon yksin (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
CYP3A4-/Pgp-estäjän vaikutus neratinibiin
Neratinibin 240 mg:n kerta-annos suun kautta otettuna yhdessä ketakonatsolin (400 mg kerran päivässä 5 päivän ajan) kanssa, joka on vahva CYP3A4-/Pgp-estäjä, lisäsi systeemistä altistusta neratinibille (Cmax-arvo kasvoi 3,2-kertaiseksi ja AUC-arvo 4,8-kertaiseksi) verrattuna neratinibin antoon yksin.
Malleihin perustuvat ennustukset viittasivat siihen, että neratinibin 240 mg:n kerta-annos suun kautta otettuna yhdessä flukonatsolin (200 mg kerran päivässä 8 päivän ajan) kanssa, joka on keskivahva CYP3A4-estäjä, lisäsi systeemistä altistusta neratinibille (Cmax-arvo kasvoi 1,3-kertaiseksi ja AUC-arvo 1,7-kertaiseksi) verrattuna neratinibin antoon yksin.
Malleihin perustuvat ennustukset viittasivat siihen, että neratinibin 240 mg:n kerta-annos suun kautta otettuna yhdessä verapamiilin (120 mg kaksi kertaa päivässä 8 päivän ajan) kanssa, joka on keskivahva CYP3A4-/Pgp-estäjä, lisäsi systeemistä altistusta neratinibille (Cmax-arvo kasvoi 3,0‑kertaiseksi ja AUC-arvo 4,0-kertaiseksi) verrattuna neratinibin antoon yksin (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Mahalaukun pH-arvoa muuttavien lääkkeiden vaikutus neratinibiin
Kun lansopratsolia tai ranitidiinia (1 x 300 mg) annettiin samanaikaisesti neratinibin 240 mg kerta-annoksen kanssa terveillä vapaaehtoisilla, neratinibin altistus väheni noin 70 prosenttia lansopratsolia ja noin 50 prosenttia ranitidiinia annettaessa. Neratinibin AUC-arvoon kohdistuvan interaktion voimakkuus väheni 25 prosenttia, kun ranitidiini (2 x 150 mg) ajoitettiin otettavaksi 2 tuntia neratinibin ottamisen jälkeen (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Muiden lääkehoitojen vaikutukset neratinibiin
Neratinibilla ei havaittu olevan ilmeisiä kliinisesti merkittäviä lääke-lääkeinteraktioita, kun sitä annettiin samanaikaisesti kapesitabiinin, paklitakselin, trastutsumabin, vinorelbiinin tai ripulilääkkeiden (loperamidin) kanssa (ks. kohta Yhteisvaikutukset).
Neratinibin vaikutus CYP-substraatteihin
Neratinibi ja metaboliitti M6 eivät ole tehokkaita suoria CYP1A2-, 2A6-, 2B6-, 2C8-, 2C9-, 2D6- tai 3A4-estäjiä, eikä aikariippuvaista estoa ole odotettavissa.
Neratinibi ei indusoi CYP1A2:ta, 2B6:ta, 2C9:ää tai 3A4:ää.
Neratinibin vaikutus kuljettajaproteiineihin
Ihmisen sappisuolapumpun (BSEP) effluksikuljettajan toiminnan esto in vitro ei ollut kliinisesti merkittävää, kun ilmoitettu IC50-arvo oli > 10 µM. Kun arvo oli 10 µM, neratinibi näytti estävän rintasyövän resistenssiproteiinin (BCRP) effluksikuljettajan toimintaa, mikä voi olla kliinisesti merkittävää suolistossa saavutettavilla pitoisuuksilla (ks kohta Yhteisvaikutukset).
In vitro ‑kokeissa neratinibin osoitettiin olevan P-glykoproteiinieffluksikuljettajan estäjä, mikä vahvistettiin edelleen kliinisessä tutkimuksessa. Useat 240 mg:n annokset neratinibia suun kautta otettuina lisäävät digoksiinialtistusta (54 %:n kasvu Cmax-arvossa ja 32 %:n kasvu AUC-arvossa) vaikuttamatta sen munuaispuhdistumaan (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Neratinibi ei estänyt soluunoton kuljettajaproteiinien OATP1B1*1a, OATP1B3, OAT1, OAT3 ja OCT2 toimintaa, kun ilmoitetut IC50-arvot olivat > 10 µM. Neratinibi esti soluunoton OCT1-kuljettajaproteiinin toimintaa, kun IC50-arvo oli 2,9 µM.
Erityisryhmät
Munuaisten vajaatoiminta
Farmokokineettisiä tutkimuksia ei ole tehty potilailla, joilla on munuaisten vajaatoiminta tai jotka saavat dialyysihoitoa. Populaatiofarmakokineettinen mallinnus osoitti, että kreatiniinipuhdistuma ei selittänyt eroja potilaiden välillä. Siksi annoksen muuttamista ei suositella potilailla, joilla on lievä tai keskivaikea munuaisten vajaatoiminta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
Neratinibi metaboloituu kattavasti maksassa. Koehenkilöillä, joilla oli vaikea olemassa oleva vajaatoiminta (Child-Pughin luokka C) ilman syöpää, neratinibin puhdistuma väheni 36 prosenttia ja altistus neratinibille lisääntyi noin kolminkertaiseksi terveisiin vapaaehtoisiin verrattuna (ks. kohdat Annostus ja antotapa ja Vasta-aiheet).
Prekliiniset tiedot turvallisuudesta
Seuraavia haittavaikutuksia ei ole todettu kliinisissä tutkimuksissa, mutta niitä on todettu koe-eläimillä, jotka ovat saaneet hoitoannoksia vastaavia määriä lääkeainetta. Siksi haitoilla voi olla kliinistä merkitystä.
Karsinogeneesi ja mutageneesi
Nerlynx ei ollut klastogeeninen tai mutageeninen genotoksisuuden vakiotestisarjassa.
Neratinibin metaboliitit M3, M6, M7 ja M11 olivat negatiivisia genotoksisuuden in vitro -vakiotestisarjassa.
Kuusi kuukautta kestäneen transgeenisillä (Tg.rasH2) hiirillä tehdyn karsinogeenisuuden tutkimuksen ja kaksi vuotta kestäneen rotilla tehdyn tutkimuksen tulokset eivät osoittaneet merkkejä karsinogeenisesta potentiaalista.
Lisääntymismyrkyllisyys
Kaniineilla ei havaittu vaikutuksia paritteluun tai kykyyn tulla raskaaksi, mutta alkio- ja sikiökuolleisuutta sekä sikiön rakenteellisia epämuodostumia (esim. kupumainen pää, aivokammioiden laajeneminen, epämuotoiset etuaukileet sekä laajentuneet etu- ja/tai taka-aukileet) havaittiin annoksilla, joita voidaan pitää kliinisesti merkittävinä.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvien riskien arviointitutkimukset ovat osoittaneet, että neratinibilla on ilmeinen potentiaali olla hitaasti hajoava, biokertyvä ja myrkyllinen ympäristölle (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Mannitoli (E421)
Mikrokiteinen selluloosa
Krospovidoni
Povidoni
Kolloidinen vedetön piidioksidi
Magnesiumstearaatti
Tabletin päällyste
Polyvinyylialkoholi
Titaanidioksidi (E171)
Makrogoli
Talkki
Punainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Suojaa purkkia kosteudelta pitämällä se tiiviisti suljettuna.
Tämän lääkevalmisteen säilytyksessä ei tarvitse noudattaa erityisiä säilytyslämpötiloja.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NERLYNX tabletti, kalvopäällysteinen
40 mg (L:ei) 180 kpl (4384,19 €)
PF-selosteen tieto
Valkoinen pyöreä 60 ml:n purkki, joka on valmistettu suurtiheyspolyeteenistä (HDPE) ja jossa on polypropeenista valmistettu turvasuljin sekä foliotiiviste.
Jokaisessa purkissa on tablettien joukossa HDPE:stä valmistettu kuivatusainesäiliö, jossa on 1 g silikageeliä.
Yksi purkki sisältää 180 tablettia.
Valmisteen kuvaus:
Soikea punainen kalvopäällysteinen tabletti, jonka toisella puolella on merkintä ”W104”. Tabletin mitat ovat 10,5 mm x 4,3 mm ja paksuus 3,1 mm.
Käyttö- ja käsittelyohjeet
Tämä lääkevalmiste saattaa olla ympäristölle haitallinen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NERLYNX tabletti, kalvopäällysteinen
40 mg 180 kpl
- Ylempi erityiskorvaus (100 %). Neratinibi: Varhaisvaiheen hormonireseptori- ja HER2-positiivisen rintasyövän hoito erityisin edellytyksin (1536).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Neratinibi: Varhaisvaiheen hormonireseptori- ja HER2-positiivisen rintasyövän jatkettu liitännäishoito erityisin edellytyksin (3037).
ATC-koodi
L01EH02
Valmisteyhteenvedon muuttamispäivämäärä
22.05.2025
Yhteystiedot
c/o Pierre Fabre Dermo-Cosmétique Nordic A/S
Metsänneidonkuja 4 02130
Espoo
www.pierre-fabre.com
