XELJANZ depottabletti 11 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Lääkäri
Opas annostukseen, annosteluun, hoidon seurantaan ja haittavaikutusten hallintaan.
Potilas
Vaikuttavat aineet ja niiden määrät
Yksi 11 mg depottabletti sisältää tofasitinibisitraattia määrän, joka vastaa 11 mg tofasitinibia.
Apuaine, jonka vaikutus tunnetaan
Yksi depottabletti sisältää 152,23 mg sorbitolia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Depottabletti
Kliiniset tiedot
Käyttöaiheet
Nivelreuma
Tofasitinibi yhdessä metotreksaatin (MTX) kanssa on tarkoitettu kohtalaisen tai vaikean aktiivisen nivelreuman hoitoon aikuisille, jotka eivät ole saaneet riittävää vastetta yhdelle tai useammalle tautiprosessia hidastavalle reumalääkkeelle (DMARD) tai jotka eivät siedä niitä (ks. kohta Farmakodynamiikka). Tofasitinibi voidaan antaa monoterapiana potilaille, jotka eivät siedä metotreksaattia tai joille metotreksaattihoito ei ole tarkoituksenmukaista (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Nivelpsoriaasi
Tofasitinibi yhdessä metotreksaatin (MTX) kanssa on tarkoitettu aktiivisen nivelpsoriaasin hoitoon aikuisille, jotka eivät ole saaneet riittävää vastetta aiemmalle tautiprosessia hidastavalle reumalääkehoidolle (DMARD) tai jotka eivät ole sietäneet sellaista hoitoa (ks. kohta Farmakodynamiikka).
Selkärankareuma
Tofasitinibi on tarkoitettu aktiivisen selkärankareuman (ankyloiva spondyliitti, AS) hoitoon aikuisille, jotka eivät ole saaneet riittävää vastetta tavanomaiseen hoitoon.
Ehto
Hoito on aloitettava ja toteutettava käyttöaiheissa mainittujen sairauksien diagnosointiin ja hoitoon perehtyneen erikoislääkärin seurannassa.
Annostus ja antotapa
Hoito tulee aloittaa ja sitä tulee seurata tofasitinibin käyttöaiheiden mukaisten sairauksien diagnosointiin ja hoitoon perehtyneen erikoislääkärin valvonnassa.
Annostus
Nivelreuma, nivelpsoriaasi ja selkärankareuma
Suositusannos, jota ei pidä ylittää, on yksi 11 mg depottabletti kerran vuorokaudessa.
Annoksen muuttaminen ei ole tarpeen, jos valmistetta käytetään yhdessä MTX:n kanssa.
Tietoja siirtymisestä kalvopäällysteisistä tofasitinibitableteista tofasitinibi-depottabletteihin ja päinvastoin annetaan taulukossa 1.
Taulukko 1: Siirtyminen kalvopäällysteisistä tofasitinibitableteista tofasitinibi-depottabletteihin ja päinvastoin
Siirtyminen 5 mg:n kalvopäällysteisistä tofasitinibitableteista 11 mg:n tofasitinibi-depottabletteihin ja päinvastoina | Kahdesti vuorokaudessa otettavasta hoidosta 5 mg:n kalvopäällysteisillä tofasitinibitableteilla voidaan siirtyä kerran vuorokaudessa otettavaan 11 mg:n tofasitinibi-depottablettihoitoon ja päinvastoin seuraavana päivänä siitä, kun potilas on saanut kumman tahansa tabletin viimeisen annoksen. |
a Kohdassa Farmakokinetiikka verrataan depottabletin ja kalvopäällysteisen tabletin farmakokinetiikkaa. | |
Hoidon keskeyttäminen ja lopettaminen
Jos potilaalle kehittyy vakava infektio, tofasitinibihoito on keskeytettävä siihen saakka, kunnes infektio on saatu hallintaan.
Hoito voi olla tarpeen keskeyttää annosriippuvaisten laboratorioarvojen poikkeamien, kuten lymfopenian, neutropenian ja anemian, hoitamiseksi. Alla olevissa taulukoissa 2, 3 ja 4 on esitetty suositukset hoidon keskeyttämisestä tai lopettamisesta laboratorioarvojen poikkeamien vaikeusasteen perusteella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidon aloittamista ei suositella potilaille, joiden absoluuttinen lymfosyyttimäärä (B-Lymf) on alle 0,75 x 109/l.
Taulukko 2. Matala absoluuttinen lymfosyyttimäärä
Matala absoluuttinen lymfosyyttimäärä (B-Lymf) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
Laboratorioarvo (solumäärä x 109/l) | Suositus |
B-Lymf ≥ 0,75 | Annos pidetään ennallaan. |
B-Lymf 0,50–0,75 | Jos lymfosyyttimäärä pysyy pitkään tällä välillä (kaksi peräkkäistä arvoa tälle välille rutiinimäärityksessä), 11 mg tofasitinibi-depottablettihoito on keskeytettävä. Kun B-Lymf on yli 0,75, jatketaan kliinisesti tarkoituksenmukaista hoitoa. |
B-Lymf < 0,5 | Jos laboratorioarvo varmistuu 7 päivän kuluessa tehdyssä uusintamäärityksessä, hoito on lopetettava. |
Hoidon aloittamista ei suositella potilaille, joiden absoluuttinen neutrofiilien määrä (B-Neut) on alle 1,0 x 109/l.
Taulukko 3. Matala absoluuttinen neutrofiilien määrä
Matala absoluuttinen neutrofiilien määrä (B-Neut) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
Laboratorioarvo (solumäärä x 109/l) | Suositus |
B-Neut > 1,0 | Annos pidetään ennallaan. |
B-Neut 0,5–1,0 | Jos neutrofiilimäärä pysyy pitkään tällä välillä (kaksi peräkkäistä arvoa tälle välille rutiinimäärityksessä), 11 mg tofasitinibi-depottablettihoito on keskeytettävä. Kun B-Neut on yli 1,0, jatketaan kliinisesti tarkoituksenmukaista hoitoa. |
B-Neut < 0,5 | Jos laboratorioarvo varmistuu 7 päivän kuluessa tehdyssä uusintamäärityksessä, hoito on lopetettava. |
Hoidon aloittamista ei suositella potilaille, joiden hemoglobiiniarvo on alle 90 g/l.
Taulukko 4. Matala hemoglobiiniarvo
Matala hemoblogiiniarvo (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
Laboratorioarvo (g/l) | Suositus |
Laskenut ≤ 20 g/l lähtötasosta ja pitoisuus on ≥ 90 g/l | Annos pidetään ennallaan. |
Laskenut > 20 g/l lähtötasosta tai pitoisuus on < 80 g/l (varmistettu uusintamäärityksellä) | Hoito on keskeytettävä, kunnes hemoglobiiniarvo on korjautunut normaaliksi. |
Yhteisvaikutukset
Jos potilas käyttää voimakkaita sytokromin P450 (CYP) 3A4 estäjiä (esim. ketokonatsolia) tai jos potilas käyttää samanaikaisesti yhtä tai useampaa lääkevalmistetta, joista aiheutuu sekä CYP3A4:n toiminnan kohtalainen estyminen että CYP2C19:n toiminnan voimakas estyminen (esim. flukonatsoli), tofasitinibin kokonaisvuorokausiannos on pienennettävä puoleen seuraavasti (ks. kohta Yhteisvaikutukset):
- Tofasitinibi-depottablettiannos 11 mg kerran vuorokaudessa on pienennettävä annokseen 5 mg kerran vuorokaudessa kalvopäällysteisinä tabletteina.
Hoidon lopettaminen selkärankareumassa
Saatavilla olevat tiedot viittaavat siihen, että kliinistä paranemista on havaittavissa 16 viikon kuluessa tofasitinibihoidon aloittamisesta. Hoidon jatkamista on harkittava perusteellisesti, jos selkärankareumaa sairastavalla potilaalla ei havaita kliinistä paranemista tämän ajan kuluessa.
Erityisryhmät
Iäkkäät
65-vuotiaiden tai sitä vanhempien potilaiden annosta ei tarvitse muuttaa. 75-vuotiaista ja vanhemmista potilaista on vähän tietoja. Katso kohta Varoitukset ja käyttöön liittyvät varotoimet, Käyttö 65-vuotiaille ja sitä vanhemmille potilaille.
Maksan vajaatoiminta
Taulukko 5. Maksan vajaatoimintaa sairastavien potilaiden annoksen muuttaminen
Maksan vajaatoiminnan aste | Luokitus | Eri tablettivahvuuksien annoksen muuttaminen potilaalle, jolla on maksan vajaatoiminta |
Lievä | Child–Pugh A | Annosta ei tarvitse muuttaa. |
Keskivaikea | Child–Pugh B | Annos on pienennettävä yhteen 5 mg kalvopäällysteiseen tablettiin kerran vuorokaudessa, kun annos potilaille, joiden maksan toiminta on normaali, on yksi 11 mg depottabletti kerran vuorokaudessa (ks. kohta Farmakokinetiikka). |
Vaikea | Child–Pugh C | Tofasitinibia ei pidä käyttää potilaille, joilla on vaikea maksan vajaatoiminta (ks. kohta Vasta-aiheet). |
Munuaisten vajaatoiminta
Taulukko 6. Munuaisten vajaatoimintaa sairastavien potilaiden annoksen muuttaminen
Munuaisten vajaatoiminnan aste | Kreatiniinipuhdistuma | Eri tablettivahvuuksien annoksen muuttaminen potilaalle, jolla on munuaisten vajaatoiminta |
Lievä | 50–80 ml/min | Annosta ei tarvitse muuttaa. |
Keskivaikea | 30–49 ml/min | Annosta ei tarvitse muuttaa. |
Vaikea (mukaan lukien hemodialyysia saavat potilaat) | < 30 ml/min | Annos on pienennettävä yhteen 5 mg kalvopäällysteiseen tablettiin kerran vuorokaudessa, kun annos potilaille, joiden munuaisten toiminta on normaali, on yksi 11 mg depottabletti kerran vuorokaudessa (ks. kohta Farmakokinetiikka). Vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoitoa on jatkettava pienennetyllä annoksella myös hemodialyysin jälkeen (ks. kohta Farmakokinetiikka). |
Pediatriset potilaat
Tofasitinibin depotmuodon turvallisuutta ja tehoa lasten (0-vuotiaat – < 18-vuotiaat) hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suun kautta.
Tofasitinibi otetaan suun kautta ruokailun yhteydessä tai tyhjään mahaan.
11 mg tofasitinibi-depottabletit on otettava kokonaisina, jotta voidaan varmistua siitä, että potilas saa koko annoksen oikein. Depottabletteja ei saa murskata, jakaa tai pureskella.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Aktiivinen tuberkuloosi, vakavat infektiot, kuten sepsis tai opportunisti-infektiot (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa).
- Raskaus ja imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Tofasitinibia tulee käyttää seuraaville potilasryhmille vain, jos soveltuvia hoitovaihtoehtoja ei ole käytettävissä:
|
Käyttö 65-vuotiaille ja sitä vanhemmille potilaille
Tofasitinibin käyttöön 65-vuotiaille ja sitä vanhemmille potilaille liittyy vakavien infektioiden, sydäninfarktin, syövän ja kuolleisuuden (kaikki syyt) lisääntynyt riski. Näin ollen tofasitinibia tulisi käyttää näillä potilailla vain, jos soveltuvia hoitovaihtoehtoja ei ole (ks. lisätietoja jäljempänä kohdasta Varoitukset ja käyttöön liittyvät varotoimet ja kohdasta Farmakodynamiikka).
Samanaikainen käyttö muiden lääkehoitojen kanssa
Tofasitinibia ei ole tutkittu yhdessä biologisten lääkkeiden, kuten TNF:n estäjien, interleukiini-1R:n (IL-1R) estäjien, IL-6R:n estäjien, CD20-antigeenin monoklonaalisten vasta-aineiden, IL-17:n estäjien, IL-12/IL-23:n estäjien, anti-integriinien, selektiivisten kostimulaation modulaattorien ja voimakkaiden immunosuppressiivisten lääkeaineiden, kuten atsatiopriinin, 6-merkaptopuriinin, siklosporiinin ja takrolimuusin, kanssa. Näiden samanaikaista käyttöä pitää välttää johtuen voimistuneen immunosuppression ja lisääntyneen infektioriskin mahdollisuudesta.
Kliinisissä nivelreumatutkimuksissa esiintyi haittavaikutuksia enemmän käytettäessä tofasitinibia yhdistelmänä metotreksaatin kanssa kuin käytettäessä tofasitinibia monoterapiana.
Tofasitinibin käyttöä yhdistelmänä fosfodiesteraasi 4:n estäjien kanssa ei ole tutkittu tofasitinibia koskevissa kliinisissä lääketutkimuksissa.
Laskimotromboembolia
Tofasitinibia käyttävillä potilailla on havaittu vakavia laskimotromboembolioita, mukaan lukien keuhkoembolioita (KE), joista osa johti potilaan kuolemaan, kallonsisäisiä sinustrombooseja ja syviä laskimotukoksia (SLT) (ks. taulukko 8 kohdassa Haittavaikutukset). Myyntiluvan myöntämisen jälkeisessä satunnaistetussa turvallisuustutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä, tofasitinibilla havaittiin annosriippuvaisesti suurentunut laskimotromboembolian riski verrattuna TNF:n estäjiin (ks. kohdat Haittavaikutukset ja Farmakodynamiikka).
Tutkimuksessa tehtiin eksploratiivinen post hoc -analyysi potilaista, joilla oli tunnettuja laskimotromboembolian riskitekijöitä. Laskimotromboembolioita havaittiin yleisimmin tofasitinibihoitoa saaneilla potilailla, joilla 12 kuukauden hoidon jälkeen D-dimeeripitoisuus oli ≥ 2× ULN, kuin niillä, joiden D-dimeeripitoisuus oli < 2× ULN. TNF:n estäjähoitoa saaneilla potilailla tämä havainto ei ollut selkeä. Vähäinen laskimotromboemboliatapahtumien määrä ja rajoitettu D-dimeeritestien saatavuus (tutkittiin ainoastaan tutkimuksen alussa, 12 kuukauden kohdalla ja tutkimuksen lopussa) rajoittavat näiden tulosten tulkintaa. Potilailla, joilla ei ollut laskimotromboemboliaa tutkimuksen aikana, keskimääräiset D-dimeeritasot olivat merkittävästi alhaisempia 12 hoitokuukauden kohdalla verrattuna lähtötasoon kaikissa hoitohaaroissa. D-dimeeritasoja ≥ 2× ULN havaittiin kuitenkin 12 kuukauden kohdalla noin 30 %:lla potilaista, joilla ei ollut laskimotromboembolisia tapahtumia. Tämä osoittaa, ettei D-dimeeritesti ollut tässä tutkimuksessa kovin spesifinen.
Potilaille, joilla on merkittävien sydän- ja verisuonitapahtumien tai syövän riskitekijöitä (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet ”Merkittävät sydän- ja verisuonitapahtumat, mukaan lukien sydäninfarkti” ja ”Syövät ja lymfoproliferatiiviset sairaudet”), tulisi käyttää tofasitinibia vain, jos soveltuvia hoitovaihtoehtoja ei ole käytettävissä.
Tofasitinibin käytössä on noudatettava varovaisuutta, jos potilaalla on muita kuin merkittäviin sydän- ja verisuonitapahtumiin tai syöpään liittyviä laskimotromboembolian riskitekijöitä. Muita kuin merkittäviin sydän- ja verisuonitapahtumiin tai syöpään liittyviä laskimotromboembolian riskitekijöitä ovat aiempi laskimotromboembolia, potilaalle tehtävä suuri leikkaus, immobilisaatio, hormonaalisten yhdistelmäehkäisytablettien tai hormonikorvausvalmisteiden käyttö, periytyvä hyytymishäiriö. Potilaat on tutkittava säännöllisesti uudelleen tofasitinibihoidon aikana laskimotromboembolian riskin muutosten arvioimiseksi.
Harkitse D-dimeeritasojen testaamista noin 12 hoitokuukauden jälkeen nivelreumapotilailla, joilla on tunnettuja laskimotromboembolian riskitekijöitä. Jos D-dimeeritestitulos on ≥ 2× ULN, varmistu ennen päätöstä hoidon jatkamisesta, että kliiniset hyödyt ylittävät tofasitinibihoidon jatkamisen riskit.
Potilas, jolla on laskimotromboembolian merkkejä ja oireita, on viipymättä tutkittava, ja tofasitinibihoito on lopetettava sen annostuksesta tai käyttöaiheesta riippumatta.
Verkkokalvon laskimotukos
Tofasitinibihoitoa saaneilla potilailla on raportoitu verkkokalvon laskimotukoksia (ks. kohta Haittavaikutukset). Potilaita pitää neuvoa hakeutumaan viipymättä lääkäriin, jos heille ilmaantuu verkkokalvon laskimotukokseen viittaavia oireita.
Vakavat infektiot
Tofasitinibihoitoa saavilla potilailla on raportoitu vakavia ja toisinaan kuolemaan johtaneita bakteerien, mykobakteerien, invasiivisten sienten, virusten tai muiden opportunististen patogeenien aiheuttamia infektioita (ks. kohta Haittavaikutukset). Aasian maantieteellisellä alueella on suurempi opportunisti-infektioiden riski (ks. kohta Haittavaikutukset). Kortikosteroideja saavat nivelreumapotilaat saattavat olla alttiita infektioille.
Tofasitinibihoitoa ei pidä aloittaa, jos potilaalla on aktiivinen infektio, paikalliset infektiot mukaan lukien.
Hoidon riskit ja hyödyt pitää arvioida ennen tofasitinibihoidon aloittamista,
- jos potilaalla on toistuvia infektioita
- jos potilaalla on aiemmin ollut jokin vakava infektio tai opportunisti-infektio
- jos potilas on asunut tai matkustanut alueilla, joilla esiintyy endeemisiä mykooseja
- jos potilaalla on perussairauksia, joiden vuoksi hän voi olla alttiimpi infektioille.
Potilasta pitää seurata tarkoin tofasitinibihoidon aikana ja sen jälkeen infektioiden merkkien ja oireiden havaitsemiseksi. Hoito on keskeytettävä, jos potilaalle kehittyy vakava infektio, opportunisti-infektio tai sepsis. Jos potilaalle kehittyy tofasitinibihoidon aikana uusi infektio, hänelle on tehtävä viipymättä kattavat immuunipuutteisiin potilaisiin sovellettavat diagnostiset kokeet, hoito asianmukaisilla mikrobilääkkeillä on aloitettava ja potilaan tilaa on seurattava tarkoin.
Infektioiden ilmaantuvuus on iäkkäillä ja diabetespotilailla yleensä tavanomaista suurempi, joten iäkkäiden ja diabetespotilaiden hoidossa on noudatettava varovaisuutta (ks. kohta Haittavaikutukset). Tofasitinibihoitoa voidaan käyttää 65-vuotiaille ja sitä vanhemmille potilaille vain, jos muita soveltuvia hoitovaihtoehtoja ei ole käytettävissä (ks. kohta Farmakodynamiikka).
Infektioriski saattaa suurentua lymfopenian vaikeusasteen pahentuessa, joten potilaan yksilöllisen infektioriskin arvioinnissa pitää ottaa huomioon lymfosyyttimäärä. Lymfopeniaan liittyvät hoidon lopettamista ja lymfopenian seurantaa koskevat kriteerit esitetään kohdassa Annostus ja antotapa.
Tuberkuloosi
Hoidon riskit ja hyödyt pitää arvioida ennen tofasitinibihoidon aloittamista,
- jos potilas on altistunut tuberkuloosille
- jos potilas on asunut tai matkustanut alueilla, joilla esiintyy endeemistä tuberkuloosia.
Potilas on tutkittava ja testattava piilevän ja aktiivisen infektion toteamiseksi ennen tofasitinibihoidon aloittamista sekä soveltuvien ohjeiden mukaisesti hoidon aikana.
Piilevää tuberkuloosia sairastavat potilaat (positiivinen testitulos) on hoidettava tavanomaisella mykobakteerilääkityksellä ennen tofasitinibihoidon aloittamista.
Tuberkuloosilääkitystä on myös harkittava ennen tofasitinibihoidon aloittamista, jos potilaan testitulos on negatiivinen, mutta potilaalla on aiemmin ollut piilevä tai aktiivinen tuberkuloosi eikä sen riittävästä hoidosta voida varmistua, tai jos potilaan testitulos on negatiivinen, mutta hänellä on tuberkuloosi-infektion riskitekijöitä. Tuberkuloosin hoitoon perehtyneen terveydenhuollon ammattilaisen konsultointia suositellaan päätöksenteon tueksi, kun selvitetään tuberkuloosihoidon tarkoituksenmukaisuutta yksittäiselle potilaalle. Potilasta on seurattava tarkoin tuberkuloosin merkkien ja oireiden kehittymisen havaitsemiseksi. Tämä koskee myös potilaita, joilla piilevän tuberkuloosin testitulos ennen hoidon aloittamista oli negatiivinen.
Virusten uudelleenaktivoituminen
Tofasitinibia saaneilla potilailla on havaittu virusten uudelleenaktivoitumista ja herpes-virusten (esim. Herpes zoster) uudelleenaktivoitumista (ks. kohta Haittavaikutukset).
Vyöruusun (Herpes zoster) riski vaikuttaa olevan muita suurempi tofasitinibihoitoa saaneilla
- japanilaisilla tai korealaisilla potilailla
- potilailla, joiden B-Lymf on alle 1,0 x 109/l (ks. kohta Annostus ja antotapa)
- potilailla, jotka ovat pitkään sairastaneet nivelreumaa ja jotka ovat aiemmin saaneet kahta tai useampaa tautiprosessia hidastavaa biologista reumalääkettä (bDMARD)
- potilailla, joiden annostus on 10 mg kaksi kertaa vuorokaudessa.
Tofasitinibin vaikutusta kroonisen virushepatiitin uudelleenaktivoitumiseen ei tiedetä. Kliinisiin tutkimuksiin ei otettu mukaan potilaita, jotka osoittautuivat seulonnassa hepatiitti B- tai C-viruksen osalta positiivisiksi. Virushepatiitin seulonta pitää tehdä kliinisten ohjeistojen mukaisesti ennen tofasitinibihoidon aloittamista.
Ainakin yksi vahvistettu etenevä multifokaalinen leukoenkefalopatia (PML) -tapaus on raportoitu nivelreumapotilailla, jotka ovat saaneet tofasitinibia valmisteen markkinoille tulon jälkeen. PML voi johtaa kuolemaan ja se on otettava huomioon tehtäessä erotusdiagnoosia immunosuppressiopotilailla, joilla on uusia tai pahenevia neurologisia oireita.
Merkittävät sydän- ja verisuonitapahtumat (mukaan lukien sydäninfarkti)
Tofasitinibia käyttävillä potilailla on todettu merkittäviä sydän- ja verisuonitapahtumia (MACE).
Myyntiluvan myöntämisen jälkeen tehdyssä valmisteen turvallisuutta koskeneessa satunnaistetussa tutkimuksessa tutkittiin vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Tutkimuksessa sydäninfarktien ilmaantuvuus lisääntyi tofasitinibilla hoidetuilla potilailla TNF:n estäjillä hoidettuihin potilaisiin verrattuna (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). 65-vuotiaille ja sitä vanhemmille potilaille, pitkään tupakoineille tai aiemmin pitkään tupakoineille sekä potilaille, joilla on aiemmin ollut ateroskleroottinen valtimotauti tai joilla on muita sydän- ja verisuonitapahtumien riskitekijöitä, tofasitinibia tulisi käyttää vain, jos soveltuvia hoitovaihtoehtoja ei ole käytettävissä (ks. kohta Farmakodynamiikka).
Syövät ja lymfoproliferatiiviset sairaudet
Tofasitinibi voi vaikuttaa elimistön syöpää torjuviin puolustusmekanismeihin
Myyntiluvan myöntämisen jälkeen tehdyssä valmisteen turvallisuutta koskeneessa satunnaistetussa tutkimuksessa tutkittiin vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Tutkimuksessa tofasitinibilla hoidetuilla potilailla syövän (erityisesti ei-melanoottisen ihosyövän, keuhkosyövän ja lymfoomien) ilmaantuvuus lisääntyi TNF:n estäjillä hoidettuihin potilaisiin verrattuna (ks. kohdat Haittavaikutukset ja Farmakodynamiikka).
Tofasitinibilla hoidetuilla potilailla on todettu ei-melanoottista ihosyöpää, keuhkosyöpää ja lymfoomia myös muissa kliinisissä tutkimuksissa ja valmisteen markkinoille tulon jälkeen.
Kliinisissä tutkimuksissa ja valmisteen markkinoille tulon jälkeen tofasitinibilla hoidetuilla potilailla on havaittu myös muita syöpiä, muun muassa rintasyöpää, melanoomaa, eturauhassyöpää ja haimasyöpää.
65-vuotiaille ja sitä vanhemmille potilaille, pitkään tupakoineille tai aiemmin pitkään tupakoineille sekä potilaille, joilla on muita syöpään liittyviä riskitekijöitä (aktiivinen tai aiemmin sairastettu syöpä, muu kuin onnistuneesti hoidettu ei-melanoottinen ihosyöpä), tofasitinibia tulisi käyttää vain, jos soveltuvia hoitovaihtoehtoja ei ole (ks. kohta Farmakodynamiikka).
Säännöllistä ihon tutkimista suositellaan kaikille potilaille, erityisesti niille, joilla on tavanomaista suurempi ihosyöpäriski, (ks. taulukko 7 kohdassa Haittavaikutukset).
Interstitiaalinen keuhkosairaus
Varovaisuutta suositellaan myös kroonista keuhkosairautta sairastavien tai aiemmin sairastaneiden potilaiden hoidossa, koska he saattavat olla alttiimpia infektioille. Tofasitinibihoitoa saaneilla potilailla on raportoitu kliinisissä nivelreumatutkimuksissa ja valmisteen markkinoille tulon jälkeen interstitiaalista keuhkosairautta (joka on toisinaan johtanut potilaan kuolemaan), mutta Janus-kinaasi (JAK) inhibition merkitystä näissä tapahtumissa ei tiedetä. Aasialaisilla nivelreumapotilailla tiedetään olevan tavanomaista suurempi interstitiaalisen keuhkosairauden riski, joten tämän potilasryhmän hoidossa on noudatettava varovaisuutta.
Maha-suolikanavan perforaatio
Kliinisissä tutkimuksissa on raportoitu maha-suolikanavan perforaatioita, mutta Janus-kinaasin (JAK) eston merkitystä näiden tapausten ilmaantumiseen ei kuitenkaan tiedetä. Tofasitinibia on käytettävä varoen, jos potilaalla voi olla suurentunut maha-suolikanavan perforaatioiden riski (esim. divertikuliittia aiemmin sairastaneet potilaat, kortikosteroideja ja/tai ei-steroidaalisia tulehduskipulääkkeitä samanaikaisesti käyttävät potilaat). Jos potilaalle ilmaantuu uusia vatsaoireita ja -löydöksiä, potilas on tutkittava viipymättä, jotta maha-suolikanavan perforaatio voidaan todeta varhaisvaiheessa.
Luunmurtumat
Tofasitinibihoitoa saaneilla potilailla on havaittu luunmurtumia.
Tofasitinibin käytössä potilaille, joilla on tunnettuja luunmurtumien riskitekijöitä, kuten iäkkäille potilaille, naispotilaille sekä kortikosteroideja käyttäville potilaille, on noudatettava varovaisuutta käyttöaiheesta ja annostuksesta riippumatta.
Maksaentsyymit
Joillakin potilailla havaittiin tofasitinibihoidon yhteydessä tavanomaista yleisemmin maksaentsyymipitoisuuksien kohoamista (ks. kohta Haittavaikutukset maksaentsyymikokeet). Tofasitinibihoidon aloittamista on harkittava tarkkaan, jos potilaan alaniiniaminotransferaasi- (ALAT) tai aspartaattiaminotransferaasipitoisuus (ASAT) on kohonnut, sekä erityisesti silloin, kun tofasitinibihoito on aloitettu yhdessä potentiaalisten maksatoksisten lääkevalmisteiden, kuten MTX:n, kanssa. Hoidon aloittamisen jälkeen suositellaan seuraamaan maksa-arvoja säännöllisesti sekä tutkimaan kohonneiden maksaentsyymipitoisuuksien mahdollinen syy, jotta mahdollinen lääkkeestä aiheutuva maksavaurio tunnistetaan. Jos lääkkeen epäillään aiheuttaneen maksavaurion, tofasitinibin anto on keskeytettävä, kunnes tämä diagnoosi on suljettu pois.
Yliherkkyys
Myyntiin tulon jälkeen on ilmoitettu yliherkkyystapauksista, jotka liittyvät tofasitinibin antoon. Allergisia reaktioita kuten angioedeema ja urtikaria; vakavia reaktioita on esiintynyt. Jos potilaalle kehittyy vakava allerginen tai anafylaktinen reaktio, tofasitinibihoito on heti keskeytettävä.
Laboratoriokokeiden tulokset
Lymfosyytit
Tofasitinibihoitoon liittyi suurentunut lymfopenian ilmaantuvuus verrattuna lumelääkkeeseen. Lymfosyyttimäärään alle 0,75 x 109/l liittyi suurentunut vakavien infektioiden ilmaantuvuus. Tofasitinibihoidon aloittamista tai jatkamista ei suositella, jos potilaan lymfosyyttimäärä on varmistetusti alle 0,75 x 109/l. Lymfosyyttimäärä on määritettävä lähtötilanteessa, ja sen jälkeen sitä on seurattava kolmen kuukauden välein. Lymfosyyttimäärän perusteella suositellut muutokset hoitoon, ks. kohta Annostus ja antotapa.
Neutrofiilit
Tofasitinibihoitoon liittyi suurentunut neutropenian (neutrofiilejä alle 2,0 x 109/l) ilmaantuvuus verrattuna lumelääkkeeseen. Tofasitinibihoidon aloittamista ei suositella, jos potilaan B-Neut on alle 1,0 x 109/l. B-Neut on määritettävä lähtötilanteessa ja uudelleen 4−8 viikon kuluttua hoidon aloittamisesta sekä tämän jälkeen 3 kuukauden välein. Neutrofiilien absoluuttisen määrän perusteella suositellut muutokset hoitoon, ks. kohta Annostus ja antotapa.
Hemoglobiini
Tofasitinibihoidon on todettu laskevan hemoglobiiniarvoja. Tofasitinibihoidon aloittamista ei suositella, jos potilaan hemoglobiiniarvon on alle 90 g/l. Hemoglobiiniarvo on määritettävä lähtötilanteessa ja uudelleen 4–8 viikon kuluttua hoidon aloittamisesta sekä tämän jälkeen 3 kuukauden välein. Hemoglobiiniarvon perusteella suositellut muutokset hoitoon, ks. kohta Annostus ja antotapa.
Lipidien seuranta
Tofasitinibihoitoon liittyi lipidien, kuten kokonaiskolesteroli-, LDL-kolesteroli- ja HDL-kolesterolipitoisuuden, suurenemista. Suurimmat poikkeamat havaittiin yleensä 6 viikon kuluessa hoidon aloittamisesta. Lipidit on määritettävä 8 viikon kuluttua tofasitinibihoidon aloittamisesta. Potilaan hyperlipidemia on hoidettava kliinisten suositusten mukaisesti. Tofasitinibiin liittyvä kohonnut kokonais- ja LDL-kolesterolipitoisuus voidaan saada pienennettyä hoitoa edeltävälle tasolle statiinihoidolla.
Hypoglykemia diabetekseen hoitoa saavilla potilailla
Diabeteslääkkeitä käyttävillä potilailla on raportoitu tofasitinibin käytön aloittamisen jälkeen hypoglykemiaa. Jos hypoglykemia ilmenee, diabeteslääkkeen annosta voi olla tarpeen muuttaa.
Rokotukset
Kaikkien potilaiden rokotukset suositellaan päivittämään ajan tasalle voimassa olevien rokotussuositusten mukaisesti ennen tofasitinibihoidon aloittamista. Elävien rokotteiden antamista tofasitinibihoidon aikana ei suositella. Päätettäessä elävien rokotteiden antamisesta ennen tofasitinibihoidon aloittamista on otettava huomioon kyseisen potilaan olemassa oleva immunosuppressio.
Profylaktisen zoster-rokotteen antoa on harkittava rokotussuositusten mukaisesti. Erityistä huomiota on kiinnitettävä potilaisiin, jotka ovat pitkään sairastaneet nivelreumaa, ja jotka ovat aiemmin saaneet kahta tai useampaa tautiprosessia hidastavaa biologista reumalääkettä (bDMARD). Jos annetaan elävää zoster-rokotetta, sitä voidaan antaa vain potilaille, joiden tiedetään sairastaneen vesirokon tai joiden tiedetään olevan vesirokkovirukselle (varicella zoster ‑virus, VZV) seropositiivisia. Jos vesirokon sairastaminen ei ole varmuudella todennettavissa, suositellaan VZV-vasta-aineiden testaamista.
Rokotus elävillä rokotteilla on annettava vähintään 2 viikkoa, mutta mieluiten 4 viikkoa, ennen kuin hoito tofasitinibilla aloitetaan tai voimassaolevien immuniteettia muuntavia lääkevalmisteita koskevien rokotusohjeiden mukaisesti. Tietoja elävien rokotteiden välityksellä saaduista sekundaarisista infektioista tofasitinibia saavilla potilailla ei ole saatavilla.
Maha-suolikanavan tukos käytettäessä lääkevalmisteita, joiden depotmuoto pysyy muuttumattomana
Varovaisuutta on noudatettava tofasitinibi-depottablettien annossa potilaille, joilla on olemassa oleva vaikea (patologinen tai hoitoperäinen) ahtauma maha-suolikanavassa. Joissakin harvinaisissa tapauksissa on ilmoitettu tukosoireita, kun potilas, jolla tiedetään olevan striktuuroita, on ottanut muita lääkevalmisteita, joiden depotmuoto pysyy muuttumattomana.
Lääkevalmisteen sisältämät apuaineet
Tofasitinibi-depottabletit sisältävät sorbitolia. Sorbitolia (tai fruktoosia) sisältävien muiden valmisteiden samanaikaisen annon sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava.
Suun kautta otettavien lääkevalmisteiden sorbitoli saattaa vaikuttaa muiden suun kautta otettavien lääkkeiden biologiseen hyötyosuuteen.
Yhteisvaikutukset
Muiden lääkevalmisteiden mahdollinen vaikutus tofasitinibin farmakokinetiikkaan
Tofasitinibi metaboloituu CYP3A4-entsyymin välityksellä, joten yhteisvaikutukset CYP3A4-entsyymiä estävien tai indusoivien lääkevalmisteiden kanssa ovat todennäköisiä. Tofasitinibialtistus suurenee, kun sitä käytetään yhdessä voimakkaiden CYP3A4:n estäjien (esim. ketokonatsolin) kanssa tai kun yhden tai useamman lääkevalmisteen samanaikainen käyttö aiheuttaa CYP3A4:n kohtalaisen estymisen ja CYP2C19:n voimakkaan estymisen (esim. flukonatsoli) (ks. kohta Annostus ja antotapa).
Tofasitinibialtistus vähenee, jos samaan aikaan annetaan voimakkaita CYP:n induktoreja (esim. rifampisiinia). Pelkät CYP2C19:n estäjät tai P-glykoproteiinin estäjät eivät todennäköisesti muuta tofasitinibin farmakokinetiikkaa merkittävästi.
Ketokonatsolin (voimakas CYP3A4:n estäjä), flukonatsolin (kohtalainen CYP3A4:n ja voimakas CYP2C19:n estäjä), takrolimuusin (heikko CYP3A4:n estäjä) ja siklosporiinin (kohtalainen CYP3A4:n estäjä) samanaikainen käyttö suurensi tofasitinibin AUC-arvoa. Rifampisiini (voimakas CYP:n induktori) puolestaan pienensi tofasitinibin AUC-arvoa. Tofasitinibin samanaikainen käyttö voimakkaiden CYP:n induktorien (esim. rifampisiinin) kanssa saattaa johtaa kliinisen vasteen häviämiseen tai heikkenemiseen (ks. kuva 1). Voimakkaiden CYP3A4:n induktorien ja tofasitinibin samanaikaista käyttöä ei suositella. Ketokonatsolin ja flukonatsolin samanaikainen käyttö suurensi tofasitinibin Cmax-arvoa, kun taas takrolimuusi, siklosporiini ja rifampisiini pienensivät tofasitinibin Cmax-arvoa. Metotreksaattiannosten 15–25 mg samanaikainen käyttö kerran viikossa ei vaikuttanut nivelreumapotilailla tofasitinibin farmakokinetiikkaan (ks. kuva 1).
Kuva 1. Muiden lääkevalmisteiden vaikutus tofasitinibin farmakokinetiikkaan
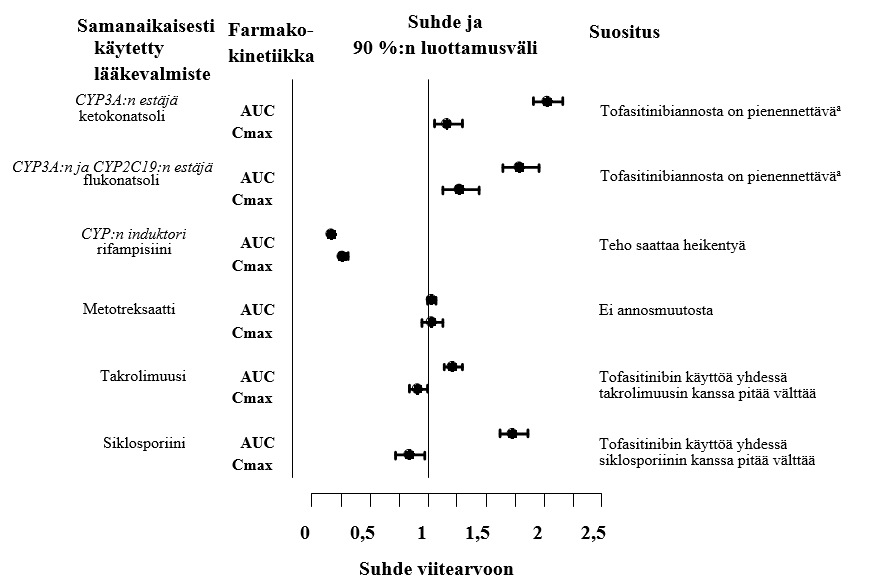
Huom.: Vertailuryhmä sai pelkästään tofasitinibia.
a Tofasitinibiannos 11 mg (depottablettina) kerran vuorokaudessa on pienennettävä annokseen 5 mg (kalvopäällysteisinä tabletteina) kerran vuorokaudessa (ks. kohta Annostus ja antotapa).
Tofasitinibin mahdollinen vaikutus muiden lääkevalmisteiden farmakokinetiikkaan
Tofasitinibin samanaikainen käyttö ei vaikuttanut terveillä vapaaehtoisilla naisilla ehkäisytablettien, levonorgestreelin ja etinyyliestradiolin, farmakokinetiikkaan.
Tofasitinibin samanaikainen käyttö metotreksaattiannosten 15–25 mg kerran viikossa kanssa pienensi nivelreumapotilailla metotreksaatin AUC-arvoa 10 % ja huippupitoisuutta (Cmax) 13 %. Metotreksaattialtistus ei pienene siinä määrin, että se edellyttäisi muutoksia metotreksaatin yksilölliseen annostukseen.
Raskaus ja imetys
Raskaus
Tofasitinibin käytöstä raskaana oleville naisille ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia. Tofasitinibin on osoitettu olevan teratogeeninen rotilla ja kaniineilla, ja sen on osoitettu vaikuttavan synnytykseen sekä peri-/postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varotoimenpiteenä tofasitinibin käyttö raskauden aikana on vasta-aiheista (ks. kohta Vasta-aiheet).
Naiset, jotka voivat tulla raskaaksi/raskauden ehkäisy naisilla
Naisia, jotka voivat tulla raskaaksi, pitää neuvoa käyttämään tehokasta ehkäisymenetelmää tofasitinibihoidon aikana ja vähintään neljä viikkoa viimeisen annoksen jälkeen.
Imetys
Julkaistujen tietojen perusteella tofasitinibi erittyy ihmisen rintamaitoon. Tofasitinibin vaikutuksia imetettävään vauvaan ei julkaistusta kirjallisuudesta ja valmisteen markkinoille tulon jälkeen saatujen tietojen perusteella tunneta, ja tiedot rajoittuvat pieneen lukumäärään tapauksia, joissa haittavaikutuksiin ei liittynyt syy-yhteyttä. Riskiä imetettävälle lapselle ei voida sulkea pois. Varotoimenpiteenä tofasitinibin käyttö imetyksen aikana on vasta-aiheista (ks. kohta Vasta-aiheet).
Hedelmällisyys
Muodollisia tutkimuksia mahdollisista vaikutuksista ihmisen hedelmällisyyteen ei ole tehty. Tofasitinibi heikensi naarasrottien, mutta ei urosrottien, hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tofasitinibilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Nivelreuma
Yleisimpiä vakavia haittavaikutuksia olivat vakavat infektiot (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Pitkäaikaisturvallisuutta koskeneessa koko altistetussa potilasjoukossa tofasitinibihoidon yhteydessä yleisimmin raportoituja vakavia infektioita ovat olleet keuhkokuume (1,7 %), vyöruusu (Herpes zoster) (0,6 %), virtsatieinfektiot (0,4 %), selluliitti (0,4 %), divertikuliitti (0,3 %) ja umpilisäketulehdus (0,2 %). Tofasitinibihoidon yhteydessä raportoituja opportunisti-infektioita ovat olleet tuberkuloosi ja muut mykobakteeri-infektiot, Cryptococcus-infektiot, histoplasmoosi, ruokatorven kandidiaasi, usean dermatomin alueella esiintyvä vyöruusu (Herpes zoster), sytomegalovirusinfektio, BK-virusinfektio ja listerioosi. Joidenkin potilaiden tautimuoto on ollut pikemminkin disseminoitunut kuin paikallinen. Muita vakavia infektioita, joita ei ole raportoitu kliinisissä tutkimuksissa, saattaa myös esiintyä (esim. koksidioidomykoosia).
Kaksoissokkoutettujen, lumelääke- tai metotreksaattikontrolloitujen kliinisten tutkimusten kolmen ensimmäisen kuukauden aikana yleisimmin raportoituja haittavaikutuksia olivat päänsärky (3,9 %), ylähengitysteiden infektiot (3,8 %), ripuli (2,9 %), pahoinvointi (2,7 %) ja hypertensio (2,2 %).
Kaksoissokkoutettujen lume- tai metotreksaattikontrolloitujen tutkimusten kolmen ensimmäisen kuukauden aikana hoidon haittavaikutusten vuoksi keskeyttäneiden potilaiden osuus oli 3,8 % tofasitinibihoitoa saaneista potilaista. Yleisimpiä hoidon keskeyttämiseen johtaneita infektioita kontrolloitujen kliinisten tutkimusten kolmen ensimmäisen kuukauden aikana olivat vyöruusu (Herpes zoster) (0,19 %) ja keuhkokuume (0,15 %).
Nivelpsoriaasi
Kaiken kaikkiaan aktiivista nivelpsoriaasia sairastaneiden tofasitinibihoitoa saaneiden potilaiden turvallisuusprofiili oli yhdenmukainen tofasitinibihoitoa saaneiden nivelreumapotilaiden turvallisuusprofiilin kanssa.
Selkärankareuma
Kaiken kaikkiaan aktiivista selkärankareumaa sairastaneiden tofasitinibihoitoa saaneiden potilaiden turvallisuusprofiili oli yhdenmukainen tofasitinibihoitoa saaneiden nivelreumapotilaiden turvallisuusprofiilin kanssa.
Haittavaikutustaulukko
Seuraavassa taulukossa luetellut haittavaikutukset ovat nivelreuma-, nivelpsoriaasi- ja selkärankareumapotilaille sekä haavaista paksusuolitulehdusta sairastaville potilaille tehdyistä kliinisistä tutkimuksista, ja ne on esitetty elinjärjestelmäluokittain (System Organ Class = SOC) ja esiintyvyyden mukaan, ja ne on määritelty seuraavan esitystavan mukaisesti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), hyvin harvinaiset (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutusten vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 7. Haittavaikutukset
| Elinjärjestelmäluokka | Yleiset ≥ 1/100, < 1/10 | Melko harvinaiset ≥ 1/1 000, < 1/100 | Harvinaiset ≥ 1/10 000, < 1/1 000 | Hyvin harvinaiset < 1/10 000 | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
| Infektiot | Keuhkokuume Influenssa Vyöruusu (Herpes zoster) Virtsatieinfektio Sinuiitti Keuhkoputki-tulehdus Nasofaryngiitti Nielutulehdus | Tuberkuloosi Divertikuliitti Pyelonefriitti Selluliitti Yskänrokko (Herpes simplex) Virusperäinen gastroenteriitti Virusinfektio | Sepsis Urosepsis Disseminoitunut tuberkuloosi Bakteremia Pneumocystis jirovecii ‑keuhkokuume Pneumokokki-keuhkokuume Bakteerikeuhko-kuume Sytomegalovirus-infektio Bakteeriperäinen artriitti | Keskushermoston tuberkuloosi Kryptokokkimeningiitti Nekrotisoiva faskiitti Enkefaliitti Stafylokokki-bakteremia Mycobacterium avium ‑kompleksi-infektio Atyyppinen mykobakteeri-infektio | |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Keuhkosyöpä Ei-melanoottiset ihosyövät | Lymfooma | |||
| Veri ja imukudos | Lymfopenia Anemia | Leukopenia Neutropenia | |||
| Immuunijärjestelmä | Yliherkkyys* Angioedeema* Urtikaria* | ||||
| Aineenvaihdunta ja ravitsemus | Dyslipidemia Hyperlipidemia Elimistön kuivuminen | ||||
| Psyykkiset häiriöt | Unettomuus | ||||
| Hermosto | Päänsärky | Parestesiat | |||
| Sydän | Sydäninfarkti | ||||
| Verisuonisto | Hypertensio | Laskimo-tromboembolia** | |||
| Hengityselimet, rintakehä ja välikarsina | Yskä | Hengenahdistus Nenän sivuonteloiden tukkoisuus | |||
| Ruoansulatuselimistö | Vatsakipu Oksentelu Ripuli Pahoinvointi Gastriitti Dyspepsia | ||||
| Maksa ja sappi | Rasvamaksa Suurentunut maksaentsyymi-pitoisuus Suurentunut transaminaasi-pitoisuus Suurentunut gammaglutamyyli-transferaasipitoisuus | Poikkeavat tulokset maksan toimintakokeissa | |||
| Iho ja ihonalainen kudos | Ihottuma Akne | Eryteema Kutina | |||
| Luusto, lihakset ja sidekudos | Nivelkipu | Nivelten turpoaminen Jännetulehdus | Tuki- ja liikuntaelimistön kipu | ||
| Yleisoireet ja antopaikassa todettavat haitat | Raajojen turvotus | Kuume Uupumus | |||
| Tutkimukset | Suurentunut veren kreatiinikinaasi-pitoisuus | Suurentunut veren kreatiniinipitoisuus Suurentunut veren kolesterolipitoisuus Suurentunut LDL-pitoisuus Painonnousu | |||
| Vammat ja myrkytykset | Nivelsiteen nyrjähdys Lihasvenähdys |
* Spontaanista haittavaikutusraportoinnista saatu tieto
** Laskimotromboembolia sisältää keuhkoembolian, syvän laskimotukoksen, verkkokalvon laskimotukoksen ja kallonsisäisen sinustromboosin.
Valikoitujen haittavaikutusten kuvaus
Laskimotromboembolia
Nivelreuma
Laajassa (N = 4 362), satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuustutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Siinä havaittiin, että TNF:n estäjiin verrattuna tofasitinibihoitoa saaneilla potilailla laskimotromboembolian ilmaantuvuus oli suurempi ja annosriippuvainen (ks. kohta Farmakodynamiikka). Valtaosa näistä tapahtumista oli vakavia, ja osa johti potilaan kuolemaan. Keuhkoembolioitten ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,17 (0,08–0,33), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,50 (0,32–0,74) ja TNF:n estäjiä saaneilla 0,06 (0,01–0,17) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden. Riskitiheyksien suhde (hazard ratio, HR) keuhkoembolian suhteen oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 2,93 (0,79–10,83) ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 8,26 (2,49–27,43) (ks. kohta Farmakodynamiikka) verrattuna TNF:n estäjiin. Tofasitinibihoitoa saaneista potilaista, joilla todettiin keuhkoembolia, suurimmalla osalla (97 %) oli laskimotromboembolian riskitekijöitä.
Selkärankareuma
Yhdistetyissä vaiheen 2 ja vaiheen 3 satunnaistetuissa kontrolloiduissa kliinisissä tutkimuksissa 420 potilaalla (seuranta 233 potilasvuotta), jotka saivat tofasitinibia enimmillään 48 viikon ajan, ei havaittu laskimotromboemboliatapahtumia.
Kaikki infektiot
Nivelreuma
Kontrolloiduissa vaiheen 3 kliinisissä tutkimuksissa 0–3 kuukauden aikana infektioiden esiintyvyys oli tofasitinibimonoterapiaa kalvopäällysteisillä tableteilla 5 mg kaksi kertaa vuorokaudessa (yhteensä 616 potilasta) saaneilla potilailla 16,2 % (100 potilasta) ja 10 mg kaksi kertaa vuorokaudessa (yhteensä 642 potilasta) saaneilla potilailla 17,9 % (115 potilasta) verrattuna 18,9 %:iin (23 potilasta) lumeryhmässä (yhteensä 122 potilasta). Kontrolloiduissa vaiheen 3 kliinisissä tutkimuksissa, joissa peruslääkityksenä oli tautiprosessia hidastava reumalääkehoito (DMARD), 0–3 kuukauden aikana infektioiden esiintyvyys oli tofasitinibia 5 mg kaksi kertaa vuorokaudessa ja DMARD-hoitoa saaneilla potilailla (yhteensä 973 potilasta) 21,3 % (207 potilasta), ja tofasitinibia 10 mg kaksi kertaa vuorokaudessa ja DMARD-hoitoa saaneilla potilailla (yhteensä 969 potilasta) 21,8 % (211 potilasta) verrattuna 18,4 %:iin (103 potilasta) lumevalmisteen ja DMARD-hoidon yhdistelmää saaneessa ryhmässä (yhteensä 559 potilasta).
Yleisimmin raportoituja infektioita olivat ylähengitysteiden infektiot (3,7 %) ja nasofaryngiitti (3,2 %).
Pitkäaikaisen turvallisuuden selvittämisessä mukana olleilla kaikilla altistetuilla potilailla (yhteensä 4 867 potilasta) infektioiden kokonaisilmaantumistiheys tofasitinibihoidon yhteydessä oli 46,1 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden (5 mg kaksi kertaa vuorokaudessa saaneilla 43,8 potilasta, joilla oli tapahtumia, ja 10 mg kaksi kertaa vuorokaudessa saaneilla vastaavasti 47,2). Monoterapiaa 5 mg kaksi kertaa vuorokaudessa saaneilla potilailla ilmaantumistiheys oli 48,9 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden, ja 10 mg kaksi kertaa vuorokaudessa saaneilla vastaavasti 41,9 (yhteensä 1 750 potilasta). Yhdistelmähoitona DMARD-lääkkeitä saaneet potilaat: 5 mg kaksi kertaa vuorokaudessa saaneiden potilaiden ilmaantumistiheys oli 41,0 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden ja 10 mg kaksi kertaa vuorokaudessa saaneilla vastaavasti 50,3 (yhteensä 3 117 potilasta).
Selkärankareuma
Yhdistetyissä vaiheen 2 ja vaiheen 3 kliinisissä tutkimuksissa infektioiden esiintyvyys enimmillään 16 viikon pituisen lumekontrolloidun jakson aikana oli tofasitinibia 5 mg kaksi kertaa vuorokaudessa saaneessa ryhmässä (185 potilasta) 27,6 % ja lumeryhmässä (187 potilasta) 23,0 %. Yhdistetyissä vaiheen 2 ja vaiheen 3 kliinisissä tutkimuksissa 5 mg tofasitinibia kaksi kertaa vuorokaudessa enimmillään 48 viikon ajan saaneilla 316 potilaalla infektioiden esiintyvyys oli 35,1 %.
Vakavat infektiot
Nivelreuma
6 kuukautta ja 24 kuukautta kestäneissä kontrolloiduissa kliinisissä tutkimuksissa tofasitinibimonoterapiaa 5 mg kaksi kertaa vuorokaudessa saaneessa ryhmässä vakavien infektioiden määrä oli 1,7 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden. Tofasitinibimonoterapiaa 10 mg kaksi kertaa vuorokaudessa saaneessa ryhmässä määrä oli 1,6 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden, vastaavasti lumeryhmässä 0 ja metotreksaattiryhmässä 1,9.
6, 12 tai 24 kuukautta kestäneissä tutkimuksissa tofasitinibia 5 mg kaksi kertaa vuorokaudessa yhdistelmänä DMARD-hoidon kanssa saaneilla potilailla vakavien infektioiden määrä oli 3,6 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden, tofasitinibia 10 mg kaksi kertaa vuorokaudessa yhdistelmänä DMARD-hoidon kanssa saaneilla potilailla vastaavasti 3,4 ja lumelääkettä yhdistelmänä DMARD-hoidon kanssa saaneilla potilailla 1,7.
Pitkäaikaisen turvallisuuden selvittämisessä mukana olleilla kaikilla altistetuilla potilailla vakavien infektioiden kokonaisilmaantumistiheys oli tofasitinibia 5 mg kaksi kertaa vuorokaudessa saaneilla 2,4 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden ja tofasitinibia 10 mg kaksi kertaa vuorokaudessa saaneilla vastaavasti 3,0. Yleisimpiä vakavia infektioita olivat mm. keuhkokuume, vyöruusu (Herpes zoster), virtsatieinfektio, selluliitti, gastroenteriitti ja divertikuliitti. Opportunisti-infektioita on raportoitu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Laajassa (N = 4 362), satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuustutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Siinä havaittiin, että TNF:n estäjiin verrattuna tofasitinibihoitoa saaneilla potilailla vakavien infektioiden ilmaantuvuus oli suurempi ja annosriippuvainen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vakavien infektioiden ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 2,86 (2,41–3,37), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 3,64 (3,11–4,23) ja TNF:n estäjiä saaneilla 2,44 (2,02–2,92) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden. Riskitiheyksien suhde (hazard ratio, HR) vakavien infektioiden osalta oli 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 1,17 (0,92–1,50) ja 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 1,48 (1,17–1,87) verrattuna TNF:n estäjiin.
Selkärankareuma
Yhdistetyissä vaiheen 2 ja vaiheen 3 kliinisissä tutkimuksissa 5 mg tofasitinibia kaksi kertaa vuorokaudessa enimmillään 48 viikon ajan saaneiden 316 potilaan joukossa ilmeni yksi vakava infektio (aseptinen meningiitti), joten sen ilmaantuvuus oli 0,43 potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden.
Vakavat infektiot iäkkäillä
Nivelreumatutkimuksiin I–VI osallistuneista 4 271 potilaasta (ks. kohta Farmakodynamiikka) kaikkiaan 608 nivelreumapotilasta oli vähintään 65-vuotiaita, mukaan lukien 85 vähintään 75-vuotiasta potilasta. Vakavien infektioiden esiintyvyys vähintään 65-vuotiailla tofasitinibilla hoidetuilla potilailla oli suurempi (4,8 sataa potilasvuotta kohden) kuin alle 65-vuotiailla potilailla (2,4 100 potilasvuotta kohden).
Laajassa (N = 4 362), satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuustutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Siinä havaittiin, että tofasitinibia 10 mg kaksi kertaa vuorokaudessa saaneilla 65-vuotiailla ja sitä vanhemmilla potilailla vakavien infektioiden ilmaantuvuus oli suurempi verrattuna TNF:n estäjiä saaneisiin ja tofasitinibia 5 mg kaksi kertaa vuorokaudessa saaneisiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). 65-vuotiailla ja sitä vanhemmilla potilailla vakavien infektioiden ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 4,03 (3,02–5,27), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 5,85 (4,64–7,30) ja TNF:n estäjiä saaneilla 3,73 (2,81–4,85) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden.
65-vuotiailla ja sitä vanhemmilla potilailla riskitiheyksien suhde (hazard ratio, HR) vakavien infektioiden osalta oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 1,08 (0,74–1,58) ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 1,55 (1,10–2,19) verrattuna TNF:n estäjiin.
Vakavat infektiot myyntiluvan saamisen jälkeen tehdystä ei-interventionaalisesta turvallisuustutkimuksesta
Tiedot myyntiluvan saamisen jälkeen tehdystä ei-interventionaalisesta turvallisuustutkimuksesta, jossa arvioitiin tofasitinibia rekisteristä (US Corrona) peräisin olevilla nivelreumapotilailla, osoittivat, että numeerisesti korkeampi määrä vakavia infektioita havaittiin kerran vuorokaudessa otetun 11 mg:n depottabletin kanssa kuin kahdesti päivässä otetun 5 mg kalvopäällysteisen tabletin kanssa. Karkeat tapahtumien ilmaantuvuusarvot (95 %:n luottamusväli) (ei sovitettu iän tai sukupuolen mukaan) kummankin formulaation saatavuudesta 12 kuukauden kohdalla hoidon aloittamisen jälkeen olivat 11 mg:n depottabletin kerran päivässä saaneilla 3,45 (1,93, 5,69) ja 5 mg:n kalvopäällysteinen tabletin kahdesti päivässä saaneilla 2,78 (1,74, 4,21) ja 36 kuukauden kohdalla ne olivat 11 mg:n depottabletin kerran päivässä saaneilla 4,71 (3,08, 6,91) ja 5 mg:n kalvopäällysteinen tabletin kahdesti päivässä saaneilla 2,79 (2,01, 3,77) potilasta 100 potilasvuotta kohden. Sovittamaton riskitiheyksien suhde oli 1,30 (95 %:n luottamusväli: 0,67, 2,50) 12 kuukauden kohdalla ja 1,93 (95 %:n luottamusväli: 1,15, 3,24) 36 kuukauden kohdalla kerran vuorokaudessa otetun 11 mg depottabletin kanssa verrattuna kahdesti vuorokaudessa otettuun 5 mg kalvopäällysteiseen tablettiin. Tiedot perustuvat pieneen määrään potilaita, joilla tapahtumia havaittiin suhteellisen suurilla luottamusväleillä ja rajallisella seuranta-ajalla.
Virusten uudelleenaktivoituminen
Tofasitinibilla hoidetuilla potilailla, jotka ovat japanilaisia tai korealaisia, tai joilla on ollut nivelreuma pitkään ja jotka olivat aiemmin saaneet kahta tai useampaa tautiprosessia hidastavaa biologista reumalääkettä (bDMARD), tai potilailla, joiden absoluuttinen lymfosyyttien määrä (B-Lymf) on alle 1,0 x 109/l, tai joiden tofasitinibiannos on 10 mg kaksi kertaa vuorokaudessa, saattaa olla suurentunut vyöruusun (Herpes zoster) riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Laajassa (N = 4 362) satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuutta koskeneessa tutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Siinä havaittiin vyöruusuun (Herpes zoster) liittyvien tapahtumien lisääntyminen tofasitinibihoitoa saaneilla potilailla TNF:n estäjiä saaneisiin verrattuna. Vyöruusun (Herpes zoster) ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 3,75 (3,22, 4,34) potilasta, 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 3,94 (3,38, 4,57) potilasta ja TNF:n estäjiä saaneilla 1,18 (0,90, 1,52) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden.
Laboratoriokokeet
Lymfosyytit
Kontrolloiduissa kliinisissä nivelreumatutkimuksissa varmistettua B-Lymf:n laskua alle 0,5 x 109/l todettiin 0,3 %:lla potilaista ja B-Lymf 0,50–0,75 x 109/l todettiin 1,9 %:lla potilaista yhdistetyssä ryhmässä (annoksia 5 mg kaksi kertaa vuorokaudessa ja 10 mg kaksi kertaa vuorokaudessa saaneet potilaat).
Pitkäaikaisen turvallisuuden selvittämisessä mukana olleilla nivelreumapotilailla varmistettua B-Lymf:n laskua alle 0,5 x 109/l todettiin yhteensä 1,3 %:lla potilaista ja B-Lymf 0,50–0,75 x 109/l todettiin 8,4 %:lla potilaista yhdistetyssä ryhmässä (annoksia 5 mg kaksi kertaa vuorokaudessa ja 10 mg kaksi kertaa vuorokaudessa saaneet potilaat).
Varmistettuun B-Lymf:n laskuun alle 0,75 x 109/l liittyi suurentunut vakavien infektioiden ilmaantuvuus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Neutrofiilit
Kontrolloiduissa kliinisissä nivelreumatutkimuksissa varmistettua B-Neut-arvon laskua alle 1,0 x 109/l esiintyi 0,08 %:lla potilaista yhdistetyssä ryhmässä (annoksia 5 mg kaksi kertaa vuorokaudessa ja 10 mg kaksi kertaa vuorokaudessa saaneet potilaat). Varmistettua B-Neut-arvon laskua alle 0,5 x 109/l ei havaittu missään hoitoryhmässä. Neutropenian ja vakavien infektioiden ilmaantuvuuden välillä ei esiintynyt selkeää yhteyttä.
Pitkäaikaisen turvallisuuden selvittämisessä mukana olleilla nivelreumapotilailla varmistetun B-Neut-arvon laskun ilmaantumistapa ja ilmaantuvuus olivat yhdenmukaiset kontrolloiduissa kliinisissä tutkimuksissa tehtyjen havaintojen kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Verihiutaleet
Vaiheen 3 kontrolloiduissa kliinisissä tutkimuksissa (nivelreuma, nivelpsoriaasi, selkärankareuma) potilaiden verihiutalemäärän piti olla ≥ 100 x 109/l, jotta he soveltuivat tutkimukseen. Siksi potilaista, joiden verihiutalemäärä ennen tofasitinibihoidon aloittamista on < 100 x 109/l, ei ole tietoja.
Maksaentsyymikokeet
Varmistettua maksaentsyymien nousua yli 3-kertaiseksi viitevälin ylärajaan nähden havaittiin nivelreumapotilailla melko harvoin. Jos näiden potilaiden maksaentsyymit olivat koholla, hoitoon tehtävät muutokset (esim. samanaikaisesti käytetyn tautiprosessia hidastavan reumalääkkeen (DMARD) annoksen pienentäminen, tofasitinibihoidon keskeyttäminen tai tofasitinibiannoksen pienentäminen) pienensivät maksaentsyymipitoisuutta tai normalisoivat pitoisuuden.
Nivelreumaa koskeneen vaiheen 3 monoterapiatutkimuksen kontrolloidussa osiossa (0–3 kuukautta) (tutkimus I, ks. kohta Farmakodynamiikka) ALAT-arvojen nousua yli 3‑kertaisiksi viitevälin ylärajaan nähden havaittiin 1,65 %:lla lumelääkettä saaneista, 0,41 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 0 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista. Tässä tutkimuksessa ASAT-arvojen nousua yli 3‑kertaisiksi viitevälin ylärajaan nähden havaittiin 1,65 %:lla lumelääkettä saaneista, 0,41 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 0 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista.
Nivelreumaa koskeneessa vaiheen 3 monoterapiatutkimuksessa (0–24 kuukautta) (tutkimus VI, ks. kohta Farmakodynamiikka) ALAT-arvojen havaittiin suurentuneen yli 3‑kertaisiksi viitearvojen ylärajaan nähden 7,1 %:lla metotreksaattia saaneista, 3,0 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 3,0 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista. Tässä tutkimuksessa ASAT-arvojen nousua yli 3-kertaisiksi viitearvojen ylärajaan nähden havaittiin 3,3 %:lla metotreksaattia saaneista, 1,6 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 1,5 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista.
Nivelreumaa koskeneiden vaiheen 3 tutkimusten, joissa peruslääkityksenä oli tautiprosessia hidastava reumalääkehoito (DMARD), kontrolloidussa osiossa (0–3 kuukautta) (tutkimukset II–V, ks. kohta Farmakodynamiikka) ALAT-arvojen nousua yli 3‑kertaisiksi viitevälin ylärajaan nähden havaittiin 0,9 %:lla lumelääkettä saaneista, 1,24 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 1,14 %:lla 10 mg tofasitinibitabletteja kaksi kertaa vuorokaudessa saaneista potilaista. Näissä tutkimuksissa ASAT-arvojen nousua yli 3‑kertaisiksi viitevälin ylärajaan nähden havaittiin 0,72 %:lla lumelääkettä saaneista, 0,5 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 0,31 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista.
Nivelreumaa koskeneissa pitkäkestoisissa monoterapiajatkotutkimuksissa ALAT-arvojen havaittiin suurentuneen yli 3‑kertaisiksi viitearvojen ylärajaan nähden 1,1 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja vastaavasti 1,4 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista. ASAT-arvojen nousua yli 3-kertaisiksi viitearvojen ylärajaan nähden havaittiin alle 1 %:lla molemmissa sekä 5 mg että 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneissa potilasryhmissä.
Nivelreumaa koskeneissa pitkäkestoisissa jatkotutkimuksissa, joissa peruslääkityksenä oli tautiprosessia hidastava reumalääkehoito (DMARD), ALAT-arvojen havaittiin suurentuneen yli 3‑kertaisiksi viitearvojen ylärajaan nähden 1,8 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja vastaavasti 1,6 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista potilaista. ASAT-arvojen nousua yli 3-kertaisiksi viitearvojen ylärajaan nähden havaittiin alle 1 %:lla molemmissa sekä 5 mg että 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneissa potilasryhmissä.
Laajassa (N = 4 362) satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuutta koskeneessa tutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Siinä ALAT-arvojen kohoamista vähintään 3‑kertaiseksi viitearvojen ylärajaan nähden havaittiin 6,01 %:lla 5 mg tofasitibinia kaksi kertaa vuorokaudessa saaneista, 6,54 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 3,77 %:lla TNF:n estäjiä saaneista potilaista. ASAT-arvojen kohoamista vähintään 3‑kertaisiksi viitearvojen ylärajaan nähden havaittiin 3,21 %:lla 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista, 4,57 %:lla 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneista ja 2,38 %:lla TNF:n estäjiä saaneista potilaista.
Lipidit
Lipidiarvojen (kokonais-, LDL- ja HDL-kolesteroli, triglyseridit) kohoamista tutkittiin nivelreumapotilailla tehdyissä kontrolloiduissa kaksoissokkoutetuissa kliinisissä tutkimuksissa ensimmäisen kerran 1 kuukauden kuluttua tofasitinibihoidon aloittamisesta. Arvojen suurenemista havaittiin kyseisenä ajankohtana, ja ne pysyivät sen jälkeen vakaina.
Kontrolloiduissa kliinisissä nivelreumatutkimuksissa lipidien muutoksia esiintyi lähtötilanteesta tutkimuksen päättymiseen saakka (6–24 kuukautta) seuraavasti:
- LDL-kolesterolipitoisuuden keskiarvo oli suurentunut 12 kuukauden hoidon jälkeen 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 15 % ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 20 %, ja 24 kuukauden hoidon jälkeen pitoisuus oli suurentunut 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 16 % ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 19 %.
- HDL-kolesterolipitoisuuden keskiarvo oli suurentunut 12 kuukauden hoidon jälkeen 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 17 % ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 18 %, ja 24 kuukauden hoidon jälkeen pitoisuus oli suurentunut 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 19 % ja 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneiden ryhmässä 20 %.
Lipidipitoisuudet palasivat tofasitinibihoidon lopettamisen jälkeen hoitoa edeltäneelle tasolle.
Sekä keskimääräisen LDL-kolesterolipitoisuuden suhde HDL-kolesterolipitoisuuteen (LDL/HDL) että apolipoproteiini B:n suhde ApoA1:een (ApoB/ApoA1) pysyivät tofasitinibihoitoa saaneilla potilailla pääasiassa ennallaan.
Kontrolloidussa kliinisessä nivelreumatutkimuksessa kohonnut LDL-kolesterolipitoisuus ja ApoB vastasivat statiinihoitoon ja pienenivät hoitoa edeltäneelle tasolle.
Pitkäaikaisen turvallisuuden selvittämisessä mukana olleilla nivelreumapotilailla kohonneet lipidiparametrit olivat yhdenmukaisia kontrolloiduissa kliinisissä tutkimuksissa tehtyjen havaintojen kanssa.
Laajassa (N = 4 362) satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuutta koskeneessa tutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Seuraavassa esitetään yhteenveto lähtötilanteen lipidiparametrien muutoksista lähtötilanteesta 24 kuukauteen saakka:
- LDL-kolesterolipitoisuuden keskiarvo oli suurentunut 12 kuukauden hoidon jälkeen 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 13,80 %, 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 17,04 % ja TNF:n estäjiä saaneilla potilailla 5,50 %. 24 kuukauden hoidon jälkeen pitoisuus oli suurentunut 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 12,71 %, 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 18,14 % ja TNF:n estäjiä saaneilla potilailla 3,64 %,
- HDL-kolesterolipitoisuuden keskiarvo oli suurentunut 12 kuukauden hoidon jälkeen 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 11,71 %, 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 13,63 % ja TNF:n estäjiä saaneilla potilailla 2,82 %. 24 kuukauden hoidon jälkeen pitoisuus oli suurentunut 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 11,58 %, 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla 13,54 % ja TNF:n estäjiä saaneilla potilailla 1,42 %.
Sydäninfarkti
Nivelreuma
Laajassa (N = 4 362) satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuutta koskeneessa tutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Sydäninfarktin (kuolemaan johtamaton) ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,37 (0,22; 0,57), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,33 (0,19; 0,53) ja TNF:n estäjiä saaneilla 0,16 (0,07; 0,31) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden. Tutkimuksessa raportoitiin muutamista kuolemaan johtaneista sydäninfarkteista, ja niiden ilmaantumistiheys oli tofasitinibilla hoidetuilla potilailla samankaltainen kuin TNF-estäjillä hoidetuilla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka). Tutkimuksessa edellytettiin vähintään 1 500 potilaan seurantaa kolmen vuoden ajan.
Syövät ei-melanoottista ihosyöpää lukuun ottamatta
Nivelreuma
Laajassa (N = 4 362) satunnaistetussa myyntiluvan myöntämisen jälkeisessä turvallisuutta koskeneessa tutkimuksessa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä. Keuhkosyövän ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,23 (0,12; 0,40), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,32 (0,18; 0,51) ja TNF:n estäjiä saaneilla 0,13 (0,05; 0,26) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka). Tutkimuksessa edellytettiin vähintään 1 500 potilaan seurantaa kolmen vuoden ajan.
Lymfoomien ilmaantumistiheys (95 %:n luottamusväli) oli 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,07 (0,02; 0,18), 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla 0,11 (0,04; 0,24) ja TNF:n estäjiä saaneilla 0,02 (0,00; 0,10) potilasta, joilla oli tapahtumia, 100 potilasvuotta kohden (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksessa suositellaan potilaan seuraamista haittavaikutusten merkkien ja oireiden havaitsemiseksi. Tofasitinibin yliannoksen hoitoon ei ole spesifistä vasta-ainetta. Hoidon on oltava oireenmukaista ja elintoimintoja tukevaa.
Terveistä vapaaehtoisista koehenkilöistä aina 100 mg:n kerta-annoksiin saakka saadut farmakokineettiset tiedot viittaavat siihen, että yli 95 % otetusta annoksesta oletetaan eliminoituvan 24 tunnin kuluessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, Januskinaasin (JAK) estäjät, ATC-koodi: L04AF01
Vaikutusmekanismi
Tofasitinibi on voimakas, selektiivinen JAK-perheen estäjä. Tofasitinibi estää entsyymimäärityksissä kinaaseja JAK1, JAK2, JAK3 ja vähäisemmässä määrin kinaasia TyK2. Tofasitinibi on kuitenkin erittäin selektiivinen muiden ihmisen genomin kinaasien suhteen. Ihmisen soluissa tofasitinibi estää lähinnä kinaaseihin JAK3 ja/tai JAK1 liittyvää heterodimeeristen sytokiinireseptorien signaalinvälitystä, joka on funktionaalisesti selektiivisempää kuin sytokiinireseptorien JAK2-kinaasiparien kautta tapahtuva signaalinvälitys. Tofasitinibin aiheuttama JAK1:n ja JAK3:n estyminen heikentää interleukiinien (IL-2, -4, -6, -7, -9, -15, -21) sekä tyypin I ja tyypin II interferonien signaalinvälitystä, mikä muuttaa immuunivastetta ja tulehdusvastetta.
Farmakodynaamiset vaikutukset
Tofasitinibihoitoon liittyi nivelreumapotilaiden pisimmillään 6 kuukautta kestäneen hoidon aikana verenkierrossa olevien luonnollisten tappajasolujen (NK) CD16/56+‑annosriippuvaista vähenemistä, ja niiden vähenemisen arvioitiin olleen suurinta noin 8−10 viikon kuluttua hoidon aloittamisen jälkeen. Nämä muutokset hävisivät tavallisesti 2–6 viikon kuluttua hoidon lopettamisen jälkeen. Tofasitinibihoitoon liittyi annosriippuvaista B-solumäärän lisääntymistä. T-lymfosyyttien ja T‑lymfosyyttien alaryhmien (CD3+, CD4+ ja CD8+) määrän muutokset verenkierrossa olivat vähäisiä ja epäjohdonmukaisia.
Pitkäaikaishoidossa (tofasitinibihoidon keston mediaani noin 5 vuotta) CD4+-määrän todettiin vähentyneen lähtötilanteesta 28 % (mediaani) ja CD8+-määrän 27 % (mediaani). Lyhytkestoisessa käytössä havaitusta vähenemisestä poiketen luonnollisten tappajasolujen CD16/56+ määrän todettiin lisääntyneen lähtötilanteesta 73 % (mediaani). CD19-positiivisten B-solujen määrän ei todettu enää lisääntyneen pitkäkestoisen tofasitinibihoidon jälkeen. Kaikkien näiden lymfosyyttialaryhmien muutokset palautuivat hoidon tilapäisen keskeyttämisen jälkeen lähemmäs lähtötilannetta. Lymfosyyttialaryhmien määrien ja vakavien tai opportunisti-infektioiden tai vyöruusun (Herpes zoster) välisestä yhteydestä ei ollut näyttöä (lymfosyyttien absoluuttisen määrän seuranta, ks. kohta Annostus ja antotapa).
IgG-, IgM- ja IgA-kokonaispitoisuuden muutokset seerumissa olivat nivelreumapotilaiden 6 kuukautta kestäneen tofasitinibihoidon aikana vähäisiä, annoksesta riippumattomia ja samankaltaisia kuin lumelääkkeen yhteydessä, mikä viittaa siihen, ettei systeemistä humoraalista suppressiota esiinny.
Nivelreumapotilaiden tofasitinibihoidon jälkeen C‑reaktiivisen proteiinin (CRP) pitoisuuden seerumissa havaittiin pienentyneen nopeasti, ja pitoisuus pysyi pienentyneenä koko hoidon ajan. Tofasitinibihoidon yhteydessä havaitut CRP-muutokset eivät korjautuneet täysin 2 viikon kuluessa hoidon lopettamisesta, mikä viittaa siihen, että farmakodynaaminen aktiivisuus kestää puoliintumisaikaa pidempään.
Rokotteita koskevat tutkimukset
Kontrolloidussa kliinisessä tutkimuksessa, jossa nivelreumapotilaille aloitettiin tofasitinibihoito 10 mg:n annoksina kaksi kertaa vuorokaudessa tai lumehoito, influenssarokotteeseen vasteen saaneiden lukumäärä oli sekä tofasitinibiryhmässä (57 %) että lumehoitoa saaneessa ryhmässä (62 %) samankaltainen. Pneumokokki-polysakkaridirokotteeseen vasteen saaneiden osuudet olivat seuraavat: 32 % sekä tofasitinibi- että metotreksaattihoitoa saaneista potilaista, 62 % tofasitinibimonoterapiaa saaneista potilaista, 62 % metotreksaattimonoterapiaa saaneista ja 77 % lumehoitoa saaneista. Tämän kliinistä merkitystä ei tiedetä, mutta samankaltaisia tuloksia saatiin pitkäkestoista tofasitinibihoitoa annoksina 10 mg kaksi kertaa vuorokaudessa saaneilla potilailla tehdyssä erillisessä influenssa- ja pneumokokki polysakkaridirokotetutkimuksessa.
Peruslääkityksenä metotreksaattia saaneilla nivelreumapotilailla tehtiin kontrolloitu tutkimus, jossa heille annettiin heikennettyä elävää herpesvirusta sisältävää rokotetta 2–3 viikkoa ennen kuin heille aloitettiin 12 viikon tofasitinibihoito annoksina 5 mg kaksi kertaa vuorokaudessa tai lumehoito. Sekä tofasitinibi- että lumehoitoa saaneilla potilailla havaittiin 6 viikon hoidon jälkeen näyttöä humoraalisista ja soluvälitteisistä vasteista VZV:lle. Vasteet olivat samankaltaisia kuin 50-vuotiailla ja vanhemmilla terveillä vapaaehtoisilla. Erään potilaan, joka ei ollut sairastanut vesirokkoa ja jolla ei ollut hoidon alkaessa vesirokon vasta-aineita, havaittiin 16 päivää rokotuksen jälkeen vesirokkoviruskannan aiheuttama levinnyt infektio. Tofasitinibihoito lopetettiin, ja potilas toipui saatuaan hoitoa tavanomaisilla viruslääkevalmisteiden annoksilla. Kyseinen potilas sai myöhemmin voimakkaan, mutta viivästyneen, humoraalisen ja soluvasteen rokotteeseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliininen teho ja turvallisuus
Nivelreuma
Kalvopäällysteisten tofasitinibitablettien tehoa ja turvallisuutta arvioitiin kuudessa satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa monikeskustutkimuksessa yli 18-vuotiailla aktiivista nivelreumaa sairastavilla potilailla, joiden nivelreuma oli diagnosoitu käyttäen ACR (American College of Rheumatology) -kriteerejä. Taulukossa 8 esitetään oleelliset tiedot tutkimusten koeasetelmasta ja potilaiden ominaisuuksista.
Taulukko 8. Vaiheen 3 kliiniset tutkimukset nivelreumapotilaille kaksi kertaa vuorokaudessa annetuilla 5 mg:n ja 10 mg:n tofasitinibiannoksilla
| Tutkimukset | Tutkimus I (ORAL Solo) | Tutkimus II (ORAL Sync) | Tutkimus III (ORAL Standard) | Tutkimus IV (ORAL Scan) | Tutkimus V (ORAL Step) | Tutkimus VI (ORAL Start) | Tutkimus VII (ORAL Strategy) |
| Potilasryhmä | DMARD-IR | DMARD-IR | MTX-IR | MTX-IR | TNFi-IR | Ei aiempaa MTX-hoitoaa | MTX-IR |
| Vertailuryhmä | Lumelääke | Lumelääke | Lumelääke | Lumelääke | Lumelääke | MTX | MTX, ADA |
| Peruslääkitys | Ei hoitoab | csDMARDit | MTX | MTX | MTX | Ei hoitoab | 3 rinnakkais-ryhmää:
|
| Keskeiset ominaisuudet | Monoterapia | Eri csDMARDit | Vaikuttava vertailuvalmiste (ADA) | Röntgenkuvaus | TNFi-IR | Monoterapia, vaikuttava vertailuvalmiste (MTX), röntgenkuvaus | Tofasitinibi joko MTX:n kanssa tai ilman MTX:ää verrattuna ADA:n ja MTX:n yhdistelmään |
| Hoitoa saaneiden potilaiden lkm | 610 | 792 | 717 | 797 | 399 | 956 | 1 146 |
| Tutkimuksen kokonaiskesto | 6 kuukautta | 1 vuosi | 1 vuosi | 2 vuotta | 6 kuukautta | 2 vuotta | 1 vuosi |
| Muut ensisijaiset tehon päätetapahtu-matc | Kuukausi 3: ACR20 HAQ-DI DAS28-4(ESR) < 2,6 | Kuukausi 6: ACR20 DAS28-4(ESR) < 2,6 Kuukausi 3: HAQ-DI | Kuukausi 6: ACR20 DAS28-4(ESR) < 2,6 Kuukausi 3: HAQ-DI | Kuukausi 6: ACR20 mTSS DAS28-4(ESR) < 2,6 Kuukausi 3: HAQ-DI | Kuukausi 3: ACR20 HAQ-DI DAS28-4(ESR) < 2,6 | Kuukausi 6: mTSS ACR70 | Kuukausi 6: ACR50 |
| Aika pakolliseen aktiiviseen hoitoon siirtymiseen (tofasitinibiannokset 5 mg tai 10 mg kaksi kertaa vuorokaudessa) | Kuukausi 3 | Kuukausi 6 (lumehoitoa saaneet tutkittavat, joiden turvonneiden ja aristavien nivelten lukumäärä oli vähentynyt < 20 %, siirtyivät tofasitinibihoitoon 3 kuukauden hoidon jälkeen) | Kuukausi 3 | NA | NA | ||
a. ≤ 3 viikottaista annosta (ei aiempaa metotreksaatti [MTX] ‑hoitoa).
b. Malarialääkkeet olivat sallittuja.
c. Muita ensisijaisia päätetapahtumia olivat: mTSS:n keskimääräinen muutos lähtötilanteesta; ACR20- tai ACR70-vasteen saaneiden tutkittavien prosenttiosuus; HAQ-DI-indeksin keskimääräinen muutos lähtötilanteesta; DAS28-4(ESR) < 2,6 -indeksin (remission) saavuttaneiden tutkittavien prosenttiosuus.
mTSS = muokatut Total Sharp -pisteet (modified Total Sharp Score), ACR20(70) = American College of Rheumatology -vasteen paraneminen ≥ 20 % (≥ 70 %), DAS28 = taudin aktiivisuutta 28 nivelessä osoittava indeksi (Disease Activity Score 28 joints), ESR = lasko (Erythrocyte Sedimentation Rate), HAQ-DI = toimintakykyindeksi (Health Assessment Questionnaire Disability Index), DMARD = tautiprosessia hidastava reumalääke (disease-modifying antirheumatic drug), IR = riittämätön vaste (inadequate responder), csDMARD = perinteinen synteettinen tautiprosessia hidastava reumalääke (conventional synthetic DMARD), TNFi = tuumorinekroositekijän estäjä (tumour necrosis factor inhibitor), NA = ei sovellettavissa (not applicable),
ADA = adalimumabi, MTX = metotreksaatti.
Kliininen vaste
ACR-vaste
Tutkimuksissa ORAL Solo, ORAL Sync, ORAL Standard, ORAL Scan, ORAL Step, ORAL Start ja ORAL Strategy ACR20-, ACR50- ja ACR70-vasteen saaneiden potilaiden prosenttiosuus tofasitinibihoitoa saaneista esitetään taulukossa 9. Kaikissa tutkimuksissa 5 mg:n tai 10 mg:n tofasitinibiannoksia kaksi kertaa vuorokaudessa saaneilla potilailla esiintyi tilastollisesti merkitsevä ACR20-, ACR50-, tai ACR70-vaste tutkimuskuukausina 3 ja 6 verrattuna lumehoitoa saaneisiin potilaisiin (tai ORAL Start ‑tutkimuksessa metotreksaattiin verrattuna).
ORAL Strategy -tutkimuksen aikana vasteet, jotka saatiin 5 mg:lla tofasitinibia kaksi kertaa vuorokaudessa yhdessä metotreksaatin kanssa, olivat numeerisesti samaa luokkaa kuin annettaessa 40 mg adalimumabia yhdessä metotreksaatin kanssa. Kummassakin näistä hoidoista vasteet olivat numeerisesti suuremmat kuin annettaessa 5 mg tofasitinibia kaksi kertaa vuorokaudessa.
Hoidon vaikutus oli samankaltainen riippumatta potilaan reumatekijätilanteesta, iästä, sukupuolesta, rodusta tai taudin tilanteesta. Vaikutus ilmaantui nopeasti (tutkimuksissa ORAL Solo, ORAL Sync ja ORAL Step vain 2 viikkoa), ja vaste parani edelleen hoidon jatkuessa. Tofasitinibia 5 mg tai 10 mg kaksi kertaa vuorokaudessa saaneiden potilaiden ACR-kokonaisvasteen tavoin myös ACR-vasteen jokainen osa-alue parani johdonmukaisesti lähtötilanteesta verrattuna kaikissa tutkimuksissa lumelääkettä yhdessä metotreksaatin tai muiden tautiprosessia hidastavien reumalääkkeiden (DMARD) kanssa saaneisiin potilaisiin (osa-alueita olivat aristavien ja turvonneiden nivelten lukumäärä, potilaan ja lääkärin tekemä kokonaisarvio, toimintakykyä osoittava indeksi, kipuarvio ja CRP).
Taulukko 9. ACR-vasteen saaneiden potilaiden osuus (%)
| ORAL Solo:Riittämätön vaste DMARD-hoitoon | ||||||
| Pääte-tapahtuma | Aika | Lumelääke N = 122 | Tofasitinibi 5 mg x 2/vrk monoterapiana N = 241 | Tofasitinibi 10 mg x 2/vrk monoterapiana N = 243 | ||
| ACR20 | Kuukausi 3 | 26 | 60*** | 65*** | ||
| Kuukausi 6 | NA | 69 | 71 | |||
| ACR50 | Kuukausi 3 | 12 | 31*** | 37*** | ||
| Kuukausi 6 | NA | 42 | 47 | |||
| ACR70 | Kuukausi 3 | 6 | 15* | 20*** | ||
| Kuukausi 6 | NA | 22 | 29 | |||
| ORAL Sync:Riittämätön vaste DMARD-hoitoon | ||||||
| Pääte-tapahtuma | Aika | Lumelääke + DMARD(eja) N = 158 | Tofasitinibi 5 mg x 2/vrk + DMARD(eja) N = 312 | Tofasitinibi 10 mg x 2/vrk + DMARD(eja) N = 315 | ||
| ACR20 | Kuukausi 3 | 27 | 56*** | 63*** | ||
| Kuukausi 6 | 31 | 53*** | 57*** | |||
| Kuukausi 12 | NA | 51 | 56 | |||
| ACR50 | Kuukausi 3 | 9 | 27*** | 33*** | ||
| Kuukausi 6 | 13 | 34*** | 36*** | |||
| Kuukausi 12 | NA | 33 | 42 | |||
| ACR70 | Kuukausi 3 | 2 | 8** | 14*** | ||
| Kuukausi 6 | 3 | 13*** | 16*** | |||
| Kuukausi 12 | NA | 19 | 25 | |||
| ORAL Standard: Riittämätön vaste metotreksaattiin (MTX) | ||||||
| Pääte-tapahtuma | Aika | Lumelääke | Tofasitinibi x 2/vrk + MTX | Adalimumabi 40 mg joka toinen viikko + MTX | ||
| ACR20 | N = 105 | 5 mg N = 198 | 10 mg N = 197 | N = 199 | ||
| Kuukausi 3 | 26 | 59*** | 57*** | 56*** | ||
| Kuukausi 6 | 28 | 51*** | 51*** | 46** | ||
| Kuukausi 12 | NA | 48 | 49 | 48 | ||
| ACR50 | Kuukausi 3 | 7 | 33*** | 27*** | 24*** | |
| Kuukausi 6 | 12 | 36*** | 34*** | 27** | ||
| Kuukausi 12 | NA | 36 | 36 | 33 | ||
| ACR70 | Kuukausi 3 | 2 | 12** | 15*** | 9* | |
| Kuukausi 6 | 2 | 19*** | 21*** | 9* | ||
| Kuukausi 12 | NA | 22 | 23 | 17 | ||
| ORAL Scan: Riittämätön vaste metotreksaattiin (MTX) | ||||||
| Pääte-tapahtuma | Aika | Lumelääke + MTX N = 156 | Tofasitinibi 5 mg x 2/vrk + MTX N = 316 | Tofasitinibi 10 mg x 2/vrk + MTX N = 309 | ||
| ACR20 | Kuukausi 3 | 27 | 55*** | 66*** | ||
| Kuukausi 6 | 25 | 50*** | 62*** | |||
| Kuukausi 12 | NA | 47 | 55 | |||
| Kuukausi 24 | NA | 40 | 50 | |||
| ACR50 | Kuukausi 3 | 8 | 28*** | 36*** | ||
| Kuukausi 6 | 8 | 32*** | 44*** | |||
| Kuukausi 12 | NA | 32 | 39 | |||
| Kuukausi 24 | NA | 28 | 40 | |||
| ACR70 | Kuukausi 3 | 3 | 10** | 17*** | ||
| Kuukausi 6 | 1 | 14*** | 22*** | |||
| Kuukausi 12 | NA | 18 | 27 | |||
| Kuukausi 24 | NA | 17 | 26 | |||
| ORAL Step: Riittämätön vaste tuumorinekroositekijän estäjään (TNF) | ||||||
| Pääte-tapahtuma | Aika | Lumelääke + MTX N = 132 | Tofasitinibi 5 mg x 2/vrk + MTX N = 133 | Tofasitinibi 10 mg x 2/vrk + MTX N = 134 | ||
| ACR20 | Kuukausi 3 | 24 | 41* | 48*** | ||
| Kuukausi 6 | NA | 51 | 54 | |||
| ACR50 | Kuukausi 3 | 8 | 26*** | 28*** | ||
| Kuukausi 6 | NA | 37 | 30 | |||
| ACR70 | Kuukausi 3 | 2 | 14*** | 10* | ||
| Kuukausi 6 | NA | 16 | 16 | |||
| ORAL Start: Ei aiempaa metotreksaattihoitoa (MTX) | ||||||
| Pääte-tapahtuma | Aika | MTX N = 184 | Tofasitinibi 5 mg x 2/vrk monoterapia N = 370 | Tofasitinibi 10 mg x 2/vrk monoterapia N = 394 | ||
| ACR20 | Kuukausi 3 | 52 | 69*** | 77*** | ||
| Kuukausi 6 | 51 | 71*** | 75*** | |||
| Kuukausi 12 | 51 | 67** | 71*** | |||
| Kuukausi 24 | 42 | 63*** | 64*** | |||
| ACR50 | Kuukausi 3 | 20 | 40*** | 49*** | ||
| Kuukausi 6 | 27 | 46*** | 56*** | |||
| Kuukausi 12 | 33 | 49** | 55*** | |||
| Kuukausi 24 | 28 | 48*** | 49*** | |||
| ACR70 | Kuukausi 3 | 5 | 20*** | 26*** | ||
| Kuukausi 6 | 12 | 25*** | 37*** | |||
| Kuukausi 12 | 15 | 28** | 38*** | |||
| Kuukausi 24 | 15 | 34*** | 37*** | |||
| ORAL Strategy:Riittämätön vaste MTX:iin | ||||||
| Pääte-tapahtuma | Aika | Tofasitinibi 5 mg x 2/vrk N = 384 | Tofasitinibi 5 mg x 2/vrk + MTX N = 376 | Adalimumabi + MTX N = 386 | ||
| ACR20 | Kuukausi 3 | 62,50 | 70,48ǂ | 69,17 | ||
| Kuukausi 6 | 62,84 | 73,14ǂ | 70,98 | |||
| Kuukausi 12 | 61,72 | 70,21ǂ | 67,62 | |||
| ACR50 | Kuukausi 3 | 31,51 | 40,96ǂ | 37,31 | ||
| Kuukausi 6 | 38,28 | 46,01ǂ | 43,78 | |||
| Kuukausi 12 | 39,31 | 47,61ǂ | 45,85 | |||
| ACR70 | Kuukausi 3 | 13,54 | 19,41ǂ | 14,51 | ||
| Kuukausi 6 | 18,23 | 25,00ǂ | 20,73 | |||
| Kuukausi 12 | 21,09 | 28,99ǂ | 25,91 | |||
* p < 0,05 ** p < 0,001 ***p < 0,0001 lumelääkkeeseen verrattuna (metotreksaattiin verrattuna ORAL Start -tutkimuksessa) ǂ p < 0,05 – 5 mg tofasitinibia + MTX verrattuna 5 mg:aan tofasitinibia ORAL Strategy ‑tutkimuksessa (normaalit p-arvot ilman monivertailukorjausta) N = analysoitujen tutkittavien lukumäärä, ACR20/50/70 = American College of Rheumatology -vastekriteereiden perusteella todettu ≥ 20, 50, 70 %:n paraneminen, NA = ei sovellettavissa (not applicable), MTX = metotreksaatti. | ||||||
DAS28-4(ESR)-vaste
Potilaiden taudin aktiivisuutta osoittavat Disease Activity Score (DAS28-4[ESR]) indeksit olivat vaiheen 3 tutkimusten lähtötilanteessa keskimäärin 6,1–6,7. Annoksia 5 mg kaksi kertaa vuorokaudessa saaneiden ryhmässä havaittiin tutkimuskuukautena 3 DAS28-4(ESR)-indeksien pienentyneen merkitsevästi lähtötilanteesta (keskimääräinen paraneminen) 1,8–2,0 ja annoksia 10 mg kaksi kertaa vuorokaudessa saaneiden ryhmässä vastaavasti 1,9–2,2 verrattuna lumehoitoon (0,7–1,1). DAS28-indeksillä osoitetun kliinisen remission (DAS28-4(ESR) < 2,6) saavuttaneiden potilaiden osuus tutkimuksissa ORAL Step, ORAL Sync ja ORAL Standard esitetään taulukossa 10.
Taulukko 10: Tutkimuskuukausina 3 ja 6 DAS28-4(ESR) < 2,6 remission saavuttaneiden tutkittavien lukumäärä (%)
| Ajankohta | N | % | ||
| ORAL Step: Riittämätön vaste tuumorinekroositekijän (TNF) estäjään | ||||
| Tofasitinibi 5 mg x 2 + MTX | Kuukausi 3 | 133 | 6 | |
| Tofasitinibi 10 mg x 2 + MTX | Kuukausi 3 | 134 | 8* | |
| Lumelääke + MTX | Kuukausi 3 | 132 | 2 | |
| ORAL Sync: Riittämätön vaste DMARD-hoitoon | ||||
| Tofasitinibi 5 mg x 2 | Kuukausi 6 | 312 | 8* | |
| Tofasitinibi 10 mg x 2 | Kuukausi 6 | 315 | 11*** | |
| Lumelääke | Kuukausi 6 | 158 | 3 | |
| ORAL Standard: Riittämätön vaste metotreksaattiin (MTX) | ||||
| Tofasitinibi 5 mg x 2 + MTX | Kuukausi 6 | 198 | 6* | |
| Tofasitinibi 10 mg x 2 + MTX | Kuukausi 6 | 197 | 11*** | |
| Adalimumabi 40 mg s.c. joka toinen viikko + MTX | Kuukausi 6 | 199 | 6* | |
| Lumelääke + MTX | Kuukausi 6 | 105 | 1 | |
| *p < 0,05, ***p < 0,0001 verrattuna lumehoitoon, s.c. = ihon alle, N = analysoitujen tutkittavien lukumäärä, DAS28 = taudin aktiivisuutta 28 nivelessä osoittava pisteytys (Disease Activity Scale 28 joints), ESR = lasko (Erythrocyte Sedimentation Rate). | ||||
Röntgenologisesti todennettu vaste
Tutkimuksissa ORAL Scan ja ORAL Start rakenteellisten nivelvaurioiden etenemisen estoa arvioitiin röntgenologisesti, ja se ilmaistiin mTSS:n ja sen osa-alueiden, eroosiopisteiden ja nivelraon kaventumista (JSN) kuvaavien pisteiden keskimääräisenä muutoksena tutkimuskuukausina 6 ja 12 lähtötilanteeseen nähden.
Tutkimuksessa ORAL Scan tofasitinibiannokset 10 mg kaksi kertaa vuorokaudessa yhdessä peruslääkityksenä käytetyn metotreksaatin kanssa estivät tutkimuskuukausina 6 ja 12 rakenteellisten vaurioiden etenemistä tilastollisesti merkitsevästi enemmän lumelääkkeen ja metotreksaatin yhdistelmään verrattuna. Tofasitinibiannosten 5 mg kaksi kertaa vuorokaudessa ja metotreksaatin yhdistelmän vaikutus rakenteellisten nivelvaurioiden keskimääräiseen etenemiseen oli samankaltainen (ei tilastollisesti merkitsevä). Eroosion ja JSN-pisteiden analyysi oli yhdenmukainen kokonaistulosten kanssa.
Lumelääkkeen ja metotreksaatin yhdistelmää saaneessa ryhmässä 78 %:lla potilaista ei havaittu röntgenologista taudin etenemistä (mTSS-muutos enintään 0,5) tutkimuskuukautena 6 verrattuna 89 %:iin tofasitinibiannoksia 5 mg kaksi kertaa vuorokaudessa ja 87 %:iin tofasitinibiannoksia 10 mg kaksi kertaa vuorokaudessa yhdistelmänä metotreksaatin kanssa saaneisiin potilaisiin. Kumpikin tulos oli lumelääkkeen ja metotreksaatin yhdistelmään verrattuna merkitsevä.
Tutkimuksessa ORAL Start tofasitinibimonoterapia esti tutkimuskuukausina 6 ja 12 rakenteellisten vaurioiden etenemistä merkitsevästi enemmän metotreksaattiin verrattuna, kuten taulukossa 11 esitetään. Tämä vaikutus säilyi tutkimuskuukauteen 24 saakka. Eroosion ja JSN-pisteiden analyysit olivat yhdenmukaiset kokonaistulosten kanssa.
Metotreksaattiryhmässä 70 %:lla potilaista ei havaittu röntgenologisesti taudin etenemistä tutkimuskuukautena 6 verrattuna 83 %:iin tofasitinibiannoksia 5 mg kaksi kertaa vuorokaudessa ja 90 %:iin tofasitinibiannoksia 10 mg kaksi kertaa vuorokaudessa saaneista potilaista. Kumpikin tulos oli metotreksaattiin verrattuna tilastollisesti merkitsevä.
Taulukko 11: Röntgenologiset muutokset tutkimuskuukausina 6 ja 12
| ORAL Scan: riittämätön vaste metotreksaattiin (MTX) | |||||
Lumelääke + MTX N=139 Keskiarvo (SD)a | Tofasitinibi 5 mg x 2/vrk + MTX N=277 Keskiarvo (SD)a | Tofasitinibi 5 mg x 2/vrk + MTX Keskimääräinen ero lumelääkkeeseenb (luottamusväli) | Tofasitinibi 10 mg x 2/vrk + MTX N=290 Keskiarvo (SD)a | Tofasitinibi 10 mg x 2/vrk + MTX Keskimääräinen ero lumelääkkeeseenb (luottamusväli) | |
mTSSc Lähtötilanne Kuukausi 6 Kuukausi 12 | 33 (42) 0,5 (2,0) 1,0 (3,9) | 31 (48) 0,1 (1,7) 0,3 (3,0) | - ‑0,3 (‑0,7; ‑0,0) ‑0,6 (‑1,3; ‑0,0) | 37 (54) 0,1 (2,0) 0,1 (2,9) | - ‑0,4 (‑0,8; ‑0,0) ‑0,9 (‑1,5; ‑0,2) |
| ORAL Start: Ei aiempaa MTX-hoitoa | |||||
MTX N = 168 Keskiarvo (SD)a | Tofasitinibi 5 mg x 2/vrk N = 344 Keskiarvo (SD)a | Tofasitinibi 5 mg x 2/vrk Keskimääräinen ero metotreksaattiind (luottamusväli) | Tofasitinibi 10 mg x 2/vrk N = 368 Keskiarvo (SD)a | Tofasitinibi 10 mg x 2/vrk Keskimääräinen ero metotreksaattiind (luottamusväli) | |
mTSSc Lähtötilanne Kuukausi 6 Kuukausi 12 | 16 (29) 0,9 (2,7) 1,3 (3,7) | 20 (41) 0,2 (2,3) 0,4 (3,0) | - ‑0,7 (‑1,0; ‑0,3) ‑0,9 (‑1,4; ‑0,4) | 19 (39) 0,0 (1,2) 0,0 (1,5) | - ‑0,8 (‑1,2; ‑0,4) ‑1,3 (‑1,8; ‑0,8) |
a SD = keskihajonta (Standard Deviation) b Tofasitinibin ja lumelääkkeen erotuksen pienimmän neliösumman ero (95 %:n luottamusväli) c Tutkimuskuukauden 6 ja tutkimuskuukauden 12 tiedot osoittavat keskimuutoksen lähtötilanteesta d Tofasitinibin ja metotreksaatin erotuksen pienimmän neliösumman ero (95 %:n luottamusväli) | |||||
Fyysisen toimintakyvyn vaste ja terveyteen liittyvät hoitotulokset
Tofasitinibihoidon yksinään tai yhdessä metotreksaatin kanssa on osoitettu parantavan fyysistä toimintakykyä HAQ-DI-indeksillä mitattuna. Tofasitinibia 5 mg tai 10 mg kaksi kertaa vuorokaudessa saaneilla potilailla todettiin fyysisen toimintakyvyn merkittävästi suurempi paraneminen lumelääkkeeseen verrattuna lähtötilanteesta tutkimuskuukauteen 3 (tutkimukset ORAL Solo, ORAL Sync, ORAL Standard ja ORAL Step) ja tutkimuskuukauteen 6 (tutkimukset ORAL Sync ja ORAL Standard). Tutkimuksissa ORAL Solo ja ORAL Sync tofasitinibia 5 mg tai 10 mg kaksi kertaa vuorokaudessa saaneiden potilaiden fyysinen toimintakyky parani lumelääkkeeseen verrattuna huomattavasti enemmän jo viikolla 2. HAQ-DI-indeksien muutokset lähtötilanteesta tutkimuksissa ORAL Standard, ORAL Step ja ORAL Sync esitetään taulukossa 12.
Taulukko 12: HAQ-DI-indeksien keskimääräinen muutos (LS mean) lähtötilanteesta tutkimuskuukautena 3
| Lumelääke + MTX | Tofasitinibi 5 mg x 2/vrk + MTX | Tofasitinibi 10 mg x 2/vrk + MTX | Adalimumabi 40 mg joka toinen viikko + MTX |
| ORAL Standard: Riittämätön vaste metotreksaattiin (MTX) | |||
| N = 96 | N=185 | N=183 | N=188 |
| ‑0,24 | ‑0,54*** | ‑0,61*** | ‑0,50*** |
| ORAL Step: Riittämätön vaste tuumorinekroositekijän (TNF) estäjään | |||
| N=118 | N=117 | N=125 | NA |
| ‑0,18 | ‑0,43*** | ‑0,46*** | NA |
Lumelääke + DMARD(eja) | Tofasitinibi 5 mg x 2/vrk + DMARD(eja) | Tofasitinibi 10 mg x 2/vrk + DMARD(eja) | |
| ORAL Sync: Riittämätön vaste DMARD-hoitoon | |||
| N=147 | N=292 | N=292 | NA |
| ‑0,21 | ‑0,46*** | ‑0,56*** | NA |
*** p < 0,0001, tofasitinibi versus lumelääke + MTX, LS = pienimmät neliösummat, N = potilaiden lukumäärä, NA = ei sovellettavissa. HAQ-DI = toimintakykyindeksi (Health Assessment Questionnaire Disability Index)
Terveyteen liittyvää elämänlaatua arvioitiin Short Form Health Survey -kyselyllä (SF-36). Tofasitinibiannoksia 5 mg tai 10 mg kaksi kertaa vuorokaudessa saaneiden potilaiden elämänlaatu oli parantunut lumelääkettä saaneisiin potilaisiin verrattuna huomattavasti enemmän lähtötilanteesta tutkimusten ORAL Solo, ORAL Scan ja ORAL Step tutkimuskuukauteen 3 mennessä, mikä todettiin SF-36-kyselyn kaikissa 8 osiossa samoin kuin fyysisen osion yhteenvedossa (Physical Component Summary) ja henkisen osion yhteenvedossa (Mental Component Summary). Tutkimuksen ORAL Scan SF-36-kyselyssä todettu keskimääräinen paraneminen säilyi tofasitinibihoitoa saaneilla potilailla tutkimuskuukauteen 12 saakka.
Väsymyksen (fatigue) vähenemistä arvioitiin kaikissa tutkimuksissa FACIT-F (Functional Assessment of Chronic Illness Therapy-Fatigue) ‑asteikolla tutkimuskuukautena 3. Väsymyksen todettiin kaikissa viidessä tutkimuksessa vähentyneen lähtötilanteesta huomattavasti enemmän 5 mg tai 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin. Tutkimuksissa ORAL Standard ja ORAL Scan tofasitinibihoitoa saaneiden potilaiden FACIT-F-pisteiden keskimääräinen paraneminen säilyi tutkimuskuukauteen 12 saakka.
Kaikissa tutkimuksissa unen laadun paranemista arvioitiin tutkimuskuukautena 3 nukkumiseen kohdistuvaa hoitotulosta arvioivan MOS-Sleep‑mittarin (Medical Outcomes Study Sleep) univaikeuksia osoittavien yhteenvetopisteytysten Sleep Problems Index I ja II avulla. Tutkimuksissa ORAL Sync, ORAL Standard ja ORAL Scan kummallakin asteikolla mitattuna unen laadun todettiin parantuneen lähtötilanteesta 5 mg tai 10 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla huomattavasti enemmän verrattuna lumelääkettä saaneisiin potilaisiin. Tutkimuksissa ORAL Standard ja ORAL Scan kummallakin asteikolla todettu keskimääräinen paraneminen säilyi tofasitinibihoitoa saaneilla potilailla tutkimuskuukauteen 12 saakka.
Kliinisten vasteiden kesto
Hoidon tehon kestoa arvioitiin pisimmillään kaksi vuotta kestäneissä tutkimuksissa ACR20-, ACR50-, ACR70-vasteiden perusteella. HAQ-DI-indeksien ja DAS28-4(ESR)-indeksien keskimääräiset (mean) muutokset säilyivät kaikissa tofasitinibihoitoa saaneissa ryhmissä tutkimusten loppuun saakka.
Tofasitinibihoidon tehon säilymisestä 5 vuoteen saakka on saatu näyttöä myös satunnaistetusta myyntiluvan myöntämisen jälkeisestä turvallisuutta koskeneesta tutkimuksesta, jossa oli mukana vähintään 50-vuotiaita nivelreumapotilaita, joilla oli vähintään yksi sydän- ja verisuonitapahtumien lisäriskitekijä, sekä päättyneistä enimmillään 8 vuoden pituisista avoimista pitkäkestoisista seurantatutkimuksista.
Pitkäaikaiset kontrolloidut turvallisuustiedot
Tutkimus ORAL Surveillance (A3921133) oli (N = 4 362), satunnaistettu vaikuttavalla vertailuvalmisteella kontrolloitu myyntiluvan myöntämisen jälkeinen turvallisuuden seurantatutkimus, johon osallistui vähintään 50-vuotiaita nivelreumapotilaita. Potilailla oli vähintään yksi sydän- ja verisuonitapahtumien riskitekijä (sydän- ja verisuonitapahtumien riskitekijöiksi määritellään tupakointi, diagnosoitu hypertensio, diabetes mellitus, ennenaikainen sepelvaltimotauti suvussa, aiempi sepelvaltimotauti, mukaan lukien aiempi revaskularisaatiotoimenpide, sepelvaltimon ohitusleikkaus, sydäninfarkti, sydämenpysähdys, epästabiili angina pectoris, akuutti sepelvaltimo-oireyhtymä ja nivelreumaan liittyvä nivelenulkoinen sairaus, esim. kyhmyt, Sjögrenin oireyhtymä, kroonisesta sairaudesta aiheutunut anemia, keuhkomanifestaatiot). Suurimmalla osalla (yli 90 %) tofasitinibihoitoa saaneista potilaista, jotka tupakoivat tai olivat aiemmin tupakoineet, tupakointi oli jatkunut yli 10 vuoden ajan. Tupakoinnin keston mediaani oli tupakoivilla 35,0 vuotta ja aiemmin tupakoineilla 39,0 vuotta. Potilailla oli oltava vakiintunut metotreksaattiannostus tutkimuksen alkaessa. Annoksen muuttaminen oli sallittua tutkimuksen aikana.
Potilaat satunnaistettiin suhteessa 1:1:1 avoimeen hoitoon, joka oli 10 mg tofasitinibia kaksi kertaa vuorokaudessa, 5 mg tofasitinibia kaksi kertaa vuorokaudessa tai TNF:n estäjähoito (TNF:n estäjä oli joko 50 mg etanerseptiä kerran viikossa tai 40 mg adalimumabia joka toinen viikko). Ensisijaiset päätetapahtumat olivat todettu syöpä (ei-melanoottista ihosyöpää lukuun ottamatta) ja todettu merkittävä sydän- ja verisuonitapahtuma (MACE; major adverse cardiovascular event); päätetapahtumat varmistettiin keskitetysti (adjudicated endpoints) ja niiden kumulatiivinen ilmaantuvuus ja tilastollinen arviointi olivat sokkoutettuja. Tutkimuksen voimalaskelma perustui tapahtumiin (event-powered study), ja sen ohella edellytettiin vähintään 1500 potilaan seuraamista 3 vuoden ajan. Tutkimushoito 10 mg:lla tofasitinibia kaksi kertaa vuorokaudessa lopetettiin, ja potilaiden hoidoksi vaihdettiin 5 mg kaksi kertaa vuorokaudessa laskimotromboemboliatapahtumien annosriippuvaisen signaalin vuoksi. Tofasitinibia 10 mg kahdesti vuorokaudessa saaneen ryhmän osalta ennen annoksen vaihtamista ja sen jälkeen kerätyt tiedot analysoitiin alun perin satunnaistetussa hoitoryhmässä.
Tutkimus ei täyttänyt yhdistettyjen tofasitinibiannosten ja TNF-estäjien väliselle ensisijaiselle vertailulle asetettua non-inferiority-kriteeriä, koska riskitiheyksien suhteelle asetettu 95 %:n luottamusvälin yläraja ylitti etukäteen määritetyn non-inferiority-kriteerin 1,8 todettujen MACE-tapahtumien ja todettujen syöpien osalta (ei-melanoottista ihosyöpää lukuun ottamatta).
Jäljempänä on esitetty tulokset todettujen MACE-tapahtumien, todettujen syöpien (ei-melanoottista ihosyöpää lukuun ottamatta) ja valikoitujen muiden tapahtumien osalta.
MACE (mukaan lukien sydäninfarkti) ja laskimotromboembolia
Muiden kuin kuolemaan johtaneiden sydäninfarktien määrän todettiin lisääntyneen tofasitinibilla hoidetuilla potilailla TNF-estäjiä saaneisiin potilaisiin verrattuna. TNF:n estäjiin verrattuna tofasitinibihoitoa saaneilla potilailla laskimotromboemboliatapahtumien ilmaantuvuuden todettiin olevan suurempi ja annosriippuvainen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Taulukko 13: MACE:n, sydäninfarktin ja laskimotromboembolian ilmaantumistiheys ja riskitiheyksien suhde
| Tofasitinibi 5 mg kahdesti vuorokaudessa | Tofasitinibi 10 mg kahdesti vuorokaudessaa | Molemmat tofasitinibi-annoksetb | TNF-estäjä (TNFi) | |
| MACEc | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,91 (0,67; 1,21) | 1,05 (0,78; 1,38) | 0,98 (0,79; 1,19) | 0,73 (0,52; 1,01) |
| HR (95 % CI) vs. TNFi | 1,24 (0,81; 1,91) | 1,43 (0,94; 2,18) | 1,33 (0,91; 1,94) | |
| Kuolemaan johtanut sydäninfarktic | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,00 (0,00; 0,07) | 0,06 (0,01; 0,18) | 0,03 (0,01; 0,09) | 0,06 (0,01; 0,17) |
| HR (95 % CI) vs. TNFi | 0,00 (0,00; Inf) | 1,03 (0,21; 5,11) | 0,50 (0,10; 2,49) | |
| Muu kuin kuolemaan johtanut sydäninfarktic | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,37 (0,22; 0,57) | 0,33 (0,19; 0,53) | 0,35 (0,24; 0,48) | 0,16 (0,07; 0,31) |
| HR (95 % CI) vs. TNFi | 2,32 (1,02; 5,30) | 2,08 (0,89; 4,86) | 2,20 (1,02; 4,75) | |
| Laskimotromboemboliad | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,33 (0,19; 0,53) | 0,70 (0,49; 0,99) | 0,51 (0,38; 0,67) | 0,20 (0,10; 0,37) |
| HR (95 % CI) vs. TNFi | 1,66 (0,76; 3,63) | 3,52 (1,74; 7,12) | 2,56 (1,30; 5,05) | |
| Keuhkoemboliad | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,17 (0,08; 0,33) | 0,50 (0,32; 0,74) | 0,33 (0,23; 0,46) | 0,06 (0,01; 0,17) |
| HR (95 % CI) vs. TNFi | 2,93 (0,79; 10,83) | 8,26 (2,49; 27,43) | 5,53 (1,70; 18,02) | |
| Syvä laskimotukosd | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,21 (0,11; 0,38) | 0,31 (0,17; 0,51) | 0,26 (0,17; 0,38) | 0,14 (0,06; 0,29) |
| HR (95 % CI) vs. TNFi | 1,54 (0,60; 3,97) | 2,21 (0,90; 5,43) | 1,87 (0,81; 4,30) | |
a Tofasitinibia 10 mg kahdesti vuorokaudessa saaneiden ryhmässä on tietoja potilaista, joiden tofasitinibiannos vaihdettiin 10 mg:sta kahdesti vuorokaudessa 5 mg:aan kahdesti vuorokaudessa tutkimuksessa tehdyn muutoksen seurauksena. b Yhdistetty tofasitinibiannos 5 mg kahdesti vuorokaudessa ja tofasitinibiannos 10 mg kahdesti vuorokaudessa. c Hoidon aikana tai 60 päivän kuluessa hoidon lopettamisesta ilmaantuneiden tapahtumien perusteella. d Hoidon aikana tai 28 päivän kuluessa hoidon lopettamisesta ilmaantuneiden tapahtumien perusteella. Lyhenteet: MACE = merkittävä sydän- ja verisuonitapahtuma, TNF = tuumorinekroositekijä, IR = ilmaantumistiheys (incidence rate), HR = riskitiheyksien suhde (hazard ratio), CI = luottamusväli (confidence interval), Inf = ääretön (infinity) | ||||
Tutkimuksessa määritettiin seuraavat sydäninfarktin (kuolemaan johtava ja muu kuin kuolemaan johtava) kehittymistä ennakoivat tekijät käyttämällä Coxin monimuuttujamallia takautuvasti (backward selection): ikä ≥ 65 vuotta, miespuolinen, nykyinen tai aiempi tupakointi, potilaan sairastama diabetes ja sepelvaltimotauti (johon sisältyy sydäninfarkti, sepelvaltimotauti, stabiili angina pectoris tai sepelvaltimotoimenpide) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Syövät
Tofasitinibilla hoidetuilla potilailla havaittiin syöpien (ei-melanoottista ihosyöpää lukuun ottamatta), erityisesti keuhkosyövän ja lymfooman lisääntymistä. Lisäksi tofasitinibilla hoidetuilla potilailla havaittiin ei-melanoottisen ihosyövän lisääntymistä TNF-estäjillä hoidettuihin potilaisiin verrattuna.
Taulukko 14: Syöpien ilmaantumistiheys ja riskitiheyksien suhdea
| Tofasitinibi 5 mg kahdesti vuorokaudessa | Tofasitinibi 10 mg kahdesti vuorokaudessab | Molemmat tofasitinibi-annoksetc | TNF-estäjä (TNFi) | |
| Syövät NMSC:tä lukuun ottamatta | ||||
| IR (95 % CI) / 100 potilasvuotta | 1,13 (0,87; 1,45) | 1,13 (0,86; 1,45) | 1,13 (0,94; 1,35) | 0,77 (0,55; 1,04) |
| HR (95 % CI) vs. TNFi | 1,47 (1,00; 2,18) | 1,48 (1,00; 2,19) | 1,48 (1,04; 2,09) | |
| Keuhkosyöpä | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,23 (0,12; 0,40) | 0,32 (0,18; 0,51) | 0,28 (0,19; 0,39) | 0,13 (0,05; 0,26) |
| HR (95 % CI) vs. TNFi | 1,84 (0,74; 4,62) | 2,50 (1,04; 6,02) | 2,17 (0,95; 4,93) | |
| Lymfooma | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,07 (0,02; 0,18) | 0,11 (0,04; 0,24) | 0,09 (0,04; 0,17) | 0,02 (0,00; 0,10) |
| HR (95 % CI) vs. TNFi | 3,99 (0,45; 35,70) | 6,24 (0,75; 51,86) | 5,09 (0,65; 39,78) | |
| NMSC | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,61 (0,41; 0,86) | 0,69 (0,47; 0,96) | 0,64 (0,50; 0,82) | 0,32 (0,18; 0,52) |
| HR (95 % CI) vs. TNFi | 1,90 (1,04; 3,47) | 2,16 (1,19; 3,92) | 2,02 (1,17; 3,50) | |
a Tiedot syövistä (ei-melanoottista ihosyöpää lukuun ottamatta), keuhkosyövästä ja lymfoomasta perustuvat hoidon aikana tai hoidon lopettamisen jälkeen tutkimuksen loppuun mennessä esiintyneisiin tapahtumiin. Tiedot ei-melanoottisesta ihosyövästä perustuvat hoidon aikana tai 28 päivän kuluessa hoidon lopettamisesta esiintyneisiin tapahtumiin. b Tofasitinibia 10 mg kahdesti vuorokaudessa saaneiden potilaiden ryhmässä on tietoja potilaista, joiden tofasitinibiannos vaihdettiin 10 mg:sta kahdesti vuorokaudessa 5 mg:aan kahdesti vuorokaudessa tutkimuksessa tehdyn muutoksen seurauksena. c Tofasitinibiannos 5 mg kahdesti vuorokaudessa ja annos 10 mg kahdesti vuorokaudessa. Lyhenteet: NMSC = ei-melanoottinen ihosyöpä, TNF = tuumorinekroositekijä, IR = ilmaantumistiheys (incidence rate), HR = riskitiheys (hazard ratio), CI = luottamusväli | ||||
Tutkimuksessa määritettiin seuraavat syövän kehittymistä (ei-melanoottista ihosyöpää lukuun ottamatta) ennakoivat tekijät käyttämällä Coxin monimuuttujamallia takautuvasti (backward selection): ikä ≥ 65 vuotta, nykyinen tai aiempi tupakointi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Kuolleisuus
Tofasitinibihoitoa saaneiden potilaiden kuolleisuuden havaittiin lisääntyneen TNF:n estäjiin verrattuna. Kuolleisuus johtui pääasiassa sydän- ja verisuonitapahtumista, infektioista ja syövistä.
Taulukko 15: Kuolleisuuden ilmaantumistiheys ja riskitiheyksien suhdea
| Tofasitinibi 5 mg kahdesti vuorokaudessa | Tofasitinibi 10 mg kahdesti vuorokaudessa b | Molemmat tofasitinibi-annoksetc | TNF-estäjä (TNFi) | |
| Kuolleisuus (kaikki syyt) | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,50 (0,33; 0,74) | 0,80 (0,57; 1,09) | 0,65 (0,50; 0,82) | 0,34 (0,20; 0,54) |
| HR (95 % CI) vs. TNFi | 1,49 (0,81; 2,74) | 2,37 (1,34; 4,18) | 1,91 (1,12; 3,27) | |
| Kuolemaan johtaneet infektiot | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,08 (0,02; 0,20) | 0,18 (0,08; 0,35) | 0,13 (0,07; 0,22) | 0,06 (0,01; 0,17) |
| HR (95 % CI) vs. TNFi | 1,30 (0,29; 5,79) | 3,10 (0,84; 11,45) | 2,17 (0,62; 7,62) | |
| Kuolemaan johtaneet sydän- ja verisuonitapahtumat | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,25 (0,13; 0,43) | 0,41 (0,25; 0,63) | 0,33 (0,23; 0,46) | 0,20 (0,10; 0,36) |
| HR (95 % CI) vs. TNFi | 1,26 (0,55; 2,88) | 2,05 (0,96; 4,39) | 1,65 (0,81; 3,34) | |
| Kuolemaan johtaneet syövät | ||||
| IR (95 % CI) / 100 potilasvuotta | 0,10 (0,03; 0,23) | 0,00 (0,00; 0,08) | 0,05 (0,02; 0,12) | 0,02 (0,00; 0,11) |
| HR (95 % CI) vs. TNFi | 4,88 (0.57; 41,74) | 0 (0,00; Inf) | 2,53 (0,30; 21,64) |
a Hoidon aikana tai 28 päivän kuluessa hoidon lopettamisesta ilmaantuneiden tapahtumien perusteella.
b Tofasitinibia 10 mg kahdesti vuorokaudessa saaneiden potilaiden ryhmässä on tietoja potilaista, joiden tofasitinibiannos vaihdettiin 10 mg:sta kahdesti vuorokaudessa 5 mg:aan kahdesti vuorokaudessa tutkimuksessa tehdyn muutoksen seurauksena.
c Tofasitinibiannos 5 mg kahdesti vuorokaudessa ja annos 10 mg kahdesti vuorokaudessa.
Lyhenteet: TNF = tuumorinekroositekijä, IR = ilmaantumistiheys (incidence rate), HR = riskitiheys (hazard ratio), CI = luottamusväli (confidence interval), Inf = ääretön (infinity)
Nivelpsoriaasi
Kalvopäällysteisten tofasitinibitablettien tehoa ja turvallisuutta aikuispotilaiden aktiivisen nivelpsoriaasin (≥ 3 turvonnutta ja ≥ 3 aristavaa niveltä) hoidossa on arvioitu 2 satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 tutkimuksessa. Potilailla oli oltava aktiivinen läiskäpsoriaasi seulontakäynnillä. Kummassakin tutkimuksessa ensisijaiset päätetapahtumat olivat ACR20-vasteen saavuttaneiden prosenttiosuus ja HAQ-DI-indeksin muutos lähtötilanteesta tutkimuskuukauden 3 kohdalla.
Tutkimuksessa PsA‑I (OPAL BROADEN) arvioitiin 422:ta potilasta, joiden aiempi vaste csDMARD-lääkkeeseen (MTX 92,7 %:lla potilaista) oli riittämätön (tehon puutteen tai intoleranssin vuoksi); 32,7 %:lla tämän tutkimuksen potilaista aiempi vaste > 1 csDMARD-lääkkeeseen tai 1 csDMARD-lääkkeeseen ja synteettiseen DMARD -täsmälääkkeeseen (tsDMARD) oli riittämätön. OPAL BROADEN -tutkimuksessa aiempi TNF:n estäjähoito ei ollut sallittua. Kaikkien potilaiden hoitoon oli kuuluttava 1 samanaikainen csDMARD; 83,9 % potilaista sai samanaikaisesti MTX:ää, 9,5 % potilaista sai samanaikaisesti sulfasalatsiinia ja 5,7 % potilaista sai samanaikaisesti leflunomidia. Nivelpsoriaasin keston mediaani oli 3,8 vuotta. Lähtötilanteessa 79,9 %:lla potilaista oli entesiitti ja 56,2 %:lla daktyliitti. Tofasitinibihoitoon satunnaistetut potilaat saivat tofasitinibia joko 5 mg kaksi kertaa vuorokaudessa tai 10 mg kaksi kertaa vuorokaudessa 12 kuukauden ajan. Lumelääkeryhmään satunnaistetut potilaat siirrettiin tutkimuskuukauden 3 kohdalla sokkoutetusti ryhmiin, joista toinen sai tofasitinibia 5 mg kaksi kertaa vuorokaudessa ja toinen tofasitinibia 10 mg kaksi kertaa vuorokaudessa tutkimuskuukauteen 12 asti. Adalimumabihoitoon (vaikuttavan vertailuvalmisteen ryhmä) satunnaistetut potilaat saivat 40 mg ihon alle joka toinen viikko 12 kuukauden ajan.
Tutkimuksessa PsA‑II (OPAL BEYOND) arvioitiin 394:ää potilasta, jotka olivat lopettaneet TNF:n estäjähoidon tehon puutteen tai intoleranssin vuoksi; 36,0 %:lla aiempi vaste > 1 biologiseen DMARD-lääkkeeseen oli ollut riittämätön. Kaikilla potilailla oli oltava 1 samanaikainen csDMARD; 71,6 % potilaista sai samanaikaisesti MTX:ää, 15,7 % potilaista sai samanaikaisesti sulfasalatsiinia ja 8,6 % potilaista sai samanaikaisesti leflunomidia. Nivelpsoriaasin keston mediaani oli 7,5 vuotta. Lähtötilanteessa 80,7 %:lla potilaista oli entesiitti ja 49,2 %:lla daktyliitti. Tofasitinibihoitoon satunnaistetut potilaat saivat joko 5 mg tai 10 mg kaksi kertaa vuorokaudessa 6 kuukauden ajan. Lumelääkeryhmään satunnaistetut potilaat siirrettiin tutkimuskuukauden 3 kohdalla sokkoutetusti tofasitinibiryhmiin, joista toinen sai tofasitinibia 5 mg kaksi kertaa vuorokaudessa ja toinen tofasitinibia10 mg kaksi kertaa vuorokaudessa tutkimuskuukauteen 6 asti.
Merkit ja oireet
Lumelääkkeeseen verrattuna tofasitinibihoito paransi nivelpsoriaasin joitakin merkkejä ja oireita merkitsevästi ACR20-vastekriteereillä arvioituna tutkimuskuukauden 3 kohdalla. Taulukossa 16 on esitetty tulokset tärkeistä tehoa koskeneista päätetapahtumista.
Taulukko 16: Kliinisen vasteen saavuttaneiden nivelpsoriaasipotilaiden osuus (%) ja keskimääräinen muutos lähtötilanteesta tutkimuksissa OPAL BROADEN ja OPAL BEYOND
Perinteinen synteettinen DMARD Riittämätön hoitovastea (ei aiempaa TNF:n estäjähoitoa) | Riittämätön vaste TNF:n estäjähoitoonb | ||||
| OPAL BROADEN | OPAL BEYONDc | ||||
| Hoito-ryhmä | Lume-lääke | Tofasitinibi 5 mg x 2/vrk | Adalimumabi 40 mg ihon alle joka toinen viikko | Lume-lääke | Tofasitinibi 5 mg x 2/vrk |
| N | 105 | 107 | 106 | 131 | 131 |
ACR20 Kuukausi 3 Kuukausi 6 Kuukausi 12 | 33 % NA NA | 50 %d,* 59 % 68 % | 52 %* 64 % 60 % | 24 % NA - | 50 %d,*** 60 % - |
ACR50 Kuukausi 3 Kuukausi 6 Kuukausi 12 | 10 % NA NA | 28 %e,** 38 % 45 % | 33 %*** 42 % 41 % | 15 % NA - | 30 %e,* 38 % - |
ACR70 Kuukausi 3 Kuukausi 6 Kuukausi 12 | 5 % NA NA | 17 %e,* 18 % 23 % | 19 %* 30 % 29 % | 10 % NA - | 17 % 21 % - |
∆LEIf Kuukausi 3 Kuukausi 6 Kuukausi 12 | −0,4 NA NA | −0,8 −1,3 −1,7 | −1,1* −1,3 −1,6 | −0,5 NA - | −1,3* −1,5 - |
∆DSSf Kuukausi 3 Kuukausi 6 Kuukausi 12 | −2,0 NA NA | −3,5 −5,2 −7,4 | −4,0 −5,4 −6,1 | −1,9 NA - | −5,2* −6,0 - |
PASI75g Kuukausi 3 Kuukausi 6 Kuukausi 12 | 15 % NA NA | 43 %d,*** 46 % 56 % | 39 %** 55 % 56 % | 14 % NA - | 21 % 34 % - |
* Nominaalinen p ≤ 0,05; ** nominaalinen p < 0,001; *** nominaalinen p < 0,0001 vaikuttavan hoidon suhteen verrattuna lumelääkkeeseen tutkimuskuukauden 3 kohdalla. Lyhenteet: BSA = BSA-arvo; ∆LEI = Leedsin entesiitti-indeksin (Leeds Enthesitis Index) muutos lähtötilanteesta; ∆DSS = daktyliitin vaikeusastetta kuvaavan pistemäärän (Dactylitis Severity Score) muutos lähtötilanteesta; ACR20/50/70 = American College of Rheumatology ‑vasteen paraneminen ≥ 20 %, ≥ 50 %, ≥ 70 %; csDMARD = perinteinen synteettinen tautiprosessia hidastava reumalääke; N = satunnaistettujen ja hoidettujen potilaiden lukumäärä; NA = ei sovellettavissa, koska tietoja lumehoidosta on saatavilla vain tutkimuskuukauteen 3 asti, jolloin lumelääkettä saaneet siirrettiin saamaan joko tofasitinibia 5 mg kaksi kertaa vuorokaudessa tai tofasitinibia 10 mg kaksi kertaa vuorokaudessa; TNFi = tuumorinekroositekijän estäjä; PASI = psoriaasin pinta-alaa ja vaikeusastetta kuvaava indeksi (Psoriasis Area and Severity Index); PASI75 = PASI-indeksin paraneminen ≥ 75 %. a Riittämätön vaste vähintään 1 csDMARD-lääkkeeseen tehon puutteen ja/tai intoleranssin vuoksi. b Riittämätön vaste vähintään 1 TNF:n estäjään tehon puutteen ja/tai intoleranssin vuoksi. c OPAL BEYOND ‑tutkimuksen kesto oli 6 kuukautta. d Saavutti globaalin tilastollisen merkitsevyyden p-arvolla ≤ 0,05 ennalta määritellyn alaspäin askeltavan testausproseduurin mukaisesti. e Saavutti tilastollisen merkitsevyyden ACR-perheessä (ACR50 ja ACR70) p-arvolla ≤ 0,05 ennalta määritellyn alaspäin askeltavan (step down) testausproseduurin mukaisesti. f Potilaille, joilla pistemäärä lähtötilanteessa > 0. g Potilaille, joilla lähtötilanteessa BSA ≥ 3 % ja PASI > 0. | |||||
Lumelääkkeeseen verrattuna ACR20-vasteet olivat tutkimuskuukauden 3 kohdalla merkitsevästi suuremmat sekä niillä tofasitinibia 5 mg kahdesti vuorokaudessa saaneilla potilailla, jotka eivät olleet saaneet aiempaa TNF:n estäjähoitoa, että niillä, joiden vaste TNF:n estäjähoitoon oli riittämätön. Ikää, sukupuolta, rotua, lähtötilanteen tautiaktiivisuutta ja PsA:n alatyyppiä koskeneissa tutkimuksissa ei tunnistettu eroja tofasitinibivasteen suhteen. Niiden potilaiden lukumäärä, joilla oli mutiloiva artriitti tai aksiaalinen tautimuoto, oli liian pieni merkityksellistä arviointia varten. Lumelääkkeeseen verrattuna ACR20-vasteen saaneiden osuus havaittiin kummassakin tutkimuksessa tilastollisesti merkitseväksi jo viikolla 2 (ensimmäinen lähtötilanteen jälkeinen arviointi) ryhmässä, joka sai tofasitinibia 5 mg kaksi kertaa vuorokaudessa.
OPAL BROADEN -tutkimuksessa vähäisen tautiaktiivisuuden (minimal disease activity, MDA) vaste saavutettiin 26,2 %:lla ryhmässä, joka sai tofasitinibia 5 mg kaksi kertaa vuorokaudessa, 25,5 %:lla adalimumabiryhmässä ja 6,7 %:lla lumelääkeryhmässä (tofasitinibi 5 mg kaksi kertaa vuorokaudessa ‑hoidon ero lumelääkkeeseen verrattuna: 19,5 % [95 %:n luottamusväli: 9,9; 29,1]) tutkimuskuukauden 3 kohdalla. OPAL BEYOND -tutkimuksessa vähäinen tautiaktiivisuus saavutettiin 22,9 %:lla potilailla, jotka saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa, ja 14,5 %:lla lumelääkettä saaneilla potilailla. Ryhmässä, joka sai tofasitinibia 5 mg kaksi kertaa vuorokaudessa, ei kuitenkaan saavutettu nominaalista tilastollista merkitsevyyttä (hoitoero lumelääkkeeseen verrattuna 8,4 % [95 %:n luottamusväli: −1,0; 17,8] tutkimuskuukauden 3 kohdalla).
Röntgenologisesti todennettu vaste
OPAL BROADEN -tutkimuksessa rakenteellisten nivelvaurioiden etenemistä arvioitiin röntgenologisesti tutkimuskuukauden 12 kohdalla van der Heijde ‑muokattujen Sharpin kokonaispisteiden (van der Heijde modified Total Sharp Score, mTSS) avulla ja niiden potilaiden osuutena, joilla tauti oli röntgenologisesti edennyt (mTSS-suurenema lähtötilanteesta yli 0,5). Tutkimuskuukauden 12 kohdalla tauti ei ollut röntgenologisesti edennyt 96 %:lla potilaista, jotka saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa, eikä 98 %:lla potilaista, jotka saivat adalimumabia 40 mg ihon alle joka toinen viikko (mTSS-suurenema lähtötilanteesta alle tai yhtä suuri kuin 0,5).
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu
Fyysisen toimintakyvyn paranemista mitattiin HAQ-DI-indeksillä. Lumelääkkeeseen verrattuna fyysisen toimintakyvyn osoitettiin tutkimuskuukauden 3 kohdalla parantuneen lähtötilanteesta enemmän (p ≤ 0,05) potilailla, jotka saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa (ks. taulukko 17).
Taulukko 17: HAQ-DI-indeksin muutos lähtötilanteesta PsA-tutkimuksissa OPAL BROADEN ja OPAL BEYOND
| HAQ-DI-indeksin muutos (LS mean) lähtötilanteesta | |||||
| Riittämätön vaste perinteisiin synteettisiin DMARD-lääkkeisiina (ei aiempaa TNF:n estäjähoitoa) | Riittämätön vaste TNF:n estäjähoitoonb | ||||
| OPAL BROADEN | OPAL BEYOND | ||||
| Hoitoryhmä | Lume-lääke | Tofasitinibi 5 mg x 2/vrk | Adalimumabi 40 mg ihon alle kahden viikon välein | Lume-lääke | Tofasitinibi 5 mg x 2/vrk |
| N | 104 | 107 | 106 | 131 | 129 |
| Kuukausi 3 | −0,18 | −0,35c,* | −0,38* | −0,14 | −0,39c,*** |
| Kuukausi 6 | NA | −0,45 | −0,43 | NA | −0,44 |
| Kuukausi 12 | NA | −0,54 | −0,45 | NA | NA |
* Nominaalinen p ≤ 0,05; *** nominaalinen p < 0,0001 vaikuttavalla aineella annetun hoidon suhteen verrattuna lumelääkkeeseen tutkimuskuukauden 3 kohdalla.
Lyhenteet: DMARD = tautiprosessia hidastava reumalääke; HAQ-DI = toimintakykyindeksi (Health Assessment Questionnaire Disability Index); N = potilaiden kokonaismäärä tilastollisessa analyysissa; TNFi = tuumorinekroositekijän estäjä.
a Riittämätön vaste vähintään yhteen perinteiseen synteettiseen DMARD (csDMARD) ‑lääkkeeseen tehon puutteen ja/tai intoleranssin vuoksi.
b Riittämätön vaste vähintään yhteen TNF:n estäjään (TNFi) tehon puutteen ja/tai intoleranssin vuoksi.
c Saavutti globaalin tilastollisen merkitsevyyden p-arvolla ≤ 0,05 ennalta määritellyn alaspäin askeltavan (step‑down) testausprosessin mukaisesti.
HAQ-DI-indeksillä mitattuna hoitoon vastanneita (vaste määriteltiin indeksin pienenemisenä lähtötilanteesta ≥ 0,35) oli tutkimuskuukauden 3 kohdalla OPAL BROADEN -tutkimuksessa 53 % ja OPAL BEYOND -tutkimuksessa 50 % ryhmässä, joka sai tofasitinibia 5 mg kahdesti vuorokaudessa, vastaavasti 31 % ja 28 % lumelääkeryhmissä sekä 53 % ryhmässä, joka sai 40 mg adalimumabia ihon alle joka toinen viikko (vain OPAL BROADEN -tutkimuksessa).
Terveyteen liittyvää elämänlaatua arvioitiin SF-36v2‑kyselyllä ja väsymystä arvioitiin FACIT-F-asteikolla. OPAL BROADEN- ja OPAL BEYOND -tutkimuksissa todettiin tutkimuskuukauden 3 kohdalla suurempaa paranemista lähtötilanteeseen nähden seuraavissa mittareissa potilailla, jotka saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa: SF-36v2‑kyselyn fyysistä toimintakykyä koskenut osa-alue, SF-36v2‑kyselyn fyysisen osion pistemäärä ja FACIT-F-pistemäärä (nominaalinen p ≤ 0,05). SF‑36v2‑kyselyn ja FACIT-F-asteikon lähtötilanteesta parantuneet tulokset säilyivät tutkimuskuukauden 6 loppuun asti (OPAL BROADEN ja OPAL BEYOND) ja tutkimuskuukauden 12 loppuun asti (OPAL BROADEN).
OPAL BROADEN- ja OPAL BEYOND -tutkimuksissa osoitettiin, että niveltulehduksesta johtuva kipu lievittyi (mitattuna VAS-asteikolla 0–100) lähtötilanteesta enemmän viikolla 2 (ensimmäinen lähtötilanteen jälkeinen arviointi) tutkimuskuukauden 3 loppuun asti potilailla, jotka saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa, kuin lumelääkettä saaneilla (nominaalinen p ≤ 0,05).
Selkärankareuma
Tofasitinibin kliiniseen kehitysohjelmaan tehon ja turvallisuuden arvioimiseksi sisältyi yksi lumekontrolloitu varmistava tutkimus (AS-I-tutkimus). AS‑I-tutkimus oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, 48 viikon pituinen kliininen tutkimus 269 aikuisella potilaalla, joiden vaste vähintään kahteen tulehduskipulääkkeeseen oli ollut riittämätön (riittämätön kliininen vaste tai intoleranssi). Potilaat satunnaistettiin ja he saivat sokkoutettuna joko 5 mg tofasitinibia tai lumelääkettä kaksi kertaa vuorokaudessa 16 viikon ajan, jonka jälkeen kaikki saivat tofasitinibia 5 mg kaksi kertaa vuorokaudessa 32 viikon ajan. Potilailla oli aktiivinen tauti, jollaiseksi se määriteltiin sekä BASDAI-indeksin (Bath Ankylosing Spondylitis Disease Activity Index) että selkäkivun pistemäärällä (BASDAI-indeksin kysymys 2) vähintään 4 huolimatta hoidosta tulehduskipulääkkeillä, kortikosteroideilla tai tautiprosessia hidastavalla reumalääkkeellä (DMARD).
Noin 7 % potilaista käytti samanaikaisesti metotreksaattia ja 21 % potilaista sulfasalatsiinia lähtötilanteesta viikkoon 16 saakka. Potilaat saivat käyttää lähtötilanteesta viikkoon 48 saakka pieniä vakioannoksia suun kautta otettavia kortikosteroideja (8,6 % käytti näitä) ja/tai tulehduskipulääkkeitä (81,8 % käytti näitä). Potilaista 22 %:lla oli riittämätön vaste yhteen tai kahteen TNF:n estäjään. Ensisijainen päätetapahtuma oli arvioida niiden potilaiden osuus, jotka saavuttivat ASAS20-vasteen viikolla 16.
Kliininen vaste
Tofasitinibia 5 mg kaksi kertaa vuorokaudessa saaneiden potilaiden ASAS20- ja ASAS40-vasteet viikolla 16 olivat parantuneet enemmän kuin lumehoitoa saaneiden (taulukko 18). Tofasitinibia 5 mg kaksi kertaa vuorokaudessa saaneiden potilaiden vasteet säilyivät viikosta 16 viikkoon 48.
Taulukko 18: AS-I-tutkimuksen ASAS20- ja ASAS40-vasteet viikolla 16
Lumelääke (N = 136) | Tofasitinibi 5 mg x 2/vrk (N = 133) | Ero lumelääkkeeseen (95 % CI) | |
| ASAS20-vaste*, % | 29 | 56 | 27 (16, 38)** |
| ASAS40-vaste*, % | 13 | 41 | 28 (18, 38)** |
* tyypin I virhe kontrolloitu.
** p < 0,0001.
Tofasitinibin teho osoitettiin potilailla, jotka eivät aiemmin olleet saaneet bDMARD-lääkkeitä, ja potilailla, joiden vaste TNF:n estäjiin oli riittämätön (IR) / jotka olivat aiemmin saaneet bDMARD-lääkkeitä (non-IR) (taulukko 19).
Taulukko 19: AS-I-tutkimuksen ASAS20- ja ASAS40-vasteet (%) viikolla 16 hoitohistorian mukaan
| Aiempi hoitohistoria | Tehon päätetapahtuma | |||||
| ASAS20 | ASAS40 | |||||
Lume-lääke N | Tofasitinibi 5 mg x 2/vrk N | Ero lume-lääkkeeseen (95 % CI) | Lume-lääke N | Tofasitinibi 5 mg x 2/vrk N | Ero lume-lääkkeeseen (95 % CI) | |
| Ei aiempaa hoitoa bDMARD-lääkkeillä | 105 | 102 | 28 (15, 41) | 105 | 102 | 31 (19, 43) |
| TNFi-IR tai aiempi hoito bDMARD-lääkkeillä (non-IR) | 31 | 31 | 23 (1, 44) | 31 | 31 | 19 (2, 37) |
| ASAS20 = asteikolla 0–10 mitattuna vähintään kolmella osa-alueella ≥ 20 %:n paraneminen ja ≥ 1 yksikön lisäys lähtötilanteesta eikä muilla osa-alueilla ≥ 20 %:n ja ≥ 1 yksikön huononemista; ASAS40 = asteikolla 0–10 mitattuna vähintään kolmella osa-alueella ≥ 40 %:n paraneminen ja ≥ 2 yksikön lisäys lähtötilanteesta eikä muilla osa-alueilla lainkaan huononemista; bDMARD = tautiprosessia hidastava biologinen reumalääke; CI = luottamusväli (confidence interval); non-IR = ei-riittämätöntä vastetta; TNFi-IR = riittämätön vaste tuumorinekroositekijän estäjiin. | ||||||
5 mg tofasitinibia kaksi kertaa vuorokaudessa paransi yksittäisiä ASAS-vasteen osa-alueita ja muita taudin aktiivisuutta kuvaavia mittareita enemmän kuin lumelääke viikolla 16, kuten taulukossa 20 osoitetaan. Paraneminen säilyi 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla viikosta 16 viikkoon 48.
Taulukko 20: AS-I-tutkimuksen ASAS-osa-alueet ja muut taudin aktiivisuuden mittarit viikolla 16
Lumelääke (N = 136) | Tofasitinibi 5 mg x 2/vrk (N = 133) | ||||
Lähtö-tilanne (keskiarvo) | Viikko 16 (pienimmän neliösumman keskiarvon muutos lähtö-tilanteesta) | Lähtö-tilanne (keskiarvo) | Viikko 16 (pienimmän neliösumman keskiarvon muutos lähtö-tilanteesta) | Ero lume-lääkkeeseen (95 % CI) | |
| ASAS-osa-alueet | |||||
| 7,0 | -0,9 | 6,9 | -2,5 | -1,6 (‑2,07, ‑1,05)** |
| 6,9 | -1,0 | 6,9 | -2,6 | -1,6 (‑2,10, ‑1,14)** |
(0‑10)b,* | 5,9 | -0,8 | 5,8 | -2,0 | -1,2 (‑1,66, ‑0,80)** |
| 6,8 | -1,0 | 6,6 | -2,7 | -1,7 (‑2,18, ‑1,25)** |
| BASDAI-pisteetd | 6,5 | -1,1 | 6,4 | -2,6 | -1,4 (‑1,88, ‑1,00)** |
| BASMIe,* | 4,4 | -0,1 | 4,5 | -0,6 | -0,5 (‑0,67, ‑0,37)** |
| hsCRPf,* (mg/dl) | 1,8 | -0,1 | 1,6 | -1,1 | -1,0 (‑1,20, ‑0,72)** |
| ASDAScrpg,* | 3,9 | -0,4 | 3,8 | -1,4 | -1,0 (‑1,16, ‑0,79)** |
* tyypin I virhe kontrolloitu. ** p < 0,0001. a Mitattu numeerisella arviointiasteikolla, jossa 0 = ei aktiivinen tai ei kipua, 10 = hyvin aktiivinen tai vaikea-asteisin kipu. b BASFI-indeksi (Bath Ankylosing Spondylitis Functional Index) mitattu numeerisella arviointiasteikolla, jossa 0 = helppo ja 10 = mahdoton. c Tulehdus on BASDAI-itsearvioinnissa jäykkyyttä raportoineiden kahden potilaan keskiarvo. d BASDAI-indeksin (Bath Ankylosing Spondylitis Disease Activity Index) kokonaispisteet. e BASMI-indeksi (Bath Ankylosing Spondylitis Metrology Index). f Herkkä C-reaktiivisen proteiinin määritys. g Selkärankareuman aktiivisuutta C-reaktiivisen proteiinin perusteella kuvaavat pisteet (Ankylosing Spondylitis Disease Activity Score [ASDAS] with C-reactive protein [CRP]). | |||||
Muut terveyteen liittyvät hoitotulokset
Selkärankareumaan liittyvää elämänlaatua osoittavien (Ankylosing Spondylitis Quality of Life) ASQoL-kokonaispisteiden (‑4,0 vs ‑2,0) ja kroonisen sairauden hoitoon liittyvää toimintakykyä väsymyksen perusteella arvioivat (Functional Assessment of Chronic Illness Therapy – Fatigue) FACIT-F‑kokonaispisteet (6,5 vs 3,1) olivat viikolla 16 parantuneet 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla lähtötilanteesta enemmän kuin lumelääkehoitoa saaneilla potilailla (p < 0,001). SF-36v2-kyselyn (Short Form health survey version 2) fyysistä vointia koskevassa PCS-osiossa (Physical Component Summary) 5 mg tofasitinibia kaksi kertaa vuorokaudessa saaneilla potilailla paraneminen lähtötilanteeseen nähden oli viikolla 16 yhdenmukaisesti suurempaa kuin lumelääkehoitoa saaneilla potilailla.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset tofasitinibin käytöstä lastenreuman (JIA) ja haavaisen paksusuolitulehduksen hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Kun 11 mg tofasitinibi-depottabletti otetaan suun kautta, huippupitoisuus plasmassa saavutetaan 4 tunnissa ja puoliintumisaika ~6 tunnissa. Vakaan tilan pitoisuus saavutetaan 48 tunnissa, ja kumuloituminen kerran vuorokaudessa tapahtuvan annon yhteydessä on hyvin vähäistä. Kerran vuorokaudessa otettavan 11 mg tofasitinibi-depottabletin AUC‑ ja Cmax-arvot ovat vakaassa tilassa vastaavat kuin kahdesti vuorokaudessa otettavilla kalvopäällysteisillä 5 mg tofasitinibitableteilla.
Imeytyminen ja jakautuminen
11 mg tofasitinibi-depottabletin anto runsasrasvaisen aterian yhteydessä ei muuttanut AUC-arvoa, mutta Cmax suureni 27 %.
Laskimoon tapahtuneen annon jälkeen jakautumistilavuus on 87 l. Kiertävästä tofasitinibista plasman proteiineihin sitoutuneena on noin 40 %. Tofasitinibi sitoutuu pääasiassa albumiiniin, eikä se vaikuta sitoutuvan α1-happamaan glykoproteiiniin. Tofasitinibi jakautuu samassa määrin veren punasoluihin ja plasmaan.
Biotransformaatio ja eliminaatio
Tofasitinibin puhdistumamekanismit ovat maksametabolia noin 70 % ja kanta-aineen erittyminen munuaisten kautta noin 30 %. Tofasitinibin metabolia on pääasiassa CYP3A4-välitteinen, ja CYP2C19 osallistuu siihen vähäisessä määrin. Ihmisellä radiomerkityllä lääkeaineella tehdyssä tutkimuksessa yli 65 % verenkierrossa olevasta kokonaisradioaktiivisuudesta vastasi muuttumatonta vaikuttavaa ainetta ja loput 35 % vastasi kahdeksaa metaboliittia, joista kukin vastasi alle 8 %:aa kokonaisradioaktiivisuudesta. Kaikkia metaboliitteja on havaittu eri eläinlajeilla. Niiden vaikutuksen JAK1/3:n estoon oletetaan olevan alle kymmenkertainen tofasitinibiin verrattuna. Molekyylirakenteen samanaikaisesta muuntumisesta (stereo conversion) ihmisnäytteissä ei havaittu näyttöä. Tofasitinibin farmakologinen aktiivisuus liittyy kantamolekyyliin. In vitro tofasitinibi on MDR1:n substraatti, mutta se ei toimi substraattina rintasyövän resistenssiproteiinille (BCRP), OATP1B1/1B3:lle tai OCT1/2:lle.
Farmakokinetiikka potilailla
CYP-entsyymien aktiivisuus on nivelreumapotilailla vähentynyt kroonisen tulehduksen vuoksi. Tofasitinibin oraalinen puhdistuma ei vaihtele nivelreumapotilailla ajan mittaan viitaten siihen, että tofasitinibihoito ei normalisoi CYP-entsyymien aktiivisuutta.
Nivelreumapotilaiden populaatiofarmakokineettinen analyysi osoitti, että systeeminen altistus (AUC) tofasitinibille oli potilaiden painon ääripäissä (40 kg, 140 kg) samankaltainen (5 %:n tarkkuudella) kuin 70 kg:n painoisella potilaalla. Iäkkäiden 80-vuotiaiden potilaiden AUC-arvon arvioitiin olevan alle 5 % suurempi verrattuna nivelreumapotilaisiin, joiden iän keskiarvo on 55 vuotta. Naisten AUC-arvon arvioitiin olevan miehiin nähden 7 % pienempi. Käytettävissä olevat tiedot ovat myös osoittaneet, ettei tofasitinibin AUC-arvossa ole merkittäviä eroja valkoihoisten, mustaihoisten ja aasialaisten potilaiden välillä. Painon ja jakautumistilavuuden välillä havaittiin lähes lineaarinen suhde, jolloin suurimmat huippupitoisuudet (Cmax) ja alimmat pienimmät pitoisuudet (Cmin) esiintyivät kevyimmillä potilailla. Tämän eron ei kuitenkaan katsota olevan kliinisesti merkityksellinen. Tofasitinibin AUC-arvon vaihtelun tutkimuspotilaiden välillä (vaihtelun % -kerroin) arvioidaan olevan noin 27 %.
Aktiivista nivelpsoriaasia tai selkärankareumaa sairastaneiden potilaiden populaatiofarmakokineettisen analyysin tulokset olivat yhdenmukaiset nivelreumapotilailla saatujen tulosten kanssa.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavien tutkittavien AUC oli 37 % (lievä vajaatoiminta, kreatiniinipuhdistuma 50–80 ml/min), 43 % (kohtalainen vajaatoiminta, kreatiniinipuhdistuma 30–49 ml/min) ja 123 % (vaikea vajaatoiminta, kreatiniinipuhdistuma < 30 ml/min) suurempi verrattuna tutkittaviin, joiden munuaisten toiminta oli normaali (ks. kohta Annostus ja antotapa). Loppuvaiheen munuaistautia (ESRD) sairastavilla tutkittavilla dialyysihoidon merkitys tofasitinibin kokonaispuhdistuman kannalta oli suhteellisen vähäinen. Kun loppuvaiheen munuaistautia sairastaville tutkittaville annettiin 10 mg:n kerta-annos, muuna kuin dialyysipäivänä mitatun pitoisuuden keskimääräinen AUC-arvo oli noin 40 % (90 %:n luottamusvälit: 1,5–95 %) suurempi verrattuna tutkittaviin, joiden munuaisten toiminta oli normaali. Tofasitinibia ei tutkittu kliinisissä tutkimuksissa potilailla, joiden kreatiniinipuhdistuma (Cockcroft-Gaultin kaavalla arvioituna) oli lähtötilanteessa alle 40 ml/min (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Lievää maksan vajaatoimintaa (Child–Pugh A) sairastavien tutkittavien AUC oli 3 % ja kohtalaista maksan vajaatoimintaa (Child–Pugh B) sairastavien potilaiden AUC oli 65 % suurempi verrattuna tutkittaviin, joiden maksan toiminta oli normaali. Tofasitinibia ei tutkittu kliinisissä tutkimuksissa tutkittavilla, joilla oli vaikeaa maksan vajaatoimintaa (Child–Pugh C) (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet) tai jotka olivat seulonnassa todettu HBV- tai HCV-positiivisiksi.
Yhteisvaikutukset
Tofasitinibi ei ole CYP-entsyymien (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ja CYP3A4) estäjä eikä induktori, eikä myöskään UGT:n estäjä (UGT1A1, UGT1A4, UGT1A6, UGT1A9 ja UGT2B7). Tofasitinibi ei ole MDR1:n, OATP1B1/1B3:n, OCT2:n, OAT1/3:n tai MRP:n estäjä kliinisesti merkittävinä pitoisuuksina.
Depottablettien ja kalvopäällysteisten tablettien farmakokinetiikan vertailu
Kerran vuorokaudessa otettavalla 11 mg tofasitinibi-depottabletilla on osoitettu olevan vastaava farmakokinetiikka (AUC ja Cmax) kuin kahdesti vuorokaudessa otettavilla 5 mg kalvopäällysteisillä tofasitinibitableteilla.
Prekliiniset tiedot turvallisuudesta
Non-kliinisissä tutkimuksissa havaittiin vaikutuksia immuunisysteemiin ja hematopoieettiseen järjestelmään. Näiden katsottiin liittyvän tofasitinibin farmakologisiin ominaisuuksiin (JAK-kinaasin estoon). Kliinisesti merkityksellisillä annoksilla havaittiin immuunivasteen heikentymisestä aiheutuvia toissijaisia vaikutuksia, kuten bakteeri- ja virusinfektioita sekä lymfoomaa. Lymfooma havaittiin 3 aikuisella apinalla 8:sta, kun altistus oli kuusin- tai kolminkertainen tofasitinibin kliiniseen altistukseen verrattuna (sitoutumattoman aineen AUC ihmisellä annosten 5 mg tai 10 mg kaksi kertaa vuorokaudessa yhteydessä). Lymfoomia ei havaittu yhdelläkään nuorella apinalla 14:stä, kun tofasitinibialtistus oli viisin- tai 2,5-kertainen annoksista 5 mg tai 10 mg kaksi kertaa vuorokaudessa aiheutuvaan kliiniseen altistukseen nähden. Lymfoomien osalta apinoille haitaton annos (No Observable Adverse Effect Level, NOAEL) oli suunnilleen 1- tai 0,5-kertainen verrattuna annoksista 5 mg tai 10 mg kaksi kertaa vuorokaudessa aiheutuvaan kliiniseen altistukseen. Muita löydöksiä ihmisen altistusta suuremmilla annoksilla olivat vaikutukset maksaan ja maha-suolikanavaan.
Tofasitinibi ei ole mutageeninen eikä genotoksinen geenimutaatioita ja kromosomipoikkeavuuksia selvittäneiden in vitro- ja in vivo ‑koesarjojen tulosten perusteella.
Tofasitinibin karsinogeenisuutta tutkittiin kuusi kuukautta kestäneessä karsinogeenisuustutkimuksessa rasH2-siirtogeenisillä hiirillä ja kaksi vuotta kestäneessä karsinogeenisuustutkimuksessa rotilla. Tofasitinibi ei ollut karsinogeeninen hiirillä 38- tai 19-kertaisella altistuksella verrattuna annoksista 5 mg tai 10 mg kaksi kertaa vuorokaudessa aiheutuvaan kliiniseen altistukseen. Rotilla havaittiin hyvänlaatuisia kivesten interstitiaalisolujen (Leydigin solujen) kasvaimia: rotilla havaitut hyvänlaatuiset leydiginsolukasvaimet eivät liity ihmisen leydiginsolukasvainriskiin. Hibernoomia (ruskean rasvakudoksen syöpää) havaittiin naarasrotilla altistuksella, joka oli vähintään 83- tai 41-kertainen verrattuna annoksista 5 mg tai 10 mg kaksi kertaa vuorokaudessa aiheutuvaan kliiniseen altistukseen. Hyvänlaatuisia kateenkorvakasvaimia havaittiin naarasrotilla 187- tai 94-kertaisella altistuksella verrattuna annoksista 5 mg tai 10 mg kaksi kertaa vuorokaudessa aiheutuvaan kliiniseen altistukseen.
Tofasitinibin osoitettiin olevan teratogeeninen rotilla ja kaniineilla, ja sen on osoitettu vaikuttavan rotilla naaraiden hedelmällisyyteen (tiineyksien vähenemistä, keltarauhasten lukumäärän vähenemistä, implantaatiokohtien vähenemistä, elinkykyisten sikiöiden vähenemistä ja varhaisvaiheen resorptioiden lisääntymistä), synnytykseen sekä peri-/postnataaliseen kehitykseen. Tofasitinibi ei vaikuttanut uroksen hedelmällisyyteen, siittiöiden liikkuvuuteen eikä siittiöpitoisuuteen. Tofasitinibi erittyi imettävien rottien maitoon pitoisuuksina, jotka olivat noin kaksinkertaisia seerumissa 1–8 tuntia annoksen antamiseen jälkeen havaittuihin pitoisuuksiin nähden. Nuorilla rotilla ja apinoilla tehdyissä tutkimuksissa ei todettu tofasitinibiin liittyviä vaikutuksia urosten eikä naaraiden luiden kehitykseen, kun altistukset olivat samansuuruisia kuin ihmisille hyväksyttyjä annoksia käytettäessä.
Nuorilla eläimillä tehdyissä tutkimuksissa ei havaittu tofasitinibiin liittyviä löydöksiä, jotka viittaisivat siihen, että pediatriset potilaat olisivat herkempiä kuin aikuiset. Nuorilla rotilla tehdyssä hedelmällisyystutkimuksessa ei saatu näyttöä kehitystoksisuudesta, vaikutuksista seksuaaliseen kypsymiseen, eikä näyttöä lisääntymistoksisuudesta (parittelu ja hedelmällisyys) sukukypsyyden saavuttamisen jälkeen. Yhden kuukauden pituisessa nuorilla rotilla tehdyssä tutkimuksessa ja 39 viikon pituisessa nuorilla apinoilla tehdyssä tutkimuksessa havaittiin tofasitinibiin liittyviä vaikutuksia immuunivasteen ja hematologisiin parametreihin, jotka olivat yhdenmukaisia JAK1/3:n ja JAK2:n estymisen kanssa. Nämä vaikutukset olivat palautuvia ja yhdenmukaisia niiden vaikutusten kanssa, joita havaittiin aikuisilla eläimillä vastaavilla altistuksilla.
Farmaseuttiset tiedot
Apuaineet
Tablettiydin
sorbitoli (E420)
hydroksietyyliselluloosa
kopovidoni
magnesiumstearaatti
Kalvopäällyste
selluloosa-asetaatti
hydroksipropyyliselluloosa (E463)
hypromelloosi (E464)
titaanidioksidi (E171)
triasetiini
punainen rautaoksidi (E172)
Painomuste
shellakka (E904)
ammoniumhydroksidi (E527)
propyleeniglykoli (E1520)
musta rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XELJANZ depottabletti
11 mg (L:ei) 28 fol (853,93 €)
PF-selosteen tieto
HDPE-purkki, jossa on 2 silikageelikuivausainepussia ja lapsiturvallinen polypropeenisuljin ja joka sisältää 30 tai 90 depottablettia.
Alumiinifolio/PVC-taustainen alumiinifolioläpipainolevy, joka sisältää 7 depottablettia. Pakkaukset sisältävät 28 tai 91 depottablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaaleanpunainen, soikea tabletti, jonka keskimääräiset mitat ovat noin 10,8 mm × 5,5 mm × 4,4 mm (pituus × leveys × paksuus). Tabletin toisen pään reunaan on porattu reikä, ja tabletin toiselle puolelle on painettu ”JKI 11”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
XELJANZ depottabletti
11 mg 28 fol
- Alempi erityiskorvaus (65 %). Tofasitinibi: Tulehduksellisten nivel- ja suolistosairauksien hoito erityisin edellytyksin (291).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Tofasitinibi: Aikuisten nivelreuman tai nivelpsoriaasin ja keskivaikean tai vaikean haavaisen paksusuolitulehduksen hoito erityisin edellytyksin (3005).
ATC-koodi
L04AF01
Valmisteyhteenvedon muuttamispäivämäärä
27.11.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
