ONIVYDE PEGYLATED LIPOSOMAL infuusiokonsentraatti, dispersiota varten 4,3 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi 10 ml:n konsentraatti‑injektiopullo sisältää 43 mg vedetöntä irinotekaanin vapaata emästä (irinotekaanisukrosofaattisuolana pegyloidussa liposomaalisessa muodossa).
Yksi ml konsentraattia sisältää 4,3 mg vedetöntä irinotekaanin vapaata emästä (irinotekaanisukrosofaattisuolana pegyloidussa liposomaalisessa muodossa).
Apuaine, jonka vaikutus tunnetaan
Yksi millilitra konsentraattia sisältää 0,144 mmol (3,31 mg) natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, dispersiota varten.
Kliiniset tiedot
Käyttöaiheet
ONIVYDE pegylated liposomal -valmiste on tarkoitettu:
- yhdessä oksaliplatiinin, 5‑fluorourasiilin (5‑FU) ja leukovoriinin (LV) kanssa haiman metastaattisen adenokarsinooman ensilinjan hoitoon aikuispotilaille.
- yhdessä 5‑FU:n ja LV:n kanssa h aiman metastaattisen adenokarsinooman hoitoon aikuispotilaille, joiden adenokarsinooma on edennyt gemsitabiiniin perustuvan hoidon jälkeen.
Ehto
Hoito tulee aloittaa ja hoitoa tulee jatkaa syöpähoitoihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
ONIVYDE pegylated liposomal ‑valmistetta) saavat määrätä ja antaa potilaille vain terveydenhuollon ammattilaiset, joilla on kokemusta syövän hoidosta.
ONIVYDE pegylated liposomal ‑valmiste ei vastaa ei‑liposomaalisia irinotekaanisia valmisteita, eikä niitä tule vaihtaa keskenään.
Annostus
ONIVYDE pegylated liposomal -valmistetta ei saa antaa ainoana lääkeaineena ja sitä tulee jatkaa sairauden etenemiseen saakka tai kunnes potilas ei enää siedä sitä.
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
ONIVYDE pegylated liposomal -valmistetta, oksaliplatiinia, LV:tä ja 5-FU:ta tulee annostella peräkkäin. ONIVYDE pegylated liposomal ‑valmisteen suositeltu annos ja hoito‑ohjelma on 50 mg/m2 laskimoon 90 minuutin aikana, jonka jälkeen annetaan oksaliplatiinia 60 mg/m2 laskimoon 120 minuutin aikana, jonka jälkeen annetaan leukovoriinia 400 mg/m2 laskimoon 30 minuutin aikana, jonka jälkeen annetaan 5‑fluorourasiilia 2 400 mg/m2 laskimoon 46 tunnin aikana, annostelu tapahtuu 2 viikon välein.
Oksaliplatiinin käytön voi keskeyttää, jos sitä ei siedetä hyvin, ja ONIVYDE pegylated liposomal + 5‑FU/LV -hoito voi jatkua.
ONIVYDE pegylated liposomal -valmisteen suositeltu aloitusannos potilailla, joiden tiedetään olevan homotsygoottisia UGT1A1*28-alleelille on muuttumaton ja pysyy 50 mg/m2 annosteltuna laskimoon 90 minuutin aikana (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
ONIVYDE pegylated liposomal ‑valmistetta, leukovoriinia (LV) ja 5‑fluorourasiilia (5‑FU) tulee annostella peräkkäin. ONIVYDE pegylated liposomal ‑valmisteen suositeltu annos ja hoito‑ohjelma on 70 mg/m2 laskimoon 90 minuutin aikana, jonka jälkeen annetaan leukovoriinia 400 mg/m2 laskimoon 30 minuutin aikana, jonka jälkeen annetaan 5‑fluorourasiilia 2 400 mg/m2 laskimoon 46 tunnin aikana, annostelu tapahtuu 2 viikon välein.
Pienennettyä ONIVYDE pegylated liposomal ‑valmisteen aloitusannosta, 50 mg/m2, tulee harkita potilaille, joiden tiedetään olevan homotsygoottisia UGT1A1*28‑alleelille (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). ONIVYDE pegylated liposomal ‑annoksen suurentamista tasolle 70 mg/m2 tulee harkita, jos sitä siedetään seuraavissa sykleissä.
Esilääkitys
On suositeltavaa, että potilaat saavat esilääkityksenä tavanomaisen annoksen deksametasonia (tai vastaavaa kortikosteroidia) yhdessä 5‑HT3 :n salpaajan (tai muun antiemeetin) kanssa vähintään 30 minuuttia ennen ONIVYDE pegylated liposomal ‑infuusiota.
Annoksen säätö
Kaikkien annosmuutosten tulee perustua pahimpaan edeltävään toksisuuteen. LV‑annos ei vaadi säätöä.
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
Taulukko 1: Suositellut annosmuutokset ONIVYDE pegylated liposomal + oksaliplatiini/5‑FU/LV
| Toksisuusluokka (arvo), NCI CTCAE †:n mukaan | ONIVYDE pegylated liposomal/oksaliplatiini/5‑FU:n säätö
| |
| Hematologiset toksisuudet | ||
| Neutropenia | Uutta hoitosykliä ei tule aloittaa, ennen kuin absoluuttinen neutrofiilimäärä on ≥ 2 000/mm3 (2x109/l) | |
| Luokka 3 tai luokka 4 (< 1 000 solua/mm3) tai neutropeeninen kuume | Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 80 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta 20 % |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 65 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Kolmas esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 50 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Neljäs esiintymä | Keskeytä hoito | |
| Trombosytopenia Leukopenia | Uutta hoitosykliä ei tule aloittaa, ennen kuin verihiutaleiden määrä on ≥ 100 000/mm3 (100x109/l). Leukopeniaan ja trombosytopeniaan liittyvät annosmuutokset perustuvat NCI CTCAE ‑toksisuusluokkiin, ja ne ovat samat kuin neutropeniaan edellä suositellut muutokset. | |
| Ei-hematologiset toksisuudet‡ * | ||
| Ripuli | Uutta hoitosykliä ei tule aloittaa, ennen kuin ripuli lieventyy ≤ luokkaan 1 (2-3 ulostuskertaa/vrk enemmän kuin ennen hoitoa). | |
| Luokka 2 | Uutta hoitosykliä ei tule aloittaa, ennen kuin ripuli lieventyy ≤ luokkaan 1 (2-3 ulostuskertaa/vrk enemmän kuin ennen hoitoa). | |
| Luokka 3 tai 4 | Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 80 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta 20 % |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 65 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Kolmas esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 50 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Neljäs esiintymä | Keskeytä hoito | |
Kaikki muut toksisuudet* Luokka 3 tai 4 | Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 80 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta 20 % |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 65 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Kolmas esiintymä | Pienennä ONIVYDE pegylated liposomal -annos 50 %:iin aloitusannoksesta Pienennä oksaliplatiini- ja 5-FU-annosta vielä 15 % | |
| Neljäs esiintymä | Keskeytä hoito | |
| Luokan ≥ 3 pahoinvointi ja oksentelu | Pienennä annosta vain, jos esiintyy optimaalisesta antiemeettisestä hoidosta huolimatta | |
| Käsi-jalkaoireyhtymä: Luokka 3 tai 4 | Ensimmäinen esiintymä | Keskeytä hoito |
| Minkä tahansa luokan neuroserebellaarinen tai ≥ luokan 2 sydäntoksisuus | Ensimmäinen esiintymä | Keskeytä hoito |
| Anafylaktinen reaktio | Ensimmäinen esiintymä | Keskeytä hoito |
| Interstitiaalinen keuhkosairaus | Ensimmäinen esiintymä | Keskeytä hoito |
* Pois lukien heikkous ja anoreksia; † NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, current version (Kansallisen syöpäinstituutin yleiset terminologiakriteerit haittavaikutuksille, nykyinen versio) | ||
Potilaille, jotka ovat homotsygoottisia UGT1A1*28-alleelille tulee aloittaa ONIVYDE pegylated liposomal -valmiste samalla annoksella ja samoja annospienennysvaatimuksia tulee noudattaa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Potilaille, joiden hoito alkaa annoksella 50 mg/m2 ONIVYDE pegylated liposomal ‑valmistetta eikä nouse annokseen 70 mg/m2, ensimmäisessä annospienennyksessä annosta suositellaan pienentämään tasolle 43 mg/m2 ja toisessa tasolle 35 mg/m2. Potilaiden hoito tulee keskeyttää, jos heidän annostaan tarvitsisi edelleen pienentää.
Potilaiden, joiden tiedetään olevan homotsygoottisia UGT1A1*28:lle ja joilla ei ole lääkkeeseen liittyviä toksisuuksia ensimmäisen hoitosyklin aikana (pienennetty 50 mg/m2:n annos), ONIVYDE pegylated liposomal ‑valmisteen annosta voidaan nostaa 70 mg/m2:n kokonaisannokseen seuraavissa sykleissä potilaan sietokyvyn mukaan.
Taulukko 2: ONIVYDE pegylated liposomal + 5‑FU/LV:n suositellut annosmuutokset luokan 3‑4 toksisuuksille, kun potilas ei ole homotsygoottinen UGT1A1*28‑alleelille
| Toksisuusluokka (arvo), NCI CTCAE 1:n mukaan | ONIVYDE pegylated liposomal / 5‑FU:n säätö (potilaille, jotka eivät ole homotsygoottisia UGT1A1*28‑alleelille) | ||
| Hematologiset toksisuudet | |||
| Neutropenia | Uutta hoitosykliä ei tule aloittaa, ennen kuin absoluuttinen neutrofiilimäärä on ≥1 500 solua/mm3. | ||
| Luokka 3 tai luokka 4(< 1 000 solua/mm3) taineutropeeninen kuume | Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 50 mg/m2:aan. Pienennä 5‑FU‑annosta 25 % (1 800 mg/m2). | |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 43 mg/m2:aan. Pienennä 5‑FU‑annosta vielä 25 % (1 350 mg/m2). | ||
| Kolmas esiintymä | Keskeytä hoito. | ||
Trombosytopenia Leukopenia | Uutta hoitosykliä ei tule aloittaa, ennen kuin verihiutaleiden määrä on ≥100 000 verihiutaletta/mm3. Leukopeniaan ja trombosytopeniaan liittyvät annosmuutokset perustuvat NCI CTCAE ‑toksisuusluokkiin, ja ne ovat samat kuin neutropeniaan edellä suositellut muutokset. | ||
| Ei‑hematologiset toksisuudet2 | |||
| Ripuli | Uutta hoitosykliä ei tule aloittaa, ennen kuin ripuli lieventyy ≤ luokkaan 1 (2‑3 ulostuskertaa/vrk enemmän kuin ennen hoitoa). | ||
| Luokka 2 | Uutta hoitosykliä ei tule aloittaa, ennen kuin ripuli lieventyy ≤ luokkaan 1 (2–3 ulostuskertaa/vrk enemmän kuin ennen hoitoa). | ||
| Luokka 3 tai 4 | Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 50 mg/m2:aan. Pienennä 5‑FU‑annosta 25 % (1 800 mg/m2). | |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 43 mg/m2:aan. Pienennä 5‑FU‑annosta vielä 25 % (1 350 mg/m2). | ||
| Kolmas esiintymä | Keskeytä hoito. | ||
| Pahoinvointi/oksentelu | Uutta hoitosykliä ei tule aloittaa, ennen kuin pahoinvointi/oksentelu lieventyy ≤ luokkaan 1 tai lähtötasolle. | ||
| Luokka 3 tai 4 (huolimatta antiemeettisestä hoidosta) | Ensimmäinen esiintymä | Optimoi antiemeettinen hoito. Pienennä ONIVYDE pegylated liposomal ‑annos 50 mg/m2:aan. | |
| Toinen esiintymä | Optimoi antiemeettinen hoito. Pienennä ONIVYDE pegylated liposomal ‑annos 43 mg/m2:aan. | ||
| Kolmas esiintymä | Keskeytä hoito. | ||
Maksaan, munuaisiin, hengitysteihin liittyvät tai muut2 toksisuudet Luokka 3 tai 4 | Uutta hoitosykliä ei tule aloittaa, ennen kuin haittavaikutus lieventyy ≤ luokkaan 1. | ||
| Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 50 mg/m2:aan. Pienennä 5‑FU‑annosta 25 % (1 800 mg/m2). | ||
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 43 mg/m2:aan. Pienennä 5‑FU‑annosta vielä 25 % (1 350 mg/m2). | ||
| Kolmas esiintymä | Keskeytä hoito. | ||
| Anafylaktinen reaktio | Ensimmäinen esiintymä | Keskeytä hoito. | |
| Interstitiaalinen keuhkosairaus | Ensimmäinen esiintymä | Keskeytä hoito. | |
1 NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, current version (Kansallisen syöpäinstituutin yleiset terminologiakriteerit haittavaikutuksille, nykyinen versio)
2 Pois lukien heikkous ja anoreksia; heikkous ja luokan 3 anoreksia eivät vaadi annoksen säätöä.
Taulukko 3: ONIVYDE pegylated liposomal + 5‑FU/LV:n suositellut annosmuutokset luokan 3–4 toksisuuksille, kun potilas on homotsygoottinen UGT1A1*28-alleelille
Toksisuusluokka (arvo) NCI CTCAE:n mukaan1 | ONIVYDE pegylated liposomal / 5‑FU:n säätö (potilaille, jotka ovat homotsygoottisia UGT1A1*28‑alleelille ja joiden lääkitystä ei aiemmin ole nostettu3 annokseen 70 mg/m2) | |
| Haittavaikutukset2luokka3 tai 4 | Uutta hoitosykliä ei tule aloittaa, ennen kuin haittavaikutus lieventyy ≤ luokkaan 1. | |
| Ensimmäinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 43 mg/m2:aan. 5‑FU:n annoksen säätö taulukon 2 mukaisesti | |
| Toinen esiintymä | Pienennä ONIVYDE pegylated liposomal ‑annos 35 mg/m2:aan. 5‑FU:n annoksen säätö taulukon 2 mukaisesti | |
| Kolmas esiintymä | Keskeytä hoito. | |
| Anafylaktinen reaktio | Ensimmäinen esiintymä | Keskeytä hoito. |
| Interstitiaalinen keuhkosairaus | Ensimmäinen esiintymä | Keskeytä hoito. |
- NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Events, current version (Kansallisen syöpäinstituutin yleiset terminologiakriteerit haittavaikutuksille, nykyinen versio)
- Pois lukien heikkous ja anoreksia; heikkous ja luokan 3 anoreksia eivät vaadi annoksen säätöä
- Mikäli ONIVYDE pegylated liposomal ‑annos suurennetaan tasolle 70 mg/m2, jos sitä siedetään seuraavissa sykleissä, annosta on muutettava Taulukossa 2 esitettyjen suositusten mukaisesti
Erityisryhmät
Maksan toimintahäiriö
ONIVYDE pegylated liposomal ‑valmisteella ei ole tehty erityisesti maksan toimintahäiriötä koskevaa tutkimusta. ONIVYDE pegylated liposomal ‑valmisteen käyttöä tulee välttää sellaisille potilaille, joiden bilirubiini on > 2,0 mg/dl tai aspartaattiaminotransferaasi (ASAT) ja alaniiniaminotransferaasi (ALAT) > 2,5 x normaalin yläraja (ULN) tai > 5 x ULN, jos potilaalla on maksametastaasi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten toimintahäiriö
ONIVYDE pegylated liposomal ‑valmisteella ei ole tehty erityisesti munuaisten toimintahäiriötä koskevaa tutkimusta. Annostuksen muuttamista ei suositella potilaille, joilla on lievä tai kohtalainen munuaisten toimintahäiriö (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). ONIVYDE pegylated liposomal ‑valmistetta ei suositella potilaille, joilla on vaikea munuaisten toimintahäiriö (CLcr < 30 ml/min).
Iäkkäät potilaat
Noin neljäkymmentäyhdeksän prosenttia (49,6 %) NAPOLI-3-tutkimuksen ja neljäkymmentäyksi prosenttia (41 %) NAPOLI--1-tutkimuksen potilaista, joita hoidettiin ONIVYDE pegylated liposomal ‑valmisteella, oli ≥ 65 vuoden ikäisiä. Annostuksen muuttamista ei suositella.
Pediatriset potilaat
ONIVYDE pegylated liposomal ‑valmisteen turvallisuutta ja tehoa ≤ 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
ONIVYDE pegylated liposomal ‑valmiste on tarkoitettu annettavaksi laskimoon. Konsentraatti on laimennettava ennen antoa, ja se annetaan yhtenä infuusiona laskimoon 90 minuutin kuluessa. Lisätietoja, ks. kohta Käyttö- ja käsittelyohjeet.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
ONIVYDE pegylated liposomal on sytotoksinen lääkevalmiste. Käsineiden, suojalasien ja suojavaatteiden käyttöä suositellaan, kun ONIVYDE pegylated liposomal ‑valmistetta käsitellään tai annetaan. Raskaana olevat hoitohenkilökunnan jäsenet eivät saa käsitellä ONIVYDE pegylated liposomal ‑valmistetta.
Vasta-aiheet
Aiemmin todettu vaikea yliherkkyys irinotekaanille tai kohdassa Apuaineet mainituille apuaineille.
Imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
ONIVYDE pegylated liposomal on liposomaalinen irinotekaanivalmiste, jolla on erilaiset farmakokineettiset ominaisuudet verrattuna ei‑liposomaaliseen irinotekaaniin. Annospitoisuus ja ‑vahvuus ovat erilaiset verrattuna ei‑liposomaalisiin irinotekaaneihin.
ONIVYDE pegylated liposomal ‑valmiste ei vastaa ei‑liposomaalisia irinotekaanivalmisteita, eikä niitä tule vaihtaa keskenään.
ONIVYDE pegylated liposomal ‑valmisteen hyötyä ei ole osoitettu aiemmin ei‑liposomaaliselle irinotekaanille altistuneille potilaille johtuen näiden potilaiden vähäisestä määrästä.
Myelosuppressio/neutropenia
Täydellisen verenkuvan seuraamista suositellaan ONIVYDE pegylated liposomal ‑hoidon aikana. Potilaiden tulee olla tietoisia neutropenian riskistä sekä kuumeen merkityksestä. Kuumeinen neutropenia (ruumiinlämpö >38 °C ja neutrofiilimäärä ≤1 000 solua/mm³) täytyy hoitaa heti sairaalassa laajakirjoisilla laskimoon annettavilla antibiooteilla. Potilailla, joilla on metastaattinen haiman adenokarsinooma ja joita on hoidettu ONIVYDE pegylated liposomal ‑valmisteella, on havaittu sepsistä, johon on liittynyt neutropeeninen kuume ja sitä seuraava kuolemaan johtanut septinen shokki.
Annoksen pienentämistä tai hoidon keskeyttämistä suositellaan potilaille, joilla on ollut vaikeita hematologisia vaikutuksia (ks. kohta Annostus ja antotapa). Vaikeaa luuytimen vajaatoimintaa sairastavia potilaita ei saa hoitaa ONIVYDE pegylated liposomal ‑valmisteella.
Aiempi vatsan sädehoito lisää ONIVYDE pegylated liposomal ‑hoidon jälkeistä vaikean neutropenian ja kuumeisen neutropenian riskiä. Verisolujen määrän huolellista tarkkailua suositellaan, ja myeloidikasvutekijöiden käyttöä tulee harkita potilaille, jotka ovat aiemmin saaneet sädehoitoa vatsan seudulle. Varovaisuutta on noudatettava, jos potilas saa sädehoitoa samanaikaisesti ONIVYDE pegylated liposomal ‑hoidon kanssa.
Potilailla, joilla on bilirubiinin glukoronidaation puutos, esimerkiksi Gilbertin oireyhtymä, saattaa olla suurempi myelosuppressioriski ONIVYDE pegylated liposomal ‑hoidon yhteydessä.
Immunosuppressiiviset vaikutukset ja rokotteet
Seurauksena voi olla vakava tai kuolemaan johtava infektio, jos elävää tai elävää heikennettyä rokotetta annetaan potilaille, jotka ovat immuunipuutteisia kemoterapeuttisista lääkevalmisteista (mukaan lukien ONIVYDE pegylated liposomal ‑valmisteesta) johtuen. Siksi rokotusta elävällä rokotteella on vältettävä. Tapettuja mikrobeja sisältäviä tai inaktivoituja rokotteita voidaan antaa. Rokotuksen teho voi kuitenkin jäädä heikoksi.
Yhteisvaikutukset voimakkaiden CYP3A4:n indusorien kanssa
ONIVYDE pegylated liposomal ‑valmistetta ei saa antaa samanaikaisesti voimakkaiden CYP3A4‑entsyymin indusorien, kuten antikonvulsanttien (fenytoiini, fenobarbitaali tai karbamatsepiini), rifampisiinin, rifabutiinin ja mäkikuisman kanssa, ellei muita hoitovaihtoehtoja ole. Sopivaa aloitusannosta ei ole määritelty potilaille, jotka ottavat näitä antikonvulsantteja tai muita voimakkaita indusoreja. Niiden korvaamista entsyymejä indusoimattomilla hoidoilla vähintään kaksi viikkoa ennen ONIVYDE pegylated liposomal ‑hoidon aloittamista on harkittava (ks. kohta Yhteisvaikutukset).
Yhteisvaikutukset voimakkaiden CYP3A4:n estäjien tai voimakkaiden UGT1A1:n estäjien kanssa
ONIVYDE pegylated liposomal ‑valmistetta ei saa antaa samanaikaisesti voimakkaiden CYP3A4‑entsyymin estäjien (esim. greippimehu, klaritromysiini, indinaviiri, itrakonatsoli, lopinaviiri, nefatsodoni, nelfinaviiri, ritonaviiri, sakinaviiri, telapreviiri, vorikonatsoli) kanssa. Voimakkaiden CYP3A4:n estäjien käyttö täytyy lopettaa vähintään viikkoa ennen ONIVYDE pegylated liposomal ‑hoidon aloittamista.
ONIVYDE pegylated liposomal ‑valmistetta ei saa antaa samanaikaisesti voimakkaiden UGT1A:n estäjien (esim. atatsanaviiri, gemfibrotsiili, indinaviiri) kanssa, ellei muita hoitovaihtoehtoja ole.
Ripuli
ONIVYDE pegylated liposomal -valmiste voi aiheuttaa vaikeaa tai hengenvaarallista ripulia. ONIVYDE pegylated liposomal -valmistetta ei saa antaa potilaille, joilla on suolitukos ja krooninen tulehduksellinen suolistosairaus.
Ripulia voi esiintyä varhain (alkaa ≤ 24 tunnin kuluessa ONIVYDE pegylated liposomal ‑hoidon aloittamisesta) tai myöhään (> 24 tuntia) (ks. kohta Haittavaikutukset).
Jos potilaalla on varhainen ripuli tai kolinergisiä oireita, on harkittava ennaltaehkäisevää hoitoa tai hoitoa atropiinilla, ellei hoidolle ole vasta‑aiheita. Potilaat täytyy saattaa tietoisiksi riskeistä, jotka liittyvät viivästyneeseen ripuliin, joka voi olla heikentävä tai harvoissa tapauksissa hengenvaarallinen, sillä jatkuvat löysät tai vetiset ulosteet voivat johtaa elimistön kuivumiseen, elektrolyyttiepätasapainoon, koliittiin, gastrointestinaaliseen haavaan, infektioon tai sepsikseen.
Heti ensimmäisen nestemäisen ulosteen esiintyessä potilaan täytyy alkaa juoda suuria määriä elektrolyyttejä sisältävää juomaa. Potilailla tulee olla loperamidia (tai vastaavaa) valmiina saatavilla myöhäisen ripulin hoidon aloittamiseen. Loperamidin käyttö on aloitettava ensimmäisten huonosti muodostuneiden tai löysien ulosteiden esiintyessä tai heti, kun suoli toimii useammin kuin tavallisesti (enintään 16 mg/päivä). Loperamidia tulee antaa, kunnes potilaalla ei ole ripulia vähintään 12 tuntiin.
Vaikean ripulin välttämiseksi lopeta kaikkien laktoosia sisältävien tuotteiden käyttö, pidä huolta nesteytyksestä ja noudata vähärasvaista ruokavaliota.
Jos ripuli jatkuu, vaikka potilas saa loperamidia pidempään kuin 24 tuntia, on harkittava suun kautta otettavan antibiootin (esim. fluorokinoloni 7 päivän ajan) lisäämistä hoitoon. Loperamidia ei saa käyttää 48 tuntia pidempään yhtäjaksoisesti suolilaman riskin vuoksi. Jos ripuli kestää pidempään kuin 48 tuntia, lopeta loperamidihoito, seuraa ja korvaa nestemäisiä elektrolyyttejä ja jatka antibioottihoitoa, kunnes ripuliin liittyvät oireet häviävät.
Uutta hoitosykliä ei tule aloittaa ennen kuin ripuli lieventyy ≤ luokkaan 1 (2–3 ulostuskertaa/vrk enemmän kuin ennen hoitoa).
Luokan 3 tai 4 ripulin jälkeen seuraavaa ONIVYDE pegylated liposomal ‑annosta tulee pienentää (ks. kohta Annostus ja antotapa).
Kolinergiset reaktiot
Varhain alkaneeseen ripuliin saattaa liittyä kolinergisiä oireita, kuten nuhaa, lisääntynyttä syljeneritystä, punastelua, runsasta hikoilua, brakykardiaa, mioosia ja hyperperistaltiikkaa. Jos potilaalla ilmenee kolinergisiä oireita, hänelle on annettava atropiinia.
Yliherkkyysreaktiot, mukaan lukien akuuttiin infuusioon liittyvät reaktiot
ONIVYDE pegylated liposomal ‑hoitoa saaneilla potilaille raportoitiin esiintyneen infuusioreaktioita, joita olivat pääasiassa ihottuma, nokkosihottuma, periorbitaalinen ödeema ja kutina. Uusia haittatapahtumia (kaikki luokan 1 tai 2 oireita) ilmaantui yleensä varhain ONIVYDE pegylated liposomal ‑hoidon aikana, ja vain kahdella potilaalla kymmenestä ilmeni haittatapahtumia viidennen annoksen jälkeen. Yliherkkyysreaktioita, mukaan lukien akuutteja infuusioreaktioita, anafylaktisia/anafylaktoidisia reaktioita ja angioedeemaa, voi ilmetä. ONIVYDE pegylated liposomal ‑hoito on keskeytettävä, jos vaikeita yliherkkyysreaktioita ilmenee (ks. kohta Annostus ja antotapa).
Aiempi Whipplen leikkaus
Whipplen leikkauksen läpikäyneillä potilailla on tavallista suurempi riski saada vakavia infektioita, kun ONIVYDE pegylated liposomal ‑valmistetta on annettu yhdessä 5‑FU:n ja leukovoriinin kanssa. Potilaita on seurattava infektioiden oireiden varalta.
Verisuonistosairaudet
ONIVYDE pegylated liposomal ‑hoitoon on liittynyt tromboembolisia tapahtumia, kuten keuhkoemboliaa, laskimotrombooseja ja valtimotromboembolioita. Potilaan anamneesi on selvitettävä tarkoin, jotta voidaan tunnistaa potilaat, joilla on kasvaimen lisäksi useita riskitekijöitä. Potilaille pitää kertoa tromboembolian oireista ja löydöksistä, ja heitä pitää kehottaa ottamaan heti yhteyttä lääkäriin tai sairaanhoitajaan, jos heille ilmaantuu tällaisia oireita tai löydöksiä.
Keuhkotoksisuus
Interstitiaalisen keuhkosairauden kaltaisia, kuolemaan johtaneita tapahtumia on ilmennyt potilailla, jotka ovat saaneet ei‑liposomaalista irinotekaania. NAPOLI--3-tutkimuksessa raportoitiin keuhkotulehdusta 0,3 %:lla potilaista, jotka saivat ONIVYDE pegylated liposomal -valmistetta yhdessä oksaliplatiinin ja 5-FU/LV:n kanssa. Riskitekijöitä ovat muun muassa olemassa oleva keuhkosairaus, keuhkoille toksisten lääkevalmisteiden käyttö, kantasoluryhmiä stimuloivat kasvutekijät tai aiempi sädehoito. Potilaita, joilla on riskitekijöitä, on tarkkailtava huolellisesti hengitystieoireiden varalta ennen ONIVYDE pegylated liposomal ‑hoitoa sekä sen aikana. Pienellä osalla potilaista, jotka osallistuivat irinotekaanin kliiniseen tutkimukseen, havaittiin retikulonodulaarinen kuvio keuhkoröntgenkuvassa. ONIVYDE pegylated liposomal ‑hoito tulee keskeyttää välittömästi, jos ilmaantuu uutta tai etenevää hengenahdistusta, yskää tai kuumetta, kunnes diagnostinen arviointi on tehty. ONIVYDE pegylated liposomal ‑valmisteen anto on lopetettava, jos potilas saa varmistetun interstitiaalisen keuhkosairausdiagnoosin (ks. kohta Annostus ja antotapa).
Maksan toimintahäiriö
Potilailla, joilla oli hyperbilirubinemia, oli korkeampi SN‑38‑kokonaispitoisuus (ks. kohta Farmakokinetiikka), minkä vuoksi neutropeniariski oli suurempi. Jos potilaan kokonaisbilirubiini on 1,0‑2,0 mg/dl, hänen täydellistä verenkuvaansa on seurattava säännöllisesti. Varovaisuutta on noudatettava, jos potilaalla on maksan toimintahäiriö (bilirubiini > 2 kertaa normaalin yläraja [ULN], transaminaasit > 5 kertaa ULN). Varovaisuutta on noudatettava, kun ONIVYDE pegylated liposomal ‑valmistetta annetaan yhdessä muiden hepatotoksisten aineiden kanssa, erityisesti, jos potilaalla on maksan toimintahäiriö.
Alipainoiset potilaat (painoindeksi < 18,5 kg/m2)
NAPOLI-1-tutkimuksessa 5 alipainoisella potilaalla 8:sta esiintyi luokan 3 tai 4 haittavaikutus, useimmiten myelosuppressio, ja 7 potilasta 8:sta tarvitsi annoksen säätöä, kuten annoksen viivästämistä, annoksen pienentämistä tai annoksen annon lopettamista. Varovaisuutta on noudatettava, jos ONIVYDE pegylated liposomal ‑valmistetta käytetään potilaille, joiden painoindeksi on < 18,5 kg/m2.
Apuaineet
Tämä lääkevalmiste sisältää 33,1 mg natriumia per injektiopullo, mikä vastaa 1,65 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Tiedot muiden lääkkeiden yhteisvaikutuksista ONIVYDE pegylated liposomal ‑valmisteen kanssa on otettu tieteellisestä kirjallisuudesta ei‑liposomaalista irinotekaania koskevista julkaisuista.
ONIVYDE pegylated liposomal ‑valmisteen käyttöön vaikuttavat yhteisvaikutukset
Voimakkaat CYP3A4:n indusorit
Jos potilas saa samanaikaisesti ei‑liposomaalista irinotekaania ja CYP3A4‑entsyymiä indusoivia antikonvulsantteja fenytoiinia, fenobarbitaalia tai karbamatsepiinia, hänen altistumisensa irinotekaanille (AUC‑arvo pienenee 12 % mäkikuisman ja 57–79 % fenytoiinin, fenobarbitaalin tai karbamatsepiinin kanssa) ja SN‑38:lle (AUC‑arvo pienenee 42 % mäkikuisman ja 36–92 % fenytoiinin, fenobarbitaalin tai karbamatsepiinin kanssa) heikentyy merkittävästi. Sen vuoksi ONIVYDE pegylated liposomal ‑valmisteen samanaikainen anto CYP3A4:n indusorien kanssa saattaa heikentää systeemistä altistumista ONIVYDE pegylated liposomal ‑valmisteelle.
Voimakkaat CYP3A4:n estäjät ja UGT1A1:n estäjät
Potilaiden altistuminen SN‑38:lle on kasvanut 109 % silloin, kun potilaat ovat saaneet samanaikaisesti ei‑liposomaalista irinotekaania ja ketokonatsolia, joka on CYP3A4:n ja UGT1A1:n estäjä. Sen vuoksi ONIVYDE pegylated liposomal ‑valmisteen samanaikainen anto muiden CYP3A4:n estäjien (esim. greippimehu, klaritromysiini, indinaviiri, itrakonatsoli, lopinaviiri, nefatsodoni, nelfinaviiri, ritonaviiri, sakinaviiri, telapreviiri, vorikonatsoli) kanssa saattaa lisätä systeemistä altistumista ONIVYDE pegylated liposomal ‑valmisteelle. Ei‑liposomaalisen irinotekaanin ja ketokonatsolin lääkeyhteisvaikutukseen perustuen ONIVYDE pegylated liposomal ‑valmisteen samanaikainen anto muiden UGT1A1:n estäjien (esim. atatsanaviiri, gemfibrotsiili, indinaviiri, regorafenibi) kanssa saattaa myös lisätä systeemistä altistumista ONIVYDE pegylated liposomal ‑valmisteelle.
Samanaikainen ONIVYDE pegylated liposomal + 5‑FU/LV‑annostelu ei muuta ONIVYDE pegylated liposomal ‑valmisteen farmakokinetiikkaa populaatiofarmakokineettisen analyysin perusteella.
Antineoplastiset lääkeaineet (mukaan lukien flusytosiini, joka on 5‑fluorourasiilin aihiolääke)
Muut antineoplastiset lääkeaineet, joiden haittavaikutusprofiili on samankaltainen, voivat pahentaa irinotekaanin haittavaikutuksia, kuten myelosuppressiota.
ONIVYDE pegylated liposomal ‑valmisteen yhteisvaikutuksia muiden lääkevalmisteiden kanssa ei tunneta.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy miehille ja naisille
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä ONIVYDE pegylated liposomal ‑hoidon aikana ja 7 kuukautta hoidon päättymisen jälkeen. Miesten on käytettävä kondomia ONIVYDE pegylated liposomal ‑hoidon aikana ja 4 kuukautta hoidon päättymisen jälkeen.
Raskaus
Ei ole riittävästi tietoja ONIVYDE pegylated liposomal ‑valmisteen käytöstä raskaana oleville naisille. ONIVYDE pegylated liposomal ‑valmiste voi raskaana oleville naisille annettuna vahingoittaa sikiötä, sillä pääainesosa irinotekaani on todettu sikiötoksiseksi ja teratogeeniseksi eläimillä (ks. kohta Prekliiniset tiedot turvallisuudesta). Sen vuoksi eläinkokeiden tulosten ja irinotekaanin vaikutusmekanismin perusteella ONIVYDE pegylated liposomal ‑valmistetta ei saa käyttää raskauden aikana, ellei se ole selvästi tarpeellista. Jos ONIVYDE pegylated liposomal ‑valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi hoitoa saadessaan, hänelle tulee kertoa mahdollisesta vaarasta sikiölle.
Imetys
Ei tiedetä, erittyvätkö ONIVYDE pegylated liposomal ‑valmiste tai sen metaboliitit ihmisen rintamaitoon. Koska ONIVYDE pegylated liposomal saattaa aiheuttaa imeväisille vakavia haittavaikutuksia rintaruokinnan aikana, ONIVYDE pegylated liposomal on vasta‑aiheista rintaruokinnan aikana (ks. kohta Vasta-aiheet). Potilaat eivät saa imettää kuukauteen viimeisen annoksen jälkeen.
Hedelmällisyys
ONIVYDE pegylated liposomal ‑valmisteen vaikutuksesta ihmisen hedelmällisyyteen ei ole tietoja. Ei‑liposomaalisen irinotekaanin todettiin aiheuttavan eläimille urosten ja naaraiden sukuelinten surkastumista useiden päivittäisten irinotekaaniannosten jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Harkitse ennen ONIVYDE pegylated liposomal ‑hoidon aloittamista neuvonnan antamista potilaalle sukusolujen ottamisesta säilöön.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
ONIVYDE pegylated liposomal ‑valmisteella on kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Hoidon aikana potilaiden tulee olla varovaisia ajaessaan tai koneita käyttäessään.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin (NALIRIFOX) kanssa
Seuraavia haittavaikutuksia, joiden arvioitiin mahdollisesti tai todennäköisesti liittyvän ONIVYDE pegylated liposomal ‑valmisteen antoon, raportoitiin 370 potilaalla, joita hoidettiin yhdessä oksaliplatiini/5-FU/LV:n kanssa ja jotka eivät olleet aikaisemmin saaneet kemoterapiaa haiman metastaattiseen adenokarsinoomaan.
Yleisimmät haittavaikutukset (yleisyys ≥ 20 %) olivat: ripuli, pahoinvointi, oksentelu, vähentynyt ruokahalu, väsymys, heikkous, neutropenia, pienentynyt neutrofiilimäärä ja anemia. Yleisimmät vaikeat haittavaikutukset (≥ 5 % luokka 3 tai 4) olivat: ripuli, pahoinvointi, oksentelu, vähentynyt ruokahalu, väsymys, heikkous, neutropenia, pienentynyt neutrofiilimäärä, anemia ja hypokalemia. Yleisimmät vakavat haittavaikutukset (≥ 2 %) olivat: ripuli, pahoivointi, oksentelu ja dehydraatio.
ONIVYDE pegylated liposomal -valmisteen käytön pysyvään lopettamiseen johtaneita haittavaikutuksia esiintyi 9,5 % potilaista. Yleisin hoidon lopettamiseen johtanut haittavaikutus oli neutropenia.
Haittatapahtumista johtuneita ONIVYDE pegylated liposomal -valmisteen annoksen pienentämisiä (syysuhteen arvioinnista riippumatta) esiintyi 52,4 %:lla potilaista. Yleisimmät annoksen pienentämiseen johtaneet haittavaikutukset (≥ 5 %) olivat: ripuli, pahoinvointi, neutropenia ja pienentynyt neutrofiilimäärä.
ONIVYDE pegylated liposomal -valmiste keskeytettiin haittatapahtumien takia (syysuhteen arvioinnista riippumatta) 1,9 % potilaista. Yleisimmät keskeytykseen johtaneet haittatapahtumat olivat yliherkkyys ja infuusioon liittyvät reaktiot, joita esiintyi 0,5 %:lla potilaista.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Seuraavia haittavaikutuksia, liittyvän ONIVYDE pegylated liposomal ‑valmisteen antoon, raportoitiin 264 potilaalla, joilla oli haiman metastaattinen adenokarsinooma ja joita hoidettiin gemsitabiinipohjaista hoitoa seuraavan sairauden etenemisen jälkeen.
Yleisimmät ONIVYDE pegylated liposomal + 5-FU/LV:n haittavaikutukset (yleisyys ≥ 20 %) olivat: ripuli, pahoinvointi, oksentelu, vähentynyt ruokahalu, neutropenia, väsymys, heikkous, anemia, suutulehdus ja pyreksia. Yleisimmät ONIVYDE pegylated liposomal ‑hoidon vakavat haittavaikutukset (≥ 2 %) olivat ripuli, oksentelu, kuumeinen neutropenia, pahoinvointi, pyreksia, sepsis, dehydraatio, septinen shokki, pneumonia, akuutti renaalinen vajaatoiminta ja trombosytopenia.
Pysyvään hoidon lopettamiseen johtaneiden haittavaikutusten prosenttiluku oli 11 % ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmässä.
Yleisimmin raportoidut hoidon lopettamiseen johtaneet haittavaikutukset olivat infektio ja ripuli ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmässä.
Haittavaikutustaulukko
Tässä kohdassa kuvatut haittavaikutukset perustuvat tutkimustietoihin ja kokemukseen ONIVYDE pegylated liposomal ‑valmisteen markkinoille tulon jälkeisestä käytöstä.
ONIVYDE pegylated liposomal ‑hoidon aikana mahdollisesti esiintyvät haittavaikutukset on esitetty seuraavassa taulukossa elinjärjestelmäluokituksen ja esiintymistiheyden mukaan (taulukko 3). Haittavaikutukset on esitetty kussakin elinjärjestelmä‑ ja yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Haittavaikutusten yleisyysluokat ovat seuraavat: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000)* ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 4: ONIVYDE pegylated liposomal ‑valmisteella hoidetuilla potilailla raportoidut haittavaikutukset
Elinjärjestelmäluokitus Esiintymistiheys* | Yhdessä oksaliplatiini/5-FU/LV:n kanssa (NAPOLI-3) | Yhdessä 5-FU/LV:n kanssa (NAPOLI-1 ja markkinoille saattamista seuraava kokemus) |
| Infektiot | ||
| Yleiset | Sepsis, Virtsatieinfektio, Kandidainfektio, Nenänielutulehdus | Septinen sokki, Sepsis, Pneumonia, Kuumeinen neutropenia, Gastroenteriitti, Sammas |
| Melko harvinaiset | Divertikuliitti, Pneumonia, Peräaukon absessi, Kuumeinen infektio, Gastroenteriitti, Limakalvoinfektio, Suun sieni-infektio, Clostridium difficile -infektio, Sidekalvotulehdus, Furunkkeli, Herpes simplex, Kurkunpäätulehdus, Parodontiitti, Märkärakkulainen ihottuma, Sinuiitti, Hammasinfektio, Vulvovaginaalinen sieni-infektio | Sappitieperäinen sepsis |
| Hyvänlaatuiset, pahanlaatuiset ja määrittelemättömät neoplasmat (mukaan lukien kystat ja polyypit) | ||
| Melko harvinaiset | Kasvaimen ympäristön edeema | |
| Veri ja imukudos | ||
| Hyvin yleiset | Anemia, Neutropenia, Trombosytopenia | Neutropenia, Leukopenia, Anemia, Trombosytopenia |
| Yleiset | Kuumeinen neutropenia, Leukopenia, Lymfopenia | Lymfopenia |
| Melko harvinaiset | Pansytopenia, Hemolyyttinen anemia | |
| Immuunijärjestelmä | ||
| Melko harvinaiset | Yliherkkyys | Yliherkkyys |
| Tuntematon | Anafylaktinen/Anafylaksian kaltainen reaktio, Angioedeema | |
| Aineenvaihdunta ja ravitsemus | ||
| Hyvin yleiset | Hypokalemia, Vähentynyt ruokahalu | Hypokalemia, Hypomagnesemia, Dehydraatio, Vähentynyt ruokahalu |
| Yleiset | Dehydraatio, Hyponatremia, Hypofosfatemia, Hypomagnesemia, Hypoalbuminemia, Hypokalsemia | Hypoglykemia, Hyponatremia, Hypofosfatemia |
| Melko harvinaiset | Elektrolyyttiepätasapaino, Hyperkalsemia, Solukuolema, Hypokloremia, Kihti, Hyperglykemia, Hyperkalemia, Raudanpuutos, Aliravitsemus | |
| Psyykkiset häiriöt | ||
| Yleiset | Unettomuus | |
| Melko harvinaiset | Unettomuus, Sekavuustila, Masennus, Neuroosi | |
| Hermosto | ||
| Hyvin yleiset | Perifeerinen neuropatia, Dysgeusia, Parestesia | Heitehuimaus |
| Yleiset | Vapina, Hermostotoksisuus, Dysestesia, Kolinerginen oireyhtymä, Päänsärky, Heitehuimaus | Kolinerginen oireyhtymä, Dysgeusia |
| Melko harvinaiset | Kohtaus, Aivoverenvuoto, Aivojen iskemia, Iskeeminen aivohalvaus, Hajuaistittomuus, Ageusia, Tasapainohäiriö, Liikaunisuus, Hypestesia, Älyllinen toimintarajoitteisuus, Letargia, Muistin heikkeneminen, Pyörtymistä enteilevät oireet, Synkopee, Ohimenevä aivoverenkiertohäiriö | |
| Silmät | ||
| Yleiset | Näön hämärtyminen | |
| Melko harvinaiset | Silmän ärsytys, Heikentynyt näöntarkkuus | |
| Kuulo ja tasapainoelin | ||
| Melko harvinaiset | Huimaus | |
| Sydän | ||
| Yleiset | Takykardia | Hypotensio |
| Melko harvinaiset | Angina pectoris, Akuutti sydäninfarkti, Sydämentykytykset | |
| Verisuonisto | ||
| Yleiset | Hypotensio, Tromboembolinen tapahtuma | Keuhkoembolia, Tromboembolinen tapahtuma |
| Melko harvinaiset | Hypertensio, ääreisosien kylmyys, Hematooma, Flebiitti | |
| Hengityselimet, rintakehä, välikarsina | ||
| Yleiset | Keuhkoembolia, Nikotus, Hengenahdistus, Nenäverenvuoto | Hengenahdistus, Dysfonia |
| Melko harvinaiset | Suunielun kipu, Yskä, Hyperoksia, Nenän inflammaatio, Atelektaasi, Dysfonia, Pneumoniitti | Hypoksia, Interstitiaalinen keuhkosairaus (mukaan lukien pneumoniitti) |
| Ruoansulatuselimistö | ||
| Hyvin yleiset | Ripuli, Pahoinvointi, Oksentelu, Vatsakipu/Epämukavuuden tunne, Suutulehdus | Ripuli, Oksentelu, Pahoinvointi, Vatsakipu, Suutulehdus |
| Yleiset | Koliitti, Enterokoliitti, Ummetus, Kuiva suu, Ilmavaivat, Vatsan turpoaminen, Dyspepsia, Ruokatorven refluksitauti, Peräpukamat, Nielemishäiriö | Koliitti, Peräpukamat |
| Melko harvinaiset | Gastrointestinaalinen toksisuus, Pohjukaissuolen tukos, Ulosteenpidätyskyvyttömyys, Aftahaavauma, Suun dysestesia, Suukipu, Kielen sairaus, Peräaukkofissuura, Suupielitulehdus, Kivulias ulostaminen, Suun parestesia, Hammaskaries, Röyhtäily, Mahalaukun toiminnallinen häiriö, Mahatulehdus, Iensairaus, ienkipu, Veriuloste, hampaiden hyperestesia, Suolilama, Huulen turvotus, Suun haavauma, Ruokatorvikouristus, Parodontaalisairaus, Peräsuolen verenvuoto | Ruokatorvitulehdus, Peräsuolitulehdus |
| Maksa ja sappi | ||
| Yleiset | Hyperbilirubinemia | Hypoalbuminemia |
| Melko harvinaiset | Sappitietulehdus, Toksinen maksatulehdus, Kolestaasi, Maksan sytolyysi | |
| Iho ja ihonalainen kudos | ||
| Hyvin yleiset | Kaljuus | Kaljuus |
| Yleiset | Kuiva iho, Palmoplantaarinen erytrodysestesiaoireyhtymä, Ihottuma, Ihon hyperpigmentaatio | Kutina |
| Melko harvinaiset | Kutina, Runsas hikoilu, Suurirakkulainen ihottuma, Yleistynyt kesivä punaiho, Eryteema, Kynsitoksisuus, Näppylä, Petekiat, Psoriaasi, Herkkä iho, Ihon eksfoliaatio, Ihon leesio, Teleangiektasia, Nokkosihottuma | Nokkosihottuma, Ihottuma, Kynnen värimuutos |
| Tuntematon | Eryteema | |
| Luusto, lihakset ja sidekudos | ||
| Yleiset | Lihasheikkous, Lihassärky, Lihasspasmit | |
| Melko harvinaiset | Nivelsärky, Selkäkipu, Luukipu, Raajakipu, Moniniveltulehdus | |
| Munuaiset ja virtsatiet | ||
| Yleiset | Akuutti munuaisvaurio | Akuutti renaalinen vajaatoiminta |
| Melko harvinaiset | Munuaisten toiminnan heikentyminen, Munuaisten vajaatoiminta, Dysuria, Proteinuria | |
| Sukupuolielimet ja rinnat | ||
| Melko harvinaiset | Ulkosynnyttimien ja emättimen kuivuus | |
| Yleisoireet ja antopaikassa todettavat haitat | ||
| Hyvin yleiset | Heikkous, Limakalvotulehdus | Pyreksia, Perifeerinen edeema, Limakalvotulehdus, Heikkous |
| Yleiset | Pyreksia, Edeema, Vilunväristykset | Infuusioon liittyvä reaktio, Edeema |
| Melko harvinaiset | Huonovointisuus, Yleisen fyysisen terveyden heikentyminen, Inflammaatio, Monielinhäiriö-oireyhtymä, Influenssan kaltainen sairaus, Ei-sydänperäinen rintakipu, Kainalokipu, Rintakipu, Hypotermia, Kipu, Kasvojen Turvotus, Huono Lämpötilansieto, Kseroosi | |
| Tutkimukset | ||
| Hyvin yleiset | Alentunut paino | Alentunut paino |
| Yleiset | Suurentuneet transaminaasiarvot (ASAT-ALAT), Suurentunut veren alkalisen fosfataasin pitoisuus, Suurentunut gammaglutamyylitransferaasiarvo, Suurentunut veren kreatiniinipitoisuus | Suurentunut bilirubiiniarvo, Suurentuneet transaminaasiarvot (ASAT-ALAT), Suurentunut INR-arvo |
| Melko harvinaiset | Suurentunut INR-arvo, Pienentynyt kokonaisproteiiniarvo, Pienentynyt munuaisten kreatiniinipuhdistuma, Pidentynyt sydänsähkökäyrän QT-aika, Suurentunut monosyyttimäärä, Suurentunut troponiini 1 -arvo | |
| Vammat, myrkytykset ja hoitokomplikaatiot | ||
| Yleiset | Infuusioon liittyvä reaktio | |
* Harvinaisia tapauksia ei voida arvioida NAPOLI-1-tutkimuksesta pienen otoskoon vuoksi.
Kuvaus valikoiduista haittavaikutuksista
Myelosuppressio
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
Kuolettavia tapahtumia olivat kuumeinen neutropenia tai pansytopenia, kumpaakin esiintyi 0,3 %:lla NALIRIFOX-ryhmän potilaista.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Myelosuppressio (neutropenia/leukopenia, trombosytopenia ja anemia) oli yleisempi ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmässä verrattuna 5‑FU/LV‑kontrolliryhmään.
Neutropenia/leukopenia
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
Luokan 3 tai 4 leukopeniaa esiintyi 0,8 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa.
NAPOLI-3-tutkimuksessa, jossa ONIVYDE pegylated liposomal plus oxaliplatin/5-FU/LV (NALIRIFOX) -hoitoa verrattiin gemsitabiini plus nab-paklitakseli (Gem+NabP) -hoitoon, turvallisuustiedot osoittivat neutropenian korkeamman esiintymisen raportoinnin Gem+NabP-ryhmässä. Luokan 3 tai 4 neutropeniaa, pienentynyt neutrofiilimäärän ja kuumeista neutropeniaa esiintyi vastaavasti 14,1 %, 9,7 % ja 1,9 % potilaista, jotka saivat NALIRIFOX-hoitoa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Neutropenia/leukopenia oli merkittävin tärkeä hematologinen toksisuus. Vähintään luokan 3 neutropeniaa esiintyi yleisemmin potilailla, joita hoidettiin ONIVYDE pegylated liposomal + 5‑FU/LV:llä (27,4 %) verrattuna potilaisiin, joita hoidettiin 5‑FU/LV:llä (1,5 %). Neutropeenistä kuumetta/sepsistä ilmeni yleisemmin ONIVYDE pegylated liposomal + 5‑FU/LV‑yhdistelmäryhmässä [neljällä potilaalla (3,4 %)] verrattuna 5‑FU/LV‑kontrolliryhmään [yhdellä potilaalla (0,7 %)].
Nadiirin saavuttamisen mediaaniaika ≥ luokan 3 neutropenialle on 23 (vaihteluväli 8–104) päivää ensimmäisen ONIVYDE pegylated liposomal -hoitoannoksen jälkeen.
Trombosytopenia
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
Luokan 3 tai 4 trombosytopeniaa esiintyi 0,5 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Vähintään luokan 3 trombosytopeniaa esiintyi 2,6 %:lla potilaista, joita hoidettiin ONIVYDE pegylated liposomal + 5‑FU/LV:llä ja 0 %:lla potilaista, joita hoidettiin 5‑FU/LV:llä.
Anemia
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
Luokan 3 tai 4 anemiaa esiintyi 7,3 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
Vähintään luokan 3 anemiaa esiintyi 10,3 %:lla potilaista, joita hoidettiin ONIVYDE pegylated liposomal + 5‑FU/LV:llä ja 6,7 %:lla potilaista, joita hoidettiin 5‑FU/LV:llä.
Akuutti munuaisten vajaatoiminta
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-3-tutkimuksessa munuaisten toiminnan heikentyminen esiintyi 0,3 %:lla potilaista ja se oli luokan 3 tai 4, munuaisten vajaatoimintaa esiintyi luokissa 1–4 0,5 %:lla potilaista, joista 0,3 % oli luokan 3 tai 4, akuuttia munuaisvauriota esiintyi luokissa 1–4 1,1 %:lla potilaista, joista 0,8 % oli luokan 3 tai 4 potilailla, jotka saivat NALIRIFOX-hoitoa. Suurentunutta veren kreatiniinipitoisuutta esiintyi kaikissa luokissa 1–4 1,4 %:lla potilaista, joista 0,3 % oli luokan 3 tai 4, pienentynyttä munuaisten kreatiniinipuhdistumaa esiintyi luokissa 1 tai 2 0,3 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa. Oli vain yksi tapaus (0,3 %) kuolemaan johtanutta munuaisten vajaatoimintaa NALIRIFOX-ryhmässä.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-1-tutkimuksessa munuaisten toimintahäiriötä ja akuuttia munuaisten vajaatoimintaa on havaittu yleensä potilailla, joilla on vähentynyt nestetilavuus pahoinvoinnin/oksentelun ja/tai ripulin vuoksi. Akuuttia munuaisten vajaatoimintaa raportoitiin 6 potilaalla 117:stä (5,1 %) ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmässä.
Ripuli ja siihen liittyvät haittavaikutukset
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-3-tutkimuksessa turvallisuustiedot osoittivat ripulin korkeamman esiintymisen NALIRIFOX-ryhmässä raportoituna kaikissa luokissa ja luokissa 3 tai 4. Luokan 1–4 ripulia esiintyi 64,3 %:lla potilaista ja luokan 3 tai 4 ripulia esiintyi 19,5 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa. Kolinergisten reaktioiden, kuten nuhan, rinorrean, syljen liikaerityksen, punastumisen, kuumien aaltojen ja lisääntyneen kyynelnesteen erityksen, esiintymistä raportoitiin potilailla, jotka saivat NALIRIFOX-hoitoa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-1-tutkimuksessa luokan 3 tai 4 ripulia esiintyi 12,8 %:lla potilaista, jotka saivat ONIVYDE pegylated liposomal + 5‑FU/LV:tä. Potilailla, joilla oli viivästynyttä ripulia, mediaaniaika viivästyneen ripulin alkamiselle oli 8 päivää edellisestä ONIVYDE pegylated liposomal ‑annoksesta. Varhaista ripulia, joka ilmaantuu tyypillisesti ≤ 24 tuntia annoksen annon jälkeen, voi esiintyä, ja se on yleensä ohimenevää. Varhain alkaneeseen ripuliin saattaa myös liittyä kolinergisiä oireita, muun muassa nuhaa, syljen liikaeritystä, punastumista, hikoilua, brakykardiaa, mioosia ja hyperperistaltiikkaa, joista viimeksi mainittu voi aiheuttaa vatsan kouristelua. Ripulin varhaista alkamista esiintyi 29,9 %:lla potilaista ja kolinergisiä tapahtumia 3,4 %:lla potilaista, jotka saivat Onivyde+5‑FU/LV:tä.
Infuusioreaktio
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-3-tutkimuksessa infuusioon liittyviä reaktioita esiintyi 1,4 %:lla potilaista, jotka saivat NALIRIFOX-hoitoa. Kaikki olivat lieviä tai keskivaikeita (luokka 1 ja 2).
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-1-tutkimuksessa akuutteja infuusioreaktioita raportoitiin 6,8 %:lla potilaista ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmässä.
Muut erityisryhmät
Iäkkäät potilaat
Kaiken kaikkiaan suuria kliinisiä eroja turvallisuudessa ei raportoitu ≥ 65‑vuotiaiden ja < 65‑vuotiaiden potilaiden välillä.
ONIVYDE pegylated liposomal -valmiste yhdessä oksaliplatiinin, 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-3-tutkimuksessa mediaani-ikä oli 65 vuotta (vaihteluväli 20–85). 50,1 % potilaista oli vähintään 65-vuotiaita, joista 6,9 % oli vähintään 75-vuotiaita. Turvallisuustiedot ikäryhmittäin olivat yhdenmukaiset NALIRIFOX-ryhmän tietojen kanssa koko potilasjoukossa.
ONIVYDE pegylated liposomal -valmiste yhdessä 5-fluorourasiilin ja leukovoriinin kanssa
NAPOLI-1-tutkimuksessa havaittiin korkeampi keskeyttämisprosentti ≥ 65-vuotiaiden potilaiden ja < 65-vuotiaiden potilaiden välillä, joita hoidettiin ONIVYDE pegylated liposomal + 5‑FU/LV:llä (vastaavasti 14,8 % ja 7,9 %), ja joissain tapauksissa haittavaikutukset eivät hävinneet. Luokan 3 tai sitä korkeammat ja vakavat hoidon aikana ilmenevät haittavaikutukset olivat yleisempiä < 65‑vuotiailla potilailla (84,1 % ja 50,8 %) verrattuna ≥ 65‑vuotiaisiin potilaisiin (68,5 % ja 44,4 %). Sitä vastoin > 75‑vuotiailla potilailla (n = 12) esiintyi useammin vakavia haittavaikutuksia, annoksen viivettä, annoksen pienentämistä ja keskeyttämistä verrattuna ≤ 75‑vuotiaisiin potilaisiin (n = 105), kun heitä hoidettiin ONIVYDE pegylated liposomal + 5‑FU/LV:llä haiman adenokarsinoomatutkimuksessa.
Aasialaiset potilaat
NAPOLI-1-tutkimuksessa aasialaisilla potilailla havaittiin valkoihoisia vähemmän ripulia [14 (19,2 %) valkoihoisella 73:sta oli ≥ luokan 3 ripuli, ja yhdellä aasialaisella 33:sta (3,3 %) oli ≥ luokan 3 ripuli], mutta heillä esiintyi enemmän ja vaikeampaa neutropeniaa. Potilailla, jotka saivat ONIVYDE pegylated liposomal + 5‑FU/LV:tä, ≥ luokan 3 neutropeniaa esiintyi enemmän aasialaisilla potilailla [18 potilaalla 33:sta (55 %)] kuin valkoihoisilla potilailla [13 potilaalla 73:sta (18 %)]. Neutropeenistä kuumetta / neutropeenistä sepsistä raportoitiin esiintyneen 6 %:lla aasialaisista potilaista mutta vain 1 %:lla valkoihoisista potilaista. Tämä tulos on yhdenmukainen populaatiofarmakokineettisen analyysin kanssa, joka osoitti, että aasialaisten altistuminen irinotekaanille on alhaisempi ja altistuminen irinotekaanin aktiiviselle metaboliitille SN‑38:lle on korkeampi kuin valkoihoisilla.
Maksan vajaatoiminta
Kliinisissä tutkimuksissa, joissa ei‑liposomaalista irinotekaania annettiin viikoittaisina annoksina, potilailla, joiden seerumin kokonaisbilirubiinipitoisuudet (1,0–2,0 mg/dl) olivat lähtötasolla kohtalaisen koholla, oli merkittävästi suurempi todennäköisyys saada ensimmäisen syklin luokan 3 tai 4 neutropenia kuin niillä, joiden bilirubiinipitoisuudet olivat alle 1,0 mg/dl.
Potilaat, joilla on UGT1A1‑alleeli
Yksilöillä, jotka ovat 7/7 homotsygoottisia UGT1A1*28‑alleelille, on suurempi ei‑liposomaalisesta irinotekaanista johtuva neutropenian riski. NAPOLI-1-tutkimuksessa ≥ luokan 3 neutropenian esiintyvyys näillä potilailla [2 potilaalla 7:stä (28,6 %)] oli samanlaista kuin potilailla, jotka eivät olleet homotsygoottisia UGT1A1*28‑alleelille ja jotka saivat ONIVYDE pegylated liposomal ‑valmistetta aloitusannoksena 70 mg/m2 [30 potilasta 110:stä (27,3 %)] (ks. kohta Farmakodynamiikka). Tätä havaintoa ei arvioitu NAPOLI-3-tutkimuksessa.
Alipainoiset potilaat (painoindeksi < 18,5 kg/m2)
NAPOLI-1-tutkimuksessa 5 alipainoisella potilaalla 8:sta esiintyi luokan 3 tai 4 haittavaikutus, useimmiten myelosuppressio, ja 7 potilasta 8:sta tarvitsi annoksen säätöä, kuten annoksen viivästämistä, annoksen pienentämistä tai annoksen annon lopettamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tätä havaintoa ei arvioitu NAPOLI-3-tutkimuksessa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa ONIVYDE pegylated liposomal ‑valmistetta annettiin enintään 210 mg/m2 :n annoksina potilaille, joilla oli eri syöpiä. Näiden potilaiden saamat haittavaikutukset olivat samankaltaisia kuin ne, joita raportoitiin suositellulla annoksella ja hoito‑ohjelmalla.
Ei‑liposomaalisen irinotekaanin yliannostuksista on raportoitu, kun annokset ovat olleet noin kaksinkertaisia verrattuna irinotekaanin terapeuttiseen annokseen. Yliannostus saattaa johtaa kuolemaan. Merkittävimmät raportoidut haittavaikutukset olivat vaikea neutropenia ja vaikea ripuli.
ONIVYDE pegylated liposomal ‑valmisteen yliannostukseen ei ole tunnettua vastalääkettä. Maksimaaliseen tukihoitoon on ryhdyttävä, jotta voidaan estää ripulista aiheutuva elimistön kuivuminen ja hoitaa mahdolliset infektiokomplikaatiot.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Topoisomeraasi I:n estäjät. ATC-koodi: L01CE02
Vaikutusmekanismi
ONIVYDE pegylated liposomal ‑valmisteen vaikuttava aine on irinotekaani (topoisomeraasi I:n estäjä), joka on kapseloituneena lipidikaksoiskerrokseen vesikkeliin tai liposomiin.
Irinotekaani on kamptotekiinin johdos. Kamptotekiinit estävät spesifisesti entsyymi DNA‑topoisomeraasi I:tä. Irinotekaani ja sen aktiivinen metaboliitti SN‑38 sitoutuvat reversiibelisti topoisomeraasi I‑DNA ‑kompleksiin ja aiheuttavat yksiketjuiseen DNA:han vaurioita, jotka salpaavat DNA:n replikaatiohaarukan ja aiheuttavat sytotoksisuuden. Irinotekaani metaboloituu karboksyyliesteraasin vaikutuksesta SN‑38:ksi. SN‑38 on arviolta 1 000 kertaa voimakkaampi ihmisen ja jyrsijöiden kasvainsolulinjoista puhdistetun topoisomeraasi I:n estäjä kuin irinotekaani.
Farmakodynaamiset vaikutukset
Eläinmalleissa ONIVYDE pegylated liposomal ‑valmisteen on osoitettu laajentavan irinotekaanin plasmatasoja ja pidentävän altistusta aktiiviselle metaboliitille SN‑38:lle kasvaimen sijaintikohdassa.
Kliininen teho ja turvallisuus
NAPOLI-3
ONIVYDE pegylated liposomal -valmisteen turvallisuutta ja tehoa yhdessä oksaliplatiinin, 5‑fluorourasiilin ja leukovoriinin kanssa (NALIRIFOX) arvioitiin NAPOLI-3-tutkimuksessa, satunnaistettu, avoin, aktiivisesti kontrolloitu monikeskustutkimus. Tutkimukseen otettiin mukaan 770 potilasta, joilla oli haiman metastaattinen adenokarsinooma ja jotka eivät olleet saaneet aikaisemmin kemoterapiaa metastaattisessa tilassa. Satunnaistaminen jaettiin alueen, maksan metastaasien ja ECOG-toimintakykyluokan mukaan. Potilaat satunnaistettiin (1:1) saamaan yhtä seuraavista hoitoryhmistä:
NALIRIFOX: ONIVYDE pegylated liposomal 50 mg/m2 infuusiona laskimoon 90 minuutin aikana, jonka jälkeen he saivat oksaliplatiinia 60 mg/m2 infuusiona laskimoon 120 minuutin aikana, jonka jälkeen he saivat leukovoriinia 400 mg/m2 infuusiona laskimoon 30 minuutin aikana, jonka jälkeen he saivat 5-FU:ta 2 400 mg/m2 infuusiona laskimoon 46 tunnin aikana. Annostelu tapahtui kahden viikon välein.
Gem+NabP: Nab-paklitakseli 125 mg/m2 infuusiona laskimoon 35 minuutin aikana, jonka jälkeen he saivat gemsitabiinia 1 000 mg/m2 infuusiona laskimoon 30 minuutin aikana päivinä 1, 8 ja 15 kussakin 28 päivän syklissä.
Potilaat, jotka olivat homotsygoottisia UGT1A1*28-alleelille aloittivat ONIVYDE pegylated liposomal -valmisteen samalla annoksella (50 mg/m2 ONIVYDE pegylated liposomal -valmistetta) ja heitä seurattiin tarkasti turvallisuuden suhteen.
Hoito jatkui RECIST V1.1-kriteerien määrittelemään sairauden etenemiseen saakka tai kunnes toksisuutta ei voinut hyväksyä. Kasvaimen tilan arviointi tehtiin lähtötilanteessa ja sen jälkeen kahdeksan viikon välein päätutkijan arvioinnin mukaan RECIST v1.1-kriteerien mukaisesti.
Pääasialliset tehokkuuden tulosmittarit olivat kokonaiselossaolo (overall survival, OS), etenemättömyysaika (progression-free survival, PFS) ja objektiivinen vaste (objective response rate, ORR).
Lähtötilanteen väestötiedot ja potilaisuuden ominaisuudet olivat seuraavat: mediaani-ikä 65 vuotta (vaihteluväli: 20–85), 50 % vähintään 65-vuotiaita, 56 % miehiä, 83 % valkoihoisia, 5 % aasialaisia, 3 % tummaihoisia tai afroamerikkalaisia, ECOG-toimintakykyluokka oli 0 43 %:lla tai 1 57 %:lla potilaista, 87 % maksan metastaaseja.
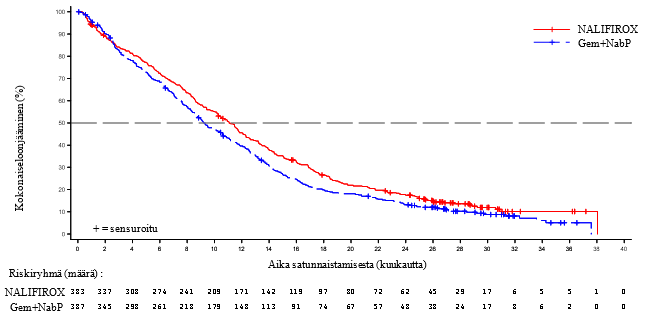
NAPOLI-3-tutkimus osoitti tilastollisesti merkittävän parannuksen kokonaiselossaolossa (OS) ja etenemättömyysajassa (PFS) NALIRIFOX-ryhmässä Gem+NabP-ryhmään verrattuna alkuperäisen luokittelun määritelmän mukaisesti tilastollisen analyysin suunnitelmassa. Mediaani OS oli 11,1 kuukautta (95 %:n CI: 10,0; 12,1; HR 0,84 [95 %:n CI: 0,71; 0,99]; p = 0,04) NALIRIFOX-ryhmässä ja 9,2 kuukautta (95 %:n CI: 8,3; 10,6) Gem+NabP-ryhmässä lopullisessa analyysissä. Päivitetyt OS-analyysin tulokset esitetään yhteenvetona taulukossa 5 ja kuvassa 1 (OS).
Taulukko 5: Tehokkuustulokset kliinisestä NAPOLI-3-tutkimuksesta
NALIRIFOX (N = 383) | Gem+NabP (N = 387) | |
| Päivitetty kokonaiselossaolo, katkaisupiste = 3. lokakuuta 2023 | ||
| Kuolemien lukumäärä, n (%) | 328 (85,6) | 345 (89,1) |
| Mediaani OS (kuukautta) | 11,1 | 9,2 |
| (95 % CI) | (10,0; 12,1) | (8,3; 10,6) |
| Riskisuhde (95 % CI)* | 0,85 (0,73; 0,99) | |
| Etenemättömyysaika (PFS), katkaisupiste = 23. heinäkuuta 2022** | ||
| Kuolema tai eteneminen, n (%) | 249 (65) | 259 (67) |
Mediaani PFS (kuukautta) | 7,4 | 5,6 |
| (95 % CI) | (6,0; 7,7) | (5,3; 5,8) |
| Riskisuhde (95 % CI)* | 0,70 (0,59; 0,84) | |
| p-arvo † | 0,0001 | |
| Objektiivinen vaste (ORR), katkaisupiste = 23. heinäkuuta 2022 | ||
| ORR (95 % CI) | 41,8 (36,8; 46,9) | 36,2 (31,4; 41,2) |
| CR, n (%) | 1 (0,3) | 1 (0,3) |
| PR, n (%) | 159 (41,5) | 139 (35,9) |
NALIRIFOX = ONIVYDE pegylated liposomal + oksaliplatiini/5-fluorourasiili/leukovoriini; Gem+NabP =gemsitabiini+nab-paklitakseli * Perustuu Coxin verrannollisten riskitiheyksien malliin lähtötilanteen ECOG-toimintakykyluokan, alueen (Pohjois-Amerikka, Itä-Aasia muu maailman) ja maksan metastaasien mukaan ** Potilaat sensuroitiin, kun seuraava syöpähoito aloitettiin tai tutkimuksen suostumus peruttiin tai menetettiin seurannasta tai jos 2 peräkkäistä kasvaimen arviointia jäi välistä, mitä seurasi eteneminen tai kuolema † Perustuu luokiteltuun logrank-testiin. | ||
| Lyhenteet: CR = täydellinen vaste, PR = osittainen vaste; CI = luottamusväli | ||
Kuva 1: Kaplan-Meierin käyrä päivitetylle kokonaiselossaololle, katkaisupiste = 3. lokakuuta 2023 NAPOLI-3-tutkimuksessa
NAPOLI-1
ONIVYDE pegylated liposomal ‑valmisteen teho ja turvallisuus tutkittiin monikansallisessa, satunnaistetussa, avoimessa, kontrolloidussa kliinisessä tutkimuksessa (NAPOLI–1), jossa testattiin kahta hoito‑ohjelmaa potilaille, joilla oli metastaattinen haiman adenokarsinooma ja joilla sairauden eteneminen oli vahvistettu gemsitabiinihoidon tai gemsitabiinia sisältävän hoidon jälkeen. Tutkimus suunniteltiin arvioimaan ONIVYDE pegylated liposomal ‑monoterapiahoidon tai ONIVYDE pegylated liposomal + 5‑FU/LV:n kliinistä tehoa ja turvallisuutta verrattuna aktiiviseen 5‑FU/LV:hen.
Potilaat, jotka oli satunnaistettu ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmään, saivat ONIVYDE pegylated liposomal ‑valmistetta 70 mg/m2 infuusiona laskimoon 90 minuutin aikana, jonka jälkeen he saivat LV:tä 400 mg/m2 laskimoon 30 minuutin aikana ja sen jälkeen 5‑FU:ta 2 400 mg/m2 laskimoon 46 tunnin aikana. Annostelu tapahtui 2 viikon välein. UGT1A1*28‑alleelille homotsygoottiset potilaat saivat pienemmän alkuannoksen ONIVYDE pegylated liposomal ‑valmistetta (ks. kohta Annostus ja antotapa). Potilaat, jotka oli satunnaistettu 5‑FU/LV‑ryhmään, saivat 200 mg/m2 leukovoriinia laskimoon 30 minuutin aikana, jonka jälkeen he saivat 2 000 mg/m2 5‑FU:ta laskimoon 24 tunnin aikana. Annostelu tapahtui päivinä 1, 8, 15 ja 22 kuuden viikon syklissä. Potilaat, jotka oli satunnaistettu ONIVYDE pegylated liposomal ‑monoterapiaryhmään, saivat 100 mg/m2 infuusiona laskimoon 90 minuutin aikana joka kolmas viikko.
Kliinisen NAPOLI‑1‑tutkimuksen tärkeimmät kelpoisuuskriteerit haiman metastaattista adenokarsinoomaa sairastaville potilaille olivat Karnofskyn suorituskykyasteikon (KPS) pistemäärä ≥70, normaali bilirubiinitaso, transaminaasitasot ≤ 2,5 kertaa ULN tai ≤ 5 kertaa ULN potilailla, joilla oli maksan metastaaseja ja albumiini ≥ 3,0 g/dl.
Yhteensä 417 potilasta satunnaistettiin ONIVYDE pegylated liposomal + 5‑FU/LV‑ryhmään (N = 117), ONIVYDE pegylated liposomal ‑monoterapiaryhmään (N = 151) ja 5‑FU/LV‑ryhmään (N = 149). Potilaiden demografiset ominaisuudet ja sairauden ominaisuudet tutkimukseen osallistumisen alussa oli hyvin tasapainotettu tutkimusryhmien välillä.
ITT‑ eli hoitoaiepopulaatiossa (kaikki satunnaistetut tutkittavat) mediaani‑ikä oli 63 vuotta (vaihteluväli 31–87 vuotta), 57 % oli miehiä, 61 %oli valkoihoisia ja 33 % aasialaisia. Keskimääräinen lähtötason albumiinitaso oli 3,6 g/dl, ja perustason KPS oli 90–100 55 %:lla potilaista. Sairauden ominaisuudet sisälsivät seuraavat: 68 %:lla potilaista oli maksan metastaaseja ja 31 %:lla potilaista oli keuhkojen metastaaseja. 12 % potilaista ei ollut saanut metastaattisen vaiheen hoitoa aiemmin, 56 % potilaista oli saanut aiemmin yhden linjan metastaattisen vaiheen hoitoa ja 32 % potilaista oli saanut aiemmin kahden tai useamman linjan metastaattisen vaiheen hoitoa.
Potilaat saivat hoitoa, kunnes sairaus eteni tai kunnes toksisuutta ei voinut hyväksyä. Ensisijainen tulosmittari oli kokonaiselossaolo (overall survival, OS). Lisäksi tuloksia mitattiin etenemättömyysajalla (progression free survival, PFS) ja objektiivisella vasteella (objective response rate, ORR). Tulokset esitetään taulukossa 6. Kokonaiselossaolo esitetään kuvassa 2.
Taulukko 6: Kliinisen NAPOLI‑1‑tutkimuksen tehotulokset
ONIVYDE pegylated liposomal + 5‑FU/LV (N = 117) | 5‑FU/LV (N = 119) | |
| Kokonaiselossaolo (OS)1 | ||
| Kuolemien lukumäärä, n (%) | 75 (64) | 80 (67) |
| Mediaani OS (kuukausia) | 6,1 | 4,2 |
| (95 % CI) | (4,8, 8,9) | (3,3, 5,3) |
| Riskisuhde (95 % CI)3 | 0,67 (0,49‑0,92) | |
| p‑‑arvo4 | 0,0122 | |
| Etenemättömyysaika (PFS)1,2 | ||
| Kuolema tai taudin eteneminen, n (%) | 83 (71) | 92 (77) |
| Mediaani PFS (kuukausia) | 3,1 | 1,5 |
| (95 % CI) | (2,7, 4,2) | (1,4, 1,8) |
| Riskisuhde (95 % CI)3 | 0,56 (0,41‑0,75) | |
| p‑‑arvo4 | 0,0001 | |
| Objektiivinen vaste (ORR)2 | ||
| N | 19 | 1 |
| ORR (%) | 16,2 | 0,8 |
| 95 % CI vasteen asteesta5 | 9,6, 22,9 | 0,0, 2,5 |
| Aste‑ero (95 % CI)5 | 15,4 (8,5, 22,3) | |
| p‑‑arvo6 | <0,0001 | |
1 Mediaani on Kaplan‑Meierin estimaatti mediaanieloonjäämisajasta.
2 RECIST‑ohjeiden mukaan, versio 1.1.
3 Coxin mallin analyysi
4 Osittamaton log‑rank‑testi
5 Perustuu normaaliin approksimointiin
6 Fisherin eksakti testi
Lyhenteet: 5‑FU/LV = 5‑fluorourasiili/leukovoriini, CI = luottamusväli.
Kuva 2 Kaplan-Meierin käyrä kokonaiselossaololle NAPOLI-1-tutkimuksessa
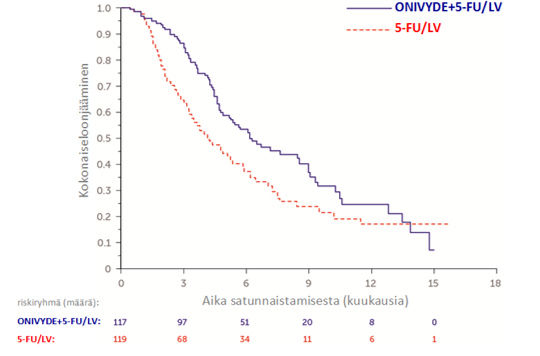
ONIVYDE pegylated liposomal ‑valmisteen hyötyä ei ole osoitettu aiemmin ei‑liposomaaliselle irinotekaanille altistuneille potilaille johtuen näiden potilaiden vähäisestä määrästä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset ONIVYDE pegylated liposomal ‑valmisteen käytöstä haimasyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Irinotekaanin liposomikapseloituminen pidentää verenkiertoa ja rajoittaa jakautumista verrattuna ei‑liposomaaliseen irinotekaaniin.
Kokonaisirinotekaanin ja kokonais‑SN‑38:n plasmafarmakokinetiikat arvioitiin syöpäpotilailla, jotka saivat ONIVYDE pegylated liposomal ‑valmistetta ainoana lääkeaineena tai osana yhdistelmäkemoterapiaa 35-155 mg/m2:n annoksina 1 058 syöpäpotilaalla käyttäen populaatiofarmakokineettistä analyysiä. Kokonaisirinotekaanin ja SN‑38‑analyyttien farmakokineettiset parametrit, jotka seurasivat ONIVYDE pegylated liposomal ‑valmisteen antoa annoksella 70 mg/m2 ainoana lääkeaineena tai osana yhdistelmäterapiaa ja 50 mg/ m2 NALIRIFOX-hoitokuurissa (ONIVYDE pegylated liposomal/oksaliplatiini/5-FU/LV) on esitetty taulukossa 7.
Taulukko 7: Yhteenveto geometrisen keskiarvon (geometric CV) kokonaisirinotekaanista ja kokonais-SN-38:sta
| Aloitusannos (mg/m2) | Kuvailevat tilastotiedot | Kokonaisirinotekaani | Kokonais-SN-38 | |||
Cmax [µg/ml] | AUCSS [päivää∙µg/ml] | t1/2 [päivää] | Cmax [ng/ml] | AUCSS [päivää∙ng/ml] | ||
| 50* | N | 360 | 360 | 360 | 360 | 360 |
| Geometrinen keskiarvo | 25,1 | 37,8 | 1,93 | 2,09 | 12,1 | |
| Geometrinen CV (%) | 18,5 | 73,6 | 14 | 42,1 | 46,6 | |
| 70** | N | 116 | 116 | 116 | 116 | 116 |
| Geometrinen keskiarvo | 29,0 | 46,6 | 1,91 | 2,50 | 14,5 | |
| Geometrinen CV (%) | 17,6 | 60,3 | 8,4 | 57,3 | 45,0 | |
| AUCSS: Plasmapitoisuuskäyrän alle jäävä pinta-ala vakaassa tilassa kahden viikon aikana | ||||||
t1/2: lopullinen eliminaation puoliintumisaika Cmax = enimmäispitoisuus plasmassa CV = variaatiokerroin * ONIVYDE pegylated liposomal/oksaliplatiini/5-FU/leukovoriini (NAPOLI-3) ** ONIVYDE pegylated liposomal/5-FU/leukovoriini (NAPOLI-1) | ||||||
Jakautuminen
Liposomaalisen irinotekaanin suora mittaus osoittaa, että 95 % irinotekaanista säilyy liposomiin kapseloituneena verenkierrossa. Ei‑liposomaalinen irinotekaani osoittaa suurta jakautumistilavuutta (1 38 l/m2). ONIVYDE pegylated liposomal ‑valmisteannoksen jakautumistilavuus oli 4 litraa (saatu populaatiofarmakokineettisestä analyysistä), mikä viittaa siihen, että ONIVYDE pegylated liposomal ‑valmiste rajoittuu suurelta osin vaskulaariseen nesteeseen.
ONIVYDE pegylated liposomal ‑valmisteen sitoutuminen plasman proteiineihin on erittäin vähäistä (< 0,44 % ONIVYDE pegylated liposomal ‑valmisteen kokonaisirinotekaanista). Ei‑liposomaalisen irinotekaanin sitoutuminen plasman proteiineihin on kohtalaista (30-68 %), ja SN‑38 sitoutuu voimakkaasti ihmisen plasman proteiineihin (arviolta 95 %).
Biotransformaatio
Irinotekaani, joka vapautuu liposomikapseloitumisesta, seuraa samanlaista metabolista reittiä kuin ei‑liposomaalisen irinotekaanin raportoitu reitti.
Karboksyyliesteraasientsyymit toimivat välittäjänä, kun irinotekaani muuttuu metabolisesti aktiiviseksi SN‑38‑metaboliitiksi. In vitro ‑tutkimukset osoittavat, että irinotekaani, SN‑38 ja toinen metaboliittinen aminopentaanikarboksyylihappo (APC) eivät estä sytokromi P‑450 ‑isoentsyymejä. SN‑38 konjugoituu jälkeenpäin ensisijaisesti UDP‑glukuronyylitransferaasientsyymin 1A1 (UGT1A1) toimesta ja muodostaa glukuronidimetaboliitin. UGT1A1‑aktiivisuus on vähentynyt yksilöillä, joilla on geneettisiä polymorfismeja (kuten UGT1A1*28‑polymorfismia), jotka johtavat vähentyneeseen entsyymiaktiivisuuteen. Populaatiofarmakokineettisessä analyysissä ei ollut merkittävää yhteyttä UGT1A1*28-polymorfismin (7/7-homotsygoottinen [8 %] vs. ei-7/7-homotsygoottinen) ja SN-38-puhdistuman välillä.
Eliminaatio
ONIVYDE pegylated liposomal ‑valmisteen ja ei‑liposomaalisen irinotekaanin jakautumisominaisuuksia ihmisissä ei ole selvitetty täysin.
Ei‑liposomaalista irinotekaania erittyy virtsaan 11-20 %, SN‑38:aa < 1 % ja SN‑38 glukuronidia 3 %. Irinotekaanin ja sen metaboliittien (SN‑38 ja SN‑38 glukuronidi) kumulatiivinen erittyminen sappeen ja virtsaan 48 tunnin aikana ei-liposomaalisen irinotekaanin annon jälkeen kahdella potilaalla vaihteli noin 25 %:sta (100 mg/m2) 50 %:iin (300 mg/m2).
Munuaisten toimintahäiriö
Farmakokineettistä tutkimusta potilailla, joilla on munuaisten toimintahäiriö, ei ole tehty. Kreatiniinipuhdistumaa ei havaittu merkittäväksi SN‑38‑puhdistuman kovariaatiksi. Vaikeaa munuaisten toimintahäiriötä (CLcr < 30 ml/min) sairastavien potilaiden tiedot olivat riittämättömiä, jotta toimintahäiriön vaikutusta farmakokinetiikkaan olisi voitu arvioida (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksan toimintahäiriö
Farmakokineettistä tutkimusta potilailla, joilla on maksan toimintahäiriö, ei ole tehty. Populaatiofarmakokineettisessä analyysissa kohonnut bilirubiinitaso liittyi alhaisempaan SN-38-puhdistumaan. Bilirubiinitaso 1,14 mg/dl (95. persentiili kokonaispopulaatiosta) johtaa SN-38 AUC:n 32 % nousuun verrattuna mediaani bilirubiinitasoon 0,44 mg/dl (1 055 mallissa arvioidusta potilaasta 54 oli bilirubiinitaso ≥ 1,14 mg/dl). Tietoja ei ole saatavilla potilaista, joiden bilirubiini on > 2,8 mg/dl). Kohonneilla ALAT/ASAT‑pitoisuuksilla ei ollut vaikutusta SN‑38:n kokonaispitoisuuksiin. Potilaista, joiden kokonaisbilirubiini on enemmän kuin 2 kertaa ULN, ei ole saatavilla tietoja.
Muut erityisryhmät
Ikä ja sukupuoli
Populaatiofarmakokineettinen analyysi potilaista, jotka olivat 20–87‑vuotiaita ja joista 11 % aikaisemmissa tutkimuksissa ja 6,9 % NAPOLI-3-tutkimuksessa oli ≥ 75‑vuotiaita, viittaa siihen, että iällä ei ollut kliinisesti merkittävää vaikutusta irinotekaanille ja SN‑38:lle altistumiseen.
Sukupuoli havaittiin merkittäväksi kovariaatiksi populaatiofarmakokineettisessä analyysissä irinotekaanin AUC:n kohotessa 28 % ja kliinisesti merkittävän SN-38:n AUC:n kohotessa 32 % naisilla, kun ei säädetty muiden kovariaattien mukaan.
Etnisyys
Populaatiofarmakokineettinen analyysi osoittaa, että irinotekaanin AUC on 32 % alhaisempi, mikä on kliinisesti merkittävää, aasialaisilla tutkittavilla kuin muuta alkuperää olevilla tutkittavilla.
Farmakokineettiset/farmakodynaamiset suhteet
NAPOLI-3
Altistusturvallisuusanalyysissä, joka keskittyi 360 NAPOLI-3-tutkimukseen osallistuneiden tutkittavien tietoihin, joita hoidettiin 50 mg/m² annoksella ONIVYDE pegylated liposomal -valmistetta yhdessä 5-FU:n, LV:n ja oksaliplatiinin kanssa, vähintään luokan 3 ripulin tai vähintään luokan 3 neutropenian todennäköisyys näytti suurenevan lisääntyvien irinotekaani- ja SN-38-altistusten kanssa. Altistuksen ja tehon suhteen ei havaittu olevan tilastollisesti merkittävä.
NAPOLI-1
353 potilaan yhdistetyssä analyysissa korkeampaan plasman SN‑38 Cmax ‑pitoisuuteen liittyi suurempi neutropenian todennäköisyys ja korkeampaan plasman kokonaisirinotekaani Cmax ‑pitoisuuteen liittyi suurempi ripulin todennäköisyys.
NAPOLI-1-tutkimuksessa plasman korkeammat altistumiset kokonaisirinotekaanille ja SN‑38:lle ONIVYDE pegylated liposomal + 5‑FU/LV‑hoitoryhmän potilailla liittyivät pidempään kokonaiselossaoloon ja etenemättömyysaikaan sekä korkeampaan objektiiviseen vasteeseen.
Prekliiniset tiedot turvallisuudesta
Kerta‑annoksen ja toistuvien annosten toksisuustutkimuksissa hiirillä, rotilla ja koirilla toksisuuden kohde‑elimiä olivat maha‑suolikanava ja hematologinen järjestelmä. Vaikutusten vaikeusaste riippui annoksesta ja oli reversiibeli. NOAEL‑taso (suurin merkitsevää vastetta tuottamaton annos) rotilla ja koirilla, jotka saivat ONIVYDE pegylated liposomal ‑valmistetta 90 minuutin laskimoinfuusiona kerran kolmen viikon välein 18 viikon ajan, oli 155 mg/m2.
Koirilla tehdyissä farmakologisissa turvallisuustutkimuksissa ONIVYDE pegylated liposomal ‑valmiste ei vaikuttanut kardiovaskulaarisiin, hemodynaamisiin, elektrokardiografisiin tai hengitysteihin liittyviin parametreihin annoksilla, jotka olivat korkeintaan 18 mg/kg tai 360 mg/m2. Rotilla tehdyissä toistuvien annosten toksisuustutkimuksissa ei havaittu keskushermostoon liittyvään toksisuuteen viittaavia löydöksiä.
Genotoksisuus ja mahdolliset karsinogeenisuutta aiheuttavat ominaisuudet
ONIVYDE pegylated liposomal ‑valmistetta ei ole tutkittu genotoksisissa tutkimuksissa. Ei‑liposomaalinen irinotekaani ja SN‑38 olivat genotoksisia in vitro kromosomipoikkeavuustestissä CHO‑soluilla ja in vivo ‑mikrotumatestissä hiirillä. Toiset tutkimukset irinotekaanista ovat kuitenkin osoittaneet, että niillä ei ole mutageenistä potentiaalia Amesin testissä.
ONIVYDE pegylated liposomal ‑valmistetta ei ole tutkittu karsinogeenisuustutkimuksissa. Kun rottia hoidettiin ei‑liposomaalisella irinotekaanilla kerran viikossa 13 viikon ajan 150 mg/m²:n enimmäisannoksella, hoitoon liittyviä kasvaimia ei ollut raportoitu 91 viikkoa hoidon päättymisen jälkeen. Näissä olosuhteissa annoksen ja yhdistettyjen kohdunsarven endometriaalisten stroomapolyyppien ja endometriaalisten stroomasarkoomien välillä oli merkittävä lineaarinen taipumus. Vaikutusmekanisminsa vuoksi irinotekaani on mahdollinen karsinogeeni.
Lisääntymistoksisuus
ONIVYDE pegylated liposomal ‑valmistetta ei ole tutkittu lisääntymis‑ ja kehitystoksisuustutkimuksissa.
Ei‑liposomaalinen irinotekaani oli teratogeenista rotissa ja kaneissa annoksilla, jotka olivat ihmisen hoitoannosta pienempiä. Kun valmisteella hoidettiin rottia, näiden rottien ulkoisia epämuodostumia omaavilla poikasilla havaittiin hedelmällisyyden laskua. Tätä ei havaittu morfologisesti normaaleissa poikasissa. Raskaana olevien rottien istukan paino laski, jälkeläisten sikiöelinkelpoisuus heikkeni ja käytöspoikkeavuudet lisääntyivät.
Ei‑liposomaalinen irinotekaani aiheutti urosten sukuelinten surkastumista sekä rotilla että koirilla useiden päivittäisten 20 mg/kg:n ja 0,4 mg/kg:n annosten jälkeen. Nämä vaikutukset hävisivät, kun hoito lopetettiin.
Farmaseuttiset tiedot
Apuaineet
Liposomeja muodostavat lipidit
1,2‑distearoyyli‑sn‑glysero‑3‑fosfokoliini (DSPC)
kolesteroli
N‑(karbonyyli‑metoksipolyetyleeniglykooli‑2000)‑1,2‑distearoyyli‑sn‑glysero‑3‑fosfoetanoliamiini (MPEG‑2000‑DSPE)
Muut apuaineet
sakkaroosioktasulfaatti
2‑ [ 4‑ (2‑hydroksietyyli)piperatsiini‑1‑yl] etaanisulfonihappo (HEPES‑puskuri)
natriumkloridi
injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
ONIVYDE pegylated liposomal ‑valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Laimennuksen jälkeen
Laimennetun infuusionesteen, dispersion, on osoitettu olevan kemiallisesti ja fysikaalisesti stabiili 15‑25 °C:ssa enintään kuuden tunnin ajan ja jääkaapissa (2–8 ºC) korkeintaan 24 tunnin ajan.
Mikrobiologisista syistä valmiste olisi käytettävä välittömästi. Jos valmistetta ei käytetä välittömästi, käytönaikainen säilytysaika ja ‑olosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2–8 °C).
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ONIVYDE PEGYLATED LIPOSOMAL infuusiokonsentraatti, dispersiota varten
4,3 mg/ml (L:ei) 10 ml (1073,31 €)
PF-selosteen tieto
Tyypin I lasinen injektiopullo, jossa on harmaa klorobutyylitulppa ja alumiininen sinetti sekä irti napsautettava ‑korkki. Injektiopullo sisältää 10 ml konsentraattia.
Yksi pakkaus sisältää yhden injektiopullon.
Valmisteen kuvaus:
Väriltään valkoinen tai kellertävä, läpikuultamaton isotoninen liposomaalinen dispersio.
Konsentraatin pH on 7,2 ja osmolaliteetti 295 mOsm/kg.
Käyttö- ja käsittelyohjeet
ONIVYDE pegylated liposomal on sytotoksinen lääkevalmiste, ja sitä on käsiteltävä varoen. Käsineiden, suojalasien ja suojavaatteiden käyttöä suositellaan, kun ONIVYDE pegylated liposomal ‑valmistetta käsitellään tai annetaan. Jos dispersiota joutuu iholle, iho on pestävä välittömästi ja huolellisesti saippualla ja vedellä. Jos dispersiota joutuu limakalvoille, ne on huuhdeltava huolellisesti vedellä. Raskaana olevat hoitohenkilökunnan jäsenet eivät saa käsitellä ONIVYDE pegylated liposomal ‑lääkevalmistetta ottaen huomioon sen sytotoksisen luonteen.
Dispersion käyttövalmiiksi saattaminen ja anto
ONIVYDE pegylated liposomal ‑valmiste toimitetaan steriilinä liposomaalisena dispersiona, jonka pitoisuus on 4,3 mg/ml, ja se täytyy laimentaa ennen antoa käyttämällä neulaa, jonka koko on enintään 21 G. Valmista dispersio, jossa on oikea annos ONIVYDE pegylated liposomal ‑valmistetta laimennettuna lopulliseen 500 ml:n tilavuuteen: laimenna injektioon tarkoitetulla 5 %:n glukoosiliuoksella tai injektioon tarkoitetulla 9 mg/ml:n (0,9 %:n) natriumkloridiliuoksella. Sekoita laimennettu dispersio varovasti kääntelemällä. Laimennettu dispersio on väriltään kirkasta, hieman valkoista tai hieman opalisoivaa, eikä siinä näy hiukkasia.
Ensilinjan hoidossa aikuispotilailla, joilla on haiman metastaattinen adenokarsinooma, ONIVYDE pegylated liposomal -valmiste on annettava ennen oksaliplatiinia, jonka jälkeen annetaan LV, jonka jälkeen annetaan 5-FU. Haiman metastaattisen adenokarsinooman hoidossa aikuispotilailla, joiden sairaus on edennyt gemsitabiinipohjaisen hoidon jälkeen, ONIVYDE pegylated liposomal ‑valmiste on annettava ennen LV:tä, jonka jälkeen annetaan 5‑FU:ta. ONIVYDE pegylated liposomal ‑valmistetta ei saa antaa bolusinjektiona tai laimentamattomana dispersiona.
Aseptisia menetelmiä on noudatettava, kun infuusiota valmistellaan. ONIVYDE pegylated liposomal ‑valmiste on tarkoitettu vain kertakäyttöön.
Varovaisuutta on noudatettava, jotta vältetään ekstravasaatio, ja infuusiokohtaa on seurattava tulehduksen merkkien varalta. Jos ekstravasaatiota ilmenee, suositellaan kohdan huuhtelua steriilillä vedellä ja/tai injektioon tarkoitetulla 9 mg/ml:n (0,9 %:n) natriumkloridiliuoksella, minkä lisäksi suositellaan jään käyttöä.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ONIVYDE PEGYLATED LIPOSOMAL infuusiokonsentraatti, dispersiota varten
4,3 mg/ml 10 ml
- Ei korvausta.
ATC-koodi
L01CE02
Valmisteyhteenvedon muuttamispäivämäärä
19.09.2024
Yhteystiedot
Äyritie 22
01510 Vantaa
09 279 8080
www.servierfinland.fi
info.finland@servier.com
