OZALIN oraaliliuos, kerta-annospakkaus 2 mg/ml
Vaikuttavat aineet ja niiden määrät
1 ml sisältää 2 mg midatsolaamia.
5 ml:n ampulli sisältää 10 mg midatsolaamia.
Apuaineet, joiden vaikutus tunnetaan: etanoli (alle 100 mg ampullia kohden), natrium (alle 1 mmol (23 mg) ampullia kohden), gammadekstriini (400 mg ampullia kohden, suositellulla annoksella alle sallitun vuorokausialtistuksen 20 mg/kg/vrk).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Oraaliliuos kerta-annospakkaus.
Kliiniset tiedot
Käyttöaiheet
OZALIN on tarkoitettu käytettäväksi imeväisten, lasten ja nuorten (6 kuisista 17 vuotiaisiin) kohtalaiseen sedaatioon ennen hoitotoimenpiteitä tai diagnostisia toimenpiteitä lievittämään toimenpiteeseen liittyvää pelkoa, ahdistuta ja kiihtymystä tai esilääkityksenä ennen anestesiaa.
Annostus ja antotapa
OZALIN-oraaliliuoksen saa antaa vain terveydenhuollon ammattilainen.
Ennen sedaatiota on noudatettava yleisiä paastoamisohjeita.
Annostus
Annos on mitoitettava potilaan painon mukaan.
OZALIN annetaan suun kautta kerta-annoksena 0,25 mg/kg pediatrisille potilaille kuuden kuukauden iästä alkaen. Toisen annoksen antamista välittömästi ei suositella (ks. kohta Farmakokinetiikka).
Enimmäisannos on 20 mg midatsolaamia (vastaa kahta ampullia), vaikka lapsi tai nuori painaisi yli 80 kg.
OZALIN on tarkoitettu annettavaksi kerta-annoksena. Sen toistuvasta annosta ei ole saatavilla tietoa.
Ylipainoisille lapsille ja nuorille annos mitoitetaan lapsen painon mukaan 20 mg:n rajaan asti.
Annos on mitoitettava potilaan painon mukaan. Oraaliannostelijassa on kiloina (kg) merkityt asteikkomerkit 3 painokilosta 40 painokiloon (ks kohta Käyttö- ja käsittelyohjeet, nro 6). Asteikkomerkkejä on kolmenlaisia:
- Lyhytasteikkomerkki tarkoittaa 1 kg:aa, mikä vastaa 0,25 mg midatsolaamia
- Väliasteikkomerkki vastaa 5 kg:aa eli 1,25 mg midatsolaamia
- Pitkä asteikkomerkki vastaa 10 kg:aa, mikä tarkoittaa 2,5 mg:n midatsolaamiannosta.
Yli 40 kg painavalle potilaalle tarvitaan 2 ampullia. Pienimmän ampullista vedettävän annoksen tulee vastata 3 kg:n annosta. Enemmän kuin yksi ampulli tarvitaan 41 ja 42 kg painavalle potilaalle. Ota ensimmäisestä ampullista annos, joka on alempi kuin 40 kg ja ota lisäannos toisesta ampullista. Ks. alla olevat esimerkit:
- Anna 41 kg painavalle potilaalle 30 kg annos ensimmäisestä ampullista ja 11 kg annos toisesta ampullista.
- Anna 42 kg painavalle potilaalle 30 kg annos ensimmäisestä ampullista ja 12 kg annos toisesta ampullista.
Erityisryhmät
Munuaisten vajaatoiminta
OZALINia on käytettävä harkiten potilailla, joilla on krooninen munuaisten vajaatoiminta, sillä se voi viivästyttää midatsolaamin eliminaatiota ja pitkittää lääkkeen vaikutuksia.
Maksan vajaatoiminta
Maksan vajaatoiminta vähentää midatsolaamipuhdistumaa, mikä pidentää terminaalista puoliintumisaikaa (eliminaation osalta) ja lisää biologista hyötyosuutta. Kun midatsolaamia on annettu tällaiselle potilaalle, mainittuja vaikutuksia ja elintärkeitä merkkejä on tarkkailtava huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
OZALINin turvallisuutta ja tehoa ei ole määritetty alle kuuden kuukauden ikäisillä lapsilla. Tietoja ei ole saatavilla.
Antotapa
OZALIN on tarkoitettu käytettäväksi vain suun kautta, ja se on annettava mukana toimitetulla erityisesti sille tarkoitetulla oraaliannostelijalla, jossa on kiloina (kg) merkityt asteikkomerkinnät.
OZALIN on annettava keskimäärin 30 minuuttia ennen toimenpidettä tai anestesiaa.
Oraaliannostelija ja suodattimella varustettu pilli on tarkoitettu yhden kerran tapahtuvaan annoksen mittaamiseen ja annosteluun.
Ampulli, oraaliannostelija ja suodattimella varustettu pilli on hävitettävä käytön jälkeen.
Tarkat ohjeet on annettu kohdassa Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Vasta-aiheinen potilailla, joilla on:
- yliherkkyys vaikuttavalle aineelle, bentsodiatsepiineille tai jollekin kohdassa Apuaineet mainitulle apuaineelle.
- myasthenia gravis
- vaikea hengityksen vajaatoiminta
- hengitysteiden anatominen poikkeavuus tai keuhkosairaus
- uniapneaoireyhtymä
- vaikea maksan vajaatoiminta
Varoitukset ja käyttöön liittyvät varotoimet
Midatsolaamia saavat antaa vain terveydenhuollon ammattilaiset sellaisessa toimintaympäristössä, joka on varustettu täydellisesti hengitystoimintojen sekä sydän- ja verisuonitoimintojen seurantaan ja tukemiseen. Henkilöillä on oltava erityiskoulutus odotettavissa olevien haittavaikutusten tunnistamiseen ja hallintaan, mukaan lukien hengityksen ja sydämen elvytys. Vaikeita sydämeen ja hengitykseen liittyviä haittavaikutuksia on raportoitu. Näitä ovat olleet hengityslama, apnea, hengityspysähdys ja/tai sydänpysähdys. Tällaiset henkeä uhkaavat tapahtumat ovat todennäköisimpiä suurilla annoksilla.
Midatsolaamin antaminen korkean riskin potilaille
Midatsolaamia on käytettävä harkiten potilailla, joilla on krooninen hengityksen vajaatoiminta, sillä se voi pahentaa hengityslamaa.
Midatsolaamia on käytettävä harkiten potilailla, joilla on lievä tai keskivaikea maksan vajaatoiminta, sydämen vajaatoiminta tai krooninen munuaisten vajaatoiminta. Midatsolaami tai sen metaboliitti voi kertyä elimistöön potilailla, joilla on krooninen munuaisten tai maksan vajaatoiminta. Midatsolaamipuhdistuma voi vähentyä potilailla, joilla on sydämen vajaatoiminta.
Suun kautta otettavaa midatsolaamia on käytettävä harkiten potilailla, joiden yleinen terveydentila on heikko, sillä he ovat muita alttiimpia bentsodiatsepiinien keskushermostovaikutuksille.
Midatsolaamin eliminaation muutos
Suun kautta otettavaa midatsolaamia on käytettävä harkiten potilailla, joiden hoitoon käytettyjen lääkevalmisteiden tiedetään estävän tai indusoivan CYP3A4:ää (ks. kohta Yhteisvaikutukset).
Alkoholin / keskushermostoa lamaavien aineiden samanaikainen käyttö
Midatsolaamin ja alkoholin ja/tai keskushermostoa lamaavien aineiden samanaikaista käyttöä on vältettävä. Tällainen yhdistelmä lisää todennäköisesti midatsolaamin kliinisiä vaikutuksia, mistä voi seurata syvä sedaatio tai kliinisesti merkityksellinen hengityslama (ks. kohta Yhteisvaikutukset).
Aiempi alkoholismi tai huumeriippuvuus
Kuten muita bentsodiatsepiineja, midatsolaamia on vältettävä potilailla, joilla on taustalla alkoholismi tai huumeriippuvuus.
Muistinmenetys
Midatsolaami aiheuttaa anterogradista muistinmenetystä.
Kotiuttamisehdot
Midatsolaamia saaneella kotiutuvalla potilaalla on oltava aikuinen saattaja, ja hän saa lähteä hoitohuoneesta tai sairaalasta vasta lääkärin luvalla ja kun sedatiiviset vaikutukset ovat täysin hävinneet.
Apuaineet:
Suositeltu kerta-annos 0,25 mg/kg (enimmäiskerta-annoksessa on 20 mg midatsolaamia), sisältää gammadekstriiniä 10 mg/kg (enimmäiskerta-annos sisältää 800 mg gammaodekstriiniä). Gammadekstriinimäärä 10 mg/kg alittaa sallitun enimmäispäiväaltistuksen, joka on 200 mg/kg päivässä ja alle kaksi vuotiailla lapsilla 20 mg/kg päivässä. Vaikka OZALINia annettaisiin ohjeiden vastaisesti 0,5 mg/kg, gammadekstriinin määrä ei ylittäisi sallittua enimmäispäiväaltistusta.
Tämä lääke sisältää ampullia kohden alle 1 mmol (23 mg) natriumia, eli tämä lääke on käytännössä ‘natriumiton’.
Tämä lääke sisältää enintään 17,4 mg alkoholia (etanolia, appelsiinimaun aineosa) per annosyksikkö eli 5 ml:n ampulli, joka vastaa 3,5 mg/ml:aa (etanolia/liuosta) tai 0,32 % w/v.
Etanolimäärä yhdessä 5 ml:n ampullissa tätä lääkettä (17,4 mg) vastaa 0,2 ml:aa viiniä. Etanolimäärä kahdessa 5 ml:n ampullissa tätä lääkettä (34,8 mg) vastaa 0,4 ml:aa viiniä midatsolaamin maksimiannoksella 20 mg.
Lääkkeen sisältämä pieni määrä alkoholia ei aiheuta havaittavia vaikutuksia.
Yhteisvaikutukset
Lääkkeiden farmakokineettiset yhteisvaikutukset
Koska midatsolaami metaboloituu ensisijaisesti CYP3A4-entsyymin vaikutuksesta, CYP3A4:n estäjät ja indusoijat voivat vastaavasti lisätä tai vähentää plasmapitoisuuksia, ja siten midatsolaamin kliiniset vaikutukset voivat lisääntyä tai vähentyä ja midatsolaamin vaikutuksen kesto pitkittyä tai lyhentyä. Kliinisten vaikutusten ja potilaan vitaalimerkkien huolellinen tarkkailu onkin suositeltavaa, kun midatsolaamia on annettu CYP3A4:n estäjän kanssa, myös kerta-annoksen jälkeen.
CYP3A4:n eston tai peruuttamattoman eston tapahduttua vaikutus midatsolaamin farmakokinetiikkaan voi jatkua useita päiviä tai useita viikkoja CYP3A4:n muuntajan (esimerkiksi klaritromysiini, erytromysiini, HIV-proteaasin estäjät, verapamiili, diltiatsemi, atorvastatiini, aprepitantti) antamisen jälkeen.
Ehkäisypillereinä otettavat etinyyliestradioli ja norgestreeli eivät samanaikaisesti otettuina muuta merkittävästi midatsolaamialtistusta.
CYP3A4:n estäjät:
- Atsoliantimykootit: ketokonatsoli, itrakonatsoli, vorikonatsoli, flukonatsoli, posakonatsoli.
- HIV-proteaasin estäjät: sakinaviiri ja muut proteaasin estäjät, mukaan lukien ritonaviiria sisältävät yhdistelmät.
- Makrolidiantibiootit: klaritromysiini, erytromysiini, telitromysiini, roksitromysiini; roksitromysiini pidentää suun kautta tablettimuodossa otettavan midatsolaamin terminaalista puoliintumisaikaa 30 %.
- Kalsiuminestäjät: verapamiili, diltiatsemi; verapamiili ja diltiatsemi lisäävät suun kautta otettavan midatsolaamin plasmapitoisuudet kolmin- ja nelinkertaisiksi vastaavasti ja pidentävät sen terminaalista puoliintumisaikaa 41 % ja 49 % vastaavasti.
- Substanssi P:n antagonistit: aprepitantti; aprepitantti aiheuttaa suun kautta otettavan midatsolaamin annoksesta riippuvaa plasmapitoisuuksien kasvua: kun aprepitanttiannoksena on 80 mg/vrk, midatsolaamin plasmapitoisuus kasvaa 3,3-kertaiseksi ja terminaalinen puoliintumisaika pitenee noin kaksinkertaiseksi.
- H2-antagonistit: simetidiini, ranitidiini.
- Selektiiviset serotoniinin takaisinoton estäjät: fluvoksamiini.
- Antikolinergiset lääkkeet: propiveriini.
- Muut lääkkeet (atorvastatiini, nefatsodoni, aprepitantti, ivakaftori).
- Kasvituotteet: greippimehu, echinacea purpurea, maustekurkuma.
CYP3A4:n indusoijat:
- Rifamysiiniantibiootit: rifampisiini; rifampisiini alentaa suun kautta otettavan midatsolaamin plasmapitoisuutta 96 %:lla terveillä henkilöillä, jolloin midatsolaamin psykomotoriset vaikutukset häviävät lähes kokonaan.
- Epilepsialääkkeet: karbamatsepiini, fenytoiini; karbamatsepiinin tai fenytoiinin toistuva antaminen alentaa suun kautta otettavan midatsolaamin plasmapitoisuutta jopa 90 % ja lyhentää terminaalista puoliintumisaikaa 60 %.
- Käänteisen transkriptaasin estäjät: efavirentsi; α-hydroksimidatsolaamin (CYP3A4:n muodostama metaboliitti) suhde kasvaa viiden kertoimella verrattuna midatsolaamiin, mikä vahvistaa efavirentsilla olevan induktiovaikutusta CYP3A4:än.
- Mäkikuisma (hypericum perforatum).
Midatsolaamin ei tiedetä muuttavan muiden lääkevalmisteiden farmakokinetiikkaa.
Lääkkeiden farmakodynaamiset yhteisvaikutukset
Midatsolaamin antaminen samanaikaisesti muiden sedatiivisten/hypnoottisten aineiden ja keskushermostoa lamaavien aineiden kanssa lisää todennäköisesti sedaatiota ja hengityslamaa.
Tällaisia sedatiivisia/hypnoottisia aineita ovat esimerkiksi alkoholi (mukaan lukien alkoholia sisältävät lääkevalmisteet), opiaatit/opioidit (käytettäessä kipulääkkeinä, yskänärsytystä vähentävinä lääkkeinä tai korvaushoitoina), psykoosilääkkeet, muut anksiolyytteinä tai hypnootteina käytettävät bentsodiatsepiinit, barbituraatit, propofoli, ketamiini, etomidaatti, sedatiiviset masennuslääkkeet, antihistamiinit, epilepsialääkkeet ja keskushermostoon vaikuttavat verenpainelääkkeet. Midatsolaami pienentää inhalaatioanesteettien alveolaarista vähimmäispitoisuutta (MAC).
Alkoholin ja midatsolaamin yhteisvaikutuksen vuoksi alkoholinkäyttöä tulee ehdottomasti välttää midatsolaamin antamisen yhteydessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja kohta Yliannostus).
Raskaus ja imetys
Raskaus
Midatsolaamin turvallisuudesta raskauden aikana ei ole saatavilla riittävästi tietoja. Eläinkokeissa ei ole havaittu teratogeenista vaikutusta, mutta sikiötoksisuutta on todettu kuten muillakin bentsodiatsepiineilla. Midatsolaamin käytöstä raskauden kahden ensimmäisen kolmanneksen aikana ei ole saatavilla tietoja.
Suurten midatsolaamiannosten antaminen raskauden viimeisen kolmanneksen aikana, synnytyksen aikana tai anestesian induktioon keisarileikkauksen yhteydessä on raporttien mukaan aiheuttanut haittavaikutuksia äidille tai sikiölle (äidin aspiraatioriski, sikiön sydämensykkeen epäsäännöllisyys sekä vastasyntyneen hypotonia, imemisvaikeudet, hypotermia ja hengityslama).
Lisäksi raskauden loppuvaiheessa pitkäaikaisesti bentsodiatsepiineja käyttävien äitien vauvoille saattaa kehittyä fyysinen riippuvuus, ja riski vieroitusoireiden esiintymiselle postnataalivaiheessa on olemassa.
Näin ollen midatsolaamia voidaan käyttää raskauden aikana, jos se on selkeästi tarpeellista, mutta sen käyttöä keisarileikkauksissa on syytä välttää.
Jos midatsolaamia annetaan kirurgisista syistä raskauden loppuvaiheessa, vastasyntyneelle aiheutuva riski on otettava huomioon.
Imetys
Midatsolaami erittyy pieninä määrinä äidinmaitoon. Imettäviä äitejä on kehotettava
keskeyttämään imetys 24 tunniksi midatsolaamin antamisen jälkeen.
Hedelmällisyys
Eläinkokeissa ei ole havaittu hedelmällisyyden laskua (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
OZALINilla on merkittävä vaikutus ajokykyyn ja koneiden käyttökykyyn.
Sedaatio, anterogradinen muistinmenetys, tarkkaavaisuuden ja lihastoiminnan heikentyminen voivat hetkellisesti vaikuttaa ajokykyyn ja koneiden käyttökykyyn. Ennen OZALINin antamista potilasta on varoitettava ajamasta tai käyttämästä koneita, ennen kuin hän on täysin toipunut. Lääkärin vastuulla on päättää, milloin näitä toimia voidaan jatkaa. Kotiutuvalla potilaalla on suositeltavaa olla aikuinen saattaja.
Haittavaikutukset
Midatsolaamin antamisen aikana on raportoitu seuraavia haittavaikutuksia, joiden yleisyyttä ei voida arvioida saatavilla olevien tietojen perusteella:
Elinjärjestelmäluokka | Lääkkeen haittavaikutus – yleisyys ei tiedossa |
Sydän | Takykardia, bradykardia. Kounisin oireyhtymä* |
Psyykkiset häiriöt | Paradoksaaliset reaktiot (kiihtymys, eksitaatio, hallusinaatiot, aggressiivisuus, estottomuus, dysforia, haitallinen käyttäytyminen, ahdistuneisuus), unihäiriöt, tahattomat liikkeet, akatisia, horjuva kävely, vapina. |
Hermosto | Pitkittynyt/liiallinen sedaatio, uneliaisuus, unettomuus, huimaus, ataksia, kiertohuimaus, dysartria, suun kuivuminen, syljeneritys, kastelu, päänsärky, anterogradinen muistinmenetys. |
Silmät | (Yleensä lievä) näön hämärtyminen, kahtena näkeminen |
Hengityselimet, rintakehä ja välikarsina | Hypoksemia, tilapäinen desaturaatio, laryngospasmi, hengityslama, hengitysteiden ahtautuminen, rahina / äänekäs hengitys, hikka, dyspnea. |
Ruoansulatuselimistö | Oksentelu, pahoinvointi. |
Iho ja ihonalainen kudos | Kutina, nokkosihottuman kaltainen reaktio, ihottuma. |
Tuki- ja liikuntaelimet ja sidekudokset | Heikentynyt lihasten hallinta. |
Yleiset häiriöt ja antokohdan tilat | Epätavallinen uupumus, heikotuksen tunne. |
Immuunijärjestelmä: | Yliherkkyys, angioedeema. |
*etenkin parenteraalisen annon jälkeen
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin.
Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Kuten kaikki bentsodiatsepiinit, midatsolaami aiheuttaa usein uneliaisuutta, ataksiaa, dysartriaa ja silmävärvettä. Midatsolaamin yliannostus on harvoin hengenvaarallista, jos valmistetta otetaan yksistään, mutta yliannostuksesta voi seurata refleksittömyys, apnea, hypotensio, sydän- ja hengityslama sekä harvoissa tapauksissa kooma. Bentsodiatsepiinien hengitystä lamauttavat vaikutukset ovat tavallista vakavampia, jos potilaalla on hengitys- tai sydänsairaus tai jos lääke yhdistetään muuhun keskushermostoa lamaavaan aineeseen, kuten alkoholiin.
Hoito
Useimmissa tapauksissa elintoimintoja on tarkkailtava.
Yliannostustapauksessa on kiinnitettävä erityistä huomiota hengitystoimintoihin sekä sydän- ja verisuonitoimintoihin teho-osastolla.
Jos lääkettä on annosteltu liikaa, oksennuta tajuissaan oleva potilas (mahdollisimman pian ja joka tapauksessa tunnin kuluessa midatsolaamin antamisesta suun kautta), tai jos potilas on tajuton, suorita mahahuuhtelu suojaten potilaan hengitystiet. Jos mahahuuhtelu ei tehoa, potilaalle on annettava lääkehiiltä absorption vähentämiseksi.
Flumatseniilia, bentsodiatsepiinin antagonistia käytetään, jos kyseessä on vaikea myrkytystila (intoksikaatio), johon liittyy hengityksen lamaantuminen tai kooma. Tämä hoito on sallittu vain tarkassa valvonnassa. Flumatseniilin puoliintumisaika on lyhyt (noin tunti), mikä tarkoittaa, että potilasta on tarkkailtava tämän valmisteen vaikutuksen päätyttyä. Äärimmäistä varovaisuutta on noudatettava, kun flumatseniilia käytetään yliannostustapauksessa eri lääkkeiden samanaikaisen antamisen jälkeen potilailla, joiden epilepsiaa jo hoidetaan bentsodiatsepiineilla. Flumatseniilia saa käyttää vain äärimmäistä varovaisuutta noudattaen potilailla, joita hoidetaan trisyklisillä masennuslääkkeillä tai epilepsiaa aiheuttavilla lääkkeillä, sekä potilailla, joilla EKG on poikkeava (QRS-keston tai QT-ajan pidentyminen).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: bentsodiatsepiinit, ATC-koodi: N05CD08
Vaikutusmekanismi
Midatsolaami on imidatsobentsodiatsepiinien ryhmän johdannainen. Bentsodiatsepiinien farmakologiset vaikutukset perustuvat bentsodiatsepiinien ja γ-aminovoihappo (GABA) -reseptorin reversiibeliin vuorovaikutukseen keskushermostossa; γ-aminovoihappo on keskushermoston tärkein inhibitorinen välittäjäaine.
Farmakodynaamiset vaikutukset
Midatsolaamin ja sen metaboliittien farmakodynaamisia ominaisuuksia – jotka ovat vastaavat kuin muilla bentsodiatsepiineilla – ovat sedatiiviset, anksiolyyttiset, amnestiset (anterogradinen muistinmenetys), hypnoottiset, lihaksia rentouttavat ja antikonvulsanttiset vaikutukset.
Midatsolaamin farmakologiselle vaikutukselle on ominaista lyhyt kesto, joka johtuu nopeasta metabolisesta transformaatiosta. Midatsolaamin vaikutus voidaan kumota helposti bentsodiatsepiinin reseptoriantagonistilla, flumatseniililla.
Kliininen teho ja turvallisuus
Pediatrisilla potilailla tehtyjä tutkimuksia koskevat julkaistut raportit osoittavat selkeästi, että suun kautta otettava midatsolaami toimii sedatiivina ja anksiolyyttinä ennen kirurgisia toimenpiteitä, jotka edellyttävät anestesiaa, sekä muissa lääketieteellisissä toimenpiteissä, jotka edellyttävät sedaatiota ilman anestesiaa.
Useita tutkimuksia on toteutettu sadoilla lapsilla, jotka ovat saaneet kohtalaista sedaatiota ennen anesteettista esilääkitystä tai lääketieteellistä toimenpidettä. Nämä lapset saivat kerta-annoksen suun kautta otettavaa midatsolaamia (yhdistämättä valmistetta muuhun keskushermostoa lamaavaan lääkkeeseen). Maksimaalinen sedaatio saavutettiin yleensä 30–45 minuutin kuluessa midatsolaamin antamisesta midatsolaamiannoksen ollessa 0,25–1,0 mg/kg. Vastaavat tiedot saatiin anksiolyyttisen vaikutuksen osalta. Sedatiiviset vaikutukset saavutettiin midatsolaamin plasmapitoisuuksien ollessa 30–160 ng/ml ja EC50:n vaihdellessa 18–171 ng/ml sedaation arvioinnissa käytettävän menetelmän mukaan (pediatriset ja aikuisia koskevat tiedot).
OZALINia koskeva tutkimus on toteutettu anesteettista esilääkitystä tarvitsevilla pediatrisilla potilailla, joiden ikä on 6 kuukaudesta 17 vuoteen. Tämän tutkimuksen tulokset ovat yhdenmukaisia kirjallisuudessa esitettyjen tulosten kanssa. Sedatiiviset ja anksiolyyttiset vaikutukset havaittiin 30 minuutin kuluessa suun kautta otettavan OZALIN-kerta-annoksen ollessa keskimäärin 0,269 mg/kg ja midatsolaamin plasmapitoisuuden 15–65 ng/ml. Terveillä aikuisilla havaittiin EC50 -taso 53,82 ng/ml suun kautta otettavan 15 mg:n OZALIN-annoksen (keskimäärin 0,245 mg/kg) jälkeen. Tietoja ei ole saatavilla OZALIN-kerta-annoksen saaneista paastoamattomista lapsista ja nuorista, joiden ikä on 6 kuukaudesta 17 vuoteen.
Farmakokinetiikka
Imeytyminen
Suun kautta otettu midatsolaami imeytyy nopeasti ja kokonaan.
Kirjallisuuteen perustuvat tiedot
Huippuplasmapitoisuus (Cmax) saavutetaan 30–60 minuutin (Tmax) kuluessa suun kautta otettavasta midatsolaamiannoksesta. Terveillä aikuisilla raportoitu Cmax-arvo on 70–154 ng/ml 15 mg:n annoksen jälkeen. 30–200 ng/ml:n Cmax-arvo on raportoitu annetusta annokseesta (0,25–1,0 mg/kg) ja lapsen iästä (6 kuukaudesta 17 vuoteen) riippuen.
Biologinen hyötyosuus vaihtelee välillä 30–50 % tutkimuksen ja suun kautta otettavan lääkkeen koostumuksen mukaan.
OZALINia koskevat tiedot
Kun OZALIN-kerta-annos oli otettu suun kautta, Cmax saavutettiin aikuisilla potilailla 35 minuutin ja nuorilla potilailla 45 minuutin kuluessa (mediaani Tmax). Populaatiofarmakokineettisen analyysin (Pop-PK), joka sisälsi aikuisten ja pediatristen potilaiden tietoja, mukaan suurin osa midatsolaamista imeytyy 30 minuutin kuluessa OZALINin ottamisesta.
Terveillä aikuisilla saavutettiin Cmax-arvo 113 ng/ml suun kautta otettavan 15 mg:n OZALIN-kerta-annoksen (keskimäärin 0,245 mg/kg) jälkeen. Lapsilla saavutettiin keskimäärin Cmax-arvo 40,8 ng/ml OZALIN-annoksella 0,12–0,30 mg/kg.
Suun kautta otettavan midatsolaamin absoluuttinen biologinen hyötyosuus on 39,4 % aikuisilla, jotka saivat 15 mg:n OZALIN-kerta-annoksen.
Jakautuminen
Suun kautta otettava midatsolaami jakautuu erittäin nopeasti, ja useimmissa tapauksissa jakautumisvaihe ei ole havaittava tai se on käytännössä toteutunut 1–2 tunnin kuluessa suun kautta otettavasta annoksesta. Midatsolaami on erittäin rasvaliukoinen ja laajasti jakautuva. Midatsolaami on erittäin plasmaproteiinisidonnainen (noin 96—98 %), ja se sitoutuu ennen kaikkea albumiiniin.
Midatsolaamin erittyminen aivo-selkäydinnesteeseen on hidasta ja merkityksetöntä. Ihmisillä midatsolaami läpäisee veri-istukkanesteen ja siirtyy hitaasti sikiön verenkiertoon. Pieniä määriä midatsolaamia erittyy äidinmaitoon.
Kirjallisuuteen perustuvat tiedot
Jakautumistilavuus vakaassa tilassa on 1,0–2,5 l/kg ja enimmillään 6,6 l/kg.
OZALINia koskevat tiedot
Midatsolaamin jakautumistilavuus on terveillä aikuisilla 4,7 l/kg.
Pop-PK-analyysin perusteella sentraaliseksi jakautumistilavuudeksi arvioitiin 27,9 l ja perifeeriseksi jakautumistilavuudeksi 413 l tyypillisellä 34 kg:n painoisella potilaalla.
Biotransformaatio
Midatsolaami eliminoituu lähes kokonaan biotransformaation kautta. CYP3A4-entsyymi hydroksyloi midatsolaamin, ja pääasiallinen virtsan ja plasman metaboliitti on α-hydroksimidatsolaami. α-hydroksimidatsolaamin plasmapitoisuus on 30–50 % emomolekyylin pitoisuuksista. α-hydroksimidatsolaami on farmakologisesti aktiivinen ja vaikuttaa merkittävästi (noin 34 %) midatsolaamin vaikutuksiin.
Kirjallisuuteen perustuvat tiedot
Suun kautta otetun annoksen jälkeen maksan ensikierron metabolia on arviolta 30–60 %.
Lapsilla suun kautta otetun annoksen jälkeen α-hydroksimidatsolaamin ja midatsolaamin pitoisuusaikakäyrän alle jäävän pinta-alan (AUC) suhde vaihtelee välillä 0,38–0,75.
OZALINia koskevat tiedot
Noin 40 % α-hydroksimidatsolaamialtistuksesta johtuu maksan ensikiertovaikutuksesta.
Metaboliasuhde on lapsilla 0,504, nuorilla 0,364 ja aikuisilla 0,313.
Eliminaatio
Terveillä aikuisilla plasmapuhdistuma on 300–500 ml/min (tai 4–13 ml/min/kg). Midatsolaami poistuu ensisijaisesti munuaisten kautta tapahtuvan erityksen kautta; 60–80 % annetusta annoksesta erittyy 24 tunnin kuluessa antamisesta ja poistuu glukuronidoituneena α-hydroksimidatsolaamina. Alle 1 % annetusta annoksesta poistuu muuttumattomana virtsassa. Midatsolaamin eliminaatiopuoliintumisaika on noin 3 tuntia ja α-hydroksimidatsolaamin eliminaatiopuoliintumisaika noin 2 tuntia.
Kirjallisuuteen perustuvat tiedot
Lapsilla puoliintumisaika voi vaihdella merkittävästi 0,5 tunnista 7 tuntiin tutkimuksen mukaan, riippumatta lapsen iästä ja midatsolaamiannoksesta. Plasmapuhdistuman on arvioitu olevan 1,5–3,6 l/h/kg.
OZALINia koskevat tiedot
Puoliintumisajan on arvioitu olevan nuorilla 3,6 tuntia. Pop-PK-analyysin perusteella midatsolaamin puhdistuman on arvioitu olevan 34,7 l/h ja α-hydroksimidatsolaamin puhdistuman 40,6 l/h tyypillisellä 34 kg:n painoisella potilaalla.
Farmakokinetiikka erityisryhmillä
Vastasyntyneet ja vauvat
OZALINia ei ole tutkittu alle 6 kuukauden ikäisillä pediatrisilla potilailla.
Ylipainoiset potilaat
Midatsolaamin keskimääräinen puoliintumisaika on ylipainoisilla potilailla pidempi kuin normaalipainoisilla potilailla (5,9 tuntia vs. 2,3 tuntia). Tämä johtuu kokonaispainon mukaan korjatun jakautumistilavuuden kasvusta noin 50 %:lla. Plasmapuhdistumassa ei ole merkittävää eroa yli- ja normaalipainoisten potilaiden välillä. Jälkimmäisten potilaiden pidempiaikainen tarkkailu toimenpiteen jälkeen voi olla tarpeen.
Potilaat, joilla on maksan vajaatoiminta
Kirroosipotilailla eliminaatiopuoliintumisaika voi olla pidempi ja puhdistuma alhaisempi kuin terveillä henkilöillä, mikä johtuu mahdollisesta α-hydroksimidatsolaamin kertymisestä (ks. kohdat Annostus ja antotapa ja Vasta-aiheet).
Potilaat, joilla on munuaisten vajaatoiminta
Kroonista munuaisten vajaatoimintaa sairastavilla potilailla eliminaatiopuoliintumisaika on vastaava kuin terveillä henkilöillä. Suun kautta otettavaa midatsolaamia on kuitenkin käytettävä harkiten potilailla, joilla on munuaisten vajaatoiminta.
Potilaat, joilla on sydämen vajaatoiminta
Kongestiivista sydämen vajaatoimintaa sairastavilla potilailla eliminaatiopuoliintumisaika on pidempi kuin terveillä henkilöillä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
Rotilla tehdyssä hedelmällisyyskokeessa, jossa eläinten saama annos oli jopa kymmenen kertaa kliinistä annosta suurempi, ei havaittu hedelmällisyyteen liittyviä haittavaikutuksia.
Lääkettä määräävälle lääkärille ei ole muita prekliinisiä tietoja kuin ne, jotka jo sisältyvät valmisteyhteenvedon muihin kohtiin.
Farmaseuttiset tiedot
Apuaineet
Sitruunahappomonohydraatti, gammadekstriini, sukraloosi, appelsiiniaromi (sisältää 70–80 % etanolia), natriumhydroksidi (pH-säätöä varten), injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Ennen avaamista: 36 kuukautta.
Avaamisen jälkeen: valmiste on käytettävä välittömästi avaamisen jälkeen ja käyttämätön valmiste tulee hävittää.
Säilytys
Säilytyslämpötila enintään 25 °C.
Ei saa laittaa jääkappiin tai pakastimeen.
Säilytä alkuperäispakkauksessa valolta suojattuna.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OZALIN oraaliliuos, kerta-annospakkaus
2 mg/ml (L:ei) 10 x 5 ml (suodattimella varustettu pilli, oraaliannostelija) (285,36 €)
PF-selosteen tieto
5 ml:n ruskeankeltainen lasiampulli (tyypin I lasi), yksi suodattimella varustettu pilli ja yksi oraaliannostelija, jotka on pakattu yhdessä erilliseen läpipainopakkaukseen.
Rasia, joka sisältää 1 ampullin, 1 suodattimella varustetun pillin ja 1 oraaliannostelijan.
Rasia, joka sisältää 5 ampullia, 5 suodattimella varustettua pilliä ja 5 oraaliannostelijaa.
Rasia, joka sisältää 10 ampullia, 10 suodattimella varustettua pilliä ja 10 oraaliannostelijaa.
Oraaliannostelija ja suodattimella varustettu pilli on tarkoitettu yhden kerran tapahtuvaan annoksen mittaamiseen ja antamiseen.
Oraaliannostelijassa on painokiloina (kg) merkitty asteikko 3 kilosta 40 kiloon; väliastemerkit ovat kilon välein.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai hieman opaalinhohtoinen liuos, väri vaaleankeltaisesta ruskehtavaan, pH 3,6–4,2.
Käyttö- ja käsittelyohjeet
Käyttö pediatrisille potilaille
OZALIN on tarkoitettu otettavaksi vain suun kautta.
Ohjeet läpipainopakkauksessa olevan OZALIN-ampullin, oraaliannostelijan ja suodattimella varustetun pillin turvalliseen käyttöön: OZALIN annostellaan erityisesti sille tarkoitetulla oraaliannostelijalla, jonka asteikko on merkittykiloina (kg).
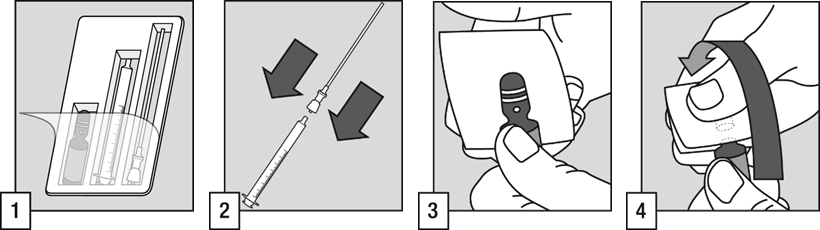
- Lääkkeen antamiseen potilaalle tarvitaan ampulli, suodattimella varustettu pilli ja oraaliannostelija
- Yhdistä suodattimella varustettu pilli oraaliannostelijaan.
- Napauta ampullin yläosaa ja varmista, että neste on valunut ampullin pohjalle. Aseta harsotaitos ampullin yläosan päälle ja toisen käden peukalo valkoisen pisteen päälle.
- Pidä ampullia tukevasti siten, että valkoinen piste osoittaa ylöspäin ja sinua kohti. Paina ampullin kaulaa taaksepäin, jolloin se aukeaa helposti.
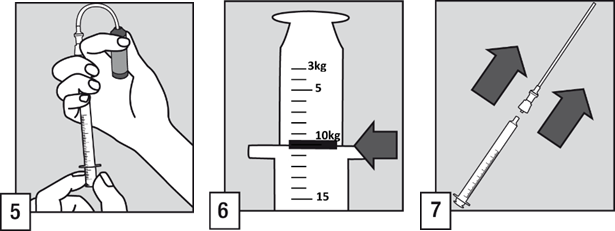
- Työnnä suodattimella varustettu pilli ampulliin. Ennen annoksen säätöä on suositeltavaa poistaa mahdollinen ilma pillistä pumppaamalla ampulliliuosta lyhyesti.
- Pidä ampulli pystysuorassa ja täytä oraaliannostelija potilaan painoa kiloina (kg) vastaavaan asteikkomerkkiin asti. Vedä oikea annos annostelijaan kohdistamalla viivamerkki laipan yläosaan.
- Irrota suodattimella varustettu pilli oraaliannostelijasta.
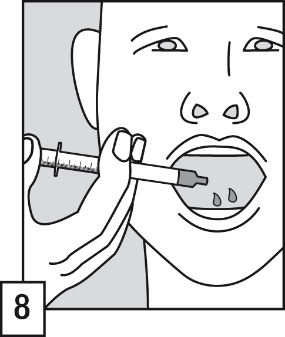
- Tyhjennä oraaliannostelijan sisältö potilaan suuhun. Liuos on nielaistava välittömästi.
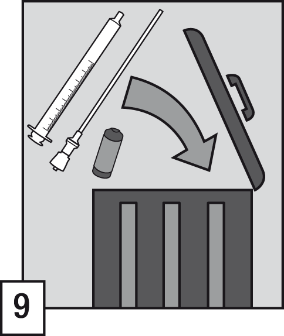
- Hävitä ampulli, suodattimella varustettu pilli, oraaliannostelija ja käyttämätön sisältö käytön jälkeen astiaan, joka on varattu tähän tarkoitukseen paikallisten valvottuja aineita ja lääketarvikkeita koskevien vaatimusten mukaisesti.
Korvattavuus
OZALIN oraaliliuos, kerta-annospakkaus
2 mg/ml 10 x 5 ml
- Ei korvausta.
ATC-koodi
N05CD08
Valmisteyhteenvedon muuttamispäivämäärä
23.08.2023
Yhteystiedot
Dronningens gate 3
0152 Oslo
Norway
www.institutogentili.com
