IMLYGIC injektioneste, liuos 1 x 10exp6 PFU/ml, 1 x 10exp8 PFU/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Lääkäri
Potilas
Vaikuttavat aineet ja niiden määrät
Talimogeenilaherparepveekki on heikennetty tyypin 1 Herpes simplex ‑virus (HSV‑1), jossa on 2 geenin (ICP34.5 ja ICP47) funktionaalinen deleetio ja johon on lisätty ihmisen granulosyytti-makrofagikasvutekijää (GM‑CSF) koodaava jakso (ks. kohta Farmakodynamiikka).
Talimogeenilaherparepveekki tuotetaan yhdistelmä‑DNA‑tekniikalla Vero‑soluissa.
Imlygic 106 plakkia muodostavaa yksikköä (PFU) / ml injektioneste, liuos
Yksi injektiopullo sisältää 1 ml (käytettävissä oleva määrä) Imlygic-valmistetta, jossa on 1 x 106 (1 miljoona) PFU/ml (nimellispitoisuus).
Imlygic 108 plakkia muodostavaa yksikköä (PFU) / ml injektioneste, liuos
Yksi injektiopullo sisältää 1 ml (käytettävissä oleva määrä) Imlygic-valmistetta, jossa on 1 x 108 (100 miljoonaa) PFU/ml (nimellispitoisuus).
Apuaine, jonka vaikutus tunnetaan:
1 ml:n injektiopullo sisältää 7,7 mg natriumia ja 20 mg sorbitolia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste).
Kliiniset tiedot
Käyttöaiheet
Imlygic on tarkoitettu aikuisille leikkaushoitoon soveltumattoman paikallisesti tai systeemisesti, mutta ei luustoon, aivoihin, keuhkoihin eikä muihin sisäelimiin, levinneen (levinneisyysasteen IIIB, IIIC tai IVM1a) melanooman hoitoon (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Ehto
Hoito tulee aloittaa ja hoitoa tulee jatkaa syöpähoitoihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Talimogeenilaherparepveekkihoito on aloitettava ja toteutettava syövän hoitoon perehtyneen lääkärin valvonnassa.
Imlygic-hoitoa saavalle potilaalle on annettava potilaskortti ja hänelle on kerrottava hoitoon liittyvistä riskeistä (ks. myös pakkausseloste).
Annostus
Imlygic toimitetaan 1 ml:n kertakäyttöisissä injektiopulloissa kahtena eri pitoisuutena:
- 106 (1 miljoona) PFU/ml – vain aloitusannos
- 108 (100 miljoonaa) PFU/ml – kaikki myöhemmät annokset.
Kullakin hoitokäynnillä injisoitava kokonaismäärä saa olla enintään 4 ml. Suositeltu aloitusannos on enintään 4 ml Imlygic-injektionesteen pitoisuutta 106 (1 miljoona) PFU/ml. Seuraavina annoksina on annettava enintään 4 ml Imlygic-injektionesteen pitoisuutta 108 (100 miljoonaa) PFU/ml.
Suositeltu hoito-ohjelma esitetään taulukossa 1.
Taulukko 1. Suositeltu hoito-ohjelma
| Hoitokäynti | Hoitoajankohta | Injisoitava enimmäismäärä | Pitoisuus | Injisoitavien leesioiden tärkeysjärjestys |
| Ensimmäinen | - | Enintään 4 ml | 106 (1 miljoona) PFU/ml |
|
| Toinen | 3 viikkoa ensimmäisen hoitokerran jälkeen | Enintään 4 ml | 108 (100 miljoonaa) PFU/ml |
|
| Kaikki seuraavat hoitokäynnit (hoidon uudelleen aloittaminen mukaan lukien) | 2 viikkoa edellisen hoitokerran jälkeen | Enintään 4 ml | 108 (100 miljoonaa) PFU/ml |
|
Imlygic-annoksen määrittäminen (leesiota kohden)
Kuhunkin leesioon injisoitava määrä riippuu leesion koosta ja on määritettävä taulukon 2 mukaisesti. Kullakin hoitokerralla injisoitava kokonaismäärä saa olla enintään 4 ml.
Taulukko 2. Injisoitavan Imlygic-määrän valitseminen leesion koon perusteella
| Leesion koko (suurin läpimitta) | Injisoitava Imlygic-määrä |
| > 5 cm | enintään 4 ml |
| > 2,5 ‑ 5 cm | enintään 2 ml |
| > 1,5 ‑ 2,5 cm | enintään 1 ml |
| > 0,5 ‑ 1,5 cm | enintään 0,5 ml |
| ≤ 0,5 cm | enintään 0,1 ml |
Ennen kuin hoitovaste saadaan, potilailla jo olevat leesiot saattavat suurentua tai heille saattaa ilmaantua uusia leesioita. Imlygic-hoitoa pitää jatkaa vähintään 6 kuukauden ajan, niin kauan kuin potilaalla on injisoitavissa oleva leesio tai leesioita, jollei lääkäri katso, että potilas ei enää hyödy Imlygic-hoidosta tai tarvitsee muuta hoitoa.
Imlygic-hoito voidaan aloittaa uudelleen, jos potilaalle ilmaantuu uusia leesioita täydellisen vasteen saavuttamisen jälkeen ja jos lääkäri arvioi potilaan hyötyvän hoidosta.
Erityisryhmät
Iäkkäät potilaat
Annosta ei tarvitse muuttaa ≥ 65‑vuotiaita potilaita hoidettaessa (ks. kohta Farmakodynamiikka).
Maksan ja munuaisten vajaatoiminta
Maksan tai munuaisten vajaatoiminnan vaikutusta talimogeenilaherparepveekin farmakokinetiikkaan ei ole tutkittu kliinisissä tutkimuksissa. Maksan tai munuaisten vajaatoimintaa sairastavien potilaiden annostusta ei ole kuitenkaan tarpeen muuttaa.
Pediatriset potilaat
Imlygic-valmisteen turvallisuutta ja tehoa pediatristen potilaiden hoidossa ei ole varmistettu. Kohdassa Farmakodynamiikka on kuvattu saatavissa olevat tiedot 7–21‑vuotiaiden lasten ja nuorten suoraan injektioon soveltuvien pitkälle edenneiden muiden kuin keskushermoston kasvainten hoidosta.
Antotapa
Imlygic annetaan injektiona leesioon, kun potilaalla on näkyvä, palpoitavissa oleva tai ultraääniohjauksessa löytyvä iholeesio, ihonalainen leesio ja/tai nodaalinen leesio.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Tämä lääkevalmiste sisältää muuntogeenisia organismeja. Henkilönsuojaimia on käytettävä talimogeenilaherparepveekin käyttökuntoon saattamisen ja annon aikana (katso kohta Käyttö- ja käsittelyohjeet).
Immuunipuutteiset tai raskaana olevat terveydenhuollon ammattilaiset eivät saa antaa Imlygic-valmistetta eivätkä olla suorassa kontaktissa valmisteella injisoitujen kohtien tai valmisteella hoidettujen potilaiden ruumiinnesteiden kanssa (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Noudata seuraavia ohjeita Imlygic-valmisteen käyttökuntoon saattamisesta ja potilaalle antamisesta:
Ennen injektiota
- Sulata Imlygic-injektiopullot huoneenlämmössä. Sulatettuja injektiopulloja voidaan säilyttää ennen antamista (ks. kohta Kestoaika). Sulatettujen injektiopullojen käsittely, ks. kohta Käyttö- ja käsittelyohjeet.
- Vedä haluttu määrä Imlygic-valmistetta injektiopullosta ruiskuun aseptista menettelytapaa noudattaen. Käytä mieluiten 22–26 G:n neulaa.
- Injektiokohta voidaan puuduttaa paikallispuudutteella. Injisoitavaa puudutetta voidaan injisoida leesion ympärille, mutta sitä ei saa injisoida suoraan leesioon.
- Puhdista leesio ja ympäröivät alueet desinfiointipyyhkeellä ja anna kuivua.
Injektion antaminen
- Injisoi Imlygic leesioon, kun kyseessä on näkyvä, palpoitavissa oleva tai ultraääniohjauksessa löytyvä iholeesio, ihonalainen leesio ja/tai nodaalinen leesio.
- Määritä kuhunkin leesioon injisoitava määrä taulukon 2 avulla.
- Injisoi Imlygic-valmistetta yhden sisäänvientikohdan kautta leesioon säteittäin useaan suuntaan niin laajalle kuin neulalla ulottuu, jotta lääke leviää tasaisesti kaikkialle leesioon. Jos leesio on suurempi kuin neulan säteittäinen ulottuvuus, voidaan käyttää useita sisäänvientikohtia.
| Iholeesiot | Ihonalaiset leesiot | Nodaaliset leesiot |
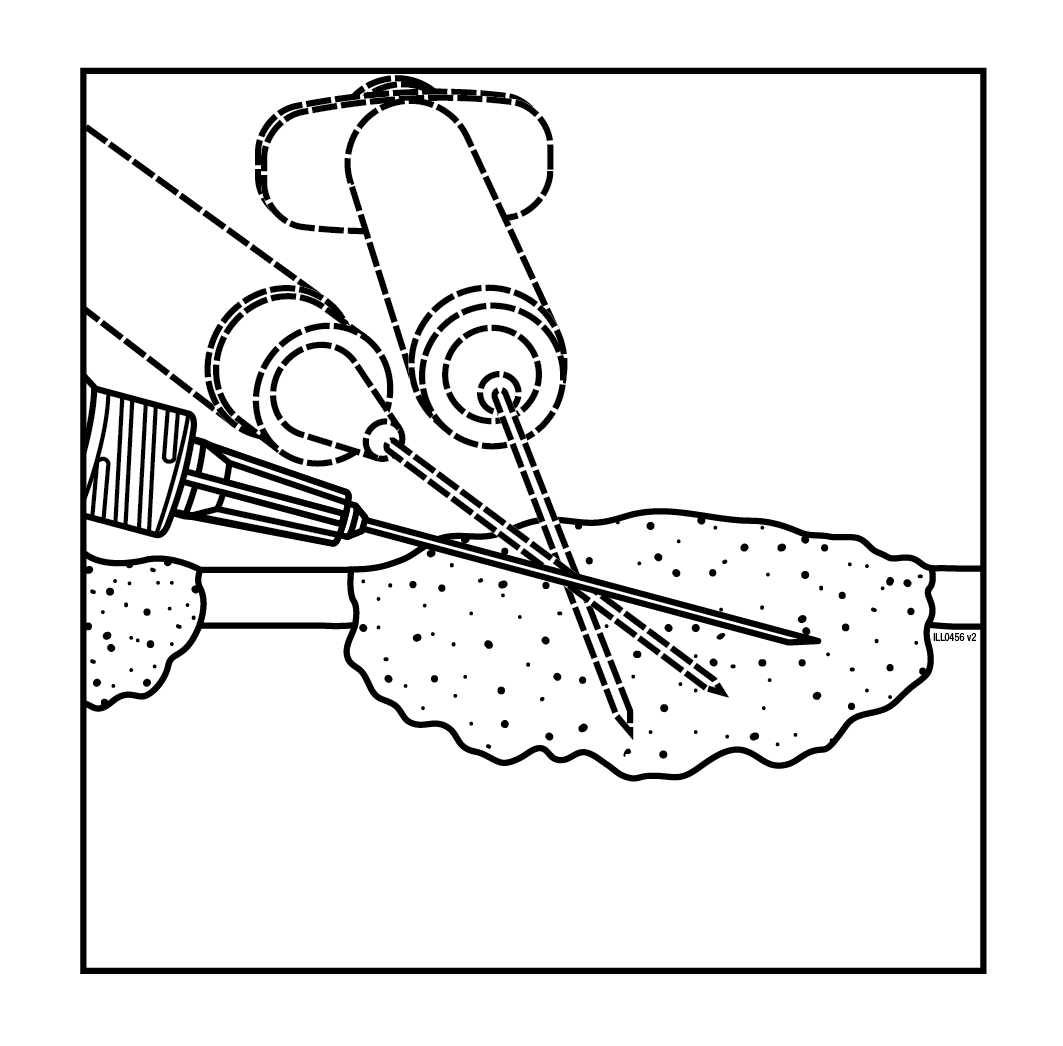 | 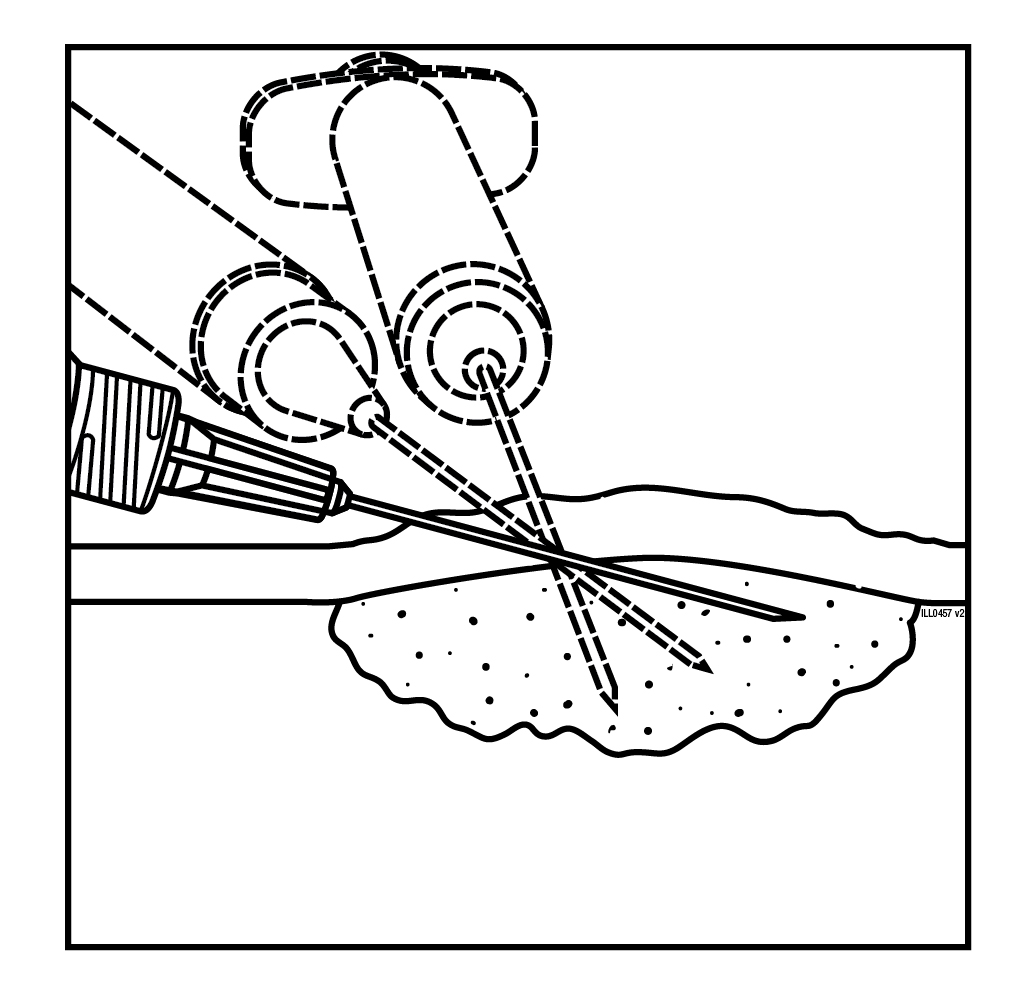 |  |
Kuva 1. Injektion anto iholeesioon | Kuva 2. Injektion anto ihonalaiseen leesioon | Kuva 3. Injektion anto nodaaliseen leesioon |
- Injisoi Imlygic-valmistetta tasaisesti kaikkialle leesioon vetämällä neulaa ulospäin mutta ei kuitenkaan pois leesiosta. Käännä neulan suuntaa tarvittavan monta kertaa ja injisoi samalla jäljellä oleva annos. Jatka, kunnes koko annos on annettu tasaisesti kaikkialle leesioon.
- Vedä neula hitaasti pois leesiosta, jotta neulan sisäänvientikohdasta ei vuoda Imlygic-valmistetta pois.
- Toista nämä vaiheet, kun injisoit muita hoidettavia leesioita. Vaihda neula aina, kun olet poistanut neulan kokonaan leesiosta ja ennen kuin ryhdyt injisoimaan seuraavaa leesiota.
Injektion jälkeen
- Paina injektiokohtaa steriilillä harsotaitoksella vähintään 30 sekunnin ajan.
- Pyyhi injektiokohta ja sitä ympäröivä alue desinfiointipyyhkeellä, ja peitä injisoitu leesio imukykyisellä taitoksella ja kuivalla okkluusiositeellä.
Vasta-aiheet
- Aiempi yliherkkyys talimogeenilaherparepveekille tai apuaineille.
- Vaikea-asteinen immuunivajavuustila (esim. potilaalla on vaikea-asteinen synnynnäinen tai hankinnainen soluvälitteinen ja/tai vasta-ainevälitteinen immuunivajaus) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Aiemmin hoitoa saaneet potilaat
Tiedot Imlygic-hoidon tehosta toisen linjan tai myöhempien linjojen hoitona ovat rajalliset.
Disseminoitunut herpesinfektio
Imlygic-hoitoa saaneilla potilailla on raportoitu disseminoituneita herpesinfektioita, joista osa on ollut vakavia (ks. kohta Haittavaikutukset).
Imlygic-valmistetta ei ole tutkittu immuunipuutteisilla potilailla. Epidemiologisten tietojen perusteella potilailla, joilla on immuunivajavuustila (esim. HIV/AIDS, leukemia, lymfooma, yleinen vaihteleva immuunipuutos tai potilas tarvitsee jatkuvasti suuria steroidiannoksia tai muita immunosuppressiivisia lääkkeitä), saattaa olla tavanomaista suurempi disseminoituneen herpesinfektion riski. Imlygic-hoidon riskit ja hyödyt pitää arvioida ennen sen antamista potilaille, joilla on immuunivajavuustila.
Eläimistä saatujen tietojen perusteella potilailla, joilla on vaikea-asteinen immuunivajavuustila, saattaa olla tavanomaista suurempi disseminoituneen herpesinfektion riski eikä heitä saa hoitaa Imlygic-valmisteella (ks. kohdat Vasta-aiheet ja Prekliiniset tiedot turvallisuudesta).
Tahaton altistuminen Imlygic-valmisteelle
Tahaton altistuminen saattaa johtaa Imlygic-tartuntaan ja herpesinfektioon. Terveydenhuollon ammattilaisten ja potilaan kanssa lähikontaktissa olevien ihmisten (esim. samassa taloudessa asuvien, potilaasta huolehtivien henkilöiden, seksikumppanien tai samassa sängyssä nukkuvien) on vältettävä suoraa kosketusta injisoituihin leesioihin tai hoitoa saaneen potilaan ruumiinnesteisiin koko hoitojakson ajan ja 30 vuorokauden ajan viimeisen hoitokerran jälkeen (ks. kohta Käyttö- ja käsittelyohjeet). Terveydenhuollon ammattilaisilla on raportoitu käyttökuntoon saattamisen ja potilaalle antamisen yhteydessä neulanpistotapaturmia ja altistumista injektiokohdasta vuotaneelle lääkkeelle.
Potilaan kanssa lähikontaktissa olevat henkilöt, jotka ovat raskaana tai joilla on immuunivajavuustila, eivät saa vaihtaa potilaan injektiokohdassa olevaa sidettä eivätkä puhdistaa injektiokohtaa. Raskaana olevat naiset, vastasyntyneet ja immuunipuutteiset henkilöt eivät saa altistua mahdollisesti kontaminoituneille hoitotarvikkeille.
Injektiokohta on pidettävä okkluusiositeellä peitettynä (ks. kohta Käyttö- ja käsittelyohjeet). Terveydenhuollon ammattilaisen on varmistettava, että potilas pystyy noudattamaan tätä vaatimusta. Potilasta on myös kehotettava välttämään injektiokohdan koskettelua tai raapimista, koska Imlygic-valmistetta saattaa näin siirtyä tahattomasti kehon muille alueille tai potilaan kanssa lähikontaktissa olevaan ihmiseen.
Ei tiedetä, voiko Imlygic tarttua ihmiseen sukupuoliyhteydessä, mutta se kuitenkin tiedetään, että villityypin HSV‑1 voi tarttua sukupuoliyhteydessä. Potilasta on kehotettava käyttämään sukupuoliyhteyden aikana lateksikondomia, jotta estetään Imlygic-tartunta. Naisia, jotka voivat tulla raskaaksi, on kehotettava käyttämään tehokasta ehkäisymenetelmää hoidon aikana (ks. kohta Raskaus ja imetys).
Potilaasta huolehtivia henkilöitä on kehotettava käyttämään suojakäsineitä, kun he auttavat potilasta okkluusiositeen kiinnittämisessä tai vaihtamisessa ja noudattamaan käytettyjen sidemateriaalien ja puhdistustarvikkeiden turvallista hävittämistä koskevia varotoimia (ks. kohta Käyttö- ja käsittelyohjeet).
Jos tapahtuu tahaton altistuminen Imlygic-valmisteelle, noudata kohdassa Käyttö- ja käsittelyohjeet olevia ohjeita. Altistuneiden henkilöiden on otettava yhteyttä terveydenhuollon ammattilaiseen, jos herpesinfektion oireita tai löydöksiä kehittyy. Mikäli herpesleesioita epäillään, potilailla, heidän läheisillään ja terveydenhuollon ammattilaisilla on mahdollisuus myyntiluvan haltijan tarjoamaan jatkotestaukseen infektiotyypin tarkempaa selvittämistä varten.
Imlygic-hoitoa saaneiden potilaiden herpesinfektiot
Imlygic-hoitoa saaneilla potilailla on raportoitu herpesinfektioita (esimerkiksi huuliherpestä ja herpeskeratiittia) sekä vakavia disseminoituneita herpesinfektioita (ks. kohta Haittavaikutukset). Imlygic-hoitoon mahdollisesti liittyvän paikallisen tai systeemisen infektion oireet ovat oletettavasti samankaltaisia kuin villityypin HSV‑1-infektiosta aiheutuvat oireet.
Henkilöillä, joilla on villityypin HSV‑1-infektio, tiedetään olevan latentin villityypin HSV‑1:n reaktivaation vuoksi elinikäinen oireisen herpesinfektion riski. Imlygic-valmisteen mahdollisesta reaktivaatiosta aiheutuva oireinen herpesinfektio pitää ottaa huomioon.
Jos potilaalle kehittyy herpesinfektio, häntä on kehotettava noudattamaan tavanomaisia hygieniaohjeita viruksen tarttumisen estämiseksi.
Talimogeenilaherparepveekki on herkkä asikloviirille. Imlygic-hoidon riskit ja hyödyt on arvioitava ennen asikloviirin tai herpesinfektioiden hoitoon tarkoitettujen muiden viruslääkkeiden käyttöä. Jos tällaisia lääkkeitä käytetään systeemisesti tai paikallisesti suoraan injektiokohtaan, ne saattavat heikentää hoidon tehoa.
Potilaskortissa on tietoja herpesleesioista.
Injektiokohdan selluliitti
Kasvainkudokseen saattaa kehittyä Imlygic-hoidon jälkeen nekroosi tai haavauma. Selluliittia ja systeemisiä bakteeri-infektioita on raportoitu. Huolellista haavanhoitoa ja varotoimenpiteitä infektioiden ehkäisemiseksi suositellaan, etenkin jos kudosnekroosi aiheuttaa avohaavoja.
Injektiokohdan heikentynyt paraneminen
Kliinisissä tutkimuksissa on raportoitu injektiokohdan heikentynyttä paranemista. Imlygic saattaa lisätä riskiä heikentyneelle paranemiselle, jos potilaalla on taustalla siihen liittyviä riskitekijöitä (esim. injektiokohdan aiempi sädehoito tai leesiot sijaitsevat heikosti verisuonitetulla alueella).
Jos potilaalle kehittyy pitkittyvä infektio tai paraneminen on hidasta, Imlygic-hoidon riskit ja hyödyt on arvioitava ennen hoidon jatkamista.
Immuunivälitteiset tapahtumat
Kliinisissä tutkimuksissa Imlygic-hoitoa saaneilla potilailla on raportoitu immuunivälitteisiä tapahtumia, mukaan lukien glomerulonefriittiä, vaskuliittia, pneumoniittia, psoriaasin pahenemista ja vitiligoa.
Imlygic-hoidon riskit ja hyödyt on arvioitava ennen hoidon aloittamista, jos potilaalla on perussairautena autoimmuunitauti, tai ennen hoidon jatkamista, jos potilaalle kehittyy immuunivälitteisiä tapahtumia.
Injektiokohdan plasmasytooma
Imlygic-valmisteen annon jälkeen on raportoitu plasmasytoomaa injektiokohdan läheisyydessä. Imlygic-hoidon riskit ja hyödyt on arvioitava, jos potilas sairastaa multippelia myeloomaa tai jos potilaalle kehittyy hoidon aikana plasmasytooma.
Ahtauttava hengitystiesairaus
Imlygic-hoidon jälkeen on raportoitu ahtauttavaa hengitystiesairautta. Injektiot lähellä suuria hengitysteitä sijaitseviin leesioihin pitää antaa varoen.
HSV‑1-seronegatiiviset potilaat
Lähtötilanteessa HSV‑1-seronegatiivisilla potilailla on raportoitu lähtötilanteessa HSV‑1-seropositiivisiin potilaisiin verrattuna etenkin 6 ensimmäisen hoitojakson aikana yleisemmin kuumetta, vilunväristyksiä ja influenssan kaltaisia oireita (ks. kohta Haittavaikutukset).
Maksan verenvuoto, joka johtuu valmisteen annosta ihon läpi maksaan
Imlygic-valmistetta ei ole tarkoitettu annettavaksi ihon läpi maksaan. Kliinisissä tutkimuksissa on raportoitu sairaalahoitoon tai kuolemaan johtanutta maksan verenvuotoa potilailla, jotka saivat Imlygic-injektioita ihon läpi maksaan.
Kaikki potilaat
Tämä lääkevalmiste sisältää 20 mg sorbitolia per 1 ml:n injektiopullo. Sorbitolia (tai fruktoosia) sisältävien muiden valmisteiden samanaikaisen annon sekä ravinnosta saatavan sorbitolin (tai fruktoosin) additiivinen vaikutus on huomioitava.
Tämä lääkevalmiste sisältää 7,7 mg natriumia per 1 ml:n injektiopullo, joka vastaa 0,4 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Imlygic-valmisteella ei ole tehty yhteisvaikutustutkimuksia. Jos asikloviiria tai muita viruslääkkeitä käytetään systeemisesti tai paikallisesti suoraan injektiokohtaan, ne saattavat heikentää hoidon tehoa. Imlygic-hoidon riskit ja hyödyt on arvioitava ennen asikloviirin tai herpesinfektioiden hoitoon tarkoitettujen muiden viruslääkkeiden käyttöä.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / raskauden ehkäisy
Naisia, jotka voivat tulla raskaaksi, on kehotettava käyttämään hoidon aikana tehokasta ehkäisymenetelmää.
Kaikkia potilaita on kehotettava käyttämään sukupuoliyhteyden aikana lateksikondomia, jotta vältetään mahdollinen Imlygic-tartunta kumppaniin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus
Talimogeenilaherparepveekkia ei ole tutkittu raskaana olevilla naisilla riittävissä ja hyvin kontrolloiduissa tutkimuksissa.
Jos raskaana olevalla naisella on villityypin HSV‑1-infektio (primaari tai reaktivaatio), virus saattaa läpäistä istukan, ja viruksen erittymisen vuoksi myös synnytyksen aikana on tartuntariski. Villityypin HSV‑1-infektioihin on liittynyt vakavia haittavaikutuksia, mukaan lukien monielinhäiriöitä ja kuolemia, jos villityypin herpes on tarttunut sikiöön tai vastasyntyneeseen. Raskaana olevien naisten talimogeenilaherparepveekki-infektioista ei ole tähän mennessä saatu kliinisiä tietoja, mutta jos talimogeenilaherparepveekin vaikutusmekanismi on samanlainen, siitä saattaa aiheutua riski sikiölle tai vastasyntyneelle. Eläinkokeissa ei ole havaittu vaikutuksia alkion- eikä sikiönkehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi talimogeenilaherparepveekin käyttöä on suositeltavaa välttää raskauden aikana.
Pahanlaatuisen melanooman etäpesäkkeet saattavat levitä istukan kautta. Talimogeenilaherparepveekin on tarkoitus päästä sisään kasvainkudokseen ja lisääntyä siellä, joten sikiö saattaa altistua talimogeenilaherparepveekille istukan läpäisseen kasvainkudoksen kautta.
Jos Imlygic-valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi hoidon aikana, potilaalle on kerrottava sikiölle ja/tai vastasyntyneelle mahdollisesti aiheutuvasta vaarasta.
Imetys
Ei tiedetä, erittyykö talimogeenilaherparepveekki ihmisen rintamaitoon. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Imlygic-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Talimogeenilaherparepveekin vaikutuksia hedelmällisyyteen ei ole tutkittu kliinisissä tutkimuksissa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Talimogeenilaherparepveekillä saattaa olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Koska haittavaikutukset, kuten huimaus ja sekavuustila (ks. kohta Haittavaikutukset), ovat mahdollisia, potilasta on kehotettava olemaan varovainen autoa ajaessaan ja koneita käyttäessään, kunnes hän voi olla varma, ettei talimogeenilaherparepveekistä aiheudu haitallisia vaikutuksia.
Haittavaikutukset
Tiivistelmä turvallisuustiedoista
Imlygic-valmisteen turvallisuutta arvioitiin keskeisessä tutkimuksessa, jossa 292 potilasta sai vähintään 1 annoksen Imlygic-valmistetta (ks. kohta Farmakodynamiikka). Imlygic-altistuksen keston mediaani oli 23 viikkoa (5,3 kuukautta). Kaksikymmentäkuusi (26) potilasta altistui Imlygic-valmisteelle vähintään yhden vuoden ajan.
Imlygic-hoitoa saaneilla potilailla yleisimmin raportoituja haittavaikutuksia (≥ 25 %) olivat uupumus (50,3 %), vilunväristykset (48,6 %), kuume (42,8 %), pahoinvointi (35,6 %), influenssan kaltaiset oireet (30,5 %) ja injektiokohdan kipu (27,7 %). Kaikkiaan 98 % näistä raportoiduista haittavaikutuksista oli vaikeusasteeltaan lieviä tai kohtalaisia. Yleisin 3. asteen tai vaikeampi haittavaikutus oli selluliitti (2,1 %) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Haittavaikutukset on määritetty kliinisistä tutkimuksista, joissa Imlygic-hoitoa verrattiin GM‑CSF-hoitoon melanoomapotilailla, sekä markkinoille tulon jälkeen saatujen kokemusten perusteella. Haittavaikutusten ilmeneminen luetellaan elinjärjestelmäluokan ja yleisyyden mukaan. Yleisyysluokat on määritelty seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10) ja melko harvinaiset (≥ 1/1 000, < 1/100). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3. Kliinisissä tutkimuksissa melanoomapotilailla havaitut ja markkinoille tulon jälkeen ilmi tulleet haittavaikutukset
| Infektiot | |
| Yleinen | Selluliitti*, herpesinfektiot** |
| Melko harvinainen | Leikkauskohdan infektio |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | |
| Yleinen | Kipu kasvaimessa, kasvaimen infektio |
| Melko harvinainen | Injektiokohdan plasmasytooma* |
| Veri ja imukudos | |
| Hyvin yleinen | Perifeerinen edeema |
| Yleinen | Anemia |
| Immuunijärjestelmä | |
| Yleinen | Immuunivälitteiset tapahtumat†* |
| Melko harvinainen | Yliherkkyys |
| Aineenvaihdunta ja ravitsemus | |
| Yleinen | Dehydraatio |
| Hermosto | |
| Hyvin yleinen | Päänsärky |
| Yleinen | Sekavuustila, ahdistuneisuus, masennus, huimaus, unettomuus |
| Silmät | |
| Melko harvinainen | Herpeskeratiitti |
| Kuulo ja tasapainoelin | |
| Yleinen | Korvakipu |
| Sydän | |
| Yleinen | Takykardia |
| Verisuonisto | |
| Yleinen | Syvä laskimotukos, korkea verenpaine, kasvojen ja kaulan punoitus |
| Hengityselimet, rintakehä ja välikarsina | |
| Hyvin yleinen | Yskä |
| Yleinen | Hengenahdistus, suunielun kipu, ylähengitystieinfektio |
| Melko harvinainen | Ahtauttava hengitystiesairaus |
| Ruoansulatuselimistö | |
| Hyvin yleinen | Oksentelu, ripuli, ummetus, pahoinvointi |
| Yleinen | Vatsakipu, epämukavat tuntemukset vatsassa |
| Iho ja ihonalainen kudos | |
| Yleinen | Vitiligo, ihottuma, dermatiitti |
| Melko harvinainen | Granulomatoottinen dermatiitti |
| Luusto, lihakset ja sidekudos | |
| Hyvin yleinen | Lihassärky, nivelsärky, raajakipu |
| Yleinen | Selkäkipu, nivuskipu |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Hyvin yleinen | Influenssan kaltaiset oireet*, kuume, vilunväristykset, uupumus, kipu, injektiokohdan reaktiot§ |
| Yleinen | Sairaudentunne, kainalokipu |
| Tutkimukset | |
| Yleinen | Painon lasku |
| Vammat ja myrkytykset | |
| Yleinen | Haavakomplikaatiot, erite haavasta, ruhje, toimenpiteestä aiheutuva kipu |
§ Injektiokohdan reaktioita ovat: hyvin yleinen: injektiokohdan kipu; yleinen: injektiokohdan punoitus, injektiokohdan verenvuoto, injektiokohdan turvotus, injektiokohdan reaktio, injektiokohdan tulehdus, eritevuoto, injektiokohdan tihkuminen; melko harvinainen: injektiokohdan kuumotus. †Immuunivälitteisiä tapahtumia ovat: melko harvinainen: vaskuliitti, pneumoniitti, psoriaasin paheneminen ja glomerulonefriitti. * Katso Tärkeimpien haittavaikutusten kuvaus. ** Herpesinfektiot (esimerkiksi huuliherpes). | |
Tärkeimpien haittavaikutusten kuvaus
Immuunivälitteiset tapahtumat
Keskeisessä kliinisessä tutkimuksessa raportoituihin immuunivälitteisiin tapahtumiin kuuluivat psoriaasin paheneminen potilaalla, jolla oli jo aiemmin todettu psoriaasi, pneumoniitti potilaalla, jolla oli jo aiemmin todettu autoimmuunitauti, vaskuliitti yhdellä potilaalla ja glomerulonefriitti kahdella potilaalla, joista toisella todettiin akuutti munuaisten vajaatoiminta.
Plasmasytooma
Kliinisissä tutkimuksissa havaittiin yksi injektiokohdan plasmasytoomatapaus potilaalla, jolla todettiin multippeli myelooma.
Selluliitti
Keskeisessä kliinisessä tutkimuksessa (tutkimus 005/05) raportoitiin selluliittitapahtumia, joista osa luokiteltiin vakaviksi haittatapahtumiksi. Yksikään niistä ei kuitenkaan johtanut Imlygic-hoidon pysyvään lopettamiseen. Huolellista haavanhoitoa ja varotoimenpiteitä infektioiden ehkäisemiseksi suositellaan, etenkin jos kudosnekroosi aiheuttaa avohaavoja.
Influenssan kaltaiset oireet
Influenssan kaltaisia oireita esiintyi 90 %:lla Imlygic-hoitoa saaneista potilaista. Kuume, vilunväristykset ja influenssan kaltaiset oireet, joita voi ilmaantua milloin tahansa hoidon aikana, hävisivät yleensä 72 tunnin kuluessa. Tällaisia tapahtumia raportoitiin yleisemmin 6 ensimmäisen hoitojakson aikana, etenkin jos potilas oli lähtötilanteessa HSV‑1-negatiivinen.
Pediatriset potilaat
Pediatriseen vaiheen 1 kliiniseen tutkimukseen (tutkimus 20110261) osallistui 15 iältään 7–21‑vuotiasta lasta ja nuorta, joilla oli suoraan injektioon soveltuvia pitkälle edenneitä muita kuin keskushermoston kasvaimia (ks. kohta Farmakodynamiikka). Turvallisuutta koskevat tiedot olivat yhdenmukaisia potilaiden syöpäsairauden ja aikuisilla todetun talimogeenilaherparepveekin turvallisuusprofiilin kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta: www-sivusto: www.fimea.fi
Yliannostus
Imlygic-yliannoksesta ei ole kliinistä kokemusta. Kliinisissä tutkimuksissa on annettu pitoisuutta 108 PFU/ml enintään 4 ml:n annoksina kahden viikon välein eikä ole havaittu viitteitä annosta rajoittavasta toksisuudesta. Turvallista maksimiannosta ei ole määritetty. Jos epäillään yliannosta tai tahatonta injisointia laskimoon, potilaalle pitää antaa oireenmukaista hoitoa, esim. asikloviiria tai muita viruslääkkeitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), ja elintoimintoja tukevat toimenpiteet on käynnistettävä tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastinen solu- ja geeniterapia, ATC-koodi: L01XL02.
Vaikutusmekanismi
Talimogeenilaherparepveekki on HSV‑1-virukseen pohjautuva onkolyyttinen immunoterapia. Talimogeenilaherparepveekki on muunnettu lisääntymään kasvaimessa ja tuottamaan immuniteettia stimuloivaa proteiinia, ihmisen granulosyytti-makrofagikasvutekijää (GM‑CSF). Talimogeenilaherparepveekki aiheuttaa kasvainsolujen kuoleman ja vapauttaa kasvaimesta peräisin olevia antigeeneja. Sen oletetaan yhdessä GM‑CSF:n kanssa tehostavan systeemistä immuunivastetta kasvaimia vastaan sekä efektori‑T‑soluvastetta. Hiiret, joiden primaarikasvain saatiin hoidon jälkeen häviämään kokonaan, olivat myöhemmin resistenttejä uudelle kasvainaltistukselle.
Talimogeenilaherparepveekki on muunneltu HSV‑1-viruksesta ICP34.5:n ja ICP47:n deleetiolla. Viruksilta suojaavat immuunivasteet suojaavat normaaleja soluja talimogeenilaherparepveekki-infektion jälkeen, mutta kasvainten on osoitettu olevan herkkiä soluvaurioille ja solukuolemille, kun ne altistuvat HSV‑1-viruksille, joista puuttuu ICP34.5, kuten talimogeenilaherparepveekille. ICP47:n deleetio estää antigeenia esittelevien molekyylien vähenemisen ja voimistaa HSV US11 ‑geenin ilmentymistä, mikä tehostaa virusten lisääntymistä kasvainsoluissa.
Kliininen teho ja turvallisuus
Tutkimus 005/05
Imlygic-monoterapian turvallisuutta ja tehoa verrattiin ihon alle annettuun GM‑CSF-hoitoon kolmannen vaiheen avoimessa ja satunnaistetussa monikansallisessa kliinisessä tutkimuksessa potilailla, joilla oli leikkaushoitoon soveltumaton levinneisyysasteen IIIB, IIIC tai IV melanooma. Melanooman aiempi systeeminen hoito oli sallittu, mutta sitä ei vaadittu. Potilas ei soveltunut tutkimukseen, jos hänellä oli aktiivisia etäpesäkkeitä aivoissa, etäpesäkkeitä luustossa, laajalti sisäelimiin levinnyt tauti, primaari silmän tai limakalvojen melanooma, viitteitä immuunisuppressiosta tai jos potilas käytti parhaillaan systeemistä herpeslääkettä.
Potilaat satunnaistettiin suhteessa 2:1 joko Imlygic-hoitoon tai GM‑CSF-hoitoon (N = 436; Imlygic-hoito 295, GM‑CSF-hoito 141). Imlygic annettiin injektioina leesioon enintään 4 ml:n annoksina käyttäen aluksi pitoisuutta 106 (1 miljoona) PFU/ml päivänä 1, ja sitten pitoisuutta 108 (100 miljoonaa) PFU/ml päivänä 21 ja sen jälkeen 2 viikon välein. GM‑CSF annettiin ihon alle annoksina 125 mikrog/m2 päivittäin 14 päivän ajan, minkä jälkeen seurasi 14 päivän hoitotauko. Tätä hoito‑ohjelmaa toistettiin.
Jotta viivästynyt immuunivälitteinen kasvaimen kasvua ehkäisevä vaikutus ehtisi kehittyä, potilaat saivat hoitoa vähintään 6 kuukauden ajan tai kunnes ei enää ollut injisoitavissa olevia leesioita. Hoitoa jatkettiin tänä aikana, vaikka potilaalla olleen leesion tai leesioiden koko kasvoi ja/tai kehittyi uusi leesio tai leesioita, paitsi jos potilaalle kehittyi sietämättömiä haittavaikutuksia tai tutkija katsoi, että olisi potilaan edun mukaista lopettaa hoito tai antaa jotakin muuta hoitoa melanoomaan. Kuuden kuukauden hoidon jälkeen potilaiden oli tarkoitus jatkaa hoitoa kliinisesti merkitykselliseen taudin etenemiseen asti (eli taudin etenemiseen, johon liittyi toimintakyvyn heikkeneminen ja/tai tutkijan arvioima vaihtoehtoisen hoidon tarve). Jos hoidolle oli vastetta 12 hoitokuukauden jälkeen, sitä voitiin jatkaa vielä enintään 6 kuukauden ajan. Hoitoaikeen mukaisen (intent-to-treat, ITT) potilasjoukon hoito kesti GM‑CSF-ryhmässä keskimäärin (keskihajonta mainittu sulkeissa) 15,76 viikkoa (15,79) ja Imlygic-ryhmässä 26,83 viikkoa (18,39). Ensisijainen päätetapahtuma oli keskitettyyn sokkoutettuun arvioon perustuva kestävä hoitovaste (durable response rate, DRR) (niiden potilaiden osuus, joiden täydellinen (CR) tai osittainen hoitovaste (PR) oli jatkunut keskeytyksettä vähintään 6 kuukautta). Toissijaisia päätetapahtumia olivat kokonaiselinaika (OS), kokonaisvasteosuus (ORR) [PR + CR], aika vasteen saavuttamiseen, vasteen kesto ja aika hoidon epäonnistumiseen (aika satunnaistamisesta ensimmäiseen kliinisesti oleelliseen taudin etenemiseen, jonka jälkeen ei enää saavutettu hoitovastetta, tai kuolemaan).
Keski-ikä oli 63 vuotta (vaihteluväli: 22–94 vuotta); 26,5 % oli yli 65‑vuotiaita ja 23,3 % yli 74‑vuotiaita. Suurin osa potilaista (98 %) oli valkoihoisia. Tutkimuspotilasjoukosta 57 % oli miehiä, ja 70 %:lla lähtötilanteen ECOG-toimintakykyluokka oli 0. Tutkimukseen otetuista potilaista 22 %:lla oli levinneisyysasteen IV M1c melanooma ja 53 % potilaista oli saanut aiemmin hoitoa melanoomaan, esimerkiksi solunsalpaajahoitoa ja sytokiinipohjaista immunoterapiaa, leikkaushoidon, liitännäishoidon tai sädehoidon lisäksi. Kaikista tutkimukseen otetuista potilaista 58 % oli lähtötilanteessa villityypin HSV‑1:n suhteen seropositiivisia ja 32,6 % oli seronegatiivisia; muiden 9,4 %:n HSV‑1-serostatus ei ollut tiedossa.
ITT-potilasjoukossa kestävän hoitovasteen ero Imlygic- ja GM‑CSF-ryhmien välillä oli tilastollisesti merkitsevä Imlygic-hoidon hyväksi (ks. taulukko 4).
Taulukko 4. Imlygic-tutkimuksen 005/05 ITT-potilasjoukon tulosten tiivistelmä
| Tutkimuksen päätetapahtuma | Imlygic N = 295 | GM‑CSF N = 141 | |
| Kestävä hoitovaste | Ensisijainen | 16,3 % (n = 48) (95 % CI: 12,1–20,5) | 2,1 % (n = 3) (95 % CI: 0,0–4,5) |
Kerroinsuhde 8,9 (95 % CI: 2,7–29,2) p < 0,0001 | |||
Kokonaisvasteosuus (% CR, % PR) | Toissijainen | 26,4 % (n = 78) (95 % CI: 21,4–31,5 %) (10,8 % CR, 15,6 % PR) | 5,7 % (n = 8) (95 % CI: 1,9–9,5 %) (0,7 % CR, 5 % PR) |
| Kokonaiselinaika | Toissijainen | Mediaani 23,3 (95 % CI: 19,5–29,6) kk | Mediaani 18,9 (95 % CI: 16,0–23,7) kk |
| Vaarasuhde (HR): 0,79 (95 % CI: 0,62–1,00), p = 0,051 | |||
| Vasteen kesto (vaste jatkui edelleen kasvaimen viimeisellä arviointikerralla) | Toissijainen | Ei saavutettu (vaihteluväli: > 0,0 ‑ > 16,8 kk) | Mediaani 2,8 kk (vaihteluväli: 1,2 ‑ > 14,9 kk) |
| HR: 0,46 (95 % CI: 0,35–0,60) | |||
| Aika vasteen saavuttamiseen (mediaani) | Toissijainen | 4,1 kk | 3,7 kk |
| Aika hoidon epäonnistumiseen (mediaani) | Toissijainen | 8,2 kk (95 % CI: 6,5–9,9) | 2,9 kk (95 % CI: 2,8–4,0) |
| HR: 0,42 (95 % CI: 0,32–0,54) | |||
Imlygic-hoitovasteen saaneista potilaista 56:lla (72 %) vaste jatkui vielä primaarianalyysin ajankohtana. Vasteen saaneista potilaista 42:lla (54 %) leesion tai leesioiden koko oli suurentunut ≥ 25 % ja/tai potilaalle oli kehittynyt uusi leesio tai leesioita ennen kuin vaste lopulta saatiin.
Imlygic-valmisteen systeemistä aktiivisuutta arvioivassa analyysissä 27 potilaalla 79:stä (34,2 %) muut kuin sisäelinleesiot, joihin ei injisoitu Imlygic-valmistetta, pienenivät kaikkiaan ≥ 50 %, ja 8 potilaalla 71:stä (11,3 %) sisäelinleesiot, joihin ei injisoitu Imlygic-valmistetta, pienenivät kaikkiaan ≥ 50 %.
Kuva 4. Kaplan‑Meierin kuvaaja – kokonaiselinaika (ITT-potilasjoukko)
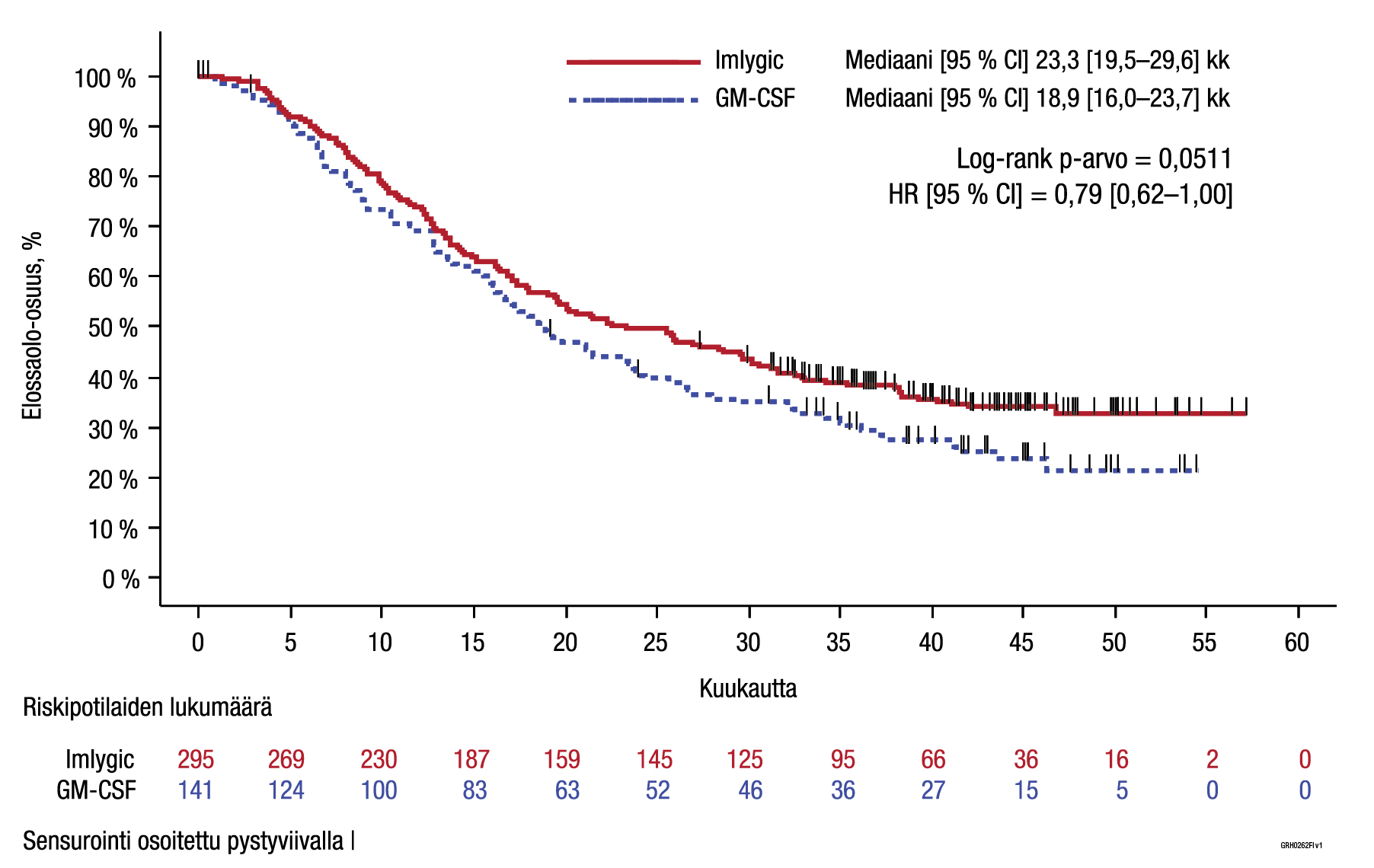
Hoidon turvallisuudessa ja tehossa ei havaittu yleisiä eroja iäkkäiden (≥ 65‑vuotiaiden) ja nuorempien aikuisten potilaiden välillä.
Eksploratiiviset alaryhmät
Kestävästä hoitovasteesta (DRR) ja kokonaiselinajasta tehtiin eksploratiiviset alaryhmäanalyysit myös suhteessa sairauden levinneisyysasteeseen (ks. kuva 5 ja taulukko 5). Keskeisen tutkimuksen voimaa ei ollut mitoitettu arvioimaan tehoa näissä yksittäisissä alaryhmissä, mutta potilaat, joilla ei ollut leesioita sisäelimissä, hyötyivät Imlygic-hoidosta enemmän kuin potilaat, joiden tauti oli edennyt pidemmälle.
Taulukko 5. Imlygic-tutkimuksen 005/05 eksploratiivisen alaryhmäanalyysin tulosten tiivistelmä
| DRR (%) | ORR (%) | OS (vaarasuhde) | |||
| Imlygic | GM‑CSF | Imlygic | GM‑CSF | Imlygic vs GM‑CSF | |
| Levinneisyysaste§ IIIB/IIIC/ levinneisyysaste IVM1a (Imlygic, n = 163; GM‑CSF, n = 86) | 25,2 | 1,2 | 40,5 | 2,3 | 0,57 (95 % CI: 0,40–0,80) |
| Levinneisyysaste§ IVM1B/ IVM1C (Imlygic, n = 131; GM‑CSF, n = 55) | 5,3 | 3,6 | 9,2 | 10,9 | 1,07 (95 % CI: 0,75–1,52) |
| § AJCC:n (American Joint Committee on Cancer) levinneisyysluokitus, 6. painos. | |||||
Kuva 5. Kokonaiselinajan Kaplan‑Meier-estimaatti satunnaistetun hoidon mukaan levinneisyysasteen IIIB/IIIC/ levinneisyysasteen IVM1a tautia sairastavassa potilasjoukossa (eksploratiivinen alaryhmäanalyysi)
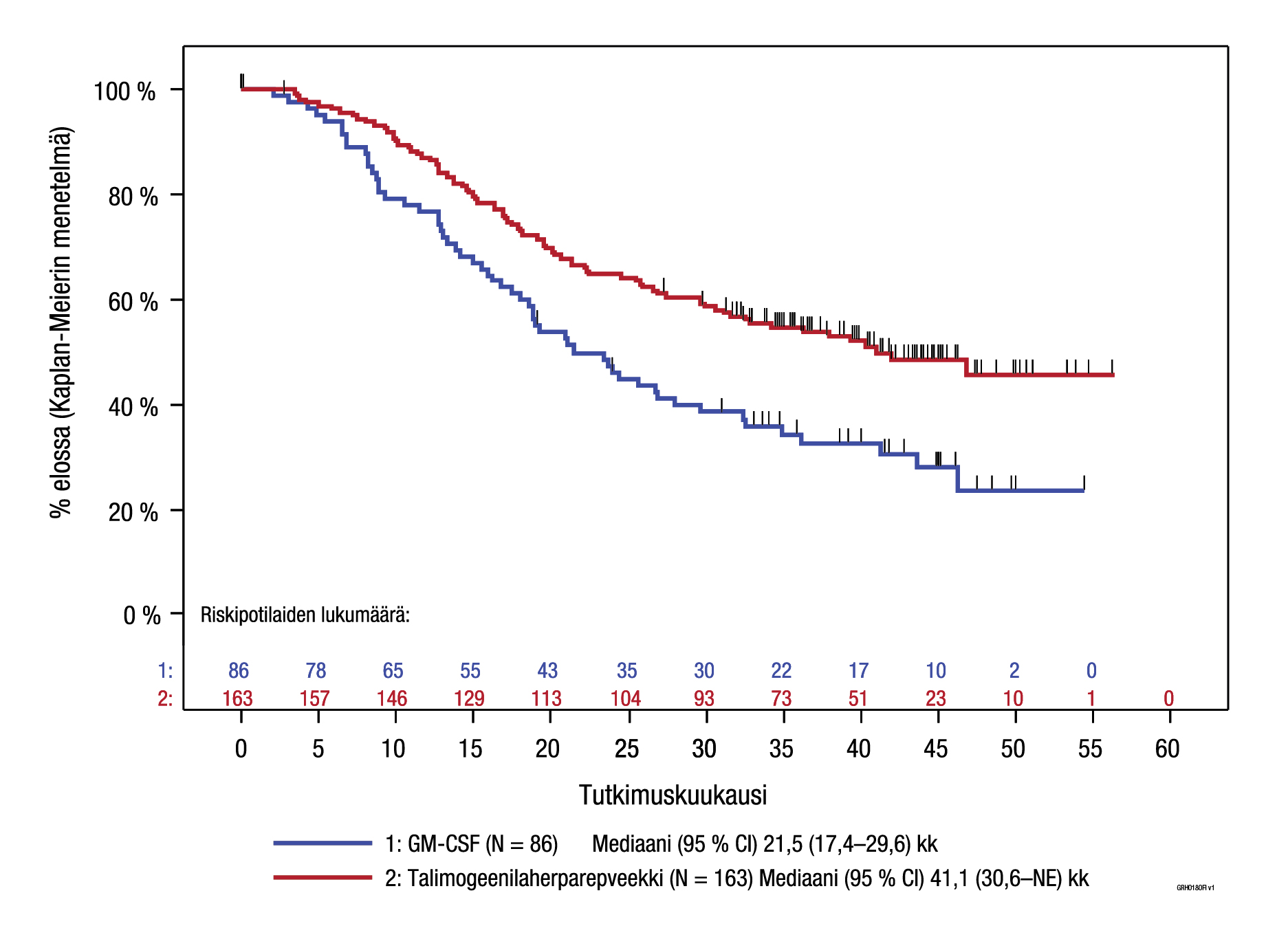
Sensurointi osoitettu pystyviivalla
NE = ei arvioitavissa
Analyysin eksploratiivisen luonteen vuoksi ja tämänhetkisen tutkimusnäytön perusteella Imlygic-hoidon vaikutusta kokonaiselinaikaan ei ole varmistettu.
Pediatriset potilaat
Talimogeenilaherparepveekin turvallisuutta ja tehoa pediatristen potilaiden suoraan injektioon soveltuvien pitkälle edenneiden muiden kuin keskushermoston kasvainten hoidossa arvioitiin yhdessä vaiheen 1 avoimessa monikeskustutkimuksessa (tutkimus 20110261), jossa oli annoksen de-eskalaation mahdollisuus. Kaikkiaan 15 potilasta, jotka olivat 7–21‑vuotiaita lapsia ja nuoria, jaettiin kahteen kohorttiin: sekä kohortti A1 (13 iältään 12–21‑vuotiasta potilasta) että kohortti B1 (2 vähintään 7- mutta alle 12‑vuotiasta potilasta) sai tutkimuksen yhteydessä talimogeenilaherparepveekkia. Annostusohjelma vastasi aikuisille suositeltua talimogeenilaherparepveekkiannosta.
Annosta rajoittavan toksisuuden (DLT) analyysi tehtiin 13 potilaan ryhmästä. Yhdelläkään potilaalla ei ilmennyt annosta rajoittavaa toksisuutta DLT‑arviointijakson aikana. Kaikilla potilailla (15 potilasta, 100,0 %) ilmeni vähintään yksi hoidon yhteydessä esiintyvä haittatapahtuma, ja 8 potilaalla (53,3 %) ilmeni 3. asteen tai sitä vaikeampia haittatapahtumia.
Vastetta ei havaittu; muokattujen irRC‑RECIST‑kriteerien mukainen kokonaisvasteosuus oli 0 % (95 % CI: 0,0–21,8).
Farmakokinetiikka
Talimogeenilaherparepveekki on muuntogeeninen ja lisääntymiskykyinen HSV‑1-virus. Siksi sen farmakokinetiikkaan ja biologiseen jakautumiseen vaikuttavat leesion sijainti, johon injektio annetaan, sekä viruksen kasvainselektiivinen lisääntyminen ja vapautuminen kasvainkudoksesta.
Imeytyminen
Kasvaimiin paikallisesti injektiona annetun talimogeenilaherparepveekin siirtyminen solun sisään tapahtuu HSV‑1-reseptorien kautta kasvainsoluissa ja muissa kuin kasvainsoluissa. Koska talimogeenilaherparepveekki injisoidaan kasvaimeen ja se lisääntyy kasvaimessa, talimogeenilaherparepveekin biologinen hyötyosuus ja systeeminen pitoisuus eivät ennakoi lääkeaineen aktiivisuutta eikä niitä ole siksi arvioitu.
Metabolia/eliminaatio
Talimogeenilaherparepveekki poistuu elimistöstä yleisten isännän puolustusmekanismien välityksellä (esim. autofagia, adaptiiviset immuunivasteet). Talimogeenilaherparepveekki hajoaa tyypillisten endogeenisten proteiinien ja DNA:n kataboliareittien kautta. Kuten muissakin villityypin HSV‑1-infektioissa talimogeenilaherparepveekin DNA:ta saattaa jäädä latenttina injektiokohtaa hermottavien hermosolujen runko-osaan, joten latentin talimogeenilaherparepveekki-infektion mahdollisuutta ei voida sulkea pois.
Biologinen jakautuminen (elimistössä) ja viruksen erittyminen (ekskreetio/sekreetio)
Talimogeenilaherparepveekin DNA:n pitoisuus määritettiin erittäin herkän ja spesifisen kvantitatiivisen polymeraasiketjureaktion (qPCR) avulla. Se ei kuitenkaan välttämättä korreloi viruksen tartuttavuusriskin kanssa. Talimogeenilaherparepveekki määritettiin kliinisissä tutkimuksissa myös injektiokohdasta sekä joissakin tapauksissa mahdollisesta herpesleesiosta otetuista valikoiduista potilasnäytteistä käyttäen viruksen tartuttavuusmäärityksiä.
Kliininen biologinen jakautuminen, eliminaatio ja erittyminen
Leesioon annetun talimogeenilaherparepveekin biologista jakautumista ja erittymistä tutkittiin kliinisessä tutkimuksessa, jossa talimogeenilaherparepveekin DNA:ta mitattiin verestä, virtsasta, injektiokohdasta, okkluusiositeiden ulkopuolelta, suun limakalvoilta, anogenitaalialueelta ja epäillyistä herpesleesioista. Kuusikymmentä melanoomapotilasta sai Imlygic-valmistetta injektioina leesioon samoina annoksina ja samalla aikataululla kuin kliinisessä tutkimuksessa 005/05 (ks. kohta Farmakodynamiikka). Okkluusiositeistä otettiin näytteitä hoidon aikana. Veri- ja virtsanäytteitä otettiin hoidon aikana ja 30 vuorokauden ajan hoidon päättymisen jälkeen. Injektiokohdasta, suun limakalvoilta ja anogenitaalialueelta otettiin näytteitä hoidon aikana ja 60 vuorokauden ajan hoidon päättymisen jälkeen. Epäillyistä herpesleesioista otettiin näytteitä aina, kun potilaalle kehittyi leesioita, joiden epäiltiin olevan herpeksen aiheuttamia. Jos qPCR-testissä todettiin talimogeenilaherparepveekin DNA:ta, tehtiin TCID50-määritys viruksen tartuttavuuden mittaamiseksi. Hoidetuista 60 potilaasta saatujen tietojen perusteella kaikissa näytteenottokohdissa todettiin talimogeenilaherparepveekin DNA:ta tutkimuksen aikana (ks. taulukko 6).
Taulukko 6. Potilaat, joilla todettiin havaittavia määriä DNA:ta hoidon aikana
Ruumiinneste/kohta | Potilaat, joilla todettiin havaittavia määriä DNA:ta hoidon aikana (n = 60) |
Veri | 59 (98 %) |
Virtsa | 19 (32 %) |
Injektiokohta | 60 (100 %) |
Okkluusiositeen ulkopuoli | 48 (80 %) |
Suun limakalvot | 8 (13 %) |
Anogenitaalialue | 5 (19 %)a |
| a 26 potilaalta testattiin anogenitaalialueen Imlygic-DNA. | |
Talimogeenilaherparepveekki-DNA-positiivisten näytteiden ja potilaiden osuus oli suurin toisen hoitojakson aikana verestä, virtsasta, injektiokohdasta ja okkluusiositeistä otettujen näytteiden osalta, ensimmäisen hoitojakson aikana suun limakalvoilta otettujen näytteiden osalta ja ensimmäisen ja toisen hoitojakson aikana anogenitaalialueelta otettujen näytteiden osalta. Niistä potilaista, joiden veressä, virtsassa, suun limakalvoilla ja anogenitaalialueella oli havaittavia määriä talimogeenilaherparepveekin DNA:ta, yhdenkään näytteissä ei ollut havaittavia määriä talimogeenilaherparepveekin DNA:ta 30 vuorokauden kuluttua hoidon päättymisestä. Niistä potilaista, joiden injisoiduissa leesioissa oli havaittavia määriä DNA:ta, yhdenkään näytteissä ei ollut havaittavia määriä talimogeenilaherparepveekin DNA:ta 60 vuorokauden kuluttua hoidon päättymisestä.
Yhteensä kolmella niistä 19 potilaasta, joilla epäiltiin olevan herpeksen aiheuttamia leesioita, todettiin talimogeenilaherparepveekin DNA:ta jossain vaiheessa tutkimuksen aikana. Virusaktiivisuus mitattiin niistä injektiokohdasta, okkluusiositeistä, suun limakalvoilta, anogenitaalialueelta ja epäillyistä herpesleesioista otetuista näytteistä, joissa oli todettu talimogeenilaherparepveekin DNA:ta. Virusaktiivisuutta ei havaittu okkluusiositeistä, suun limakalvoilta, anogenitaalialueelta ja epäillyistä herpesleesioista otetuissa näytteissä. Tartuttamiskykyistä talimogeenilaherparepveekkivirusta havaittiin injektiokohdassa 7 potilaalla (11 %:lla) useina ajankohtina tutkimuksen aikana. Tartuttamiskykyistä virusta ei havaittu yhdessäkään näytteessä toisen hoitojakson tai tutkimuksen päättymisen jälkeen.
Farmakokinetiikka erityisryhmissä
Talimogeenilaherparepveekin farmakokinetiikkaa ei ole tutkittu erityisryhmissä.
Prekliiniset tiedot turvallisuudesta
Immunokompetenttien hiirten, rottien ja koirien ihon alle, laskimoon tai kasvaimeen kerta-annoksena tai toistuvina annoksina enintään 4 x 108 PFU/kg tai 107 PFU/annos (60‑kertainen annos suurimpaan ehdotettuun kliiniseen annokseen verrattuna) injisoitu talimogeenilaherparepveekki oli hyvin siedetty. Neuropatologisia tai haitallisia neurologisia vaikutuksia ei havaittu. In vivo ‑tutkimuksessa injektiona aivoihin annettu talimogeenilaherparepveekki oli 10 000 kertaa vähemmän neurovirulentti kuin villityypin HSV‑1 annoksena, joka tappaa 50 % hiiristä.
Talimogeenilaherparepveekkiä injisoitiin immuunipuutteisten hiirten (nude- ja SCID-hiirten) erilaisiin vieraslajisiirrekasvaimiin enintään 2 x 108 PFU/kg annoksena (30‑kertainen annos suurimpaan ehdotettuun kliiniseen annokseen verrattuna). Kuolemaan johtaneita systeemisiä virusinfektioita havaittiin enimmillään 20 %:lla nude-hiiristä (pääasiassa T‑lymfosyyttien toiminnanvajaus) ja 100 %:lla SCID-hiiristä (sekä T‑ että B‑lymfosyytit puuttuvat).
Kuolemaan johtaneita laajalle levinneitä virusinfektioita havaittiin kaikissa tutkimuksissa 14 %:lla nude-hiiristä, jotka saivat talimogeenilaherparepveekkiä annoksina, jotka olivat 10–100 kertaa suurempia kuin villityypin HSV‑1‑annokset, jotka tappoivat 100 % eläimistä.
Mutageenisuus
Talimogeenilaherparepveekin genotoksisuutta ei ole tutkittu pitkäkestoisissa eläinkokeissa eikä ihmisillä tehdyissä tutkimuksissa. Villityypin HSV‑1 ei integroidu isännän perimään, joten talimogeenilaherparepveekin insertiomutageenisuuden riski on merkityksettömän pieni.
Karsinogeenisuus
Talimogeenilaherparepveekin karsinogeenisuutta ei ole tutkittu pitkäkestoisissa eläinkokeissa eikä ihmisillä tehdyissä tutkimuksissa. Talimogeenilaherparepveekistä ja villityypin HSV‑1:stä käytettävissä olevat tiedot eivät kuitenkaan viittaa karsinogeenisuusriskiin ihmisellä.
Lisääntymis- ja kehitystoksisuus
Aikuisille hiirille annetut enintään 4 x 108 PFU/kg annokset (PFU/kg:n perusteella 60‑kertainen annos suurimpaan kliiniseen annokseen verrattuna) eivät vaikuttaneet urosten eivätkä naaraiden lisääntymiskudoksiin. Organogeneesin aikana tiineille hiirille enintään 4 x 108 (400 miljoonaa) PFU/kg annoksina (PFU/kg:n perusteella 60‑kertainen annos suurimpaan kliiniseen annokseen verrattuna) annetun talimogeenilaherparepveekin ei havaittu vaikuttavan alkion ja sikiön kehitykseen. Sikiöiden verestä havaittiin merkityksettömän pieniä määriä (< 0,001 % emon veressä olevista pitoisuuksista) talimogeenilaherparepveekin DNA:ta.
Farmaseuttiset tiedot
Apuaineet
Dinatriumfosfaattidihydraatti, natriumdivetyfosfaattidihydraatti, natriumkloridi, myo‑inositoli, sorbitoli (E 420), injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
5 vuotta.
Käyttökuntoon saattaminen ja säilytys ennen antoa
Anna sulatettu Imlygic potilaalle niin pian kuin se on käytännössä mahdollista.
Sulatettu Imlygic-valmiste kestää säilytyksen 2–25 °C:n lämpötilassa valolta suojattuna alkuperäisessä injektiopullossa, ruiskussa tai alkuperäisessä injektiopullossa ja sen jälkeen ruiskussa. Älä ylitä taulukoissa 7 ja 8 ilmoitettuja säilytysaikoja.
Jos sulatettua Imlygic-valmistetta säilytetään alkuperäisessä injektiopullossa ja sen jälkeen ruiskussa:
- samaa lämpötila-aluetta on noudatettava koko säilytyksen ajan siihen asti, kun valmiste annetaan potilaalle
- säilytysaika ruiskussa huoneenlämmössä (enintään 25 °C:ssa) ei saa olla yli 2 tuntia pitoisuudelle 106 (1 miljoona) PFU/ml eikä yli 4 tuntia pitoisuudelle 108 (100 miljoonaa) PFU/ml (ks. taulukko 7)
- kumulatiivinen enimmäissäilytysaika (säilytysaika injektiopullossa + säilytysaika ruiskussa) ei saa ylittää taulukossa 8 ilmoitettuja säilytysaikoja.
Sulatettua Imlygic-valmistetta ei saa pakastaa uudelleen. Hävitä injektiopulloon tai ruiskuun jäänyt sulatettu Imlygic, jos sen säilytysaika ylittää alla mainitut säilytysajat.
Taulukko 7. Sulatetun Imlygic-valmisteen enimmäissäilytysaika ruiskussa
106 (1 miljoona) PFU/ml | 108 (100 miljoonaa) PFU/ml | |
2–8 °C | 8 tuntia | 8 tuntia |
enintään 25 °C | 2 tuntia | 4 tuntia |
Taulukko 8. Sulatetun Imlygic-valmisteen kumulatiivinen enimmäissäilytysaika (säilytysaika injektiopullossa + säilytysaika ruiskussa)
106 (1 miljoona) PFU/ml | 108 (100 miljoonaa) PFU/ml | |
2–8 °C | 24 tuntia | 1 viikko (7 vrk) |
enintään 25 °C | 12 tuntia | 24 tuntia |
Säilytys
Säilytä ja kuljeta pakastettuna (−90 °C ‑ −70 °C).
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Sulatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
IMLYGIC injektioneste, liuos
1 x 10exp6 PFU/ml (L:ei) 1 ml (1 milj. PFU/ml) (3150,82 €)
1 x 10exp8 PFU/ml (L:ei) 1 ml (100 milj. PFU/ml) (3150,82 €)
PF-selosteen tieto
Yksi ml säilytysaineetonta Imlygic-liuosta toimitetaan kertakäyttöisessä injektiopullossa (syklistä polyolefiinimuovia), jossa on tulppa (klooributyylielastomeeria) ja suljin (alumiinia) sekä suojakansi (polypropeenia), ja se on saatavana kahdessa eri muodossa:
Kuva 6. Kertakäyttöinen injektiopullo asennettuna kiinteästi kirkkaan muovipäällyksen (kopolyesteriä) sisään |
|
TAI |
Kuva 7. Kertakäyttöinen injektiopullo ilman kirkasta muovipäällystä |
|
Injektiopullon suojakansi on värikoodattu: 106 (1 miljoonaa) PFU/ml on vaaleanvihreä ja 108 (100 miljoonaa) PFU/ml on syvänsininen.
Valmisteen kuvaus:
Imlygic 106 plakkia muodostavaa yksikköä (PFU) / ml injektioneste, liuos
Jäädytetystä valmisteesta sulatettu neste on kirkasta tai lähes läpikuultavaa.
Neste saattaa sisältää valkoisia, silmämääräisesti havaittavia, erimuotoisia, virusta sisältäviä hiukkasia.
Imlygic 108 plakkia muodostavaa yksikköä (PFU) / ml injektioneste, liuos
Jäädytetystä valmisteesta sulatettu neste on lähes läpikuultavaa tai läpinäkymätöntä.
Neste saattaa sisältää valkoisia, silmämääräisesti havaittavia, erimuotoisia, virusta sisältäviä hiukkasia.
Käyttö- ja käsittelyohjeet
Imlygic-injektiopullojen sulattaminen
- Sulata jäisiä Imlygic-injektiopulloja ennen käyttöä huoneenlämmössä (20–25 °C), kunnes Imlygic on muuttunut nestemäiseksi. Ympäristön lämpötilasta riippuen injektiopullojen sulaminen kokonaan vie oletusarvoisesti noin 30–70 minuuttia. Pyörittele injektiopulloa varovasti. ÄLÄ ravista.
- Injektiopullot pitää sulattaa ja säilyttää valmisteen antoon saakka alkuperäispakkauksessa. Herkkä valolle.
Käsittely ja anto
Noudata valmisteen käsittelyä ja antoa, henkilönsuojainten käyttöä, roiskeita ja jätteiden hävittämistä koskevia paikallisia ohjeita.
- Käytä Imlygic-valmisteen käyttökuntoon saattamisen tai annon aikana suoja- tai laboratoriotakkia, suojalaseja tai kasvosuojusta ja suojakäsineitä. Peitä mahdolliset suojaamattomat haavat ennen valmisteen antoa. Vältä kosketusta ihon, silmien ja limakalvojen kanssa.
- Kun valmiste on annettu, vaihda suojakäsineet ennen okkluusiositeiden kiinnittämistä injisoitujen leesioiden päälle. Pyyhi okkluusiositeen ulkopuoli desinfiointipyyhkeellä. Injektiokohta tulisi pitää koko ajan ilma- ja vesitiiviillä sidoksella peitettynä, jos mahdollista. Jotta virustartunnan riski voitaisiin välttää, potilaan on pidettävä injektiokohta suojattuna vähintään 8 päivän ajan viimeisen hoitokerran jälkeen tai pidempään, jos injektiokohdasta vuotaa tai tihkuu eritettä. Kehota potilasta kiinnittämään side terveydenhuollon ammattilaisen antamien ohjeiden mukaisesti ja vaihtamaan side, jos se irtoaa.
- Hävitä kaikki Imlygic-valmisteen kanssa kosketuksissa olleet materiaalit (esim. injektiopullo, ruisku, neula, vanu tai harsotaitos) paikallisten toimintatapojen mukaisesti.
Tahaton altistus
- Jos Imlygic-valmisteen käyttökuntoon saattamisen tai annon aikana tapahtuu tahaton työperäinen altistuminen lääkevalmisteelle (esim. roiskeet silmiin tai limakalvoille), altistunutta aluetta on huuhdeltava puhtaalla vedellä vähintään 15 minuutin ajan. Jos rikkoutunut iho altistuu valmisteelle tai tapahtuu neulanpistotapaturma, altistunut alue on puhdistettava huolellisesti vedellä ja saippualla ja/tai desinfiointiaineella.
- Pyyhi Imlygic-roiskeet aina viruksia tappavalla aineella ja imukykyisellä pyyhkeellä.
- Neuvo potilasta laittamaan käytetyt sidemateriaalit ja puhdistustarvikkeet suljettavaan muovipussiin, koska ne voivat olla kontaminoituneita, ja hävittämään pussi talousjätteiden mukana.
Tämä lääke sisältää muuntogeenisia organismeja.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
IMLYGIC injektioneste, liuos
1 x 10exp6 PFU/ml 1 ml
1 x 10exp8 PFU/ml 1 ml
- Ei korvausta.
ATC-koodi
L01XL02
Valmisteyhteenvedon muuttamispäivämäärä
25.07.2024
Yhteystiedot
Keilaranta 10, PL 86
02101 Espoo
09 5490 0500