HUMIRA injektioneste, liuos, esitäytetty ruisku 20 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Potilaskortti aikuisille / Patient card for adults / Patientkort för vuxna
Potilaskortti lapsille / Patient card for children / Patientkort för barn
Vaikuttavat aineet ja niiden määrät
Yksi esitäytetty 0,2 ml:n kerta-annosruisku sisältää 20 mg adalimumabia.
Adalimumabi on rekombinantti ihmisen monoklonaalinen vasta-aine, joka on tuotettu kiinanhamsterin munasarjasoluissa (CHO).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio).
Kliiniset tiedot
Käyttöaiheet
Idiopaattinen juveniili artriitti
Idiopaattinen juveniili polyartriitti
Humira on tarkoitettu käytettäväksi aktiivisen idiopaattisen juveniili polyartriitin hoitoon yhdessä metotreksaatin kanssa 2 vuoden iästä alkaen, kun yhdellä tai useammalla DMARD-lääkkeellä ei ole saatu riittävää vastetta. Humiraa voidaan antaa myös yksinään, jos potilas ei siedä metotreksaattia tai metotreksaattihoidon jatkaminen ei ole tarkoituksenmukaista (monoterapian teho, ks. kohta Farmakodynamiikka). Humiraa ei ole tutkittu alle 2-vuotiailla potilailla.
Entesiitteihin liittyvä artriitti
Humira on tarkoitettu aktiivisen entesiitteihin liittyvän artriitin hoitoon 6 vuoden iästä alkaen, kun tavanomaisilla hoidoilla ei ole saatu riittävää vastetta tai ne ovat olleet huonosti siedettyjä (ks. kohta Farmakodynamiikka).
Läiskäpsoriaasi lapsilla
Humira on tarkoitettu vaikean, kroonisen läiskäpsoriaasin hoitoon lapsille ja nuoreille 4 vuoden iästä alkaen, kun paikallishoidolla ja valohoidolla ei ole saatu riittävää vastetta, tai ne eivät sovellu.
Crohnin tauti lapsilla
Humira on tarkoitettu keskivaikean tai vaikean, aktiivisen Crohnin taudin hoitoon lapsille 6 vuoden iästä alkaen, kun tavanomaisilla hoidoilla (mm. primaarinen ravitsemushoito ja kortikosteroidi ja/tai immunomodulantti) ei ole saatu riittävää vastetta tai ne ovat olleet huonosti siedettyjä tai kyseiset hoidot ovat vasta-aiheisia.
Pediatrinen uveiitti
Humira on tarkoitettu pediatrisen, kroonisen ei-infektioperäisen anteriorisen uveiitin hoitoon 2 vuoden iästä alkaen, kun tavanomaiselle hoidolle ei ole saatu riittävää vastetta tai se on ollut huonosti siedettyä, tai se ei ole tarkoituksenmukaista.
Ehto
Hoito tulee toteuttaa indikaation mukaiseen hoitoon perehtyneen lääkärin aloittamana ja valvonnassa. Hoitoa saaville potilaille tulee antaa erityinen potilaskortti.
Annostus ja antotapa
Humira-hoito tulee toteuttaa indikaation mukaisten sairauksien diagnosointiin ja hoitoon perehtyneen lääkärin aloittamana ja valvonnassa. Silmätautien erikoislääkäreitä kehotetaan konsultoimaan asianmukaista erikoislääkäriä ennen Humira-hoidon aloitusta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Humira-hoitoa saaville potilaille tulee antaa Potilaskortti.
Kun potilas hallitsee pistämistekniikan kunnolla, hän voi pistää Humira-annoksensa itse, jos lääkäri pitää tätä soveliaana ja seuraa tarvittaessa potilaan tilaa.
Muut samanaikaiset hoidot (esim. kortikosteroidit ja/tai immunomoduloivat hoidot) tulee optimoida Humira-hoidon aikana.
Annostus
Pediatriset potilaat
Idiopaattinen juveniili artriitti
Idiopaattinen juveniili polyartriitti 2 vuoden iästä alkaen
Idiopaattista juveniilia polyartriittia sairastavien Humiran suositeltu kerta-annos 2 vuoden iästä alkaen lasketaan potilaan painon perusteella (taulukko 1). Humiraa annostellaan joka toinen viikko injektiona ihon alle.
Taulukko 1. Humira-annos idiopaattista juveniilia polyartriittia sairastaville potilaille
Potilaan paino | Annos |
10 kg – < 30 kg | 20 mg joka toinen viikko |
≥ 30 kg | 40 mg joka toinen viikko |
Saatavilla olevien tietojen mukaan kliininen vaste saavutetaan yleensä 12 hoitoviikossa. Jos potilas ei saavuta vastetta tämän ajan kuluessa, hoidon jatkamista on harkittava tarkoin.
Ei ole asianmukaista käyttää Humiraa alle 2 vuoden ikäisille tämän käyttöaiheen hoidossa.
Humiraa voi olla saatavilla myös muita vahvuuksia ja/tai annostelumuotoja riippuen yksilöllisestä hoidon tarpeesta.
Entesiitteihin liittyvä artriitti
Entesiitteihin liittyvää artriittia sairastavien Humiran suositeltu kerta-annos 6 vuoden iästä alkaen lasketaan potilaan painon perusteella (taulukko 2). Humiraa annostellaan joka toinen viikko injektiona ihon alle.
Taulukko 2. Humira-annos entesiitteihin liittyvää artriittia sairastaville potilaille
Potilaan paino | Annos |
15 kg – < 30 kg | 20 mg joka toinen viikko |
≥ 30 kg | 40 mg joka toinen viikko |
Humiraa ei ole tutkittu entesiitteihin liittyvää artriittia sairastavilla alle 6-vuotiailla potilailla.
Humiraa voi olla saatavilla myös muita vahvuuksia ja/tai annostelumuotoja riippuen yksilöllisestä hoidon tarpeesta.
Läiskäpsoriaasi lapsilla
Läiskäpsoriaasia sairastavien 4–17-vuotiaiden potilaiden suositeltu kerta-annos lasketaan painon perusteella (taulukko 3). Humira annostellaan injektiona ihon alle.
Taulukko 3. Humira-annos läiskäpsoriaasia sairastaville lapsipotilaille
Potilaan paino | Annos |
15 kg – < 30 kg | Aloitusannos 20 mg, jonka jälkeen 20 mg joka toinen viikko alkaen viikon kuluttua aloitusannoksesta. |
≥ 30 kg | Aloitusannos 40 mg, jonka jälkeen 40 mg joka toinen viikko alkaen viikon kuluttua aloitusannoksesta. |
Jos potilas ei saavuta vastetta 16 viikon kuluessa, hoidon jatkamista on harkittava tarkoin.
Jos uusintahoito Humiralla on aiheellista, noudatetaan edellä annettuja ohjeita annoksesta ja hoidon kestosta.
Humiran turvallisuutta on arvioitu pediatrisilla läiskäpsoriaasipotilailla keskimäärin 13 kuukauden ajan.
Ei ole asianmukaista käyttää Humiraa alle 4 vuoden ikäisille lapsille tämän käyttöaiheen hoidossa.
Humiraa voi olla saatavilla myös muita vahvuuksia ja/tai annostelumuotoja riippuen yksilöllisestä hoidon tarpeesta.
Crohnin tauti lapsilla
Crohnin tautia sairastavien 6‑17-vuotiaiden potilaiden suositeltu kerta-annos laskteaan painon perusteella (taulukko 4). Humira annostellaan injektiona ihon alle.
Taulukko 4. Humira-annos Crohnin tautia sairastavilla pediatrisilla potilailla
Potilaan paino | Aloitusannos | Ylläpitoannos alkaen viikolta 4 |
< 40 kg |
Jos nopeampi hoitovaste on tarpeen, voidaan antaa
On kuitenkin muistettava, että suurempia aloitusannoksia käytettäessä haittatapahtumariski voi olla suurempi. | 20 mg joka toinen viikko |
≥ 40 kg |
Jos nopeampi hoitovaste on tarpeen, voidaan antaa
On kuitenkin muistettava, että suurempia aloitusannoksia käytettäessä haittatapahtumariski voi olla suurempi. | 40 mg joka toinen viikko |
Potilaat, joilla vaste on riittämätön, saattavat hyötyä annostuksen suurentamisesta:
- < 40 kg: 20 mg joka viikko
- ≥ 40 kg: 40 mg joka viikko tai 80 mg joka toinen viikko.
Hoidon jatkamista on harkittava tarkoin, jos potilas ei saavuta vastetta viikkoon 12 mennessä.
Ei ole asianmukaista käyttää Humiraa alle 6 vuoden ikäisille tämän käyttöaiheen hoidossa.
Humiraa voi olla saatavilla myös muita vahvuuksia ja/tai annostelumuotoja riippuen yksilöllisestä hoidon tarpeesta.
Uveiitti lapsilla
Uveiittia sairastavien lapsipotilaiden suositeltu kerta-annos 2 vuoden iästä alkaen lasketaan painon perusteella (taulukko 5). Humira annostellaan injektiona ihon alle.
Ei ole olemassa kokemuksia lasten uveiitin hoidosta Humiralla ilman samanaikaista metotreksaattihoitoa.
Taulukko 5. Humira-annos uveiittia sairastavilla pediatrisilla potilailla
Potilaan paino | Annos |
< 30 kg | 20 mg joka toinen viikko yhdessä metotreksaatin kanssa |
≥ 30 kg | 40 mg joka toinen viikko yhdessä metotreksaatin kanssa |
Kun Humira-hoito aloitetaan, voidaan viikkoa ennen ylläpitohoidon aloitusta antaa 40 mg latausannos < 30 kg potilaille tai 80 mg latausannos ≥ 30 kg potilaille. Kliinistä tutkimustietoa Humira-latausannoksen käytöstä alle 6-vuotiailla lapsilla ei ole (ks. kohta Farmakokinetiikka).
Ei ole asianmukaista käyttää Humiraa alle 2 vuoden ikäisille tämän käyttöaiheen hoidossa.
Pitkäaikaisen hoidon hyödyt ja riskit on suositeltavaa arvioida vuosittain (ks. kohta Farmakodynamiikka).
Humiraa voi olla saatavilla myös muita vahvuuksia ja/tai annostelumuotoja riippuen yksilöllisestä hoidon tarpeesta.
Munuaisten ja/tai maksan vajaatoiminta
Humiraa ei ole tutkittu näissä potilasryhmissä. Annossuosituksia ei voida antaa.
Antotapa
Humira pistetään ihon alle (subkutaanisesti). Katso käyttöohjeet pakkausselosteesta.
Humiraa voi olla saatavilla myös muita vahvuuksia ja annostelumuotoja.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Aktiivinen tuberkuloosi tai jokin muu vakava infektio, kuten sepsis, sekä opportunistiset infektiot (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Keskivaikea tai vaikea sydämen vajaatoiminta (NYHA III/IV) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun lääkevalmisteen nimi ja eränumero tulisi kirjata ylös selkeästi.
Infektiot
Potilaat, jotka käyttävät TNF-antagonisteja ovat herkempiä vakaville infektioille. Heikentynyt keuhkojen toiminta voi lisätä infektioiden kehittymisen riskiä. Potilaita tulee siksi seurata huolellisesti infektioiden, mm. tuberkuloosin, varalta ennen Humira-hoidon aloittamista, hoidon aikana ja sen jälkeen. Koska adalimumabin eliminoituminen voi viedä neljä kuukautta, seurantaa tulee jatkaa siihen saakka.
Humira-hoitoa ei tule aloittaa potilailla, joilla on aktiivinen infektio (krooninen tai paikallinen), ennen kuin infektio on hallinnassa. Potilailla, jotka ovat altistuneet tuberkuloosille sekä potilailla, jotka ovat matkustaneet korkean tuberkuloosin tai endeemisen mykoosin (kuten histoplasmoosi, koksidioidomykoosi tai blastomykoosi) riskialueilla, Humira-hoidon hyödyt ja riskit on huomioitava ennen hoidon aloittamista (ks. Muut opportunistiset infektiot).
Potilaita, joille kehittyy uusi infektio Humira-hoidon aikana, tulee seurata huolellisesti ja heille on tehtävä täydellinen diagnostinen arvio. Jos potilaalle kehittyy uusi, vakava infektio tai sepsis, tarvittava antimikrobinen tai antimykoottinen hoito on aloitettava ja Humiran antaminen on keskeytettävä, kunnes infektio saadaan hallintaan. Lääkärien tulee noudattaa varovaisuutta harkitessaan Humiran käyttöä potilailla, joilla on ollut toistuvia infektioita tai perussairaus, joka voi altistaa infektioille mukaan lukien samanaikainen immunosuppressiivisen lääkityksen käyttö.
Vakavat infektiot
Vakavia infektioita, mukaan lukien sepsis, joka johtuu bakteereista, mykobakteereista, invasiivisista sieni-infektioista, parasiiteista, viruksista tai muista opportunistisista infektioista kuten listerioosista, legionelloosista ja pneumokystoosista, on raportoitu Humiraa käyttävillä potilailla.
Muita vakavia infektioita, joita on ilmennyt kliinisissä tutkimuksissa, sisältävät pneumonian, pyelonefriitin, septisen niveltulehduksen ja sepsiksen kaltaisia infektioita. Infektioihin liittyvää sairaalahoitoa tai kuolemaan johtavia tapauksia on raportoitu.
Tuberkuloosi
Humira-hoitoa saaneilla potilailla on raportoitu tuberkuloosia, mukaan lukien tuberkuloosin reaktivaatiota ja uusia tapauksia. Raportit sisälsivät sekä keuhko- että keuhkojen ulkopuolista (eli disseminoitunut) tuberkuloosia.
Ennen Humira-hoidon aloittamista tulee kaikki potilaat tutkia sekä aktiivisen että inaktiivisen (”latentin”) tuberkuloosin varalta. Tähän tutkimukseen tulee kuulua huolellinen potilaan arviointi, jotta saadaan selville potilaan aikaisemmin sairastama tuberkuloosi ja aiemmat kontaktit aktiivista tuberkuloosia sairastavan henkilön kanssa sekä aikaisemmat ja/tai käynnissä olevat immunosuppressiiviset hoidot. Asianmukaisia seulontatestejä (tuberkuliinikoe ja keuhkoröntgen) voidaan joutua tekemään kaikille potilaille (paikallisten vaatimusten mukaisesti). Nämä kokeet ja niiden tulokset on suositeltavaa merkitä Potilaskorttiin. Lääkäriä muistutetaan, että tuberkuliinikokeessa saatetaan saada väärä negatiivinen tulos etenkin, jos kyseessä on vaikeasti sairas tai immuunivajavuudesta kärsivä potilas.
Jos todetaan aktiivinen tuberkuloosi, Humira-hoitoa ei saa aloittaa (ks. kohta Vasta-aiheet).
Alla kuvatuissa tilanteissa Humira-hoidon hyötyjen ja riskien suhdetta on harkittava hyvin huolellisesti.
Jos potilaalla epäillään latenttia tuberkuloosia, on tuberkuloosin hoitoon perehtynyttä lääkäriä konsultoitava.
Jos potilaalla todetaan latentti tuberkuloosi, sen hoito profylaktisella tuberkuloosihoidolla on käynnistettävä ennen Humira-hoidon aloittamista paikallisten suositusten mukaisesti.
Profylaktista tuberkuloosihoitoa on harkittava ennen Humira-hoidon aloittamista myös siinä tapauksessa, että potilaalla on useita tai merkittäviä tuberkuloosin riskitekijöitä, mutta latentin tuberkuloosin osoituskoe on negatiivinen, ja potilaalla, jolla on aiemmin ollut latentti tai aktiivinen tuberkuloosi, eikä hoidon asianmukaisesta toteutuksesta ole varmuutta.
Humira-hoitoa saaneilla potilailla on ilmennyt tuberkuloosin reaktivaatiotapauksia profylaktisesta hoidosta huolimatta. Joillekin potilaille, joita on aiemmin hoidettu menestyksekkäästi aktiivisen tuberkuloosin vuoksi, on uudelleen kehittynyt tuberkuloosi Humira-hoidon aikana.
Potilaita tulee myös kehottaa kääntymään lääkärin puoleen, jos heillä esiintyy tuberkuloosi-infektioon viittaavia merkkejä/oireita (esim. sitkeää yskää, laihtumista/painon laskua, lämpöilyä, voimattomuutta) Humira-hoidon aikana tai sen jälkeen.
Muut opportunistiset infektiot
Humiraa saavilla potilailla on tavattu opportunistisia infektioita kuten invasiivisia sieni-infektioita. TNF-antagonisteja saavilla potilailla näitä infektioita ei ole välttämättä tunnistettu ja tämä on johtanut asianmukaisen hoidon viivästymiseen ja joskus kuolemaan.
Jos potilaalle kehittyy sellaisia merkkejä ja oireita kuten kuume, huonovointisuus, painonlasku, hikoilu, yskä, hengenahdistus, ja/tai keuhkoinfiltraatteja tai muita vakavia systeemisiä sairauksia, liittyi niihin sokki tai ei, invasiivista sieni-infektiota tulisi epäillä ja Humiran anto lopettaa viipymättä. Diagnoosi ja empiirisen antifungaalisen hoidon aloitus tulisi tehdä yhteistyössä lääkärin kanssa, jolla on kokemusta invasiivisten sieni-infektioiden hoidosta.
B-hepatiitin uudelleenaktivoituminen
B-hepatiittiviruksen kroonisilla kantajilla (eli pinta-antigeeni-positiivisilla) on todettu B-hepatiitin uudelleenaktivoitumista TNF-salpaajahoidon, myös Humira-hoidon, aikana. Jotkin tapaukset ovat johtaneet kuolemaan. Potilaat on tutkittava HBV-infektion varalta ennen Humira-hoidon aloittamista. Jos potilas osottautuu HBV-tartunnan kantajaksi, suositellaan hepatiitti B-infektion hoitoon perehtyneen lääkärin konsultoimista.
Jos HBV-kantaja tarvitsee ehdottomasti Humira-hoitoa, häntä on seurattava tarkasti aktiiviseen HBV-infektioon viittaavien merkkien ja oireiden varalta koko hoitojakson ajan ja useita kuukausia hoidon päättymisen jälkeen. TNF-salpaajahoitoa saavien HBV-kantajien hoitamisesta samanaikaisesti viruslääkkeillä B-hepatiitin uudelleenaktivoitumisen estämiseksi ei ole riittävästi tietoa. Jos potilaan B-hepatiitti aktivoituu uudelleen, on Humira-hoito lopetettava ja tehokas viruslääkitys ja asianmukainen tukihoito aloitettava.
Neurologiset tapahtumat
TNF-salpaajiin, kuten Humiraan, on harvinaisissa tapauksissa liittynyt keskushermoston demyelinoivan sairauden (mukaan lukien MS-tauti ja optikusneuriitti) ja ääreishermoston demyelinoivan sairauden (mukaan lukien Guillain–Barrén oireyhtymä) kliinisten oireiden ja/tai röntgenlöydösten ilmeneminen tai paheneminen. Varovaisuutta tulee siis noudattaa määrättäessä Humiraa potilaille, joilla on joko aiemmin tai hiljattain alkanut keskus- tai ääreishermoston myeliinikatosairaus. Humira-hoidon keskeytystä on harkittava, jos potilaalle kehittyy jokin näistä sairauksista. Intermediaarisen uveiitin ja keskushermoston demyelinoivien sairauksien välillä on tunnettu yhteys. Potilaille, joilla on ei-infektioperäinen intermediaarinen uveiitti, on ennen Humira-hoidon aloitusta sekä säännöllisesti hoidon aikana tehtävä neurologinen arvio, jossa arvioidaan aiemmin alkaneita tai kehittymässä olevia keskushermoston demyelinoivia sairauksia.
Allergiset reaktiot
Kliinisissä tutkimuksissa Humira-hoitoon liittyvät vakavat allergiset reaktiot olivat harvinaisia. Humiraan liitetyt lievät allergiset reaktiot olivat kliinisissä tutkimuksissa melko harvinaisia. Humiran annon yhteydessä on raportoitu vakavia allergisia reaktioita, mukaan lukien anafylaksia. Jos anafylaktinen tai muu vakava allerginen reaktio ilmenee, tulee Humiran antaminen keskeyttää välittömästi ja aloittaa asianmukainen hoito.
Immunosuppressio
Tutkimuksessa, jossa 64 nivelreumapotilasta sai Humira-hoitoa, ei havaittu viivästyneen yliherkkyysreaktion heikkenemistä, immunoglobuliinipitoisuuden pienenemistä eikä muutoksia efektori T- tai B-solujen, luonnollisten tappajasolujen, monosyyttien/makrofagien eikä neutrofiilien määrässä.
Maligniteetit ja lymfoproliferatiiviset häiriöt
TNF-antagonisteilla tehtyjen kliinisten tutkimusten kontrolloiduissa osioissa TNF-antagonistia saaneilla potilailla on havaittu enemmän maligniteetteja, mukaan lukien lymfoomia, kuin verrokeilla. Niitä esiintyi kuitenkin harvoin. Leukemiaa on raportoitu markkinoilletulon jälkeen potilailla, joita hoidettiin TNF-antagonisteilla. Lymfooman ja leukemian taustariski on suurentunut nivelreumapotilailla, joilla on hyvin aktiivinen, pitkään kestänyt tulehduksellinen tauti, mikä vaikeuttaa riskin arviointia. Tämänhetkisten tietojen perusteella lymfoomien, leukemian ja muiden maligniteettien kehittymisriskiä ei voida sulkea pois TNF-antagonistihoitoa saavien potilaiden kohdalla.
Maligniteetteja, myös kuolemaan johtaneita, on ilmoitettu lapsilla, nuorilla ja nuorilla aikuisilla (alle 22-vuotiailla), jotka ovat saaneet TNF-antagonistihoitoa (hoidon aloitusikä ≤ 18 vuotta), markkinoilletulon jälkeinen adalimumabihoito mukaan lukien. Noin puolet tapauksista oli lymfoomia. Muut tapaukset olivat erilaisia maligniteetteja, ja mukana oli harvinaisia, yleensä immunosuppressioon liittyviä muotoja. Maligniteettiriskiä ei voida sulkea pois lapsilla ja nuorilla, jotka saavat TNF-antagonistihoitoa.
Adalimumabilla hoidetuilla potilailla on markkinoilletulon jälkeen raportoitu harvoin hepatospleenistä T-solulymfoomaa. Tämä harvinainen T-solulymfooma on taudinkuvaltaan aggressiivinen ja tavallisesti fataali. Osa Humira-hoidon aikana ilmenneistä hepatospleenisistä T-solulymfoomista on ilmennyt nuorilla aikuisilla, joilla on hoidettu tulehduksellista suolistotautia samanaikaisesti atsatiopriinilla tai 6-merkaptopuriinilla. Atsatiopriinin tai 6-merkaptopuriinin ja Humiran yhdistelmähoitoon liittyvä mahdollinen riski on huomioitava. Hepatospleenisen T-solulymfooman kehittymisen riskiä ei voida poissulkea potilailla, joita hoidetaan Humiralla (ks. kohta Haittavaikutukset).
Tutkimuksia ei ole tehty potilailla, joilla on ollut jokin maligniteetti ennen Humira-hoitoa, tai joilla Humira-hoitoa olisi jatkettu maligniteetin kehittymisen jälkeen. Siksi erityistä varovaisuutta tulee noudattaa harkittaessa Humira-hoitoa näille potilaille (ks. kohta Haittavaikutukset).
Kaikki potilaat tulee tutkia muiden ihosyöpien kuin melanooman varalta ennen Humira-hoitoa ja sen aikana. Tämä koskee etenkin potilaita, jotka ovat käyttäneet runsaasti immunosuppressiivisia hoitoja, sekä PUVA-hoitoa saaneita psoriaasipotilaita. TNF-salpaajia, kuten adalimumabia, saaneilla potilailla on ilmoitettu esiintyneen myös melanoomaa ja merkelinsolukarsinoomaa (ks. kohta Haittavaikutukset).
Eksploratiivisessa kliinisessä tutkimuksessa, jossa arvioitiin erään toisen TNF-antagonistin, infliksimabin, käyttöä potilailla, joilla oli keskivaikea tai vaikea keuhkoahtaumatauti, infliksimabihoitoa saaneilla potilailla ilmoitettiin enemmän maligniteetteja etenkin keuhkojen, pään ja kaulan alueella kuin verrokkipotilailla. Kaikki potilaat olivat aiemmin tupakoineet runsaasti. Tämän vuoksi varovaisuutta on noudatettava, kun keuhkoahtaumatautipotilaita hoidetaan millä tahansa TNF-antagonistilla, samoin kuin potilailla, joiden maligniteettiriski on suurentunut runsaan tupakoinnin vuoksi.
Tämänhetkisen tiedon perusteella ei tiedetä vaikuttaako adalimumabihoito dysplasian tai paksusuolen syövän kehittymisen riskiin. Kaikki ulseratiivista koliittia sairastavat potilaat, joilla on lisääntynyt riski dysplasiaan tai paksusuolen syöpään (esimerkiksi potilaat, joilla on pitkäaikainen ulseratiivinen koliitti tai primaarinen sklerosoiva kolangiitti), tai potilaat, joilla on aiemmin ollut dysplasia tai paksusuolen syöpä, tulee seuloa dysplasian varalta säännöllisin väliajoin ennen hoidon aloitusta ja hoidon aikana. Seulonnan tulisi sisältää kolonoskopia ja biopsia paikallisten suositusten mukaisesti.
Verenkuvamuutokset
Pansytopeniaa, mukaan lukien aplastista anemiaa, on ilmoitettu harvinaisissa tapauksissa TNF-salpaajien käytön yhteydessä. Hematologiseen järjestelmään kohdistuvia haittavaikutuksia, kuten lääketieteellisesti merkitsevää sytopeniaa (esim. trombosytopenia, leukopenia), on ilmoitettu Humira-hoidon yhteydessä. Kaikkia potilaita tulee kehottaa hakeutumaan välittömästi lääkärin hoitoon, jos heille kehittyy Humira-hoidon aikana verenkuvamuutoksiin viittaavia merkkejä ja oireita (esim. sitkeä kuume, mustelmanmuodostus, verenvuoto, kalpeus). Humira-hoidon keskeyttämistä tulee harkita, jos potilaalla todetaan merkitseviä hematologisia poikkeavuuksia.
Rokotukset
Kun 226 aikuista nivelreumapotilasta sai adalimumabi- tai lumelääkehoitoa, havaitut vasta-ainevasteet tavanomaiselle 23-valentille pneumokokkirokotteelle ja trivalentille influenssavirusrokotteelle olivat samankaltaiset. Elävien rokotteiden aiheuttamista infektioiden sekundaarisista siirtymisistä ei ole tietoa Humira-hoitoa saaneilla potilailla.
Kaikkien lapsipotilaiden kohdalla on suositeltavaa varmistaa mahdollisuuksien mukaan, että potilas saa kaikki ajankohtaisten rokotussuositusten mukaiset rokotukset ennen Humira-hoidon aloittamista.
Potilaille voidaan antaa rokotuksia Humira-hoidon aikana eläviä rokotteita lukuun ottamatta. Elävien rokotteiden (esim. BCG-rokotteen) antamista vauvoille, jotka ovat altistuneet adalimumabille kohdussa, ei suositella 5 kuukauteen äidin viimeisestä raskaudenaikaisesta adalimumabi-injektiosta.
Kongestiivinen sydämen vajaatoiminta
Erästä toista TNF-salpaajaa koskevassa kliinisessä tutkimuksessa havaittiin kongestiivisen sydämen vajaatoiminnan pahenemista ja kongestiivisesta sydämen vajaatoiminnasta johtuvan kuolleisuuden lisääntymistä. Myös Humira-hoidon aikana on raportoitu kongestiivisen sydämen vajaatoiminnan pahenemista. Humiran käytössä on noudatettava varovaisuutta potilailla, joilla on lievä sydämen vajaatoiminta (NYHA I/II). Keskivaikea ja vaikea sydämen vajaatoiminta ovat Humiran käytön vasta-aiheita (ks. kohta Vasta-aiheet). Humira-hoito tulee keskeyttää, jos potilaalle tulee kongestiivisen sydämen vajaatoiminnan oireita tai jos oireet pahenevat.
Autoimmuuniprosessit
Humira-hoito voi johtaa autovasta-aineiden muodostukseen. Pitkäaikaisen Humira-hoidon vaikutusta autoimmuunisairauksien kehittymiseen ei tunneta. Jos potilaalle kehittyy lupuksen kaltaiseen oireyhtymään viittaavia oireita Humira-hoidon jälkeen ja hänellä todetaan vasta-aineita kaksijuosteiselle DNA:lle, Humira-hoitoa ei tule jatkaa (ks. kohta Haittavaikutukset).
Samanaikainen biologisten DMARDien tai TNF-salpaajien antaminen
Kliinisissä tutkimuksissa anakinran ja toisen TNF-salpaajan, etanerseptin, yhteiskäytössä on todettu vakavia infektioita, eikä yhteiskäytöstä ollut lisääntynyttä kliinistä hyötyä verrattuna etanerseptin antamiseen yksinään. Etanerseptin ja anakinran yhteiskäytössä havaittujen haittatapahtumien luonteen vuoksi samankaltainen toksisuus on mahdollista myös anakinran ja muiden TNF-salpaajien yhteiskäytössä. Siksi adalimumabin ja anakinran yhteiskäyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Adalimumabin ja muiden biologisten DMARDien (kuten anakinra ja abatasepti) tai muiden TNF-salpaajien samanaikaista antoa ei suositella perustuen infektioiden mahdollisesti lisääntyneeseen riskiin, mukaan lukien vakavat infektiot ja muut farmakologiset yhteisvaikutukset (ks. kohta Yhteisvaikutukset).
Leikkaus
Turvallisuustiedot Humiralla hoidettujen potilaiden leikkaushoidoista ovat rajalliset. Leikkausta suunniteltaessa on otettava huomioon adalimumabin pitkä puoliintumisaika. Leikkaushoitoa vaatineen Humira-potilaan infektioita on tarkkaan seurattava ja asianmukaisiin toimenpiteisiin on tarvittaessa ryhdyttävä. Turvallisuustiedot artroplastiahoitoa vaativien Humira-potilaiden hoidosta ovat rajalliset.
Ohutsuolitukos
Jos Crohnin tauti ei reagoi hoitoon, potilaalla saattaa olla kiinteä fibroottinen striktuura, joka saattaa vaatia leikkaushoitoa. Nykyisten tietojen perusteella Humira ei pahenna striktuuroita eikä aiheuta niitä.
Iäkkäät potilaat
Vakavien infektioiden esiintyvyys oli korkeampi yli 65-vuotiailla potilailla (3,7 %), joita hoidettiin Humiralla, kuin alle 65-vuotiailla (1,5 %). Jotkin näistä infektioista olivat fataaleja. Vanhuksia hoidettaessa tulee erityisesti ottaa huomioon infektioriski.
Pediatriset potilaat
Katso Rokotukset yllä.
Yhteisvaikutukset
Humiraa on tutkittu nivelreumaa, idiopaattista juveniili polyartriittia ja nivelpsoriaasia sairastavilla potilailla sekä yksinään että metotreksaattiin yhdistettynä. Vasta-ainemuodostus oli vähäisempää metotreksaatin kanssa annettuna kuin yksinään. Humiran käyttö ilman metotreksaattia lisäsi vasta-ainemuodostusta, tehosti adalimumabin puhdistumaa ja heikensi sen tehoa (ks. kohta Farmakodynamiikka).
Humiran ja anakinran yhdistämistä ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet "Samanaikainen biologisten DMARDien tai TNF-salpaajien antaminen").
Humiran ja abataseptin yhdistämistä ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet "Samanaikainen biologisten DMARDien tai TNF-salpaajien antaminen").
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on harkittava riittävää raskauden ehkäisyä Humira-hoidon aikana ja vähintään viiden kuukauden ajan viimeisen Humira-annoksen jälkeen.
Raskaus
Laajat tiedot eivät viittaa epämuodostumien lisääntymiseen vastasyntyneillä. Tiedot kerättiin prospektiivisesti noin 2 100 raskaudesta, joiden aikana oli tapahtunut adalimumabialtistus ja jotka olivat johtaneet elävän lapsen syntymään tiedossa olevin lopputuloksin (mukaan lukien tiedot yli 1 500:sta ensimmäisen raskauskolmanneksen aikana tapahtuneesta altistuksesta).
Prospektiivisessa kohorttirekisterissä oli mukana 257 naista, joilla oli nivelreuma tai Crohnin tauti ja jotka saivat adalimumabia vähintään ensimmäisellä raskauskolmanneksella, ja 120 naista, joilla oli nivelreuma tai Crohnin tauti ja jotka eivät saaneet adalimumabia. Ensisijainen päätetapahtuma oli merkittävien synnynnäisten kehityshäiriöiden esiintyvyys syntymähetkellä. Vähintään yhden elävän, merkittävästi kehityshäiriöisen lapsen syntymään johtaneiden raskauksien osuus oli adalimumabihoitoa saaneilla nivelreumaa sairastavilla naisilla 6/69 (8,7 %) ja hoitamattomilla nivelreumaa sairastavilla naisilla 5/74 (6,8 %) (korjaamaton vetosuhde 1,31; 95 % luottamusväli [lv] 0,38–4,52). Adalimumabihoitoa saaneilla Crohnin tautia sairastavilla naisilla vastaava osuus oli 16/152 (10,5 %) ja hoitamattomilla Crohnin tautia sairastavilla naisilla 3/32 (9,4 %) (korjaamaton vetosuhde 1,14; 95 % lv 0,31–4,16). Korjattu vetosuhde (lähtötilanteen eroja koskeva) oli 1,10 (95 % lv 0,45–2,73), kun nivelreumaa ja Crohnin tautia koskevat tiedot yhdistettiin. Selviä eroja adalimumabihoitoa saaneiden ja hoitamattomien naisten välillä ei todettu toissijaisten päätetapahtumien kohdalla. Näitä olivat keskenmenot, vähäiset synnynnäiset kehityshäiriöt, ennenaikaiset synnytykset, syntymäkoko ja vakavat infektiot tai opportunistiset infektiot. Kohtukuolemia ja maligniteetteja ei ilmoitettu. Rekisterin metodologiset rajoitukset, mm. pieni otoskoko ja satunnaistamaton tutkimusasetelma, saattavat vaikuttaa tietojen tulkintaan.
Apinoilla tehdyssä sikiökehityksen toksisuustutkimuksessa ei havaittu merkkejä emoon eikä alkioon kohdistuvasta toksisuudesta eikä teratogeenisuudesta. Adalimumabin postnataalitoksisista vaikutuksista ei ole prekliinistä tietoa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Koska adalimumabi estää TNFα:aa, sen antaminen raskausaikana voi vaikuttaa vastasyntyneen normaaliin immuunivasteeseen. Adalimumabia saa käyttää raskausaikana vain, jos se on selvästi tarpeellista.
Adalimumabi voi läpäistä adalimumabihoitoa saavan naisen istukan ja päätyä sikiön verenkiertoon raskauden aikana. Tästä johtuen näillä imeväisillä voi olla syntymän jälkeen kohonnut infektioriski. Elävien rokotteiden (esim. BCG-rokotteen) antamista imeväisille, jotka ovat altistuneet adalimumabille in utero, ei suositella 5 kuukauteen äidin viimeisestä raskaudenaikaisesta adalimumabi-injektiosta.
Imetys
Julkaistusta kirjallisuudesta saadut suppeat tiedot viittaavat siihen, että adalimumabi erittyy hyvin pieninä pitoisuuksina ihmisen rintamaitoon ja sen pitoisuus ihmisen rintamaidossa on 0,1–1 % äidin seerumin adalimumabipitoisuudesta. Suun kautta annettuna immunoglobuliini G ‑proteiinit hajoavat suolistossa proteolyysin kautta ja niiden biologinen hyötyosuus on pieni. Ei ole odotettavissa vaikutuksia vastasyntyneisiin/imeväisiin. Näin ollen Humiraa voi käyttää imetyksen aikana.
Hedelmällisyys
Prekliinistä tietoa adalimumabin vaikutuksista hedelmällisyyteen ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Humira-valmisteella saattaa olla vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn. Humiran ottamisen jälkeen saattaa esiintyä kiertohuimausta ja näön heikentymistä (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Humiraa on tutkittu tärkeimmissä kontrolloiduissa ja avoimissa tutkimuksissa 9 506 potilaalla jopa 60 kuukauden ajan tai yli. Näihin tutkimuksiin osallistui nivelreumapotilaita, joiden tauti oli kestänyt lyhyen tai pitkän aikaa, sekä idiopaattista juveniilia artriittia (idiopaattista juveniilia polyartriittia ja entesiitteihin liittyvää artriittia), aksiaalista spondylartriittia (selkärankareumaa ja aksiaalista spondylartriittia (ilman radiografista näyttöä selkärankareumasta)), nivelpsoriaasia, Crohnin tautia, ulseratiivista koliittia, psoriaasia, hidradenitis suppurativaa ja uveiittia sairastavia potilaita. Tärkeimmissä kontrolloiduissa tutkimuksissa 6 089 potilasta sai Humiraa ja 3 801 potilasta sai plaseboa tai vaikuttavaa vertailuvalmistetta kontrolloidun vaiheen aikana.
Tärkeimmissä kontrolloiduissa kaksoissokkotutkimuksissa hoidon keskeytti haittatapahtumien vuoksi 5,9 % Humiraa ja 5,4 % vertailuhoitoa saaneista potilaista.
Yleisimmin ilmoitettuja haittavaikutuksia ovat infektiot (esim. nenänielutulehdus, ylähengitystieinfektiot ja sinuiitti), pistoskohdan reaktiot (punoitus, kutina, verenvuoto, kipu tai turvotus), päänsärky ja tuki- ja liikuntaelimistön kipu.
Humira-hoidon yhteydessä on ilmoitettu vakavia haittavaikutuksia. TNF-antagonistit, kuten Humira, vaikuttavat immuunijärjestelmään, ja niiden käyttö voi vaikuttaa elimistön kykyyn torjua infektioita ja syöpää. Humiran käytön yhteydessä on ilmoitettu kuolemaan johtaneita ja henkeä uhanneita infektioita (mm. sepsistä, opportunistisia infektioita ja tuberkuloosia), HBV-infektion reaktivaatiota ja eri syöpätauteja (mm. leukemiaa, lymfoomia ja hepatospleenistä T-solulymfoomaa).
Myös vakavia hematologisia, neurologisia ja autoimmuunireaktioita on ilmoitettu. Näistä pansytopeniaa, aplastista anemiaa ja keskus- ja ääreishermoston myeliinikatotapauksia on ilmoitettu harvoin. Myös lupusta, lupuksen kaltaisia oireistoja ja Stevens–Johnsonin oireyhtymää on ilmoitettu.
Pediatriset potilaat
Lapsipotilailla todetut haittatapahtumat olivat yleisesti ottaen yleisyydeltään ja luonteeltaan samanlaisia kuin aikuispotilailla todetut haitat.
Haittavaikutustaulukko
Allaolevassa taulukossa 6 on lueteltu kliinisissä tutkimuksissa ja markkinoilletulon jälkeen esiintulleet haittatapahtumat, ja ne on jaoteltu elinryhmittäin ja esiintyvyyden perusteella: hyvin yleiset (≥ 1/10); yleiset (≥ 1/100 ja < 1/10); melko harvinaiset (≥ 1/1 000 ja < 1/100); harvinaiset (≥ 1/10 000 ja < 1/1 000) sekä tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Kunkin yleisyysluokan haittavaikutukset on esitetty vakavuuden mukaisessa järjestyksessä vakavimmasta haittavaikutuksesta alkaen. Eri käyttöaiheiden tiedoista on valittu suurin yleisyysluku. Elinjärjestelmäsarakkeessa oleva tähti (*) tarkoittaa, että kohdissa Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset on lisätietoa aiheesta.
Taulukko 6
Haittavaikutukset
Elinjärjestelmä | Yleisyys | Haittavaikutus |
Infektiot* | Hyvin yleiset | Hengitystieinfektiot (mm. ylä- ja alahengitystieinfektiot, keuhkokuume, sinuiitti, nielutulehdus, nenänielutulehdus ja herpesviruspneumonia) |
Yleiset | Systeemiset infektiot (mm. sepsis, kandidiaasi ja influenssa), suolistoinfektiot (mm. virusperäinen gastroenteriitti), iho- ja pehmytkudosinfektiot (mm. paronykia, selluliitti, märkärupi, nekrotisoiva faskiitti ja vyöruusu), korvatulehdukset, suutulehdukset (mm. herpes simplex, huuliherpes ja hammasinfektiot), sukuelininfektiot (mm. vulvovaginan sieni-infektiot), virtsatieinfektiot (mm. pyelonefriitti), sieni-infektiot, nivelinfektiot | |
Melko harvinaiset | Hermostoinfektiot (mm. virusmeningiitti), opportunistiset infektiot ja tuberkuloosi (mm. koksidioidomykoosi, histoplasmoosi ja Mycobacterium avium ‑infektiot), bakteeriperäiset infektiot, silmäinfektiot, divertikuliitti1) | |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit)* | Yleiset | Ei-melanoomatyyppiset ihosyövät (mm. tyvisolusyöpä ja okasolusyöpä), hyvänlaatuiset kasvaimet |
Melko harvinaiset | Lymfooma**, kiinteät kasvaimet (mm. rintasyöpä, keuhkokasvaimet ja kilpirauhaskasvaimet), melanooma** | |
Harvinaiset | Leukemia1) | |
Tuntematon | Hepatospleeninen T-solu lymfooma1) , merkelinsolukarsinooma (ihon neuroendokriininen karsinooma)1), Kaposin sarkooma | |
Veri ja imukudos* | Hyvin yleiset | Leukopenia (mm. neutropenia ja agranulosytoosi), anemia |
Yleiset | Leukosytoosi, trombosytopenia | |
Melko harvinaiset | Idiopaattinen trombosytopeeninen purppura | |
Harvinaiset | Pansytopenia | |
Immuunijärjestelmä* | Yleiset | Yliherkkyys, allergiat (myös kausiallergiat) |
Melko harvinaiset | Sarkoidoosi1), vaskuliitti | |
Harvinaiset | Anafylaksia1) | |
Aineenvaihdunta ja ravitsemus | Hyvin yleiset | Kohonneet rasva-arvot |
Yleiset | Hypokalemia, kohonneet virtsahappoarvot, poikkeavat veren natriumarvot, hypokalsemia, hyperglykemia, hypofosfatemia, nestehukka | |
Psyykkiset häiriöt | Yleiset | Mielialanvaihtelut (mm. masennus), ahdistuneisuus, unettomuus |
Hermosto* | Hyvin yleiset | Päänsärky |
Yleiset | Parestesiat (mm. hypestesia), migreeni, hermojuuren kompressio | |
Melko harvinaiset | Aivohalvaus1), vapina, neuropatia | |
Harvinaiset | MS-tauti, myeliinikatohäiriöt (esim. optikusneuriitti, Guillain–Barrén -oireyhtymä)1) | |
Silmät | Yleiset | Näköhäiriöt, sidekalvotulehdus, luomitulehdus, silmän turvotus |
Melko harvinaiset | Kaksoiskuvat | |
Kuulo ja tasapainoelin | Yleiset | Kiertohuimaus |
Melko harvinaiset | Kuurous, tinnitus | |
Sydän* | Yleiset | Takykardia |
Melko harvinaiset | Sydänkohtaus1), rytmihäiriöt, kongestiivinen sydämen vajaatoiminta | |
Harvinaiset | Sydämenpysähdys | |
Verisuonisto | Yleiset | Hypertensio, kuumat aallot, hematooma |
Melko harvinaiset | Aortan aneurysma, valtimotukos, tromboflebiitti | |
Hengityselimet, rintakehä ja välikarsina* | Yleiset | Astma, hengenahdistus, yskä |
Melko harvinaiset | Keuhkoembolia1), interstitiaalinen keuhkosairaus, keuhkoahtaumatauti, pneumoniitti, pleuraeffuusio1) | |
Harvinaiset | Keuhkofibroosi1) | |
Ruoansulatuselimistö | Hyvin yleiset | Vatsakipu, pahoinvointi ja oksentelu |
Yleiset | Ruoansulatuskanavan verenvuoto, dyspepsia, ruokatorven refluksitauti, Sjögrenin oireyhtymä | |
Melko harvinaiset | Haimatulehdus, dysfagia, kasvojen turvotus | |
Harvinaiset | Suolen puhkeama1) | |
Maksa ja sappi* | Hyvin yleiset | Kohonneet maksaentsyymiarvot |
Melko harvinaiset | Kolekystiitti ja sappikivet, maksan rasvoittuminen, kohonneet bilirubiiniarvot, | |
Harvinaiset | Hepatiitti, B-hepatiitin uudelleenaktivoituminen1), autoimmuunihepatiitti1) | |
Tuntematon | Maksan vajaatoiminta1) | |
Iho ja ihonalainen kudos | Hyvin yleiset | Ihottuma (mm. eksfoliatiivinen ihottuma) |
Yleiset | Psoriaasin puhkeaminen tai paheneminen (mukaan lukien palmoplantaarinen pustuloosi psoriaasi)1), nokkosihottuma, mustelmat (mm. purppura), ihotulehdus (mm. ekseema), kynsien murtuminen, voimakas hikoilu, alopesia, kutina | |
Melko harvinaiset | Öinen hikoilu, arpimuodostus | |
Harvinaiset | Erythema multiforme1), Stevens–Johnsonin oireyhtymä1), angioedeema1), ihon vaskuliitti1), likenoidi (punajäkälää muistuttava) ihoreaktio1) | |
| Tuntematon | Dermatomyosiitin oireiden paheneminen1) | |
Luusto, lihakset ja sidekudos | Hyvin yleiset | Luusto- ja lihaskipu |
Yleiset | Lihasspasmit (mm. kohonneet veren kreatiinifosfokinaasiarvot) | |
Melko harvinaiset | Rabdomyolyysi, systeeminen lupus erythematosus (SLE/LED) | |
Harvinaiset | Lupuksen kaltainen oireyhtymä1) | |
Munuaiset ja virtsatiet | Yleiset | Munuaisten vajaatoiminta, hematuria |
Melko harvinaiset | Nokturia | |
Sukupuolielimet ja rinnat | Melko harvinaiset | Erektiohäiriöt |
Yleisoireet ja antopaikassa todettavat haitat* | Hyvin yleiset | Pistoskohdan reaktiot (mm. pistoskohdan punoitus) |
Yleiset | Rintakipu, turvotus, kuume1) | |
Melko harvinaiset | Inflammaatio | |
Tutkimukset* | Yleiset | Hyytymis- ja verenvuotohäiriöt (mm. APTT-ajan piteneminen), positiivinen tulos autovasta-ainetestissä (mm. kaksijuosteisen DNA:n vasta-aineet), kohonneet veren laktaattidehydrogenaasiarvot |
| Tuntematon | Painonnousu2 | |
Vammat ja myrkytykset | Yleiset | Hidas paraneminen |
* lisätietoa kohdissa Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset
** myös avoimissa jatkotutkimuksissa
1) mukaan lukien spontaaniraportit
2) Adalimumabin yhteydessä keskimääräinen painon muutos lähtötilanteesta oli 0,3–1,0 kg aikuisten käyttöaiheissa, kun taas lumelääkettä käytettäessä paino laski tai nousi keskimäärin 0,4 kg 4–6 kuukauden pituisen hoitojakson aikana. Pitkäaikaisissa jatkotutkimuksissa, joissa ei ollut vertailuryhmää, on havaittu myös 5–6 kg:n painonnousua, kun potilaat ovat altistuneet lääkevalmisteelle noin 1–2 vuoden ajan. Tämä koskee erityisesti potilaita, joilla on Crohnin tauti ja haavainen paksusuolitulehdus. Mekanismi, johon tämä vaikutus perustuu, on epäselvä, mutta se voi liittyä adalimumabin tulehduksia estävään ja lievittävään vaikutukseen.
Uveiitti
Turvallisuusprofiili Humiraa joka toinen viikko saaneilla uveiittipotilailla oli yhdenmukainen Humiran tunnetun turvallisuusprofiilin kanssa.
Tiettyjen haittavaikutusten kuvaus
Pistoskohdan reaktiot
Tärkeimmissä kontrolloiduissa tutkimuksissa aikuisilla ja lapsilla pistoskohdan reaktioita (punoitus ja/tai kutina, verenvuoto, kipu tai turvotus) ilmeni 12,9 %:lla Humiraa ja 7,2 %:lla plaseboa tai vaikuttavaa vertailuvalmistetta saaneista potilaista. Pistoskohdan reaktioiden yhteydessä ei lääkityksen keskeyttäminen yleensä ollut tarpeen.
Infektiot
Tärkeimmissä kontrolloiduissa tutkimuksissa aikuisilla ja lapsilla infektioiden esiintyvyys oli Humiraa saaneilla 1,51 tapausta ja plaseboa tai vaikuttavaa vertailuvalmistetta saaneilla 1,46 tapausta potilasvuotta kohti. Valtaosa infektioista oli nenänielutulehduksia, ylähengitystieinfektioita ja nenän sivuontelotulehduksia (sinuiitti). Useimmat potilaat jatkoivat Humira-lääkitystä infektion parannuttua.
Vakavien infektioiden esiintyvyys oli Humiraa saaneilla 0,04 tapausta ja plaseboa tai vaikuttavaa vertailuvalmistetta saaneilla 0,03 tapausta potilasvuotta kohti.
Humiralla tehdyissä kontrolloiduissa ja avoimissa tutkimuksissa aikuisilla ja lapsilla on ilmoitettu vakavia infektioita (myös kuolemaan johtaneita infektioita, joita esiintyi harvoin), esim. tuberkuloosia (esim. miliaarituberkuloosia ja keuhkojen ulkopuolella esiintyvää tuberkuloosia) ja invasiivisia opportunistisia infektioita (esim. disseminoitunutta tai extrapulmonaalista histoplasmoosia, blastomykoosia, koksidioidomykoosia, pneumokystoosia, kandidiaasia, aspergilloosia ja listerioosia). Valtaosa tuberkuloositapauksista kehittyi kahdeksan kuukauden kuluessa hoidon aloittamisesta, mikä saattaa viitata latentin sairauden uudelleen-aktivoitumiseen.
Maligniteetit ja lymfoproliferatiiviset häiriöt
Idiopaattista juveniilia artriittia (idiopaattista juveniilia polyartriittia ja entesiitteihin liittyvää artriittia) koskeneissa Humira-tutkimuksissa 249:llä pediatrisella potilaalla, joiden kokonaisaltistus oli 655,6 potilasvuotta, ei havaittu maligniteetteja. Maligniteetteja ei havaittu myöskään lasten Crohnin tautia koskeneissa Humira-tutkimuksissa 192 lapsipotilaalla, joiden kokonaisaltistus oli 498,1 potilasvuotta. Maligniteetteja ei havaittu 77:llä pediatrisella potilaalla lasten kroonista läiskäpsoriaasia koskeneissa Humira-tutkimuksissa, joiden kokonaisaltistus oli 80,0 potilasvuotta. Lasten uveiittia koskeneessa Humira-tutkimuksessa 60:llä lapsipotilaalla, joiden kokonaisaltistus oli 58,4 potilasvuotta, ei havaittu maligniteettejä.
Tärkeimpiin vähintään 12 viikkoa kestäneisiin aikuisten Humira-tutkimuksiin osallistui potilaita, joilla oli keskivaikea tai vaikea aktiivinen nivelreuma, selkärankareuma, aksiaalinen spondylartriitti (ilman radiografista näyttöä selkärankareumasta), nivelpsoriaasi, psoriaasi, hidradenitis suppurativa, Crohnin tauti, ulseratiivinen koliitti tai uveiitti. Näiden tutkimusten kontrolloiduissa osissa 5 291 Humira-hoitoa saaneella potilaalla havaittiin 6,8 (95 % luottamusväli 4,4–10,5) maligniteettia (lukuun ottamatta lymfoomia ja muita ihosyöpiä kuin melanoomia) 1 000 potilasvuotta kohti, kun taas 3 444 verrokkipotilaalla todettiin 6,3 (95 % luottamusväli 3,4–11,8) tapausta 1 000 potilasvuotta kohti. Hoidon mediaanikesto oli 4,0 kk Humira-ryhmässä ja 3,8 kk verrokkipotilailla. Muiden ihosyöpien kuin melanooman esiintymistiheys oli Humira-hoitoa saaneilla potilailla 8,8 (95 % luottamusväli 6,0–13,0) tapausta 1 000 potilasvuotta kohti ja verrokkipotilailla 3,2 (95 % luottamusväli 1,3–7,6) tapausta 1 000 potilasvuotta kohti. Näistä ihosyövistä levyepiteelikarsinoomien esiintymistiheys oli Humira-hoitoa saaneilla potilailla 2,7 (95 % luottamusväli 1,4–5,4) tapausta 1 000 potilasvuotta kohti ja verrokkipotilailla 0,6 (95 % luottamusväli 0,1–4,5) tapausta 1 000 potilasvuotta kohti. Lymfoomien esiintymistiheys oli Humira-hoitoa saaneilla potilailla 0,7 (95 % luottamusväli 0,2–2,7) tapausta 1 000 potilasvuotta kohti ja verrokkiryhmässä 0,6 (95 % luottamusväli 0,1–4,5) tapausta 1 000 potilasvuotta kohti.
Näiden tutkimusten kontrolloitujen osien ja parhaillaan tehtävien sekä lopetettujen avointen jatkotutkimusten mediaanikesto on noin 3,3 vuotta, ja niihin on osallistunut 6 427 potilasta yhteensä yli 26 439 potilashoitovuoden ajan. Kun näiden tutkimusten tulokset yhdistetään, havaittujen maligniteettien esiintymistiheydeksi saadaan noin 8,5 tapausta 1 000 potilasvuotta kohti (lymfoomia ja muita ihosyöpiä kuin melanoomaa lukuun ottamatta). Muiden ihosyöpien kuin melanooman havaittu esiintymistiheys on noin 9,6 tapausta 1 000 potilasvuotta kohti, ja lymfoomien havaittu esiintymistiheys noin 1,3 tapausta 1 000 potilasvuotta kohti.
Markkinoille tulon jälkeen tammikuusta 2003 joulukuuhun 2010 pääasiassa nivelreumapotilailla ilmoitettujen maligniteettien esiintymistiheys on noin 2,7 tapausta 1 000 potilas-hoitovuotta kohti. Muiden ihosyöpien kuin melanooman ilmoitettu esiintymistiheys on noin 0,2 tapausta 1 000 potilasvuotta kohti ja lymfoomien ilmoitettu esiintymistiheys noin 0,3 tapausta 1 000 potilas-hoitovuotta kohti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Adalimumabilla hoidetuilla potilailla on markkinoilletulon jälkeen raportoitu harvoin hepatospleenistä T-solulymfoomaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Autovasta-aineet
Potilaiden seeruminäytteistä määritettiin nivelreumatutkimuksissa I–V autovasta-aineet useana ajankohtana. Näissä tutkimuksissa 11,9 %:lla Humiraa ja 8,1 %:lla plaseboa tai vaikuttavaa vertailuvalmistetta saaneista potilaista lähtötason negatiivinen tumavasta-ainetitteri muuttui positiiviseksi viikolla 24. Kaikissa nivelreuma- ja nivelpsoriaasitutkimuksissa kahdella 3 441:stä Humiraa saaneesta potilaasta havaittiin kliinisiä merkkejä lupuksen kaltaisen oireiston kehittymisestä. Tila korjaantui hoidon keskeyttämisen jälkeen. Yhdellekään potilaalle ei kuitenkaan tullut lupuksesta johtuvaa nefriittiä eikä keskushermosto-oireita.
Maksa- ja sappitapahtumat
Nivelreuma- ja nivelpsoriaasipotilailla tehdyissä kontrolloiduissa vaiheen 3 Humira-tutkimuksissa, joiden kontrolloidun osan kesto oli 4–104 viikkoa, ALAT-arvojen suurenemista ≥ 3 kertaa viitevälin ylärajan (ULN) suuruisiksi esiintyi 3,7 %:lla Humira-hoitoa saaneista ja 1,6 %:lla vertailuhoitoa saaneista.
Idiopaattista juveniilia polyartriittia sairastavilla 4–17-vuotiailla potilailla ja entesiitteihin liittyvää artriittia sairastavilla 6–17-vuotiailla potilailla tehdyissä kontrolloiduissa vaiheen 3 Humira-tutkimuksissa ALAT-tason suurenemista tasolle ≥ 3 x ULN esiintyi 6,1 %:lla Humira-hoitoa saaneista ja 1,3 %:lla vertailuhoitoa saaneista. ALAT-tason suurenemisista useimmat havaittiin potilailla, jotka käyttivät samanaikaisesti myös metotreksaattia. Kenelläkään vaiheen 3 Humira-tutkimukseen osallistuneista idiopaattista juveniilia polyartriittia sairastavista 2–<4-vuotiaista potilaista ei esiintynyt ALAT-tason suurenemista ≥ 3 x ULN.
Crohnin tautia tai ulseratiivista koliittia sairastavilla potilailla tehdyissä kontrolloiduissa vaiheen 3 Humira-tutkimuksissa, joiden kontrolloidun osan kesto oli 4–52 viikkoa, ALAT-arvojen suurenemista tasolle ≥ 3 x ULN esiintyi 0,9 %:lla Humira-hoitoa saaneista ja 0,9 %:lla vertailuhoitoa saaneista.
Crohnin tautia sairastavilla lapsipotilailla tehdyssä vaiheen 3 kliinisessä tutkimuksessa, jossa selvitettiin Humiran tehoa ja turvallisuutta painonmukaisen induktiohoidon jälkeisessä ylläpitohoidossa lapsipotilailla, jotka saivat Humiraa painonmukaisella annoksella (2 painoluokkaa) 52 viikon ajan, ALAT-arvojen suurenemista tasolle ≥ 3 x ULN esiintyi 2,6 %:lla (5/192) potilaista. Näistä potilaista 4 oli saanut samanaikaista immonosupressiivista hoitoa lähtötilanteessa.
Läiskäpsoriaasipotilailla tehdyissä kontrolloiduissa vaiheen 3 Humira-tutkimuksissa, joiden kontrolloidun osan kesto oli 12–24 viikkoa, ALAT-arvojen suurenemista tasolle ≥ 3 x ULN esiintyi 1,8 %:lla Humira-hoitoa saaneista ja 1,8 %:lla vertailuhoitoa saaneista.
Kenelläkään vaiheen 3 Humira-tutkimukseen osallistuneista läiskäpsoriaasia sairastaneista lapsipotilaista ei havaittu ALAT-tason suurenemista ≥ 3 x ULN.
Uveiittia sairastavilla aikuispotilailla tehdyissä kontrolloiduissa 80 viikkoa kestäneissä Humira-tutkimuksissa (aloitusannos 80 mg viikolla 0, jonka jälkeen 40 mg joka toinen viikko alkaen viikolta 1), joissa altistumisajan mediaani Humira-hoitoa saaneilla potilailla oli 166,5 vuorokautta ja vertailuhoitoa saaneilla potilailla 105,0 vuorokautta, ALAT-arvojen kohoamista ≥ 3 x ULN esiintyi 2,4 %:lla Humira-hoitoa saaneista ja 2,4 %:lla vertailuhoitoa saaneista.
Potilaat, joilla esiintyi ALAT-arvojen suurenemista, olivat kaikkien käyttöaiheiden kliinisissä tutkimuksissa oireettomia. Arvojen suureneminen oli useimmiten ohimenevää ja korjautui, kun hoitoa jatkettiin. Adalimumabilla hoidetuilla potilailla on kuitenkin markkinoilletulon jälkeen raportoitu myös maksan vajaatoimintaa ja lievempiä maksan häiriöitä, jotka saattavat edeltää maksan vajaatoimintaa, mm. hepatiittia (myös autoimmuunihepatiittia).
Samanaikainen hoito atsatiopriinilla/6-merkaptopuriinilla
Aikuisten Crohnin tautia käsittelevissä tutkimuksissa pahanlaatuisten ja vakavien infektioihin liittyvien haittatapahtumien ilmaantuvuus oli suurempi käytettäessä Humiran ja atsatiopriinin/6-merkaptopuriinin yhdistelmähoitoa verrattuna pelkkään Humiraan.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Annosta rajoittavaa toksisuutta ei havaittu kliinisissä tutkimuksissa. Suurin tutkittu annos on 10 mg/kg laskimonsisäisesti useana annoksena, mikä on noin 15 kertaa suositusannoksen verran.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, Tuumorinekroositekijä alfan (TNF-α) estäjät, ATC-koodi: L04AB04
Vaikutusmekanismi
Adalimumabi sitoutuu spesifisesti tuumorinekroositekijään (TNF) ja neutraloi TNF:n biologisen toiminnan estämällä sen vaikutuksen solukalvon TNF-reseptoreihin (p55 ja p75).
Adalimumabi säätelee myös TNF:n indusoimia tai säätelemiä biologisia vasteita, mm. leukosyyttien migraatiosta vastaavien adheesiomolekyylien määrän muutoksia (ELAM-1, VCAM-1 ja ICAM-1, joilla IC50 on 0,1–0,2 nM).
Farmakodynaamiset vaikutukset
Humira-hoidon jälkeen todettiin, että nivelreumapotilailla tulehduksen akuutin vaiheen osoittajien (C-reaktiivinen proteiini ja lasko) ja seerumin sytokiinien (IL-6) määrät pienenivät lähtötasoon verrattuna nopeasti. Myös rustotuhoa aiheuttavaa kudosten uudismuodostusta tuottavien matriksin metalloproteinaasientsyymien (MMP-1 ja MMP-3) pitoisuudet seerumissa pienenivät Humiran antamisen jälkeen. Humiraa saaneilla potilailla havaittiin usein kroonisen tulehduksen hematologisten merkkien parantumista.
Humiraa käyttävillä idiopaattista juveniilia polyartriittia, Crohnin tautia, ulseratiivista koliittia ja hidradenitis suppurativaa sairastavilla potilailla todettiin myös CRP-arvojen pienenevän nopeasti. Crohnin tauti -potilailla havaittiin tulehdusmarkkereita ilmentävien solujen määrän väheneminen paksusuolessa, mukaan lukien TNFα:n ilmentymisen merkittävä väheneminen. Suolen limakalvon endoskooppiset tutkimukset ovat osoittaneet limakalvon paranemista tapahtuvan adalimumabilla hoidetuilla potilailla.
Kliininen teho ja turvallisuus
Aikuiset nivelreumapotilaat
Humiraa on kliinisissä tutkimuksissa arvioitu yhteensä yli 3 000:lla nivelreumapotilaalla. Humiran tehoa ja turvallisuutta nivelreuman hoidossa on arvioitu viidessä satunnaistetussa, hyvin kontrolloidussa kaksoissokkotutkimuksessa. Osa potilaista sai hoitoa 120 kuukauden ajan.
Nivelreumatutkimuksessa I arvioitiin 271 vähintään 18-vuotiasta keskivaikeaa tai vaikeaa aktiivista
nivelreumaa sairastavaa potilasta, joilla hoito vähintään yhdellä taudin kulkuun vaikuttavalla reumalääkkeillä oli epäonnistunut ja joilla metotreksaatti ei ollut riittävän tehokas annostasolla 12,5‑25 mg/vko (10 mg/vko, jos potilas ei siedä metotreksaattia) annoksen pysyessä vakiona 10‑25 mg/vko. Humiraa tai plaseboa annettiin 20, 40 tai 80 mg:n annoksina joka toinen viikko 24 viikon ajan.
Nivelreumatutkimuksessa II arvioitiin 544 vähintään 18-vuotiasta keskivaikeaa tai vaikeaa aktiivista nivelreumaa sairastavaa potilasta, joilla hoito vähintään yhdellä taudin kulkuun vaikuttavalla reumalääkkeellä oli epäonnistunut. Humiraa annettiin ihonalaisina injektioina 20 tai 40 mg annoksina siten, että Humiraa annettiin yksinään joko viikoittain tai vuoroviikoin plasebon kanssa 26 viikon ajan; plaseboa annettiin viikoittain samanmittaisen ajanjakson verran. Muiden taudin kulkuun vaikuttavien reumalääkkeiden käyttö ei ollut sallittua.
Nivelreumatutkimuksessa III arvioitiin 619 vähintään 18-vuotiasta keskivaikeaa tai vaikeaa aktiivista nivelreumaa sairastavaa potilasta, joilla metotreksaattihoito ei ollut riittävän tehokas annostasolla 12,5–25 mg/vko tai jotka eivät sietäneet 10 mg/vko annoksia metotreksaattia. Tutkimuksessa oli kolme ryhmää. Ensimmäinen ryhmä sai plaseboa viikoittain pistoksena 52 viikon ajan. Toinen ryhmä sai 20 mg Humiraa viikoittain 52 viikon ajan. Kolmas ryhmä sai vuoroviikoin 40 mg Humiraa ja vuoroviikoin plaseboa. Ensimmäisen 52 viikon jälkeen 457 potilasta siirrettiin avoimeen jatkovaiheeseen, jossa annettiin 40 mg Humiraa/metotreksaattia joka toinen viikko enintään 10 vuoden ajan.
Nivelreumatutkimuksessa IV arvioitiin ensisijaisesti turvallisuutta 636 vähintään 18-vuotiaalla keskivaikeaa tai vaikeaa aktiivista nivelreumaa sairastavalla potilaalla. Potilailla ei ollut aikaisempaa taudin kulkuun vaikuttavaa reumalääkitystä tai he saivat jatkaa nykyistä reumalääkitystään, kunhan hoito pysyi samana vähintään 28 päivän ajan. Lääkitys oli metotreksaatti, leflunomidi, hydroksiklorokiini, sulfasalatsiini ja/tai kultasuolat. Potilaat satunnaistettiin saamaan joko 40 mg Humiraa tai plaseboa joka toinen viikko 24 viikon ajan.
Nivelreumatutkimuksessa V arvioitiin 799 aikuispotilasta, joilla oli keskivaikea tai vaikea aktiivinen varhaisvaiheen nivelreuma (taudin kesto keskimäärin alle 9 kuukautta) ja jotka eivät olleet saaneet aiemmin metotreksaattihoitoa. Tässä tutkimuksessa arvioitiin eri hoitojen tehoa nivelvaurioiden oireiden ja löydösten vähenemisen sekä nivelvaurioiden etenemisen hidastumisen suhteen nivelreumapotilailla 104 viikon aikana, ja tutkittavat hoidot olivat: Humira 40 mg joka toinen viikko yhdistelmänä metotreksaatin kanssa, Humira 40 mg joka toinen viikko monoterapiana ja metotreksaatti monoterapiana.. Ensimmäisen 104 viikon jälkeen 497 potilasta siirrettiin avoimeen jatkovaiheeseen, jossa annettiin 40 mg Humiraa joka toinen viikko enintään 10 vuoden ajan.
Ensisijainen päätetapahtuma nivelreumatutkimuksissa I, II ja III ja toissijainen päätetapahtuma nivelreumatutkimuksessa IV oli niiden potilaiden prosentuaalinen osuus, jotka saavuttivat ACR 20 -vasteen viikolla 24 tai 26. Ensisijainen päätetapahtuma nivelreumatutkimuksessa V oli niiden potilaiden prosentuaalinen osuus, jotka saavuttivat ACR 50 -vasteen viikolla 52. Ensisijaisena päätetapahtumana nivelreumatutkimuksissa III ja V oli viikolla 52 todettu taudin etenemisen hidastuminen (röntgentutkimuksella todettuna). Ensisijaisena päätetapahtumana nivelreuma-tutkimuksessa III oli lisäksi elämänlaadussa tapahtunut muutos.
ACR-vaste
Prosentuaaliset osuudet niistä Humiraa saaneista potilasta, jotka saavuttivat ACR 20, 50 ja 70 -vasteet, olivat yhdenmukaiset nivelreumatutkimuksissa I, II ja III. Yhteenveto annostasolla 40 mg joka toinen viikko saaduista tuloksista on esitetty taulukossa 7.
Taulukko 7 ACR-vasteet plasebokontrolloiduissa tutkimuksissa
(prosentuaalinen osuus potilaista)
Vaste | Nivelreumatutkimus Ia** | Nivelreumatutkimus IIa** | Nivelreumatutkimus IIIa** | |||
Plasebo/ MTXc n = 60 | Humirab/ MTXc n = 63 | Plasebo n = 110 | Humirab n = 113 | Plasebo/ MTXc n = 200 | Humirab /MTXc n = 207 | |
ACR 20 | ||||||
6 kk kuluttua | 13,3 % | 65,1 % | 19,1 % | 46,0 % | 29,5 % | 63,3 % |
12 kk kuluttua | NA | NA | NA | NA | 24,0 % | 58,9 % |
ACR 50 | ||||||
6 kk kuluttua | 6,7 % | 52,4 % | 8,2 % | 22,1 % | 9,5 % | 39,1 % |
12 kk kuluttua | NA | NA | NA | NA | 9,5 % | 41,5 % |
ACR 70 | ||||||
6 kk kuluttua | 3,3 % | 23,8 % | 1,8 % | 12,4 % | 2,5 % | 20,8 % |
12 kk kuluttua | NA | NA | NA | NA | 4,5 % | 23,2 % |
a Nivelreumatutkimus I viikolla 24, nivelreumatutkimus II viikolla 26 ja nivelreumatutkimus III viikoilla 24 & 52 b 40 mg Humiraa joka toinen viikko c MTX = metotreksaatti ** p < 0,01, Humira vs. Plasebo | ||||||
Nivelreumatutkimuksissa I‑IV viikon 24 tai 26 kohdalla mitattu paraneminen ACR-vastekriteerien kaikkien yksittäisten osa-alueiden osalta [aristavien ja turvonneiden nivelten lukumäärä, lääkärin ja potilaan arvio sairauden aktiivisuudesta ja kivusta, toimintakykyindeksin (HAQ) pisteet ja CRP (mg/dl)] oli huomattavampaa kuin plaseboryhmässä. Nivelreumatutkimuksessa III paranemiset säilyivät 52 viikon ajan.
Nivelreumatutkimuksen III avoimessa jatkovaiheessa vaste säilyi useimmilla ACR-vasteen saavuttaneilla potilailla enintään 10 vuoden seurannan ajan. 207 potilaasta, jotka oli satunnaistettu saamaan 40 mg Humiraa joka toinen viikko, 114 jatkoi 40 mg Humira-annosten käyttöä joka toinen viikko 5 vuoden ajan. Näistä potilaista 86 (75,4 %) saavutti ACR 20 -vasteen, 72 potilasta (63,2 %) saavutti ACR 50 -vasteen ja 41 potilasta (36 %) ACR 70 -vasteen. 207 potilaasta 81 jatkoi 40 mg Humira-annosten käyttöä joka toinen viikko 10 vuoden ajan. Näistä potilaista 64 (79,0 %) saavutti ACR 20 -vasteen, 56 potilasta (69,1 %) saavutti ACR 50 -vasteen ja 43 potilasta (53,1 %) ACR 70 -vasteen.
Nivelreumatutkimuksessa IV Humiraa ja standardihoitoa saaneiden potilaiden ACR 20 -vaste oli tilastollisesti merkitsevästi parempi kuin plaseboa ja standardihoitoa saaneiden (p < 0,001).
Nivelreumatutkimuksissa I–IV Humiraa saaneet potilaat saavuttivat plaseboon verrattuna tilastollisesti merkitsevät ACR 20 ja 50 -vasteet jopa 1-2 viikon kuluttua hoidon aloittamisesta.
Nivelreumatutkimuksessa V potilailla, joilla oli varhaisvaiheen nivelreuma ja jotka eivät olleet aiemmin saaneet metotreksaattihoitoa, Humiran ja metotreksaatin yhdistelmä sai aikaan nopeamman ja merkitsevästi paremman ACR-vasteen viikolla 52 kuin pelkkä metotreksaatti tai pelkkä Humira, ja vaste säilyi viikkoon 104 saakka (ks. taulukko 8).
Taulukko 8 ACR-vasteet nivelreumatutkimuksessa V (potilaiden prosentuaalinen osuus) | |||||||
Vaste | MTX n = 257 | Humira n = 274 | Humira/MTX n = 268 | p-arvoa | p-arvob | p-arvoc | |
ACR 20 | |||||||
Viikko 52 | 62,6 % | 54,4 % | 72,8 % | 0,013 | < 0,001 | 0,043 | |
Viikko 104 | 56,0 % | 49,3 % | 69,4 % | 0,002 | < 0,001 | 0,140 | |
ACR 50 | |||||||
Viikko 52 | 45,9 % | 41,2 % | 61,6 % | < 0,001 | < 0,001 | 0,317 | |
Viikko 104 | 42,8 % | 36,9 % | 59,0 % | < 0,001 | < 0,001 | 0,162 | |
ACR 70 | |||||||
Viikko 52 | 27,2 % | 25,9 % | 45,5 % | < 0,001 | < 0,001 | 0,656 | |
Viikko 104 | 28,4 % | 28,1 % | 46,6 % | < 0,001 | < 0,001 | 0,864 | |
a p-arvo on saatu metotreksaattimonoterapian ja Humira/metotreksaattiyhdistelmähoidon parivertailusta Mann–Whitneyn U-testillä. b p-arvo on saatu Humira-monoterapian ja Humira/metotreksaattiyhdistelmähoidon parivertailusta Mann–Whitneyn U-testillä. c p-arvo on saatu Humira-monoterapian ja metotreksaattimonoterapian parivertailusta Mann–Whitneyn U-testillä. | |||||||
Nivelreumatutkimuksen V avoimessa jatkovaiheessa ACR-vasteet säilyivät enintään 10 vuoden seurannassa. 542:sta potilaasta, jotka oli satunnaistettu saamaan 40 mg Humiraa joka toinen viikko, 170 jatkoi 40 mg:n Humira-annosten käyttöä joka toinen viikko 10 vuoden ajan. Näistä potilaista 154 (90,6 %) saavutti ACR 20 -vasteen, 127 potilasta (74,7 %) saavutti ACR 50 -vasteen ja 102 potilasta (60,0 %) ACR 70 -vasteen.
Viikolla 52 Humira/metotreksaattiyhdistelmähoitoa saaneista potilaista 42,9 %:llä saavutettiin kliininen remissio (DAS28 (CRP) < 2,6), kun vastaava luku oli pelkkää metotreksaattia saaneilla 20,6 % ja pelkkää Humiraa saaneilla 23,4 %. Humira/metotreksaattiyhdistelmähoito lievitti tautia kliinisesti ja tilastollisesti paremmin kuin pelkkä metotreksaatti (p < 0,001) tai pelkkä Humira (p < 0,001) potilailla, joilla oli äskettäin diagnosoitu keskivaikea tai vaikea nivelreuma. Vasteet olivat samankaltaiset näissä kahdessa monoterapiaryhmässä (p = 0,447). 342:sta potilaasta, jotka oli alun perin satunnaistettu saamaan Humiraa monoterapiana tai Humira/metotreksaattiyhdistelmähoitoa ja jotka jatkoivat avoimessa jatkotutkimuksessa, 171 jatkoi Humira-hoitoa 10 vuotta. Heistä 109:n (63,7 %) raportoitiin olevan remissiossa 10 vuoden kohdalla.
Radiologinen vaste
Nivelreumatutkimuksessa III, jossa Humiraa saavilla potilailla oli ollut nivelreuma noin 11 vuotta, rakenteelliset nivelvauriot arvioitiin röntgenkuvista ja ilmaistiin muutoksina modifioiduissa Sharpin (TSS) kokonaispisteissä ja sen komponenteissa, eroosiopisteissä ja nivelraon madaltumispisteissä. Humira/metotreksaattipotilailla todettiin 6 ja 12 kuukauden kohdalla merkitsevästi vähemmän röntgentutkimuksella osoitettua etenemistä kuin pelkkää metotreksaattia saavilla potilailla (ks. taulukko 9).
Avoimen nivelreumatutkimuksen III jatkotutkimuksessa rakenteellisten vaurioiden etenemisnopeuden hidastuminen säilyy 8 ja 10 vuotta osalla potilaista. 8 vuoden kohdalla arvioitiin röntgenkuvista 81 potilasta 207 potilaasta, joita alun perin hoidettiin Humiralla (40 mg joka toinen viikko). 48 potilaalla näistä ei havaittu rakenteellisten vaurioiden etenemistä (määritelmä: mTSS-arvon muutokset lähtötilanteesta 0,5 tai vähemmän). 10 vuoden kohdalla tehtiin radiologiset arvioinnit 79:lle 207:sta potilaasta, joita alun perin hoidettiin Humiralla (40 mg joka toinen viikko). 40:llä näistä potilaista ei todettu rakenteellisten vaurioiden etenemistä (määritelmä: mTSS-arvon muutos lähtötilanteesta enintään 0,5 pistettä).
Taulukko 9 Radiologiset keskiarvomuutokset 12 kuukauden aikana nivelreumatutkimuksessa III | ||||
Plasebo/ MTXa | Humira/MTX 40 mg joka toinen viikko | Plasebo/MTX-Humira/MTX (95 % luottamusvälib) | p-arvo | |
TSS | 2,7 | 0,1 | 2,6 (1,4; 3,8) | < 0,001c |
Eroosioaste | 1,6 | 0,0 | 1,6 (0,9; 2,2) | < 0,001 |
Nivelraon madaltuma | 1,0 | 0,1 | 0,9 (0,3; 1,4) | 0,002 |
a metotreksaatti b 95 % luottamusväli muutosasteen eroissa metotreksaatin ja Humiran välillä. c perustuu ranking analyysiin | ||||
Nivelreumatutkimuksessa V rakenteelliset nivelvauriot arvioitiin röntgenkuvista ja ilmaistiin muutoksina modifioiduissa Sharpin kokonaispisteissä (ks. taulukko 10).
Taulukko 10 Radiologiset keskiarvomuutokset viikolla 52 nivelreumatutkimuksessa V | ||||||
MTX n = 257 (95 % luottamusväli) | Humira n = 274 (95 % luottamusväli) | Humira/MTX n = 268 (95 % luottamusväli) | p-arvoa | p-arvob | p-arvoc | |
TSS | 5,7 (4,2–7,3) | 3,0 (1,7–4,3) | 1,3 (0,5–2,1) | < 0,001 | 0,0020 | < 0,001 |
Eroosioaste | 3,7 (2,7–4,7) | 1,7 (1,0–2,4) | 0,8 (0,4–1,2) | < 0,001 | 0,0082 | < 0,001 |
Nivelraon madaltuma | 2,0 (1,2–,8) | 1,3 (0,5–21) | 0,5 (0–1,0) | < 0,001 | 0,0037 | 0,151 |
a p-arvo on saatu metotreksaattimonoterapian ja Humira/metotreksaattiyhdistelmähoidon parivertailusta Mann–Whitneyn U-testillä. b p-arvo on saatu Humira-monoterapian ja Humira/metotreksaattiyhdistelmähoidon parivertailusta Mann–Whitneyn U-testillä. c p-arvo on saatu Humira-monoterapian ja metotreksaattimonoterapian parivertailusta Mann–Whitneyn U-testillä. | ||||||
52 ja 104 viikon hoidon jälkeen niiden potilaiden prosentuaalinen osuus, joilla tauti ei ollut edennyt (muutos lähtötilanteesta modifioiduissa Sharpin kokonaispisteissä ≤ 0,5) oli merkitsevästi suurempi potilailla, jotka olivat saaneet Humira/metotreksaattiyhdistelmähoitoa (63,8 % ja 61,2 %) kuin potilailla, jotka olivat saaneet pelkkää metotreksaattia (37,4 % ja 33,5 %, p < 0,001) tai pelkkää Humiraa (50,7 %, p < 0,002 ja 44,5 %, p < 0,001).
Avoimessa nivelreumatutkimuksen V jatkovaiheessakeskimääräinen muutos lähtötilanteesta 10 vuoden kohdalla modifioiduissa Sharpin kokonaispisteissä (TSS) oli alun perin metotreksaattimonoterapiaan satunnaistetuilla potilailla 10,8, Humira-monoterapiaan satunnaistetuilla potilailla 9,2 ja Humira/metotreksaatti-yhdistelmähoitoon satunnaistetuilla potilailla 3,9. Vastaavat osuudet potilaista, joilla ei tapahtunut radiologista etenemistä, olivat 31,3 %, 23,7 % ja 36,7 %.
Elämänlaatu ja fyysinen toimintakyky
Terveyteen liittyvää elämänlaatua ja fyysistä toimintakykyä arvioitiin kaikissa neljässä asianmukaisessa ja hyvin kontrolloidussa tutkimuksessa toimintakykyindeksillä (HAQ), joka oli nivelreumatutkimuksessa III ennalta määritelty ensisijainen päätetapahtuma viikolla 52. Kaikki Humira-annokset/annostusohjelmat kaikissa neljässä tutkimuksessa osoittivat, että paraneminen mitattuna HAQ-toimintakykyindeksillä lähtötasolta kuukaudelle 6 oli plaseboon verrattuna tilastollisesti merkitsevästi parempaa, ja nivelreumatutkimuksessa III havaittiin samaa viikolla 52. Short Form Health Survey (SF 36) -kyselyn tulokset Humiran kaikkien annosten/annostusohjelmien osalta tukevat näitä löydöksiä (mm. PCS-pisteet ja kipu- ja vitaliteettiosioiden pisteet annokselle 40 mg joka toinen viikko olivat tilastollisesti merkitseviä). FACIT-pisteet osoittavat, että väsymys väheni tilastollisesti merkitsevästi kaikissa niissä kolmessa tutkimuksessa, joissa sitä arvioitiin (nivelreumatutkimukset I, III ja IV).
Nivelreumatutkimuksessa III useimmilla potilailla, joiden fyysinen toimintakyky parani ja jotka jatkoivat hoitoa, paraneminen säilyi avoimen tutkimuksen viikkoon 520 asti (120 kuukautta). Elämänlaadun paraneminen mitattiin viikolle 156 (36 kuukautta) asti. Elämänlaadun paraneminen pysyi samalla tasolla koko tämän ajan.
Nivelreumatutkimuksessa V toimintakykyindeksin (HAQ) ja SF 36 -kyselyn fyysisen komponentin paraneminen oli merkittävämpää (p < 0,001) Humira/metotreksaattiyhdistelmähoidon kuin pelkän metotreksaattihoidon tai pelkän Humira-hoidon yhteydessä viikolla 52, ja vaikutus säilyi viikolle 104. Niillä 250:llä potilaalla, jotka olivat avoimessa jatkotutkimuksessa loppuun asti, fyysisessä toimintakyvyssä havaitut paranemiset säilyivät 10 hoitovuoden ajan.
Läiskäpsoriaasi aikuisilla
Humiran tehoa ja turvallisuutta tutkittiin satunnaistetuissa, kaksoissokkoutetuissa tutkimuksissa aikuispotilailla, joilla oli krooninen läiskäpsoriaasi (≥ 10 % kehon pinta-alasta ja PASI-indeksi ≥ 12 tai ≥ 10) ja joille harkittiin systeemistä hoitoa tai valohoitoa. 73 % psoriaasitutkimuksiin I ja II osallistuneista potilaista oli käyttänyt aiemmin systeemistä hoitoa tai valohoitoa. Humiran tehoa ja turvallisuutta tutkittiin satunnaistetussa kaksoissokkoutetussa tutkimuksessa (Psoriaasitutkimus III) myös aikuispotilailla, jotka sairastivat keskivaikeaa tai vaikeaa kroonista läiskäpsoriaasia ja siihen liittyvää käsi- ja/tai jalkapsoriaasia ja joille harkittiin systeemistä hoitoa.
Psoriaasitutkimuksessa I (REVEAL) arvioitiin 1 212 potilasta kolmen hoitojakson puitteissa. Hoitojaksolla A potilaat saivat joko lumehoitoa tai Humira-hoitoa (80 mg aloitusannos, jonka jälkeen 40 mg joka toinen viikko; ensimmäinen 40 mg annos otettiin viikon kuluttua aloitusannoksesta). 16 hoitoviikon jälkeen ne potilaat, joilla saavutettiin vähintään PASI 75 -vaste (PASI-indeksi parani vähintään 75 % lähtötilanteeseen nähden), siirtyivät hoitojaksoon B ja saivat avointa Humira-hoitoa annoksella 40 mg joka toinen viikko. Potilaat, joilla oli edelleen ≥ PASI 75 -vaste viikolla 33 ja jotka oli alun perin satunnaistettu hoitojaksolla A saamaan vaikuttavaa hoitoa, satunnaistettiin uudelleen hoitojaksolla C saamaan joko lumehoitoa tai 40 mg Humiraa joka toinen viikko vielä 19 viikon ajan. Kaikissa hoitoryhmissä lähtötilanteen PASI-indeksi oli keskimäärin 18,9 ja lääkärin yleisarvio potilaan sairaudesta oli lähtötilanteessa "keskivaikea” (53 % tutkimushenkilöistä), "vaikea” (41 %) tai "hyvin vaikea” (6 %).
Psoriaasitutkimuksessa II (CHAMPION) Humiran tehoa ja turvallisuutta verrattiin metotreksaattiin ja lumehoitoon 271 potilaalla. Potilaat saivat 16 viikon ajan joko lumehoitoa, metotreksaattia (aloitusannos 7,5 mg, jonka jälkeen annosta nostettiin viikolle 12 asti; maksimiannos 25 mg) tai Humira-hoitoa (80 mg aloitusannos, jonka jälkeen 40 mg joka toinen viikko; ensimmäinen 40 mg annos viikon kuluttua aloitusannoksesta). Humiraa ja metotreksaattia vertailevia tietoja 16 hoitoviikkoa pidemmältä ajalta ei ole. Metotreksaattiryhmässä potilaiden annosta ei enää nostettu, jos heillä saavutettiin ≥ PASI 50 vaste viikolla 8 ja/tai viikolla 12. Kaikissa hoitoryhmissä lähtötilanteen PASI-indeksi oli keskimäärin 19,7 ja lääkärin yleisarvio potilaan sairaudesta oli lähtötilanteessa ”lievä” (< 1 % tutkimushenkilöistä), ”keskivaikea” (48 %), ”vaikea” (46 %) tai "hyvin vaikea” (6 %).
Kaikkiin vaiheen 2 ja vaiheen 3 psoriaasitutkimuksiin osallistuneet potilaat soveltuivat avoimeen jatkotutkimukseen, jossa Humiraa annettiin vielä vähintään 108 viikon ajan.
Psoriaasitutkimusten I ja II ensisijainen päätetapahtuma oli niiden potilaiden osuus, jotka saavuttivat viikolla 16 PASI 75 -vasteen lähtötilanteeseen nähden (ks. taulukot 11 ja 12).
Taulukko 11 Psoriaasitutkimus I (REVEAL) Tehotulokset 16 viikon kohdalla | ||
Lumehoito N = 398 n (%) | Humira (40 mg joka 2. viikko) N = 814 n (%) | |
≥ PASI 75a | 26 (6,5) | 578 (70,9)b |
PASI 100 | 3 (0,8) | 163 (20,0)b |
Lääkärin yleisarvio: puhdas/melkein puhdas | 17 (4,3) | 506 (62,2)b |
a PASI 75 –vasteen saavuttaneiden potilaiden prosenttiosuus laskettiin keskusten mukaan vakioituna b p < 0,001, Humira vs. Lumehoito | ||
Taulukko 12 Psoriaasitutkimus II (CHAMPION) Tehotulokset 16 viikon kohdalla | |||
Lumehoito N = 53 n (%) | Metotreksaatti N = 110 n (%) | Humira (40 mg joka 2. viikko) N = 108 n (%) | |
≥ PASI 75 | 10 (18,9) | 39 (35,5) | 86 (79,6) a, b |
PASI 100 | 1 (1,9) | 8 (7,3) | 18 (16,7) c, d |
Lääkärin yleisarvio: puhdas/melkein puhdas | 6 (11,3) | 33 (30,0) | 79 (73,1) a, b |
a p < 0,001 Humira vs. lumehoito b p < 0,001 Humira vs. metotreksaatti c p < 0,01 Humira vs. lumehoito d p < 0,05 Humira vs. Metotreksaatti | |||
Psoriaasitutkimuksessa I 28 % potilaista, joilla saavutettiin PASI 75 -vaste ja jotka satunnaistettiin uudelleen saamaan lumehoitoa viikolla 33, menetti riittävän vasteen (PASI-indeksi viikon 33 jälkeen ja viikolla 52 tai sitä ennen oli sellainen, että PASI-vaste lähtötilanteeseen nähden oli < 50, ja indeksi suureni vähintään 6 pistettä viikkoon 33 nähden). Humira-hoitoa jatkaneessa ryhmässä näin tapahtui vain 5 %:lle potilaista (p < 0,001). 38 % (25/66) niistä potilaista, jotka menettivät riittävän vasteen lumehoitoon satunnaistamisen jälkeen ja siirtyivät myöhemmin avoimeen jatkotutkimukseen, saavutti jälleen PASI 75 -vasteen 12 hoitoviikon jälkeen ja 55 % (36/66) 24 hoitoviikon jälkeen.
Yhteensä 233 PASI 75 -vasteen viikolla 16 ja viikolla 33 saavuttanutta potilasta sai jatkuvaa Humira-hoitoa 52 viikon ajan psoriaasitutkimuksessa I ja jatkoi Humira-hoitoa avoimessa jatkotutkimuksessa. 108 viikon avoimen lisähoidon jälkeen (tutkimuksen alusta yhteensä 160 viikkoa) 74,7 % potilaista sai PASI 75 -vasteen ja 59,0 %:lla iho oli lääkärin yleisarvion mukaan puhdas tai melkein puhdas. Analyysissä, jossa kaikki potilaat, jotka keskeyttivät tutkimuksen haittatapahtumien tai riittämättömän tehon vuoksi tai joiden annosta suurennettiin, luokiteltiin ilman vastetta jääneiksi potilaiksi, PASI 75 -vasteen sai 69,6 % potilaista ja 55,7 %:lla iho oli lääkärin yleisarvion mukaan puhdas tai melkein puhdas 108 viikon avoimen lisähoidon jälkeen (yhteensä 160 viikkoa).
Yhteensä 347 pysyvän vasteen saavuttanutta potilasta osallistui hoidon keskeyttämistä ja uusintahoitoa arvioivaan avoimeen jatkotutkimukseen. Keskeyttämisjakson aikana psoriaasioireet uusiutuivat ajan myötä, ja relapsiin (lääkärin yleisarvio huononi ”keskivaikeaksi” tai huonommaksi) kuluneen ajan mediaani oli noin 5 kuukautta. Yhdelläkään potilaista ei esiintynyt rebound-ilmiötä keskeyttämisjakson aikana. Yhteensä 76,5 %:lla (218/285) uusintahoitojakson aloittaneista potilaista lääkärin yleisarvio oli ”puhdas” tai ”melkein puhdas” 16 uusintahoitoviikon kuluttua riippumatta siitä, esiintyikö relapseja keskeyttämisjakson aikana (69,1 % [123/178] potilaista, joilla oli relapsi keskeyttämisjakson aikana, ja 88,8 % [95/107] potilaista, joilla ei ollut relapsia keskeyttämisjakson aikana). Uusintahoidon aikana turvallisuusprofiili oli samankaltainen kuin ennen hoidon keskeyttämistä.
DLQI-elämänlaatumittarilla (Dermatology Life Quality Index) mitattuna potilaiden vointi koheni merkitsevästi viikkoon 16 mennessä lähtötilanteeseen nähden, kun tuloksia verrattiin lumehoitoon (tutkimukset I ja II) ja metotreksaattiin (tutkimus II). Tutkimuksessa I myös SF-36-mittarin fyysisten ja psyykkisten osioiden yhteispisteet paranivat merkitsevästi verrattuna lumehoitoon.
Avoimessa jatkotutkimuksessa osa potilaista siirtyi riittämättömän PASI-vasteen (< 50 %) vuoksi käyttämään 40 mg annoksia joka viikko joka toisen viikon sijasta. Näistä potilaista 26,4 % (92/349) saavutti PASI 75 -vasteen 12 viikon kuluttua ja 37,8 % (132/349) 24 viikon kuluttua tehostettuun hoitoon siirtymisestä.
Psoriaasitutkimus III (REACH) vertasi Humira- ja lumehoidon tehoa ja turvallisuutta 72 potilaalla, joilla oli keskivaikea tai vaikea krooninen läiskäpsoriaasi ja käsi- ja/tai jalkapsoriaasi. Potilaat saivat 16 viikon ajan joko lumehoitoa tai Humiraa aloitusannoksen 80 mg ja tämän jälkeen 40 mg joka toinen viikko (alkaen yksi viikko aloitusannoksen jälkeen). 16 viikon kohdalla tilastollisesti merkitsevästi suuremmalla osalla potilaista, jotka saivat Humira-hoitoa (30,6 %), iho oli lääkärin yleisarvion mukaan puhdas tai melkein puhdas käsien ja/tai jalkojen osalta verrattuna niihin potilaisiin, jotka saivat lumehoitoa (4,3 %, [p = 0,014]).
Psoriaasitutkimus IV vertasi Humiran ja lumelääkkeen tehoa ja turvallisuutta 217 aikuispotilaalla, joilla oli keskivaikea tai vaikea kynsipsoriaasi. Potilaat saivat joko Humiraa (aloitusannos 80 mg, jonka jälkeen 40 mg joka toinen viikko alkaen viikon kuluttua aloitusannoksesta) tai lumelääkettä 26 viikon ajan, minkä jälkeen he jatkoivat avointa Humira-hoitoa toiset 26 viikkoa. Kynsipsoriaasia arvioitiin mNAPSI (Modified Nail Psoriasis Severity Index)-, PGA-F (Physician’s Global Assessment of Fingernail Psoriasis)- ja NAPSI (Nail Psoriasis Severity Index) -mittareilla (ks. taulukko 13). Kynsipsoriaasipotilaat, joilla oli eriasteisia iho-oireita (60 %:lla potilaista psoriaasi peitti ≥ 10 % kehon pinta-alasta ja 40 %:lla potilaista psoriaasi peitti < 10 % ja ≥ 5 % kehon pinta-alasta) hyötyivät Humira-hoidosta.
Taulukko 13
Psoriaasitutkimus IV Tehotulokset 16, 26 ja 52 viikon kohdalla
Päätetapahtuma | Viikko 16 lumekontrolloitu | Viikko 26 lumekontrolloitu | Viikko 52 avoin jakso | ||
lumelääke N = 108 | Humira 40 mg joka 2. viikko N = 109 | lumelääke N = 108 | Humira 40 mg joka 2. viikko N = 109 | Humira 40 mg joka 2. viikko N = 80 | |
≥ mNAPSI 75 (%) | 2,9 | 26,0a | 3,4 | 46,6a | 65,0 |
PGA-F puhdas/melkein puhdas ja ≥ 2 asteen paraneminen (%) | 2,9 | 29,7a | 6,9 | 48,9a | 61,3 |
Prosentuaalinen muutos sormenkynsien kokonais-NAPSI-pistemäärässä (%) | -7,8 | -44,2 a | -11,5 | -56,2a | -72,2 |
a p < 0.001, Humira vs. Lumelääke | |||||
Humira-hoitoa saaneilla potilailla elämänlaatu parani tilastollisesti merkitsevästi verrattuna lumelääkettä saaneisiin potilaisiin DLQI-elämänlaatumittarilla mitattuna 26 hoitoviikon kohdalla.
Crohnin tauti aikuisilla
Humiran tehoa ja turvallisuutta arvioitiin satunnaistetuissa, kaksoissokkoutetuissa ja lume-kontrolloiduissa tutkimuksissa yli 1 500 potilaalla, joilla oli keskivaikea tai vaikea aktiivinen Crohnin tauti (pisteet taudin aktiivisuutta mittaavalla CDAI-indeksillä ≥ 220 ja ≤ 450). Aminosalisylaatit, kortikosteroidit ja/tai immunomodulaattorit muuttumattomina annoksina olivat tutkimuksen aikana sallittuja, ja 80 % potilaista sai ainakin yhtä näistä lääkityksistä.
Kliinisen remission (määritelmän mukaan CDAI < 150) induktiota arvioitiin Crohn-tutkimuksessa I (CLASSIC I) ja Crohn-tutkimuksessa II (GAIN). Crohn-tutkimuksessa I 299 potilasta, jotka eivät olleet aiemmin saaneet TNF-salpaajia, satunnaistettiin johonkin neljästä tutkimusryhmästä. Ryhmille annettiin joko lumelääkettä viikoilla 0 ja 2, 160 mg Humiraa viikolla 0 ja 80 mg Humiraa viikolla 2, 80 mg Humiraa viikolla 0 ja 40 mg Humiraa viikolla 2, tai 40 mg Humiraa viikolla 0 ja 20 mg Humiraa viikolla 2. Crohn-tutkimukseen II otettiin 325 potilasta, jotka olivat joko menettäneet infliksimabihoitovasteensa tai eivät sietäneet infliksimabia. Heidät satunnaistettiin saamaan joko 160 mg Humiraa viikolla 0 ja 80 mg Humiraa viikolla 2 tai lumelääkettä viikoilla 0 ja 2. Potilaat, joilla ei saavutettu primaarista hoitovastetta, suljettiin pois tutkimuksista, eikä heitä arvioitu pidempään.
Crohn-tutkimuksessa III (CHARM) arvioitiin kliinisen remission pysyvyyttä. Crohn-tutkimuksessa III 854 potilasta sai avoimesti 80 mg Humiraa viikolla 0 ja 40 mg Humiraa viikolla 2. Viikolla 4 potilaat satunnaistettiin saamaan joko 40 mg Humiraa joka toinen viikko, 40 mg Humiraa kerran viikossa tai lumelääkettä. Tutkimuksen kokonaiskesto oli 56 viikkoa. Potilaat, joilla todettiin kliininen hoitovaste (CDAI-pisteiden väheneminen ≥ 70:lla) viikolla 4, stratifioitiin ja analysoitiin erillään potilaista, joilla ei saavutettu kliinistä hoitovastetta viikkoon 4 mennessä. Kortikosteroidiannoksen pienentäminen sallittiin viikon 8 jälkeen.
Crohn-tutkimuksissa I ja II saavutetut remissio- ja vasteprosentit on esitetty taulukossa 14.
Taulukko 14 Kliininen remissio ja vasteet (% potilaista) | |||||
Crohn-tutkimus I: potilaat, jotka eivät olleet aiemmin saaneet infliksimabia | Crohn-tutkimus II: aiemmin infliksimabia saaneet potilaat | ||||
Lumelääke N = 74 | Humira 80/40 mg N = 75 | Humira 160/80 mg N = 76 | Lumelääke N = 166 | Humira 160/80 mg N = 159 | |
Viikko 4 | |||||
Kliininen remissio | 12 % | 24 % | 36 %* | 7 % | 21 %* |
Kliininen vaste (CR-100) | 24 % | 37 % | 49 %** | 25 % | 38 %** |
Kaikki p-arvot on saatu Humiran ja lumelääkkeen osuuksien parivertailuista. * p < 0,001 ** p < 0,01 | |||||
Remissioprosentit olivat viikon 8 kohdalla samankaltaiset riippumatta siitä, saivatko potilaat hoidon alussa 160/80 mg vai 80/40 mg Humiraa, mutta 160/80 mg saaneilla potilailla haittatapahtumien esiintymistiheys oli suurempi.
Crohn-tutkimuksessa III 58 %:lla potilaista (499/854) todettiin kliininen vaste viikolla 4, ja nämä potilaat otettiin mukaan päävasteanalyysiin. Viikkoon 4 mennessä kliinisen hoitovasteen saavuttaneista potilaista 48 % oli saanut aiemmin jotain muuta TNF-salpaajahoitoa. Remission ja vasteiden pysyvyys on esitetty taulukossa 15. Kliinisen remission ylläpidon suhteen tulokset pysyivät melko muuttumattomina aiemmista TNF-salpaajahoidoista riippumatta.
Sairauteen liittyvien sairaalahoitojaksojen ja leikkausten määrä väheni adalimumabihoidolla lumehoitoon verrattuna tilastollisesti merkitsevästi viikolla 56.
Taulukko 15 Kliinisen remission ja vasteiden ylläpito (% potilaista) | |||
Lumelääke | 40 mg Humiraa joka toinen viikko | 40 mg Humiraa kerran viikossa | |
Viikko 26 | N = 170 | N = 172 | N = 157 |
Kliininen remissio | 17 % | 40 %* | 47 %* |
Kliininen vaste (CR-100) | 27 % | 52 %* | 52 %* |
Potilaat, joiden remissio ilman steroideja kesti ≥ 90 päivääa | 3 % (2/66) | 19 % (11/58)** | 15 % (11/74)** |
Viikko 56 | N = 170 | N = 172 | N = 157 |
Kliininen remissio | 12 % | 36 %* | 41 %* |
Kliininen vaste (CR-100) | 17 % | 41 %* | 48 %* |
Potilaat, joiden remissio ilman steroideja kesti ≥ 90 päivääa | 5 % (3/66) | 29 % (17/58)* | 20 % (15/74)** |
* p < 0,001 saatu Humiran ja lumelääkkeen osuuksien parivertailuista ** p < 0,02 saatu Humiran ja lumelääkkeen osuuksien parivertailuista a Potilaista, jotka käyttivät lähtötilanteessa kortikosteroideja | |||
Potilaista, joilla ei todettu hoitovastetta viikolla 4, 43 % Humiraa ylläpitohoitona saaneista ja 30 % lumelääkettä ylläpitohoitona saaneista potilaista saavuttivat hoitovasteen viikkoon 12 mennessä. Näiden tulosten perusteella ylläpitohoidon jatkamisesta viikolle 12 voi olla hyötyä joillekin potilaille, joilla ei saavuteta hoitovastetta viikkoon 4 mennessä. Hoidon jatkaminen yli 12 viikon ajan ei lisännyt merkitsevästi vasteen saaneiden lukumäärää (ks. kohta Annostus ja antotapa).
117/276 potilasta Crohn-tutkimuksesta I ja 272/777 potilasta Crohn-tutkimuksista II ja III seurattiin vähintään 3 vuoden ajan avoimessa adalimumabihoidossa. 88 (tutkimuksessa I) ja 189 (tutkimuksissa II ja III) potilasta pysyi kliinisessa remissiossa. Kliininen vaste (CR-100) säilyi 102 (tutkimuksessa I) ja 233 potilaalla (tutkimuksissa II ja III).
Elämänlaatu
Crohn-tutkimuksissa I ja II potilailla, jotka oli satunnaistettu saamaan Humiraa joko annoksena 80/40 mg tai 160/80 mg, todettiin lumelääkettä saaneisiin potilaisiin verrattuna tilastollisesti merkitsevää paranemista tulehduksellisia suolistosairauksia spesifisesti arvioivan IBDQ-kyselylomakkeen kokonaispisteissä viikolla 4. Samansuuntaista paranemista todettiin myös Crohn-tutkimuksessa III viikolla 26 ja viikolla 56 adalimumabia saaneissa hoitoryhmissä lumelääkkeeseen verrattuna.
Uveiitti aikuisilla
Humiran turvallisuutta ja tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (UV I ja II) aikuispotilailla, joilla oli ei-infektioperäinen intermediaarinen uveiitti, posteriorinen uveiitti tai panuveiitti, pois lukien pelkkää anteriorista uveiittia sairastavat. Potilaat saivat joko lumelääkettä tai Humiraa (80 mg aloitusannos, jonka jälkeen 40 mg joka toinen viikko; ensimmäinen 40 mg annos otettiin viikon kuluttua aloitusannoksesta). Samanaikainen hoito yhdellä vakaa-annoksisella ei-biologisella immunosuppressantilla sallittiin.
UV I -tutkimuksessa arvioitiin 217 potilasta, joilla oli aktiivinen uveiitti kortikosteroidihoidosta huolimatta (peroraalinen prednisoni annoksella 10–60 mg/vrk). Kaikki potilaat saivat 2 viikon ajan prednisonihoitoa standardiannoksella 60 mg/vrk tutkimukseenottovaiheessa, jonka jälkeen oli pakollinen annoksen pienentämisvaihe, ja kortikosteroidihoito lopetettiin kokonaan viikkoon 15 mennessä.
UV II -tutkimuksessa arvioitiin 226 potilasta, joiden inaktiivinen uveiitti vaati lähtötilanteessa pitkäaikaista kortikosteroidihoitoa (peroraalinen prednisoni 10–35 mg/vrk) taudin hallinnassa pysymiseksi. Tämän jälkeen oli pakollinen annoksen pienentämisvaihe, ja kortikosteroidihoito lopetettiin kokonaan viikkoon 19 mennessä.
Ensisijainen tehon päätetapahtuma oli kummassakin tutkimuksessa ”hoidon epäonnistumiseen kuluva aika”. Hoidon epäonnistumisen määritelmänä oli monitekijäinen vastemuuttuja, joka perustui inflammatorisiin suoni- ja verkkokalvon ja/tai inflammatorisiin verkkokalvon verisuonien leesioihin, etukammion solujen määrään, lasiaissamentumien asteeseen ja parhaaseen lasikorjattuun näöntarkkuuteen (BCVA).
Potilaat jotka olivat mukana UV I ja UV II -tutkimuksissa olivat oikeutettuja osallistumaan kontrolloimattomaan pitkäkestoiseen jatkotutkimukseen, jonka alkuperäinen suunniteltu kesto oli 78 viikkoa. Potilaat saivat jatkaa tutkimuslääkkeellä viikon 78 jälkeen, siihen saakka kun he saivat Humiraa.
Kliininen vaste
Kummassakin tutkimuksessa havaittiin Humira-ryhmässä tilastollisesti merkitsevä hoidon epäonnistumisriskin pienentyminen vs. lumeryhmä (ks. taulukko 16). Kummassakin tutkimuksessa Humira-hoidolla havaittiin varhainen ja pitkäkestoinen vaikutus hoidon epäonnistumisosuuteen vs. lume (ks. kuva 1).
Taulukko 16
Hoidon epäonnistumiseen kulunut aika UV I- ja UV II -tutkimuksissa
Analyysi Hoito | N | EpäonnistuminenN (%) | Mediaaniaika epäonnistumi-seen (kk) | HRa | 95 % lv, HRa | p-arvob |
Hoidon epäonnistumiseen kulunut aika viikon 6 kohdalla tai sen jälkeen UV I -tutkimuksessa | ||||||
Ensisijainen analyysi (ITT) | ||||||
lume | 107 | 84 (78,5) | 3,0 | -- | -- | -- |
adalimumabi | 110 | 60 (54,5) | 5,6 | 0,50 | 0,36–0,70 | < 0,001 |
Hoidon epäonnistumiseen kulunut aika viikon 2 kohdalla tai sen jälkeen UV II -tutkimuksessa | ||||||
Ensisijainen analyysi (ITT) | ||||||
lume | 111 | 61 (55,0) | 8,3 | -- | -- | -- |
adalimumabi | 115 | 45 (39,1) | EAc | 0,57 | 0,39–0,84 | 0,004 |
Huom. Hoidon epäonnistuminen viikon 6 kohdalla tai sen jälkeen (UV I -tutkimus) tai viikon 2 kohdalla tai sen jälkeen (UV II -tutkimus) laskettiin tapahtumaksi. Muusta syystä kuin hoidon epäonnistumisesta johtuneet keskeytykset tutkimuksessa rajattiin keskeytyshetken kohdalta.
- Adalimumabin vs. lumeen riskisuhde (HR) laskettiin suhteellisen riskin regressiolla, jossa tekijänä oli hoito.
- 2-tahoinen p-arvo laskettiin log-rank-testillä.
- EA = ei arvioitavissa. Alle puolella riskille alttiista potilaista esiintyi tapahtuma.
Kuva 1: Hoidon epäonnistumiseen kulunut aika yhteenvetona Kaplan–Meier-käyrinä viikon 6 kohdalla tai sen jälkeen (UV I -tutkimus) tai viikon 2 kohdalla tai sen jälkeen (UV II -tutkimus)
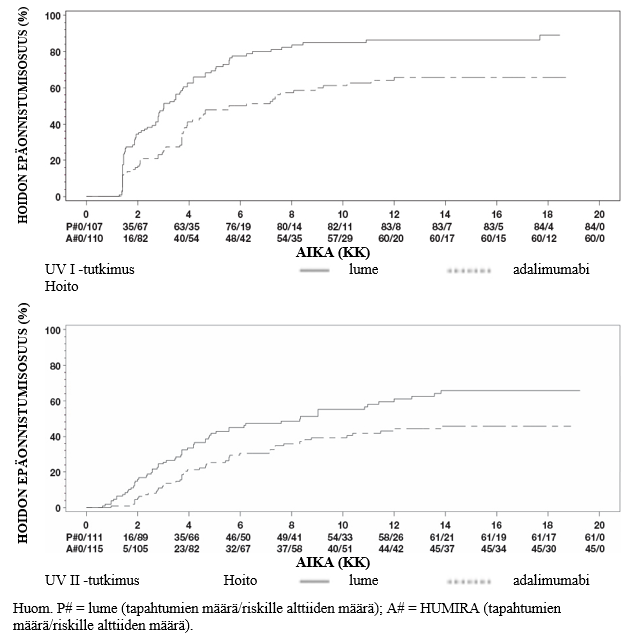
UV I -tutkimuksessa havaittiin tilastollisesti merkitseviä eroja adalimumabin hyväksi vs. lume kunkin hoidon epäonnistumisen osatekijän osalta. UV II -tutkimuksessa havaittiin tilastollisesti merkitseviä eroja vain näöntarkkuuden osalta, mutta muutkin osatekijät olivat adalimumabilla numeerisesti paremmat.
Tutkimusten UV I ja UV II kontrolloimattomaan pitkäkestoiseen jatkotutkimukseen otettiin 424 tutkittavaa. Heistä 60 tutkittavan ei katsottu soveltuvan analyysiin (esim. poikkeamien, diabeettisen retinopatian sekundaaristen komplikaatioiden, kaihileikkauksen tai vitrektomian vuoksi), ja heidät suljettiin pois ensisijaisesta tehoanalyysistä. Jäljelle jääneistä 364 tutkittavasta 269 arviointikelpoista tutkittavaa (74 %) sai avointa adalimumabihoitoa 78 viikon ajan. Havaintotietojen perusteella 216 tutkittavan (80,3 %) tilanne oli rauhallinen (ei aktiivisia tulehdusmuutoksia, etukammion solujen määrä ≤ 0,5+, lasiaissamentumien aste ≤ 0,5+) ja samanaikaisesti käytössä ollut steroidiannos oli ≤ 7,5 mg/vrk. 178 tutkittavalla (66,2 %) tilanne oli rauhallinen eikä käytössä ollut steroidilääkitystä. Paras lasikorjattu näöntarkkuus (BCVA) oli joko aiempaa parempi tai ennallaan (huonontunut < 5 kirjaimen verran) 88,6 %:ssa silmistä viikolla 78. Viikon 78 jälkeiset tiedot olivat yleisesti yhdenmukaisia näiden tulosten kanssa, mutta (tutkimukseen) osallistuneiden tutkittavien määrä laski tämän ajan jälkeen. Kaiken kaikkiaan tutkimuksen keskeyttäneistä tutkittavista 18 % keskeytti osallistumisensa haittatapahtumien vuoksi ja 8 % siksi, että adalimumabihoidolla saavutettu vaste oli riittämätön.
Elämänlaatu
Kummassakin kliinisessä tutkimuksessa arvioitiin potilaiden ilmoittamia lopputulemia näköön liittyvästä toimintakyvystä NEI VFQ-25-kyselyllä. Humira oli numeerisesti parempi valtaosassa alaosioista, ja tilastollisesti merkitsevät keskimääräiset erot saavutettiin UV I -tutkimuksessa yleisen näkökyvyn, silmäkivun, lähinäön, mielenterveyden ja kokonaispisteiden alaosioissa sekä UV II -tutkimuksessa yleisen näkökyvyn ja mielenterveyden alaosioissa. Näkökykyyn liittyvät vaikutukset eivät olleet Humira-hoidolla numeerisesti parempia UV I -tutkimuksessa värinäön osalta ja UV II -tutkimuksessa värinäön, perifeerisen näön ja lähinäön osalta.
Immunogeenisuus
Anti-adalimumabivasta-aineiden muodostus tehostaa adalimumabin puhdistumaa ja heikentää sen tehoa. Anti-adalimumabivasta-aineiden muodostuksen ja haittatapahtumien esiintymistiheyden välillä ei ole mitään selkeää yhteyttä.
Anti-adalimumabivasta-aineita todettiin 15,8 %:lla (27/171) niistä idiopaattista juveniilia polyartriittia sairastavista 4‑17-vuotiaista potilaista, jotka saivat adalimumabia. Potilailla, jotka eivät saaneet samanaikaisesti metotreksaattia, ilmaantuvuus oli 25,6 % (22/86), kun taas potilailla, joilla adalimumabia käytettiin metotreksaattihoidon lisänä, ilmaantuvuus oli 5,9 % (5/85). Anti‑adalimumabivasta-aineita todettiin 7 %:lla (1/15) idiopaattista juveniilia polyartriittia sairastavista 2 < 4-vuotiaista tai alle 15 kg painavista 4-vuotiaista tai vanhemmista potilaista. Tämä yksi potilas sai samanaikaista metotreksaattihoitoa.
Entesiitteihin liittyvää artriittia sairastavilla potilailla anti-adalimumabivasta-aineita todettiin 10,9 %:lla (5/46) adalimumabia saaneista potilaista. Potilailla, jotka eivät saaneet samanaikaisesti metotreksaattia, ilmaantuvuus oli 13,6 % (3/22), kun taas potilailla, joilla adalimumabia käytettiin metotreksaattihoidon lisänä, ilmaantuvuus oli 8,3 % (2/24).
Nivelreumatutkimuksissa I, II, ja III potilailta mitattiin anti-adalimumabivasta-aineet 6–12 kuukauden aikana useana ajankohtana. Avaintutkimuksissa anti-adalimumabivasta-aineita todettiin 5,5 %:lla (58/1 053) adalimumabia saaneista potilaista ja 0,5 %:lla (2/370) lumeryhmän potilaista. Niiden ilmaantuvuus oli 12,4 % potilailla, jotka eivät saaneet samanaikaisesti metotreksaattia, ja 0,6 % potilailla, jotka saivat adalimumabia metotreksaattihoidon lisänä.
Kun 38 pediatrista psoriaasipotilasta sai 0,8 mg/kg adalimumabia monoterapiana, anti-adalimumabivasta-aineita todettiin 5 tutkimushenkilöllä (13 %).
Kun 920 aikuista psoriaasipotilasta sai adalimumabia monoterapiana, anti-adalimumabivasta-aineita todettiin 77 tutkimushenkilöllä (8,4 %).
Pitkään adalimumabimonoterapiahoitoa saaneilla aikuisilla läiskäpsoriaasipotilailla, jotka osallistuivat hoidon keskeyttämistä ja uudelleenaloitusta arvioivaan tutkimukseen, anti-adalimumabivasta-aineita todettiin hoidon uudelleenaloituksen jälkeen (11/482 potilaalla; 2,3 %) samassa määrin kuin ennen hoidon keskeytystä (11/590 potilaalla; 1,9 %).
Keskivaikeaa tai vaikeaa, aktiivista Crohnin tautia sairastavilla lapsilla anti-adalimumabivasta-aineita esiintyi 3,3 %:lla adalimumabia saavista potilaista.
Anti-adalimumabivasta-aineita todettiin 7:llä 269:stä Crohnin tautia sairastavasta potilaasta (2,6 %).
Ei-infektioperäistä uveiittia sairastavilla aikuispotilailla anti-adalimumabivasta-aineita todettiin 4,8 %:lla (12/249) adalimumabihoitoa saaneista potilaista.
Koska immunogeenisuusanalyysit ovat valmistekohtaisia, vasta-aineiden esiintyvyyksien vertailu muita valmisteita koskevien vasta-aineiden esiintyvyyksiin ei ole tarkoituksenmukaista.
Pediatriset potilaat
Idiopaattinen juveniili artriitti (JIA)
Idiopaattinen juveniili polyartriitti (pJIA)
Humiran tehoa ja turvallisuutta arvioitiin kahdessa tutkimuksessa (pJIA-tutkimukset I ja II) lapsilla, joilla oli aktiivinen idiopaattinen juveniili polyartriitti tai taudinkulultaan polyartikulaarinen idiopaattinen juveniili artriitti. Idiopaattisen juveniilin artriitin alkuvaihe vaihteli, mutta useimmiten kyseessä oli aluksi reumatekijänegatiivinen tai -positiivinen polyartriitti tai leviävä oligoartriitti.
pJIA-I
Humiran tehoa ja turvallisuutta arvioitiin satunnaistetussa, kaksoissokkoutetussa, rinnakkaisryhmissä toteutetussa monikeskustutkimuksessa, johon osallistui 171 lasta, joilla oli idiopaattinen juveniili polyartriitti (ikä 4–17 v). Avoimessa aloitusvaiheessa potilaat stratifioitiin kahteen ryhmään, metotreksaattia käyttäviin ja ei metotreksaattia käyttäviin. Potilaat, jotka eivät käyttäneet metotreksaattia, eivät joko olleet käyttäneet sitä koskaan tai olivat lopettaneet sen käytön viimeistään kaksi viikkoa ennen tutkimuslääkkeen antamista. Potilaat käyttivät edelleen vakaina annoksina steroideihin kuulumattomia tulehduskipulääkkeitä (NSAID-lääkkeitä) ja/tai prednisonia (≤ 0,2 mg/kg/vrk tai enintään 10 mg/vrk). Avoimessa aloitusvaiheessa kaikki potilaat saivat 24 mg/m2 Humira-hoitoa (enintään 40 mg) joka toinen viikko 16 viikon ajan. Potilaiden jakaumat iän ja avoimessa aloitusvaiheessa käytetyn minimi-, mediaani- ja maksimiannoksen mukaan esitetään taulukossa 17.
Taulukko 17
Potilaiden jakauma iän ja avoimessa aloitusvaiheessa käytetyn adalimumabiannoksen mukaan
Ikäryhmä | Potilasmäärä lähtötilanteessa, n (%) | Minimi-, mediaani- ja maksimiannos |
4–7 v | 31 (18,1) | 10, 20 ja 25 mg |
8–12 v | 71 (41,5) | 20, 25 ja 40 mg |
13–17 v | 69 (40,4) | 25, 40 ja 40 mg |
Potilaat, joilla saavutettiin Paediatric ACR 30 -vaste viikolla 16, voitiin satunnaistaa kaksoissokkoutettuun vaiheeseen, jossa he saivat joko Humiraa (24 mg/m2, enintään 40 mg) tai lumelääkettä joka toinen viikko vielä 32 viikon ajan tai taudin pahenemisvaiheeseen saakka. Pahenemisvaiheen kriteerit määriteltiin seuraavasti: lähtötasoon verrattuna ≥ 30 % huonompi tulos vähintään 3:ssa Paediatric ACR -kriteerien 6 keskeisestä kriteeristä, tautiaktiivisuutta ≥ 2 nivelessä ja > 30 % parempi tulos enintään 1 kriteerin kohdalla 6:sta. 32 viikon kuluttua tai taudin pahenemisvaiheessa potilaat saivat siirtyä avoimeen jatkovaiheeseen.
Taulukko 18
Idiopaattisen juveniilin polyartriitin tutkimuksen Pediatric ACR 30 -vasteprosentit
Ryhmä | Metotreksaatti | Ei metotreksaattia | ||
Vaihe | ||||
Avoin aloitusvaihe, 16 viikkoa | ||||
PedACR 30 ‑vaste (n/N) | 94,1 % (80/85) | 74,4 % (64/86) | ||
Tehokkuustulokset | ||||
Kaksoissokkoutettu vaihe, 32 viikkoa | Humira/MTX (N = 38) | Lume/MTX (N = 37) | Humira (N = 30) | Lume (N = 28) |
Potilaat, joilla esiintyi taudin pahenemisvaiheita 32 viikon aikanaa (n/N) | 36,8 % (14/38) | 64,9 % (24/37) b | 43,3 % (13/30) | 71,4 % (20/28) c |
Pahenemisvaiheen alkamiseen kuluneen ajan mediaani | > 32 viikkoa | 20 viikkoa | > 32 viikkoa | 14 viikkoa |
a Ped ACR 30/50/70 -vasteprosentit viikolla 48 merkitsevästi suuremmat kuin lumeryhmässä
b p = 0,015
c p = 0,031
Jos tutkimushenkilö saavutti vasteen viikolla 16 (n = 144), Paediatric ACR 30/50/70/90 -vaste säilyi jopa 6 vuoden ajan avoimessa jatkovaiheessa niillä potilailla, jotka saivat Humiraa koko tutkimuksen ajan. Yhteensä 19 tutkimushenkilöä sai hoitoa vähintään 6 vuoden ajan. 11 heistä kuului lähtötilanteessa 4–12-vuotiaiden ikäryhmään ja 8 taas lähtötilanteessa 13–17-vuotiaiden ikäryhmään.
Kokonaisvasteprosentit olivat yleisesti ottaen paremmat ja harvemmille potilaille kehittyi vasta-aineita Humiran ja metotreksaatin yhdistelmää käytettäessä kuin pelkän Humira-hoidon aikana. Kun nämä tulokset otetaan huomioon, Humiraa suositellaan käytettäväksi yhdessä metotreksaatin kanssa ja käytettäväksi ainoana lääkkeenä niillä potilailla, joille metotreksaatin käyttö ei sovi (ks. kohta Annostus ja antotapa).
pJIA-II
Humiran turvallisuutta ja tehoa arvioitiin avoimessa monikeskustutkimuksessa, johon osallistui 32 lasta (ikä 2– < 4 v tai ikä vähintään 4 v ja paino < 15 kg), joilla oli keskivaikea tai vaikea, aktiivinen idiopaattinen juveniili polyartriitti. Potilaat saivat Humira-valmistetta kerta-annoksen 24 mg/m2 kehon pinta-alasta (enintään 20 mg) joka toinen viikko injektiona ihon alle vähintään 24 viikon ajan. Useimmat potilaat käyttivät tutkimuksen aikana samanaikaisesti myös metotreksaattia, kun taas kortikosteroidien tai tulehduskipulääkkeiden käyttöä ilmoitettiin harvemmin.
Viikolla 12 PedACR30-vasteprosentti oli 93,5 % ja viikolla 24 90,0 % (havaintotiedot). Viikolla 12 PedACR50/70/90-vasteen saavutti 90,3 %/61,3 %/38,7 % potilaista ja viikolla 24 83,3 %/73,3 %/36,7 % potilaista. Niistä potilaista, jotka saavuttivat Paediatric ACR 30 -vasteen viikolla 24 (n = 27 yhteensä 30 potilaasta), Paediatric ACR 30 -vaste säilyi jopa 60 viikon ajan avoimessa jatkovaiheessa, kun potilaat saivat Humiraa koko tämän ajan. Yhteensä 20 potilasta sai hoitoa vähintään 60 viikon ajan.
Entesiitteihin liittyvä artriitti
Humiran turvallisuutta ja tehoa arvioitiin satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa, johon osallistui 46 pediatrista potilasta (6–17-vuotiaita), joilla oli keskivaikea entesiitteihin liittyvä artriitti. Potilaat satunnaistettiin saamaan joko Humiraa 24 mg/m2 kehon pinta-alasta (korkeintaan 40 mg) tai lumelääkettä joka toinen viikko 12 viikon ajan. Tutkimus jatkuu kaksoissokkoutetun jakson jälkeen avoimena tutkimuksena vielä 192 viikon ajan. Avoimen tutkimusjakson aikana potilaat saivat Humiraa 24 mg/m2 kehon pinta-alasta (korkeintaan 40 mg) joka toinen viikko injektiona ihon alle. Ensisijaisena päätetapahtuma pidettiin prosentuaalista muutosta lähtötilanteesta viikolle 12 aktiivisten tulehtuneiden nivelten määrässä (nivelen turvotusta, joka ei johtunut epämuodostumasta, tai niveliä, joissa oli liikerajoitteita sekä kipua ja/tai arkuutta).
Ensisijainen päätetapahtuma saavutettiin, sillä Humira-ryhmässä todettiin keskimäärin -62,6 %:n muutos (muutoksen mediaani -88,9 %) ja lumelääkeryhmässä -11,6 %:n muutos (muutoksen mediaani -50,0 %). Aktiivisten tulehtuneiden nivelten määrässä havaittu positiivinen muutos säilyi samana avoimen tutkimusjakson viikolle 156 asti 26:lla tutkimuksessa jatkaneesta Humira-ryhmän 31:sta potilaasta (84 %). Enemmistöllä potilaista myös toissijaisten päätetapahtumien mittareissa, kuten entesiitin esiintymiskohtien määrä, arkojen nivelten määrä (tender joint count, TJC), turvonneiden nivelten määrä (swollen joint count, SJC), Paediatric ACR 50 -vaste ja Paediatric ACR 70 -vaste, havaittiin kliinistä paranemista, vaikkakaan ei tilastollisesti merkitsevästi.
Läiskäpsoriaasi lapsilla
Humiran tehoa arvioitiin satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa tutkimuksessa 114:llä vähintään 4-vuotiaalla pediatrisella potilaalla, joilla oli vaikea krooninen läiskäpsoriaasi (määritelmänä lääkärin yleisarvio ≥ 4 tai > 20 % kehon pinta-alasta tai > 10 % kehon pinta-alasta sekä hyvin paksuja leesioita tai PASI ≥ 20 tai ≥ 10 sekä kliinisesti merkittäviä muutoksia kasvoissa, sukuelimissä tai käsissä/jalkaterissä) ja joilla paikallishoito ja auringonvalohoito tai valohoito eivät olleet tuottaneet riittävää vastetta.
Potilaat saivat Humiraa 0,8 mg/kg joka toinen viikko (enintään 40 mg), 0,4 mg/kg joka toinen viikko (enintään 20 mg) tai metotreksaattia 0,1–0,4 mg/kg viikoittain (enintään 25 mg). Viikon 16 kohdalla positiivinen tehovaste (esim. PASI 75) havaittiin useammin Humira 0,8 mg/kg -hoitoon satunnaistetuilla potilailla kuin potilailla, jotka oli satunnaistettu saamaan Humiraa 0,4 mg/kg joka toinen viikko tai metotreksaattia.
Taulukko 19: Tehotulokset pediatrisilla läiskäpsoriaasipotilailla 16 viikon kohdalla | ||
MTXa N = 37 | Humira (0,8 mg/kg joka 2. viikko) N = 38 | |
PASI 75b | 12 (32,4 %) | 22 (57,9 %) |
Lääkärin yleisarvio: puhdas/melkein puhdasc | 15 (40,5 %) | 23 (60,5 %) |
a MTX = metotreksaatti b p = 0,027, Humira 0,8 mg/kg vs. MTX c p = 0,083, Humira 0,8 mg/kg vs. MTX | ||
Jos potilas saavutti PASI 75 -vasteen ja lääkärin yleisarvio oli puhdas tai melkein puhdas, hoito keskeytettiin enintään 36 viikoksi ja potilasta seurattiin taudin pahenemisen varalta (lääkärin yleisarvio huononee vähintään 2 astetta). Tämän jälkeen potilaat saivat uusintahoitona 0,8 mg/kg adalimumabia joka toinen viikko vielä 16 viikon ajan. Uusintahoidon aikana havaitut vasteet olivat samaa luokkaa kuin aiemman kaksoissokkovaiheen aikana: PASI 75 -vasteen saavutti 78,9 % tutkimushenkilöistä (15 tutkimushenkilöä 19:stä) ja lääkärin yleisarvion puhdas tai melkein puhdas iho 52,6 % tutkimushenkilöistä (10 tutkimushenkilöä 19:stä).
Tutkimuksen avoimessa vaiheessa PASI 75 -vaste ja lääkärin yleisarvio puhdas tai melkein puhdas iho säilyivät vielä enintään 52 viikon ajan ilman uusia turvallisuuslöydöksiä.
Crohnin tauti lapsilla
Humira-hoitoa arvioitiin satunnaistetussa, kaksoissokkoutetussa kliinisessä monikeskustutkimuksessa, jossa arvioitiin induktio- ja ylläpitohoidon tehoa ja turvallisuutta painon (< 40 kg tai ≥ 40 kg) mukaisina annoksina 192 lapsipotilaalla, joiden ikä oli 6–17 vuotta ja joilla oli keskivaikea tai vaikea Crohnin tauti (määritelmä: Paediatric Crohn’s Disease Activity Index -pisteet [PCDAI] > 30). Mukaan otettiin vain potilaita, joilla Crohnin taudin tavanomainen hoito (mm. kortikosteroidi- ja/tai immunomodulanttihoito) oli epäonnistunut. Myös aiemman infliksimabihoitovasteen menettäminen tai infliksimabihoitoon liittyneet siedettävyysongelmat olivat hyväksyttäviä mukaanottoperusteita.
Kaikki potilaat käyttivät avointa induktiohoitoa, jonka annos riippui heidän painostaan lähtötilanteessa. ≥ 40 kg painoiset potilaat saivat 160 mg annoksen viikolla 0 ja 80 mg annoksen viikolla 2. Alle 40 kg painoiset taas saivat 80 mg viikolla 0 ja 40 mg viikolla 2.
Viikolla 4 potilaat satunnaistettiin ajankohtaisen painon mukaan suhteessa 1:1 käyttämään joko pieniä tai tavanomaisia annoksia ylläpitohoitona (ks. taulukko 20).
Taulukko 20 Ylläpitohoito | ||
Paino | Pieni annos | Tavanomainen annos |
< 40 kg | 10 mg joka 2. viikko | 20 mg joka 2. viikko |
≥ 40 kg | 20 mg joka 2. viikko | 40 mg joka 2. viikko |
Tehotulokset
Tutkimuksen ensisijainen päätetapahtuma oli kliininen remissio viikolla 26 (määritelmä: PCDAI-pisteet ≤ 10).
Kliiniset remissio- ja vasteprosentit esitetään taulukossa 21 (Kliinisen vasteen määritelmä: PCDAI-pisteet pienenivät vähintään 15 p lähtöarvoihin nähden). Kortikosteroidi- tai immunomodulanttihoidon lopettamisprosentit esitetään taulukossa 22.
Taulukko 21 Tutkimus lasten Crohnin taudista Kliininen PCDAI-remissio ja vaste | |||
Tavanomainen annos 40/20 mg joka 2. viikko N = 93 | Pieni annos 20/10 mg joka 2. viikko N = 95 | p-arvo* | |
Viikko 26 | |||
Kliininen remissio | 38,7 % | 28,4 % | 0,075 |
Kliininen vaste | 59,1 % | 48,4 % | 0,073 |
Viikko 52 | |||
Kliininen remissio | 33,3 % | 23,2 % | 0,100 |
Kliininen vaste | 41,9 % | 28,4 % | 0,038 |
* Tavanomaisen ja pienen annoksen vertailun p-arvo. | |||
Taulukko 22 Tutkimus lasten Crohnin taudista Kortikosteroidien tai immunomodulanttien lopettaminen ja fistelien remissio | |||
Tavanomainen annos 40/20 mg joka 2. viikko | Pieni annos 20/10 mg joka 2. viikko | p-arvo1 | |
Lopetti kortikosteroidit | N = 33 | N = 38 | |
Viikko 26 | 84,8 % | 65,8 % | 0,066 |
Viikko 52 | 69,7 % | 60,5 % | 0,420 |
Lopetti immunomodulantit2 | N = 60 | N = 57 | |
Viikko 52 | 30,0 % | 29,8 % | 0,983 |
Fistelien remissio3 | N = 15 | N = 21 | |
Viikko 26 | 46,7 % | 38,1 % | 0,608 |
Viikko 52 | 40,0 % | 23,8 % | 0,303 |
1 Tavanomaisen ja pienen annoksen vertailun p-arvo. 2 Immunosuppressanttihoito voitiin lopettaa aikaisintaan viikolla 26 tutkijan arvion mukaan, jos kliinisen vasteen kriteerit täyttyivät. 3 Määritelmä: kaikki lähtötilanteessa vuotaneet fistelit sulkeutuneina vähintään kahdella peräkkäisellä käynnillä lähtötasokäynnin jälkeen. | |||
Molemmissa hoitoryhmissä todettiin, että painoindeksi ja pituuskasvunopeus suurenivat (paranivat) tilastollisesti merkitsevästi lähtötilanteen ja viikkojen 26 ja 52 välillä.
Molemmissa hoitoryhmissä todettiin myös elämänlaatuparametrien (mm. IMPACT III) parantuneen tilastollisesti ja kliinisesti merkitsevästi lähtötilanteeseen nähden.
Lasten Crohnin tauti -tutkimukseen osallistuneista potilaista sata (n = 100) jatkoi avoimeen pitkäkestoiseen jatkotutkimukseen. 5 vuoden adalimumabihoidon jälkeen 74,0 % (37/50) 50:stä tutkimuksessa jäljellä olevasta potilaasta pysyi kliinisessä remissiossa, ja 92,0 %:lla (46/50) potilaista säilyi kliininen vaste PCDAI:n mukaan.
Uveiitti lapsilla
Humiran turvallisuutta ja tehoa arvioitiin satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa tutkimuksessa, johon osallistui 90 2 – < 18-vuotiasta lapsipotilasta, joilla oli aktiivinen JIA:iin liittyvä ei-infektioperäinen anteriorinen uveiitti, ja joilla tauti oli refraktaarinen vähintään 12 viikkoa kestäneestä metotreksaattihoidosta huolimatta. Potilaat saivat joko lumelääkettä tai 20 mg adalimumabia (paino < 30 kg) tai 40 mg adalimumabia (paino ≥ 30 kg) joka toinen viikko yhdessä lähtötilanteen metotreksaattiannoksensa kanssa.
Ensisijainen päätetapahtuma oli "hoidon epäonnistumiseen kuluva aika". Hoidon epäonnistumisen määritelmänä oli silmän tulehduksen pahentuminen tai pysyvä ei-paraneminen, osittainen paraneminen, johon liittyi muiden samanaikaisten pysyvien silmäsairauksien kehittyminen tai paheneminen, muun samanaikaisen lääkityksen luvaton käyttö ja hoidon keskeytys pidemmäksi ajaksi.
Kliininen vaste
Adalimumabi viivästytti merkitsevästi hoidon epäonnistumiseen kuluvaa aikaa verrattuna lumelääkkeeseen (ks. kuva 2, p < 0,0001 log-rank-testillä). Mediaaniaika hoidon epäonnistumiseen oli 24,1 viikkoa lumelääkettä saaneilla potilailla. Adalimumabihoitoa saaneiden potilaiden mediaaniaikaa hoidon epäonnistumiseen ei voitu arvioida, koska alle puolella heistä hoito epäonnistui. Adalimumabi pienensi merkitsevästi hoidon epäonnistumisen riskiä 75 %:lla verrattuna lumelääkkeeseen, kuten riskisuhde osoittaa (HR = 0,25 [95 % luottamusväli 0,12‑0,49]).
Kuva 2: Hoidon epäonnistumiseen kulunut aika yhteenvetona Kaplan‑Meier-käyrinä lasten uveiittitutkimuksessa
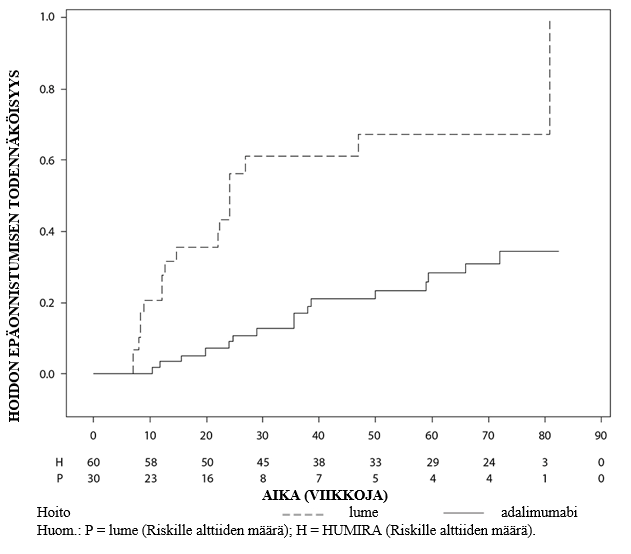
Farmakokinetiikka
Imeytyminen ja jakautuminen
Kun idiopaattista juveniilia polyartriittia sairastavat 4–17-vuotiaat potilaat saivat adalimumabia 24 mg/m2 (enintään 40 mg) ihon alle joka toinen viikko, adalimumabin vakaan tilan minimipitoisuuksien keskiarvo seerumissa (arvot viikoilta 20–48) oli 5,6 ± 5,6 µg/ml (variaatiokerroin 102 %) käytettäessä adalimumabia ilman metotreksaattia ja 10,9 ± 5,2 µg/ml (variaatiokerroin 47,7 %) samanaikaisen metotreksaattihoidon aikana.
Kun idiopaattista juveniilia polyartriittia sairastaville potilaille, joiden ikä oli 2– < 4 v tai ikä vähintään 4 v ja paino < 15 kg, annettiin adalimumabia 24 mg/m2, adalimumabin vakaan tilan minimipitoisuuksien keskiarvo seerumissa oli 6,0 ± 6,1 µg/ml (variaatiokerroin 101 %) käytettäessä adalimumabia ilman metotreksaattia ja 7,9 ± 5,6 µg/ml (variaatiokerroin 71,2 %) samanaikaisen metotreksaattihoidon aikana.
Kun entesiitteihin liittyvää artriittia sairastavat 6–17-vuotiaat potilaat saivat adalimumabia 24 mg/m2 (enintään 40 mg) ihon alle joka toinen viikko, adalimumabin vakaan tilan minimipitoisuuksien keskiarvo seerumissa (mitattu viikolla 24) oli 8,8 ± 6,6 µg/ml käytettäessä adalimumabia ilman metotreksaattia ja 11,8 ± 4,3 µg/ml samanaikaisen metotreksaattihoidon aikana.
Kun kroonista läiskäpsoriaasia sairastaville lapsipotilaille oli annettu 0,8 mg/kg (enintään 40 mg) adalimumabia ihon alle joka toinen viikko, adalimumabin vakaan tilan minimipitoisuuksien keskiarvo (± keskihajonta) oli noin 7,4 ± 5,8 µg/ml (variaatiokerroin 79 %).
Keskivaikeaa tai vaikeaa Crohnin tautia sairastavien lapsipotilaiden avoin adalimumabiannos oli induktiohoidon viikoilla 0 ja 2 joko 160/80 mg (vähintään 40 kg painoiset) tai 80/40 mg (alle 40 kg painoiset). Viikolla 4 potilaat satunnaistettiin suhteessa 1:1 käyttämään ylläpitohoitoa painon mukaan joko tavanomaisina annoksina (40/20 mg joka toinen viikko) tai pieninä annoksina (20/10 mg joka toinen viikko). Seerumin adalimumabipitoisuuksien minimin keskiarvo (± keskihajonta) viikolla 4 oli 15,7 ± 6,6 μg/ml, jos potilas painoi ≥ 40 kg (160/80 mg), ja 10,6 ± 6,1 μg/ml, jos potilas painoi < 40 kg (80/40 mg).
Satunnaistettua hoitoaan jatkaneilla potilailla adalimumabin minimipitoisuuksien keskiarvo (± keskihajonta) viikolla 52 oli tavanomaisen annoksen ryhmässä 9,5 ± 5,6 μg/ml ja pienen annoksen ryhmässä 3,5 ± 2,2 μg/ml. Minimipitoisuuksien keskiarvo pysyi ennallaan, kun potilaat jatkoivat adalimumabihoidon käyttöä joka toinen viikko 52 viikon ajan. Jos hoitoa tehostettiin ottamalla lääke joka viikko, seerumin adalimumabipitoisuuksien keskiarvo (± keskihajonta) oli viikolla 52 joko 15,3 ± 11,4 μg/ml (40/20 mg joka viikko) tai 6,7 ± 3,5 μg/ml (20/10 mg joka viikko).
Adalimumabialtistus uveiittia sairastavilla lapsilla arvioitiin käyttämällä populaatiofarmakokineettistä mallinnusta ja simulaatiota, jotka perustuivat muiden käyttöaiheiden farmakokinetiikkaan muilla lapsipotilailla (psoriaasi lapsilla, juveniili idiopaattinen artriitti, Crohnin tauti lapsilla ja entesiitteihin liittyvä artriitti). Kliinistä tietoa altistumisesta latausannokselle alle 6-vuotiailla lapsilla ei ole saatavilla. Ennustetut altistukset viittaavat siihen, että ilman metotreksaattia latausannos voi johtaa aluksi systeemisen altistuksen nousuun.
Altistus-vastesuhde pediatrisilla potilailla
Plasmapitoisuuden ja PedACR 50 -vasteen välinen altistus-vastesuhde arvioitiin juveniilia idiopaattista artriittia (pJIA ja ERA) sairastavilla potilailla tehtyjen kliinisten tutkimusten perusteella. Havaittava adalimumabin pitoisuus plasmassa, joka aiheuttaa puolet todennäköisestä PedACR 50 -vasteiden enimmäismäärästä (EC50), oli 3 μg/ml (95 % luottamusväli 1‑6 μg/ml).
Adalimumabi pitoisuuden ja tehon välinen altistus-vastesuhde pediatrisilla potilailla, joilla oli vaikea krooninen läiskäpsoriaasi, arvioitiin PASI 75 -vasteelle ja PGA puhdas/melkein puhdas -vasteelle. PASI 75 ja PGA puhdas/melkein puhdas -vasteet paranivat, kun adalimumabipitoisuus nousi. Molemmilla havaittu EC50 oli sama, noin 4,5 μg/ml (95 % luottamusväli 0,4‑47,6 [PASI 75] ja 1,9‑10,5 [PGA]).
Aikuiset
Ihonalaisen 40 mg:n kerta-annoksen jälkeen adalimumabin imeytyminen ja jakautuminen oli hidasta, huippupitoisuus seerumissa saavutettiin n. 5 päivän kuluttua lääkkeen antamisesta. Kolmesta tutkimuksesta saatujen tulosten perusteella adalimumabin absoluuttisen biologisen hyötyosuuden arvioidaan olevan keskimäärin 64 % 40 mg:n ihonalaisen kerta-annoksen jälkeen. Laskimonsisäisten kerta-annosten (0,25‑10 mg/kg) jälkeen pitoisuudet olivat annoksesta riippuvaisia. Puhdistuma 0,5 mg/kg:n annosten (~40 mg) jälkeen oli 11–15 ml/h, jakautumistilavuus (Vss) vaihteli välillä 5‑6 litraa, ja terminaalivaiheen puoliintumisajan keskiarvo oli noin kaksi viikkoa. Useilla nivelreumapotilailla adalimumabin pitoisuudet nivelnesteessä olivat 31–96 % seerumista mitattaviin pitoisuuksiin verrattuna.
Ihonalaisen 40 mg:n joka toinen viikko annetun adalimumabikerta-annoksen jälkeen vakaan tilan pienin pitoisuus aikuisilla nivelreumapotilailla oli keskimäärin n. 5 μg/ml (jos samanaikaisesti ei käytetty metotreksaattia) tai 8‑9 μg/ml (jos samanaikaisesti käytettiin metotreksaattia). Vakaassa tilassa seerumin pienin adalimumabipitoisuus suureni lähes annoksesta riippuvaisesti, kun valmistetta annettiin ihonalaisesti 20, 40 ja 80 mg joka toinen viikko tai viikoittain.
Aikuisilla psoriaasipotilailla vakaan tilan minimipitoisuuksien keskiarvo oli 5 μg/ml adalimumabimonoterapian aikana (40 mg joka toinen viikko).
Kun Crohnin tautia sairastaville potilaille annettiin 80 mg:n latausannos Humiraa viikolla 0 ja sen jälkeen 40 mg viikolla 2, seerumin pienimmät adalimumabipitoisuudet olivat hoidon aloitusvaiheen aikana noin 5,5 μg/ml. Kun potilaille annettiin 160 mg:n latausannos Humiraa viikolla 0 ja sen jälkeen 80 mg viikolla 2, seerumin pienimmät adalimumabipitoisuudet olivat hoidon aloitusvaiheen aikana noin 12 μg/ml. Vakaassa tilassa pienimmät pitoisuudet Crohnin tautia sairastavilla potilailla olivat keskimäärin noin 7 μg/ml, kun potilaat saivat 40 mg Humiraa ylläpitoannoksena joka toinen viikko.
Kun uveiittia sairastaville aikuispotilaille annettiin 80 mg:n latausannos adalimumabia viikolla 0 ja sen jälkeen 40 mg adalimumabia joka toinen viikko alkaen viikolla 1, vakaan tilan pitoisuuden keskiarvo oli noin 8–10 μg/ml.
Populaatiofarmakokineettinen ja farmakokineettinen/farmakodynaaminen mallinnus ja simulaatio ennustivat adalimumabialtistuksen ja tehon olevan samaa luokkaa annoksella 40 mg kerran viikossa ja 80 mg joka toinen viikko (potilaina aikuisia, joilla oli nivelreuma, HS-tauti, ulseratiivinen koliitti, Crohnin tauti tai läiskäpsoriaasi, nuoria, joilla oli hidradenitis suppurativa, sekä ≥ 40 kg painavia lapsipotilaita, joilla oli Crohnin tauti).
Eliminaatio
Farmakokineettisissä yli 1 300 nivelreumapotilasta käsittävissä väestötutkimuksissa havaittiin adalimumabin näennäisen puhdistuman lisääntyvän ruumiinpainon mukaan. Kun tulokset vakioitiin painoerojen suhteen, havaittiin sukupuolella ja iällä olevan ainoastaan minimaalinen vaikutus adalimumabin puhdistumaan. Vapaan adalimumabin (adalimumabin, joka ei ole sitoutunut adalimumabin vasta-aineisiin) pitoisuudet seerumissa todettiin pienemmiksi niillä potilailla, joilla oli mitattavissa olevat määrät adalimumabin vasta-aineita.
Maksan tai munuaisten vajaatoiminta
Humiraa ei ole tutkittu maksan tai munuaisten vajaatoimintaa sairastavilla potilailla.
Prekliiniset tiedot turvallisuudesta
Kerta-altistuksen aiheuttamaa toksisuutta, toistuvan altistuksen aiheuttamaa toksisuutta ja geenitoksisuutta koskevien tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Makakiapinoilla tehdyssä alkion/sikiön kehitykseen kohdistuvaa toksisuutta/postnataalia kehitystä koskevassa tutkimuksessa ei havaittu adalimumabin aiheuttavan haittaa sikiölle annostasolla 0, 30 ja 100 mg/kg (9‑17 apinaa/ryhmä). Adalimumabilla ei ole tehty karsinogeenisuustutkimuksia eikä fertiliteettiä tai postnataalitoksisuutta koskevia standardiarviointeja, koska ei ole saatavilla sopivia malleja, joissa vasta-aine reagoisi rajoitetusti ristiin jyrsijän TNF:n kanssa, ja koska jyrsijöissä kehittyy neutraloivia vasta-aineita.
Farmaseuttiset tiedot
Apuaineet
Mannitoli
Polysorbaatti 80
Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Säilytys
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä. Pidä esitäytetty ruisku ulkopakkauksessa. Herkkä valolle.
Yksittäinen esitäytetty ruisku voidaan säilyttää huoneenlämmössä enintään 25°C:ssa 14 päivän ajan. Ruisku tulee suojata valolta, ja se on hävitettävä, jos sitä ei käytetä 14 päivän aikana.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
HUMIRA injektioneste, liuos, esitäytetty ruisku
20 mg (L:ei) 2 x 0,2 ml (20 mg/0,2 ml) (225,63 €)
PF-selosteen tieto
Humira 20 mg injektioneste, liuos esitäytetyssä kertakäyttöruiskussa (tyypin I lasi). Männän tulppa on bromibutyylikumia ja neulansuojus termoplastista elastomeeria.
Pakkaukset:
- 2 esitäytettyä ruiskua (0,2 ml steriiliä liuosta) ja 2 puhdistuslappua läpipainopakkauksessa.
Valmisteen kuvaus:
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
HUMIRA injektioneste, liuos, esitäytetty ruisku
20 mg 2 x 0,2 ml
- Alempi erityiskorvaus (65 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli ja tosilitsumabi (tulehdukselliset reumasairaudet): Nivelreuman, juveniilin polyartriitin, psoriaasiin liittyvän niveltulehduksen, selkärankareuman tai edellä mainittuja niveltulehduksia läheisesti muistuttavan niveltulehduksen hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman hoito erityisin edellytyksin (281).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli, tosilitsumabi ja ustekinumabi (tulehdukselliset reumasairaudet): Eräiden reumasairauksien hoito erityisin edellytyksin / Adalimumabi: Uveiitin hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman ja jättisoluarteriitin hoito erityisin edellytyksin (313), Adalimumabi, bimekitsumabi, brodalumabi, etanersepti, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sekukinumabi, sertolitsumabipegoli, tildrakitsumabi ja ustekinumabi (ihopsoriaasi): Vaikean kroonisen ihopsoriaasin hoito erityisin edellytyksin (319), Adalimumabi, golimumabi, infliksimabi, risankitsumabi, ustekinumabi ja vedolitsumabi (tulehdukselliset suolistosairaudet): Eräiden suolistosairauksien hoito erityisin edellytyksin (326).
- Oikeus käyttää samaa biologista lääkettä (sama kauppanimi) 6 kk ajan.
ATC-koodi
L04AB04
Valmisteyhteenvedon muuttamispäivämäärä
02.07.2021
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
