TSOLEDRONIHAPPO MEDAC infuusioneste, liuos 4 mg/100 ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Terveydenhuollon ammattilainen
Vaikuttavat aineet ja niiden määrät
Yksi 100 ml:n pullo liuosta sisältää 4 mg tsoledronihappoa (monohydraattina).
Yksi ml liuosta sisältää 0,04 mg tsoledronihappoa (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
- Luustotapahtumien (patologiset murtumat, selkäydinkompressio, luuston sädehoito tai leikkaus tai kasvaimen aiheuttama hyperkalsemia) ehkäiseminen aikuispotilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä.
- Kasvaimen aiheuttaman hyperkalsemian hoito aikuispotilailla.
Ehto
Valmistetta saa käyttää vain laskimoon annettavien bisfosfonaattien antoon perehtynyt lääkäri.
Annostus ja antotapa
Vain laskimoon annettavien bisfosfonaattien antoon perehtynyt terveydenhuollon henkilöstö saa määrätä ja antaa potilaille Tsoledronihappo medac -valmistetta. Tsoledronihappo medac -hoitoa saaville potilaille tulee antaa pakkausseloste ja potilaan muistutuskortti.
Annostus
Luustotapahtumien ehkäiseminen potilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä
Aikuiset ja iäkkäät henkilöt
Suositeltu annos luustotapahtumien ehkäisyyn potilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä, on 4 mg tsoledronihappoa joka 3.–4. viikko.
Potilaille tulee lisäksi antaa päivittäin suun kautta 500 mg kalsiumia ja 400 IU D-vitamiinia.
Päätettäessä ehkäistä luustoon liittyviä tapahtumia potilailla, joilla on luuetäpesäkkeitä, on otettava huomioon, että hoidon vaikutuksen alkaminen kestää 2−3 kuukautta.
Kasvaimen aiheuttaman hyperkalsemian hoito
Aikuiset ja iäkkäät henkilöt
Suositeltu annos hyperkalsemiassa (albumiinilla korjattu seerumin kalsiumpitoisuus ≥ 12,0 mg/dl tai 3,0 mmol/l) on 4 mg tsoledronihappoa kerta-annoksena.
Munuaisten vajaatoiminta
Kasvaimen aiheuttaman hyperkalsemian hoito:
Kasvaimen aiheuttamaa hyperkalsemiaa sairastaville potilaille, joilla on myös vaikea-asteinen munuaisten vajaatoiminta, tsoledronihappohoitoa tulee harkita vain hoidon riskien ja hyötyjen arvioinnin jälkeen. Potilaita, joiden seerumin kreatiniini oli > 400 µmol/l tai > 4,5 mg/dl, ei otettu mukaan kliinisiin tutkimuksiin. Annosta ei tarvitse muuttaa potilaille, joilla on kasvaimen aiheuttama hyperkalsemia seerumin kreatiniinin ollessa < 400 µmol/l tai < 4,5 mg/dl (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Luustotapahtumien ehkäisyyn potilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä:
Aloitettaessa tsoledronihappohoitoa potilaille, joilla on multippeli myelooma tai kiinteiden kasvaimien aiheuttamia metastaattisia luuleesioita, seerumin kreatiniini ja kreatiniinipuhdistuma (CLcr) tulee määrittää. CLcr on laskettu seerumin kreatiniinista Cockcroft-Gault -kaavalla. Tsoledronihappoa ei suositella potilaille, joilla on ennen hoidon aloittamista vaikea-asteinen munuaisten vajaatoiminta. Vaikea-asteinen munuaisten vajaatoiminta määritetään tälle potilasryhmälle CLcr < 30 ml/min. Potilaita, joiden seerumin kreatiniini oli > 265 µmol/l tai > 3,0 mg/dl, ei otettu mukaan kliinisiin tutkimuksiin.
Potilailla, joilla on normaali munuaistentoiminta (määritelty CLcr > 60 ml/min), tsoledronihappoa 4 mg/100 ml infuusionesteenä, liuos, voidaan antaa suoraan ilman käyttöönvalmistusta. Potilailla, joilla on luumetastaaseja ja ennen hoidon aloittamista lievä tai kohtalainen munuaisten vajaatoiminta, suositetaan seuraavia pienennettyjä tsoledronihappoannoksia. Lievä tai kohtalainen munuaisten vajaatoiminta määritetään tälle potilasryhmälle CLcr 30–60 ml/min (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lähtötason kreatiniinipuhdistuma (ml/min) | Suositettu tsoledronihappoannos* |
> 60 | 4,0 mg |
50–60 | 3,5 mg* |
40–49 | 3,3 mg* |
30–39 | 3,0 mg* |
* Annokset on laskettu tavoitteena AUC-arvo 0,66 (mg•hr/l) (CLcr = 75 ml/min). Pienennettyjä annoksia saavien munuaisten vajaatoimintapotilaiden oletetaan saavuttavan saman AUC-arvon kuin potilaiden, joiden kreatiniinipuhdistuma on 75 ml/min.
Hoidon aloituksen jälkeen: seerumin kreatiniini tulee mitata ennen jokaista tsoledronihappoannosta ja hoito tulee keskeyttää, jos munuaisten toiminta on heikentynyt. Kliinisissä tutkimuksissa munuaistoiminnan heikkeneminen määriteltiin seuraavasti:
- Potilailla, joilla normaali kreatiniinipitoisuus lähtötilanteessa (< 1,4 mg/dl tai < 124 µmol/l): 0,5 mg/dl tai 44 µmol/l nousu.
- Potilailla, joilla epänormaali kreatiniinipitoisuus lähtötilanteessa (> 1,4 mg/dl tai > 124 µmol/l): 1,0 mg/dl tai 88 µmol/l nousu.
Kliinisissä tutkimuksissa tsoledronihappohoito aloitettiin uudestaan vain jos kreatiniiniarvot palautuivat 10 % sisälle lähtötilanteen arvoista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tsoledronihappohoito tulee aloittaa uudestaan samalla annoksella, jota annettiin ennen hoidon keskeyttämistä.
Pediatriset potilaat
Tsoledronihapon turvallisuutta ja tehoa 1−17 vuoden ikäisten lasten hoidossa ei ole varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdassa Farmakodynamiikka, ei voida antaa suosituksia annostuksesta.
Antotapa
Laskimoon.
Tsoledronihappo medac 4 mg/100 ml infuusionestettä, liuosta, tulee antaa vähintään 15 minuutin ajan kestävänä kerta-annosinfuusiona laskimoon.
Normaalin munuaisfunktion omaavilla potilailla (määritelty CLcr > 60 ml/min) tsoledronihappo 4 mg/100 ml infuusionestettä, liuos, ei tule laimentaa edelleen.
Potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta, suositellaan pienennettyjä Tsoledronihappo medac -annoksia (ks. kohta ”Annostus” yllä ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pienennettyjen annosten valmistamiseksi potilaille, joilla on lähtötason CLcr ≤ 60 ml/min, katso alla olevaa taulukkoa 1. Poista ensin osoitettu määrä Tsoledronihappo medac 4 mg/100 ml -liuosta pullosta ja korvaa sitten samalla määrällä steriiliä 9 mg/ml (0,9 %) natriumkloridi-injektionestettä, tai 5 % glukoosi-injektionestettä.
Taulukko 1: Pienennettyjen Tsoledronihappo medac 4 mg/100 ml infuusionesteen, liuos, annosten valmistus
Lähtötason kreatiniinipuhdistuma (ml/min) | Poista seuraava määrä Tsoledronihappo medac infuusionestettä, liuos (ml) | Lisää steriiliä 9 mg/ml (0,9 %) natriumkloridi- tai 5 % glukoosi-injektionestettä, liuos (ml) | Mukautettu annos (tsoledronihappoa mg/100 ml) |
50−60 | 12,0 | 12,0 | 3,5 |
40−49 | 18,0 | 18,0 | 3,3 |
30−39 | 25,0 | 25,0 | 3,0 |
Tsoledronihappo medac 4 mg/100 ml infuusionestettä, liuos, ei saa sekoitaa muiden infuusionesteiden kanssa, ja se tulee antaa kerta-annoksena laskimoon käyttäen erillistä infuusioletkua.
Potilaat on nesteytettävä kunnolla ennen ja jälkeen tsoledronihapon antoa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle, muille bisfosfonaateille tai kohdassa Apuaineet mainituille apuaineille.
- Imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
Ennen tsoledronihapon antoa potilaat täytyy tutkia riittävän nesteytyksen varmistamiseksi.
Liiallista nesteytystä tulee välttää, jos potilaalla on sydämen vajaatoiminnan vaara.
Hyperkalsemiaan liittyviä metabolisia peruslaboratorioarvoja, kuten seerumin kalsium-, fosfaatti- ja magnesiumpitoisuutta tulee seurata huolellisesti tsoledronihappohoidon aloittamisen jälkeen. Lyhytaikainen tukihoito voi olla tarpeen hypokalsemian, hypofosfatemian tai hypomagnesemian ilmetessä. Hoitamattomien hyperkalsemiapotilaiden munuaisten toiminta on yleensä jonkin verran heikentynyttä, minkä vuoksi on harkittava munuaisten toiminnan huolellista seurantaa.
Muita tsoledronihappoa vaikuttavana aineena sisältäviä lääkevalmisteita on saatavissa osteoporoosin käyttöaiheisiin ja Pagetin luutaudin hoitoon. Tsoledronihappo medac -hoitoa saaville potilaille ei pidä antaa samanaikaisesti tällaisia lääkevalmisteita tai muita bisfosfonaatteja, koska näiden aineiden yhteisvaikutusta ei tunneta.
Munuaisten vajaatoiminta
Kasvaimen aiheuttamaa hyperkalsemiaa sairastavat potilaat, joilla todetaan heikentynyt munuaisten toiminta, tulee asianmukaisesti tutkia, ja harkita, onko tsoledronihappohoidolla saavutettava mahdollinen hyöty suurempi kuin siitä mahdollisesti aiheutuva riski.
Tehtäessä päätöstä hoidon antamisesta luustotapahtumien ehkäisemiseksi potilaille, joilla on luumetastaaseja, tulee ottaa huomioon, että hoito alkaa tehota 2–3 kuukauden kuluttua.
Tsoledronihapon käytön yhteydessä on raportoitu munuaisten vajaatoimintaa. Tekijöihin, jotka voivat lisätä munuaisten toimintakyvyn heikkenemisen mahdollisuutta, kuuluvat dehydraatio, todettu munuaisten vajaatoiminta, useat 4 mg:n tsoledronihappo- tai muut bisfosfonaattikäyttökerrat kuten myös muiden munuaistoksisten lääkevalmisteiden käyttö. Vaikka riski on pienempi annettaessa 4 mg:n annos tsoledronihappoa 15 minuutin aikana, voi munuaistoiminta silti heikentyä. Munuaisten vajaatoimintaan ja dialyysiin johtanutta munuaisten toiminnan heikkenemistä on raportoitu potilailla, jotka ovat saaneet aloitusannoksen tai 4 mg:n kerta-annoksen tsoledronihappoa. Seerumin kreatiniiniarvot ovat myös nousseet joillakin potilailla, joille on annettu kroonisesti tsoledronihappoa luustotapahtumien ehkäisemiseksi suositetulla annoksella, tosin harvemmin.
Potilaiden seerumin kreatiniinipitoisuudet täytyy tutkia ennen jokaista tsoledronihappoannosta. Aloitettaessa hoitoa potilaille, joilla on luumetastaaseja ja lievä tai kohtalainen munuaisten vajaatoiminta, suositetaan pienempiä tsoledronihappoannoksia. Tsoledronihapon käyttö tulee lopettaa potilailla, joilla hoidon aikana havaitaan munuaisten toiminnan heikentyneen. Tsoledronihappohoito aloitetaan uudestaan vain kun seerumin kreatiniiniarvot palautuvat 10 % sisälle lähtötilanteen arvoista. Tsoledronihappo medac -hoito tulee aloittaa uudelleen samalla annostuksella kuin ennen hoidon keskeyttämistä.
Koska tsoledronihappo voi vaikuttaa munuaisten toimintaan, eikä vaikea-asteista munuaisten vajaatoimintaa alkutilanteessa sairastavia potilaita (kliinisissä tutkimuksissa määrittely kasvaimen aiheuttamaa hyperkalsemiaa sairastaville potilaille: seerumin kreatiniini ≥ 400 µmol/l tai ≥ 4,5 mg/dl, ja syöpäpotilaille, joilla on luumetastaaseja: seerumin kreatiniini ≥ 265 µmol/l tai ≥ 3,0 mg/dl) koskevaa kliinistä turvallisuustietoa ole, ja koska farmakokinetiikasta vaikea-asteista munuaisten vajaatoimintaa alkutilanteessa sairastavilla potilailla (kreatiniinipuhdistuma < 30 ml/min) on vain vähän tietoa, tsoledronihapon käyttöä ei suositeta potilaille, joilla on vaikea-asteinen munuaisten vajaatoiminta.
Maksan vajaatoiminta
Koska on vain vähän tietoa potilaista, joilla on vaikea-asteinen maksan vajaatoiminta, spesifisiä hoitosuosituksia tämän potilasryhmän osalta ei voida antaa.
Osteonekroosi
Leuan osteonekroosi
Leuan osteonekroosia (ONJ) on melko harvinaisissa tapauksissa raportoitu tsoledronihappoa saavilla potilailla kliinisissä tutkimuksissa ja markkinoille tulon jälkeen. Markkinoille tulon jälkeiset tiedot ja kirjallisuus viittaavat siihen, että ONJ:tä koskevia ilmoituksia on annettu useammin kasvaintyypin perusteella (pitkälle edennyt rintasyöpä, multippeli myelooma). Eräässä tutkimuksessa osoitettiin, että ONJ:tä esiintyi enemmän myeloomapotilailla kuin muita syöpiä sairastavilla potilailla (ks. kohta Farmakodynamiikka).
Hoidon tai uuden hoitojakson aloittamista tulee lykätä potilailla, joilla on suussa parantumattomia, avoimia pehmytkudosleesioita, paitsi lääketieteellisissä hätätilanteissa.
Potilaille, joilla on samanaikaisia riskitekijöitä, suositellaan hammastarkastuksen tekemistä, asianmukaista ennaltaehkäisevää hammashoitoa sekä yksilöllisen hyöty-riski-arvion tekemistä ennen bisfosfonaattihoitoa.
Seuraavat riskitekijät on huomioitava arvioitaessa potilaan riskiä leuan osteonekroosin kehittymiselle:
- Bisfosfonaatin voimakkuusluokka (mitä tehokkaampi aine, sitä suurempi riski), antoreitti (suurempi riski parenteraalisen antotavan yhteydessä) ja bisfosfonaatin kumulatiivinen annos
- Syöpä, lisäsairaudet (esim. anemia, koagulopatiat, infektiot), tupakointi
- Samanaikaiset hoidot: kemoterapia, angiogeneesin estäjät (ks. kohta Yhteisvaikutukset), kaulan ja pään sädehoito, kortikosteroidit
- Aiempi hammassairaus, huono suuhygienia, periodontaalinen sairaus, invasiiviset hammastoimenpiteet (esim. hampaanpoistot) ja huonosti istuvat hammasproteesit.
Kaikkia potilaita tulee kehottaa noudattamaan hyvää suuhygieniaa, käymään säännöllisissä hammastarkastuksissa ja kertomaan välittömästi kaikista Tsoledronihappo medac -hoidon aikana esiintyvistä suuoireista, kuten hampaiden liikkumisesta, kivusta, turvotuksesta, huonosti paranevista haavaumista tai vuodosta. Hoidon aikaisia invasiivisia hammastoimenpiteitä tulee tehdä ainoastaan huolellisen harkinnan jälkeen, ja niiden tekemistä on vältettävä lähellä tsoledronihapon antoa. Potilaille, joille kehittyy leuan osteonekroosi bisfosfonaattihoidon aikana, hammaskirurgia voi pahentaa tilaa. Ei ole tietoa, vähentääkö bisfosfonaattihoidon keskeytys leuan osteonekroosiriskiä potilailla, jotka vaativat hammaskäsittelyä.
Hoitavan lääkärin tulee laatia ONJ-potilaiden hoitosuunnitelmat tiiviissä yhteistyössä ONJ:hin perehtyneen hammaslääkärin tai suukirurgin kanssa.
Jos mahdollista, on harkittava tsoledronihappohoidon väliaikaista keskeyttämistä siihen saakka, kunnes sairaus paranee ja myötävaikuttavat riskitekijät ovat lieventyneet.
Muiden anatomisten osien osteonekroosi
Korvakäytävän osteonekroosia on ilmoitettu bisfosfonaattien käytön ja lähinnä pitkäaikaisen hoidon yhteydessä. Korvakäytävän osteonekroosin mahdollisia riskitekijöitä ovat steroidien käyttö ja kemoterapia ja/tai paikalliset riskitekijät, kuten infektio tai trauma. Korvakäytävän osteonekroosin mahdollisuus on huomioitava, jos bisfosfonaatteja saavalla potilaalla ilmenee korvaoireita, krooniset korvatulehdukset mukaan lukien.
Lisäksi on raportoitu lähinnä aikuisilla Tsoledronihappo medac -hoitoa saavilla syöpäpotilailla satunnaisia osteonekroositapauksia muissa elimistön osissa, kuten lonkassa ja reisiluussa.
Luusto- ja lihaskipu
Lääkkeen markkinoille tulon jälkeisen kokemuksen perusteella vaikea-asteisesta ja ajoittaisesta luu-, nivel-, ja/tai lihaskivusta on raportoitu bisfosfonaatteja, mukaan lukien tsoledronihappoa, käyttävillä potilailla. Kyseisiä tapahtumia on kuitenkin raportoitu harvoin. Oireiden ilmaantumista edeltävä aika vaihteli päivästä useaan kuukauteen hoidon aloittamisesta. Useimmilla potilailla oireet lievenivät hoidon lopettamisen jälkeen. Osalla potilaista oireet palasivat, kun hoito aloitettiin uudelleen joko tsoledronihapolla tai toisella bisfosfonaatilla.
Epätyypilliset reisiluun murtumat
Epätyypillisiä subtrokanteerisia ja diafyseaalisia reisiluun murtumia on raportoitu bisfosfonaattihoidon yhteydessä, ensisijaisesti niillä potilailla, jotka ovat saaneet pitkäaikaista bisfosfonaattihoitoa osteoporoosiin. Tällaisia poikittaisia tai lyhyitä, vinoja murtumia voi ilmetä missä tahansa reisiluun pienen trokanterin alapuolen ja nivelnastan yläpuolisen alueen välissä. Näitä murtumia tapahtuu yleensä hyvin pienten traumojen yhteydessä tai ilman traumaa, jotkut potilaat voivat kokea kipua reidessä tai nivusissa. Usein murtumat muistuttavat ensin rasitusmurtumia ennen kuin viikkojen ja kuukausien kuluessa ne muuttuvat täydellisiksi reisiluun murtumiksi. Murtumat saattavat olla molemminpuolisia, joten toinenkin reisiluu on tutkittava, jos bisfosfonaattihoitoa saavalla potilaalla todetaan reisiluun varsiosan murtuma. Näiden murtumien viivästynyttä paranemista on myös raportoitu. Potilailla, joilla epäillään epätyypillistä reisiluun murtumaa, tulee harkita bisfosfonaattihoidon keskeyttämistä potilaan tilan arvion ajaksi, ja keskeyttämispäätöksen on perustuttava yksilölliseen riski-hyötysuhteen arvioon.
Potilaita on ohjeistettava ilmoittamaan kaikista mahdollisista bisfosfonaattihoidon aikana ilmenevistä reisi-, lonkka- tai nivuskivuista, ja tällaisista oireista kertovat potilaat on tutkittava mahdollisen reisiluun epätäydellisen murtuman varalta.
Hypokalsemia
Hypokalsemiaa on raportoitu potilailla, joita on hoidettu tsoledronihapolla.. Sydämen rytmihäiriöitä ja neurologisia haittavaikutuksia (mukaan lukien kouristuskohtaukset, heikentynyt tuntoherkkyys ja tetania) on raportoitu vaikea-asteisten hypokalsemiatapausten seurauksena. Sairaalahoitoa vaatineita vaikea-asteisia hypokalsemiatapauksia on raportoitu. Joissakin tapauksissa hypokalsemia voi olla potilaan henkeä uhkaava (ks. kohta Haittavaikutukset).
Varovaisuutta on noudatettava kun tsoledronihappoa annetaan yhdessä lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan hypokalsemiaa, koska näillä valmisteilla saattaa olla synergistinen vaikutus, joka aikaansaa vakavan hypokalsemian (ks. kohta Yhteisvaikutukset). Seerumin kalsium tulee mitata ja hypokalsemia korjata ennen tsoledronihappohoidon aloittamista. Potilaille tulee antaa riittävä määrä kalsium- ja D-vitamiinilisiä.
Natrium
Tsoledronihappo medac sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Kliinisissä tutkimuksissa tsoledronihappoa on annettu samaan aikaan yleisesti käytössä olevien syöpälääkkeiden, diureettien, mikrobilääkkeiden ja analgeettien kanssa ilman ilmeisiä kliinisiä yhteisvaikutuksia. Tsoledronihappo ei sitoudu mainittavassa määrin plasman proteiineihin eikä estä ihmisen P450-entsyymejä in vitro (ks. kohta Farmakokinetiikka), mutta muodollisia kliinisiä yhteisvaikutustutkimuksia ei ole tehty.
Varovaisuutta suositetaan, kun bisfosfonaatteja annetaan aminoglykosidien, kalsitoniinin tai loop-diureettien kanssa, koska näillä lääkkeillä voi olla additiivinen vaikutus, jolloin seerumin kalsiumpitoisuus voi pysyä pienenä pitempään kuin olisi tarpeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varovaisuutta on noudatettava annettaessa tsoledronihappoa yhdessä muiden mahdollisesti munuaistoksisten lääkevalmisteiden kanssa. Huomiota tulee kiinnittää myös hypomagnesemian kehittymisen mahdollisuuteen hoidon aikana.
Multippelia myeloomaa sairastavilla potilailla munuaisten vajaatoiminnan riski saattaa olla suurentunut annettaessa tsoledronihappoa yhdessä talidomidin kanssa.
Varovaisuuteen on syytä käytettäessä tsoledronihappoa samanaikaisesti antiangiogeenisten lääkevalmisteiden kanssa, sillä ONJ-tapausten esiintyvyyden on havaittu lisääntyneen potilailla, jotka ovat saaneet samanaikaista hoitoa em. lääkevalmisteilla.
Raskaus ja imetys
Raskaus
Ei ole olemassa tarkkoja tietoja tsoledronihapon käytöstä raskaana oleville naisille. Tsoledronihappoa koskevissa lisääntymistutkimuksissa eläimillä on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmiselle ei tunneta. Tsoledronihappoa ei pidä käyttää raskauden aikana. Naisia, jotka voivat tulla raskaaksi, tulee neuvoa välttämään raskaaksi tulemista.
Imetys
Ei tiedetä, erittyykö tsoledronihappo ihmisen rintamaitoon. Tsoledronihappo on vasta-aiheinen rintaruokinnan aikana (ks. kohta Vasta-aiheet).
Hedelmällisyys
Tsoledronihapon mahdollista haitallista vaikutusta vanhempien ja F1 -sukupolven hedelmällisyyteen arvioitiin rotilla. Tämä johti liioiteltuun farmakologiseen vaikutukseen, jonka katsotaan liittyvän valmisteen luuston kalsiumin aineenvaihdunnan estosta johtuvaan tiineen rotan hypokalsemiaan, joka on bisfosfonaattien luokkavaikutus, sekä dystokiaan että ennenaikaiseen tutkimuksen lopetukseen. Niinpä näiden tulosten perusteella ei voida määrittää tsoledronihapon todellista vaikutusta hedelmällisyyteen ihmisissä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Haittavaikutukset, kuten huimaus ja uneliaisuus, voivat vaikuttaa ajokykyyn tai koneidenkäyttökykyyn, joten varovaisuutta on noudatettava tsoledronihappohoidon aikaisessa autolla ajossa ja koneiden käytössä.
Haittavaikutukset
Yhteenveto valmisteen turvallisuusprofiilista
Kolmen päivän sisällä tsoledronihappoannoksesta havaittava akuutin vaiheen reaktio on ilmoitettu haittavaikutus. Oireisiin liittyy luukipua, kuumetta, heikkoutta, nivelkipua, myalgiaa, kuumehorkkaa sekä artriittia ja sen seurauksena nivelturvotusta. Nämä oireet yleensä häviävät parin päivän sisällä (ks. kuvaus valikoiduista haittavaikutuksista).
Tsoledronihapon hyväksytyissä indikaatioissa tärkeät identifioidut riskit ovat seuraavia:
Munuaisten vajaatoiminta, leuan osteonekroosi, akuutin vaiheen reaktio, hypokalsemia, eteisvärinä, anafylaksia, interstitiaalinen keuhkosairaus. Jokaisen riskin esiintyvyydet on lueteltu taulukossa 2.
Taulukkomuodossa esitetty luettelo haittavaikutuksista
Seuraavat taulukossa 2 luetellut haittavaikutukset on koottu kliinisistä tutkimuksista ja markkinoille tulon jälkeisistä raporteista, joissa 4 mg tsoledronihappoa on käytetty pääasiassa krooniseen hoitoon:
Taulukko 2
Haittavaikutukset on luokiteltu yleisyyden mukaan aloittaen yleisimmistä seuraavasti: Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| Veri ja imukudos | |||
| Yleiset: | Anemia | ||
| Melko harvinaiset: | Trombosytopenia, leukopenia | ||
| Harvinaiset: | Pansytopenia | ||
| Immuunijärjestelmä | |||
| Melko harvinaiset: | Yliherkkyysreaktio | ||
| Harvinaiset: | Angioneuroottinen ödeema | ||
| Psyykkiset häiriöt | |||
| Melko harvinaiset: | Ahdistuneisuus, unihäiriöt | ||
| Harvinaiset: | Sekavuus | ||
| Hermosto | |||
| Yleiset: | Päänsärky | ||
| Melko harvinaiset: | Heitehuimaus, tuntoharha, makuhäiriö, heikentynyt tuntoherkkyys, lisääntynyt tuntoherkkyys, vapina, uneliaisuus | ||
| Hyvin harvinaiset: | Kouristuskohtaukset, heikentynyt tuntoherkkyys ja tetania (hypokalsemian seurauksena) | ||
| Silmät | |||
| Yleiset: | Konjunktiviitti | ||
| Melko harvinaiset: | Näön sumentuminen, silmän kovakalvon tulehdus (skleriitti) ja silmäkuopan tulehdus | ||
| Harvinaiset: | Suonikalvoston tulehdus | ||
| Hyvin harvinaiset: | Episkleriitti | ||
| Sydän | |||
| Melko harvinaiset: | Kohonnut verenpaine, matala verenpaine, eteisvärinä, matala verenpaine johtaen pyörtymiseen tai verenkiertokollapsiin | ||
| Harvinaiset: | Sydämen harvalyöntisyys, sydämen rytmihäiriöt (hypokalsemian seurauksena) | ||
| Hengityselimet, rintakehä ja välikarsina | |||
| Melko harvinaiset: | Hengenahdistus, yskä, keuhkoputkien supistelu | ||
| Harvinaiset: | Interstitiaalinen keuhkosairaus | ||
| Ruoansulatuselimistö | |||
| Yleiset: | Pahoinvointi, oksentelu, heikentynyt ruokahalu | ||
| Melko harvinaiset: | Ripuli, ummetus, vatsakipu, ruoansulatushäiriö, suutulehdus, suun kuivuminen | ||
| Iho ja ihonalainen kudos | |||
| Melko harvinaiset: | Kutina, ihottuma (mukaan lukien punoittava ihottuma ja täpläinen (makulaarinen) ihottuma), lisääntynyt hikoilu | ||
| Luusto, lihakset ja sidekudos | |||
| Yleiset: | Luukipu, lihaskipu, nivelkipu, laaja-alainen kipu | ||
| Melko harvinaiset: | Lihaskouristukset, leuan osteonekroosi | ||
| Hyvin harvinainen: | Korvakäytävän osteonekroosi (bisfosfonaattien luokkahaittavaikutus) ja muiden anatomisten osien osteonekroosi (mukaan lukien reisiluu ja lonkka) | ||
| Munuaiset ja virtsatiet | |||
| Yleiset: | Munuaisten toiminnan häiriö | ||
| Melko harvinaiset: | Akuutti munuaisten vajaatoiminta, hematuria, proteinuria | ||
| Harvinaiset: | Hankinnainen Fanconin oireyhtymä | ||
| Tuntematon: | Tubulointerstitiaalinefriitti | ||
| Yleisoireet ja antopaikassa todettavat haitat | |||
| Yleiset: | Kuume, flunssankaltainen oireyhtymä (johon liittyy väsymys, vilunväreet, huonovointisuus ja punotus) | ||
| Melko harvinaiset: | Voimattomuus, perifeerinen turvotus, injektiokohdan reaktiot (mukaan lukien kipu, ärtyminen, turvotus, kovettuminen), rintakipu, painon nousu, anafylaktinen reaktio/sokki, urtikaria | ||
| Harvinaiset: | Akuutin vaiheen reaktion oireina artriitti ja nivelturvotus | ||
| Tutkimukset | |||
| Hyvin yleiset: | Hypofosfatemia | ||
| Yleiset: | Veren kreatiniini- ja urea-arvojen nousu, hypokalsemia | ||
| Melko harvinaiset: | Hypomagnesemia, hypokalemia | ||
| Harvinaiset: | Hyperkalemia, hypernatremia | ||
Kuvaus valikoiduista haittavaikutuksista
Munuaistoiminnan heikentyminen
Tsoledronihapon käyttöön on yhdistetty tapauksia munuaisten vajaatoiminnasta. Tsoledronihapon rekisteröintitutkimuksissa tutkittiin luustoon liittyvien tapahtumien ehkäisyä luustoon levinneen syövän osalta. Kerättyjen turvallisuustietojen poolatussa analyysissä tsoledronihapon epäiltyjen munuaistoimintaa heikentävien haittatapahtumien (haittavaikutusten) esiintymistiheys oli seuraava: multippeli myelooma (3,2 %), prostatasyöpä (3,1 %), rintasyöpä (4,3 %), keuhkosyöpä ja muut kiinteät kasvaimet (3,2 %). Tekijöitä, jotka saattavat nostaa todennäköisyyttä munuaistoiminnan heikentymisestä ovat kuivuminen, ennestään esiintynyt munuaisen toimintahäiriö, useat tsoledronihapon tai muiden bisfosfonaattien hoitojaksot, munuaistoksisten lääkevalmisteiden samanaikainen käyttö tai infuusioajan lyhentäminen alle suositusten. Ensimmäisen 4 mg:n tsoledronihappoannoksen tai yhden annoksen jälkeen potilaissa on raportoitu munuaistoiminnan huononemista tai etenemistä munuaisten vajaatoimintaan ja dialyysiin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Leuan osteonekroosi
Leuan osteonekroositapauksia on raportoitu potilaissa, jotka ovat olleet enimmäkseen syöpäpotilaita ja jotka ovat saaneet luun resorptiota estäviä lääkevalmisteita, kuten Tsoledronihappo medac -valmistetta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Monet näistä potilaista saivat myös kemoterapiaa ja kortikosteroideja ja heillä oli merkkejä paikallisesta infektiosta mukaan lukien osteomyeliitti. Pääosa näistä tapauksista raportoitiin syöpäpotilailla hampaan poiston tai muun hammasleikkauksen jälkeen.
Eteisvärinä
Yhdessä kolme vuotta kestäneessä, satunnaistetussa, kaksoissokkoutetussa tutkimuksessa, jossa verrattiin tsoledronihapon (5 mg kerran vuodessa) tehoa ja turvallisuutta lumelääkkeeseen postmenopausaalisen osteoporoosin (PMO) hoidossa, eteisvärinän kokonaisesiintyvyys oli 5 mg tsoledronihappoa saaneilla potilailla 2,5 % (96/3 862) ja lumelääkettä saaneilla potilailla 1,9 % (75/3 852). Vakavina haittatapahtumina eteisvärinää esiintyi 1,3 %:lla tsoledronihappoa saaneista potilaista (51/3 862) ja 0,6 %:lla lumelääkettä saaneista potilaista (22/3 852). Tässä tutkimuksessa havaittua eroa ei ole havaittu muissa tsoledronihappotutkimuksissa, joissa syöpäpotilaat saivat 4 mg tsoledronihappoa joka 3.−4. viikko. Tässä yhdessä tutkimuksessa esille tullutta eteisvärinän esiintyvyyden lisääntymisen mekanismia ei tunneta.
Akuutin vaiheen reaktio
Tämä haittavaikutus koostuu monen oireen yhdistelmästä, joka sisältää kuumetta, myalgiaa, päänsärkyä, raajakipuja, pahoinvointia, oksentelua, ripulia, nivelkipuja sekä artriittia ja sen seurauksena nivelturvotusta. Aika oireiden ilmaantumiseen on ≤ 3 päivää tsoledronihappoinfuusion jälkeen. Reaktiota voidaan myös kuvata ”flunssankaltaisiksi” tai ”annoksen jälkeisiksi” oireiksi.
Epätyypilliset reisiluun murtumat
Markkinoille tulon jälkeisenä aikana on raportoitu seuraavia reaktioita (joiden yleisyys on harvinainen):
Epätyypilliset subtrokanteeriset ja diafyseaaliset reisiluun murtumat (bisfosfonaattien luokkavaikutus).
Hypokalsemiaan liittyvät haittavaikutukset
Hypokalsemia on tärkeä tsoledronihapon käyttöaiheiden mukaisessa käytössä todettu riski. Kliinisissä tutkimuksissa ja lääkkeen markkinoille tulon jälkeen todettujen tapausten arvioinnin perusteella on riittävästi näyttöä tsoledronihappo-hoidon ja raportoitujen hypokalsemiatapausten sekä niiden seurauksena kehittyneiden rytmihäiriötapausten yhteydestä. Lisäksi on olemassa näyttöä hypokalsemian ja sen yhteydessä raportoitujen sekundaaristen neurologisten tapahtumien, kuten kouristuskohtausten, heikentyneen tuntoherkkyyden ja tetanian, välisestä yhteydestä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Tsoledronihapon aiheuttamasta akuutista yliannostuksesta oleva kliininen kokemus on vähäinen. Tsoledronihappoannoksia 48 mg:aan asti on ilmoitettu virheellisesti annetuiksi. Suositettuja annoksia suurempia annoksia (ks. kohta Annostus ja antotapa) saaneita potilaita on seurattava huolellisesti, koska munuaisten toiminnan heikkenemistä (mukaan lukien munuaisten vajaatoiminta) ja seerumin elektrolyyttien (mukaan lukien kalsium, fosfori ja magnesium) poikkeavuuksia on ilmaantunut. Hypokalsemian kehittyessä potilaalle tulee antaa kliinisen tilanteen vaatiessa kalsiumglukonaatti-infuusio.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Luukudokseen vaikuttavat lääkkeet, bisfosfonaatit, ATC-koodi: M05BA08
Vaikutusmekanismi
Tsoledronihappo kuuluu bisfosfonaattien ryhmään ja vaikuttaa ensisijaisesti luuhun. Se on osteoklastien aiheuttaman luun resorption estäjä.
Bisfosfonaattien selektiivinen vaikutus luuhun perustuu siihen, että niiden hakuisuus mineralisoituneeseen luuhun on voimakas. Tarkkaa osteoklastien toiminnan estävää mekanismia ei molekyylitasolla kuitenkaan vielä tunneta. Pitkäaikaisten eläintutkimusten mukaan tsoledronihappo estää luun resorptiota vaikuttamatta haitallisesti luun muodostukseen, mineralisaatioon tai mekaanisiin ominaisuuksiin.
Sen lisäksi, että tsoledronihappo on potentti luun resorption estäjä, sillä on myös useita kasvainten kasvua estäviä ominaisuuksia, jotka saattavat myötävaikuttaa sen tehoon metastaattisen luusairauden hoidossa. Prekliinisissä tutkimuksissa on osoitettu seuraavat ominaisuudet:
- In vivo: Estää luun osteoklastista resorptiota, mikä muuttaa luuytimen mikroympäristöä tehden sen epäsuotuisammaksi kasvainsolujen kasvulle; verisuonten kasvun estäminen ja kivun esto.
- In vitro: Estää osteoblastien lisääntymistä, suora kasvainsoluihin kohdistuva sytostaattinen ja pro-apoptoottinen toiminta, synergistinen sytostaattinen vaikutus muiden syöpälääkevalmisteiden kanssa, estää kiinni tarttumista ja tunkeutumista.
Kliininen teho ja turvallisuus
Kliinisten tutkimusten tulokset koskien luustotapahtumien ehkäisemistä potilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä
Ensimmäisessä satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa verrattiin 4 mg:n annoksin toteutettua tsoledronihappohoitoa lumelääkkeeseen luustoon liittyvien tapahtumien ehkäisemisessä (Skeletal Related Events, SRE) eturauhassyöpäpotilailla. 4 mg:n tsoledronihappohoito pienensi merkitsevästi niiden potilaiden osuutta, joilla ilmeni vähintään yksi luustoon liittyvä tapahtuma (SRE), pidensi mediaaniaikaa ensimmäisen luustoon liittyvän tapahtuman ilmaantumiseen yli viidellä kuukaudella ja vähensi tapahtumien vuosittaista ilmaantuvuutta potilasta kohden eli luustosairastuvuutta. Monitapahtuma-analyysi osoitti luustoon liittyvien tapahtumien kehittymisriskin pienentyneen 36 % tsoledronihappohoitoa annoksella 4 mg saaneiden ryhmässä lumelääkeryhmään verrattuna. Tsoledronihappohoitoa annoksella 4 mg saaneet potilaat raportoivat vähemmän kivun lisääntymistä kuin potilaat, jotka saivat lumelääkettä. Erot olivat merkitseviä kuukausina 3, 9, 21 ja 24. Tsoledronihappohoitoa annoksella 4 mg saaneiden potilaiden ryhmässä havaittiin vähemmän patologisia murtumia. Hoidon teho oli heikompi potilailla, joilla oli blastisia leesioita. Tehotulokset on esitetty taulukossa 3.
Toiseen tutkimukseen osallistui potilaita, joilla oli jokin muu kiinteä kasvain kuin rinta- tai eturauhassyöpä. Tsoledronihappo annoksella 4 mg vähensi merkitsevästi luustoon liittyvien tapahtumien lukumäärää, pidensi mediaaniaikaa ensimmäisen luustoon liittyvän tapahtuman ilmaantumiseen yli kahdella kuukaudella ja vähensi luustosairastuvuutta. Monitapahtuma-analyysi osoitti luustoon liittyvien tapahtumien kehittymisriskin pienentyneen 30,7 % tsoledronihappohoitoa annoksella 4 mg saaneiden ryhmässä lumelääkeryhmään verrattuna. Tehotulokset on esitetty taulukossa 4.
Taulukko 3: Tehotulokset (hormonihoitoa saavat eturauhassyöpäpotilaat)
SRE (+TIH) | Murtumat* | Luun sädehoito | |||||
Tsole-droni-happo 4 mg | Lumelääke | Tsole-droni-happo 4 mg | Lumelääke | Tsole-droni-happo 4 mg | Lumelääke | ||
n | 214 | 208 | 214 | 208 | 214 | 208 | |
Potilaiden osuus, joilla esiintyi SRE (%) | 38 | 49 | 17 | 25 | 26 | 33 | |
p-arvo | 0,028 | 0,052 | 0,119 | ||||
Mediaaniaika SRE:n ilmaantumiseen (päivinä) | 488 | 321 | ES | ES | ES | 640 | |
p-arvo | 0,009 | 0,020 | 0,055 | ||||
Luustosairastuvuus | 0,77 | 1,47 | 0,20 | 0,45 | 0,42 | 0,89 | |
p-arvo | 0,005 | 0,023 | 0,060 | ||||
Riskin pieneneminen sairastaa useita tapahtumia** (%) | 36 | - | NA | NA | NA | NA | |
p-arvo | 0,002 | NA | NA | ||||
* Sisältää nikamamurtumat ja muut kuin nikamamurtumat
** Sisältää kaikki luustotapahtumat; niiden kokonaismäärän sekä ajan jokaisen tapahtuman ilmaantumiseen tutkimuksen aikana
ES Ei saavutettu
NA Ei oleellinen
SRE Luustoon liittyvät tapahtumat (skeletal related events)
TIH Kasvaimen aiheuttama hyperkalsemia (tumour induced hypercalcaemia)
Taulukko 4: Tehotulokset (Potilaat, joilla on muita kiinteitä kasvaimia kuin rinta- tai eturauhassyöpä)
SRE (+TIH) | Murtumat* | Luun sädehoito | |||||||
Tsole-droni-happo 4 mg | Lumelääke | Tsole-droni-happo 4 mg | Lumelääke | Tsole-droni-happo 4 mg | Lumelääke | ||||
n | 257 | 250 | 257 | 250 | 257 | 250 | |||
Potilaiden osuus, joilla esiintyi SRE (%) | 39 | 48 | 16 | 22 | 29 | 34 | |||
p-arvo | 0,039 | 0,064 | 0,173 | ||||||
Mediaaniaika SRE:n ilmaantumiseen (päivinä) | 236 | 155 | ES | ES | 424 | 307 | |||
p-arvo | 0,009 | 0,020 | 0,079 | ||||||
Luustosairastuvuus | 1,74 | 2,71 | 0,39 | 0,63 | 1,24 | 1,89 | |||
p-arvo | 0,012 | 0,066 | 0,099 | ||||||
Riskin pieneneminen sairastaa useita tapahtumia** (%) | 30,7 | - | NA | NA | NA | NA | |||
p-arvo | 0,003 | NA | NA | ||||||
* Sisältää nikamamurtumat ja muut kuin nikamamurtumat
** Sisältää kaikki luustotapahtumat; niiden kokonaismäärän sekä ajan jokaisen tapahtuman ilmaantumiseen tutkimuksen aikana
ES Ei saavutettu
NA Ei oleellinen
SRE Luustoon liittyvät tapahtumat (skeletal related events)
TIH Kasvaimen aiheuttama hyperkalsemia (tumour induced hypercalcaemia)
Kolmannessa faasi III:n satunnaistetussa kaksoissokkotutkimuksessa verrattiin tsoledronihappoa annoksella 4 mg pamidronaatti 90 mg:aan annosteltuina joka 3.–4. viikko. Tutkimukseen osallistui potilaita, joilla oli multippeli myelooma tai rintasyöpä, johon liittyi ainakin yksi luuleesio. Tulokset osoittivat, että tsoledronihappo annoksella 4 mg oli yhtä tehokas kuin 90 mg pamidronaattia luustotapahtumien ehkäisyssä. Monitapahtuma-analyysi paljasti merkitsevän, 16 % riskin pienentymisen potilailla, joita hoidettiin 4 mg:lla tsoledronihappoa verrattuna pamidronaattihoitoa saaneisiin potilaisiin. Tehotulokset on esitetty taulukossa 5.
Taulukko 5: Tehotulokset (rintasyöpä- ja multippeli myeloomapotilaat)
SRE (+TIH) | Murtumat* | Luun sädehoito | |||||
Tsole-droni-happo 4 mg | Pamidro-naatti 90 mg | Tsole-droni-happo 4 mg | Pamidro-naatti 90 mg | Tsole-droni-happo 4 mg | Pamidro-naatti 90 mg | ||
n | 561 | 555 | 561 | 555 | 561 | 555 | |
Potilaiden osuus, joilla esiintyi SRE (%) | 48 | 52 | 37 | 39 | 19 | 24 | |
p-arvo | 0,198 | 0,653 | 0,037 | ||||
Mediaaniaika SRE:n ilmaantumiseen (päivinä) | 376 | 356 | ES | 714 | ES | ES | |
p-arvo | 0,151 | 0,672 | 0,026 | ||||
Luustosairastuvuus | 1,04 | 1,39 | 0,53 | 0,60 | 0,47 | 0,71 | |
p-arvo | 0,084 | 0,614 | 0,015 | ||||
Riskin pieneneminen sairastaa useita tapahtumia** (%) | 16 | - | NA | NA | NA | NA | |
p-arvo | 0,030 | NA | NA | ||||
* Sisältää nikamamurtumat ja muut kuin nikamamurtumat
** Sisältää kaikki luustotapahtumat; niiden kokonaismäärän sekä ajan jokaisen tapahtuman ilmaantumiseen tutkimuksen aikana
ES Ei saavutettu
NA Ei oleellinen
SRE Luustoon liittyvät tapahtumat (skeletal related events)
TIH Kasvaimen aiheuttama hyperkalsemia (tumour induced hypercalcaemia)
Tsoledronihappoa 4 mg:n annoksin tutkittiin myös kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa tutkimuksessa 228 potilaalla, joilla oli rintasyövän aiheuttamia dokumentoituja luumetastaaseja. Tutkimuksessa arvioitiin tsoledronihapon (4 mg:n annoksin) vaikutusta luustotapahtumien (skeletal related event, SRE) taajuussuhteeseen, joka laskettiin jakamalla luustotapahtumien (hyperkalsemiaa lukuun ottamatta, aiempiin luunmurtumiin mukautettuna) kokonaismäärä riskiperiodilla. Potilaat saivat vuoden ajan joko 4 mg tsoledronihappoa tai lumelääkettä joka neljäs viikko. Potilaat jakautuivat tasaisesti tsoledronihappo- ja lumeryhmiin.
Luustotapahtumien suhde oli tsoledronihapolla 0,628 ja lumelääkkeellä 1,096 (tapahtumat/henkilö vuoden aikana). Tsoledronihappohoitoa saaneessa ryhmässä 29,8 %:lla potilaista oli vähintään yksi luustotapahtuma (hyperkalsemiaa lukuun ottamatta), kun lumeryhmässä vastaava luku oli 49,6 % (p=0,003). Tsoledronihapporyhmässä ensimmäisen luustotapahtuman kehittymiseen kuluvan ajan mediaania ei saavutettu tutkimuksen loppuun mennessä, ja se piteni huomattavasti lumehoitoon verrattuna (p=0,007). Monitapahtuma-analyysissä 4 mg:n tsoledronihappohoito pienensi luustotapahtumien riskiä 41 %:lla (riskisuhde=0,59; p=0,019) lumehoitoon verrattuna.
Tsoledronihappohoitoa saaneessa ryhmässä kipu (Brief Pain Inventory (BPI) -asteikolla arvioituna) alkoi vähentyä tilastollisesti merkitsevästi lähtötilanteeseen verrattuna neljän viikon kuluttua verrattuna lumelääkkeeseen (Kuva 1). Kipu tsoledronihapporyhmässä oli johdonmukaisesti perustason alapuolella ja kivun lievittymiseen tuntui liittyvän vähäisempi kipulääkeiden käyttö.
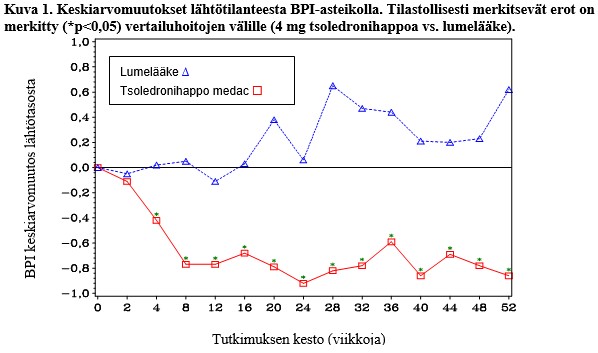
CZOL446EUS122/SWOG-tutkimus
Tämän havainnoivan tutkimuksen ensisijaisena tavoitteena oli arvioida leuan osteonekroosin (ONJ) kumulatiivista ilmaantuvuutta 3 vuoden kohdalla syöpäpotilailla, joilla oli luumetastaasi ja jotka saivat tsoledronihappoa. Osteoklastien estohoito, muu syövän hoito ja hammashoito toteutettiin kliinisen tilanteen vaatimusten mukaisesti, jotta ne edustaisivat mahdollisimman hyvin sekä yliopisto- ja muissa sairaaloissa että terveyskeskuksissa annettavaa hoitoa. Lähtotilanteessa tehtävä hammastarkastus oli suositeltava, mutta ei pakollinen.
Arvioitavina oli 3 491 potilasta, joista 87:llä vahvistettiin ONJ-diagnoosi. Vahvistetun ONJ:n arvioitu kumulatiivinen kokonaisilmaantuvuus kolmen (3) vuoden kohdalla oli 2,8 % (95 %:n CI: 2,3-3,5 %). Yhden (1) vuoden kohdalla osuus oli 0,8 % ja kahden (2) vuoden kohdalla 2,0 %. Vahvistetun ONJ:n prosenttiosuudet olivat kolmen (3) vuoden kohdalla suurimmat myeloomapotilailla (4,3 %) ja pienimmät rintasyöpäpotilailla (2,4 %). Vahvistetun ONJ:n tapausmäärät olivat tilastollisesti merkittävästi suuremmat potilailla, joilla oli multippeli myelooma (p = 0,03) kuin muita syöpiä sairastavilla potilailla yhteensä.
Kliinisten tutkimusten tulokset koskien kasvaimen aiheuttaman hyperkalsemian hoitoa
Kasvaimen aiheuttamaa hyperkalsemiaa koskevat kliiniset tutkimukset ovat osoittaneet, että tsoledronihapon vaikutukselle ovat ominaisia seerumin kalsiumpitoisuuden pieneneminen ja kalsiumin erittyminen virtsaan. Faasin I annostutkimuksissa lievää tai kohtalaista kasvaimen aiheuttamaa hyperkalsemiaa sairastaneilla potilailla tutkitut vaikuttavat annokset olivat noin 1,2–2,5 mg.
Tsoledronihapon (4 mg) ja pamidronaatin (90 mg) vaikutusten vertaamiseksi kasvaimen aiheuttamaa hyperkalsemiaa koskevan kahden keskeisen monikeskustutkimuksen tulokset yhdistettiin etukäteen suunnitellussa analyysissa. Korjattu seerumin kalsiumpitoisuus normaalistui nopeammin päivänä 4 annoksella 8 mg tsoledronihappoa, ja päivänä 7 annoksilla 4 mg ja 8 mg tsoledronihappoa. Vasteprosentit olivat seuraavat:
Taulukko 6: Täydellisen vasteen saaneiden potilaiden osuus eri päivinä yhdistetyissä kasvaimen aiheuttamaa hyperkalsemiaa koskevissa tutkimuksissa
Päivä 4 | Päivä 7 | Päivä 10 | |
Tsoledronihappo 4 mg (n=86) | 45,3 % (p=0,104) | 82,6 % (p=0,005)* | 88,4 % (p=0,002)* |
Tsoledronihappo 8 mg (n=90) | 55,6 % (p=0,021)* | 83,3 % (p=0,010)* | 86,7 % (p=0,015)* |
Pamidronaatti 90 mg (n=99) | 33,3 % | 63,6 % | 69,7 % |
*p:n arvot pamidronaattiin nähden. | |||
Veren kalsiumpitoisuuden normalisoitumiseen kulunut mediaaniaika oli 4 päivää. Mediaaniaika relapsiin (albumiinin suhteen korjatun seerumin kalsiumpitoisuuden suureneminen uudelleen arvoon ≥ 2,9 mmol/l) oli 30–40 päivää tsoledronihappohoitoa saaneilla ja 17 päivää 90 mg pamidronaattia saaneilla potilailla (p = 0,001 tsoledronihappoa 4 mg ja p = 0,007 tsoledronihappoa 8 mg saaneiden potilaiden ryhmässä). Mainittujen kahden tsoledronihappoannosten välillä ei ollut tilastollisesti merkitsevää eroa.
Kliinisissä tutkimuksissa hoidettiin uudelleen 8 mg:lla tsoledronihappoa 69 potilasta, joiden tila uusi tai jotka eivät vastanneet ensimmäiseen hoitoon (tsoledronihappo 4 mg, 8 mg tai pamidronaatti 90 mg). Näiden potilaiden vasteprosentti oli noin 52. Koska potilaita hoidettiin uudelleen vain 8 mg:n annoksella, tietoja 4 mg:n tsoledronihappoannokseen vertaamiseksi ei ole.
Kliinisissä tutkimuksissa potilailla, joilla oli kasvaimen aiheuttama hyperkalsemia, yleinen turvallisuusprofiili kaikissa kolmessa hoitoryhmässä (4 tai 8 mg tsoledronihappoa tai 90 mg pamidronaattia) oli samankaltainen haittavaikutusten tyypin ja vaikeusasteen suhteen.
Pediatriset potilaat
Kliinisten tutkimusten tulokset vaikea-asteista osteogenesis imperfectaa sairastavilla 1−17-vuotiailla lapsipotilailla
Laskimoon annettavan tsoledronihapon vaikutuksia vaikea-asteista osteogenesis imperfectaa (tyypit I, III ja IV) sairastavilla 1−17-vuotiailla lapsipotilailla verrattiin laskimoon annettavaan pamidronaattihoitoon yhdessä kansainvälisessä, satunnaistetussa, avoimessa monikeskustutkimuksessa, jonka tsoledronihapporyhmään kuului 74 ja pamidronaattiryhmään 76 potilasta. Tutkimuksen hoitovaihe kesti 12 kuukautta, ja sitä edelsi 4−9 viikon seulontavaihe, jonka aikana osallistujat käyttivät D-vitamiini- ja kalsiumlisää vähintään 2 viikon ajan. 1–< 3-vuotiaat potilaat saivat kliinisen tutkimusohjelman puitteissa 0,025 mg/kg tsoledronihappoa (maksimikerta-annos 0,35 mg) 3 kuukauden välein ja 3−17-vuotiaat potilaat taas 0,05 mg/kg tsoledronihappoa (maksimikerta-annos 0,83 mg) 3 kuukauden välein. Kerran tai kahdesti vuodessa annosteltavan tsoledronihapon yleistä pitkäaikaisturvallisuutta ja sen pitkäaikaisturvallisuutta munuaisten kannalta arvioitiin 12 kuukauden pituisessa jatkotutkimuksessa lapsilla, jotka olivat suorittaneet vuoden kestäneen tsoledronihappo- tai pamidronaattihoidon loppuun varsinaisen tutkimuksen puitteissa.
Tutkimuksen ensisijaisena päätetapahtumana oli lannerangan luuntiheyden (BMD) prosentuaalinen muutos lähtötilanteeseen nähden 12 kuukauden hoidon jälkeen. Tutkimuksen asetelma ei ollut riittävän vahva, jotta pystyttäisiin vahvistamaan tsoledronihapon kliinisiä etuja BMD:n suhteen. Erityisesti ei ollut selkeää tehonäyttöä murtumien tai kivun esiintyvyyteen. Vaikea-asteista osteogenesis imperfectaa sairastavista potilaista alaraajojen pitkien luiden murtumahaittoja ilmoitettiin noin 24 %:lla (reisiluu) ja 14 %:lla (sääriluu) tsoledronihappohoitoa saavista versus 12 %:lla ja 5 %:lla pamidronaattihoitoa saavista, taudin tyypistä ja murtumien syystä riippumatta. Murtumien kokonaisilmaantuvuus oli verrattavissa tsoledronaattihoitoa ja pamidronaattihoitoa saavilla potilailla: 43 % (32/74) versus 41 % (31/76). Murtumariskin tulkintaa vaikeuttaa se, että vaikea-asteista osteogenesis imperfectaa sairastavilla esiintyy yleisesti murtumia itse tautiprosessin vuoksi.
Tässä populaatiossa havaitut haittavaikutukset olivat luonteeltaan samanlaisia kuin mitä on aiemmin havaittu pitkälle edenneitä, luuta affisioivia syöpätauteja sairastavilla aikuisilla (ks. kohta Haittavaikutukset). Haittavaikutukset esitetään taulukossa 7 yleisyyden mukaan ryhmiteltyinä. Ryhmittelyssä käytetään seuraavaa vakiintunutta luokitusta: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 7: Vaikea-asteista osteogenesis imperfectaa sairastavilla lapsilla havaitut haittavaikutukset1
Hermosto | ||
Yleiset: | Päänsärky | |
Sydän | ||
Yleiset: | Takykardia | |
Hengityselimet, rintakehä ja välikarsina | ||
Yleiset: | Nenä-nielutulehdus | |
Ruoansulatuselimistö | ||
Hyvin yleiset: | Oksentelu, pahoinvointi | |
Yleiset: | Vatsakipu | |
Luusto, lihakset ja sidekudos | ||
Yleiset: | Raajojen kipu, nivelkipu, tuki- ja liikuntaelimistön kipu | |
Yleisoireet ja antopaikassa todettavat haitat | ||
Hyvin yleiset: | Kuume, väsymys | |
Yleiset: | Akuutin vaiheen reaktiot, kipu | |
Tutkimukset | ||
Hyvin yleiset: | Hypokalsemia | |
Yleiset: | Hypofosfatemia | |
1Haittavaikutuksia, joiden esiintyvyystiheys oli < 5 %, arvioitiin lääketieteellisesti ja kävi ilmi, että nämä tapaukset ovat johdonmukaisia tsoledronihapon hyvin vakiintuneen turvallisuusprofiilin kanssa (ks. kohta Haittavaikutukset).
Vaikea-asteista osteogenesis imperfectaa sairastavilla lapsilla tsoledronihappohoitoon näyttää liittyvän pamidronaattihoitoa suurempi akuutin vaiheen reaktioiden, hypokalsemian ja selittämättömän takykardian riski, mutta tämä eroavaisuus pieneni seuraavien infuusioiden jälkeen.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset tsoledronihappoa sisältävän viitelääkevalmisteen käytöstä hoidossa kaikissa pediatrisissa potilasryhmissä sekä kasvaimen aiheuttamassa hyperkalsemiassa että luustotapahtumien ehkäisemisessä potilailla, joilla on luustosta lähtöisin oleva tai luustoon levinnyt pitkälle edennyt syöpä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Annettaessa 5 ja 15 minuutin kertainfuusiona ja toistoannostelussa 2, 4, 8 ja 16 mg tsoledronihappoa 64 potilaalle, joilla oli luustometastaaseja, saatiin seuraavat farmakokineettiset tiedot, joiden todettiin olevan annoksesta riippumattomia.
Jakautuminen
Tsoledronihappoinfuusion aloittamisen jälkeen tsoledronihappopitoisuudet plasmassa suurenevat nopeasti saavuttaen korkeimman pitoisuuden infuusion lopussa. Tämän jälkeen pitoisuudet nopeasti pienenevät ollen alle 10 %:ia korkeimmasta arvosta 4 tunnin kuluttua ja alle 1 %:ia 24 tunnin kuluttua, jonka jälkeen seuraa jakso, jolloin pitoisuus on erittäin pieni alle 0,1 %:ia korkeimmasta arvosta ennen seuraavaa tsoledronihappoinfuusiota päivänä 28.
Eliminaatio
Laskimoon annettu tsoledronihappo eliminoituu kolmivaiheisesti: se häviää nopeasti kahdessa vaiheessa verenkierrosta; puoliintumisajat ovat t½α 0,24 ja t½β 1,87 tuntia. Tätä seuraa pitkä eliminaatiojakso, ja terminaalisen eliminaation puoliintumisaika t½γ on 146 tuntia. Joka 28. päivä tapahtuneessa toistoannostelussa tsoledronihapon ei havaittu kumuloituvan plasmaan. Tsoledronihappo ei metaboloidu, ja se erittyy muuttumattomana munuaisten kautta. Ensimmäisten 24 tunnin aikana 39 ± 16 % annoksesta erittyy virtsaan ja loppu sitoutuu lähinnä luukudokseen. Luukudoksesta se vapautuu erittäin hitaasti takaisin systeemiseen verenkiertoon ja eliminoituu munuaisten kautta. Elimistön kokonaispuhdistuma on annoksesta riippumatta 5,04 ± 2,5 l/h, eikä sukupuoli, ikä, rotu tai paino vaikuta siihen. Infuusioajan pidentäminen 5 minuutista 15 minuuttiin pienensi tsoledronihappopitoisuutta 30 prosentilla infuusion lopussa, mutta ei vaikuttanut AUC:hen.
Tsoledronihapon farmakokineettisten tunnuslukujen vaihtelu potilaiden kesken oli suuri, kuten muillakin bisfosfonaateilla.
In vitro -tutkimuksessa tsoledronihapolla oli alhainen affiniteetti ihmisen veren sellulaarisiin komponentteihin (keskimääräinen veren ja plasman konsentraatioiden suhde oli 0,59 konsentraatioiden vaihteluvälin ollessa 30–5 000 ng/ml). Plasman proteiineihin sitoutuminen on vähäistä sitoutumattoman tsoledronihappo-osuuden vaihdellessa 60 %:sta 77 %:iin tsoledronihappopitoisuuksilla 2 ng/ml ja 2 000 ng/ml.
Erityisryhmät
Maksan vajaatoiminta
Tsoledronihapon farmakokinetiikasta ei ole tietoa hyperkalsemiaa eikä maksan vajaatoimintaa sairastavien potilaiden osalta. Tsoledronihappo ei inhiboi ihmisen P450-entsyymejä in vitro, eikä se muunnu elimistössä. Eläinkokeiden mukaan < 3 % annoksesta erittyi ulosteeseen, mikä viittaa siihen, ettei maksan toiminnalla ole oleellista merkitystä tsoledronihapon farmakokinetiikassa.
Munuaisten vajaatoiminta
Tsoledronihapon munuaispuhdistuma korreloi kreatiniininpuhdistuman kanssa; munuaispuhdistuma oli 75 ± 33 % kreatiniinipuhdistumasta. Kreatiniinipuhdistuman keskiarvo 64 tutkitulla syöpäpotilaalla oli 84 ± 29 ml/min (vaihteluväli 22–143 ml/min). Populaatioanalyysin perusteella potilaalla, jonka kreatiniinipuhdistuma on 20 ml/min (vaikea-asteinen munuaisten vajaatoiminta), vastaava ennustettu tsoledronihapon puhdistuma on 37 % ja potilaalla, jonka kreatiniinipuhdistuma on 50 ml/min (kohtalainen vajaatoiminta), vastaava ennustettu tsoledronihapon puhdistuma on 72 % arvosta, joka on potilaalla, jolla kreatiniinipuhdistuma on 84 ml/min. Farmakokinetiikasta vaikea-asteista munuaisten vajaatoimintaa sairastavilla potilailla (kreatiniinipuhdistuma < 30 ml/min) on vain vähän tietoa.
Pediatriset potilaat
Rajalliset farmakokinetiikan tiedot vaikea-asteista osteogenesis imperfectaa sairastavista lapsista viittaavat siihen, että tsoledronihapon farmakokinetiikka on 3−17-vuotiailla lapsilla samankaltainen kuin samanlaisia annoksia (mg/kg) käyttävillä aikuisilla. Ikä, paino, sukupuoli ja kreatiniinipuhdistuma eivät nähtävästi vaikuta systeemiseen tsoledronihappoaltistukseen.
Prekliiniset tiedot turvallisuudesta
Akuutti toksisuus
Suurin ei-letaali kerta-annos laskimoon oli hiirellä 10 mg/kg ja rotalla 0,6 mg/kg.
Subkrooninen ja krooninen toksisuus
Tsoledronihappo oli hyvin siedetty, kun sitä annettiin rotalle ihon alle ja koiralle laskimoon enimmillään 0,02 mg/kg vuorokaudessa neljän viikon ajan. Rotilla 0,001 mg/kg vuorokaudessa ihon alle ja koirilla 0,005 mg/kg kerran 2–3 vuorokauden välein laskimoon enimmillään 52 viikon ajan olivat myös hyvin siedettyjä.
Yleisin havainto toistoannoksella tehdyissä tutkimuksissa oli primaarin hohkaluun lisääntyminen kasvavien eläinten pitkien luiden varsiosassa lähes kaikilla annostasoilla merkkinä valmisteen farmakologisesta luun resorptiota estävästä vaikutuksesta.
Munuaisvaikutuksia koskevat turvallisuusmarginaalit olivat kapeat pitkäaikaisissa toistuvaa parenteraalista annostusta käyttäen tehdyissä eläinkokeissa, mutta kumulatiivinen haittavaikutukseton taso (NOAEL) kerta-antoa (1,6 mg/kg) ja toistuvaa antoa (0,06–0,6 mg/kg/vrk) käyttäen, enimmillään kuukauden kestäneissä tutkimuksissa, ei viitannut munuaisvaikutuksiin, kun käytettiin annoksia, jotka olivat vähintään ihmiselle tarkoitetun maksimaalisen hoitoannoksen suuruisia. Pitkäaikainen toistuva anto annoksina, jotka vastaavat ihmiselle tarkoitettua tsoledronihapon suurinta hoitoannosta, aiheutti toksisia vaikutuksia muissa elimissä, kuten maha-suolikanavassa, maksassa, pernassa ja keuhkoissa sekä laskimon punktiokohdassa.
Lisääntymistoksisuus
Tsoledronihappo oli teratogeeninen rotalla ≥ 0,2 mg/kg:n ihonalaisina annoksina. Vaikka teratogeenisuutta tai sikiötoksisuutta ei kaniinilla havaittu, emoon kohdistuvaa toksisuutta havaittiin. Rotalla havaittiin synnytyksen vaikeutumista pienimmällä annostasolla (0,01 mg/kg).
Mutageenisuus ja karsinogeenisuus
Mutageenisuuskokeiden perusteella tsoledronihappo ei ollut mutageeninen, eivätkä karsinogeenisuustutkimukset viitanneet siihen, että tsoledronihappo olisi karsinogeeninen.
Farmaseuttiset tiedot
Apuaineet
Mannitoli
Natriumsitraatti
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Lääkevalmiste ei saa tulla kosketuksiin kalsiumia sisältävien nesteiden kanssa eikä sitä saa sekoittaa tai antaa laskimoon muiden lääkevalmisteiden kanssa käyttäen samaa infuusioletkua.
Kestoaika
Avaamaton pullo: 3 vuotta.
Ensimmäisen avaamisen jälkeen: käytön aikaisen kemiallisen ja fysikaalisen stabiiliuden on osoitettu olevan 4 vuorokautta 2−8 ºC:ssa ja 25 ºC:ssa.
Kemiallisen ja fysikaalisen käytön aikaisen stabiiliuden on osoitettu olevan 96 tuntia 2−8 ºC:ssa ja 25 ºC:ssa, kun on käytetty lasipulloja sekä useita polyvinyylikloridista, polyetyleenistä ja polypropyleenistä tehtyjä infuusiopussi- ja infuusioletkutyyppejä (jotka on esitäytetty 9 mg/ml (0,9 %) natriumkloridi-injektionesteellä, liuos, tai 5 % m/V glukoosiliuoksella).
Käyttöön valmistettu ja laimennettu liuos: Mikrobiologiselta kannalta lääkevalmiste tulee käyttää heti. Jos liuosta ei käytetä heti, käytön aikainen säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä normaalisti saa ylittää 24 tuntia 2 °C–8 °C:ssa, ellei laimentamista ole tehty kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Ei saa jäätyä.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TSOLEDRONIHAPPO MEDAC infuusioneste, liuos
4 mg/100 ml (L:ei) 1 kpl (297,73 €)
PF-selosteen tieto
Väritön tyypin I lasipullo, jossa on fluoropolymeerilla päällystetystä halobutyylikumista valmistettu korkki ja alumiininen repäisykorkki.
Yksi injektiopullo sisältää 100 ml liuosta.
Tsoledronihappo medac toimitetaan pakkauksissa, jotka sisältävät 1 pullon tai monipakkauksissa sisältäen 4 pahvikoteloa, joista kukin sisältää 1 pullon. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Lisätietoja Tsoledronihappo medac 4 mg/100 ml:n käsittelystä, myös valmistusohjeet alennettuihin annoksiin Tsoledronihappo medac -valmisteen käyttövalmista pulloa käyttäen, on annettu kohdassa Annostus ja antotapa.
Infuusio täytyy valmistaa aseptisin menetelmin. Vain kertakäyttöön.
Vain kirkas hiukkasia sisältämätön liuos, jonka väri ei ole muuttunut, on käyttökelpoinen.
Terveydenhuollon ammattilaisten tulee ottaa huomioon, että käyttämätöntä Tsoledronihappo medac -valmistetta ei saa hävittää paikallisen viemäriverkoston kautta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TSOLEDRONIHAPPO MEDAC infuusioneste, liuos
4 mg/100 ml 1 kpl
- Ei korvausta.
ATC-koodi
M05BA08
Valmisteyhteenvedon muuttamispäivämäärä
01.05.2024
Yhteystiedot
Spektri Business Park, Metsänneidonkuja 4
02130 Espoo
010 420 4000
www.medac.fi
info@medac.fi
