BCG-MEDAC jauhe ja liuotin suspensiota varten, virtsarakkoon
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Potilaskortti sisältää tärkeää turvallisuuteen liittyvää tietoa potilaalle, joka saa tai on aiemmin saanut BCG-medac-hoitoa.
Vaikuttavat aineet ja niiden määrät
Käyttökuntoon saattamisen jälkeen yksi lääkepullo sisältää:
Mycobacterium bovisista johdettua BCG (Bacillus Calmette-Guerin) bakteeria, 1173‑P2‑kannasta johdettu RIVM‑kanta ...................................................................................................... 2 x 108 - 3 x 109 elävää bakteeria
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Jauhe ja liuotin suspensiota varten, virtsarakkoon
Kliiniset tiedot
Käyttöaiheet
Virtsarakon ei-invasiivisen uroteelisyövän hoito:
- Syövän in situ kuratiivinen hoito
-
Uusiutumisen estohoito kun:
- uroteelisyöpä rajoittuu limakalvoon:
- Ta (G1‑G2) jos kasvain on multifokaalinen ja/tai uusiutunut
- Ta (G3)
- uroteelisyöpä rakon tyvikalvossa mutta ei lihaksessa (T1)
- syöpä in situ
- uroteelisyöpä rajoittuu limakalvoon:
Annostus ja antotapa
BCG‑medacia saavat annostella vain terveydenhuollon ammattilaiset, joilla on kokemusta tästä hoidosta.
BCG‑medac on tarkoitettu annettavaksi virtsarakkoon käyttökuntoon saattamisen jälkeen.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet BCG‑medac-suspension valmistelusta ennen lääkkeen antoa.
Annostus
Aikuiset ja iäkkäät
Yhteen rakonsisäiseen instillaatioon tarvitaan yksi lääkepullollinen ohjeiden mukaan uudelleen suspendoitua lääkettä.
Induktiohoito
BCG-hoito aloitetaan 2–3 viikkoa transuretraaliresektion (TUR) tai rakkobiopsian jälkeen, ellei katetrointi ole aiheuttanut kudosvauriota, ja jatketaan viikon välein 6 viikon ajan. Kohtalaisen ja korkean riskin kasvainten kohdalla hoitoa jatketaan ylläpitohoitona. Ylläpitohoito-ohjelmat on esitetty edempänä.
Ylläpitohoito
Kliinisten tutkimusten perusteella ylläpitohoito on erittäin suositeltava induktiohoidon jälkeen. Suositeltava ylläpitohoito käsittää 3 annosta viikon välein kuukausina 3, 6, 12, 18, 24, 30 ja 36 vähintään yhden vuoden ja enintään kolmen vuoden ajan annettuna. Tässä ohjelmassa lääkettä annostellaan enintään 27 kertaa 3 vuoden aikana.
Ylläpitohoito vähentää uusiutumista ja saattaa hidastaa etenemistä, mutta hoitoon liittyvät haittavaikutukset ja epämiellyttävät oireet saattavat olla joillakin potilailla suurempia kuin hoidon hyödyt. Tämän vuoksi hyöty-riskiarviointi ja potilaan mieltymysten huomioiminen on tärkeää ennen ylläpitohoidon aloittamista tai jatkamista. Puolen vuoden välein annettavan ylläpitohoidon tarve ensimmäisen hoitovuoden jälkeen on arvioitava myös kasvaimen luokituksen ja kliinisen vasteen perusteella.
Pediatriset potilaat
BCG‑medac-valmisteen turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Potilas ei saa nauttia nesteitä neljään tuntiin ennen instillaatiota eikä kahteen tuntiin sen jälkeen.
Virtsarakon katetrointiin soveltuva katetri viedään rakkoon aseptisissa olosuhteissa. Liukastusainetta on käytettävä riittävästi virtsaputken limakalvojen vaurioitumisen riskin ja siitä aiheutuvan vaikeiden komplikaatioiden riskin pienentämiseksi sekä toimenpiteestä potilaalle aiheutuvan epämukavuuden vähentämiseksi. Rakko tulee tyhjentää ennen BCG-instillaatiota. Rakon tyhjentäminen kokonaan katetrisoinnin jälkeen vähentää mahdollisesti rakkoon asti päätyneiden liukastusainejäämien määrää ennen BCG-medac-instillaatiota.
BCG‑medac instilloidaan rakkoon katetrin avulla alhaisella paineella. BCG‑medac-suspension tulee olla rakossa kaksi tuntia. Tänä aikana on huolehdittava siitä, että suspensio on kosketuksessa rakon koko limakalvoon. Siksi potilaan on oltava liikkeellä mahdollisimman paljon, tai vuodepotilasta tulee kääntää selältä vatsalleen ja takaisin 15 minuutin välein. Kahden tunnin kuluttua potilaan tulee tyhjentää rakkonsa istuma-asennossa.
Ellei mitään erityistä lääketieteellistä vasta-aihetta ole, potilaan runsasta nesteytystä suositellaan 48 tunnin ajan rakonsisäisen instillaation jälkeen.
BCG‑medac-hoitoa saaville potilaille tulee antaa pakkausseloste ja potilaskortti.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
BCG‑medac-valmistetta ei saa antaa immuunivajepotilaille tai potilaille, joilla immuunivaje on joko synnynnäinen tai hankittu, joko samanaikaisesta sairaudesta (esim. HIV‑positiivisuus, leukemia, lymfooma), syöpähoidosta (esim. solusalpaajia sisältävät lääkevalmisteet, sädehoito) tai immunosuppressiivisesta hoidosta (esim. kortikosteroidit) johtuva.
BCG‑medac-valmistetta ei saa antaa aktiivista tuberkuloosia sairastaville potilaille. Aktiivisen tuberkuloosin riski on poissuljettava asianmukaisen anamneesin avulla sekä tarvittaessa diagnostisten kokeiden avulla paikallisten ohjeiden mukaisesti.
Virtsarakon aikaisempi sädehoito.
BCG‑medac-hoito on vasta-aiheinen imettävillä naisilla (ks. kohta Raskaus ja imetys).
BCG‑medac-valmistetta ei saa instilloida ennen kuin 2–3 viikkoa on kulunut transuretraaliresektiosta, rakkobiopsiasta tai kudosvaurion aiheuttaneesta katetroinnista.
Rakon puhkeaminen, joka voi lisätä vaikeiden systeemisten infektioiden riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Akuutti virtsatietulehdus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Yksittäinen havainto oireettomasta leukosyturiasta ja oireeton bakteerivirtsaisuus eivät ole vasta-aiheita virtsarakkoon annettavalle BCG‑medac-hoidolle eikä antibioottiprofylaksi ole välttämätöntä.
Varoitukset ja käyttöön liittyvät varotoimet
BCG‑medac-valmistetta ei saa annostella ihon alle, ihon sisään, lihakseen tai laskimoon eikä rokotteena.
Oireiden, merkkien tai oireyhtymän hoito
Ks. kohta Haittavaikutukset.
Käsittelyyn liittyvät varotoimet
BCG‑medac-valmistetta ei saa käsitellä huoneessa, jossa solunsalpaajia sisältäviä lääkevalmisteita valmistetaan annettavaksi laskimoon eikä samojen henkilöiden toimesta. Henkilö, jolla on todettu immuunipuutos, ei saa käsitellä BCG‑medac-valmistetta. Iho- ja limakalvokosketusta BCG-medac‑valmisteeseen tulee välttää. Kontaminaatio voi johtaa kosketusalueen yliherkkyysreaktioon tai infektioon.
BCG-medac-valmisteen läikkyminen
Läikkynyt BCG‑medac-suspensio tulee puhdistaa desinfektioaineella, joka tehoaa todistetusti mykobakteereihin. Iholle joutunut lääke tulee puhdistaa sopivalla desinfektioaineella.
Potilaan yleinen hygienia
Käsien ja genitaalialueen peseminen on suositeltavaa virtsaamisen jälkeen. Tämä koskee etenkin ensimmäisiä virtsaamiskertoja BCG-instillaation jälkeen. Jos virtsaa joutuu rikkoontuneelle iholle, sopivan desinfektioaineen käyttö on suositeltavaa.
Tuberkuliini-testit
Ihotestit
Rakonsisäinen BCG‑medac-hoito saattaa herkistää tuberkuliinille ja vaikeuttaa mykobakteeridiagnoosia varten tehtävän tuberkuliini-ihotestin tulkitsemista. Siitä syystä on aiheellista tehdä tuberkuliini-ihotesti ennen BCG‑medac-annostelua.
Bacillus Calmette-Guérin-bakteerin havaitseminen
Lääkäreiden tulee olla tietoisia siitä, että negatiivinen tulos koepalan mikrobiviljelystä ja testituloksista ei sulje pois systeemistä BCG-infektiota. Useissa tapauksissa mikrobia ei onnistuttu havaitsemaan, vaikka potilaalla oli systeeminen BCG-infektio. Saatavana olevat menetelmät (mikroskopia, PCR ja/tai viljelyt ja/tai tuberkuloosiin sopivan histologian havaitseminen) eivät ole luotettavia.
Vakava systeeminen BCG-infektio/reaktio
Vamman aiheuttava katetrointi saattaa edesauttaa BCG-septikemisiä tapahtumia, joihin saattaa liittyä septinen sokki ja hengenvaarallinen tila. Ks. hoitovaihtoehdot kohdasta Haittavaikutukset.
Virtsatieinfektio on aina poissuljettava ennen BCG-instillaatiota (virtsarakon limakalvotulehdus saattaa lisätä riskiä, että BCG leviää veren kautta). Jos virtsatieinfektio todetaan BCG-hoidon aikana, hoito tulee keskeyttää, kunnes virtsakokeen tulos on normalisoitunut ja antibioottihoito on annettu loppuun asti.
Vaikeiden systeemisten BCG-infektioiden mahdollisuus ja niihin liittyvän tuberkuloosihoidon välttämättömyys tulee huomioida ennen BCG-hoidon aloittamista erityisesti iäkkäille potilaille (ks. Iäkkäät potilaat) ja potilaille, joilla on heikentynyt maksan toiminta.
Vaikeita systeemisiä BCG-infektioita/reaktioita on raportoitu alle 5 %:lla tutkimuspopulaatiosta. Katso merkit ja oireet kohdasta Haittavaikutukset.
Jos systeemistä infektiota epäillään, tulee konsultoida infektiotauteihin erikoistunutta lääkäriä. BCG-infektio voi olla mahdollisesti kuolemaan johtava. Katso lisätietoja kohdasta Haittavaikutukset.
Toisin kuin systeemiset infektiot, Reiterin oireyhtymä ilmenee pääasiassa immuunivälitteisenä reaktiona, joka ei välttämättä johdu BCG:n leviämisestä vaan sen voi laukaista myös pelkästään virtsateihin paikallistunut BCG.
Kuume tai makroskooppinen hematuria
Hoito tulee keskeyttää, kunnes kuume ja makroskooppinen hematuria ovat parantuneet.
Pieni rakon kapasiteetti
Rakkokontraktuurariski saattaa kasvaa potilailla, joilla rakon kapasiteetti on pieni.
HLA‑B27
HLA‑B27‑positiivisilla potilailla reaktiivisen artriitin tai Reiterin oireyhtymän esiintyvyys saattaa lisääntyä.
Latentin BCG-infektion aktivoituminen (ml. viivästynyt diagnoosi)
Yksittäisiä tapauksia on raportoitu, joissa BCG-bakteereja pysyi elimistössä usean vuoden ajan. Tällaiset latentit BCG-infektiot saattavat aktivoitua vuosia alkuperäisen infektion jälkeen, ja ne voivat ilmetä erityisesti granulomatoottisena pneumoniittina, absesseina, infektoituneina aneurysmina tai implantin, siirteen tai ympäröivän kudoksen infektioina.
Potilaalle on kerrottava latenttien BCG-infektioiden myöhäisen aktivoitumisen mahdollisuudesta ja heille on annettava ohjeistus siitä, miten toimia tuntemattomasta syystä johtuvien oireiden, kuten kuumeen ja laihtumisen, ilmetessä.
Jos latentin BCG-infektion aktivoitumista epäillään, tulee konsultoida infektiotauteihin erikoistunutta lääkäriä.
Iäkkäät potilaat
BCG:n anto iäkkäille potilaille ei ole vasta-aiheista. Systeemisen BCG-infektion/reaktion riski on kuitenkin huomioitava ennen ensimmäistä antoa. Iäkkäiden potilaiden munuaisten tai maksan toiminta voi olla heikentynyt, mikä voi vaikuttaa tuberkuloosin lääkehoitoon vaikean systeemisen BCG-infektion/reaktion tapauksessa. Erityistä varovaisuutta on noudatettava yleistilaltaan heikentyneiden iäkkäiden potilaiden kanssa.
Raskaus
BCG‑medac-valmisteen käyttöä ei suositella raskauden aikana (ks. kohta Raskaus ja imetys).
Immuunipuutospotilaiden kanssa kontaktissa olevat potilaat
BCG-medac-hoitoa saavien potilaiden on otettava käyttöön riittävät hygieniatoimenpiteet, jos he ovat kontaktissa immuunipuutospotilaiden kanssa. M. bovis on vähemmän patogeeninen kuin M. tuberculosis eikä tartuntoja ihmisten välillä ole vielä raportoitu, mutta sitä ei voida poissulkea erityisesti immuunipuutospotilaiden kohdalla.
Sukupuoliteitse tapahtuva tartunta
BCG:n ei toistaiseksi ole raportoitu tarttuvan sukupuoliteitse, mutta yhdynnässä on suositeltavaa käyttää kondomia viikon ajan BCG-hoidon jälkeen.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yhteisvaikutukset
BCG-bakteerit ovat herkkiä tuberkuloosin hoidossa käytettäville lääkevalmisteille (esim. etambutoli, streptomysiini, para-aminosalisyylihappo [PAS], isoniatsidi [INH] ja rifampisiini), antibiooteille ja antiseptisille aineille. Resistenssiä pyratsinamidille ja sykloseriinille on raportoitu.
Rakonsisäisen BCG-hoidon aikana tuberkuloosilääkkeiden ja antibioottien kuten fluorokinolonien, doksisykliinin ja gentamysiinin käyttöä tulee välttää koska BCG on herkkä näille lääkevalmisteille.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja BCG:n käytöstä raskaana oleville naisille. Lisääntymistutkimuksia ei ole suoritettu eläimillä. BCG‑medac-valmisteen käyttöä ei suositella raskauden aikana.
Imetys
Ei ole riittävästi tietoja BCG:n/metaboliittien erittymisestä ihmisen rintamaitoon. BCG‑medac on vasta-aiheista rintaruokinnan aikana (ks. kappale Vasta-aiheet).
Hedelmällisyys
Rakonsisäisen BCG-hoidon on todettu vaikuttavan haitallisesti spermatogeneesiin ja voivan mahdollisesti aiheuttaa oligospermiaa tai atsoospermiaa. Eläinkokeiden perusteella nämä vaikutukset saattavat olla ohimeneviä ja palautuvia. Miesten on kuitenkin syytä keskustella lääkärin kanssa siittiöiden talteenoton mahdollisuudesta ennen hoidon aloittamista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
BCG-medac-hoidon aikana esiintyvät paikalliset tai systeemiset oireet saattavat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Alla luetellaan haittavaikutukset elinjärjestelmän ja esiintyvyyden mukaan. Esiintyvyydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Elinjärjestelmäluokka | Yleisyysluokitus ja haittavaikutukset |
| Infektiot | Hyvin yleinen Virtsarakon kystiitti ja tulehdusreaktiot (granulooma), oireeton granulomatoottinen prostatiitti Melko harvinainen Virtsatietulehdus, orkiitti, epididymiitti, oireinen granulomatoottinen prostatiitti, vakava systeeminen BCG-reaktio/infektio, BCG-sepsis, miliaarikeuhkokuume, ihoabsessi, Reiterin oireyhtymä (konjunktiviitti, epäsymmetrinen oligoartriitti ja kystiitti) Harvinainen Vaskuliitti (esim. tulehtunut aneurysma), munuaisabsessi Hyvin harvinainen Implanttien ja ympäröivän kudoksen BCG-infektio (esim. aorttasiirteen infektio, sydämen defibrillaattori, lonkan tai polven artroplastia), paikallinen imusolmuketulehdus, osteomyeliitti, luuydintulehdus, peritoniitti, psoasabsessi, terskatulehdus, tuberkuloosilääkkeille resistentti orkiitti tai epididymiitti |
| Veri ja imukudos | Melko harvinainen Sytopenia, anemia Hyvin harvinainen Kohdunkaulan lymfadeniitti Tuntematon Hemofagosyyttinen oireyhtymä |
| Immuunijärjestelmä | Hyvin yleinen Ohimenevä systeeminen BCG-reaktio (kuume < 38,5 °C, flunssankaltaiset oireet, mukaan lukien sairauden tunne, kuume, vilunväristykset, yleinen huono olo, myalgia) Hyvin harvinainen Yliherkkyysreaktio (esim. silmäluomien edeema, yskä) |
| Silmät | Hyvin harvinainen Korioretiniitti, konjunktiviitti, uveiitti |
| Verisuonisto | Melko harvinainen Hypotensio Hyvin harvinainen Verisuonifisteli Tuntematon Vaskuliitti (mukaan lukien keskushermoston vaskuliitti) |
| Hengityselimet, rintakehä ja välikarsina | Melko harvinainen Keuhkogranulooma |
| Ruoansulatuselimistö | Hyvin yleinen Pahoinvointi Yleinen Ripuli, vatsakipu Hyvin harvinainen Oksentelu, suolifisteli |
| Maksa ja sappi | Melko harvinainen Hepatiitti |
| Iho ja ihonalainen kudos | Melko harvinainen Ihottuma |
| Luusto, lihakset ja sidekudos | Yleinen Myalgia Melko harvinainen Artriitti, artralgia |
| Munuaiset ja virtsatiet | Hyvin yleinen Tihentynyt virtsaamistarve ja kipu virtsatessa Yleinen Virtsanpidätyskyvyttömyys Melko harvinainen Makroskooppinen hematuria, rakkoretentio, virtsaputken ahtauma, kutistusrakko Tuntematon Munuaisten vajaatoiminta, pyelonefriitti, nefriitti (ml. tubulointerstitiaalinen nefriitti, interstitiaalinefriitti ja glomerulonefriitti) |
| Sukupuolielimet ja rinnat | Tuntematon Sukupuolielinten häiriöt (esim. emätinkipu, dyspareunia), oligospermia, atsoospermia |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen Uupumus Yleinen Kuume ≥ 38,5 °C Hyvin harvinainen Perifeerinen ödeema |
| Tutkimukset | Melko harvinainen Maksaentsyymi koholla Tuntematon Prostataspesifinen antigeeni (PSA) koholla |
BCG-hoidon aikana haittavaikutuksia esiintyy yleisesti, mutta ne ovat yleensä lieviä ja ohimeneviä. Haittavaikutukset yleensä lisääntyvät BCG-instillaatiokertojen mukaan.
Myalgiaa saattaa esiintyä yleisesti ja artriittia/artralgiaa ja ihottumaa saattaa esiintyä melko harvoin. Useimmissa artriitti-, artralgia- ja ihottumatapauksissa ne voidaan katsoa johtuvan potilaan yliherkkyydestä BCG:lle. Joissakin tapauksissa saattaa olla aiheellista keskeyttää BCG-medac-hoito.
Paikalliset haittavaikutukset
Kipua virtsatessa ja tihentynyttä virtsaamistarvetta esiintyy jopa 90 %:lla potilaista. Kystiitti ja tulehdusreaktio (granulomata) saattavat olla oleellisia BCG:n antituumorivaikutuksen kannalta.
Muita epätavallisia, paikallisia haittavaikutuksia ovat: makroskooppinen hematuria, virtsatieinfektio, rakkoretraktio, virtsatien ahtauma, rakkokontraktuura, oireellinen granulomatoottinen prostatiitti, orkiitti ja epididymiitti. Munuaisabsesseja esiintyy harvoin. Sukupuolielinten häiriöitä (esim. emätinkipu, dyspareunia) voi esiintyä, joskaan niiden yleisyyttä ei tunneta.
Ohimenevä systeeminen BCG-reaktio
Lievää kuumetta, flunssan kaltaisia oireita ja yleistä huonon olon tunnetta saattaa esiintyä. Nämä oireet häviävät yleensä 24 – 48 tunnin kuluessa ja ne tulee hoitaa oireenmukaisesti tavanomaisella hoidolla. Nämä reaktiot viittaavat alkavaan immuunireaktioon. Kaikkia lääkevalmistetta saavia potilaita tulee seurata huolellisesti ja kehottaa heitä ilmoittamaan mahdollisesta kuumeilusta ja virtsateihin liittymättömistä tapahtumista.
Vakavat systeemiset haittavaikutukset/infektiot
BCG-infektion erottaminen BCG:n aiheuttamasta immuunireaktiosta on haastavaa, sillä oireet ovat alussa hyvin samanlaiset. Sitä vastoin ohimenevä systeeminen BCG-reaktio on hyvin yleinen haittavaikutus, joka on erotettava muista infektioista.
BCG-infektion/reaktion ensimmäisiä kliinisiä merkkejä ja oireita ovat yli 12 tuntia kestävä yli 39,5 °C:n kuume, yli 48 tuntia kestävä yli 38,5 °C:n kuume ja yleistilan heikkeneminen.
Tyypillisiä infektion merkkejä ovat miliaarikeuhkokuume, granulomatoottinen hepatiitti, poikkeavat maksakokeiden tulokset (erityisesti kohonnut alkalinen fosfataasi), elinten toimintahäiriöt (muut kuin urogenitaaliset), joissa biopsiassa todetaan ajan kuluessa granulomatoottinen tulehdus.
Jos systeemistä infektiota epäillään, tulee konsultoida infektiotauteihin erikoistunutta lääkäriä. BCG-infektio voi olla mahdollisesti kuolemaan johtava.
Systeemisen BCG-infektion oireet eivät eroa tuberkuloosin oireista. Potilasta ei siitä huolimatta tarvitse eristää, koska M. bovis on vähemmän patogeeninen ihmisille kuin M. tuberculosis.
Latentin infektion aktivoituessa potilailla yleisesti ilmeneviä oireita ovat kuume ja tuntemattomasta syystä johtuva laihtuminen. Useat tapausraportit osoittavat, että diagnosoiminen on haastavaa, koska oireet vaihtelevat ja lääkärit eivät epäile kausaalista suhdetta BCG-infektioon.
Oikea ja varhain tehty diagnoosi ja siitä seuraava asianmukainen hoito on tärkeää lopputuloksen kannalta erityisesti iäkkäille tai yleistilaltaan heikentyneille potilaille kuolemantapauksien välttämiseksi. Huomaa, että potilaalle on annettava potilaskortti, jossa käsitellään tätä aihetta (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos latentin BCG-infektion aktivoitumista epäillään, tulee konsultoida infektiotauteihin erikoistunutta lääkäriä.
Kortikosteroidien käyttö voi olla suositeltavaa muun hoidon ohella, kun potilaalla on sepsis, granulomatoottinen reaktio (esim. keuhko tai maksa) tai muu immuunivälitteinen reaktio.
Hoitosuositukset, ks. alla oleva taulukko.
| Oireiden, merkkien ja oireyhtymien hoito | |
| Oireet, merkit tai oireyhtymä | Hoito |
| 1) Alle 48 tuntia kestävät rakkoärsytysoireet | Oireenmukainen hoito |
| 2) 48 tuntia tai sitä pidempään kestävä rakkoärsytysoire | Keskeytä BCG‑medac-hoito ja aloita kinolonihoito. Mikäli oireet eivät ole hävinneet kokonaan kymmenessä päivässä, annostele isoniatsidia (INH)* kolmen kuukauden ajan. Mikäli tuberkuloosilääkettä joudutaan antamaan, BCG‑medac-hoito on ehdottomasti lopetettava. |
| 3) Samanaikainen virtsateiden bakteeriperäinen infektio | Keskeytä BCG‑medac-hoito, kunnes virtsakoe on normalisoitunut ja antibioottihoito on loppunut. |
| 4) Muut urogenitaaliset haittavaikutukset: oireileva granulomatoottinen prostatiitti, epididymiitti ja orkiitti, virtsatien ahtauma ja munuaisabsessi | Keskeytä BCG‑medac-hoito. Annostele isoniatsidia (INH)* ja rifampisiinia* 3–6 kuukauden ajan vaikeusasteesta riippuen. Mikäli tuberkuloosilääkettä joudutaan antamaan, BCG‑medac-hoito on ehdottomasti lopetettava. |
| 5) Alle 48 tuntia kestävä alle 38,5 °C kuume | Oireenmukainen hoito parasetamolilla. |
| 6) Iho-oireet, artralgia tai artriitti tai Reiterin oireyhtymä | Keskeytä BCG‑medac-hoito. Harkitse infektiotautien erikoislääkärin konsultoimista. Annostele antihistamiineja tai tulehduskipulääkkeitä (NSAID). Kortisonihoitoa tulee harkita, mikäli potilaalla on immuunivälitteinen reaktio. Mikäli vastetta ei saada, annostele isoniatsidia* 3 kuukauden ajan. Mikäli tuberkuloosilääkettä joudutaan antamaan, BCG‑medac-hoito on ehdottomasti lopetettava. |
| 7) Systeeminen BCG-reaktio/infektio** ilman septisen sokin merkkejä | BCG‑medac-hoito on ehdottomasti lopetettava. Harkitse infektiolääkärin konsultointia. Anna kolmoistuberkuloosilääkitys* 6 kuukauden ajan ja pieniannoksista kortikosteroidihoitoa. |
| 8) Systeeminen BCG-reaktio/infektio, johon liittyy septisen sokin merkkejä | BCG‑medac-hoito on ehdottomasti lopetettava. Anna välittömästi kolmoistuberkuloosilääkitys* yhdistettynä suureen annokseen nopeavaikutteista kortikosteroidia. Kysy infektiolääkärin mielipidettä. |
* Varoitus: BCG-bakteerit ovat herkkiä kaikille nykykäytössä oleville tuberkuloosin hoidossa käytettäville lääkevalmisteille lukuunottamatta pyratsinamidia. Jos kolmoistuberkuloosilääkitys on välttämätön, yleensä suositellaan isoniatsidin (INH), rifampisiinin ja etambutolin yhdistelmää.
** Määritelmä kuvataan yllä
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Yliannostus on epätodennäköinen koska yksi lääkepullo BCG‑medac-valmistetta vastaa yhtä annosta.
Ei ole tietoa siitä aiheuttaako yliannostus edellä kuvattujen haittavaikutusten lisäksi muita oireita.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunostimulantit, muut immunostimulantit, ATC‑koodi: L03AX03
BCG‑medac on Mycobacterium bovisin RIVM‑kannasta johdetuista elävistä alhaisen taudinaiheutuskyvyn omaavista Bacillus Calmette-Guerin-bakteereista valmistettu kylmäkuivattu suspensio.
Vaikutusmekanismi
BCG‑medac stimuloi immuunijärjestelmää ja sillä on antituumorivaikutus.
Tutkimukset osoittavat, että yhden mekanismin sijasta BCG vaikuttaa immuunijärjestelmään ei-spesifisesti vaikuttamalla monin tavoin immuunijärjestelmän soluihin. BCG vaikuttaa stimuloivasti pernaan, lisää makrofagien toimintaa pernassa ja aktivoi luonnollisia tappajasoluja. BCG-instillaatio stimuloi granulosyyttien, monosyyttien/makrofaagien ja T‑lymfosyyttien lisääntymistä, mikä on osoitus immuunijärjestelmän paikallisesta aktivoitumisesta. Myös sytokiinit IL1, IL2, IL6 ja TNF-α lisääntyvät.
Farmakokinetiikka
Suurin osa basilleista erittyy virtsaan ensimmäisten tuntien aikana rakkoinstillaation jälkeen. Toistaiseksi ei tiedetä pystyvätkö mykobakteerit läpäisemään terveen uroteeliseinämän. Yksittäisiä tapauksia on raportoitu, joissa BCG-bakteereja pysyi virtsaputkessa yli 16 kuukauden ajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
BCG:n RIVM‑kannan toksisuutta, immunostimuloivia ominaisuuksia ja antituumorivaikutusta on testattu lukuisilla eläimillä. Suuret BCG-annokset aiheuttivat painon kehityksen hidastumista hiirillä ja maksahäiriöitäkin on todettu. Suonensisäinen injektio näytti aiheuttavan kuumetta kaneilla. Toistuvat rakonsisäiset instillaatiot marsuilla aiheuttivat tulehdusreaktioita rakon seinämään. Haittavaikutuksina granulomatoottisia leesioita esiintyi suurilla annoksilla maksassa ja keuhkoissa. Koirilla rakonsisäinen annostus aiheutti minimaalisia mekaanisia leesioita uroteelissä, mutta mitään merkkejä akuutista tulehduksesta ei ole todettu suburoteelistroomassa.
Mutageenisyys-, karsinogeenisyys- ja lisääntymistutkimuksia ei ole tehty.
Farmaseuttiset tiedot
Apuaineet
Jauhe: polygeliini, vedetön glukoosi ja polysorbaatti 80.
Liuotin: natriumkloridi ja injektioihin käytettävä vesi.
Yhteensopimattomuudet
BCG‑medac on yhteensopimaton hypotonisten ja hypertonisten liuosten kanssa.
Kestoaika
2 tai 3 vuotta kun elävien bakteerien määrä vapauttamishetkellä on suurempi kuin 5 x 108 cfu/lääkepullo. Missään tapauksessa ei kuitenkaan yli 4 vuotta bakteerien keräämisestä.
Fysikaalisen ja kemiallisen käytönaikaisen säilyvyyden on osoitettu olevan 24 tuntia, kun valmistetta säilytetään valolta suojattuna huoneenlämmössä (20°C -25 °C) tai jääkaappilämpötilassa (2°C -8 °C). Mikrobiologiselta kannalta lääkevalmiste on käytettävä välittömästi.
Jos valmistetta ei käytetä välittömästi, käytönaikainen säilytysaika ja käyttöä edeltävät säilytysolosuhteet ovat käyttäjän vastuulla ja ovat normaalisti enintään 24 tuntia 2-°C -8 °C:n lämpötilassa, ellei tuotetta ole tehty käyttövalmiiksi kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BCG-MEDAC jauhe ja liuotin suspensiota varten, virtsarakkoon
3 kpl (814,41 €), 3 kpl (ei katetria) (814,41 €)
PF-selosteen tieto
Jauhe on kumitulpalla suljetussa lääkepullossa (I-tyypin lasi) + 50 ml liuotinta pussissa (edistyksellinen polypropeeni), jossa on lääkepullon liitin ja katetriliitin, mahdollinen katetri sekä Luer-Lock-liitin kartioliittimeen.
Pakkauskoot:
- 1, 3, 5 tai 6 lääkepullo(a), liuotinpussi(a), Luer-Lock-liitin(tä) kartioliittimeen ja mahdollinen/mahdollista katetri(a).
- 1 tai 3 lääkepullo(a), liuotinpussi(a) ja mahdollinen/mahdollista katetri(a).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Jauhe:
Valkoinen tai lähes valkoinen jauhe tai huokoinen jauhekakku, jossa on kellertävä ja harmahtava värisävy
Liuotin:
Väritön, kirkas liuos
Käyttö- ja käsittelyohjeet
Tärkeitä tietoja BCG-medac-valmisteen käytöstä
BCG-medac-valmistetta saavat käyttää vain kokeneet terveydenhuollon ammattilaiset. Varmista pakkauksen sopiva säilytys (ks. kohta Säilytys) ja eheys.
BCG-medac-valmistetta on annosteltava virtsarakonsisäisen endoskopian edellyttämissä olosuhteissa.
BCG-medac-valmistetta ei saa antaa ihon alle, intradermaalisesti, lihakseen, laskimoon tai tuberkuloosirokotuksena.
Liuotinpussin Luer-Lock-liitintä kartioliittimeen saa käyttää vain virtsarakonsisäiseen instillaatioon!
BCG-medac-valmisteen käytön perusperiaatteet ja suojatoimenpiteet
Yleensä suoraa kosketusta BCG-medac-valmisteeseen on vältettävä. BCG-medac on lääkevalmiste, joka voi aiheuttaa infektion ihmiselle ja riskin terveydenhuollon ammattilaisille. Vaara voi ilmetä, jos lääkevalmistetta pääsee kehoon vahingoittuneen ihon kautta, aerosoleja hengitetään, pisaroita joutuu silmiin tai limakalvoille tai valmistetta niellään. Älä syö, juo tai tupakoi työalueilla äläkä säilytä ruokaa, juomia tai tupakkatuotteita näillä alueilla. BCG-medac-valmistetta ei saa käsitellä huoneessa, jossa sytotoksisia lääkevalmisteita valmistellaan laskimonsisäiseen käyttöön, eivätkä sitä saa käsitellä henkilöt, jotka valmistelevat sytotoksisia lääkevalmisteita laskimonsisäiseen käyttöön.
Lääkevalmistetta eivät saa käsitellä henkilöt, joilla on tunnettu immuunivajavuus.
Suljettua, roiskeenkestävää suojaviittaa, kertakäyttökäsineitä, FFP2-hengityssuojainta ja sivusuojilla varustettuja suojalaseja suositellaan käytettävän henkilönsuojaimina käsittelyn aikana.
BCG-medac-valmistetta saa kuljettaa vain suljetuissa säiliöissä (ks. kohdasta Kestoaika säilytysolosuhteet käyttövalmiiksi saattamisen jälkeen).
Kun työ on valmis, pyyhi työpinnat sopivalla desinfiointiaineella. Kun olet lopettanut työn ja jos valmiste on ollut kosketuksessa ihoon, desinfioi kädet käsihuuhteella, anna niiden kuivua, pese ne ja käytä ihonhoitotuotteita.
Tuberkuliini-ihotesti
Virtsarakonsisäinen BCG-medac-hoito saattaa herkistää tuberkuliinille ja vaikeuttaa mykobakteeridiagnoosia varten tehtävän tuberkuliini-ihotestin tulkitsemista. Siitä syystä on aiheellista tehdä tuberkuliini-ihotesti ennen BCG-medac-annostelua.
Käyttövalmiiksi saatetun rakonsisäisen suspension valmistelu
Ennen käyttöä lääkevalmiste on suspendoitava uudelleen aseptisissa olosuhteissa käyttäen steriiliä 0,9 %:n (9 mg/ml) natriumkloridiliuosta (ks. käyttöohjeet kohdasta 7). Katetri on asetettava erityisellä huolella, jotta vältetään virtsaputken ja virtsarakon epiteelin vammat, jotka voivat johtaa systeemiseen BCG-infektioon. Voiteluaineen käyttöä suositellaan, jotta traumaattisen katetroinnin riski minimoidaan ja toimenpiteestä tehdään mahdollisimman mukava. Naiset tarvitsevat ehkä vähemmän voiteluainetta kuin miehet. Voiteluaineen mahdollisen antiseptisen tehon ei ole havaittu vaikuttavan valmisteen tehokkuuteen. Tyhjennä rakko katetroinnin jälkeen, jotta vähennät järjestelmään mahdollisesti kulkeutuvan voiteluaineen määrää ennen BCG-medac-valmisteen antamista. Suspensio sekoitetaan pyörittämällä sitä kevyesti ennen käyttöä. Makroskooppisesti näkyvillä hiukkasilla ei ole vaikutusta lääkevalmisteen tehokkuuteen ja turvallisuuteen.
Lääkepullon sisältö on tarkoitettu kertakäyttöön/yksittäisen annoksen antamiseen. Mahdollinen jäljelle jäävä suspensio on hävitettävä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Toiminta hätätapauksissa ja BCG-medac-valmisteen läikkyessä
Käytä suojavaatteita ja vältä nostattamasta pölyä.
Peitä läikkynyt BCG-medac-suspensio selluloosalla ja kostuta se desinfiointiaineella, joka on todettu tehokkaaksi mykobakteereja vastaan. Kun olet pyyhkinyt läikkyneen BCG-medac-suspension, puhdista pinta uudelleen desinfiointiaineella ja anna sen kuivua. Iholle läikkynyt valmiste on poistettava sopivalla desinfiointiaineella.
Ensiapu
Ota aina yhteyttä lääkäriin saastumistapauksissa.
Jos valmistetta joutuu iholle, riisu saastunut vaatetus. Desinfioi ja puhdista iho ja tarkista se haavojen saastumisen varalta.
Jos valmistetta joutuu silmiin, huuhtele kyseinen silmä riittävällä määrällä silmähuuhdetta tai vaihtoehtoisesti vedellä. Poista mahdolliset piilolinssit.
Jos valmistetta on nielty, huuhtele suu runsaalla määrällä vettä.
Jos valmistetta on hengitetty, varmista riittävä raitis ilma.
Lisätietoja katetrista on vastaavissa käyttöohjeissa.
Ohjeet BCG-medac-valmisteen käyttäjille
Instillaatiosarjan osat ja käyttö, <kun sarjassa on katetri mutta ei Luer-Lock-liitintä kartioliittimeen>
Instillaatiosarjan pääosat
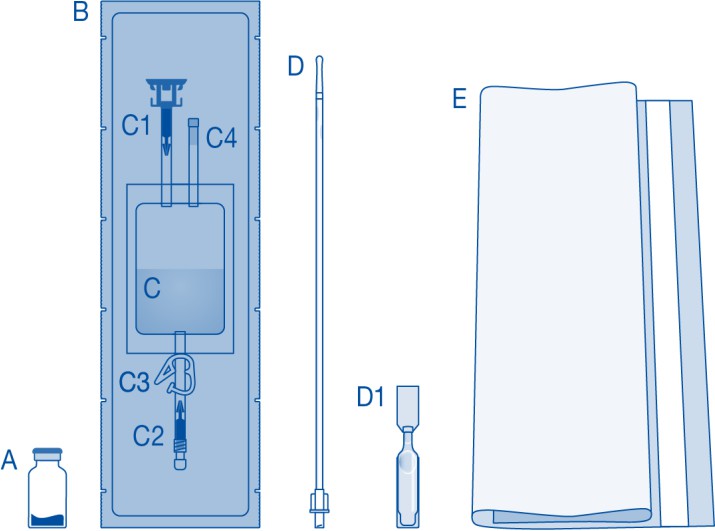
| Pääosa | Kuvaus |
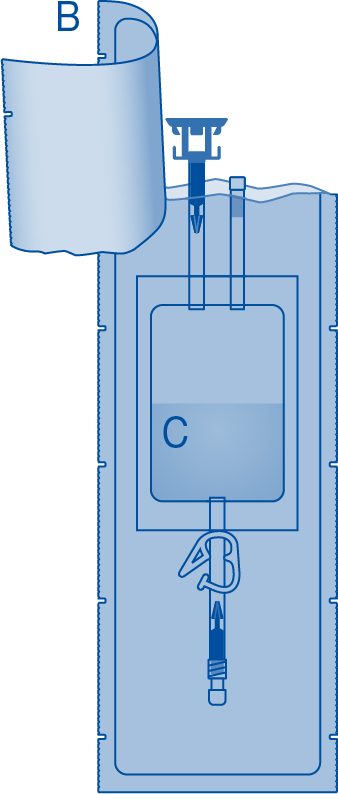
| A | Lääkepullo, jossa jauhetta |
| B | Suojus |
| C | Liuotinpussi, jossa 0,9 %:n (9 mg/ml) natriumkloridiliuosta |
| C1 | Lääkepullon liitin, jossa suojakorkki ja auki murrettava sinetti |
| C2 | Luer-Lock-katetriliitin, jossa suojakorkki ja auki murrettava sinetti |
| C3 | Painepuristin |
| C4 | Täyttöportti ilman applikointitoimintoa |
| D | Luer-Lock-katetri |
| D1 | Voiteluaine |
| E | Jätepussi |
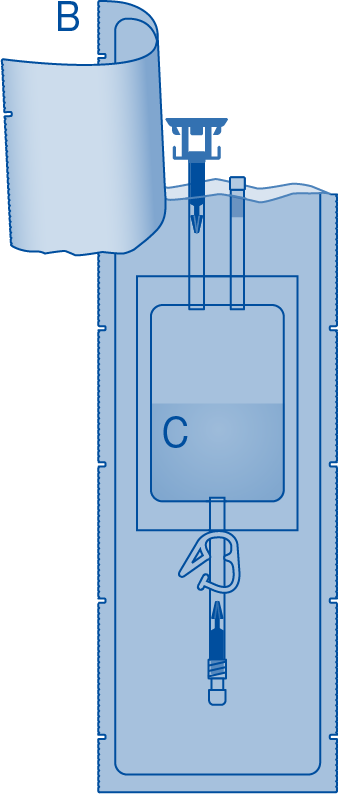
Lääkepullon liittäminen liuotinpussiin
- Aseta jätepussi (E) valmiiksi sarjan hävittämiseksi heti instillaation jälkeen, jotta estetään saastuminen.
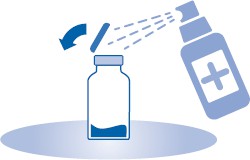
2. Poista repäistävä korkki lääkepullosta (A) ja desinfioi tulppa paikallisten säädösten mukaisesti.
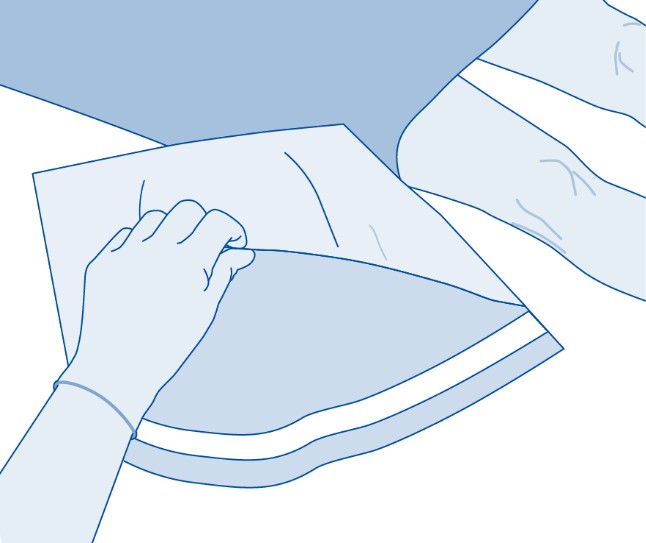
3. Repäise liuotinpussin (C) suojus (B) ja poista suojus kokonaan.
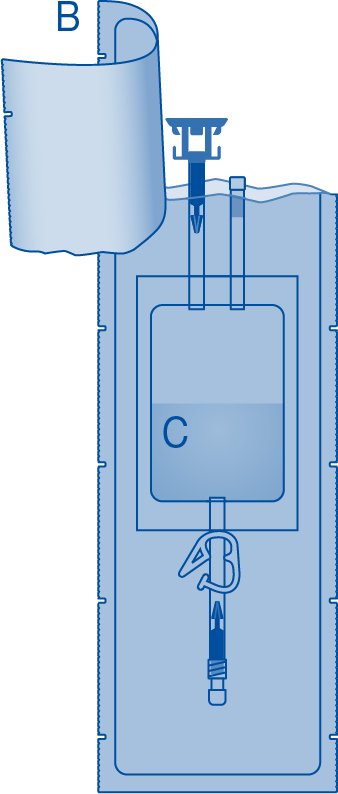
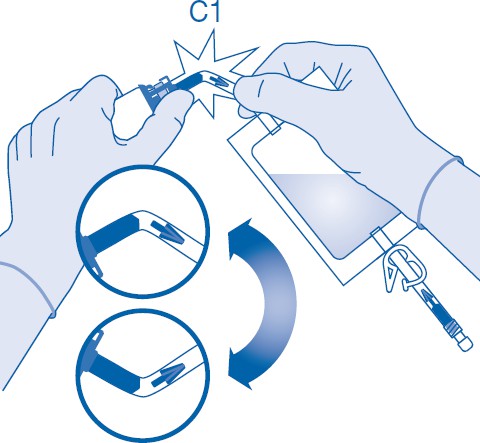
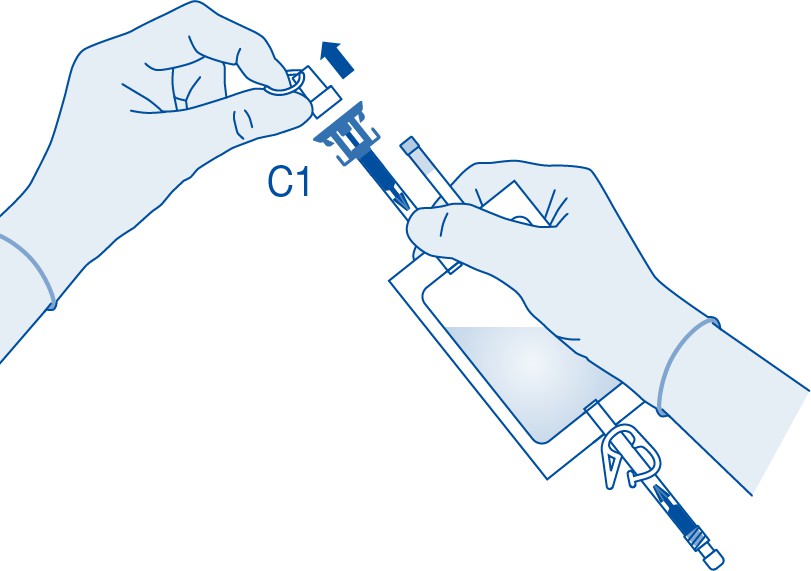
4. Poista suojus lääkepullon liittimestä (C1).
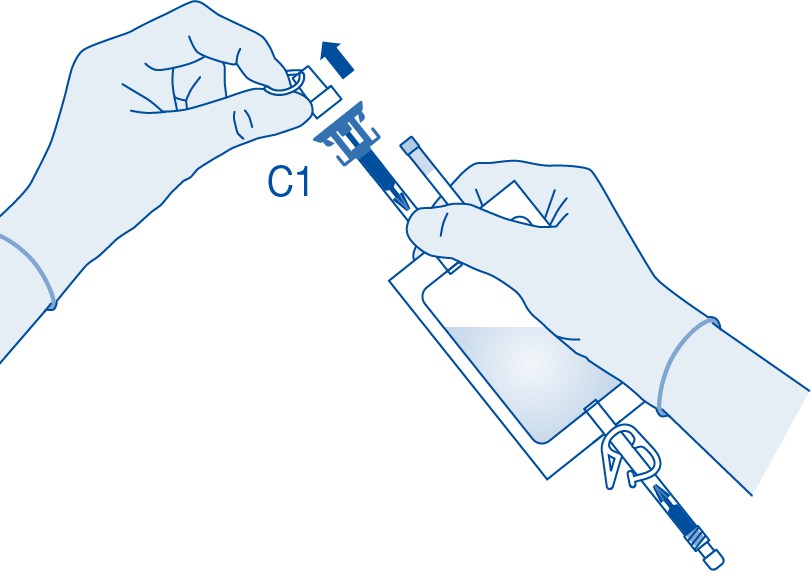
5. Paina liitin lääkepulloon pysäyttimeen saakka.
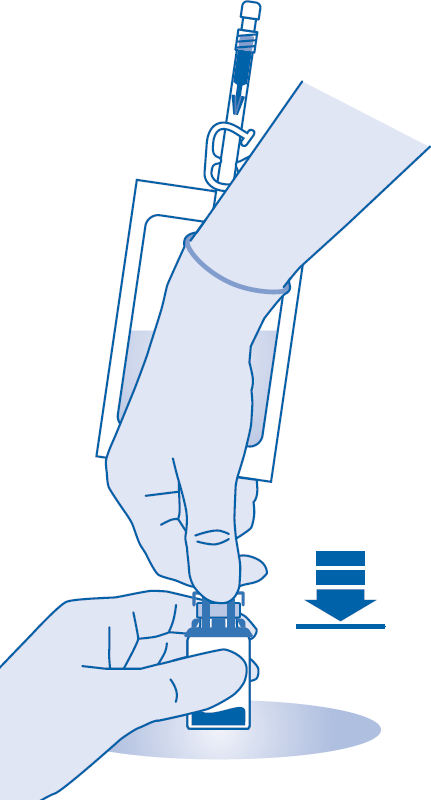
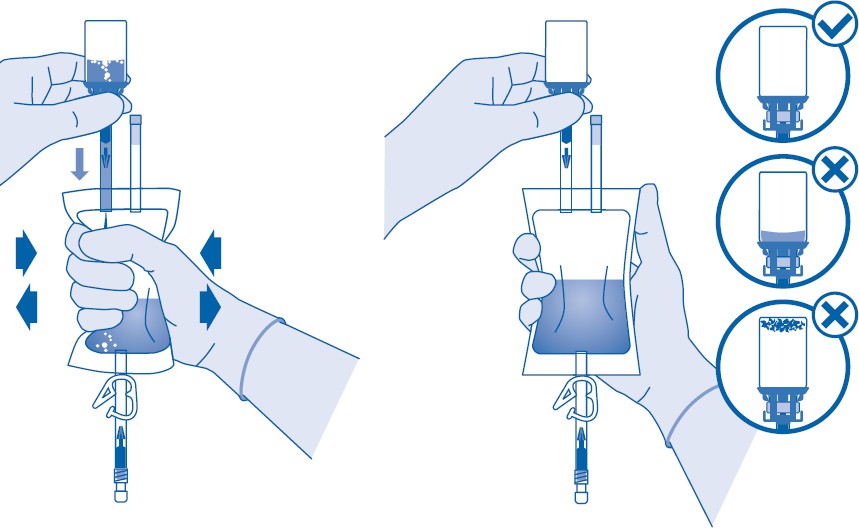
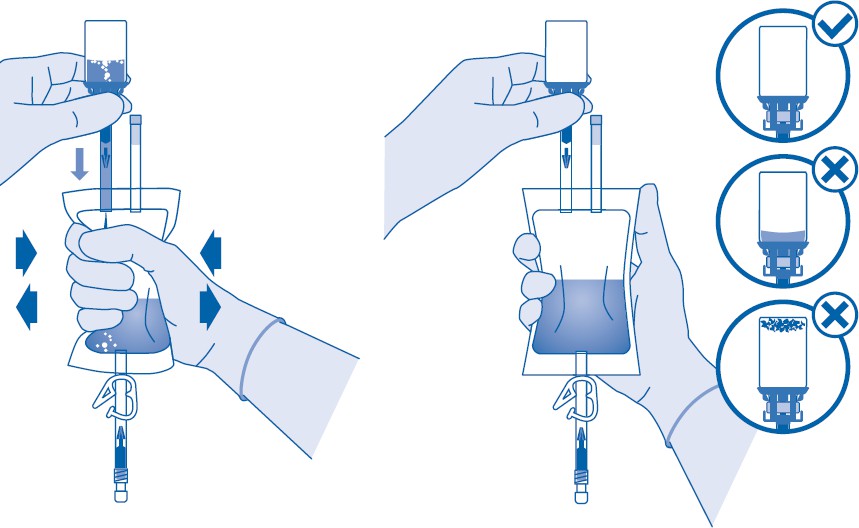
Jauheen sekoittaminen liuottimeen
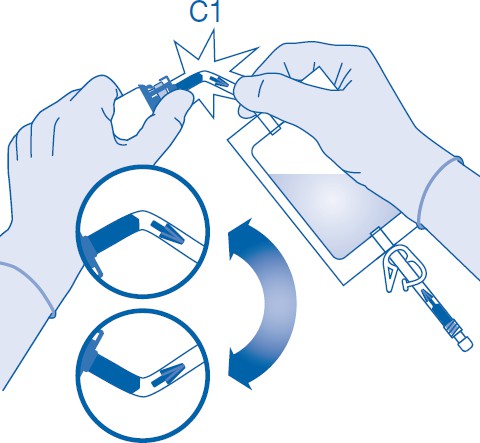
6. Murra auki murrettava sinetti taivuttamalla sitä lääkepullon liittimen (C1) putken sisällä ylös ja alas useita kertoja.
7. Pidä liuotinpussia niin, että lääkepullo on sen alapuolella.
Purista liuotinpussia useita kertoja, jotta siirrät riittävästi liuotinta lääkepulloon.
Varmista, että lääkepullo ei täyty kokonaan, jotta suspension voi sen jälkeen siirtää liuotinpussiin. Hieman liuotinta saattaa jäädä pussiin.
Pyöritä lääkepulloa hitaasti voimakkaan vaahtoamisen minimoimiseksi sekoittaessasi lääkevalmistetta liuottimeen. Jos vaahtoa on paljon, anna lääkepullon olla hetki paikallaan (muutama minuutti).
Lääkepullon sisällön on muodostettava homogeeninen suspensio. Tämä voi kestää muutamia minuutteja.
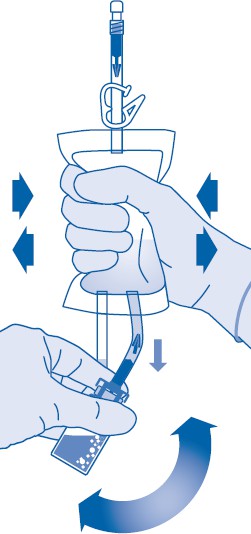
8. Käännä liuotinpussi ylösalaisin ja pidä sitä niin, että lääkepullo on sen yläpuolella.
Pidä lääkepullosta kiinni.
Purista liuotinpussia useita kertoja, kunnes lääkepullo on kokonaan tyhjä.
Jos lääkepulloon jää jauhetta, toista vaiheet 7 ja 8.
Mikrobiologiselta kannalta lääkevalmiste on käytettävä välittömästi. Jos lääkevalmistetta ei käytetä välittömästi, katso kohta Kestoaika ”Kestoaika”.
Suspensiota ei saa instilloida jääkaappilämpötilassa, jotta estetään potilaan virtsaamistarve, joka johtaisi lyhennettyyn altistusaikaan.
Katetrointi
9. Katetroi potilas paikallisten säädösten sekä mukana olevan Luer-Lock-katetrin (D) ja voiteluaineen (D1) tai muun sopivan katetrin ja/tai voiteluaineen käyttöohjeiden mukaisesti.
Tyhjennä virtsarakko katetrilla.
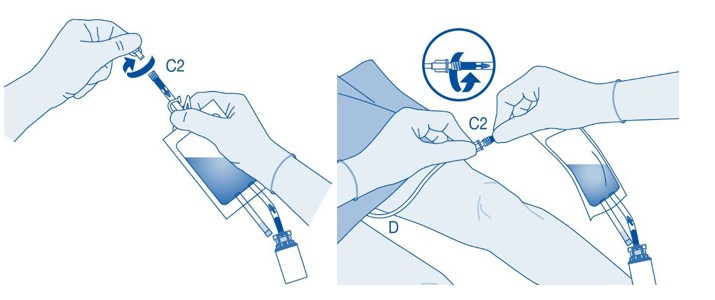
Katetrin liittäminen liuotinpussiin
10. Sekoita mahdollinen sakka kääntämällä ja pyörittämällä pussia ennen sen liittämistä.
Älä anna suspensiota jääkaappilämpötilassa. Poista suojakorkki katetrin liittimestä (C2).
Liitä potilaan Luer-Lock-katetri (D) liuotinpussin katetriliittimeen (C2).
Instillaatio
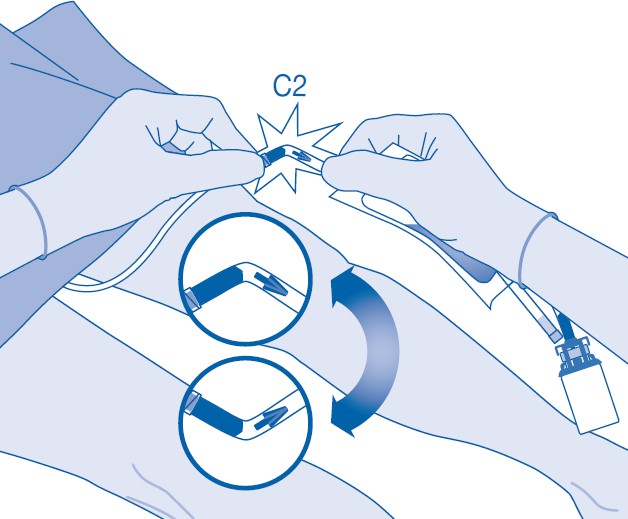
11. Murra auki murrettava sinetti taivuttamalla sitä katetriliittimen (C2) putken sisällä ylös ja alas useita kertoja.
Pidä samalla potilaan katetria vakaasti paikallaan.
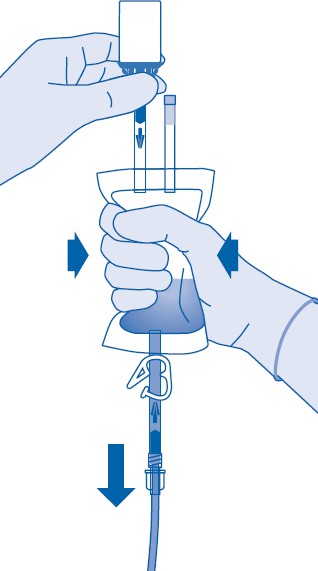
12. Pidä liuotinpussia niin, että lääkepullo on ylösalaisin pussin yläpuolella.
Purista liuotinpussia kevyesti toisella kädellä niin, että lääkevalmiste instilloituu hitaasti potilaan virtsarakkoon.
Jatka puristamista, kunnes liuotinpussi ja lääkepullo ovat tyhjät.
13. Purista jäljellä oleva ilma liuotinpussista, jotta saat katetrin mahdollisimman tyhjäksi.
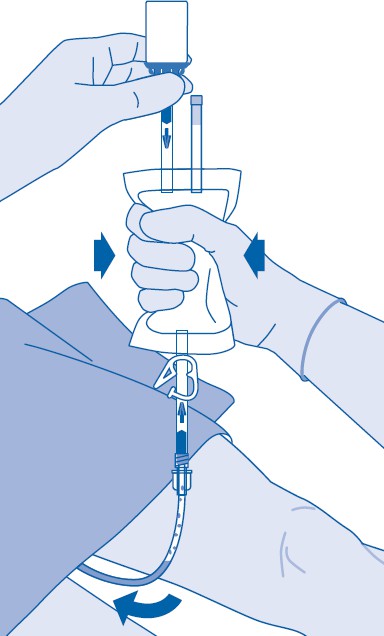
Instillaation jälkeen
14. Painepuristimen (C3) sulkeminen estää nesteen takaisinvirtauksen katetriin ja minimoi saastumisen riskin. Vaihtoehtoisesti voit pitää liuotinpussin kompressoituna suorittaessasi vaiheet 15 ja 16.
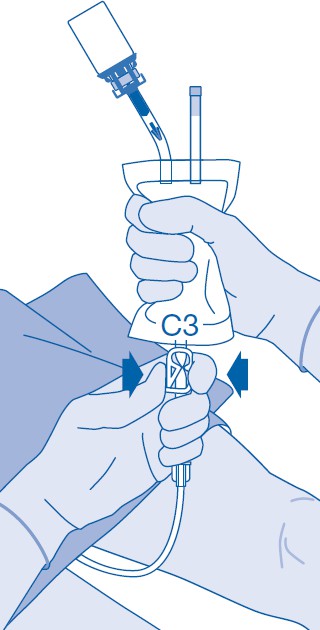
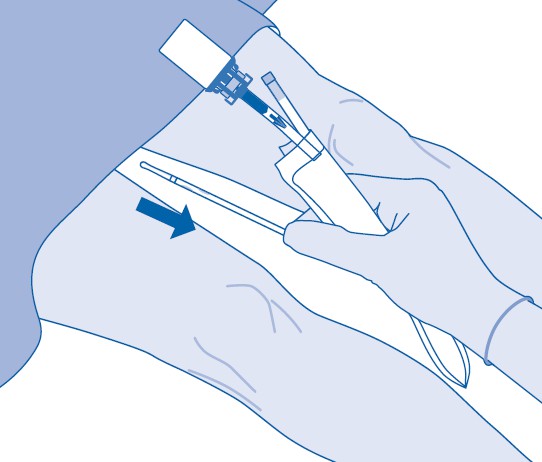
15. Poista katetri huolella rakosta irrottamatta liuotinpussia katetrista. Vältä roiskuvien pisaroiden aiheuttamaa saastumista.
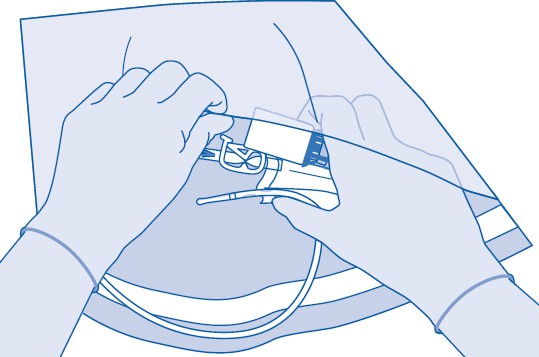
16. Hävitä valmiste kansallisten säädösten mukaisesti jätepussin avulla.
Lääkepullon sisältö on tarkoitettu kertakäyttöön / yksittäisen annoksen antamiseen. Mahdollinen jäljelle jäävä suspensio on hävitettävä.
Ohjeet BCG-medac-valmisteen käyttäjille
Instillaatiosarjan osat ja käyttö, <kun sarjassa on katetri ja Luer-Lock-liitin kartioliittimeen>
Instillaatiosarjan pääosat
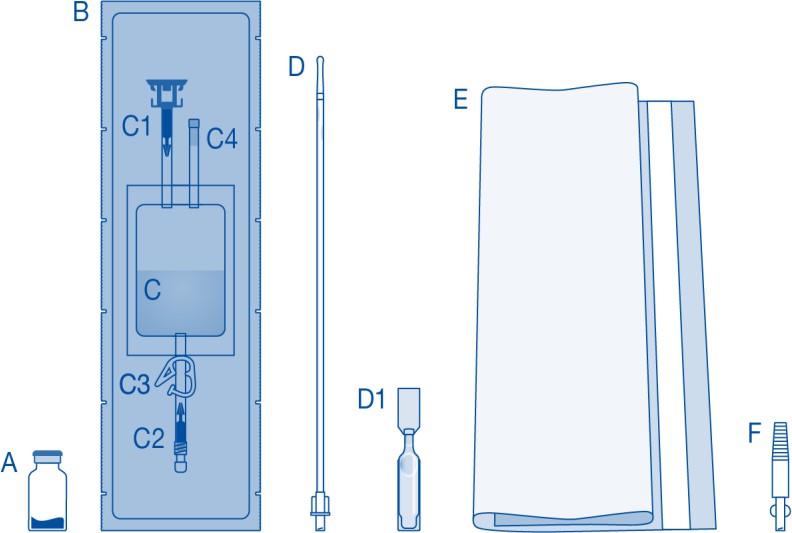
| Pääosa | Kuvaus |
| A | Lääkepullo, jossa jauhetta |
| B | Suojus |
| C | Liuotinpussi, jossa 0,9 %:n (9 mg/ml) natriumkloridiliuosta |
| C1 | Lääkepullon liitin, jossa suojakorkki ja auki murrettava sinetti |
| C2 | Luer-Lock-katetriliitin, jossa suojakorkki ja auki murrettava sinetti |
| C3 | Painepuristin |
| C4 | Täyttöportti ilman applikointitoimintoa |
| D | Luer-Lock-katetri |
| D1 | Voiteluaine |
| E | Jätepussi |
| F | Luer-Lock-liitin kartioliittimeen |
Lääkepullon liittäminen liuotinpussiin
- Aseta jätepussi (E) valmiiksi sarjan hävittämiseksi heti instillaation jälkeen, jotta estetään saastuminen.
2. Poista repäistävä korkki lääkepullosta (A) ja desinfioi tulppa paikallisten säädösten mukaisesti.
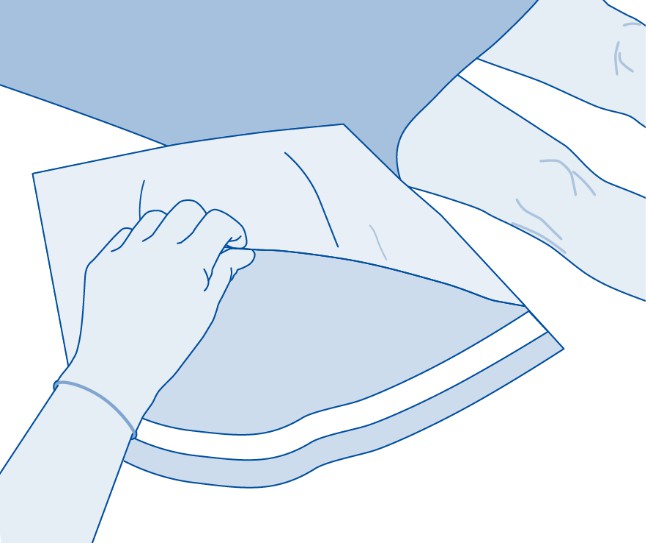
3. Repäise liuotinpussin (C) suojus (B) ja poista suojus kokonaan.
4. Poista suojus lääkepullon liittimestä (C1).
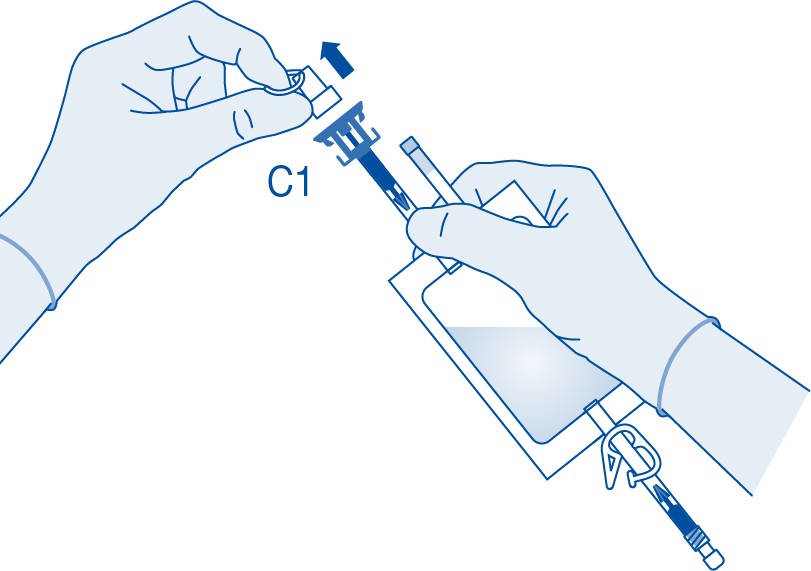
5. Paina liitin lääkepulloon pysäyttimeen saakka.
Jauheen sekoittaminen liuottimeen
6. Murra auki murrettava sinetti taivuttamalla sitä lääkepullon liittimen (C1) putken sisällä ylös ja alas useita kertoja.
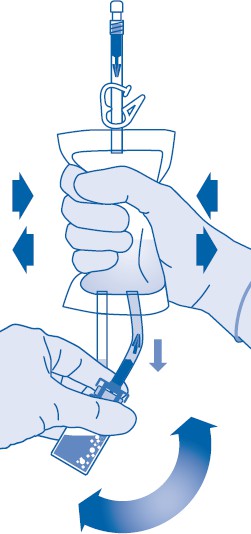
7. Pidä liuotinpussia niin, että lääkepullo on sen alapuolella.
Purista liuotinpussia useita kertoja, jotta siirrät riittävästi liuotinta lääkepulloon.
Varmista, että lääkepullo ei täyty kokonaan, jotta suspension voi sen jälkeen siirtää liuotinpussiin. Hieman liuotinta saattaa jäädä pussiin.
Pyöritä lääkepulloa hitaasti voimakkaan vaahtoamisen minimoimiseksi sekoittaessasi lääkevalmistetta liuottimeen. Jos vaahtoa on paljon, anna lääkepullon olla hetki paikallaan (muutama minuutti).
Lääkepullon sisällön on muodostettava homogeeninen suspensio. Tämä voi kestää muutamia minuutteja.
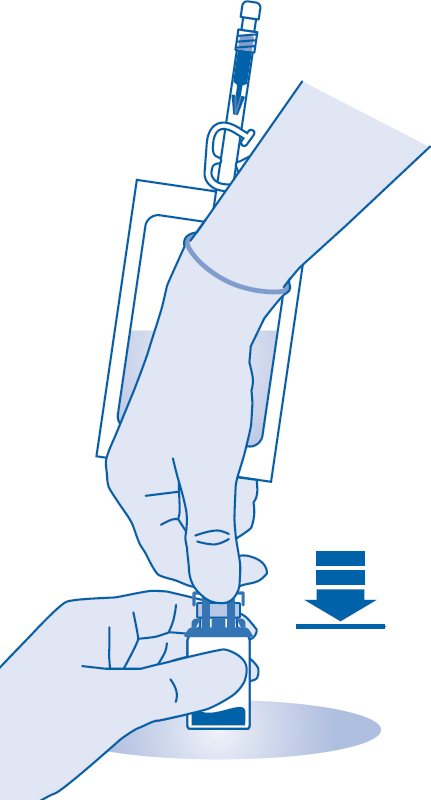
8. Käännä liuotinpussi ylösalaisin ja pidä sitä niin, että lääkepullo on sen yläpuolella.
Pidä lääkepullosta kiinni.
Purista liuotinpussia useita kertoja, kunnes lääkepullo on kokonaan tyhjä.
Jos lääkepulloon jää jauhetta, toista vaiheet 7 ja 8.
Mikrobiologiselta kannalta lääkevalmiste on käytettävä välittömästi.
Jos lääkevalmistetta ei käytetä välittömästi, katso kohta Kestoaika ”Kestoaika”.
Suspensiota ei saa instilloida jääkaappilämpötilassa, jotta estetään potilaan virtsaamistarve, joka johtaisi lyhennettyyn altistusaikaan.
Katetrointi
9. Katetroi potilas paikallisten säädösten sekä mukana olevan Luer-Lock-katetrin (D) ja voiteluaineen (D1) tai muun sopivan katetrin ja/tai voiteluaineen käyttöohjeiden mukaisesti.
Tyhjennä virtsarakko katetrilla.
Huomautus itse valitun katetrin käytöstä kartioliittimen kanssa:
Mukana olevaa Luer-Lock-liitintä kartioliittimeen (F) on käytettävä pussin liittämiseen itse valittuun katetriin (ei kuvassa).
Tätä varten on suoritettava seuraavat lisävaiheet:
- Poista suojakorkki katetriliittimestä (C2, ks. vaihe 10).
- Käännä ja pyöritä pussia ennen sen liittämistä, jotta mahdollinen sakka sekoittuu.
- Liitä Luer-Lock-liitin kartioliittimeen (F) pussin katetriliittimeen (C2).
- Liitä pussi huolellisesti liittimellä (F) potilaan katetriin.
-
Jatka sitten vaiheesta 11.
Katetrin liittäminen liuotinpussiin
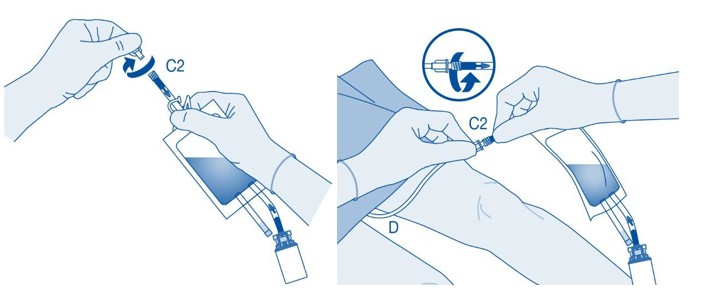
10. Sekoita mahdollinen sakka kääntämällä ja pyörittämällä pussia ennen sen liittämistä.
Älä anna suspensiota jääkaappilämpötilassa. Poista suojakorkki katetrin liittimestä (C2).
Liitä potilaan Luer-Lock-katetri (D) liuotinpussin katetriliittimeen (C2).
Instillaatio
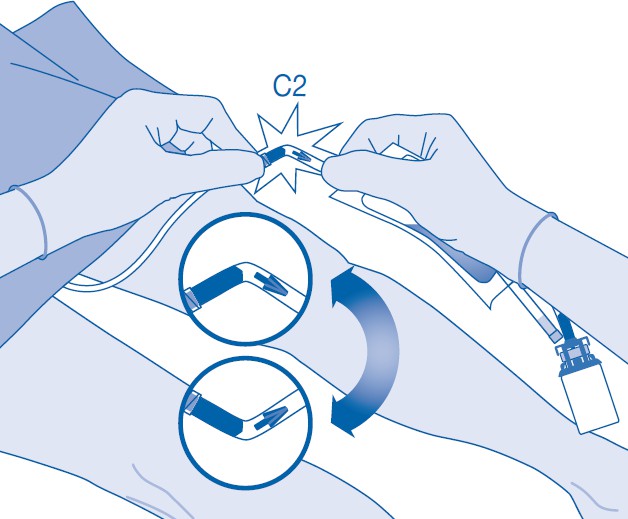
11. Murra auki murrettava sinetti taivuttamalla sitä katetriliittimen (C2) putken sisällä ylös ja alas useita kertoja.
Pidä samalla potilaan katetria vakaasti paikallaan.
12. Pidä liuotinpussia niin, että lääkepullo on ylösalaisin pussin yläpuolella.
Purista liuotinpussia kevyesti toisella kädellä niin, että lääkevalmiste instilloituu hitaasti potilaan virtsarakkoon.
Jatka puristamista, kunnes liuotinpussi ja lääkepullo ovat tyhjät.
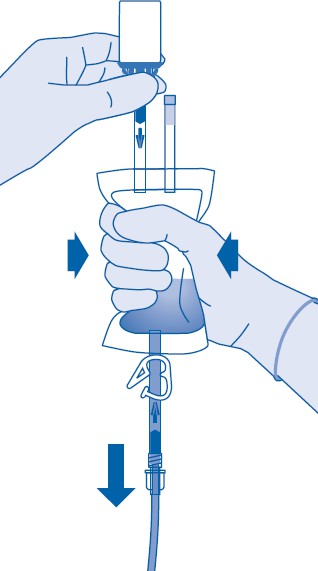
13. Purista jäljellä oleva ilma liuotinpussista, jotta saat katetrin mahdollisimman tyhjäksi.
Instillaation jälkeen
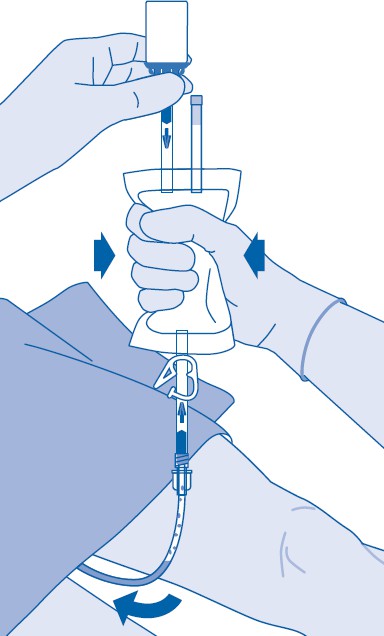
14. Painepuristimen (C3) sulkeminen estää nesteen takaisinvirtauksen katetriin ja minimoi saastumisen riskin. Vaihtoehtoisesti voit pitää liuotinpussin kompressoituna suorittaessasi vaiheet 15 ja 16.
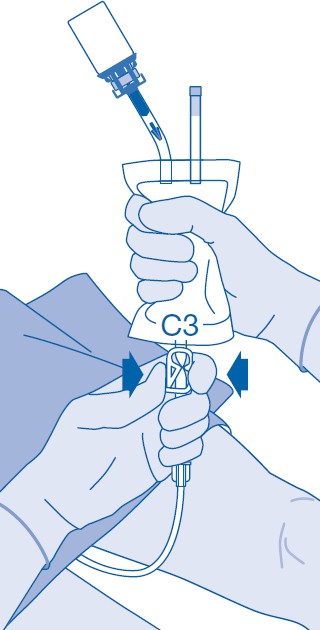
15. Poista katetri huolella rakosta irrottamatta liuotinpussia katetrista. Vältä roiskuvien pisaroiden aiheuttamaa saastumista.
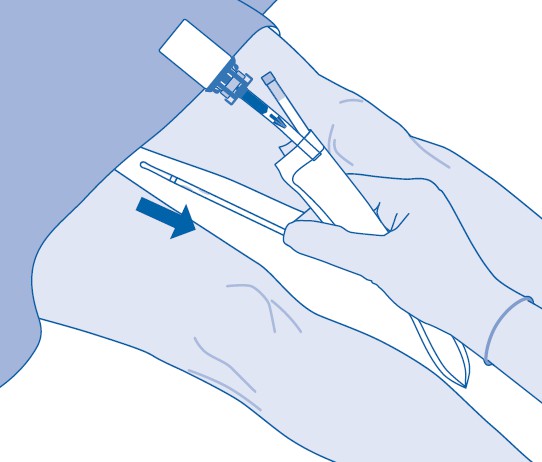
16. Hävitä valmiste kansallisten säädösten mukaisesti jätepussin avulla.
Lääkepullon sisältö on tarkoitettu kertakäyttöön/yksittäisen annoksen antamiseen. Mahdollinen jäljelle jäävä suspensio on hävitettävä.

Ohjeet BCG-medac-valmisteen käyttäjille
Instillaatiosarjan osat ja käyttö, <kun sarjassa ei ole katetria eikä Luer-Lock-liitintä kartioliittimeen>
Instillaatiosarjan pääosat
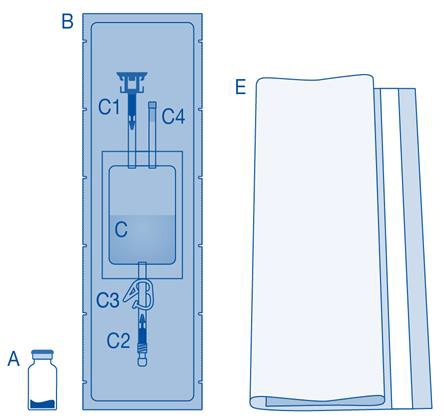
| Pääosa | Kuvaus |
| A | Lääkepullo, jossa jauhetta |
| B | Suojus |
| C | Liuotinpussi, jossa 0,9 %:n (9 mg/ml) natriumkloridiliuosta |
| C1 | Lääkepullon liitin, jossa suojakorkki ja auki murrettava sinetti |
| C2 | Luer-Lock-katetriliitin, jossa suojakorkki ja auki murrettava sinetti |
| C3 | Painepuristin |
| C4 | Täyttöportti ilman applikointitoimintoa |
| E | Jätepussi |
Lääkepullon liittäminen liuotinpussiin
- Aseta jätepussi (E) valmiiksi sarjan hävittämiseksi heti instillaation jälkeen, jotta estetään saastuminen.
2. Poista repäistävä korkki lääkepullosta (A) ja desinfioi tulppa paikallisten säädösten mukaisesti.
3. Repäise liuotinpussin (C) suojus (B) ja poista suojus kokonaan.
4. Poista suojus lääkepullon liittimestä (C1).
5. Paina liitin lääkepulloon pysäyttimeen saakka.
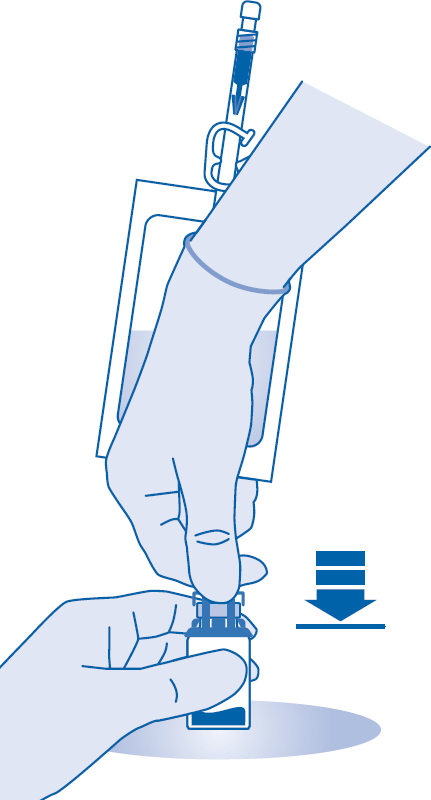
Jauheen sekoittaminen liuottimeen
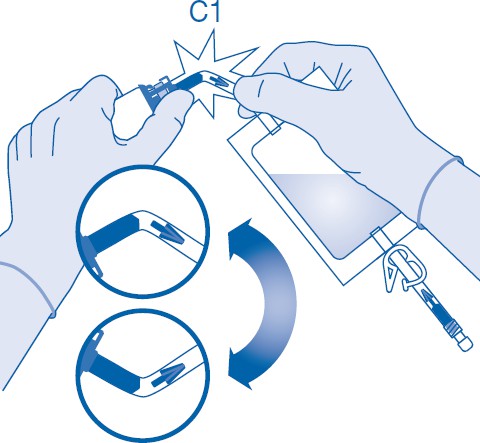
6. Murra auki murrettava sinetti taivuttamalla sitä lääkepullon liittimen (C1) putken sisällä ylös ja alas useita kertoja.
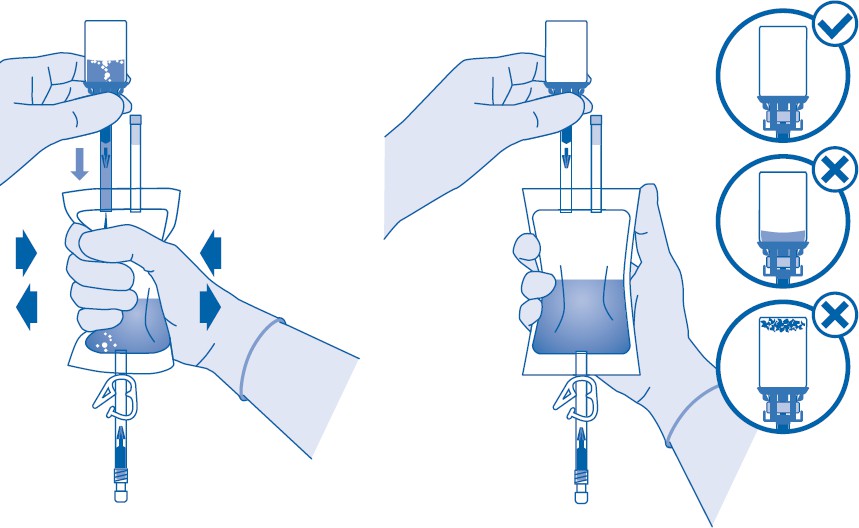
7. Pidä liuotinpussia niin, että lääkepullo on sen alapuolella.
Purista liuotinpussia useita kertoja, jotta siirrät riittävästi liuotinta lääkepulloon.
Varmista, että lääkepullo ei täyty kokonaan, jotta suspension voi sen jälkeen siirtää liuotinpussiin. Hieman liuotinta saattaa jäädä pussiin.
Pyöritä lääkepulloa hitaasti voimakkaan vaahtoamisen minimoimiseksi sekoittaessasi lääkevalmistetta liuottimeen. Jos vaahtoa on paljon, anna lääkepullon olla hetki paikallaan (muutama minuutti).
Lääkepullon sisällön on muodostettava homogeeninen suspensio. Tämä voi kestää muutamia minuutteja.

8. Käännä liuotinpussi ylösalaisin ja pidä sitä niin, että lääkepullo on sen yläpuolella.
Pidä lääkepullosta kiinni.
Purista liuotinpussia useita kertoja, kunnes lääkepullo on kokonaan tyhjä.
Jos lääkepulloon jää jauhetta, toista vaiheet 7 ja 8.
Mikrobiologiselta kannalta lääkevalmiste on käytettävä välittömästi.
Jos lääkevalmistetta ei käytetä välittömästi, katso kohta Kestoaika ”Kestoaika”.
Suspensiota ei saa instilloida jääkaappilämpötilassa, jotta estetään potilaan virtsaamistarve, joka johtaisi lyhennettyyn altistusaikaan.
Katetrointi
9. Katetroi potilas paikallisten säädösten sekä sopivan katetrin ja voiteluaineen käyttöohjeiden mukaisesti.
Tyhjennä virtsarakko katetrilla.
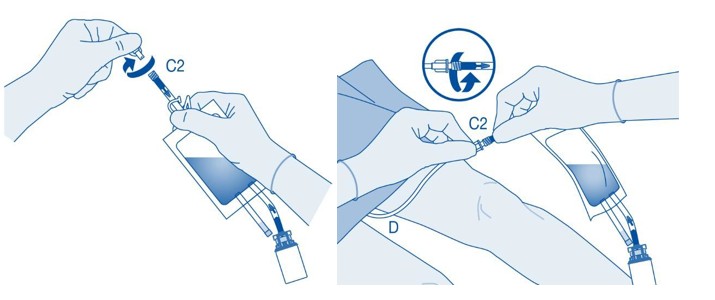
Katetrin liittäminen liuotinpussiin
10. Sekoita mahdollinen sakka kääntämällä ja pyörittämällä pussia ennen sen liittämistä.
Älä anna suspensiota jääkaappilämpötilassa. Poista suojakorkki katetrin liittimestä (C2).
Liitä potilaan katetri liuotinpussin katetriliittimeen (C2).
Instillaatio
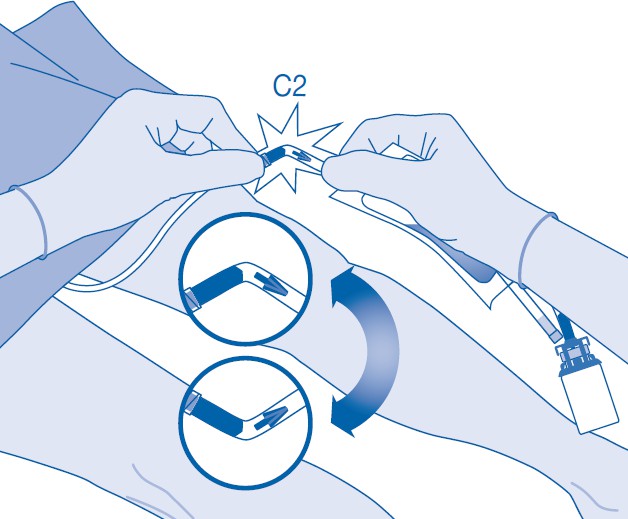
11. Murra auki murrettava sinetti taivuttamalla sitä katetriliittimen (C2) putken sisällä ylös ja alas useita kertoja.
Pidä samalla potilaan katetria vakaasti paikallaan.
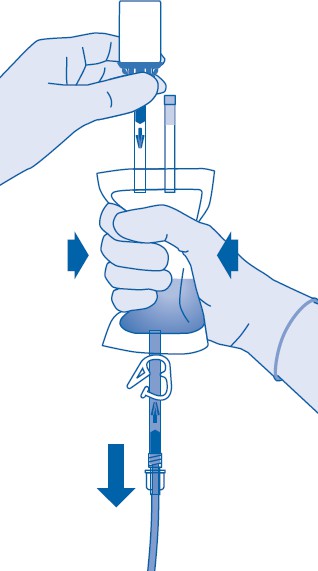
12. Pidä liuotinpussia niin, että lääkepullo on ylösalaisin pussin yläpuolella.
Purista liuotinpussia kevyesti toisella kädellä niin, että lääkevalmiste instilloituu hitaasti potilaan virtsarakkoon.
Jatka puristamista, kunnes liuotinpussi ja lääkepullo ovat tyhjät.
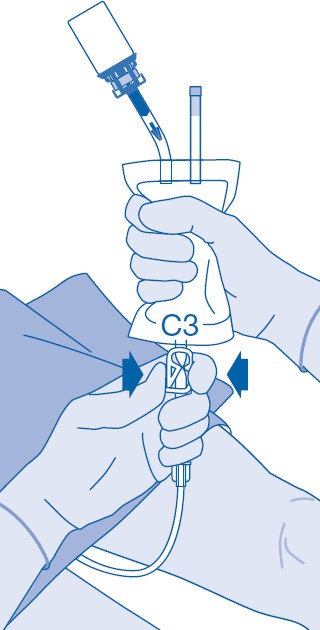
13. Purista jäljellä oleva ilma liuotinpussista, jotta saat katetrin mahdollisimman tyhjäksi.

Instillaation jälkeen
14. Painepuristimen (C3) sulkeminen estää nesteen takaisinvirtauksen katetriin ja minimoi saastumisen riskin. Vaihtoehtoisesti voit pitää liuotinpussin kompressoituna suorittaessasi vaiheet 15 ja 16.
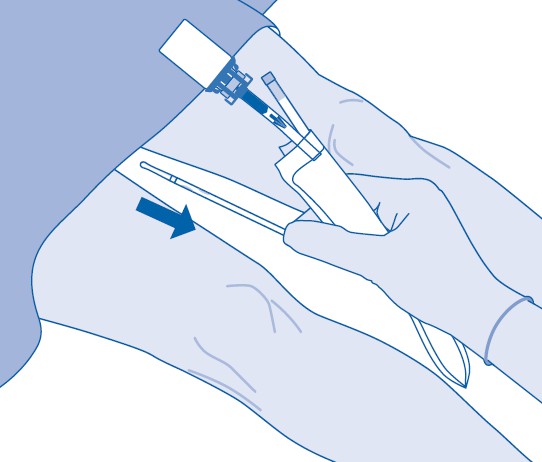
15. Poista katetri huolella rakosta irrottamatta liuotinpussia katetrista. Vältä roiskuvien pisaroiden aiheuttamaa saastumista.
16. Hävitä valmiste kansallisten säädösten mukaisesti jätepussin avulla.
Lääkepullon sisältö on tarkoitettu kertakäyttöön / yksittäisen annoksen antamiseen. Mahdollinen jäljelle jäävä suspensio on hävitettävä.
Ohjeet BCG-medac-valmisteen käyttäjille
Instillaatiosarjan osat ja käyttö, <kun sarjassa ei ole katetria mutta on Luer-Lock-liitin kartioliittimeen>
Instillaatiosarjan pääosat
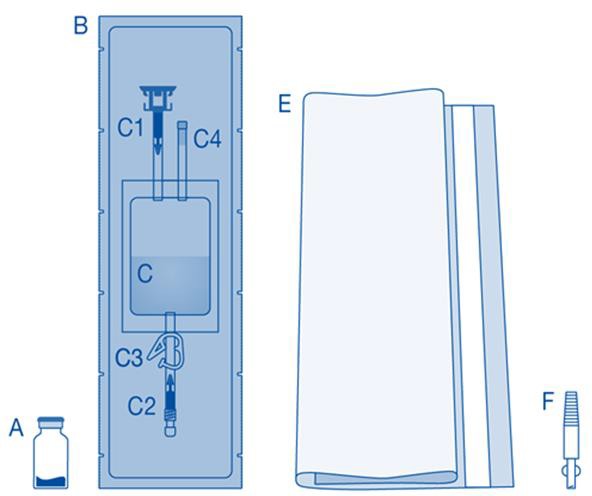
| Pääosa | Kuvaus |
| A | Lääkepullo, jossa jauhetta |
| B | Suojus |
| C | Liuotinpussi, jossa 0,9 %:n (9 mg/ml) natriumkloridiliuosta |
| C1 | Lääkepullon liitin, jossa suojakorkki ja auki murrettava sinetti |
| C2 | Luer-Lock-katetriliitin, jossa suojakorkki ja auki murrettava sinetti |
| C3 | Painepuristin |
| C4 | Täyttöportti ilman applikointitoimintoa |
| E | Jätepussi |
| F | Luer-Lock-liitin kartioliittimeen |
Lääkepullon liittäminen liuotinpussiin
- Aseta jätepussi (E) valmiiksi sarjan hävittämiseksi heti instillaation jälkeen, jotta estetään saastuminen.
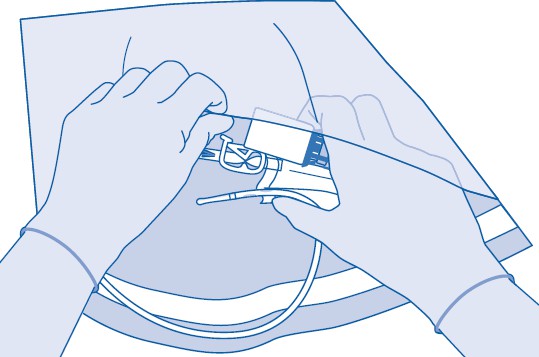
2. Poista repäistävä korkki lääkepullosta (A) ja desinfioi tulppa paikallisten säädösten mukaisesti.

3. Repäise liuotinpussin (C) suojus (B) ja poista suojus kokonaan.
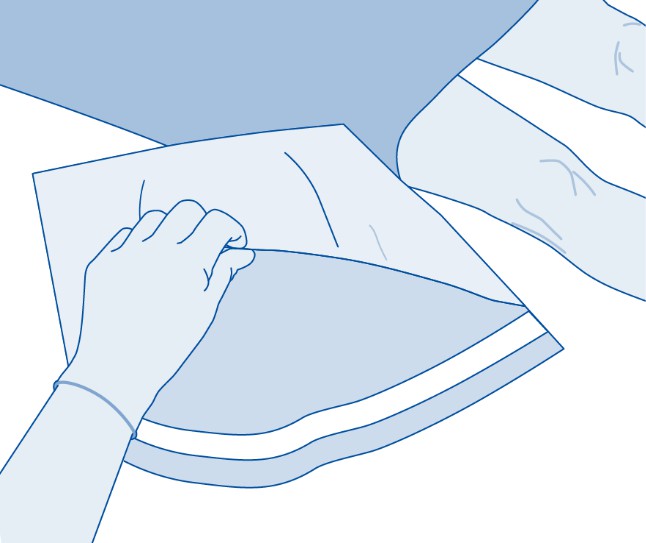
4. Poista suojus lääkepullon liittimestä (C1).
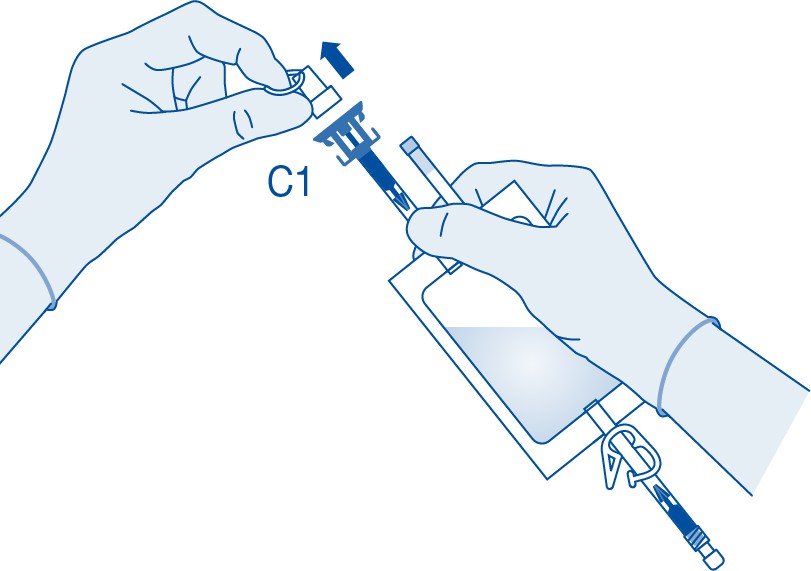
5. Paina liitin lääkepulloon pysäyttimeen saakka.
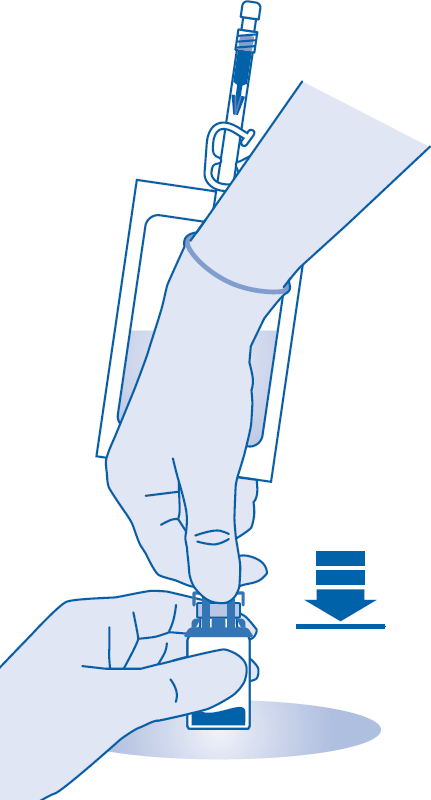
Jauheen sekoittaminen liuottimeen
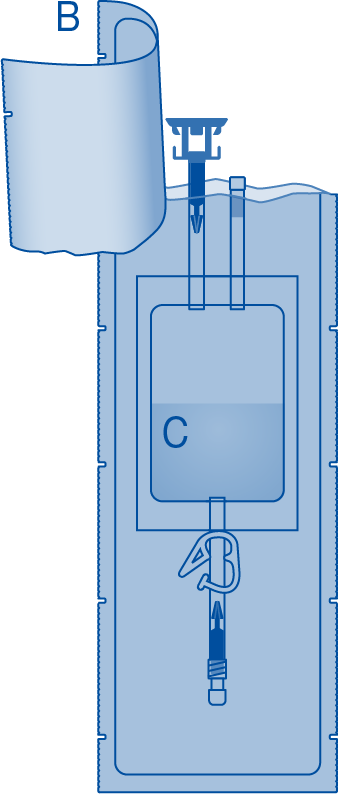
6. Murra auki murrettava sinetti taivuttamalla sitä lääkepullon liittimen (C1) putken sisällä ylös ja alas useita kertoja.

7. Pidä liuotinpussia niin, että lääkepullo on sen alapuolella.
Purista liuotinpussia useita kertoja, jotta siirrät riittävästi liuotinta lääkepulloon.
Varmista, että lääkepullo ei täyty kokonaan, jotta suspension voi sen jälkeen siirtää liuotinpussiin. Hieman liuotinta saattaa jäädä pussiin.
Pyöritä lääkepulloa hitaasti voimakkaan vaahtoamisen minimoimiseksi sekoittaessasi lääkevalmistetta liuottimeen. Jos vaahtoa on paljon, anna lääkepullon olla hetki paikallaan (muutama minuutti).
Lääkepullon sisällön on muodostettava homogeeninen suspensio. Tämä voi kestää muutamia minuutteja.
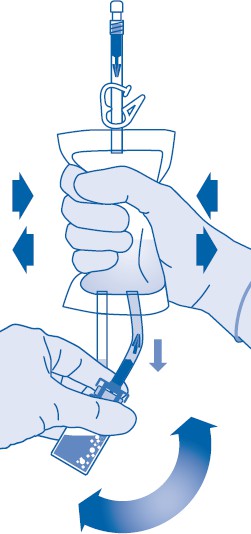
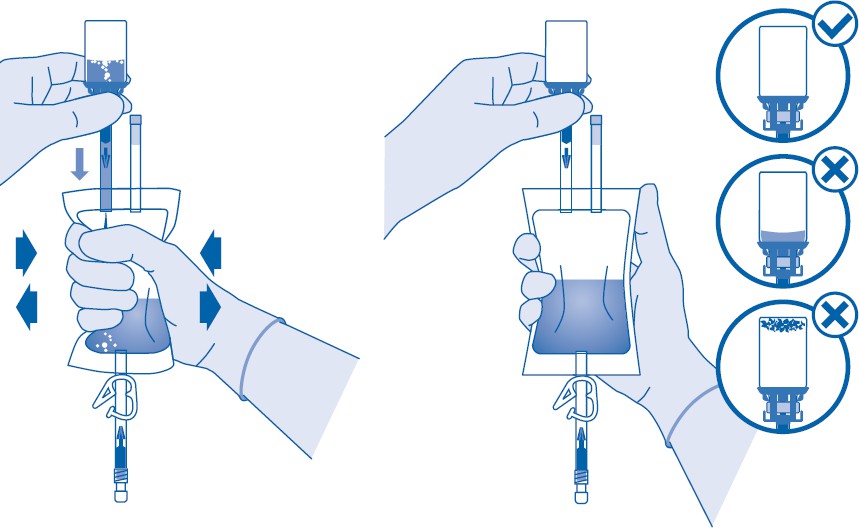
8. Käännä liuotinpussi ylösalaisin ja pidä sitä niin, että lääkepullo on sen yläpuolella.
Pidä lääkepullosta kiinni.
Purista liuotinpussia useita kertoja, kunnes lääkepullo on kokonaan tyhjä.
Jos lääkepulloon jää jauhetta, toista vaiheet 7 ja 8.
Mikrobiologiselta kannalta lääkevalmiste on käytettävä välittömästi.
Jos lääkevalmistetta ei käytetä välittömästi, katso kohta Kestoaika ”Kestoaika”.
Suspensiota ei saa instilloida jääkaappilämpötilassa, jotta estetään potilaan virtsaamistarve, joka johtaisi lyhennettyyn altistusaikaan.
Katetrointi
9. Katetroi potilas paikallisten säädösten sekä sopivan katetrin ja voiteluaineen käyttöohjeiden mukaisesti.
Tyhjennä virtsarakko katetrilla.
Tämä pakkaus ei sisällä katetria. Liitä pussi mukana olevalla liittimellä (F) potilaan katetriin, jossa on kartioliitin (ei kuvassa).
Tätä varten on suoritettava seuraavat lisävaiheet:
- Poista suojakorkki katetriliittimestä (C2, ks. vaihe 10).
- Liitä liitin (F) pussin katetriliittimeen (C2).
- Liitä pussi huolellisesti liittimellä (F) potilaan katetriin.
-
Jatka sitten vaiheesta 11.
Katetrin liittäminen liuotinpussiin
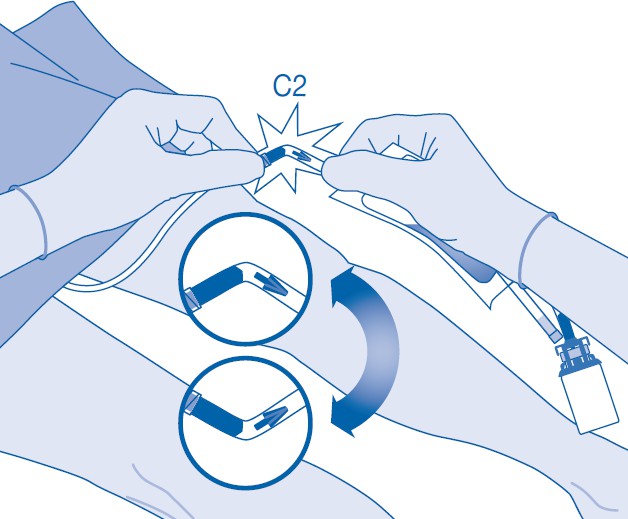
10. Sekoita mahdollinen sakka kääntämällä ja pyörittämällä pussia ennen sen liittämistä.
Älä anna suspensiota jääkaappilämpötilassa. Poista suojakorkki katetrin liittimestä (C2).
Liitä potilaan katetri liuotinpussin katetriliittimeen (C2).
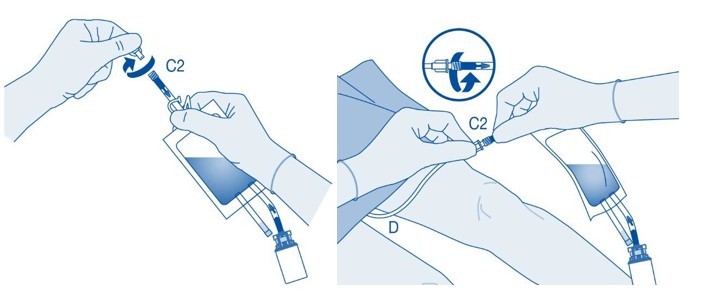
Instillaatio
11. Murra auki murrettava sinetti taivuttamalla sitä katetriliittimen (C2) putken sisällä ylös ja alas useita kertoja.
Pidä samalla potilaan katetria vakaasti paikallaan.
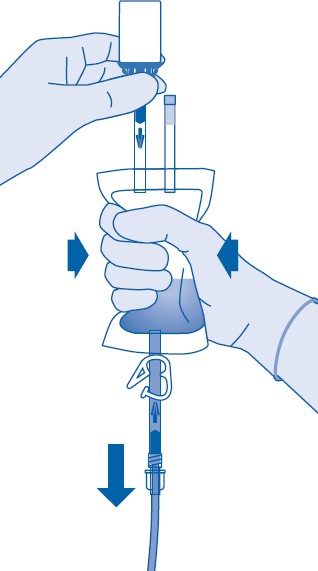
12. Pidä liuotinpussia niin, että lääkepullo on ylösalaisin pussin yläpuolella.
Purista liuotinpussia kevyesti toisella kädellä niin, että lääkevalmiste instilloituu hitaasti potilaan virtsarakkoon.
Jatka puristamista, kunnes liuotinpussi ja lääkepullo ovat tyhjät.
13. Purista jäljellä oleva ilma liuotinpussista, jotta saat katetrin mahdollisimman tyhjäksi.
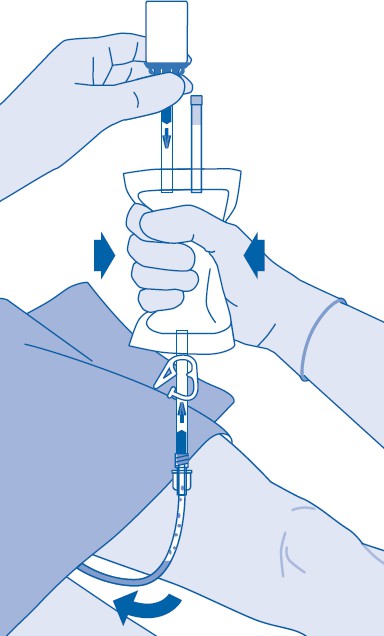
Instillaation jälkeen
14. Painepuristimen (C3) sulkeminen estää nesteen takaisinvirtauksen katetriin ja minimoi saastumisen riskin. Vaihtoehtoisesti voit pitää liuotinpussin kompressoituna suorittaessasi vaiheet 15 ja 16.
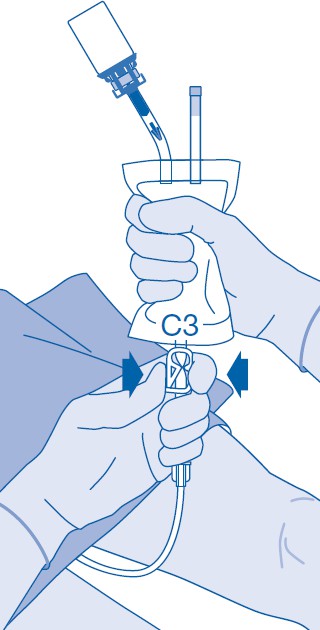
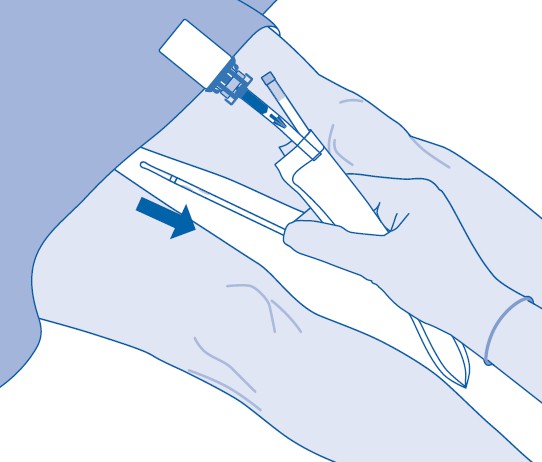
15. Poista katetri huolella rakosta irrottamatta liuotinpussia katetrista. Vältä roiskuvien pisaroiden aiheuttamaa saastumista.
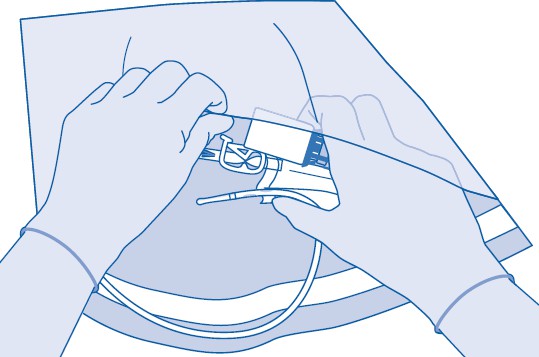
16. Hävitä valmiste kansallisten säädösten mukaisesti jätepussin avulla.
Lääkepullon sisältö on tarkoitettu kertakäyttöön / yksittäisen annoksen antamiseen. Mahdollinen jäljelle jäävä suspensio on hävitettävä.
Korvattavuus
BCG-MEDAC jauhe ja liuotin suspensiota varten, virtsarakkoon
3 kpl, 3 kpl
- Ei korvausta.
ATC-koodi
L03AX03
Valmisteyhteenvedon muuttamispäivämäärä
01.12.2024
Yhteystiedot
Spektri Business Park, Metsänneidonkuja 4
02130 Espoo
010 420 4000
www.medac.fi
info@medac.fi
