NIMENRIX injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
Käyttökuntoon saattamisen jälkeen 1 annos (0,5 ml) sisältää:
Neisseria meningitidis ryhmän A polysakkaridia1 5 mikrogrammaa
Neisseria meningitidis ryhmän C polysakkaridia1 5 mikrogrammaa
Neisseria meningitidis ryhmän W-135 polysakkaridia1 5 mikrogrammaa
Neisseria meningitidis ryhmän Y polysakkaridia1 5 mikrogrammaa
1konjugoituna tetanustoksoidikantajaproteiiniin 44 mikrogrammaa
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Nimenrix on tarkoitettu 6 viikon iästä alkaen aktiiviseen immunisaatioon Neisseria meningitidis ‑ryhmien A, C, W-135 ja Y aiheuttamia invasiivisia meningokokkitauteja vastaan.
Annostus ja antotapa
Annostus
Nimenrixiä tulee käyttää käytettävissä olevien virallisten suositusten mukaan.
Perusrokotus
6 viikon – alle 6 kuukauden ikäiset imeväiset: kaksi 0,5 ml:n annosta, joista toinen annetaan 2 kuukauden kuluttua ensimmäisestä annoksesta.
Vähintään 6 kuukauden ikäiset imeväiset, lapset, nuoret ja aikuiset: yksi 0,5 ml:n kerta-annos.
Joillekin henkilöille voidaan harkita annettavaksi lisäannos Nimenrixiä perusrokotusannoksena (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tehosteannokset
Nimenrix-rokotuksella aikaansaatujen vasta-aineiden säilymisestä on pitkäaikaistietoja 10. vuoteen saakka rokotuksen jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Kun 6 viikon – alle 12 kuukauden ikäiset imeväiset ovat saaneet koko perusrokotussarjan, annetaan tehosteannos 12 kuukauden iässä vähintään 2 kuukauden kuluttua viimeisimmästä Nimenrix-rokotuksesta (ks. kohta Farmakodynamiikka).
Nimenrix voidaan antaa tehosteannoksena aiemmin rokotetuille vähintään 12 kuukauden ikäisille henkilöille, jos nämä ovat aikaisemmin ovat saaneet perusrokotuksen meningokokkikonjugaattirokotteilla tai meningokokkipolysakkaridirokotteilla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Antotapa
Rokote annetaan vain injektiona lihakseen.
Suositeltava injektiokohta on pikkulapsilla reiden etu-sivuosa ja vähintään 1‑vuotiailla reisilihaksen etu-sivuosa tai hartialihas (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero kirjattava selkeästi.
Nimenrixiä ei saa missään olosuhteissa antaa suoneen, ihonsisäisesti eikä ihon alle.
Hyviin kliinisiin käytäntöihin kuuluu selvittää henkilön lääketieteellinen historia (erityisesti aikaisemmat rokotukset ja niiden mahdollisesti aiheuttamat ei-toivotut vaikutukset) sekä tehdä kliininen tutkimus.
Potilasta on seurattava harvinaisten anafylaktisten reaktioiden varalta rokotuksen jälkeen ja asianmukaisesta lääketieteellisestä hoitovalmiudesta on huolehdittava.
Samanaikainen sairaus
Nimenrix-rokotusta tulee lykätä silloin, kun rokotettavalla on akuutti vaikea kuumetauti. Vähäinen infektio, kuten nuhakuume, ei kuitenkaan ole rokotuksen este.
Pyörtyminen
Erityisesti nuorilla saattaa rokotuksen jälkeen, tai jopa ennen, esiintyä pyörtymistä psykogeenisenä reaktiona neulan pistokselle. Pyörtymiseen voi liittyä useita neurologisia löydöksiä, kuten ohimeneviä näköhäiriöitä, tuntohäiriöitä ja toonis-kloonisia raajojen liikkeitä. Pyörtymisen aiheuttamien vammojen välttämiseksi on oltava asianmukaiset toimintavalmiudet.
Trombosytopenia ja veren hyytymishäiriöt
Nimenrixiä tulee antaa varoen henkilöille, joilla on trombosytopenia tai mikä tahansa veren hyytymishäiriö, sillä näillä henkilöillä saattaa esiintyä verenvuotoa lihaksensisäisen annon seurauksena.
Immuunivajaus
On mahdollista, että immunosuppressiivista hoitoa saavilla henkilöillä tai immuunipuutospotilailla ei saavuteta riittävää immuunivastetta.
Henkilöillä, joilla on todettu familiaalisia komplementtipuutoksia (esim. C5- tai C3-komplemettipuutosta), ja henkilöillä, jotka saavat komplementin terminaalisen osan aktivaatiota estävää hoitoa (esim. ekulitsumabia), on suurentunut riski sairastua Neisseria meningitidis A, C,
W-135 ja Y -seroryhmien aiheuttamaan invasiiviseen tautiin, vaikka heille kehittyisikin vasta-aineita Nimenrix-rokotuksen jälkeen.
Suoja meningokokkitauteja vastaan
Nimenrix antaa suojaa vain Neisseria meningitidiksen ryhmiä A, C, W-135 ja Y vastaan. Nimenrix ei anna suojaa muita Neisseria meningitidiksen ryhmiä vastaan.
Suojaavaa rokotevastetta ei ehkä saavuteta kaikilla henkilöillä.
Aiemmin annetun meningokokkipolysakkaridirokotteen vaikutus
Henkilöillä, jotka aikaisemmin olivat saaneet meningokokkipolysakkaridirokotteen ja joille annettiin Nimenrix 30–42 kuukautta myöhemmin, oli matalammat geometriset keskiarvotitterit (GMT) kuin henkilöillä, jotka eivät olleet saaneet mitään meningokokkirokotetta viimeisten 10 vuoden aikana (ks. kohta Farmakodynamiikka). GMT-titterit määritettiin rSBA-menetelmällä (seerumin bakterisidisessa vasta-ainemäärityksessä käyttäen kanin komplementtia). Havainnon kliinistä merkitystä ei tunneta.
Olemassa olevien tetanustoksoidivasta-aineiden vaikutus
Nimenrixin turvallisuutta ja immunogeenisuutta on tutkittu antamalla Nimenrixiä toisena ikävuotena joko peräkkäin tai samanaikaisesti sellaisen rokotteen kanssa, joka sisältää difteria- ja tetanustoksoideja, solutonta hinkuyskärokotetta, inaktivoituja polioviruksia (1, 2 ja 3), hepatiitti B ‑pinta-antigeenia ja Haemophilus influenzae tyyppi b polyribosyyliribitolifosfaattia konjugoituna tetanustoksoidiin (DTaP-HBV-IPV/Hib). Verrattuna samanaikaiseen antoon ryhmien A, C ja W-135 rSBA GMT-arvot olivat matalammat, kun Nimenrix annettiin kuukauden kuluttua DTaP-HBV-IPV/Hib-rokotteen annosta (ks. kohta Yhteisvaikutukset). Havainnon kliinistä merkitystä ei tunneta.
Immuunivaste 6 kuukauden – alle 12 kuukauden ikäisillä imeväisillä
6 kuukauden iässä annetun yhden annoksen jälkeen seerumin bakterisidisessa vasta-ainemäärityksessä ihmisen komplementtia (hSBA) käyttäen määritetyt titterit ryhmille W-135 ja Y olivat matalammat kuin 2, 4 ja 6 kuukauden iässä annettujen kolmen annoksen jälkeen (ks. kohta Farmakodynamiikka). Tämän havainnon kliinistä merkitystä ei tunneta. Jos 6 kuukauden – alle 12 kuukauden ikäisellä imeväisellä oletetaan olevan erityinen riski saada invasiivinen meningokokkitauti johtuen altistumisesta ryhmille W-135 ja/tai Y, voidaan harkita toisen Nimenrix-perusrokotusannoksen antamista 2 kuukauden kuluttua.
Immuunivasteet 12–14 kuukauden ikäisillä pikkulapsilla
12–14 kuukauden ikäisillä pikkulapsilla oli samanlaiset rSBA-titterit ryhmille A, C, W-135 ja Y sekä kuukauden kuluttua yhden Nimenrix-annoksen jälkeen että kuukauden kuluttua kahden Nimenrix-annoksen jälkeen, jotka oli annettu kahden kuukauden välein.
Yhden annoksen jälkeen hSBA:lla määritetyt titterit ryhmille W-135 ja Y olivat matalammat kuin kahden kuukauden välein annettujen kahden annoksen jälkeen. Ryhmille A ja C vasteet olivat samanlaiset yhden ja kahden annoksen jälkeen (ks. kohta Farmakodynamiikka). Tämän havainnon kliinistä merkitystä ei tunneta. Jos pikkulapsella oletetaan olevan erityinen riski saada invasiivinen meningokokkitauti johtuen altistumisesta ryhmille W-135 ja/tai Y, voidaan harkita toisen Nimenrix-annoksen antamista 2 kuukauden kuluttua. Ks. lisätietoa ryhmän A- tai ryhmän C-vasta-aineiden vähenemisestä ensimmäisen Nimenrix-annoksen jälkeen 12–23 kuukauden ikäisillä lapsilla kohdasta ”Seerumin bakterisidisten vasta-ainetittereiden säilyvyys”.
Seerumin bakterisidisten vasta-ainetittereiden säilyvyys
Nimenrixin annon jälkeisten seerumin bakterisidisten vasta-ainetittereiden ryhmä A:ta vastaan on havaittu alenevan hSBA:lla tehdyissä määrityksissä (ks. kohta Farmakodynamiikka). Tämän havainnon kliinistä merkitystä ei tiedetä. Jos riski altistua ryhmä A:lle on erityisen suuri ja Nimenrix-annos on annettu yli vuotta aikaisemmin, tehosteannosta voidaan harkita.
Ryhmille A, C, W-135 ja Y vasta-ainetittereiden on todettu laskevan ajan myötä. Tämän havainnon kliinistä merkitystä ei tunneta. Tehosteannosta voidaan harkita yksilöille, jotka on rokotettu pikkulapsina ja joilla on edelleen korkea riski altistua seroryhmien A, C, W-135 tai Y meningokokkien aiheuttamille taudeille (ks. kohta Farmakodynamiikka).
Vaikutus anti-tetanus-vasta-aineiden pitoisuuksiin
Vaikka Nimenrixin annon jälkeen havaittiin antitetanustoksoidi (TT) vasta-aineissa nousua, Nimenrix ei korvaa tetanusrokotusta. TT-rokotuksen aikaansaama vaste ei muutu, eikä sillä ole merkittävää vaikutusta turvallisuuteen, kun Nimenrix annetaan samanaikaisesti tai kuukautta ennen TT-rokotusta toisena ikävuotena. Tiedot puuttuvat yli 2 vuoden ikäisiltä.
Natriumsisältö
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos, eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Nimenrix voidaan antaa pikkulapsille samanaikaisesti DTaP-HBV-IPV/Hib-yhdistelmärokotteiden ja 10‑valenttisen pneumokokkikonjugaattirokotteen kanssa.
Nimenrix voidaan antaa 1 vuoden iästä alkaen samanaikaisesti minkä tahansa seuraavista rokotteista kanssa: Hepatiitti A- (HAV) ja hepatiitti B (HBV)-rokotteet, tuhkarokko-, sikotauti-, vihurirokkorokotteet (MPR), tuhkarokko-, sikotauti-, vihurirokko-, vesirokkorokotteet (MPRV), 10-valenttinen pneumokokkikonjugaattirokote tai ilman adjuvanttia oleva kausi-influenssarokote.
Toisena ikävuotena Nimenrix voidaan myös antaa samanaikaisesti kurkkumätä-, jäykkäkouristus-, soluton hinkuyskäyhdistelmärokotteen (DTaP), mukaan lukien DTaP-rokotteen ja hepatiitti B-, inaktivoitu polio- tai Haemophilus influenzae tyyppi b -yhdistelmärokotteiden (HBV, IPV tai Hib), kuten DTaP-HBV-IPV/Hib-rokotteen, ja 13-valenttisen pneumokokkikonjugaattirokotteen kanssa.
Nimenrix voidaan antaa 9–25‑vuotiaille samanaikaisesti rekombinantin kaksivalenttisen [tyypit 16 and 18] papilloomavirusrokotteen (HPV2) kanssa.
Nimenrix tulee antaa aina mahdollisuuksien mukaan joko samanaikaisesti tetanustoksoidia (TT) sisältävän rokotteen (kuten DTaP-HBV-IPV/Hib-rokotteen) kanssa tai vähintään yksi kuukausi ennen tetanustoksoidia (TT) sisältävää rokotetta.
Yhden pneumokokkiserotyypin kohdalla (tetanustoksoidikantajaproteiiniin konjugoitu 18 C) havaittiin matalampia geometrisiä keskiarvopitoisuuksia (GMC) ja opsonofagosyyttista aktiivisuutta (OPA) kuvaavia GMT-arvoja kuukauden kuluttua Nimenrixin ja 10-valenttisen pneumokokkikonjugaattirokotteen samanaikaisesta annosta. Havainnon kliinistä merkitystä ei tunneta. Samanaikainen anto ei vaikuttanut yhdeksän muun pneumokokkiserotyypin immuunivasteisiin.
Jokaisen hinkuyskäantigeenin (hinkuyskätoksoidi [PT], filamenttihemagglutiniini [FHA] ja pertaktiini [PRN]) kohdalla havaittiin matalampia GMC-arvoja kuukauden kuluttua siitä, kun 9–25‑vuotiaille henkilöille annettiin samanaikaisesti Nimenrix ja yhdistelmärokote, joka sisälsi tetanustoksoidia, matalapitoisuuksista difteriatoksoidia ja solutonta hinkuyskärokotetta (Tdap, adsorboitu). Anti-PT‑, anti-FHA‑ tai anti-PRN-pitoisuudet ylittivät määritysten raja-arvokynnykset yli 98 %:lla rokotetuista. Näiden havaintojen kliinistä merkitystä ei tunneta. Samanaikainen anto ei vaikuttanut immuunivasteisiin Nimenrixin tai Tdap-rokotteen jäykkäkouristus- tai kurkkumätäantigeenien kohdalla.
Kun Nimenrix annetaan samanaikaisesti muiden injisoitavien rokotteiden kanssa, muut rokotteet on annettava aina eri kohtaan.
On mahdollista, että immunosuppressiivista hoitoa saavilla potilailla ei saavuteta riittävää vastetta.
Raskaus ja imetys
Raskaus
Nimenrixin käytöstä raskaana olevilla naisilla on rajoitetusti kokemusta.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria vaikutuksia raskauteen, alkion/sikiön kehitykseen, synnytykseen tai syntymänjälkeiseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Nimenrixiä käytetään raskauden aikana vain pakottavista syistä. Mahdollisten hyötyjen tulee olla potentiaalisia riskejä suuremmat.
Imetys
Ei tiedetä erittyykö Nimenrix ihmisen rintamaitoon.
Nimenrix annetaan rintaruokinnan aikana vain, jos mahdolliset hyödyt ovat suuremmat kuin potentiaaliset riskit.
Hedelmällisyys
Eläimillä suoritetut tutkimukset eivät viittaa suoriin tai epäsuoriin vaikutuksiin hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nimenrixillä ei ole suoritettu tutkimuksia, joissa selvitettäisiin sen vaikutuksia ajokykyyn ja koneidenkäyttökykyyn. Jotkut kohdassa Haittavaikutukset mainituista haittavaikutuksista voivat kuitenkin vaikuttaa ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Seuraavassa taulukossa esitetty Nimenrixin turvallisuus perustuu kahden kliinisen tutkimuksen tietoaineistoihin seuraavasti:
- Yhdistetty analyysi 9621 tutkittavan tiedoista; tutkittavat saivat yhden Nimenrix-kerta-annoksen. Tutkittavista 3079 oli pikkulapsia (12–23 kuukauden ikäisiä), 909 iältään 2–5-vuotiasta lasta, 990 iältään 6–10-vuotiasta lasta, 2317 nuorta (11–17-vuotiaita) ja 2326 aikuista (18–55-vuotiaita).
- Tiedot tutkimuksesta (MenACWY‑TT-083), jossa pikkulapset olivat ensimmäisen annoksen antohetkellä 6–12 viikkoa, 1052 tutkittavaa sai vähintään yhden annoksen Nimenrixin 2 tai 3 annoksen perusrokotussarjasta ja 1008 sai tehosteannoksen noin 12 kuukauden iässä.
Turvallisuustietoja on arvioitu myös erillisessä tutkimuksessa, jossa 274 vähintään 56‑vuotiasta henkilöä sai yhden Nimenrix-kerta-annoksen.
Paikalliset ja yleiset haittavaikutukset
Tutkimuksessa, jossa 6–12 viikon ja 12–14 kuukauden ikäisille tutkittaville annettiin kaksi Nimenrix-annosta siten, että annosten väliin jäi kaksi kuukautta, sekä ensimmäiseen että toiseen annokseen liittyi samankaltaista paikallista ja systeemistä reaktogeenisuutta.
Kun Nimenrix-tehosterokoteannos annettiin 12 kuukaudesta 30 vuoden ikäisille tutkittaville perusrokotuksena saadun Nimenrix-rokotteen tai muiden meningokokkikonjugaattirokotteiden tai meningokokkipolysakkaridirokotteiden jälkeen, paikallisten ja yleisten haittavaikutusten profiili oli samanlainen kuin perusrokotuksena annetun Nimenrix-rokotteen jälkeen todettu profiili, lukuun ottamatta maha-suolikanavan oireita (mukaan lukien ripuli, oksentelu ja pahoinvointi). Maha-suolikanavan oireet olivat hyvin yleisiä vähintään 6‑vuotiailla tutkittavilla.
Haittavaikutustaulukko
Raportoidut haittavaikutukset on lueteltu seuraavien frekvenssien mukaan:
Hyvin yleiset (≥ 1/10)
Yleiset (≥ 1/100, < 1/10)
Melko harvinaiset (≥ 1/1000, < 1/100)
Harvinaiset (≥ 1/10000, < 1/1000)
Hyvin harvinaiset (< 1/10000)
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
Taulukossa 1 on haittavaikutukset, joita on raportoitu 6 viikon – 55 vuoden ikäisille tutkittaville tehdyissä tutkimuksissa sekä valmisteen markkinoille tulon jälkeen. Yli 55‑vuotiailla raportoidut haittavaikutukset olivat samankaltaisia kuin nuoremmilla aikuisilla havaitut.
Taulukko 1: Haittavaikutukset taulukoituina elinjärjestelmän luokan mukaan
| Elinjärjestelmän luokka | Frekvenssi | Haittavaikutus |
| Veri ja imukudos | Tuntematon*** | Lymfadenopatia |
| Immuunijärjestelmä | Melko harvinaiset | Yliherkkyys*** |
| Tuntematon | Anafylaksia*** | |
| Aineenvaihdunta ja ravitsemus | Hyvin yleiset | Ruokahaluttomuus |
| Psyykkiset häiriöt | Hyvin yleiset | Ärtyneisyys |
| Melko harvinaiset | Unettomuus Itku | |
| Hermosto | Hyvin yleiset | Uneliaisuus Päänsärky |
| Melko harvinaiset | Hypoestesia Huimaus | |
| Harvinaiset | Kuumekouristus | |
| Ruoansulatuselimistö | Yleiset | Ripuli Oksentelu Pahoinvointi* |
| Iho ja ihonalainen kudos | Melko harvinaiset | Kutina Urtikaria Ihottuma** |
| Luusto, lihakset ja sidekudos | Melko harvinaiset | Lihaskipu Raajojen kipu |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | Kuume Injektiokohdan turvotus Injektiokohdan kipu Injektiokohdan punoitus Väsymys |
| Yleiset | Injektiokohdan verenpurkauma* | |
| Melko harvinaiset | Huonovointisuus Injektiokohdan kovettuma Injektiokohdan kutina Injektiokohdan kuumotus Injektiokohdan tunnottomuus | |
| Tuntematon*** | Laajamittainen raajan turvotus injektiokohdassa, johon usein liittyy punoitusta, joka joskus kattaa viereisen nivelen tai koko injektion saaneen raajan turpoaminen |
* Pahoinvointia ja injektiokohdan verenpurkaumaa ilmeni imeväisillä melko harvoin.
** Ihottumaa ilmeni imeväisillä yleisesti.
*** Haittavaikutukset, jotka tunnistettu valmisteen markkinoille tulon jälkeen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: rokotteet, meningokokkirokotteet, ATC-koodi: J07AH08
Vaikutusmekanismi
Meningokokin kapselivasta-aineet suojaavat meningokokkitaudeilta komplementin välittämän bakterisidisen aktiivisuuden kautta. Nimenrix aikaansaa bakterisidisen vasta-ainetuotannon Neisseria meningitidiksen seroryhmien A, C, W-135 ja Y kapselipolysakkarideja vastaan. Vasteet ovat mitattavissa käyttäen joko rSBA‑ tai hSBA‑menetelmää.
Immunogeenisuus imeväisikäisillä
Tutkimuksessa MenACWY-TT-083 ensimmäinen annos annettiin 6–12 viikon iässä, toinen tästä 2 kuukauden kuluttua, ja kolmas (tehoste)annos annettiin noin 12 kuukauden iässä. Samanaikaisesti annettiin DTaP-HBV-IPV/Hib-rokote ja 10-valenttinen pneumokokkikonjugaattirokote. Nimenrix sai aikaan rSBA- ja hSBA-titterit kaikkia neljää meningokokkiryhmää vastaan, kuten taulukossa 2 esitetään. Vaste ryhmä C:tä vastaan oli verrattavissa lisensoitujen MenC-CRM- ja MenC‑TT-rokotteiden aikaansaamaan vasteeseen, kun vertailukohteena olivat ≥ 8 rSBA-tittereiden prosentuaaliset osuudet 1 kuukauden kuluttua toisesta annoksesta.
Tästä tutkimuksesta saadut tiedot tukevat immunogeenisuustietojen ja annostelun ekstrapolointia vähintään 12 viikon mutta alle 6 kuukauden ikäisille imeväisille.
| Taulukko 2: rSBA- ja hSBA-titterit 2 kuukauden välein annetun kahden Nimenrix-annoksen (tai MenC-CRM- tai MenC-TT-annoksen) jälkeen, kun ensimmäinen annos annettiin imeväisille 6–12 viikon iässä ja sen jälkeen tehosterokotus 12 kuukauden iässä (tutkimus MenACWY-TT-083) | ||||||||
| Meningokokkiryhmä | Rokoteryhmä | Ajankohta | rSBA* | hSBA** | ||||
| N | ≥ 8 | GMT | N | ≥ 8 | GMT | |||
| (95 % CI) | (95 % CI) | (95 % CI) | (95 % CI) | |||||
| A | Nimen rix | Annoksen 2 jälkeen(1) | 456 | 97,4 % (95,4; 98,6) | 203 (182; 227) | 202 | 96,5 % (93,0; 98,6) | 157 (131; 188) |
| Tehosteen jälkeen(1) | 462 | 99,6 % (98,4; 99,9) | 1561 (1412; 1725) | 214 | 99,5 % (97,4;100) | 1007 (836;1214) | ||
| C | Nimen rix | Annoksen 2 jälkeen(1) | 456 | 98,7 % (97,2; 99,5) | 612 (540; 693) | 218 | 98,6 % (96,0; 99,7) | 1308 (1052; 1627) |
| Tehosteen jälkeen(1) | 463 | 99,8 % (98,8; 100) | 1177 (1059; 1308) | 221 | 99,5 % (97,5; 100) | 4992 (4086; 6100) | ||
| MenC-CRM-rokote | Annoksen 2 jälkeen(1) | 455 | 99,6 % (98.4; 99.9) | 958 (850; 1079) | 202 | 100 % (98,2; 100) | 3188 (2646; 3841) | |
| Tehosteen jälkeen(1) | 446 | 98,4 % (96,8; 99,4) | 1051 (920; 1202) | 216 | 100 % (98,3; 100) | 5438 (4412; 6702) | ||
| MenC-TT- rokote | Annoksen 2 jälkeen(1) | 457 | 100 % (99,2; 100) | 1188 (1080; 1307) | 226 | 100 % (98,4; 100) | 2626 (2219; 3109) | |
| Tehosteen jälkeen(1) | 459 | 100 % (99,2; 100) | 1960 (1776; 2163) | 219 | 100 % (98,3; 100) | 5542 (4765; 6446) | ||
| W | Nimen rix | Annoksen 2 jälkeen(1) | 455 | 99,1 % (97,8; 99,8) | 1605 (1383; 1862) | 217 | 100 % (98,3; 100) | 753 (644; 882) |
| Tehosteen jälkeen(1) | 462 | 99,8 % (98,8; 100) | 2777 (2485; 3104) | 218 | 100 % (98,3; 100) | 5123 (4504; 5826) | ||
| Y | Nimen rix | Annoksen 2 jälkeen(1) | 456 | 98,2 % (96,6; 99,2) | 483 (419; 558) | 214 | 97,7 % (94,6; 99,2) | 328 (276; 390) |
| Tehosteen jälkeen(1) | 462 | 99,4 % (99,1; 99,9) | 881 (787; 986) | 217 | 100 % (98,3; 100) | 2954 (2498; 3493) | ||
| Immunogeenisuus tutkittiin tutkimussuunnitelman mukaisessa (ATP, according-to-protocol) ensisijaisessa kohortissa. | ||||||||
| * rSBA tutkittu Public Health England (PHE) ‑laboratorioissa Isossa-Britanniassa | ||||||||
| ** hSBA tutkittu GSK:n laboratorioissa | ||||||||
| (1) verinäytteet otettiin 21–48 päivän kuluttua rokotuksesta | ||||||||
Tutkimuksessa MenACWY-TT-087 imeväiset saivat joko yhden perusrokotusannoksen 6 kuukauden iässä ja sen jälkeen tehosteannoksen 15–18 kuukauden iässä (kumpanakin rokotusajankohtana annettiin samalla DTaP-IPV/Hib-yhdistelmärokote ja 10‑valenttinen pneumokokkikonjugaattirokote), tai kolme perusrokotusannosta 2, 4 ja 6 kuukauden iässä ja niiden jälkeen tehosteannos 15–18 kuukauden iässä. Yksi perusrokotusannos 6 kuukauden iässä aikaansai vahvat rSBA-titterit neljää meningokokkiryhmää vastaan mitattuna niiden henkilöiden prosentuaalisella osuudella, joiden rSBA-titteri oli ≥ 8. Nämä vasteet olivat verrattavissa vasteisiin, jotka saadaan kolmen annoksen perusrokotussarjan viimeisen annoksen jälkeen. Tehosteannos aikaansai kaikkia neljää meningokokkiryhmää vastaan vahvat rSBA-vasteet, jotka olivat vastaavia mainittujen kahden hoitoryhmän välillä. Tulokset esitetään taulukossa 3.
Taulukko 3: rSBA- ja hSBA-titterit imeväisillä, jotka saivat Nimenrix-kerta-annoksen 6 kuukauden iässä sekä ennen tehosterokotusta 15–18 kuukauden iässä ja sen jälkeen (tutkimus MenACWY-TT-087)
| Meningokokki-ryhmä | Ajankohta | rSBA* | hSBA** | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Annoksen 1 jälkeen(1) | 163 | 98,8 % (95,6; 99,9) | 1333 (1035; 1716) | 59 | 98,3 % (90,9; 100) | 271 (206; 355) |
| Ennen tehostetta | 131 | 81,7 % (74; 87,9) | 125 (84,4; 186) | 71 | 66,2 % (54; 77) | 20,8 (13,5; 32,2) | |
| Tehosteen jälkeen(1) | 139 | 99,3 % (96,1; 100) | 2762 (2310; 3303) | 83 | 100 % (95,7; 100) | 1416 (1140; 1758) | |
| C | Annoksen 1 jälkeen (1) | 163 | 99,4 % (96,6; 100) | 592 (482; 726) | 66 | 100 % (94,6;100) | 523 (382; 717) |
| Ennen tehostetta | 131 | 65,6 % (56,9; 73,7) | 27,4 (20,6; 36,6) | 78 | 96,2 % (89,2; 99,2) | 151 (109; 210) | |
| Tehosteen jälkeen(1) | 139 | 99,3 % (96,1; 100) | 2525 (2102; 3033) | 92 | 100 % (96,1; 100) | 13360 (10953; 16296) | |
| W | Annoksen 1 jälkeen(1) | 163 | 93,9 % (89; 97) | 1256 (917; 1720) | 47 | 87,2 % (74,3; 95,2) | 137 (78,4; 238) |
| Ennen tehostetta | 131 | 77,9 % (69,8; 84,6) | 63,3 (45,6; 87,9) | 53 | 100 % (93,3; 100) | 429 (328; 559) | |
| Tehosteen jälkeen(1) | 139 | 100 % (97,4; 100) | 3145 (2637; 3750) | 59 | 100 % (93,9; 100) | 9016 (7045; 11537) | |
| Y | Annoksen 1 jälkeen(1) | 163 | 98,8 % (95,6; 99,9) | 1470 (1187; 1821) | 52 | 92,3 % (81,5; 97,9) | 195 (118; 323) |
| Ennen tehostetta | 131 | 88,5 % (81,8; 93,4) | 106 (76,4; 148) | 61 | 98,4 % (91,2; 100) | 389 (292; 518) | |
| Tehosteen jälkeen(1) | 139 | 100 % (97,4; 100) | 2749 (2301; 3283) | 69 | 100 % (94,8; 100) | 5978 (4747; 7528) | |
Immunogeenisuus tutkittiin ensisijaisessa ATP-kohortissa.
* rSBA tutkittu PHE‑laboratorioissa Isossa-Britanniassa
** hSBA tutkittu Neomed-laboratoriossa Kanadassa
(1) verinäytteet otettiin 1 kuukauden kuluttua rokotuksesta
hSBA-titterit mitattiin tutkimuksessa MenACWY-TT-087 toissijaisena päätetapahtumana. Vaikka kummallakin annosteluohjelmalla havaittiin samankaltaisia vasteita ryhmiä A ja C vastaan, hSBA-titterit ryhmiä W‑135 ja Y vastaan olivat alhaisemmat imeväisillä, jotka saivat 6 kuukauden iässä yhden perusrokotusannoksen. Vasteen mittarina käytettiin niiden henkilöiden prosentuaalista osuutta, joiden hSBA-titteri oli ≥ 8. Yhden perusrokotusannoksen annostelulla ≥8 hSBA-titterin ryhmää W‑135 vastaan saavutti 87,2 % (95 % CI: 74,3; 95,2) ja ryhmää Y vastaan 92,3 % (95 % CI: 81,5; 97,9) verrattuna 2, 4 ja 6 kuukauden iässä annettuun kolmen perusrokotusannoksen annosteluun, jossa vastaavat osuudet olivat 100 % (95 % CI: 96,6; 100) ja 100 % (95 % CI: 97,1; 100) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tehosteannoksen jälkeen hSBA-titterit kaikkia neljää meningokokkiryhmää vastaan olivat toisiinsa verrattavat mainittujen kahden hoito-ohjelman välillä. Tulokset esitetään taulukossa 3.
Immunogeenisuus 12–23 kuukauden ikäisillä pikkulapsilla
Kliinisissä tutkimuksissa MenACWY-TT-039 ja MenACWY-TT-040 yksittäinen Nimenrix-annos sai aikaan SBA-titterit kaikkia neljää meningokokkiryhmää vastaan. Ryhmä C:n rSBA-titterit olivat verrattavissa lisensioidun MenC-CRM-rokotteen aikaansaamiin tittereihin, kun vertailukohteena oli niiden koehenkilöiden prosentuaalinen osuus, joiden rSBA-titterit olivat ≥ 8. hSBA mitattiin tutkimuksessa MenACWY-TT-039 myös toissijaisena päätetapahtumana. Tulokset esitetään taulukossa 4.
Taulukko 4:SBA*-titterit Nimenrix-kerta-annoksen (tai MenC-CRM-kerta-annoksen) jälkeen 12–23 kuukauden ikäisillä pikkulapsilla (tutkimukset MenACWY-TT-039/040)
| Meningo-kokki-ryhmä | Rokoteryhmä | Tutkimus MenACWY-TT-039(1) | Tutkimus MenACWY-TT-040(2) | |||||||
| rSBA* | hSBA* | rSBA* | ||||||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Nimenrix | 354 | 99,7 % (98,4; 100) | 2205 (2008; 2422) | 338 | 77,2 % (72,4; 81,6) | 19,0 (16,4; 22,1) | 183 | 98,4 % (95,3; 99,7) | 3170 (2577; 3899) |
| C | Nimenrix | 354 | 99,7 % (98,4; 100) | 478 (437; 522) | 341 | 98,5 % (96,6; 99,5) | 196 (175; 219) | 183 | 97,3 % (93,7; 99,1) | 829 (672; 1021) |
| MenC-CRM-rokote | 121 | 97,5 % (92,9; 99,5) | 212 (170; 265) | 116 | 81,9 % (73,7; 88,4) | 40,3 (29,5; 55,1) | 114 | 98,2 % (93,8; 99,8) | 691 (521; 918) | |
| W-135 | Nimenrix | 354 | 100 % (99,0; 100) | 2682 (2453; 2932) | 336 | 87,5 % (83,5 ; 90,8) | 48,9 (41,2; 58,0) | 186 | 98,4 % (95,4; 99,7) | 4022 (3269; 4949) |
| Y | Nimenrix | 354 | 100 % (99,0; 100) | 2729 (2473; 3013) | 329 | 79,3 % (74,5; 83,6) | 30,9 (25,8; 37,1) | 185 | 97,3 % (93,8; 99,1) | 3168 (2522; 3979) |
Immunogeenisuus tutkittiin tutkimussuunnitelman mukaisissa ATP-kohorteissa.
(1) verinäytteet otettiin 42–56 päivän kuluttua rokotuksesta
(2) verinäytteet otettiin 30−42 päivän kuluttua rokotuksesta
*SBA tutkittu GSK:n laboratorioissa
Pitkäkestoinen immunogeenisuus pikkulapsilla
Tutkimuksessa MenACWY-TT-104 arvioitiin 12–14 kuukauden ikäisillä pikkulapsilla immunogeenisuutta 1 kuukauden kuluttua ja vasteen säilymistä 5 vuoteen saakka yhden tai kahden Nimenrix-annoksen (2 kuukauden välein) antamisen jälkeen. Kuukausi yhden ja kahden Nimenrix-annoksen antamisen jälkeen saavutettiin kaikkia neljää meningokokkiryhmää vastaan rSBA-titterit, joiden GMT:t olivat samansuuruiset ja rSBA-titteri ≥ 8 saavuttaneiden koehenkilöiden prosenttiosuus oli samansuuruinen. Toissijaisena päätetapahtumana mitattiin hSBA-titterit. Kuukausi kahden Nimenrix-annoksen jälkeen hSBA-titterit ryhmiä W-135 ja Y vastaan olivat ≥ 8 prosentuaalisesti suuremmalla osalla koehenkilöistä verrattuna yhden annoksen saaneisiin koehenkilöihin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Yhdellä ja kahdella Nimenrix-annoksella saavutettiin hSBA-titterit ≥ 8 ryhmiä A ja C vastaan samankaltaisella prosenttiosuudella koehenkilöistä. Vuoden 5 aikapisteessä yhden ja kahden annoksen välillä havaittiin hSBA-tittereinä ≥ 8 kaikkia ryhmiä vastaan vasta-aineiden säilymisessä vain pieni ero koehenkilöiden prosenttiosuuksissa. Vuoden 5 aikapisteessä todettiin vasta-aineiden säilyminen ryhmiä C, W-135 ja Y vastaan. Yhden ja kahden annoksen jälkeen niiden koehenkilöiden prosentuaalinen osuus, joilla hSBA-titterit olivat ≥ 8, olivat ryhmän C osalta 60,7 % (1 annos) ja 67,8 % (2 annosta), ryhmän W-135 osalta 58,9 % (1 annos) ja 63,6 % (2 annosta) ja ryhmän Y osalta 61,5 % (1 annos) ja 54,2 % (2 annosta). Ryhmän A osalta 27,9 %:lla yhden annoksen ja 17,9 %:lla kaksi annosta saaneista oli hSBA-titteri ≥ 8. Tulokset esitetään taulukossa 5.
Taulukko 5: rSBA- ja hSBA-titterit yhden tai kahden Nimenrix-annoksen jälkeen, kun ensimmäinen annos annettiin 12–14 kuukauden ikäisille pikkulapsille, ja tittereiden säilyminen 5 vuoteen saakka (tutkimus MenACWY-TT-104)
| Meningo-kokki-ryhmä | Nimenrix-annosryhmä | Ajankohta(1) | rSBA* | hSBA** | ||||
| N | ≥ 8 (95 %CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | |||
| A | 1 annos | Annoksen 1 jälkeen | 180 | 97,8 % (94,4; 99,4) | 1437 (1118; 1847) | 74 | 95,9 % (88,6; 99,2) | 118 (86,8; 161) |
| Vuosi 1 | 167 | 63,5 % (55,7; 70,8) | 62,7 (42,6; 92,2) | 70 | 35,1 % (25,9; 49,5) | 6,1 (4,1; 8,9) | ||
| Vuosi 3 | 147 | 46,9 % (38,7; 55,3) | 29,7 (19,8; 44,5) | 55 | 36,4 % (23,8; 50,4) | 5,8 (3,8; 8,9) | ||
| Vuosi 5 | 133 | 58,6 % (49,8; 67,1) | 46,8 (30,7; 71,5) | 61 | 27,9 % (17,1; 40,8) | 4,4 (3,1; 6,2) | ||
| 2 annosta | Annoksen 1 jälkeen | 158 | 96,8 % (92,8; 99,0) | 1275 (970; 1675) | 66 | 97,0 % (89,5; 99,6) | 133 (98,1; 180) | |
| Annoksen 2 jälkeen | 150 | 98,0 % (94,3; 99,6) | 1176 (922; 1501) | 66 | 97,0 % (89,5; 99,6) | 170 (126; 230) | ||
| Vuosi 1 | 143 | 70,6 % (62,4; 77,9) | 76,6 (50,7; 115,7) | 62 | 35,5 % (23,7; 48,7) | 6,4 (4,2; 10,0) | ||
| Vuosi 3 | 121 | 54,5 % (45,2; 63,6) | 28,5 (18,7; 43,6) | 50 | 36,0 % (22,9; 50,8) | 5,4 (3,6; 8,0) | ||
| Vuosi 5 | 117 | 65,8 % (56,5; 74,3) | 69,9 (44,7; 109,3) | 56 | 17,9 % (8,9; 30,4) | 3,1 (2,4; 4,0) | ||
| C | 1 annos | Annoksen 1 jälkeen | 179 | 95,0 % (90,7; 97,7) | 452 (346; 592) | 78 | 98,7 % (93,1; 100) | 152 (105; 220) |
| Vuosi 1 | 167 | 49,1 % (41,3; 56,9) | 16,2 (12,4; 21,1) | 71 | 81,7 % (70,7; 89,9) | 35,2 (22,5; 55,2) | ||
| Vuosi 3 | 147 | 35,4 % (27,7; 43,7) | 9,8 (7,6; 12,7) | 61 | 65,6 % (52,3; 77,3) | 23,6 (13,9; 40,2) | ||
| Vuosi 5 | 132 | 20,5 % (13,9; 28,3) | 6,6 (5,3; 8,2) | 61 | 60,7 % (47,3; 72,9) | 18,1 (10,9; 30,0) | ||
| 2 annosta | Annoksen 1 jälkeen | 157 | 95,5 % (91,0; 98,2) | 369 (281; 485) | 70 | 95,7 % (88,0; 99,1) | 161 (110; 236) | |
| Annoksen 2 jälkeen | 150 | 98,7 % (95,3; 99,8) | 639 (522; 783) | 69 | 100 % (94,8; 100) | 1753 (1278; 2404) | ||
| Vuosi 1 | 143 | 55,2 % (46,7; 63,6) | 21,2 (15,6; 28,9) | 63 | 93,7 % (84,5; 98,2) | 73,4 (47,5; 113,4) | ||
| Vuosi 3 | 121 | 33,9 % (25,5; 43,0) | 11,5 (8,4; 15,8) | 56 | 67,9 % (54,0; 79,7) | 27,0 (15,6; 46,8) | ||
| Vuosi 5 | 116 | 28,4 % (20,5; 37,6) | 8,5 (6,4; 11,2) | 59 | 67,8 % (54,4; 79,4) | 29,4 (16,3; 52,9) | ||
| W-135 | 1 annos | Annoksen 1 jälkeen | 180 | 95,0 % (90,8; 97,7) | 2120 (1601; 2808) | 72 | 62,5 % (50,3; 73,6) | 27,5 (16,1; 46,8) |
| Vuosi 1 | 167 | 65,3 % (57,5; 72,5) | 57,2 (39,9; 82,0) | 72 | 95,8 % (88,3; 99,1) | 209,0 (149,9; 291,4) | ||
| Vuosi 3 | 147 | 59,2 % (50,8; 67,2) | 42,5 (29,2; 61,8) | 67 | 71,6 % (59,3; 82,0) | 30,5 (18,7; 49,6) | ||
| Vuosi 5 | 133 | 44,4 % (35,8; 53,2) | 25,0 (16,7; 37,6) | 56 | 58,9 % (45,0; 71,9) | 20,8 (11,6; 37,1) | ||
| 2 annosta | Annoksen 1 jälkeen | 158 | 94,9 % (90,3; 97,8) | 2030 (1511; 2728) | 61 | 68,9 % (55,7; 80,1) | 26,2 (16,0; 43,0) | |
| Annoksen 2 jälkeen | 150 | 100 % (97,6; 100) | 3533 (2914; 4283) | 70 | 97,1 % (90,1; 99,7) | 757 (550; 1041) | ||
| Vuosi 1 | 143 | 77,6 % (69,9; 84,2) | 123 (82,7; 183) | 65 | 98,5 % (91,7; 100,0) | 232,6 (168,3; 321,4) | ||
| Vuosi 3 | 121 | 72,7 % (63,9; 80,4) | 92,9 (59,9; 144) | 54 | 87,0 % (75,1; 94,6) | 55,5 (35,3; 87,1) | ||
| Vuosi 5 | 117 | 50,4 % (41,0; 59,8) | 37,1 (23,3; 59,0) | 44 | 63,6 % (47,8; 77,6) | 19,5 (10,7; 35,2) | ||
| Y | 1 annos | Annoksen 1 jälkeen | 180 | 92,8 % (88,0; 96,1) | 952 (705; 1285) | 71 | 67,6 % (55,5; 78,2) | 41,2 (23,7; 71,5) |
| Vuosi 1 | 167 | 73,1 % (65,7; 79,6) | 76,8 (54,2; 109,0) | 62 | 91,9 % (82,2; 97,3) | 144 (97,2; 214,5) | ||
| Vuosi 3 | 147 | 61,9 % (53,5; 69,8) | 58,0 (39,1; 86,0) | 64 | 53,1 % (40,2; 65,7) | 17,3 (10,1; 29,6) | ||
| Vuosi 5 | 133 | 47,4 % (38,7; 56,2) | 36,5 (23,6; 56,2) | 65 | 61,5 % (48,6; 73,3) | 24,3 (14,3; 41,1) | ||
| 2 annosta | Annoksen 1 jälkeen | 157 | 93,6 % (88,6; 96,9) | 933 (692; 1258) | 56 | 64,3 % (50,4; 76,6) | 31,9 (17,6; 57,9) | |
| Annoksen 2 jälkeen | 150 | 99,3 % (96,3; 100) | 1134 (944; 1360) | 64 | 95,3 % (86,9; 99,0) | 513 (339; 775) | ||
| Vuosi 1 | 143 | 79,7 % (72,2; 86,0) | 112,3 (77,5; 162,8) | 58 | 87,9 % (76,7; 95,0) | 143,9 (88,5; 233,8) | ||
| Vuosi 3 | 121 | 68,6 % (59,5; 76,7) | 75,1 (48,7; 115,9) | 52 | 61,5 % (47,0; 74,7) | 24,1 (13,3; 43,8) | ||
| Vuosi 5 | 117 | 58,1 % (48,6; 67,2) | 55,8 (35,7; 87,5) | 48 | 54,2 % (39,2; 68,6) | 16,8 (9,0; 31,3) | ||
Immunogeenisuus tutkittiin ATP-kohortissa.
(1) verinäytteet otettiin 21–48 päivän kuluttua rokotuksesta
* rBSA tutkittu PHE‑laboratorioissa
**hSBA tutkittu GSK:n laboratorioissa
rSBA- ja hSBA-titterit määritettiin 10 vuoden ajanjakson ajan lapsilla, jotka oli alun perin rokotettu tutkimuksessa MenACWY-TT-027 yhdellä Nimenrix- tai MenC-CRM-annoksella 12–23 kuukauden iässä. SBA-titterien säilymistä arvioitiin kahdessa jatkotutkimuksessa: MenACWY-TT-032 (5. vuoteen asti) ja MenACWY-TT-100 (10. vuoteen asti). Tutkimuksessa MenACWY-TT-100 arvioitiin myös vastetta yhteen Nimenrix-tehosteannokseen 10 vuotta aluksi annetun Nimenrix- tai MenC-CRM-rokotuksen jälkeen. Tulokset esitetään taulukossa 6 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 6: rSBA- ja hSBA-titterit yhden Nimenrix-annoksen (tai MenC-CRM-annoksen) jälkeen 12–23 kuukauden ikäisillä pikkulapsilla, titterien säilyminen 10. vuoteen asti ja 10 vuoden kuluttua alun perin annetusta rokotuksesta annetun tehosterokotuksen jälkeen (tutkimukset MenACWY-TT-027/032/100)
| Meningo-kokki-ryhmä | Rokote-ryhmä | Ajankohta (vuosi) | rSBA* | hSBA** | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | |||
| A | Nimenrix | Kuukausi 1(1) | 222 | 100 % (98,4; 100) | 3707 (3327; 4129) | 217 | 91,2 % (86,7; 94,6) | 59,0 (49,3; 70,6) |
| Vuosi 4(2) | 45 | 64,4 % (48,8; 78,1) | 35,1 (19,4; 63,4) | 44 | 52,3 % (36,7; 67,5) | 8,8 (5,4; 14,2) | ||
| Vuosi 5(2) | 49 | 73,5 % (58,9; 85,1) | 37,4 (22,1; 63,2) | 45 | 35,6 % (21,9: 51,2) | 5,2 (3,4; 7,8) | ||
| Vuosi 10(3) (Ennen tehostetta) | 62 | 66,1 % (53,0; 77,7) | 28,9 (16,4; 51,0) | 59 | 25,4 % (15,0; 38,4) | 4,2 (3,0; 5,9) | ||
| (Tehosteen jälkeen)(3,4) | 62 | 98,4 % (91,3; 100) | 5122 (3726; 7043) | 62 | 100 % (94,2; 100) | 1534 (1112; 2117) | ||
| C | Nimenrix | Kuukausi 1(1) | 220 | 100 % (98,3; 100) | 879 (779; 991) | 221 | 99,1 % (96,8; 99,9) | 190 (165; 219) |
| Vuosi 4(2) | 45 | 97,8 % (88,2; 99,9) | 110 (62,7; 192) | 45 | 97,8 % (88,2; 99,9) | 370 (214; 640) | ||
| Vuosi 5(2) | 49 | 77,6 % (63,4; 88,2) | 48,9 (28,5; 84,0) | 48 | 91,7 % (80,0; 97,7) | 216 (124; 379) | ||
| Vuosi 10(3) (Ennen tehostetta) | 62 | 82,3 % (70,5; 90,8) | 128 (71,1; 231) | 60 | 91,7 % (81,6; 97,2) | 349 (197; 619) | ||
| (Tehosteen jälkeen)(3,4) | 62 | 100 % (94,2; 100) | 7164 (5478; 9368) | 59 | 100 % (93,9; 100) | 33960 (23890; 48274) | ||
MenC-CRM rokote | Kuukausi 1(1) | 68 | 98,5 % (92,1; 100) | 415 (297; 580) | 68 | 72,1 % (59,9; 82,3) | 21,2 (13,9; 32,3) | |
| Vuosi 4(2) | 10 | 80,0 % (44,4; 97,5) | 137 (22,6; 832) | 10 | 70,0 % (34,8; 93,3) | 91,9 (9,8; 859) | ||
| Vuosi 5(2) | 11 | 63,6 % (30,8; 89,1) | 26,5 (6,5; 107) | 11 | 90,9 % (58,7; 99,8) | 109 (21,2; 557) | ||
| Vuosi 10(3) (Ennen tehostetta) | 16 | 87,5 % (61,7; 98,4) | 86,7 (29,0; 259) | 15 | 93,3 % (68,1; 99,8) | 117 (40,0; 344) | ||
| (Tehosteen jälkeen)(3,4) | 16 | 100 % (79,4; 100) | 5793 (3631; 9242) | 15 | 100 % (78,2; 100) | 42559 (20106; 90086) | ||
| W-135 | Nimenrix | Kuukausi 1(1) | 222 | 100 % (98,4; 100) | 5395 (4870; 5976) | 177 | 79,7 % (73,0; 85,3) | 38,8 (29,7; 50,6) |
| Vuosi 4(2) | 45 | 60,0 % (44,3; 74,3) | 50,8 (24,0; 108) | 45 | 84,4 % (70,5; 93,5) | 76,9 (44,0; 134) | ||
| Vuosi 5(2) | 49 | 34,7 % (21,7; 49,6) | 18,2 (9,3; 35,3) | 46 | 82,6 % (68,6; 92,2) | 59,7 (35,1; 101) | ||
| Vuosi 10(3) (Ennen tehostetta) | 62 | 30,6 % (19,6; 43,7) | 15,8 (9,1; 27,6) | 52 | 44,2 % (30,5; 58,7) | 7,7 (4,9; 12,2) | ||
| (Tehosteen jälkeen)(3,4) | 62 | 100 % (94,2; 100) | 25911 (19120; 35115) | 62 | 100 % (94,2; 100) | 11925 (8716; 16316) | ||
| Y | Nimenrix | Kuukausi 1(1) | 222 | 100 % (98,4; 100) | 2824 (2529; 3153) | 201 | 66,7 % (59,7; 73,1) | 24,4 (18,6; 32,1) |
| Vuosi 4(2) | 45 | 62,2 % (46,5; 76,2) | 44,9 (22,6; 89,3) | 41 | 87,8 % (73,8; 95,9) | 74,6 (44,5; 125) | ||
| Vuosi 5(2) | 49 | 42,9 % (28,8; 57,8) | 20,6 (10,9; 39,2) | 45 | 80,0 % (65,4; 90,4) | 70,6 (38,7; 129) | ||
| Vuosi 10(3) (Ennen tehostetta) | 62 | 45,2 % (32,5; 58,3) | 27,4 (14,7; 51,0) | 56 | 42,9 % (29,7; 56,8) | 9,1 (5,5; 15,1) | ||
| (Tehosteen jälkeen)(3,4) | 62 | 98,4 % (91,3; 100) | 7661 (5263; 11150) | 61 | 100 % (94,1; 100) | 12154 (9661; 15291) | ||
Immunogeenisuus tutkittiin yhden kuukauden ja viiden vuoden kohdalla ATP-kohorteissa sekä tehosterokotus-ATP-kohortissa. Koehenkilöiden, joilla oli suboptimaalinen vaste meningokokkiryhmää C vastaan (määriteltiin ennalta määriteltyä määritysrajaa pienemmäksi SBA-titteriksi), oli tarkoitus saada lisäannos MenC-rokotetta ennen 6. vuotta. Nämä koehenkilöt jätettiin pois 4. ja 5. vuoden analyyseistä, mutta otettiin mukaan 10. vuoden analyysiin.
- Tutkimus MenACWY-TT-027
- Tutkimus MenACWY-TT-032
- Tutkimus MenACWY-TT-100
- Verinäytteet otettiin 10. vuonna 1 kuukausi tehosteannoksesta.
*rSBA tutkittu GSK:n laboratorioissa 1 kuukauden ensisijaisten rokotusnäytteiden osalta ja PHE-laboratorioissa Isossa-Britanniassa sen jälkeisten näytteiden osalta
** hSBA tutkittu GSK:n laboratorioissa ja Neomed-laboratoriossa Kanadassa MenACWY-TT-100-tutkimuksen ajankohtien osalta.
Tehostevasteen säilyminen
Tutkimus MenACWY-TT-102 arvioi SBA-tittereiden säilymistä kuuteen vuoteen asti tutkimuksessa MenACWY-TT-048 Nimenrix- tai MenC-CRM197-tehosteannoksen saaneilla lapsilla, jotka alun perin saivat saman rokotteen 12-23 kuukauden iässä tutkimuksessa MenACWY-TT-039. Yksittäinen tehosteannos annettiin 4 vuotta ensimmäisen rokotuksen jälkeen. Tulokset esitetään taulukossa 7 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 7: rSBA- ja hSBA-titterit yhden Nimenrix-annoksen (tai MenC-CRM-annoksen) jälkeen 12-23 kuukauden ikäisillä lapsilla, säilyvyys 4 vuoteen saakka ja vaste 4 vuotta ensimmäisen annoksen jälkeen annettuun tehosteeseen, ja säilyvyys 6 vuoteen saakka tehosterokotuksen jälkeen (Tutkimukset MenACWY-TT-039/048/102)
| Meningokokkiryhmä | Rokoteryhmä | Ajankohta | rSBA* | hSBA** | ||||
| N | ≥8 (95% CI) | GMT (95% CI) | N | ≥8 (95% CI) | GMT (95% CI) | |||
| A | Nimenrix | Kuukausi 1(1) | 354 | 99,7% (98,4; 100) | 2205 (2008; 2422) | 338 | 77,2% (72,4; 81,6) | 19.0 (16,4; 22,1) |
Vuosi 4(2) (Ennen Nimenrix-tehostetta) | 212 | 74,5% (68,1; 80,2) | 112 (80,3; 156) | 187 | 28,9% (22,5; 35,9) | 4,8 (3,9; 5,9) | ||
| (Tehosteen jälkeen)(2,3) | 214 | 100% (98,3; 100) | 7173 (6389; 8054) | 202 | 99,5% (97,3; 100) | 1343 (1119; 1612) | ||
| 5 vuotta tehosteen jälkeen(4) | 137 | 89,8% (83,4; 94,3) | 229 (163; 322) | 135 | 53,3% (44,6; 62,0) | 13,2 (9,6; 18,3) | ||
| 6 vuotta tehosteen jälkeen(4) | 134 | 92,5% (86,7; 96,4) | 297 (214; 413) | 130 | 58,5% (49,5; 67,0) | 14,4 (10,5; 19,7) | ||
| C | Nimenrix | Kuukausi 1(1) | 354 | 99,7% (98,4; 100) | 478 (437; 522) | 341 | 98,5% (96,6; 99,5) | 196 (175; 219) |
Vuosi 4(2) (Ennen Nimenrix-tehostetta) | 213 | 39,9% (33,3; 46,8) | 12,1 (9,6; 15,2) | 200 | 73,0% (66,3; 79,0) | 31,2 (23,0; 42,2) | ||
| (Tehosteen jälkeen)(2,3) | 215 | 100% (98,3; 100) | 4512 (3936; 5172) | 209 | 100% (98,3; 100) | 15831 (13626; 18394) | ||
| 5 vuotta tehosteen jälkeen(4) | 137 | 80,3% (72,6; 86,6) | 66,0 (48,1; 90,5) | 136 | 99,3% (96,0; 100) | 337 (261; 435) | ||
| 6 vuotta tehosteen jälkeen(4) | 134 | 71,6% (63,2; 79,1) | 39,6 (28,6; 54,6) | 130 | 97,7% (93,4; 99,5) | 259 (195; 345) | ||
MenC-CRM -rokote | Kuukausi 1(1) | 121 | 97,5% (92,9; 99,5) | 212 (170; 265) | 116 | 81,9% (73,7; 88,4) | 40,3 (29,5; 55,1) | |
Vuosi 4(2) (Ennen MenC-CRM197-tehostetta) | 43 | 37,2% (23,0; 53,3) | 14,3 (7,7; 26,5) | 31 | 48,4% (30,2; 66,9) | 11,9 (5,1; 27,6) | ||
| (Tehosteen jälkeen)(2,3) | 43 | 100% (91,8; 100) | 3718 (2596; 5326) | 33 | 100% (89,4; 100) | 8646 (5887; 12699) | ||
| 5 vuotta tehosteen jälkeen(4) | 23 | 78,3% (56,3; 92,5) | 47,3 (19,0; 118) | 23 | 100% (85,2; 100) | 241 (139; 420) | ||
| 6 vuotta tehosteen jälkeen(4) | 23 | 65,2% (42,7; 83,6) | 33,0 (14,7; 74,2) | 23 | 95,7% (78,1; 99,9) | 169 (94,1; 305) | ||
| W-135 | Nimenrix | Kuukausi 1(1) | 354 | 100% (99,0; 100) | 2682 (2453; 2932) | 336 | 87,5% (83,5; 90,8) | 48,9 (41,2; 58,0) |
Vuosi 4(2) (Ennen Nimenrix-tehostetta) | 213 | 48,8% (41,9; 55,7) | 30,2 (21,9; 41,5) | 158 | 81,6% (74,7; 87,3) | 48,3 (36,5; 63,9) | ||
| (Tehosteen jälkeen)(2,3) | 215 | 100% (98,3; 100) | 10950 (9531; 12579) | 192 | 100% (98,1; 100) | 14411 (12972 ; 16010) | ||
| 5 vuotta tehosteen jälkeen(4) | 137 | 88,3% (81,7; 93,2) | 184 (130; 261) | 136 | 100% (97,3; 100) | 327 (276; 388) | ||
| 6 vuotta tehosteen jälkeen(4) | 134 | 85,8% (78,7; 91,2) | 172 (118; 251) | 133 | 98,5% (94,7; 99,8) | 314 (255; 388) | ||
| Y | Nimenrix | Kuukausi 1(1) | 354 | 100% (99,0; 100) | 2729 (2473; 3013) | 329 | 79,3% (74,5; 83,6) | 30,9 (25,8; 37,1) |
Vuosi 4(2) (Ennen Nimenrix-tehostetta) | 213 | 58,2% (51,3; 64,9) | 37,3 (27,6; 50,4) | 123 | 65,9% (56,8; 74,2) | 30,2 (20,2; 45,0) | ||
| (Tehosteen jälkeen)(2,3) | 215 | 100% (98,3; 100) | 4585 (4129; 5093) | 173 | 100% (97,9; 100) | 6776 (5961; 7701) | ||
| 5 vuotta tehosteen jälkeen(4) | 137 | 92,7% (87,0; 96,4) | 265 (191; 368) | 137 | 97,8% (93,7; 99,5) | 399 (321; 495) | ||
| 6 vuotta tehosteen jälkeen(4) | 134 | 94,0% (88,6; 97,4) | 260 (189; 359) | 131 | 97,7% (93,5; 99,5) | 316 (253; 394) | ||
Immunogeenisuus tutkittiin kunakin ajankohtana ATP-kohortissa.
- Tutkimus MenACWY-TT-039
- Tutkimus MenACWY-TT-048
- Verinäytteet otettiin 4. vuonna 1 kuukausi tehosteannoksesta
- Tutkimus MenACWY-TT-102
*rSBA tutkittu GSK:n laboratorioissa 1 kuukauden ensisijaisten rokotusnäytteiden osalta ja PHE-laboratorioissa Isossa-Britanniassa sen jälkeisten näytteiden osalta.
**hSBA tutkittu GSK:n laboratoroissa ja Neomed-laboratoriossa Kanadassa MenACWY-TT-102-tutkimuksen ajankohtien osalta.
Immunogeenisuus 2–10 vuoden ikäisillä lapsilla
Tutkimuksessa MenACWY-TT-081 Nimenrix-kerta-annoksen vasteen ryhmää C vastaan (94,8 % [95 % CI: 91,4; 97,1]) osoitettiin olevan vähintään samanarvoinen kuin toisen lisensioidun MenC-CRM-rokotteen vaste (95,7 % [95 % CI: 89,2; 98,8]). GMT-arvot olivat matalammat Nimenrix-ryhmässä (2795 [95 % CI: 2393; 3263]) kuin MenC-CRM-rokoteryhmässä (5292 [95 % CI: 3815; 7340]).
Tutkimuksessa MenACWY-TT-038 Nimenrix-kerta-annoksen vasteen neljää meningokokkiryhmää vastaan osoitettiin olevan vähintään samanarvoinen kuin lisensioidun ACWY-PS-rokotteen vaste, kuten taulukossa 8 esitetään.
Taulukko 8:rSBA*-titterit yhden Nimenrix-annoksen (tai ACWY-PS-annoksen) jälkeen 2–10-vuotiailla lapsilla (tutkimus MenACWY-TT-038)
| Meningokokkiryhmä | Nimenrix(1) | ACWY-PS-rokote(1) | ||||
| N | RV (95 % CI) | GMT (95 % CI) | N | RV (95 % CI) | GMT (95 % CI) | |
| A | 594 | 89,1 % (86,3; 91,5) | 6343 (5998; 6708) | 192 | 64,6 % (57,4; 71,3) | 2283 (2023; 2577) |
| C | 691 | 96,1 % (94,4; 97,4) | 4813 (4342; 5335) | 234 | 89,7 % (85,1; 93,3) | 1317 (1043; 1663) |
| W-135 | 691 | 97,4 % (95,9; 98,4) | 11543 (10873; 12255) | 236 | 82,6 % (77,2; 87,2) | 2158 (1815; 2565) |
| Y | 723 | 92,7 % (90,5; 94,5) | 10825 (10233; 11452) | 240 | 68,8 % (62,5; 74,6) | 2613 (2237; 3052) |
Immunogeenisuus tutkittiin ATP-kohortissa.
(1)Verinäytteet otettiin 1 kuukausi rokotuksen jälkeen
RV: Rokotevaste: Osuus tutkittavista, joilla
- rSBA-titteri ≥ 32, vaikka tutkittavat olleet alun perin seronegatiivisia (rokotusta edeltävä rSBA-titteri < 8)
- rSBA-titterin nousu vähintään 4‑kertaiseksi rokotuksen jälkeen rokotusta edeltävästä arvosta, vaikka tutkittavat olleet alun perin seropositiivisia (rokotusta edeltävä rSBA-titteri ≥ 8).
* rSBA tutkittu GSK:n laboratorioissa
SBA-tittereiden säilymistä tutkittiin lapsilla, jotka oli alun perin rokotettu tutkimuksessa MenACWY-TT-081, kuten taulukossa 9 esitetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 9: rSBA- ja hSBA-titterit 44 kuukauteen asti Nimenrix‑rokotuksen (tai MenC-CRM‑rokotuksen) jälkeen lapsilla, jotka olivat rokotushetkellä 2–10-vuotiaita (tutkimus MenACWY-TT-088)
| Meningo-kokki-ryhmä | Rokote-ryhmä | Ajan-kohta (kk) | rSBA* | hSBA** | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | |||
| A | Nimenrix | 32 | 193 | 86,5 % (80,9; 91,0) | 196 (144; 267) | 90 | 25,6 % (16,9; 35,8) | 4,6 (3,3; 6,3) |
| 44 | 189 | 85,7 % (79,9; 90,4) | 307 (224; 423) | 89 | 25,8 % (17,1; 36,2) | 4,8 (3,4; 6,7) | ||
| C | Nimenrix | 32 | 192 | 64,6 % (57,4; 71,3) | 34,8 (26,0; 46,4) | 90 | 95,6 % (89,0; 98,8) | 75,9 (53,4; 108) |
| 44 | 189 | 37,0 % (30,1; 44,3) | 14,5 (10,9; 19,2) | 82 | 76,8 % (66,2; 85,4) | 36,4 (23,1; 57,2) | ||
| MenC-CRM rokote | 32 | 69 | 76,8 % (65,1; 86,1) | 86,5 (47,3; 158) | 33 | 90,9 % (75,7; 98,1) | 82,2 (34,6; 196) | |
| 44 | 66 | 45,5 % (33,1; 58,2) | 31,0 (16,6; 58,0) | 31 | 64,5 % (45,4; 80,8) | 38,8 (13,3; 113) | ||
| W-135 | Nimenrix | 32 | 193 | 77,2 % (70,6; 82,9) | 214 (149; 307) | 86 | 84,9 % (75,5; 91,7) | 69,9 (48,2; 101) |
| 44 | 189 | 68,3 % (61,1; 74,8) | 103 (72,5; 148) | 87 | 80,5 % (70,6; 88,2) | 64,3 (42,7; 96,8) | ||
| Y | Nimenrix | 32 | 193 | 81,3 % (75,1; 86,6) | 227 (165; 314) | 91 | 81,3 % (71,8; 88,7) | 79,2 (52,5; 119) |
| 44 | 189 | 62,4 % (55,1; 69,4) | 78,9 (54,6; 114) | 76 | 82,9 % (72,5; 90,6) | 127 (78,0; 206) | ||
Immunogeenisuutta tutkittiin ATP-ryhmässä vasta-aineiden säilyvyyden osalta kussakin aikapisteessä.
* rSBA tutkittu PHE-laboratorioissa Isossa-Britanniassa
** hSBA tutkittu GSK:n laboratorioissa
hSBA-tittereiden säilymistä tutkittiin yhden vuoden kuluttua rokotuksesta iältään 6–10-vuotiailla lapsilla, jotka oli alun perin rokotettu MenACWY-TT-027-tutkimuksessa (taulukko 10) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 10: hSBA*-titterit yhden Nimenrix-annoksen (tai ACWY-PS-annoksen) jälkeen 6–10 vuoden ikäisillä lapsilla ja titterien säilyminen 1 vuosi rokotuksen jälkeen (tutkimukset MenACWY-TT-027/028)
| Meningo-kokki-ryhmä | Rokote-ryhmä | 1 kuukausi rokotuksesta (tutkimus MenACWY-TT-027) | 1 vuosi rokotuksesta (tutkimus MenACWY-TT-028) | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Nimenrix | 105 | 80,0 % (71,1; 87,2) | 53,4 (37,3; 76,2) | 104 | 16,3 % (9,8; 24,9) | 3,5 (2,7; 4,4) |
| ACWY-PS-rokote | 35 | 25,7 % (12,5; 43,3) | 4,1 (2,6; 6,5) | 35 | 5,7 % (0,7; 19,2) | 2,5 (1,9; 3,3) | |
| C | Nimenrix | 101 | 89,1 % (81,3; 94,4) | 156 (99,3; 244) | 105 | 95,2 % (89,2; 98,4) | 129 (95,4; 176) |
| ACWY-PS-rokote | 38 | 39,5 % (24,0; 56,6) | 13,1 (5,4; 32,0) | 31 | 32,3 % (16,7; 51,4) | 7,7 (3,5; 17,3) | |
| W-135 | Nimenrix | 103 | 95,1 % (89,0; 98,4) | 133 (99,9; 178) | 103 | 100 % (96,5; 100) | 257 (218; 302) |
| ACWY-PS-rokote | 35 | 34,3 % (19,1; 52,2) | 5,8 (3,3; 9,9) | 31 | 12,9 % (3,6; 29,8) | 3,4 (2,0; 5,8) | |
| Y | Nimenrix | 89 | 83,1 % (73,7; 90,2) | 95,1 (62,4; 145) | 106 | 99,1 % (94,9; 100) | 265 (213; 330) |
| ACWY-PS-rokote | 32 | 43,8 % (26,4; 62,3) | 12,5 (5,6; 27,7) | 36 | 33,3 % (18,6; 51,0) | 9,3 (4,3; 19,9) | |
Immunogeenisuutta tutkittiin ATP-ryhmän vasta-aineiden säilyvyyden osalta vuosi rokotuksen jälkeen.
hSBA-titteriä ei tutkittu 2 – < 6-vuotiailla lapsilla (rokotusajankohtana).
* hSBA tutkittu GSK:n laboratorioissa
SBA-titterit määritettiin 10 vuoden ajan lapsilla, jotka saivat tutkimuksessa MenACWY-TT-027 alun perin yhden Nimenrix- tai ACWY-PS-annoksen 2–10 vuoden iässä. SBA-tittereiden säilymistä tutkittiin kahdessa jatkotutkimuksessa: MenACWY-TT-032 (5. vuoteen asti) ja MenACWY-TT-100 (10. vuoteen asti). Tutkimuksessa MenACWY-TT-100 tutkittiin myös vastetta yhteen Nimenrix-tehosteannokseen 10 vuotta alun perin annetun Nimenrix- tai ACWY-PS-rokotuksen jälkeen. Tulokset esitetään taulukossa 11 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 11: rSBA- ja hSBA-titterit yhden Nimenrix-annoksen (tai ACWY-PS-annoksen) jälkeen 2–10-vuotiailla lapsilla, titterin säilyminen 10. vuoteen asti ja 10 vuoden kuluttua alun perin annetusta rokotuksesta annetun tehosteen jälkeen (tutkimukset MenACWY-TT-027/032/100)
| Meningo-kokki-ryhmä | Rokote-ryhmä | Ajankohta | rSBA* | hSBA** | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | |||
| A | Nimenrix | Kuukausi 1(1) | 225 | 100 % (98,4; 100) | 7301 (6586; 8093) | 111(5) | 81,1 % (72,5; 87,9) | 57,0 (40,3; 80,6) |
| Vuosi 5(2) | 98 | 90,8 % (83,3; 95,7) | 141 (98,2; 203) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 98 | 79,6 % (70,3; 87,1) | 107 (66,0; 174) | 90 | 41,1 % (30,8; 52,0) | 6,5 (4,8; 8,8) | ||
| Vuosi 10(3) (Ennen tehostetta) | 73 | 89,0 % (79,5; 95,1) | 96,3 (57,1; 163) | 62 | 33,9 % (22,3; 47,0) | 4,5 (3,3; 6,2) | ||
| (Tehosteen jälkeen)(3,4) | 74 | 95,9 % (88,6; 99,2) | 4626 (3041; 7039) | 73 | 100 % (95,1; 100) | 1213 (994; 1481) | ||
| ACWY-PS-rokote | Kuukausi 1(1) | 75 | 100 % (95,2; 100) | 2033 (1667; 2480) | 35(5) | 25,7 % (12,5; 43,3) | 4,1 (2,6; 6,5) | |
| Vuosi 5(2) | 13 | 15,4 % (1,9; 45,4) | 4,7 (3,7; 6,0) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 24 | 12,5 % (2,7; 32,4) | 5,8 (3,5; 9,6) | 21 | 33,3 % (14,6; 57,0) | 5,9 (3,0; 11,7) | ||
| Vuosi 10(3) (Ennen tehostetta) | 17 | 23,5 % (6,8; 49,9) | 8,0 (3,3; 19,3) | 17 | 29,4 % (10,3; 56,0) | 6,2 (2,4; 15,7) | ||
| (Tehosteen jälkeen)(3,4) | 17 | 100 % (80,5; 100) | 6414 (3879; 10608) | 17 | 100 % (80,5; 100) | 211 (131; 340) | ||
| C | Nimenrix | Kuukausi 1(1) | 225 | 100 % (98,4; 100) | 2435 (2106; 2816) | 107(5) | 89,7 % (82,3; 94,8) | 155 (101; 237) |
| Vuosi 5(2) | 98 | 90,8 % (83,3; 95,7) | 79,7 (56,0; 113) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 98 | 82,7 % (73,7; 89,6) | 193 (121; 308) | 97 | 93,8 % (87,0; 97,7) | 427 (261; 700) | ||
| Vuosi 10(3) (Ennen tehostetta) | 74 | 85,1 % (75,0; 92,3) | 181 (106; 310) | 73 | 91,8 % (83,0; 96,9) | 222 (129; 380) | ||
| (Tehosteen jälkeen)(3,4) | 74 | 100 % (95,1; 100) | 4020 (3319; 4869) | 71 | 100 % (94,9; 100) | 15544 (11735; 20588) | ||
| ACWY-PS-rokote | Kuukausi 1(1) | 74 | 100 % (95,1; 100) | 750 (555; 1014) | 38(5) | 39,5 % (24,0; 56,6) | 13,1 (5,4; 32,0) | |
| Vuosi 5(2) | 13 | 100 % (75,3; 100) | 128 (56,4; 291) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 24 | 79,2 % (57,8; 92,9) | 98,7 (42,2; 231) | 24 | 100 % (85,8; 100) | 235 (122; 451) | ||
| Vuosi 10(3) (Ennen tehostetta) | 17 | 76,5 % (50,1; 93,2) | 96,2 (28,9; 320) | 17 | 100 % (80,5; 100) | 99,1 (35,8; 274) | ||
| (Tehosteen jälkeen)(3,4) | 17 | 100 % (80,5; 100) | 15101 (7099; 32122) | 17 | 94,1 % (71,3; 99,9) | 44794 (10112; 198440) | ||
| W-135 | Nimenrix | Kuukausi 1(1) | 225 | 100 % (98,4; 100) | 11777 (10666; 13004) | 107(5) | 95,3 % (89,4; 98,5) | 134 (101; 178) |
| Vuosi 5(2) | 98 | 78,6 % (69,1; 86,2) | 209 (128; 340) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 98 | 73,5 % (63,6; 81,9) | 265 (155; 454) | 92 | 81,5 % (72,1; 88,9) | 62,5 (42,0; 93,1) | ||
| Vuosi 10(3) (Ennen tehostetta) | 74 | 68,9 % (57,1; 79,2) | 206 (109; 392) | 59 | 61,0 % (47,4; 73,5) | 17,5 (10,5; 29,2) | ||
| (Tehosteen jälkeen)(3,4) | 74 | 100 % (95,1; 100) | 27944 (22214; 35153) | 74 | 100 % (95,1; 100) | 6965 (5274; 9198) | ||
| ACWY-PS-rokote | Kuukausi 1(1) | 75 | 100 % (95,2; 100) | 2186 (1723; 2774) | 35(5) | 34,3 % (19,1; 52,2) | 5,8 (3,3, 9,9) | |
| Vuosi 5(2) | 13 | 0 % (0,0; 24,7) | 4,0 (4,0; 4,0) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 24 | 12,5 % (2,7; 32,4) | 7,6 (3.7; 15.6) | 23 | 30,4 % (13,2; 52,9) | 7,0 (2,9; 16,9) | ||
| Vuosi 10(3) (Ennen tehostetta) | 17 | 23,5 % (6,8; 49,9) | 15,4 (4,2; 56,4) | 15 | 26,7 % (7,8; 55,1) | 4,1 (2,0; 8,5) | ||
| (Tehosteen jälkeen)(3,4) | 17 | 94,1 % (71,3; 99,9) | 10463 (3254; 33646) | 15 | 100 % (78,2; 100) | 200 (101; 395) | ||
| Y | Nimenrix | Kuukausi 1(1) | 225 | 100 % (98,4; 100) | 6641 (6044; 7297) | 94(5) | 83,0 % (73,8; 89,9) | 93,7 (62,1; 141) |
| Vuosi 5(2) | 98 | 78,6 % (69,1; 86,2) | 143 (88,0; 233) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 98 | 71,4 % (61,4; 80,1) | 136 (82,6; 225) | 89 | 65,2 % (54,3; 75,0) | 40,3 (23,9; 68,1) | ||
| Vuosi 10(3) (Ennen tehostetta) | 74 | 67,6 % (55,7; 78,0) | 98,5 (54,3; 179) | 65 | 72,3 % (59,8; 82,7) | 35,7 (21,0; 60,6) | ||
| (Tehosteen jälkeen)(3,4) | 74 | 100 % (95,1; 100) | 7530 (5828; 9729) | 74 | 100 % (95,1; 100) | 11127 (8909; 13898) | ||
| ACWY-PS-rokote | Kuukausi 1(1) | 75 | 100 % (95,2; 100) | 1410 (1086; 1831) | 32(5) | 43,8 % (26,4; 62,3) | 12,5 (5,6; 27,7) | |
| Vuosi 5(2) | 13 | 7,7 % (0,2; 36,0) | 5,5 (2,7; 11.1) | n/a(6) | -- | -- | ||
| Vuosi 6(3) | 24 | 20,8 % (7,1; 42,2) | 11,6 (4,7; 28,7) | 24 | 25,0 % (9,8; 46,7) | 7,3 (2,7; 19,8) | ||
| Vuosi 10(3) (Ennen tehostetta) | 17 | 17,6 % (3,8; 43,4) | 10,2 (3,5; 30,2) | 14 | 35,7 % (12,8; 64,9) | 7,8 (2,5; 24,4) | ||
| (Tehosteen jälkeen)(3,4) | 17 | 100 % (80,5; 100) | 6959 (3637; 13317) | 17 | 100 % (80,5; 100) | 454 (215; 960) | ||
Immunogeenisuus tutkittiin kunakin ajankohtana ATP-kohortissa. Koehenkilöiden, joilla oli suboptimaalinen vaste meningokokkiryhmää C vastaan (määriteltiin ennalta määriteltyä määritysrajaa pienemmäksi SBA-titteriksi), oli tarkoitus saada lisäannos MenC-rokotetta ennen 6. vuotta. Nämä koehenkilöt jätettiin pois 5. vuoden analyysistä, mutta otettiin mukaan 6. ja 10. vuoden analyysiin.
- Tutkimus MenACWY-TT-027
- Tutkimus MenACWY-TT-032
- Tutkimus MenACWY-TT-100
- Verinäytteet otettiin 10. vuonna 1 kuukausi tehosteannoksen jälkeen.
- Sisältää 6 – < 11-vuotiaat lapset. hSBA:ta ei tutkittu 2- – < 6-vuotiailla lapsilla (rokotusajankohtana).
- Tutkimuksen MenACWY-TT-032 tutkimussuunnitelman mukaan hSBA:ta ei mitattu tässä ikäryhmässä 5. vuotena.
*rSBA tutkittu GSK:n laboratorioissa 1 kuukauden ensisijaisten rokotusnäytteiden osalta ja PHE-laboratorioissa Isossa-Britanniassa sen jälkeisten näytteiden osalta.
**hSBA tutkittu GSK:n laboratorioissa ja Neomed-laboratoriossa Kanadassa MenACWY-TT-100-tutkimuksen ajankohtien osalta.
Immunogeenisuus 11–17 vuoden ikäisillä nuorilla ja ≥ 18-vuotiailla aikuisilla
Kaksi kliinistä tutkimusta suoritettiin iältään 11–17-vuotiailla nuorilla (tutkimus MenACWY-TT-036) ja iältään 18–55-vuotiailla aikuisilla (tutkimus MenACWY-TT-035). Tutkimuksissa annettiin joko yksi annos Nimenrixiä tai yksi annos ACWY-PS-rokotetta.
Nimenrixin vasteen osoitettiin olevan immunologisesti vähintään samanarvoinen kuin ACWY-PS-rokotteen vaste, kuten esitetään taulukossa 12).
Taulukko 12: rSBA*-titterit Nimenrix- (tai ACWY-PS-) rokotteen kerta-annoksen jälkeen 11–17-vuotiailla nuorilla ja ≥ 18–55-vuotiailla aikuisilla (tutkimukset MenACWY-TT-035/036)
| Meningo-kokki-ryhmä | Rokote-ryhmä | Tutkimus MenACWY-TT-036 (11–17-vuotiaat)(1) | Tutkimus MenACWY-TT-035 (18–55-vuotiaat)(1) | ||||
| N | RV (95 % CI) | GMT (95 % CI) | N | RV (95 % CI) | GMT (95 % CI) | ||
| A | Nimenrix | 553 | 85,4 % (82,1; 88,2) | 5928 (5557; 6324) | 743 | 80,1 % (77,0; 82,9) | 3625 (3372; 3897) |
| ACWY-PS-rokote | 191 | 77,5 % (70,9; 83,2) | 2947 (2612; 3326) | 252 | 69,8 % (63,8; 75,4) | 2127 (1909; 2370) | |
| C | Nimenrix | 642 | 97,4 % (95,8; 98,5) | 13110 (11939; 14395) | 849 | 91,5 % (89,4; 93,3) | 8866 (8011; 9812) |
| ACWY-PS-rokote | 211 | 96,7 % (93,3; 98,7) | 8222 (6807; 9930) | 288 | 92,0 % (88,3; 94,9) | 7371 (6297; 8628) | |
| W-135 | Nimenrix | 639 | 96,4 % (94,6; 97,7) | 8247 (7639; 8903) | 860 | 90,2 % (88,1; 92,1) | 5136 (4699; 5614) |
| ACWY-PS-rokote | 216 | 87,5 % (82,3; 91,6) | 2633 (2299; 3014) | 283 | 85,5 % (80,9; 89,4) | 2461 (2081; 2911) | |
| Y | Nimenrix | 657 | 93,8 % (91,6; 95,5) | 14086 (13168; 15069) | 862 | 87,0 % (84,6; 89,2) | 7711 (7100; 8374) |
| ACWY-PS-rokote | 219 | 78,5 % (72,5; 83,8) | 5066 (4463; 5751) | 288 | 78,8 % (73,6; 83,4) | 4314 (3782; 4921) | |
Immunogeenisuus tutkittiin ATP-kohortissa.
- Verinäytteet otettiin 1 kuukausi rokotuksen jälkeen
RV: Rokotevasteeksi määriteltiin seuraavien koehenkilöiden osuus:
- alun perin seronegatiiviset potilaat (eli rSBA-titteri ennen rokotusta < 8), joiden rSBA-titterit ≥ 32
- alun perin seropositiiviset potilaat (eli rSBA-titteri ennen rokotusta ≥ 8), joiden rokotusta edeltävät rSBA-titterit vähintään nelinkertaistuivat rokotuksen jälkeen
* rSBA tutkittu GSK:n laboratorioissa
rSBA-titterit määritettiin 10 vuoden ajan koehenkilöillä, jotka saivat tutkimuksessa MenACWY-TT-036 alun perin rokotuksen yhdellä Nimenrix- tai ACWY-PS-annoksella 11–17 vuoden iässä. rSBA-tittereiden säilymistä tutkittiin kahdessa jatkotutkimuksessa: MenACWY-TT-043 (5. vuoteen asti) ja MenACWY-TT-101 (10. vuoteen asti). Tutkimuksessa MenACWY-TT-101 tutkittiin myös vastetta yhteen Nimenrix-tehosteannokseen 10 vuoden kuluttua alun perin annetun Nimenrix- tai ACWY-PS-rokotuksen jälkeen. Tulokset esitetään taulukossa 13.
Taulukko 13: rSBA*-titterit yhden Nimenrix-annoksen (tai ACWY-PS-annoksen) jälkeen 11–17 vuoden ikäisillä nuorilla, titterin säilyminen 10. vuoteen asti ja 10 vuoden kuluttua aluksi annetusta rokotuksesta annetun tehosterokotuksen jälkeen (tutkimukset MenACWY-TT-036/043/101)
| Meningokokkiryhmä | Aikapiste | Nimenrix | ACWY-PS-rokote | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Kuukausi 1(1) | 674 | 100 % (99,5; 100) | 5929 (5557; 6324) | 224 | 99,6 % (97,5; 100) | 2947 (2612; 3326) |
| Vuosi 3(2) | 449 | 92,9 % (90,1; 95,1) | 448 (381; 527) | 150 | 82,7 % (75,6; 88,4) | 206 (147; 288) | |
| Vuosi 5(2) | 236 | 97,5 % (94,5; 99,1) | 644 (531; 781) | 86 | 93,0 (85,4; 97,4) | 296 (202; 433) | |
| Vuosi 10(3) (Ennen tehostetta) | 162 | 85,2 % (78,8; 90,3) | 248 (181; 340) | 51 | 80,4 % (66,9; 90,2) | 143 (80,5; 253) | |
| (Tehosteen jälkeen)(3,4) | 162 | 100 % (97,7; 100) | 3760 (3268; 4326) | 51 | 100 % (93,0; 100) | 2956 (2041; 4282) | |
| C | Kuukausi 1(1) | 673 | 100 % (99,5; 100) | 13110 (11939; 14395) | 224 | 100 % (98,4; 100) | 8222 (6808; 9930) |
| Vuosi 3(2) | 449 | 91,1 % (88,1; 93,6) | 371 (309; 446) | 150 | 86,0 % (79,4; 91,1) | 390 (262; 580) | |
| Vuosi 5(2) | 236 | 88,6 % (83,8; 92,3) | 249 (194; 318) | 85 | 87,1 (78,0; 93,4) | 366 (224; 599) | |
| Vuosi 10(3) (Ennen tehostetta) | 162 | 90,1 % (84,5; 94,2) | 244 (182; 329) | 51 | 82,4 % (69,1; 91,6) | 177 (86,1; 365) | |
| (Tehosteen jälkeen)(3,4) | 162 | 100 % (97,7; 100) | 8698 (7391 10235) | 51 | 100 % (93,0; 100) | 3879 (2715; 5544) | |
| W-135 | Kuukausi 1(1) | 678 | 99,9 % (99,2; 100) | 8247 (7639; 8903) | 224 | 100 % (98,4; 100) | 2633 (2299; 3014) |
| Vuosi 3(2) | 449 | 82,0 % (78,1; 85,4) | 338 (268; 426) | 150 | 30,0 % (22,8; 38,0) | 16,0 (10,9; 23,6) | |
| Vuosi 5(2) | 236 | 86,0 % (80,9; 90,2) | 437 (324; 588) | 86 | 34,9 (24,9; 45,9) | 19,7 (11,8; 32,9) | |
| Vuosi 10(3) (Ennen tehostetta) | 162 | 71,6 % (64,0; 78,4) | 146 (97,6; 217) | 51 | 43,1 % (29,3; 57,8) | 16,4 (9,2; 29,4) | |
| (Tehosteen jälkeen)(3,4) | 162 | 100 % (97,7; 100) | 11243 (9367; 13496) | 51 | 100 % (93,0; 100) | 3674 (2354; 5734) | |
| Y | Kuukausi 1(1) | 677 | 100 % (99,5; 100) | 14087 (13168; 15069) | 224 | 100 % (98,4; 100) | 5066 (4463; 5751) |
| Vuosi 3(2) | 449 | 93,1 % (90,3; 95,3) | 740 (620; 884) | 150 | 58,0 % (49,7; 66,0) | 69,6 (44,6; 109) | |
| Vuosi 5(2) | 236 | 96,6 % (93,4; 98,5) | 1000 (824; 1214) | 86 | 66,3 (55,3; 76,1) | 125 (71,2; 219) | |
| Vuosi 10(3) (Ennen tehostetta) | 162 | 90,7 % (85,2; 94,7) | 447 (333; 599) | 51 | 49,0 % (34,8; 63,4) | 32,9 (17,1; 63,3) | |
| (Tehosteen jälkeen)(3,4) | 162 | 100 % (97,7; 100) | 7585 (6748; 8525) | 51 | 98,0 % (89,6; 100) | 3296 (1999; 5434) | |
Immunogeenisuutta tutkittiin ATP-ryhmässä kussakin aikapisteessä.
- Tutkimus MenACWY-TT-036
- Tutkimus MenACWY-TT-043
- Tutkimus MenACWY-TT-101
- Verinäytteet otettiin 10. vuonna 1 kuukausi tehosteannoksen jälkeen.
*rSBA tutkittu GSK:n laboratorioissa 1 kuukauden ensisijaisten rokotusnäytteiden osalta ja PHE-laboratorioissa Isossa-Britanniassa sen jälkeisten näytteiden osalta.
hSBA:n säilymistä arvioitiin 5. vuoteen asti rokotuksesta nuorilla ja aikuisilla, jotka oli alun perin rokotettu MenACWY-TT-052-tutkimuksessa, kuten taulukossa 14 esitetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 14: hSBA*-titterit yhden Nimenrix-annoksen jälkeen 11–25 vuoden ikäisillä nuorilla ja aikuisilla ja titterin säilyminen 5. vuoteen asti rokotuksen jälkeen (tutkimukset MenACWY-TT-052/059)
| Meningokokkiryhmä | Aikapiste | N | ≥ 8 (95 % CI) | GMT (95 % CI) | |
| A | kuukausi 1(1) | 356 | 82,0 % (77,6; 85,9) | 58,7 (48,6; 70,9) | |
| vuosi 1(2) | 350 | 29,1 % (24,4; 34,2) | 5,4 (4,5; 6,4) | ||
| vuosi 5(2) | 141 | 48,9 % (40,4; 57,5) | 8,9 (6,8; 11,8) | ||
| C | kuukausi 1(1) | 359 | 96,1 % (93,5; 97,9) | 532 (424; 668) | |
| vuosi 1(2) | 336 | 94,9 % (92,0; 97,0) | 172 (142; 207) | ||
| vuosi 5(2) | 140 | 92,9 % (87,3; 96,5) | 94,6 (65,9; 136) | ||
| W-135 | kuukausi 1(1) | 334 | 91,0 % (87,4; 93,9) | 117 (96,8; 141) | |
| vuosi 1(2) | 327 | 98,5 % (96,5; 99,5) | 197 (173; 225) | ||
| vuosi 5(2) | 138 | 87,0 % (80,2; 92,1) | 103 (76,3; 140) | ||
| Y | kuukausi 1(1) | 364 | 95,1 % (92,3; 97,0) | 246 (208; 291) | |
| vuosi 1(2) | 356 | 97,8 % (95,6; 99,0) | 272(237; 311) | ||
| vuosi 5(2) | 142 | 94,4 % (89,2; 97,5) | 225 (174; 290) |
Immunogeenisuutta tutkittiin ATP-ryhmässä vasta-aineiden säilyvyyden osalta kussakin aikapisteessä.
- Tutkimus MenACWY-TT-052
- Tutkimus MenACWY-TT-059
* hSBA tutkittu GSK:n laboratorioissa
rSBA-titterit määritettiin 10 vuoden ajan koehenkilöillä, jotka saivat tutkimuksessa MenACWY-TT-015 alun perin yhden Nimenrix- tai ACWY-PS-annoksen 11–55 vuoden iässä. rSBA-tittereiden säilymistä tutkittiin kahdessa jatkotutkimuksessa: MenACWY-TT-020 (5. vuoteen asti) ja MenACWY-TT-099 (10. vuoteen asti). Tutkimuksessa MenACWY-TT-099 tutkittiin myös vastetta yhteen Nimenrix-tehosteannokseen 10 vuotta alun perin annetun Nimenrix- tai ACWY-PS-rokotuksen jälkeen. Tulokset esitetään taulukossa 15.
| Taulukko 15: rSBA*-titterit yhden Nimenrix-annoksen (tai ACWY-PS-annoksen) jälkeen 11–55-vuotiailla nuorilla ja aikuisilla, titterin säilyminen 10. vuoteen asti ja 10 vuoden kuluttua alun perin annetusta rokotuksesta annetun tehosteen jälkeen (tutkimukset MenACWY-TT-015/020/099) | |||||||
| Meningokokki-ryhmä | Ajankohta | Nimenrix | ACWY-PS-rokote | ||||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Kuukausi 1(1) | 323 | 100 % (98,9; 100) | 4945 (4452, 5493) | 112 | 100 % (96,8, 100) | 2190 (1858, 2582) |
| Vuosi 4(2) | 43 | 95,3 % (84,2; 99,4) | 365 (226; 590) | 17 | 76,5 % (50,1; 93,2) | 104 (31,0; 351) | |
| Vuosi 5(2) | 51 | 84,3 % (71,4; 93,0) | 190 (108; 335) | 19 | 57,9 % (33,5; 79,7) | 37,0 (12,6; 109) | |
| Vuosi 10(3) (Ennen tehostetta) | 155 | 78,1 % (70,7; 84,3) | 154 (108; 219) | 52 | 71,2 % (56,9; 82,9) | 75,1 (41,4; 136) | |
| (Tehosteen jälkeen)(3,4) | 155 | 100 % (97,6; 100) | 4060 (3384; 4870) | 52 | 100 % (93,2; 100) | 3585 (2751; 4672) | |
| C | Kuukausi 1(1) | 341 | 99,7 % (98,4; 100) | 10074 (8700, 11665) | 114 | 100 % (96,8; 100) | 6546 (5048; 8488) |
| Vuosi 4(2) | 43 | 76,7 % (61,4; 88,2) | 126 (61.6; 258) | 17 | 41,2 % (18,4; 67,1) | 16,7 (5,7; 48,7) | |
| Vuosi 5(2) | 51 | 72,5 % (58,3; 84,1) | 78.5 (41.8; 147) | 18 | 38,9 % (17,3; 64,3) | 17,3 (6,0; 49,7) | |
| Vuosi 10(3) (Ennen tehostetta) | 154 | 90,9 % (85,2; 94,9) | 193 (141; 264) | 52 | 88,5 % (76,6; 95,6) | 212 (110; 412) | |
| (Tehosteen jälkeen)(3,4) | 155 | 100 % (97,6; 100) | 13824 (10840; 17629) | 52 | 98,1 % (89,7; 100) | 3444 (1999; 5936) | |
| W-135 | Kuukausi 1(1) | 340 | 99,7 % (98,4; 100) | 8577 (7615; 9660) | 114 | 100 % (96,8; 100) | 2970 (2439; 3615) |
| Vuosi 4(2) | 43 | 90,7 % (77,9; 97,4) | 240 (128; 450) | 17 | 17,6 % (3,8; 43,4) | 8,3 (3,6; 19,5) | |
| Vuosi 5(2) | 51 | 86,3 % (73,7; 94,3) | 282 (146; 543) | 19 | 31,6 % (12,6; 56,6) | 15,4 (5,7; 41,9) | |
| Vuosi 10(3) (Ennen tehostetta) | 154 | 71,4 % (63,6; 78,4) | 166 (107; 258) | 52 | 21,2 % (11,1; 34,7) | 10,9 (6,1; 19,3) | |
| (Tehosteen jälkeen)(3,4) | 155 | 100 % (97,6; 100) | 23431 (17351; 31641) | 52 | 98,1 % (89,7; 100) | 5793 (3586; 9357) | |
| Y | Kuukausi 1(1) | 340 | 100 % (98,9; 100) | 10315 (9317; 11420) | 114 | 100 % (96,8; 100) | 4574 (3864; 5414) |
| Vuosi 4(2) | 43 | 86,0 % (72,1; 94,7) | 443 (230; 853) | 17 | 47,1 % (23,0; 72,2) | 30,7 (9,0; 105) | |
| Vuosi 5(2) | 51 | 92,2 % (81,1; 97,8) | 770 (439; 1351) | 19 | 63,2 % (38,4; 83,7) | 74,1 (21,9; 250) | |
| Vuosi 10(3) (Ennen tehostetta) | 154 | 86,4 % (79,9; 91,4) | 364 (255; 519) | 52 | 61,5 % (47,0; 74,7) | 56,0 (28,8; 109) | |
| (Tehosteen jälkeen)(3,4) | 155 | 100 % (97,6; 100) | 8958 (7602; 10558) | 52 | 100 % (93,2; 100) | 5138 (3528; 7482) | |
Immunogeenisuus tutkittiin yhden kuukauden ja viiden vuoden kohdalla ATP-kohorteissa sekä tehosterokotus-ATP-kohortissa.
- Tutkimus MenACWY-TT-015
- Tutkimus MenACWY-TT-020
- Tutkimus MenACWY-TT-099
- Verinäytteet otettiin 10. vuonna 1 kuukausi tehosteannoksen jälkeen.
* rSBA tutkittu GSK:n laboratorioissa 1 kuukauden ensisijaisten rokotusnäytteiden osalta ja PHE-laboratorioissa Isossa-Britanniassa sen jälkeisten näytteiden osalta.
Toisessa tutkimuksessa (MenACWY-TT-085) Nimenrixin kerta-annos annettiin 194:lle vähintään 56‑vuotiaalle libanonilaiselle aikuiselle (133:lle iältään 56–65‑vuotiaalle ja 61:lle vähintään 65‑vuotiaalle). Niiden henkilöiden prosentuaalinen osuus, joilla rSBA-titteri (mitattu GSK:n laboratorioissa) oli ennen rokotusta ≥ 128, vaihteli välillä 45 % (ryhmä C) ja 62 % (ryhmä Y). Yhden kuukauden kuluttua rokotuksesta niiden henkilöiden prosentuaalinen osuus, joilla rSBA-titteri oli ≥ 128, vaihteli kaiken kaikkiaan välillä 93 % (ryhmä C) ja 97 % (ryhmä Y). Yli 65‑vuotiaiden alaryhmässä niiden henkilöiden prosentuaalinen osuus, joilla rSBA-titteri oli ≥ 128 1 kuukauden kuluttua rokotuksesta, vaihteli välillä 90 % (ryhmä A) ja 97 % (ryhmä Y).
Tehosteannoksen vaste tutkittavilla, jotka oli aikaisemmin rokotettu konjugoidulla Neisseria meningitidis-meningokokkirokotteella
Nimenrix-tehosterokotusta tutkittiin vähintään 12 kuukauden ikäisillä tutkittavilla, jotka oli aiemmin rokotettu monovalenttisella (MenC‑CRM) tai nelivalenttisella konjugoidulla meningokokkirokotteella (MenACWY‑TT). Vahva anamnestinen vaste havaittiin perusrokotteen antigeenille/-geeneille (ks. taulukot 6, 7, 11, 13 ja 15).
Nimenrix-vaste tutkittavilla, jotka oli aikaisemmin rokotettu Neisseria meningitidistä vastaan polysakkaridirokotteella
Tutkimuksessa MenACWY-TT-021 Nimenrixin immunogeenisuutta tutkittiin 4,5–34 vuoden ikäisillä henkilöillä siten, että toinen ryhmä sai Nimenrixin 30–42 kuukauden kuluttua ACWY-PS-rokotuksesta ja toinen iältään samanlainen ryhmä sai Nimenrixin ilman, että heitä olisi rokotettu millään meningokokkirokotteella viimeisten 10 vuoden aikana. Immuunivaste oli (rSBA-titteri ≥ 8) havaittavissa kaikille neljälle meningokokkiryhmälle kaikilla henkilöillä riippumatta aikaisemmasta meningokokkirokotuksista. rSBA GMT-arvot olivat merkittävästi matalammat henkilöillä, jotka olivat saaneet ACWY-PS-annoksen 30−42 kuukautta ennen Nimenrixiä. Sata prosenttia tutkittavista saavutti kuitenkin immuunivasteen (rSBA-titterit ≥ 8) kaikille meningokokkiryhmille (A, C, W-135, Y) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lapset (2–17 vuotta), joilla on anatominen tai funktionaalinen asplenia
Tutkimuksessa MenACWY-TT-084 verrattiin kahden Nimenrix-annoksen immuunivasteita 43:lla iältään 2–7-vuotiaalla henkilöllä, joilla oli anatominen tai funktionaalinen asplenia ja joille annokset annettiin 2 kuukauden välillä, vasteisiin 43 samanikäisellä henkilöllä, joilla pernan toiminta oli normaalia. Yhden kuukauden kuluttua ensimmäisestä rokoteannoksesta ja 1 kuukauden kuluttua toisesta annoksesta prosentuaalisesti yhtä monella henkilöllä näissä kahdessa ryhmässä rSBA-titterit olivat ≥ 8 ja ≥ 128 sekä hSBA-titterit ≥ 4 ja ≥ 8.
Immunogeenisuus 3 kuukauden ja 12 kuukauden iässä annettujen kahden Nimenrix-annoksen jälkeen
Tutkimuksessa C0921062 imeväiset saivat yhden perusrokotusannoksen 3 kuukauden iässä ja sen jälkeen tehosteannoksen 12 kuukauden iässä. Yksi perusrokotusannos 3 kuukauden iässä sai aikaan vahvat rSBA-titterit neljää meningokokkiryhmää vastaan mitattuna niiden henkilöiden prosentuaalisella osuudella, joiden rSBA-titteri oli ≥ 8, ja GMT-arvolla. Tehosteannos sai aikaan vahvat vasteet kaikkia neljää meningokokkiryhmää vastaan. Tulokset esitetään taulukossa 16.
| Taulukko 16: rSBA-titterit ennen 3 kuukauden ja 12 kuukauden iässä kahtena annoksena annettua rokotusta ja rokotuksen jälkeen (tutkimus C0921062) | ||||
| Meningokokki-ryhmä | Ajankohta | rSBA* | ||
| N | ≥ 8 (95 % CI) | GMT (95 % CI) | ||
| A | Ennen annosta 1 | 128 | 0,0 % (0,0; 2,8) | 4,0 (4,0; 4,0) |
| Annoksen 1 jälkeen(1) | 124 | 82,3 % (74,4; 88,5) | 54,7 (41,1; 72,9) | |
| Ennen tehostetta | 125 | 33,6 % (25,4; 42,6) | 9,9 (7,6; 13,0) | |
| Tehosteen jälkeen(1) | 128 | 100 % (97,2; 100) | 1818 (1498; 2207) | |
| C | Ennen annosta 1 | 128 | 4,7 % (1,7; 9,9) | 4,4 (4,0; 4,7) |
| Annoksen 1 jälkeen(1) | 124 | 91,1 % (84,7; 95,5) | 108 (81,3; 143) | |
| Ennen tehostetta | 125 | 64,8 % (55,8; 73,1) | 21,8 (16,1; 29,5) | |
| Tehosteen jälkeen(1) | 128 | 100 % (97,2; 100) | 1300 (1052; 1605) | |
| W | Ennen annosta 1 | 128 | 0,8 % (0,0; 4,3) | 4,1 (3,9; 4,3) |
| Annoksen 1 jälkeen(1) | 124 | 89,5 % (82,7; 94,3) | 202 (150; 274) | |
| Ennen tehostetta | 125 | 67,2 % (58,2; 75,3) | 21,7 (16,3; 28,9) | |
| Tehosteen jälkeen(1) | 128 | 100 % (97,2; 100) | 2714 (2233; 3299) | |
| Y | Ennen annosta 1 | 128 | 7,8 % (3,8; 13,9) | 5,0 (4,3; 5,8) |
| Annoksen 1 jälkeen(1) | 124 | 90,3 % (83,7; 94,9) | 187 (142; 248) | |
| Ennen tehostetta | 125 | 66,4 % (57,4; 74,6) | 24,5 (18,0; 33,4) | |
| Tehosteen jälkeen(1) | 128 | 100 % (97,2; 100) | 1667 (1394; 1994) | |
*rSBA tutkittu Health Security Agency (UKHSA) ‑laboratorioissa Isossa-Britanniassa
(1) verinäytteet otettiin 1 kuukauden kuluttua rokotuksesta
Taulukossa ei ole tietoja hSBA:n toissijaisesta päätetapahtumasta, koska tietoja on vähän.
Nimenrix-kerta-annoksen vaikutus
Alankomaat lisäsi Nimenrix-rokotteen vuonna 2018 kansalliseen rokotusohjelmaansa kerta-annoksena 14 kuukauden ikäisille taaperoille korvatakseen meningokokki C ‑konjugaattirokotteen. Vuonna 2018 aloitettiin myös 14–18-vuotiaiden nuorten täydennysrokotukset Nimenrix-kerta-annoksilla, mikä muodostui vuonna 2020 rutiiniksi ja siten taaperoita ja nuoria koskevaksi kansalliseksi rokotusohjelmaksi. Kahden vuoden kuluessa ryhmien C, W ja Y bakteerien aiheuttaman meningokokkitaudin ilmaantuvuus väheni 14–18-vuotiailla merkitsevästi 100 % (95 % CI: 14; 100), kaikissa rokotukseen oikeutetuissa ikäryhmissä 85 % (95 % CI: 32; 97) (suora vaikutus) ja rokottamattomissa ikäryhmissä 50 % (95 % CI: 28; 65) (epäsuora vaikutus). Nimenrix-rokotteen vaikutus perustui pääasiassa ryhmän W taudin vähenemiseen.
Farmakokinetiikka
Ei sovellettavissa.
Prekliiniset tiedot turvallisuudesta
Ei-kliiniset tutkimukset eivät tuoneet ilmi mitään erityistä riskiä ihmisille. Päätelmät perustuvat paikalliseen siedettävyyteen, akuutin ja toistuvan annostuksen toksisuus-, kehitys- ja lisääntymistoksisuus- ja hedelmällisyyskokeisiin.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
Sakkaroosi
Trometamoli
Liuotin:
Natriumkloridi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
4 vuotta.
Avaamaton injektiopullo säilyy 72 tuntia, kun sitä säilytetään lämpötilassa 0–2 °C tai 8–25 °C. Mainitun ajan kuluttua Nimenrix-valmiste pitää käyttää tai hävittää. Nämä tiedot on tarkoitettu ohjeeksi terveydenhuollon ammattilaisille vain siinä tapauksessa, että hyväksytystä lämpötilasta on poikettu tilapäisesti.
Käyttökuntoon saattamisen jälkeen:
Rokote on käytettävä pikaisesti käyttökuntoon saattamisen jälkeen. Vaikka viivyttämistä ei suositella, rokote säilyy käyttökuntoon saattamisen jälkeen 8 tuntia 30 °C:ssa. Jos rokotetta ei anneta 8 tunnin kuluessa käyttökuntoon saattamisesta, sitä ei saa antaa.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys: ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NIMENRIX injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
1 annos (2 neulaa) (63,70 €)
PF-selosteen tieto
Kuiva-aine injektiopullossa (tyypin I lasia), jossa korkki (butyylikumia), ja liuotin esitäytetyssä ruiskussa, jossa tulppa (butyylikumia).
Pakkauskoot 1 ja 10 neuloilla tai ilman neuloja.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen kuiva-aine tai kuiva-ainekakku.
Kirkas ja väritön liuotin.
Käyttö- ja käsittelyohjeet
Käyttökuntoon saattaminen: Esitäytetyn ruiskun liuottimen lisääminen kuiva-aineeseen
Nimenrix saatetaan käyttökuntoon lisäämällä esitäytetyn ruiskun koko sisältö (liuotin) injektiopulloon (kuiva-aine).
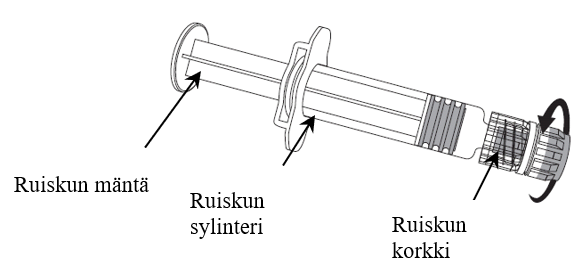
Neula kiinnitetään ruiskuun alla olevan kuvan mukaan. Nimenrix-ruisku saattaa kuitenkin olla hieman erilainen (ilman kierteitä) kuin kuvassa. Tässä tapauksessa neula kiinnitetään kiertämättä.
1. Pidä ruiskun sylinteri yhdessäkädessä (älä koske ruiskun mäntään), poista ruiskun korkki kiertämällä vastapäivään.
2. Kiinnitä neula ruiskuun kiertämällä neulaa myötäpäivään kunnes tunnet neulan lukittuvan ruiskuun.
3. Poista neulan suojus. Suojus voi joskus tuntua jäykältä.
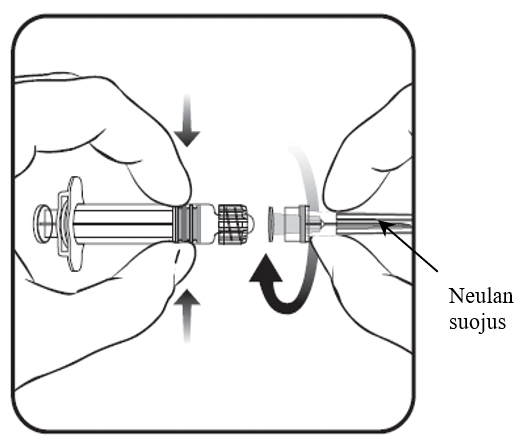
4. Lisää liuotin kuiva-aineeseen. Tämä jälkeen seosta ravistetaan hyvin kunnes kuiva-aine on täysin liuennut.
Käyttökuntoon saatettu rokote on kirkas ja väritön liuos.
Käyttökuntoon saatettu rokote tarkistetaan silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta ennen rokotteen antamista. Hävitettävä, jos jompaakumpaa havaitaan.
Rokote on käytettävä pikaisesti käyttökuntoon saattamisen jälkeen.
Rokotteen antamiseen käytetään toista neulaa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NIMENRIX injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
1 annos
- Ei korvausta.
ATC-koodi
J07AH08
Valmisteyhteenvedon muuttamispäivämäärä
24.10.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
