GAMMAGARD S/D infuusiokuiva-aine ja liuotin, liuosta varten
Vaikuttavat aineet ja niiden määrät
Ihmisen normaali immunoglobuliini (IVIg).
Ihmisen plasmaproteiinipitoisuus on 50 mg/ml, josta IgG:n osuus on vähintään 90 %.
Gammaglobuliinin alaluokat jakautuvat seuraavasti:
IgG1 ≥ 56,9%,
IgG2 ≥ 16,0 %,
IgG3 ≥ 3,3 %,
IgG4 ≥ 0,3 %
IgA pitoisuus: korkeintaan 3 mikrog/ml 50 mg/ml -liuoksessa.
Valmistettu ihmisen plasmasta.
Apuaineet: natriumkloridi, glukoosimonohydraatti
Täydellinen apuaineluettelo ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine ja liuotin, liuosta varten
Kliiniset tiedot
Käyttöaiheet
Korvaushoito aikuisille sekä lapsille ja nuorille (0–18v):
- Primaareissa immuunivajavuusoireyhtymissä, joihin liittyy alentunut vasta-aineiden tuotanto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Hypogammaglobulinemiassa ja toistuvissa bakteeri-infektioissa potilailla, joilla on krooninen lymfaattinen leukemia ja joilla antibioottiprofylaksi on epäonnistunut.
- Hypogammaglobulinemiassa ja toistuvissa bakteeri-infektioissa tasannevaiheen multippelia myeloomaa sairastavilla potilailla, joilla ei ole saatu vastetta pneumokokkirokotukseen.
- Hypogammaglobulinemiassa potilailla allogeenisen hematopoieettisen kantasolusiirron jälkeen.
- Synnynnäisessä AIDSissa, jossa toistuvia bakteeri-infektioita.
Immunomodulaatio aikuisille sekä lapsille ja nuorille (0–18v):
- Primaarissa idiopaattisessa trombosytopeenisessa purppurassa (ITP), kun on suuri vaara vuotoihin tai ennen leikkausta korjaamaan verihiutaleiden määrää
- Guillain-Barrén oireyhtymässä
- Kawasakin taudissa
Ehto
Valmistetta saadaan käyttää vain sairaaloissa ja sairaalassa aloitettuun jatkohoitoon.
Annostus ja antotapa
Korvaushoidon aloittaa ja sitä valvoo immuunivajavuuksien hoitoon perehtynyt lääkäri.
Annostus
Annos ja annostus riippuvat käyttöaiheesta.
Korvaushoidossa annos voidaan joutua määräämään potilaalle yksilöllisesti farmakokineettisen ja kliinisen vasteen mukaan. Seuraavat annostukset ovat vain ohjeellisia.
Primaarien immuunivajavuusoireyhtymien korvaushoito:
Hoidon tavoitteena on saavuttaa immunoglobuliinin pohja-arvo vähintään 5–6 g/l (mitattuna ennen seuraavaa infuusiota). Tasapainon saavuttaminen hoidon aloituksesta kestää 3–6 kuukautta. Suositeltu aloitusannos on 0,4–0,8 g /kg ja sen jälkeen vähintään 0,2 g/kg joka 3–4 viikon välein.
5–6 g/l pohja-arvoon tarvitaan 0,2–0,8 g/kg/kk. Kun vakaa tila on saavutettu, lääke annetaan 3–4 viikon välein.
Pohja-arvoa tulee mitata ja arvioida infektiotapauksissa. Jotta vähennetään infektioiden uusiutumisriskiä, voi olla välttämätöntä suurentaa annosta ja saada suuremmat pohja-arvot.
Hypogammaglobulinemia ja toistuvat bakteeri-infektiot potilailla, joilla on krooninen lymfaattinen leukemia ja joilla antibioottiprofylaksi on epäonnistunut; hypogammaglobulinemia ja toistuvat bakteeri-infektiot tasannevaiheen multippelia myeloomaa sairastavilla potilailla, joilla ei ole saatu vastetta pneumokokkirokotukseen;
lapset ja nuoret, joilla on synnynnäinen AIDS ja toistuvia bakteeri-infektioita:
Suositeltu annos on 0,2–0,4 g/kg 3–4 viikon välein.
Hypogammaglobulinemiapotilailla allogeenisen hematopoieettisen kantasolusiirron jälkeen:
Suositeltu annos on 0,2–0,4 g/kg 3–4 viikon välein. Pohja-arvojen tulee jatkuvasti ylittää 5 g/l.
Primaari immuunitrombosytopenia:
Hoitoaikatauluissa on kaksi vaihtoehtoa
- 0,8–1 g/kg ensimmäisenä päivänä; tämä hoito voidaan toistaa kerran kolmen vuorokauden aikana.
- 0,4 g/kg annettuna kerran vuorokaudessa 2–5 päivänä.
Hoito voidaan toistaa, jos sairaus uusiutuu.
Guillain–Barrén oireyhtymä:
0,4 g/kg/vrk 5 päivän ajan.
Kawasakin tauti:
1,6–2,0 g/kg useampana annoksena 2–5 päivän aikana tai 2,0 g/kg yhtenä annoksena. Potilaille pitää antaa samanaikaisesti asetyylisalisyylihappoa.
Annossuositukset ovat seuraavassa taulukossa:
| Käyttöaihe | Annos | Injektioiden tiheys |
Primaarin immuunivajavuuden korvaushoito | aloitusannos: 0,4 - 0,8 g/kg sen jälkeen: 0,2 - 0,8 g/kg | 3–4 viikon välein, kunnes IgG:n pohja-arvo on vähintään 5–6 g/l |
Sekundaarin immuunivajavuuden korvaushoito | 0,2 - 0,4 g/kg | 3–4 viikon välein, kunnes IgG:n pohja-arvo on vähintään 5–6 g/l |
AIDS-lapset ja -nuoret | 0,2 - 0,4 g/kg | 3–4 viikon välein |
| Hypergammaglobulinemia (<4 g/l) -potilailla allogeenisen hematopoieettisen kantasolusiirron jälkeen | 0,2 - 0,4 g/kg | 3–4 viikon välein, kunnes IgG:n pohja-arvo on vähintään 5 g/l |
| Immunomodulaatio: | ||
Primaari immuunitrombosytopenia | 0,8 - 1 g/kg | 1. päivänä, mahdollinen lisäannos kerran kolmen päivän aikana |
0,4 g/kg/vrk | 2 – 5 päivän ajan | |
| Guillain-Barrén oireyhtymä | 0,4 g/kg/vrk | 5 päivän ajan |
| Kawasakin tauti | 1,6 - 2,0 g/kg | useina annoksina 2–5 päivän ajan yhdessä asetyylisalisyylihapon kanssa |
| 2 g/kg | yksi annos yhdessä asetyylisalisyylihapon kanssa | |
Pediatriset potilaat
Lasten ja nuorten (0–18-vuotiaiden) annos ei eroa aikuisten annoksesta, koska kaikkien käyttöaiheiden annokset on annettu painon mukaan ja sairaustiloihin sopiviksi.
Antotapa
Laskimoon.
Jos mahdollista, Gammagard S/D 100 mg/ml annetaan kyynärtaipeen suoneen, jotta potilaasta ei tuntuisi pistoskohdassa epämukavalta.
Gammagard S/D 50 mg/ml (5 %) annetaan laskimoon alkunopeudella 0,5 ml/kg/tunti. Jos potilas sietää hoitoa hyvin, antonopeutta voidaan asteittain lisätä suurimpaan antonopeuteen, 4 ml/kg/tunti.
Potilaille, jotka sietävät Gammagard S/D 50 mg/ml annon infuusionopeudella 4 ml/kg/tunti, voidaan 100 mg/ml (10 %) infuusio antaa laskimoon alkunopeudella 0,5 ml/kg/tunti. Jos haittavaikutuksia ei ilmene, infuusionopeutta voidaan asteittain lisätä suurimpaan antonopeuteen 8 ml/kg/tunti.
Vasta-aiheet
Yliherkkyys tai tunnettu anafylaktinen reaktio valmisteen vaikuttavalle aineelle tai jollekin apuaineelle.
Yliherkkyys ihmisen immunoglobuliineille, kuten tapauksissa, jolloin potilaalla on IgA-vasta-aineita. Gammagard S/D -valmisteessa on vähän IgA:ta.
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
Gammagard S/D 50 mg/ml -valmisteessa on noin 20 mg/ml glukoosia. Tämä pitää ottaa huomioon erityisesti hoidettaessa potilaita, joilla on latentti diabetes (jossa voidaan havaita ajoittaista glukosuriaa), diabetes tai vähäsokerinen ruokavalio. Ks. alla munuaisiin liittyvät komplikaatiot.
Jotkut vakavat haittavaikutukset voivat liittyä infuusionopeuteen. Suositeltua infuusionopeutta, joka on annettu kohdassa Annostus ja antotapa, tulee ehdottomasti noudattaa. Potilasta tulee tarkkailla huolellisesti mahdollisten haittavaikutusten varalta koko infuusion ajan.
Joitakin haittavaikutuksia voi sattua useammin,
- jos infuusionopeus on suuri
- hypo- ja agammaglobulinemiapotilailla, mahdollisesti yhdessä IgA-puutoksen kanssa
-
immuunipuutospotilailla, jotka saavat ensimmäistä kertaa ihmisen normaalia immunoglobuliinia tai harvoin, kun ihmisen normaali immunoglobuliini -valmiste vaihdetaan toiseen tai edellisestä infuusiosta on kulunut pitkä aika
Mahdollisia komplikaatioita voidaan usein välttää
- varmistamalla etteivät potilaat ole herkkiä ihmisen normaalille immunoglobuliinille infusoimalla valmiste ensimmäisellä hoitokerralla hitaasti (0,5–1 ml/kg/tunti)
- tarkkailemalla potilaita huolellisesti mahdollisten haittavaikutusoireiden varalta koko infuusion ajan. Potilasta tulee tarkkailla huolella ensimmäisen infuusion aikana ja tunti sen jälkeen, jotta havaitaan mahdolliset haittavaikutukset, erityisesti kun potilaalle annetaan ensimmäisen kerran ihmisen normaalia immunoglobuliinia, vaihdettaessa ihmisen normaali immunoglobuliini-valmiste toiseen vaihtoehtoon, tai kun on kulunut pitkä aika edellisestä infuusiosta. Kaikkia muita potilaita tulee tarkkailla vähintään 20 minuuttia infuusion jälkeen.
Haittavaikutuksia havaittaessa joko infuusionopeutta on vähennettävä tai infuusio on lopetettava.
Tarvittava hoito riippuu haittavaikutusten laadusta ja vaikeudesta.
Sokin saanutta potilasta hoidetaan sokin yleisten hoito-ohjeiden mukaisesti.
IVIg-hoitoa annettaessa on tärkeää
- asianmukainen nesteytys ennen IVIg-infuusion aloitusta ja sen jälkeen virtsaerityksen seuranta
- plasman kreatiniinipitoisuuden seuranta
- samanaikaisten loop-diureettien käytön välttäminen
Yliherkkyys
Todelliset yliherkkyysreaktiot ovat harvinaisia. Niitä voi esiintyä hyvin harvoin, kun potilaalla on IgA-puutos ja anti-IgA-vasta-aineita.
Potilailla, joilla on IgA-vasta-aineita tai IgA-puutos, joka on osasyy primaariseen immuunivajavuussairauteen annettavaan IVIg-hoitoon, voi olla lisääntynyt anafylaktisen reaktion vaara. Anafylaksiaa on raportoitu Gammagard S/D-valmisteen käytön yhteydessä, vaikka valmisteen IgA-pitoisuus on matala (ks. kohta Haittavaikutukset). Potilaille, joilla on ollut vaikea yliherkkyysreaktio, tulee antaa Gammagard S/D -valmistetta erittäin varoen ja paikassa jossa on saatavilla henkeä uhkaavien reaktioiden varalta tarvittava hoito.
Varotoimet
Tromboembolia
Kliinisesti on osoitettu yhteys IVIg-hoidon (mukaan lukien Gammagard S/D) ja tromboembolisten haittavaikutusten välillä, mukaan lukien sydäninfarkti, aivoverenkierron häiriöt (esim. aivohalvaus), keuhkoveritulppa ja syvät laskimotromboosit. Tämän oletetaan liittyvän veren viskositeetin suurenemiseen, kun immunoglobuliinia infusoidaan laskimoon nopeasti.
Varovaisuutta on noudatettava määrättäessä ja infusoitaessa IVIg-valmistetta ylipainoisille potilaille ja potilaille, joilla on tromboottisten haittavaikutusten riskitekijöitä (kuten aikaisemmin diagnosoitu ateroskleroosi, lukuisat kardiovaskulaariset riskitekijät, korkea ikä, heikentynyt sydämen minuuttitilavuus, todettu tai epäilty hyperviskositeetti (esimerkiksi dehydraatio tai paraproteiinit), hyperkoagulaatiohäiriöt, pitkittyneet liikkumattomuusjaksot, liikalihavuus, diabetes mellitus, estrogeenien käyttö, keskussuonikatetri, suuret annokset ja nopea infuusio, hankinnainen tai perinnöllinen tromboositaipumus, todettu verisuonisairaus, aikaisemmin todettu tromboottinen tai tromboembolinen tapahtuma.) Tromboembolisia haittavaikutuksia voi ilmetä myös ilman tunnettuja riskitekijöitä.
IVIg-valmisteet tulee antaa hitaimmalla käytössä olevalla infuusionopeudella minimiannoksina potilaille, joilla vaarana voi olla tromboemboliset haittavaikutukset.
Munuaisiin liittyvät komplikaatiot
Vakavia munuaishaittavaikutuksia on raportoitu potilailla, jotka saavat IVIg-hoitoa. Useimmissa tapauksissa altistavana tekijänä on ollut esimerkiksi aiempi munuaisten vajaatoiminta, diabetes mellitus, nestevajaus, ylipaino, sepsis, hyperviskositeetti, veren runsasproteiinisuus, samanaikainen nefrotoksisten lääkkeiden käyttö tai yli 65 vuoden ikä.
Kun munuaisten toiminta on heikentynyt, joudutaan harkitsemaan IVIg-hoidon keskeyttämistä.
Muita vaikeita haittavaikutuksia on raportoitu IVIg-hoidon aikana. Näitä ovat akuutti munuaisten vajaatoiminta (raportoitu Gammagard S/D-valmisteen käytön yhteydessä), akuutti munuaistiehyiden kuolio, proksimaalinen munuaistiehyiden neuropatia ja osmoottinen nefroosi.
Munuaisten toiminnan heikkenemistä ja akuutista munuaisten vajaatoiminnasta on raportoitu useita eri apuaineita, kuten sakkaroosia, glukoosia ja maltoosia, sisältäviä IVIg-valmisteita käytettäessä. Näitä haittavaikutuksia on esiintynyt suhteellisesti enemmän sakkaroosia stabiloivana aineena sisältävien valmisteiden yhteydessä.
Riskipotilaille voidaan harkita IVIg-valmisteita, joissa ei ole sakkaroosia. Gammagard S/D -valmisteessa ei ole sakkaroosia eikä maltoosia.
IVIg-valmisteet tulee antaa hitaimmalla käytössä olevalla infuusionopeudella minimiannoksina potilaille, joilla vaarana voi olla akuutti munuaisten vajaatoiminta.
Verensiirtoon liittyvä akuutti keuhkovaurio (TRALI)
IVIg -valmisteita saaneilla potilailla on raportoitu keuhkopöhöä (TRALI), joka ei ole sydänperäinen.
Aseptinen aivokalvontulehduksen oireyhtymä
Aseptisen aivokalvontulehduksen oireyhtymää (aseptic meningitis syndrome AMS) on raportoitu IVIg-valmisteen (mukaan lukien Gammagard S/D) käytön yhteydessä.
IVIg-hoidon keskeyttäminen saattaa lieventää tätä oireyhtymää joiden päivien kuluessa. Oireyhtymä alkaa tavallisesti IVIg-valmisteen antamisen jälkeen joidenkin tuntien - kahden vuorokauden kuluessa.
- Selkäydinnesteen tutkimustulokset ovat usein solupositiivisia, runsassoluisia, useampia tuhansia soluja/mm3. Pääasiallisesti solut ovat granulosyyttejä ja proteiinipitoisuus on suurentunut useaan mg/ml (useaan sataan mg/dl).
- Aseptinen aivokalvontulehduksen oireyhtymä voi esiintyä useammin naispotilailla.
Hemolyyttinen anemia
IVIg-hoidon seurauksena voi kehittyä hemolyyttistä anemiaa. Gammagard S/D-valmisteeessa on veriryhmien vasta-aineita, jotka voivat toimia hemolysiineinä ja in vivo saavat aikaan punasolujen peittymisen (RBC) immunoglobuliineilla , aiheuttaen positiivisen suoran antiglobuliinireaktion (suora Coombsin koe). Viivästynyt hemolyyttinen anemia voi kehittyä Gammagard –hoidon jälkeen lisääntyneen punasolujen sekvestraation takia; intravaskulaarisen hemolyysin kanssa yhdenmukaista akuuttia hemolyysia on raportoitu. Seuraavat riskitekijät voivat liittyä hemolyysin kehittymiseen: suuret annokset (kerta-annos tai useille päiville jaettu annos) ja ei-O-veriryhmä.
Taustalla oleva tulehdustila voi kasvattaa hemolyysiriskiä yksittäisellä potilaalla, mutta sen rooli on epävarma.
IVIg-valmisteita saavia potilaita tulee tarkkailla hemolyysin oireiden varalta.
Selektiivinen IgA puute
Gammagard S/D ei ole indikoitu potilaille, joilla selektiivinen IgA puute on ainoa poikkeavuus.
Runsasproteiinisuus
IVIg-hoitoa saavilla potilailla voi olla runsaasti proteiineja veressä ja seerumin viskositeetti voi suurentua.
Natriumin saanti
Tämä lääkevalmiste sisältää 668 mg natriumia per injektiopullo (10 g), joka vastaa 34 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Suurin vuorokausiannos lisää merkittävästi natriumin määrää vähänatriumisessa ruokavaliossa ja on otettava huomioon hoidettaessa potilaita, joilla on vähänatriuminen ruokavalio. Gammagard S/D -valmiste sisältää 0,85 % NaCl, tai keskimäärin 3340 mg natriumia litrassa 5 % pitoisuudessa. 70 kilogrammaa painava potilas saisi annostuksella 1 g/kg (1,4 l) 4676 mg natriumia.
Infektioiden aiheuttajien siirtyminen
Gammagard S/D valmistetaan ihmisen plasmasta. Kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkkeitä, käytössä on vakiomenetelmiä infektioiden aiheuttajien siirtymisen estämiseksi. Luovuttajat valitaan tarkoin, ja yksittäisistä luovutuksista ja plasmapooleista seulotaan infektioiden erityiset tunnusmerkit ja valmistuksessa virusten inaktivoinnissa/poistamisessa käytetään tehokkaita menetelmiä. Varotoimista huolimatta infektioiden aiheuttajien siirtymismahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös tuntemattomia ja uusia viruksia ja muita taudinaiheuttajia.
Näitä menetelmiä pidetään tehokkaina vaipallisia viruksia, kuten ihmisen immuunikatovirus (HIV), hepatiitti B-virus (HBV) ja hepatiitti C-virus (HCV), sekä vaipattomia viruksia, kuten hepatiitti A-virus (HAV) ja parvovirus B19, vastaan.
Kliinisen kokemuksen perusteella hepatiitti A ja parvovirus B19 eivät siirry immunoglobuliinien välityksellä. Valmisteen sisältämät vasta-aineet vaikuttanevat myös merkittävästi sen turvallisuuteen virustartuntojen suhteen.
On hyvin tärkeää aina Gammagard S/D-valmistetta annettaessa merkitä valmisteen nimi ja erä potilasasiakirjoihin, jotta ne ovat tiedossa tarvittaessa.
Vaikutus serologisiin koetuloksiin
Immunoglobuliini-infuusion jälkeen joidenkin passiivisesti siirtyneiden vasta-aineiden lyhytaikainen lisääntyminen potilaan veressä voi aiheuttaa harhaanjohtavia positiivisia tuloksia serologisissa kokeissa, esim. hepatiitti A ja B, tuhkarokko ja vesirokko.
Vasta-aineiden passiivinen siirtyminen erytrosyyttiantigeeneihin, esim. A, B, D, voi vaikuttaa joihinkin punasolujen allovasta-aineiden (esim. Coombsin koe, DAT), retikulosyytti- ja haptoglobiinimäärityksen tuloksiin.
Gammagard S/D-valmisteen anto voi aiheuttaa vääriä positiivisia tuloksia testeissä, jotka perustuvat beeta-D-glukaanien tunnistamiseen sieni-infektioita diagnosoitaessa. Vaikutus voi jatkua infuusiota seuraavien viikkojen ajan.
Yhteisvaikutukset
Elävistä, heikennetyistä viruksista valmistetut rokotteet
Immunoglobuliinivalmisteiden anto voi heikentää elävien heikennettyjen virusrokotteiden, kuten tuhkarokko, vihurirokko, sikotauti ja vesirokko, tehoa vähintään 6 viikosta jopa 3 kuukauteen. Gammagard S/D -valmisteen antamisen jälkeen on odotettava kolme kuukautta ennen kuin eläviä heikennettyjä viruksia sisältäviä rokotteita annetaan potilaille. Tuhkarokkorokotteen ollessa kyseessä immunoglobuliinien tehoa heikentävä vaikutus voi kestää jopa vuoden. Sen vuoksi potilaille, joille annetaan tuhkarokkorokote, on suoritettava vasta-aineiden määritys.
Pediatriset potilaat
Gammagard S/D -valmisteella ei ole tutkittu yhteisvaikutuksia lapsilla.
Raskaus ja imetys
Raskaus
Gammagard S/D-valmisteen turvallisuutta ihmisille raskauden aikana ei ole osoitettu valvotuissa kliinisissä kokeissa ja siksi sitä pitäisi antaa varoen raskaana oleville ja imettäville naisille. On osoittautunut, että raskaana oleville naisille annettu IVIg-valmiste läpäisee istukan. Istukan läpäisevyys on suurin kolmannen trimesterin aikana. Immunoglobuliinien käytöstä saatujen kliinisten kokemusten perusteella oletetaan, että immunoglobuliinien aiheuttamia haittavaikutuksia raskauden aikana tai sikiölle tai vastasyntyneelle ei ole odotettavissa.
Imetys
Immunoglobuliinit erittyvät maitoon ja voivat auttaa suojaamaan vastasyntynyttä niitä patogeeneja vastaan, jotka tunkeutuvat limakalvon kautta.
Fertiliteetti
Immunoglobuliineista saadut kliiniset kokemukset viittaavat siihen, ettei haitallisia vaikutuksia hedelmällisyyteen ole odotettavissa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ajokyky tai koneiden käyttökyky voi olla huonontunut joidenkin Gammagard S/D -valmisteen mahdollisten haittavaikutusten takia. Haittavaikutuksia kokevien potilaiden tulee odottaa niiden häviämistä ennen ajamista tai koneiden käyttämistä.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Annettaessa ihmisen normaaleja immunoglobuliineja laskimoon on havaittu toisinaan haittavaikutuksia kuten vilunväreitä, päänsärkyä, huimausta, kuumetta, oksentelua, allergisia reaktioita, pahoinvointia, nivelkipua, matalaa verenpainetta ja keskivaikeaa alaselän kipua.
Ihmisen normaali immunoglobuliini voi harvoin aiheuttaa äkillistä verenpaineen laskua ja joissain yksittäisissä tapauksissa anafylaktisen sokin, vaikka potilas ei ollut yliherkkä aikaisemmalla antokerralla.
Ihmisen normaalin immunoglobuliinin käytön yhteydessä on havaittu tapauksia, joissa esiintyy korjaantuvaa (reversible) aseptista meningiittiä, ja harvoja tapauksia, joissa esiintyy ohimeneviä ihoreaktioita (myös ihon punahukkaa (cutaneous lupus erythematosus) – esiintymistiheisyys tuntematon). Ohimeneviä hemolyyttisiä reaktioita on tavattu, erityisesti A-, B- ja AB-veriryhmiin kuuluvilla potilailla. Jossakin harvassa tapauksessa on suuriannoksisen IVIg-hoidon jälkeen tarvittu hemolyyttisen anemian hoitoon verensiirto.
Plasman kreatiniinipitoisuuden suurenemista ja/tai munuaisten akuuttia vajaatoimintaa on esiintynyt.
Hyvin harvinaiset:
On havaittu tromboembolisia tapauksia, kuten sydäninfarkti, aivohalvaus, keuhko-veritulppa ja syvä laskimotukos.
Kliininen kokemus on osoittanut IVIg -annon mahdollisen yhteyden tromboottisten tapausten kehittymiseen. Tarkka syy on tuntematon, siksi on noudatettava varovaisuutta määrättäessä ja annettaessa IVIg -valmistetta potilaille, jotka ovat alttiita tai joilla on /on ollut sydän- ja verenkiertosairauksia tai tromboottisia sairauksia. Suuri infuusionopeus voi altistaa tromboottisille haittavaikutuksille.
Haittavaikutusten esiintyvyys taulukossa
Haittavaikutukset ovat kussakin luokassa vaikeimmista lievimpiin.
Esiintyvyys on arvioitu seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) Gammagard S/D -valmisteen haittavaikutukset | ||
MedDRA-järjestelmän elinluokitus | MedDRA:n mukainen haittavaikutus | Esiintyvyysluokka* |
Infektiot | influenssa | melko harvinainen |
| aseptinen meningiitti | tuntematon | |
Veri ja imukudos | hemolyysi, anemia, trombosytopenia, imusolmukesairaus | tuntematon |
Immuunijärjestelmä | anafylaktiset tai anafylaktoidiset reaktiot, anafylaktinen sokki, yliherkkyys | tuntematon |
Aineenvaihdunta ja ravitsemus | ruokahaluttomuus | melko harvinainen |
Psyykkiset häiriöt | ahdistus, kiihtymys | melko harvinainen |
levottomuus | tuntematon | |
Hermosto | päänsärky | yleinen |
uneliaisuus | melko harvinainen | |
aivohalvaus, ohimenevä aivoverenkiertohäiriö, kouristukset, migreeni, huimaus, tuntoharha ja tuntohäiriö, pyörtyminen, vapina, keskushermoston verenpurkaumat | tuntematon | |
Silmät | sumentunut näkö | melko harvinainen |
verkkokalvon verisuonen tukkeuma, näköhäiriö, silmäkipu, valonarkuus | tuntematon | |
Sydän | sydämen tykytys | melko harvinainen |
sydäninfarkti, syanoosi, takykardia, bradykardia | tuntematon | |
Verisuonisto | punastelu | yleinen |
| verenpaineen muutokset | melko harvinainen | |
valtimotukos, onttolaskimotukos, syvä laskimotukos, laskimotukkotulehdus, matala verenpaine, korkea verenpaine, kalpeus | tuntematon | |
Hengityselimet, rintakehä ja välikarsina | hengenahdistus, nenäverenvuoto | melko harvinainen |
keuhkoveritulppa, keuhkopöhö, hapenpuute, keuhkoputkien kouristus, hengityksen vinkuminen, hyperventilointi, karhea kurkku, yskä | tuntematon | |
Ruoansulatuselimistö | oksentelu, pahoinvointi | yleinen |
ripuli, suutulehdus, ylävatsakipu, epämukava olo vatsassa | melko harvinainen | |
vatsakipu, dyspepsia | tuntematon | |
Maksa ja sappi | maksatulehdus (ei tarttuva) | tuntematon |
Iho ja ihonalainen kudos | nokkosihottuma, kutina, kylmä hiki, voimakas hikoilu, | melko harvinainen |
angioneuroottinen edeema, ihotulehdus, punoitus, ihottuma | tuntematon | |
Luusto, lihakset ja sidekudos | selkäkipu, lihaskouristukset, raajojen kipu | melko harvinainen |
nivelsärky, lihassärky | tuntematon | |
Munuaiset ja virtsatiet | munuaisten vajaatoiminta | tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | väsymys, vilunväreet, kuume | yleinen |
rintakipu, pahanolon tunne, kipu, epämukava tunne rinnassa, epätavallinen olo, kylmän tunne, kuuman tunne, influenssan kaltaiset oireet, pistoskohdan punoitus, infuusionesteen valuminen pistoskohdan suonen ulkopuolelle, pistoskohdan kipu | melko harvinainen | |
pistoskohdan reaktiot, voimattomuus, turvotus | tuntematon | |
Tutkimukset | verenpaineen nousu | melko harvinainen |
suoran Coombsin kokeen positiivinen tulos | tuntematon | |
*pohjautuu prosenttimäärään/infuusiot
Siirtyviä taudinaiheuttajia koskeva turvallisuus ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannos voi aiheuttaa nesteylikuormituksen ja veren hyperviskositeetin. Suurimmassa vaarassa ovat iäkkäät henkilöt ja munuaisten tai sydämen vajaatoimintaa sairastavat potilaat.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immunoseerumit ja immunoglobuliinit, ihmisen normaali immunoglobuliini, iv
ATC koodi: J06B A02
Ihmisen normaalissa immunoglobuliinissa on pääasiassa hyvin toimivaa immunoglobuliini G:tä (IgG), jossa on laaja spektri infektioiden aiheuttajien vasta-aineita.
Ihmisen normaalissa immunoglobuliinissa on immunoglobuliini G -vasta-aineita, joita on normaaliväestössä. Se valmistetaan tavallisesti vähintään 1000 luovuttajan plasmapoolista. Valmisteessa on immunoglobuliini G:n alaluokkia lähes samassa suhteessa kuin normaalissa ihmisen plasmassa. Riittävä määrä tätä lääkevalmistetta voi palauttaa epätavallisen pienet immunoglobuliini G -pitoisuudet normaaleiksi.
Muissa käyttöaiheissa kuin korvaushoidossa vaikutusmekanismia ei täysin tunneta, mutta niihin sisältyy immunomodulaarisia vaikutuksia.
Farmakokinetiikka
Gammagard S/D on heti laskimoon antamisen jälkeen täysin biologisesti käytettävissä saajan verenkierrossa. IgG jakaantuu suhteellisen nopeasti plasmaan ja ektravaskulaarinesteeseen. Tasapaino intra- ja ekstravaskulaaritilan välillä saavutetaan noin 3-5 vuorokauden kuluessa.
Gammagard S/D-valmisteen puoliintumisaika on noin 37,7 ± 15 vuorokautta. Tämä puoliintumisaika voi vaihdella eri potilailla, erityisesti primaareissa immuunivajavuustiloissa.
IgG ja IgG-kompleksit hajoavat retikuloendoteliaalijärjestelmän soluissa.
Prekliiniset tiedot turvallisuudesta
Gammagard S/D-valmisteen turvallisuus on osoitettu useissa (ei-kliinisissä) tutkimuksissa. Tavanomaisiin farmakologisiin turvallisuus- ja genotoksisuustutkimuksiin perustuvat (ei-kliiniset) tiedot eivät osoita mitään erityisiä riskejä ihmisille.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: Ihmisen albumiini (0,06 g/g IgG), glysiini, natriumkloridi, glukoosimonohydraatti, natriumhydroksidi ja suolahappo
Liuotin: Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Gammagard S/D -valmistetta ei saa sekoittaa muihin lääkevalmisteisiin. Suositellaan annettavaksi erillään muista lääkevalmisteista, joita potilas mahdollisesti saa.
Kestoaika
2 vuotta.
Liuotetun Gammagard S/D -valmisteen kemiallinen ja fysikaalinen säilyvyys on osoitettu 24 tunniksi 2–8 ºC:ssa. Mikrobiologiselta kannalta valmiste olisi käytettävä heti, muuten säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä normaalisti saa ylittää 24 tuntia 2 - 8 °C:ssa, ellei valmiste ole liuotettu aseptisissa valvotuissa ja validoiduissa oloissa.
Säilytys
Säilytä alle 25 °C.
Ei saa jäätyä, liuotinpullo voi särkyä
Säilytä injektiopullo ulkopakkauksessa. Herkkä valolle.
Älä käytä pakkaukseen merkityn viimeisen käyttöpäivämäärän jälkeen.
Ei lasten ulottuville eikä näkyville.
Liuotetun valmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GAMMAGARD S/D infuusiokuiva-aine ja liuotin, liuosta varten
5 g (529,05 €), 10 g (1025,04 €)
PF-selosteen tieto
Infuusiokuiva-aine ja liuotin ovat injektiopulloissa (tyyppi I lasia), joissa silikonoidut bromobutyylitulpat.
5 g ja 10 g pakkauksessa on liuotinpullo (96 ml, 192 ml), steriili siirtolaite ja steriili annostelulaite, jossa suodatin.
Gammagard S/D -valmisteen pakkauskoot ovat 5 g ja 10 g. Kaikkia pakkauskokoja ei mahdollisesti ole myynnissä.
Valmisteen kuvaus:
Gammagard S/D on kylmäkuivattu valkea tai hieman kellertävä jauhe/jauhekakku, eikä siinä ole nähtävissä vieraita hiukkasia.
Käyttö- ja käsittelyohjeet
Valmisteen liuottamiseen voi kulua kaikkiaan 30 minuuttia. Gammagard S/D -infuusioneste täytyy lämmittää ennen käyttöä huoneen- tai kehonlämpöiseksi.
Liuotettu valmiste on kirkas tai hieman opalisoiva ja väritön tai hieman kellertävä liuos. Älä käytä, jos liuos on samea tai siinä on saostumia.
Liuotetut valmisteet pitää tutkia silmämääräisesti ennen antoa hiukkasten tai värjäytymisen varalta.
Käyttämättä jäänyt osuus ja jäte on hävitettävä paikallisten hyväksyttyjen ohjeiden mukaisesti.
Liuottamisohjeet
Käytä aseptista tekniikkaa.
5 g ja 10 g pakkaukset
Varmistu, että sekä Gammagard S/D -infuusiokuiva-aine ja injektionesteisiin käytettävä vesi (liuotin) ovat huoneenlämpöisiä. Tämä lämpötila on tarpeen kunnes infuusiokuiva-aine on täysin liuennut.
A. 50 mg/ml (5 %) liuos
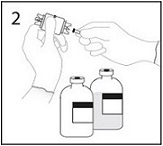
1. Poista molempien injektiopullojen suojakorkit ja desinfioi tulpat.
2. Poista suojus siirtolaitteen toisesta päästä. Älä koske kärkeen.
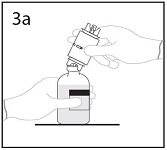
3a. Aseta liuotinpullo tasaiselle alustalle. Työnnä siirtolaitteen kärki liuotinpulloon tulpan keskiosan läpi.
Huom. Jos kärki ei mene tulpan läpi keskeltä tulppaa, tulppa voi siirtyä paikaltaan.
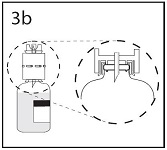
3b. Varmistu, että pullon suuosa on kunnollisesti siirtolaitteen sisällä painamalla siirtolaitetta lujasti alaspäin.
Samalla kun pidät siirtolaitteesta kiinni, poista suojus toisesta päästä. Älä koske kärkeen.
4. Pidä liuotinpulloa ja siinä kiinni olevaa siirtolaitetta kulma-asennossa infuusiokuiva-ainepulloon nähden, jotta liuotinta ei valu hukkaan.
Huom. Älä pidä liuotinpulloa ylösalaisin, koska tällöin liuotinta voi valua hukkaan.
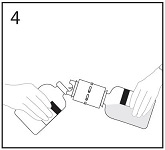
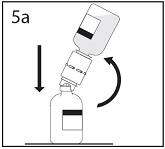
5a. Työnnä siirtolaitteen vapaa kärki infuusiokuiva-ainepullon tulpan läpi kohtisuoraan keskeltä tulppaa ja käännä vesipullo nopeasti ylösalaisin infuusiokuiva-ainepullon yläpuolelle jotta liuotinta ei valu hukkaan.
HUOM. Jos kärki ei mene infuusiokuiva-ainepullon tulpan läpi keskeltä tulppaa, tulppa voi siirtyä paikaltaan ja pullon alipaine hävitä.
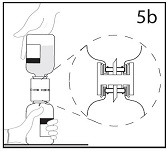
5b. Varmistu, että infuusiokuiva-ainepullon suuosa on täysin siirtolaitteen sisällä painamalla lujasti liuotinpulloa, jossa on siirtolaite, alaspäin.
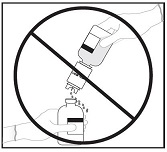
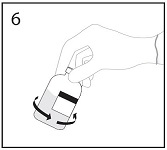
6. Kun kaikki liuotin on infuusiokuiva-ainepullossa, irrota siirtolaite ja tyhjä liuotinpullo. Pyörittele heti pulloa varovasti, jotta sisältö sekoittuu kunnolla.
HUOM. Älä ravista pulloa. Vältä vaahtoamista.
Hävitä kertakäyttöinen siirtolaite kertakäytön jälkeen.
B. 100 mg/ml (10 %) liuos
1. Poista molempien injektiopullojen suojakorkit ja desinfioi tulpat.
2. Kun valmistetaan 100 mg/ml (10 %) liuos pitää puolet liuottimen määrästä poistaa. Taulukossa on liuotinmäärät, jotka poistetaan liuotinpullosta ennen siirtolaitteen liittämistä liuotinpulloon 100 mg/ml (10 %) liuoksen valmistamiseksi. Käytä aseptista tekniikkaa. Vedä ylimääräinen liuotin injektioneulan avulla ruiskuun. Hävitä ruisku liuottimineen.
3. Käytä liuotinpulloon jäänyt liuotin, noudata kohtia 2-6 aiemmasta A-kohdasta.
 |  |  |
 |  | |
 |  |  |
TAULUKKO Poistettava liuotinmäärä | ||
Infuusiokuiva-aine | 5 g pakkaus | 10 g pakkaus |
50 mg/ml (5 %) liuos | Älä poista liuotinta lainkaan | |
100 mg/ml (10 %) liuos | 48 ml | 96 ml |
VALMISTEEN ANTAMINEN – käytä aseptista tekniikkaa
5 g ja 10 g pakkauskoot
Noudata pakkauksessa olevan letkuston käyttöohjetta. Jos käytetään jotain muuta annostelulaitetta valmisteen antamiseen, pitää varmistua että siinä on samanlainen suodatin.
Korvattavuus
GAMMAGARD S/D infuusiokuiva-aine ja liuotin, liuosta varten
5 g, 10 g
- Ei korvausta.
ATC-koodi
J06BA02
Valmisteyhteenvedon muuttamispäivämäärä
28.04.2023
Yhteystiedot
 TAKEDA OY
TAKEDA OY PL 1406, Ilmalankuja 3
00101 Helsinki
0800 774 051
www.takeda.fi
etunimi.sukunimi@takeda.com
