QDENGA injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Käyttökuntoon saattamisen jälkeen yksi annos (0,5 ml) sisältää:
Dengueviruksen serotyyppi 1 (elävä, heikennetty)*: ≥ 3,3 log10 PFU**/annos
Dengueviruksen serotyyppi 2 (elävä, heikennetty)#: ≥ 2,7 log10 PFU**/annos
Dengueviruksen serotyyppi 3 (elävä, heikennetty)*: ≥ 4,0 log10 PFU**/annos
Dengueviruksen serotyyppi 4 (elävä, heikennetty)*: ≥ 4,5 log10 PFU**/annos
*Tuotettu Vero-soluissa yhdistelmä-DNA-tekniikalla. Serotyyppispesifisten pintaproteiinien geenejä, jotka on valmistettu tyypin 2 denguen runkoon. Tämä tuote sisältää muuntogeenisiä organismeja (GMO).
#Tuotettu Vero-soluissa yhdistelmä-DNA-teknologian avulla
**PFU = plakkia muodostavat yksiköt
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Qdenga on tarkoitettu denguetaudin ehkäisyyn vähintään 4-vuotiaille henkilöille.
Qdenga-valmistetta on käytettävä virallisten suositusten mukaisesti.
Annostus ja antotapa
Annostus
Vähintään 4-vuotiaat henkilöt
Qdenga annetaan 0,5 ml:n annoksena, kahden annoksen (0 ja 3 kuukauden) aikataulun mukaisesti.
Tehostusannoksen tarvetta ei ole osoitettu.
Muut lapsipotilaat (alle 4-vuotiaat lapset)
Qdenga-valmisteen turvallisuutta ja tehoa alle 4-vuotiaiden lasten hoidossa ei ole vielä varmistettu.
Saatavissa olevat tiedot on kuvattu kohdassa Haittavaikutukset, mutta suositusta annostuksesta ei voida antaa.
Iäkkäät
Annosta ei ole tarpeen mukauttaa iäkkäämpien, vähintään 60-vuotiaiden henkilöiden hoidossa. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Antotapa
Kun kylmäkuivattu rokote on saatettu kokonaan käyttökuntoon liuottimella, Qdenga on annettava ihonalaisena injektiona, mieluiten olkavarteen hartialihaksen alueelle.
Qdenga-valmistetta ei saa antaa verisuoneen, ihon sisään tai lihakseen.
Rokotetta ei saa sekoittaa samassa ruiskussa minkään muiden rokotteiden tai muiden parenteraalisten lääkevalmisteiden kanssa.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet Qdenga-valmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai yliherkkyys aiemmalle Qdenga-annokselle.
- Henkilöt, joilla on synnynnäinen tai hankinnainen immuunivajavuus, mukaan lukien ne, jotka ovat saaneet immunosuppressiivisia hoitoja, kuten suuriannoksisia systeemisiä kortikosteroideja (esim. 20 mg/vrk tai 2 mg/kg/vrk prednisonia vähintään 2 viikon ajan) rokotusta edeltäneiden 4 viikon aikana, tai mitä tahansa muita lääkevalmisteita, joilla tiedetään olevan immunosuppressiivisia ominaisuuksia, kuten solunsalpaajia. Rokotuksen lykkäyksen pituus immunosuppressiivisen hoidon jälkeen on harkittava yksilöllisesti.
- Henkilöt, joilla on oireellinen HIV-infektio tai oireeton HIV-infektio, johon liittyy näyttöä heikentyneestä immuunijärjestelmän toiminnasta.
- Raskaana olevat naiset (ks. kohta Raskaus ja imetys).
- Imettävät naiset (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yleiset suositukset
Anafylaksia
Anafylaksiaa on raportoitu henkilöillä, jotka ovat saaneet Qdenga-valmistetta. Kuten kaikkien injektiona annettavien rokotteiden kohdalla, asianmukainen lääketieteellinen hoito ja valvonta on aina oltava nopeasti saatavilla rokotteen annon jälkeisen harvinaisen anafylaktisen reaktion varalta.
Sairaushistoriaan tutustuminen
Ennen rokottamista on tutustuttava henkilön sairaushistoriaan (erityisesti aikaisempiin rokotuksiin ja mahdollisiin rokotusten jälkeen ilmenneisiin yliherkkyysreaktioihin).
Samanaikainen sairaus
Qdenga-rokotusta on lykättävä henkilöillä, joilla on akuutti vaikea kuumetauti. Lievän infektio, kuten flunssa, ei edellytä rokotuksen lykkäämistä.
Rokotteen tehon rajoitukset
Suojaavaa immuunivastetta kaikkia dengueviruksen serotyyppejä vastaan ei välttämättä saavuteta kaikilla Qdenga-valmisteella rokotetuilla henkilöillä, ja immuunivaste saattaa heiketä ajan myötä (ks. kohta Farmakodynamiikka). Tällä hetkellä ei tiedetä, voiko suojauksen puute johtaa denguen vaikeusasteen lisääntymiseen. Rokottamisen jälkeen on suositeltavaa edelleen suojautua hyttysten pistoilta. Henkilöiden on hakeuduttava lääkärin hoitoon, jos heillä ilmenee denguen oireita tai denguesta varoittavia merkkejä.
Ei ole olemassa tietoja Qdenga-valmisteen käytöstä yli 60-vuotiaille ja on olemassa vain vähän tietoja käytöstä potilaille, joilla on pitkäaikaissairauksia.
Ahdistukseen liittyvät reaktiot
Ahdistukseen liittyviä reaktioita, kuten vasovagaalisia reaktioita (pyörtyminen), hyperventilaatiota tai stressiin liittyviä reaktioita saattaa esiintyä rokotuksen yhteydessä psykogeenisenä vasteena neulanpistolle. On tärkeää huolehtia varotoimista, jotta rokotettava ei voi vahingoittaa itseään pyörtyessään.
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on vältettävä raskautta vähintään yhden kuukauden ajan rokotuksen jälkeen, kuten muidenkin elävien heikennettyjen rokotteiden kohdalla (ks. kohdat Raskaus ja imetys ja Vasta-aiheet).
Muuta
Qdenga-valmistetta ei saa missään tapauksessa antaa suonensisäisenä, ihonsisäisenä tai lihaksensisäisenä injektiona.
Apuaineet
Qdenga sisältää alle 1 mmol (23 mg) natriumia annosta kohden, eli sen voidaan sanoa olevan ”natriumiton”.
Qdenga sisältää kaliumia alle 1 mmol (39 mg) per annos eli sen voidaan sanoa olevan ”kaliumiton”.
Yhteisvaikutukset
On suositeltavaa, että immunoglobluliineja tai immunoglobuliineja sisältäviä verivalmisteita, kuten verta tai plasmaa, saaneiden potilaiden kohdalla odotetaan hoidon lopettamisen jälkeen vähintään 6 viikkoa, mieluiten 3 kuukautta, ennen Qdenga-valmisteen antoa, jotta estetään rokotteen sisältämien heikennettyjen virusten neutraloituminen.
Qdenga-valmistetta ei pidä antaa henkilöille, jotka saavat immunosuppressiivisia hoitoja, kuten suuriannoksisia systeemisiä kortikosteroideja rokotusta edeltäneiden 4 viikon sisällä, tai mitä tahansa muita lääkevalmisteita, joilla tiedetään olevan immunosuppressiivisia ominaisuuksia, kuten solunsalpaajia (ks. kohta Vasta-aiheet). Rokotuksen lykkäyksen pituus immunosuppressiivisen hoidon jälkeen on harkittava yksilöllisesti.
Käyttö muiden rokotteiden kanssa
Jos Qdenga-valmistetta annetaan samanaikaisesti toisen pistettävän rokotteen kanssa, rokotteet on aina annettava eri injektiokohtiin.
Qdenga-valmistetta voi antaa samanaikaisesti hepatiitti A -rokotteen kanssa. Samanaikaista antoa aikuisilla on tutkittu.
Qdenga-valmistetta voi antaa samanaikaisesti keltakuumerokotteen kanssa. Noin 300 aikuisen tutkittavan kliinisessä tutkimuksessa annettiin Qdenga-valmistetta samanaikaisesti 17D-keltakuumerokotteen kanssa, eikä sillä ollut vaikutusta keltakuumeen serosuojaukseen. Denguevasta-ainevasteet vähenivät Qdenga-valmisteen ja 17D-keltakuumerokotteen samanaikaisen annon jälkeen. Tämän kliinistä merkitystä ei tunneta.
Qdenga-valmistetta voi antaa samanaikaisesti HPV eli papilloomavirusrokotteen kanssa (ks. kohta Farmakodynamiikka).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, pitää välttää raskautta vähintään yhden kuukauden ajan rokotuksen jälkeen. Naisia, jotka aikovat tulla raskaaksi, on neuvottava lykkäämään rokotusta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Vasta-aiheet).
Raskaus
Lisääntymistoksisuutta koskevat eläinkokeet ovat riittämättömiä (ks. kappale Prekliiniset tiedot turvallisuudesta).
On olemassa vain vähän tietoja Qdenga-valmisteen käytöstä raskaana olevilla naisilla. Ei ole riittävästi tietoja, jotta voitaisiin tehdä johtopäätöksiä Qdenga-valmisteen mahdollisista vaikutuksista raskauteen, alkion ja sikiön kehitykseen, synnytykseen tai synnytyksen jälkeiseen kehitykseen.
Qdenga on eläviä heikennettyjä viruksia sisältävä rokote, ja siksi Qdenga on vasta-aiheinen raskauden aikana (ks. kohta Vasta-aiheet).
Imetys
Ei tiedetä, erittyykö Qdenga ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voi poissulkea.
Qdenga on vasta-aiheinen imetyksen aikana (ks. kohta Vasta-aiheet).
Hedelmällisyys
Lisääntymistoksisuutta koskevat eläinkokeet ovat riittämättömiä (ks. kappale Prekliiniset tiedot turvallisuudesta).
Ihmisten hedelmällisyyttä koskevia erillisiä tutkimuksia ei ole tehty.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Qdenga-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kliinisissä tutkimuksissa yleisimmin raportoidut reaktiot 4–60-vuotiailla tutkittavilla olivat injektiokohdan kipu (50 %), päänsärky (35 %), lihaskipu (31 %), injektiokohdan punoitus (27 %), huonovointisuus (24 %), heikkous (20 %) ja kuume (11 %).
Näitä haittavaikutuksia ilmeni yleensä 2 päivän kuluessa injektiosta, ja ne olivat vaikeusasteeltaan lieviä tai kohtalaisia ja lyhytkestoisia (1–3 päivää) sekä niitä ilmeni harvemmin toisen Qdenga-injektion jälkeen kuin ensimmäisen injektion jälkeen.
Rokoteviremia
Kliinisessä tutkimuksessa DEN-205 havaittiin ohimenevää rokoteviremiaa Qdenga-rokotuksen jälkeen 49 prosentilla tutkimukseen osallistujista, joilla ei ollut aiemmin dengue-infektiota, ja 16 prosentilla tutkimukseen osallistujista, joilla oli ollut aiemmin dengue-infektio. Rokoteviremia alkoi yleensä toisella viikolla ensimmäisen injektion jälkeen, ja sen keskimääräinen kesto oli 4 päivää. Rokoteviremiaan liittyi joillakin tutkittavilla ohimeneviä, lieviä tai kohtalaisia oireita, joita voi esiintyä myös denguekuumeen yhteydessä, kuten päänsärkyä, nivelkipua, lihaskipua ja ihottumaa. Rokoteviremiaa havaittiin harvoin toisen annoksen jälkeen.
Dengue-infektion diagnostiset testit saattavat olla positiivisia rokoteviremian aikana eikä niitä voida käyttää erottamaan rokoteviremiaa villityypin dengue-infektiosta.
Haittavaikutustaulukko
Kliinisistä tutkimuksissa ja myyntiluvan myöntämisen jälkeen raportoidut Qdenga-valmisteen liitetyt haittavaikutukset on taulukoitu alla (taulukko 1).
Alla esitetty turvallisuusprofiili perustuu lumelääkekontrolloiduista kliinisistä tutkimuksista ja myyntiluvan myöntämisen jälkeen saatuihin tietoihin. Yhdistetty analyysi kliinisistä tutkimuksista sisälsi 14 627 Qdenga-valmisteella rokotettua tutkimukseen osallistunutta henkilöä, jotka olivat iältään 4–60-vuotiaita (13 839 lasta ja 788 aikuista). Tähän sisältyi 3 830 henkilön (3 042 lasta ja 788 aikuista) reaktogeenisuuden alaryhmä.
Ilmoitetut haittavaikutukset on lueteltu seuraavien esiintymistiheyksien mukaisesti:
Hyvin yleinen: ≥1/10
Yleinen: ≥1/100...<1/10
Melko harvinainen: ≥1/1 000...<1/100
Harvinainen: ≥1/10 000...<1/1 000
Hyvin harvinainen: <1/10 000
Tuntematon: koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin
Taulukko 1: Kliinisissä tutkimuksissa (ikä 4–60 vuotta) ja myyntiluvan myöntämisen jälkeen (ikä vähintään 4 vuotta) ilmenneet haittavaikutukset
| MedDRA-elinjärjestelmäluokka | Esiintymistiheys | Haittavaikutukset |
| Infektiot | Hyvin yleinen | Ylähengitystieinfektioa |
| Yleinen | Nasofaryngiitti Faryngotonsilliittib | |
| Melko harvinainen | Bronkiitti Nuha | |
| Veri ja imukudos | Hyvin harvinainen | Trombosytopeniac |
| Immuunijärjestelmä | Tuntematon | Anafylaktinen reaktio, mukaan lukien anafylaktinen sokkic |
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Ruokahalun heikkeneminend |
| Psyykkiset häiriöt | Hyvin yleinen | Ärtyneisyysd |
| Hermosto | Hyvin yleinen | Päänsärky Uneliaisuusd |
| Melko harvinainen | Heitehuimaus | |
| Silmät | Tuntematon | Silmäkipuc |
| Ruoansulatuselimistö | Melko harvinainen | Ripuli Pahoinvointi Vatsakipu Oksentelu |
| Iho ja ihonalainen kudos | Melko harvinainen | Ihottumae Kutinaf Urtikaria |
| Hyvin harvinainen | Angioedeema | |
| Harvinainen | Petekiatc | |
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihaskipu |
| Yleinen | Nivelkipu | |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Injektiokohdan kipu Injektiokohdan punoitus Huonovointisuus Heikkous Kuume |
| Yleinen | Injektiokohdan turvotus Injektiokohdan mustelmaf Injektiokohdan kutinaf Influenssan kaltainen sairaus | |
| Melko harvinainen | Injektiokohdan verenvuotof Väsymysf Injektiokohdan värimuutoksetf |
a Sisältää ylähengitystieinfektion ja virusperäisen ylähengitystieinfektion
b Sisältää faryngotonsilliitin ja tonsilliitin
c Haittavaikutus havaittu myyntiluvan myöntämisen jälkeen
d Kerätty alle 6-vuotiailta lapsilta kliinisissä tutkimuksissa
e Sisältää ihottuman, virusihottuman, makulopapulaarisen ihottuman, kutinan
f Raportoitu aikuisilla kliinisissä tutkimuksissa
Pediatriset potilaat
Pediatriset tiedot 4–17-vuotiaista tutkittavista
Yhdistetyt turvallisuustiedot kliinisistä tutkimuksista ovat saatavilla 13 839 lapsesta (9 210 4–11-vuotiasta ja 4 629 12–17-vuotiasta). Tämä sisältää reaktogeenisuustiedot, jotka on kerätty 3 042 lapsesta (1 865 4–11-vuotiasta ja 1 177 12–17-vuotiasta).
Haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste lapsilla olivat suurelta osin samanlaisia kuin aikuisilla. Yleisemmin lapsilla kuin aikuisilla raportoidut haittavaikutukset olivat kuume (11 % vs. 3 %), ylähengitystieinfektio (11 % vs. 3 %), nasofaryngiitti (6 % vs. 0,6 %), faryngotonsilliitti (2 % vs. 0,3 %) ja influenssan kaltainen sairaus (1 % vs. 0,1 %). Harvemmin lapsilla kuin aikuisilla raportoidut haittavaikutukset olivat injektiokohdan punoitus (2 % vs. 27 %), pahoinvointi (0,03 % vs. 0,8 %) ja nivelkipu (0,03 % vs. 1 %).
Seuraavat reaktiot kerättiin 357:ltä alle 6-vuotiaalta lapselta, jotka rokotettiin Qdengalla:
vähentynyt ruokahalu (17 %), uneliaisuus (13 %) ja ärtyneisyys (12 %).
Pediatriset tiedot alle 4-vuotiailla tutkittavilla, ts. ikäindikaation ulkopuolella
Alle 4-vuotiaiden reaktogeenisuutta arvioitiin 78 tutkittavalla, jotka saivat vähintään yhden annoksen Qdenga-valmistetta ja joista 13 tutkittavaa sai ilmoitetun kahden annoksen hoito-ohjelman. Hyvin yleisiä reaktioita olivat ärtyneisyys (25 %), kuume (17 %), injektiokohdan kipu (17 %) ja ruokahaluttomuus (15 %). Uneliaisuutta (8 %) ja injektiokohdan punoitusta (3 %) raportoitiin yleisesti. Injektiokohdan turvotusta ei havaittu alle 4-vuotiailla tutkittavilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Rokotteet, virusrokotteet, ATC-koodi: J07BX04
Vaikutusmekanismi
Qdenga sisältää eläviä, heikennettyjä dengueviruksia. Qdenga-valmisteen ensisijainen vaikutusmekanismi on replikoitua paikallisesti ja saada aikaan humoraalisia ja soluvälitteisiä immuunivasteita neljää dengueviruksen serotyyppiä vastaan.
Kliininen teho
Qdenga-valmisteen kliinistä tehoa arvioitiin tutkimuksessa DEN-301, joka oli pivotaalinen vaiheen III kaksoissokkoutettu satunnaistettu lumelääkekontrolloitu tutkimus, joka suoritettiin viidessä maassa Latinalaisessa Amerikassa (Brasilia, Kolumbia, Dominikaaninen tasavalta, Nicaragua, Panama) ja kolmessa maassa Aasiassa (Sri Lanka, Thaimaa, Filippiinit). Yhteensä 20 099 lasta (ikä 4–16 vuotta) satunnaistettiin (suhde 2:1) saamaan Qdenga-valmistetta tai lumelääkettä aiemmasta dengueinfektiosta riippumatta.
Tehokkuutta arvioitiin aktiivisella seurannalla koko tutkimuksen keston ajan. Kuka tahansa tutkittava, jolla oli kuumetauti (määritelmän mukaan vähintään 38 °C:n kuume minä tahansa kahtena kolmesta peräkkäisestä päivästä), joutui käymään tutkimuskeskuksessa tutkijan tekemää denguekuumeen arviointia varten. Tutkittavia/huoltajia muistutettiin tästä vaatimuksesta vähintään kerran viikossa, jotta kaikki oireelliset virologisesti vahvistetut denguetapaukset (VCD) voitiin havaita mahdollisimman tehokkaasti. Febriiliepisodit vahvistettiin validoidulla kvantitatiivisella dengue-RT-PCR:llä tiettyjen dengueserotyyppien havaitsemiseksi.
Kliinistä tehoa koskevat tulokset 4–16-vuotiailla tutkittavilla
Rokotteen tehoa koskevat tulokset ensisijaisen päätetapahtuman (virologisesti vahvistettu denguekuume, joka esiintyy 30 päivän ja 12 kuukauden välillä toisen rokotuksen jälkeen) osalta on esitetty taulukossa 2. Protokollan mukaisen tutkimuspopulaation keskimääräinen ikä oli 9,6 vuotta (keskihajonta 3,5 vuotta), ja tutkittavista 12,7 % oli 4–5-vuotiaiden, 55,2 % 6–11-vuotiaiden ja 32,1 % 12–16-vuotiaiden ikäryhmissä. Näistä 46,5 % oli Aasiassa ja 53,5 % Latinalaisessa Amerikassa, 49,5 % naisia ja 50,5 % miehiä. Dengueserostatus lähtötilanteessa (ennen ensimmäistä injektiota) arvioitiin kaikilla tutkittavilla mikroneutralisaatiotestillä (MNT50), jotta rokotteen tehokkuutta voitiin arvioida lähtötilanteen serostatuksen perusteella. Lähtötilanteen dengue-seronegatiivisuusprosentti protokollan mukaisen analyysin kokonaispopulaatiossa oli 27,7 %.
Taulukko 2.Rokotteen teho minkä tahansa serotyypin aiheuttaman VCD-kuumeen ehkäisemisessä 30 päivän – 12 kuukauden kuluttua toisesta rokotuksesta tutkimuksessa DEN-301 (protokollan mukainen analyysi)a
| Qdenga N = 12 700b | Lumelääke N = 6 316b | |
| VCD-kuume, n (%) | 61 (0,5) | 149 (2,4) |
| Rokotteen teho (CI 95 %) (%) | 80,2 (73,3, 85,3) | |
| p-arvo | < 0,001 | |
CI: luottamusväli; n: kuumeisten tutkimushenkilöiden lukumäärä; VCD: virologisesti vahvistettu dengue
a Tehokkuustietojen ensisijainen analyysi perustui protokollan mukaiseen analyysiin, joka koostui kaikista satunnaistetuista tutkittavista, joilla ei ollut merkittäviä protokollan rikkomuksia, mukaan lukien ettei tutkittava saanut oikean Qdenga- tai lumelääkemääräyksen molempia annoksia.
b Arvioitujen tutkittavien määrä
Taulukossa 3 esitetään rokotteen tehoa kuvaavat toissijaisten päätetapahtumien VCD-kuumeen aiheuttaman sairaalahoidon tarpeen ehkäiseminen, VCD-kuumeen ehkäiseminen (serostatuksittain, serotyypeittäin) ja vaikean VCD-kuumeen ehkäiseminen. Vaikean VCD-kuumeen kohdalla tarkasteltiin kahdentyyppisiä päätetapahtumia: kliinisesti vaikeita VCD-tapauksia ja VCD-tapauksia, jotka täyttivät WHO:n vuoden 1997 dengueverenvuotokuumeelle (DHF) asettamat kriteerit. Tutkimuksessa DEN-301 käytetyt kriteerit riippumattoman ”Dengue Case severity Adjudication Committee” (DCAC) -komitean VCD:n vakavuuden arviointia varten perustuivat WHO:n vuoden 2009 ohjeisiin. DCAC arvioi kaikki VCD:stä johtuvat sairaalahoitotapaukset käyttäen ennalta määritettyjä kriteerejä, joihin kuului verenvuotopoikkeavuuden, plasmavuodon, maksan toiminnan, munuaisten toiminnan, sydämen toiminnan, keskushermoston ja sokin arviointi. Tutkimuksessa DEN-301 VCD-tapaukset, jotka täyttivät WHO:n vuoden 1997 dengueverenvuotokuumeelle asettamat kriteerit, tunnistettiin käyttäen ohjelmoitua algoritmia, ts. ilman lääketieteellistä harkintaa. Kriteereihin kuului yleisesti ottaen kuume, joka kesti 2–7 päivää, verenvuototaipumus, trombosytopenia ja näyttö plasmavuodosta.
Taulukko 3: Rokotteen teho VCD-kuumeen aiheuttaman sairaalahoidon tarpeen ehkäisemisessä, VCD-kuumeen ehkäisemisessä dengueserotyypeittäin, VCD-kuumeen ehkäisemisessä lähtötilanteen dengue-serostatuksittain ja vaikeiden dengue-muotojen ehkäisemisessä 30 päivästä 18 kuukauteen toisen rokotuksen jälkeen tutkimuksessa DEN-301 (protokollan mukainen analyysi)
Qdenga N = 12 700a | Lumelääke N = 6 316a | Rokotteen teho (CI 95 %) | |
| Rokotteen teho VCD-kuumeesta johtuvan sairaalahoidon tarpeen ehkäisemisessäb, n (%) | |||
| VCD-kuumeesta johtuvat sairaalahoidotc | 13 (0,1) | 66 (1,0) | 90,4 (82,6; 94,7)d |
| Rokotteen teho VCD-kuumeen ehkäisemisessä dengueserotyypeittäin, n (%) | |||
| DENV-1:n aiheuttama VCD-kuume | 38 (0,3) | 62 (1,0) | 69,8 (54,8; 79,9) |
| DENV-2:n aiheuttama VCD-kuume | 8 (< 0,1) | 80 (1,3) | 95,1 (89,9; 97,6) |
| DENV-3:n aiheuttama VCD-kuume | 63 (0,5) | 60 (0,9) | 48,9 (27,2; 64,1) |
| DENV-4:n aiheuttama VCD-kuume | 5 (< 0,1) | 5 (< 0,1) | 51,0 (–69,4; 85,8) |
| Rokotteen teho VCD-kuumeen ehkäisemisessä lähtötilanteen dengueserostatuksittain, n (%) | |||
| VCD-kuume kaikilla tutkittavilla | 114 (0,9) | 206 (3,3) | 73,3 (66,5; 78,8) |
| VCD-kuume lähtötilanteessa seropositiivisilla tutkittavilla | 75 (0,8) | 150 (3,3) | 76,1 (68,5; 81,9) |
| VCD-kuume lähtötilanteessa seronegatiivisilla tutkittavilla | 39 (1,1) | 56 (3,2) | 66,2 (49,1; 77,5) |
| Rokotteen teho minkä tahansa dengueserotyypin aiheuttaman DHF:n estämisessä, n (%) | |||
| Yhteensä | 2 (< 0,1) | 7 (0,1) | 85,9 (31,9; 97,1) |
| Rokotteen teho minkä tahansa dengueserotyypin aiheuttaman vakavan denguen estämisessä, n (%) | |||
| Yhteensä | 2 (< 0,1) | 1 (< 0,1) | 2,3 (–977,5; 91,1) |
CI: luottamusväli; n: tutkimushenkilöiden lukumäärä; VCD: virologisesti vahvistettu dengue; DENV: dengueviruksen serotyyppi
a Arvioitujen tutkittavien määrä
b Keskeinen toissijainen päätetapahtuma
c Suurin osa havaituista tapauksista johtui DENV-2:sta (0 tapausta Qdenga-valmistetta käyttävässä haarassa ja 46 tapausta lumelääkettä käyttävässä haarassa)
d p-arvo < 0,001
Suojan havaittiin alkavan varhain, ja eksploratiivinen rokotteen teho oli 81,1 % (95 %:n luottamusväli: 64,1 %, 90,0 %) kaikkien serotyyppien aiheuttamaa VCD-kuumetta vastaan ensimmäisestä rokotuksesta toiseen rokotukseen.
Pitkäaikainen suoja
Tutkimuksessa DEN-301 tehtiin useita eksploratiivisia analyysejä, joilla arvioitiin pitkäaikaista suojaa ensimmäisestä annoksesta aina 4,5 vuoteen toisen annoksen jälkeen (taulukko 4).
Taulukko 4: Rokotteen teho VCD-kuumeen ja sairaalahoidon tarpeen ehkäisemisessä yleisesti, lähtötilanteen dengueserostatuksen mukaan ja eri serotyypeittäin lähtötilanteen serostatuksen mukaan ensimmäisestä annoksesta 54 kuukauteen toisesta annoksesta tutkimuksessa DEN-301 (turvallisuussarja)
Qdenga n/N | Lumelääke n/N | Rokotteen teho (CI 95 %) VCD-kuumeen ehkäisemisessäa | Qdenga n/N | Lumelääke n/N | Rokotteen teho (CI 95 %) VCD-kuumeen aiheuttaman sairaalahoidon tarpeen ehkäisemisessäa | |
| Yhteensä | 442/13380 | 547/6687 | 61,2 (56,0; 65,8) | 46/13380 | 142/6687 | 84,1 (77,8; 88,6) |
| Lähtötilanne seronegatiivinen, N = 5 546 | ||||||
| Kaikki serotyypit | 147/3714 | 153/1832 | 53,5 (41,6; 62,9) | 17/3714 | 41/1832 | 79,3 (63,5; 88,2) |
| DENV-1 | 89/3714 | 79/1832 | 45,4 (26,1; 59,7) | 6/3714 | 14/1832 | 78,4 (43,9; 91,7) |
| DENV-2 | 14/3714 | 58/1832 | 88,1 (78,6; 93,3) | 0/3714 | 23/1832 | 100 (88,5; 100)b |
| DENV-3 | 36/3714 | 16/1832 | –15,5 (–108,2; 35,9) | 11/3714 | 3/1832 | –87,9 (–573,4; 47,6) |
| DENV-4 | 12/3714 | 3/1832 | –105,6 (–628,7; 42,0) | 0/3714 | 1/1832 | ei olec |
| Lähtötilanne seropositiivinen, N = 14 517 | ||||||
| Kaikki serotyypit | 295/9663 | 394/4854 | 64,2 (58,4; 69,2) | 29/9663 | 101/4854 | 85,9 (78,7; 90,7) |
| DENV-1 | 133/9663 | 151/4854 | 56,1 (44,6; 65,2) | 16/9663 | 24/4854 | 66,8 (37,4; 82,3) |
| DENV-2 | 54/9663 | 135/4854 | 80,4 (73,1; 85,7) | 5/9663 | 59/4854 | 95,8 (89,6; 98,3) |
| DENV-3 | 96/9663 | 97/4854 | 52,3 (36,7; 64,0) | 8/9663 | 15/4854 | 74,0 (38,6; 89,0) |
| DENV-4 | 12/9663 | 20/4854 | 70,6 (39,9; 85,6) | 0/9663 | 3/4854 | ei olec |
CI: luottamusväli, VCD: virologisesti vahvistettu dengue, n: tutkittavien lukumäärä, N: arvioitujen tutkittavien lukumäärä
a Eksploratiiviset analyysit; tutkimusta ei ollut tarkoitettu eikä suunniteltu osoittamaan eroa rokotteen ja lumelääkeryhmän välillä.
b Arvioitu käyttämällä yksipuolista 95 %:n luottamusväliä
c Arviota rokotteen tehosta ei ole, sillä sekä tetravalentin denguerokotteen että lumelääkkeen osalta havaittiin alle kuusi tapausta.
Lisäksi rokotteen teho minkä tahansa serotyypin aiheuttaman DHF:n estämisessä oli 70,0 % (95 %:n luottamusväli: 31,5 %, 86,9 %), ja minkä tahansa serotyypin aiheuttamien kliinisesti vakavien VCD-tapausten estämisessä 70,2 % (95 %:n luottamusväli: –24,7 %, 92,9 %).
Rokotteen tehoa havaittiin VCD:n estämisessä kaikilla neljällä serotyypillä lähtötilanteessa dengueseropositiivisilla tutkittavilla. Lähtötilanteessa seronegatiivisilla tutkittavilla rokotteen tehoa havaittiin serotyypeille DENV-1 ja DENV-2, mutta DENV-3:lle sitä ei ilmennyt eikä sitä voitu osoittaa DENV-4:n kohdalla, koska tapauksia esiintyi vähemmän (taulukko 4).
Toisen annoksen jälkeen tehtiin vuosikohtainen analyysi neljään ja puoleen vuoteen saakka (taulukko 5).
Taulukko 5: Rokotteen teho VCD-kuumeen ja sairaalahoidon tarpeen ehkäisemisessä yleisesti ja lähtötilanteen dengueserostatuksen mukaan vuoden välein 30 päivää toisesta annoksesta tutkimuksessa DEN-301 (protokollan mukainen analyysi)
Rokotteen teho (CI 95 %) VCD-kuumeen ehkäisemiseen Na = 19 021 | Rokotteen teho (CI 95 %) VCD-kuumeen aiheuttaman sairaalahoidon tarpeen ehkäisemiseen Na = 19 021 | ||
| Vuosi 1b | Yhteensä | 80,2 (73,3; 85,3) | 95,4 (88,4; 98,2) |
Lähtötilanteen dengueserostatuksen mukaan Seropositiivinen Seronegatiivinen | 82,2 (74,5; 87,6) 74,9 (57,0; 85,4) | 94,4 (84,4; 98,0) 97,2 (79,1; 99,6) | |
| Vuosi 2c | Yhteensä | 56,2 (42,3; 66,8) | 76,2 (50,8; 88,4) |
Lähtötilanteen dengueserostatuksen mukaan Seropositiivinen Seronegatiivinen | 60,3 (44,7; 71,5) 45,3 (9,9; 66,8) | 85,2 (59,6; 94,6) 51,4 (-50,7; 84,3) | |
| Vuosi 3d | Yhteensä | 45,0 (32,9; 55,0) | 70,8 (49,6; 83,0) |
Lähtötilanteen dengueserostatuksen mukaan Seropositiivinen Seronegatiivinen | 48,7 (34,8; 59,6) 35,5 (7.4; 55,1) | 78,4 (57,1; 89,1) 45,0 (-42,6; 78,8) | |
| Vuosi 4e | Yhteensä | 62,8 (41,4; 76,4) | 96,4 (72,2; 99,5) |
Lähtötilanteen dengueserostatuksen mukaan Seropositiivinen Seronegatiivinen | 64,1 (37,4; 79,4) 60,2 (11,1; 82,1) | 94,0 (52,2; 99,3) ei olef |
CI: luottamusväli, VCD: virologisesti vahvistettu dengue, N: analyysisarjassa olevien tutkittavien kokonaismäärä, a kunakin vuonna arvioitujen tutkittavien määrä on erilainen.
b Vuosi 1 tarkoittaa 11 kuukautta, joka alkaa 30 päivää toisen annoksen jälkeen.
c Vuosi 2 tarkoittaa 13–24 kuukautta toisen annoksen jälkeen.
d Vuosi 3 tarkoittaa 25–36 kuukautta toisen annoksen jälkeen.
e Vuosi 4 tarkoittaa 37–48 kuukautta toisen annoksen jälkeen.
f Arviota rokotteen tehosta ei ole, sillä sekä tetravalentin denguerokotteen että lumelääkkeen osalta havaittiin alle kuusi tapausta.
Kliininen teho vähintään 17-vuotiailla tutkittavilla
Valmisteen tehoa selvittäviä kliinisiä tutkimuksia ei ole tehty vähintään 17-vuotiailla tutkittavilla. Qdenga-valmisteen teho vähintään 17-vuotiailla tutkittavilla perustuu kliiniseen tehoon 4–16-vuotiailla tutkittavilla yhdistämällä immunogeenisuustietoja (ks. alla).
Immunogeenisuus
Denguesuojan korrelaattien puuttuessa immunogeenisuustietojen kliinistä merkitystä ei ymmärretä täysin.
Immunogeenisuutta koskevat tiedot 4–16-vuotiailla tutkittavilla endeemisillä alueilla
4–16-vuotiaiden tutkittavien geometriset keskiarvotitterit (GMT-arvot) dengueserostatuksittain tutkimuksen DEN-301 lähtötilanteessa on esitetty taulukossa 6.
Taulukko 6: Immunogeenisuus lähtötilanteen dengueserostatuksen mukaan tutkimuksessa DEN-301 (protokollan mukainen analyysi immunogeenisuuden selvittämistä varten)a
| Lähtötilanne seropositiivinen | Lähtötilanne seronegatiivinen | |||
Ennen rokotusta N = 1 816* | 1 kuukausi annoksen 2 jälkeen N = 1 621 | Ennen rokotusta N = 702 | 1 kuukausi annoksen 2 jälkeen N = 641 | |
DENV-1 GMT CI 95 % | 411,3 (366,0; 462,2) | 2 115,2 (1 957,0; 2 286,3) | 5,0 NE** | 184,2 (168,6; 201,3) |
DENV-2 GMT CI 95 % | 753,1 (681,0; 832,8) | 4 897,4 (4 645,8; 5 162,5) | 5,0 NE** | 1 729,9 (1 613,7; 1 854,6) |
DENV-3 GMT CI 95 % | 357,7 (321,3; 398,3) | 1 761,0 (1 645,9; 1 884,1) | 5,0 NE** | 228,0 (211,6; 245,7) |
DENV-4 GMT CI 95 % | 218,4 (198,1; 240,8) | 1 129,4 (1 066,3; 1 196,2) | 5,0 NE** | 143,9 (133,6; 155,1) |
N: arvioitujen tutkittavien lukumäärä; DENV: denguevirus; GMT: geometrinen keskiarvotitteri; CI: luottamusväli; NE: ei arvioitu
a Immunogeenisuuden alaryhmä oli satunnaisesti valittu tutkittavien alaryhmä, ja protokollan mukainen analyysi immunogeenisuuden selvittämistä varten oli sellaisten tutkittavien osa kyseisestä alaryhmästä, jotka kuuluvat myös protokollan mukaiseen analyysiryhmään
* DENV-2 ja DENV-3: N = 1 815
** GMT-arvot olivat alle pienimmän havaittavissa olevan arvon (10) kaikilla tutkittavilla, joten ne raportoitiin viitenä ilman luottamusvälejä
Immunogeenisuutta koskevat tiedot 18–60-vuotiailla tutkittavilla ei-endeemisillä alueilla
Qdenga-valmisteen immunogeenisuutta 18–60-vuotiailla aikuisilla arvioitiin vaiheen III kaksoissokkoutetussa satunnaistetussa lumelääkekontrolloidussa tutkimuksessa DEN-304 ei-endeemisessä maassa (Yhdysvallat). Annoksen 2 jälkeiset GMT:t on esitetty taulukossa 7.
Taulukko 7: Dengueneutralisoivien vasta-aineiden GMT:t tutkimuksessa DEN-304 (protokollan mukainen analyysi)
| Lähtötilanne seropositiivinen* | Lähtötilanne seronegatiivinen* | |||
Ennen rokotusta N = 68 | 1 kuukausi annoksen 2 jälkeen N = 67 | Ennen rokotusta N = 379 | 1 kuukausi annoksen 2 jälkeen N = 367 | |
DENV-1 GMT CI 95 % | 13,9 (9,5; 20,4) | 365,1 (233,0; 572,1) | 5,0 NE** | 268,1 (226,3; 317,8) |
DENV-2 GMT CI 95 % | 31,8 (22,5; 44,8) | 3 098,0 (2 233,4; 4 297,2) | 5,0 NE** | 2 956,9 (2 635,9; 3 316,9) |
DENV-3 GMT CI 95 % | 7,4 (5,7; 9,6) | 185,7 (129,0; 267,1) | 5,0 NE** | 128,9 (112,4; 147,8) |
DENV-4 GMT CI 95 % | 7,4 (5,5; 9,9) | 229,6 (150,0; 351,3) | 5,0 NE** | 137,4 (121,9; 155,0) |
N: arvioitujen tutkittavien määrä; DENV: denguevirus; GMT: geometrinen keskiarvotitteri; CI: luottamusväli; NE: ei arvioitu
* Yhdistetyt tiedot tetravalentin denguerokotteen eristä 1, 2 ja 3
** GMT-arvot olivat alle pienimmän havaittavissa olevan arvon (10) kaikilla tutkittavilla, joten ne raportoitiin viitenä ilman luottamusvälejä
Tehon vertailu perustuu immunogeenisuustietoihin ja tuloksiin yhdenvertaisuusanalyysistä (non-inferiority), jossa verrataan rokotuksen jälkeisiä GMT-arvoja lähtötilanteessa dengueseronegatiivisissa populaatioissa tutkimuksissa DEN-301 ja DEN-304 (taulukko 8). Suoja denguetautia vastaan on odotettavissa aikuisilla, vaikkakaan todellinen teho suhteessa lapsilla ja nuorilla havaittuun ei ole tiedossa.
Taulukko 8: GMT-suhteet lähtötilanteen dengueseronegatiivisten tutkittavien välillä tutkimuksissa DEN-301 (4–16 v) ja DEN-304 (18–60 v) (protokollan mukainen analyysi immunogeenisuuden selvittämistä varten)
| GMT-suhde* (CI 95 %) | DENV-1 | DENV-2 | DENV-3 | DENV-4 |
| 1 kk toisen annoksen jälkeen | 0,69 (0,58; 0,82) | 0,59 (0,52; 0,66) | 1,77 (1,53; 2,04) | 1,05 (0,92; 1,20) |
| 6 kk toisen annoksen jälkeen | 0,62 (0,51; 0,76) | 0,66 (0,57; 0,76) | 0,98 (0,84; 1,14) | 1,01 (0,86; 1,18) |
DENV: denguevirus; GMT: Geometrinen keskiarvotitteri; CI: luottamusväli; kk: kuukausi/kuukautta
*Yhdenvertaisuus: 95 %:n luottamusvälin yläraja on alle 2,0.
Vasta-aineiden pitkäaikainen pysyvyys
Neutraloivien vasta-aineiden pitkäaikainen pysyvyys osoitettiin tutkimuksessa DEN-301, jossa kaikkien neljän serotyypin titterit pysyivät reilusti rokotusta edeltävien pitoisuuksien yläpuolella jopa 51 kuukauden ajan ensimmäisen annoksen jälkeen.
Samanaikainen anto HPV-rokotteen kanssa
DEN‑308-tutkimuksessa, jossa noin 300 iältään 9–14‑vuotiasta tutkittavaa saivat Qdenga-valmistetta samanaikaisesti 9‑valenttisen HPV‑rokotteen kanssa, ei ilmennyt vaikutusta HPV‑rokotteen tuottamaan immuunivasteeseen. Tutkimuksessa testattiin ainoastaan Qdenga-valmisteen ja 9‑valenttisen HPV‑rokotteen ensimmäisten annosten samanaikaista antoa. Tutkimuksessa ei ole suoraan arvioitu Qdenga-valmisteen tuottaman immuunivasteen yhdenvertaisuutta annettaessa Qdenga-valmistetta samanaikaisesti 9‑valenttisen HPV‑rokotteen kanssa. Dengueseronegatiivisen tutkimuspopulaation denguevasta-ainevasteiden vaihteluvälit olivat samanaikaisen annon jälkeen samankaltaiset kuin vaiheen III tutkimuksessa (DEN‑301), jossa osoitettiin teho VCD-tapauksia sekä sairaalahoitoa vaatineita VCD-tapauksia vastaan.
Farmakokinetiikka
Qdenga-valmisteella ei ole tehty farmakokineettisiä tutkimuksia.
Prekliiniset tiedot turvallisuudesta
Tavanomaisten, ei-kliinisten yhden annoksen, paikallisen toleranssin, toistuvan annoksen aiheuttamaa toksisuutta ja lisääntymis- ja kehitystoksisuutta selvittävien tutkimusten turvallisuutta koskevat tiedot eivät viittaa erityiseen vaaraan ihmisille. Jakelu- ja erittymistutkimuksessa Qdenga-valmisteen RNA:ta ei erittynyt ulosteisiin ja virtsaan, mikä vahvisti riskin rokotteen siirtymisestä ympäristöön tai rokotettujen tartuttamisesta olevan pieni. Neurovirulenssitutkimus osoittaa, että Qdenga ei ole neurotoksinen.
Vaikka merkittävää vaaraa ei havaittu, lisääntymistoksisuutta selvittävien tutkimusten merkitys on rajallinen, koska kanit eivät ole alttiita denguevirusinfektiolle.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
α,α-trehaloosidihydraatti
poloksameeri 407
ihmisen seerumialbumiini
kaliumdivetyfosfaatti
dinatriumvetyfosfaatti
kaliumkloridi
natriumkloridi
Liuotin:
natriumkloridi
injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa yhteenkuuluvaa liuotinta lukuun ottamatta.
Kestoaika
24 kuukautta.
Qdenga tulee käyttää välittömästi, kun se on saatettu käyttökuntoon valmisteen mukana toimitettavalla liuottimella.
Jos Qdenga-valmistetta ei käytetä välittömästi, se on käytettävä 2 tunnin kuluessa.
Kemiallisen ja fysikaalisen käytönaikaisen stabiiliuden on osoitettu olevan 2 tuntia huoneenlämmössä (enintään 32,5 °C) rokotepullon käyttökuntoon saattamisen jälkeen. Tämän ajan jälkeen rokote on hävitettävä. Älä laita sitä takaisin jääkaappiin.
Mikrobiologiselta kannalta Qdenga-valmiste on käytettävä heti. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja -olosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa.
Käyttökuntoon saatetun Qdenga-valmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
QDENGA injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
1 annos (2 neulaa) (137,03 €)
PF-selosteen tieto
Qdenga injektiokuiva-aine ja liuotin, liuosta varten:
- Jauhe (1 annos) lasisessa injektiopullossa (tyypin I lasia), jossa on tulppa (butyylikumia) ja alumiinisinetti, jossa on muovinen vihreä repäisykorkki + 0,5 ml liuotinta (1 annos) lasisessa injektiopullossa (tyypin I lasia), jossa on tulppa (bromobutyylikumia) ja alumiinisinetti, jossa on muovinen violetti repäisykorkki Pakkauskoko 1 tai 10.
Qdenga-injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku:
- Jauhe (1 annos) injektiopullossa (tyypin I lasia), jossa on tulppa (butyylikumia) ja alumiinisinetti, jossa on muovinen vihreä repäisykorkki + 0,5 ml liuotinta (1 annos) esitäytetyssä ruiskussa (tyypin I lasia), mäntätulppa (bromobutyyliä) ja kärkikorkki (polypropeenia), jossa on 2 erillistä neulaa Pakkauksen koko on 1 tai 5.
- Jauhe (1 annos) injektiopullossa (tyypin I lasia), jossa on tulppa (butyylikumia) ja alumiinisinetti, jossa on muovinen vihreä repäisykorkki + 0,5 ml liuotinta (1 annos) esitäytetyssä ruiskussa (tyypin I lasia), mäntätulppa (bromobutyyliä) ja kärkikorkki (polypropeenia) ilman neuloja Pakkauksen koko on 1 tai 5.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Ennen käyttökuntoon saattamista rokote on valkoinen tai luonnonvalkoinen kylmäkuivattu jauhe (tiivis kakku).
Liuotin on kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Ohjeet rokotteen käyttökuntoon saattamiseen injektiopullossa olevalla liuottimella
Qdenga on kaksiosainen rokote, joka koostuu pakastekuivattua rokotetta sisältävästä injektiopullosta ja liuotinta sisältävästä injektiopullosta. Pakastekuivattu rokote on saatettava käyttökuntoon liuottimella ennen antoa.
Käytä vain steriilejä ruiskuja Qdenga-valmisteen käyttökuntoon saattamiseen ja injektoimiseen. Qdenga-valmistetta ei saa sekoittaa muiden lääkevalmisteiden tai rokotteiden kanssa samassa ruiskussa.
Käytä Qdenga-valmisteen käyttökuntoon saattamiseen vain rokotteen mukana toimitettua liuotinta (0,22-prosenttista natriumkloridiliuosta), koska siinä ei ole säilöntäaineita tai muita viruslääkkeitä. Kosketusta säilöntäaineiden, antiseptisten aineiden, pesuaineiden ja muiden viruslääkkeiden kanssa on vältettävä, sillä ne voivat inaktivoida rokotteen.
Ota rokote- ja liuotinpullot jääkaapista.
Liuottimen injektiopullo |
|
Pakastekuivatun rokotteen injektiopullo |
|
Käyttökuntoon saatettu rokote |
|
Käyttökuntoon saattamisen jälkeen tuloksena olevan liuoksen on oltava kirkasta, väritöntä tai vaaleankeltaista, eikä siinä saa olla vieraita hiukkasia. Hävitä rokote, jos siinä näkyy hiukkasia ja/tai jos siinä näkyy värimuutoksia.
Käyttökuntoon saatettu rokote |
|
Qdenga tulee antaa välittömästi käyttökuntoon saattamisen jälkeen. Kemiallisen ja fysikaalisen käytönaikaisen stabiiliuden on osoitettu olevan 2 tuntia huoneenlämpötilassa (enintään 32,5 °C) rokotepullon käyttökuntoon saattamisen jälkeen. Tämän ajan jälkeen rokote on hävitettävä. Älä laita sitä takaisin jääkaappiin. Mikrobiologiselta kannalta Qdenga-valmiste on käytettävä heti. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja -olosuhteet ovat käyttäjän vastuulla.
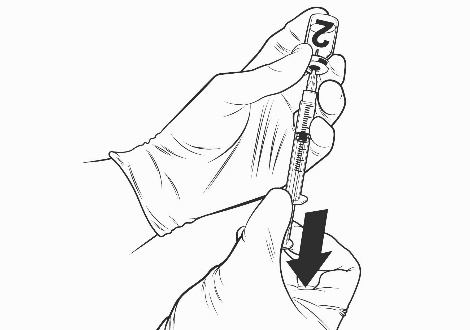
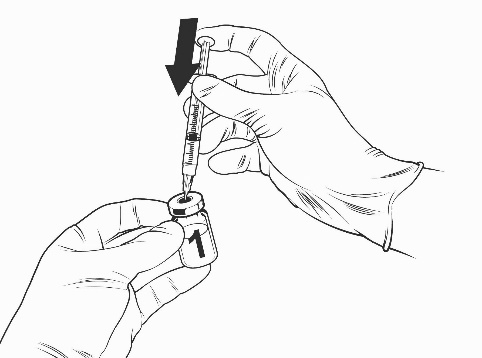
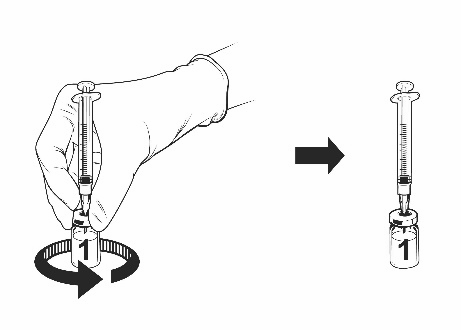
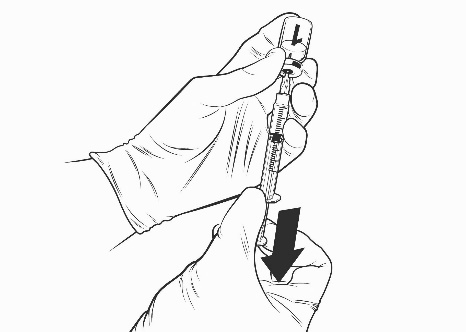
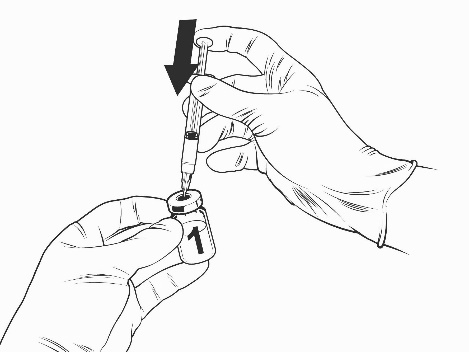
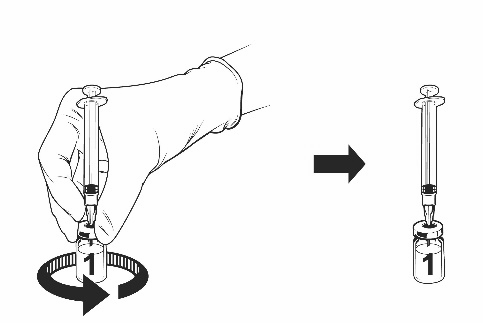
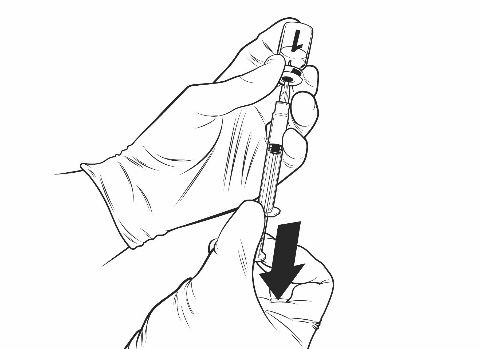
Ohjeet rokotteen käyttökuntoon saattamiseen esitäytetyssä ruiskussa olevalla liuottimella
Qdenga on kaksiosainen rokote, joka koostuu pakastekuivattua rokotetta sisältävästä injektiopullosta ja esitäytetyssä ruiskussa olevasta liuottimesta. Pakastekuivattu rokote on saatettava käyttökuntoon liuottimella ennen antoa.
Qdenga-valmistetta ei saa sekoittaa muiden rokotteiden kanssa samassa ruiskussa.
Käytä vain rokotteen mukana toimitettua liuotinta (0,22-prosenttista natriumkloridiliuosta) esitäytetyssä ruiskussa, koska siinä ei ole säilöntäaineita tai muita viruslääkkeitä. Kosketusta säilöntäaineiden, antiseptisten aineiden, pesuaineiden ja muiden viruslääkkeiden kanssa on vältettävä, sillä ne voivat inaktivoida rokotteen.
Ota rokotteen injektiopullo ja esitäytetty ruisku liuotinta jääkaapista.
Pakastekuivatun rokotteen injektiopullo |
|
Käyttökuntoon saatettu rokote |
|
Käyttökuntoon saattamisen jälkeen tuloksena olevan liuoksen on oltava kirkasta, väritöntä tai vaaleankeltaista, eikä siinä saa olla vieraita hiukkasia. Hävitä rokote, jos siinä näkyy hiukkasia ja/tai jos siinä näkyy värimuutoksia.
Käyttökuntoon saatettu rokote |
|
Qdenga tulee antaa välittömästi käyttökuntoon saattamisen jälkeen. Kemiallisen ja fysikaalisen käytönaikaisen stabiiliuden on osoitettu olevan 2 tuntia huoneenlämpötilassa (enintään 32,5 °C) rokotepullon käyttökuntoon saattamisen jälkeen. Tämän ajan jälkeen rokote on hävitettävä. Älä laita sitä takaisin jääkaappiin. Mikrobiologiselta kannalta Qdenga-valmiste on käytettävä heti. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja -olosuhteet ovat käyttäjän vastuulla.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
QDENGA injektiokuiva-aine ja liuotin, liuosta varten, esitäytetty ruisku
1 annos
- Ei korvausta.
ATC-koodi
J07BX04
Valmisteyhteenvedon muuttamispäivämäärä
19.12.2025
Yhteystiedot
 TAKEDA OY
TAKEDA OY PL 1406, Ilmalankuja 3
00101 Helsinki
0800 774 051
www.takeda.fi
etunimi.sukunimi@takeda.com