EFLUELDA TETRA injektioneste, suspensio, esitäytetty ruisku 60 mikrog HA/0,7 ml
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Influenssavirus (inaktivoitu, fragmentoitu) seuraavista kannoista*:
Kannan A/Victoria/4897/2022 (H1N1)pdm09 kaltainen virus (A/Victoria/4897/2022, IVR-238) ............................................60 mikrogrammaa HA**
Kannan A/Croatia/10136RV/2023 (H3N2) kaltainen virus (A/Croatia/10136RV/2023, X-425A)......................................................................60 mikrogrammaa HA**
Kannan B/Austria/1359417/2021 kaltainen virus (B/Michigan/01/2021, villityyppi) ..............................................................60 mikrogrammaa HA**
Kannan B/Phuket/3073/2013 kaltainen virus (B/Phuket/3073/2013, villityyppi) ....................................................................60 mikrogrammaa HA**
0,7 ml:n annoksessa
* kasvatettu hedelmöitetyissä kananmunissa
** hemagglutiniini
Rokote on WHO:n suositusten (pohjoinen pallonpuolisko) ja EU:n päätöksen mukainen kaudelle 2025/2026.
Efluelda Tetra saattaa sisältää häviävän pieniä määriä kananmunaa, esim. ovalbumiinia, sekä formaldehydiä, joita on käytetty valmistusprosessissa (ks. kohta Vasta-aiheet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio, esitäytetty ruisku
Kliiniset tiedot
Käyttöaiheet
Efluelda Tetra on tarkoitettu vähintään 60-vuotiaiden aikuisten aktiiviseen immunisaatioon influenssataudin ennaltaehkäisemiseksi.
Efluelda Tetra -rokotteen käytön pitää perustua influenssarokotuksia koskeviin virallisiin suosituksiin.
Annostus ja antotapa
Annostus
Vähintään 60-vuotiaat aikuiset: yksi 0,7 ml:n annos.
Pediatriset potilaat
Efluelda Tetra -rokotteen turvallisuutta ja tehokkuutta alle 18 vuoden ikäisillä lapsilla ei ole varmistettu.
Antotapa
Tämä rokote on suositeltavaa antaa lihakseen, mutta se voidaan antaa myös ihon alle.
Suositeltava lihakseen annettavan injektion pistoskohta on hartialihaksen alue. Rokotetta ei saa injektoida pakaran alueelle tai alueille, joissa saattaa olla suuri hermorunko.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai jollekin aineelle, josta rokotteessa saattaa olla jäämiä, kuten kananmunalle (ovalbumiinille tai kanan proteiineille) tai formaldehydille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kuten aina injektoitavia rokotteita annettaessa, pitää asianmukaisen hoidon ja valvonnan olla helposti saatavilla rokotuksen jälkeen mahdollisesti ilmenevän anafylaktisen reaktion varalta.
Efluelda Tetra -rokotetta ei saa missään tapauksessa antaa suoneen.
Rokotusta on lykättävä potilailla, joilla on akuutti kuumesairaus, kunnes kuume on laskenut.
Jos henkilölle on ilmaantunut Guillain-Barrén oireyhtymä (GBS) kuuden viikon kuluessa minkä tahansa aiemman influenssarokotuksen jälkeen, Efluelda Tetra -rokotteen antamista koskevan päätöksen on perustuttava mahdollisten hyötyjen ja riskien huolelliseen arviointiin.
Kuten muita lihakseen injektoitavia rokotteita annettaessa, varovaisuutta on noudatettava rokotettaessa trombosytopeniaa tai verenvuotohäiriötä sairastavia henkilöitä, koska näillä henkilöillä saattaa ilmetä verenvuotoa lihasinjektioiden jälkeen.
Pyörtymistä voi ilmetä rokottamisen aikana tai jopa sitä ennen psyykkisperäisenä reaktiona neulainjektioon. Pyörtymisestä johtuvat vammat on estettävä ja tajunnanmenetykseen liittyviin reaktioihin on varauduttava varotoimenpiteillä.
Vasta-ainevaste saattaa olla riittämätön henkilöillä, joilla on sisäsyntyinen tai hoidosta johtuva heikentynyt immuunivaste.
Kuten millä tahansa rokotteella, kaikilla rokotetuilla ei välttämättä muodostu taudilta suojaavaa vastetta.
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Efluelda Tetra -rokotteen samanaikaista antoa COVID‑19-mRNA-rokotteen (nukleosidimodifioitu/elasomeraani) kokeellisen 100 mikrogramman tehosteannoksen kanssa on arvioitu kuvailevassa kliinisessä tutkimuksessa pienellä määrällä tutkittavia (ks. kohdat Haittavaikutukset ja Farmakodynamiikka).
Jos Efluelda Tetra on tarpeen antaa samanaikaisesti toisen injektoitavan rokotteen tai rokotteiden kanssa, injektiot on annettava eri raajoihin.
On huomattava, että haittavaikutukset saattavat olla voimakkaampia samanaikaisen annon yhteydessä.
Immuunivaste saattaa heikentyä, jos potilas saa immunosuppressiivista lääkitystä.
Influenssarokotuksen jälkeen on esiintynyt vääriä positiivisia tuloksia serologisissa testeissä, joissa on käytetty ELISA-menetelmää HIV-1-, hepatiitti C- ja varsinkin HTLV1-vasta-aineiden määrittämiseksi. ELISA-menetelmällä saadut testitulokset on vahvistettava tai hylättävä asianmukaisella Western Blot -menetelmällä. Tilapäiset väärät positiiviset reaktiot saattavat johtua influenssarokotteen aikaansaamasta epäspesifisestä IgM-vasteesta.
Raskaus ja imetys
Efluelda Tetra on tarkoitettu vain vähintään 60-vuotiaille aikuisille.
Efluelda Tetra -rokotetta ei ole kliinisesti arvioitu raskaana olevilla tai imettävillä naisilla.
Raskaus
Inaktivoituja influenssarokotteita voidaan käyttää tavanomaisilla annoksilla (yhdessä annoksessa 15 mikrogrammaa hemagglutiniinia kustakin viruskannasta) raskauden kaikissa vaiheissa. Raskauden toiselle ja kolmannelle kolmannekselle on olemassa laajemmat turvallisuustiedot kuin ensimmäiselle kolmannekselle. Maailmanlaajuiset tiedot inaktivoitujen influenssarokotteiden käytöstä tavanomaisella annoksella eivät viittaa rokotteen aiheuttamiin haittatapahtumiin sikiöllä tai äidillä. On kuitenkin vain vähän tietoja sellaisten influenssarokotteiden käytöstä raskaana oleville naisille, joissa yksi annos sisältää 60 mikrogrammaa hemagglutiniinia kustakin viruskannasta.
Imetys
Efluelda Tetra -rokotetta voidaan käyttää imetyksen aikana. Tavanomaisilla annoksilla annetuista rokotteista saatujen kokemusten perusteella ei ole odotettavissa imeväisiin kohdistuvia vaikutuksia.
Hedelmällisyys
Efluelda Tetra -rokotteen mahdollisia vaikutuksia ihmisen hedelmällisyyteen ei ole tutkittu.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Efluelda Tetra -rokotteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
a. Turvallisuusprofiilin yhteenveto
Tiedot haittatapahtumista perustuvat kahdesta Efluelda Tetra -rokotetta koskevasta kliinisestä tutkimuksesta saatuihin tietoihin sekä kolmivalenttisesta korkea-annoksisesta influenssarokotteesta (virusfragmentit, inaktivoitu) (TIV‑HD) kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeen saatuihin kokemuksiin.
Efluelda Tetra -rokotteen turvallisuutta arvioitiin kahden kliinisen tutkimuksen (QHD00013 ja QHD00011) yhdistetyssä analyysissä, jossa 2 549 vähintään 60-vuotiasta aikuista (378 60–64-vuotiasta ja 2 171 vähintään 65-vuotiasta aikuista) sai Efluelda Tetra -rokotteen.
Yleisimmin ilmoitettu haittavaikutus rokotuksen jälkeen oli kipu injektiokohdassa, jota raportoitiin 42,6 %:lla tutkittavista, ja seuraavaksi yleisimmät olivat lihaskipu (23,8 %), päänsärky (17,3 %) ja huonovointisuus (15,6 %). Useimmat näistä reaktioista ilmenivät ja hävisivät kolmen vuorokauden kuluessa rokottamisesta. Useimmat näistä reaktioista olivat voimakkuudeltaan lieviä tai keskivaikeita.
Kaiken kaikkiaan haittavaikutuksia ilmeni yleisesti ottaen harvemmin vähintään 65-vuotiailla kuin 60–64-vuotiailla tutkittavilla.
Efluelda Tetra -rokotteen reaktogeenisuus oli hieman lisääntynyt verrattuna tavanomaisen annoksen sisältävään rokotteeseen, mutta voimakkuudessa ei havaittu suurta eroa.
Efluelda Tetra -rokotteen eli nelivalenttisen korkea-annoksisen influenssarokotteen (QIV‑HD) turvallisuutta arvioitiin kuvailevassa tutkimuksessa (QHD00028). Tutkittavat saivat QIV‑HD-rokotetta samanaikaisesti nukleosidimodifioidun COVID‑19-mRNA-rokotteen kokeelliseen 100 mikrogramman tehosteannokseen (n = 100) kanssa tai vain QIV‑HD-rokotetta (n = 92) tai vain kokeellisen 100 mikrogramman tehosteannoksen nukleosidimodifioitua COVID‑19-mRNA-rokotetta (n = 104). Paikallisten ja systeemisten haittavaikutusten esiintymistiheydet ja vaikeusasteet olivat samankaltaiset tutkittavilla, joille annettiin samanaikaisesti QIV‑HD-rokotetta ja myyntiluvallista COVID‑19-mRNA-rokotetta, ja tutkittavilla, joille annettiin tehosteannos myyntiluvallista COVID‑19-mRNA-rokotetta.
b. Haittavaikutustaulukko
Alla on esitetty yhteenveto esiintymistiheyksistä haittavaikutuksille, jotka kirjattiin Efluelda Tetra -rokotuksen jälkeen, sekä haittavaikutuksille, joita on ilmoitettu TIV‑HD-rokotteen kliinisen kehittämisen aikana ja myyntiluvan myöntämisen jälkeen (merkitty *:llä alla olevassa taulukossa).
Haittatapahtumat on luokiteltu seuraavien esiintymistiheyksien mukaan:
hyvin yleinen (≥ 1/10);
yleinen (≥ 1/100, < 1/10);
melko harvinainen (≥ 1/1 000, < 1/100);
harvinainen (≥ 1/10 000, < 1/1 000);
hyvin harvinainen (< 1/10 000);
tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| HAITTAVAIKUTUKSET | ESIINTYMISTIHEYS |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Kipu injektiokohdassa, injektiokohdan punoitus, huonovointisuus | Hyvin yleinen |
| Injektiokohdan turvotus, kovettuma injektiokohdassa, mustelma injektiokohdassa, kuume (≥ 37,5 °C), vilunväristykset | Yleinen |
| Injektiokohdan kutina, väsymys | Melko harvinainen |
| Astenia | Harvinainen |
| Rintakipu | Tuntematon* |
| Luusto, lihakset ja sidekudos | |
| Lihaskipu | Hyvin yleinen |
| Lihasheikkousa | Melko harvinainen |
| Nivelkipu, kipu raajoissa | Harvinainen |
| Hermosto | |
| Päänsärky | Hyvin yleinen |
| Letargiaa | Melko harvinainen |
| Heitehuimaus, parestesia | Harvinainen |
| Guillain-Barrén oireyhtymä (GBS), kouristuskohtaukset, kuumekouristukset, myeliitti (mukaan lukien enkefalomyeliitti ja transversaalimyeliitti), kasvohalvaus (Bellin pareesi), näköhermotulehdus/neuropatia, hartiapunoksen hermotulehdus, pyörtyminen (pian rokottamisen jälkeen) | Tuntematon* |
| Veri ja imukudos | |
| Trombosytopenia, lymfadenopatia | Tuntematon* |
| Hengityselimet, rintakehä ja välikarsina | |
| Yskä, kipu suun ja nielun alueella | Melko harvinainen |
| Voimakas nuha | Harvinainen |
| Hengenahdistus, hengityksen vinkuminen, kuristava tunne kurkussa | Tuntematon* |
| Ruoansulatuselimistö | |
| Pahoinvointi, oksentelu, dyspepsiaa, ripuli | Melko harvinainen |
| Immuunijärjestelmä | |
| Kutina, urtikaria, yöhikoilu, ihottuma | Harvinainen |
| Anafylaksi, muut allergiset reaktiot tai yliherkkyysreaktiot (myös angioedeema) | Tuntematon* |
| Verisuonisto | |
| Punoitus | Harvinainen |
| Vaskuliitti, vasodilataatio | Tuntematon* |
| Kuulo ja tasapainoelin | |
| Huimaus | Harvinainen |
| Silmät | |
| Silmän hyperemia | Harvinainen |
a Dyspepsiaa, letargiaa ja lihasheikkoutta todettiin TIV-HD-rokotteen käytön yhteydessä QHD00013-tutkimuksessa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
TIV‑HD-rokotteella on ilmoitettu tahattomaan käyttöön liittyviä tapauksia, joissa rokotetta on lääkitysvirheen vuoksi annettu suositeltua annosta suuremmalla annoksella alle 60-vuotiaille henkilöille. Ilmoitettujen haittavaikutusten tiedot olivat yhdenmukaiset TIV‑HD-rokotteen tunnetun turvallisuusprofiilin kanssa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Influenssarokote, ATC-koodi: J07BB02.
Vuosittainen influenssarokotteen ottaminen on suositeltavaa, koska immuniteetti heikkenee vuoden aikana rokottamisen jälkeen ja koska liikkeellä olevat influenssaviruskannat vaihtuvat vuosittain.
Farmakodynaamiset vaikutukset
Immunogeenisuus – QHD00013
Vähintään 65-vuotiailla aikuisilla tehtiin satunnaistettu, aktiivikontrolloitu, modifioitu, kaksoissokkoutettu vaiheen III kliininen tutkimus Yhdysvalloissa.
Tavoitteena oli osoittaa, että Efluelda Tetra on vähintään samanveroinen (non-inferior) verrattuna TIV‑HD-rokotteeseen. Tätä arvioitiin hemagglutinaation inhibitio (HI) ‑menetelmällä tutkituilla keskimääräisillä geometrisilla vasta-ainetittereillä (GMT) päivänä 28 sekä serokonversioluvuilla.
Yhteensä 2 670 aikuista, vähintään 65-vuotiasta tutkittavaa satunnaistettiin saamaan joko yksi annos Efluelda Tetra -rokotetta tai yksi annos TIV‑HD-rokotetta (jompaakumpaa kahdesta vertailurokotevalmisteesta [TIV-HD1 tai TIV-HD2]). Kumpikin TIV-HD-valmiste sisälsi B-kannan, joka vastasi toista Efluelda Tetra:n sisältämästä kahdesta B-kannasta (joko Yamagata-linjan B-kantaa tai Victoria-linjan B-kantaa).
Immunogeenisuustulokset on esitetty yhteenvetona taulukossa 1.
Taulukko 1: Tutkimus 1a: Efluelda Tetra -rokotteen vähintään samanveroisuuden (non-inferiority) analysointi verrattuna kolmivalenttiseen korkea-annoksiseen influenssarokotteeseen (TIV-HD) hemagglutinaation inhibitio (HI) ‑menetelmällä rokotuksen jälkeen mitattujen keskimääräisten geometristen vasta-ainetitterien (GMT) ja serokonversiolukujen mukaan vähintään 65-vuotiailla aikuisilla, tutkimussuunnitelman mukainen analyysisarja
| Influenssaviruskanta | GMT | GMT-suhde | Serokonversio (%)b | Serokonversiolukujen välinen ero | Vähintään samanarvoisuudelle ennalta asetettujen kriteerien täyttyminenf | ||||
EFLUELDA TETRA Nc = 1 679–1 680 (95 %:n CI) | TIV-HD1d (B1 Victoria) Nc = 423 (95 %:n CI) | TIV-HD2e (B2 Yamagata) Nc = 430 (95 %:n CI) | EFLUELDA TETRA/ TIV-HD (95 %:n CI) | EFLUELDA TETRA Nc = 1668–1669 (95 %:n CI) | TIV-HD1d (B1 Victoria) Nc = 420–421 (95 %:n CI) | TIV-HD2e (B2 Yamagata) Nc = 428 (95 %:n CI) | EFLUELDA TETRA rokotteen ja TIV-HD:n välinen erotus (95 %:n CI) | ||
| A (H1N1) g | 312 (292, 332) | 374 (341, 411) | 0,83 (0,744, 0,932) | 50,4 (48,0, 52,8) | 53,7 (50,2, 57,1) | -3,27 (-7,37, 0,86) | Kyllä | ||
| A (H3N2) g | 563 (525, 603) | 594 (540, 653) | 0,95 (0,842, 1,066) | 49,8 (47,3, 52,2) | 50,5 (47,1, 53,9) | -0,71 (-4,83, 3,42) | Kyllä | ||
| B1 (Victoria) | 516 (488, 545) | 476 (426, 532) | -- | 1,08 (0,958, 1,224) | 36,5 (34,2, 38,9) | 39,0 (34,3, 43,8) | -- | -2,41 (-7,66, 2,70) | Kyllä |
| B2 (Yamagata) | 578 (547, 612) | -- | 580 (519, 649) | 1,00 (0,881, 1,129) | 46,6 (44,2, 49,0) | -- | 48,4 (43,5, 53,2) | -1,75 (-7,04, 3,53) | Kyllä |
a NCT03282240
b Serokonversioluvut: tutkittavilla, joilla rokotusta edeltävä titteri oli < 10 (1/dil), luvut kuvaavat niiden tutkittavien osuutta, joilla rokotuksen jälkeinen titteri oli ≥ 40 (1/dil), ja tutkittavilla, joilla rokotusta edeltävä titteri oli ≥ 10 (1/dil), luvut kuvaavat niiden tutkittavien osuutta, joilla oli vähintään nelinkertainen titterin nousu rokotusta edeltävästä titteristä rokotuksen jälkeiseen titteriin.
c N on niiden rokotteen saaneiden osallistujien määrä, joista oli käytettävissä luettelossa mainittua immunologista päätetapahtumaa koskevat tiedot.
d TIV-HD1 sisälsi seuraavat viruskannat: A/Michigan/45/2015 (H1N1), A/Hong Kong/4801/2014 (H3N2) ja B/Brisbane/60/2008 (B1, Victoria-linja).
e TIV-HD2 sisälsi seuraavat viruskannat: A/Michigan/45/2015 (H1N1), A/Hong Kong/4801/2014 (H3N2) ja B/Phuket/3073/2013 (B2, Yamagata-linja).
f Ennalta määritellyt vähintään samanveroisuuden (non-inferiority) kriteerit serokonversioluvuille: serokonversiolukujen välisen eron (Efluelda Tetra miinus TIV‑HD) kaksitahoisen 95 %:n luottamusvälin alaraja on > ‑10 %. Ennalta määritellyt vähintään samanveroisuuden (non-inferiority) kriteerit GMT-suhteelle: GMT-suhteen (Efluelda Tetra jaettuna TIV‑HD:llä) 95 %:n luottamusvälin alaraja on > 0,667.
g Kannan A vertailua varten TIV-HD1 ja TIV-HD2 yhdistettiin TIV-HD-ryhmäksi, jotta sitä voitiin verrata Efluelda Tetra -rokotteeseen.
Efluelda Tetra oli yhtä immunogeeninen kuin TIV‑HDGMT-arvojen ja serokonversiolukujen suhteen yhteisille influenssakannoille. Lisäksi Efluelda Tetra sai aikaan paremman immuunivasteen rokotteeseen lisätylle B-kannalle kuin TIV‑HD, joka ei sisällä vastaavaa B‑kantaa.
Koska tilastollisesti verrannollinen immunogeenisuus TIV‑HD-rokotteen ja Efluelda Tetra -rokotteen välillä on osoitettu, TIV‑HD-rokotteen tehoa ja vaikuttavuutta koskevia tuloksia voidaan soveltaa myös Efluelda Tetra -rokotteeseen.
QHD00011
Satunnaistettu, aktiivikontrolloitu, modifioitu kaksoissokkoutettu, vaiheen III kliininen tutkimus tehtiin Euroopassa vähintään 60-vuotiailla aikuisilla osoittamaan Efluelda Tetra -rokotteen paremmuus kaikkia kantoja kohtaan verrattuna tavanomaisen annoksen sisältävään nelivalenttiseen influenssarokotteeseen (QIV-SD). Tämä arvioitiin hemagglutinaation inhibition (HI) keskimääräisillä geometrisilla vasta-ainetittereillä (GMT) päivänä 28 iältään 60–64-vuotiailla ja vähintään 65-vuotiailla aikuisilla.
Kaikkiaan 1 539 aikuista (760 iältään 60–64-vuotiasta ja 779 iältään vähintään 65-vuotiasta) satunnaistettiin saamaan joko yksi annos Efluelda Tetra -rokotetta tai yksi annos tavanomaisen annoksen sisältävää nelivalenttista influenssarokotetta.
Taulukko 2: Tutkimus 2a: Efluelda Tetra -rokotteen paremmuuden analysointi verrattuna tavanomaisen annoksen sisältävään nelivalenttiseen influenssarokotteeseen (QIV-SD) hemagglutinaation inhibitio (HI) -menetelmällä rokotuksen jälkeen mitattujen keskimääräisten geometristen vasta-ainetitterien (GMT) mukaan 60–64-vuotiailla ja vähintään 65-vuotiailla aikuisilla, täydellinen analyysisarja
| Influenssa-kanta | 60–64-vuotiaat aikuiset |
Paremmuu-delle ennalta asetettujen kriteerien täyttyminenc | Vähintään 65-vuotiaat aikuiset | Paremmuu-delle ennalta asetettujen kriteerien täyttyminenc | ||||
GMT
| GMT-suhde | GMT
| GMT-suhde | |||||
Efluelda Tetra (95 %:n CI) | QIV-SD Nb = 377 (95 %:n CI) | Efluelda Tetra vs. QIV-SD (95 %:n CI) | Efluelda Tetra
(95 %:n CI) | QIV-SD Nb = 381 (95 %:n CI) | Efluelda Tetra vs. QIV-SD (95 %:n CI) | |||
| A (H1N1) | 471 (416, 533) | 248 (217, 283) | 1,90 (1,58, 2,28) |
Kyllä | 286 (250, 326) | 162 (139, 190) | 1,76 (1,44, 2,15) | Kyllä |
| A (H3N2) | 303 (262, 350) | 178 (154, 206) | 1,70 (1,38, 2,08) |
Kyllä | 324 (281, 374) | 151 (129, 176) | 2,15 (1,74, 2,65) | Kyllä |
| B1 (Victoria) | 497 (450, 548) | 330 (297, 367) | 1,51 (1,30, 1,74) |
Kyllä | 405 (366, 447) | 262 (236, 291) | 1,55 (1,34, 1,79) | Kyllä |
| B2 (Yamagata) | 766 (690, 849) | 433 (391, 480) | 1,77 (1,53, 2,04) |
Kyllä | 536 (485, 592) | 305 (274, 340) | 1,76 (1,52, 2,03) | Kyllä |
a NCT04024228
b N on niiden osallistujien määrä, joista oli käytettävissä tarkasteltavaa päätetapahtumaa koskevat tiedot.
c Paremmuus katsottiin osoitetuksi, jos eri ryhmien (QIV-HD/QIV-SD) keskimääräisten geometristen vasta-ainetitterien välisen suhteen kaksitahoisen 95 %:n luottamusvälin alaraja oli > 1 kutakin kantaa kohden kummassakin ikäryhmässä.
Koska tilastollisesti verrannollinen immunogeenisuus TIV‑HD-rokotteen ja Efluelda Tetra -rokotteen välillä vähintään 65-vuotiailla aikuisilla (QHD00013) on osoitettu ja 60–64-vuotiailla aikuisilla ja vähintään 65-vuotiailla aikuisilla on havaittu samankaltaiset immuunivasteet (QHD00011), TIV‑HD-rokotteen tehoa ja vaikuttavuutta koskevia tuloksia voidaan soveltaa myös Efluelda Tetra -rokotteeseen.
Lisäksi Efluelda Tetra sai aikaan paremman (superior) immuunivasteen kuin QIV-SD-rokote kaikkia neljää viruskantaa vastaan 28 päivän kuluttua rokotuksesta 60–64-vuotiailla aikuisilla ja vähintään 65-vuotiailla aikuisilla.
Keskeinen kliininen teho (FIM12)
FIM12 oli Yhdysvalloissa ja Kanadassa tehty kaksoissokkoutettu tehoa koskeva monikeskustutkimus, jossa vähintään 65‑vuotiaat aikuiset satunnaistettiin (1:1) saamaan joko TIV‑HD-rokotteen tai influenssarokotteen tavanomaisella annoksella. Tutkimuksessa, joka toteutettiin kahden influenssakauden aikana (2011–2012 ja 2012–2013), arvioitiin ensisijaisena päätetapahtumana minkä tahansa influenssaviruksen tyypin tai alatyypin aiheuttaman laboratoriovarmennetun influenssan esiintyvyys influenssan kaltaisen sairauden (ILI) yhteydessä.
Osallistujia tarkkailtiin hengityselinsairauksien ilmaantumisen suhteen sekä aktiivisella että passiivisella seurannalla; seuranta alkoi 2 viikkoa rokotteen saamisen jälkeen ja jatkui noin 7 kuukauden ajan. Henkilöiltä, joilla oli ilmennyt hengityselinsairausepisodi, otettiin nenänielutikkunäytteet analysointia varten ja laskettiin tautijaksojen määrät ja rokotteen teho. Ensisijaisen päätetapahtuman ennalta määritelty tilastollisen paremmuuden kriteeri (kaksitahoisen 95 %:n luottamusvälin alaraja, TIV‑HD-rokotteen teho verrattuna tavanomaisella annoksella annetun rokotteen tehoon, > 9,1 %) täyttyi.
Taulukko 3: Rokotteen suhteellinen teho influenssan kaltaisen sairaudena ehkäisemisessä ≥ 65‑vuotiailla aikuisilla
| Korkea-annoksinen rokote Nb = 15 892 nc (%) | Tavanomaisen annoksen sisältävärokote Nb = 15 911 nc (%) | Suhteellinen Teho % (95 %:n CI) | |
| Laboratoriotutkimuksella varmistettu influenssad, jonka aiheuttaja on: | |||
| 227 (1,43) | 300 (1,89) | 24,2 (9,7, 36,5) |
| 73 (0,46) | 113 (0,71) | 35,3 (12,4, 52,5) |
a Todettu ainakin yksi seuraavista hengitystieoireista: kurkkukipu, yskä, limannousu, hengityksen vinkuminen tai hengitysvaikeudet, ja samanaikaisesti ainakin yksi seuraavista systeemisistä oireista tai merkeistä: > 37,2 °C:n lämpö, vilunväristykset, väsymys, päänsärky tai lihaskipu
b N on rokotteen saaneiden osallistujien määrä tehon arviointiin tarkoitetussa tutkimussuunnitelman mukaisessa analyysisarjassa
c n on niiden osallistujien määrä, joilla todettiin tutkimussuunnitelmassa määritelty influenssan kaltainen sairaus, joka oli laboratoriovarmennettu
d Laboratoriovarmennettu: varmistettu viljelyllä- tai polymeraasiketjureaktiomenetelmällä
e Ensisijainen päätetapahtuma
Vaikuttavuustutkimukset
Satunnaistetut kliiniset tutkimukset
Yhdysvaltalaisissa hoitokodeissa tehdyssä klusterisatunnaistetussa kontrolloidussa kliinisessä tutkimuksessa arvioitiin TIV‑HD-rokotteen suhteellista vaikutusta sairaalahoitoihin tavanomaisella annoksella annettuun influenssarokotteeseen verrattuna 53 008 henkilöllä influenssakauden 2013–2014 aikana.
Kauden 2013–2014 aikana hengityselinsairauksiin liittyvien sairaalahoitojaksojen ilmaantuvuus (ensisijainen tavoite) pieneni merkitsevästi, 12,7 % (korjattu riskisuhde [ARR] 0,873, 95 %:n luottamusväli 0,776–0,982, p = 0,023), yksiköissä, joissa asukkaat olivat saaneet TIV‑HD-rokotteen, verrattuna yksiköihin, joissa potilaat olivat saaneet influenssarokotteen tavanomaisella annoksella. Lisäksi TIV‑HD vähensi toissijaisia päätetapahtumia: keuhkokuumeesta johtuvia sairaalahoitojaksoja 20,9 % (ARR 0,791, 95 %:n luottamusväli: 0,267–0,953, p = 0,013) ja mistä tahansa syystä johtuvia sairaalahoitojaksoja 8 % (ARR 0,915, 95 %:n luottamusväli: 0,863–0,970, p = 0,0028).
Havainnoivat tutkimukset
Useissa retrospektiivisissä tutkimuksissa, jotka on tehty kahdeksan influenssakauden aikana ja joihin on osallistunut yli 24 miljoonaa vähintään 65‑vuotiasta henkilöä, on varmistettu, että TIV‑HD-rokotteen antama suoja influenssaan liittyviä komplikaatioita, kuten keuhkokuumetta ja influenssasta johtuvia sairaalahoitojaksoja, vastaan on 13,4 % parempi (95 %:n luottamusväli: 7,3–19,2 %, p < 0,001), kardiorespiratorisista syistä johtuvia sairaalahoitojaksoja vastaan 17,9 % parempi (95 %:n luottamusväli:14,9–20,9 %, p < 0,001) ja mistä tahansa syystä johtuvia sairaalahoitojaksoja vastaan 8,1 % parempi (95 %:n luottamusväli: 5,9–10,3 %, p < 0,001) verrattuna tavanomaisella annoksella annettuun influenssarokotteeseen, vaikka vaikutukset saattavat vaihdella kausittain.
Samanaikainen anto COVID‑19-mRNA-rokotteen (nukleosidimodifioitu) kanssa
Kuvailevassa avoimessa kliinisessä tutkimuksessa (NCT04969276) terveet, vähintään 65‑vuotiaat aikuiset jaettiin kolmeen ryhmään. Ryhmän 1 tutkittaville annettiin vain Efluelda Tetra -rokotetta (N = 92), ryhmän 2 tutkittaville (N = 100) annettiin Efluelda Tetra -rokotetta samanaikaisesti nukleosidimodifioidun COVID‑19-mRNA-rokotteen kokeellisen 100 mikrogramman tehosteannoksen kanssa aikaisintaan 5 kuukauden kuluttua perusrokotussarjan toisen annoksen antamisesta, ja ryhmän 3 tutkittaville (N = 104) annettiin vain nukleosidimodifioidun COVID‑19-mRNA-rokotteen kokeellinen 100 mikrogramman tehosteannos.
Samanaikainen anto ei vaikuttanut influenssarokotteen aikaansaamiin immuunivasteisiin, jotka mitattiin hemagglutinaation inhibitio (HI) ‑menetelmällä. Samanaikainen anto johti samankaltaisiin vasteisiin COVID‑19-mRNA-rokotteelle arvioituna IgG vasta-aineiden määrityksellä piikkiproteiinille (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Paikallista siedettävyyttä koskevien konventionaalisten tutkimusten ja toistuvan altistuksen aiheuttavaa toksisuutta koskevien tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Efluelda Tetra -valmisteen karsinogeenisuutta tai mutageenisuutta ei ole arvioitu, eikä valmisteella ole tehty kehitys- ja lisääntymistoksisuutta koskevia tutkimuksia.
Farmaseuttiset tiedot
Apuaineet
- Natriumfosfaattipuskuroitu isotoninen natriumkloridiliuos
- Natriumkloridi,
- Yksiemäksinen natriumfosfaatti
- Kaksiemäksinen natriumfosfaatti
- Injektionesteisiin käytettävä vesi
- Oktoksinoli-9
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
12 kuukautta
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C). Ei saa jäätyä. Säilytä ruisku ulkopakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EFLUELDA TETRA injektioneste, suspensio, esitäytetty ruisku
60 mikrog HA/0,7 ml (L:ei) 0,7 ml (1 erillinen neula) (49,84 €)
PF-selosteen tieto
0,7 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa on männänpysäytin (bromibutyylikumia) ja kärkisuojus.
Pakkauskoot: 1, 5 tai 10 esitäytettyä ruiskua, joissa ei ole neuloja.
Pakkauskoot: 1, 5 tai 10 esitäytettyä ruiskua, joissa on erilliset neulat (ruostumatonta terästä).
Pakkauskoot: 1 tai 10 esitäytettyä ruiskua, joissa on erilliset neulat (ruostumatonta terästä) ja niiden turvasuojukset (polykarbonaattia).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Efluelda Tetra on kevyen ravistamisen jälkeen väritön opaalinhohtoinen neste.
Käyttö- ja käsittelyohjeet
Rokotteen on annettava lämmetä huoneenlämpöön ennen käyttöä.
Ravistettava ennen käyttöä.
Rokotteet on tarkastettava silmämääräisesti hiukkasten ja/tai värimuutosten varalta ennen antoa aina kun liuos ja pakkaus tämän sallivat. Jos liuoksessa havaitaan tällaisia muutoksia, rokotetta ei saa antaa.
Valmistelut ennen antamista
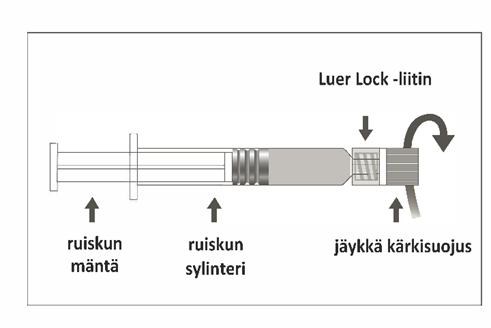
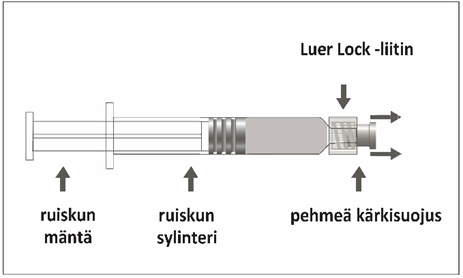
Esitäytetyssä ruiskussa voi olla Luer Lock ‑liitin, jossa on joko jäykkä kärkisuojus (kuva A) tai pehmeä kärkisuojus (kuva D). Ruisku, jossa on injektioneste, suspensio, on tarkastettava silmämääräisesti ennen antamista. Jos injektionesteessä on vierashiukkasia, ruisku vuotaa, mäntä on aktivoitunut ennenaikaisesti tai kärkisuojus on viallinen, esitäytetty ruisku on hävitettävä.
Kuva A: Luer Lock ‑ruisku, jossa on jäykkä kärkisuojus
| Vaihe 1: Pidä toisella kädellä kiinni Luer Lock ‑liittimestä (älä pidä kiinni ruiskun männästä tai sylinteristä) ja poista kärkisuojus kiertämällä sitä. | 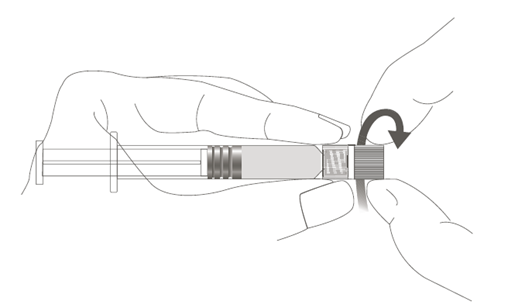 |
| Vaihe 2: Kiinnitä neula ruiskuun kiertämällä neulaa varovasti ruiskun Luer Lock ‑liittimeen, kunnes tunnet vähäisen vastuksen. | 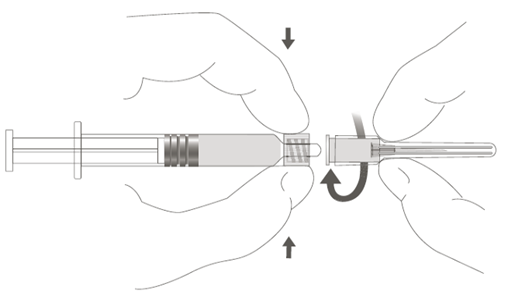 |
Ohjeet turvaneulan käytölle esitäytetyn Luer Lock ‑ruiskun kanssa:
Valmistele Luer Lock ‑ruisku ja neula kiinnittämistä varten noudattaen edellä esitettyjä vaiheita 1 ja 2.
| Kuva B: Turvaneula (kotelossa) | Kuva C: Turvaneulan osat (valmisteltuna käyttöä varten) |
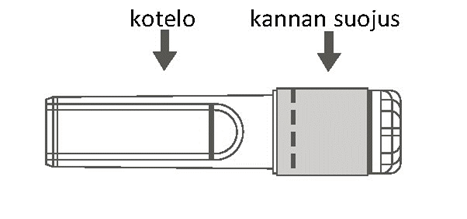 |  |
Vaihe 3: Poista turvaneulan kotelo vetämällä kohtisuoraan. Neula on turvasuojuksen ja suojaosan sisällä. |
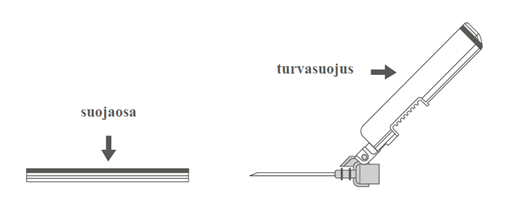
Vaihe 4: A: Käännä turvasuojusta poispäin neulasta, kohti ruiskun sylinteriä kuvassa esitettyyn asentoon. B: Poista suojaosa vetämällä kohtisuoraan. | 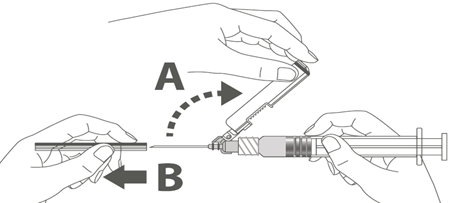 |
Vaihe 5: Kun pistos on annettu, lukitse (aktivoi) turvasuojus käyttämällä jotakin kolmesta (3) yhden käden tekniikasta, jotka on esitetty kuvassa, eli aktivoinnilla pintaa vasten, peukalolla tai sormella. Huomaa: Aktivointi on onnistunut, kun kuulet ja/tai tunnet naksahduksen. | 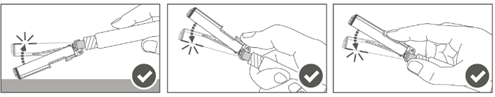 |
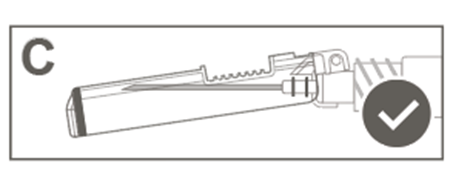
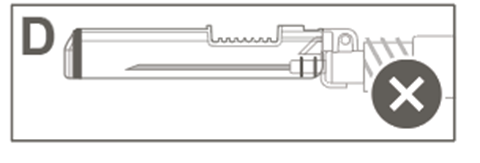
Vaihe 6: Tarkasta turvasuojuksen aktivoituminen silmämääräisesti. Turvasuojuksen on oltava täysin lukkiutunut (aktivoitunut), kuten kuvassa C on esitetty. Kuvassa D on turvasuojus, joka EI ole täysin lukkiutunut (ei ole aktivoitunut).
|
|
| Varoitus: Älä yritä poistaa turvalaitteen lukitusta (peruuttaa turvalaitteen aktivointia) ottamalla neula väkisin pois turvasuojuksesta. |
Kuva D: Luer Lock ‑ruisku, jossa on pehmeä kärkisuojus
| Vaihe 1: Pidä toisella kädellä kiinni Luer Lock ‑liittimestä (älä pidä kiinni ruiskun männästä tai sylinteristä) ja poista kärkisuojus vetämällä. | 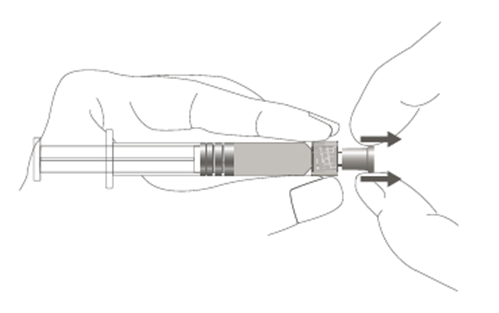 |
| Vaihe 2: Kiinnitä neula ruiskuun kiertämällä neulaa varovasti ruiskun Luer Lock ‑liittimeen, kunnes tunnet vähäisen vastuksen. | 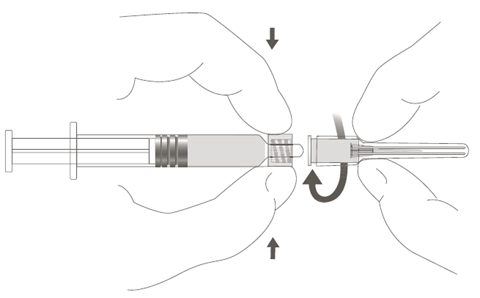 |
Ruisku on tarkoitettu vain yhtä käyttökertaa varten, eikä sitä saa käyttää uudelleen. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
EFLUELDA TETRA injektioneste, suspensio, esitäytetty ruisku
60 mikrog HA/0,7 ml 0,7 ml
- Ei korvausta.
ATC-koodi
J07BB02
Valmisteyhteenvedon muuttamispäivämäärä
02.07.2025
Yhteystiedot
 SANOFI OY
SANOFI OY Revontulenkuja 1
02100 Espoo
0201 200 300
www.sanofi.fi