KISPLYX kapseli, kova 4 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
Kisplyx 4 mg kovat kapselit
Yksi kova kapseli sisältää 4 mg lenvatinibia (mesilaattina).
Kisplyx 10 mg kovat kapselit
Yksi kova kapseli sisältää 10 mg lenvatinibia (mesilaattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kapseli, kova.
Kliiniset tiedot
Käyttöaiheet
Kisplyx-valmiste on tarkoitettu aikuispotilaiden pitkälle edenneen munuaissyövän (RCC) hoitoon:
- yhdistelmänä pembrolitsumabin kanssa ensilinjan hoitona (ks. kohta Farmakodynamiikka)
- yhdistelmänä everolimuusin kanssa yhden aikaisemman endoteelikasvutekijään (VEGF) kohdistuvan täsmähoidon (VEGF-täsmähoidon) jälkeen (ks. kohta Farmakodynamiikka).
Ehto
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Annostus ja antotapa
Hoito pitää aloittaa ja sitä pitää valvoa terveydenhuollon ammattilainen, jolla on kokemusta syöpähoidoista.
Annostus
Kisplyx yhdistelmänä pembrolitsumabin kanssa ensilinjan hoitona
Suositeltu lenvatinibiannos on 20 mg (kaksi 10 mg:n kapselia) suun kautta kerran päivässä yhdistettynä 30 minuutin laskimoinfuusiona 3 viikon välein annettavan 200 mg:n pembrolitsumabiannoksen tai 6 viikon välein annettavan 400 mg:n pembrolitsumabiannoksen kanssa. Lenvatinibin vuorokausiannosta säädetään tarpeen mukaan annosten ja toksisuuksien hallintaa koskevan suunnitelman mukaisesti. Lenvatinibihoitoa jatketaan taudin etenemiseen asti tai kunnes ilmenee jokin ei-hyväksyttävissä oleva toksisuus. Pembrolitsumabihoitoa jatketaan taudin etenemiseen asti, kunnes ilmenee jokin ei-hyväksyttävissä oleva toksisuus, tai pembrolitsumabihoidolle määritellyn enimmäiskeston ajan.
Katso täydelliset pembrolitsumabin annostelua koskevat tiedot pembrolitsumabivalmisteen valmisteyhteenvedosta.
Kisplyx yhdistelmänä everolimuusin kanssa toisen linjan hoitona
Lenvatinibin suositeltu vuorokausiannos on 18 mg (yksi 10 mg:n kapseli ja kaksi 4 mg:n kapselia) suun kautta kerran päivässä yhdessä kerran päivässä otettavan 5 mg:n everolimuusiannoksen kanssa. Lenvatinibin, ja tarvittaessa everolimuusin, vuorokausiannosta säädetään tarpeen mukaan annostusohjelman ja toksisuutta koskevan hoitosuunnitelman mukaisesti.
Katso täydelliset everolimuusin annostelua koskevat tiedot everolimuusivalmisteen valmisteyhteenvedosta.
Jos potilas unohtaa lenvatinibiannoksen eikä ota sitä 12 tunnin sisällä, annos jätetään väliin ja seuraava annos otetaan tavanomaisena ajankohtana.
Hoitoa on jatkettava niin kauan kuin siitä on kliinistä hyötyä tai kunnes ilmenee toksisuutta, joka ei ole hyväksyttävissä.
Lenvatinibiannoksen säätäminen ja hoidon lopettaminen
Haittavaikutusten hoitaminen saattaa edellyttää lenvatinibihoidon keskeyttämistä, annostuksen muuttamista tai yhdistelmähoidon lopettamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Lievät tai keskivaikeat (asteen 1 tai 2) haittavaikutukset eivät yleensä vaadi lenvatinibihoidon keskeyttämistä, paitsi jos ne ovat optimaalisesta hoidosta huolimatta sietämättömiä potilaalle.
Vaikea-asteiset (asteen 3) tai sietämättömät haittavaikutukset edellyttävät lenvatinibihoidon keskeyttämistä siihen saakka, kunnes vaikutukset lieventyvät asteeseen 0–1 tai lähtötilanteen tasolle.
Pahoinvoinnin, oksentelun ja ripulin optimaalinen lääkinnällinen hoito tulee aloittaa ennen kuin lenvatinibihoito keskeytetään tai annosta pienennetään. Maha-suolikanavaan kohdistuvat toksisuudet on hoidettava aktiivisesti, jotta munuaisten toiminnan heikentymisen tai vajaatoiminnan riski vähenee (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos toksisuuden oletetaan liittyvän lenvatinibiin (ks. taulukko 2), hoitoa pitää haittavaikutusten lievennyttyä/parannuttua asteeseen 0–1 tai lähtötilanteen tasolle jatkaa pienemmällä annoksella taulukon 1 suosituksen mukaisesti.
Taulukko 1 Lenvatinibin suositellun vuorokausiannoksen muuttaminena
| Lenvatinibiannos yhdistelmänä pembrolitsumabin kanssa | Lenvatinibiannos yhdistelmänä everolimuusin kanssa | |
| Suositeltu vuorokausiannos | 20 mg suun kautta kerran päivässä (kaksi 10 mg:n kapselia) | 18 mg suun kautta kerran päivässä (yksi 10 mg:n kapseli + kaksi 4 mg:n kapselia) |
| Ensimmäinen annoksen pienentäminen | 14 mg suun kautta kerran päivässä (yksi 10 mg:n kapseli + yksi 4 mg:n kapseli) | 14 mg suun kautta kerran päivässä (yksi 10 mg:n kapseli + yksi 4 mg:n kapseli) |
| Toinen annoksen pienentäminen | 10 mg suun kautta kerran päivässä (yksi 10 mg:n kapseli) | 10 mg suun kautta kerran päivässä (yksi 10 mg:n kapseli) |
| Kolmas annoksen pienentäminen | 8 mg suun kautta kerran päivässä (kaksi 4 mg:n kapselia) | 8 mg suun kautta kerran päivässä (kaksi 4 mg:n kapselia) |
| a Alle 8 mg:n annoksista on vain rajallisesti tietoja | ||
Jos lenvatinibia käytetään yhdessä pembrolitsumabin kanssa, jommankumman tai molempien lääkkeiden käyttö on tarvittaessa keskeytettävä. Lenvatinibin käyttö on tarpeen mukaan joko keskeytettävä, lääkkeen annosta pienennettävä tai hoito lopetettava. Pembrolitsumabin käyttö on keskeytettävä tai hoito lopetettava pembrolitsumabin valmisteyhteenvedossa annettujen ohjeiden mukaisesti. Pembrolitsumabiannoksen pienentämistä ei suositella.
Jos toksisuuden oletetaan liittyvän everolimuusiin, hoito pitää keskeyttää, annostus pienentää annettavaksi joka toinen päivä tai hoito lopettaa (ks. annoksen muuttamista koskevat suositukset tiettyjen haittavaikutusten yhteydessä everolimuusin valmisteyhteenvedosta).
Jos toksisuuden oletetaan liittyvän sekä lenvatinibiin että everolimuusiin, lenvatinibiannosta pitää pienentää (ks. taulukko 1) ennen everolimuusiannoksen pienentämistä.
Jos potilaalla on hengenvaarallisia (esim. asteen 4) haittavaikutuksia, kaikki hoidot on lopetettava. Jos poikkeavien laboratorioarvojen ei kuitenkaan katsota aiheuttavan hengenvaaraa, ne täytyy hoitaa vaikeina (esim. asteen 3) haittavaikutuksina.
Haittavaikutusten asteet perustuvat NCI:n (National Cancer Institute) CTCAE-luokitukseen (Common Terminology Criteria for Adverse Events).
Taulukko 2 Haittavaikutukset, jotka edellyttävät lenvatinibiannoksen muuttamista
| Haittavaikutus | Vaikeusaste | Toimenpide | Annoksen pienentäminen ja lenvatinibihoidon jatkaminen |
| Hypertensio | Aste 3 (optimaalisesta verenpainelääkityksestä huolimatta) | Keskeytys | Lieventyessä asteeseen 0, 1 tai 2. Ks. yksityiskohtaiset ohjeet taulukosta 3 kohdassa Varoitukset ja käyttöön liittyvät varotoimet. |
| Aste 4 | Lopetus | Ei pidä jatkaa | |
| Proteinuria | ≥ 2 g / 24 tuntia | Keskeytys | Lieventyessä tasolle < 2 g / 24 tuntia. |
| Nefroottinen oireyhtymä | ------- | Lopetus | Ei pidä jatkaa |
| Munuaistoiminnan heikentyminen tai munuaisten vajaatoiminta | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1 tai lähtötilanteen tasolle. |
| Aste 4* | Lopetus | Ei pidä jatkaa | |
| Sydämen vajaatoiminta | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1 tai lähtötilanteen tasolle. |
| Aste 4 | Lopetus | Ei pidä jatkaa | |
| Posteriorinen reversiibeli enkefalopatia-oireyhtymä (PRES) / reversiibeli posteriorinen leukoenkefalopatia-oireyhtymä (RPLS) | Mikä tahansa vaikeusaste | Keskeytys | Lieventyessä asteeseen 0 tai 1 voidaan harkita jatkamista pienennetyllä annoksella. |
| Maksatoksisuus | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1 tai lähtötilanteen tasolle. |
| Aste 4* | Lopetus | Ei pidä jatkaa | |
| Valtimo-tromboemboliat | Mikä tahansa vaikeusaste | Lopetus | Ei pidä jatkaa |
| Verenvuoto | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1. |
| Aste 4 | Lopetus | Ei pidä jatkaa | |
| Maha-suolikanavan puhkeama tai fisteli | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1 tai lähtötilanteen tasolle. |
| Aste 4 | Lopetus | Ei pidä jatkaa | |
| Muualla kuin maha-suolikanavassa oleva fisteli | Aste 4 | Lopetus | Ei pidä jatkaa |
| QT-ajan pidentyminen | > 500 ms | Keskeytys | Lieventyessä tasolle < 480 ms tai lähtötilanteen tasolle. |
| Ripuli | Aste 3 | Keskeytys | Lieventyessä asteeseen 0 tai 1 tai lähtötilanteen tasolle. |
| Aste 4 (lääkinnällisestä hoidosta huolimatta) | Lopetus | Ei pidä jatkaa | |
| *Jos asteen 4 poikkeavien laboratorioarvojen ei katsota aiheuttavan hengenvaaraa, ne voidaan hoitaa vaikeina (esim. asteen 3) haittavaikutuksina | |||
Erityisryhmät
Tiedot lenvatinibin ja pembrolitsumabin yhdistelmähoidosta kertynyeestä kliinisestä kokemuksesta löytyvät kohdasta Haittavaikutukset.
Lenvatinibin siedettävyys vaikuttaa olevan tavallista huonompi lähtötilanteessa hypertensiosta tai munuaisten vajaatoiminnasta kärsivillä, ≥ 65-vuotiailla potilailla (ks. kohta Haittavaikutukset).
Useimmista erityisryhmistä ei ole lenvatinibin ja everolimuusin yhdistelmähoitoa koskevia tietoja. Seuraavat tiedot perustuvat kliiniseen kokemukseen erilaistunutta kilpirauhaskarsinoomaa sairastaville potilaille annetusta lenvatinibimonoterapiasta (erilaistunut kilpirauhaskarsinooma, ks. Lenvima-valmisteen valmisteyhteenveto).
Kaikkien potilaiden, paitsi vaikeaa maksan tai munuaisten vajaatoimintaa sairastavien potilaiden (ks. jäljempänä), hoito pitää aloittaa suositusannoksella 20 mg lenvatinibia päivässä yhdessä pembrolitsumabin kanssa tai 18 mg lenvatinibia ja 5 mg everolimuusia kerran päivässä käyttöaiheen mukaan, minkä jälkeen annosta säädetään edelleen yksilöllisesti siedettävyyden perusteella.
Hypertensiopotilaat
Verenpaineen on ennen lenvatinibihoitoa oltava hyvässä hoitotasapainossa, ja sitä on seurattava säännöllisesti hoidon aikana (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Maksan vajaatoimintaa sairastavat potilaat
Tietoja lenvatinibin ja pembrolitsumabin yhdistelmähoidosta maksan vajaatoiminnasta kärsivillä potilailla on vain rajallisesti. Yhdistelmähoidon aloitusannosta ei tarvitse muuttaa maksan toiminnan perusteella, jos potilaalla on lievä (Child-Pugh A) tai keskivaikea (Child-Pugh B) maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa (Child-Pugh C) sairastaville potilaille suositeltu aloitusannos on 10 mg lenvatinibia kerran päivässä. Tarkista maksan vajaatoimintaa sairastaville potilaille suositellut pembrolitsumabiannokset pembrolitsumabin valmisteyhteenvedosta. Annosta voi tämän jälkeen olla tarpeen säätää yksilöllisesti siedettävyyden mukaan. Vaikeaa maksan vajaatoimintaa sairastaville potilaille on syytä antaa yhdistelmähoitoa vain, jos hyödyn oletetaan olevan riskiä suurempi (ks. kohta Haittavaikutukset).
Maksan vajaatoimintaa sairastavista potilaista ei ole saatavissa lenvatinibin ja everolimuusin yhdistelmähoitoa koskevia tietoja. Yhdistelmähoidon aloitusannosta ei tarvitse muuttaa maksan toiminnan perusteella, jos potilaalla on lievä (Child-Pugh A) tai keskivaikea (Child-Pugh B) maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa (Child-Pugh C) sairastaville potilaille suositeltu aloitusannos on 10 mg lenvatinibia kerran päivässä yhdistelmänä everolimuusin valmisteyhteenvedossa vaikeaa maksan vajaatoimintaa sairastaville potilaille suositellun everolimuusiannoksen kanssa. Annosta voi tämän jälkeen olla tarpeen säätää yksilöllisesti siedettävyyden mukaan. Vaikeaa maksan vajaatoimintaa sairastaville potilaille on syytä antaa yhdistelmähoitoa vain, jos hyödyn oletetaan olevan riskiä suurempi (ks. kohta Haittavaikutukset).
Munuaisten vajaatoimintaa sairastavat potilaat
Aloitusannosta ei tarvitse muuttaa munuaisten toiminnan perusteella, jos potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta. Vaikeaa munuaisten vajaatoimintaa sairastaville potilaille suositeltu aloitusannos on 10 mg lenvatinibia kerran päivässä. Tarkista munuaisten vajaatoimintaa sairastavien potilaiden pembrolitsumabi- tai everolimuusiannokset pembrolitsumabin tai everolimuusin valmisteyhteenvedosta. Annosta voi tämän jälkeen olla tarpeen säätää yksilöllisesti siedettävyyden mukaan. Loppuvaiheen munuaissairautta sairastavia potilaita ei ole tutkittu, joten lenvatinibia ei suositella tälle potilasryhmälle (ks. kohta Haittavaikutukset).
Iäkkäät potilaat
Aloitusannosta ei tarvitse muuttaa iän perusteella. Käytöstä ≥ 75-vuotiaille potilaille on vähän tietoa (ks. kohta Haittavaikutukset).
Pediatriset potilaat
Lenvatinibin turvallisuutta ja tehoa 2 – < 18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Saatavilla olevan tiedon perusteelle, joka on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Lenvatinibia ei pidä käyttää alle 2-vuotiaille lapsille eläinkokeissa havaittujen turvallisuutta koskevien huolenaiheiden vuoksi (ks. kohta Prekliiniset tiedot turvallisuudesta).
Etninen alkuperä
Aloitusannosta ei tarvitse muuttaa rodun perusteella (ks. kohta Farmakokinetiikka). Tällä hetkellä saatavilla olevat tiedot on kuvattu kohdassa Haittavaikutukset.
Alle 60 kg painavat potilaat
Aloitusannosta ei tarvitse muuttaa kehon painon perusteella. Lenvatinibin ja everolimuusin yhdistelmähoidosta alle 60 kg painavilla, pitkälle edennyttä munuaissyöpää sairastavilla potilailla on vain vähän tietoa (ks. kohta Haittavaikutukset).
Toimintakykyluokka
Potilaita, joiden ECOG (Eastern Cooperative Oncology Group) -toimintakykyluokka oli 2 tai suurempi, ei otettu mukaan munuaissyöpää sairastaville potilaille tehtyyn tutkimukseen 205 (ks. kohta Farmakodynamiikka). Potilaita, joiden KPS (Karnofskyn toimintakykyluokka) oli < 70, ei otettu mukaan tutkimukseen 307 (CLEAR). Hyöty-haitta-suhdetta ei ole arvioitu näillä potilailla.
Antotapa
Lenvatinibi otetaan suun kautta. Kapselit pitää ottaa suurin piirtein samaan aikaan joka päivä ruoan kanssa tai tyhjään mahaan (ks. kohta Farmakokinetiikka). Potilasta hoitava henkilö ei saa avata kapselia, jotta vältetään toistuva altistuminen kapselin sisällölle.
Lenvatinibikapselit voidaan niellä kokonaisina veden kanssa tai ne voidaan antaa suspensiona liuottamalla kokonainen kapseli tai kokonaiset kapselit veteen, omenamehuun tai maitoon. Suspensio voidaan antaa suun kautta tai ravitsemusletkun kautta. Jos suspensio annetaan ravitsemusletkun kautta, se on valmistettava veteen (ks. kohta Käyttö- ja käsittelyohjeet, Suspension valmistus ja anto).
Jos lenvatinibisuspensiota ei käytetä valmistusajankohtana, sitä voidaan säilyttää peitetyssä astiassa kylmässä 2–8 ºC:ssa enintään 24 tuntia. Kun suspensio otetaan jääkaapista, sitä on ravisteltava noin 30 sekunnin ajan ennen käyttöä. Jos suspensiota ei anneta 24 tunnin kuluessa, se on hävitettävä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
Imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Hypertensio
Lenvatinibihoitoa saavilla potilailla on raportoitu hypertensiota, jota on yleensä esiintynyt hoidon alkuvaiheessa (ks. kohta Haittavaikutukset). Verenpaineen on ennen lenvatinibihoitoa oltava hyvässä hoitotasapainossa. Jos potilaalla tiedetään olevan korkea verenpaine, potilasta on hoidettava vakiintuneella verenpainelääkeannoksella vähintään 1 viikon ajan ennen lenvatinibihoitoa. Vakavia huonossa hoitotasapainossa olevan hypertension aiheuttamia komplikaatioita, mukaan lukien aortan dissekaatioita, on raportoitu. Hypertension varhainen havaitseminen ja tehokas hoito ovat tärkeitä, jotta lenvatinibihoidon keskeyttämisen ja annoksen pienentämisen tarve voidaan minimoida. Verenpainelääkitys on aloitettava heti, kun kohonnut verenpaine varmistuu. Verenpaine pitää mitata 1 viikon lenvatinibihoidon jälkeen, ja sen jälkeen 2 viikon välein ensimmäisten 2 kuukauden ajan, ja tämän jälkeen kerran kuukaudessa. Verenpainelääkitys pitää valita yksilöllisesti potilaan kliinisen tilanteen ja tavanomaisen hoitokäytännön mukaan. Jos aiemmin normotensiivisellä potilaalla havaitaan kohonnut verenpaine, aloitetaan monoterapia yhden verenpainelääkeryhmän lääkkeellä. Jos potilas käyttää verenpainelääkitystä jo ennestään, nykyisen lääkevalmisteen annosta voidaan suurentaa, jos se on asianmukaista, tai hoitoon voidaan lisätä yksi tai useampi jonkin toisen verenpainelääkeryhmän valmiste. Hoida hypertensiota tarvittaessa taulukon 3 suositusten mukaisesti.
Taulukko 3 Hypertension hoitosuositus
| Verenpaine | Suositellut toimenpiteet |
| Systolinen verenpaine ≥ 140 – < 160 mmHg tai diastolinen verenpaine ≥ 90 – < 100 mmHg | Jatka lenvatinibihoitoa ja aloita verenpainelääkitys, jos sitä ei ole vielä aloitettu. TAI Jatka lenvatinibihoitoa ja suurenna nykyisen verenpainelääkkeen annosta tai lisää hoitoon uusi verenpainelääke. |
| Systolinen verenpaine ≥ 160 mmHg tai diastolinen verenpaine ≥ 100 mmHg optimaalisesta verenpainelääkityksestä huolimatta | 1. Keskeytä lenvatinibihoito. 2. Kun systolinen verenpaine on ≤ 150 mmHg, diastolinen verenpaine ≤ 95 mmHg ja potilas on käyttänyt verenpainelääkitystä vakioannoksina vähintään 48 tunnin ajan, jatka lenvatinibihoitoa pienemmällä annoksella (ks. kohta Annostus ja antotapa). |
| Hengenvaaralliset seuraukset (pahanlaatuinen hypertensio, neurologiset puutosoireet tai hypertensiivinen kriisi) | Kiireelliset hoitotoimenpiteet ovat aiheellisia. Lopeta lenvatinibihoito ja aloita asianmukainen lääketieteellinen hoito. |
Aneurysmat ja valtimon dissekaatiot
VEGF-reitin estäjien käyttö potilailla, joilla on kohonnut verenpaine tai joilla ei ole kohonnutta verenpainetta, saattaa edistää aneurysmien ja/tai valtimon dissekaatioiden muodostumista. Tämä riski on arvioitava tarkoin ennen lenvatinibihoidon aloittamista potilaille, joilla on riskitekijöitä, kuten kohonnut verenpaine tai aikaisempi aneurysma.
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä erittäin tehokasta ehkäisyä lenvatinibihoidon aikana sekä yhden kuukauden ajan sen päättymisestä (ks. kohta Raskaus ja imetys). Tällä hetkellä ei tiedetä, lisääkö lenvatinibi tromboembolisten tapahtumien riskiä, kun sitä käytetään yhdessä suun kautta otettavien ehkäisyvalmisteiden kanssa.
Proteinuria
Lenvatinibihoitoa saavilla potilailla on raportoitu proteinuriaa, jota on yleensä esiintynyt hoidon alkuvaiheessa (ks. kohta Haittavaikutukset). Virtsan proteiinipitoisuutta pitää seurata säännöllisesti. Jos proteinuria on virtsan liuskatestillä mitattuna ≥ 2+, hoidon keskeyttäminen, annoksen muuttaminen tai hoidon lopettaminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa). Lenvatinibia käyttävillä potilailla on raportoitu nefroottista oireyhtymää. Lenvatinibihoito on lopetettava, jos potilaalle ilmaantuu nefroottinen oireyhtymä.
Munuaisten vajaatoiminta ja munuaistoiminnan heikentyminen
Lenvatinibihoitoa saavilla potilailla on raportoitu munuaistoiminnan heikentymistä ja munuaisten vajaatoimintaa (ks. kohta Haittavaikutukset). Ensisijainen havaittu riskitekijä oli maha-suolikanavan toksisuudesta johtuva elimistön kuivuminen ja/tai hypovolemia. Maha-suolikanavan toksisuutta on hoidettava aktiivisesti, jotta munuaistoiminnan heikentymisen tai munuaisten vajaatoiminnan riski pienenee. Varovaisuutta on noudatettava potilailla, jotka saavat reniini-angiotensiini-aldosteronijärjestelmään vaikuttavia lääkkeitä, sillä yhdistelmähoito saattaa lisätä akuutin munuaisten vajaatoiminnan riskiä. Hoidon keskeyttäminen, annoksen muuttaminen tai hoidon lopettaminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa).
Vaikea-asteista munuaisten vajaatoimintaa sairastavien potilaiden lenvatinibihoidon aloitusannosta pitää muuttaa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Sydämen toimintahäiriöt
Lenvatinibihoitoa saavilla potilailla on raportoitu sydämen vajaatoimintaa (< 1 %) ja vasemman kammion ejektiofraktion pienentymistä (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava sydämen dekompensaation kliinisten oireiden tai löydösten havaitsemiseksi, sillä hoidon keskeyttäminen, annoksen muuttaminen tai hoidon lopettaminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa).
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES) / Reversiibeli posteriorinen leukoenkefalopatiaoireyhtymä (RPLS)
Lenvatinibihoitoa saavilla potilailla on raportoitu PRES:iä (tunnetaan myös lyhenteellä RPLS) (< 1 %; ks. kohta Haittavaikutukset). PRES on neurologinen sairaus, joka voi ilmetä päänsärkynä, kouristuskohtauksina, letargiana, sekavuutena, psyykkisen toiminnan muutoksina, sokeutena tai muina näköön liittyvinä tai neurologisina häiriöinä. Lievää tai keskivaikeaa hypertensiota voi esiintyä. Magneettikuvaus on välttämätön PRES-diagnoosin varmistamiseksi. Verenpaine pitää hoitaa asianmukaisin menetelmin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet, Hypertensio). Jos potilaalla on PRES-oireyhtymän löydöksiä tai oireita, saattaa olla tarpeen keskeyttää hoito, muuttaa annosta tai lopettaa hoito (ks. kohta Annostus ja antotapa).
Maksatoksisuus
Lenvatinibihoitoa saavilla potilailla yleisimmin raportoidut maksaan liittyvät haittavaikutukset olivat suurentuneet alaniiniaminotransferaasi-, aspartaattiaminotransferaasi- ja veren bilirubiinipitoisuudet. Lenvatinibihoitoa saavilla potilailla on raportoitu maksan vajaatoimintaa ja akuuttia maksatulehdusta (< 1 %; ks. kohta Haittavaikutukset). Maksan vajaatoimintaa raportoitiin yleensä potilailla, joilla oli eteneviä maksametastaaseja. Maksan toimintakokeet pitää tehdä ennen hoidon aloittamista, ja sen jälkeen 2 viikon välein ensimmäisten 2 kuukauden ajan ja tämän jälkeen kerran kuukaudessa. Jos potilaalla on maksatoksisuutta, saattaa olla tarpeen keskeyttää hoito, muuttaa annosta tai lopettaa hoito (ks. kohta Annostus ja antotapa).
Vaikea-asteista maksan vajaatoimintaa sairastavien potilaiden lenvatinibihoidon aloitusannosta tulee muuttaa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Valtimotromboemboliat
Lenvatinibihoitoa saavilla potilailla on raportoitu valtimotromboembolioita (aivoverisuonitapahtumia, ohimeneviä aivoverenkiertohäiriöitä ja sydäninfarkteja, ks. kohta Haittavaikutukset). Lenvatinibia ei ole tutkittu potilailla, joilla on ollut valtimotromboembolia hoitoa edeltävän 6 kuukauden aikana, joten tämän potilasryhmän hoidossa pitää olla varovainen. Hoitopäätöksen pitää perustua potilaan hyöty-riskisuhteen yksilölliseen arviointiin. Lenvatinibihoito on lopetettava valtimotromboembolisen tapahtuman jälkeen.
Verenvuoto
Kliinisissä tutkimuksissa on esiintynyt ja markkinoille tulon jälkeen on raportoitu vakavia kasvaimeen liittyviä verenvuotoja, mukaan lukien kuolemaan johtaneita verenvuototapahtumia (ks. kohta Haittavaikutukset). Markkinoille tulon jälkeisen seurannan aikana vakavia ja kuolemaan johtaneita kaulavaltimon verenvuotoja esiintyi useammin niillä potilailla, joilla oli erilaistumaton kilpirauhaskarsinooma, kuin niillä potilailla, joilla oli erilaistunut kilpirauhaskarsinooma tai muita kasvaintyyppejä. Kasvaimen suuriin verisuoniin (esim. kaulavaltimoon) tunkeutumisen/infiltraation aste tulee ottaa huomioon lenvatinibihoidon aikaansaaman kasvaimen kutistumiseen/nekroosiin liittyvän vaikean verenvuodon mahdollisen riskin vuoksi. Jotkin verenvuototapaukset ovat aiheutuneet sekundaarisesti kasvaimen kutistumisesta ja fistelin muodostumisesta esim. henkitorven ja ruokatorven välille. Kuolemaan johtanutta kallonsisäistä verenvuotoa on raportoitu joillakin potilailla, joista osalla oli ja osalla ei ollut aivometastaaseja. Verenvuotoa muualla kuin aivoissa (esim. henkitorvessa, vatsaontelossa, keuhkoissa) on myös raportoitu.
Verenvuodon ilmaantuessa saattaa olla tarpeen keskeyttää hoito, muuttaa annosta tai lopettaa hoito (ks. kohta Annostus ja antotapa, taulukko 2).
Maha-suolikanavan puhkeama ja fistelin muodostuminen
Lenvatinibihoitoa saavilla potilailla on raportoitu maha-suolikanavan puhkeamia ja fisteleitä (ks. kohta Haittavaikutukset). Maha-suolikanavan puhkeamia ja fisteleitä esiintyi useimmiten potilailla, joilla oli riskitekijöitä, kuten aiempi leikkaus tai aiemmin saatu sädehoito. Maha-suolikanavan puhkeaman tai fistelin ilmaantuessa saattaa olla tarpeen keskeyttää hoito, muuttaa annosta tai lopettaa hoito (ks. kohta Annostus ja antotapa).
Muualla kuin maha-suolikanavassa oleva fisteli
Lenvatinibihoitoa saavilla potilailla saattaa olla tavallista suurempi fistelien kehittymisen riski. Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen on havaittu myös maha-suolikanavan ulkopuolisten fistelien muodostumista tai suurentumista (esim. henkitorvessa, henki- ja ruokatorven välillä, ruokatorvessa, ihossa, naisten sukupuolielimissä). Myös ilmarintaa on raportoitu, ja sen yhteydessä on saattanut joskus esiintyä selkeää näyttöä bronkopleuraalisesta fistelistä. Kasvaimen regression tai nekroosin yhteydessä on joskus raportoitu fisteleitä ja ilmarintaa. Aiempi leikkaus- ja sädehoito saattavat olla myötävaikuttavia riskitekijöitä. Myös keuhkometastaasit saattavat lisätä ilmarinnan riskiä. Pahenemisen välttämiseksi lenvatinibihoitoa ei pidä aloittaa potilaille, joilla on fisteli, ja lenvatinibihoito on lopetettava pysyvästi, jos potilaalla havaitaan fisteli, joka on yhteydessä ruokatorveen, henkitorveen tai keuhkoputkiin, tai mikä tahansa asteen 4 fisteli (ks. kohta Annostus ja antotapa); lenvatinibihoidon keskeyttämisestä tai annoksen pienentämisestä muiden tapahtumien hoidon yhteydessä on rajallisesti tietoa, mutta pahentumista on joissakin tapauksissa havaittu, minkä vuoksi varovaisuutta tulee noudattaa. Lenvatinibi saattaa vaikuttaa negatiivisesti haavojen paranemisprosessiin, kuten muutkin saman luokan lääkeaineet.
QT-ajan pidentyminen
QT/QTc-ajan pidentymistä raportoitiin yleisemmin lenvatinibihoitoa saavilla kuin lumelääkettä saavilla potilailla (ks. kohta Haittavaikutukset). Kaikkien potilaiden sydämen sähkökäyrää pitää seurata ja kiinnittää erityisesti huomiota niihin potilaisiin, joilla on synnynnäinen pitkä QT-aika, kongestiivista sydämen vajaatoimintaa, bradyarytmiaa tai jotka käyttävät lääkevalmisteita, joiden tiedetään pidentävän QT-aikaa, mukaan lukien luokkien Ia ja III rytmihäiriölääkkeitä. Lenvatinibihoito pitää keskeyttää, jos potilaalle kehittyy asteen yli 500 ms:n QT-ajan pidentymä. Lenvatinibihoitoa jatketaan pienemmällä annoksella, kun QTc-ajan pidentymä on lieventynyt < 480 ms:iin tai lähtötilanteen tasolle.
Elektrolyyttihäiriöt, kuten hypokalemia, hypokalsemia tai hypomagnesemia, lisäävät QT-ajan pidentymisen riskiä, joten mahdolliset elektrolyyttihäiriöt pitää selvittää ja korjata kaikilla potilailla ennen hoidon alkamista. EKG:n ja elektrolyyttien (magnesium, kalium ja kalsium) seurantaa säännöllisin väliajoin hoidon aikana on harkittava. Veren kalsiumpitoisuutta pitää seurata vähintään kerran kuukaudessa ja puuttuva kalsium korvata tarvittaessa lenvatinibihoidon aikana. Lenvatinibihoito pitää tarvittaessa keskeyttää tai annosta pienentää riippuen vaikeusasteesta, mahdollisista EKG-muutoksista ja hypokalsemian jatkumisesta.
Tyreotropiinin suppression heikentyminen / kilpirauhasen toimintahäiriöt
Lenvatinibihoitoa saavilla potilailla on raportoitu kilpirauhasen vajaatoimintaa (ks. kohta Haittavaikutukset). Kilpirauhasen toimintaa pitää seurata ennen lenvatinibihoidon aloittamista ja säännöllisesti koko hoidon ajan. Kilpirauhasen vajaatoiminta pitää hoitaa normaalin hoitokäytännön mukaisesti eutyreoosin ylläpitämiseksi.
Lenvatinibi heikentää eksogeenista kilpirauhasen suppressiota (ks. kohta Haittavaikutukset). Tyreotropiinipitoisuutta (TSH) pitää seurata säännöllisesti, ja kilpirauhashormonin antoa on säädettävä asianmukaisen tyreotropiinipitoisuuden saavuttamiseksi potilaan hoitotavoitteen mukaisesti.
Ripuli
Ripulia on raportoitu yleisesti lenvatinibihoitoa saavilla potilailla, yleensä hoidon alkuvaiheessa (ks. kohta Haittavaikutukset). Ripulin lääkinnällinen hoito pitää aloittaa nopeasti, jotta elimistön kuivuminen vältetään. Jos asteen 4 ripuli jatkuu lääkinnällisestä hoidosta huolimatta, lenvatinibihoito pitää lopettaa.
Haavojen paranemisen komplikaatiot
Tutkimuksia erityisesti lenvatinibin vaikutuksista haavojen paranemiseen ei ole tehty. Lenvatinibia saavilla potilailla on raportoitu heikentynyttä haavojen paranemista. Lenvatinibihoidon väliaikaista keskeyttämistä tulee harkita potilailla, joille tehdään suuria leikkauksia. Lenvatinibihoidon uudelleenaloittamisen ajankohdasta suuren leikkauksen jälkeen on niukasti kliinistä kokemusta. Siksi lenvatinibihoidon uudelleenaloittamispäätöksen tulisi perustua kliiniseen arvioon riittävästä haavan paranemisesta leikkauksen jälkeen.
Leuan luukuolio
Lenvatinibilla hoidetuilla potilailla on raportoitu leuan luukuoliotapauksia. Joitain tapauksia havaittiin potilailla, jotka olivat aiemmin saaneet tai saivat samanaikaista luuston antiresorptiivista hoitoa ja/tai muita angiogeneesin estäjiä, kuten bevasitsumabia, tyrosiinikinaasin estäjiä tai mTOR-estäjiä. Käytettäessä lenvatinibia on siis noudatettava varovaisuutta, kun sitä käytetään samanaikaisesti antiresorptiivisen hoidon ja/tai muiden angiogeneesin estäjien kanssa tai niiden jälkeen.
Invasiiviset hammastoimenpiteet ovat tunnistettu riskitekijä. Ennen lenvatinibihoitoa on harkittava hammastutkimusta ja asianmukaista ennaltaehkäisevää hammashoitoa. Invasiivisia hammastoimenpiteitä on mahdollisuuksien mukaan vältettävä potilailla, jotka ovat aiemmin saaneet tai saavat parhaillaan laskimonsisäisiä bisfosfonaatteja (ks. kohta Haittavaikutukset).
Tuumorilyysioireyhtymä (TLS)
Lenvatinibi voi aiheuttaa tuumorilyysioireyhtymän, joka voi johtaa kuolemaan. Tuumorilyysioireyhtymän riskitekijöitä ovat muun muassa suuri kasvaintaakka, jo olemassa oleva
munuaisten vajaatoiminta ja dehydraatio. Näitä potilaita on seurattava tiiviisti ja hoidettava kliinisen
tarpeen mukaisesti. Ennaltaehkäisevää nesteytystä on harkittava.
Erityisryhmät
Valmisteen käytöstä potilaille, jotka ovat etniseltä alkuperältään muita kuin valkoihoisia tai aasialaisia, sekä vähintään 75-vuotiaille potilaille on vähän tietoa. Lenvatinibin käytössä näille potilasryhmille pitää olla varovainen, sillä aasialaiset ja iäkkäät potilaat sietävät lenvatinibia huonommin (ks. kohta Haittavaikutukset).
Lenvatinibin käytöstä välittömästi sorafenibin tai muiden syöpähoitojen jälkeen ei ole tietoja. Lisääntyvän toksisuuden riski on mahdollinen, jos hoitojen välinen aika ei ole riittävä. Kliinisissä tutkimuksissa lyhyin hoitojen välinen aika oli 4 viikkoa.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus lenvatinibiin
Solunsalpaajat
Lenvatinibin, karboplatiinin ja paklitakselin samanaikaisella annolla ei ole merkittävää vaikutusta näiden kolmen aineen farmakokinetiikkaan. Lisäksi munuaissyöpää sairastavilla potilailla everolimuusin samanaikainen käyttö ei vaikuttanut merkittävästi lenvatinibin farmakokinetiikkaan.
Lenvatinibin vaikutus muihin lääkevalmisteisiin
CYP3A4:n substraatit
Syöpäpotilailla tehty, lääkkeiden välisiä yhteisvaikutuksia selvittänyt kliininen tutkimus osoitti, että midatsolaamin (herkkä CYP3A:n ja P-gp:n substraatti) pitoisuudet plasmassa eivät muuttuneet lenvatinibin vaikutuksesta. Lisäksi munuaissyöpää sairastavilla potilailla lenvatinibin samanaikainen käyttö ei vaikuttanut merkittävästi everolimuusin farmakokinetiikkaan. Lenvatinibin ja muiden CYP3A4:n/P-gp:n substraattien välillä ei siis ole odotettavissa merkittäviä yhteisvaikutuksia.
Suun kautta otettavat ehkäisyvalmisteet
Tällä hetkellä ei tiedetä, voiko lenvatinibi heikentää hormonaalisten ehkäisyvalmisteiden tehoa. Sen vuoksi hormonaalista ehkäisyä käyttävien naisten pitää käyttää lisäehkäisynä estemenetelmää (ks. kohta Raskaus ja imetys).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, pitää välttää raskaaksi tulemista ja käyttää erittäin tehokasta ehkäisyä lenvatinibihoidon aikana sekä vähintään kuukauden ajan hoidon päättymisen jälkeen. Tällä hetkellä ei tiedetä, voiko lenvatinibi heikentää hormonaalisten ehkäisyvalmisteiden tehoa. Siksi hormonaalista ehkäisyä käyttävien naisten pitää käyttää lisäehkäisynä estemenetelmää.
Raskaus
Ei ole olemassa tietoja lenvatinibin käytöstä raskaana oleville naisille. Lenvatinibi oli rotille ja kaniineille annettuna alkiotoksinen ja teratogeeninen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Lenvatinibia ei pidä käyttää raskauden aikana, ellei se ole selvästi välttämätöntä ja ellei äidin hoitotarvetta ja sikiöön kohdistuvia riskejä ole arvioitu huolellisesti.
Imetys
Ei tiedetä, erittyykö lenvatinibi ihmisen rintamaitoon. Lenvatinibi ja sen metaboliitit erittyvät rottaemojen maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vastasyntyneeseen tai imeväiseen kohdistuvia riskejä ei voida poissulkea, ja lenvatinibi on siksi vasta-aiheista rintaruokinnan aikana (ks. kohta Vasta-aiheet).
Hedelmällisyys
Vaikutuksia ihmiselle ei tunneta. Kivesten ja munasarjojen toksisuutta on kuitenkin havaittu rotilla, koirilla ja apinoilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Lenvatinibilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn sen haittavaikutusten, kuten väsymyksen ja huimauksen, vuoksi. Jos potilaalla esiintyy näitä oireita, ajamisessa ja koneiden käytössä on noudatettava varovaisuutta.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Lenvatinibin turvallisuusprofiili perustuu yhdistettyihin tietoihin 497:stä munuaissyöpää sairastavasta potilaasta, jotka saivat lenvatinibin ja pembrolitsumabin yhdistelmää mukaan lukien tutkimus 307 (CLEAR); yhdistetyt tiedot 623:sta munuaissyöpää sairastavasta potilaasta, jotka saivat lenvatinibin ja everolimuusin yhdistelmää; 458:sta erilaistunutta kilpirauhaskarsinoomaa sairastavasta potilaasta sekä 496:sta maksasolukarsinoomaa sairastavasta potilaasta, jotka saivat lenvatinibimonoterapiaa.
Lenvatinibi yhdistelmänä pembrolitsumabin kanssa munuaissyövän hoidossa
Lenvatinibin ja pembrolitsumabin yhdistelmähoidon turvallisuusprofiili perustuu 497:stä munuaissyöpää sairastavasta potilaasta saatuihin tietoihin. Yleisimmin raportoidut haittavaikutukset (joita esiintyi ≥ 30 %:lla potilaista) olivat ripuli (61,8 %), hypertensio (51,5 %), väsymys (47,1 %), kilpirauhasen vajaatoiminta (45,1 %), ruokahalun heikentyminen (42,1 %), pahoinvointi (39,6 %), suutulehdus (36,6 %), proteinuria (33,0 %), dysfonia (32,8 %) ja nivelsärky (32,4 %).
Yleisimmät vaikea-asteiset (asteen ≥ 3) haittavaikutukset (≥ 5 %) olivat hypertensio (26,2 %), lipaasipitoisuuden suureneminen (12,9 %), ripuli (9,5 %), proteinuria (8,0 %), amylaasipitoisuuden suureneminen (7,6 %), painon lasku (7,2 %) ja väsymys (5,2 %).
Potilaista 33,4 % lopetti lenvatinibin, pembrolitsumabin tai molempien käytön haittavaikutuksen takia: 23,7 % lopetti lenvatinibin käytön ja 12,9 % molempien lääkkeiden käytön. Yleisimpiä (≥ 1 %) lenvatinibin, pembrolitsumabin tai molempien käytön lopettamiseen johtaneita haittavaikutuksia olivat sydäninfarkti (2,4 %), ripuli (2,0 %), proteinuria (1,8 %) ja ihottuma (1,4 %). Yleisimpiä (≥ 1 %) lenvatinibin käytön lopettamiseen johtaneita haittavaikutuksia olivat sydäninfarkti (2,2 %), proteinuria (1,8 %) ja ripuli (1,0 %).
Potilaista 80,1 % keskeytti lenvatinibin, pembrolitsumabin tai molempien käytön haittavaikutuksen takia: 75,3 % keskeytti lenvatinibin käytön ja 38,6 % molempien lääkkeiden käytön. Lenvatinibin annosta pienennettiin 68,4 %:lla potilaista. Yleisimpiä (≥ 5 %) lenvatinibin annoksen pienentämiseen tai käytön keskeyttämiseen johtaneita haittavaikutuksia olivat ripuli (25,6 %), hypertensio (16,1 %), proteinuria (13,7 %), väsymys (13,1 %), ruokahalun heikentyminen (10,9 %), palmoplantaarinen erytrodysestesia (käsi-jalkaoireyhtymä) (10,7 %), pahoinvointi (9,7 %), voimattomuus (6,6 %), suutulehdus (6,2 %), lipaasipitoisuuden suureneminen (5,6 %) ja oksentelu (5,6 %).
Lenvatinibi yhdistelmänä everolimuusin kanssa munuaissyövän hoidossa
Lenvatinibin turvallisuusprofiili yhdistelmänä everolimuusin kanssa käytettäessä perustuu 623 potilaan tietoihin.
Yleisimmin raportoidut haittavaikutukset (esiintyivät ≥ 30 %:lla potilaista) olivat ripuli (69,0 %), väsymys (41,9 %), hypertensio (41,7 %), ruokahalun heikentyminen (41,6 %), suutulehdus (40,6 %), pahoinvointi (38,8 %), proteinuria (34,2 %), oksentelu (32,7 %) ja painon lasku (31,3 %).
Yleisimmät (≥ 5 %) vaikeat (asteen ≥ 3) haittavaikutukset olivat hypertensio (19,3 %), ripuli (13,8 %), proteinuria (8,8 %), väsymys (7,1 %), ruokahalun heikentyminen (6,3 %) ja painon lasku (5,8 %).
Lenvatinibi- tai everolimuusihoito tai kummatkin oli lopetettava haittavaikutuksen vuoksi 27,0 %:lla potilaista; 21,7 %:lla lenvatinibiryhmässä ja 18,7 %:lla molempia lääkeaineita saaneessa ryhmässä. Yleisimmät (≥ 1 %) lenvatinibi- tai everolimuusihoidon tai kummankin hoidon lopettamiseen johtaneet haittavaikutukset olivat proteinuria (2,7 %), ripuli (1,0 %) ja ruokahalun heikentyminen (1,0 %). Lenvatinibihoidon lopettamiseen yleisimmin (≥ 1 %) johtanut haittavaikutus oli proteinuria (2,1 %).
Lenvatinibi- tai everolimuusihoito tai kummatkin hoidot oli keskeytettävä haittavaikutuksen vuoksi 82,2 %:lla potilaista. Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibihoito keskeytettiin 74,3 %:lla ja molemmat lääkehoidot 71,9 %:lla potilaista. Yleisimmät (≥ 5 %) lenvatinibi- tai everolimuusihoidon tai kummankin hoidon keskeyttämiseen johtaneet haittavaikutukset olivat ripuli (30,4 %), väsymys (15,3 %), proteinuria (14,7 %), ruokahalun heikentyminen (13,4 %), suutulehdus (13,2 %), pahoinvointi (10,9 %), oksentelu (10,2 %), hypertensio (9,2 %), voimattomuus (7,9 %), verihiutalemäärän pieneneminen (5,7 %) ja painon lasku (5,1 %).
Haittavaikutusten luettelo
Kliinisissä tutkimuksissa havaitut ja lenvatinibin markkinoilletulon jälkeisessä käytössä raportoidut haittavaikutukset on lueteltu taulukossa 4. Lenvatinibin tai muiden yhdistelmähoidon osana käytettävien lääkkeiden tunnettuja haittavaikutuksia voi esiintyä hoidon aikana, kun näitä lääkevalmisteita käytetään yhdistelmähoitona, vaikka kyseisiä haittavaikutuksia ei olisikaan ilmoitettu yhdistelmähoidon kliinisissä tutkimuksissa.
Lisätietoja lenvatinibin yhdistelmähoidon turvallisuudesta, ks. käytettävän yhdistelmähoidon toisen lääkevalmisteen valmisteyhteenveto.
Esiintymistiheydet on määritelty seuraavasti:
- Hyvin yleinen (≥ 1/10)
- Yleinen (≥ 1/100, < 1/10)
- Melko harvinainen (≥ 1/1 000, < 1/100)
- Harvinainen (≥ 1/10 000, < 1/1 000)
- Hyvin harvinainen (< 10 000)
- Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 4 Lenvatinibihoitoa saaneilla potilailla raportoidut haittavaikutukset§
Elinjärjestelmä (MedDRA-luokitus) | Lenvatinibimonoterapia | Yhdistelmähoito everolimuusin kanssa | Yhdistelmähoito pembrolitsumabin kanssa |
|---|---|---|---|
| Infektiot | |||
| Hyvin yleinen | Virtsatieinfektio | ||
| Yleinen | Virtsatieinfektio | Virtsatieinfektio | |
| Melko harvinainen | Välilihan absessi | Välilihan absessi | Välilihan absessi |
| Veri ja imukudos | |||
| Hyvin yleinen | Trombosytopenia‡ Lymfopenia‡ Leukopenia‡ Neutropenia‡ | Trombosytopenia‡ Lymfopenia‡ Leukopenia‡ Neutropenia‡ | Trombosytopenia‡ Lymfopenia‡ Leukopenia‡ Neutropenia‡ |
| Melko harvinainen | Pernainfarkti | ||
| Umpieritys | |||
| Hyvin yleinen | Kilpirauhasen vajaatoiminta* | Kilpirauhasen vajaatoiminta* | Kilpirauhasen vajaatoiminta* |
| Veren tyreotropiinipitoisuuden suureneminen*,‡ | Veren tyreotropiinipitoisuuden suureneminen*,‡ | Veren tyreotropiinipitoisuuden suureneminen*,‡ | |
| Yleinen | Lisämunuaisen vajaatoiminta | ||
| Melko harvinainen | Lisämunuaisen vajaatoiminta | Lisämunuaisen vajaatoiminta | |
| Aineenvaihdunta ja ravitsemus | |||
| Hyvin yleinen | Hypokalsemia*,‡ Hypokalemia‡ Hypomagnesemia‡ Hyperkolesterolemia‡ Painon lasku Ruokahalun heikentyminen | Hypokalsemia‡ Hypokalemia‡ Hypomagnesemia‡ Hyperkolesterolemia*, ‡ Painon lasku Ruokahalun heikentyminen | Hypokalsemia‡ Hypokalemia‡ Hypomagnesemia‡ Hyperkolesterolemia*,‡ Painon lasku Ruokahalun heikentyminen |
| Yleinen | Elimistön kuivuminen | Elimistön kuivuminen | Elimistön kuivuminen |
| Harvinainen | Tuumorilyysioireyhtymä† | Tuumorilyysioireyhtymä† | Tuumorilyysioireyhtymä† |
| Psyykkiset häiriöt | |||
| Hyvin yleinen | Unettomuus | Unettomuus | Unettomuus |
| Hermosto | |||
| Hyvin yleinen | Huimaus Päänsärky Makuhäiriö | Päänsärky Makuhäiriö | Huimaus Päänsärky Makuhäiriö |
| Yleinen | Aivoverisuonitapahtuma† | Huimaus | |
| Melko harvinainen | Posteriorinen reversiibeli enkefalopatiaoireyhtymä Monopareesi Ohimenevä aivoverenkiertohäiriö | Aivoverisuonitapahtuma† Ohimenevä aivoverenkiertohäiriö | Aivoverisuonitapahtuma Posteriorinen reversiibeli enkefalopatiaoireyhtymä Ohimenevä aivoverenkiertohäiriö |
| Sydän | |||
| Yleinen | Sydäninfarktia,† | Sydäninfarktia,† | Sydäninfarktia QT-ajan pidentymä sydänsähkökäyrässä |
Sydämen vajaatoiminta QT-ajan pidentymä sydänsähkökäyrässä Ejektiofraktion pienentyminen | Sydämen vajaatoiminta† QT-ajan pidentymä sydänsähkökäyrässä | ||
| Melko harvinainen | Ejektiofraktion pienentyminen | Sydämen vajaatoiminta† Ejektiofraktion pienentyminen | |
| Verisuonisto | |||
| Hyvin yleinen | Verenvuotob,*,† Hypertensioc,* Hypotensio | Verenvuotob,*,† Hypertensioc,* | Verenvuotob,*,† Hypertensioc,* |
| Yleinen | Hypotensio | Hypotensio | |
| Tuntematon | Aneurysmat ja valtimon dissekaatiot | Aneurysmat ja valtimon dissekaatiot | Aneurysmat ja valtimon dissekaatiot |
| Hengityselimet, rintakehä ja välikarsina | |||
| Hyvin yleinen | Dysfonia | Dysfonia | Dysfonia |
| Yleinen | Keuhkoembolia† | Keuhkoembolia Ilmarinta | Keuhkoembolia |
| Melko harvinainen | Ilmarinta | Ilmarinta | |
| Ruoansulatuselimistö | |||
| Hyvin yleinen | Ripuli* Vatsakipu ja maha-suolikanavan kipud Oksentelu Pahoinvointi Suutulehduse Suukipuf Ummetus Dyspepsia Suun kuivuminen Lipaasipitoisuuden nousu‡ Amylaasipitoisuuden nousu‡ | Ripuli* Vatsakipu ja maha-suolikanavan kipud Oksentelu Pahoinvointi Suutulehduse Suukipuf Ummetus Dyspepsia Lipaasipitoisuuden nousu‡ Amylaasipitoisuuden nousu‡ | Ripuli* Vatsakipu ja maha-suolikanavan kipud Oksentelu Pahoinvointi Suutulehduse Suukipuf Ummetus Dyspepsia Suun kuivuminen Lipaasipitoisuuden nousu‡ Amylaasipitoisuuden nousu‡ |
| Yleinen | Peräaukon fisteli Ilmavaivat Mahasuolikanavan puhkeama | Suun kuivuminen Ilmavaivat Mahasuolikanavan puhkeama | Haimatulehdusg Colitis Ilmavaivat Mahasuolikanavan puhkeama |
| Melko harvinainen | Haimatulehdusg Paksusuolen tulehdus | Haimatulehdusg Peräaukon fisteli Paksusuolen tulehdus | Peräaukon fisteli |
| Maksa ja sappi | |||
| Hyvin yleinen | Veren bilirubiinipitoisuuden nousu*,‡ Hypoalbuminemia*,‡ Alaniiniaminotransferaasipitoisuuden nousu*,‡ Aspartaattiaminotransferaasipitoisuuden nousu*,‡ Veren alkalisen fosfataasin pitoisuuden nousu‡ Gammaglutamyylitransferaasipitoisuuden nousu‡ | Hypoalbuminemia*,‡ Alaniiniaminotransferaasipitoisuuden nousu‡ Aspartaattiaminotransferaasipitoisuuden nousu‡ Veren alkalisen fosfataasin pitoisuuden nousu‡ | Veren bilirubiinipitoisuuden nousu‡ Hypoalbuminemia‡ Alaniiniaminotransferaasipitoisuuden nousu‡ Aspartaattiaminotransferaasipitoisuuden nousu‡ Veren alkalisen fosfataasin pitoisuuden nousu‡ |
| Yleinen | Maksan vajaatoimintah,† Hepaattinen enkefalopatiai,† Kolekystiitti Maksan toiminnan poikkeavuudet | Kolekystiitti Maksan toiminnan poikkeavuudet Gammaglutamyylitransferaasipitoisuuden nousu Veren bilirubiinipitoisuuden nousu*,‡ | Kolekystiitti Maksan toiminnan poikkeavuudet Gammaglutamyylitransferaasipitoisuuden nousu |
| Melko harvinainen | Maksasoluvauriot/maksatulehdusj | Maksan vajaatoimintah,† Hepaattinen enkefalopatiai | Maksan vajaatoimintah,† Hepaattinen enkefalopatiai Maksasoluvauriot/maksatulehdusj |
| Iho ja ihonalainen kudos | |||
| Hyvin yleinen | Palmoplantaarinen erytrodysestesiaoireyhtymä Ihottuma Hiustenlähtö | Palmoplantaarinen erytrodysestesiaoireyhtymä Ihottuma | Palmoplantaarinen erytrodysestesiaoireyhtymä Ihottuma |
| Yleinen | Hyperkeratoosi | Hiustenlähtö | Hyperkeratoosi Hiustenlähtö |
| Melko harvinainen | Hyperkeratoosi | ||
| Luusto, lihakset ja sidekudos | |||
| Hyvin yleinen | Selkäkipu | Selkäkipu | Selkäkipu |
| Nivelsärky | Nivelsärky | Nivelsärky | |
| Lihassärky | Lihassärky | ||
| Raajakipu | Raajakipu | ||
| Luusto- ja lihaskipu | Luusto- ja lihaskipu | ||
| Yleinen | Lihassärky Raajakipu Luusto- ja lihaskipu | ||
| Melko harvinainen | Leuan luukuolio | Leuan luukuolio | |
| Munuaiset ja virtsatiet | |||
| Hyvin yleinen | Proteinuria* | Proteinuria* | Proteinuria* |
| Veren kreatiniinipitoisuuden nousu‡ | Veren kreatiniinipitoisuuden nousu‡ | Veren kreatiniinipitoisuuden nousu‡ | |
| Yleinen | Munuaisten vajaatoimintak,*,† Munuaistoiminnan heikentyminen* Veren ureapitoisuuden nousu | Munuaisten vajaatoimintak,*,† Munuaistoiminnan heikentyminen* Veren ureapitoisuuden nousu | Munuaisten vajaatoimintak,* Veren ureapitoisuuden nousu |
| Melko harvinainen | Nefroottinen oireyhtymä | Nefroottinen oireyhtymä Munuaistoiminnan heikentyminen* | |
| Yleisoireet ja antopaikassa todettavat haitat | |||
| Hyvin yleinen | Väsymys Voimattomuus Perifeerinen turvotus | Väsymys Voimattomuus Perifeerinen turvotus | Väsymys Voimattomuus Perifeerinen turvotus |
| Yleinen | Huonovointisuus | Huonovointisuus | Huonovointisuus |
| Melko harvinainen | Heikentynyt paraneminen | Heikentynyt paraneminen Muualla kuin maha-suolikanavassa oleva fistelil | Heikentynyt paraneminen Muualla kuin maha-suolikanavassa oleva fistelill |
| Tuntematon | Muualla kuin maha-suolikanavassa oleva fistelil | ||
§: Taulukossa 4 esitetyt haittavaikutusten esiintymistiheydet eivät välttämättä koske pelkästään lenvatinibia, ja niihin voivat osaltaan vaikuttaa myös potilaan perussairaus tai muut samanaikaisesti käytetyt lääkevalmisteet.
*: Ks. lisätietoja kohdasta Haittavaikutukset Valikoitujen haittavaikutusten kuvaus.
†: Käsittää myös kuolemaan johtaneita tapauksia.
‡: Esiintymistiheys laboratoriotietojen perusteella.
Seuraavat termit on yhdistetty:
a: Sydäninfarkti käsittää sydäninfarktin ja akuutin sydäninfarktin.
b: Verenvuoto käsittää kaikki seuraavat:
Verenvuodot, joita esiintyi vähintään viidellä lenvatinibi- ja pembrolitsumabihoitoa saaneella munuaissyöpäpotilaalla: nenäverenvuoto, hematuria, ruhjevamma, ienverenvuoto, peräsuolen verenvuoto, veriyskä, ekkymoosi ja ulosteen verisyys.
c: Hypertensio käsittää seuraavat: hypertensio, hypertensiivinen kriisi, diastolisen verenpaineen nousu, ortostaattinen hypertensio ja verenpaineen nousu.
d: Maha-suolikanavan kipu ja vatsakipu käsittävät seuraavat: vatsavaivat, vatsakipu, alavatsakipu, ylävatsakipu, vatsan arkuus, keskiylävatsavaivat ja maha-suolikanavan kipu.
e: Suutulehdus käsittää seuraavat: aftainen suutulehdus, aftahaavauma, ikenien eroosio, ikenien haavaumat, suun limakalvojen rakkulat, suutulehdus, kielitulehdus, suun haavaumat ja limakalvotulehdus.
f: Suukipu käsittää seuraavat: suukipu, kielikipu, ienkipu, epämiellyttävä tunne suunielussa, suunielun kipu ja epämiellyttävä tunne kielessä.
g: Haimatulehdus käsittää seuraavat: haimatulehdus ja akuutti haimatulehdus.
h: Maksan vajaatoiminta käsittää seuraavat: maksan vajaatoiminta, akuutti maksan vajaatoiminta ja krooninen maksan vajaatoiminta.
i: Hepaattinen enkefalopatia käsittää seuraavat: hepaattinen enkefalopatia, maksakooma, metabolinen enkefalopatia ja enkefalopatia.
j: Maksasoluvauriot ja maksatulehdus käsittävät seuraavat: lääkeaineperäinen maksavaurio, maksan rasvoittuminen ja kolestaattinen maksavaurio.
k: Munuaisten vajaatoiminta käsittää seuraavat: akuutti prerenaalinen vajaatoiminta, munuaisten vajaatoiminta, akuutti munuaisten vajaatoiminta, akuutti munuaisvaurio ja munuaistiehyiden kuolio.
l: Muualla kuin maha-suolikanavassa oleva fisteli käsittää tapaukset, joissa fisteli sijaitsi mahalaukun ja suoliston ulkopuolella, kuten henkitorvessa, henki- ja ruokatorven välillä, ruokatorvessa, ihossa tai naisten sukupuolielimissä.
Valikoitujen haittavaikutusten kuvaus
Hypertensio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
CLEAR-tutkimuksessa (ks. kohta Farmakodynamiikka) hypertensiota raportoitiin 56,3 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista ja 42,6 %:lla sunitinibihoitoa saaneen ryhmän potilaista. Altistuksen mukaan mukautettu hypertension esiintyvyys oli lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä 0,65 tapausta potilasvuotta kohti ja sunitinibihoitoa saaneiden ryhmässä 0,73 tapausta potilasvuotta kohti. Mediaaniaika haittavaikutuksen alkuun lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä oli 0,7 kuukautta. Vähintään asteen 3 haittavaikutus ilmeni 28,7 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneista potilaista ja 19,4 %:lla sunitinibihoitoa saaneista potilaista. Lenvatinibiannosta muutettiin 16,8 %:lla potilaista, joilla ilmeni hypertensiota (9,1 %:lla hoito keskeytettiin ja 11,9 %:lla annosta pienennettiin). Hypertensio johti pysyvään hoidon lopettamiseen 0,9 %:lla potilaista.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, hypertensiota raportoitiin 42,5 %:lla potilaista (asteen 3 tai asteen 4 hypertension ilmaantuvuus oli 19,7 %). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 9,8 %:lla potilaista, joilla ilmeni hypertensiota (5,3 %:lla annosta pienennettiin ja 6,2 %:lla hoito keskeytettiin). Hypertensio johti pysyvään hoidon lopettamiseen 0,9 %:lla potilaista. Mediaaniaika hypertensiotapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 0,5 kuukautta.
Proteinuria (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, proteinuriaa raportoitiin 34,8 %:lla potilaista (9,0 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 15,1 %:lla potilaista, joilla ilmeni proteinuriaa (9,6 %:lla annosta pienennettiin ja 9,8 %:lla hoito keskeytettiin). Proteinuria johti pysyvään hoidon lopettamiseen 2,1 %:lla potilaista. Mediaaniaika proteinuriatapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 1,4 kuukautta.
Munuaisten vajaatoiminta ja munuaistoiminnan heikentyminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, 1,3 %:lle potilaista kehittyi munuaisten vajaatoimintaa (0,6 %:lla vaikeusaste oli ≥ 3) ja 5,3 %:lle kehittyi akuutti munuaisvaurio (2,7 %:lla vaikeusaste oli ≥ 3). Munuaistapahtumia raportoitiin 17,2 %:lla potilaista (4,3 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 5,5 %:lla potilaista, joilla ilmeni munuaistapahtumia (2,3 %:lla annosta pienennettiin ja 4,0 %:lla hoito keskeytettiin). Munuaistapahtumat johtivat pysyvään hoidon lopettamiseen 1,9 %:lla potilaista. Mediaaniaika munuaistapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 3,5 kuukautta.
Sydämen toimintahäiriöt (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, sydämen toimintahäiriötapahtumia raportoitiin 3,5 %:lla potilaista (1,8 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 0,9 %:lla potilaista, joilla ilmeni sydämen toimintahäiriötapahtumia (0,4 %:lla annosta pienennettiin ja 0,8 %:lla hoito keskeytettiin). Sydämen toimintahäiriötapahtumat johtivat pysyvään hoidon lopettamiseen 0,6 %:lla potilaista. Mediaaniaika sydämen toimintahäiriötapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 3,6 kuukautta.
Posteriorinen reversiibeli enkefalopatiaoireyhtymä (PRES) / Reversiibeli posteriorinen leukoenkefalopatiaoireyhtymä (RPLS) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, raportoitiin yksi PRES-tapahtuma (aste 2). Tapahtuma havaittiin, kun hoito oli kestänyt 1,3 kuukautta. Annosta ei tarvinnut muuttaa eikä hoitoa lopettaa sen vuoksi.
Maksatoksisuus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
CLEAR-tutkimuksessa (ks. kohta Farmakodynamiikka) yleisimmin raportoidut maksaan liittyneet haittavaikutukset lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä olivat maksaentsyymipitoisuuksien nousu, mukaan lukien suurentuneet alaniiniaminotransferaasipitoisuudet (11,9 %), aspartaattiaminotransferaasipitoisuudet (11,1 %) ja veren bilirubiinipitoisuudet (4,0 %). Samankaltaisia tapahtumia ilmeni sunitinibihoitoa saaneiden ryhmässä: vastaavat esiintyvyydet olivat 10,3 %, 10,9 % ja 4,4 %. Mediaaniaika maksatapahtumien alkuun oli 3,0 kuukautta lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä (mikä tahansa vaikeusaste) ja 0,7 kuukautta sunitinibihoitoa saaneiden ryhmässä. Altistuksen mukaan korjattu maksatoksisuustapahtumien esiintyvyys lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä oli 0,39 tapausta potilasvuotta kohti. Sunitinibihoitoa saaneiden ryhmässä vastaava esiintyvyys oli 0,46 tapausta potilasvuotta kohti. Maksaan liittyneitä asteen 3 haittavaikutuksia esiintyi 9,9 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneista potilaista ja 5,3 %:lla sunitinibihoitoa saaneista potilaista. Maksaan liittyneet haittavaikutukset johtivat lenvatinibihoidon keskeyttämiseen 8,5 %:lla, lenvatinibiannoksen pienentämiseen 4,3 %:lla ja lenvatinibihoidon pysyvään lopettamiseen 1,1 %:lla potilaista.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, yleisimmin raportoidut maksaan liittyneet haittavaikutukset olivat maksaentsyymipitoisuuksien suureneminen, mukaan lukien suurentuneet alaniiniaminotransferaasipitoisuudet (11,9 %), aspartaattiaminotransferaasipitoisuudet (11,4 %) ja gammaglutamyylitransferaasipitoisuudet (2,7 %). Maksaan liittyneitä asteen 3 haittavaikutuksia esiintyi 6,1 %:lla lenvatinibi–everolimuusi-yhdistelmähoitoa saaneista potilaista. Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 6,0 %:lla potilaista, joilla ilmeni maksatoksisuuden tapahtumia (2,8 %:lla annosta pienennettiin ja 4,2 %:lla hoito keskeytettiin). Maksatoksisuuden tapahtumat johtivat pysyvään hoidon lopettamiseen 0,9 %:lla potilaista. Mediaaniaika maksaan liittyvien tapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 1,8 kuukautta.
Valtimotromboemboliat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
CLEAR-tutkimuksessa (ks. kohta Farmakodynamiikka) valtimotromboemboliatapahtumia (joista 3,7 % oli ≥ 3. asteen tapahtumia) raportoitiin 5,4 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista ja 2,1 %:lla sunitinibihoitoa saaneen ryhmän potilaista (näistä 0,6 % oli ≥ 3. asteen tapahtumia). Yksikään näistä tapahtumista ei johtanut kuolemaan. Altistuksen mukaan mukautettu valtimotromboemboliatapahtumien esiintyvyys oli lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä 0,04 tapausta potilasvuotta kohti ja sunitinibihoitoa saaneiden ryhmässä 0,02 tapausta potilasvuotta kohti. Yleisimmin raportoitu valtimotromboemboliatapahtuma lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä oli sydäninfarkti (3,4 %). Sunitinibihoitoa saaneiden ryhmässä ilmeni yksi sydäninfarkti (0,3 %). Mediaaniaika valtimotromboemboliatapahtumien alkuun lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä oli 10,4 kuukautta.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, valtimotromboemboliatapahtumia raportoitiin 2,7 %:lla potilaista (2,2 %:lla vaikeusaste oli ≥3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 0,6 %:lla potilaista, joilla ilmeni valtimotromboemboliatapahtumia (0,6 %:lla hoito keskeytettiin). Valtimotromboemboliatapahtumat johtivat pysyvään hoidon lopettamiseen 1,5 %:lla potilaista. Lenvatinibi–everolimuusi-yhdistelmähoitoa saaneessa ryhmässä yleisimmin raportoitu valtimotromboemboliatapahtuma oli sydäninfarkti (1,3 %). Mediaaniaika valtimotromboemboliatapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 6,8 kuukautta.
Verenvuoto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, verenvuototapahtumia raportoitiin 28,6 %:lla potilaista (3,2 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 4,9 %:lla potilaista, joilla ilmeni verenvuototapahtumia (4,2 %:lla hoito keskeytettiin ja 0,8 %:lla annosta pienennettiin). Verenvuototapahtumat johtivat pysyvään hoidon lopettamiseen 0,6 %:lla potilaista. Lenvatinibi–everolimuusi-yhdistelmähoitoa saaneessa ryhmässä yleisimmin raportoidut verenvuototapahtumat olivat nenäverenvuoto (19,4 %) ja hematuria (4,2 %). Mediaaniaika verenvuototapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 1,9 kuukautta.
Hypokalsemia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet, QT-ajan pidentyminen)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, hypokalsemiaa raportoitiin 4,8 %:lla potilaista (1,1 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 0,8 %:lla potilaista, joilla ilmeni hypokalsemiaa (0,6 %:lla hoito keskeytettiin ja 0,4 %:lla annosta pienennettiin). Hypokalsemia ei johtanut pysyvään hoidon lopettamiseen yhdelläkään potilaalla. Mediaaniaika hypokalsemiatapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 2,9 kuukautta.
Maha-suolikanavan puhkeama ja fistelin muodostuminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, maha-suolikanavan puhkeamatapahtumia raportoitiin 3,7 %:lla potilaista (2,9 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 2,1 %:lla potilaista, joilla ilmeni maha-suolikanavan puhkeamia (1,5 %:lla hoito keskeytettiin ja 0,6 %:lla annosta pienennettiin). Maha-suolikanavan puhkeamat johtivat pysyvään hoidon lopettamiseen 1,1 %:lla potilaista. Mediaaniaika maha-suolikanavan puhkeamatapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 3,6 kuukautta.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, fistelin muodostustapahtumia raportoitiin 1,0 %:lla potilaista (0,5 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 0,8 %:lla potilaista, joilla ilmeni maha-suolikanavan puhkeamia (0,8 %:lla hoito keskeytettiin). Maha-suolikanavan puhkeamat johtivat pysyvään hoidon lopettamiseen 0,4 %:lla potilaista. Mediaaniaika fistelin muodostustapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 3,7 kuukautta.
Muualla kuin maha-suolikanavassa olevat fistelit (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Lenvatinibin käyttöön on yhdistetty fistelitapauksia, joista osa on johtanut kuolemaan. Mahan ja suoliston ulkopuolella sijaitsevia fisteleitä on raportoitu useassa eri käyttöaiheessa. Niiden ilmaantuminen on ajoittunut kahdesta viikosta yli yhteen vuoteen lenvatinibihoidon aloittamisen jälkeen; ilmaantumista edeltävän ajan mediaani on noin 3 kuukautta.
QT-ajan pidentyminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, 60 ms ylittäviä QTcF-aikoja raportoitiin 9,8 %:lla potilaista. Lenvatinibi–everolimuusi-yhdistelmähoitoa saaneessa ryhmässä ilmeni 500 ms ylittäviä QTc-aikoja 3,3 %:lla potilaista. Mediaaniaika QT-ajan pidentymistapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 3,0 kuukautta.
Veren tyreotropiinipitoisuuden suureneminen / kilpirauhasen vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
CLEAR-tutkimuksessa (ks. kohta Farmakodynamiikka) kilpirauhasen vajaatoimintaa esiintyi 47,2 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista ja 26,5 %:lla sunitinibihoitoa saaneen ryhmän potilaista. Altistuksen mukaan mukautettu kilpirauhasen vajaatoiminnan esiintyvyys oli lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä 0,39 tapausta potilasvuotta kohti ja sunitinibihoitoa saaneiden ryhmässä 0,33 tapausta potilasvuotta kohti. Yleisesti ottaen suurin osa lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneiden ryhmässä esiintyneistä kilpirauhasen vajaatoimintatapauksista oli asteen 1 tai 2 tapahtumia. Asteen 3 kilpirauhasen vajaatoimintaa raportoitiin 1,4 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista, ja sunitinibihoitoa saaneiden ryhmässä sitä ei esiintynyt lainkaan. Lähtötilanteessa TSH-arvot olivat enintään normaalialueen ylärajalla 90,0 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista ja 93,1 %:lla sunitinibihoitoa saaneen ryhmän potilaista. TSH-arvojen kohoamista yli normaalialueen ylärajan havaittiin lähtötilanteen jälkeen 85,0 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista ja 65,6 %:lla sunitinibihoitoa saaneen ryhmän potilaista. Kilpirauhasen vajaatoimintatapahtumat johtivat lenvatinibiannoksen muuttamiseen (annoksen pienentämiseen tai hoidon keskeyttämiseen) 2,6 %:lla lenvatinibin ja pembrolitsumabin yhdistelmähoitoa saaneen ryhmän potilaista, ja yksi potilas lopetti lenvatinibihoidon pysyvästi.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, kilpirauhasen vajaatoimintaa esiintyi 24,1 %:lla potilaista. Yleisesti ottaen kilpirauhasen vajaatoimintatapahtumien vaikeusaste oli useimmissa tapauksissa 1 tai 2. Vaikeusasteen 3 kilpirauhasen vajaatoimintaa raportoitiin 0,3 %:lla potilaista, jotka saivat lenvatinibi–everolimuusi-yhdistelmähoitoa. Mediaaniaika kilpirauhasen vajaatoimintatapahtumien alkuun lenvatinibin ja everolimuusin yhdistelmähoitoa saaneiden ryhmässä oli 2,7 kuukautta. Lähtötilanteessa TSH-arvo oli normaalialueen ylärajalla tai sen alle 83,0 %:lla potilaista, jotka saivat lenvatinibi–everolimuusi-yhdistelmähoitoa. TSH-arvojen kohoamista yli normaalialueen ylärajan havaittiin lähtötilanteen jälkeen 71,3 %:lla potilaista, jotka saivat lenvatinibin ja everolimuusin yhdistelmähoitoa. Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 1,3 %:lla potilaista, joilla ilmeni kilpirauhasen vajaatoimintatapahtumia (0,4 %:lla annosta pienennettiin ja 0,9 %:lla hoito keskeytettiin). Yhtään hoidon lopettamistapausta ei raportoitu.
Ripuli (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, ripulia raportoitiin 69,0 %:lla potilaista (13,8 %:lla vaikeusaste oli ≥ 3). Niistä potilaista, joiden yksilöllisistä lääkemuutoksista kerättiin tietoa, lenvatinibiannosta muutettiin 30,4 %:lla potilaista (17,7 %:lla hoito keskeytettiin ja 19,6 %:lla annosta pienennettiin). Ripuli johti pysyvään hoidon lopettamiseen 0,6 %:lla potilaista.
Pediatriset potilaat
Pediatrisissa tutkimuksissa 216 ja 231 (ks. kohta Farmakodynamiikka) lenvatinibin yleinen turvallisuusprofiili monoterapiana tai yhdistelmähoitona everolimuusin kanssa oli yhdenmukainen lenvatinibihoitoa saaneilla aikuisilla todetun turvallisuusprofiilin kanssa.
Tutkimuksessa 216 ilmarinta todettiin kolmella potilaalla (4,7 %), joilla oli Ewingin sarkooma, rabdomyosarkooma (RMS) ja Wilmsin kasvain; kaikilla kolmella potilaalla oli lähtötilanteessa keuhkometastaaseja. Tutkimuksessa 231 ilmarinta todettiin seitsemällä potilaalla (5,5 %), joilla oli sukkulasolusarkooma, erilaistumaton sarkooma, RMS, pahanlaatuinen perifeerinen hermotuppikasvain, synoviaalisarkooma, sukkulasolukarsinooma ja pahanlaatuinen fibromyksoidi luutuva kasvain; kaikilla seitsemällä potilaalla oli lähtötilanteessa keuhkometastaaseja tai rintakehän seinämän tai keuhkopussinontelon primaaritauti. Yksikään tutkimuksiin 216 ja 231 osallistuneista potilaista ei lopettanut tutkimushoitoa ilmarinnan vuoksi (lisätietoja pediatrisista potilaista on myös Lenvima-valmisteyhteenvedon kohdassa Haittavaikutukset).
Tutkimuksen 216 vaiheessa 1 (yhdistelmähoidon annoshakukohortti) yleisimmin (≥ 40 %) raportoidut haittavaikutukset olivat hypertensio, kilpirauhasen vajaatoiminta, hypertriglyseridemia, vatsakipu ja ripuli, ja vaiheessa 2 (laajennettu yhdistelmähoitokohortti) yleisimmin (≥ 35 %) raportoidut haittavaikutukset olivat hypertriglyseridemia, proteinuria, ripuli, lymfosyyttimäärän pieneneminen, valkosolumäärän pieneneminen, veren kolesterolipitoisuuden nousu, väsymys ja verihiutalemäärän pieneneminen.
Tutkimuksessa 231 yleisimmin raportoidut (≥ 15 %) haittavaikutukset olivat kilpirauhasen vajaatoiminta, hypertensio, proteinuria, ruokahalun heikentyminen, ripuli ja verihiutalemäärän pieneneminen.
Muut erityisryhmät
Iäkkäät potilaat
CLEAR-tutkimuksessa iäkkäillä (≥ 75-vuotiailla) potilailla esiintyi yleisemmin (≥ 10 %:n ero) proteinuriaa kuin nuoremmilla (< 65-vuotiailla) potilailla.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, iäkkäillä (≥ 75‑vuotiailla) potilailla esiintyi yleisemmin (≥ 10 %:n ero) verihiutalemäärän vähenemistä, painon laskua, proteinuriaa ja hypertensiota kuin nuoremmilla (< 65‑vuotiailla) potilailla.
Sukupuoli
CLEAR-tutkimuksessa miehillä esiintyi yleisemmin (≥ 10 %:n ero) ripulia kuin naisilla.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, naisilla esiintyi miehiä yleisemmin (≥ 10 %:n ero) pahoinvointia, oksentelua, voimattomuutta ja hypertensiota.
Etninen alkuperä
CLEAR-tutkimuksessa aasialaisilla potilailla esiintyi yleisemmin (≥ 10 %:n ero) palmoplantaarista erytrodysestesiaa (käsi-jalkaoireyhtymää), proteinuriaa ja kilpirauhasen vajaatoimintaa (mukaan lukien veren tyreotropiinin nousua) ja valkoihoisilla potilailla esiintyi yleisemmin väsymystä, pahoinvointia, nivelsärkyä, oksentelua ja voimattomuutta.
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, aasialaisilla potilailla esiintyi valkoihoisia yleisemmin (≥ 10 %:n ero) kilpirauhasen vajaatoimintaa, suutulehdusta, verihiutalemäärän vähenemistä, proteinuriaa, dysfoniaa, palmoplantaarista erytrodysestesiaa (käsi-jalkaoireyhtymää) ja hypertensiota. Valkoihoisilla potilailla esiintyi vastaavasti enemmän pahoinvointia, voimattomuutta, väsymystä ja hyperkolesterolemiaa.
Hypertensio lähtötilanteessa
CLEAR-tutkimuksessa potilailla, joilla oli lähtötilanteessa hypertensio, esiintyi yleisemmin proteinuriaa kuin potilailla, joilla ei ollut lähtötilanteessa hypertensiota.
Diabetes lähtötilanteessa
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, potilailla, joilla oli lähtötilanteessa diabetes, esiintyi yleisemmin (≥ 10 %:n ero) proteinuriaa kuin niillä, joilla ei ollut lähtötilanteessa diabetesta.
Maksan vajaatoiminta
Munuaissyöpää sairastavista potilaista, joilla on maksan vajaatoimintaa, on vain vähän tietoja.
Munuaisten vajaatoiminta
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, potilailla, joilla oli lähtötilanteessa munuaisten vajaatoiminta, esiintyi yleisemmin trombosytopeniaa tai verihiutalemäärän vähenemistä kuin potilailla, joiden munuaiset toimivat normaalisti.
Potilaat, joiden paino on < 60 kg
Munuaissyöpää sairastaneiden potilaiden yhdistetyssä ryhmässä, jota hoidettiin lenvatinibilla ja everolimuusilla, ruumiinpainoltaan pienillä (< 60 kg) potilailla esiintyi yleisemmin (≥ 10 %:n ero) verihiutalemäärän vähenemistä ja hypertensiota.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Suurimmat kliinisesti tutkitut lenvatinibiannokset olivat 32 mg ja 40 mg päivässä. Kliinisissä tutkimuksissa on vahingossa tapahtuneiden annostusvirheiden takia otettu myös 40–48 mg:n kerta-annoksia. Yleisimmin havaitut haittavaikutukset näillä annoksilla olivat hypertensio, pahoinvointi, ripuli, väsymys, suutulehdus, proteinuria, päänsärky ja palmoplantaarisen erytrodysestesian (käsi-jalkaoireyhtymän) paheneminen. Myös sellaisia yliannostustapauksia on raportoitu, joissa lenvatinibia on otettu 6–10 kertaa suositeltua vuorokausiannosta suurempana kerta-annoksena. Näissä tapauksissa haittavaikutukset (munuaisten ja sydämen vajaatoiminta) olivat yhdenmukaisia lenvatinibin tunnetun turvallisuusprofiilin kanssa tai haittavaikutuksia ei esiintynyt ollenkaan.
Lenvatinibin yliannostukseen ei ole saatavilla erityistä vastalääkettä. Jos yliannostusta epäillään, lenvatinibihoito pitää keskeyttää ja potilaalle pitää tarvittaessa antaa sopivaa elintoimintoja tukevaa hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Solunsalpaajat, proteiinikinaasin estäjät, ATC-koodi: L01EX08
Vaikutusmekanismi
Lenvatinibi on reseptorityrosiinikinaasin (RTK) estäjä, joka estää valikoivasti endoteelikasvutekijän (VEGF) reseptoreiden VEGFR1 (FLT1), VEGFR2 (KDR) ja VEGFR3 (FLT4) kinaasin aktiivisuutta ja lisäksi muita angiogeneesiä edistäviin ja onkogeenisiin reitteihin liittyviä reseptorityrosiinikinaaseja, mukaan lukien fibroblastikasvutekijän (FGF) reseptorit FGFR1, 2, 3 ja 4 sekä verihiutalekasvutekijän (PDGF) reseptorit PDGFRα, KIT ja RET. Syngeenisten hiirten kasvainmalleissa lenvatinibi vähensi kasvaimeen liittyvien makrofagien määrää, lisäsi aktivoituneiden sytotoksisten T-solujen määrää ja esti kasvaimen kasvua paremmin yhdistelmänä monoklonaalisen PD‑1-vasta-aineen kanssa kuin kumpikaan hoito yksinään.
Lenvatinibin ja everolimuusin yhdistelmän angiogeneesiä ja kasvaimen kasvua estävä vaikutus oli voimakkaampi kuin kummankaan aineen yksinään käytettynä, minkä osoitti ihmisen endoteelisolujen proliferaation, verisuonimuodostuksen ja endoteelikasvutekijöiden signaloinnin väheneminen in vitro sekä hiiriin siirretyn ihmisen munuaissyövän kasvaintilavuuden pieneneminen.
Vaikka lenvatinibin hypertensiota aiheuttavan vaikutuksen mekanismia ei ole tutkittu suoranaisesti, sen oletetaan liittyvän VEGFR2:n estoon verisuonten endoteelisoluissa. Samalla tavalla ilman suoranaisia tutkimuksia oletetaan myös proteinuriaa aiheuttavan vaikutusmekanismin liittyvän VEGFR1:n ja VEGFR2:n suppressioon glomerulusten podosyyteissä.
Kilpirauhasen vajaatoiminnan aiheuttavaa mekanismia ei ole täysin selvitetty.
Lenvatinibin ja everolimuusin yhdistelmähoidon hyperkolesterolemiaa pahentavan vaikutuksen mekanismia ei ole tutkittu suoranaisesti, eikä sitä ole täysin selvitetty.
Vaikka lenvatinibin ja everolimuusin yhdistelmähoidon ripulia pahentavan vaikutuksen mekanismia ei ole tutkittu suoranaisesti, sen uskotaan liittyvän yksittäisten lääkeaineiden vaikutusmekanismin – lenvatinibin VEGF/VEGF- ja c‑KIT-eston ja everolimuusin mTOR/NHE3-eston – aiheuttamaan suoliston toiminnan heikentymiseen.
Kliininen teho ja turvallisuus
Ensilinjan hoito munuaissyöpää sairastavilla potilailla (yhdistelmänä pembrolitsumabin kanssa)
Lenvatinibin ja pembrolitsumabin yhdistelmän tehoa ensilinjan hoitona selvitettiin tutkimuksessa 307 (CLEAR). Kyseessä oli avoin, satunnaistettu monikeskustutkimus, johon osallistuneilla 1 069 potilaalla oli pitkälle edennyt munuaissyöpä (RCC), jossa oli kirkassolukomponentti ja muita histologisia piirteitä (kuten sarkomatoidisia ja papillaarisia piirteitä). Tutkimukseen otettiin potilaita riippumatta siitä, ilmensivätkö heidän kasvaimensa PD-L1:tä vai eivät. Tutkimukseen ei otettu potilaita, joilla oli aktiivinen autoimmuunisairaus tai jokin immunosuppressiohoitoa vaativa sairaus. Satunnaistaminen ositettiin maantieteellisen alueen perusteella (Pohjois-Amerikka ja Länsi-Eurooppa vs. ”muu maailma”) ja Memorial Sloan Kettering Cancer Center (MSKCC) -ennustepisteiden (hyvä, kohtalainen ja huono ennuste) perusteella.
Potilaat satunnaistettiin saamaan lenvatinibia 20 mg suun kautta kerran päivässä ja pembrolitsumabia 200 mg laskimoon 3 viikon välein (n = 355) tai lenvatinibia 18 mg suun kautta kerran päivässä ja everolimuusia 5 mg suun kautta kerran päivässä (n = 357) tai sunitinibia 50 mg suun kautta kerran päivässä 4 viikon ajan, minkä jälkeen pidettiin 2 viikon hoitotauko (n = 357). Kaikki lenvatinibin ja pembrolitsumabin yhdistelmää saaneet potilaat saivat aluksi lenvatinibia 20 mg suun kautta kerran päivässä. Mediaaniaika lenvatinibiannoksen ensimmäiseen pienentämiseen oli 1,9 kuukautta. Lenvatinibin keskimääräisen vuorokausiannoksen mediaani oli 14 mg. Hoitoa jatkettiin sietämättömään toksisuuteen tai tutkijan määrittämään ja riippumattoman radiologisen arviointilautakunnan (IRC) vahvistamaan, RECIST 1.1. -kriteerien (Response Evaluation Criteria in Solid Tumours 1.1) mukaiseen taudin etenemiseen asti. Lenvatinibin ja pembrolitsumabin yhdistelmän anto sallittiin myös RECIST-kriteerien mukaisen taudin etenemisen jälkeen, jos potilaan kliininen tila oli vakaa ja jos hoidosta oli tutkijan arvion mukaan edelleen kliinistä hyötyä. Pembrolitsumabihoitoa jatkettiin enintään 24 kuukauden ajan, mutta lenvatinibihoitoa oli mahdollista jatkaa pidempään kuin 24 kuukautta. Kasvaimen arviointi tehtiin lähtötilanteessa ja sen jälkeen 8 viikon välein.
Tutkimuspopulaation (355 potilasta lenvatinibin ja pembrolitsumabin yhdistelmää saaneessa ryhmässä ja 357 potilasta sunitinibia saaneessa ryhmässä) ominaisuudet olivat: mediaani-ikä 62 vuotta (vaihteluväli: 29–88 vuotta); 41 % oli vähintään 65‑vuotiaita; 74 % oli miehiä; 75 % oli valkoihoisia, 21 % aasialaisia, 1 % tummaihoisia ja 2 % muiden rotujen edustajia; 17 %:lla potilaista lähtötilanteen KPS oli 70–80 ja 83 %:lla 90–100; International Metastatic RCC Database Consortium (IMDC) ‑riskiluokituksen perusteella 33 %:n ennuste oli hyvä, 56 %:n kohtalainen ja 10 %:n huono, ja MSKCC-ennustepisteiden perusteella 27 %:n ennuste oli hyvä, 64 %:n kohtalainen ja 9 %:n huono. 99 %:lla potilaista oli metastasoitunut tauti ja 1 %:lla paikallisesti edennyt tauti. Yleisiä etäpesäkkeiden sijaintipaikkoja olivat keuhkot (69 %), imusolmukkeet (46 %) ja luusto (26 %).
Ensisijainen tehoa koskeva mittari oli RECIST 1.1 -kriteereihin perustuva, IRC:n arvioima elossaoloaika ilman taudin etenemistä (PFS). Toissijaisia tehoa koskevia mittareita olivat kokonaiselossaoloaika (OS) ja objektiivisten vasteiden osuus (ORR). Lenvatinibin ja pembrolitsumabin yhdistemä paransi PFS-, OS- ja ORR-tuloksia tilastollisesti merkitsevästi paremmin kuin sunitinibi ennalta määritellyssä välianalyysissa (lopullinen PFS-analyysi). PFS:n mediaani oli 23,9 kuukautta (95 %:n luottamusväli: 20,8; 27,7) lenvatinibin ja pembrolitsumabin yhdistelmällä ja 9,2 kuukautta (95 %:n luottamusväli: 6,0; 11,0) sunitinibilla, kun riskisuhde (HR) oli 0,39 (95 %:n luottamusväli: 0,32; 0,49; p‑arvo < 0,0001). OS:n osalta riskisuhde oli 0,66 (95 %:n luottamusväli: 0,49; 0,88; p‑arvo 0,0049), kun OS:n seurannan mediaanikesto oli 26,5 kuukautta ja lenvatinibin ja pembrolitsumabin yhdistelmähoidon mediaanikesto oli 17,0 kuukautta. ORR oli 71 % (95 %:n luottamusväli: 66, 76) lenvatinibin ja pembrolitsumabin yhdistelmällä ja 36 % (95 %:n luottamusväli: 31, 41) sunitinibilla p‑arvon ollessa < 0,0001. Taulukossa 5, kuvassa 1 ja kuvassa 2 on yhteenveto tehoa koskevista PFS-, OS- ja ORR-tuloksista tutkimussuunnitelman mukaisessa lopullisessa analyysissa (seurannan mediaanikesto 49,4 kuukautta). PFS-tulokset olivat yhdenmukaiset ennalta määritellyissä alaryhmissä sekä MSKCC-ennustepisteiden ja kasvainten PD‑L1-ilmentymisen mukaan jaetuissa ryhmissä. Taulukossa 6 on yhteenveto tehotuloksista MSKCC-ennustepisteiden perusteella jaettujen ryhmien mukaan.
Lopullista OS-analyysia ei korjattu huomioimaan myöhempiä hoitoja; 195/357 (54,6 %) potilasta sunitinibia saaneessa ryhmässä ja 56/355 (15,8 %) potilasta lenvatinibin ja pembrolitsumabin yhdistelmää saaneessa ryhmässä sai myöhemmin hoitoa PD‑1:n/PD‑L1:n estäjillä.
| Taulukko 5 Riippumattoman arviointilautakunnan (IRC) vahvistamat tehotulokset munuaissyövän osalta CLEAR-tutkimuksessa | ||
Lenvatinibi 20 mg ja pembrolitsumabi 200 mg N = 355 | Sunitinibi 50 mg N = 357 | |
| Elossaoloaika ilman taudin etenemistä (PFS)* | ||
| Tapahtumien lukumäärä, n (%) | 207 (58 %) | 214 (60 %) |
| PFS:n mediaani kuukausina (95 %:n luottamusväli)a | 23,9 (20,8; 27,7) | 9,2 (6,0; 11,0) |
| Riskisuhde (95 %:n luottamusväli)b, c | 0,47 (0,38; 0,57) | |
| p-arvoc | < 0,0001 | |
| Kokonaiselossaoloaika (OS) | ||
| Kuolemien lukumäärä, n (%) | 149 (42 %) | 159 (45 %) |
| OS:n mediaani kuukausina (95 %:n luottamusväli) | 53,7 (48,7; EA) | 53,4 (40,9, EA) |
| Riskisuhde (95 %:n luottamusväli)b, c | 0,79 (0,63; 0,99) | |
| p-arvoc | 0,0424 | |
| Objektiivisten vasteiden lukumäärä (vahvistettu) | ||
| Objektiivisten vasteiden lukumäärä, n (%) | 253 (71,3 %) | 131 (36,7 %) |
| (95 %:n luottamusväli) | (66,6; 76,0) | (31,7; 41,7) |
| Täydellisten vasteiden (CR) lukumäärä, n (%) | 65 (18,3 %) | 17 (4,8 %) |
| Osittaisten vasteiden (PR) lukumäärä, n (%) | 188 (53,0 %) | 114 (32 %) |
| p-arvod | < 0,0001 | |
| Vasteen kestoa | ||
| Mediaani kuukausina (vaihteluväli) | 26,7 (1,64+; 55,92+) | 14,7 (1,64+; 54,08+) |
Kasvaimet arvioitiin RECIST 1.1. -kriteerien mukaisesti; ORR-tuloksissa ovat mukana vain vahvistetut vasteet. Tiedonkeruun katkaisupiste = 31.7.2022 EA = ei arvioitavissa * Ensisijainen PFS-analyysi käsitti uusien syöpähoitojen sensuroinnin. PFS-tulokset olivat johdonmukaiset riippumatta siitä, sensuroitiinko uudet syöpähoidot vai ei. a. Kvartiilit on arvioitu Kaplan-Meierin menetelmällä. b. Riskisuhde perustuu Coxin suhteellisten riskitiheyksien malliin, jossa hoitoryhmää käytetään tekijänä; tasatulosten kohdalla käytetään Efronin approksimaatiomallia. c. Ositus on tehty maantieteellisen alueen perusteella (alue 1: Länsi-Eurooppa ja Pohjois-Amerikka, alue 2: muu maailma) ja MSKCC-ennustepisteiden (hyvä, kohtalainen ja huono ennuste) perusteella IxRS:ssä. Nimellinen kaksipuolinen p-arvo perustuu ositettuun log-rank-testiin. d. Nimellinen kaksipuolinen p-arvo perustuu ositettuun Cochran-Mantel-Haenszelin (CMH) testiin. Aiemmassa etukäteen määritellyssä lopullisessa ORR-analyysissa (seuranta-ajan mediaani 17,3 kuukautta) lenvatinibin ja pembrolitsumabin yhdistelmällä saavutettiin tilastollisesti merkitsevästi parempi ORR kuin sunitinibilla, (kerroinsuhde: 3,84 (95 %:n luottamusväli: 2,81; 5,26), p-arvo < 0,0001). | ||
Kuva 1Kaplan-Meier-kuvaajat elossaoloajasta ilman taudin etenemistä CLEAR-tutkimuksessa*
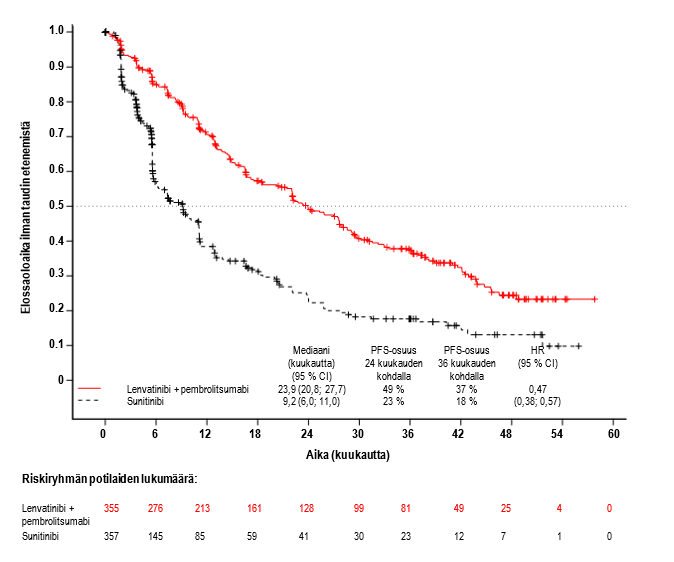
Tiedonkeruun katkaisupiste: 31.7.2022
*Perustuu päivitettyyn PFS-analyysiin, joka tehtiin tutkimussuunnitelman mukaisen lopullisen OS-analyysin aikaan.
Kuva 2 Kaplan-Meier-kuvaajat kokonaiselossaoloajasta CLEAR-tutkimuksessa*
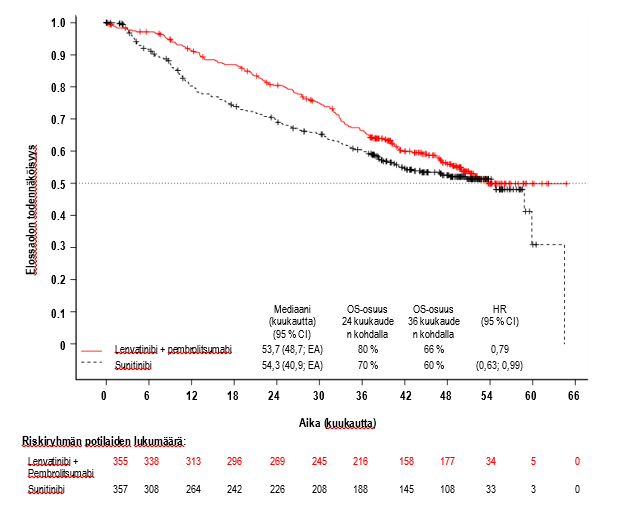
EA = ei arvioitavissa.
Tiedonkeruun katkaisupiste: 31.7.2022
*Perustuu tutkimussuunnitelman mukaiseen lopulliseen OS-analyysiin.
CLEAR-tutkimusta ei ollut suunniteltu tehon arviointiin yksittäisissä alaryhmissä. Taulukossa 6 esitetään yhteenveto tehon mittareista MSKCC:n kriteereillä määritellyn ennusteryhmän mukaan lopullisen OS-analyysin perusteella seurannan mediaanikeston 49,4 kuukautta kohdalla.
Taulukko 6 CLEAR-tutkimuksen tehoa koskevat tulokset MSKCC:n kriteereillä määritellyn ennusteryhmän mukaan
| Lenvatinibi + pembrolitsumabi (N = 355) | Sunitinibi (N = 357) | Lenvatinibi + pembrolitsumabi vs. sunitinibi | |||
| Potilaiden lukumäärä | Tapahtumien lukumäärä | Potilaiden lukumäärä | Tapahtumien lukumäärä | ||
| Elossaoloaika ilman taudin etenemistä (PFS) IRC:n mukaana | PFS-riskisuhde (95 %:n luottamusväli) | ||||
| Hyvä | 96 | 56 | 97 | 65 | 0,46 (0,32; 0,67) |
| Kohtalainen | 227 | 129 | 228 | 130 | 0,51 (0,40; 0,65) |
| Huono | 32 | 22 | 32 | 19 | 0,18 (0,08; 0,42) |
| Kokonaiselossaoloaika (OS)a | OS-riskisuhde (95 %:n luottamusväli) | ||||
| Hyvä | 96 | 27 | 97 | 31 | 0,89 (0,53; 1,50) |
| Kohtalainen | 227 | 104 | 228 | 108 | 0,81 (0,62; 1,06) |
| Huono | 32 | 18 | 32 | 20 | 0,59 (0,31; 1,12) |
a Seurannan mediaanikesto 49,9 kuukautta (tiedonkeruun katkaisupiste – 31.7.2022)
Avoin yhden hoitoryhmän vaiheen 2 tutkimus
Lisätietoja on saatavilla avoimesta vaiheen 2 tutkimuksesta KEYNOTE-B61, jossa oli yksi hoitoryhmä: ensilinjan hoitona annettiin lenvatinibin (20 mg kerran päivässä) ja pembrolitsumabin (400 mg 6 viikon välein) yhdistelmää potilaille, joilla oli pitkälle edennyt tai metastaattinen munuaissyöpä (RCC) ja ei-kirkassoluinen histologia (n = 158); näistä 59 % oli papillaarisia, 18 % kromofobisia, 4 %:ssa tapauksista oli translokaatio, 1 % medullaarisia, 13 % määrittelemättömiä ja 6 % muita. Objektiivisten vasteiden osuus (ORR) oli 50,6 % (95 %:n luottamusväli [42,6; 58,7]), ja vasteen mediaanikesto oli 19,5 kuukautta (95 %:n luottamusväli 15,3; ES).
Toisen linjan hoito munuaissyöpää sairastavilla potilailla (yhdistelmänä everolimuusin kanssa)
Lenvatinibin turvallisuutta ja tehoa yksinään tai yhdistelmänä everolimuusin kanssa annettuna arvioitiin satunnaistetussa, avoimessa monikeskustutkimuksessa, eli tutkimuksessa 205, johon osallistuneilla potilailla oli pitkälle edennyt tai metastaattinen munuaissyöpä (RCC), joka ei ollut poistettavissa. Tutkimus koostui vaiheesta 1b, joka oli annoshakuvaihe, ja vaiheesta 2. Vaiheeseen 1b osallistui 11 potilasta, jotka saivat 18 mg lenvatinibia ja 5 mg everolimuusia yhdistelmänä. Vaiheeseen 2 osallistui yhteensä 153 potilasta, joilla oli pitkälle edennyt tai metastaattinen munuaissyöpä, joka ei ollut poistettavissa. Nämä potilaat olivat saaneet yhtä aiempaa VEGF-täsmähoitoa. Yhteensä 62 potilasta sai lenvatinibin ja everolimuusin yhdistelmää suositeltuina annoksina. Potilaiden oli täytettävä muun muassa seuraavat kriteerit: histologisesti varmistettu pääasiallisesti kirkassoluinen munuaissyöpä, RECIST 1.1. -kriteerien mukainen radiologinen näyttö taudin etenemisestä, yksi aiempi VEGF-täsmähoito sekä Eastern Cooperative Oncology Group (ECOG) ‑toimintakykyluokka 0 tai 1.
Potilaat satunnaistettiin suhteessa 1:1:1 johonkin kolmesta hoitoryhmästä: 18 mg lenvatinibia + 5 mg everolimuusia, 24 mg lenvatinibia tai 10 mg everolimuusia. Potilaat ositettiin hemoglobiinipitoisuuden (miehillä ≤ 130 g/l tai > 130 g/l ja naisilla ≤ 115 g/l tai > 115 g/l) ja korjatun seerumin kalsiumpitoisuuden (≥ 10 mg/dl tai < 10 mg/dl) perusteella. Keskimääräisen päiväannoksen mediaani potilasta kohden yhdistelmähoitoryhmässä oli 13,5 mg lenvatinibia (75,0 % 18 mg:n aiotusta annoksesta) ja 4,7 mg everolimuusia (93,6 % 5 mg:n aiotusta annoksesta). Lopullinen annostaso yhdistelmähoitoryhmässä oli 18 mg 29 %:lle potilaista, 14 mg 31 %:lle potilaista, 10 mg 23 %:lle potilaista, 8 mg 16 %:lle potilaista ja 4 mg 2 %:lle potilaista.
Satunnaistetuista 153 potilaasta 73 % oli miehiä. Potilaiden iän mediaani oli 61 vuotta, ja 37 % potilaista oli vähintään 65-vuotiaita, 7 % vähintään 75-vuotiaita ja 97 % oli valkoihoisia. Metastaaseja oli 95 %:lla potilaista, ja 5 %:lla potilaista sairaus oli pitkälle edennyt eikä kasvain ollut poistettavissa. Kaikkien potilaiden lähtötilanteen ECOG-toimintakykyluokka oli joko 0 (55 %) tai 1 (45 %), ja toimintakykyluokkien osuudet olivat samankaltaiset kaikissa kolmessa hoitoryhmässä. Memorial Sloan Kettering Cancer Center (MSKCC) -ennustepisteiden perusteella huono ennuste todettiin 39 %:lla lenvatinibi + everolimuusi -ryhmän potilaista, 44 %:lla lenvatinibiryhmän potilaista ja 38 %:lla everolimuusiryhmän potilaista. International mRCC Database Consortium (IMDC) ‑ennustepisteiden perusteella huono ennuste todettiin 20 %:lla lenvatinibi + everolimuusi -ryhmän potilaista, 23 %:lla lenvatinibiryhmän potilaista ja 24 %:lla everolimuusiryhmän potilaista. Diagnoosin ja ensimmäisen annoksen välisen ajan mediaani oli lenvatinibi + everolimuusi -potilasryhmässä 32 kuukautta, lenvatinibiryhmässä 33 kuukautta ja everolimuusiryhmässä 26 kuukautta. Kaikki potilaat olivat aiemmin saaneet hoitoa yhdellä VEGF-estäjällä: 65 % sunitinibilla, 23 % patsopanibilla, 4 % tivotsanibilla, 3 % bevasitsumabilla, 2 % sorafenibilla ja 2 % aksitinibilla.
Ensisijainen tehoa koskevan lopputuloksen mittari oli tutkijoiden arvioimaan tuumorivasteeseen perustuva elossaoloaika ilman taudin etenemistä lenvatinibin ja everolimuusin yhdistelmää saaneessa ryhmässä verrattuna everolimuusiryhmään ja lenvatinibiryhmässä verrattuna everolimuusiryhmään. Muut tehoa koskevan lopputuloksen mittarit olivat kokonaiselossaolo ja tutkijoiden arvioima objektiivisten vasteiden lukumäärä. Kasvaimet arvioitiin RECIST 1.1. -kriteerien mukaisesti.
Lenvatinibi + everolimuusi -potilasryhmässä elossaoloaika ilman taudin etenemistä piteni tilastollisesti merkitsevästi ja kliinisesti merkittävästi suhteessa everolimuusiryhmään (ks. taulukko 7 ja kuva 3). Pienellä potilasmäärällä alaryhmää kohden tehdyn eksploratiivisen post-hoc-analyysin perusteella myönteinen vaikutus elossaoloaikaan ilman taudin etenemistä oli riippumaton siitä, oliko aiemmassa VEGF-täsmähoitona käytetty sunitinibia (riskisuhde = 0,356 [95 %:n luottamusväli: 0,188, 0,674] vai muuta hoitoa (riskisuhde = 0,350 [95 %:n luottamusväli: 0,148, 0,828]). Myös lenvatinibiryhmässä elossaoloaika ilman taudin etenemistä parani everolimuusiryhmään verrattuna. Kokonaiselossaolo oli pisin lenvatinibi + everolimuusi -potilasryhmässä (taulukko 7 ja kuva 4). Tutkimusta ei ollut suunniteltu kokonaiselossaolon analysointia varten.
Yhdistelmähoidon vaikutusta elossaoloaikaan ilman taudin etenemistä ja objektiivisten vasteiden lukumäärään tuki myös retrospektiivinen, riippumaton, sokkoutettu kuvantamistutkimusten post-hoc-arvio. Lenvatinibi + everolimuusi -potilasryhmässä elossaoloaika ilman taudin etenemistä piteni tilastollisesti merkitsevästi ja kliinisesti merkittävästi verrattuna everolimuusiryhmään. Objektiivisten vasteiden lukumäärää koskevat tulokset olivat yhdenmukaisia tutkijoiden arvion kanssa: 35,3 % lenvatinibi + everolimuusi -potilasryhmässä, mikä käsitti yhden täydellisen vasteen ja 17 osittaista vastetta; yhdelläkään everolimuusiryhmän potilaista ei todettu objektiivista vastetta (P < 0,0001), mikä osoitti lenvatinibi + everolimuusi -ryhmän edun.
Taulukko 7 Tehoa koskevat tulokset yhden aiemman VEGF-täsmähoidon jälkeen munuaissyöpää koskeneessa tutkimuksessa 205
lenvatinibi 18 mg + everolimuusi 5 mg (N = 51) | lenvatinibi 24 mg (N = 52) | everolimuusi 10 mg (N = 50) | |
| Elossaoloaika ilman taudin etenemistä (PFS)a, tutkijoiden arvio | |||
| PFS:n mediaani kuukausina (95 %:n luottamusväli) | 14,6 (5,9, 20,1) | 7,4 (5,6, 10,2) | 5,5 (3,5, 7,1) |
Riskisuhde (95 %:n luottamusväli)b lenvatinibi + everolimuusi vs. everolimuusi | 0,40 (0,24, 0,67) | - | - |
P-arvo lenvatinibi + everolimuusi vs. everolimuusi | 0,0005 | - | - |
| Elossaoloaika ilman taudin etenemistä (PFS)a, retrospektiivinen, riippumaton post-hoc-arvio | |||
| PFS:n mediaani kuukausina (95 %:n luottamusväli) | 12,8 (7,4, 17,5) | 9,0 (5,6, 10,2) | 5,6 (3,6, 9,3) |
Riskisuhde (95 %:n luottamusväli)b lenvatinibi + everolimuusi vs. everolimuusi | 0,45 (0,26, 0,79) | - | - |
P-arvo lenvatinibi + everolimuusi vs. everolimuusi | 0,003 | - | - |
| Kokonaiselossaoloc | |||
| Kuolemien lukumäärä, n (%) | 32 (63) | 34 (65) | 37 (74) |
| Kokonaiselossaolon mediaani kuukausina (95 %:n luottamusväli) | 25,5 (16,4, 32,1) | 19,1 (13,6, 26,2) | 15,4 (11,8, 20,6) |
Riskisuhde (95 %:n luottamusväli)b lenvatinibi + everolimuusi vs. everolimuusi | 0,59 (0,36, 0,97) | - | - |
| Objektiivisten vasteiden lukumäärä, n (%), tutkijoiden arvio | |||
| Täydelliset vasteet | 1 (2) | 0 | 0 |
| Osittaiset vasteet | 21 (41) | 14 (27) | 3 (6) |
| Objektiivisten vasteiden lukumäärä | 22 (43) | 14 (27) | 3 (6) |
| Vakaa sairaus | 21 (41) | 27 (52) | 31 (62) |
| Vasteen keston mediaani kuukausina (95 %:n luottamusväli) | 13,0 (3,7, EA) | 7,5 (3,8, EA) | 8,5 (7,5, 9,4) |
Kasvaimet arvioitiin RECIST 1.1. -kriteerien mukaisesti. Tiedonkeruun katkaisupiste: 13.6.2014 Prosenttiosuudet perustuvat koko analyysijoukon potilaiden kokonaismäärään kyseisessä hoitoryhmässä. EA = ei arvioitavissa aPiste-estimaatit perustuvat Kaplan‑Meierin menetelmään ja 95 %:n luottamusvälit Greenwoodin bOsitettu riskisuhde perustuu ositettuun Coxin regressiomalliin, jossa hoitoa käytettiin kovariaattina ja hemoglobiinia ja korjattua seerumin kalsiumpitoisuutta ositteina. Tasatulosten korjaukseen käytettiin Efronin menetelmää. cTiedonkeruun katkaisupiste = 31.7.2015 | |||
Kuva 3: Kaplan‑Meier-kuvaaja elossaoloajasta ilman taudin etenemistä
(tutkijoiden arvio)
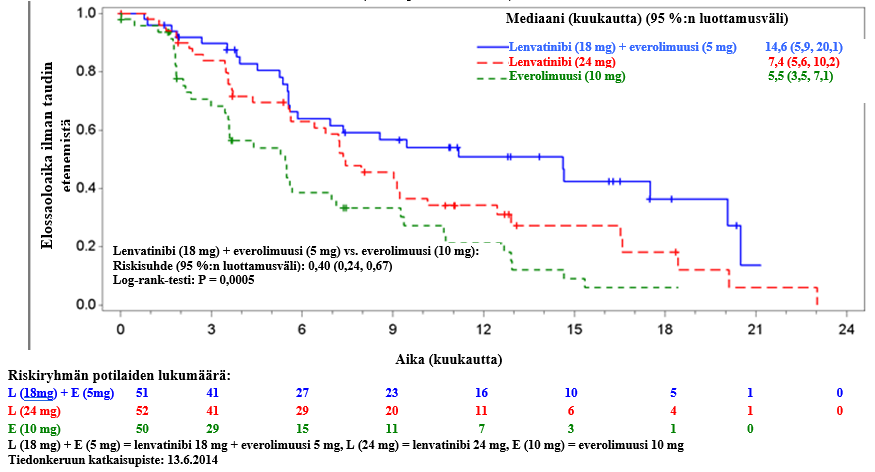
Kuva 4: Kaplan‑Meier-kuvaaja kokonaiselossaoloajasta
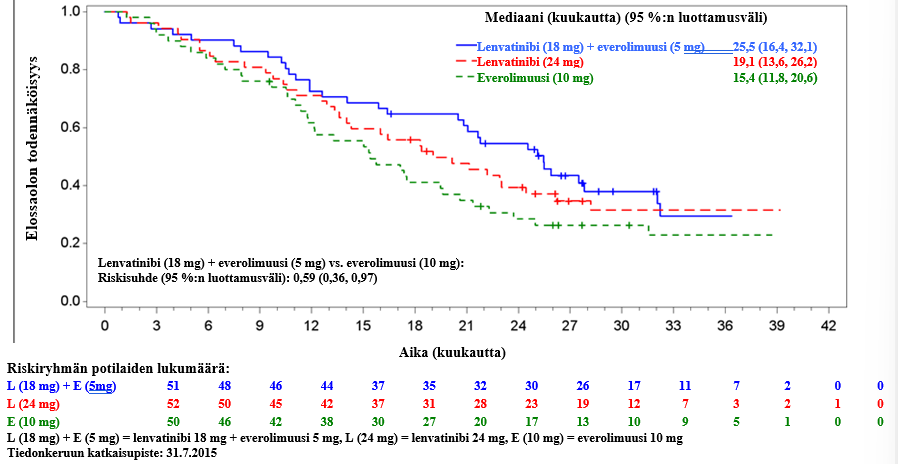
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset lenvatinibin käytöstä munuaissyövän hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Pediatriset tutkimukset
Lenvatinibin tehoa arvioitiin, mutta ei varmistettu, kahdessa avoimessa tutkimuksessa (lisätietoja pediatrisista potilaista on myös Lenvima-valmisteyhteenvedon kohdassa Farmakodynamiikka).
Tutkimus 261 oli avoin, yhdellä hoitoryhmällä toteutettu vaiheen 1/2 monikeskustutkimus, jossa yhdistelmähoitona everolimuusin kanssa annetun lenvatinibin turvallisuutta, siedettävyyttä ja kasvaimia tuhoavaa vaikutusta selvitettiin pediatrisilla potilailla (ja ≤ 21 vuoden ikäisillä nuorilla aikuisilla), joilla oli uusiutuneita tai refraktorisia kiinteitä maligniteetteja, mukaan lukien keskushermoston kasvaimet. Tutkimukseen otettiin ja siinä hoidettiin kaikkiaan 64 potilasta. Vaiheeseen 1 (yhdistelmähoidon annoshakuvaihe) otettiin 23 potilasta, jotka saivat hoitoa: 5 potilasta sai hoitoa annostasolla 1 (lenvatinibi 8 mg/m2 ja everolimuusi 3 mg/m2) ja 18 potilasta annostasolla 1 (lenvatinibi 11 mg/m2 ja everolimuusi 3 mg/m2). Yhdistelmähoidon suositeltu annos oli lenvatinibi 11 mg/m2 ja everolimuusi 3 mg/m2 kerran vuorokaudessa. Vaiheeseen 2 (laajennettu yhdistelmähoito) otettiin 41 potilasta, jotka saivat hoitoa suositellulla annoksella seuraavissa kohorteissa: Ewingin sarkooma (EWS, n = 10), rabdomyosarkooma (RMS, n = 20) ja korkea-asteinen gliooma (HGG, n = 11). Ensisijainen tehoa koskevan lopputuloksen vertailuperuste oli arviointikelpoisten potilaiden objektiivinen vasteprosentti (ORR) viikolla 16, jonka tutkija arvioi RECIST v.1.1- tai RANO-kriteerien (HGG-potilaiden kohdalla) perusteella. EWS- ja HGG-kohorteissa ei todettu yhtään objektiivista vastetta, ja RMS-kohortissa todettiin kaksi osittaista ORR-vastetta viikolla 16: 10 % (95 %:n luottamusväli: 1,2; 31,7).
Tutkimus 231 on avoin, vaiheen 2 monikeskus- ja koritutkimus, jossa lenvatinibin kasvaimia tuhoavaa vaikutusta ja turvallisuutta arvioidaan 2 – ≤ 21 vuoden ikäisillä lapsilla, nuorilla ja nuorilla aikuisilla, joilla on uusiutuneita tai refraktorisia kiinteitä maligniteetteja, mukaan lukien EWS, RMS ja HGG. Tutkimukseen otettiin kaikkiaan 127 potilasta, jotka saivat hoitoa lenvatinibin suositellulla annoksella (14 mg/m2) seuraavissa kohorteissa: EWS (n = 9), RMS (n = 17), HGG (n = 8) ja muut kiinteät kasvaimet (n = 9 kaikissa seuraavissa: diffuusi keskilinjan gliooma, medulloblastooma ja ependymooma; kaikki muut kiinteät kasvaimet n = 66). Ensisijainen tehoa koskevan lopputuloksen vertailuperuste oli arviointikelpoisten potilaiden ORR viikolla 16, jonka tutkija arvioi RECIST v.1.1- tai RANO-kriteerien (HGG-potilaiden kohdalla) perusteella. Yhtään objektiivista vastetta ei todettu potilailla, joilla oli HGG, diffuusi keskilinjan gliooma, medulloblastooma tai ependymooma. Sekä EWS- että RMS-kohorteissa todettiin kaksi osittaista ORR-vastetta viikolla 16: 22,2 % (95 %:n luottamusväli: 2,8; 60,0) ja 11,8 % (95 %:n luottamusväli: 1,5; 36,4). Kaikkien muiden kiinteiden kasvainten joukossa todettiin viisi osittaista ORR-vastetta (synoviaalisarkooma [n = 2], kaposiforminen hemangioendoteliooma [n = 1], Wilmsin kasvain eli nefroblastooma [n = 1] ja kirkassolukarsinooma [n = 1]) viikolla 16: 7,7 % (95 %:n luottamusväli: 2,5; 17,0).
Farmakokinetiikka
Lenvatinibin farmakokineettisiä parametreja on tutkittu terveillä aikuisilla koehenkilöillä sekä aikuisilla koehenkilöillä, joilla on maksan vajaatoimintaa, munuaisten vajaatoimintaa ja kiinteitä kasvaimia.
Imeytyminen
Lenvatinibi imeytyy nopeasti suun kautta tapahtuneen annon jälkeen; tmax havaittiin tyypillisesti 1–4 tuntia annoksen jälkeen. Ruoka ei vaikuta imeytymisen määrään, mutta hidastaa imeytymistä. Terveille koehenkilöille ruoan kanssa annettaessa huippupitoisuus plasmassa viivästyy 2 tunnilla. Absoluuttista biologista hyötyosuutta ihmisellä ei ole määritetty, mutta tiedot massatasetutkimuksesta viittaavat noin 85 %:iin.
Jakautuminen
Lenvatinibin sitoutuminen ihmisen plasman proteiineihin on runsasta in vitro: 98–99 % (0,3–30 μg/ml, mesilaatti). Lenvatinibi sitoutui pääasiassa albumiiniin sekä vähäisemmässä määrin happamaan alfa-1-glykoproteiiniin ja γ‑globuliiniin. Plasman proteiineihin sitoutumisen todettiin olevan samaa luokkaa (97–99 %) maksan vajaatoimintaa sairastavilla henkilöillä, munuaisten vajaatoimintaa sairastavilla henkilöillä ja vastaavilla terveillä henkilöillä, eikä sitoutuminen ollut riippuvaista lenvatinibin pitoisuuksista (0,2–1,2 μg/ml).
Veren ja plasman lenvatinibipitoisuuksien suhde in vitro vaihteli välillä 0,589–0,608 (0,1–10 μg/ml, mesilaatti).
In vitro -tutkimukset osoittavat lenvatinibin olevan P-gp:n ja BCRP:n substraatti. Lenvatinibin P-gp- ja BCRP-välitteistä kuljettajaproteiinitoimintaa estävä vaikutus oli minimaalinen tai olematon. Myöskään P-gp mRNA:n ekspressiota indusoivaa vaikutusta ei havaittu. Lenvatinibi ei ole OAT1:n, OAT3:n, OATP1B1:n, OATP1B3:n, OCT1:n, OCT2:n tai BSEP:n substraatti. Lenvatinibi ei estänyt aldehydioksidaasitoimintaa ihmisen maksasolujen sytosolissa.
Potilailla ensimmäisen annoksen näennäisen jakautumistilavuuden mediaani (Vz/F) vaihteli välillä 50,5–92 l, ja se oli yleisesti ottaen yhdenmukainen annosryhmien (3,2–32 mg) välillä. Vastaava vakaan tilan näennäisen jakautumistilavuuden (Vz/Fss) mediaani vaihteli välillä 43,2–121 l, ja se oli myös yleisesti ottaen yhdenmukainen annosryhmien välillä.
Biotransformaatio
Sytokromi P450 3A4:n osoitettiin in vitro olevan pääasiallinen (> 80 %) lenvatinibin P450-välitteiseen metaboliaan osallistuva isoformi. In vivo -tiedot kuitenkin osoittivat ei-P450-välitteisten reittien osallistuvan merkittävässä määrin lenvatinibin kokonaismetaboliaan. Näin ollen CYP3A4:n indusoijilla ja estäjillä oli minimaalinen vaikutus lenvatinibialtistukseen in vivo (ks. kohta Yhteisvaikutukset).
Lenvatinibin demetyloituneen muodon (M2) havaittiin olevan pääasiallinen metaboliitti ihmisen maksan mikrosomeissa. Pääasialliset metaboliitit ihmisen ulosteessa, M2’ ja M3’, muodostuivat M2-metaboliitista ja lenvatinibista aldehydioksidaasin avulla.
Plasmanäytteissä, jotka kerättiin 24 tunnin kuluessa annon jälkeen, lenvatinibin osuus radioaktiivisuudesta plasman radiokromatogrammeissa oli 97 %, kun taas M2-metaboliitin osuus oli 2,5 %. AUC(0–inf)-arvon perusteella lenvatinibin osuus kokonaisradioaktiivisuudesta plasmassa oli 60 % ja osuus kokonaisradioaktiivisuudesta veressä 64 %.
Ihmisillä tehdyn massatase-eritystutkimuksen tiedot osoittavat lenvatinibin metaboloituvan ihmisillä voimakkaasti. Pääasiallisten metaboliareittien havaittiin ihmisellä olevan hapettuminen aldehydioksidaasin avulla, demetylaatio CYP3A4:n avulla, glutationin konjugaatio, jossa O-aryyliryhmä (kloorifenyyliosa) eliminoituu, sekä näiden reittien yhdistelmät ja niitä seuraavat biotransformaatiot (esim. glukuronidaatio, glutationiosan hydrolyysi, kysteiiniosan pilkkoutuminen sekä kysteinyyliglysiinin ja kysteiinin konjugaattien molekyylinsisäinen uudelleen ryhmittyminen ja sitä seuraava dimerisaatio). Nämä metaboliset reitit in vivo ovat yhdenmukaisia ihmisen biomateriaaleilla tehtyjen in vitro -kokeiden tulosten kanssa.
Kuljettajaproteiineilla tehdyt in vitro -kokeet
Ks. jakautumista koskeva kohta.
Eliminaatio
Pitoisuus plasmassa laskee bieksponentiaalisesti huippupitoisuuden (Cmax) jälkeen. Lenvatinibin keskimääräinen terminaalinen eksponentiaalinen puoliintumisaika on noin 28 tuntia.
Kun radioaktiivisesti merkittyä lenvatinibia annettiin 6 potilaalle, joilla oli kiinteitä kasvaimia, noin kaksi kolmannesta radioaktiivisesta merkkiaineesta poistui ulosteen mukana ja yksi neljännes virtsan mukana. M3-metaboliitti oli tärkein analyytti ulosteessa (noin 17 % annoksesta) ja sen jälkeen M2’ (noin 11 % annoksesta) ja M2 (noin 4,4 % annoksesta).
Lineaarisuus/ei-lineaarisuus
Annosten suhteellisuus ja kumuloituminen
Potilailla, joilla oli kiinteitä kasvaimia ja joille annettiin yksittäisiä tai useita lenvatinibiannoksia kerran päivässä, lenvatinibille altistus (Cmax ja AUC) kasvoi suorassa suhteessa annettuun annokseen annosvälillä 3,2–32 mg kerran päivässä.
Lenvatinibin kumuloituminen vakaassa tilassa on minimaalista. Tällä alueella kumuloitumisindeksi (Rac) vaihteli välillä 0,96 (20 mg) – 1,54 (6,4 mg).
Erityisryhmät
Maksan vajaatoiminta
Lenvatinibin farmakokinetiikkaa 10 mg:n kerta-annoksen jälkeen arvioitiin 6 koehenkilöllä, joilla oli lievä (Child-Pugh A) tai keskivaikea (Child-Pugh B) maksan vajaatoiminta. Lisäksi arvioitiin 5 mg:n annosta 6 koehenkilöllä, joilla oli vaikea (Child-Pugh C) maksan vajaatoiminta. Verrokkeina käytettiin kahdeksaa tervettä, demografisesti kaltaistettua henkilöä, jotka saivat 10 mg:n annoksen. Puoliintumisajan mediaani oli verrannollinen koehenkilöillä, joilla oli lievä, keskivaikea tai vaikea maksan vajaatoiminta, ja koehenkilöillä, joilla oli normaali maksan toiminta, ja se vaihteli välillä 26–31 tuntia. Lenvatinibiannoksen virtsaan erittyvä prosenttiosuus oli pieni kaikissa kohorteissa (< 2,16 % hoitokohortista riippumatta).
Lenvatinibille altistuminen oli annoskorjattujen AUC(0‑t)- ja AUC(0‑inf)-arvojen perusteella lievää maksan vajaatoimintaa sairastavilla koehenkilöillä 119 %, keskivaikeaa maksan vajaatoimintaa sairastavilla 107 % ja vaikeaa maksan vajaatoimintaa sairastavilla 180 % niiden koehenkilöiden arvosta, joiden maksan toiminta oli normaali. On todettu, että plasman proteiineihin sitoutuminen maksan vajaatoimintaa sairastavien henkilöiden plasmassa oli samanlaista kuin kaltaistetuilla terveillä henkilöillä, eikä pitoisuudella havaittu olevan riippuvuussuhdetta. Annostussuositukset, ks. kohta Annostus ja antotapa.
Munuaisten vajaatoiminta
Lenvatinibin farmakokinetiikkaa 24 mg:n kerta-annoksen jälkeen arvioitiin 6 koehenkilöllä, joilla oli lievä, keskivaikea tai vaikea munuaisten vajaatoiminta, sekä 8 terveellä, demografisesti kaltaistetulla verrokilla. Loppuvaiheen munuaissairautta sairastavia potilaita ei tutkittu.
Lenvatinibille altistuminen oli AUC(0‑inf)-tietojen perusteella lievää munuaisten vajaatoimintaa sairastavilla koehenkilöillä 101 %, keskivaikeaa munuaisten vajaatoimintaa sairastavilla koehenkilöillä 90 % ja vaikeaa munuaisten vajaatoimintaa sairastavilla koehenkilöillä 122 % niiden koehenkilöiden arvosta, joiden munuaisten toiminta oli normaali. On todettu, että plasman proteiineihin sitoutuminen munuaisten vajaatoimintaa sairastavien henkilöiden plasmassa oli samanlaista kuin kaltaistetuilla terveillä henkilöillä, eikä pitoisuudella havaittu olevan riippuvuussuhdetta. Annostussuositukset, ks. kohta Annostus ja antotapa.
Ikä, sukupuoli, paino, etninen alkuperä
Populaatiofarmakokineettisessä analyysissa, joka käsitti enintään 24 mg lenvatinibia kerran päivässä saavia potilaita, iällä, sukupuolella, painolla ja rodulla (japanilainen vs. muu, valkoihoinen vs. muu) ei ollut merkittävää vaikutusta puhdistumaan (ks. kohta Annostus ja antotapa).
Pediatriset potilaat
Populaatiofarmakokineettisessä analyysissa, joka suoritettiin 2–12 vuoden ikäisillä pediatrisilla potilailla ja joka käsitti tiedot pediatriseen lenvatinibiohjelmaan kuuluneista 3 pediatrisesta potilaasta, joiden ikä oli 2 – < 3 vuotta, 28 pediatrisesta potilaasta, joiden ikä oli ≥ 3 – < 6 vuotta, ja 89 pediatrisesta potilaasta, joiden ikä oli 6 – ≤ 12 vuotta, lenvatinibin puhdistumaan suun kautta (CL/F) vaikutti tutkittavan paino, ei kuitenkaan ikä. Ennustetut altistustasot käyrän alle jäävän pinta-alan mukaan vakaassa tilassa (AUCss) pediatrisilla potilailla, jotka saivat 14 mg/m2, olivat verrannolliset kiinteän 24 mg:n annoksen saaneiden aikuisten potilaiden altistustasoihin. Näissä tutkimuksissa ei havaittu ilmeisiä eroja vaikuttavan aineen, lenvatinibin, farmakokinetiikassa lapsilla (ikä 2–12 vuotta), nuorilla ja nuorilla aikuisilla, joilla oli tutkittuja kasvaintyyppejä, mutta lapsia koskevat tiedot ovat suhteellisen rajalliset, joten varmoja päätelmiä ei voida tehdä (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Toistuvien annosten toksisuutta arvioivissa tutkimuksissa (kesto enintään 39 viikkoa) lenvatinibi aiheutti toksikologisia muutoksia eri elimissä ja kudoksissa. Muutokset liittyivät lenvatinibin odotettuihin farmakologisiin vaikutuksiin, ja niitä olivat glomerulopatia, kivesten solukato, munasarjojen follikulaarinen atresia, maha-suolikanavan muutokset, luuston muutokset, lisämunuaisten muutokset (rotilla ja koirilla) ja valtimoleesiot (arteriaalinen fibrinoidi nekroosi, mediaalinen rappeuma tai verenvuoto) rotilla, koirilla ja cynomolgus-apinoilla. Maksatoksisuuteen liittyvää transaminaasipitoisuuksien kohoamista havaittiin myös rotilla, koirilla ja apinoilla. Toksikologisten muutosten havaittiin hävinneen 4 viikkoa kestäneen palautumisjakson lopussa kaikilla tutkituilla eläinlajeilla.
Geenitoksisuus
Lenvatinibi ei ollut geenitoksinen.
Lenvatinibilla ei ole tehty karsinogeenisuustutkimuksia.
Lisääntymis- ja kehitystoksisuus
Lenvatinibin vaikutusta hedelmällisyyteen arvioivia erityisiä eläintutkimuksia ei ole tehty. Toistuvien annosten toksisuutta arvioivissa eläintutkimuksissa havaittiin kuitenkin muutoksia kiveksissä (siementiehyiden epiteelin solukatoa) ja munasarjoissa (follikulaarista atresiaa) altistuksilla, jotka vastasivat 11–15-kertaista (rotta) tai 0,6–7-kertaista (apina) odotettua kliinistä altistusta (perustuu AUC-arvoon) ihmisen suurimmalla siedetyllä annoksella. Näiden löydösten havaittiin korjautuneen 4 viikon pituisen palautumisjakson lopussa.
Lenvatinibin anto organogeneesin aikana johti rotilla alkiokuolemiin ja teratogeenisuuteen (sikiöiden ulkoisiin ja luuston poikkeavuuksiin) altistuksilla, jotka olivat pienempiä kuin kliininen altistus (perustuu AUC-arvoon) ihmisen suurimmalla siedetyllä annoksella, ja kaniineilla alkiokuolemiin ja teratogeenisuuteen (sikiöiden ulkoisiin, sisäelinten ja luuston poikkeavuuksiin) kehon pinta-alan (mg/m2) perusteella ihmisen suurinta siedettyä annosta vastaavalla altistuksella. Nämä löydökset viittaavat mahdolliseen teratogeenisuuteen, joka todennäköisesti liittyy lenvatinibin farmakologiseen aktiivisuuteen verisuonien kasvua estävänä aineena.
Lenvatinibi ja sen metaboliitit erittyvät rottaemojen maitoon.
Toksisuustutkimukset nuorilla eläimillä
Kuolleisuus oli annosta rajoittava toksisuus nuorilla rotilla, joille anto aloitettiin 7. tai 21. postnataalisena päivänä, ja se havaittiin altistuksilla, jotka olivat 125 tai 12 kertaa pienempiä kuin altistustasot, joilla aikuisilla rotilla havaittiin kuolleisuutta, mikä viittaa siihen, että herkkyys toksisuudelle sitä suurempaa, mitä nuorempi eläin on. Kuolleisuus voidaan siten yhdistää pohjukaissuolen primaarileesioihin liittyviin komplikaatioihin, ja kehittymättömiin elimiin kohdistunut toksisuus mahdollisesti lisää kuolleisuutta.
Lenvatinibin toksisuus oli voimakkaampaa nuoremmilla rotilla, joille anto aloitettiin 7. postnataalisena päivänä, kuin rotilla, joille anto aloitettiin 21. postnataalisena päivänä. Kuolleisuutta ja tietyntyyppistä toksisuutta havaittiin lisäksi aikaisemmin nuorilla rotilla, joiden annos oli 10 mg/kg, kuin aikuisilla rotilla, jotka saivat samansuuruisen annoksen. Nuorilla rotilla havaittiin lisäksi kasvun hidastumista, fyysisen kehityksen sekundaarista viivästymistä ja farmakologisiin vaikutuksiin yhdistettyjä leesioita (etuhampaissa, reisiluussa [kasvurustossa], munuaisissa, lisämunuaisissa ja pohjukaissuolessa).
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Kalsiumkarbonaatti
Mannitoli
Mikrokiteinen selluloosa
Hydroksipropyyliselluloosa
Matalasubstituutioasteinen hydroksipropyyliselluloosa
Talkki
Kapselin kuori
Hypromelloosi
Titaanidioksidi (E 171)
Keltainen rautaoksidi (E 172)
Punainen rautaoksidi (E 172)
Painomuste
Shellakka
Musta rautaoksidi (E 172)
Kaliumhydroksidi
Propyleeniglykoli
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Säilytä alle 25 °C.
Säilytä alkuperäisessä läpipainopakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
KISPLYX kapseli, kova
4 mg (L:ei) 30 fol (1663,07 €)
10 mg (L:ei) 30 fol (1748,26 €)
PF-selosteen tieto
Polyamidi/alumiini/PVC/alumiiniläpipainopakkaukset, jotka sisältävät 10 kapselia. Yksi pakkaus sisältää 30, 60 tai 90 kovaa kapselia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kisplyx 4 mg kovat kapselit
Kellertävän punainen runko ja kellertävän punainen kansi. Pituus on noin 14,3 mm. Kanteen on merkitty mustalla musteella ”Є” ja runkoon ”LENV 4 mg”.
Kisplyx 10 mg kovat kapselit
Keltainen runko ja kellertävän punainen kansi. Pituus on noin 14,3 mm. Kanteen on merkitty mustalla musteella ”Є” ja runkoon ”LENV 10 mg”.
Käyttö- ja käsittelyohjeet
Potilasta hoitava henkilö ei saa avata kapselia, jotta vältetään toistuva altistus kapselin sisällölle.
Suspension valmistus ja anto:
- Suspensio voidaan valmistaa veteen, omenamehuun tai maitoon. Jos suspensio annetaan ravitsemusletkun kautta, se on valmistettava veteen.
- Pane määrättyä annosta vastaava määrä kapseleita (enintään 5 kapselia) pieneen astiaan (tilavuudeltaan noin 20 ml tai 4 teelusikallista) tai mittaruiskuun (20 ml). Älä riko tai murskaa kapseleita.
-
Lisää astiaan tai mittaruiskuun 3 ml nestettä. Odota 10 minuuttia, jotta kapselin kuori (ulkopinta) liukenee, ja sitten sekoita tai ravista seosta 3 minuutin ajan, kunnes kapselit ovat täysin liuenneet.
- Jos käytät mittaruiskua, sulje se korkilla, irrota mäntä ja lisää neste ruiskuun toisella ruiskulla tai kalibroidulla tiputtimella. Kiinnitä mäntä takaisin paikalleen ennen sekoittamista.
- Anna astian tai mittaruiskun koko sisältö. Suspensio voidaan antaa astiasta suoraan suuhun tai mittaruiskusta suoraan suuhun tai ravitsemusletkun kautta.
- Lisää seuraavaksi astiaan tai mittaruiskuun vielä 2 ml nestettä toisella ruiskulla tai tiputtimella. Pyöritä tai ravista nesteseosta ja anna potilaalle. Varmista, että koko annos on otettu, toistamalla tämä vaihe vähintään kahdesti, kunnes jäämiä ei enää näy.
Huomaa: Yhteensopivuus on vahvistettu seuraavien suhteen: polypropeeniruiskut ja läpimitaltaan vähintään 5 F:n ravitsemusletkut (polyvinyylikloridi- tai polyuretaaniletku), läpimitaltaan vähintään 6 F:n (silikoniletku) ja läpimitaltaan enintään 16 F:n polyvinyylikloridi-, polyuretaani- ja silikoniletkut.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
KISPLYX kapseli, kova
4 mg 30 fol
10 mg 30 fol
- Ylempi erityiskorvaus (100 %). Lenvatinibi: Kilpirauhassyövän, maksasolukarsinooman, munuaissyövän ja kohdunrungon syövän hoito erityisin edellytyksin (1508).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Lenvatinibi: Kilpirauhassyövän, maksasolukarsinooman, munuaissyövän ja kohdunrungon syövän hoito erityisin edellytyksin (3019).
ATC-koodi
L01EX08
Valmisteyhteenvedon muuttamispäivämäärä
17.04.2025
Yhteystiedot
Svärdvägen 15
18233 Danderyd
Ruotsi
+46 8 501 01 60
www.eisai.eu
nordic_medinfo@eisai.net
Edustaja Suomessa: EISAI AB
