PEMETREXED MEDAC kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 500 mg, 1000 mg
Vaikuttavat aineet ja niiden määrät
Pemetrexed medac 100 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Yksi injektiopullo sisältää pemetreksedidinatriumhemipentahydraattia määrän, joka vastaa 100 mg pemetreksediä.
Apuaine, jonka vaikutus tunnetaan
Yksi 100 mg injektiopullo sisältää noin 11 mg natriumia.
Pemetrexed medac 500 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Yksi injektiopullo sisältää pemetreksedidinatriumhemipentahydraattia määrän, joka vastaa 500 mg pemetreksediä.
Apuaine, jonka vaikutus tunnetaan
Yksi 500 mg injektiopullo sisältää noin 54 mg natriumia.
Pemetrexed medac 1000 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Yksi injektiopullo sisältää pemetreksedidinatriumhemipentahydraattia määrän, joka vastaa 1000 mg pemetreksediä.
Apuaine, jonka vaikutus tunnetaan
Yksi 1000 mg injektiopullo sisältää noin 108 mg natriumia.
Käyttökuntoon saatetun liuoksen (välikonsentraatin) pitoisuus on 25 mg/ml pemetreksediä (ks. kohta Käyttö- ja käsittelyohjeet).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos.
Kliiniset tiedot
Käyttöaiheet
Keuhkopussin pahanlaatuinen mesoteliooma
Pemetrexed medac on tarkoitettu yhdessä sisplatiinin kanssa pahanlaatuisen keuhkopussin mesoteliooman hoitoon potilaille, jotka eivät ole saaneet aiempaa kemoterapiahoitoa, ja kun leikkaushoito ei ole mahdollinen.
Ei-pienisoluinen keuhkosyöpä
Pemetrexed medac on tarkoitettu yhdessä sisplatiinin kanssa ensilinjan hoidoksi potilaille, joilla on paikallisesti levinnyt tai metastaattinen, histologialtaan pääosin muunlainen kuin levyepiteeliperäinen
ei-pienisoluinen keuhkosyöpä (ks. kohta Farmakodynamiikka).
Pemetrexed medac on tarkoitettu monoterapiana ylläpitohoidoksi välittömästi platinapohjaisen kemoterapian jälkeen potilaille, joilla on paikallisesti levinnyt tai metastaattinen, histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä, joka ei ole edennyt ensilinjan hoitosyklien jälkeen (ks. kohta Farmakodynamiikka).
Pemetrexed medac on tarkoitettu monoterapiana toisen linjan hoidoksi potilaille, joilla on paikallisesti levinnyt tai metastaattinen, histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (ks. kohta Farmakodynamiikka).
Ehto
Valmistetta saa antaa vain syövän kemoterapian antoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Pemetrexed medac -valmistetta saa antaa vain syövän kemoterapian antoon perehtyneen lääkärin valvonnassa.
Annostus
Pemetrexed medac -valmisteen ja sisplatiinin yhdistelmähoito
Pemetrexed medac -valmisteen suositusannos on 500 mg/m² 10 minuutin laskimoinfuusiona jokaisen 21 vuorokautta kestävän hoitosyklin ensimmäisenä päivänä. Sisplatiinin suositusannos on 75 mg/m² kahden tunnin infuusiona noin 30 minuuttia pemetreksedi-infuusion jälkeen jokaisen 21 vuorokautta
kestävän hoitosyklin ensimmäisenä päivänä. Potilaille pitää antaa riittävästi antiemeettejä ja asianmukaisesta nesteytyksestä on huolehdittava ennen sisplatiinin antoa ja/tai sen jälkeen (ks. tarkat annosteluohjeet sisplatiinin valmisteyhteenvedosta).
Pemetrexed medac -monoterapia
Potilailla, jotka saavat hoitoa ei-pienisoluiseen keuhkosyöpään aikaisemman kemoterapian jälkeen, Pemetrexed medac -valmisteen suositusannos on 500 mg/m² 10 minuutin laskimoinfuusiona jokaisen 21 vuorokautta kestävän hoitosyklin ensimmäisenä päivänä.
Esilääkitys
Ihoreaktioiden esiintyvyyden ja vaikeusasteen vähentämiseksi potilaalle annetaan kortikosteroidia pemetreksedin antoa edeltävänä päivänä, pemetreksedin antopäivänä ja pemetreksedin antoa
seuraavana päivänä. Kortikosteroidin tulee vastata 4 mg deksametasoniannosta suun kautta kahdesti päivässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Toksisuuden vähentämiseksi pemetreksediä saaville potilaille pitää antaa lisäksi vitamiineja (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Potilaiden pitää ottaa päivittäin suun kautta foolihappoa tai monivitamiinivalmistetta, joka sisältää foolihappoa (350 – 1000 µg). Ensimmäistä pemetreksediannosta edeltävien seitsemän päivän aikana potilaalle annetaan vähintään viisi foolihappoannosta, ja annostelun tulee jatkua koko hoidon ajan sekä 21 päivää viimeisen pemetreksediannoksen jälkeen. Potilaille pitää antaa myös B12‑ vitamiini-injektio (1000 µg) lihakseen ensimmäistä pemetreksediannosta edeltävän viikon aikana ja tämän jälkeen joka kolmannen syklin aikana. Myöhemmät B12‑injektiot voidaan antaa samana päivänä kuin pemetreksedi.
Seuranta
Pemetreksediä saavilta potilailta tulee tarkistaa ennen jokaista annosta suuri verenkuva, mukaan lukien valkosolujen erittelylaskenta ja trombosyytit. Veren kemia tulee määrittää ennen jokaista kemoterapia-
annosta maksan ja munuaisten toiminnan arvioimiseksi. Potilailla tulee olla seuraavat arvot ennen
jokaisen kemoterapiasyklin aloittamista: Absoluuttinen neutrofiilimäärä (ANC) ≥ 1500 solua/mm³ ja trombosyytit ≥ 100000 solua/mm³.
Kreatiniinipuhdistuma ≥ 45 ml/min.
Kokonaisbilirubiini ≤ 1,5 x normaaliarvon yläraja. Alkalinen fosfataasi (AFOS), aspartaattiaminotransferaasi (ASAT) ja alaniiniaminotransferaasi (ALAT) ≤ 3 x normaaliarvon yläraja. AFOS, ASAT ja ALAT ≤ 5 x normaaliarvon yläraja ovat hyväksyttäviä arvoja, mikäli maksassa on etäispesäkkeitä.
Annoksen muuttaminen
Myöhempien syklien alussa annoksen muuttaminen tulee tehdä edellisen hoitosyklin alimpien veriarvojen (nadiiri) tai ei-hematologisen maksimitoksisuuden perusteella. Hoitoa voidaan lykätä riittävän toipumisajan varmistamiseksi. Toipumisen jälkeen potilaan annosta pienennetään taulukoissa 1, 2 ja 3 annettujen suositusten mukaisesti, jotka pätevät kun Pemetrexed medac -valmistetta käytetään yksin tai yhdessä sisplatiinin kanssa.
Taulukko 1 – Pemetreksediannoksen (yksin tai yhdistelmähoitona) ja sisplatiiniannoksen muuttaminen – hematologinen toksisuus | |
Absoluuttinen neutrofiilimäärä, alin arvo (ANC-nadiiri) < 500/mm³ ja trombosyyttimäärän alin arvo ≥ 50000/mm³ | 75 % aiemmasta annoksesta (sekä pemetreksedi että sisplatiini) |
Trombosyyttimäärän alin arvo < 50000/mm³ riippumatta absoluuttisen neutrofiilimäärän alimmasta arvosta | 75 % aiemmasta annoksesta (sekä pemetreksedi että sisplatiini) |
Trombosyyttimäärän alin arvo < 50000/mm³ ja potilaalla on verenvuoto riippumatta absoluuttisen neutrofiilimääräna alimmasta arvosta | 50 % aiemmasta annoksesta (koskee sekä pemetreksediä että sisplatiinia) |
aVastaa National Cancer Instituten yleisen toksisuuskriteeristön (Common Toxicity Criteria, CTC) (versio 2.0; NCI 1998) CTC verenvuodon astetta ≥ 2.
Jos potilaalle kehittyy vähintään asteen 3 ei-hematologista toksisuutta (paitsi neurotoksisuus), pemetreksedihoito tulee keskeyttää kunnes arvot palaavat vähintään hoitoa edeltävälle tasolle. Hoitoa jatketaan taulukossa 2 annettujen suositusten mukaisesti.
Taulukko 2 – Pemetreksediannoksen (yksin tai yhdistelmähoitona) ja sisplatiiniannoksen muuttaminen – ei-hematologinen toksisuusa,b | ||
Pemetreksediannos (mg/m²) | Sisplatiiniannos (mg/m²) | |
Mikä tahansa asteen 3 tai 4 toksisuus lukuun ottamatta mukosiittia | 75 % aiemmasta annoksesta | 75 % aiemmasta annoksesta |
Mikä tahansa ripuli (asteesta riippumatta), joka vaatii sairaalahoitoa tai asteen 3 tai 4 ripuli | 75 % aiemmasta annoksesta | 75 % aiemmasta annoksesta |
Asteen 3 tai 4 mukosiitti | 50 % aiemmasta annoksesta | 100 % aiemmasta annoksesta |
a National Cancer Instituten yleiset toksisuuskriteerit (Common Toxicity Criteria, CTC) versio 2.0; NCI 1998
b Paitsi neurotoksisuus
Mikäli neurotoksisuutta esiintyy, Pemetrexed medac -valmisteen ja sisplatiinin annosta muutetaan taulukossa 3 annettujen suositusten mukaisesti. Hoito on lopetettava, jos potilaalla esiintyy asteen 3 tai 4 neurotoksisuutta.
Taulukko 3 – Pemetreksediannoksen (yksin tai yhdistelmähoitona) ja sisplatiiniannoksen muuttaminen – neurotoksisuus | ||
Yleiset toksisuuskriteerit (CTCa -aste) | Pemetrexed medac -annos (mg/m²) | Sisplatiiniannos (mg/m²) |
0 – 1 | 100 % aiemmasta annoksesta | 100 % aiemmasta annoksesta |
2 | 100 % aiemmasta annoksesta | 50 % aiemmasta annoksesta |
a National Cancer Instituten yleiset toksisuuskriteerit (Common Toxicity Criteria; CTC) versio 2.0; NCI 1998
Pemetreksedihoito on lopetettava, jos potilaalla esiintyy hematologista tai ei-hematologista asteen 3 tai 4 toksisuutta sen jälkeen, kun annosta on pienennetty kahdesti. Hoito lopetetaan välittömästi, jos potilaalle kehittyy asteen 3 tai 4 neurotoksisuutta.
Erityisryhmät
Iäkkäät
Kliinisissä tutkimuksissa ei ole saatu näyttöä siitä, että 65-vuotiailla tai vanhemmilla potilailla olisi suurempi haittatapahtumien riski kuin alle 65-vuotiailla potilailla. Annoksen muuttaminen ei ole tarpeen lukuun ottamatta tilanteita, joissa annoksen laskeminen on tarpeen muista syistä.
Pediatriset potilaat
Ei ole asianmukaista käyttää Pemetrexed medac –valmistetta pediatristen potilaiden pahanlaatuisen keuhkopussin mesoteliooman ja ei-pienisoluisen keuhkosyövän hoitoon.
Munuaisten vajaatoimintapotilaat (standardi cockcroftin ja gaultin kaava tai Tc99m-DPTA seerumipuhdistumamenetelmällä mitattu glomerulusten suodatusnopeus)
Pemetreksedi erittyy pääasiassa muuttumattomassa muodossa munuaisten kautta. Kliinisissä tutkimuksissa annoksen muuttaminen ei ollut tarpeen potilailla, joiden kreatiniinipuhdistuma oli ≥ 45 ml/min, lukuun ottamatta tilanteita, joissa annoksen laskeminen on tarpeen muista syistä. Pemetreksedin käytöstä potilailla, joiden kreatiniinipuhdistuma on < 45 ml/min, ei ole riittävästi tietoa, jonka vuoksi pemetreksedin käyttöä ei suositella näille potilaille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoimintapotilaat
ASAT-, ALAT- ja kokonaisbilirubiiniarvojen sekä pemetreksedin farmakokinetiikan välillä ei havaittu yhteyttä. Potilaita, joilla on maksan vajaatoiminta, kuten bilirubiini > 1,5 x normaaliarvon yläraja ja/tai aminotransferaasit > 3,0 x normaaliarvon yläraja (ei maksametastaaseja) tai > 5,0 x normaaliarvon yläraja (maksametastaaseja), ei kuitenkaan ole erityisesti tutkittu.
Antotapa
Pemetrexed medac -valmiste annetaan laskimoon. Pemetrexed medac -valmiste annetaan 10 minuutin laskimoinfuusiona jokaisen 21 vuorokautta kestävän hoitosyklin ensimmäisenä päivänä.
Pemetrexed medac -valmisteen käsittelyyn tai käyttöön liittyvät varotoimet ja Pemetrexed medac -valmisteen käsittely-, käyttöönvalmistus- ja laimennusohjeet ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
Imetys (ks. kohta Raskaus ja imetys).
Samanaikainen keltakuumerokotus (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Pemetreksedi voi estää luuytimen toimintaa, mikä ilmenee neutropeniana, trombosytopeniana ja anemiana (tai pansytopeniana) (ks. kohta Haittavaikutukset). Myelosuppressio on tavallisesti annosta rajoittava toksisuus. Potilaita tulee seurata myelosuppression varalta hoidon aikana, eikä pemetreksediä saa antaa ennen kuin absoluuttinen neutrofiiliarvo (ANC) palautuu tasolle ≥ 1500 solua/mm³ ja trombosyyttiarvo tasolle ≥ 100000 solua/mm³. Myöhempien syklien kohdalla annoksen pienentäminen tehdään edellisen syklin absoluuttisen neutrofiilimäärän alimman arvon, trombosyyttiarvon ja ei-hematologisen maksimitoksisuuden perusteella (ks. kohta Annostus ja antotapa).
Foolihappo- ja B12-vitamiiniesilääkityksen jälkeen ilmoitettiin vähemmän toksisuutta sekä asteen 3/4 hematologisen ja ei-hematologisen toksisuuden (kuten neutropenia, kuumeinen neutropenia ja asteen 3/4 neutropenia, johon liittyi infektio) vähenemistä. Siksi pemetreksedihoitoa saaville potilaille annetaan foolihappoa ja B12-vitamiinia profylaktisesti hoitoon liittyvän toksisuuden vähentämiseksi (ks. kohta Annostus ja antotapa).
Ihoreaktioita on ilmoitettu potilailla, jotka eivät saaneet kortikosteroidia esilääkityksenä. Deksametasoni (tai vastaava) esilääkityksenä voi pienentää ihoreaktioiden esiintyvyyttä ja vaikeusastetta (ks. kohta Annostus ja antotapa).
Potilaita, joiden kreatiniinipuhdistuma on < 45 ml/min, ei ole tutkittu riittävästi. Siksi pemetreksedin käyttöä ei suositella potilailla, joiden kreatiniinipuhdistuma on < 45 ml/min (ks. kohta Annostus ja antotapa).
Potilaiden, joilla on lievä tai kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 45 – 79 ml/min), tulee välttää steroideihin kuulumattomien tulehduskipulääkkeiden (NSAID) kuten ibuprofeenin ja asetyylisalisyylihapon (> 1,3 g/vrk) ottamista 2 päivää ennen pemetreksedin antoa, pemetreksedin antopäivänä ja 2 päivää pemetreksedin annon jälkeen (ks. kohta Yhteisvaikutukset).
Potilaiden, joilla on lievä tai kohtalainen munuaisten vajaatoiminta ja joille voidaan aloittaa pemetreksedihoito, tulee keskeyttää pitkän puoliintumisajan omaavien steroideihin kuulumattomien tulehduskipulääkkeiden (NSAID) ottaminen vähintään 5 päivää ennen pemetreksedin antoa, pemetreksedin antopäivänä ja vähintään 2 päivää pemetreksedin annon jälkeen (ks. kohta Yhteisvaikutukset).
Vakavia munuaisiin kohdistuvia haittatapahtumia mukaan lukien akuutti munuaisten vajaatoiminta on ilmoitettu liittyneen pemetreksedihoitoon sekä käytettäessä sitä ainoana lääkkeenä, että yhdistettynä muihin solunsalpaajiin. Monilla potilailla, joille ilmeni näitä haittavaikutuksia, oli muita munuaishaitoille altistavia vaaratekijöitä kuten dehydraatio tai korkea verenpaine tai diabetes. Lisäksi valmisteen myyntiintulon jälkeen on ilmoitettu renaalisesta diabetes insipiduksesta ja tubulusnekroosista, kun pemetreksedia on annettu yksinään tai yhdistettynä muihin solunsalpaajiin. Useimmat haittavaikutuksista hävisivät, kun pemetreksedihoito lopetettiin. Potilaita on seurattava säännöllisesti akuutin tubulusnekroosin, munuaisten vajaatoiminnan ja renaalisen diabetes insipiduksen oireiden (esim. hypernatremian) varalta.
Poikkeavan nesteen kertymisen (esim. pleuraeffuusio, askites) vaikutus pemetreksediin ei ole täysin selvillä. Faasin 2 tutkimuksessa 31 potilaalla, joilla oli kiinteä kasvain ja stabiili nestekertymä, ei ilmennyt eroja pemetreksedin annoksen mukaan vakioiduissa plasmapitoisuuksissa tai puhdistumassa verrattuna potilaisiin, joilla ei ollut nestekertymää. Näin ollen nestekertymän poistoa ennen pemetreksedin antoa tulisi harkita, mutta se ei ehkä ole tarpeen.
Pemetreksedin ja sisplatiinin yhdistelmähoidolla on gastrointestinaalista toksisuutta, ja vaikeaa nestehukkaa on havaittu. Siksi potilaille tulee antaa riittävästi antiemeettejä ja asianmukaisesta nesteytyksestä on huolehdittava ennen hoitoa ja/tai sen jälkeen.
Vakavia kardiovaskulaaritapahtumia, mukaan lukien sydäninfarkti ja aivoverisuonitapahtumia on raportoitu melko harvoin pemetreksedillä tehdyissä kliinisissä tutkimuksissa, ja yleensä ne ovat esiintyneet jonkin toisen sytotoksisen aineen samanaikaisen käytön aikana. Useimmilla potilailla, joilla näitä tapahtumia havaittiin, oli ennestään kardiovaskulaarisia riskitekijöitä (ks. kohta Haittavaikutukset).
Immuunivasteen heikentyminen on syöpäpotilailla yleistä. Siksi elävien, heikennettyjen rokotteiden samanaikaista käyttöä ei suositella (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
Pemetreksedillä voi olla geneettisesti vahingollisia vaikutuksia. Sukukypsät miehet eivät saa siittää lasta hoidon aikana eivätkä 3 kuukauteen sen jälkeen. Ehkäisyä tai sukupuoliyhdynnästä pidättäytymistä suositellaan. Pemetreksedihoito voi aiheuttaa pysyvää hedelmättömyyttä, joten miesten kannattaa harkita sperman varastoimista spermapankkiin ennen hoidon aloittamista.
Hedelmällisessä iässä olevien naisten tulee käyttää tehokasta ehkäisyä pemetreksedihoidon aikana ja 6 kuukauden ajan hoidon päättymisen jälkeen (ks. kohta Raskaus ja imetys).
Sädepneumoniittia on ilmoitettu potilailla, jotka ovat saaneet sädehoitoa joko ennen pemetreksedihoitoa, sen aikana tai pemetreksedihoidon jälkeen. Näiden potilaiden suhteen tulee olla erityisen valppaana. Lisäksi tulee olla varovainen, kun näille potilaille käytetään muita sädeherkistäjiä.
Sädehoidon myöhäisreaktioita (ihoreaktioita) on ilmoitettu potilailla, jotka ovat saaneet sädehoitoa viikkoja tai vuosia aikaisemmin.
Apuaineet
Pemetrexed medac 100 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 mg:n injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Pemetrexed medac 500 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Tämä lääkevalmiste sisältää 54 mg natriumia per 500 mg:n injektiopullo, joka vastaa 2,7 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Pemetrexed medac 1000 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Tämä lääkevalmiste sisältää 108 mg natriumia per 1000 mg:n injektiopullo, joka vastaa 5,4 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Pemetreksedi erittyy pääasiassa muuttumattomassa muodossa tubulusten kautta ja vähemmässä määrin glomerulusten kautta. Samanaikainen nefrotoksisten lääkeaineiden käyttö (esim. aminoglykosidit, loop-diureetit, platinayhdisteet, siklosporiini) voi hidastaa pemetreksedin puhdistumaa. Varovaisuutta on syytä noudattaa, jos näitä lääkkeitä käytetään samanaikaisesti. Kreatiniinipuhdistumaa tulee tarpeen mukaan seurata huolellisesti.
Muiden tubulusten kautta erittyvien aineiden (esim. probenesidi, penisilliini) samanaikainen käyttö voi hidastaa pemetreksedin puhdistumaa. Varovaisuutta tulee noudattaa, jos näitä lääkkeitä käytetään samanaikaisesti pemetreksedin kanssa. Kreatiniinipuhdistumaa tulee tarpeen mukaan seurata huolellisesti.
Potilailla, joilla on normaali munuaistoiminta (kreatiniinipuhdistuma > 80 ml/min) isot annokset steroideihin kuulumattomia tulehduskipulääkkeitä (NSAID, kuten ibuprofeeni > 1600 mg/vrk) ja asetyylisalisyylihappo (> 1,3 g/vrk) voivat hidastaa pemetreksedin puhdistumaa ja siten lisätä pemetreksedin haittatapahtumia. Näin ollen on syytä varovaisuuteen, jos pemetreksedin kanssa käytetään samanaikaisesti suuria annoksia NSAID-lääkkeitä tai asetyylisalisyylihappoa potilailla, joilla on normaali munuaistoiminta (kreatiniinipuhdistuma ≥ 80 ml/min).
Potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 45 – 79 ml/min) samanaikaisen suuriannoksisen NSAID-lääkkeen (kuten ibuprofeeni) tai asetyylisalisyylihapon käyttöä pemetreksedin kanssa tulee välttää 2 päivän ajan ennen pemetreksedin antoa, pemetreksedin antopäivänä ja 2 päivää pemetreksedin annon jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pitemmän puoliintumisajan omaavien NSAID-lääkkeiden, kuten piroksikaamin, rofekoksibin ja pemetreksedin yhteiskäytön vaikutuksia ei tunneta. Potilaiden, joilla on lievä tai kohtalainen munuaisten vajaatoiminta, tulee keskeyttää näiden lääkkeiden samanaikainen käyttö vähintään 5 päivää ennen pemetreksedin antoa, pemetreksedin antopäivänä ja vähintään 2 päivää pemetreksedin annon jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos NSAID-lääkkeiden ja pemetreksedin samanaikainen käyttö on tarpeen, potilaita tulee seurata tarkoin toksisuuden, erityisesti myelosuppression ja ruoansulatuskanavaan kohdistuvan toksisuuden varalta.
Pemetreksedin maksametabolia on rajallista. Ihmisen maksan mikrosomeilla tehtyjen in vitro - tutkimusten perusteella pemetreksedin ei odoteta estävän kliinisesti merkitsevästi CYP3A:n, CYP2D6:n, CYP2C9:n, ja CYP1A2:n vaikutuksesta metaboloituvien lääkeaineiden metabolista puhdistumaa.
Kaikille sytotoksisille aineille yhteiset yhteisvaikutukset
Syöpäpotilailla on suurentunut tromboosiriski, joten antikoagulanttihoitoa annetaan usein. Suuret yksilökohtaiset vaihtelut koagulaatiostatuksessa taudin aikana ja oraalisten antikoagulanttien ja syövän kemoterapian mahdolliset yhteisvaikutukset vaativat tiheämpää INR-arvon seurantaa, mikäli potilaalle päätetään antaa antikoagulanttihoitoa.
Samanaikainen käyttö on vasta-aiheista: keltakuumerokote: fataalin yleistyneen rokotetaudin riski (ks. kohta Vasta-aiheet).
Samanaikaista käyttöä ei suositella: elävät heikennetyt rokotteet (paitsi keltakuumerokote, jonka samanaikainen käyttö on vasta-aiheista): systeemisen, mahdollisesti fataalin taudin riski. Riski on suurempi potilailla, joiden immuunipuolustus on jo heikentynyt perussairauden takia. Inaktivoitua rokotetta tulee käyttää mahdollisuuksien mukaan (poliomyeliitti) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Miesten ja naisten ehkäisy
Pemetreksedillä voi olla geneettisesti vahingollisia vaikutuksia. Hedelmällisessä iässä olevien naisten pitää käyttää tehokasta ehkäisyä pemetreksedihoidon aikana ja 6 kuukauden ajan hoidon päättymisen jälkeen.
Sukukypsiä miehä kehotetaan käyttämään tehokkaita ehkäisymenetelmiä ja he eivät saa siittää lasta hoidon aikana eivätkä 3 kuukauteen sen jälkeen.
Raskaus
Pemetreksedin käytöstä raskauden aikana ei ole tietoa. Kuten muidenkin antimetaboliittien, pemetreksedin raskaudenaikaisen käytön epäillään voivan aiheuttaa vakavia syntymävikoja.
Eläintutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Pemetreksediä ei tule käyttää raskauden aikana, ellei se ole selvästi välttämätöntä, ja äidin tarpeita ja sikiölle koituvaa riskiä on harkittava huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Ei tiedetä, erittyykö pemetreksedi rintamaitoon ihmisellä, ja imeväiseen kohdistuvia haittavaikutuksia ei voida sulkea pois. Imetys on lopetettava pemetreksedihoidon ajaksi (ks. kohta Vasta-aiheet).
Hedelmällisyys
Pemetreksedihoito voi aiheuttaa pysyvää hedelmättömyyttä, joten miesten kannattaa harkita sperman varastoimista spermapankkiin ennen hoidon aloittamista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia vaikutuksesta ajokykyyn ja koneiden käyttökykyyn ei ole tehty. Pemetreksedin on kuitenkin ilmoitettu voivan aiheuttaa väsymystä. Potilaita tulee kehottaa välttämään ajamista ja koneiden käyttöä, mikäli sitä esiintyy.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Pemetreksedille joko yksin käytettynä tai yhdistelmähoidossa yleisimmin ilmoitettuja haittavaikutuksia ovat luuydinsupressio ja ruoansulatuskanavan haittavaikutukset. Luuydinsupressio ilmenee anemiana, neutropeniana, leukopeniana ja trombosytopeniana. Ruoansulatuskanavaan liittyviä vaikutuksia ovat ruokahalun puute, pahoinvointi, oksentelu, ripuli, ummetus, faryngiitti, mukosiitti ja stomatiitti. Muita haittavaikutuksia ovat munuaistoksisuus, kohonneet aminotransferaasit, hiusten lähtö, väsymys, dehydraatio, ihottuma, infektio/sepsis ja neuropatia. Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi ovat harvinaisia.
Haittavaikutustaulukko
Taulukossa 4 on esitetty haittavaikutukset kausaliteetista riippumatta pemetreksedia monoterapiana käytettäessä tai yhdessä sisplatiinin kanssa keskeisissä rekisteröintitutkimuksissa (JMCH, JMEI, JMBD, JMEN ja PARAMOUNT) ja myyntiluvan myöntämisen jälkeiseltä ajalta.
Haittavaikutukset on lueteltu MedDRA-elinjärjestelmäluokan mukaan. Haittavaikutukset on luokiteltu seuraavan yleisyysluokituksen mukaan: Hyvin yleiset (≥ 1/10); Yleiset (≥ 1/100, < 1/10); Melko harvinaiset (≥ 1/1 000, < 1/100); Harvinaiset (≥ 1/10 000, < 1/1 000); Hyvin harvinaiset (< 1/10 000) ja yleisyyttä ei tiedetä (saatavissa oleva tieto ei riitä arviointiin).
Taulukko 4. Kaiken asteisten haittavaikutusten yleisyys kausaliteetista riippumatta keskeisissä rekisteröintitutkimuksissa: JMEI (ALIMTA vs doketakseli), JMDB (ALIMTA ja sisplatiini versus GEMZAR ja sisplatiini, JMCH (ALIMTA+sisplatiini versus sisplatiini), JMEN ja PARAMOUNT (pemetreksedi versus lumelääke; kummassakin ryhmässä lisäksi paras oireenmukainen hoito)ja myyntiluvan myöntämisen jälkeiseltä ajalta.
Elin-järjestelmä (MedDRA) | Hyvin yleiset | Yleiset | Melko harvinaiset | Harvinaiset | Hyvin harvinaiset | Yleisyyttä ei tiedetä |
Infektiot | Infektiota Nielutulehdus | Sepsisb | Verinahanalaisen kudoksen tulehdus | |||
Veri ja imukudos | Neutropenia Leukopenia Hemoglobiinin lasku | Kuumeinen neutropenia Verihiutaleiden määrän lasku | Pansytopenia | Autoimmuunihemolyyttinen anemia | ||
Immuunijär-jestelmä | Yliherkkyys | Anafylaktinen shokki | ||||
Aineenvaih-dunta ja ravitsemus | Kuivuminen | |||||
Hermosto | Makuhäiriöt Perifeerinen motorinen neuropatia Perifeerinen sensorinen neuropatia Huimaus | Aivoverenkiertohäiriö Iskeeminen aivohalvaus Kallonsisäinen verenvuoto | ||||
Silmät | Sidekalvotulehdus Kuivat silmät Lisääntynyt kyynelnesteen eritys Keratoconjunctivitis sicca Silmäluomien turvotus Silmän pinnan sairaus | |||||
Sydän | Sydämen vajaatoiminta Rytmihäiriö | Rasitusrintakipu Sydäninfarkti Sepelvaltimotauti Supraventrikulaarinen rytmihäiriö | ||||
Verisuonisto | Perifeerinen iskemiac | |||||
Hengitys-elimet, rintakehä ja välikarsina | Keuhkoembolia Interstitiaalinen pneumoniittibd | |||||
Ruoansulatus-elimistö | Stomatiitti Anoreksia Oksentelu Ripuli Pahoinvointi | Dyspepsia Ummetus Vatsakipu | Peräsuoliverenvuoto Maha-suolikanavan verenvuoto Suolen puhkeama Ruokatorvitulehdus Paksusuolitulehdus e | |||
Maksa ja sappi | ALAT-arvon suureneminen ASAT-arvon suureneminen | Hepatiitti | ||||
Iho ja ihonalainen kudos | Ihottuma Ihon hilseily | Hyperpigmentaatio Kutina Monimuotoinen punavihoittuma Hiusten lähtö Nokkosihottuma | Eryteema | Stevens-Johnson syndroomab Toksinen epidermaalinen nekrolyysib Pemphigoidi Rakkulaihottuma Hankinnainen rakkulainen epidermolyysi Erytematoottinen turvotusf Pseudoselluliitti Dermatiitti Rohtuma Kutinatauti | ||
Munuaiset ja virtsatiet | Kreatiniinipuhdistuman lasku Veren kreatiniinin nousue | Munuaisten vajaatoiminta Glomerulusten suodatusnopeuden hidastuminen | Nefrogeeninen diabetes insipidus Munuaistiehyiden kuolio | |||
Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Kuume Kipu Turvotus Rintakipu Mukosiitti | ||||
Tutkimukset | Gammaglutamyylitransferaasin nousu | |||||
Vahingot, myrkytykset ja menettelytapaan liiittyvät kompikaatiot | Säteilyn aiheuttama esofagiitti Säteilyn aiheuttama pneumoniitti | Recall-ilmiö |
a lisäksi neutropenia tai ei neutropeniaa
b johti joissain tapauksista kuolemaan
c johti joskus ääriosien nekroosiin
d lisäksi hengitysvajaus
e havaittu ainoastaan yhdessä sisplatiinin kanssa
f pääasiassa alaraajoissa
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ilmoitettuja yliannostusoireita ovat neutropenia, anemia, trombosytopenia, mukosiitti, sensorinen polyneuropatia ja ihottuma. Odotettavissa olevia yliannostuskomplikaatioita ovat luuydinsuppressio, joka ilmenee neutropeniana, trombosytopeniana ja anemiana. Lisäksi voi esiintyä infektioita, joihin voi liittyä kuumetta, ripulia ja/tai mukosiittia. Jos yliannostusta epäillään, potilaan veriarvoja pitää seurata ja antaa tukihoitoa tarpeen mukaan. Kalsiumfolinaatin/foliinihapon käyttöä tulee harkita pemetreksediyliannostuksen hoidossa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Syöpälääkkeet, foolihappoanalogit, ATC-koodi: L01BA04
Pemetrexed medac on monikohteinen antifolaattisyöpälääke, joka vaikuttaa häiritsemällä solun replikaation kannalta välttämättömiä, folaatista riippuvia metabolisia prosesseja.
In vitro tutkimukset ovat osoittaneet, että pemetreksedi käyttäytyy monikohteisen antifolaatin tavoin estämällä tymidylaattisyntaasia (TS), dihydrofolaattireduktaasia (DHFR) ja glysinamidiribonukleotidiformyylitransferaasia (GARFT), jotka ovat välttämättömiä folaatista riippuvaisia entsyymejä tymidiini- ja puriininukleotidien de novo biosynteesissä. Pemetreksedi kulkeutuu soluihin sekä folaatinkuljettajaproteiinin että solukalvon folaattia sitovan proteiinin välityksellä. Päästyään soluun pemetreksedi muuttuu folyylipolyglutamaattisyntetaasientsyymin vaikutuksesta nopeasti ja tehokkaasti polyglutamaattimuotoiseksi. Polyglutamaattimuodot pysyvät soluissa ja ovat vielä voimakkaampia TS:n ja GARFT:n estäjiä. Polyglutamaatio on kasvainsoluissa ja vähemmässä määrin normaalissa kudoksessa tapahtuva ajasta ja pitoisuudesta riippuva prosessi. Polyglutamoituneilla metaboliiteilla on pidempi solunsisäinen puoliintumisaika, mikä johtaa pidempään vaikutusaikaan pahanlaatuisissa soluissa.
Kliininen teho
Mesoteliooma
Satunnaistettu, sokkoutettu vaiheen 3 monikeskustutkimus (EMPHACIS) pemetreksedin ja sisplatiinin yhdistelmästä verrattuna pelkkään sisplatiiniin potilailla, joilla oli pahanlaatuinen keuhkopussin mesoteliooma ja jotka eivät olleet aiemmin saaneet kemoterapiahoitoa, osoitti, että pemetreksedin ja sisplatiinin yhdistelmää saaneilla potilailla elossaolon mediaani oli kliinisesti merkittävästi 2,8 kuukautta pidempi kuin pelkkää sisplatiinia saaneilla potilailla.
Tutkimuksen aikana potilaiden hoitoon lisättiin pieniannoksinen foolihappo ja B12-vitamiinilisä toksisuuden vähentämiseksi. Tämän tutkimuksen pääasiallinen analyysi tehtiin koko sillä potilaspopulaatiolla, joka satunnaistettiin tutkimuslääkeryhmään (satunnaistettiin ja hoidettiin). Alaryhmäanalyysi tehtiin potilailla, jotka saivat foolihappoa ja B12-vitamiinilisää koko tutkimuslääkityksen ajan (täydet annokset). Yhteenveto näistä tehoanalyyseistä on esitetty seuraavassa taulukossa:
Taulukko 5. Pemetreksedin ja sisplatiinin yhdistelmän teho vs. sisplatiinin teho pahanlaatuisessa keuhkopussin mesotelioomassa
Satunnaistetut ja hoidetut potilaat | Täyden vitamiinilisän saaneet potilaat | |||
Tehoparametri | Pemetreksedi/ sisplatiini (N = 226) | Sisplatiini (N = 222) | Pemetreksedi/ sisplatiini (N = 168) | Sisplatiini (N = 163) |
OS mediaani (kk) | 12,1 | 9,3 | 13,3 | 10,0 |
(95 % CI) | (10,0 – 14,4) | (7,8 – 10,7) | (11,4 – 14,9) | (8,4 – 11,9) |
Log Rank p-arvoa | 0,020 | 0,051 | ||
Kasvaimen etenemiseen kuluneen ajan mediaani (kk) | 5,7 | 3,9 | 6,1 | 3,9 |
(95 % CI) | (4,9 – 6,5) | (2,8 – 4,4) | (5,3 – 7,0) | (2,8 – 4,5) |
Log Rank p-arvoa | 0,001 | 0,008 | ||
Hoidon epäonnistumiseen kulunut aika (kk) | 4,5 | 2,7 | 4,7 | 2,7 |
(95 % CI) | (3,9 – 4,9) | (2,1 – 2,9) | (4,3 – 5,6) | (2,2 – 3,1) |
Log Rank p-arvoa | 0,001 | 0,001 | ||
Kokonaisvasteprosenttib | 41,3 % | 16,7 % | 45,5 % | 19,6 % |
(95 % CI) | (34,8 – 48,1) | (12,0 – 22,2) | (37,8 – 53,4) | (13,8 – 26,6) |
Fisherin eksakti p-arvoa | < 0,001 | < 0,001 | ||
Lyhenne: CI = luottamusväli; OS = kokonaiselossaoloajan
a p-arvo tarkoittaa vertailua hoitoryhmien välillä.
b Pemetreksedi /sisplatiiniryhmässä satunnaistetut ja hoidetut (N = 225) sekä täyden vitamiinilisän saaneet (N = 167)
Keuhkosyövän oireasteikolla (Lung Cancer Symptom Scale) osoitettiin tilastollisesti merkitsevää paranemista pahanlaatuiseen keuhkopussin mesotelioomaan liittyvien kliinisesti relevanttien oireiden (kipu ja hengenahdistus) suhteen pemetreksedi /sisplatiiniryhmässä (212 potilasta) verrattuna pelkkää sisplatiinia saaneiden ryhmään (218 potilasta). Myös keuhkojen toimintakokeissa havaittiin tilastollisesti merkitseviä eroja. Hoitoryhmien välille saatiin ero, kun keuhkojen toiminta parani pemetreksedi/sisplatiiniryhmässä ja heikkeni kontrolliryhmässä hoidon aikana.
Pelkällä pemetreksedillä hoidetuista potilaista, joilla on pahanlaatuinen keuhkopussin mesoteliooma, on rajallisesti tietoa. Pelkkää pemetreksediä annoksella 500 mg/m² tutkittiin 64 potilaalla, joilla oli pahanlaatuinen keuhkopussin mesoteliooma ja jotka eivät olleet aiemmin saaneet kemoterapiahoitoa. Kokonaisvasteprosentti oli 14,1 %.
Ei-pienisoluinen keuhkosyöpä, toisen linjan hoito
Satunnaistetussa, avoimessa, vaiheen 3 monikeskustutkimuksessa pemetreksediä verrattiin doketakseliin potilailla, joilla oli paikallisesti levinnyt tai metastaattinen ei-pienisoluinen keuhkosyöpä (NSCLC), aiemman kemoterapiahoidon jälkeen. Tutkimuksessa todettiin, että pemetreksedihoitoa saaneiden potilaiden (hoitoaikomuspopulaatio [Intent To Treat, ITT] n = 283) elossaoloajan mediaani oli 8,3 kuukautta, kun doketakselia saaneilla potilailla (ITT n = 288) se oli 7,9 kuukautta. Pemetreksedi ei kuulunut aikaisempaan kemoterapiahoitoon. Kun selvitettiin ei-pienisoluisen keuhkosyövän histologian merkitystä hoidon tehoon ja kokonaiselossaoloaikaan (OS), havaittiin, että pemetreksedi oli parempi kuin doketakseli potilaille, jotka sairastivat sellaista ei pienisoluista keuhkosyöpää, joka oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen (n = 399; 9,3 vs. 8,0 kuukautta, korjattu riskisuhde [HR] = 0,78; 95 %:n luottamusväli [CI] = 0,61 – 1,00, p = 0,047). Doketakseli tehosi paremmin potilaille, joilla on levyepiteelikarsinooma (n = 172, 6,2 vs. 7,4 kuukautta, HR = 1,56; 95 % CI = 1,08 – 2,26, p = 0,018). Histologisten alaryhmien välillä ei todettu kliinisesti relevantteja eroja pemetreksedin turvallisuusprofiilin suhteen.
Rajalliset kliiniset tiedot erillisistä, kontrolloiduista, satunnaistetuista vaiheen 3 kliinisistä tutkimuksista viittaavat siihen, että tulokset, jotka kuvaavat pemetreksedin tehoa (OS, Progressiovapaa elinaika [PFS]) ovat samanlaiset riippumatta siitä, onko potilas saanut aikaisemmin hoitoa doketakselilla (n = 41) vai ei (n = 540).
Taulukko 6. Pemetreksedin teho vs. doketakselin teho ei-pienisoluisessa keuhkosyövässä – ITT‑populaatio
Pemetreksedi medac | Doketakseli | |
Elossaoloaika (kk) | (n = 283) | (n = 288) |
| 8,3 | 7,9 |
| (7,0 – 9,4) | (6,3 – 9,2) |
| 0,99 | |
| (0,82 – 1,20) | |
| 0,226 | |
PFS (kk) | (n = 283) | (n = 288) |
| 2,9 | 2,9 |
| 0,97 (0,82 – 1,16) | |
Hoidon epäonnistumiseen kulunut aika (TTTF – kk) | (n = 283) | (n = 288) |
| 2,3 | 2,1 |
| 0,84 (0,71 - 0,997) | |
Vaste (n: vastearvioitu) | (n = 264) | (n = 274) |
| 9,1 (5,9 – 13,2) | 8,8 (5,7 – 12,8) |
| 45,8 | 46,4 |
Lyhenteet: CI = luottamusväli; HR = riskisuhde; ITT = hoitoaikomus; n = populaation koko; PFS = Progressiovapaa elinaika
NSCLC, ensilinjan hoito
Satunnaistetussa, avoimessa, vaiheen 3 monikeskustutkimuksessa verrattiin yhdistelmää pemetreksedi + sisplatiini (PC) yhdistelmään gemsitabiini + sisplatiini (GC) potilailla, jotka eivät olleet aikaisemmin saaneet kemoterapiaa ja joilla oli paikallisesti levinnyt tai metastaattinen (asteen IIIB tai IV) NSCLC. Tutkimus osoitti, että pemetreksedi + sisplatiini (ITT-populaation koko = 862) täytti tutkimuksen ensisijaiselle päätetapahtumalle asetetut odotukset ja että tämä yhdistelmä oli kliinisesti yhtä tehokas kuin gemsitabiini + sisplatiini (ITT-populaation koko = 863) mitattuna kokonaiselossaolomuuttujalla (HR 0,94; 95 %:n CI 0,84 – 1,05). Kaikkien tutkimuksen potilaiden ECOG-suorituskykyluokka oli 0 tai 1.
Tehoa arvioitiin primaarisen muuttujan suhteen ITT-populaatiossa. Keskeisten tehokkuutta mittaavien päätetapahtumien herkkyysanalyysi käsitti lisäksi tutkimussuunnitelman mukaisesti tutkimukseen soveltuvat (Protocol Qualified, PQ) potilaat. Kun tehokkuusanalyysiin otettiin tämä PQ-populaatio, olivat tulokset yhtäpitävät ITT-populaatiota koskevien tulosten kanssa, ja ne tukevat käsitystä, että PC-hoidon ja GC-hoidon välillä ei ole tehoeroa (non-inferiority).
PFS ja kokonaisvaste (overall response rate) olivat samansuuruiset molemmissa hoitoryhmissä: mediaaninen PFS oli 4,8 kuukautta ryhmässä pemetreksedi + sisplatiini ja 5,1 kuukautta ryhmässä gemsitabiini + sisplatiini (HR 1,04; 95 %:n CI 0,94 – 1,15) ja kokonaisvaste oli 30,6 % (95 %:n luottamusväli 27,3 – 33,9) hoitoryhmässä pemetreksedi + sisplatiini ja 28,2 % (95 %:n CI 25,0 – 31,4) hoitoryhmässä gemsitabiini + sisplatiini. PFS-tulos sai osittaista vahvistusta riippumattomasta tuloksen arvioinnista (jossa 400 potilasta 1725:sta valittiin sattumanvaraisesti tätä arviointia varten).
Analysoitaessa ei-pienisoluisen keuhkosyövän histologisen rakenteen merkitystä OS, havaittiin kliinisesti merkityksellisiä elossaoloaikaeroja, ks. seuraava taulukko.
Taulukko 7. Teho: Pemetreksedi + sisplatiini vs. gemsitabiini + sisplatiini ei-pienisoluisen keuhkosyövän ensilinjan hoitona – ITT-populaatio ja histologiset alaryhmät
ITT-populaatio ja histologiset alaryhmät | Mediaaninen elossaoloaika kuukausina (95 %:n, CI) | Korjattu HR (95 % CI) | Paremmuus, p-arvo | |||
Pemetreksedi + sisplatiini | Gemsitabiini + sisplatiini | |||||
ITT-populaatio (N = 1725) | 10,3 (9,8 – 11,2) | N=862 | 10,3 (9,6 – 10,9) | N=863 | 0,94a (0,84 – 1,05) | 0,259 |
Adenokarsinooma (N=847) | 12,6 (10,7 – 13,6) | N=436 | 10,9 (10,2 – 11,9) | N=411 | 0,84 (0,71–0,99) | 0,033 |
Suurisoluinen (N=153) | 10,4 (8,6 – 14,1) | N=76 | 6,7 (5,5 – 9,0) | N=77 | 0,67 (0,48–0,96) | 0,027 |
Muu (N=252) | 8,6 (6,8 – 10,2) | N=106 | 9,2 (8,1 – 10,6) | N=146 | 1,08 (0,81–1,45) | 0,586 |
Levyepiteelisolu (N=473) | 9,4 (8,4 – 10,2) | N=244 | 10,8 (9,5 – 12,1) | N=229 | 1,23 (1,00–1,51) | 0,050 |
Lyhenteitä: CI = luottamusväli (confidence interval); HR = riskisuhde; ITT = intent-to-treat, hoitoaikomus; N = populaation kokonaiskoko.
a Tilastollinen merkitsevyys hoitojen samanarvoisuudesta (noninferiority), sillä riskisuhteen CI on kokonaisuudessaan alle arvon 1,17645 joka on samanarvoisuutta osoittava raja-arvo (p < 0,001).
Kaplan-Meierin kuvaajat kokonaiselossaoloajasta histologian mukaan
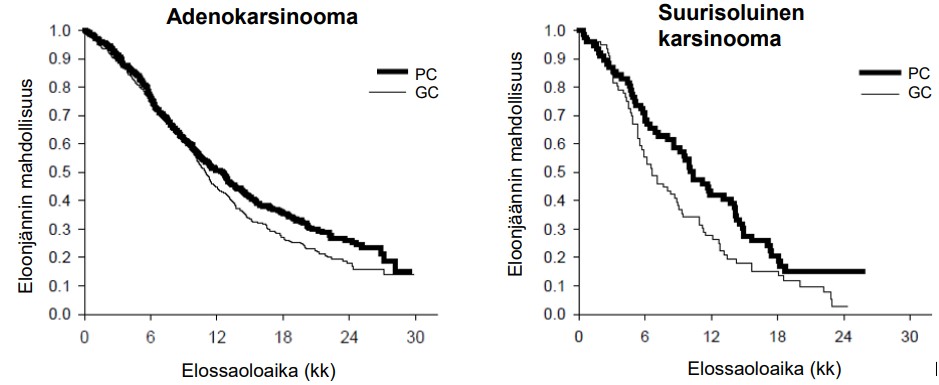
Erilaisilla histologisilla alaryhmillä ei todettu olevan kliinisesti merkitseviä eroja verrattaessa pemetreksedi +sisplatiinihoitoa saavien potilaiden turvallisuuteen liittyviä tuloksia.
Pemetreksedi + sisplatiinihoitoa saaneet potilaat tarvitsivat harvempia verensiirtoja (16,4 % vs. 28,9 %, p < 0,001), punasolusiirtoja (16,1 % vs. 27,3 %, p < 0,001), trombosyyttisiirtoja (1,8 % vs. 4,5 %, p = 0,002), erytropoietiinia / darbopoietiinia (10,4 % vs. 18,1 %, p < 0,001), G-CSF/GM-CSF-valmisteita (3,1 % vs. 6,1 %, p = 0,004) ja rautavalmisteita (4,3 % vs. 7,0 %, p = 0,021).
Ei-pienisoluinen keuhkosyöpä, ylläpitohoito
JMEN
Satunnaistetussa, kaksoissokkoutetussa, vaiheen 3 plasebokontrolloidussa monikeskustutkimuksessa (JMEN) verrattiin pemetreksedi-ylläpitohoidon (n = 441) tehoa ja turvallisuutta plaseboon (n = 222). Kummassakin tutkimushaarassa annettiin parasta mahdollista tukihoitoa. Tutkittavilla oli paikallisesti edennyt (levinneisyysaste IIIB) tai metastaattinen (levinneisyysaste IV) NSCLC, joka ei ollut edennyt neljän ensilinjan hoitosyklin jälkeen, johon kuului sisplatiini tai karboplatiini yhdistettynä joko gemsitabiiniin, paklitakseliin tai doketakseliin. Pemetreksedi ei ollut mukana ensilinjan yhdistelmähoidoissa. Kaikkien tutkimukseen osallistuneiden potilaiden suorituskykyluokka oli 0 tai 1 ECOG-luokituksessa. Potilaat saivat ylläpitohoitoa sairauden etenemisen toteamiseen asti. Tehoa ja turvallisuutta mitattiin ensilinjan hoidon päättymisen jälkeen tehdystä satunnaistamisesta alkaen. Potilaat saivat 5 sykliä (mediaani) pemetreksedi-ylläpitohoitoa ja 3,5 sykliä plaseboa. Kaikkiaan 213 potilasta (48,3 %) sai ≥ 6 pemetreksedisykliä ja 103 potilasta (23,4 %) sai ≥ 10 pemetreksedisykliä.
Tutkimukselle asetettu päätetapahtuma saavutettiin ja tutkimus osoitti tilastollisesti merkitsevää parannusta PFS pemetreksedihaarassa plaseboon verrattuna (n = 581, riippumattoman tahon arviointi, mediaanihoitoaika pemetreksedihaarassa 4 kuukautta ja plasebohaarassa 2 kuukautta) (riskisuhde 0,60, 95 %, CI: 0,49 – 0,73, p < 0,00001). Potilaista otettujen kuvantamistutkimusten riippumattoman tahon arviointi vahvisti tutkijoiden arvion progressiovapaasta elossaoloajasta. Mediaanielossaoloaika koko populaatiossa (n = 663) oli 13,4 kuukautta Pemetrexed medac - haarassa ja 10,6 kuukautta plasebohaarassa, riskisuhde 0,79 (95 %, CI: 0,65 – 0,95, p < 0,01192).
Yhtenevästi muiden pemetrekseditutkimusten kanssa JMEN-tutkimuksessa havaittiin tehoeroa histologian mukaan. Niillä NSCLC-potilailla, joilla oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (n = 430, riippumattoman tahon arviointi) PFS:n mediaani oli pemetreksedihaarassa 4,4 kuukautta ja plasebohaarassa 1,8 kuukautta, riskisuhde 0,47 (95 % CI: 0,37 – 0,60, p = 0,00001). Niillä NSCLC-potilailla, joilla oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (n = 481) mediaanielossaoloaika oli pemetreksedihaarassa 15,5 kuukautta ja plasebohaarassa 10,3 kuukautta, riskisuhde 0,70 (95 % CI: 0,56–0,88 p=0,002). Kun mukaan otetaan ensilinjan hoito niillä NSCLC-potilailla, joilla oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä, mediaanielossaoloaika oli pemetreksedihaarassa 18,6 kuukautta ja plasebohaarassa 13,6 kuukautta, riskisuhde 0,71 (95 % CI = 0,56–0,88 p=0,002).
Histologialtaan pääosin levyepiteeliperäistä syöpää sairastavilla PFS ja OS saadut tulokset eivät viittaa pemetreksedin paremmuuteen plaseboon nähden.
Pemetreksedin turvallisuusprofiilissa ei havaittu kliinisesti merkityksellisiä eroja histologisissa alaryhmissä.
JMEN: Kaplan-Meierin kuvaajat: PFS ja OS, pemetreksedi- vs. plasebopotilailla, joilla oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (NSCLC)
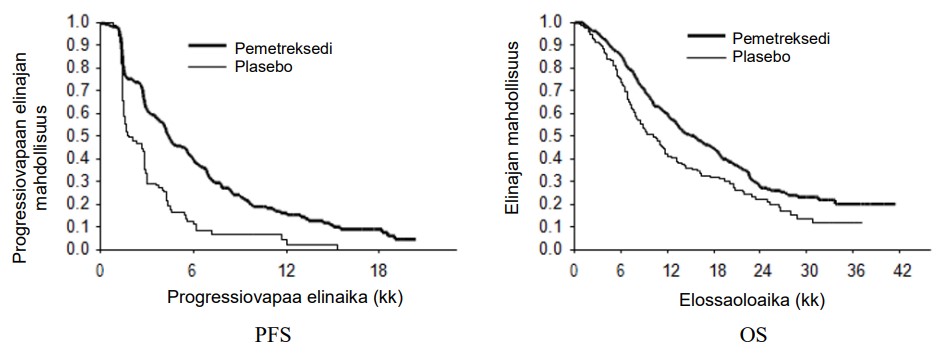
PARAMOUNT
Satunnaistetussa, kaksoissokkoutetussa, vaiheen 3 plasebokontrolloidussa monikeskustutkimuksessa (PARAMOUNT) verrattiin pemetreksedin Pemetreksedi(n = 359) tehoa ja turvallisuutta plaseboon (n = 180) jatketussa ylläpitohoitotutkimuksessa. Kummassakin haarassa potilaat saivat parasta oireenmukaista hoitoa. Potilailla oli paikallisesti edennyt (aste IIIB) tai levinnyt (aste IV) ei-pienisoluinen keuhkosyöpä, joka oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen. Näiden potilaiden tauti ei ollut edennyt ensimmäisen linjan hoidon (pemetreksedi + sisplatiini) 4 syklin jälkeen. Pemetreksedi + sisplatiini ensimmäisen linjan hoitoa sai 939 potilasta, joista 539 satunnaistettiin saamaan joko pemetreksedia tai plaseboa jatkettuna ylläpitohoitona. Satunnaistetuista potilaista 44,9 %:lla oli täysi tai osittainen hoitovaste pemetreksedi + sisplatiini ensilinjan hoitoon ja 51,9 %:lla oli stabiili tauti. Jatkettuun ylläpitohoitoon satunnaistetuilla potilailla tuli olla ECOG-suorituskyky 0 tai 1. Mediaaniaika pemetreksedi + sisplatiini ensilinjan hoidosta ylläpitohoidon aloitukseen oli 2,96 kuukautta molemmissa tutkimushaaroissa. Satunnaistetut potilaat saivat jatkettua ylläpitohoitoa taudin etenemiseen saakka. Teho ja turvallisuus mitattiin ensilinjan hoidon jälkeen tehdystä satunnaistamisesta. Potilaat saivat jatkettua ylläpitohoitoa sekä pemetreksedi- että plaseboryhmässä mediaanisti 4 sykliä. Kaikkiaan 169 potilasta (47,1 %) sai ≥ 6 sykliä pemetreksedin jatkettua ylläpitohoitoa eli yhteensä vähintään 10 pemetreksedisykliä.
Tutkimus saavutti päätetapahtuman tavoitteen ja osoitti pemetreksedihaarassa tilastollisesti merkitsevän pidennyksen progressiovapaaseen elinaikaan verrattuna plaseboon (riippumattoman tahon arvioimat potilaat n = 472, mediaanit pemetreksedi 3,9 ja plasebo 2,6 kuukautta) (riskisuhde 0,64, 95 %, CI = 0,51 – 0,81, p = 0,0002). Riippumattoman tahon potilaskuvien mittaaminen vahvisti tutkijoiden tekemän arvioinnin progressiovapaasta elinajasta. Satunnaistetuilla potilailla pemetreksedi + sisplatiini ensilinjan hoidon alusta mitattuna, tutkijoiden arvioima progressiovapaan elinajan mediaani oli pemetreksedihaarassa 6,9 kuukautta ja plasebolla 5,6 kuukautta (riskisuhde 0,59, 95 %, CI = 0,47 – 0,74).
Pemetreksedi /sisplatiini ensilinjan hoidon (4 sykliä) jälkeen, pemetreksedi-ylläpitohoitohaarassa elossaoloaika oli tilastollisesti parempi kuin plasebolla (mediaani 13,9 kk vs.11,0 kk, riskisuhde 0,78, 95 % CI = 0,64 – 0,96, p = 0,0195). Tämän lopullisen elossaoloaika-analyysin tekohetkellä 28,7 % pemetreksedi-haaran potilaista oli elossa tai ei ollut tavoitettavissa, vastaava luku plasebohaarassa oli 21,7 %. Pemetreksedi-valmisteen suhteellinen hoitovaikutus oli samanlainen eri alaryhmien välillä (mukaan lukien taudin levinneisyysaste, ensilinjan hoitovaste, ECOG-suorituskyky, tupakointitilanne, sukupuoli, histologia ja ikä). Hoitovaikutus oli samanlainen kuin havaittiin korjaamatonta kokonaiselossaoloaikaa ja progressiovapaata elossaoloaikaa tarkastelevissa tilastollisissa analyyseissa. Pemetreksedihaaran potilaista yhden vuoden jälkeen oli elossa 58 % (plaseboryhmästä 45 %) ja kahden vuoden jälkeen 32 % (plaseboryhmästä 21 %). Pemetreksedi/sisplatiini ensilinjan hoidon alusta laskettuna mediaani elossaoloaika oli pemetreksedihaarassa 16,9 kuukautta ja plasebohaarassa 14 kuukautta (riskisuhde 0,78, 95 % CI = 0,64 – 0,96). Tutkimuksen jälkeistä lääkitystä sai 64,3 % pemetreksedihaaran potilaista ja 71,7 % plasebohaaran potilaista.
PARAMOUNT: Kaplan-Meierin kuvaajat: PFS ja OS pemetreksedi vs. plasebo jatkettu ylläpitohoitotutkimus potilailla, joilla oli histologialtaan pääosin muunlainen kuin levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (NSCLC) (laskettu randomisoinnista)
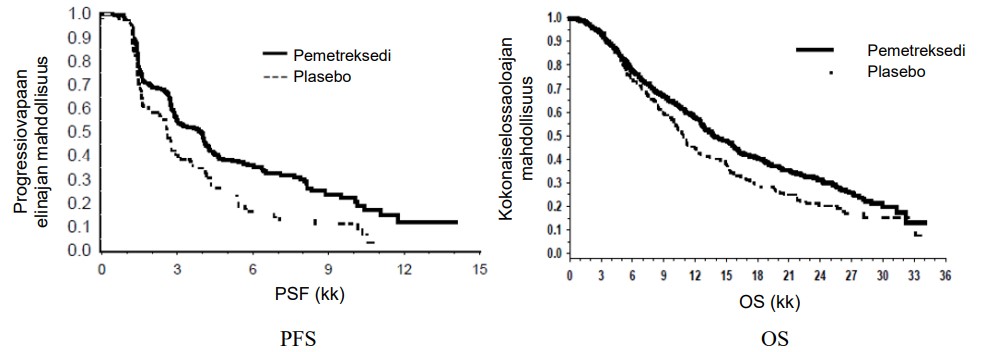
Pemetreksedin turvallisuusprofiili oli samanlainen JMEN- ja PARAMOUNT-tutkimuksessa.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset pemetreksedin käytöstä kaikkien pediatristen potilasryhmien hoidossa pediatrisen tutkimussuunnitelman päätöksen mukaan myönnetyssä käyttöaiheessa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Pelkän pemetreksedin farmakokinetiikkaa on arvioitu 426 syöpäpotilaalla, joilla oli erilaisia kiinteitä kasvaimia, annoksella 0,2 – 838 mg/m² kymmenen minuutin infuusiona. Pemetreksedin vakaan tilan jakautumistilavuus on 9 l/m². In vitro tutkimusten mukaan pemetreksedi sitoutuu plasman proteiineihin noin 81-prosenttisesti. Eriasteinen munuaisten vajaatoiminta ei vaikuttanut sitoutumiseen merkittävästi. Pemetreksedin maksametabolia on rajallista. Pemetreksedi erittyy pääasiassa virtsaan. Annoksesta 70 – 90 % erittyy virtsaan muuttumattomassa muodossa 24 tunnin sisällä lääkkeen annosta. In vitro -tutkimukset osittavat, että pemetreksedi erittyy aktiivisesti OAT3:n (organic anion transporter 3) kautta. Pemetreksedin systeeminen kokonaispuhdistuma on 91,8 ml/min ja eliminaation puoliintumisaika plasmassa 3,5 tuntia potilailla, joiden munuaistoiminta on normaali (kreatiniinipuhdistuma 90 ml/min). Potilaiden välinen vaihtelu puhdistuman suhteen on kohtalaista, 19,3 %. Pemetreksedin systeeminen kokonaisaltistus (AUC) ja suurin pitoisuus plasmassa suurenevat suhteessa annokseen. Pemetreksedin farmakokinetiikka on johdonmukainen useiden hoitosyklien ajan.
Samanaikainen sisplatiinin käyttö ei vaikuta pemetreksedin farmakokinetiikkaan. Suun kautta annettava foolihappo ja lihakseen annettava B12-vitamiinilisä eivät vaikuta pemetreksedin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Pemetreksedin anto tiineille hiirille aiheutti sikiöiden elinkelpoisuuden heikkenemistä, sikiöiden painon pienenemistä, joidenkin luustorakenteiden luutumishäiriöitä ja suulakihalkiota.
Pemetreksedin anto uroshiirille aiheutti lisääntymistoksisuutta, joka ilmeni hedelmällisyyden heikkenemisenä ja kivesatrofiana. Beagle-koirilla tehdyssä tutkimuksessa, jossa pemetreksediä annettiin laskimoon bolusinjektiona 9 kuukautta, havaittiin kiveslöydöksiä (siemenepiteelin degeneraatio/nekroosi). Tämä viittaa siihen, että pemetreksedi voi heikentää urosten hedelmällisyyttä. Naaraiden hedelmällisyyttä ei tutkittu.
Pemetreksedi ei ollut mutageeninen kiinanhamsterin munasoluilla tehdyssä kromosomiaberraatiotestissä in vitro eikä Amesin testissä. Pemetreksedin on osoitettu olevan klastogeeninen in vivo -mikrotumatestissä hiirellä.
Pemetreksedin karsinogeenisuudesta ei ole tehty tutkimuksia.
Farmaseuttiset tiedot
Apuaineet
Mannitoli (E421)
Suolahappo (pH:n säätöä varten)
Natriumhydroksidi (pH:n säätöä varten)
Yhteensopimattomuudet
Pemetreksedi ei ole fysikaalisesti yhteensopiva kalsiumia sisältävien laimentimien kanssa, mukaan lukien Ringerin laktaattiliuos ja Ringerin liuos. Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
3 vuotta
Käyttökuntoon saatettu liuos (välikonsentraatti) ja infuusioliuos
Kun pemetreksedi valmistetaan ohjeiden mukaan, käyttökuntoon saatettu liuos ja infuusioliuos eivät sisällä antimikrobiaalisia säilöntäaineita.
Käyttökuntoon saatettu pemetreksediliuos ja infuusioliuos säilyvät kemiallisesti ja fysikaalisesti 24 tuntia jääkaapissa.
Mikrobiologiselta kannalta valmiste tulee käyttää välittömästi. Jos valmistetta ei käytetä välittömästi, käytönaikainen säilytysaika ja säilytysolosuhteet ovat käyttäjän vastuulla, mutta ne ovat kuitenkin enintään 24 tuntia 2°C –8°C:n lämpötilassa.
Säilytys
Ei erityisvaatimuksia säilytyksen suhteen.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PEMETREXED MEDAC kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
500 mg (L:ei) 500 mg (804,07 €)
1000 mg (L:ei) 1000 mg (1417,46 €)
PF-selosteen tieto
Tyypin I lasista valmistettu injektiopullo, jossa on (fluoripolymeerilla päällystetystä bromobutyylikumista valmistettu) kumitulppa ja joka sisältää 100, 500 tai 1000 mg pemetreksediä.
Pakkauksessa on 1 injektiopullo.
Valmisteen kuvaus:
Valkoinen tai vaaleankeltainen jauhe.
Käyttö- ja käsittelyohjeet
1. Pemetreksedin käyttökuntoon saattaminen ja laimennus laskimoinfuusiota varten tulee tehdä aseptisesti.
2. Laske tarvittava annos ja Pemetrexed medac -injektiopullojen lukumäärä. Injektiopulloissa on hieman ylimääräistä pemetreksediä etiketissä mainitun määrän antamisen helpottamiseksi.
3. Yhden 100 mg:n injektiopullon sisältö saatetaan käyttökuntoon lisäämällä 4,2 ml 9 mg/ml (0,9 %) natriumkloridi-injektionestettä (säilöntäaineeton) kuiva-aineeseen, jolloin tuloksena on 25 mg/ml pemetreksediä sisältävä liuos (välikonsentraatti). Pyöritä injektiopulloa varovasti, kunnes kuiva-aine on liuennut kokonaan. Valmis liuos on kirkas ja sen väri vaihtelee värittömästä keltaiseen. Väri ei vaikuta valmisteen laatuun. Käyttövalmiin liuoksen pH on 6,6 – 7,8. Liuos on jatkolaimennettava.
Yhden 500 mg:n injektiopullon sisältö saatetaan käyttökuntoon lisäämällä 20 ml 9 mg/ml (0,9 %) säilöntäaineetonta natriumkloridi-injektionestettä, jolloin tuloksena on 25 mg/ml pemetreksediä sisältävä liuos (välikonsentraatti). Pyörittele jokaista injektiopulloa varovasti, kunnes kuiva-aine on täysin liuennut. Valmis liuos on kirkas ja sen väri vaihtelee värittömästä keltaiseen. Väri ei vaikuta valmisteen laatuun. Käyttövalmiin liuoksen pH on 6,6 – 7,8. Liuos on jatkolaimennettava.
Yhden 1000 mg:n injektiopullon sisältö saatetaan käyttökuntoon lisäämällä 40 ml 9 mg/ml (0,9 %) säilöntäaineetonta natriumkloridi-injektionestettä, jolloin tuloksena on 25 mg/ml pemetreksediä sisältävä liuos (välikonsentraatti). Pyörittele jokaista injektiopulloa varovasti, kunnes kuiva-aine on täysin liuennut. Valmis liuos on kirkas ja sen väri vaihtelee värittömästä keltaiseen. Väri ei vaikuta valmisteen laatuun. Käyttövalmiin liuoksen pH on 6,6 – 7,8. Liuos on jatkolaimennettava.
4. Oikea määrä pemetreksedi-välikonsentraattia pitää jatkolaimentaa 100 ml:n kokonaistilavuuteen 9 mg/ml (0,9 %) natriumkloridi-injektionesteellä (säilöntäaineeton) ja antaa 10 minuutin laskimoinfuusiona.
5. Yllä mainitulla tavalla valmistettu pemetreksedi-infuusioliuos on yhteensopiva polyvinyylikloridilla ja polyolefiinilla päällystettyjen antolaitteiden ja infuusiopussien kanssa.
6. Parenteraaliset lääkevalmisteet pitää tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa. Jos valmisteessa näkyy hiukkasia, sitä ei saa antaa.
7. Pemetreksediliuos on tarkoitettu vain kertakäyttöön. Käyttämättömät valmisteet tai niistä peräisin oleva jätemateriaali on hävitettävä paikallisten määräysten mukaisesti.
Valmistusta ja antoa koskevat varotoimet
Kuten muidenkin mahdollisesti toksisten syöpälääkkeiden kohdalla, pemetreksedi-infuusioliuoksen käsittelyssä ja käyttöönvalmistuksessa on noudatettava varovaisuutta. Käsineiden käyttöä suositellaan. Jos pemetreksediliuosta joutuu iholle, pese iho heti perusteellisesti vedellä ja saippualla. Jos pemetreksediliuosta joutuu limakalvoille, huuhdo ne huolellisesti vedellä. Pemetreksedi ei aiheuta rakkuloita. Pemetreksedin ekstravasaatioon ei ole mitään spesifistä vasta-ainetta. Muutamia pemetreksedin ekstravasaatiotapauksia on ilmoitettu, mutta tutkija ei pitänyt niitä vakavina. Kuten muidenkin ei rakkuloita aiheuttavien aineiden kohdalla, ekstravasaatio tulee hoitaa paikallisen standardikäytännön mukaisesti.
Korvattavuus
PEMETREXED MEDAC kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
500 mg 500 mg
1000 mg 1000 mg
- Ei korvausta.
ATC-koodi
L01BA04
Valmisteyhteenvedon muuttamispäivämäärä
01.08.2022
Yhteystiedot
Spektri Business Park, Metsänneidonkuja 4
02130 Espoo
010 420 4000
www.medac.fi
info@medac.fi
