ONTOZRY tabletti, kalvopäällysteinen 50 mg, 100 mg, 150 mg, 200 mg, tabletti, kalvopäällysteinen + tabletti 25 mg+12,5 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Ontozry 12,5 mg tabletit
Yksi tabletti sisältää 12,5 mg senobamaattia.
Ontozry 25 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 25 mg senobamaattia.
Ontozry 50 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 50 mg senobamaattia.
Ontozry 100 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 100 mg senobamaattia.
Ontozry 150 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 150 mg senobamaattia.
Ontozry 200 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 200 mg senobamaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi 12,5 mg:n tabletti sisältää 39,7 mg laktoosimonohydraattia.
Yksi 25 mg:n kalvopäällysteinen tabletti sisältää 79,3 mg laktoosimonohydraattia.
Yksi 50 mg:n kalvopäällysteinen tabletti sisältää 158,7 mg laktoosimonohydraattia.
Yksi 100 mg:n kalvopäällysteinen tabletti sisältää 108,7 mg laktoosimonohydraattia.
Yksi 150 mg:n kalvopäällysteinen tabletti sisältää 163 mg laktoosimonohydraattia.
Yksi 200 mg:n kalvopäällysteinen tabletti sisältää 217,4 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Ontozry 12,5 mg tabletti
Tabletti
Ontozry 25 mg, 50 mg, 100 mg, 150 mg ja 200 mg kalvopäällysteinen tabletti
Kalvopäällysteinen tabletti
Kliiniset tiedot
Käyttöaiheet
Ontozry on tarkoitettu lisälääkkeeksi paikallisalkuisten toissijaisesti yleistyvien tai yleistymättömien kohtausten hoitoon epilepsiaa sairastaville aikuispotilaille, joiden sairaus ei ole riittävässä hoitotasapainossa aiemmin käytetyistä vähintään kahdesta epilepsialääkkeestä huolimatta.
Annostus ja antotapa
Annostus
Aikuiset
Senobamaatin suositeltu aloitusannos on 12,5 mg/vrk, jota suurennetaan asteittain suositeltuun tavoiteannokseen 200 mg/vrk. Annosta voidaan suurentaa kliinisen vasteen perusteella enintään 400 mg:aan vuorokaudessa.
Suositeltu titrausaikataulu on esitetty taulukossa 1. Sitä ei pidä ylittää vakavien haittavaikutusten mahdollisuuden vuoksi (ks. kohta Haittavaikutukset).
Taulukko 1: Suositeltu annostus aikuisille, joilla on paikallisalkuisia epilepsiakohtauksia
| Hoitovaihe | Annos (vuorokaudessa, suun kautta) | Kesto |
| Hoidon aloitus | 12,5 mg | Viikot 1 ja 2 |
| 25 mg | Viikot 3 ja 4 | |
| Titraus | 50 mg | Viikot 5 ja 6 |
| 100 mg | Viikot 7 ja 8 | |
| 150 mg | Viikot 9 ja 10 | |
| Tavoiteannos | 200 mg | Viikot 11 ja 12 ja siitä eteenpäin |
| Annoksen optimointi | Jotkut potilaat, jotka eivät saavuta optimaalista kohtausten hallintaa, voivat hyötyä yli 200 mg:n annoksista (annosta suurennetaan lisäämällä 50 mg/vrk kahden viikon välein). Enimmäisannos on 400 mg vuorokaudessa. | |
Annoksen jääminen väliin
Jos potilaalta jää väliin yksi annos, on suositeltavaa, että hän ottaa kerta‑annoksen heti muistaessaan, ellei seuraavaan aikataulun mukaiseen annokseen ole alle 12 tuntia.
Hoidon lopettaminen
On suositeltavaa, että hoito lopetetaan vähitellen (vähintään kahden viikon aikana) rebound‑kohtausten mahdollisuuden minimoimiseksi, elleivät turvallisuuteen liittyvät huolenaiheet edellytä äkillistä lopettamista.
Iäkkäät potilaat (vähintään 65‑vuotiaat)
Senobamaatin kliinisiin tutkimuksiin ei osallistunut riittävää määrää vähintään 65-vuotiaita potilaita, jotta voitaisiin määrittää, vastasivatko he hoitoon eri lailla kuin nuoremmat potilaat. On raportoitu, että epilepsialääkkeitä saavilla iäkkäillä potilailla esiintyy useammin tiettyjä haittavaikutuksia, kuten väsymystä/uupumusta, kävelyhäiriöitä, kaatumista, ataksiaa, tasapainohäiriöitä, heitehuimausta ja uneliaisuutta. Yleisesti ottaen on noudatettava varovaisuutta valittaessa annosta iäkkäille potilaille ja aloitettava tavallisesti annosalueen alapäästä. Valinnassa on huomioitava maksan tai munuaisten heikentyneen toiminnan ja muiden samanaikaisten sairauksien suurempi esiintyvyys sekä mahdolliset yhteisvaikutukset monilääkehoitoa saavilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Senobamaattia on käytettävä varoen ja tavoiteannoksen pienentämistä voidaan harkita potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma 30 – < 90 ml/min) tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma < 30 ml/min). Suositeltu enimmäisannos potilaille, joilla on lievä, kohtalainen tai vaikea munuaisten vajaatoiminta, on 300 mg/vrk. Senobamaattia ei pidä käyttää potilaille, joilla on loppuvaiheen munuaissairaus tai jotka saavat hemodialyysihoitoa.
Maksan vajaatoiminta
Senobamaattialtistus oli suurempaa potilailla, joilla oli krooninen maksasairaus. Aloitusannosta ei tarvitse muuttaa. Tavoiteannoksen pienentämistä jopa 50 %:iin voidaan kuitenkin joutua harkitsemaan. Suurin suositeltu annos potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta, on 200 mg/vrk. Senobamaattia ei pidä käyttää potilaille, joilla on vaikea maksan vajaatoiminta.
Pediatriset potilaat
Ontozry‑valmisteen turvallisuutta ja tehoa 0 kuukauden – 18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suun kautta.
Senobamaatti otetaan yleensä kerta‑annoksena suun kautta kerran vuorokaudessa mihin aikaan tahansa. Se on kuitenkin suositeltavaa ottaa samaan aikaan joka päivä. Ontozry voidaan ottaa joko aterian yhteydessä tai tyhjään mahaan (ks. kohta Farmakokinetiikka). Tabletti niellään kokonaisena vesilasillisen kanssa. Tabletteja ei voi jakaa tarkasti, koska niissä ei ole jakouurretta, eikä annoksen tarkkuutta voida taata.
Tabletti voidaan ottaa kokonaisena tai murskata. Murskattu tabletti voidaan sekoittaa veteen ja antaa suun kautta tai nenä-mahaletkun kautta (ks. kohta Käyttö- ja käsittelyohjeet).
Murskattujen tablettien antaminen nenä-mahaletkun kautta:
Murskatut Ontozry-tabletit voidaan sekoittaa veteen ja antaa nenä-mahaletkun kautta seuraavasti:
1. Murskaa määrätty annos tabletteja.
2. Sekoita murskatut tabletit ja 25 ml vettä asianmukaisessa astiassa.
3. Sekoita muodostaaksesi suspensio murskatuista tableteista.
4. Varmista, ettei astiaan jää hiukkasia ja vedä suspensio ruiskuun ja ruiskuta se nenä-mahaletkuun.
5. Täytä katetrin kärjen ruisku uudelleen 10 ml vedellä, pyörittele kevyesti ja anna annostele.
6. Varmista silmämääräisesti, ettei ruiskuun ole jäänyt hiukkasia. Jos hiukkasia on jäljellä, toista kohta 5.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Familiaalinen lyhyt QT -oireyhtymä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Itsetuhoajatukset
Epilepsialääkkeillä, mukaan lukien senobamaatti, hoidetuilla potilailla on raportoitu itsetuhoajatuksia ja itsetuhoista käyttäytymistä. Satunnaistettujen, lumelääkekontrolloitujen epilepsialääkkeiden tutkimusten meta‑analyysi on myös osoittanut itsetuhoajatusten ja itsetuhoisen käyttäytymisen riskin vähäistä lisääntymistä. Tämän riskin mekanismia ei tunneta. Näin ollen potilaita on seurattava itsetuhoajatusten ja itsetuhoisen käyttäytymisen merkkien varalta, ja asianmukaista hoitoa on harkittava.
Potilaita (ja heidän omaisiaan) on neuvottava hakeutumaan lääkäriin, jos merkkejä itsetuhoajatuksista tai itsetuhoisesta käyttäytymisestä ilmenee.
Lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (DRESS‑reaktio)
Lääkkeeseen liittyvää yleisoireista eosinofiilista reaktiota (DRESS‑reaktiota), joka voi olla hengenvaarallinen tai johtaa kuolemaan, on raportoitu senobamaattihoidon yhteydessä, kun hoito on aloitettu suuremmilla annoksilla ja suurennettu nopeasti (viikoittain tai nopeammin) (ks. kohta Haittavaikutukset). Kun senobamaattihoito aloitettiin annoksella 12,5 mg/vrk ja titrattiin kahden viikon välein avoimessa 1 340 epilepsiapotilaan turvallisuustutkimuksessa, DRESS‑tapauksia ei raportoitu.
Potilaille on kerrottava DRESS‑reaktion merkeistä ja oireista lääkettä määrättäessä, ja heitä on seurattava tarkasti ihoreaktioiden varalta. DRESS‑reaktion oireita ovat tyypillisesti (joskaan ei pelkästään) kuume, muun elinjärjestelmän oireiluun liittyvä ihottuma, lymfadenopatia, maksan toimintakokeiden tulosten poikkeavuudet ja eosinofilia. On tärkeää huomata, että yliherkkyyden varhaisia ilmenemismuotoja, kuten kuumetta tai lymfadenopatiaa, voi esiintyä, vaikka ihottumaa ei olisikaan havaittavissa. Jos näihin reaktioihin viittaavia merkkejä ja oireita ilmenee, senobamaattihoito on keskeytettävä välittömästi ja jotain toista hoitovaihtoehtoa on harkittava (soveltuvin osin).
QT‑välin lyheneminen
Senobamaatin käytön yhteydessä on havaittu annoksesta riippuvaista QTcF‑välin lyhenemistä. QTcF‑välin lyhenemistä alle 340 millisekuntiin ei ole havaittu (ks. kohta Farmakodynamiikka). Kliinisissä tutkimuksissa ei ilmennyt näyttöä siitä, että senobamaatin ja muiden epilepsialääkkeiden yhdistelmä lyhentäisi edelleen QT‑väliä. Lääkärin on noudatettava varovaisuutta määrätessään senobamaattia yhdessä muiden lääkevalmisteiden kanssa, joiden tiedetään lyhentävän QT‑väliä.
Familiaalinen lyhyt QT ‑oireyhtymä on harvinainen geneettinen oireyhtymä, joka on yhteydessä äkkikuoleman ja kammioperäisten rytmihäiriöiden, erityisesti kammiovärinän, suurentuneeseen riskiin. Senobamaattia ei saa käyttää potilaille, joilla on familiaalinen lyhyt QT -oireyhtymä (ks. kohta Vasta-aiheet).
Sisältää laktoosia
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi‑intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi‑imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Senobamaatti metaboloituu laajasti, pääasiassa glukuronidaation kautta ja vähäisemmässä määrin oksidaation kautta.
Senobamaatti saattaa vähentää altistusta pääasiassa CYP3A4:n ja 2B6:n kautta metaboloituville valmisteille. Senobamaatti saattaa suurentaa altistusta pääasiassa CYP2C19:n kautta metaboloituville valmisteille. Senobamaattihoitoa aloitettaessa tai lopetettaessa tai annosta muutettaessa uuden entsyymiaktiivisuustason saavuttamiseen saattaa kulua 2 viikkoa.
Farmakodynaamiset yhteisvaikutukset
Keskushermostoa lamaavat aineet
Senobamaatin samanaikainen käyttö muiden keskushermostoa lamaavien aineiden, kuten alkoholin, barbituraattien ja bentsodiatsepiinien, kanssa voi lisätä neurologisten haittavaikutusten riskiä. Yksilöllisen vasteen perusteella barbituraatti‑ ja bentsodiatsepiiniannoksia on siten mahdollisesti pienennettävä kliinisen tarpeen mukaan, jos niitä käytetään samanaikaisesti senobamaatin kanssa.
Yhteisvaikutukset muiden epilepsialääkkeiden kanssa
| Lääkeaine- tai substraattityyppi | Kliininen suositus | Vaikutus farmakodynaamisiin parametreihin |
|---|---|---|
| Epilepsialääke | ||
| Fenytoiini | Senobamaattiannosta ei tarvitse muuttaa.
Fenytoiinipitoisuuksia on seurattava senobamaatin titrauksen aikana, ja yksilöllisestä vasteesta riippuen fenytoiiniannosta voi olla tarpeen pienentää. | ↑ Fenytoiinipitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa senobamaatin (200 mg/vrk) ja fenytoiinin (300 mg/vrk) samanaikainen anto pienensi senobamaattialtistusta hieman (Cmax-pitoisuus pieneni 27 % ja AUC-arvo 28 %) ja suurensi fenytoiinialtistusta (Cmax-pitoisuus suureni 67 % ja AUC-arvo 84 %). |
| Fenobarbitaali | Senobamaattiannosta ei tarvitse muuttaa.
Fenobarbitaalipitoisuuksia on seurattava senobamaatin titrauksen aikana, ja yksilöllisestä vasteesta riippuen fenobarbitaaliannosta voi olla tarpeen pienentää. | ↑ Fenobarbitaalipitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa senobamaatin (200 mg/vrk) ja fenobarbitaalin (90 mg/vrk) samanaikainen anto ei aiheuttanut kliinisesti merkittäviä muutoksia senobamaattialtistukseen mutta suurensi fenobarbitaalialtistusta (Cmax‑pitoisuus suureni 34 % ja AUC‑arvo 37 %). |
| Klobatsaami | Senobamaattiannosta ei tarvitse muuttaa.
Koska klobatsaamin aktiivisen metaboliitin (N‑desmetyyliklobatsaamin) altistus saattaa suurentua CYP3A4:n induktion (formaation) ja CYP2C19:n eston (eliminaation) takia, klobatsaamiannosta voi olla tarpeen pienentää. | ↑ Klobatsaamin aktiivisen metaboliitin pitoisuudet plasmassa
Terveiltä tutkittavilta ja potilailta saatujen tietojen farmakometristen analyysien mukaan klobatsaami suurentaa senobamaattialtistusta hieman (24 %). |
Lamotrigiini
| Yksilöllisestä vasteesta riippuen senobamaattiannosta voidaan joutua suurentamaan.
Samanaikaista lamotrigiinihoitoa saavien potilaiden alaryhmäanalyysien perusteella joissakin tapauksissa tehon saavuttamiseksi saatetaan tarvita suurempia senobamaattiannoksia (200–400 mg/vrk). | ↓ Lamotrigiinipitoisuudet plasmassa
Terveiden tutkittavien ja potilaiden tietojen farmakometriset analyysit osoittivat, että senobamaatin samanaikainen anto lamotrigiinin kanssa ei vaikuttanut senobamaattialtistukseen mutta pienensi lamotrigiinipitoisuuksia annosriippuvaisesti (lamotrigiinipitoisuus pieneni 21 %, kun senobamaattiannos oli 100 mg/vrk, 35 %, kun senobamaattiannos oli 200 mg/vrk, ja 52 %, kun senobamaattiannos oli 400 mg/vrk). |
| Karbamatsepiini | Samanaikaisesti karbamatsepiinia käyttävillä potilailla ei havaittu kliinisesti merkittävää tehon pienenenemistä. Karbamatsepiinin ja senobamaatin annosta ei tarvitse muuttaa. | ↓ Karbamatsepiini pitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa ei havaittu merkittävää muutosta senobamaattialtistuksessa, kun senobamaattia annettiin 200 mg kerran vuorokaudessa ja karbamatsepiinia 200 mg kahdesti vuorokaudessa. Karbamatsepiinialtistus kuitenkin pieneni hieman (Cmax-pitoisuus pieneni 23 % ja AUC-arvo pieneni 24 %). |
| Valproiinihappo | Senobamaatin ja valproiinihapon annosta ei tarvitse muuttaa. | Valproiinihapolla ei ole kliinisesti merkittävää vaikutusta.
Terveillä tutkittavilla tehdyssä tutkimuksessa ei havaittu merkittäviä muutoksia altistuksessa kummallekaan lääkevalmisteelle, kun senobamaattia annettiin 150 mg kerran vuorokaudessa ja valproiinihappoa 1 000 mg kerran vuorokaudessa. Terveiden tutkittavien ja potilaiden tietojen farmakometriset analyysit osoittivat, että senobamaatin ja valproiinihapon samanaikainen käyttö ei vaikuttanut senobamaattialtistuksiin eikä aiheuttanut kliinisesti merkittävää valproiinihappopitoisuuden pienenemistä. |
| Lakosamidi, levetirasetaami ja okskarbatsepiini | Senobamaatin, lakosamidin, levetirasetaamin tai okskarbatsepiinin annosta ei tarvitse muuttaa. | Lakosamidilla, levetirasetaamilla ja okskarbatsepiinilla ei ole kliinisesti merkittävää vaikutusta.
Terveiden tutkittavien ja potilaiden tietojen farmakometriset analyysit osoittivat, että samanaikainen käyttö lakosamidin, levetirasetaamin tai okskarbatsepiinin kanssa ei vaikuttanut senobamaattialtistukseen, eikä senobamaatilla ollut kliinisesti merkittävää vaikutusta lakosamidi-, levetirasetaami- tai okskarbatsepiinialtistukseen. |
Muut lääkevalmisteet
| Lääkeaine- tai substraattityyppi | Kliininen suositus | Vaikutus farmakodynaamisiin parametreihin |
|---|---|---|
Suun kautta otettavat ehkäisyvalmisteet (CYP3A4) | Suun kautta otettavia ehkäisyvalmisteita samanaikaisesti käyttävien naisten, jotka voivat tulla raskaaksi, on käytettävä lisäksi tai vaihtoehtoisesti muita ehkäisymenetelmiä, jotka eivät ole hormonaalisia (ks. kohta Raskaus ja imetys). | ↓ Suun kautta otettavat ehkäisyvalmisteet pitoisuudet plasmassa
Senobamaatin havaittiin indusoivan CYP3A4:ää annosriippuvaisesti, mikä pienensi altistusta (AUC) CYP3A4:n substraatti midatsolaamille (annos 2 mg) 72 %, kun midatsolaamia annettiin yhdessä senobamaatin (200 mg/vrk) kanssa terveille tutkittaville. Koska myös hormonaaliset ehkäisyvalmisteet voivat metaboloitua CYP3A4:n välityksellä, niiden teho voi heikentyä, jos niitä käytetään samanaikaisesti senobamaatin kanssa. |
| CYP3A4:n substraatit | CYP3A4-välitteisesti metaboloituvien lääkkeiden annoksen suurentaminen voi olla tarpeen, kun niitä käytetään samanaikaisesti senobamaatin kanssa. | ↓ CYP3A4:n substraatit pitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa senobamaatin samanaikainen anto pienensi altistusta (AUC) CYP3A4:n substraatti midatsolaamille (annos 2 mg) 27 % senobamaattiannoksen ollessa 100 mg ja 72 % senobamaattiannoksen ollessa 200 mg. |
| CYP2B6:n substraatit | CYP2B6-välitteisesti metaboloituvien lääkkeiden annoksen suurentaminen voi olla tarpeen, kun niitä käytetään samanaikaisesti senobamaatin kanssa. | ↓ CYP2B6:n substraatit pitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa senobamaatin samanaikainen anto (200 mg kerran vuorokaudessa) pienensi altistusta CYP2B6:n substraatti bupropionille (annos 150 mg) (Cmax-pitoisuus pieneni 23 % ja AUC-arvo pieneni 39 %). |
| CYP2C19:n substraatit | CYP2C19-välitteisesti metaboloituvien lääkkeiden annoksen pienentäminen voi olla tarpeen, kun niitä käytetään samanaikaisesti senobamaatin kanssa. | ↑ CYP2C19:n substraatit pitoisuudet plasmassa
Terveillä tutkittavilla tehdyssä tutkimuksessa senobamaatin samanaikainen anto (200 mg kerran vuorokaudessa) suurensi altistusta CYP2C19:n substraatti omepratsolille (annos 20 mg) (Cmax-pitoisuus suureni 83 % ja AUC-arvo suureni 107 %). |
| OAT3:n substraatit | Senobamaatin ja OAT3:n kuljettamien lääkevalmisteiden samanaikainen anto voi suurentaa altistusta näille lääkevalmisteille. | ↑ OAT3:n substraatit pitoisuudet plasmassa
In vitro ‑tutkimukset ovat osoittaneet, että senobamaatti estää OAT3:a, kuljettajaproteiinia, joka on vallitsevasti mukana tiettyjen lääkkeiden eliminaatiossa (esim. barisitinibi, kefaklori, empagliflotsiini, G-penisilliini, ritobegroni ja sitagliptiini). |
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi, ja raskaudenehkäisy miehillä ja naisilla
Senobamaatin käyttöä ei suositella sellaisten naisten hoitoon, jotka voivat tulla raskaaksi mutta eivät käytä ehkäisyä. Naisten, jotka voivat tulla raskaaksi ja jotka käyttävät suun kautta otettavia ehkäisyvalmisteita, on käytettävä lisäksi tai vaihtoehtoisesti muita ehkäisymenetelmiä, jotka eivät ole hormonaalisia, senobamaattihoidon aikana ja neljä viikkoa hoidon päättymisen jälkeen (ks. kohta Yhteisvaikutukset).
Raskaus
Epilepsiaan ja epilepsialääkkeisiin yleisesti liittyvä riski
On osoitettu, että epilepsiahoitoa saaneiden naisten jälkeläisillä epämuodostumien esiintyvyys on 2–3 kertaa suurempi kuin yleisväestössä, jossa esiintyvyys on noin 3 %. Hoitoa saaneessa potilasjoukossa epämuodostumien lisääntymistä on havaittu monilääkityksen yhteydessä. Hoidon ja/tai taustalla olevan sairauden vaikutuksen määrää ei kuitenkaan ole selvitetty. Epilepsiahoitojen keskeyttäminen voi pahentaa sairautta, mikä voi olla haitallista äidille ja sikiölle.
Senobamaattiin liittyvä riski
Ontozry‑valmisteen käytöstä raskaana oleville naisille ei ole olemassa riittävästi tietoja.
Eläimillä tehdyt tutkimukset ovat osoittaneet, että senobamaatti läpäisee rotan istukan. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta kliinistä altistumista pienemmillä pitoisuuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Ontozry-valmistetta ei pidä käyttää raskauden aikana, ellei raskaana olevan potilaan kliininen tilanne edellytä hoitoa senobamaatilla. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä senobamaattihoidon aikana ja neljän viikon ajan hoidon päättymisen jälkeen (ks. kohta Yhteisvaikutukset).
Imetys
Ei tiedetä, erittyvätkö senobamaatti tai sen metaboliitit ihmisillä äidinmaitoon.
Rotilla tehdyt tutkimukset osoittivat senobamaatin erittyvän rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Varotoimena imetys on lopetettava Ontozry‑hoidon ajaksi.
Hedelmällisyys
Senobamaatin vaikutuksia ihmisen hedelmällisyyteen ei tunneta. Tiedot eläimillä tehdyistä tutkimuksista ovat riittämättömiä, koska altistuminen tapahtui kliinistä altistumista pienemmillä pitoisuuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ontozry‑valmisteella on kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Senobamaatti voi aiheuttaa uneliaisuutta, heitehuimausta, väsymystä/uupumusta, näön heikentymistä ja muita keskushermostoon liittyviä oireita, jotka voivat vaikuttaa ajokykyyn tai koneidenkäyttökykyyn. Potilaita neuvotaan olemaan ajamatta ajoneuvoa, käyttämättä monimutkaisia koneita tai ryhtymättä muihin mahdollisesti vaarallisiin toimiin, kunnes tiedetään, vaikuttaako senobamaatti heidän kykyynsä suoriutua näistä tehtävistä (ks. kohta Yhteisvaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin raportoidut haittavaikutukset olivat uneliaisuus, heitehuimaus, väsymys/uupumus ja päänsärky.
Kliinisissä tutkimuksissa hoidon keskeytti haittavaikutusten takia 5 % potilaista, jotka oli satunnaistettu saamaan senobamaattia 100 mg/vrk, 6 % potilaista, jotka oli satunnaistettu saamaan senobamaattia 200 mg/vrk ja 19 % potilaista, jotka oli satunnaistettu saamaan senobamaattia 400 mg/vrk. Keskeyttämisprosentti oli 3 % potilailla, jotka oli satunnaistettu saamaan lumelääkettä. 400 mg:n annokseen liittyi enemmän haittavaikutuksia, erityisesti käytettäessä sitä samanaikaisesti klobatsaamin kanssa.
Yleisimmin hoidon keskeyttämiseen johtaneet haittavaikutukset olivat, alenevassa järjestyksessä, ataksia (1,6 % vs. 0,5 % lumelääke), heitehuimaus (1,6 % vs. 0,5 % lumelääke), uneliaisuus (1,4 % vs. 0,5 % lumelääke), nystagmus (0,7 % vs. 0 % lumelääke), kiertohuimaus (0,7 % vs. 0 % lumelääke) ja diplopia (0,5 % vs. 0 % lumelääke). Nämä haittavaikutukset riippuvat annoksesta, ja titrausaikataulua on noudatettava tarkasti.
Taulukkomuotoinen luettelo haittavaikutuksista
Kliinisissä tutkimuksissa raportoidut haittavaikutukset on lueteltu taulukossa 2 elinjärjestelmäluokan (SOC) ja esiintymistiheyden mukaan. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vaikeusasteen mukaan alenevassa järjestyksessä: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100) ja harvinainen (≥ 1/10 000, < 1/1 000).
Taulukko 2: Taulukkomuotoinen luettelo haittavaikutuksista
| Elinjärjestelmäluokka | Esiintymistiheys | Kliinisissä tutkimuksissa esiintyneet haittavaikutukset |
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys* |
| Psyykkiset häiriöt | Yleinen | Sekavuustila, ärtyneisyys |
| Melko harvinainen | Itsetuhoajatukset | |
| Hermosto | Hyvin yleinen | Uneliaisuus*, koordinaatio- ja kävelyhäiriöt*, päänsärky |
| Yleinen | Dysartria, nystagmus, afasia, muistin heikentyminen | |
| Silmät | Yleinen | Diplopia, näön hämärtyminen |
| Ruoansulatuselimistö | Yleinen | Ummetus, ripuli, pahoinvointi, oksentelu, suun kuivuminen |
| Iho ja ihonalainen kudos | Yleinen | Ihottuma* |
| Harvinainen | Lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (DRESS‑reaktio) | |
| Tutkimukset | Yleinen | Maksaentsyymiarvojen suureneminen* |
*Ryhmitellyt termit: uneliaisuus: uneliaisuus, väsymys/uupumus, sedaatio ja hypersomnia; koordinaatio- ja kävelyhäiriöt: heitehuimaus, kiertohuimaus, tasapainohäiriöt, ataksia, kävelyhäiriö ja epänormaali koordinaatio; yliherkkyys: yliherkkyys, lääkeyliherkkyys, silmäluomien turvotus; ihottuma: ihottuma, punoittava ihottuma, yleistynyt ihottuma, makulaarinen ihottuma, makulopapulaarinen ihottuma, morbilliforminen ihottuma, papulaarinen ihottuma, kutiseva ihottuma; maksaentsyymiarvojen suureneminen: alaniiniaminotransferaasiarvon suureneminen, aspartaattiaminotransferaasiarvon suureneminen, maksaentsyymiarvon suureneminen, maksan epänormaali toiminta, transaminaasiarvojen suureneminen.
Valikoitujen haittavaikutusten kuvaukset
Lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (DRESS‑reaktio)
Kolme DRESS‑tapausta raportoitiin 2–4 viikon sisällä senobamaatin aloittamisesta tutkimuksissa, joissa käytettiin suuria aloitusannoksia (50 mg tai 100 mg kerran vuorokaudessa) ja viikoittaista tai nopeampaa titrausta. Kun senobamaattihoito aloitettiin annoksella 12,5 mg/vrk ja titrattiin kahden viikon välein avoimessa 1 340 epilepsiapotilaan turvallisuustutkimuksessa, DRESS‑tapauksia ei raportoitu.
Potilaille on kerrottava DRESS‑reaktion merkeistä ja oireista lääkettä määrättäessä, ja heitä on seurattava tarkasti ihoreaktioiden varalta. DRESS‑reaktion oireita ovat tyypillisesti (joskaan ei pelkästään) kuume, muun elinjärjestelmän oireiluun liittyvä ihottuma, lymfadenopatia, maksan toimintakokeiden tulosten poikkeavuudet ja eosinofilia. On tärkeää huomata, että yliherkkyyden varhaisia ilmenemismuotoja, kuten kuumetta tai lymfadenopatiaa, voi esiintyä, vaikka ihottumaa ei olisikaan havaittavissa. Jos näihin reaktioihin viittaavia merkkejä ja oireita ilmenee, senobamaattihoito on keskeytettävä välittömästi ja jotain toista hoitovaihtoehtoa on harkittava (soveltuvin osin). Ontozry‑hoito on aina aloitettava 12,5 mg:n annoksella kerran vuorokaudessa, ja sitä ei pidä titrata nopeammin kuin kahden viikon välein (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Yliherkkyys
Neljällä (0,9 %) senobamaattihoitoa saaneella potilaalla ja yhdellä (0,5 %) lumelääkettä saaneella potilaalla ilmeni yliherkkyystapahtuma. Kahdella senobamaattiannosryhmän potilaalla raportoitu tapahtuma oli lääkeyliherkkyys. Yhdellä senobamaattihoitoa saaneella potilaalla raportoitu tapahtuma oli yliherkkyys, ja yhdellä senobamaattihoitoa saaneella potilaalla raportoitu tapahtuma oli silmäluomien turvotus. Lumelääkettä saaneella potilaalla raportoitu tapahtuma oli yliherkkyys. Kaikki tapahtumat luokiteltiin lieviksi tai kohtalaisiksi.
Iäkkäät potilaat
Turvallisuutta koskevat tiedot yhdistetyistä kaksoissokkoutetuista ja kaikista vaiheen 2/3 tietojoukoista sekä vaiheen 1 tutkimuksesta saadut farmakokineettiset tiedot eivät viitanneet ylimääräisiin turvallisuusriskeihin iäkkäillä tutkittavilla, jotka olivat > 65‑vuotiaita aloittaessaan tutkimuksen. Ne tutkittavat, jotka olivat > 65‑vuotiaita osallistuessaan tutkimukseen, ryhmiteltiin iän osalta alaryhmiin: näiden 87 tutkittavan haittavaikutustulokset olivat samankaltaiset kuin niiden 51 tutkittavan tulokset, jotka olivat > 65‑vuotiaita tutkimuksen aloittaessaan (ks. kohta Annostus ja antotapa).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen oireiden odotetaan olevan yhdenmukaisia Ontozry‑valmisteen tunnettujen haittavaikutusten kanssa. Niihin kuuluvat uneliaisuus, väsymys/uupumus ja heitehuimaus. Senobamaatin vaikutuksia varten ei ole käytettävissä spesifistä vastalääkettä. Potilaan yleinen tukihoito on aiheellista, mukaan lukien elintoimintojen seuranta ja potilaan kliinisen tilan tarkkailu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: epilepsialääkkeet, muut epilepsialääkkeet, ATC‑koodi: N03AX25.
Vaikutusmekanismi
Senobamaatti on pieni molekyyli, jolla on kaksi vaikutusmekanismia. Se on γ‑aminovoihapon (GABAA)‑ionikanavan alatyyppien positiivinen allosterinen modulaattori, joka ei sitoudu bentsodiatsepiinin sitoutumiskohtaan. Senobamaatin on myös osoitettu vähentävän toistuvaa hermosolujen laukeamista tehostamalla natriumkanavien inaktivointia ja estämällä natriumvirran pysyvää komponenttia. Tarkkaa vaikutusmekanismia, jolla senobamaatin terapeuttiset vaikutukset toteutuvat paikallisalkuisia kohtauksia sairastavilla potilailla, ei tunneta.
Farmakodynaamiset vaikutukset
Sydämen elektrofysiologia
Terveillä vapaaehtoisilla tehdyssä lumelääkekontrolloidussa QT‑tutkimuksessa havaittiin QTcF‑välin annosriippuvaista lyhenemistä senobamaatin käytön yhteydessä. Keskimääräinen ΔΔQTcF‑arvo on ‑10,8 [luottamusväli: ‑13,4; ‑8,2] msek annoksen ollessa 200 mg kerran vuorokaudessa ja ‑18,4 [luottamusväli: ‑21,5; ‑15,2] msek annoksen ollessa 500 mg kerran vuorokaudessa (1,25 kertaa suositeltu enimmäisannos). QTcF‑välin lyhenemistä alle 340 millisekuntiin ei havaittu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliininen teho ja turvallisuus
Senobamaatin tehoa paikallisalkuisten kohtausten lisälääkkeenä tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa monikeskustutkimuksessa aikuisilla potilailla, joilla oli paikallisalkuinen epilepsia, joka ei ollut riittävässä hoitotasapainossa aiemmasta epilepsialääkehoidosta huolimatta. Potilaita hoidettiin 1–3 samanaikaisella epilepsialääkkeellä, jotka pysyivät muuttumattomina kaksoissokkoutetun tutkimushoidon aikana. Senobamaatin vuorokausiannos oli 100–400 mg/vrk.
Tutkimuksessa oli 8 viikon prospektiivinen lähtötasojakso, jonka aikana potilailla oli oltava vähintään 3 tai 4 paikallisalkuista kohtausta 28 vuorokauden aikana, eikä potilaalla saanut olla yli 3–4 viikkoa kestävää kohtauksetonta jaksoa. Tämän jälkeen tutkimuksessa oli 18 viikon hoitojakso, mukaan lukien 12 viikkoa kiinteällä annoksella. Yleisimmin käytettyjä epilepsialääkkeitä tutkimuksen aloitushetkellä olivat levetirasetaami, lamotrigiini, karbamatsepiini ja lakosamidi. Kaikilla tutkimuksessa aloittaneilla tutkittavilla kohtauksia tuli edelleen huolimatta siitä, että suurin osa heistä oli aiemmin saanut hoitoa kahdella tai useammalla epilepsialääkkeellä. Yli 80 % potilaista käytti kahta tai useampaa samanaikaisesti käytettävää epilepsialääkettä tutkimuksessa aloittamisen hetkellä. Tehoa koskevista tuloksista on esitetty yhteenveto taulukossa 3.
Tutkimuksessa verrattiin senobamaattiannoksia 100 mg/vrk, 200 mg/vrk ja 400 mg/vrk lumelääkkeeseen, standardihoidon lisänä. Tutkittavat jatkoivat vakaata hoitoa 1–3:lla taustalääkityksenä olevalla epilepsialääkkeellä. Hoito aloitettiin 50 mg:n vuorokausiannoksella ja annosta suurennettiin 50 mg/vrk joka viikko, kunnes saavutettiin 200 mg/vrk. Tämän jälkeen annosta suurennettiin 100 mg/vrk joka viikko tutkittavilla, jotka oli satunnaistettu saamaan 400 mg/vrk.
Taulukossa 3 on esitetty niiden potilaiden osuus, joilla kohtausten esiintymistiheys väheni vähintään 50 % lähtötasosta.
Taulukko 3: Niiden potilaiden osuus, jotka saivat vähintään 50 %:n vasteen tutkimuksessa C017
Tutkimus | Standardihoito ja lumelääke | Standardihoito ja senobamaatti | ||
100 mg/vrk | 200 mg/vrk | 400 mg/vrk | ||
Tutkimus C017 | ||||
n = 102 | n = 102 | n = 98 | n = 95 | |
50 %:n vasteen saaneiden määrä1 | 26 (25,5 %) | 41 (40,2 %) | 55 (56,1 %) | 61 (64,2 %) |
Senobamaatin ja lumelääkkeen ero | 14,7 % (p = 0,036) | 30,6 % (p < 0,001) | 38,7 % (p < 0,001) | |
112 viikkoa kestäneen kiinteän annoksen kaksoissokkoutetun hoidon aikana
Kuvassa 1 on esitetty potilaiden prosenttiosuus ylläpitovaiheen aikaisen kohtausvasteen mukaan luokiteltuina. Vasteen kriteerit tiukentuvat kategoriasta toiseen siirryttäessä.
Kuva 1: Kohtausten prosentuaalinen väheneminen lähtötasoon nähden; kumulatiivinen jakauma hoitoryhmittäin tutkimuksen 12 viikon kiinteän annoksen jakson aikana
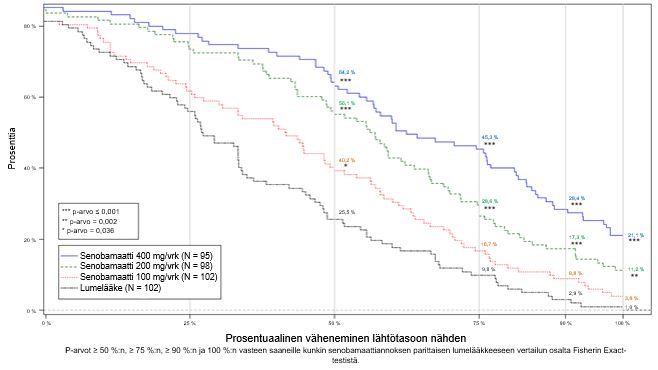
Tutkimuksessa kohtauksettomuuden (kohtausten väheneminen 100 %:lla) saavutti neljä potilasta 102:sta (3,9 %) senobamaattia 100 mg/vrk saaneessa ryhmässä, 11 potilasta 98:sta (11,2 %) senobamaattia 200 mg/vrk saaneessa ryhmässä, 20 potilasta 95:stä (21,1 %) senobamaattia 400 mg/vrk saaneessa ryhmässä ja yksi potilas 102:sta (1 %) lumelääkettä saaneessa ryhmässä 12 viikon kiinteän annoksen vaiheen aikana. Samankaltaisia vasteita havaittiin alaryhmissä, joissa kohtausten esiintymistiheys oli mediaania suurempaa tai pienempää ja sairauden kesto mediaania pidempi tai lyhempi.
Pitkäkestoinen avoin tutkimus
Suurin osa tutkittavista päätti osallistua avoimeen jatkotutkimukseen tutkimuksen 1 jälkeen (98,9 %). 80 % tutkittavista pysyi tutkimuksessa vähintään 12 kuukautta ja 58 % vähintään 60 kuukautta. Kohtausten esiintymistiheydestä kerättiin lisätietoja, ja ne olivat yhdenmukaisia tutkimuksen kaksoissokkoutetun osan tulosten kanssa.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Ontozry‑valmisteen käytöstä epilepsian hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Senobamaatti imeytyy hyvin (vähintään 88‑prosenttisesti virtsanäytteiden perusteella) suun kautta otettuna. Tmax‑ajan mediaanin vaihteluväli on 1–4 tuntia kerta‑annoksen tai useiden annosten annon jälkeen paasto‑olosuhteissa annosalueella 10–400 mg.
Samanaikainen anto rasvapitoisen aterian (800–1 000 kcal, jossa rasvaa oli 50 %) kanssa ei vaikuttanut merkittävästi senobamaatin imeytymisnopeuteen ja imeytymisen laajuuteen.
Suun kautta tai nenä-mahaletkun kautta annettujen murskattujen, ja veteen sekoitettujen senobamaattitablettien aiheuttama altistus plasmassa vastaa kokonaisten tablettien aiheuttamaa altistusta (AUC- ja Cmax-arvojen luottamusvälit välillä 80–125 %). Murskattujen tablettien Tmax-ajan mediaani on 0,5 tuntia.
Jakautuminen
Senobamaatin näennäinen jakautumistilavuus (Vd/F) suun kautta annon jälkeen on noin 40–50 l. Senobamaatti sitoutuu plasman proteiineihin 60‑prosenttisesti ja pitoisuudesta riippumattomasti in vitro. Senobamaatti sitoutuu pääasiassa ihmisen albumiiniproteiiniin.
Biotransformaatio
Senobamaatti metaboloituu laajasti. Ensisijainen metabolinen reitti on UGT2B7:n kautta tapahtuva glukuronidaatio ja vähäisemmässä määrin UGT2B4:n kautta tapahtuva glukuronidaatio. Vähäisempiä senobamaatin metabolian reittejä ovat CYP2E1‑, CYP2A6‑, CYP2B6‑ ja vähäisemmässä määrin CYP2C19‑ ja CYP3A4/5‑entsyymien kautta tapahtuva oksidaatio.
Eliminaatio
Senobamaatti ja sen metaboliitit eliminoituvat pääasiassa virtsan kautta. Ulosteiden kautta erittyminen vastasi vain 5,2 %:ia annoksesta. Yli 50 % annoksesta erittyi 72 tunnin kuluessa. Senobamaatin näennäinen puoliintumisaika plasmassa oli 50–60 tuntia terapeuttisella alueella 100–400 mg/vrk. Vakaa tila saavutetaan 14 vuorokauteen mennessä.
Lineaarisuus/ei‑lineaarisuus
Senobamaatin Cmax‑pitoisuus lisääntyi suhteessa suun kautta otettujen 5–750 mg:n kerta‑annosten ja suun kautta otettujen toistuvien 50–500 mg:n vuorokausiannosten suurenemiseen. Vakaan tilan altistukset (Cmax ja AUC) lisääntyivät suhteessa annosten suurenemiseen terapeuttisella alueella (100‑400 mg), mutta alle 100 mg/vrk:n annokset saattavat poistua elimistöstä nopeammin.
Erityiset potilasryhmät
Munuaisten vajaatoiminta
Plasman senobamaattipitoisuuden AUC‑arvo oli 1,4–1,5‑kertainen terveisiin verrokkeihin verrattuna lievää munuaisten vajaatoimintaa (CLcr 60 – < 90 ml/min) ja kohtalaista munuaisten vajaatoimintaa (CLcr 30 – < 60 ml/min) sairastavilla tutkittavilla, jotka saivat senobamaattia 200 mg:n kerta‑annoksen suun kautta. Vaikeaa munuaisten vajaatoimintaa (CLcr < 30 ml/min) sairastavilla tutkittavilla plasman senobamaattipitoisuuden AUC‑arvo ei ollut merkitsevästi muuttunut terveisiin verrokkeihin verrattuna senobamaatin suun kautta annetun 100 mg:n kerta‑annoksen jälkeen (ks. kohta Annostus ja antotapa). Hemodialyysin vaikutusta senobamaatin farmakokinetiikkaan ei ole tutkittu.
Maksan vajaatoiminta
Plasman senobamaattipitoisuuden AUC‑arvo oli 1,9‑kertainen lievää munuaisten vajaatoimintaa sairastavilla tutkittavilla ja 2,3‑kertainen kohtalaista munuaisten vajaatoiminta sairastavilla tutkittavilla senobamaatin suun kautta annetun 200 mg:n kerta‑annoksen jälkeen terveisiin verrokkeihin verrattuna (ks. kohta Annostus ja antotapa). Vaikean maksan vajaatoiminnan vaikutusta senobamaatin farmakokinetiikkaan ei ole tutkittu.
Sukupuoli
Senobamaatin farmakokinetiikassa ei havaittu eroa mies‑ ja naispotilaiden välillä.
Etninen tausta
Etnisellä taustalla ei havaittu olevan kliinisesti merkittävää vaikutusta senobamaatin farmakokinetiikkaan populaatiofarmakokineettisessä analyysissä. Analyysi tehtiin kliinisistä tutkimuksista saaduilla yhdistetyillä tiedoilla, jotka olivat peräisin tutkittavilta, jotka oli luokiteltu aasialaisiksi, mustiksi, valkoihoisiksi, latinalaisamerikkalaisiksi tai muiksi.
Kehonpaino
Altistuksen on arvioitu vähenevän 45 %:lla painoalueella 54–112 kg. Tämän vaihtelun ei katsota olevan kliinisesti merkityksellistä senobamaatin annosta määritettäessä. Senobamaatin annoksen muuttamista voidaan kuitenkin joutua harkitsemaan potilaille, joiden kehonpaino muuttuu vähintään 30 % alkupainosta.
Iäkkäät potilaat (vähintään 65‑vuotiaat)
Senobamaatin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja iän perusteella 18–77‑vuotiailta tutkittavilta saatujen tietojen perusteella.
Pediatriset potilaat
Ontozry‑valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten potilaiden hoidossa ei ole varmistettu.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Karsinogeenisuustutkimuksessa rotilla saavutettu suurin systeeminen altistus oli kuitenkin pienempi kuin ihmisten altistus käytettäessä suurinta ihmisille suositeltua annosta 400 mg/vrk.
Toistuvan altistuksen aiheuttama toksisuus
Enimmäisannoksia toistuvien annosten toksisuustutkimuksissa rajoittivat senobamaatin korostuneet keskushermostovaikutukset (mukaan lukien hypoaktiivisuus, koordinoimaton kävely, hypotermia ja vapina). Systeeminen altistus haittavaikutuksettomalla pitoisuudella (no observed adverse effect levels, NOAEL) oli samankaltainen tai pienempi kuin mikä saavutetaan ihmisillä käytettäessä suurinta ihmisille suositeltua annosta.
Lisääntymis‑ ja kehitystoksisuus
Lisääntymistoksisuustutkimuksissa kerran päivässä suun kautta annosteltuna todettiin alkion ja sikiön kehitykseen sekä syntymänjälkeiseen kehitykseen kohdistuvia haittavaikutuksia. Hedelmällisyyteen kohdistuvia haittavaikutuksia ei todettu erillisessä tutkimuksessa rotilla. Systeemiset altistukset vastaavilla haittavaikutuksettomilla pitoisuuksilla (NOAEL) hedelmällisyyttä, alkion ja sikiön sekä syntymänjälkeistä kehitystä koskevissa tutkimuksissa olivat kuitenkin ihmisen altistusta pienempiä käytettäessä suurinta ihmisille suositeltua annosta.
Teratogeenisia vaikutuksia ei ilmennyt, kun senobamaattia annettiin organogeneesin aikana suun kautta kahdesti päivässä naaraspuolisille rotille ja kerran päivässä naaraspuolisille kaneille. Senobamaatin antaminen tiineille kaneille johti kuitenkin lisääntyneeseen alkio‑ ja sikiökuolleisuuteen annostasolla, joka on toksinen emolle. Systeeminen altistus vastaavilla vaikutuksettomilla pitoisuuksilla (NOEL) oli ihmisen altistusta pienempi käytettäessä suurinta ihmisille suositeltua annosta.
Kun senobamaattia annettiin naaraspuolisille rotille tiineyden ja imetyksen aikana, jälkeläisillä havaittiin neurobehavioraalista heikentymistä (voimistunut kuulonvarainen säpsähdysreaktio) kaikilla annoksilla. Tämän lisäksi jälkikasvulla havaittiin vieroitusta edeltävän ruumiinpainon nousun vähenemistä ja haittavaikutuksia naaraiden lisääntymistoiminnoissa (pienentynyttä keltarauhasten, implantaatioiden ja elävien sikiöiden määrää).
Senobamaatin siirtyminen istukan ja maidon kautta varmistui senobamaatin esiintymisellä sekä tiineiden rottien lapsivedessä että sikiöveressä ja imettävien rottien maidossa.
Ympäristöön kohdistuvien riskien arviointi osoitti, että senobamaatti on erittäin pysyvä (vP) aine vesistöissä (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Tabletin ja kalvopäällysteisen tabletin sisältö
Laktoosimonohydraatti, magnesiumstearaatti (E470b), mikrokiteinen selluloosa (E460), kolloidinen vedetön piidioksidi (E551), natriumtärkkelysglykolaatti.
Kalvopäällyste
25 mg:n ja 100 mg:n kalvopäällysteiset tabletit
Indigokarmiinialumiinilakka (E132), punainen rautaoksidi (E172), keltainen rautaoksidi (E172), makrogoli, osittain hydrolysoitu poly(vinyylialkoholi) (E1203), talkki (E553b), titaanidioksidi (E171).
50 mg:n kalvopäällysteiset tabletit
Keltainen rautaoksidi (E172), makrogoli, osittain hydrolysoitu poly(vinyylialkoholi) (E1203), talkki (E553b), titaanidioksidi (E171).
150 mg:n ja 200 mg:n kalvopäällysteiset tabletit
Punainen rautaoksidi (E172), keltainen rautaoksidi (E172), makrogoli, osittain hydrolysoitu poly(vinyylialkoholi) (E1203), talkki (E553b), titaanidioksidi (E171).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ONTOZRY tabletti, kalvopäällysteinen
50 mg (L:kyllä) 14 fol (80,68 €), 28 fol (87,94 €)
100 mg (L:kyllä) 14 fol (82,41 €), 28 fol (128,66 €)
150 mg (L:kyllä) 14 fol (86,71 €), 28 fol (165,96 €)
200 mg (L:kyllä) 14 fol (90,91 €), 28 fol (169,39 €)
ONTOZRY tabletti, kalvopäällysteinen + tabletti
25 mg+12,5 mg (L:kyllä) 14+14 fol (14x25 mg+14x12,5 mg) (147,16 €)
PF-selosteen tieto
PVC/alumiini-läpipainopakkaukset
Ontozry-hoidon aloituspakkaus – 12,5 mg tabletit ja 25 mg kalvopäällysteiset tabletit
Pakkauksessa on 14 kpl 25 mg:n tabletteja ja 14 kpl 25 mg:n kalvopäällysteisiä tabletteja.
Ontozry 50 mg kalvopäällysteiset tabletit
50 mg – 14, 28 tai 84 kpl:n pakkaukset
Ontozry 100 mg kalvopäällysteiset tabletit
100 mg – 14, 28 tai 84 kpl:n pakkaukset
Ontozry 150 mg kalvopäällysteiset tabletit
150 mg – 14, 28 tai 84 kpl:n pakkaukset
Ontozry 200 mg kalvopäällysteiset tabletit
200 mg – 14, 28 tai 84 kpl:n pakkaukset
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Ontozry 12,5 mg tabletti
Päällystämätön pyöreä valkoinen tai luonnonvalkoinen tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”12”.
Ontozry 25 mg kalvopäällysteinen tabletti
Kalvopäällysteinen pyöreä ruskea tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”25”.
Ontozry 50 mg kalvopäällysteinen tabletti
Kalvopäällysteinen pyöreä keltainen tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”50”.
Ontozry 100 mg kalvopäällysteinen tabletti
Kalvopäällysteinen pyöreä ruskea tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”100”.
Ontozry 150 mg kalvopäällysteinen tabletti
Kalvopäällysteinen vaaleanoranssi pyöreä tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”150”.
Ontozry 200 mg kalvopäällysteinen tabletti
Kalvopäällysteinen soikea vaaleanoranssi tabletti, jonka toisella puolella on merkintä ”AV” ja toisella puolella merkintä ”200”.
Käyttö- ja käsittelyohjeet
Senobamaatti on erittäin pysyvä (vP) aine vesistöissä. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Murskattu tabletti voidaan antaa nenä-mahaletkun kautta. Tällöin tabletti tulee murskata jauheeksi ja sekoittaa veteen (25 ml).
Katso yksityiskohtaiset ohjeet antamisesta nenä-mahaletkun kautta kohdasta Annostus ja antotapa.
Korvattavuus
ONTOZRY tabletti, kalvopäällysteinen
50 mg 14 fol, 28 fol
100 mg 14 fol, 28 fol
150 mg 14 fol, 28 fol
200 mg 14 fol, 28 fol
ONTOZRY tabletti, kalvopäällysteinen + tabletti
25 mg+12,5 mg 14+14 fol
- Ylempi erityiskorvaus (100 %). Senobamaatti: Aikuisten paikallisalkuisen epilepsian hoito lisälääkkeenä erityisin edellytyksin (1541).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Senobamaatti: Aikuisten paikallisalkuisen epilepsian hoito lisälääkkeenä erityisin edellytyksin (3069).
- Epilepsian hoidossa lääkevaihto vain saman kauppanimen valmisteeseen.
ATC-koodi
N03AX25
Valmisteyhteenvedon muuttamispäivämäärä
18.09.2025
Yhteystiedot
Birger Jarlsgatan 6D
114 34 Stockholm
Sweden
nordic.medinfo@angelinipharma.com
