VIZAMYL injektioneste, liuos 400 MBq/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml injektionestettä, liuosta, sisältää referenssiajankohtana 400 MBq flutemetamolia (18F).
Aktiivisuus voi referenssiajankohtana vaihdella injektiopullokohtaisesti välillä 400–4 000 MBq tai 400–6 000 MBq.
Fluori (18F) hajoaa vakaaksi hapeksi (18O), jonka puoliintumisaika on noin 110 minuuttia, lähettämällä 634 keV:n positronisäteilyä, mitä seuraa 511 keV:n fotoniannihilaatiosäteily.
Apuaineet, joiden vaikutus tunnetaan
Yksi ml liuosta sisältää 55,2 mg etanolia ja 4,1 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Tämä lääkevalmiste on tarkoitettu vain diagnostiseen käyttöön.
VIZAMYL on radiofarmaseuttinen lääkevalmiste, joka on tarkoitettu aivojen neuriittisten beeta‑amyloidiplakkien tiheyden kuvantamiseen positroniemissiotomografialla (PET). Kuvauksia voidaan tehdä aikuispotilaille, joilla on kognitiivista heikentymistä ja joita arvioidaan Alzheimerin taudin ja kognitiivisen heikentymisen muiden syiden tutkimiseksi. VIZAMYL‑valmistetta on käytettävä yhdessä kliinisen arvion kanssa.
Negatiivinen kuvantamistulos osoittaa, että plakkeja on harvassa tai ei lainkaan, mikä ei sovi Alzheimerin taudin diagnoosiin. Positiivisen kuvantamistuloksen tulkinnan rajoitukset: ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Ehto
Valmisteen avulla tehtävän tutkimuksen voivat määrätä lääkärit, joilla on kokemusta neurodegeneratiivisten sairauksien kliinisestä hoitamisesta.
Annostus ja antotapa
Flutemetamolin (18F) avulla tehtävän PET‑tutkimuksen voivat määrätä lääkärit, joilla on kokemusta neurodegeneratiivisten sairauksien kliinisestä hoitamisesta.
VIZAMYL‑kuvia saavat tulkita vain lääkärit, jotka ovat saaneet koulutuksen flutemetamolin (18F) avulla otettujen PET‑kuvien tulkintaan. Jos harmaan aineen sijainti ja harmaan ja valkean aineen rajan sijainti ovat PET‑kuvauksessa epävarmat, potilaalle äskettäin samaan aikaan tehty tietokonetomografiakuvaus (TT‑kuvaus) tai magneettikuvaus suositellaan yhdistämään PET‑kuvaukseen, jotta saadaan yhdistetty PET‑TT‑ tai yhdistetty PET‑magneettikuvaus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. VIZAMYL‑kuvien tulkitseminen).
Annostus
Aikuiset
Aikuisille suositeltu aktiivisuus on 185 MBq flutemetamolia (18F) laskimoon (boluksena noin 40 sekunnin kuluessa). Injektion tilavuuden on oltava vähintään 1 ml ja enintään 10 ml.
Erityisryhmät
Lääkevalmisteen käytöstä normaaleille potilasryhmille ja erityispotilasryhmille ei ole tehty laajoja annosaluetta ja annoksen muuttamista koskevia tutkimuksia.
Iäkkäät potilaat
Iän perusteella tehtäviä annosmuutoksia ei suositella.
Munuaisten ja maksan vajaatoiminta
VIZAMYL‑valmistetta ei ole tutkittu potilailla, joilla on ollut merkittävää munuaisten tai maksan vajaatoimintaa. Annettavan aktiivisuuden määrä on harkittava tarkoin, koska säteilyaltistus voi näillä potilailla olla suurentunut (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Flutemetamolin (18F) farmakokinetiikkaa munuaisten tai maksan vajaatoimintaa sairastavilla potilailla ei ole tutkittu.
Pediatriset potilaat
Ei ole asianmukaista käyttää VIZAMYL‑valmistetta pediatristen potilaiden diagnostiikassa.
Antotapa
VIZAMYL on tarkoitettu annettavaksi laskimoon.
Flutemetamolin (18F) aktiivisuus on mitattava annoskalibraattorilla juuri ennen injektion antamista.
VIZAMYL‑valmisteen injisointi lyhyen (noin 12,5 cm:n pituisen tai lyhyemmän) laskimokanyylin kautta vähentää vaaraa, että vaikuttavaa ainetta adsorboituu kanyyliin.
VIZAMYL on tarkoitettu moniannoskäyttöön. Sitä ei saa laimentaa.
Annos annetaan noin 40 sekunnin kestoisena bolusinjektiona laskimoon. Jos käytetään laskimoletkua, laskimoyhteys huuhdellaan injektion jälkeen 5–15 ml:lla steriiliä 0,9-prosenttista (9 mg/ml) natriumkloridiliuosta, millä varmistetaan, että potilas saa koko annoksen.
Flutemetamoli‑injektio (18F) on annettava laskimoon, jotta vältetään paikallisesta ekstravasaatiosta aiheutuva säteily sekä kuvantamisartefaktit.
Kuvantaminen
VIZAMYL‑kuvat on otettava 90 minuutin kuluttua injektion annosta PET‑kuvauslaitteella, joka on 3D‑moodissa, ja josta saatuihin tietoihin on tehty asianmukaiset korjaukset. Aseta potilas selinmakuulle pää asetettuna siten, että potilaan aivot (myös pikkuaivot) ovat yhden kuvakentän sisällä. Potilaan päätä on kallistettava siten, että isoaivojen etu‑ ja takaliittimen (ACPC) taso on kohtisuorassa PET‑kuvauslaitteen kuvaustunnelin akseliin nähden. Pää on asetettava sopivaan päätukeen. Pään liikkeitä voidaan vähentää tarranauhoilla tai muilla joustavilla päätuilla.
Rekonstruktiossa on suositeltavaa käyttää iteratiivista tai suodatettua takaisinprojisointimenetelmää sekä 2–4 mm:n leikepaksuutta, aksiaalista matriisikokoa 128 x 128 ja noin 2 mm:n pikselikokoa. Silloin kun pehmennyksen jälkeiseen suodatukseen voidaan käyttää puoliarvoleveyttä (FWHM) enintään 5 mm, suodattimen FWHM on valittava siten, että saadaan optimaalinen signaali‑kohinasuhde samalla, kun rekonstruoidun kuvan terävyys säilyy. Kuvaus kestää yleensä 20 minuuttia.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Yliherkkyysreaktioiden tai anafylaktisten reaktioiden mahdollisuus
Jos yliherkkyysreaktioita tai anafylaktisia reaktioita ilmenee, lääkevalmisteen anto on keskeytettävä välittömästi ja laskimoon annettava hoito on aloitettava tarvittaessa. Jotta voidaan ryhtyä välittömiin toimiin hätätilanteissa, tarvittavien lääkevalmisteiden ja hoitovälineiden, kuten intubaatioputken ja ventilaattorin, on olla saatavilla käyttövalmiina.
Yksilöllinen hyöty–riskiarvio
Kunkin potilaan säteilyaltistus on perusteltava todennäköisellä hyödyllä. Annettavan aktiivisuuden on oltava aina niin vähäistä kuin kohtuullisesti on mahdollista tarvittavien diagnostisten tietojen saamiseksi.
Munuaisten ja maksan vajaatoiminta
Tämän potilasryhmän potilaiden hyöty–riskisuhde on arvioitava tarkoin, sillä säteilyaltistus saattaa olla tavanomaista suurempi. Flutemetamoli (18F) erittyy suuressa määrin maksan ja sapen kautta, joten maksan vajaatoimintaa sairastavien potilaiden säteilyaltistus saattaa olla tavanomaista suurempi. Ks. kohta Annostus ja antotapa.
Pediatriset potilaat
Tietoa valmisteen käytöstä pediatrisille potilaille, ks. kohdat Annostus ja antotapa ja Farmakodynamiikka.
VIZAMYL‑kuvien tulkinta
VIZAMYL‑kuvia saavat tulkita vain lääkärit, jotka ovat saaneet koulutuksen flutemetamolin (18F) avulla otettujen PET‑kuvien tulkintaan. Negatiivisessa kuvaustuloksessa korteksissa ei havaita lainkaan neuriittisia beeta‑amyloidiplakkeja tai niitä on harvassa. Positiivisessa kuvaustuloksessa plakkeja näkyy tiheästi tai melko tiheästi. Aivojen neuriittisten beeta‑amyloidiplakkien tiheyden arvioinnissa on havaittu kuvan tulkintavirheitä, mukaan lukien virheellisiä negatiivisia ja virheellisiä positiivisia tulkintoja kuvista.
PET‑kuvat pitää tulkita Sokoloffin, Rainbow‑ tai Spectrum‑väriasteikon avulla. Kuvia tulkitsevan lääkärin pitää verrata korteksin harmaan aineen signaalinvoimakkuutta valkean aineen suurimpaan signaalinvoimakkuuteen. Kuvia pitää tarkastella systemaattisesti (kuva 1) aloittamalla aivosillan tasolta (p) ja vierittämällä kuvaa ylöspäin seuraaviin:
- otsalohkot ja etupihtipoimu (f, ac, aksiaalileike)
- takapihtipoimu ja etukiila (pc, sagittaalileike)
- ohimo–päälakilohkot, mukaan lukien insula (in, aksiaalileike sekä tp-in, koronaalileike)
- ohimolohkot lateraalisuunnasta (lt, aksiaalileike)
- aivojuovioalue (s, aksiaalileike).
Kuvat tulkitaan visuaalisesti vertaamalla kortikaalisen harmaan aineen aktiivisuutta viereisen kortikaalisen valkean aineen aktiivisuuteen.
- Alueen katsotaan sisältävän negatiivisen (normaalin) kuvion, jos merkkiainesignaali korteksin alueella on heikko (ts. selvästi heikompi signaalin intensiteetti verrattuna viereiseen valkeaan aineeseen, ja intensiteetti samanlainen kuin pikkuaivojen runsaasti harmaata ainetta sisältävillä alueilla). Signaali ei puutu täysin kuvien harmaan aineen alueelta, koska viereisiin alueisiin sitoutunut valkea aine vuotaa harmaan aineen alueille PET:n osittaisten tilavuusresoluutiovaikutusten takia.
- Alue katsotaan positiiviseksi (poikkeavaksi), jos merkkiainesignaali korteksin alueella vaikuttaa voimakkaalta (ts. noin sama tai voimakkaampi signaalin intensiteetti kuin viereisessä valkeassa aineessa ja voimakkaampi kuin pikkuaivojen runsaasti harmaata ainetta sisältävillä alueilla).
- Jos jokin näistä alueista on selvästi positiivinen (poikkeava), kuva on luokiteltava positiiviseksi (poikkeavaksi). Muuten se on luokiteltava negatiiviseksi (normaaliksi).
Monilla aivojen alueilla voi esiintyä atrofiaa, minkä vuoksi kuvan tulkinta voi olla vaikeampaa, koska harmaan aineen häviäminen vähentää merkkiaineen kertymistä, jolloin positiivinen kuvaustulos on vaikeampi tunnistaa. VIZAMYL‑kuvan tulkinnassa on erittäin suositeltavaa käyttää apuna magneettikuvaus‑ tai tietokonetomografiakuvia, jos tällaiset kuvat on saatavilla, etenkin jos epäillään atrofiaa.
Kuva 1
Esimerkkejä VIZAMYL PET ‑tapauksista, joissa flutemetamolilla (18F) tehdyn PET‑kuvauksen tulos on negatiivinen (vasen) ja positiivinen (oikea). Kuvassa esitetään aksiaalileike (ensimmäinen rivi), sagittaalileike (toinen rivi) ja koronaalileike (kolmas rivi).
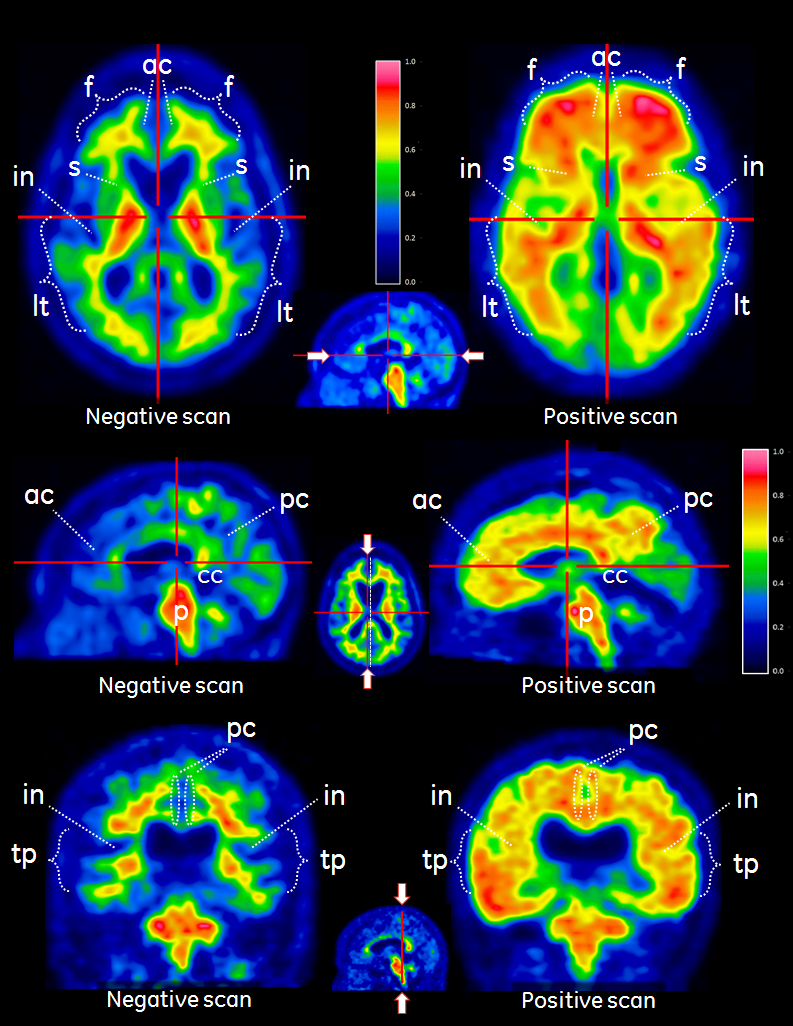
Kuva 1. Aksiaalinen (a), sagittaalinen (b) ja koronaalinen (c) leike negatiivisesta (vasemmalla) ja positiivisesta (oikealla) flutemetamoli (18F)‑kuvantamistuloksesta. Negatiivisissa kuvissa on näkyvissä aivouurteen/aivopoimun valkea aine. Oikeanpuoleisessa positiivisessa kuvantamistuloksessa aivouurre ja aivopoimu eivät ole erotettavissa. Huomioi, että intensiteetti on positiivisten kuvien harmaan aineen alueilla suurempi (> 60 % maksimista) verrattuna negatiivisiin kuviin ja että intensiteetti säteilee lateraalileikkeessä tarkkarajaiseen kuperaan rajapintaan. Negatiivisissa kuvissa intensiteetti vähenee kudoksen reuna‑aluetta kohden. Huomioi myös mediaaliset alueet, joilla oikeanpuoleisissa positiivisissa kuvissa on harmaan aineen alueilla nähtävissä voimakas intensiteetti. Selitykset: harmaa aine – f otsalohko ja ac etupihtipoimu, pc takapihtipoimu ja etukiila, lt ohimolohko lateraalisuunnasta, tp ohimo‑päälakilohkot ja in insula sekä s aivojuovio; valkea aine – p aivosilta ja cc aivokurkiainen.
Korteksin radioaktiivisen signaalin voimakkuutta voidaan arvioida kvantitatiivisesti käyttämällä validoitua ja CE‑merkittyä tietokoneohjelmistoa. Täten kvantitatiivista tietoa voidaan käyttää apuna arvioitaessa radioaktiivisten signaalien jakautumista visuaalisesti. Tällainen ohjelmisto laskee aivojen amyloiditaakan jakamalla niiden korteksin alueen kuvien, joihin liittyy amyloidikertymiä (lisääntyneet Alzheimerin tautia sairastavilla), keskimääräisen intensiteetin jonkin referenssialueen, kuten aivosillan, kuvien keskimääräisellä intensiteetillä. Lukemaa kutsutaan vakioitujen kertymäarvojen suhteeksi eli SUVR:ksi. Flutemetamolin (18F) kuvantamistulosten dikotomiset visuaaliset tulkinnat validoitiin harvassa olevien ja melko tiheästi esiintyvien neuriittisten plakkien tiheyksien rajan suhteen. On selvitetty, että CE‑merkitystä ohjelmistosta saatu SUVR‑kynnysarvo 0,59–0,61, kun aivosiltaa on käytetty referenssinä, on ollut erittäin yhdenmukainen visuaalisten tulkintojen kanssa (ks. kohta Farmakodynamiikka), ja sitä voidaan käyttää visuaalisen tulkinnan tukena.
Käyttäjien pitää saada valmistajalta koulutus CE‑merkityn ohjelmiston käyttöön, ja heidän pitää olla suorittanut koulutus Vizamyl‑kuvien visuaaliseen tulkintaan.
Jos visuaalisen tulkinnan ja kvantitaatiotuloksen välillä on ristiriitaa, seuraavat kohdat on käytävä läpi tarkasti lopullisen arvion saavuttamiseksi.
Arvioijien on tulkittava kuvat visuaalisesti ja suorittaa sitten kvantitaatioanalyysi valmistajan ohjeiden mukaisesti mm. kvantitaatioprosessin laaduntarkistuksia käyttäen. Kvantitatiivisia tuloksia verrataan visuaaliseen tulkintaan huomioiden negatiivisten ja positiivisten kuvien oletetut vaihteluvälit. Jos kvantitatiiviset arvot ovat ristiriidassa visuaalisen tulkinnan kanssa, arvioitsijan on:
- Tarkistettava mielenkiintoalueiden (region of interest, ROI) asemointi aivokuvassa. Alueet asemoidaan aivojen harmaan aineen alueille siten, että mielenkiintoalue ei kata aivo-selkäydinnestettä tai merkittäviä alueita valkeasta aineesta.
- Tarkistettava, että referenssialueen mielenkiintoalue(et) on hyvin asemoitu alueelle. Tutki seuraavaksi, löytyykö referenssialueelta rakenteellisia poikkeamia tai alueita, joilla perfuusio on vähentynyt.
- Tarkempaa tietoa visuaalisten ja kvantitatiivisten tulosten ristiriitaisuudesta
i) Jos visuaalinen arviointi on amyloidin suhteen positiivinen ja kvantitaatiotulos negatiivinen tai rajatapaus, pitää visuaalisesti positiivisen tuloksen antavia alueita verrata vastaavaan mielenkiintoalueeseen. Jos merkkiaineen kertyminen on hyvin paikallista, saattaa olla, että mielenkiintoalue kattaa laajemman alueen ja mielenkiintoalueen keskiarvo antaa negatiivisen tuloksen. Visuaalisessa tulkinnassa on saatettu lisäksi välttää atrofia-alueita, kun taas kvantitatiiviset tulokset saattavat pitää sisällään näitä alueita.
ii) Jos visuaalinen arviointi on amyloidin suhteen negatiivinen ja kvantitaatiotulos positiivinen, referenssialue on tarkistettava, ja jos on ilmeistä epäillä mielenkiintoalueen asemoinnin tarkkuutta tai vähentynyttä kertymistä, on käytettävä vaihtoehtoista aluetta (ohjelmisto antaa käyttää useita eri referenssialueita). Lisäksi korteksin mielenkiintoalueiden asemointi on tarkistettava, jotta voidaan määrittää, onko näytealueella valkeaa ainetta. Tämä voi suurentaa kvantitaatioarvoja.
4. PET‑kuvan lopullisen tulkinnan on perustuttava visuaaliseen arviointiin, jonka tekemisessä on käytetty apuna kohtia 1–3.
Käytön rajoitukset
Positiivinen kuvantamistulos ei yksinään riitä Alzheimerin taudin tai muun kognitiivisen häiriön toteamiseen, koska neuriittisten plakkien kertymistä harmaaseen aineeseen voi esiintyä sekä oireettomilla iäkkäillä potilailla että tiettyjen neurodegeneratiivisten dementioiden yhteydessä (Alzheimerin tauti, Lewyn kappale ‑dementia ja Parkinsonin tautiin liittyvä dementia).
Käytön rajoitukset, jos potilaalla on lievää kognitiivista heikentymistä, ks. kohta Farmakodynamiikka.
Flutemetamolin (18F) tehoa Alzheimerin taudin kehittymisen ennustamisessa tai hoitovasteen seurannassa ei ole varmistettu (ks. kohta Farmakodynamiikka).
Joidenkin kuvien tulkinta voi olla vaikeaa kuvakohinan, atrofian ja ohentuneen aivokuorinauhan tai kuvan epätarkkuuden vuoksi, mikä voi aiheuttaa tulkintavirheitä. Jos harmaan aineen sijainnista ja harmaan/valkean aineen rajan sijainnista ei PET‑kuvauksessa ole varmuutta ja saatavilla on samaan aikaan äskettäin otettu tietokonetomografia- tai magneettikuva, kuvaa tulkitsevan lääkärin on tutkittava yhdistetty PET‑TT‑ tai PET‑magneettikuva PET‑radioaktiivisuuden ja harmaan aineen anatomian välisen suhteen selvittämiseksi.
Toimenpiteen jälkeen
Lähikontaktia imeväisten ja raskaana olevien naisten kanssa on rajoitettava 24 tunnin ajan injektion jälkeen.
Erityiset varoitukset
Tämä lääkevalmiste sisältää (7 til‑%) etanolia (alkoholia), ts. enimmillään 552 mg (noin 0,7 ml) per annos. Tämä määrä voi olla haitallinen alkoholismia sairastaville. Tämä on otettava huomioon raskaana olevilla ja imettävillä naisilla ja suuren riskin ryhmissä, kuten potilailla, joilla on maksasairaus tai epilepsia.
Tämä lääkevalmiste sisältää natriumia enintään 41 mg (tai 1,8 mmol) per annos. Tämä vastaa 2 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle. Potilaat, joilla on ruokavalion natriumrajoitus, voivat joutua huomioimaan tämän.
Ympäristöriskiä koskevat varotoimet, ks. kohta Käyttö- ja käsittelyohjeet.
Yhteisvaikutukset
Farmakodynaamisia lääkkeiden yhteisvaikutustutkimuksia ei ole tehty sen selvittämiseksi, missä määrin samanaikaisesti käytettävät muut lääkevalmisteet saattavat muuttaa VIZAMYL‑valmisteen kuvantamistuloksia.
In vivo ‑yhteisvaikutustutkimuksia ei ole tehty.
In vitro ‑sitoutumistutkimuksissa ei ole todettu, että Alzheimerin tautia sairastavien potilaiden yleisesti käyttämät muut lääkevalmisteet häiritsisivät flutemetamolin (18F) sitoutumista beeta‑amyloidiplakkeihin.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Kun radiofarmaseuttista valmistetta on tarkoitus antaa naiselle, joka voi tulla raskaaksi, on tärkeää selvittää, onko nainen raskaana. Kuukautisten jäädessä väliin on aina oletettava, että nainen on raskaana, kunnes osoitetaan toisin. Jos raskauden mahdollisuus on epäselvä (kuukautiset jääneet väliin, hyvin epäsäännöllinen kuukautiskierto jne.), potilaan kohdalla on käytettävä sellaisia muita vaihtoehtoisia menetelmiä, joihin ei liity ionisoivaa säteilyä (jos sellaisia on saatavilla).
Raskaus
Raskaana oleville naisille ei ole tehty tutkimuksia. Flutemetamolin (18F) vaikutusta lisääntymiseen ei ole tutkittu eläinkokeissa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Raskaana oleville naisille tehdyissä radionukliditoimenpiteissä myös sikiö altistuu säteilylle. Siksi raskausaikana saa tehdä vain täysin välttämättömiä tutkimuksia, joiden mahdollinen hyöty katsotaan selvästi äitiin ja sikiöön kohdistuvia riskejä suuremmaksi.
Imetys
Ei tiedetä, erittyykö flutemetamoli (18F) ihmisen rintamaitoon imetyksen aikana. Ennen radiofarmaseuttisen valmisteen antamista imettävälle äidille on pohdittava, voidaanko radionuklidin antoa lykätä imetyksen päättymiseen saakka tai mikä radiofarmaseuttinen valmiste on sopivin, kun radioaktiivisuuden erittyminen rintamaitoon otetaan huomioon. Jos valmisteen antaminen katsotaan tarpeelliseksi, imetys on keskeytettävä 24 tunniksi ja sinä aikana tuotettu maito on hävitettävä.
Lähikontaktia imeväisten kanssa on rajoitettava 24 tunnin ajan injektion jälkeen.
Hedelmällisyys
Hedelmällisyyttä koskevia tutkimuksia ei ole tehty.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
VIZAMYL‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
VIZAMYL voi kuitenkin aiheuttaa ohimenevää huimausta ja kiertohuimausta. Sen vuoksi VIZAMYL‑valmisteen antamisen jälkeen potilaiden ei ole suositeltavaa ajaa, käyttää monimutkaisia koneita tai ryhtyä muihin mahdollisesti vaarallisiin toimiin, kunnes tällaiset vaikutukset ovat kokonaan hävinneet.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
VIZAMYL‑valmisteen yleinen turvallisuusprofiili perustuu tietoihin valmisteen antamisesta 831 tutkittavalle.
Haittavaikutustaulukko
Haittavaikutusten esiintymistiheydet ovat seuraavat:
Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Seuraavat haittavaikutukset on lueteltu jäljempänä taulukossa 1:
Taulukko 1 Luettelo haittavaikutuksista
| Elinjärjestelmä | Yleinen | Melko harvinainen |
| Immuunijärjestelmä | Anafylaktoidinen reaktio | |
| Psyykkiset häiriöt | Ahdistuneisuus | |
| Hermosto | Heitehuimaus Päänsärky Hypestesia Hypotonia Makuhäiriö Vapina | |
| Silmät | Silmien turpoaminen | |
| Kuulo ja tasapainoelin | Kiertohuimaus | |
| Sydän | Sydämentykytys | |
| Verisuonisto | Punoitus | Kalpeus |
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus Hyperventilaatio Kurkun ärsytys | |
| Ruoansulatuselimistö | Pahoinvointi Oksentelu Ruoansulatusvaivat Epämukava tunne vatsassa Epämukava tunne suussa | |
| Iho ja ihonalainen kudos | Kasvojen hypestesia Kutina Ihottuma Ihon kireys Kasvojen turpoaminen | |
| Luusto, lihakset ja sidekudos | Selkäkipu Lihasten kireys Tuki‑ ja liikuntaelimistön kipu | |
| Sukupuolielimet ja rinnat | Erektiohäiriö | |
| Yleisoireet ja antopaikassa todettavat haitat | Epämukava tunne rinnassa Kuumuuden tunne Voimattomuus Väsymys Epänormaali tunne Palelu Infuusiopaikan kipu Turvotus Kuume | |
| Tutkimukset | Kohonnut verenpaine | Veren glukoosipitoisuuden pieneneminen Veren laktaattidehydrogenaasipitoisuuden suureneminen Neutrofiilimäärän lisääntyminen Tihentynyt hengitys |
Ionisoivalle säteilylle altistuminen on yhteydessä syövän syntyyn ja voi aiheuttaa perinnöllisiä vaurioita. Koska efektiivinen annos on noin 5,9 mSv, kun annetaan suurin suositeltu aktiivisuus 185 MBq flutemetamolia (18F), tällaiset haittavaikutukset ovat oletettavasti epätodennäköisiä.
Valikoitujen haittavaikutusten kuvaus
Seuraavia haittavaikutuksia voi ilmetä oireina ja löydöksinä yliherkkyydestä VIZAMYL‑valmisteelle tai sen apuaineille (ks. kohta Apuaineet): silmien/kasvojen turpoaminen, kalpeus, hengenahdistus, kurkun ärsytys, oksentelu, ihottuma, kutina, ihon kireys, puristuksen tunne rinnassa (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta‑tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yksi annos sisältää pienen määrän flutemetamolia (18F), joten yliannostuksesta ei oletettavasti aiheudu farmakologisia vaikutuksia. Jos potilas saa yliannoksen säteilyä, annoksen imeytymistä on vähennettävä, mikäli mahdollista, lisäämällä radionuklidin eliminoitumista elimistöstä tiheän virtsaamisen ja ulostuksen avulla. Käytetyn efektiivisen annoksen arvioinnista voi olla hyötyä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diagnostiset radioaktiiviset lääkevalmisteet, keskushermosto; ATC‑koodi: V09AX04
Vaikutusmekanismi
Flutemetamoli (18F) sitoutuu aivojen neuriittisiin beeta‑amyloidiplakkeihin.
Flutemetamoli (18F) sitoutuu in vitro aivojen neuriittisiin beeta‑amyloidiplakkeihin, ja sen sitoutuminen neurofibrillikimppuihin on vähäistä. Tiedot viittaavat siihen, että flutemetamoli (18F) pystyy merkitsemään tiiviitä (cored) ja diffuuseja beeta‑amyloidikertymiä ja neuriittiplakkeja. Siitä ei ole näyttöä, että flutemetamoli (18F) sitoutuisi beeta‑amyloidiproteiinin liukoisiin muotoihin.
Elämän loppuvaiheen potilailla arvioitiin in vivo flutemetamolin (18F) kortikaaliseen harmaaseen aineeseen kertymisen ja ruumiinavauksesta saatujen näytteiden beeta‑amyloidikokonaistaakan kvantitatiivista korrelaatiota 4G8‑amyloidivasta‑aineiden avulla. 4G8‑amyloidivasta‑aine värjää sekä neuriittiplakeissa että diffuuseissa plakeissa olevan beeta‑amyloidin. Flutemetamoli (18F) voi löytää in vivo diffuusit beeta‑amyloidiplakit, kun niitä on tiheästi. Flutemetamolin (18F) sitoutumista in vivo muihin beeta‑amyloidirakenteisiin tai aivojen muihin rakenteisiin tai reseptoreihin ei tunneta.
Farmakodynaamiset vaikutukset
VIZAMYL-valmisteen sisältämillä pienillä flutemetamolin (18F) pitoisuuksilla ei ole havaittavaa farmakodynaamista aktiivisuutta.
Flutemetamolin (18F) kertymistä aivoihin ja sen jakautumista aivoissa ei selvitetty spesifisessä tutkimuksessa, jonka tarkoitus oli arvioida farmakodynamiikkaa. Kahdessa samankaltaisessa biologista jakautumista koskevassa tutkimuksessa sekä faasin II kliinisessä tutkimuksessa keskimääräiset kvantitatiiviset kertymäarvot PET‑kuvissa olivat todennäköistä Alzheimerin tautia sairastavien potilaiden ja terveiden vapaaehtoisten tutkittavien eniten tutkituilla aivojen alueilla erilaiset.
Kliininen teho
Pivotaalitutkimuksessa 68:lla elämän loppuvaiheen potilaalla oli tarkoitus varmistaa flutemetamolin (18F) diagnostinen teho kortikaalisen neuriittiplakkitiheyden havaitsemisessa. PET‑kuvannustuloksia verrattiin potilailta ruumiinavauksessa saaduista kahdeksan ennalta määritellyn aivoalueen leikkeistä mitattuun neuriittiplakkitiheyteen. Histopatologisissa alueissa oli mukana CERAD‑alueet, mutta ne eivät rajoittuneet näihin. Potilaiden kognitiivista statusta ei selvitetty. 68 potilaan sokkoutetussa visuaalisessa potilastason PET‑tutkimuksessa, jossa kuvat luki viisi sokkoutettua lääkäriä, lukuherkkyys oli useimmiten 86 % (95 %:n luottamusväli: 72–95 %) ja spesifisyys 92 % (95 %:n luottamusväli: 74–99 %).
Flutemetamolin (18F) herkkyyttä ja spesifisyyttä beeta‑amyloidikertymien arvioinnissa tutkittiin lisäksi yhdessä tutkimuksessa, jossa kuvat tulkitsi viisi sähköisesti toteutetun koulutuksen saanutta sokkoutettua lääkäriä, jotka eivät olleet samat kuin aiemmassa tutkimuksessa. He tulkitsivat näiden samojen pivotaalitutkimuksessa mukana olleiden 68 potilaan kuvat ruumiinavauksen jälkeen. Pivotaalitutkimuksen histopatologiset tiedot olivat käytössä. Lukuherkkyys oli useimmiten 93 % (95 %:n luottamusväli: 81–99 %) ja spesifisyys oli 84 % (95 %:n luottamusväli: 64–96 %).
Tutkimuksessa, jossa kuvat luettiin uudelleen, pivotaalitutkimuksessa mukana olleeseen potilasjoukkoon otettiin mukaan lisäksi 38 potilasta, joille oli tehty ruumiinavaus (eli mukana oli yhteensä 106 potilasta), jolloin tiheästi tai melko tiheästi esiintyvien neuriittisten beeta‑amyloidiplakkien havaitsemisherkkyys ensisijaisessa analyysissä oli 91 % (95 %:n luottamusväli: 82–96 %) ja havaitsemisspesifisyys oli 90 % (95 %:n luottamusväli: 74–98 %), mikä perustui yleisimpään lukutulokseen (eli siihen tulkintaan kuvasta, johon sähköisesti toteutetun koulutuksen jälkeen päätyi vähintään kolme lukijaa viidestä). Toissijaisessa analyysissa, jossa käytettiin varmistuksena CERADin alun perin suosittelemaa kolmea neokortikaalialuetta, joilla esiintyi eniten neuriittiplakkeja, herkkyys oli 92 % (95 %:n luottamusväli: 83–97 %) ja spesifisyys oli 88 % (95 %:n luottamusväli: 71,0–97 %).
Pitkittäistutkimuksessa tehtiin lähtötilanteessa flutemetamolin (18F) avulla PET‑kuvaus 232 potilaalle, joilla oli kliinisesti todettu amnestinen lievä kognitiivinen heikentyminen. Potilaita seurattiin tämän jälkeen 36 kuukauden ajan, jotta voitiin arvioida flutemetamolilla (18F) tehdyn kuvauksen ja diagnostisen statuksen muutosten välistä suhdetta. Näistä 232 potilaasta 98:lla (42 %) oli flutemetamolilla (18F) saatu poikkeava (positiivinen) kuvaustulos. Riippumaton arvioijakomitea arvioi tästä 232:n tutkimukseen mukaan otetun potilaan joukosta 224 potilaan kuvat vähintään kerran kuvauksen jälkeen, ja näiden potilaiden tiedot otettiin mukaan analyysiin. 36 kuukauden seurannan aikana 81 (35 %) konvertoitui kliiniseen Alzheimerin tautiin. Niistä 97 potilaasta, joilla oli todettu amnestinen lievä kognitiivinen heikentyminen, joiden PET‑kuvaustulos oli positiivinen ja joista oli vähintään yksi arvioijakomitean arvio, 52 (54 %) potilaan luokiteltiin kliinisesti konvertoituneen 36 kuukauden jälkeen kliiniseen Alzheimerin tautiin verrattuna 29 (23 %) potilaaseen 127:stä, joiden kuvaustulos oli negatiivinen ja joista oli vähintään yksi arvioijakomitean arvio. Jos potilaalla oli ollut amnestista lievää kognitiivista heikentymistä, 36 kuukauden kohdalla flutemetamolilla (18F) tehtyjen kuvausten herkkyys ennakoida potilaiden konvertoitumista Alzheimerin tautiin oli 81 konvertoituneen potilaan osalta 64 % (95 %:n luottamusväli: 54–75 %), ja spesifisyys 143 konvertoitumattoman potilaan osalta oli 69 % (95 %:n luottamusväli: 60–76 %). Useimpien lukutulosten perusteella positiivisen kuvaustuloksen todennäköisyyssuhde oli 2,04 ja negatiivisen kuvaustuloksen todennäköisyyssuhde oli 0,52. Tämän tutkimuksen koeasetelmassa ei ollut mahdollista arvioida sitä riskiä, että lievä kognitiivinen heikentyminen etenee kliiniseksi Alzheimerin taudiksi.
Kliiniset tutkimukset kvantitatiivisen tiedon käytöstä kuvien tulkinnan tukena
Kvantitatiivisen tiedon käytön luotettavuutta visuaalisen tulkinnan tukena analysoitiin kahdessa kliinisessä tutkimuksessa, joissa verrattiin näiden kahden kuvien tulkintamenetelmän yhdenmukaisuutta. Molemmissa tutkimuksissa (yhteensä n = 379) käytettiin CE‑merkittyä ohjelmistoa amyloidin kvantitatiiviseen määrittämiseen, ja visuaalisten tulkintojen ja kvantitatiivisten tulosten välinen prosenttimääräinen yhteneväisyys oli 98,8–99 %. Ensimmäisessä tutkimuksessa kynnysarvot amyloidin kvantitatiiviseen määrittämiseen laskettiin kuoleman jälkeisestä aivojen amyloidistatuksen vahvistamisesta todellisena tuloksena (pivotaalinen lääketieteellisten ruumiinavausten kohortti n = 68) sekä terveiden vapaaehtoisten kohortista (n = 105), jonka avulla määritettiin referenssiraja-arvot normaaleille kvantitatiivisille tuloksille. Täten saatuja raja-arvoja käytettiin testikohortin 172 kuvan (33 todennäköistä Alzheimerin tautitapausta, 80 amnestista lievää kognitiivista heikentymistä ja 59 tervettä vapaaehtoista) luokittelussa negatiivisiksi tai positiivisiksi ja verrattiin visuaalisen tulkinnan mukaiseen luokitteluun. Yhteneväisyys oli 98,8 % (170/172 kuvaa).
Toisessa tutkimuksessa tutkittiin flutemetamolin (18F) kanssa tehdyn amyloidi‑PET‑kuvauksen vaikutusta diagnosointiin ja hoidon hallintaan potilaskohortissa, jonka potilaat kävivät tertiaarisella muistipoliklinikalla. 207 potilaan kuvat tulkittiin visuaalisesti tai CE‑merkityllä ohjelmistolla, ja näiden kahden tulkintamenetelmän yhteneväisyys oli 99 % (205/207 kuvaa).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset flutemetamolin (18F) käytöstä kaikkien pediatristen potilasryhmien hoidossa, sillä sairautta tai tilaa, johon kyseistä lääkevalmistetta käytetään, esiintyy vain aikuisilla (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Jakautuminen
Flutemetamoli (18F) jakautuu kaikkialle elimistöön useiden minuuttien kuluessa injektion antamisesta. 20 minuutin kuluttua noin 20 % flutemetamolin (18F) aktiivisesta yhdisteestä on verenkierrossa, mikä vähenee 10 %:iin 180 minuutin kuluttua.
Kertyminen elimiin
Flutemetamolin (18F) maksimaalinen kertyminen aivoihin, noin 7 % injektoidusta annoksesta, tapahtuu kahden minuutin kuluessa injektion antamisesta. Tätä seuraa nopea puhdistuma aivoista ensimmäisten 90 minuutin aikana (suositeltu aika aloittaa kuvaus), mitä seuraa hitaampi puhdistuma. Viisi elintä/kudosta, joissa kumulatiivinen aktiivisuus oli suurinta, olivat ohutsuolen seinämä, maksa, virtsarakon seinämä, paksusuolen yläosan seinämä ja sappirakon seinämä.
Terveillä verrokeilla on osoitettu flutemetamolin (18F) kertymistä pieninä pitoisuuksina aivokuoreen. Kertymä on suurinta aivosillassa ja muilla valkean aineen alueilla. Alzheimer‑potilaiden aivokuoren ja aivojuovion alueilla on osoitettu merkittävästi suurempi kertymä verrattuna verrokkien aivokuorialueisiin. Alzheimer‑potilailla, kuten verrokeillakin, kertyminen on suurinta aivosiltaan ja muille valkean aineen alueille.
Flutemetamolin (18F) elävän ihmisen aivojen valkeaan aineeseen kertymisen biofysikaalista perustaa ei ole varmasti selvitetty. Radiofarmaseuttisen valmisteen liukoisuuden aivokudoksen lipidisisältöön oletetaan edistävän kertymistä valkeaan aineeseen.
Eliminaatio ja puoliintumisaika
Flutemetamoli (18F) poistuu verenkierrosta nopeasti (suoliston ja virtsateiden kautta). 20 minuutin kuluttua injektion annon jälkeen 75 % plasman radioaktiivisuudesta oli läsnä polaarisina metaboliitteina. 180 minuutin kuluttua 90 % radioaktiivisuudesta oli läsnä plasmassa polaarisina metaboliitteina. Flutemetamolista (18F) eliminoituu noin 37 prosenttia munuaisten kautta ja 52 prosenttia maksan ja sapen kautta. Eliminaation laskennallinen puoliintumisaika on 4,5 tuntia, kun taas flutemetamolin (18F) radioaktiivisuuden puoliintumisaika on 110 minuuttia.
Munuaisten ja maksan vajaatoiminta
Valmisteen farmakokinetiikkaa ei ole tutkittu potilailla, jotka sairastavat munuaisten tai maksan vajaatoimintaa.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Flutemetamoli (18F) oli positiivinen bakteereilla ja nisäkässoluilla tehdyissä in vitro ‑geenitoksisuustesteissä, mutta negatiivinen kolmessa eri in vivo ‑tutkimuksessa, joissa annos oli riittävän suuri. Kliinisesti olennainen mutageenisuus katsotaan siten erittäin epätodennäköiseksi.
Flutemetamolilla (18F) ei ole tehty karsinogeenisuutta ja lisääntymistoksisuutta koskevia tutkimuksia.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Etanoli, vedetön
Polysorbaatti 80
Natriumdivetyfosfaattidihydraatti
Dinatriumvetyfosfaattidodekahydraatti
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Kahdeksan tuntia referenssiajankohdasta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Radiofarmaseuttiset valmisteet säilytetään radioaktiivisia aineita koskevien kansallisten määräysten mukaisesti.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VIZAMYL injektioneste, liuos
400 MBq/ml 1-10 ml (-), 1-15 ml (-)
PF-selosteen tieto
VIZAMYL toimitetaan 10 ml:n ja 15 ml:n tyypin I lasisissa injektiopulloissa, joissa on halobutyylikumitulppa ja alumiinisinetti.
Valmistusprosessin vuoksi joidenkin injektiopullojen kumitulpat saattavat jakeluvaiheessa olla jo lävistettyjä.
Pakkauskoko
Yksi 10 ml:n moniannosinjektiopullo sisältää 1–10 ml liuosta, mikä vastaa referenssiajankohtana 400−4 000 MBq:ä.
Yksi 15 ml:n moniannosinjektiopullo sisältää 1–15 ml liuosta, mikä vastaa referenssiajankohtana 400−6 000 MBq:ä.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai hieman kellertävä liuos.
Käyttö- ja käsittelyohjeet
Valmiste vedetään injektiopullosta aseptisesti. Injektiopullon saa avata vasta, kun tulppa on desinfioitu. Liuos vedetään tämän jälkeen injektiopullosta tulpan läpi kerta‑annosruiskulla, jossa on sopiva suojus ja kertakäyttöinen, steriili neula. Myös hyväksyttyä automaattista antolaitetta voidaan käyttää. Jos injektiopullon eheyttä ei voida varmistaa, valmistetta ei saa käyttää.
Yleinen varoitus
Vain valtuutetut henkilöt saavat vastaanottaa, käyttää ja antaa radiofarmaseuttisia valmisteita, ja käsittelyn on tapahduttava tähän tarkoitukseen varatuissa tiloissa. Valmisteiden vastaanotossa, säilytyksessä, käytössä, kuljetuksessa ja hävittämisessä on noudatettava toimivaltaisten viranomaisten antamia määräyksiä ja/tai asianmukaisia lupia.
Radiofarmaseuttisten valmisteiden valmistuksessa on huomioitava sekä säteilyturvallisuus että farmaseuttiset laatuvaatimukset. Asianmukaisia aseptisia varotoimia on noudatettava.
VIZAMYL on radioaktiivinen lääkevalmiste. Se lähettää positroneja, jotka annihiloituvat elektronien kanssa ja tuottavat gammasäteilyä. Valmisteen käsittelyssä on noudatettava turvallisuustoimenpiteitä, jotta hoitohenkilökunnan ja potilaiden säteilyaltistus voidaan minimoida. VIZAMYL‑valmistetta saa antaa lääkäri, jolla on erityisestä koulutuksesta saatu pätevyys ja kokemusta radionuklidien turvallisesta käytöstä ja käsittelystä, tai antamisen on tapahduttava tällaisen lääkärin valvonnassa. Lääkärin kokemuksen ja koulutuksen täytyy olla asianmukaisen radiofarmaseuttisten valmisteiden käytön valtuuttavan lupaviranomaisen hyväksymä. Virtsarakon säteilyannoksen minimoimiseksi potilasta on kehotettava juomaan nestettä ennen VIZAMYL‑valmisteen antoa sekä sen jälkeen, jotta rakko voidaan tyhjentää usein. Potilasta on kehotettava tyhjentämään virtsarakko ennen VIZAMYL‑kuvantamista ja usein sen jälkeen seuraavien 24 tunnin aikana.
Jos injektiopullon eheyttä ei voida valmisteen käyttökuntoon saattamisen aikana varmistaa, valmistetta ei saa käyttää.
Valmistetta annettaessa on minimoitava lääkevalmisteen kontaminaation riski ja käyttäjään kohdistuvan säteilyn riski. Asianmukaisten suojavarusteiden käyttö on pakollista.
Radiofarmaseuttisten valmisteiden antoon mahdollisesti liittyvät säteilyvuodot tai virtsan, oksennuksen tms. välityksellä tapahtuva kontaminaatio voivat olla vaaraksi muille. Säteilysuojausta koskevia kansallisia määräyksiä on noudatettava.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VIZAMYL injektioneste, liuos
400 MBq/ml 1-10 ml, 1-15 ml
- Ei korvausta.
ATC-koodi
V09AX04
Valmisteyhteenvedon muuttamispäivämäärä
26.06.2024
Dosimetria
Seuraavassa taulukossa 2 on dosimetria OLINDA/EXM (Organ Level INternal Dose Assessment/Exponential Modeling) ‑ohjelmistolla laskettuna. Aikuisten arvioitu absorboituva säteilyannos VIZAMYL‑laskimoinjektion jälkeen on esitetty taulukossa 2. Arvot laskettiin olettaen virtsarakon tyhjenevän 3,5 tunnin välein ja käyttämällä OLINDA/EXM‑ohjelmiston ihmistä koskevan biologisen jakautumisen tietoja.
Taulukko 2 Laskimoon annetusta VIZAMYL‑valmisteesta absorboituva arvioitu säteilyannos (aikuiset)
Elin/kudos | Absorboitunut annos annettua aktiivisuutta kohden [mGy/MBq] |
Lisämunuainen | 0,013 |
Aivot | 0,011 |
Rinnat | 0,005 |
Sappirakko | 0,287 |
Sydän | 0,014 |
Munuaiset | 0,031 |
Maksa | 0,057 |
Paksusuolen alaosan seinämä | 0,042 |
Keuhkot | 0,016 |
Lihakset | 0,009 |
Osteogeeniset solut | 0,011 |
Munasarjat | 0,025 |
Haima | 0,015 |
Punainen luuydin | 0,013 |
Iho | 0,005 |
Ohutsuoli | 0,102 |
Perna | 0,015 |
Mahalaukku | 0,012 |
Kivekset | 0,008 |
Kateenkorva | 0,006 |
Kilpirauhanen | 0,006 |
Paksusuolen yläosa | 0,117 |
Virtsarakko | 0,145 |
Kohtu | 0,025 |
Muut elimet | 0,012 |
Efektiivinen annos (mSv/MBq) | 0,032 |
Aikuisten efektiivinen annos suurimman suositellun aktiivisuuden sisältävän 185 MBq:n annoksen antamisen jälkeen, kun aikuinen painaa 70 kg, on noin 5,9 mSv. Jos annettu aktiivisuus on 185 MBq, tyypillinen säteilyannos kohde‑elimelle (aivoille) on 2,0 mGy. Jos osana PET‑toimenpidettä tehdään samanaikaisesti TT‑kuvaus, altistus ionisoivalle säteilylle suurenee TT‑kuvauksessa käytettyjen asetusten mukaisen määrän verran.
Jos annettu aktiivisuus on 185 MBq, kriittisiin elimiin päätyvät tyypilliset säteilyannokset ovat: sappirakkoon 53,1 mGy, virtsarakon seinämään 26,8 mGy, paksusuolen yläosan seinämään 21,6 mGy, paksusuolen alaosan seinämään 7,8 mGy, ohutsuoleen 18,9 mGy ja maksaan 10,5 mGy.
Radiofarmaseuttisten valmisteiden valmistusohjeet
Valmistustapa
Pakkaus on tarkistettava ennen käyttöä ja aktiivisuus on mitattava annoskalibraattorilla.
Käsittelyä koskevat erityiset varotoimet, ks. kohta Käyttö- ja käsittelyohjeet.
Flutemetamolia (18F) ei saa laimentaa.
Laadunvalvonta
Liuos on tarkastettava silmämääräisesti ennen käyttöä. Liuoksen saa käyttää vain, jos se on kirkasta eikä siinä ole näkyviä hiukkasia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti (ks. kohta Käyttö- ja käsittelyohjeet).
Lisätietoa tästä lääkevalmisteesta on Euroopan lääkeviraston verkkosivuilla http://www.ema.europa.eu.
Yhteystiedot
 OY GE HEALTHCARE BIO-SCIENCES AB
OY GE HEALTHCARE BIO-SCIENCES AB PL 400
00031 GE
010 39411
www.gehealthcare.fi
customerservicefinland@ge.com
