LIDBREE geeli kohtuun 42 mg/ml
Vaikuttavat aineet ja niiden määrät
Lidokaiini 42 mg/ml
Apuaineet, joiden vaikutus tunnetaan
Yksi millilitra geeliä sisältää 284 mg makrogoliglyserolirisiinioleaattia (polyoksyylirisiiniöljyä) ja 28 mikrogrammaa butyloitua hydroksitolueenia (E 321).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Geeli kohtuun.
Kliiniset tiedot
Käyttöaiheet
Lidbree on tarkoitettu paikallispuudutteeksi kohtalaiseen akuuttiin kipuun kohdunkaulan ja kohdunsisäisissä toimenpiteissä aikuisille ja ≥15-vuotiaille nuorille. Ks. kohta Farmakodynamiikka.
Annostus ja antotapa
Annostus
Kohdunkaulan toimenpiteet
Annostele 2-3 ml paksuna kerroksena kohdunnapukkaan ja 3 ml kohdunkaulan kanavaan steriiliä asetinta käyttämällä 5 minuuttia ennen toimenpiteen alkua.
Kohdunsisäiset toimenpiteet
Steriiliä asetinta käyttäen annostele 1-2 ml kohdunnapukan etuhuuleen ja 2-3 ml kohdunkaulan kanavaan. Odota 2 minuuttia vaikutuksen alkamista sisäkäytävässä. Sen jälkeen vie asetin kohtuonteloon ja annostele 3-5 ml 5 minuuttia ennen toimenpidettä. Asetin on merkitty senttimetriasteikolla. Pienempi määrä voidaan antaa esimerkiksi synnyttämättömille potilaille, jos potilas kokee epämukavuutta ennen kuin koko määrä on annettu. Kohdunsisäinen kerta-annos ei saa ylittää yhteensä 10 ml.
≥15-vuotiaat pediatriset potilaat
Pienipainoisilla, alle 30 kg painavilla nuorilla annosta on pienennettävä suhteellisesti, eikä kerta-annos saa ylittää suositeltua enimmäisannosta parenteraaliseen käyttöön (6 mg/kg lidokaiinihydrokloridia vastaten 5,2 mg/kg lidokaiiniemästä Lidbree-valmisteessa, ts. 1,2 ml jokaista 10 painokiloa kohti). 30 kg painavilla nuorilla Lidbree-valmisteen enimmäisannos on yhteensä 3,6 ml.
Lidbree-valmisteen turvallisuutta ja tehoa imeväisten ja alle 15 vuoden ikäisten lasten hoidossa ei ole varmistettu. Lidbree-valmistetta ei pidä käyttää alle 15 vuoden ikäisten lasten hoitoon sen turvallisuuteen liittyvien seikkojen vuoksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Iäkkäät
Annoksen pienentäminen ei ole tarpeen iäkkäillä potilailla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Kerta-annoksen pienentäminen ei ole tarpeen potilailla, joilla on maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen pienentäminen ei ole tarpeen potilailla, joilla on munuaisten vajaatoiminta.
Antotapa
Vain kohdunkaulaan ja kohdun sisäiseen käyttöön.
Lidbree-valmisteen tulee olla liuos sen antohetkellä. Jos valmiste on geeliytynyt, on se asetettava jääkaappiin, kunnes siitä on tullut jälleen liuosta. Tällöin ruiskussa näkyvä ilmakupla liikkuu, jos ruiskua kallistetaan.
Kokoa valmiste vaiheittain, ja annostele viskoosi liuos pakkauksessa mukana olevaa steriiliä asetinta käyttämällä:
- Tarkista ruiskun ulkonäkö samalla kun kallistat sitä. Ruiskussa oleva ilmakupla liikkuu ruiskua kallistettaessa, jos valmiste on nestemäisessä tilassa valmiina käytettäväksi. Jos ilmakupla ei liiku, valmiste on geeliytynyt – aseta silloin valmiste jääkaappiin, kunnes siitä on tullut jälleen liuosta.
- Liitä männänvarsi ja asetin ruiskuun sekä varmista, että ne ovat tiiviisti kiinnitettyinä.

- Työnnä ilmakupla ulos ja täytä asetin geelillä painamalla ruiskun mäntää varovasti.
- Käytä asettimen senttimetriasteikkoa apuna Lidbree-valmisteen paikalleen asettamiseen.
Kun asetin on paikallaan, ruiskusta voidaan antaa 8,5 ml geeliä. Yksi millilitra sisältää 42 mg lidokaiinia. Annostele geeli vaiheittain (1-3) kuvan osoittamalla tavalla.
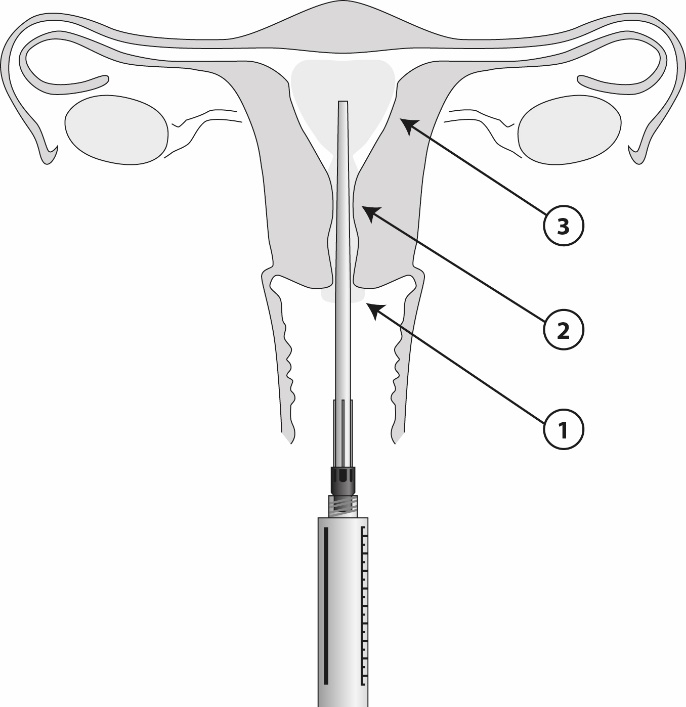
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Vain kohdunkaulaan ja kohdun sisäiseen käyttöön. Paikallispuudutteen aiheuttaman toksisuuden ja henkeä uhkaavien embolisten komplikaatioiden akuutit oireet saattavat ilmaantua, jos viskoosia lämpötilan vaikutuksesta geeliytyvää liuosta on annettu tahattomasti suonensisäisenä injektiona (systeemisten toksisten reaktioiden hoito, ks. kohta Yliannostus). Muut tahattomat parenteraaliset antoreitit saattavat aiheuttaa paikallista kudostoksisuutta.
Mikäli kohdunsisäisten ehkäisyvälineiden asettaminen on ollut vaikeaa ja/tai potilas kokee poikkeuksellista kipua tai verenvuotoa asettamisen aikana tai sen jälkeen, fyysinen tarkastus ja ultraäänitutkimus on tehtävä välittömästi kohdunrungon tai kohdunkaulan puhkeamisen poissulkemiseksi, sillä tehokas paikallispuudute saattaa estää potilasta tuntemasta puhkeamisen yhteydessä ilmenevää kipua.
Jotkut potilaat vaativat erityishuomiota:
- Potilaat, joilla on osittainen tai täydellinen sydämen johtumishäiriö - koska paikallispuudutteet saattavat vähentää sydänlihaksen konduktiota.
- Potilaita, joita hoidetaan luokan III rytmihäiriölääkkeillä (esim. amiodaroni), tulee seurata tarkkaan ja harkita EKG-monitorointia, sillä sydänvaikutukset saattavat olla additiivisia.
- Potilaat, joilla on akuutin vaiheen porfyria. Lidokaiini on todennäköisesti porfyrinogeeninen ja sitä tulee määrätä akuutissa vaiheessa oleville porfyriaa sairastaville potilaille ainoastaan erittäin vahvoin tai kiireellisin perustein. Riittävää varovaisuutta tulee noudattaa kaikkien porfyriapotilaiden kohdalla.
- Potilaat, joilla on heikko yleiskunto.
Pediatriset potilaat
Lidbree-valmistetta ei tule annostella imeväisten tai alle 15 vuoden ikäisten lasten limakalvoille, sillä lidokaiinin plasmapitoisuudet saattavat ylittää toksisuudelle määritetyn kynnysarvon (ks. kohta Farmakodynamiikka).
Apuaineet
Tämä lääkevalmiste sisältää makrogoliglyserolirisiinioleaattia (polyoksyylirisiiniöljyä) ja butyloitua hydroksitolueenia (E 321).
Makrogoliglyserolirisiinioleaatti saattaa aiheuttaa vaikeita allergisia reaktioita.
Butyloitu hydroksitolueeni (E 321) saattaa aiheuttaa limakalvoärsytystä.
Yhteisvaikutukset
Mikäli Lidbree-valmistetta käytetään samanaikaisesti muiden lidokaiinia sisältävien valmisteiden kanssa, suuria lidokaiiniannoksia tulee käyttää varoen potilailla, jotka saavat muita paikallispuudutteita tai lääkkeitä, jotka muistuttavat rakenteellisesti amidityyppisiä paikallispuudutteita, esim. tiettyjä rytmihäiriölääkkeitä kuten meksiletiinia, koska systeemiset toksiset vaikutukset ovat additiivisia. Erityisiä yhteisvaikutustutkimuksia lidokaiinilla ja luokan III rytmihäiriölääkkeillä (esim. amidaroni) ei ole tehty, mutta varovaisuutta tulee noudattaa (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Lisääntymis- ja kehitystoksisuutta koskevia tutkimuksia ei ole tehty Lidbree-valmisteella. Lidokaiini läpäisee istukan. On kohtuullista olettaa, että lidokaiinia on käytetty suurella määrällä raskaana tai hedelmällisessä iässä olevia naisia. Ei ole voitu osoittaa, että lidokaiini aiheuttaisi lisääntymisprosessiin liittyviä häiriöitä, kuten epämuodostumien esiintyvyyden nousua. Ihmiselle koituvaa vaaraa ei ole kuitenkaan täysin tutkittu. Lidokaiinin lisääntymistoksisuutta on tutkittu ei-kliinisillä malleilla, jotka osoittivat, että lidokaiinista ei aiheudu haittaa sikiölle.
Imetys
Lidokaiinia saattaa erittyä äidinmaitoon, mutta niin pieninä määrinä, ettei siitä yleisesti ole vaaraa vastasyntyneelle. Imetystä voidaan siksi jatkaa Lidbree-hoidon ajan.
Hedelmällisyys
Ei ole olemassa riittävästi tietoja Lidbree-valmisteen vaikutuksesta hedelmällisyyteen. Lidokaiinilla ei tiedetä olevan vaikutusta hedelmällisyyteen tai alkion varhaiskehitykseen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Lidbree-valmisteella ei ole haitallista vaikutusta tai on vain vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kliinisissä tutkimuksissa raportoidut haittavaikutukset olivat tyypiltään ja esiintyvyydeltään samanlaisia sekä Lidbree-valmistetta että lumelääkegeeliä saaneilla naisilla ja edustivat ohimeneviä, kohdunsisäisten ehkäisyvälineiden (ehkäisykierukan) asettamisen yhteydessä ilmeneviä haittavaikutuksia. Vakavia haittavaikutuksia ei ole raportoitu.
Haittavaikutustaulukko
Haittavaikutukset on luokiteltu yleisyyksien ja elinjärjestelmien mukaan. Yleisyyluokat on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Seuraavista haittavaikutuksista on ilmoitettu 2 %:n tai sitä suuremmalla esiintymistiheydellä Lidbree-valmisteen annostelun jälkeen.
Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
Hermosto | Yleinen | Huimaus, päänsärky |
Ruoansulatuselimistö | Hyvin yleinen | Pahoinvointi |
| Yleinen | Muut ruoansulatuskanavan vaivat |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kun Lidbree-valmistetta käytetään suositusten mukaisesti, ei se todennäköisesti aiheuta lidokaiinin toksisia pitoisuuksia plasmassa. Jos kuitenkin muita paikallispuudutteita annetaan samanaikaisesti, vaikutukset ovat additiivisia ja saattavat aiheuttaa yliannostuksen, kuten myös tahaton suonensisäinen injektio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), ja systeemisiä toksisia reaktioita.
Oireet
Systeemiset toksiset reaktiot kohdistuvat pääasiassa keskushermostoon ja verenkiertojärjestelmään ja käyvät yhä ilmeisemmiksi plasmapitoisuuden kasvaessa 5 000:sta 10 000:teen ng/ml. Keskushermostotoksisuuden merkit ilmaantuvat yleensä ennen verenkiertojärjestelmään kohdistuvia toksisia vaikutuksia.
Keskushermostotoksisuus ilmenee oireiden ja merkkien asteittaisena pahenemisena. Ensimmäisiä oireita ovat yleensä suun ympäristön parestesia, kielen tunnottomuus, sekava olo, hyperakusia, tinnitus ja näköhäiriöt. Dysartria, lihasten nykiminen tai vapina ovat vakavampia oireita ja edeltävät yleistyvää kouristelua. Tajuttomuutta ja grand mal -kouristuskohtauksia saattaa ilmetä ja ne voivat kestää muutamasta sekunnista useaan minuuttiin. Hypoksia ja hyperkarbia seuraavat nopeasti kouristuksia lisääntyneen lihastoiminnan, hengityksen häiriytymisen ja mahdollisen hengitysteiden toiminnan heikentymisen vuoksi. Vaikeissa tapauksissa voi ilmetä apnea. Asidoosi hyperkalemia, hypokalsemia ja hypoksia lisäävät ja pidentävät paikallispuudutteiden toksisia vaikutuksia.
Toipuminen riippuu paikallispuudutteen poistumisesta keskushermostojärjestelmästä ja sen jälkeisestä metaboliasta ja erittymisestä.
Verenkiertojärjestelmään kohdistuvaa toksisuutta saattaa esiintyä vaikeissa tapauksissa, ja sitä edeltävät yleensä keskushermostotoksisuuden merkit. Hypotensio, bradykardia, rytmihäiriöt ja jopa sydämenpysähdys saattavat tapahtua paikallispuudutteiden korkeiden systeemipitoisuuksien seurauksena, mutta harvinaisissa tapauksissa sydämenpysähdys on tapahtunut ilman aikaisemmin edeltäneitä keskushermosto-oireita.
Hoito
Vaikeat keskushermosto-oireet (kouristukset, keskushermostolama) tulee hoitaa heti tukemalla hengitystä asianmukaisesti ja antamalla antikonvulsiivista lääkitystä.
Jos verenkiertojärjestelmän lamaa esiintyy (hypotensio, bradykardia), asianmukaista hoitoa vasopressorilla, kronotrooppisella ja/tai inotrooppisella lääkeaineella tulee harkita.
Jos sydän pysähtyy, aloitetaan välittömästi elvytys. Tällöin on erittäin tärkeää ylläpitää riittävä hapetus, ventilaatio ja verenkierron tuki sekä hoitaa asidoosi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Anestesia-aineet; paikallispuudutteet: ATC-koodi: N01BB02
Vaikutusmekanismi
Lidokaiini on amidityyppinen paikallispuudute. Lidokaiini stabiloi palautuvasti neuronaalisia solukalvoja ja estää hermoimpulssien syntymisen ja johtumisen, puuduttaen siten paikallisesti. Korkeilla plasmapitoisuuksilla lidokaiini saattaa myös vähentää eksitatoristen neuraalisten solukalvojen johtuvuutta aivoissa ja sydänlihaksessa.
Farmakodynaamiset vaikutukset
Lidbree on lämpötilan vaikutuksesta geeliytyvä, säilöntäaineeton ja paikallisesti puuduttava viskoosi liuos. Valmiste geeliytyy, kun lämpötila nousee kehon lämpötilaan, ja pysyy siten kiinnittyneenä kohdunkaulan ja kohdun limakalvoille (minimoiden nestemäisille valmisteille ominaista pois valumista). Valmisteen laimenemista liman kanssa rajoittaa sen lämpötilan vaikutuksesta geeliytyvä formulaatio, ja paikallispuudute toimii puskurijärjestelmänä.
Lidbree-valmisteen puudutusvaikutuksen alkamisaika paikallisen kohdunkaulan limakalvoille annostelun jälkeen on 2 minuuttia. Kohdunrungon paikallispuudutus kohdunsisäisiä toimenpiteitä varten saavutetaan 5 minuutin kuluessa valmisteen annostelusta kohtuonteloon. Vaikutuksen kesto on vähintään 30 minuuttia, mutta tehoa toimenpiteen jälkeiseen kipuun ei ole verrattaessa lumelääkegeeliin 60 minuutin jälkeen.
Näkyvyys hysteroskopian aikana ei ole heikentynyt.
Kliininen teho ja turvallisuus
Lidbree-valmisteen turvallisuus ja teho paikallispuudutteena kohdunkaulan ja kohdunsisäisissä toimenpiteissä osoitettiin seuraavalla kipumallilla: lumekontrolloitu, monikeskustutkimus 218:llä synnyttämättömällä naisella, joille asetettiin kohdunsisäinen ehkäisyväline (ehkäisykierukka) pyynnöstä. Tämä kipumalli edustaa kohdunsisäisissä toimenpiteissä, kuten diagnostisessa hysteroskopiassa sekä kohdunkaulan ja kohdun limakalvonäytteiden ottohetkellä koettua kipua, joihin liittyy samat kipua tuottavat ärsykkeet (kohdunkaulaan tarttuminen kuulapihdeillä, kohdunkaulan manipulaatio ja kohdun laajentaminen). Lumekontrolloidussa tutkimuksessa geeliä annosteltiin kohdunnapukkaan, kohdunkaulan kanavaan ja kohtuun, joka täytettiin geelillä 5 minuuttia ennen ehkäisykierukan asettamista. Täyttä määrää (8,5 ml) ei pystytty antamaan 72/218 naisesta, koska synnyttämättömillä naisilla on usein pienempi kohtu. VAS-kipujanalla (100 mm Visual Analogue Scale) arvioitu maksimaalinen kipu, jota koettiin ehkäisykierukan asettamisen aikana ja 10 minuutin kuluessa asettamisen alkamisesta, oli merkittävästi matalampi Lidbree-valmistetta saaneilla naisilla (p < 0,0001), joilla vaikutuksen suuruuden arvioitiin olevan 16 mm (eron keskiarvo) ja vastaavan 36 % matalampaa VAS-keskiarvoa, kuin lumelääkegeeliä saaneilla naisilla. Niiden potilaiden osuus, joiden pisteet olivat lähellä kivuttomuutta kuvaavia pisteitä (0‑10), oli 31 % Lidbree-ryhmässä ja 9,7 % lumeryhmässä, ja vastaavaasti niiden potilaiden osuus, joiden korkeat pisteet olivat merkki kohtalaisesta tai vaikeasta kivusta (51‑100), oli 18 % Lidbree-ryhmässä ja 40 % lumeryhmässä. Niiden potilaiden osuus, joiden kipupisteet olivat merkki vaikeasta kivusta (71‑100), oli 9,4 % Lidbree-ryhmässä ja 19,4 % lumeryhmässä. Kipulääkkeiden tarve ensimmäisen tunnin aikana ehkäisykierukan asettamisen jälkeen oli 15,4 % Lidbree-ryhmässä ja 30,5 % lumeryhmässä. Niiden potilaiden osuus, jotka saivat lähellä kivuttomuutta kuvaavia pisteitä (VAS 0‑10) 30 minuutin jälkeen, oli 34,5 % Lidbree-ryhmässä ja 16,1 % lumeryhmässä (p < 0,01) ja 60 minuutin jälkeen 38,7 % Lidbree-ryhmässä ja 32,4 % lumeryhmässä.
Yhdessäkään tapauksessa ei havaittu kohdun puhkeamista ultraäänitutkimuksella. Vakavia haittatapahtumia ei ollut.
Pediatriset potilaat
Lidbree-valmistetta ei ole tutkittu alle 18 vuoden ikäisten lasten hoidossa. Lidokaiinin tiedetään olevan tehokas paikallispuudute lasten, nuorten ja aikuisten hoidossa. Annostusohjeet nuorille perustuvat aikuisille tehtyihin tehotutkimuksiin (ks. kohta Annostus ja antotapa). Lidbree-valmistetta ei ole tarkoitettu annosteltavaksi imeväisten ja alle 15 vuoden ikäisten lasten limakalvoille (ks. kohta Annostus ja antotapa), ja sen käytöstä saattaa seurata paikallispuudutteen aiheuttama systeeminen toksisuus alle 30 kg painavilla henkilöillä, jos annettu lidokaiiniannos on suurempi kuin suositeltu enimmäisannos parenteraaliseen käyttöön (6 mg/kg lidokaiinihydrokloridia vastaten 5,2 mg/kg lidokaiiniemästä Lidbree-valmisteessa, ts. 1,2 ml jokaista 10 painokiloa kohti).
Farmakokinetiikka
Imeytyminen
Lidokaiinin systeeminen imeytyminen Lidbree-valmisteesta riippuu käytetystä annoksesta. Ei‑kliinisissä tutkimuksissa plasmapitoisuudet kohdunsisäisen annon jälkeen osoittivat pienempiä nousuja huippupitoisuudessa kuin suhteessa annoksiin.
Korkea lidokaiinipitoisuus voi tilapäisesti nostaa liman pH-arvoa valmisteen antopaikassa, mikä lisää paikallispuudutteen imeytymisnopeutta.
Lidokaiinin imeytymistä kohdunkaulaan ja kohdun sisään annetun Lidbree-valmisteen kerta-annoksen (8,5 ml) jälkeen tutkittiin viidellätoista 20–36 vuoden ikäisellä naisella (joista useat olivat kuukautiskiertonsa vaiheessa 1-6 vrk) ennen ehkäisykierukan asettamista. Kaikilla potilailla lidokaiinia havaittiin plasmassa 5‑10 minuutin kuluessa geelin kohdunsisäisestä annostelusta. Plasman maksimipitoisuudet havaittiin ajanhetkellä 30–180 minuuttia (keskiarvo 68 minuuttia). Plasman huippupitoisuuden (Cmax) keskiarvo (keskihajonta, SD) oli 351 (205) ng/ml, ja vaihteluväli oli 65–725 ng/ml. Paikallispuudutteen aiheuttaman toksisuuden oireet käyvät yhä ilmeisemmiksi plasmapitoisuuden noustessa 5 000:sta 10 000:een ng/ml, ja havaittu plasman huippupitoisuuden (Cmax) keskiarvo on vähemmän kuin 10 % keskushermostotoksisuuden ensimerkkien ylärajasta. Useimmilla potilailla pitoisuudet ajanhetkellä 3 tuntia olivat laskeneet 30–50 prosenttiin maksimipitoisuuksista.
Biotransformaatio, eliminaatio
Lidokaiinin pääasiallinen eliminaatioreitti on maksametabolia CYP 1A2- ja 3A4-välitteisesti muodostaen monoetyyliglysiiniksylididiä (MEGX), joka on farmakologiselta aktiivisuudeltaan lidokaiinin kaltainen. MEGX metaboloituu edelleen CYP 2A6-välitteisesti, ja muodostuneet metaboliatuotteet erittyvät munuaisten kautta. Laskimonsisäisen annon jälkeen lidokaiinin systeeminen puhdistuma on 10–20 ml/min/kg ja eliminaation puoliintumisaika on 1,5‑2 tuntia. Paikallispuudutteen metabolia- ja eliminaationopeutta Lidbree-valmisteen paikallisannon jälkeen säätelee kuitenkin imeytymisnopeus. Sen vuoksi puhdistuman lasku esimerkiksi vaikeaa maksan vajaatoimintaa sairastavilla potilailla vaikuttaa vain rajallisesti systeemisiin plasmapitoisuuksiin kerta-annon jälkeen.
Erityisryhmät
Iäkkäät potilaat
Lidokaiinin puhdistuma epiduraalitilaan antamisen jälkeen laskee noin 40 %:lla naisilla, joiden keski-ikä on 77 vuotta, verrattuna naisiin, joiden keski-ikä on 42 vuotta. Sen sijaan lidokaiinin plasmapitoisuuksissa ei ole tilastollisesti merkitseviä eroavaisuuksia. Koska imeytymisnopeus säätelee paikallispuudutteen metabolia- ja eliminaationopeutta Lidbree-valmisteen paikallisannon jälkeen, puhdistuman lasku vaikuttaa vain rajallisesti plasmapitoisuuksiin kerta-annon jälkeen.
Farmakokineettisiä tietoja lidokaiinin käytöstä kohdun sisään ja kohdunkaulaan vaihdevuosi-ikäisillä naisilla ei ole saatavilla. Turvallisuustiedot eivät osoittaneet suurentunutta riskiä vaihdevuosi-ikäisillä naisilla kohdunkaulaan ja kohdun sisään annetun lidokaiinin kerta-annoksen jälkeen.
Prekliiniset tiedot turvallisuudesta
40 mg/ml tai 50 mg/ml lidokaiinia sisältävän Lidbree-valmisteen paikallista ja systeemistä toksisuutta annoksilla aina kohdunsisäiseen enimmäisannokseen 1 ml/kg saakka tutkittiin naaraskoirilla (beagle) 28 vuorokauden ajan. Valmisteen sisältämän makrogoliglyserolirisiinioleaatin ja ääreisneuropatiaan viittaavien vähäisten muutosten johdosta 28 päivän kestoisen tutkimuksen aikana ääreishermoja arvioiva kerta-annostutkimus tehtiin Lidbree-valmisteen enimmäismäärällä 1 ml/kg. Lidokaiinin 40 mg/kg:n tai 50 mg/kg:n annokset olivat 7‑10 kertaa suurempia kuin terapeuttinen annos ihmistä hoidettaessa. Lidbree-valmisteen anto naaraskoirien (beagle) kohtuun osoitti, että lidokaiini pääsee nopeasti systeemiseen verenkiertoon. Lidbree-valmisteen ei kyseisellä annoksella osoitettu aiheuttavan systeemistä lidokaiinitoksisuutta tai paikallisreaktioita vaginassa, kohdunkaulassa tai kohdun limakalvoilla. Lidokaiinin 40 mg/kg:n annoksella tehdyssä kerta-annostutkimuksessa mikään ei osoittanut riskiä systeemiseen toksisuuteen tai ääreishermotoksisuuteen ihmisille kerta-annon jälkeen.
Lisääntymistoksisuus
Hedelmällisyyttä, alkion- ja sikiönkehitykseen kohdistuvaa toksisuutta tai pre- ja postnataalista toksisuutta koskevia ei-kliinisiä tutkimuksia ei ole tehty Lidbree-valmisteella. Lidokaiinilla tehdyissä tutkimuksissa uros- tai naarasrottien hedelmällisyyden ei havaittu heikentyvän.
Lidokaiini läpäisee istukkaesteen yksinkertaisen diffuusion avulla. Lidokaiinin alkio- ja sikiötoksisia vaikutuksia havaittiin kaniineilla, mutta ainoastaan annoksilla, jotka aiheuttivat emolle toksisuutta ja jotka ovat kliinisiä annoksia suurempia.
Genotoksisuus ja karsinogeenisuus
Tutkimuksia genotoksisuudesta tai karsinogeenisuudesta ei ole tehty Lidbree-valmisteella.
Lidokaiinilla tehdyt genotoksisuustutkimukset eivät osoittaneet mutageenisuutta. Lidokaiinin metaboliitti, 2,6-dimetyylianiliini, osoitti heikkoa aktiivisuutta joissakin genotoksisuustutkimuksissa. Pitkäaikaisaltistusta arvioivissa prekliinisissä toksikologisissa tutkimuksissa 2,6-dimetyylianiliinilla osoitettiin olevan karsinogeenisia ominaisuuksia. Riskinarvioinnit, joissa laskennallista epäsäännöllisen lidokaiinin käytön maksimialtistusta ihmisellä verrattiin prekliinisten tutkimusten altistukseen, osoittavat laajaa turvallisuusmarginaalia kliinisessä käytössä. Lidokaiinilla ei ole tehty syöpätutkimuksia, mikä johtuu lääkkeen terapeuttisesta käyttöalueesta ja käytön kestosta.
Farmaseuttiset tiedot
Apuaineet
Makrogoliglyserolirisiinioleaatti (polyoksyylirisiiniöljy), poloksameeri (sisältäen butyloitua hydroksitolueenia (E 321)), natriumaskorbaatti (E 301), kloorivetyhappo pH:n säätöön, natriumhydroksidi pH:n säätöön, injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LIDBREE geeli kohtuun
42 mg/ml (L:ei) 10 ml (31,37 €)
PF-selosteen tieto
Lidbree 42 mg/ml geeli kohtuun on saatavilla steriilissä 10 ml esitäytetyssä ruiskussa (syklistä olefiinikopolymeeriä), jossa on bromobutyylikumikorkki ja tulppa ja joka on pakattu samaan läpipainopakkaukseen kuin männänvarsi. Ruiskussa on millilitra-asteikko. Steriili asetin (polypropyleeniä), jossa on esitäytettyyn ruiskuun yhteensopiva Luer-liitin, on saatavilla erillisessä pussissa kotelossa. Ruiskuasettimesta voidaan työntää ulos 8,5 ml.
Pakkauskoko: 1 x 10 ml geeli kohtuun esitäytetyssä ruiskussa.
Valmisteen kuvaus:
Steriili, kirkas tai melkein kirkas, hieman ruskeankeltainen viskoosi liuos, joka on geeli kehon lämpötilassa.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
LIDBREE geeli kohtuun
42 mg/ml 10 ml
- Ei korvausta.
ATC-koodi
N01BB02
Valmisteyhteenvedon muuttamispäivämäärä
20.04.2021
Yhteystiedot
Barnhusgatan 22, 5tr
111 23 Stockholm
Sweden
+358105793700
medinfo.fi@gedeonrichter.eu
