VERQUVO tabletti, kalvopäällysteinen 2,5 mg, 5 mg, 10 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Verquvo 2,5 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 2,5 mg verisiguaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 58,14 mg laktoosia (monohydraattina), ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Verquvo 5 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 5 mg verisiguaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 55,59 mg laktoosia (monohydraattina), ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Verquvo 10 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 10 mg verisiguaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 111,15 mg laktoosia (monohydraattina), ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti (tabletti)
Kliiniset tiedot
Käyttöaiheet
Verquvo on tarkoitettu oireisen kroonisen sydämen vajaatoiminnan hoitoon aikuispotilailla, joilla on alentunut ejektiofraktio ja jotka on stabiloitu äskettäin tapahtuneen, laskimonsisäistä hoitoa vaatineen dekompensaation jälkeen (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Verisiguaattia annetaan yhdessä muiden sydämen vajaatoimintaan tarkoitettujen hoitojen kanssa.
Ennen verisiguaattihoidon aloittamista nestetasapaino ja diureettilääkitys on optimoitava potilaan stabiloimiseksi dekompensaation jälkeen, etenkin potilailla, joiden NT-proBNP-pitoisuudet ovat hyvin korkeat (ks. kohta Farmakodynamiikka).
Suositeltu aloitusannos on 5 mg verisiguaattia kerran vuorokaudessa. Tavoitteena olevan ylläpitoannoksen, 10 mg kerran vuorokaudessa, saavuttamiseksi annos on kaksinkertaistettava noin 2 viikon kuluttua huomioiden lääkkeen siedettävyys potilaalla.
Suositeltu aloitusannos potilaille, joilla on ollut oireellista hypotensiota edellisten 4 viikon aikana, on 2,5 mg verisiguaattia kerran vuorokaudessa. Tavoitteena olevan ylläpitoannoksen, 10 mg kerran vuorokaudessa, saavuttamiseksi annos on kaksinkertaistettava noin 2 viikon välein huomioiden lääkkeen siedettävyys potilaalla.
Jos potilaalla ilmenee lääkkeen siedettävyyteen liittyviä ongelmia (symptomaattinen hypotensio tai systolinen verenpaine [SBP] alle 90 mmHg), suositellaan verisiguaattiannoksen tilapäistä pienentämistä tai verisiguaattihoidon keskeyttämistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoitoa ei pidä aloittaa potilaille, joiden systolinen verenpaine on < 100 mmHg (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Unohtunut annos
Jos annos unohtuu, se tulee ottaa samana päivänä heti, kun potilas muistaa asian. Potilas ei saa ottaa kahta verisiguaattiannosta samana päivänä.
Erityisryhmät
Iäkkäät potilaat
Annosta ei tarvitse muuttaa iäkkäille potilaille (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla arvoitu glomerulusten suodatusnopeus (eGFR) on ≥ 15 ml/min/1,73 m2 (ilman dialyysia). Verisiguaattihoitoa ei suositella potilaille, joilla eGFR on < 15 ml/min/1,73 m2 hoidon alkaessa tai jotka saavat dialyysihoitoa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta. Verisiguaattihoitoa ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Verisiguaatin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu. Kliinisiä tietoja ei ole saatavilla. Prekliinisissä tutkimuksissa todettiin haittavaikutuksia kasvuikäisessä luustossa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Antotapa
Suun kautta. Verquvo otetaan aterian yhteydessä (ks. kohta Farmakokinetiikka).
Tablettien murskaaminen
Jos potilas ei pysty nielemään kokonaisia tabletteja, Verquvo voidaan murskata ja sekoittaa veteen juuri ennen sen ottamista (ks. kohta Farmakokinetiikka).
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
- Muiden liukoisten guanylaattisyklaasin (sGC) stimulaattorien, kuten riosiguaatin samanaikainen käyttö (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Symptomaattinen hypotensio
Verisiguaatti voi aiheuttaa symptomaattista hypotensiota (ks. kohta Haittavaikutukset). Tutkimuksiin ei osallistunut potilailta, joiden systolinen verenpaine oli alle 100 mmHg tai joilla esiintyi symptomaattista hypotensiota hoidon aloittamishetkellä.
Symptomaattisen hypotension mahdollisuus on otettava huomioon potilailla, joilla on hypovolemia, vaikea vasemman kammion ulosvirtauksen ahtauma, hypotensio levossa, autonomisen hermoston toimintahäiriö, aiempi hypotensio tai jotka käyttävät samanaikaisesti verenpainelääkkeitä tai orgaanisia nitraatteja (ks. kohta Yhteisvaikutukset). Jos potilaalla ilmenee lääkkeen siedettävyyteen liittyviä ongelmia (symptomaattinen hypotensio tai systolinen verenpaine alle 90 mmHg), suositellaan verisiguaattiannoksen tilapäistä pienentämistä tai verisiguaattihoidon keskeyttämistä (ks. kohta Annostus ja antotapa).
Verisiguaatin ja PDE5:n estäjien, kuten sildenafiilin, samanaikaista käyttöä ei ole tutkittu potilailla, joilla on sydämen vajaatoimintaa. Näin ollen samanaikaista käyttöä ei suositella, koska se voi suurentaa symptomaattisen hypotension riskiä (ks. kohta Yhteisvaikutukset).
Munuaisten vajaatoiminta
Potilaita, joiden eGFR oli < 15 ml/min/1,73 m2 hoidon aloittamishetkellä tai jotka saivat dialyysihoitoa, ei ole tutkittu ja näin ollen näille potilaille ei suositella verisiguaattihoitoa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Maksan vajaatoiminta
Potilaita, joilla on vaikea maksan vajaatoiminta, ei ole tutkittu ja näin ollen näille potilaille ei suositella verisiguaattihoitoa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Apuaineet
Laktoosi
Tämä lääkevalmiste sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkevalmistetta.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Farmakodynaamiset interaktiot
Verisiguaatin samanaikainen käyttö hemodynaamiikkaan vaikuttavien aineiden kanssa ei johtanut additiivista vaikutusta suurempaan vaikutukseen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka). Lisäksi verisiguaatti alensi systolista verenpainetta noin 1–2 mmHg, kun sitä käytettiin samanaikaisesti muiden sydämen vajaatoimintaa sairastavilla potilailla käytettävien lääkevalmisteiden kanssa (ks. kohta Haittavaikutukset).
Muut liukoiset guanylaattisyklaasin (sGC) stimulaattorit
Verquvo-valmisteen käyttö samanaikaisesti muiden liukoisten guanylaattisyklaasin (sGC) stimulaattorien, kuten riosiguaatin, kanssa on vasta-aiheista (ks. kohta Vasta-aiheet).
PDE5:n estäjät
Kun yksittäisiä sildenafiiliannoksia (25, 50 tai 100 mg) lisättiin useampiin verisiguaattiannoksiin (10 mg) kerran vuorokaudessa terveillä tutkittavilla, istuma-asennossa mitattava verenpaine laski edelleen 5,4 mmHg (systolinen/diastolinen verenpaine, keskiverenpaine [MAP]) tai vähemmän verrattuna tilanteeseen, jossa annettiin pelkästään verisiguaattia. Sildenafiilin eri annoksilla ei havaittu annosriippuvaista suuntausta.
Samanaikainen käyttö ei vaikuttanut kliinisesti merkittävästi kummankaan lääkevalmisteen altistukseen (AUC ja Cmax).
Verisiguaatin ja PDE5:n estäjien, kuten sildenafiilin, samanaikaista käyttöä ei ole tutkittu potilailla, joilla on sydämen vajaatoimintaa. Näin ollen samanaikaista käyttöä ei suositella, koska se voi suurentaa symptomaattisen hypotension riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Asetyylisalisyylihappo
Yhden verisiguaattiannoksen (15 mg) antaminen terveille tutkittaville ei muuttanut asetyylisalisyylihapon (500 mg) vaikutusta vuotoaikaan tai verihiutaleiden aggregaatioon. Vuotoaika tai verihiutaleiden aggregaatio eivät muuttuneet käytettäessä ainoastaan verisiguaattia (15 mg).
Asetyylisalisyylihapon samanaikainen käyttö ei vaikuttanut kliinisesti merkittävästi verisiguaatin altistukseen (AUC ja Cmax).
Varfariini
Useiden verisiguaattiannosten (10 mg) antaminen kerran vuorokaudessa terveille tutkittaville ei muuttanut yhden varfariiniannoksen (25 mg) vaikutusta protrombiiniaikaan tai hyytymistekijöiden II, VII ja X toimintaan.
Samanaikainen käyttö ei vaikuttanut kliinisesti merkittävästi kummankaan lääkevalmisteen altistukseen (AUC ja Cmax).
Sakubitriili/valsartaani-yhdistelmä
Terveillä tutkittavilla useiden verisiguaattiannosten (2,5 mg) lisäämisellä useisiin sakubitriili/valsartaani-annoksiin (97/103 mg) ei ollut lisävaikutusta istuma-asennossa mitattavaan verenpaineeseen verrattuna pelkän sakubitriili/valsartaani-yhdistelmän antamiseen.
Samanaikainen käyttö ei vaikuttanut kliinisesti merkittävästi kummankaan lääkevalmisteen altistukseen (AUC ja Cmax).
Orgaaniset nitraatit
Useiden, 10 mg:aan saakka nostettavien verisiguaattiannosten samanaikainen käyttö kerran vuorokaudessa ei merkittävästi muuttanut lyhyt- ja pitkävaikutteisten nitraattien (nitroglyseriinisuihke ja isosorbidimononitraatti [ISMN]) vaikutusta istuma-asennossa mitattavaan verenpaineeseen sepelvaltimotautia sairastavilla potilailla. Potilaat, joilla oli sydämen vajaatoimintaa, sietivät lyhytvaikutteisten nitraattien samanaikaista käyttöä hyvin. Kokemusta on rajallisesti verisiguaatin ja pitkävaikutteisten nitraattien samanaikaisesta käytöstä potilailla, joilla on sydämen vajaatoimintaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset
Verisiguaatti eliminoituu elimistössä useita eri reittejä pitkin. Pääasiallinen reitti on UGT1A9- ja UGT1A1-välitteinen glukuronidaatio eikä verisiguaatti vaikuta muiden lääkevalmisteiden farmakokinetiikkaan (ks. kohta Farmakokinetiikka).
UGT1A9/1A1:n estäjät
Verisiguaatti metaboloituu UGT1A9:n ja UGT1A1:n välityksellä. Näiden UGT-entsyymien estäjät saattavat lisätä verisiguaatin altistusta.
Kliinisesti merkittävää vaikutusta verisiguaatin altistukseen ei havaittu käytettäessä verisiguaattia samanaikaisesti mefenaamihapon (heikko tai kohtalainen UGT1A9:n estäjä) kanssa.
Koska UGT1A9:n tai yhdistetyn UGT1A9/1A1:n vahvaa estoa ei ole testattu kliinisissä lääkeaineiden yhteisvaikutustutkimuksissa estäjien puuttumisen vuoksi, näiden lääkkeiden samanaikaisen käytön kliinisiä seurauksia ei tällä hetkellä tunneta.
Samanaikainen käyttö mahalaukun pH-arvoa nostavien lääkevalmisteiden kanssa
Samanaikainen käyttö sellaisten lääkevalmisteiden kanssa, jotka nostavat mahalaukun pH-arvoa, kuten protonipumpun estäjät (omepratsoli), H2-reseptorin antagonistit tai haponestolääkkeet (alumiinihydroksidi/magnesiumhydroksidi), eivät vaikuttaneet sydämen vajaatoimintaa sairastavilla potilailla verisiguaatin altistukseen, kun verisiguaatti otettiin ohjeiden mukaisesti aterian yhteydessä (ks. kohta Annostus ja antotapa).
Ei merkittäviä yhteisvaikutuksia
Sellaisten lääkevalmisteiden samanaikaisella annolla, jotka vaikuttavat yhteen tai useampaan verisiguaatin eliminaatioreiteistä, ei ole kliinisesti merkittävää vaikutusta verisiguaatin farmakokinetiikkaan.
Kliinisesti merkittävää vaikutusta verisiguaatin altistukseen ei havaittu, kun verisiguaattia käytettiin samanaikaisesti ketokonatsolin (useita reittejä käyttävien CYP-entsyymien ja kuljettajaproteiinien estäjä) tai rifampisiinin (useita reittejä käyttävien UGT- ja CYP-entsyymien sekä kuljettajaproteiinien indusoija) kanssa.
Kliinisesti merkittävää vaikutusta midatsolaamin (CYP3A:n substraatti) tai digoksiinin (P‑gp:n substraatti) altistukseen ei havaittu käytettäessä verisiguaattia samanaikaisesti näiden lääkevalmisteiden kanssa.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja verisiguaatin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta emolle toksisten annosten yhteydessä (ks. kohta Prekliiniset tiedot turvallisuudesta). Varotoimenpiteenä verisiguaattia ei pidä käyttää raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö verisiguaatti ihmisillä äidinmaitoon, tai onko verisiguaatilla vaikutuksia imetettäviin vauvoihin tai maidontuotantoon. Verisiguaattia havaittiin imettävien rottien maidossa. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö verisiguaattihoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ei ole olemassa tietoja verisiguaatin vaikutuksesta ihmisten hedelmällisyyteen. Uros- ja naarasrotilla suoritetussa tutkimuksessa verisiguaatti ei heikentänyt koe-eläinten hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Verisiguaatilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Ajettaessa tai koneita käytettäessä on otettava huomioon, että valmiste voi joskus aiheuttaa heitehuimausta.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kaikista yleisimmin raportoitu haittavaikutus verisiguaattihoidon aikana on ollut hypotensio (16,4 %).
Haittavaikutustaulukko
Verisiguaatin turvallisuus arvioitiin faasin III tutkimuksessa (VICTORIA), johon osallistui yhteensä 2 519 verisiguaattihoitoa (korkeintaan 10 mg kerran vuorokaudessa) saavaa potilasta (ks. kohta Farmakodynamiikka). Verisiguaattialtistuksen keskimääräinen kesto oli 1 vuosi ja maksimikesto oli 2,6 vuotta.
Kliinisissä tutkimuksissa raportoidut verisiguaatin haittavaikutukset on esitetty seuraavassa taulukossa elinjärjestelmäluokituksen mukaisesti ja esiintymistiheyden mukaan. Määritetyt esiintymistiheydet ovat hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000).
Taulukko 1: Haittavaikutukset
MedDRA-elinjärjestelmäluokitus | ||
Veri ja imukudos | ||
| Yleinen | Anemia | |
Hermosto | ||
| Yleinen | Heitehuimaus, päänsärky | |
Verisuonisto | ||
| Hyvin yleinen | Hypotensio | |
Ruoansulatuselimistö | ||
| Yleinen | Pahoinvointi, dyspepsia, oksentelu, ruokatorven refluksitauti | |
Valikoitujen haittavaikutusten kuvaus
Hypotensio
VICTORIA-tutkimuksen aikana keskimääräinen systolisen verenpaineen lasku oli verisiguaattia saavilla potilailla noin 1–2 mmHg suurempi kuin lumelääkettä saavilla potilailla. VICTORIA-tutkimuksessa hypotensiota raportoitiin 16,4 %:lla verisiguaattihoitoa saavista potilaista ja 14,9 %:lla lumelääkettä saavista potilaista. Näihin lukuihin sisältyy myös ortostaattinen hypotensio, jota raportoitiin 1,3 %:lla verisiguaattihoitoa saavista potilaista ja 1,0 %:lla lumelääkettä saavista potilaista. Symptomaattista hypotensiota raportoitiin 9,1 %:lla verisiguaattia ja 7,9 %:lla lumelääkettä saavista potilaista ja sitä pidettiin vakavana haittavaikutuksena 1,2 %:lla verisiguaattia saavista potilaista ja 1,5 %:lla lumelääkettä saavista potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Yliannostus
Verisiguaatin yliannostus voi aiheuttaa hypotensiota. Potilaalle on annettava tarvittaessa oireenmukaista hoitoa. Lääkevalmiste ei todennäköisesti eliminoidu hemodialyysissä, koska se sitoutuu voimakkaasti proteiineihin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: sydänlääkkeet, muut sydänsairauksien hoitoon käytettävät vasodilataattorit, ATC-koodi: C01DX22
Vaikutusmekanismi
Verisiguaatti on liukoisen guanylaattisyklaasin (sGC) stimulaattori. Sydämen vajaatoimintaan liittyy typpioksidin (NO) heikentynyt synteesi ja sen reseptorin, sGC:n, heikentynyt toiminta. SGC-peräisen syklisen guanosiinimonofosfaatin (cGMP) puute aiheuttaa sydänlihaksen ja verisuonien toimintahäiriöitä. Verisiguaatti korjaa NO-sGC-cGMP-reitin suhteellisen puutteen stimuloimalla sGC:tä suoraan, NO:sta riippumatta, sekä synergeettisesti NO:n kanssa. Tämä nostaa cGMP:n tasoja solujen sisällä, mikä voi parantaa sekä sydänlihaksen että verisuonien toimintaa.
Farmakodynaamiset vaikutukset
Verisiguaatin farmakodynaamiset vaikutukset ovat sGC:n stimulaattorien toimintaperiaatteen mukaisia ja johtavat sileiden lihasten relaksaatioon sekä vasodilataatioon.
Sydämen vajaatoimintaa sairastavilla potilailla tehdyssä 12 viikkoa kestäneessä lumekontrolloidussa annosmääritystutkimuksessa (SOCRATES-REDUCED) verisiguaatin havaittiin pienentävän annosriippuvaisesti sydämen vajaatoiminnan biomarkkeria NT-proBNP:tä verrattuna lumelääkkeeseen, kun niitä käytettiin hoitosuositusten mukaisen hoidon lisänä. VICTORIA-tutkimuksessa arvioitu lasku lähtötilanteen NT-proBNP-tasoon viikon 32 kohdalla oli verisiguaattia saavilla potilailla suurempi kuin lumelääkettä saavilla potilailla (ks. kliininen teho ja turvallisuus).
Sydämen elektrofysiologia
Vakaata sepelvaltimotautia sairastavilla potilailla tehdyssä erityisessä QT-tutkimuksessa 10 mg:n verisiguaattiannoksen antaminen vakaassa tilassa ei pidentänyt QT-väliä kliinisesti merkittävässä määrin eli QTcF-välin maksimaalinen keskimääräinen pidentymä ei ollut yli 6 ms (90 %:n luottamusvälin yläraja oli < 10 ms).
Kliininen teho ja turvallisuus
Verisiguaatin turvallisuutta ja tehoa arvioitiin satunnaistetussa, rinnakkaisryhmillä toteutetussa, lumekontrolloidussa, kaksoissokkoutetussa, tapahtumalähtöisessä monikeskustutkimuksessa (VICTORIA), jossa verrattiin verisiguaattia ja lumelääkettä 5 050 aikuispotilaalla, joilla oli symptomaattinen krooninen sydämen vajaatoiminta (NYHA-luokka II–IV) ja joiden vasemman kammion ejektiofraktio (LVEF) oli alle 45 % sydämen vajaatoiminnan pahenemisvaiheen jälkeen. Sydämen vajaatoiminnan pahenemisvaihe määriteltiin sydämen vajaatoiminnasta johtuvaksi sairaalahoidoksi satunnaistamista edeltäneiden 6 kuukauden aikana tai avohoidossa laskimoon annettavien diureettien käytöksi sydämen vajaatoiminnan hoitoon satunnaistamista edeltävien 3 kuukauden aikana.
Potilaille annettiin verisiguaattia korkeintaan tavoitteen mukainen ylläpitoannos 10 mg kerran vuorokaudessa tai vastaava annos lumelääkettä yhdessä muiden sydämen vajaatoimintaan tarkoitettujen hoitojen kanssa. Hoidon aloitusannos oli 2,5 mg verisiguaattia kerran vuorokaudessa ja annosta suurennettiin noin 2 viikon välein 5 mg:aan kerran vuorokaudessa ja sitten 10 mg:aan kerran vuorokaudessa sietokyvyn mukaan. Noin 1 vuoden kuluttua 89 % verisiguaattihoitoa saaneista potilaista ja 91 % lumelääkettä saaneista potilaista sai 10 mg:n tavoiteannoksen muiden sydämen vajaatoimintaan tarkoitettujen hoitojen kanssa.
Ensisijainen päätemuuttuja oli aika kardiovaskulaarikuoleman ja sydämen vajaatoiminnasta johtuvan sairaalahoidon muodostaman yhdistelmäpäätemuuttujan ensimmäiseen tapahtumaan. Ensisijaisen päätemuuttujan seuranta-ajan mediaani oli 11 kuukautta. Verisiguaattia saavien potilaiden keskimääräinen hoitoaika oli 1 vuosi ja pisin hoitoaika 2,6 vuotta.
Tutkimuspopulaation keski-ikä oli 67 vuotta. Yhteensä 1 596 (63 %) verisiguaattihoitoa saaneista potilaista oli 65-vuotiaita tai sitä vanhempia ja 783 (31 %) verisiguaattihoitoa saaneista potilaista oli 75-vuotiaita tai sitä vanhempia. Satunnaistamishetkellä 58,9 % potilaista oli NYHA-luokkaa II, 39,7 % potilaista NYHA-luokkaa III ja 1,3 % potilaista NYHA-luokkaa IV. Keskimääräinen LVEF oli 28,9 %; noin puolella potilaista LVEF oli < 30 % ja 14,3 %:lla potilaista LVEF oli 40–45 %. Sydämen vajaatoiminnan lisäksi yleisimmin raportoidut sairaudet olivat hypertensio (79 %), sepelvaltimotauti (58 %), hyperlipidemia (57 %), diabetes mellitus (47 %), eteisvärinä (45 %) ja sydäninfarkti (42 %). Satunnaistamishetkellä keskimääräinen eGFR oli 62 ml/min/1,73 m2 (88 %:lla potilaista > 30 ml/min/1,73 m2; 10 %:lla potilaista ≤ 30 ml/min/1,73 m2). 67 % VICTORIA-tutkimuksen potilaista otettiin mukaan tutkimukseen 3 kuukauden kuluessa sydämen vajaatoiminnasta johtuvasta sairaalahoidosta; 17 % otettiin mukaan tutkimukseen 3–6 kuukauden kuluessa sydämen vajaatoiminnasta johtuvasta sairaalahoidosta ja 16 % otettiin mukaan tutkimukseen 3 kuukauden sisällä avohoidossa annetusta laskimonsisäisestä diureettihoidosta. NT-proBNP-tason mediaani oli satunnaistamishetkellä 2 816 pg/ml.
Lähtötilanteessa yli 99 % potilaista sai sydämen vajaatoimintaan muuta hoitoa, joita olivat esimerkiksi beetasalpaajat (93 %), angiotensiinikonvertaasin (ACE) estäjät tai angiotensiinireseptorin II salpaajat (ARB) (73 %), mineralokortikoidireseptorin salpaajat (MRA) (70 %), angiotensiinireseptorin salpaajan ja neprilysiinin estäjän yhdistelmä (ARNI) (15 %), ivabradiini (6 %), implantoitava defibrillaattori (28 %) ja biventrikulaarinen tahdistin (15 %). 91 % potilaista sai kahta tai useampaa lääkevalmistetta sydämen vajaatoimintaan (beetasalpaaja, jokin reniini-angiotensiinijärjestelmän [RAS] estäjä tai MRA) ja 60 % potilaista sai kaikkia kolmea lääkevalmistetta. 3 % potilaista sai natrium-glukoosi-yhteiskuljettajaproteiini 2:n (SGLT2) estäjää.
Tapahtumaan kulunut aika -analyysin perusteella verisiguaatti pienensi lumelääkettä paremmin kardiovaskulaarikuoleman tai sydämen vajaatoiminnasta johtuvan sairaalahoidon riskiä. Tutkimuksen aikana vuotuinen absoluuttinen riskin väheneminen (ARR) verisiguaattia käytettäessä oli 4,2 % verrattuna lumelääkkeeseen. Näin ollen 24:ää potilasta täytyisi hoitaa keskimäärin 1 vuoden ajan 1 ensisijaisen päätemuuttujatapahtuman estämiseksi. Hoidon vaikutus näkyi kardiovaskulaarikuoleman riskin, sydämen vajaatoiminnasta johtuvan sairaalahoidon, kaikki kuolinsyyt kattavan kuolleisuuden tai sydämen vajaatoiminnasta johtuvan sairaalahoidon sekä sydämen vajaatoiminnasta johtuvien sairaalahoitojaksojen kokonaismäärän pienenemisenä (ks. taulukko 2 ja kuva 1).
Taulukko 2: Hoidon vaikutus ensisijaiseen yhdistelmäpäätemuuttujaan, sen osatekijöihin ja toissijaisiin päätemuuttujiin
Verisiguaatti N=2 526 | Lumelääke N=2 524 | Hoitojen vertailu | |
n (%) [Vuotuinen %1] | n (%) [Vuotuinen %1] | Riskisuhde (95 %:n luottamusväli)2 [Vuotuinen ARR %]4 | |
Ensisijainen päätemuuttuja | |||
Kardiovaskulaarikuoleman ja sydämen vajaatoiminnasta johtuvan sairaalahoidon yhdistelmäpäätemuuttuja5 | 897 (35,5) [33,6] | 972 (38,5) [37,8] | 0,90 (0,82; 0,98) p = 0,0193 [4,2] |
Kardiovaskulaarikuolema | 206 (8,2) | 225 (8,9) | |
Sydämen vajaatoiminnasta johtuva sairaalahoito | 691 (27,4) | 747 (29,6) | |
Toissijaiset päätemuuttujat | |||
Kardiovaskulaarikuolema | 414 (16,4) [12,9] | 441 (17,5) [13,9] | 0,93 (0,81; 1,06) |
Sydämen vajaatoiminnasta johtuva sairaalahoito | 691 (27,4) [25,9] | 747 (29,6) [29,1] | 0,90 (0,81; 1,00) |
Kaikki kuolinsyyt kattava kuolleisuus ja sydämen vajaatoiminnasta johtuvan sairaalahoidon yhdistelmäpäätemuuttuja5 | 957 (37,9) [35,9] | 1 032 (40,9) [40,1] | 0,90 (0,83; 0,98) |
Sydämen vajaatoiminnasta johtuvien sairaalahoitojaksojen kokonaismäärä (ensimmäinen ja toistuva) | 1 223 [38,3] | 1 336 [42,4] | 0,91 (0,84; 0,99)6 |
1 Potilaita yhteensä riskin ollessa yksi tapahtuma 100 potilasvuotta kohden.
2 Riskisuhde (verisiguaatti vs. lumelääke) ja luottamusväli Coxin suhteellisen vaaran mallin mukaan.
3 Log-rank-testistä. P-arvot koskevat vain riskisuhdetta (HR), eivät vuotuisen absoluuttisen riskin vähenemistä (ARR).
4 Vuotuisen absoluuttinen riskin väheneminen, joka on (lumelääkkeen ja verisiguaatin) vuotuinen ero prosentteina.
5 Niillä potilailla, joilla on useampia tapahtumia, lasketaan vain yhdistelmäpäätemuuttujan ensimmäinen tapahtuma.
6 Riskisuhde (verisiguaatti vs. lumelääke) ja luottamusväli Andersen-Gill-mallin mukaan.
N = potilaiden lukumäärä hoitoaikeen mukaisessa (ITT) populaatiossa; n = niiden potilaiden lukumäärä, joilla esiintyy tapahtuma.
Kuva 1: Kaplan-Meier-käyrä ensisijaiselle yhdistelmäpäätemuuttujalle: aika kardiovaskulaarikuoleman tai sydämen vajaatoiminnasta johtuvan sairaalahoidon ensimmäiseen esiintymiseen
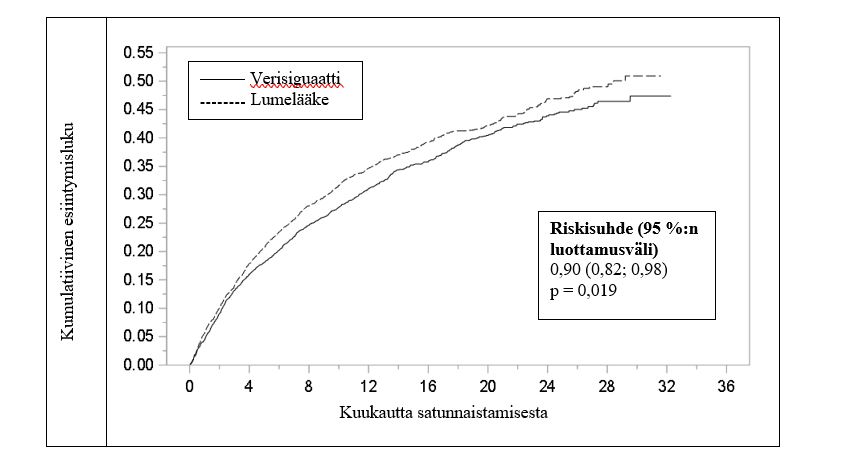
Riskialttiiden potilaiden lukumäärä
Verisiguaatti | 2526 | 2099 | 1621 | 1154 | 826 | 577 | 348 | 125 | 1 | 0 |
Lumelääke | 2524 | 2053 | 1555 | 1097 | 772 | 559 | 324 | 110 | 0 | 0 |
Useiden demografisten ominaisuuksien, sairauden lähtötilanteen tunnusmerkkien ja samanaikaisesti lähtötilanteessa käytettyjen lääkevalmisteiden vaikutusta hoitotuloksiin tutkittiin ja ensisijaisen yhdistelmäpäätemuuttujan tulokset olivat yleisesti ottaen yhtenevät eri alaryhmissä. Valittujen, ennalta määritettyjen alaryhmien analyysien tulokset on esitetty kuvassa 2.
Kuva 2: Ensisijainen yhdistelmäpäätemuuttuja (aika kardiovaskulaarikuoleman tai sydämen vajaatoiminnasta johtuvan sairaalahoidon ensimmäiseen esiintymiseen) – ennalta määritettyjen analyysien valitut alaryhmät
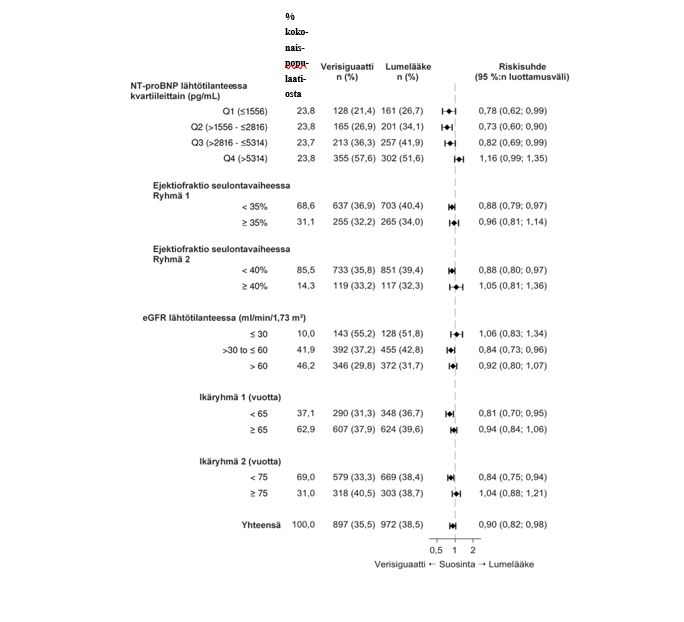
Potilaita, joiden NT-proBNP on erittäin korkea, ei mahdollisesti voida stabiloida täysin ja heidän kohdallaan nestetasapainoa ja diureettilääkitystä on optimoitava edelleen (ks. kohdat Käyttöaiheet ja Annostus ja antotapa).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Verquvo-valmisteen käytöstä vasemman kammion vajaatoiminnan hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Yleinen johdanto
Verisiguaatin farmakokinetiikka on ajasta riippumatonta ja sen vaihtelevuus on vähäistä tai kohtalaista, kun lääke otetaan aterian yhteydessä. Se on farmakokinetiikaltaan annosriippuvainen terveillä vapaaehtoisilla ja hieman vähemmän kuin annosriippuvainen sydämen vajaatoimintaa sairastavilla potilailla. Verisiguaattia kertyy plasmaan 155–171 % ja farmakokineettinen vakaa tila saavutetaan noin 6 vuorokaudessa. Taulukossa 3 on tiivistelmä verisiguaatin keskimääräisistä vakaan tilan populaatiofarmakokineettisistä muuttujista sydämen vajaatoimintaa sairastavilla potilailla. Vakaan tilan altistuksen arvioidaan olevan sydämen vajaatoimintaa sairastavilla potilailla noin 20 % korkeampi kuin terveillä vapaaehtoisilla.
Taulukko 3: Populaatiofarmakokineettinen malli, joka perustuu plasman farmakokineettisten parametrien geometriseen keskiarvoon (CV%) vakaassa tilassa, kun sydämen vajaatoimintaa sairastaville potilaille annetaan 2,5 mg, 5 mg tai 10 mg verisiguaattia (N = 2 321)
Farmakokineettiset parametrit | 2,5 mg | 5 mg | 10 mg |
Cmax (µg/l) | 120 (29,0) | 201 (29,0) | 350 (29,0) |
AUC (µg•h/l) | 2 300 (33,9) | 3 850 (33,9) | 6 680 (33,9) |
Imeytyminen
Verisiguaatin absoluuttinen biologinen hyötyosuus on korkea (93 %), kun lääke otetaan aterian yhteydessä. Suun kautta annetun murskatun ja veteen sekoitetun verisiguaatin biologinen hyötyosuus (AUC) ja plasman huippupitoisuudet (Cmax) ovat verrattavissa kokonaisena otetun tabletin arvoihin (ks. kohta Annostus ja antotapa).
Ruuan vaikutus
Kun verisiguaatti otetaan runsaasti rasvaa ja kaloreita sisältävän aterian yhteydessä, Tmax -arvo suurenee 1 tunnista (paasto) noin 4 tuntiin (kylläinen), farmakokineettisten parametrien vaihtelu on pienempää ja verisiguaatin altistus kasvaa 5 mg:n tabletin osalta 19 % (AUC) ja 9 % (Cmax) ja 10 mg:n tabletin osalta 44 % (AUC) ja 41 % (Cmax) verrattuna annosteluun paastotilassa. Vastaavia tuloksia saatiin, kun verisiguaatti annosteltiin vähärasvaisen, hiilihydraattipitoisen aterian yhteydessä. Näin ollen Verquvo tulisi ottaa aterian yhteydessä (ks. kohta Annostus ja antotapa).
Jakautuminen
Verisiguaatin keskimääräinen vakaan tilan jakautumistilavuus terveillä tutkittavilla on noin 44 l. Verisiguaatin sitoutuminen plasman proteiineihin on noin 98 % seerumin albumiinin ollessa pääasiallinen sitova aineosa. Munuaisten tai maksan vajaatoiminta ei muuta verisiguaatin sitoutumista plasman proteiineihin.
Biotransformaatio
Verisiguaatti metaboloituu pääasiassa glukuronidaation kautta N-glukuronidiksi, joka on farmakologisesti inaktiivinen ja vallitseva lääkkeeseen liittyvä yhdiste plasmassa. N-glukuronidin osuus lääkkeen AUC-kokonaisaltistuksesta on 72 % sen kanta-aineen verisiguaatin osuuden ollessa 28 %. N-glukuronidaatiota katalysoi ensisijaisesti UGT1A9 ja lisäksi UGT1A1. CYP-välitteisen metabolian kautta tapahtuvan eliminaation katsotaan olevan vähäistä (< 5 %).
UGT-entsyymeihin liittyvän geneettisen polymorfismin mahdollista vaikutusta ei ole tutkittu, sillä yksilöiden välinen vaihtelu on verisiguaattia käytettäessä vähäistä tai kohtalaista (ks. taulukko 3). Verisiguaatin annoksen säätäminen vähentää altistumisen mahdollisten muutosten kliinisiä vaikutuksia (ks. kohta Annostus ja antotapa).
Eliminaatio
Verisiguaatti erittyy hitaasti (1,6 l/h terveillä tutkittavilla). Puoliintumisaika on noin 20 tuntia terveillä tutkittavilla ja 30 tuntia sydämen vajaatoimintaa sairastavilla potilailla. Kun [14C]-verisiguaattia annettiin suun kautta terveille tutkittaville, noin 53 % annoksesta erittyi virtsaan (pääasiassa N-glukuronidina) ja 45 % annoksesta erittyi ulosteeseen (pääasiassa verisiguaattina, todennäköisesti N-glukuronidin erittyessä sappeen, minkä jälkeen se hydrolysoituu takaisin verisiguaatiksi suoliston mikroflooran vaikutuksesta).
Erityisryhmät
Munuaisten vajaatoiminta
Sydämen vajaatoimintaa sairastavilla potilailla, joilla oli lievä munuaisten vajaatoiminta, verisiguaatin keskimääräinen altistus (AUC) suureni 5 % verrattuna potilaisiin, joiden munuaiset toimivat normaalisti, kun kohtalaisessa munuaisten vajaatoiminnassa se suureni 13 % ja vaikeassa munuaisten vajaatoiminnassa, joka ei vaatinut dialyysia, se suureni 20 %. Näitä eroja altistuksessa ei pidetä kliinisesti merkittävinä. Verisiguaatin farmakokinetiikkaa ei ole tutkittu potilailla, joiden eGFR on < 15 ml/min/1,73 m2 hoidon alkaessa tai jotka saavat dialyysihoitoa (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Erityisessä kliinisessä farmakologisessa tutkimuksessa muuten terveillä tutkittavilla, joilla oli lievä munuaisten vajaatoiminta, verisiguaatin keskimääräinen altistus (kehon painon suhteen normalisoitu sitoutumaton AUC) oli 8 % suurempi kuin terveillä verrokeilla yhden kerta-annoksen jälkeen, kun kohtalaisessa munuaisten vajaatoiminnassa se oli 73 % suurempi ja vaikeassa munuaisten vajaatoiminnassa 143 % suurempi.
Tämän näennäisen eron munuaisten vajaatoiminnan vaikutuksessa verisiguaatin altistukseen erityisen kliinisen farmakologisen tutkimuksen ja sydämen vajaatoimintaa sairastavilla potilailla tehdyn analyysin välillä voidaan katsoa johtuvan eroista tutkimusasetelmissa ja tutkimusten koossa.
Maksan vajaatoiminta
Altistuksessa (sitoutumaton AUC) ei havaittu merkittävää suurentumista tutkittavilla, joilla oli lievä maksan vajaatoiminta (Child-Pugh A), verisiguaatin keskimääräisen altistuksen ollessa 21 % korkeampi verrattuna terveisiin tutkittaviin, joiden maksa toimi normaalisti. Tutkittavilla, joilla oli kohtalainen maksan vajaatoiminta (Child-Pugh B), verisiguaatin keskimääräinen altistus oli 47 % korkeampi verrattuna terveisiin tutkittaviin, joiden maksa toimi normaalisti. Verisiguaatin farmakokinetiikkaa ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh C) (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Iän, painon, sukupuolen, etnisen alkuperän, rodun ja lähtötason NT-proBNP-arvon vaikutukset
Verisiguaatin käytöstä sydämen vajaatoimintaa sairastavilla potilailla suoritetun tutkimuksen tietojen integroidun populaatiofarmakokineettisen analyysin perusteella iällä (23–98 vuotta), painolla, sukupuolella, etnisellä alkuperällä, rodulla ja lähtötason NT‑proBNP-arvolla ei ole kliinisesti merkittävää vaikutusta verisiguaatin farmakokinetiikkaan (ks. kohta Farmakodynamiikka).
Pediatriset potilaat
Verisiguaatilla ei ole vielä tehty pediatrisia potilaita koskevia tutkimuksia.
Lääkevalmisteiden yhteisvaikutusten in vitro -arviointi
Verisiguaatti on sekä UGT1A9:n että UGT1A1:n substraatti (ks. kohta Yhteisvaikutukset). In vitro -tutkimukset ovat osoittaneet, että kliinisesti merkittävillä pitoisuuksilla verisiguaatti ja sen N-glukuronidi eivät ole tärkeimpien CYP-isoentsyymien (CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 ja 3A4) tai UGT-isoentsyymien (UGT1A1, 1A4, 1A6, 1A9, 2B4, ja 2B7) estäjiä eivätkä CYP1A2:n, 2B6:n tai 3A4:n indusoijia.
Verisiguaatti on P-glykoproteiinin (Pgp) ja rintasyövän resistenssiproteiinin (BCRP) kuljettajien substraatti. Se ei ole orgaanisen kationikuljettajan (OCT1) tai orgaanisten anionikuljettajaproteiinien (OATP1B1, OATP1B3) substraatti. Kliinisesti merkittävillä pitoisuuksilla verisiguaatti ja sen N-glukuronidi eivät ole lääkkeiden kuljettajina toimivien aineiden, joita ovat esimerkiksi Pgp, BCRP, BSEP, OATP1B1/1B3, OAT1, OAT3, OCT1, OCT2, MATE1 ja MATE2K, estäjiä.
Kaiken kaikkiaan nämä tiedot osoittavat, että verisiguaatin antaminen ei todennäköisesti vaikuta sellaisten samanaikaisesti annettujen lääkevalmisteiden farmakokinetiikkaan, jotka ovat näiden entsyymien tai kuljettajien substraatteja.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä urosten ja naaraiden hedelmällisyyttä koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Toistuvan altistuksen aiheuttamaa toksisuutta arvioivissa tutkimuksissa toksikologiselle profiilille oli tunnusomaista liioitellusta farmakodynamiikasta aiheutuvat vaikutukset. Sileiden lihasten relaksaatiosta seuraavia hemodynaamisia ja gastrointestinaalisia vaikutuksia havaittiin kaikilla tutkituilla lajeilla.
Nuorten, nopeasti kasvavien rottien luissa havaittiin korjaantuvia vaikutuksia, joita olivat kasvulevyjen hypertrofia sekä hyperostoosi ja uudismuodostus luun metafyseaalisella ja diafyseaalisella vyöhykkeellä. Näitä vaikutuksia ei havaittu verisiguaatin pitkäkestoisen annostelun jälkeen aikuisilla rotilla ja lähes täysikasvuisilla koirilla.
Tiineenä olevilla rotilla tehty tutkimus osoitti, että verisiguaatti kulkeutuu istukan kautta sikiöön. Rotilla tehdyissä kehitystoksisuustutkimuksissa, joissa verisiguaattia annosteltiin suun kautta organogeneesin aikana, kehitystoksisuutta ei havaittu altistuksen ollessa korkeintaan 21-kertainen ihmisen altistukseen (perustuen sitoutumattomaan AUC-arvoon) verrattuna ihmiselle suositellun enimmäisannoksen (MRDH) ollessa 10 mg. Kaneilla havaittiin myöhäisiä keskenmenoja ja resorptioita emon toksisen annoksen ollessa ≥ 6-kertainen ihmiselle suositeltuun enimmäisannokseen (MRHD) verrattuna. Rotilla tehdyssä pre-/postnataalisessa toksisuustutkimuksessa, jossa käytettiin emolle toksisia annoksia, havaittiin poikasten painon kasvun vähenemistä, mikä johti hampaiden puhkeamisen ja emätinaukon kehittymisen lievään viivästymiseen altistuksen ollessa noin ≥ 21-kertainen ihmiselle suositeltuun enimmäisannokseen (MRHD) verrattuna. Keskenmenojen lisääntymistä, poikasten eloonjäämisen heikentymistä ja viivästynyttä esinahan ja terskan erkaantumista havaittiin altistuksen ollessa 49-kertainen ihmiselle suositeltuun enimmäisannokseen (MRHD) verrattuna.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin: Mikrokiteinen selluloosa, kroskarmelloosinatrium, hypromelloosi 2910, laktoosimonohydraatti, magnesiumstearaatti, natriumlauryylisulfaatti
Kalvopäällyste: Hypromelloosi 2910, talkki, titaanidioksidi (E 171), punainen rautaoksidi (E 172) (ainoastaan Verquvo 5 mg), keltainen rautaoksidi (E 172) (ainoastaan Verquvo 10 mg)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VERQUVO tabletti, kalvopäällysteinen
2,5 mg (L:kyllä) 14 fol (53,66 €)
5 mg (L:kyllä) 14 fol (53,66 €)
10 mg (L:kyllä) 14 fol (53,66 €), 28 fol (102,29 €)
PF-selosteen tieto
2,5 mg; PVC/PVDC/alumiiniläpipainopakkaukset pahvirasioissa, jotka sisältävät 14 kalvopäällysteistä tablettia tai perforoidut yksittäispakatut läpipainopakkaukset pahvirasioissa, jotka sisältävät 100 × 1 kalvopäällysteistä tablettia.
5 mg: PVC/PVDC/alumiiniläpipainopakkaukset pahvirasioissa, jotka sisältävät 14 kalvopäällysteistä tablettia tai perforoidut yksittäispakatut läpipainopakkaukset pahvirasioissa, jotka sisältävät 100 × 1 kalvopäällysteistä tablettia.
10 mg: PVC/PVDC/alumiiniläpipainopakkaukset pahvirasioissa, jotka sisältävät 14 tai 28 kalvopäällysteistä tablettia tai perforoidut yksittäispakatut läpipainopakkaukset pahvirasioissa, jotka sisältävät 100 × 1 kalvopäällysteistä tablettia.
Valmisteen kuvaus:
Verquvo 2,5 mg kalvopäällysteiset tabletit
Pyöreä, kaksoiskupera, valkoinen kalvopäällysteinen tabletti, jonka halkaisija on 7 mm. Tabletin toiselle puolelle on merkitty ”2.5” ja toiselle puolelle ”VC”.
Verquvo 5 mg kalvopäällysteiset tabletit
Pyöreä, kaksoiskupera, punaruskea kalvopäällysteinen tabletti, jonka halkaisija on 7 mm. Tabletin toiselle puolelle on merkitty ”5” ja toiselle puolelle ”VC”.
Verquvo 10 mg kalvopäällysteiset tabletit
Pyöreä, kaksoiskupera, keltaoranssi kalvopäällysteinen tabletti, jonka halkaisija on 9 mm. Tabletin toiselle puolelle on merkitty ”10” ja toiselle puolelle ”VC”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VERQUVO tabletti, kalvopäällysteinen
2,5 mg 14 fol
5 mg 14 fol
10 mg 14 fol, 28 fol
- Alempi erityiskorvaus (65 %). Verisiguaatti: NYHA II–IV-luokan kroonisen sydämen vajaatoiminnan hoito erityisin edellytyksin (257).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Verisiguaatti: NYHA II–IV-luokan kroonisen sydämen vajaatoiminnan hoito erityisin edellytyksin (3058).
ATC-koodi
C01DX22
Valmisteyhteenvedon muuttamispäivämäärä
24.10.2025
Yhteystiedot
 BAYER OY
BAYER OY Tuulikuja 2, PL 73
02151 Espoo
020 785 21
www.bayer.fi
