TRIMBOW inhalaatiojauhe 88/5/9 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi vapautunut annos (suukappaleesta lähtevä annos) sisältää 88 mikrogrammaa beklometasonidipropionaattia (beclometasoni dipropionas), 5 mikrogrammaa formoterolifumaraattidihydraattia (formoteroli fumaras dihydricus) ja 9 mikrogrammaa glykopyrroniumia (glycopyrronium) (11 mikrogrammana glykopyrroniumbromidia).
Yksi mitattu annos sisältää 100 mikrogrammaa beklometasonidipropionaattia (beclometasoni dipropionas), 6 mikrogrammaa formoterolifumaraattidihydraattia (beclometasoni dipropionas) ja 10 mikrogrammaa glykopyrroniumia (glycopyrronium) (12,5 mikrogrammana glykopyrroniumbromidia).
Apuaine, jonka vaikutus tunnetaan:
Yksi inhalaatio sisältää 9,9 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe
Kliiniset tiedot
Käyttöaiheet
Keskivaikean tai vaikean keuhkoahtaumataudin (COPD) ylläpitohoito aikuispotilailla, joiden tilaa ei pystytä riittävästi hoitamaan inhaloitavan kortikosteroidin ja pitkävaikutteisen beeta2-agonistin yhdistelmällä tai pitkävaikutteisen beeta2-agonistin ja pitkävaikutteisen muskariiniantagonistin yhdistelmällä (hoidon vaikutukset oireiden hallintaan ja pahenemisvaiheiden ehkäisyyn, ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Suositeltu annos on kaksi inhalaatiota kahdesti vuorokaudessa.
Enimmäisannos on kaksi inhalaatiota kahdesti vuorokaudessa.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (65‑vuotiaat ja sitä vanhemmat).
Munuaisten vajaatoiminta
Trimbow‑valmistetta voidaan käyttää suositeltuna annoksena potilaille, joilla on lievä (glomerulusten suodatusnopeus [GFR] > 50 – < 80 ml/min/1,73 m2) tai kohtalainen (GFR > 30 – < 50 ml/min/1,73 m2) munuaisten vajaatoiminta. Valmisteen käyttöä vaikeaa (GFR < 30 ml/min/1,73 m2) munuaisten vajaatoimintaa tai dialyysiä edellyttävää loppuvaiheen (GFR < 15 ml/min/1,73 m2) munuaistautia (erityisesti, jos sairauteen liittyy merkittävää painon laskua) sairastaville potilaille tulee harkita vain, jos odotettu hyöty on suurempi kuin mahdollinen riski (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Trimbow‑valmisteen käytöstä vaikeaa maksan vajaatoimintaa (määriteltynä Child-Pugh-luokituksena C) sairastaville potilaille ei ole huomioon otettavia tietoja, ja tätä lääkevalmistetta on käytettävä varoen näille potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Trimbow-valmistetta (alle 18-vuotiaille) pediatrisille potilaille keuhkoahtaumataudin (COPD) hoitoon.
Antotapa
Inhalaatioon.
Inhalaattoria käytetään hengityksen voimalla. Jotta voidaan varmistaa lääkkeen oikea käyttö, lääkärin tai muun terveydenhuollon ammattilaisen on näytettävä potilaalle, miten inhalaattoria käytetään oikein. Potilaan inhalaatiotekniikka on lisäksi syytä tarkistaa ajoittain (ks. ”Käyttöohjeet” alla).
Potilasta on kehotettava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita.
Jokaisen inhalaation jälkeen suu on huuhdeltava tai kurlattava vedellä nielemättä sitä tai on harjattava hampaat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Käyttöohjeet
Käy seuraavat asiat läpi uutta inhalaattoria käyttävän potilaan kanssa
- Jos pussi on avautunut tai rikki tai jos inhalaattori näyttää rikkoutuneelta tai vaurioituneelta, potilaan on palautettava inhalaattori apteekkiin ja hankittava uusi.
- Potilaan on kirjattava pussin avaamispäivämäärä pakkauksessa olevaan etikettiin.
-
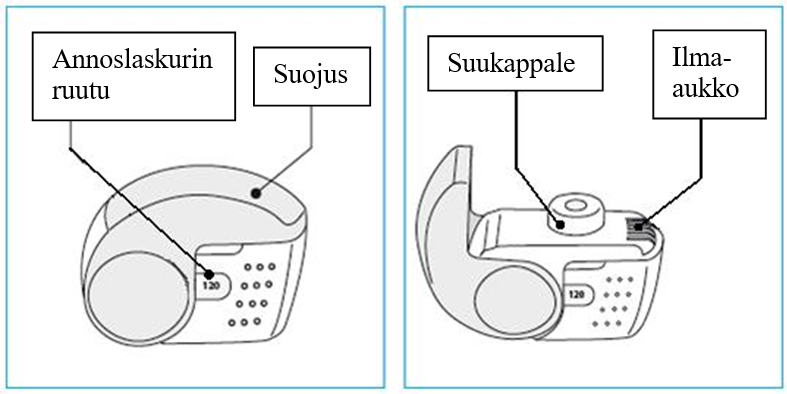
Annoslaskurissa näkyvän lukeman on oltava 120. Jos laskurissa näkyvä luku on pienempi kuin 120, potilaan on palautettava inhalaattori paikkaan, josta hän on sen saanut, ja hankittava uusi.
Inhalaattorin käyttö
Potilaan on seisottava tai istuttava pystyasennossa inhalaattorin käytön aikana. Hänen pitää noudattaa seuraavia ohjeita.
-
Potilas pitää inhalaattoria pystyasennossa, tarkistaa annosmäärän (välillä 1–120 oleva luku, joka osoittaa jäljellä olevien annosten määrän) ja avaa suojuksen kokonaan.

- Potilas hengittää hitaasti ulos niin syvään kuin tuntuu hyvältä, jotta keuhkot tyhjentyvät.
- Potilas asettaa inhalaattorin suuhunsa sulkemalla huulet suukappaleen ympärille siten, että ilma-aukko ei peity, eikä potilas hengitä ilma-aukkoon.
-
Potilas hengittää sisään voimakkaasti ja syvään suun kautta. Lääkkeen maku saattaa tuntua suussa tai laitteesta saattaa kuulua naksahdus.

- Potilas ottaa inhalaattorin pois suustaan, pidättää hengitystään niin pitkään kuin tuntuu hyvältä (5‑10 sekunnin ajan), ja hengittää sitten hitaasti ulos. Potilas ei saa hengittää ulos inhalaattorin kautta.
-
Käytön jälkeen inhalaattori asetetaan pystyasentoon, suojus suljetaan kokonaan ja varmistetaan, että annoslaskurin lukema on vähentynyt yhdellä.

- Jos potilas tarvitsee toisen annoksen, toistetaan vaiheet 1–6.
HUOMAUTUS: Jos suojus suljetaan ilman, että potilas on hengittänyt sisään inhalaattorin kautta, annoslaskurissa näkyvä inhalaatioiden lukumäärä ei vähene. Potilaita on ohjeistettava avaamaan inhalaattorin suojus vain tarvittaessa. Jos potilas on avannut inhalaattorin mutta ei ole inhaloinut lääkettä ja suojus on laitettu kiinni, annos on siirtynyt takaisin inhalaattorissa olevaan säiliöön. Seuraava annos voidaan inhaloida normaalisti.
Puhdistaminen
Inhalaattoria ei yleensä tarvitse puhdistaa säännöllisesti. Potilaat voivat puhdistaa inhalaattorin käytön jälkeen kuivalla liinalla tai paperipyyhkeellä, mutta puhdistamiseen ei saa käyttää vettä tai muuta nestettä.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei akuuttiin käyttöön
Tätä lääkevalmistetta ei ole tarkoitettu akuuttien bronkospasmikohtausten tai taudin akuuttien pahenemisvaiheiden hoitoon (ns. kohtauslääkkeeksi).
Yliherkkyys
Valmisteen antamisen jälkeen on raportoitu ilmenneen välittömiä yliherkkyysreaktioita. Jos allergisiin reaktioihin viittaavia merkkejä, varsinkin angioedeemaa (mukaan lukien hengitys- ja nielemisvaikeudet, kielen, huulten ja kasvojen turvotus), nokkosihottumaa tai ihottumaa, esiintyy, hoito on välittömästi lopetettava ja ryhdyttävä käyttämään muuta hoitoa.
Paradoksaalinen bronkospasmi
Paradoksaalista bronkospasmia saattaa esiintyä. Se ilmenee hengityksen vinkumisen ja hengenahdistuksen äkillisenä lisääntymisenä annoksen ottamisen jälkeen. Tätä pitää hoitaa heti nopeavaikutteisella inhaloitavalla bronkodilaattorilla (kohtauslääkkeellä). Hoito on lopetettava heti, potilaan tila on arvioitava ja tarvittaessa vaihdettava hoitoa.
Sairauden paheneminen
Hoitoa ei ole suositeltavaa lopettaa äkillisesti. Jos hoito ei potilaan mielestä tehoa, hänen pitää hakeutua lääkäriin tilanteen arvioimiseksi, mutta samalla jatkaa valmisteen käyttämistä. Kohtauslääkkeinä käytettävien bronkodilaattorien lisääntynyt käyttö viittaa taustasairauden pahenemiseen ja on merkki hoidon uudelleenarvioinnin tarpeesta. Oireiden äkillinen tai etenevä paheneminen on hengenvaarallista, ja näissä tilanteissa potilaan on hakeuduttava kiireesti lääkäriin hoidon arviointia varten.
Vaikutukset sydämeen ja verisuonistoon
Pitkävaikutteisten beeta2-agonistien ja pitkävaikutteisten muskariiniantagonistien läsnäolosta johtuen Trimbow-valmistetta on käytettävä varoen, jos potilaalla on sydämen rytmihäiriöitä, etenkin kolmannen asteen eteis-kammiokatkos ja takyarytmiaa (sydämenlyöntien kiihtymistä ja/tai epäsäännöllisyyttä, eteisvärinä mukaan lukien), idiopaattinen subvalvulaarinen aortan ahtauma, hypertrofinen obstruktiivinen kardiomyopatia, vaikea sydäntauti (etenkin akuutti sydäninfarkti, iskeeminen sydänsairaus, kongestiivinen sydämen vajaatoiminta, ahtauttava verisuonitauti (etenkin ateroskleroosi), verenpainetauti ja aneurysma.
Potilaan hoidossa on oltava varovainen myös, jos hänellä tiedetään tai epäillään olevan joko synnynnäistä tai lääkehoidosta johtuvaa QT-ajan pitenemistä (QTc > 450 millisekuntia miehillä tai > 470 millisekuntia naisilla). Potilaat, joilla oli kuvattuja sydän- ja verisuonitauteja, suljettiin pois Trimbow‑valmisteen kliinisistä tutkimuksista.
Jos potilas aiotaan nukuttaa halogenoituja anesteettejä käyttäen, Trimbow‑valmistetta ei saa antaa ainakaan 12 tuntia ennen anestesian aloittamista sydämen rytmihäiriöriskin vuoksi.
Hoidossa on oltava varovainen myös, jos potilaalla on tyreotoksikoosi, diabetes mellitus, feokromosytooma tai hoitamaton hypokalemia.
Keuhkokuume keuhkoahtaumapotilailla
Inhaloitavia kortikosteroideja saavilla keuhkoahtaumatautipotilailla on havaittu keuhkokuumeen ilmaantuvuuden lisääntymistä, myös sairaalahoitoa vaativaa keuhkokuumetta. Keuhkokuumeriskin kasvusta steroidiannoksen kasvun myötä on jonkin verran näyttöä, mutta tätä ei ole voitu varmasti osoittaa kaikissa tutkimuksissa.
Luotettavaa näyttöä keuhkokuumeriskin suuruuden luokansisäisistä eroista eri inhaloitavien kortikosteroidivalmisteiden välillä ei ole.
Lääkärien on seurattava keuhkoahtaumatautipotilaiden tilaa valppaasti keuhkokuumeen mahdollisen kehittymisen varalta, sillä näiden infektioiden kliiniset piirteet ovat samankaltaisia keuhkoahtaumataudin pahenemisvaiheen oireiden kanssa.
Keuhkoahtaumatautipotilailla keuhkokuumeen riskitekijöitä ovat mm. tupakoinnin jatkuminen, korkea ikä, alhainen painoindeksi ja vaikea keuhkoahtaumatauti.
Kortikosteroidien systeemiset vaikutukset
Inhaloitavien kortikosteroidien yhteydessä voi esiintyä systeemisiä vaikutuksia etenkin, jos potilaalle määrätään pitkäkestoinen hoito suurilla annoksilla. Trimbow‑valmisteen vuorokausiannos vastaa keskisuurta inhaloitavan kortikosteroidin annosta, ja lisäksi tällaisten vaikutusten esiintyminen on huomattavasti epätodennäköisempää inhaloitavien kortikosteroidien kuin suun kautta otettavien kortikosteroidien käytön yhteydessä. Mahdollisia systeemisiä vaikutuksia ovat: Cushingin oireyhtymä, Cushingin oireyhtymän tyyppiset piirteet, lisämunuaisten toiminnan lamaantuminen, kasvun hidastuminen, luuntiheyden väheneminen sekä harvemmin psykologiset ja käyttäytymiseen liittyvät vaikutukset kuten psykomotorinen hyperaktiivisuus, unihäiriöt, ahdistuneisuus, masentuneisuus tai aggressiivisuus (erityisesti lapsilla). Sen vuoksi on tärkeää, että potilaan tilaa seurataan säännöllisesti.
Trimbow‑valmistetta on annettava varoen potilaille, joilla on aktiivinen tai piilevä keuhkotuberkuloosi ja potilaille, joilla on hengitysteiden sieni- tai virusinfektio.
Hypokalemia
Beeta2-agonistihoito voi johtaa potentiaalisesti vakavaan hypokalemiaan. Se voi mahdollisesti aiheuttaa sydämeen ja verisuonistoon kohdistuvia haittavaikutuksia. Erityistä varovaisuutta on noudatettava hoidettaessa vaikeaa tautia sairastavia potilaita, sillä hypoksia voi voimistaa tätä vaikutusta. Hypokalemia voi myös voimistua jos samanaikaisesti käytetään muita lääkevalmisteita, jotka voivat indusoida hypokalemiaa, kuten ksantiinijohdannaisia, steroideja ja diureetteja (ks. kohta Yhteisvaikutukset).
Varovaisuutta on noudatettava myös, kun käytössä on monia keuhkoputkia avaavia kohtauslääkkeitä. On suositeltavaa, että seerumin kaliumpitoisuutta seurataan näissä tilanteissa.
Hyperglykemia
Formoterolin inhalaatio voi aiheuttaa veren glukoosipitoisuuden nousua. Sen vuoksi veren glukoosiarvoja on tarkkailtava hoidon aikana diabetespotilaille tarkoitettujen vakiintuneiden ohjeiden mukaisesti.
Antikolinerginen vaikutus
Glykopyrroniumia on käytettävä varoen potilaille, joilla on ahdaskulmaglaukooma, eturauhasen liikakasvu tai virtsaumpi. Potilaille on kerrottava äkillisen ahdaskulmaglaukooman merkeistä ja oireista ja heitä on neuvottava lopettamaan hoito ja ottamaan välittömästi yhteyttä lääkäriin, jos heille kehittyy jotain näistä merkeistä tai oireista.
Glykopyrroniumin antikolinergisen vaikutuksen vuoksi valmisteen pitkäaikaista antoa yhdessä muiden antikolinergejä sisältävien lääkevalmisteiden kanssa ei myöskään suositella (ks. kohta Yhteisvaikutukset).
Vaikeaa munuaisten vajaatoimintaa sairastavat potilaat
Vaikeaa munuaisten vajaatoimintaa sairastaville potilaille, mukaan lukien dialyysiä edellyttävää loppuvaiheen munuaistautia sairastavat (erityisesti, jos sairauteen liittyy merkittävää painon laskua), Trimbow-valmistetta saa käyttää vain, jos odotettu hyöty on suurempi kuin mahdollinen riski (ks. kohta Farmakokinetiikka). Näitä potilaita on tarkkailtava mahdollisten haittavaikutusten varalta.
Vaikeaa maksan vajaatoimintaa sairastavat potilaat
Vaikeaa maksan vajaatoimintaa sairastaville potilaille Trimbow‑valmistetta tulee käyttää vain, jos odotettu hyöty on suurempi kuin mahdollinen riski (ks. kohta Farmakokinetiikka). Näitä potilaita on tarkkailtava mahdollisten haittavaikutusten varalta.
Suunielun infektioiden ehkäisy
Suunielun hiivasieni-infektion riskin vähentämiseksi potilaita on neuvottava huuhtelemaan suunsa tai kurlaamaan vedellä nielemättä sitä tai harjaamaan hampaansa sen jälkeen, kun he ovat inhaloineet heille määrätyn annoksen.
Näköhäiriö
Systeemisesti tai topikaalisesti käytettävien kortikosteroidien käytön yhteydessä saatetaan ilmoittaa näköhäiriöistä. Jos potilaalla esiintyy oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, potilas on ohjattava silmälääkärille, joka arvioi oireiden mahdolliset syyt. Niitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet, kuten sentraalinen seroosi korioretinopatia, joista on ilmoitettu systeemisten tai topikaalisten kortikosteroidien käytön jälkeen.
Laktoosisisältö
Tämä lääkevalmiste sisältää laktoosia.
Laktoosi sisältää pieniä määriä maitoproteiineja, jotka saattavat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Farmakokineettiset yhteisvaikutukset
Koska glykopyrronium eliminoituu pääosin munuaisten kautta, yhteisvaikutus voi olla mahdollinen, jos potilas käyttää myös munuaiseritykseen vaikuttavia lääkevalmisteita (ks. kohta Farmakokinetiikka). Kun potilaalle annettiin samanaikaisesti simetidiiniä (käyttäen sitä OCT2- ja MATE1-kuljettajien tyyppiestäjänä), inhaloidun glykopyrroniumin dispositioon kohdistuva orgaanisten kationien kuljetuksen estovaikutus munuaisissa lisäsi glykopyrroniumin systeemistä kokonaisaltistusta (AUC0‑t) niukasti (16 %) ja vähensi munuaispuhdistumaa hieman (20 %).
Beklometasoni on vähemmän riippuvainen CYP3A-välitteisestä metaboliasta kuin jotkin muut kortikosteroidit, ja yleensä ottaen yhteisvaikutukset ovat epätodennäköisiä; systeemisten vaikutusten mahdollisuutta ei voida kuitenkaan poissulkea samanaikaisessa käytössä voimakkaiden CYP3A:n estäjien (kuten ritonaviirin tai kobisistaatin) kanssa, ja siksi varovaisuus ja asianmukainen seuranta on suositeltavaa tällaisten lääkevalmisteiden käytössä.
Farmakodynaamiset yhteisvaikutukset
Formoterolin osalta
Inhaloitavaa formoterolia käyttävien potilaiden on vältettävä ei-kardioselektiivisten beetasalpaajien käyttämistä (myös silmätippoina). Jos beetasalpaajia joudutaan pakottavista syistä ottamaan, formoterolin vaikutus vähenee tai kumoutuu.
Beeta-adrenergisten lääkevalmisteiden samanaikaisella käytöllä saattaa olla additiivisia vaikutuksia. Hoidossa on siksi oltava varovainen, jos samanaikaisesti formoterolin kanssa määrätään muita beeta-adrenergisiä lääkevalmisteita.
Samanaikainen hoito kinidiinillä, disopyramidilla, prokaiiniamidilla, antihistamiineilla, MAO:n (monoamiinioksidaasin) estäjillä, trisyklisillä masennuslääkkeillä ja fentiatsiineilla saattaa pidentää QT-aikaa ja lisätä kammioperäisten rytmihäiriöiden vaaraa. Lisäksi levodopa, levotyroksiini, oksitosiini ja alkoholi voivat heikentää sydämen beeta2-sympatomimeettien sietokykyä.
Samanaikainen hoito MAO:n estäjillä, myös ominaisuuksiltaan samankaltaisilla lääkevalmisteilla, kuten furatsolidonilla ja prokarbatsiinilla, voi edistää hypertensiivisten reaktioiden ilmaantumista.
Rytmihäiriöiden riski kohoaa, jos potilas saa hoidon aikana anestesiaa halogenoiduilla hiilivety-yhdisteillä.
Samanaikainen hoito ksantiinijohdannaisilla, steroideilla ja diureeteilla saattaa voimistaa beeta2-agonistien mahdollisia hypokaleemisia vaikutuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Hypokalemia voi lisätä alttiutta sydämen rytmihäiriöille, jos potilas saa hoitoa digitalisglykosideilla.
Glykopyrroniumin osalta
Trimbow-valmisteen pitkäaikaista antoa yhdessä muiden antikolinergejä sisältävien lääkevalmisteiden kanssa ei suositella, koska siitä ei ole tehty tutkimuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja Trimbow-valmisteen käytöstä raskaana oleville naisille.
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Glukokortikoideilla tiedetään olevan vaikutuksia raskauden varhaisessa vaiheessa, kun taas beeta2-sympatomimeeteillä, kuten formoterolilla, on tokolyyttisiä vaikutuksia. Sen vuoksi varotoimenpiteenä on suotavaa välttää Trimbow‑valmisteen käyttöä raskauden aikana ja synnytyksen aikana.
Trimbow-valmistetta on syytä käyttää raskauden aikana vain, jos hoidosta potilaalle odotettavat hyödyt ovat suuremmat kuin sikiöön kohdistuva mahdollinen riski. Jos imeväisen tai vastasyntyneen äiti on saanut huomattavia määriä valmistetta, lasta on tarkkailtava lisämunuaisten toiminnan lamaantumisen varalta.
Imetys
Merkityksellisiä kliinisiä tietoja Trimbow-valmisteen käytöstä imetyksen aikana ihmisillä ei ole.
Glukokortikoidit erittyvät ihmisen rintamaitoon. On syytä olettaa, että myös beklometasonidipropionaatti ja sen metaboliitit erittyvät ihmisen rintamaitoon.
Ei tiedetä, kulkeutuvatko formoteroli tai glykopyrronium (mukaan lukien niiden metaboliitit) ihmisen rintamaitoon, mutta niitä on havaittu imettävien eläinten maidossa. Antikolinergit, kuten esimerkiksi glykopyrronium, saattavat estää laktaatiota.
On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Trimbow-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Trimbow‑valmisteella ei ole suoritettu tutkimuksia koskien sen turvallisuutta ihmisen hedelmällisyydelle. Eläimillä tehdyissä tutkimuksissa on havaittu hedelmällisyyden heikkenemistä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Trimbow‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
4 viikkoa kestäneessä tutkimuksessa Trimbow-inhalaatiojauheen turvallisuusprofiilin havaittiin vastaavan Trimbow-inhalaatiosumutteen turvallisuusprofiilia.
Trimbow-inhalaatiosumutetta käyttäneillä keuhkoahtaumatauti- tai astmapotilailla ilmoitettiin yleisimmin seuraavista haittavaikutuksista: dysfonia (0,3 % ja 1,5 %) ja suun kandidiaasi (0,8 % ja 0,3 %), jotka liittyvät yleensä inhaloitaviin kortikosteroideihin; lihaskouristukset (0,4 % ja 0,2 %), joiden voidaan katsoa johtuvan pitkävaikutteisesta beeta2-agonistista; ja suun kuivuminen (0,4 % ja 0,5 %), joka on tyypillinen antikolinerginen vaikutus. Vastaavasti suun kuivumista ilmoitettiin 2 potilaalla (0,6 %) Trimbow-inhalaatiojauhetta käyttäneistä potilaista. Astmapotilailla haittavaikutukset tyypillisesti kertyvät ensimmäisten 3 kuukauden ajalla hoidon aloittamisen jälkeen ja vähenevät pitkäaikaisen käytön myötä (6 kuukautta hoidon aloittamisen jälkeen).
Taulukkomuotoinen luettelo haittavaikutuksista
Beklometasonidipropionaatti/formoteroli/glykopyrronium-yhdistelmän käyttöön liittyvät haittavaikutukset, joita ilmeni kliinisten tutkimusten aikana ja valmisteen markkinoille tulon jälkeen, sekä markkinoilla olevien yksittäisten lääkeaineiden käyttöön liittyvät haittavaikutukset on lueteltu seuraavassa elinjärjestelmän ja yleisyyden mukaan.
Esiintymistiheydet määritellään seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
MedDRA-elinjärjestelmä | Haittavaikutus | Yleisyys |
Infektiot | Keuhkokuume (keuhkoahtaumatautipotilailla), nielutulehdus, suun kandidiaasi, virtsatieinfektio1, nasofaryngiitti1 | Yleinen |
Influenssa1, suun sieni-infektio, suunielun kandidiaasi, ruokatorven kandidiaasi, sienen aiheuttama (oro)faryngiitti sinuiitti1, nuha1, maha-suolitulehdus1, vulvovaginaalinen kandidiaasi1 | Melko harvinainen | |
Alahengitysteiden (sieni-) infektio | Harvinainen | |
Veri ja imukudos | Granulosytopenia1 | Melko harvinainen |
Trombosytopenia1 | Hyvin harvinainen | |
Immuunijärjestelmä | Allerginen ihottuma1 | Melko harvinainen |
Yliherkkyysreaktiot, kuten ihon punoitus, huulten, kasvojen, silmien ja nielun turvotus | Harvinainen | |
Umpieritys | Lisämunuaisten toiminnan lamaantuminen1 | Hyvin harvinainen |
Aineenvaihdunta ja ravitsemus | Hypokalemia, hyperglykemia | Melko harvinainen |
Vähentynyt ruokahalu | Harvinainen | |
Psyykkiset häiriöt | Levottomuus1 | Melko harvinainen |
Psykomotorinen hyperaktiivisuus1, unihäiriöt1, ahdistuneisuus, masentuneisuus1, aggressiivisuus1, käyttäytymismuutokset (lähinnä lapsilla) 1 | Yleisyys tuntematon | |
Unettomuus | Harvinainen | |
Hermosto | Päänsärky | Yleinen |
Vapina, heitehuimaus, makuhäiriöt1, hypestesia1 | Melko harvinainen | |
Liikaunisuus | Harvinainen | |
Silmät | Näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet) | Yleisyys tuntematon |
Glaukooma1, kaihi1 | Hyvin harvinainen | |
Kuulo ja tasapainoelin | Korvatorven tulehdus1 | Melko harvinainen |
Sydän | Eteisvärinä, EKG:ssa havaittava QT-ajan piteneminen, takykardia, takyarytmia1, palpitaatiot | Melko harvinainen |
Angina pectoris (stabiili1 ja epästabiili), lisälyönnit (ventrikulaariset1 ja supraventrikulaariset), nodaalirytmi, sinusbradykardia | Harvinainen | |
Verisuonisto | Verekkyys1, punoitus1, korkea verenpaine | Melko harvinainen |
Veren ekstravasaatio | Harvinainen | |
Hengityselimet, rintakehä ja välikarsina | Dysfonia | Yleinen |
Astmaattinen kriisi1, yskä, limainen yskä1, kurkun ärsytys, nenäverenvuoto1, nielun punoitus | Melko harvinainen | |
Paradoksaalinen bronkospasmi1, astman paheneminen, suunielun kipu, nielutulehdus, nielun kuivuminen | Harvinainen | |
Hengenahdistus1 | Hyvin harvinainen | |
Ruoansulatuselimistö | Ripuli1, suun kuivuminen, dysfagia1, pahoinvointi, dyspepsia1, polttava tunne huulilla1, hammaskaries1, (aftainen) suutulehdus | Melko harvinainen |
Iho ja ihonalainen kudos | Ihottuma1, nokkosihottuma, kutina, liikahikoilu1 | Melko harvinainen |
Angioedeema1 | Harvinainen | |
Luusto, lihakset ja sidekudos | Lihaskouristukset, lihassärky, raajakipu1, muskuloskeletaalinen rintakipu1 | Melko harvinainen |
Kasvun hidastuminen1 | Hyvin harvinainen | |
Munuaiset ja virtsatiet | Vaikeutunut virtsaaminen, virtsaumpi, munuaistulehdus1 | Harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Uupumus1 | Melko harvinainen |
Voimattomuus | Harvinainen | |
Perifeerinen edeema1 | Hyvin harvinainen | |
Tutkimukset | C‑reaktiivisen proteiinin pitoisuuden lisääntyminen1, verihiutalemäärän lisääntyminen1, vapaiden rasvahappojen määrän lisääntyminen1, veren insuliinipitoisuuden lisääntyminen1, veren ketoainepitoisuuden lisääntyminen1, kortisolipitoisuuden pieneneminen1 | Melko harvinainen |
Verenpaineen kohoaminen1, verenpaineen aleneminen1 | Harvinainen | |
Luuntiheyden väheneminen1 | Hyvin harvinainen |
1 Vähintään yhden yksittäisen komponentin valmisteyhteenvedossa ilmoitettuja haittavaikutuksia, joita ei kuitenkaan ole havaittu haittavaikutuksina Trimbow-valmisteen kliinisessä kehityksessä
Havaituista haittavaikutuksista seuraavat liitetään tyypillisesti lääkeaineisiin seuraavasti:
Beklometasonidipropionaatti
Keuhkokuume, suun sieni-infektio, alahengitysteiden (sieni-) infektio, dysfonia, kurkun ärsytys, hyperglykemia, psyykkiset häiriöt, kortisolipitoisuuden pieneneminen, näön hämärtyminen.
Formoteroli
Hypokalemia, hyperglykemia, vapina, palpitaatiot, lihaskouristukset, EKG:ssä havaittava QT-ajan piteneminen, verenpaineen kohoaminen, verenpaineen aleneminen, eteisvärinä, takykardia, takyarytmia, angina pectoris (stabiili ja epästabiili), kammiolisälyönnit, nodaalirytmi.
Glykopyrronium
Glaukooma, eteisvärinä, takykardia, palpitaatiot, suun kuivuminen, hammaskaries, virtsaamisvaikeudet, virtsaumpi, virtsatieinfektio.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Trimbow‑valmisteen yliannos voi aiheuttaa merkkejä ja oireita johtuen kunkin yksittäisen aineosan farmakologisista vaikutuksista, mukaan lukien ne, joita on havaittu beeta2-agonistien tai antikolinergien yliannostuksen yhteydessä ja jotka ovat yhdenmukaisia inhaloitavien kortikosteroidien tunnettujen luokkavaikutusten kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Yliannostuksen sattuessa potilaan oireita on hoidettava tukihoidolla ja tarkkailtava potilaan vointia tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergiset lääkeaineet yhdistettynä kolinergisiin lääkeaineisiin, sis. kolmoisyhdistelmähoidon kortikosteroidien kanssa, ATC-koodi: R03AL09.
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Trimbow sisältää beklometasonidipropionaattia, formoterolia ja glykopyrroniumia (BDP/FF/G) kuivassa jauheessa muodostaen erittäin hienojakoisista hiukkasista koostuvan, erittäin hienojakoisen aerosolin, jossa kaikki kolme ainesosaa kulkeutuvat yhdessä. Trimbow‑valmisteen aerosolipartikkelit ovat keskimäärin paljon pienempiä kuin ei-hienojakoisissa lääkemuodoissa olevat hiukkaset. Beklometasonidipropionaatin kohdalla tämä johtaa voimakkaampaan vaikutukseen kuin lääkemuodoilla, joiden partikkelikokojakauma on ei-hienojakoinen (100 mikrogrammaa beklometasonidipropionaattia hienojakoisessa Trimbow‑valmisteessa vastaa 250 mikrogrammaa beklometasonidipropionaattia ei-hienojakoisessa lääkemuodossa).
Beklometasonidipropionaatti
Suositeltuina annoksina inhalaationa annetulla beklometasonidipropionaatilla on anti-inflammatorinen glukokortikoidivaikutus keuhkoihin. Glukokortikoideja käytetään yleisesti tulehduksen hillitsemiseen kroonisissa tulehdussairauksissa. Ne sitoutuvat sytoplasman glukokortikoidireseptoreihin, mikä johtaa tulehdusta estäviä proteiineja koodaavien geenien transkription lisääntymiseen.
Formoteroli
Formoteroli on selektiivinen beeta2‑adrenerginen agonisti, joka relaksoi reversiibeliä hengitysteiden ahtaumaa sairastavien potilaiden keuhkoputkien sileää lihasta. Keuhkoputkia laajentava vaikutus alkaa nopeasti, 1‑3 minuutin kuluessa inhalaation ottamisesta, ja vaikutus kestää 12 tuntia kerta-annoksen ottamisen jälkeen.
Glykopyrronium
Glykopyrronium on voimakkaasti sitoutuva, pitkävaikutteinen muskariinireseptoriantagonisti (antikolinergi), jota käytetään inhalaationa bronkodilatoivaan hoitoon. Glykopyrronium vaikuttaa estämällä asetyylikoliinin keuhkoputkia supistavan vaikutuksen hengitysteiden sileiden lihasten soluissa laajentaen näin hengitysteitä. Glykopyrroniumbromidi on voimakkaasti sitoutuva muskariinireseptorin antagonisti, jonka selektiivisyys ihmisen M3-reseptoreihin on tutkimusten mukaan yli 4‑kertainen ihmisen M2‑reseptoreihin verrattuna.
Kliininen teho ja turvallisuus
Trimbow-inhalaatiojauhe
Trimbow-inhalaatiojauheen kehitysohjelma tehtiin BDP/FF/G 88/5/9‑valmisteella ja siihen kuului 4 viikon pituinen non-inferioriteettitutkimus. TRI‑D‑tutkimus oli satunnaistettu, kaksoissokkoutettu, kaksoislumetekniikalla toteutettu, aktiivikontrolloitu, kolmen eri annostuksen vaihtovuoroinen monikeskustutkimus, jossa verrattiin keskenään kolmea 4 viikon pituista hoitojaksoa. Vertaillut hoidot olivat BDP/FF/G-inhalaatiojauhe, BDP/FF/G-inhalaatiosumute ja kiinteäannoksinen 100/6 mikrogramman beklometasonidipropionaatin ja formoterolin yhdistelmä inhalaatiosumutteena, liuos. Kukin hoito annettiin vakaassa tilassa olevaa keskivaikeaa tai vaikeaa keuhkoahtaumatautia sairastaville potilaille 2 inhalaationa kahdesti päivässä, ja hoitojaksojen välissä pidettiin kahden viikon pituinen lääkityskatko. Tehoa koskevat ensisijaiset päätetapahtumat olivat ajan suhteen normalisoidun FEV1 AUC0-12h-arvon ja FEV1-pohja-arvon (trough-arvon) muutokset lähtötilanteesta 24 tunnin kohdalla päivänä 28.
Vaikutukset keuhkojen toimintaan
366 potilasta satunnaistettiin. BDP/FF/G-inhalaatiojauheen yhdenveroisuus (non-inferiority) suhteessa BDP/FF/G-inhalaatiosumutteeseen osoitettiin molempien päätetapahtumien osalta luottamusvälin alarajan keskimääräisen muutoksen jäädessä yli yhdenveroisuuden raja-arvon (‑50 ml): keskimääräiset muutokset (95 %:n CI) olivat ‑20 ml (‑35; ‑6) FEV1 AUC0-12h:n osalta ja 3 ml (‑15; 20) FEV1-pohja-arvon (trough-arvon) osalta 24 tunnin kohdalla päivänä 28.
Sekä BDP/FF/G-inhalaatiojauhe että -inhalaatiosumute paransivat merkitsevästi FEV1 AUC0-12h-arvoa verrattuna inhalaatiosumutteena annettuun beklometasonidipropionaatin ja formoterolin kiinteäannoksiseen yhdistelmään. Inhalaatiojauhe paransi FEV1 AUC0-12h-arvoa 85 ml (95 %:n CI: 70; 99) ja inhalaatiosumute 105 ml (95 %:n CI: 90; 120) (p < 0,001 molempien osalta).
Sisäänhengitysvirtaus
Sen varmistamiseksi, ettei potilaan ikä, sairaus tai sen vaikeusaste vaikuta inhalaattorin läpi kulkevaan sisäänhengitysvirtaukseen, suoritettiin avoin lumelääketutkimus. Tämä auttoi varmistamaan, että kaikki potilaat pystyvät aktivoimaan inhalaattorin ja vapauttamaan vaikuttavan aineen. Ensisijainen päätetapahtuma oli niiden potilaiden prosentuaalinen osuus kussakin ikä- ja sairausryhmässä, jotka pystyivät aktivoimaan inhalaattorin. Tutkimukseen osallistui 89 potilasta, jotka olivat 5–84-vuotiaita, joiden joukossa oli myös keskivaikeaa (FEV1 > 60 % viitearvosta) ja vaikeaa (FEV1 ≤ 60 % viitearvosta) astmaa sairastavia potilaita sekä potilaita, joilla oli keskivaikea (FEV1 ≥ 50 % viitearvosta) tai vaikea (FEV1 < 50 % viitearvosta) keuhkoahtaumatauti. Kaikki potilaat pystyivät iästä, sairaudesta ja sairauden vaikeusasteesta riippumatta tuottamaan inhalaattorin aktivoimiseen riittävän sisäänhengitysvirtauksen. Lumelääkkeellä tehtiin vielä avoin lisätutkimus, jossa todettiin, että lievää tai keskivaikeaa keuhkoahtaumatautia sairastavat potilaat pystyivät toimintakyvyn rajoituksista riippumatta aktivoimaan inhalaattorin ja käyttämään sitä tehokkaasti.
Trimbow-inhalaatiosumute
Trimbow-inhalaatiosumutteen kehitysohjelma keuhkoahtaumataudin hoidossa tehtiin BDP/FF/G 87/5/9 ‑valmisteella ja siihen kuului kaksi 52 viikon aktiivikontrolloitua tutkimusta. TRILOGY‑tutkimuksessa BDP/FF/G‑valmistetta verrattiin kiinteään yhdistelmähoitoon, jossa annettiin beklometasonidipropionaattia ja formoterolia 100/6 mikrogrammaa kaksi inhalaatiota kahdesti vuorokaudessa (1 368 satunnaistettua potilasta). TRINITY‑tutkimuksessa BDP/FF/G‑valmistetta verrattiin tiotropium 18 mikrogrammaa ‑inhalaatiojauheeseen, kova kapseli, jota annettiin yksi inhalaatio kerran vuorokaudessa. Lisäksi vaikutuksia verrattiin kolmen lääkkeen vapaaseen yhdistelmään, johon sisältyi beklometasonidipropionaatti-formoteroli 100/6 mikrogrammaa ‑yhdistelmähoito (vastaa 84,6/5,0 mikrogramman vapautunutta annosta), jota annettiin kaksi inhalaatiota kahdesti vuorokaudessa, sekä tiotropium 18 mikrogrammaa ‑injektiojauhe, kova kapseli, jota annettiin yksi inhalaatio kerran vuorokaudessa (2 691 satunnaistettua potilasta). TRIBUTE-tutkimuksessa BDP/FF/G-valmistetta verrattiin kiinteäannoksiseen indakateroli/glykopyrronium 85/43 mikrogrammaa -inhalaatiojauheeseen (kova kapseli), jota annettiin yksi inhalaatio kerran vuorokaudessa (1 532 satunnaistettua potilasta).
Keuhkoahtaumataudin pahenemisvaiheiden väheneminen
BDP/FF/G‑hoito vähensi keskivaikeiden/vaikeiden pahenemisvaiheiden määrää 52 viikon aikana 23 %:lla kiinteäannoksiseen beklometasonidipropionaatin ja formoterolin yhdistelmään verrattuna (0,41 vs. 0,53 tapahtumaa per potilas/vuosi; p = 0,005) , 20 %:lla tiotropiumiin verrattuna (0,46 vs. 0,57 tapahtumaa per potilas/vuosi; p = 0,003) ja 15 %:lla kiinteäannoksiseen indakateroli-glykopyrroniumyhdistelmähoitoon verrattuna (0,50 vs. 0,59 tapahtumaa per potilas/vuosi; p = 0,043). Eroja ei havaittu verrattaessa BDP/FF/G‑valmistetta kolmen lääkkeen vapaaseen yhdistelmään, joka koostui kiinteäannoksisesta beklometasonidipropionaatti-formoteroliyhdistelmähoidosta ja tiotropiumista (keskivaikeiden/vaikeiden pahenemisvaiheiden lukumäärät: 0,46 vs. 0,45 tapahtumaa per potilas/vuosi).
Vaikutukset keuhkojen toimintaan
Kiinteäannoksiseen beklometasonidipropionaatti‑formoteroliyhdistelmähoitoon verrattuna BDP/FF/G‑hoito paransi ennen annosta mitattua FEV1-arvoa 71 ml:lla 28 päivän jälkeen, 81 ml:lla 26 hoitoviikon jälkeen ja 63 ml:lla 52 hoitoviikon jälkeen. Tiotropiumiin verrattuna BDP/FF/G‑hoito paransi ennen annosta mitattua FEV1-arvoa 51 ml:lla 26 hoitoviikon jälkeen ja 61 ml:lla 52 hoitoviikon jälkeen. Nämä parantumiset olivat tilastollisesti merkitseviä (p < 0,001). Kiinteäannoksiseen indakateroli-glykopyrroniumyhdistelmähoitoon verrattuna BDP/FF/G‑hoito paransi ennen annosta mitattua keskimääräistä FEV1-arvoa 22 ml:lla 52 viikkoa kestäneen hoitovaiheen aikana (p = 0,018). Samankaltaisia parantumisia todettiin viikoilla 26 ja 52, mutta ne eivät olleet tilastollisesti merkitseviä.
Eroja ei havaittu verrattaessa BDP/FF/G‑valmistetta ja kolmen lääkkeen vapaata yhdistelmää, joka koostui kiinteäannoksisesta beklometasonidipropionaatti-formoteroliyhdistelmähoidosta ja tiotropiumista (3 ml:n ero ennen annosta mitatussa FEV1 ‑arvossa 52 hoitoviikon jälkeen).
Vaikutus oireisiin
BDP/FF/G oli elämänlaadun paranemisen suhteen tilastollisesti merkitsevästi parempi kuin kiinteäannoksinen beklometasonidipropionaatti-formoteroliyhdistelmähoito, tiotropium tai kiinteäannoksinen indakateroli-glykopyrroniumyhdistelmähoito (Saint George Respiratory Questionnaire -kyselyn (SGRQ) kokonaispistemäärällä mitattuna).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Trimbow-valmisteen käytöstä kaikkien pediatristen potilasryhmien keuhkoahtaumataudin hoidossa (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Trimbow – kiinteä yhdistelmävalmiste
Beklometasonidipropionaatin (ja sen aktiivisen metaboliitin beklometasoni-17-monopropionaatin), formoterolin ja glykopyrroniumbromidin farmakokinetiikkaa tutkittiin terveillä tutkimushenkilöillä tehdyssä farmakokineettisessä tutkimuksessa, jossa Trimbow-inhalaatiojauhetta verrattiin inhalaatiosumutteeseen. Molemmissa lääkemuodoissa potilaille annettiin beklometasonipropionaattia, formoterolifumaraattia ja glykopyrroniumbromidia vahvuutena 100/6/12,5 µg/inhalaatio (8 inhalaatiota, vastaa yhteensä 800/48/100 µg:n kokonaisannosta). Suhteellista systeemistä kokonaisaltistusta arvioitiin ilman aktiivihiilen ottamista, jotta saatiin huomioitua sekä keuhkoista että ruoansulatuskanavasta imeytynyt vaikuttava aine, kun taas suhteellista hyötyosuutta keuhkoissa tutkittiin aktiivihiiltä ottaen sulkemaan pois vaikuttavan aineen imeytymisen ruoansulatuskanavasta.
Beklometasonidipropionaatti imeytyi nopeasti, ja sekä Trimbow-inhalaatiojauhetta että inhalaatiosumutetta käytettäessä huippupitoisuus plasmassa saavutettiin 10 minuuttia annoksen ottamisen jälkeen. Inhalaatiojauheen anto johti suurempaan systeemiseen kokonaisaltistukseen (1,2‑kertainen Cmax ja 2,4‑kertainen AUC0-t) ja hyötyosuuteen keuhkoissa (1,3‑kertainen Cmax ja 2,5‑kertainen AUC0-t) inhalaatiosumutteeseen verrattuna. Beklometasoni-17-monopropionaattia alkoi muodostua nopeasti, ja huippupitoisuus plasmassa saavutettiin noin 15–30 minuutissa lääkevalmisteen annon jälkeen. Inhalaatiojauheen anto johti hieman pienempään systeemiseen kokonaisaltistukseen inhalaatiosumutteeseen verrattuna (Cmax ‑17 % ja AUC0-t ‑16 %), kun taas sen hyötyosuus keuhkoissa vastasi AUC0-t-arvon osalta inhalaatiosumutetta ja oli Cmax-arvon osalta hieman inhalaatiosumutetta pienempi (‑13 %).
Formoteroli imeytyi nopeasti, ja sekä inhalaatiojauhetta että inhalaatiosumutetta käytettäessä huippupitoisuus plasmassa saavutettiin 10 minuuttia annoksen ottamisen jälkeen. Inhalaatiojauheen anto johti suurempaan systeemiseen kokonaisaltistukseen (1,6‑kertainen Cmax ja 1,2‑kertainen AUC0-t) ja hyötyosuuteen keuhkoissa (1,8‑kertainen Cmax ja 1,9‑kertainen AUC0-t) inhalaatiosumutteeseen verrattuna.
Glykopyrroniumbromidin farmakokineettiselle profiilille tunnusomaista oli nopea imeytyminen, ja sen huippupitoisuus plasmassa saavutettiin 10 minuutissa annoksen ottamisen jälkeen sekä inhalaatiojauhetta että inhalaatiosumutetta käytettäessä. Inhalaatiojauhe ja inhalaatiosumute johtivat samankaltaiseen systeemiseen kokonaisaltistukseen, mutta inhalaatiojauhetta käytettäessä suurin pitoisuus oli 2,2‑kertainen inhalaatiosumutteeseen verrattuna. Inhalaatiojauhetta käytettäessä hyötyosuus keuhkoissa oli suurempi (2,9‑kertainen Cmax ja 1,2‑kertainen AUC0-t).
Munuaisten vajaatoiminnan vaikutus
Lievä tai vaikea munuaisten vajaatoiminta ei vaikuttanut beklometasonidipropionaatin, sen metaboliitin beklometasoni‑17‑monopropionaatin eikä formoterolin systeemiseen altistukseen (AUC0‑t). Glykopyrroniumilla ei havaittu olevan vaikutusta potilaissa, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta. Potilailla, joilla oli vaikea-asteista munuaisten vajaatoimintaa (glomerulusten suodatusnopeus alle 30 ml/min/1,73 m2), havaittiin systeemisen kokonaisaltistuksen nousua enintään 2,5‑kertaiseksi johtuen virtsaan erittyneen määrän merkittävästä vähentymisestä (glykopyrroniumin munuaispuhdistuma pieneni noin 90 %). Farmakokineettista mallia käyttäen tehdyt simulaatiot osoittivat, että silloinkin kun kovariaatteina oli äärimmäisiä arvoja (potilaan paino alle 40 kg ja samanaikaisesti glomerulusten suodatusnopeus alle 27 ml/min/1,73 m²), altistus Trimbow‑valmisteen vaikuttaville aineille pysyy noin 2,5‑kertaisena verrattuna altistukseen tyypillisellä potilaalla, jolla on mediaaniset kovariaattiarvot.
Beklometasonidipropionaatti
Beklometasonidipropionaatti on aihiolääke, jonka affiniteetti glukokortikoideja sitoviin reseptoreihin on heikko. Se hydrolysoituu esteraasientsyymien välityksellä aktiiviseksi metaboliitiksi, beklometasoni-17‑monopropionaatiksi, jolla on voimakkaampi paikallinen anti-inflammatorinen vaikutus kuin aihiolääke beklometasonidipropionaatilla.
Imeytyminen, jakautuminen ja biotransformaatio
Inhaloitu beklometasonidipropionaatti imeytyy nopeasti keuhkoista. Ennen imeytymistä se muuntuu useimmissa kudoksissa esiintyvän esteraasientsyymin välityksellä laajasti aktiiviseksi metaboliitiksi, beklometasoni-17‑monopropionaatiksi. Aktiivisen metaboliitin systeeminen hyötyosuus on seurausta imeytymisestä keuhkoista (36 %) ja niellyn annoksen imeytymisestä ruoansulatuskanavasta. Niellyn beklometasonidipropionaatin hyötyosuus on kuitenkin merkityksettömän pieni. Presysteemisen beklometasoni‑17‑monopropionaatiksi muuntumisen seurauksena 41 % annoksesta imeytyy aktiivisena metaboliittina. Systeeminen altistus suurenee inhaloidun annoksen suurenemisen myötä lähes lineaarisesti. Inhalaationa annettuna absoluuttinen hyötyosuus nimellisannoksesta on noin 2 % muuttumattomalle beklometasonidipropionaatille ja 62 % beklometasoni‑17‑monopropionaatille. Laskimoon annettuna beklometasonidipropionaatille ja sen aktiiviselle metaboliitille on luonteenomaista suuri puhdistuma plasmasta (beklometasonidipropionaatin puhdistuma 150 l/h ja aktiivisen metaboliitin puhdistuma 120 l/h), beklometasonidipropionaatin pieni jakautumistilavuus (20 l) vakaassa tilassa ja aktiivisen metaboliitin suurempi jakautumistilavuus (424 l) kudoksiin. Sitoutuminen plasman proteiineihin on kohtalaisen voimakasta.
Eliminaatio
Beklometasonidipropionaatin pääasiallinen eliminaatioreitti on erittyminen polaarisina metaboliitteina ulosteisiin. Beklometasonidipropionaatin ja sen metaboliittien eliminoituminen munuaisten kautta on hyvin vähäistä. Beklometasodinipropionaatin terminaalisen eliminaation puoliintumisaika on 0,5 tuntia ja beklometasoni‑17‑monopropionaatin 2,7 tuntia.
Maksan vajaatoimintaa sairastavat potilaat
Beklometasonidipropionaatin farmakokinetiikkaa maksan vajaatoimintaa sairastavilla potilailla ei ole tutkittu. Koska beklometasonidipropionaatti kuitenkin metaboloituu suolistonesteissä, seerumissa, keuhkoissa ja maksassa esiintyvien esteraasientsyymien välityksellä hyvin nopeasti polaarisemmiksi aineenvaihduntatuotteiksi, beklometasoni‑21‑monopropionaatiksi, beklometasoni‑17‑monopropionaatiksi ja beklometasoniksi, maksan vajaatoiminnalla ei odoteta olevan beklometasonidipropionaatin farmakokinetiikkaa ja turvallisuusprofiilia muuttavia vaikutuksia.
Formoteroli
Imeytyminen ja jakautuminen
Inhalaationa otettu formoteroli imeytyy sekä keuhkoista että ruoansulatuskanavasta. Inhalaationa annossumuttimella otetun annoksen jälkeen niellyn lääkkeen osuus on 60–90 %. Vähintään 65 % niellystä osuudesta imeytyy ruoansulatuskanavasta. Muuttumattoman vaikuttavan aineen huippupitoisuus plasmassa saavutetaan 0,5‑1 tuntia suun kautta annon jälkeen. Formoterolista sitoutuu plasman proteiineihin 61–64 %, josta 34 % sitoutuu albumiiniin. Sitoutuminen ei saturoitunut hoitoannoksista saatavien pitoisuuksien yhteydessä. Suun kautta annettuna eliminaation puoliintumisajaksi on määritelty 2–3 tuntia. Formoterolin imeytyminen on lineaarista, kun inhalaationa otettu formoteroliannos on 12‑96 mikrogrammaa.
Biotransformaatio
Formoteroli metaboloituu laajasti, ja tärkein metaboliareitti on suora konjugoituminen fenolihydroksyyliryhmän avulla. Glukuronidihappokonjugaatti on inaktiivinen. Toinen tärkeä metaboliareitti on O-demetylaatio, jota seuraa fenoli‑2'‑hydroksyyliryhmän konjugoituminen. Sytokromi P450:n isoentsyymit CYP2D6, CYP2C19 ja CYP2C9 osallistuvat formoterolin O‑demetylaatioon. Maksa vaikuttaa olevan pääasiallinen metaboliareitti. Formoteroli ei estä CYP450‑entsyymejä hoidon kannalta merkityksellisillä pitoisuuksilla.
Eliminaatio
Jauheinhalaattorista inhaloidun formoterolikerta-annoksen jälkeen kumulatiivinen erittyminen virtsaan suureni lineaarisesti annoksilla 12–96 mikrogrammaa. Keskimäärin formoteroliannoksesta erittyi muuttumattomana 8 % ja kokonaisuudessaan 25 %. Plasmassa esiintyvien pitoisuuksien mittaukset osoittivat, että 12 terveen vapaaehtoisen otettua inhalaationa 120 mikrogramman kerta-annoksen, keskimääräinen eliminaation puoliintumisaika oli 10 tuntia. Virtsaan erittyneestä muuttumattomasta vaikuttavasta aineesta noin 40 % oli (R,R)-enantiomeeria ja noin 60 % (S,S)-enantiomeeria. Näiden kahden enantiomeerin suhteellinen osuus pysyi muuttumattomana tutkitulla annosalueella eikä toisen enantiomeerin suuremmasta suhteellisesta kumuloitumisesta toistuvan annon jälkeen ollut näyttöä. Kun valmistetta annettiin terveille vapaaehtoisille suun kautta (40‑80 mikrogrammaa), annoksesta 6‑10 % havaittiin virtsassa muuttumattomana aineena, ja enintään 8 % annoksesta havaittiin glukuronidimuodossa. Yhteensä 67 % suun kautta annetusta formoteroliannoksesta erittyy virtsaan (pääasiassa metaboliitteina) ja loput ulosteisiin. Formoterolin munuaispuhdistuma on 150 ml/min.
Maksan vajaatoimintaa sairastavat potilaat
Formoterolin farmakokinetiikkaa ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla. Formoteroli eliminoituu kuitenkin pääasiassa maksametabolian kautta, joten vaikea-asteista maksakirroosia sairastavien potilaiden altistuksen oletetaan olevan suurempi.
Glykopyrronium
Imeytyminen ja jakautuminen
Glykopyrroniumilla on kvaternaarinen ammoniumrakenne, mikä rajoittaa sen kulkua biologisten kalvojen läpi ja saa aikaan hitaan, vaihtelevan ja epätäydellisen imeytymisen maha-suolikanavasta. Inhalaation jälkeen glykopyrroniumin hyötyosuus keuhkoissa oli 10,5 % (kun samaan aikaan nieltiin aktiivihiiltä) ja absoluuttinen hyötyosuus 12,8 % (ilman aktiivihiilen nauttimista), mikä vahvistaa niukan imeytymisen maha-suolikanavasta ja osoittaa, että yli 80 % glykopyrroniumin systeemisestä altistuksesta aiheutui imeytymisestä keuhkoista. Kun keuhkoahtaumatautipotilaat inhaloivat glykopyrroniumia paineistetulla annossumuttimella toistuvasti kahdesti vuorokaudessa annosten suuruuden ollessa 12,5–50 mikrogrammaa, glykopyrroniumin farmakokinetiikka oli lineaarinen ja siinä havaittiin vain vähän systeemistä kumuloitumista vakaassa tilassa (keskimääräinen kumulaatiosuhde 2,2–2,5).
Inhaloidun glykopyrroniumin näennäinen jakautumistilavuus (Vz) suureni verrattuna laskimoon annettuun infuusioon (6 420 l vs. 323 l), mikä kuvastaa hitaampaa eliminaatiota inhalaation jälkeen.
Biotransformaatio
Glykopyrroniumin metaboliareitti in vitro (ihmisten, koirien, rottien, hiirten ja kanien maksan mikrosomit ja hepatosyytit) oli samanlainen eri lajeilla, ja pääasiallinen metabolinen reaktio oli fenyyli- tai syklopentyylirenkaiden hydroksylaatio. Tutkimuksissa havaittiin, että CYP2D6 oli ainoa glykopyrroniumin metaboliasta vastannut entsyymi.
Eliminaatio
Glykopyrroniumin keskimääräinen eliminaation puoliintumisaika terveillä vapaaehtoisilla oli noin 6 tuntia laskimonsisäisen injektion jälkeen, kun keuhkoahtaumatautipotilailla se oli 5–12 tuntia vakaassa tilassa. Sen jälkeen, kun glykopyrroniumin kerta-annos oli annettu laskimoon injektiona, 40 % annoksesta erittyi virtsaan 24 tunnin aikana. Keuhkoahtaumatautipotilailla, jotka saivat inhaloitavaa kortikosteroidia toistuvasti kahdesti vuorokaudessa, virtsaan erittyneen annoksen osuus oli 13,0–14,5 % vakaassa tilassa. Keskimääräinen puhdistuma munuaisissa oli kaikilla testatuilla annoksilla samanlainen sekä kerta-annoksena otetun että toistuvan inhalaation jälkeen (281-396 ml/min).
Prekliiniset tiedot turvallisuudesta
Farmakologinen turvallisuus
Inhalaatiotutkimuksessa, joka tehtiin koirilla telemetrian avulla, Trimbow-valmisteen akuuttien vaikutusten pääasiallinen kohde-elinjärjestelmä oli sydän ja verisuonisto (sydämensykkeen nousu, verenpaineen lasku, EKG:n muutokset suuremmilla annoksilla); nämä vaikutukset liittyvät luultavasti pääasiassa formoterolin beeta2-adrenergiseen aktiivisuuteen ja glykopyrroniumin antimuskariiniseen aktiivisuuteen. Kolmen lääkeaineen yhdistelmähoidon yliadditiivisista vaikutuksista ei saatu näyttöä verrattaessa lääkkeen yksittäisiin aineosiin.
Toistuvan altistuksen aiheuttama toksisuus
Enintään 13 viikkoa kestäneissä toistuvan altistuksen inhalaatiotutkimuksissa, jotka tehtiin Trimbow-valmistetta käyttäen rotilla ja koirilla, pääasialliset havaitut muutokset olivat immuunijärjestelmään kohdistuneet vaikutukset (luultavasti johtuen beklometasonidipropionaatin ja sen vaikuttavan metaboliitin eli beklometasoni-17-monopropionaatin systeemisistä kortikosteroidivaikutuksista) ja sydämeen ja verisuonistoon kohdistuneet vaikutukset (luultavasti liittyen formoterolin beeta2-adrenergiseen ja glykopyrroniumin antimuskariiniseen aktiivisuuteen). Kolmen lääkeaineen yhdistelmähoidon toksikologinen profiili muistutti yksittäisten vaikuttavien aineosien profiilia, eikä siinä havaittu toksisuuden merkittävää nousua tai odottamattomia löydöksiä.
Lisääntymis- ja kehitystoksisuus
Beklometasonidipropionaatista/beklometasoni-17-monopropionaatista johtuvana pidettiin rotilla havaittua lisääntymistoksisuutta, kuten esimerkiksi hedelmöittymislukujen, hedelmällisyysindeksin ja varhaisen alkionkehityksen muuttujien (alkioiden menettäminen) heikkenemistä, luutumisen viivästymistä ja sisäelinmuutosten lisääntymistä; sen sijaan tokolyyttisiä ja antimuskariinisia vaikutuksia, joiden ajateltiin johtuvan formoterolin beeta2‑adrenergisestä ja glykopyrroniumin antimuskariinisesta aktiivisuudesta, havaittiin tiineillä rotilla tiineyden myöhäisessä vaiheessa ja/tai varhaisessa laktaatiovaiheessa; nämä johtivat poikasten menettämiseen.
Genotoksisuus
Trimbow-valmisteen genotoksisuutta ei ole selvitetty, mutta yksittäisillä vaikuttavilla aineilla ei havaittu perinteisissä tutkimuksissa genotoksisia vaikutuksia.
Karsinogeenisuus
Trimbow-valmisteella ei ole suoritettu karsinogeenisuustutkimuksia. Rotilla tehdyssä inhalaation karsinogeenisuutta selvittäneessä 104 viikon tutkimuksessa ja transgeenisillä Tg‑rasH2-hiirillä tehdyssä oraalisen annon karsinogeenisuutta selvittävässä 26 viikon tutkimuksessa glykopyrroniumbromidilla ei kuitenkaan ilmennyt karsinogeenisiä vaikutuksia. Myöskään rotilla tehdyistä beklometasonidipropionaatin ja formoterolifumaraatin vaikutusta selvittäneistä pitkäkestoisista tutkimuksista julkaistujen tietojen perusteella kliinisesti merkittäviä karsinogeenisia vaikutuksia ei ole.
Farmaseuttiset tiedot
Apuaineet
Laktoosimonohydraatti (saattaa sisältää maitoproteiineja)
Magnesiumstearaatti
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
21 kuukautta.
Pussin avaamisen jälkeen lääkevalmiste on käytettävä 6 viikon kuluessa ja säilytettävä kuivassa paikassa.
Säilytys
Säilytä alle 25 °C.
Säilytä inhalaattori alkuperäispakkauksessa. Herkkä kosteudelle. Poista pussista vasta juuri ennen ensimmäistä käyttökertaa.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TRIMBOW inhalaatiojauhe
88/5/9 mikrog (L:kyllä) 120 annosta (Nexthaler) (73,14 €), 3 x 120 annosta (Nexthaler) (199,36 €)
PF-selosteen tieto
Valkoinen inhalaattori, jossa on harmaa suukappaleen suojus jainhalaatiolaskuri. Inhalaattori koostuu kuoresta, jonka alaosassa on jäljellä olevien inhalaatioiden määrän osoittava laskuri, ja siihen kiinteästi liitetystä suojuksesta. Inhalaatiolaskurin toiminta perustuu suojuksen avaamiseen ja sulkemiseen. Kun suojus avataan, näkyviin tulee suukappale, jonka läpi lääkevalmiste inhaloidaan.
Alaosan kuori ja suukappale on valmistettu akryylinitriilibutadieenistyreenistä, ja suojus on valmistettu polypropeenista.
Inhalaattori on pakattu kuumasaumattuun polyamidi/alumiini/polyeteeni- (PA/Al/PE) tai polyeteeni-tereftalaatti/alumiini/polyeteeni- (PET/Al/PE) pussiin.
Pakkauskoot:
1 inhalaattorin pakkaus, jossa 120 inhalaatiota
Kerrannaispakkaus, jossa 240 inhalaatiota (2 inhalaattoria, joista kumpikin sisältää 120 inhalaatiota)
Kerrannaispakkaus, jossa 360 inhalaatiota (3 inhalaattoria, joista kukin sisältää 120 inhalaatiota)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai lähes valkoinen jauhe valkoisessa inhalaattorissa (NEXThaler).
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TRIMBOW inhalaatiojauhe
88/5/9 mikrog 120 annosta, 3 x 120 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AL09
Valmisteyhteenvedon muuttamispäivämäärä
13.02.2025
Yhteystiedot
Klara Norra Kyrkogata 34
111 22 Stockholm
Sverige
(+46) 8 753 35 20
www.chiesi.fi
infonordic@chiesi.com
