DOPTELET tabletti, kalvopäällysteinen 20 mg
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää avatrombopagimaleaattia vastaten 20 mg avatrombopagia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 120,8 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen
Kliiniset tiedot
Käyttöaiheet
Doptelet on tarkoitettu vaikean trombosytopenian hoitoon aikuispotilaille, joilla on krooninen maksasairaus ja joille suunnitellaan kajoavaa toimenpidettä.
Doptelet on tarkoitettu primaarin kroonisen immuunitrombosytopenian (ITP) hoitoon aikuispotilaille, jotka ovat resistenttejä muille hoidoille (esim. kortikosteroidit, immunoglobuliinit).
Ehto
Hoito on toteutettava verisairauksien hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Annostus
Hoito pitää aloittaa ja toteuttaa hematologisten sairauksien hoitoon perehtyneen lääkärin valvonnassa. Doptelet otetaan aina samaan aikaan vuorokaudesta (esim. aamulla tai illalla) ruoan kanssa, myös silloin kun annos otetaan harvemmin kuin kerran vuorokaudessa.
Krooninen maksasairaus
Määritä trombosyyttimäärä ennen Doptelet‑hoidon antoa ja toimenpidepäivänä trombosyyttimäärän riittävän nousun varmistamiseksi ja sen varmistamiseksi, että trombosyyttimäärä ei nouse odottamattoman paljon kohdissa Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset kuvattujen potilasryhmien kohdalla.
Avatrombopagin suositeltu vuorokausiannos perustuu potilaan trombosyyttimäärään (ks. taulukko 1). Lääkkeen anto aloitetaan 10–13 päivää ennen suunniteltua toimenpidettä. Toimenpide tehdään 5‑8 päivää viimeisen avatrombopagiannoksen jälkeen.
Taulukko 1: Suositeltava avatrombopagin vuorokausiannos
| Trombosyytit (× 109/l) | Annos kerran vuorokaudessa | Hoidon kesto |
| < 40 | 60 mg (3 kpl 20 mg tabletteja) | 5 vrk |
| ≥ 40, < 50 | 40 mg (2 kpl 20 mg tabletteja) | 5 vrk |
Hoidon kesto
Koska tietoa on niukasti saatavilla, avatrombopagia ei saa käyttää pidempään kuin 5 vuorokauden ajan.
Unohtuneet annokset
Jos annos unohtuu, potilaan on otettava se heti kun hän muistaa asian. Kahta annosta ei saa ottaa yhtä aikaa unohtuneen annoksen korvaamiseksi. Seuraava annos otetaan tavanomaiseen aikaan seuraavana päivänä.
Krooninen immuunitrombosytopenia
Käytä pienintä Doptelet-annosta, jolla voidaan saavuttaa ja ylläpitää verenvuotoriskin vähentämiseen tarvittava trombosyyttimäärä ≥ 50 × 109/l. Älä käytä avatrombopagia trombosyyttimäärien normalisoimiseen. Kliinisissä tutkimuksissa trombosyyttimäärät lisääntyivät yleensä 1 viikon kuluessa avatrombopagihoidon aloittamisen jälkeen ja vähenivät 1‑2 viikon kuluessa hoidon lopettamisen jälkeen.
Annos hoito-ohjelman alussa
Suositeltu Doptelet- aloitusannos on 20 mg (1 tabletti) kerran vuorokaudessa ruoan kanssa.
Trombosyyttimäärän tarkkailu ja annoksen muuttaminen
Määritä trombosyyttimäärät hoidon aloittamisen jälkeen vähintään kerran viikossa, kunnes on saavutettu vakaa trombosyyttimäärä ≥ 50 × 109/l - ≤ 150 × 109/l. Ensimmäisten hoitoviikkojen aikana potilaille, jotka saavat avatrombopagia vain yhden tai kaksi kertaa viikossa, on tehtävä trombosyyttimäärän määritys kahdesti viikossa. Myös hoidon aikana tehtävien annosmuutosten jälkeen on tehtävä trombosyyttimäärän määritys kahdesti viikossa.
Koska hoidon ensimmäisten viikkojen aikana on potentiaalinen riski, että trombosyyttimäärät nousevat yli 400 × 109/l, potilaita on tarkkailtava huolellisesti trombosytoosin mahdollisten merkkien ja oireiden varalta. Vakaan trombosyyttimäärän saavuttamisen jälkeen tutki trombosyyttimäärät vähintään kuukausittain. Avatrombopagin käytön lopettamisen jälkeen trombosyyttimäärät on tutkittava kerran viikossa vähintään seuraavien 4 viikon ajan.
Annosmuutokset (ks. taulukko 2 ja taulukko 3) perustuvat trombosyyttivasteeseen. Älä ylitä 40 mg:n (2 tablettia) päivittäistä annosta.
Taulukko 2: Avatrombopagin annoksen muuttaminen potilaille, jolla on primaari immuunitrombosytopenia
| Trombosyytit (× 109/l) | Annoksen muuttaminen tai muu toimenpide |
| < 50 sen jälkeen, kun avatrombopagihoito on kestänyt vähintään 2 viikkoa |
|
| > 150 - ≤ 250 |
|
| > 250 |
|
| < 50 sen jälkeen, kun avatrombopagia on annettu 4 viikon ajan 40 mg kerran vuorokaudessa |
|
| > 250 sen jälkeen, kun avatrombopagia on annettu 2 viikon ajan 20 mg kerran viikossa |
|
Taulukko 3: Avatrombopagin annostasot titrausta varten potilaille, jolla on primaari immuunitrombosytopenia
| Annos≠ | Annostaso |
| 40 mg kerran vuorokaudessa | 6 |
| 40 mg kolmesti viikossa JA 20 mg viikon muina neljänä päivänä | 5 |
| 20 mg kerran vuorokaudessa* | 4 |
| 20 mg kolmesti viikossa | 3 |
| 20 mg kahdesti viikossa TAI 40 mg kerran viikossa | 2 |
| 20 mg kerran viikossa | 1 |
*Aloitushoito kaikille potilaille paitsi niille, jotka käyttävät keskivahvoja tai vahvoja CYP2C9- ja CYP3A4/5-toiminnan kaksoisindusoreja tai keskivahvoja tai vahvoja CYP2C9- ja CYP3A4/5-toiminnan kaksoisestäjiä tai pelkän CYP2C9:n toiminnan keskivahvoja tai vahvoja indusoreja tai estäjiä.
≠ Potilaiden, jotka ottavat avatrombopagia harvemmin kuin kerran vuorokaudessa, on otettava lääkevalmiste johdonmukaisella tavalla viikosta toiseen.
Annostaso 3: Kolmena ei-peräkkäisenä päivänä viikossa, esim. maanantaina, keskiviikkona ja perjantaina
Annostaso 2: Kahtena ei-peräkkäisenä päivänä viikossa, esim. maanantaina ja perjantaina
Annostaso 1: Aina samana viikonpäivänä, esim. maanantaina
Jos annos on unohtunut välistä, potilaan pitää ottaa unohtunut avatrombopagiannos heti muistaessaan sen. Potilaan ei pidä ottaa kahta annosta kerralla korvatakseen unohtuneen annoksen. Seuraava annos on otettava senhetkisen hoito-ohjelman mukaisesti.
Avatrombopagia voidaan antaa muiden ITP-lääkevalmisteiden lisäksi. Annettaessa avatrombopagia yhdessä muiden lääkevalmisteiden kanssa primaarin ITP:n hoitoon trombosyyttimääriä on tarkkailtava, jotta vältetään suositellun vaihteluvälin ulkopuolella olevat trombosyyttimäärät ja voidaan päättää, pitääkö jommankumman lääkevalmisteen annosta pienentää.
Hoidon lopettaminen
Lopeta avatrombopagihoito, jos trombosyyttimäärä ei nouse arvoon ≥ 50 × 109/l, kun hoitoa on annettu 4 viikon ajan maksimiannoksella 40 mg kerran vuorokaudessa. Lopeta Doptelet-hoito, jos trombosyyttimäärä on suurempi kuin 250 × 109/l, kun hoitoa on annettu 2 viikon ajan annoksella 20 mg kerran viikossa.
Samanaikaisesti annettavien keskivahvojen tai vahvojen CYP2C9- ja CYP3A4/5-toiminnan kaksoisindusorien tai -estäjien tai pelkän CYP2C9-toiminnan keskivahvojen tai vahvojen indusorien ja estäjien suositeltu annos potilaille, joilla on krooninen immuunitrombosytopenia.
Suositellut avatrombopagi-aloitusannokset kroonista immuunitrombosytopeniaa sairastaville potilaille, jotka saavat samanaikaisesti muita lääkevalmisteita, on esitetty taulukossa 4.
Taulukko 4: Suositeltu avatrombopagi-aloitusannos kroonista primaaria immuunitrombosytopeniaa sairastaville potilaille riippuen samanaikaisista lääkityksistä
| Samanaikaiset lääkevalmisteet | Suositeltu aloitusannos |
| CYP2C9- ja CYP3A4/5‑toiminnan keskivahvat tai vahvat kaksoisestäjät tai pelkän CYP2C9-toiminnan keskivahvat tai vahvat estäjät (esim. flukonatsoli) | 20 mg (1 tabletti) kolmesti viikossa |
| CYP2C9- ja CYP3A4/5‑toiminnan keskivahvat tai vahvat kaksoisindusorit tai pelkän CYP2C9-toiminnan keskivahvat tai vahvat indusorit (esim. rifampisiini, entsalutamidi) | 40 mg (2 tablettia) kerran vuorokaudessa |
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa 65 vuotta täyttäneiden potilaiden kohdalla (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Avatrombopagi ei eliminoidu munuaisteitse, joten annosta ei tarvitse muuttaa lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavilla. Avatrombopagia ei ole tutkittu vaikeaa munuaisten vajaatoimintaa sairastavilla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on lievä (Child–Pugh‑luokka A) tai keskivaikea (Child–Pugh‑luokka B) maksan vajaatoiminta.
Avatrombopagin turvallisuutta ja tehoa vaikeaa maksan vajaatoimintaa sairastavilla (Child–Pugh‑luokka C, MELD‑pisteet > 24) ei ole varmistettu, koska tietoja on niukasti saatavilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Annosta ei oletettavasti tarvitse muuttaa näillä potilailla. Vaikeaa maksan vajaatoimintaa sairastaville voidaan aloittaa avatrombopagihoito vain, jos sen odotetut hyödyt ylittävät odotetut riskit (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Samanaikaiset sairaudet tai tilat
Koska tietoa on saatavilla vain niukasti tai ei lainkaan, avatrombopagin tehoa ja turvallisuutta ei ole varmistettu aikuispotilailla, joilla on krooninen ITP ja ihmisen immuunikatovirus [HIV], hepatiitti C ‑virus [HCV] tai potilailla, joilla tiedetään olevan jokin seuraavista: systeeminen lupus erythematosus, akuutti hepatiitti, aktiivinen krooninen hepatiitti, kirroosi, lymfoproliferatiivinen sairaus, myeloproliferatiiviset sairaudet, leukemia, myelodysplasia (MDS), samanaikainen maligni sairaus tai merkittävä sydän- ja verisuonisairaus (esim. graduksen III/IV kongestiivinen sydämen vajaatoiminta, eteisvärinä, aiemmin suoritettu sepelvaltimon ohitusleikkaus tai stentti).
Pediatriset potilaat
Avatrombopagin turvallisuutta ja tehoa alle 1 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Saatavissa olevat tiedot vähintään 1 vuoden – alle 18 vuoden ikäisistä pediatrisista potilaista on kuvattu kohdissa Haittavaikutukset ja Farmakodynamiikka.
CYP2C9:n toiminnan menetystä aiheuttavat polymorfismit
Avatrombopagin altistus saattaa suurentua potilailla, joilla on CYP2C9*2- ja CYP2C9*3-alleelien toiminnan menetystä aiheuttavia polymorfismeja. Terveillä tutkittavilla (n = 2), jotka olivat homotsygoottisia näiden mutaatioiden suhteen (hitaasti metaboloivia), oli noin 2‑kertaisesti suurempi altistus verrattuna tutkittaviin, joilla oli villityypin CYP2C9.
Antotapa
Doptelet on tarkoitettu otettavaksi suun kautta, ja tabletit on otettava ruoan kanssa (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Tromboottiset/tromboemboliset tapahtumat
Tromboembolisten tapahtumien riskin tiedetään olevan suurentunut potilailla, joilla on krooninen maksasairaus. Porttilaskimotromboosia on ilmoitettu tavanomaista yleisemmin kroonista maksasairautta sairastavilla potilailla, joiden trombosyyttimäärä oli > 200 × 109/l ja jotka saivat trombopoietiinireseptorin agonistia (ks. kohta Haittavaikutukset). Kroonista immuunitrombosytopeniaa sairastavilla potilailla tromboembolisia tapahtumia (valtimoissa tai laskimoissa) ilmeni 7 prosentilla (9/128) avatrombopagia saaneista potilaista (ks. kohta Haittavaikutukset).
Doptelet‑valmistetta ei ole tutkittu potilailla, joilla on anamneesissa tromboembolisia tapahtumia. Mahdollisesti suurentunut tromboosiriski on otettava huomioon, kun Doptelet‑valmistetta annetaan potilaille, joilla tiedetään olevan tromboembolian riskitekijöitä kuten muun muassa protromboottiset geneettiset tilat (esim. hyytymistekijä V Leiden, protrombiini 20210A, antitrombiinin puutos tai proteiini C:n tai proteiini S:n puutos), hankinnaiset riskitekijät (kuten fosfolipidivasta-aineoireyhtymä), korkea ikä, pitkät immobilisaatiojaksot, maligniteetit, ehkäisyvalmisteet ja hormonikorvaushoito, leikkaus/trauma, liikalihavuus ja tupakointi. Doptelet‑valmistetta ei saa antaa kroonista maksasairautta tai kroonista immuunitrombosytopeniaa sairastavalle potilaalle trombosyyttiarvojen normalisoimiseksi.
QTc-ajan pidentäminen samanaikaisten lääkevalmisteiden avulla
Doptelet ei pidentänyt QT-aikaa kliinisesti merkittävässä määrin altistuksilla, jotka vastasivat 40 mg:n ja 60 mg:n annoksella saavutettuja altistuksia. Kroonista maksasairautta sairastavilla potilailla tehdyistä yhdistetyistä kliinisistä tutkimuksista saatujen tietojen analyysin perusteella ei ole odotettavissa, että suurimmalla suositellulla terapeuttisella annoksella saavutettaisiin > 20 ms:n keskimääräisiä QTc-ajan pidentymisvaikutuksia. Varovaisuutta on kuitenkin noudatettava annettaessa Doptelet‑valmistetta yhdessä keskivahvojen tai vahvojen CYP3A4/5‑ ja CYP2C9‑toiminnan kaksoisestäjien tai keskivahvojen tai vahvojen CYP2C9-toiminnan estäjien kanssa, sillä nämä lääkevalmisteet voivat lisätä avatrombopagin altistuksia. Varovaisuutta on noudatettava myös potilailla, joilla on CYP2C9:n toiminnan menetystä aiheuttavia polymorfismeja, sillä nämä voivat suurentaa avatrombopagin altistusta.
Trombosytopenian uusiutuminen ja verenvuoto hoidon lopettamisen jälkeen kroonista immuunitrombosytopeniaa sairastavilla potilailla
ITP-potilailla trombosytopenia ilmaantuu todennäköisesti uudelleen avatrombopagihoidon lopettamisen jälkeen. Avatrombopagihoidon lopettamisen jälkeen trombosyyttimäärät palautuvat lähtötilanteen arvoihin suurimmalla osalla potilaita 2 viikon kuluessa, mikä lisää verenvuotoriskiä ja voi joissakin tapauksissa johtaa verenvuotoon. Verenvuotoriski on suurentunut, jos avatrombopagihoito keskeytetään antikoagulanttihoidon tai trombosyyttien toimintaa estävän lääkityksen aikana. Avatrombopagihoidon lopettamisen yhteydessä potilaiden tilaa seurataan tarkoin trombosyyttiarvon laskun havaitsemiseksi ja asianmukaista hoitoa annetaan verenvuotojen välttämiseksi. Jos avatrombopagihoito lopetetaan, ITP:n hoito tulisi aloittaa uudelleen voimassa olevien hoitosuositusten mukaisesti. Muuhun lääketieteelliseen hoitoon voi kuulua antikoagulanttihoidon ja/tai trombosyyttien toimintaa estävän lääkityksen lopettaminen, antikoagulaation kumoaminen tai trombosyyttituki.
Lisääntynyt luuytimen retikuliini
Luuytimen retikuliinin lisääntymisen arvellaan johtuvan trombopoietiini (TPO) -reseptorin stimulaatiosta, joka johtaa megakaryosyyttien lisääntymiseen luuytimessä, ja tämä voi puolestaan johtaa sytokiinien vapautumiseen. Morfologiset muutokset perifeerisen veren soluissa voivat olla merkkejä retikuliinin lisääntymisestä, joka voidaan todeta luuydinbiopsian avulla. Solujen morfologiset poikkeavuudet tulisi tutkia perifeerisen veren sivelyvalmisteesta ja tehdä täydelliset verenkuvan määritykset ennen avatrombopagihoitoa ja hoidon aikana.
Jos hoitoteho häviää ja perifeerisen veren sivelyvalmisteessa havaitaan poikkeavuuksia, avatrombopagihoito on keskeytettävä, lääkärin on tutkittava potilas ja harkittava luuydinbiopsiaa, josta tehdään asianmukainen retikuliinivärjäys. Jos aikaisempi luuydinbiopsianäyte on käytettävissä, tehdään vertailu siihen. Jos hoitoteho säilyy mutta perifeerisen veren sivelyvalmisteessa havaitaan poikkeavuuksia, on lääkärin käytettävä asianmukaista kliinistä harkintaa ja harkittava myös luuydinbiopsian ottamista. Myös avatrombopagihoidon ja vaihtoehtoisten ITP:n hoitomuotojen riski-hyötysuhde on arvioitava uudelleen.
Olemassa olevan myelodysplastisen oireyhtymän (MDS) eteneminen
Doptelet-valmisteen tehoa ei turvallisuutta MDS:stä johtuvan trombosytopenian hoidossa ei ole vahvistettu. Doptelet-valmistetta ei saa käyttää MDS:stä johtuvan trombosytopenian hoitoon muutoin kuin kliinisissä tutkimuksissa.
Teoriassa voidaan ajatella, että trombopoietiinireseptorin (TPO-R) agonistit saattavat edistää jo olemassa olevien pahanlaatuisten hematopoieettisten sairauksien, kuten myelodysplastisten oireyhtymien (MDS), etenemistä. TPO-R-agonistit ovat kasvutekijöitä, jotka aktivoivat trombopoieettisen progenitorisolun kasvua ja erilaistumista ja trombosyyttien muodostumista. TPO-R ilmentyy pääasiassa myeloisen linjan solujen pinnassa.
Aikuisten ja iäkkäiden potilaiden ITP-diagnoosi on vahvistettava sulkemalla pois muut kliiniset tilat, joihin liittyy trombosytopeniaa, varsinkin myelodysplastisen oireyhtymän (MDS) diagnoosi on suljettava pois. Luuydinaspiraation ja -biopsian tekemistä on harkittava sairauden ja hoidon aikana, varsinkin jos potilas on yli 60-vuotias tai hänellä on systeemisiä oireita tai poikkeavia löydöksiä, kuten perifeeristen blastisolujen lisääntymistä.
Vaikea maksan vajaatoiminta
Avatrombopagin käytöstä on niukasti tietoa potilailla, joilla on vaikea maksan vajaatoiminta (Child–Pugh‑luokka C, MELD‑pisteet > 24). Avatrombopagia saa käyttää näiden potilaiden hoitoon vain, jos hoidon odotetut hyödyt ylittävät sen odotetut riskit (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Potilaille, joilla on vaikea maksan vajaatoiminta, on järjestettävä kliinisen käytännön mukaisia tukitoimia ja heidän vointiaan on seurattava tiiviisti pahenevan tai alkavan maksaenkefalopatian, askiteksen tai tromboosi‑ tai verenvuototaipumuksen ensimerkkien varalta seuraamalla maksan toimintakokeiden ja hyytymiskokeiden tuloksia ja kuvantamalla tarvittaessa porttilaskimoverenkierto.
Avatrombopagia ennen kajoavaa toimenpidettä käyttävät potilaat, joilla on Child–Pugh‑luokan C maksasairaus, on arvioitava toimenpidepäivänä siltä varalta, että trombosyyttimäärä on suurentunut odottamattoman paljon.
Käyttö kroonista maksasairautta sairastavilla potilailla, joille tehdään kajoava toimenpide
Doptelet‑hoidon tavoitteena on trombosyyttimäärän suurentaminen. Sen hyöty‑riskiprofiili on todennäköisesti samankaltainen sellaisten toimenpiteiden kohdalla, joita ei arvioitu spesifisesti kliinisissä tutkimuksissa. Avatrombopagin tehoa ja turvallisuutta ei kuitenkaan ole varmistettu suurien leikkausten kuten laparotomian, torakotomian, avosydänleikkausten, kraniotomian eikä elinten poistoleikkausten yhteydessä.
Uusintahoito kroonista maksasairautta sairastaville potilaille, joille tehdään kajoava toimenpide
Avatrombopagin käytöstä potilailla, jotka ovat aiemmin altistuneet avatrombopagille, on niukasti tietoa.
Interferonivalmisteiden samanaikainen käyttö
Interferonivalmisteiden tiedetään pienentäneen trombosyyttimäärää. Asia on otettava huomioon, jos avatrombopagia annetaan samanaikaisesti interferonivalmisteiden kanssa.
Laktoosi
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi‑intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi‑imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
P‑gp:n estäjät
Avatrombopagin käyttö samanaikaisesti P‑gp:n estäjien kanssa johti altistuksen muutoksiin, joilla ei ollut kliinistä merkitystä. Annoksen muuttamista ei suositella (ks. kohta Farmakokinetiikka).
CYP3A4/5‑ ja CYP2C9‑toiminnan estäjät
Avatrombopagin käyttö samanaikaisesti keskivahvojen tai vahvojen CYP3A4/5‑ ja CYP2C9‑toiminnan kaksoisestäjien (esim. flukonatsoli) kanssa suurentaa avatrombopagialtistusta. Avatrombopagin käytön samanaikaisesti keskivahvojen tai vahvojen CYP2C9-estäjien kanssa odotetaan suurentavan avatrombopagialtistusta.
Krooninen maksasairaus
Avatrombopagialtistuksen suureneminen ei oletettavasti vaikuta kliinisesti merkittävästi trombosyyttimäärään, sillä hoito kestää 5 vuorokautta. Annoksen muuttamista ei suositella. Nämä potilaat on kuitenkin arvioitava toimenpidepäivänä siltä varalta, että trombosyyttiamäärä suurenee odottamattoman paljon (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Krooninen immuunitrombosytopenia
Pienennä avatrombopagin aloitusannosta, kun valmistetta käytetään samanaikaisesti keskivahvan tai vahvan CYP2C9- ja CYP3A4/5-toiminnan kaksoisestäjän kanssa (ks. taulukko 4 ja kohta Annostus ja antotapa). Aloitusannoksen pienentämistä on harkittava myös niille potilaille, jotka saavat keskivahvaa tai vahvaa CYP2C9-toiminnan estäjää.
Potilailla, joille aloitetaan hoito keskivahvoilla tai vahvoilla CYP2C9- tai CYP3A4/5-toiminnan kaksoisestäjillä tai keskivahvoilla tai vahvoilla CYP2C9-toiminnan estäjillä samanaikaisesti, kun he saavat avatrombopagia, on tarkkailtava trombosyyttimääriä ja muutettava avatrombopagiannosta tarpeen mukaan (ks. taulukko 2, taulukko 3 ja kohta Annostus ja antotapa).
CYP3A4/5‑ ja CYP2C9‑toiminnan indusorit
Keskivahvojen tai vahvojen CYP3A4/5‑ ja CYP2C9‑toiminnan kaksoisindusorien (esim. rifampisiini, entsalutamidi) samanaikainen käyttö pienentää avatrombopagialtistusta ja voi heikentää hoidon vaikutusta trombosyyttimäärään. Avatrombopagin käytön samanaikaisesti keskivahvojen tai vahvojen CYP2C9-toiminnan indusorien kanssa odotetaan pienentävän avatrombopagin altistusta.
Krooninen maksasairaus
Avatrombopagialtistuksen pieneneminen ei oletettavasti vaikuta kliinisesti merkittävästi trombosyyttimäärään, sillä hoito kestää 5 vuorokautta. Annoksen muuttamista ei suositella (ks. kohta Farmakokinetiikka).
Krooninen immuunitrombosytopenia
Suurenna Doptelet-valmisteen suositeltua aloitusannosta, kun valmistetta käytetään samanaikaisesti keskivahvan tai vahvan CYP2C9- ja CYP3A4/5-toiminnan kaksoisindusorin kanssa (ks. taulukko 4 ja kohta Annostus ja antotapa). Aloitusannoksen suurentamista on harkittava myös potilaille, jotka saavat keskivahvaa tai vahvaa CYP2C9-toiminnan indusoria.
Potilailla, joille aloitetaan hoito keskivahvoilla tai vahvoilla CYP2C9- tai CYP3A4/5-toiminnan kaksoisindusoreilla tai keskivahvoilla tai vahvoilla CYP2C9-toiminnan indusoreilla samanaikaisesti, kun he saavat avatrombopagia, on seurattava trombosyyttimääriä ja muutettava annosta tarpeen mukaan (ks. taulukko 2, taulukko 3 ja kohta Annostus ja antotapa).
ITP:n hoidossa käytettävät lääkkeet
Kliinisissä tutkimuksissa avatrombopagia on annettu yhdessä seuraavien ITP:n hoidossa käytettävien lääkkeiden kanssa: kortikosteroidit, danatsoli, dapsoni ja laskimoon annettava immunoglobuliinihoito (IVig). Trombosyyttimääriä on tarkkailtava, kun avatrombopagia annetaan yhdessä muiden ITP-lääkkeiden kanssa, jotta vältettäisiin suositellun vaihteluvälin ulkopuoliset trombosyyttimäärät.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja avatrombopagin käytöstä raskaana oleville naisille. Ei ole tehty riittäviä eläinkokeita lisääntymistoksisuuden selvittämiseksi (ks. kappale Prekliiniset tiedot turvallisuudesta). Doptelet‑valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Avatrombopagin erittymisestä ihmisen rintamaitoon, sen vaikutuksista imetettävään lapseen ja sen vaikutuksista maidoneritykseen ei ole tietoa. Ei tiedetä, erittyykö/erittyvätkö avatrombopagi/metaboliitit ihmisen rintamaitoon. Avatrombopagia esiintyi imettävien rottien maidossa, ks. kohta Prekliiniset tiedot turvallisuudesta. Imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Doptelet‑hoito, ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Avatrombopagin vaikutusta ihmisen hedelmällisyyteen ei ole selvitetty eikä riskejä voida sulkea pois. Eläintutkimuksissa avatrombopagi ei vaikuttanut urosten eikä naaraiden hedelmällisyyteen eikä alkionkehityksen varhaisvaiheisiin rotalla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Doptelet‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Krooninen maksasairaus
Avatrombopagin turvallisuutta arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (ADAPT‑1 ja ADAPT‑2), joissa 430 potilasta, joilla oli krooninen maksasairaus ja trombosytopenia, sai joko avatrombopagia (n = 274) tai lumelääkettä (n = 156) ja joille tehtiin yksi lääkkeen annon jälkeinen turvallisuusarviointi.
Krooninen immuunitrombosytopenia
Avatrombopagin turvallisuutta aikuispotilailla arvioitiin kolmessa kontrolloidussa tutkimuksessa ja yhdessä kontrolloimattomassa tutkimuksessa, joihin otetuilla 161 potilaalla oli krooninen immuunitrombosytopenia. Näistä neljästä tutkimuksesta saaduissa yhdistetyissä turvallisuustiedoissa oli mukana 128 potilasta, jotka altistuivat avatrombopagille keskimäärin 29 viikon pituisen ajan.
Avatrombopagin turvallisuutta pediatrisilla potilailla, jotka olivat iältään ≥ 1 – < 18 vuotta ja joilla oli pitkittynyt tai krooninen trombosytopenia, arvioitiin satunnaistetussa, lumekontrolloidussa tutkimuksessa. Siinä oli 12 viikon pituinen kaksoissokkoutettu päävaihe ja sen jälkeen vapaaehtoinen avoin jatkovaihe, jossa potilailla oli mahdollisuus saada avatrombopagia enintään 2 vuoden ajan. Päävaiheen turvallisuustiedot käsittävät 54 potilasta, jotka altistuivat avatrombopagille 12 viikon (mediaani) ajan. Avatrombopagihoitoa saaneiden pediatristen potilaiden yleinen turvallisuusprofiili oli verrattavissa aikuispotilaiden turvallisuusprofiiliin.
Haittavaikutustaulukko
Haittavaikutukset luetellaan alla haittavaikutustermeittäin ja elinjärjestelmäluokittain sekä esiintymistiheyksien mukaisesti. Esiintymistiheyksien määritelmät ovat seuraavat: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Kroonisen maksasairauden tutkimuspopulaatio
Elinjärjestelmäluokka (MedDRA‑termit*) | Yleinen | Melko harvinainen | Tuntematon |
| Veri ja imukudos | Anemia | ||
| Immuunijärjestelmä | Yliherkkyys | ||
| Verisuonisto | Porttilaskimotromboosi | ||
| Luusto, lihakset ja sidekudos | Luustokipu Lihaskipu | ||
| Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Kuume |
* Medical Dictionary for Regulatory Activities (MedDRA), versio 19.1.
Kroonisen primaarin immuunitrombosytopenian tutkimuspopulaatio
Elinjärjestelmäluokka MedDRA-termit* | Esiintymistiheys | Haittavaikutus |
| Infektiot | Melko harvinainen | Furunkkeli, septinen laskimontukkotulehdus, ylähengitysteiden infektio |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Melko harvinainen | Myelofibroosi |
| Veri ja imukudos | Yleinen | Trombosytopenia, anemia, splenomegalia |
| Melko harvinainen | Leukosytoosi | |
| Immuunijärjestelmä | Tuntematon | Yliherkkyys |
| Aineenvaihdunta ja ravitsemus | Yleinen | Hyperlipidemia, ruokahalun heikkeneminen |
| Melko harvinainen | Dehydraatio, hypertriglyseridemia, ruokahalun lisääntyminen, raudanpuute | |
| Psyykkiset häiriöt | Melko harvinainen | Mielialan vaihtelut |
| Hermosto | Hyvin yleinen | Päänsärky |
| Yleinen | Huimaus, epämukava tunne päässä, migreeni, parestesia | |
| Melko harvinainen | Aivoverisuonitapahtuma, kognitiivinen häiriö, dysgeusia, hypoestesia, tuntohäiriö, ohimenevä aivoverenkiertohäiriö (TIA) | |
| Silmät | Melko harvinainen | Poikkeava tunne silmässä, silmä-ärsytys, silmän kutina, silmän turvotus, lisääntynyt kyynelnesteen eritys, epämukava tunne silmässä, valonarkuus, verkkokalvovaltimon tukkeuma, hämärtynyt näkö, näön heikkeneminen |
| Kuulo ja tasapainoelin | Melko harvinainen | Korvakipu, hyperakuusi |
| Sydän | Melko harvinainen | Sydäninfarkti |
| Verisuonisto | Yleinen | Hypertensio |
| Melko harvinainen | Syvä laskimotromboosi, kaulalaskimon tromboosi, verisuonten supistuminen | |
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Nenäverenvuoto, hengenahdistus |
| Melko harvinainen | Veriyskä, nenän tukkoisuus, keuhkoembolia | |
| Ruoansulatuselimistö | Yleinen | Pahoinvointi, ripuli, oksentelu, ylävatsakipu, ilmavaivat |
| Melko harvinainen | Epämukava tunne vatsassa, vatsan pingotus, alavatsakipu, peräsuolen tai -aukon suonikohjut, ummetus, röyhtäily, gastroesofagiaalinen refluksitauti, glossodynia, peräpukamat, suun parestesia, kielen turpoaminen, kielivaivat | |
| Maksa ja sappi | Melko harvinainen | Porttilaskimotromboosi |
| Iho ja ihonalainen kudos | Yleinen | Ihottuma, akne, petekia, kutina |
| Melko harvinainen | Hiustenlähtö, ihon kuivuminen, mustelma, liikahikoilu, pigmenttihäiriö, kutiseva ihottuma, ihoverenvuoto, ihon ärsytys | |
| Luusto, lihakset ja sidekudos | Yleinen | Nivelkipu, selkäkipu, raajakipu, lihaskipu, muskuloskeletaalinen kipu |
| Melko harvinainen | Nivelsairaus, epämukava tunne raajoissa, lihaskouristukset, lihasheikkous, muskuloskeletaalinen rintakipu | |
| Munuaiset ja virtsatiet | Melko harvinainen | Hematuria |
| Sukupuolielimet ja rinnat | Melko harvinainen | Runsas kuukautisvuoto, nännikipu |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Uupumus |
| Yleinen | Astenia | |
| Melko harvinainen | Epämukava tunne rintakehässä, nälkä, kipu, perifeerinen turvotus | |
| Tutkimukset | Yleinen | Kohonnut verensokeriarvo, kohonnut trombosyyttimäärä**, alentunut verensokeriarvo, kohonneet veren triglyseridiarvot, kohonnut veren laktaattidehydrogenaasiarvo, alentunut trombosyyttimäärä, kohonnut alaniiniaminotransferaasiarvo, kohonnut veren gastriiniarvo |
| Melko harvinainen | Kohonnut asparaattiaminotransferaasiarvo, kohonnut verenpaine, epäsäännöllinen sydämen syke, kohonnut maksaentsyymiarvo |
* Medical Dictionary for Regulatory Activities (MedDRA), versio 19.1.
** Pediatrisilla potilailla tehdyssä kliinisessä tutkimuksessa trombosytoosia raportoitiin yhdellä potilaalla tutkimuksen päävaiheessa ja yhdellä potilaalla tutkimuksen avoimessa jatkovaiheessa.
Valikoitujen haittavaikutusten kuvaus
Tromboemboliset tapahtumat
Trombosytopeniaa ja kroonista maksasairautta sairastaneilla potilailla tehdyissä kliinisissä ADAPT‑1‑ ja ADAPT‑2‑tutkimuksissa todettiin 1 hoidon aikana ilmennyt porttilaskimotromboositapahtuma yhdellä potilaalla (n = 1/274 avatrombopagia saaneista potilaista). Tapahtuma ilmoitettiin 14 päivän kuluttua Doptelet‑hoidon päättymisestä. Tämä haittavaikutus katsottiin ei‑vakavaksi.
Kroonista immuunitrombosytopeniaa sairastavilla aikuispotilailla tehdyissä neljässä kliinisessä tutkimuksessa tromboembolisia tapahtumia havaittiin 7 prosentilla (9/128) potilaista. Ainoa useammalla kuin yhdellä potilaalla esiintynyt tromboembolinen tapahtuma oli aivoverisuonitapahtuma, joka esiintyi 1,6 prosentilla (2/128). Niistä pediatrisista potilaista, jolla oli pitkittynyt tai krooninen immuunitrombosytopenia, tromboembolisia tapahtumia esiintyi 1,4 %:lla (1/73) avatrombopagia saaneista potilaista.
Trombosytopenia hoidon lopettamisen jälkeen kroonista immuunitrombosytopeniaa sairastavilla potilailla
Kroonista immuunitrombosytopeniaa sairastavilla potilailla tehdyissä neljässä yhdistetyssä kliinisessä tutkimuksessa havaittiin trombosyyttimäärien ohimeneviä laskuja lähtötilannetta alempiin arvoihin hoidon lopettamisen jälkeen 8,6 prosentilla (11/128) avatrombopagilla hoidetuista potilaista.
Yliherkkyysreaktiot
Yliherkkyysreaktiot, mukaan lukien kutina, ihottuma, kasvojen turpoaminen ja kielen turpoaminen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista luetellun kansallisen ilmoitusjärjestelmän kautta.
Suomi/Finland
[Finnish]
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
[Swedish]
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Yliannostus
Avatrombopagin yliannokselle ei ole spesifistä vastalääkettä. Jos yliannostus tapahtuu tai sitä epäillään, Doptelet‑valmisteen anto on lopetettava ja trombosyyttiarvoja on seurattava huolellisesti, sillä avatrombopagi suurentaa trombosyyttimäärää annosriippuvaisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Hemostaatit, muut systeemisesti käytettävät hemostaatit, ATC‑koodi: B02BX08
Vaikutusmekanismi
Avatrombopagi on suun kautta otettuna aktiivinen, pienimolekyylinen trombopoietiinin (TPO) reseptorin agonisti, joka stimuloi megakaryosyyttien proliferaatiota ja erilaistumista luuytimen progenitorisoluista ja lisää näin trombosyyttituotantoa. Avatrombopagi ei kilpaile TPO:n kanssa TPO‑reseptoriin sitoutumisesta, ja sillä on TPO:n kanssa additiivinen vaikutus trombosyyttituotantoon.
Kliininen teho ja turvallisuus
Kroonista maksasairautta sairastavilla tehdyt tutkimukset
Avatrombopagin tehoa ja turvallisuutta kroonista maksasairautta sairastavilla aikuispotilailla, joiden trombosyyttimäärä oli ˂ 50 × 109/l ja joille suunniteltiin toimenpidettä, arvioitiin kahdessa tutkimusasetelmaltaan identtisessä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 monikeskustutkimuksessa (ADAPT‑1 ja ADAPT‑2). Molemmissa tutkimuksissa potilaat määrättiin lähtötilanteen trombosyyttimäärän perusteella lähtötilanteen joko pienen trombosyyttiarvon kohorttiin (˂ 40 × 109/l) tai lähtötilanteen suuren trombosyyttiarvon kohorttiin (≥ 40 ja ˂ 50 × 109/l). Tämän jälkeen potilaat satunnaistettiin suhteessa 2:1 saamaan joko avatrombopagia tai lumelääkettä.
Lähtötilanteen pienen trombosyyttimäärän kohortin potilaat saivat 60 mg avatrombopagia tai vastaavaa lumelääkettä kerran vuorokaudessa 5 päivän ajan, kun taas lähtötilanteen suuren trombosyyttimäärän kohortin potilaat saivat 40 mg avatrombopagia tai vastaavaa lumelääkettä kerran vuorokaudessa 5 päivän ajan. Tutkimukseen soveltuville potilaille oli tarkoitus tehdä toimenpide (pienen verenvuotoriskin toimenpide kuten tähystys tai kolonoskopia [60,8 %]; kohtalaisen verenvuotoriskin toimenpide, kuten maksabiopsia tai maksasolusyövän kemoembolisaatio [17,2 %]; tai suuren verenvuotoriskin toimenpide, kuten hammastoimenpide tai radiotaajuusablaatio [22,1 %]) 5–8 päivän kuluttua viimeisestä hoitoannoksesta. Potilaspopulaatiot olivat lähtötilanteen pienen ja suuren trombosyyttimäärän kohorteissa samankaltaiset. Potilaista 66 % oli miehiä ja 35 % naisia, mediaani‑ikä oli 58 vuotta ja 61 % oli valkoihoisia, 34 % aasialaisia ja 3 % mustia. Yhteensä 24,8 % potilaista oli ≥ 65‑vuotiaita, 4,6 % oli ≥ 75‑vuotiaita ja vain 1 potilas (0,2 %) oli ≥ 85‑vuotias. Potilaiden MELD‑pisteet olivat < 10 (37,5 %), 10–14 (46,3 %) ja > 14 – < 24 (16,2 %), ja potilaat kuuluivat CTP‑luokkiin A (56,4 %), B (38,1 %) ja C (5,6 %).
ADAPT‑1-tutkimukseen satunnaistettiin yhteensä 231 potilasta, joista 149 potilasta satunnaistettiin avatrombopagiryhmään ja 82 potilasta lumeryhmään. Lähtötilanteen pienen trombosyyttimäärän kohortissa lähtötilanteen trombosyyttiamäärän keskiarvo oli avatrombopagiryhmässä 31,1 × 109/l ja lumeryhmässä 30,7 × 109/l. Lähtötilanteen suuren trombosyyttimäärän kohortissa lähtötilanteen trombosyyttimäärän keskiarvo oli avatrombopagiryhmässä 44,3 × 109/l ja lumeryhmässä 44,9 × 109/l.
ADAPT‑2-tutkimukseen satunnaistettiin yhteensä 204 potilasta, joista 128 potilasta satunnaistettiin avatrombopagiryhmään ja 76 potilasta lumeryhmään. Lähtötilanteen pienen trombosyyttimäärän kohortissa lähtötilanteen trombosyyttimäärän keskiarvo oli avatrombopagiryhmässä 32,7 × 109/l ja lumeryhmässä 32,5 × 109/l. Lähtötilanteen suuren trombosyyttimäärän kohortissa lähtötilanteen trombosyyttimäärän keskiarvo oli avatrombopagiryhmässä 44,3 × 109/l ja lumeryhmässä 44,5 × 109/l.
Potilaat määriteltiin vasteen saavuttaneiksi, jos he eivät tarvinneet trombosyyttisiirtoa eivätkä mitään varatoimenpidettä verenvuodon hoitoon satunnaistamisen jälkeen ja 7 päivän kuluessa suunnitellusta toimenpiteestä. Tulokset esitetään taulukossa 5.
Taulukko 5: Tehotulokset lähtötilanteen trombosyyttimäärä kohortin ja hoitoryhmän mukaan – ADAPT‑1 ja ADAPT‑2
| Lähtötilanteen pienen trombosyyttimäärän kohortti (< 40 × 109/l) | ||||||||||||
| Ryhmä | ADAPT‑1 | ADAPT‑2 | ||||||||||
Lume (n = 48) | Avatrombo-pagi 60 mg (n = 90) | Lume (n = 43) | Avatrombopagi 60 mg (n = 70) | |||||||||
| Niiden tutkittavien osuus, jotka eivät tarvinneet trombosyyttisiirtoa eivätkä varatoimenpidettä verenvuodon hoitoon | ||||||||||||
Vasteen saavuttaneet 95 % lva | 23 % (11; 35) | 66 % (56; 75) | 35 % (21; 49) | 69 % (58; 79) | ||||||||
| p‑arvob | ˂ 0,0001 | 0,0006 | ||||||||||
| Niiden tutkittavien osuus, joiden trombosyyttimäärä oli toimenpidepäivänä ≥ 50 × 109/l | ||||||||||||
Vasteen saavuttaneet 95 % lva | 4 % (0; 10) | 69 % (59; 79) | 7 % (0; 15) | 67 % (56; 78) | ||||||||
| p‑arvob | ˂ 0,0001 | ˂ 0,0001 | ||||||||||
| Trombosyyttimäärän muutos lähtötilanteesta toimenpidepäivään | ||||||||||||
| Keskiarvo (keskihajonta) × 109/l | 0,8 (6,4) | 32,0 (25,5) | 3,0 (10,0) | 31,3 (24,1) | ||||||||
| Mediaani × 109/l | 0,5 | 28,3 | 0,5 | 28,0 | ||||||||
| p‑arvoc | ˂ 0,0001 | ˂ 0,0001 | ||||||||||
| Lähtötilanteen suuri trombosyyttimäärä (≥ 40 – < 50 × 109/l) | ||||||||||||
| Ryhmä | ADAPT‑1 | ADAPT‑2 | ||||||||||
Lume (n = 34) | Avatrombo-pagi 40 mg (n = 59) | Lume (n = 33) | Avatrombo-pagi 40 mg (n = 58) | |||||||||
| Niiden tutkittavien osuus, jotka eivät tarvinneet trombosyyttisiirtoa eivätkä varatoimenpidettä verenvuodon hoitoon | ||||||||||||
Vasteen saavuttaneet 95 % lva | 38 % (22; 55) | 88 % (80; 96) | 33 % (17; 49) | 88 % (80; 96) | ||||||||
| p‑arvob | ˂ 0,0001 | ˂ 0,0001 | ||||||||||
| Niiden tutkittavien osuus, joiden trombosyyttimäärä oli toimenpidepäivänä ≥ 50 × 109/l | ||||||||||||
Vasteen saavuttaneet 95 % lva | 21 % (7; 34) | 88 % (80; 96) | 39 % (23; 56) | 93 % (87; 100) | ||||||||
| p‑arvob | ˂ 0,0001 | ˂ 0,0001 | ||||||||||
| Trombosyyttimäärän muutos lähtötilanteesta toimenpidepäivään | ||||||||||||
| Keskiarvo (keskihajonta) × 109/l | 1,0 (9,3) | 37,1 (27,4) | 5,9 (14,9) | 44,9 (33,0) | ||||||||
| Mediaani × 109/l | 0,0 | 33,0 | 3,3 | 41,3 | ||||||||
| p‑arvoc | ˂ 0,0001 | ˂ 0,0001 | ||||||||||
| ||||||||||||
Trombosyyttimäärien suureneminen oli mitattavissa molemmissa avatrombopagihoitoryhmissä ajan mittaan. Trombosyyttimäärät alkoivat suurentua päivänä 4 lääkkeen annon jälkeen, saavuttivat huippunsa päivinä 10–13 ja palasivat lähes lähtötasoon päivään 35 mennessä (kuva 1). Trombosyyttimäärän keskiarvo oli päivänä 17 (käynnillä 5) edelleen 50 × 109/l tai enemmän.
Kuva 1: Trombosyyttimäärien keskiarvo (+/‑ keskivirhe) eri päivinä lääkkeen käytön aloittamisen jälkeen, lähtötilanteen trombosyyttimääräkohorttien ja hoitoryhmien mukaan – ADAPT‑1- ja ADAPT‑2-tutkimusten yhdistetyt tiedot
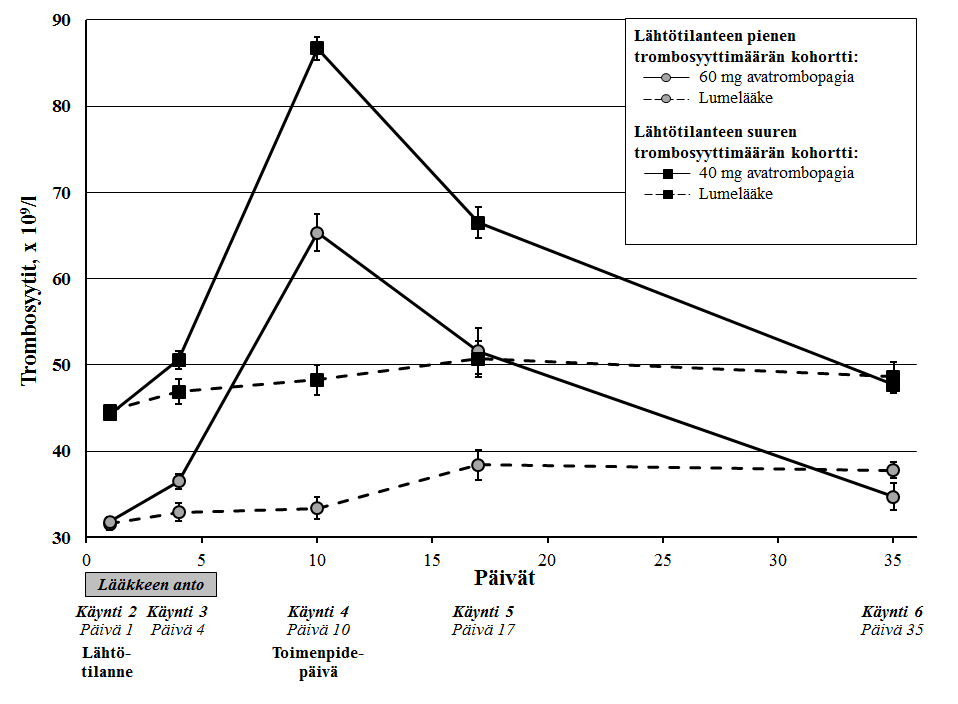
Avatrombopagin teho oli samaa luokkaa vaiheen 3 tutkimusten (ADAPT‑1 ja ADAPT‑2) yhdistetyn potilaspopulaation eri alaryhmissä. Niiden tutkittavien osuus, jotka eivät tarvinneet trombosyyttisiirtoa eivätkä varatoimenpidettä verenvuodon hoitoon, oli yleisesti ottaen samaa luokkaa eri alaryhmissä.
Kroonista immuunitrombosytopeniaa sairastavilla tehdyt tutkimukset
Doptelet-valmisteen tehoa kroonista immuunitrombosytopeniaa sairastavilla aikuispotilailla arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen 3 monikeskustutkimuksessa (tutkimus 302). Potilaat olivat aiemmin saaneet yhtä tai useampaa hoitoa krooniseen immuunitrombosytopeniaan ja heidän trombosyyttimääränsä seulonnassa ja lähtötilanteessa olivat keskimäärin < 30 × 109/l. Potilaat stratifioitiin sentraalisesti splenektomiastatuksen, lähtötilanteen trombosyyttimäärän (≤ 15 tai > 15 × 109/l) sekä kroonisen immuunitrombosytopenian hoitoon samanaikaisesti käytettyjen lääkevalmisteiden mukaan ja satunnaistettiin sitten (2:1) saamaan joko avatrombopagia tai lumelääkettä 6 kuukauden ajan. Potilaat saivat aloitusannoksena avatrombopagia 20 mg kerran vuorokaudessa ja sen jälkeen trombosyyttivasteen perusteella titrattuja annoksia.
Lisäksi potilaat pystyivät vähentämään muiden samanaikaisten ITP-lääkkeiden käyttöä, ja he saivat varahoitoja paikallisten hoitosuositusten mukaisesti. Yli puolet kaikista potilaista kummassakin hoitoryhmässä oli saanut aikaisemmin vähintään kolmea ITP-hoitoa, ja perna oli poistettu 29 prosentilta lumelääkepotilaista ja 34 prosentilta avatrombopagipotilaista.
Neljäkymmentäyhdeksän potilasta satunnaistettiin, 32 avatrombopagiryhmään ja 17 lumelääkeryhmään. Molemmissa ryhmissä keskimääräiset [SD] trombosyyttimäärät olivat samanlaiset (14,1 [8,6] × 109/l ja vastaavasti 12,7 [7,8] × 109/l. Mediaani-ikä oli 44 vuotta, 63 % oli naisia ja 94 % oli valkoihoisia, 4 % aasialaisia ja 2 % mustia. Yhteensä 8,2 % potilaista oli ≥ 65‑vuotiaita, eikä yksikään potilaista ollut ≥ 75-vuotias. Altistuksen mediaanikesto avatrombopagilla hoidetuilla potilailla oli 26 viikkoa ja lumelääkkeellä hoidetuilla potilailla 6 viikkoa. Tehon ensisijainen lopputulos oli niiden viikkojen kumulatiivinen lukumäärä, jolloin trombosyyttimäärä oli ≥ 50 × 109/l kuusi (6) kuukautta kestäneen hoitojakson aikana ilman varahoitoon turvautumista. Avatrombopagilla hoidetuilla potilailla trombosyyttimäärät pysyivät pitempään arvossa ≥ 50 × 109/l ilman varahoitoon turvautumista kuin lumelääkettä saaneilla (mediaani 12,4 [0; 25] vs. vastaavasti 0 [0; 2] viikkoa, p < 0,0001) (ks. taulukko 6).
Taulukko 6: Trombosiittivasteviikkojen kumulatiivinen lukumäärä – tutkimus 302
| Tehon ensisijainen lopputulos | Avatrombopagi(n = 32) | Lumelääke (n = 17) |
| Trombosiittivasteviikkojen kumulatiivinen lukumäärä* | ||
| Keskiarvo (SD) | 12,0 (8,75) | 0,1 (0,49) |
| Mediaani | 12,4 | 0,0 |
| Min., maks. | 0; 25 | 0; 2 |
| Wilcoxonin järjestyssummatestin p-arvo | < 0,0001 | |
*Trombosyyttivasteviikkojen kumulatiivinen lukumäärä määriteltiin seuraavasti: niiden viikkojen kokonaismäärä, jolloin trombosyyttimäärä oli ≥ 50 × 109/l kuusi (6) kuukautta kestäneen hoitojakson aikana ilman turvautumista varahoitoon.
Lisäksi suuremmalla osuudella avatrombopagia saaneen hoitoryhmän potilaista trombosyyttimäärät olivat ≥ 50 × 109/l Päivänä 8 verrattuna lumelääkeryhmään (21/32; 66 % vs. vastaavasti 0/17; 0,0 %, 95 %:n CI (47; 86); p < 0,0001). Vaikka vain harvat potilaat saivat samanaikaisia ITP-lääkevalmisteita lähtötilanteessa, ITP-lääkevalmisteiden käyttö oli vähentynyt lähtötilanteesta avatrombopagia saaneen hoitoryhmän potilaista suuremmalla osuudella kuin lumelääkeryhmässä (5/15; 33 % vs. vastaavasti 0/7; 0,0 %; 95 %:n CI (12; 62); p = 0,1348).
Pitkittynyttä tai kroonista immuunitrombosytopeniaa koskenut tutkimus pediatrisilla potilailla
Doptelet-valmisteen tehoa arvioitiin satunnaistetussa, kaksoissokkoutetussa ja lumekontrolloidussa tutkimuksessa ≥ 1 – < 18 vuoden ikäisillä pediatrisilla potilailla, joilla oli pitkittynyt tai krooninen immuunitrombosytopenia. 12 viikon pituista satunnaistettua hoitovaihetta (päävaihe) seurasi vapaaehtoinen jatkovaihe, jossa kaikki potilaat saivat avatrombopagia.
Potilailla täytyi olla ≥ 6 kuukautta aikaisemmin vahvistettu primaarin immuunitrombosytopenian diagnoosi ja riittämätön vaste vähintään yhteen aiempaan hoitoon. Tutkimukseen otettiin 75 potilasta, jotka satunnaistettiin suhteessa 3:1 saamaan avatrombopagia tai lumelääkettä kolmessa ikäkohortissa: ≥ 12 – < 18 vuotta (n = 29), ≥ 6 – < 12 vuotta (n = 28) ja ≥ 1 – < 6 vuotta (n = 18).
Ensisijainen päätetapahtuma oli pitkäkestoinen trombosyyttivaste, joka määriteltiin niiden potilaiden osuudeksi, joiden trombosyyttimäärä oli ≥ 50 × 109/l vähintään kuudessa kahdeksasta viikoittaisesta mittauksesta tutkimuksen päävaiheen 12 viikon pituisen hoitojakson viimeisten 8 viikon aikana ilman varahoitoa.
Vaihtoehtoinen ensisijainen päätetapahtuma (joka analysoitiin toissijaisena päätetapahtumana) oli trombosyyttivaste, joka määriteltiin niiden tutkittavien osuudeksi, joiden trombosyyttimäärä oli ≥ 50 × 109/l vähintään kahdessa peräkkäisessä mittauksessa tutkimuksen päävaiheessa ilman varahoitoa.
Taulukko 7: Pitkäkestoinen trombosyyttivaste ja trombosyyttivaste – vaiheen 3 tutkimus pediatrisilla potilailla, joilla on pitkittynyt tai krooninen immuunitrombosytopenia
| Päätetapahtuma | Avatrombopagi (n = 54) | Lumelääke (n = 21) |
| Pitkäkestoinen trombosyyttivaste, n% (ensisijainen) | ||
| Kyllä | 15 (27,8) | 0 |
| Ei | 39 (72,2) | 21 (100,0) |
| Osuuksien ero (avatrombopagi – lumelääke) (95 % lv) | 27,8 (15,8; 39,7) | |
| Cochran–Mantel–Haenszel (avatrombopagi vs. lumelääke) p-arvo | p = 0,0077a | |
| Trombosyyttivaste, n% (vaihtoehtoinen ensisijainen) | ||
| Kyllä | 44 (81,5) | 0 |
| Ei | 10 (18,5) | 21 (100,0) |
| Osuuksien ero (avatrombopagi – lumelääke) (95 % lv) | 81,5 (71,1; 91,8) | |
| Cochran–Mantel–Haenszel (avatrombopagi vs. lumelääke) p-arvo | p < 0,0001a | |
a Tarkoittaa p-arvoa, joka saatiin Fisherin eksaktilla testillä Cochran–Mantel–Haenszel-testin sijasta, koska ositteessa oli vähän vasteen saaneita.
Huom.: Cochran–Mantel–Haenszel-testi vakioitiin ikäryhmän ja lähtötilanteen trombosyyttimäärän suhteen.
Varalääkitystä tarvinneiden tutkittavien osuus oli avatrombopagiryhmässä (7,4 %) merkitsevästi pienempi (p = 0,0008) kuin lumeryhmässä (42,9 %).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Doptelet‑valmisteen käytöstä maksasairaudesta johtuvan trombosytopenian hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Kun avatrombopagia annettiin suun kautta, plasman pitoisuus‑aikaprofiileissa todettiin lyhyt aikaviive (0,5–0,75 h) ja altistushuippu saavutettiin 6–8 tunnin kuluttua annoksesta. Terveillä vapaaehtoisilla tehdyissä farmakokinetiikan tutkimuksissa, joissa annettiin toistuvia annoksia, vakaa tila saavutettiin lääkkeen antopäivään 5 mennessä. Avoimissa, satunnaistetuissa, vaihtovuoroisissa ja tutkimusasetelmaltaan identtisissä kliinisissä tutkimuksissa arvioitiin runsasrasvaisen ja vähärasvaisen ruoan vaikutuksia avatrombopagin biologiseen hyötyosuuteen ja farmakokinetiikan vaihteluun terveillä vapaaehtoisilla. Avatrombopagin anto kummankaan ruokatyypin kanssa ei vaikuttanut kliinisesti merkittävästi avatrombopagialtistuksen nopeuteen (Cmax) eikä laajuuteen (AUC). Avatrombopagin AUC‑ ja Cmax‑arvojen vaihtelu eri tutkittavien välillä ja saman tutkittavan kohdalla väheni kuitenkin merkittävästi (noin 50 %), kun avatrombopagi otettiin ruoan kanssa (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset).
Yhteisvaikutukset ruoan kanssa
Avatrombopagin anto yhtä aikaa joko runsasrasvaisen tai vähärasvaisen aterian kanssa ei vaikuttanut kliinisesti merkittävästi avatrombopagin imeytymisnopeuteen eikä imeytymisprosenttiin. Avatrombopagin anto runsasrasvaisen tai vähärasvaisen aterian kanssa kuitenkin vähensi avatrombopagin farmakokineettisten muuttujien vaihtelua eri tutkittavien välillä ja saman tutkittavan kohdalla noin 50 %. On siis suositeltavaa antaa avatrombopagi ruoan kanssa (ks. kohta Annostus ja antotapa).
Jakautuminen
In vitro ‑tutkimukset viittaavat siihen, että avatrombopagi sitoutuu laajalti (> 96‑prosenttisesti) ihmisen plasman proteiineihin. Populaatiofarmakokinetiikan analyysin mukaan avatrombopagin näennäinen jakautumistilavuus potilailla, joilla on trombosytopenia ja krooninen maksasairaus, on noin 180 l ja näennäinen jakautumistilavuus potilailla, joilla on krooninen immuunitrombosytopenia, on noin 235 l. Tämä viittaa siihen, että avatrombopagi jakautuu laajalti elimistöön.
Biotransformaatio
Avatrombopagin oksidatiivista metaboliaa välittävät lähinnä CYP2C9 ja CYP3A4. Avatrombopagi on P‑glykoproteiinin (P‑gp) välityksellä tapahtuvan kuljetuksen substraatti. Avatrombopagin anto yhdessä vahvan P‑gp:n estäjän kanssa ei kuitenkaan oletettavasti vaikuta trombosyyttiarvon suurenemiseen kliinisesti merkittävällä tavalla. In vitro ‑tutkimusten perusteella muut kuljettajaproteiinit (OATP1B1, OATP1B3, OCT2, OAT1 ja OAT3) eivät oletettavasti osallistu merkittävästi avatrombopagin kulkeutumiseen.
Taulukko 8: Lääkkeiden yhteisvaikutukset: Avatrombopagin farmakokinetiikan muutokset eri lääkevalmisteiden samanaikaisen käytön yhteydessä
| Samanaikaisesti annettava lääkevalmiste* | Avatrombopagin geometristen keskiarvojen suhde (GMR) [90 % lv] samanaikaisesti annettavaa lääkettä käytettäessä / ilman samanaikaisesti annettavaa lääkettä (ei vaikutusta = 1,00) | |
| AUC0‑inf | Cmax | |
| Vahva CYP3A:n estäjä | ||
| Itrakonatsoli | 1,37 (1,10; 1,72) | 1,07 (0,86; 1,35) |
| Keskivahva CYP3A:n ja CYP2C9:n estäjä | ||
| Flukonatsoli | 2,16 (1,71; 2,72) | 1,17 (0,96; 1,42) |
| Keskivahva CYP2C9:n indusori ja vahva CYP3A:n indusori | ||
| Rifampisiini | 0,57 (0,47; 0,62) | 1,04 (0,88; 1,23) |
| P‑gp:n estäjä | ||
| Siklosporiini | 0,83 (0,65; 1,04) | 0,66 (0,54; 0,82) |
| P‑gp:n estäjä ja keskivahva CYP3A:n estäjä | ||
| Verapamiili | 1,61 (1,21; 2,15) | 1,26 (0,96; 1,66) |
* vakaassa tilassa; poikkeuksena siklosporiini, joka annettiin kerta‑annoksena
Avatrombopagin vaikutus
Avatrombopagi ei estä entsyymejä CYP1A, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ja CYP3A, ei indusoi entsyymejä CYP1A, CYP2B6, CYP2C ja CYP3A ja indusoi heikosti entsyymejä CYP2C8 ja CYP2C9 in vitro.
Avatrombopagi estää orgaanisten anionien kuljettajien (OAT) 1 ja 3 toimintaa ja rintasyöpäresistenssiproteiinin (BCRP) toimintaa, mutta se ei estä orgaanisten anionien kuljettajapolypeptidin (OATP) 1B1 ja 1B3 toimintaa eikä orgaanisten kationien kuljettajaproteiinin (OCT) 2 toimintaa in vitro.
Kuljettajaproteiinien vaikutus
Avatrombopagi on P‑glykoproteiinin (P‑gp) välittämän kuljetuksen substraatti (ks. taulukko 8). Avatrombopagi ei ole OATP1B1‑, OATP1B3‑, OCT2‑, OAT1‑ eikä OAT3‑kuljettajien substraatti.
Eliminaatio
Avatrombopagin tärkein eliminaatioreitti on erittyminen ulosteeseen. Kun terveille vapaaehtoisille miehille annettiin kerta‑annoksena 20 mg 14C‑avatrombopagia, 88 % annoksesta erittyi ulosteeseen ja 6 % virtsaan. Ulosteeseen erittyneestä lääkeperäisestä materiaalista (88 % annoksesta) 77 % oli kanta‑aineen (34 %) tai 4‑hydroksimetaboliitin (44 %) muodossa. Avatrombopagin metaboliitteja ei todettu plasmassa.
Avatrombopagin eliminaation puoliintumisajan keskiarvo plasmassa (%CV) on noin 19 tuntia (19 %). Avatrombopagin puhdistuman keskiarvo (%CV) on arviolta 6,9 l/h (29 %).
Lineaarisuus
Avatrombopagin farmakokinetiikka oli suhteessa annokseen, kun tutkittaville annettiin kerta‑annoksia, jotka vaihtelivat 10 mg:sta (0,5 kertaa pienin hyväksytty annos) 80 mg:aan (1,3 kertaa suurin hyväksytty annos).
Erityisryhmät
Iäkkäät
Populaatiofarmakokinetiikan analyysi plasman avatrombopagipitoisuuksista kliinisten tutkimusten terveillä tutkittavilla ja tutkittavilla, joilla oli kroonisesta maksasairaudesta johtuva trombosytopenia, tai terveillä tutkittavilla ja ITP:tä sairastavilla tutkittavilla, viittasi siihen, että ikä ei vaikuta avatrombopagialtistukseen (ks. kohta Annostus ja antotapa). Kyseisissä kliinisissä tutkimuksissa 11 % (84/787) ja vastaavasti 4 % (24/577) tutkimuspopulaatiosta oli iältään ≥ 65‑vuotiaita.
Etniset ryhmät
Populaatiofarmakokinetiikan analyysi plasman avatrombopagipitoisuuksista kliinisten tutkimusten terveillä tutkittavilla, tutkittavilla, joilla oli kroonisesta maksasairaudesta johtuva trombosytopenia, ja ITP:tä sairastavilla tutkittavilla, viittasi siihen, että avatrombopagialtistus oli tutkituissa etnisissä ryhmissä samaa luokkaa.
Munuaisten vajaatoiminta
Ihmistutkimukset osoittivat, että munuaisteitse tapahtuva eliminaatio ei ole merkittävä eliminaatioreitti muuttumattoman avatrombopagin eikä sen metaboliitin kohdalla. Avatrombopagin tunnetun metabolisen profiilin perusteella ja ottaen huomioon, että vain 6 % annoksesta erittyy virtsaan, vaikuttaa hyvin epätodennäköiseltä, että munuaisten vajaatoiminta vaikuttaisi avatrombopagin farmakokinetiikkaan (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Avatrombopagin populaatiofarmakokinetiikan analyysi terveillä tutkittavilla ja tutkittavilla, joilla oli kroonisesta maksasairaudesta johtuva trombosytopenia, viittasi siihen, että altistus on samaa luokkaa terveillä tutkittavilla ja tutkittavilla, joilla on lievä tai keskivaikea munuaisten vajaatoiminta (CrCL ≥ 30 ml/min, Cockcroft–Gault).
Avatrombopagin farmakokinetiikkaa ja farmakodynamiikkaa ei ole tutkittu potilailla, joilla on vaikea munuaisten vajaatoiminta (CrCL < 30 ml/min, Cockcroft–Gault), ei myöskään hemodialyysihoitoa tarvitsevilla potilailla.
Maksan vajaatoiminta
Populaatiofarmakokinetiikan analyysissä arvioitiin plasman avatrombopagialtistusta potilailla, joilla oli MELD‑pistemäärän (Model for End‑Stage Liver Disease) ja Child–Turcotte–Pugh‑pistemäärän perusteella lievä tai keskivaikea maksan vajaatoiminta. Avatrombopagialtistuksissa ei todettu kliinisesti merkittäviä eroja, kun terveitä tutkittavia verrattiin potilaisiin, joiden Child–Turcotte–Pugh‑pistemäärien vaihteluväli oli 5–12 ja MELD‑pistemäärien vaihteluväli 4–23. Vaiheen 3 avaintutkimuksissa plasman avatrombopagialtistus oli verrattavissa potilailla, joilla oli virushepatiitista johtuva krooninen maksasairaus (n = 242), ei‑alkoholiperäinen steatohepatiitti (n = 45) ja alkoholiperäinen maksasairaus (n = 49). Näiden ryhmien altistustiedot olivat myös verrattavissa altistukseen terveillä tutkittavilla (n = 391). Saatavilla olevat tiedot ovat niukat, joten avatrombopagia tulee käyttää Child–Pugh‑luokan C potilaiden hoitoon vain, jos sen odotetut hyödyt ylittävät sen odotetut riskit.
Prekliiniset tiedot turvallisuudesta
Avatrombopagi ei stimuloi trombosyyttituotantoa hiirellä, rotalla, apinalla eikä koiralla ainutlaatuisen TPO‑reseptorispesifisyyden vuoksi. Näiden eläintutkimusten tietojen perusteella ei siis pystytä täysin mallintamaan mahdollisia haittavaikutuksia, jotka liittyvät avatrombopagin aiheuttamaan trombosyyttiarvojen suurenemiseen ihmisellä.
Haittoja on koe‑eläimillä todettu vain silloin, kun on käytetty altistusta, joka ylittää suurimman ihmisille käytettävän annostuksen niin huomattavasti, että asialla on kliinisen käytön kannalta vain vähäinen merkitys. Toistuvilla annoksilla toteutetuissa avaintutkimuksissa tärkein toksisuus kohdistui mahalaukkuun suuria annoksia käytettäessä. Turvallisuusmarginaalit olivat riittävät, kun käytettyjä annoksia verrataan ihmisen suurimman suositusannoksen tuottamaan altistukseen. Muutokset olivat korjautuvia myös pitkän aikavälin toksisuutta arvioineissa tutkimuksissa.
Karsinogeneesi
Hiirellä ja rotalla toteutetuissa kaksivuotisissa karsinogeenisuustutkimuksissa todettiin mahalaukussa neuroendokriinisten solujen (enterochromaffin‑like‑ eli ECL‑solujen) kasvaimia (karsinoidikasvaimia) suuria annoksia käytettäessä. Mahalaukun karsinoidikasvainten katsottiin johtuvan todennäköisesti toksisuustutkimuksissa havaitusta pitkäkestoisesta hypergastrinemiasta. Jyrsijöillä todettavien hypergastrinemiaan liittyvien mahalaukun karsinoidikasvainten riskin ja merkityksen ihmiselle katsotaan yleensä olevan vähäinen.
Avatrombopagi ei ollut mutageeninen bakteerien käänteismutaatiokokeessa (Amesin testi) in vitro eikä klastogeeninen ihmisen lymfosyyttien kromosomipoikkeavuuskokeessa in vitro eikä rotan luuytimen mikrotumakokeessa in vivo.
Eläintoksikologia ja/tai ‑farmakologia
4 viikon pituisissa ja pidemmissä toistuvaisannoksilla tehdyissä toksisuustutkimuksissa todettiin hoitoon liittyviä mahalaukkumuutoksia hiirellä, rotalla ja jaavanmakakilla. Näillä lajeilla avatrombopagin käytön yhteydessä todettiin histopatologisia muutoksia glandulaarisen mahan funduksen limakalvolla. Muutosten tyyppipiirteenä oli rauhasepiteelin degeneraatio ja kypsien parietaalisolujen väheneminen. Ilmiöön ei liittynyt tulehdusreaktiota eikä eroosion eikä haavaumamuodostuksen merkkejä. Mahalaukun muutosten vaikeusaste riippui annoksesta ja avatrombopagin käytön kestosta, ja muutoksilla oli selvä taipumus korjautua lääkkeettömän jakson aikana. Altistus (AUC) annoksilla, joilla mahalaukkumuutoksia ei todettu, oli eri lajeilla 3‑33‑kertaisesti suurempi kuin ihmisen altistus ihmisen suurimmalla suositusannoksella.
Lisääntymis‑ ja kehitystoksisuus
Avatrombopagi ei vaikuttanut hedelmällisyyteen eikä alkioiden varhaiskehitykseen, kun urosrottien altistus oli 22‑kertainen ja naarasrottien altistus 114‑kertainen verrattuna potilailla todettuihin AUC‑arvoihin suositusannoksella 60 mg kerran vuorokaudessa.
Erittyminen maitoon
Avatrombopagi erittyi imettävien rottien maitoon, kun rotille annettiin radioaktiivisesti leimattua avatrombopagia suun kautta. Avatrombopagin farmakokinetiikka maidossa vastasi sen farmakokinetiikkaa plasmassa, ja avatrombopagiin liittyvän radioaktiivisuuden altistussuhde (maidon altistus / plasman altistus) oli 0,94.
Nuorilla eläimillä tehdyt kokeet
Nuorilla rotilla tehdyssä 10 viikon toksisuustutkimuksessa avatrombopagia annettiin annoksilla, joiden suuruus vaihteli välillä 20-300 mg/kg/vrk. Annoksilla, jotka olivat korkeintaan 300 mg/kg/vrk, ei todettu testiaineeseen liittyvää kuolleisuutta tai kliinisiä löydöksiä. Annosriippuvaista regeneraatiota, regeneratiivistä hyperplasiaa ja rauhasepiteelin atrofiaa ilmeni vatsassa annoksilla 100 ja 300 mg/kg/vrk; altistukset annoksilla 100 mg/kg/vrk urosrotilla olivat 14-kertaisia verrattuna AUC-arvoihin potilailla, joita hoidetaan maksimisuositusannoksella 60 mg kerran vuorokaudessa. Avatrombopagi ei aiheuttanut mahalaukun muutoksia nuorilla urosrotilla, joiden altistus oli 7‑kertainen verrattuna potilailla todettuihin AUC-arvoihin maksimisuositusannoksella 60 mg kerran vuorokaudessa. Lisäksi taustalla esiintyvän fokaalisen mineralisaation lisääntynyttä insidenssiä havaittiin naaraiden munuaisissa annoksella 300 mg/kg/vrk (naarasrottien altistus oli 50 kertaa ihmisen altistuksen suuruinen perustuen AUC-arvoon 60 mg:n päivittäisannoksella).
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Laktoosimonohydraatti
Mikrokiteinen selluloosa (E460(i))
Krospovidoni, tyyppi B (E1202)
Piidioksidi, kolloidinen, vedetön (E551)
Magnesiumstearaatti (E470b)
Kalvopäällyste
Poly(vinyylialkoholi) (E1203)
Talkki (E553b)
Makrogoli 3350 (E1521)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DOPTELET tabletti, kalvopäällysteinen
20 mg (L:kyllä) 10 fol (704,70 €), 15 fol (1034,86 €), 30 fol (2014,76 €)
PF-selosteen tieto
Läpipainopakkaus (polyamidilla ja polyvinyylikloridilla laminoitu alumiinikalvo ja alumiini‑polyeteenitereftalaattiläpipainokalvo), jossa on joko 10 tai 15 kalvopäällysteistä tablettia. Yksi kotelo sisältää yhden läpipainopakkauksen, jossa on 10 tai 15 kalvopäällysteistä tablettia tai kaksi 15 kalvopäällysteisen tabletin läpipainopakkausta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaaleankeltainen, pyöreä, kaksoiskupera kalvopäällysteinen tabletti, jonka koko on 7,6 mm ja jonka toisella puolella on kaiverrus ”AVA” ja toisella puolella kaiverrus ”20”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DOPTELET tabletti, kalvopäällysteinen
20 mg 30 fol
- Ylempi erityiskorvaus (100 %). Avatrombopagi: Aikuisten kroonisen primaarin immuunitrombosytopenian hoito erityisin edellytyksin (1524).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Avatrombopagi: Aikuisten kroonisen primaarin immuunitrombosytopenian (ITP) hoito erityisin edellytyksin (3052).
DOPTELET tabletti, kalvopäällysteinen
20 mg 10 fol, 15 fol
- Ylempi erityiskorvaus (100 %). Avatrombopagi: Aikuisten kroonisen primaarin immuunitrombosytopenian hoito erityisin edellytyksin (1524).
- Rajoitettu peruskorvaus reseptimerkinnällä (40 %). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Maksasairaus, vaikea trombosytopenia, toimenpide (E020).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Avatrombopagi: Aikuisten kroonisen primaarin immuunitrombosytopenian (ITP) hoito erityisin edellytyksin (3052).
ATC-koodi
B02BX08
Valmisteyhteenvedon muuttamispäivämäärä
22.05.2025
Yhteystiedot
Äyritie 18
01510 Vantaa
0201 558 840
www.sobi.fi
mail.fi@sobi.com
