SIXMO implantaatti 74,2 mg
Huomioitavaa
▼Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Implantaatti sisältää buprenorfiinihydrokloridia, joka vastaa 74,2 mg:aa buprenorfiinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Implantaatti
Kliiniset tiedot
Käyttöaiheet
Sixmo on tarkoitettu kliinisesti vakaassa tilassa olevien ja enintään 8 mg/vrk sublinguaalista buprenorfiinia käyttävien opioidiriippuvaisten aikuisten opioidikorvaushoitoon osana lääketieteellistä, sosiaalista ja psykologista hoitokokonaisuutta.
Ehto
Valmistetta voi käyttää vain sosiaali- ja terveysministeriön asetuksen opioidiriippuvuuden vieroitus- ja korvaushoidosta eräillä lääkkeillä mukaisesti ja niissä terveydenhuollon yksiköissä, joissa lääke luovutetaan käyttöön valvotusti tai yksiköissä, joissa lääkkeen annostelee potilaalle terveydenhuollon henkilökunta. Valmistetta ei saa toimittaa apteekista potilaalle.
Annostus ja antotapa
Hoidosta vastaavalla ja sitä valvovalla terveydenhuollon ammattilaisella on oltava kokemusta opioidiriippuvuuden hoidosta. Sixmo-implantaatit asettavalla ja poistavalla lääkärillä on oltava pätevyys pienten leikkausten tekemiseen sekä Sixmo-implantaattien asettamis- ja poistamiskoulutus. Sixmo-hoidon aikana on huolehdittava riittävistä varotoimista, kuten potilaan tarpeisiin ja lääkärin kliiniseen arvioon perustuvista seurantakäynneistä.
Aiemmin sublinguaalisella buprenorfiinilla tai sublinguaalisella buprenorfiinin ja naloksonin yhdistelmällä hoidettujen potilaiden täytyy käyttää kiinteää 2–8 mg:n vuorokausiannosta vähintään 30 vuorokauden ajan, ja hoidosta vastaavan terveydenhuollon ammattilaisen on todettava heidän tilansa kliinisesti vakaaksi.
Kliinisen tilan vakauden ja Sixmo-hoidon soveltuvuuden määrittelyssä on otettava huomioon seuraavat tekijät:
- opioidien väärinkäytöstä kulunut aika
- elinympäristön vakaus
- jäsentyneeseen toimintaan/työelämään osallistuminen
- johdonmukainen osallistuminen suositeltuun käyttäytymisterapiaan/vertaistukiohjelmaan
- johdonmukainen sitoutuminen vastaanottokäynteihin
- vähäinen tai olematon halu tai tarve opioidien väärinkäyttöön
- sairaalahoitojaksoista (riippuvuuteen tai mielenterveyteen liittyvistä), ensiapukäynneistä tai kriisihoidoista kulunut aika
- sosiaalinen tukiverkosto.
Annostus
Sixmo-valmistetta saa antaa vain potilaille, joille on kehittynyt opioiditoleranssi. Yksi annos koostuu neljästä implantaatista, jotka asetetaan ihon alle olkavarren sisäsivulle.
Sixmo-implantaatit asetetaan paikalleen kuudeksi kuukaudeksi, jona aikana ne vapauttavat hitaasti buprenorfiinia. Ne poistetaan kuuden kuukauden kuluttua.
Sixmo-hoito
Hoito sublinguaalisella buprenorfiinilla keskeytetään 12–24 tuntia ennen Sixmo-implantaattien asettamista ihon alle.
Kriteerit täydentävälle hoidolle sublinguaalisella buprenorfiinilla
On mahdollista, että osa potilaista tarvitsee satunnaisesti lisäbuprenorfiinia sublinguaalisesti hallitakseen opioidien vieroitusoireita ja niiden käyttöön liittyviä mielihaluja, esim. henkilökohtaisissa kuormitus- tai kriisitilanteissa.
Hoitavan lääkärin on harkittava sublinguaalisen buprenorfiinin antamista muun hoidon lisäksi, jos:
- potilaalla on vieroitusoireita, kuten hikoilu, kyynelvuoto, haukottelu, pahoinvointi, oksentelu, takykardia, kohonnut verenpaine, piloerektio, laajentuneet silmäterät
- jos potilas itse ilmoittaa heroiinin tai muiden opioidien käytöstä tai niiden himosta, tai jos potilaan virtsanäytteet ovat positiivisia opioidien suhteen.
Vaikka jotkut potilaat saattavat ajoittain tarvita lisäannoksia buprenorfiinia, heille ei anneta reseptiä, jolla he voisivat tarvittaessa saada sublinguaalisia buprenorfiinivalmisteita. Sen sijaan ne, jotka tuntevat tarvitsevansa lisäannoksia, täytyy tutkia ja arvioida viiveettä.
Hoidon keskeyttämiskriteerit
Hoitavan lääkärin on harkittava implantaattien poistamista, jos:
- potilas saa vakavia tai sietämättömiä haittavaikutuksia (mukaan lukien vakavat vieroitusoireet);
- potilaalla on myrkytyksen tai yliannostuksen merkkejä (mioosi, huulten sinerrys, sedaatio, bradykardia, matala verenpaine, hengityslama);
- jos lääkkeen teho on riittämätön, mikä näkyy jatkuvina vieroitusoireina, joiden hoitamiseksi tarvitaan toistuvasti sublinguaalista buprenorfiinia.
Hoidon keskeyttäminen
Sixmo-hoidon keskeyttäneiden potilaiden on palattava aikaisempaan sublinguaalisen buprenorfiinin annokseensa 12–24 tunnin kuluessa Sixmo-implantaattien poistosta (eli annokseen, jota he käyttivät ennen Sixmo-hoitoon siirtymistä). Buprenorfiinin jakaantumisen µ-opioidireseptoreista odotetaan kestävän jopa useita päiviä Sixmo-hoidon keskeyttämisen jälkeen, mikä estää vieroitusoireiden kehittymisen heti Sixmo-implantaattien poistamisen jälkeen.
Hoidon jatkaminen
Jos hoitoa halutaan jatkaa ensimmäisen kuuden kuukauden hoitojakson jälkeen, vanhojen implantaattien poiston jälkeen potilaalle voidaan asettaa neljä uutta Sixmo-implantaattia toisen kuuden kuukauden hoitojakson ajaksi. Toisesta hoitojaksosta on vain vähän kokemuksia. Yli 12 kuukautta kestävästä implantaattihoidosta ei ole kokemuksia. Uudet implantaatit on asetettava vastakkaisen yläraajan olkavarren sisäsivulle kuin missä vanhat olivat. Alla olevia asetusohjeita noudattamalla voidaan määrittää sopiva asetuskohta.
Jos hoitoa jatketaan, uudet implantaatit on asetettava ihon alle mahdollisimman pian edellisten implantaattien poistamisen jälkeen, mielellään samana päivänä. Jos implantaatteja jatkohoitoa varten ei aseteta samana päivänä, jona edelliset implantaatit poistetaan, potilaille annetaan sublinguaalista buprenorfiinia kiinteinä 2–8 mg:n vuorokausiannoksina kliinisen tarpeen mukaan siihen saakka kun implantaattihoito taas jatkuu. Sublinguaalisen buprenorfiinin antaminen lopetetaan 12–24 tuntia ennen neljän Sixmo-implantaatin asettamista.
Kun molempien olkavarsien ihon alle on asetettu implantaatit (yhteensä kaksi hoitojaksoa), suurin osa potilaista siirtyy takaisin aiempaan sublinguaaliseen buprenorfiiniannokseen (eli annokseen, jota he käyttivät ennen Sixmo-hoitoon siirtymistä) jatkohoitoa varten. Tietoja kahden hoitojakson jälkeen jatkuneesta Sixmo-hoidosta ei ole, eikä Sixmo-implantaattien asettamisesta muualle kuin olkavarteen tai uudelleen samoihin kohtiin ole kokemuksia.
Erityisryhmät
Iäkkäät
Sixmo-valmisteen kliinisiin tutkimuksiin ei osallistunut yli 65‑vuotiaita potilaita, joten valmisteen käyttöä tässä ikäryhmässä ei suositella. Buprenorfiinin tehoa ja turvallisuutta yli 65‑vuotiailla potilailla ei ole varmistettu. Annossuosituksia ei voida antaa.
Maksan vajaatoiminta
Koska buprenorfiinipitoisuuksia ei ole mahdollista säätää Sixmo-hoidon aikana, Sixmo on vasta-aiheinen potilailla, joilla on vaikea maksan vajaatoiminta (Child‑Pugh C) (kohdat Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Lievää tai kohtalaista maksan vajaatoimintaa sairastavia potilaita (Child‑Pugh A ja B) on seurattava kohonneiden buprenorfiinipitoisuuksien aiheuttamien myrkytys- ja yliannostusoireiden varalta (mioosi, huulten sinerrys, sedaatio, bradykardia, matala verenpaine, hengityslama). Jos havaitaan myrkytys- tai yliannostusoireita, implantaatit on poistettava ja siirryttävä käyttämään lääkevalmistetta, jonka annosta voidaan säätää.
Jos potilaalle kehittyy maksan vajaatoiminta Sixmo-hoidon aikana, häntä on seurattava myrkytys- ja yliannostusoireiden varalta. Jos potilaalle kehittyy myrkytys- tai yliannostusoireita, implantaatit on poistettava ja siirryttävä käyttämään lääkevalmistetta, jonka annosta voidaan säätää.
Munuaisten vajaatoiminta
Buprenorfiinin kokonaispuhdistumassa eliminaatio munuaisten kautta ei ole kovin merkittävää (noin 30 %), eikä munuaisten vajaatoimintaa sairastavilla potilailla ole havaittu kohonneita buprenorfiinipitoisuuksia plasmassa.
Sixmo-annoksen säätämistä ei vaadita munuaisten vajaatoimintaa sairastaville potilaille. Varovaisuutta on noudatettava, kun valmistetta annetaan vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (kreatiniinipuhdistuma < 30 ml/min) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Sixmo-valmisteen turvallisuutta ja tehoa alle 18‑vuotiaiden lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Ihon alle
Huomioitavia asioita ennen lääkkeen käsittelyä tai antoa
- Sixmo-implantaatit asetetaan ja poistetaan aseptisissa olosuhteissa.
- Potilaan on oltava selinmakuulla.
- Lääkärin on suositeltavaa istua koko asettamistoimenpiteen ajan, jotta asettamiskohta ja neulan liike ihon alla ovat selvästi nähtävissä sivulta. Toimenpiteen saa suorittaa vain sellainen lääkäri, joka on pätevä tekemään pieniä leikkauksia, ja joka on saanut koulutuksen Sixmo-implantaattien asettamiseen. Toimenpiteen suorittamiseen saa käyttää ainoastaan implantaatin asetinta ja suositeltua soveltuvaa paikallispuudutetta.
- Kaikki neljä implantaattia asetetaan yhdellä asettimella.
- Lisäksi on huomioitava, että Sixmo-valmisteen asettavassa ja sen poistavassa terveydenhuollon yksikössä pitää olla käytössä ultraääni- ja MRI-laite.
- Jos potilaalla on vasta-aiheita MRI-tutkimukselle, hänelle ei saa asettaa implantaattia.
Välineet, joita tarvitaan Sixmo-implantaattien asettamisessa ihon alle
Seuraavia välineitä tarvitaan, kun implantaatit asetetaan ihon alle aseptisissa olosuhteissa:
- tutkimuspöytä, jolla potilas makaa
- steriilillä leikkausliinalla päällystetty instrumenttipöytä
- riittävä valaistus, esim. otsalamppu
- steriili reikälakana
- steriilit lateksikäsineet, joissa ei ole talkkia
- alkoholipyyhe
- merkkauskynä leikkausalueen merkitsemiseen
- antiseptinen liuos, esim. klooriheksidiini
- paikallispuudute, esim. 1 % lidokaiini ja adrenaliini 1:100 000
- 5 ml:n ruisku ja 25G×1,5" neula (0,5 × 38 mm)
- Adson-väkäpihdit
- skalpelli #15
- kapea, noin 6 mm:n levyinen haavateippi (perhosteippi)
- 100×100 mm:n steriili sideharso
- laastareita
- noin 8 cm leveä paineside
- kudosliima
- 4 Sixmo-implantaattia
- 1 implantaatin asetin.
Implantaatin asetin (kertakäyttöinen) ja sen osat esitetään kuvassa 1.
Kuva 1
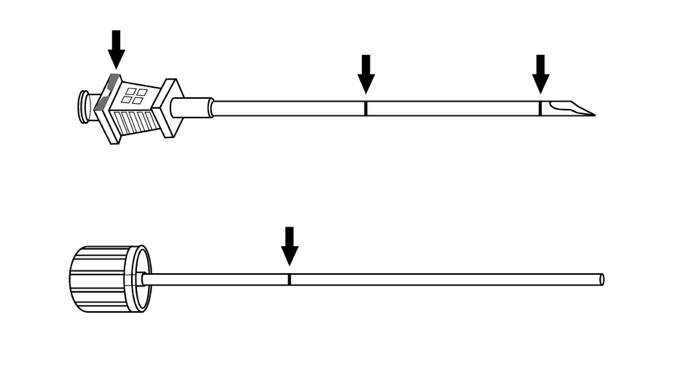
Ohjeet Sixmo-implantaattien asettamiseksi ihon alle
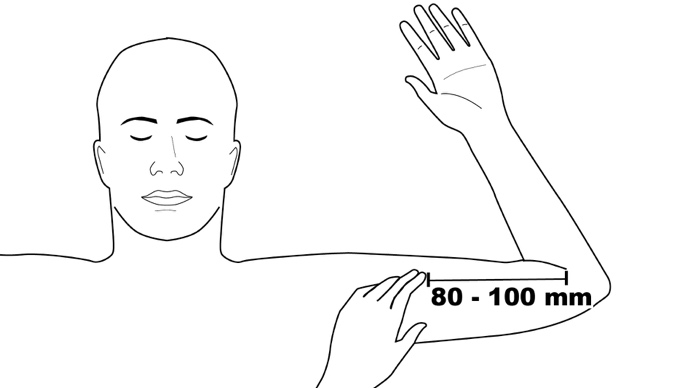
Vaihe 1: Potilaan on maattava selällään, valittu käsivarsi kyynärpäästä taivutettuna ja ulospäin kierrettynä siten, että kämmen sijaitsee pään vierellä. Etsi oikea asetuskohta, joka sijaitsee olkavarren sisäsivulla, noin 80–100 mm (8–10 cm) mediaaliepikondyylin yläpuolella, hauislihaksen ja kolmipäisen olkalihaksen välisessä uurteessa. Oikea kohta saattaa löytyä helpommin, jos potilas jännittää hauislihastaan (kuva 2).
Kuva 2
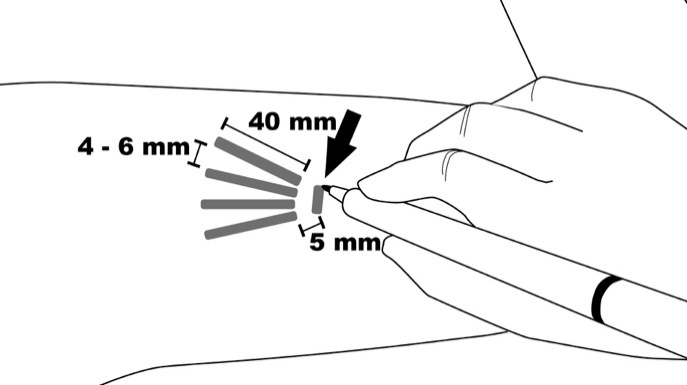
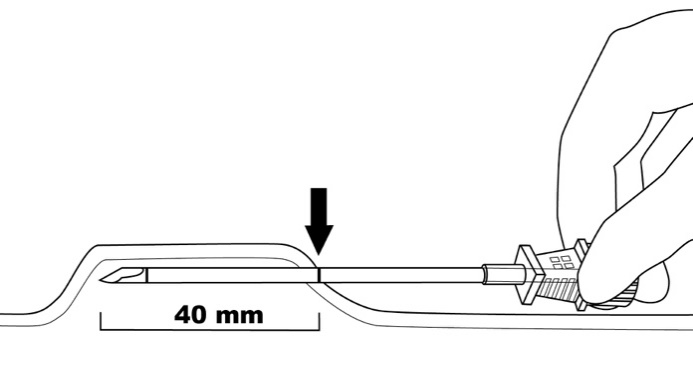
Vaihe 2: Puhdista asettamiskohta alkoholipyyhkeellä. Merkitse asetuskohta merkkauskynällä. Implantaatit asetetaan pienen ihoon tehtävän 2,5–3 mm pitkän viillon kautta. Merkitse jokaisen implantaatin asettamisreitti piirtämällä neljä 40 mm:n pituista viivaa. Implantaatit asetetaan suljetun viuhkan muotoiseen asetelmaan 4–6 mm:n etäisyydelle toisistaan siten, että viuhkan avonainen pää suuntautuu hartiaa kohti (kuva 3).
Kuva 3
Vaihe 3: Laita käsiisi steriilit käsineet ja varmista implantaatin asettimen toimivuus poistamalla ohjain kanyylistä ja lukitsemalla se sitten takaisin paikoilleen. Puhdista asetuskohta antiseptisella liuoksella, esim. klooriheksidiinilla. Älä kuivaa tai pyyhi pois.
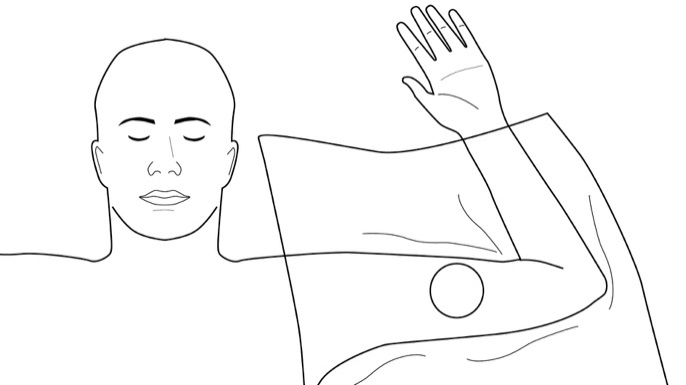
Aseta steriili reikälakana potilaan käsivarren päälle (kuva 4). Puuduta ihonalainen asettamisalue viiltokohdasta asetusreittien mukaisesti pistämällä 5 ml lidokaiinia (1 %) ja adrenaliinia (1:100 000). Kun puudutus on riittävä ja tehokas, tee pieni 2,5–3 mm pitkä viilto merkitsemääsi kohtaan.
Kuva 4
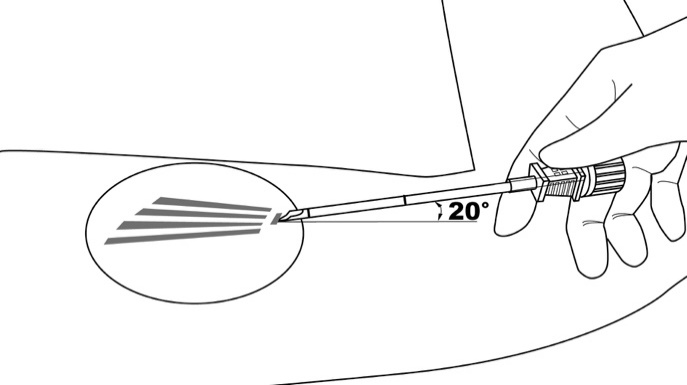
Vaihe 4: Kohota viillon reunaa väkäpihtien avulla. Työnnä asetinta kevyesti ihoon pienessä kulmassa (enintään 20 astetta), ja pistä vain asettimen kärki 3‑4 mm ihon alle siten, että kanyylin viistetty kärki osoittaa ylöspäin ja kärjessä oleva merkintä on selkeästi näkyvissä ohjaimen ollessa täysin lukittuna kanyyliin (kuva 5).
Kuva 5
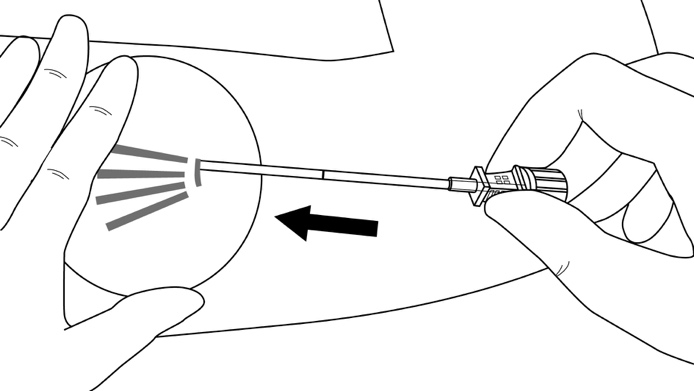
Vaihe 5: Laske asetin vaakatasoon, ja nosta ihoa asettimen kärjellä, mutta pidä kanyyli ihonalaisessa sidekudoksessa (kuva 6).
Kuva 6
Vaihe 6: Työnnä asetinta varovasti ihon alla ihoon merkittyä asettamisreittiä pitkin, ja nosta samalla ihoa. Lopeta heti, kun kanyylin keskikohdassa oleva merkintä on hävinnyt viillon sisälle (kuvat 7 ja 8).
Kuva 7
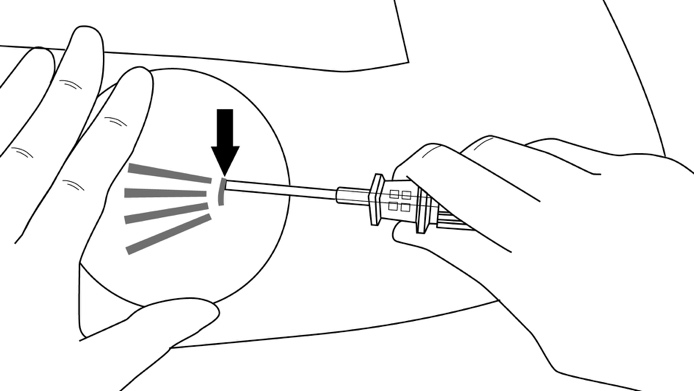
Kuva 8
Vaihe 7: Pidä kanyylia paikoillaan, vapauta ohjain ja poista se. Laita kanyylin sisälle yksi implantaatti (kuva 9), aseta ohjain takaisin paikoilleen ja työnnä sitä varovaisesti eteenpäin (jolloin tuntuu lievää vastusta), kunnes ohjaimessa oleva viivamerkintä on samalla kohdalla kuin kanyylin viistetyn kärjen viivamerkintä. Nyt implantaatti on kanyylin kärjessä (kuva 10). Älä työnnä implantaattia väkisin ohjaimella kanyylin kärkeä pitemmälle. Kun implantaatti on oikeassa kohdassa, implantaatin ja viillon välinen etäisyys on vähintään 5 mm.
Kuva 9
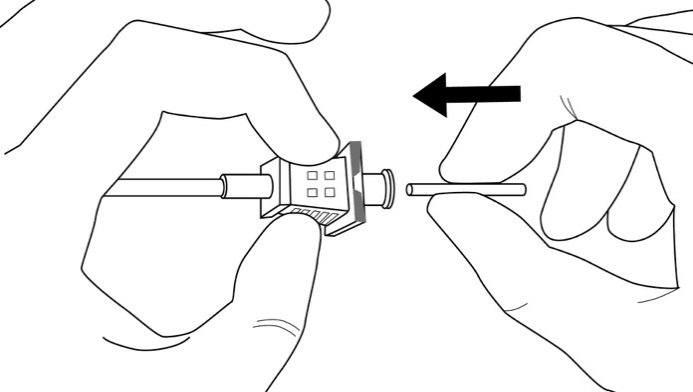
Kuva 10
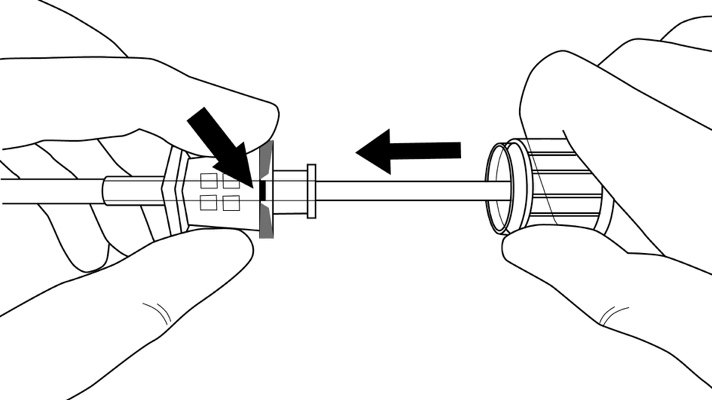
Vaihe 8: Pidä ohjainta paikallaan käsivarressa, ja vedä samalla kanyylia ohjaimen suuntaan, jolloin implantaatti jää paikoilleen (kuva 11). Huomioi: Älä paina ohjainta. Vedä kanyylia, kunnes keskikohta on samalla tasolla ohjaimen kanssa, käännä sitten ohjainta myötäpäivään, jolloin se lukittuu kanyyliin (kuva 12). Vedä asetinta viistetty kärki ylöspäin, kunnes kanyylin distaalinen merkintä tulee näkyviin viillon sisältä (terävä kärki edelleen ihon alla).
Kuva 11
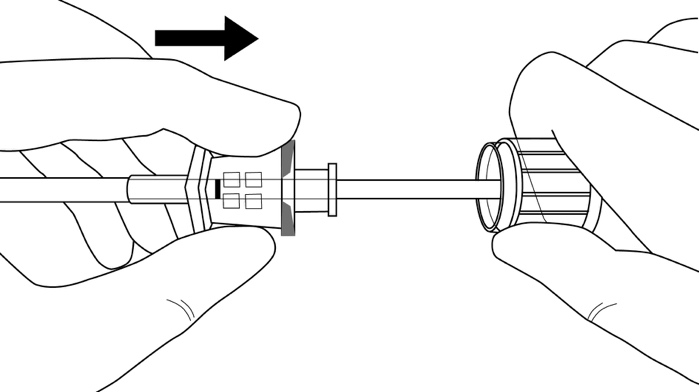
Kuva 12
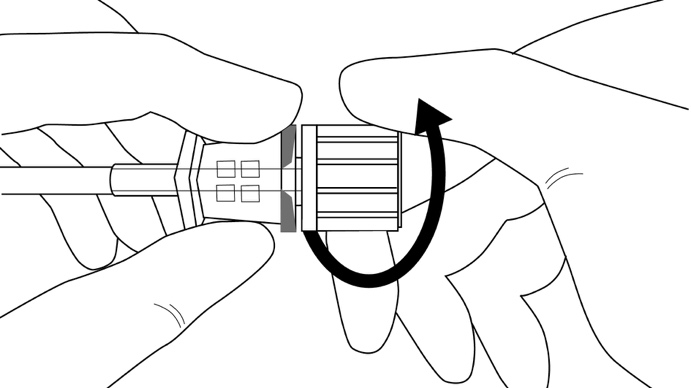
Vaihe 9: Suuntaa asetin kohti seuraavaa asettamisreittiä, ja pidä samalla aikaisemmin asettamaasi implantaattia paikoillaan etusormesi avulla, sormi poispäin terävästä kärjestä (kuva 13). Toista vaiheet 6–9 jäljellä olevien kolmen implantaatin asettamiseksi saman viillon kautta.
Kuva 13
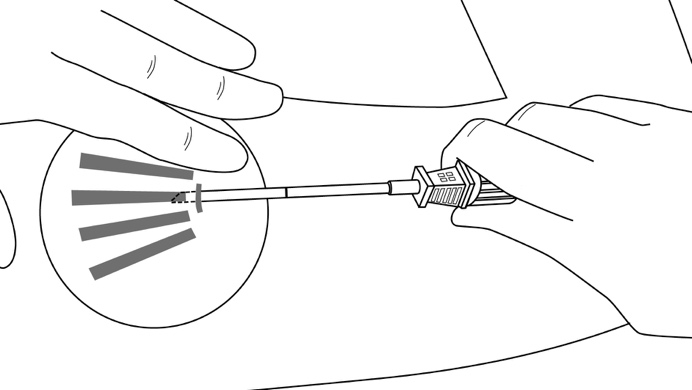
Vaihe 10: Varmista kaikkien implantaattien (pituus 26,5 mm) sijainti palpoimalla potilaan käsivarsi välittömästi asentamisen jälkeen kuvan 14 mukaisesti. Jos et havaitse kaikkia neljää implantaattia tai olet epävarma niiden sijainnista, varmista niiden paikka muiden menetelmien avulla.
Kuva 14
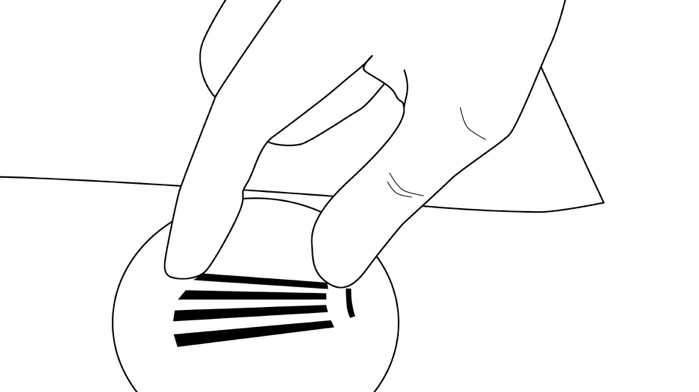
Vaihe 11: Paina viiltokohtaa tarvittaessa noin viiden minuutin ajan. Puhdista viiltokohta. Laita kudosliimaa viiltoa reunustavalle iholle, ja anna kuivua ennen kuin suljet haavan noin 6 mm leveällä haavateipillä (perhosteippi). Laita asettamiskohdan päälle pieni laastari. Lisää paineside ja steriiliä sideharsoa mustelmien vähentämiseksi. Neuvo potilaita irrottamaan paineside 24 tunnin ja laastari 3–5 vuorokauden kuluttua ja pitämään jäähaudetta käsivarren päällä 40 minuutin ajan kahden tunnin välein ensimmäisten 24 tunnin ajan ja sen jälkeen tarvittaessa.
Vaihe 12: Täytä potilaskortti, ja anna se potilaalle säilytettäväksi. Kirjaa lisäksi implantaatiotoimenpiteen yksityiskohdat potilastietoihin. Ohjeista potilas hoitamaan asettamiskohtaa asianmukaisella tavalla.
Ohjeet implantaattien paikallistamiseen ennen poistoa
Varmista implantaattien sijainti palpoimalla. Jos implantaatteja ei havaita palpoimalla, niiden sijainti on varmistettava ennen poistoyritystä. Tällöin implantaatit pitää poistaa ultraääniohjauksen avulla (sijainnin varmistamisen jälkeen). Soveltuvia menetelmiä sijainnin varmistamiseen ovat ultraäänitutkimus korkean taajuuden lineaarianturilla (vähintään 10 MHz), tai jos ultraäänitutkimus ei onnistu, MRI-tutkimus. Sixmo-implantaatit eivät ole röntgenpositiivisia eikä niitä voi havaita röntgen- tai TT-kuvassa. Jos kaikkien neljän implantaatin tarkka sijainti ei ole tiedossa, tutkimusleikkausta ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Välineet, joita tarvitaan Sixmo-implantaattien poistamisessa
Implantaatit pitää poistaa aseptisissa olosuhteissa, ja poistamisessa tarvitaan seuraavia välineitä:
- tutkimuspöytä, jolla potilas makaa
- steriilillä leikkausliinalla päällystetty instrumenttipöytä
- riittävä valaistus, esim. otsalamppu
- steriilit reikälakanat
- steriilit lateksikäsineet, joissa ei ole talkkia
- alkoholipyyhe
- merkkauskynä leikkausalueen merkitsemiseen
- antiseptinen liuos, esim. klooriheksidiini
- paikallispuudute, esim. 1 % lidokaiini ja adrenaliini 1:100 000
- 5 ml:n ruisku ja 25G×1,5" neula (0,5 × 38 mm)
- Adson-väkäpihdit
- moskiittopihdit
- kahdet X-plant-rengaspihdit (vasektomiassa käytettävät rengaspihdit, joiden renkaan halkaisija on 2,5 mm)
- värikalvosakset
- neulanpidike
- skalpelli #15
- steriili viivain
- 100×100 mm steriili sideharso
- laastari
- noin 8 cm leveä paineside
- ommellankaa, esim. 4‑0 Prolene™ ja FS‑2 leikkaava neula (voi olla absorboituva).
Sixmo-implantaattien poistamisohjeet
Vaihe 13: Potilaan on maattava selällään, valittu käsivarsi kyynärpäästä taivutettuna ja ulospäin kierrettynä siten, että kämmen sijaitsee pään vierellä. Varmista implantaattien sijainti palpoimalla. Puhdista poistokohta alkoholipyyhkeellä ennen kuin teet ihoon merkintöjä. Merkitse kynällä implantaattien ja viillon sijainti. Viilto on tehtävä käsivarren suuntaisesti toisen ja kolmannen implantaatin väliin, mistä päästään ihon alle (kuva 15).
Kuva 15
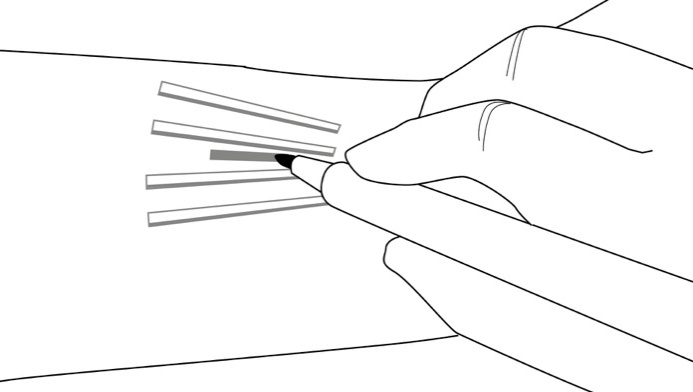
Vaihe 14: Laita käsiisi steriilit käsineet. Aseta steriilit välineet instrumenttipöydälle aseptista tekniikkaa käyttäen. Puhdista poistokohta antiseptisellä liuoksella, esim. klooriheksidiinilla. Älä kuivaa tai pyyhi pois. Aseta steriili lakana potilaan käsivarren päälle. Puuduta viiltokohta ja ihonalainen alue, jolla implantaatit sijaitsevat (esim. pistämällä 5–7 ml lidokaiinia [1 %] ja adrenaliinia [1:100 000]).
HUOMIOI: Varmista, että pistät paikallispuudutteen syvälle implantaattien väliin, sillä tällöin implantaatit nousevat ihon pintaa kohti ja niiden poistaminen on helpompaa. Kun olet varmistanut, että puudute vaikuttaa asianmukaisesti ja tehokkaasti, tee skalpellilla 7–10 mm pitkä käsivarren suuntainen viilto toisen ja kolmannen implantaatin väliin.
Vaihe 15: Kohota viillon reunalla olevaa ihoa Adson-väkäpihdeillä, ja erota näkyvän implantaatin ylä- ja alapuolella sijaitsevat kudokset värikalvosaksia tai taivutettuja moskiittopihtejä käyttäen (kuva 16).
Tartu implantaatin keskikohtaan X-plant-rengaspihdellä (kuva 17) ja vedä kevyesti. Jos implantaatti on kapseloitunut, tai jos havaitset pieniä kuoppia, poista kiinnittynyt kudos skalpellin avulla ja irrota implantaatti.
Kuva 16
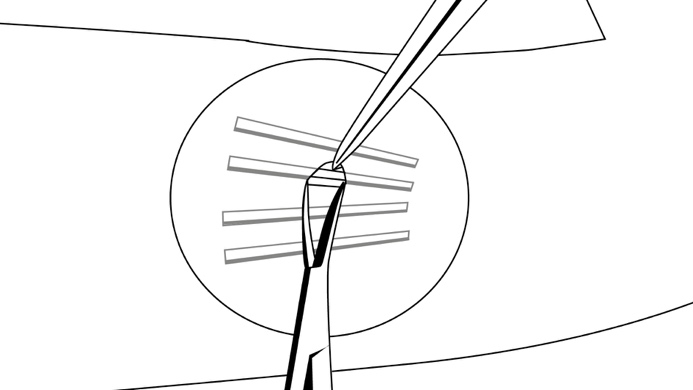
Kuva 17
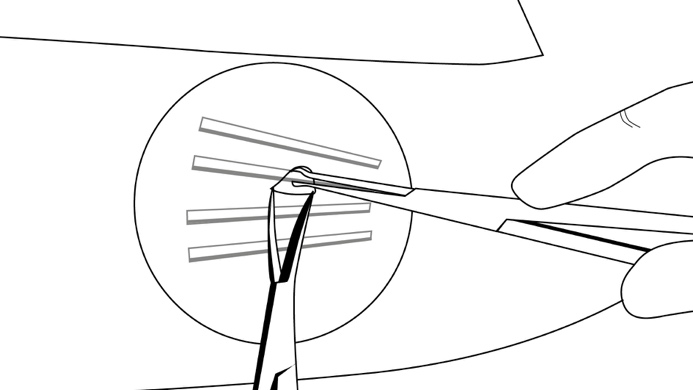
Vaihe 16: Mittaa poistamisen jälkeen jokainen implantaatti (pituus 26,5 mm) varmistaaksesi, että implantaatit on saatu poistettua kokonaisina. Toista vaiheet 15 ja 16 jäljellä olevien implantaattien poistamiseksi saman viillon kautta. Samaa tekniikkaa käytetään esille työntyneiden ja osittaisten implantaattien poistamiseen. Jos kaikkien neljän implantaatin tarkka sijainti ei ole tiedossa, tutkimusleikkausta ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vaihe 17: Kun kaikki implantaatit on poistettu, puhdista viiltokohta. Sulje viilto ompelemalla. Laita viiltokohdan päälle laastari. Käytä steriiliä sideharsoa ja paina viiltokohtaa kevyesti viiden minuutin ajan hemostaasin varmistamiseksi. Lisää paineside ja steriiliä sideharsoa mustelmien vähentämiseksi. Neuvo potilaita irrottamaan paineside 24 tunnin ja laastari 3–5 vuorokauden kuluttua. Neuvo potilaille asianmukaisen aseptinen haavanhoito. Neuvo potilasta pitämään jäähaudetta käsivarren päällä 40 minuutin ajan kahden tunnin välein ensimmäisten 24 tunnin ajan, ja sen jälkeen tarvittaessa. Sovi vastaanottokäynti tikkien poistamista varten.
Vaihe 18: Sixmo-implantaatit pitää hävittää paikallisten vaatimusten mukaisesti, sillä ne sisältävät buprenorfiinia.
Jos implantaattia (implantaatteja) tai niiden osaa (osia) ei saada poistettua toimenpiteen aikana, potilaalle pitää tehdä mahdollisimman pian kuvantamistutkimus implantaattien paikallistamiseksi. Seuraava poistoyritys pitää tehdä samana päivänä paikallistamisen kanssa. Jos paikallistamista ja toista poistotoimenpidettä ei tehdä samana päivänä ensimmäisen poistotoimenpiteen kanssa, haava pitää sulkea ompelemalla.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Vaikea hengitysvaje.
Vaikea maksan vajaatoiminta.
Akuutti alkoholismi tai delirium tremens.
Opioidiantagonistien (naltreksoni, nalmefeeni) samanaikainen käyttö alkoholi- tai opioidiriippuvuuden hoitoon.
Jos potilaalle on aiemmin muodostunut keloideja tai liikakasvuisia arpia, hänelle ei saa asettaa implantaatteja ihon alle, sillä niiden poisto saattaa olla vaikeaa.
Potilaat, joilla on vasta-aiheita MRI-tutkimukselle.
Varoitukset ja käyttöön liittyvät varotoimet
Hoidon seuranta
Potilaat saattavat olla uneliaita etenkin implantaattien asettamista seuraavan viikon aikana, mistä potilaita on varoitettava (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
Asetuskohta pitää tutkia viikon kuluttua implantaattien asettamisesta ja sen jälkeen säännöllisesti infektion merkkien tai haavan paranemiseen liittyvien ongelmien varalta, kuten implantaatin työntyminen ulos ihosta ja väärinkäyttö. Suurimmalle osalle potilaista suositellaan vastaanottokäyntejä vähintään kerran kuukaudessa jatkoneuvontaa ja psykososiaalista tukea varten.
Sixmo-implantaattien asettamiseen ja poistoon liittyvät vakavat komplikaatiot
Lääkeimplantaattien virheellinen asettaminen olkavarteen saattaa aiheuttaa harvinaisia mutta vakavia komplikaatioita kuten hermojen vaurioituminen ja implantaatin vaeltaminen pois paikoiltaan, jotka voivat johtaa emboliaan ja kuolemaan. Muita mahdollisia komplikaatioita voivat olla implantaatin siirtyminen pois paikaltaan, työntyminen esiin tai ulos ja rikkoontuminen asettamisen jälkeen tai poistamisen aikana. Paikaltaan pois siirtynyt implantaatti on poistettava kirurgisesti.
Kun implantaatti on asetettu ihon alle, on ehdottoman tärkeää varmistaa sen oikea sijainti palpoimalla. Jos implantaatit asetetaan liian syvälle (lihakseen tai kalvoon), seurauksena saattaa olla hermo- tai verisuonivaurio asettamisen tai poistamisen yhteydessä.
Asettamis- tai poistokohta voi infektoitua. Liiallinen palpointi välittömästi implantaattien asettamisen jälkeen saattaa lisätä infektioriskiä. Virheellinen poistaminen lisää asetuskohdan infektion ja implantaattien rikkoontumisen riskiä.
Joissain harvinaisissa tapauksissa implantaatteja tai niiden osia ei ole pystytty paikallistamaan eikä siten myöskään poistamaan (ks. kohta Annostus ja antotapa).
Implantaatin työntyminen ulos
Jos implantaatti työntyy spontaanisti ulos asettamisen jälkeen, on noudatettava seuraavia ohjeita:
- Potilaalle on varattava mahdollisimman pian vastaanottoaika implantaatin asettaneelle lääkärille.
- Potilasta on neuvottava laittamaan implantaatti kannelliseen lasiastiaan ja säilyttämään sitä turvallisessa paikassa poissa muiden ja etenkin lasten ulottuvilta ja tuomaan se terveydenhuollon ammattilaiselle, joka selvittää, onko koko implantaatti työntynyt ulos.
Huomioi: Buprenorfiini voi aiheuttaa vakavan ja mahdollisesti kuolemaan johtavan hengityslaman lapsille, jotka altistuvat sille vahingossa.
- Jos potilas palauttaa ulos työntyneen implantaatin, implantaatti on mitattava, jotta voidaan varmistaa, onko koko implantaatti työntynyt ulos (pituus 26,5 mm).
- Viiltokohta on tutkittava infektion varalta. Mahdollinen infektio hoidetaan asianmukaisesti ja arvioidaan, pitääkö jäljellä olevat implantaatit poistaa.
- Jos ulos on työntynyt vain osa implantaatista, terveydenhuollon ammattilaisen on palpoitava asettamiskohta ihon alle jääneen implantaatin osien paikallistamiseksi. Ihon alle jääneet implantaatin osat on poistettava kohdan Annostus ja antotapa ”Sixmo-implantaattien poistamisohjeet” mukaisesti.
- Jos ihon alle jääneitä implantaatin osia ei löydetä palpoimalla, on tehtävä ultraääni- tai MRI-tutkimus kohdan Annostus ja antotapa ”Sixmo-implantaattien poistamisohjeet” mukaisesti.
- Terveydenhuollon ammattilaisten on seurattava potilaan tilaa tarkasti implantaatin vaihtamiseen asti mahdollisten vieroitusoireiden tai sublinguaalisen buprenorfiinin tarpeeseen viittaavien muiden kliinisten merkkien varalta.
- Korvaava implantaatti (korvaavat implantaatit) on asetettava samaan käsivarteen joko mediaalisesti tai lateraalisesti in situ -implantaatteihin nähden. Korvaava implantaatti (korvaavat implantaatit) voidaan asettaa myös toiseen käsivarteen.
Väärinkäyttö ja viihdekäyttö
Buprenorfiiniin liittyy väärinkäytön ja rikollisen viihdekäytön riski. Sixmo-valmisteen annosmuoto on viihde- ja väärinkäytön kannalta epäedullinen. Buprenorfiinin saaminen Sixmo-implantaateista on kuitenkin mahdollista. Näitä riskejä ja potilaan tilan vakautta opioidiriippuvuuden hoitoa ajatellen on harkittava, kun arvioidaan Sixmo-hoidon soveltuvuutta potilaalle.
Buprenorfiinin väärinkäyttöön liittyy yliannostuksen ja kuoleman riski. Riski kasvaa, jos buprenorfiinin kanssa käytetään samanaikaisesti alkoholia ja muita aineita, erityisesti bentsodiatsepiineja.
Kaikkia Sixmo-valmistetta saavia potilaita pitää tarkkailla viihdekäyttöön viittaavien olosuhteiden sekä opioidiriippuvuuden pahenemisen ja addiktiivisen käyttäytymisen varalta, sillä tällöin riippuvuuteen saatetaan tarvita intensiivisempää ja strukturoidumpaa hoitoa.
Riippuvuus
Buprenorfiini on osittainen µ (myy) -opioidireseptorin agonisti, ja sen pitkäaikainen käyttö aiheuttaa opioidiriippuvuuden kaltaisen riippuvuuden. Eläinkokeet ja kliininen kokemus ovat osoittaneet, että buprenorfiini saattaa aiheuttaa riippuvuutta, mutta vähemmässä määrin kuin puhtaat agonistit, esim. morfiini.
Jos potilaalle ei aseteta uusia Sixmo-implantaatteja heti vanhojen implantaattien poiston yhteydessä, potilaille pitää antaa sublinguaalista buprenorfiinia (2–8 mg/vrk) kliinisen tarpeen mukaan Sixmo-hoidon jatkumiseen asti. Sixmo-hoidon keskeyttäviä potilaita on seurattava vieroitusoireyhtymän varalta, ja sublinguaalisen buprenorfiinin aloittamista laskevin annoksin on harkittava.
Opioidivieroitusoireyhtymän paheneminen
Buprenorfiini on osittainen agonisti, joten se saattaa pahentaa opioidien vieroitusoireiden merkkejä ja oireita puhtaista opioidiagonisteista (esim. heroiini, morfiini, metadoni) riippuvaisilla henkilöillä, ennen kuin puhtaiden agonistien vaikutukset ovat ehtineet laantua. Varmista, että potilaat ovat käyttäneet sublinguaalista buprenorfiinia tai buprenorfiinia/naloksonia riittävän pitkään, tai että he ovat jo kliinisesti vakaassa tilassa buprenorfiini- tai buprenorfiini-/naloksonihoidon avulla ennen Sixmo-implantaattien asettamista (ks. kohta Annostus ja antotapa).
Hengityslama ja keskushermostolama
Buprenorfiinin käyttöön liittyen on raportoitu useita hengityslaman aiheuttaneita kuolemantapauksia, etenkin kun buprenorfiinia on käytetty samanaikaisesti bentsodiatsepiinien kanssa (ks. kohta Yhteisvaikutukset) tai kun buprenorfiinia on käytetty ohjeiden vastaisesti. Kuolemantapauksia on raportoitu myös buprenorfiinin samanaikaisesta käytöstä muiden lamaavien aineiden kuten alkoholin tai muiden opioidien kanssa. Kuolemaan johtava hengityslama on mahdollinen annettaessa buprenorfiinia henkilöille, joilla ei ole opioidiriippuvuutta eikä opioiditoleranssia.
Valmistetta on käytettävä varoen potilailla, jotka sairastavat astmaa tai hengityksen vajaatoimintaa (esim. keuhkoahtaumatauti, akuutti keuhkosydänsairaus, vähentynyt hengitysreservi, hypoksia, hyperkapnia, hengityslama tai kyfoskolioosi [selkärangan vinouma, joka saattaa aiheuttaa hengenahdistusta]).
Buprenorfiini voi aiheuttaa uneliaisuutta erityisesti yhdessä alkoholin tai keskushermostoa lamaavien aineiden (esim. rauhoittavien lääkkeiden, sedatiivien tai unilääkkeiden) kanssa otettuna (ks. kohta Yhteisvaikutukset).
Ennen Sixmo-hoidon aloittamista potilaan lääketieteellinen ja hoitohistoria, mukaan lukien muiden psykoaktiivisten aineiden kuin opioidien käyttö, on selvitettävä, jotta voidaan varmistua siitä, että Sixmo-hoidon aloittaminen on turvallista.
Hepatiitti ja maksavauriot
Opioidiriippuvaisilla on raportoitu esiintyneen buprenorfiinin käyttöön liittyviä akuutteja maksavaurioita (myös kuolemaan johtaneita tapauksia) sekä kliinisissä tutkimuksissa että myyntiluvan myöntämisen jälkeisissä haittavaikutusilmoituksissa. Seuraavia poikkeavuuksia on raportoitu: ohimenevä oireeton maksan transaminaasiarvojen kohoaminen, maksan vajaatoiminta, maksanekroosi, hepatorenaalinen oireyhtymä, hepaattinen enkefalopatia ja kuolema. Monissa tapauksissa aiempi maksan vajaatoiminta (perinnöllinen sairaus, poikkeamat maksaentsyymeissä, B- tai C‑hepatiittivirusinfektio, alkoholin väärinkäyttö, anoreksia, muiden mahdollisesti maksatoksisten aineiden samanaikainen käyttö) ja jatkuva piikitettävien huumeiden käyttö voivat aiheuttaa vaurioita tai edistää niiden syntyä. Nämä taustatekijät ja mahdolliset hepatiittivirus-infektiot on otettava huomioon ennen Sixmo-valmisteen määräämistä sekä hoidon aikana. Jos epäillään maksavaurioita, on tehtävä maksan toimintakokeet ja harkittava Sixmo-hoidon keskeyttämistä. Jos hoitoa jatketaan, maksan toimintaa on seurattava tarkasti.
Maksan vajaatoiminta
Buprenorfiini metaboloituu pääasiassa maksassa. Sublinguaalista buprenorfiinia koskevassa farmakokineettisessa tutkimuksessa plasman buprenorfiinipitoisuuksien havaittiin olevan suurempia ja puolittumisaikojen pitempiä kohtalaista ja vaikeaa maksan vajaatoimintaa sairastavilla potilailla, mutta ei lievää maksaa vajaatoimintaa sairastavilla potilailla (ks. kohta Farmakokinetiikka). Lievää tai kohtalaista maksan vajaatoimintaa sairastavia potilaita on seurattava kohonneiden buprenorfiinipitoisuuksien aiheuttamien myrkytys- ja yliannostusoireiden varalta (ks. kohta Annostus ja antotapa).
Akuutin kivun hoito Sixmo-hoidon aikana
Sixmo-hoidon aikana saattaa esiintyä tilanteita, joissa potilaat tarvitsevat akuutin kivun hoitoa tai anestesiaa. Näitä potilaita hoidetaan ei-opioidikipulääkkeillä aina kun se on mahdollista. Opioidihoitoa kivunlievitykseen tarvitsevia potilaita voidaan hoitaa korkean affiniteetin puhtailla opioidianalgeeteilla terveydenhuollon ammattilaisen valvonnassa, jos hengitystoimintaan kiinnitetään erityistä huomiota. Suuremmat annokset saattavat olla tarpeen analgeettisen vaikutuksen saamiseksi. Tästä syystä opioideja annettaessa mahdollinen myrkytyksen riski on suurempi. Jos opioidihoito on tarpeen osana anestesiaa, potilaan jatkuvasta seurannasta anestesiahoidon aikana vastaavat sellaiset henkilöt, jotka eivät osallistu kirurgiseen tai diagnostiseen toimenpiteeseen . Opioidihoidosta vastaa lääkäri, joka on perehtynyt anesteettisten lääkevalmisteiden käyttöön ja vahvojen opioidien hengitysvaikutusten hoitoon ja hallitsee ilmateiden varmistamisen ja hengityksen avustamisen.
Munuaisten vajaatoiminta
Eliminaatio munuaisten kautta saattaa viivästyä, sillä 30 % annetusta annoksesta eliminoituu munuaisten kautta. Buprenorfiinin metaboliitit kumuloituvat munuaisten vajaatoimintaa sairastavilla potilailla. Varovaisuutta on noudatettava, kun valmistetta annetaan vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (kreatiniinipuhdistuma < 30 ml/min) (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
CYP3A-entsyymin estäjät
CYP3A4-entsyymin toimintaa estävät lääkkeet saattavat nostaa buprenorfiinin pitoisuuksia. Sixmo-valmistetta saavia potilaita on seurattava tarkasti myrkytyksen merkkien varalta, jos he saavat samanaikaisesti voimakkaita CYP3A4:n estäjiä (esim. proteaasin estäjät kuten ritonaviiri, nelfinaviiri tai indinaviiri tai atsoliryhmän sieni-infektiolääkkeet kuten ketokonatsoli ja itrakonatsoli tai makrolidiantibiootit). Ennen Sixmo-hoidon aloittamista lääkärin on arvioitava potilaan hoitohistorian perusteella, soveltuuko samanaikainen CYP3A4:n estäjien käyttö potilaalle (ks. kohta Yhteisvaikutukset).
Opioidien antamiseen liittyvät yleiset varotoimet
Opioidit voivat aiheuttaa ortostaattista hypotensiota jalkeilla olevilla potilailla.
Opioidit voivat aiheuttaa kouristuskohtauksiin johtavaa aivo-selkäydinnesteen paineen nousua, joten opioideja on käytettävä varoen potilaille, joilla on pään alueen vammoja, intrakraniaalisia leesioita tai muita sairauksia, jotka voivat aiheuttaa aivo-selkäydinnesteen paineen nousua, tai joilla on ollut kouristuskohtauksia.
Opioideja on käytettävä varoen potilaille, joilla on matala verenpaine, eturauhasen liikakasvua tai virtsaputken ahtauma.
Opioidien aiheuttama mioosi, tajunnan tason muutokset tai muutokset kivun aistimisessa saattavat vaikeuttaa potilaan tutkimista ja samanaikaisesti esiintyvän sairauden toteamista tai taudinkulun arviointia.
Opioideja on käytettävä varoen potilailla, joilla esiintyy myksedeemaa, kilpirauhasen vajaatoimintaa tai lisämunuaiskuoren vajaatoimintaa (esim. Addisonin tauti).
Potilaille, joilla on sappiteiden toimintahäiriöitä, opioideja annetaan varoen, sillä opioidit nostavat sapenjohtimen sisäistä painetta.
Opioideja on annettava varoen iäkkäille ja huonokuntoisille potilaille.
Morfiinista saatujen kokemusten perusteella, samanaikainen käyttö monoamiinioksidaasin (MAO:n) estäjien kanssa voi lisätä opioidien vaikutuksia (ks. kohta Yhteisvaikutukset).
Serotoniinioireyhtymä
Sixmo-valmisteen ja muiden serotonergisten lääkeaineiden, kuten MAO:n estäjien, selektiivisten serotoniinin takaisinoton estäjien (SSRI-lääkkeiden), serotoniinin ja noradrenaliinin takaisinoton estäjien (SNRI-lääkkeiden) tai trisyklisten masennuslääkkeiden, samanaikainen käyttö voi johtaa serotoniinioireyhtymään, joka voi olla hengenvaarallinen tila (ks. kohta Yhteisvaikutukset).
Jos muiden serotonergisten lääkeaineiden samanaikainen käyttö on kliinisesti tarpeen, potilasta on tarkkailtava huolellisesti etenkin hoitoa aloitettaessa ja annosta suurennettaessa.
Serotoniinioireyhtymän oireita ovat esimerkiksi mielentilan muutokset, autonomisen hermoston epävakaus, neuromuskulaariset poikkeavuudet ja/tai maha-suolikanavan oireet.
Jos potilaalla epäillään serotoniinioireyhtymää, on syytä harkita annoksen pienentämistä tai hoidon keskeyttämistä oireiden vaikeusasteesta riippuen.
Iho
Sixmo-valmistetta on annettava varoen myös niille potilaille, joilla on ollut sidekudossairauksia (esim. sklerodermaa) tai toistuvia metisilliiniiresistenttejä Staphylococcus aureus -infektioita. Sixmo-valmiste on vasta-aiheinen potilaille, joilla on ollut keloideja tai liikakasvuisia arpia sillä alueella, jolle Sixmo-implantaatit on tarkoitus asettaa, sillä implantaattien poisto saattaa vaikeutua (ks. kohta Vasta-aiheet).
Yhteisvaikutukset
Buprenorfiinia ei pidä käyttää samanaikaisesti:
- alkoholijuomien tai alkoholia sisältävien lääkkeiden kanssa, sillä alkoholi vahvistaa buprenorfiinin sedatiivista vaikutusta.
Buprenorfiinia on käytettävä varoen seuraavien aineiden kanssa:
- Bentsodiatsepiinit: Yhdistelmä voi johtaa keskushermostoperäisen hengityslaman aiheuttamaan kuolemaan. Siksi annosten on oltava pieniä, ja yhdistelmää on vältettävä, jos on olemassa väärinkäytön riski. Potilaita pitää varoittaa siitä, että muiden kuin lääkärin määräämien bentsodiatsepiinien ottaminen samanaikaisesti tämän lääkevalmisteen kanssa on hengenvaarallista. Lisäksi heitä on kehotettava käyttämään bentsodiatsepiineja ainoastaan lääkärin antamien ohjeiden mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Muut keskushermostoa lamaavat aineet: Muut opioidijohdannaiset (esim. metadoni, analgeetit ja antitussiivit), tietyt masennuslääkkeet, sedatiiviset H1-reseptoriantagonistit, barbituraatit, muut anksiolyytit kuin bentsodiatsepiinit, neuroleptit, klonidiini ja sen sukuiset aineet; nämä yhdistelmät voimistavat keskushermostolamaa. Tarkkaavaisuuden herpaantuminen saattaa vaarallisella tavalla heikentää ajokykyä ja kykyä käyttää koneita (ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn).
- Opioidianalgeetit: Kivun hoito puhtailla opioidiagonisteilla saattaa olla riittämätöntä buprenorfiinia käyttävillä potilailla. Siksi puhtaiden agonistien käyttöön liittyy yliannostuksen riski, etenkin jos yritetään välttää buprenorfiinin osittaisia agonistisia vaikutuksia, tai jos plasman buprenorfiinipitoisuudet ovat laskeneet (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Opioidiantagonistit: Naltreksoni ja nalmefeeni voivat estää buprenorfiinin farmakologisia vaikutuksia. Samanaikainen käyttö buprenorfiinihoidon aikana on vasta-aiheista potentiaalisesti vaarallisten yhteisvaikutusten takia, jotka voivat aiheuttaa äkillisen, pitkittyneen ja voimakkaan vieroitusoireyhtymän (ks. kohta Vasta-aiheet).
- CYP3A4-entsyymin estäjät ja induktorit: Buprenorfiini metaboloituu norbuprenorfiiniksi pääasiallisesti CYP3A4:n kautta. Yhteisvaikutukset ovat mahdollisia, jos Sixmo-valmistetta annetaan samanaikaisesti CYP3A4:n toimintaan vaikuttavien lääkevalmisteiden kanssa. CYP3A4:n estäjät voivat estää buprenorfiinin metaboliaa, ja johtaa buprenorfiinin ja nonbuprenorfiinin kohonneisiin Cmax- pitoisuuksiin ja AUC-arvoihin. CYP:n estäjillä (esim. ritonaviiri, ketokonatsoli, itrakonatsoli, troleandomysiini, klaritromysiini, nelfinaviiri, nefatsodiini, verapamiili, diltiatseemi, amiodaroni, amprenaviiri, fosamprenaviiri, aprepitantti, flukonatsoli, erytromysiini ja greippimehu) hoidettavia potilaita on seurattava myrkytyksen ja yliannostuksen merkkien ja oireiden varalta (mioosi, huulten sinerrys, sedaatio, bradykardia, matala verenpaine, hengityslama). Jos havaitaan myrkytys- tai yliannostusoireita, implantaatit on poistettava ja siirryttävä lääkevalmisteeseen, jonka annoksia voidaan säätää.
- Vastaavasti, CYP3A4:n induktorit (esim. fenobarbitaali, karbamatsepiini, fenytoiini, rifampiini) saattavat alentaa buprenorfiinin pitoisuuksia plasmassa, kun buprenorfiinin metabolia norbuprenorfiiniksi kiihtyy.
- MAO:n estäjät: Morfiinista saatujen kokemusten perusteella, opioidin vaikutus saattaa voimistua.
- Serotonergiset lääkevalmisteet, kuten MAO:n estäjät, selektiiviset serotoniinin takaisinoton estäjät (SSRI), serotoniinin ja noradrenaliinin takaisinoton estäjät (SNRI) tai trisykliset masennuslääkkeet; näiden lääkkeiden samanaikainen käyttö suurentaa serotoniinioireyhtymän (joka voi olla hengenvaarallinen tila) riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja buprenorfiinin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista ihmiseen kohdistuvaa riskiä ei tunneta.
Raskauden loppua kohti buprenorfiini voi aiheuttaa vastasyntyneillä hengityslamaa jopa lyhytaikaisen käytön jälkeen. Buprenorfiinin pitkäaikainen käyttö kolmen viimeisen raskauskuukauden aikana saattaa aiheuttaa vastasyntyneelle vieroitusoireyhtymän (esim. hypertoniaa, vapinaa, kiihtyneisyyttä, myoklonusta ja kouristuksia). Oireyhtymä voi olla lievempi ja pitkäkestoisempi kuin lyhytvaikutteisten puhtaiden μ-opioidiagonistien aiheuttama oireyhtymä. Oireyhtymä alkaa yleensä viivästyneenä, useita tunteja tai päiviä syntymän jälkeen. Oireyhtymän luonne voi vaihdella riippuen äidin aiemmasta lääkkeiden käyttöhistoriasta.
Buprenorfiinin pitkästä puoliintumisajasta johtuen raskauden lopulla on suositeltavaa harkita useita päiviä kestävää vastasyntyneen tilan seurantaa. Näin voidaan ehkäistä vastasyntyneiden hengityslaman ja vieroitusoireyhtymän riskiä.
Koska annosten suurentamisen ja raskauden aikaisen lisääntyneiden annosvaatimusten annosta on tarpeen suurentaa, Sixmo-hoitoa ei ole optimaalinen hoitovaihtoehto raskaana oleville naisille eikä sitä pidä heille aloittaa, sillä annoksen säätäminen ja lisääntyneet annosvaatimukset eivät ole toteutettavissa . Sixmo-valmisteen käyttöä ei suositella raskauden aikana eikä hedelmällisessä iässä oleville naisille, jotka eivät käytä ehkäisyä. Jos potilas tulee raskaaksi Sixmo-hoidon aikana, potilaalle hoidosta aiheutuvia hyötyjä on punnittava sikiölle koituviin riskeihin nähden. Yleisesti muita buprenorfiinihoitoja tai -lääkemuotoja pidetään tällaisessa tilanteessa soveltuvampina.
Imetys
Buprenorfiini ja sen metaboliitit erittyvät ihmisen rintamaitoon siinä määrin, että vaikutukset vastasyntyneeseen/imeväiseen ovat todennäköisiä. Siksi imetys on lopetettava Sixmo-hoidon ajaksi.
Hedelmällisyys
Ei ole olemassa tai on vain vähän tietoja buprenorfiinin vaikutuksista ihmisen hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Buprenorfiini voi vaikuttaa ajokykyyn ja kykyyn käyttää koneita, ja se saattaa heikentää henkistä tai fyysistä kykyä suoriutua potentiaalisesti vaarallisista tehtävistä, kuten autolla ajamisesta tai koneiden käytöstä. Valmiste saattaa aiheuttaa heitehuimausta, uneliaisuutta ja sedaatiota erityisesti hoidon alussa.
Buprenorfiinin pitoisuudet plasmassa ovat suurimmillaan ensimmäisten 24–48 tunnin aikana Sixmo-implantaattien asettamisen jälkeen. Erityisesti uneliaisuutta voi esiintyä viikon sen jälkeen, kun implantaatit on asetettu ihon alle;siksi potilaita on varoitettava autolla ajamiseen ja koneiden käyttöön liittyvistä riskeistä tänä aikana. Potilaiden on oltava varmoja siitä, ettei Sixmo-valmiste vaikuta haitallisesti heidän kykyynsä suoriutua tällaisista tehtävistä, ennen kuin he ajavat autolla tai käyttävät vaarallisia koneita.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Sixmo-valmisteen turvallisuutta arvioitiin viidessä faasin III tutkimuksessa (kolme kaksoissokkoutettua lumelääkekontrolloitua ja/tai verrokkivalmisteella kontrolloitua tutkimusta sekä kaksi avointa jatkotutkimusta).
Haittavaikutukset luokiteltiin implantaattiin liittyviksi tai liittymättömiksi haittavaikutuksiksi. Yleisimmät implantaattiin liittymättömät Sixmo-valmisteen haittavaikutukset kliinisissä tutkimuksissa olivat päänsärky, ummetus ja unettomuus. Ne ovat hyvin yleisiä tai yleisiä buprenorfiinin haittavaikutuksia.
Kun käytettiin nykyaikaisia (ja kaupallisessa käytössä olevia) asettamis- ja poistotekniikoita, implantaatiokohtaan liittyviä haittavaikutuksia raportoitiin 25,9 prosentilla potilaista kaksoissokkoutetuissa tutkimuksissa ja 14,1 prosentilla potilaista jatkotutkimuksissa. Yleisimmät implantaattiin liittyvät haittavaikutukset olivat implantaatiokohdan kipu, implantaatiokohdan kutina, implantaatiokohdan hematooma, implantaatiokohdan verenvuoto, implantaatiokohdan eryteema ja implantaatiokohdan ihottuma.
Haittavaikutustaulukko
Raportoidut (implantaattiin liittyvät ja liittymättömät) haittavaikutukset on lueteltu seuraavassa taulukossa. Haittavaikutukset on jaoteltu MedDRA-elinjärjestelmäluokkien, suositeltujen termien ja esiintyvyystiheyden mukaan.
Esiintyvyystiheydet on määritetty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1: Kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeen raportoidut Sixmo-valmisteen ja/tai muiden buprenorfiinivalmisteiden haittavaikutukset
Elinjärjestelmäluokka | Esiintyvyys | Haittavaikutus |
Infektiot | Yleinen | Virusinfektio, bronkiitti**, infektio**, influenssa**, faryngiitti**, riniitti** |
Melko harvinainen | Selluliitti, ihoinfektio, kurkkupaise, pustulaarinen ihottuma, virtsatieinfektio, ulkosynnyttimien ja emättimen sieni-infektio, implantaatiokohdan infektio*, implantaatiokohdan paise* | |
Veri ja imukudos | Melko harvinainen | Lymfadenopatia, neutropenia |
Aineenvaihdunta ja ravitsemus | Yleinen | Vähentynyt ruokahalu |
Melko harvinainen | Epätavallinen painonnousu, kuivuminen, lisääntynyt ruokahalu | |
Psyykkiset häiriöt | Yleinen | Unettomuus, ahdistuneisuus, vihamielisyys**, hermostuneisuus**, vainoharhaisuus** |
Melko harvinainen | Masennus, heikentynyt libido, unihäiriöt, apatia, euforinen mieliala, orgasmituntemusten heikkeneminen, levottomuus, ärtyneisyys, lääkeriippuvuus***, kiihtyneisyys***, epätavalliset ajatukset*** | |
Hermosto | Yleinen | Päänsärky, heitehuimaus, uneliaisuus, hypertonia**, pyörtyminen** |
Melko harvinainen | Heikentynyt tunto, migreeni, alentunut tajunnantaso, liikaunisuus, parestesia, vapina | |
Silmät | Yleinen | Mydriaasi** |
Melko harvinainen | Silmäerite, lakrimaatiohäiriöt, hämärtynyt näkö | |
Sydän | Yleinen | Sydämentykytys** |
Melko harvinainen | Eteislepatus, bradykardia | |
Verisuonisto | Yleinen | Kuumat aallot, vasodilataatio**, kohonnut verenpaine** |
Hengityselimet, rintakehä ja välikarsina | Yleinen | Yskä**, hengenahdistus** |
Melko harvinainen | Hengityslama, haukottelu | |
Ruoansulatuselimistö | Yleinen | Ummetus, pahoinvointi, oksentelu, ripuli, vatsakipu, ruoansulatuskanavan sairaudet**, hammassairaudet** |
Melko harvinainen | Suun kuivuminen, dyspepsia, ilmavaivat, veriulosteet | |
Iho ja ihonalainen kudos | Yleinen | Liikahikoilu |
Melko harvinainen | Kylmä hiki, ihon kuivuminen, ihottuma, iholeesiot, ekkymoosi* | |
Luusto, lihakset ja sidekudos | Yleinen | Luukipu**, myalgia** |
Melko harvinainen | Lihaskouristukset, epämukavat tuntemukset raajoissa, muskuloskeletaalinen kipu, niskakipu, raajakipu, leukanivelen toimintahäiriöoireyhtymä, nivelkipu*** | |
Munuaiset ja virtsatiet | Melko harvinainen | Virtsaamisen aloitusvaikeudet, virtsaamispakko, tiheävirtsaisuus |
Sukupuolielimet ja rinnat | Melko harvinainen | Kuukautiskipu, erektiohäiriö |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Väsymys, vilunväreet, voimattomuus, kipu, implantaatiokohdan hematooma*, implantaatiokohdan kipu*, implantaatiokohdan kutina*, implantaatiokohdan verenvuoto*, implantaatiokohdan eryteema*, implantaatiokohdan arvet*, rintakipu**, huonovointisuus***, vieroitusoireyhtymä*** |
Melko harvinainen | Perifeerinen edeema, epämukava olo, kasvojen edeema, palelu, kuume, turvotus, implantaatiokohdan edeema*, implantaatiokohdan reaktio*, implantaatin työntyminen ulos*, hidastunut paraneminen*, implantaatiokohdan parestesia*, implantaatiokohdan ihottuma*, arpeutuminen* | |
Tutkimukset | Yleinen | Alaniiniaminotransferaasin nousu |
Melko harvinainen | Aspartaattiaminotransferaasin nousu, laihtuminen, veren laktaattidehydrogenaasin nousu, gammaglutamyylitransferaasin nousu, painonnousu, veren alkalisen fosfataasin lasku, amylaasin nousu, veren bikarbonaatin nousu, veren bilirubiinin nousu, veren kolesterolin lasku, verensokerin nousu, hematokriitin lasku, hemoglobiinin lasku, lipaasin nousu, lymfosyyttien määrän lasku, solujen keskihemoglobiinin määrän nousu, epätavallinen punasolujen keskitilavuus, monosyyttien määrän nousu, neutrofiilen määrän nousu, verihiutaleiden määrän lasku, punasolujen määrän lasku | |
Vammat, myrkytykset ja hoitokomplikaatiot | Yleinen | Toimenpiteeseen liittyvä kipu*, toimenpidekohdan reaktio* |
Melko harvinainen | Toimenpiteen jälkeinen komplikaatio (*), kontuusio (*), haavan avautuminen*, lääkeimplantaatin siirtyminen pois paikaltaan***, laitteen särkyminen*** |
* Implantaatiokohdan haittavaikutus
(*) Havaitut implantaattiin liittyvät ja liittymättömät lääkkeen aiheuttamat haittavaikutukset
** Raportoitu muista myyntiluvan saaneista pelkästään buprenorfiinia sisältävistä lääkevalmisteista
*** Vain myyntiluvan myöntämisen jälkeiset tiedot
Valikoitujen haittavaikutusten kuvaus
Implantaattien asettamiseen ja poistoon liittyvien vakavien komplikaatioiden riski
Lääkeimplantaattien virheellinen asettaminen saattaa aiheuttaa harvinaisia mutta vakavia komplikaatioita kuten hermovaurioita ja implantaatin vaeltamisen , jotka voivat johtaa emboliaan ja kuolemaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Myyntiluvan myöntämisen jälkeen raportoitiin kaksi tapausta, joissa Sixmo-implantaatit olivat siirtyneet pois asettamiskohdasta. Kliinisissä tutkimuksissa kolmella hoitoa saaneella potilaalla ja myyntiluvan myöntämisen jälkeen yhdellä hoidetulla potilaalla implantaatteja tai niiden osia ei voitu paikallistaa eikä siksi myöskään poistaa hoidon loputtua. Kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeen havaittiin seitsemän kliinisesti merkittävää tapausta, joissa implantaatti rikkoontui (särkymiseen liittyi haittavaikutuksia).
Implantaatin ulostyöntymisriski
Virheellinen asettaminen tai infektiot voivat johtaa implantaatin esiin tai ulos työntymiseen. Sixmo-valmisteen kliinisissä tutkimuksissa havaittiin muutamia tällaisia tapauksia, jotka johtuivat pääosin virheellisestä asettamistekniikasta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi ,
Lääkealan turvallisuus- ja kehittämiskeskus Fimea,
Lääkkeiden haittavaikutusrekisteri,
PL 55
00034 FIMEA
Yliannostus
Oireet
Buprenorfiinin akuuttiin yliannostukseen liittyviä oireita ovat pienet pupillit, sedaatio, matala verenpaine, hengityslama ja kuolema.
Hoito
Tärkeimpiä toimenpiteitä ovat potilaan elintoimintoja ylläpitävä hoito sekä hengitysteiden varmistaminen ja hengityksen avustaminen tarvittaessa. Verenkiertoelinten sokin ja keuhkoedeeman hoitoon on käytettävä tarpeen mukaan tukitoimenpiteitä (esim. lisähappi, vasopressorit). Sydänpysähdyksen ja rytmihäiriöiden hoidossa tarvitaan tehoelvytystä.
Opioidiantagonisti naloksoni on spesifinen vasta-aine opioidien yliannostuksen aiheuttamaan hengityslamaan. Naloksoni voi olla hyödyllinen buprenorfiinin yliannostuksen hoidossa. Tavallista suuremmat annokset ja toistuva anto saattavat olla tarpeen.
Terveydenhuollon ammattilaisten on huomioitava buprenorfiinin potentiaalinen osuus ja vaikutukset, jos sitä annetaan yhdessä muiden keskushermostoa lamaavien lääkevalmisteiden, CYP3A4:n estäjien tai muiden opioidien kanssa, sekä maksan vajaatoimintaa sairastavilla potilailla, kun päätetään implantaattien mahdollisesta poistamisesta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut hermostoon vaikuttavat lääkeaineet, Opioidiriippuvuuden hoitoon käytettävät lääkeaineet, ATC-koodi: N07BC01
Vaikutusmekanismi
Buprenorfiini on osittainen opioidiagonisti/antagonisti, joka sitoutuu aivojen μ (myy)- ja κ (kappa) ‑reseptoreihin. Sen aktiivisuus opioidiriippuvuuden ylläpitohoidossa perustuu sen hitaasti palautuviin vaikutuksiin µ‑reseptoreissa, mikä minimoi muiden opioidien tarpeen pitkäksi aikaa.
Kliinisissä farmakologisissa kokeissa opioidiriippuvaisilla potilailla havaittiin buprenorfiinin kattovaikutus (ceiling effect) useissa farmakodynamiikkaa ja turvallisuutta koskevissa muuttujissa. Sillä on suhteellisen laaja terapeuttinen ikkuna sen osittaisten agonististen/antagonististen ominaisuuksien ansiosta, mikä vähentää sydän-, verisuoni- ja hengitystoimintojen lamaa.
Sixmo-valmisteen kliininen teho ja turvallisuus
Sixmo-valmisteen turvallisuutta ja tehoa tutkittiin kolmessa faasin III kaksoissokkoutetussa kliinisessä tutkimuksessa, joissa yhteensä 309 potilasta sai Sixmo-hoitoa enintään 6 kuukauden ajan (yksi implantaattijakso). Näistä 309 potilaasta yhteensä 107 potilasta hoidettiin jatkotutkimuksissa vielä toiset kuusi kuukautta (eli kaksi implantaattijaksoa).
Osoitettu teho perustuu pääosin tutkimukseen PRO‑814, joka on satunnaistettu, kaksoissokkoutettu ja vertailuvalmiste-kontrolloitu faasin III tutkimus aikuisilla potilalla, jotka täyttivät opioidiriippuvuuden DSM-IV-TR-kriteerit, ja joiden kliininen tila oli vakaa sublinguaalisen buprenorfiinin avulla. Tutkimuksessa noin 75 % potilaista ilmoitti väärinkäyttävänsä ensisijaisesti heille reseptillä määrättyjä opioideja, ja 21 % potilaista heroiinia. Implantaatin käyttöaika oli 24 viikkoa. Tutkimukseen osallistui 84 potilasta Sixmo-ryhmässä ja 89 potilasta sublinguaalisen buprenorfiinin ryhmässä. Mediaani-ikä (vaihteluväli) oli 36 (21–63) vuotta Sixmo-ryhmässä ja 37 (22–64) vuotta sublinguaalista buprenorfiinia käyttäneessä ryhmässä. Kaksoissokkoutetussa double-dummy -tutkimuksessa potilaiden enintään 8 mg:n päivittäinen sublinguaalinen buprenorfiiniannos vaihdettiin neljään Sixmo-implantaattin (ja päivittäiseeen sublinguaaliseen lumelääkkeeseen) tai sublinguaaliseeen lääkkeeseen, jonka annos oli enintään 8 mg/vrk (ja neljään lumelääkeimplantaattin). Ensisijaiseksi päätepisteeksi oli määritetty hoitovasteen saaneiden potilaiden osuus, jossa virtsakokeiden ja itseraportoinnin perusteella oli näyttöä luvattomasta opioidien käytöstä enintään kahden kuukauden ajalta yhteensä kuudesta kuukaudesta. Päätepistettä pidettiin kyseisessä käyttöaiheessa kliinisesti merkittävänä. Sixmo-valmisteen osoitettiin olevan vertailukelpoinen (non-inferior) sublinguaalisen buprenorfiinin kanssa, ja hoitovasteen saaneiden osuus oli 87,6 % sublinguaalista buprenorfiinia saaneiden ryhmässä ja 96,4 % Sixmo-ryhmässä. Vertailukelpoisuuden (non-inferiority) osoittamisen jälkeen tutkittiin ja osoitettiin Sixmo-valmisteen paremmuus verrattuna sublinguaaliseen buprenorfiiniin (p=0,034). Hoito-ohjelmassa pysyneiden osuus oli suuri, Sixmo-potilaista 96,4 % ja sublinguaalista buprenorfiinia saaneista potilaista 94,4 % oli mukana tutkimuksen loppuun saakka.
Lisäksi kahdessa satunnaistetussa, kaksoissokkoutetussa ja lumelääkekontrolloidussa faasin III tutkimuksessa saatiin tehoa ja farmakokinetiikkaa tukevia tietoja (tutkimukset PRO‑805 ja PRO‑806). Molemmissa tutkimuksissa opioidiriippuvaisia aikuispotilaita, jotka aloittivat buprenorfiinihoidon ensimmäistä kertaa, hoidettiin 24 viikon ajan neljällä Sixmo-implantaatilla tai neljällä lumelääkeimplantaatilla. Jos hoito neljän implantaatin annoksella ei ollut riittävää, potilaat saivat viidennen implantaatin. Tutkimukseen PRO‑806 sisältyi avoin vertailuhaara, jossa potilaat saivat sublinguaalista buprenorfiinia (12–16 mg/vrk). Kaikkien hoitoryhmien potilaat saivat käyttää buprenorfiinin lisäannoksia mahdollisten vieroitusoireiden tai käyttöhimon hallitsemiseksi ennalta määriteltyjen kriteerien mukaisesti.
Potilaiden ominaisuudet näissä tutkimuksissa on esitetty alla.
Taulukko 2: Potilaiden ominaisuudet tutkimuksissa PRO‑805 ja PRO‑806
Tutkimus PRO‑805 | Tutkimus PRO‑806 | ||||
Sixmo N=108 | Lumelääke N=55 | Sixmo N=114 | Lumelääke N=54 | Sublinguaalinen buprenorfiini N=119 | |
Mediaani-ikä (vaihteluväli), vuotta | 33 (19–62) | 39 (20–61) | 36 (19–60) | 33 (19–59) | 32 (18–60) |
Ensisijaisesti väärinkäytetty opioidi, n (%) | |||||
Heroiini | 69 (63,9 %) | 34 (61,8 %) | 76 (66,7 %) | 28 (51,9 %) | 75 (63,0 %) |
Määrätyt opioidit | 39 (36,1 %) | 21 (38,2 %) | 38 (33,3 %) | 26 (48,1 %) | 43 (36,1 %)* |
* Yhdellä potilaalla (0,8 %) ensisijaisesti väärinkäytetty opioidi kuului ryhmään “muut”.
Ensisijainen tehon päätepiste molemmissa tutkimuksissa oli väärinkäytettyjen opioidien suhteen negatiivisten virtsanäytteiden prosentuaalisen osuuden kertymäfunktio (cumulative distribution function, CDF) (arvioituna kolmesti viikossa tehdyn virtsan huume- ja lääkeaineseulan sekä potilaan opioidien käyttöä koskevan itseraportoinnin perusteella).
Tutkimuksen PRO‑805 ensisijainen päätepiste oli väärinkäytettyjen opioidien suhteen negatiivisten virtsanäytteiden prosentuaalisen osuuden kertymäfunktio viikoilla 1–16, ja toissijainen päätepiste oli vastaava kertymäfunktio viikoilla 17–24.
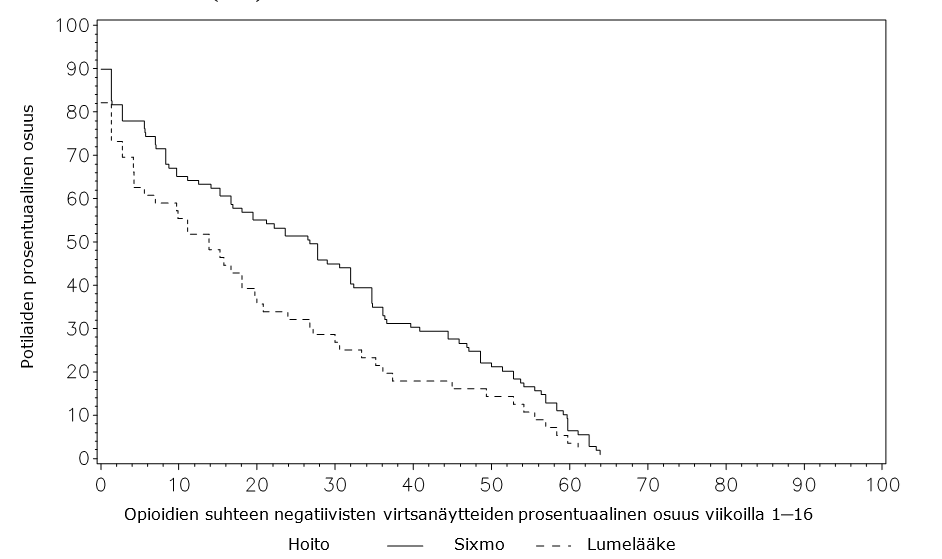
Taulukko 3: Opioidien suhteen negatiivisten virtsanäytteiden prosentuaalinen osuus viikoilla 1–16 ja viikoilla 17–24, tutkimus PRO‑805 (ITT)
Negatiivisten tulosten prosentuaalinen osuus | Sixmo N=108 | Lumelääke N=55 |
Viikot 1–16 | ||
Keskiarvo (SE) | 40,4 (3,15) | 28,3 (3,97) |
Keskiarvon CI | 34,18 - 46,68 | 20,33 - 36,26 |
Mediaani (vaihteluväli) | 40,7 (0; 98) | 20,8 (0; 92) |
Viikot 17–24 | ||
Keskiarvo (SE) | 29,0 (3,34) | 10,7 (3,19) |
Keskiarvon CI | 22,41 - 35,66 | 4,33 - 17,12 |
Mediaani (vaihteluväli) | 4,4 (0; 100) | 0,0 (0; 92) |
CI=luottamusväli, ITT=hoitoaie (intention-to-treat), N=tutkittavien lukumäärä, SE=keskivirhe
Kertymäfunktion analyysissa (viikot 1–16) hoitojen välillä havaittiin tilastollisesti merkitsevä ero (p=0,0361) Sixmo-valmisteen eduksi.
Kuva 1: Opioidien suhteen negatiivisten virtsanäytteiden kertymäfunktio viikoilla 1–16, tutkimus PRO‑805 (ITT)
ITT=hoitoaie (intention-to-treat)
Buprenorfiini ei sisältynyt virtsan huume- ja lääkeaineseuloihin.
Tutkimuksessa PRO‑806 oli kaksi ensisijaista päätepistettä: väärinkäytettyjen opioidien suhteen negatiivisten virtsanäytteiden prosentuaalisen osuuden kertymäfunktio viikoilla 1–24 Sixmo- ja lumelääkeryhmässä (ensisijainen 1) ja väärinkäytettyjen opioidien suhteen negatiivisten virtsanäytteiden prosentuaalisen osuuden kertymäfunktio viikoilla 1–24 Sixmo- ja lumelääkeryhmässä, johon kuului lääkkeiden luvattoman käytön itseraportoinnin imputointi (ensisijainen 2).
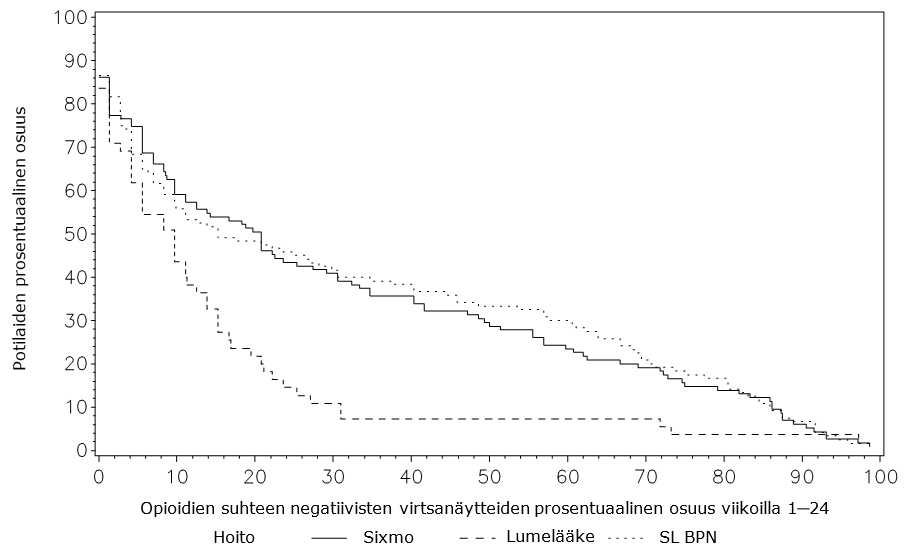
Taulukko 4: Opioidien suhteen negatiivisten virtsanäytteiden prosentuaalinen osuus viikoilla 1–24, tutkimus PRO‑806 (ITT)
Negatiivisten tulosten prosentuaalinen osuus | Sixmo N=114 | Lumelääke N=54 | Sublinguaalinen buprenorfiini N=119 |
Keskiarvo (SE) | 31,21 (2,968) | 13,41 (2,562) | 33,48 (3,103) |
Keskiarvon CI | 25,33 - 37,09 | 8,27 - 18,55 | 27,33 - 39,62 |
Mediaani (vaihteluväli) | 20,28 (0,0; 98,6) | 9,03 (0,0; 97,3) | 16,33 (0,0; 98,6) |
CI=luottamusväli, ITT=hoitoaie (intention-to-treat), N=tutkittavien lukumäärä, SE=keskivirhe
Kertymäfunktion analyysissa (ensisijainen päätepiste 1) hoitojen välillä havaittiin tilastollisesti merkitsevä ero (p<0,0001) Sixmo-valmisteen eduksi.
Kuva 2: Opioidien suhteen negatiivisten virtsanäytteiden kertymäfunktio viikoilla 1–24 (ensisijainen yhdistetty päätepiste 1), tutkimus PRO‑806 (ITT-populaatio)
ITT=hoitoaie (intention-to-treat), SL BPN = sublinguaalinen buprenorfiini
Buprenorfiini ei sisältynyt virtsan huume- ja lääkeaineseuloihin.
Ensisijaisen päätepisteen 2 kertymäfunktiot vastasivat olennaisilta osin päätepisteen 1 tuloksia (p < 0,0001).
Tutkimuksen PRO‑806 tärkeä toissijainen päätepiste oli ero Sixmo-valmistetta käyttäneiden potilaiden opioidien suhteen negatiivisten virtsanäytteiden suhteellisessa osuudessa 24 viikon ajalta verrattuna sublinguaalista buprenorfiinia saaneiden potilaiden virtsanäytteiden vastaavaan osuuteen. Vaikka vertailuhaara oli avoin, päätepistettä pidetään luotettavana, sillä se perustuu virtsan huume- ja lääkeaineseuloihin. Analyysissa opioidien suhteen negatiivisten virtsanäytteiden prosentuaalinen osuus sublinguaalista buprenorfiinia saaneiden ryhmässä (33 %) oli hyvin samankaltainen kuin Sixmo-ryhmässä (31 %), ja Sixmo-valmisteen osoitettiin olevan vertailukelpoinen (non-inferior) sublinguaalisen buprenorfiinin kanssa.
PRO‑805-tutkimuksessa 62,0 % ja PRO‑806-tutkimuksessa 39,5 % Sixmo-hoitoa saaneista tutkittavista tarvitsi lisäksi sublinguaalista buprenorfiinia. Sixmo-hoitoa saaneilla tutkittavilla annos oli keskimäärin 5,16 mg PRO‑805-tutkimuksessa 0,45 käyttöpäivänä viikossa, ja keskimäärin 3,16 mg PRO‑806-tutkimuksessa 0,31 käyttöpäivänä viikossa. Molemmissa tutkimuksissa sublinguaalista buprenorfiinia lisähoitona tarvinneiden tutkittavien suhteellinen osuus oli merkitsevästi suurempi lumelääkeryhmässä (90,9 % tutkittavista) kuin Sixmo-ryhmässä (66,7 % tutkittavista), ja käyttöpäiviä oli viikossa keskimäärin 2,17 (tutkimus PRO‑805) ja 1,27 (tutkimus PRO‑806).
Hoito-ohjelmassa pysyneiden osuus oli suuri Sixmo-ryhmissä, kun tutkimuksessa oli loppuun asti mukana 65,7 % (tutkimus PRO‑805) ja 64,0 % (tutkimus PRO‑806) potilaista.
Molemmissa tutkimuksissa suurin osa potilaista (noin 80 %) sai riittävän vasteen neljällä implantaatilla, noin 20 prosentilla potilaista annosta oli tarpeen nostaa viidenteen implantaattiin.
Osalla potilaista Sixmo-implantaatti rikkoontui poistamisen yhteydessä. Rikkoontuneiden implantaattien osuus väheni tutkimuksissa nykyisten menetelmien käyttöönoton ja koulutuksen myötä. Yleisesti ottaen implantaattien rikkoontumista ei pidetty tutkimuksissa potilasturvallisuutta heikentävänä tekijänä.
Taulukko 5: Sixmo-implantaattien särkyminen kaksoissokkoutetuissa faasin III tutkimuksissa
Nykyaikaiset menetelmät ja koulutus | |||
PRO‑806 | PRO‑811 | PRO‑814 | |
Sixmo N=99 | Sixmo N=78 | Sixmo N=82 | |
Särkyneiden implantaattien osuus (%) | 71 (17,0 %) | 81 (25,0 %) | 35 (10,7 %) |
Potilaat (%), joilla särkynyt implantaatti (särkyneitä implantaatteja) | 42 (42,4 %) | 38 (48,7 %) | 22 (26,8 %) |
N=niiden potilaiden lukumäärä, joista tieto oli saatavilla
Muut kuin valkoihoiset potilaat
Muiden kuin valkoihoisten potilaiden hoidosta Sixmo-valmisteella on toistaiseksi vain vähän kliinisiä kokemuksia.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Sixmo-valmisteen käytöstä kaikkien pediatristen potilasryhmien opioidiriippuvuuden hoidossa (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
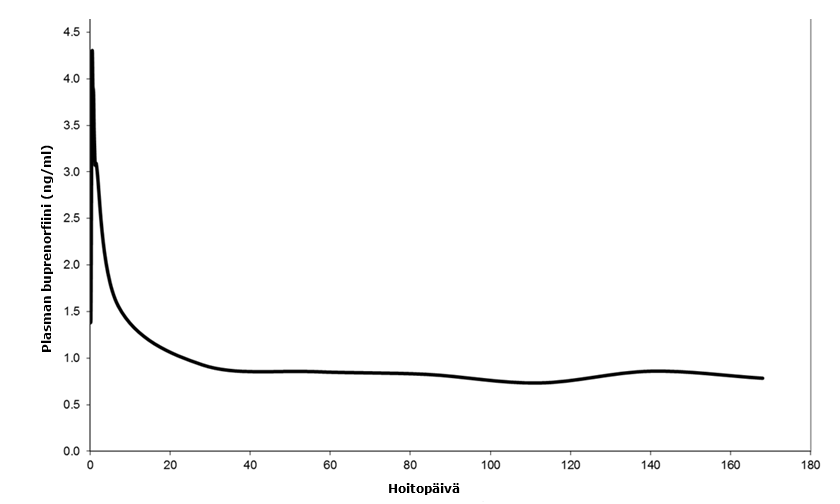
Sixmo-valmisteen farmakokinetiikkaa arvioitiin opioidiriippuvaisilla potilailla tutkimuksissa TTP‑400‑02‑01, PRO‑810, PRO‑805, PRO‑806, PRO‑807 ja PRO‑811. Tutkimusten PRO‑805, PRO‑806, PRO‑810 ja TTP‑400‑02‑01 lähtötilanteessa potilaat olivat kohtalaisesti tai vaikea-asteisesti opiodiriippuvaisia aikuisia, jotka eivät olleet aiemmin saaneet hoitoa. Suurin osa potilaista käytti pääasiassa heroiinia. Sixmo-implantaattien asettamisen jälkeen buprenorfiinin huippupitoisuuden mediaaniaika (Tmax) oli 12 tuntia. Tämän jälkeen plasman buprenorfiinipitoisuudet laskivat hitaasti, ja vakaa tila saavutettiin noin viikolla 4. Vakaan tilan buprenorfiinipitoisuudet plasmassa olivat yhdenmukaisia kaikissa kliinisissä tutkimuksissa, noin 0,5–1 ng/ml (neljällä implantaatilla), ja ne pysyivät sillä tasolla noin 20 viikon ajan (viikolta 4 viikolle 24) 24 viikon hoitojakson aikana. Vakaassa vaiheessa buprenorfiinipitoisuudet laskivat hieman viikkojen 4‑24 aikana. Yleisesti ottaen buprenorfiinin pitoisuudet plasmassa olivat vertailukelpoisia sublinguaalisen buprenorfiinin 8 mg:n vuorokausiannoksen kanssa.
Plasman buprenorfiinipitoisuudet on esitetty kuvassa 3. Plasman keskimääräiset buprenorfiinipitoisuudet 28. päivään asti perustuvat suhteellista biologista hyötyosuutta koskeneen tutkimuksen PRO‑810 (jossa kerättiin suuri määrä farmakokineettisiä näytteitä) tietoihin, kun taas 28. päivän jälkeiset pitoisuudet perustuvat tutkimuksista PRO‑805, PRO‑806, PRO‑807 ja PRO‑811 saatuihin yhdistettyihin tietoihin.
Kuva 3: Plasman buprenorfiinipitoisuudet Sixmo-implantaatin asettamisen jälkeen (pitoisuudet 28. päivään asti perustuvat tutkimukseen PRO‑810, ja pitoisuudet 28. päivän jälkeen perustuvat tutkimuksiin PRO‑805, PRO‑806, PRO‑807 ja PRO‑811)
Jakautuminen
Noin 96 % buprenorfiinista sitoutuu proteiineihin, pääasiassa alfa- ja beeta-globuliineihin.
Biotransformaatio
Buprenorfiini metaboloituu N‑dealkylaation kautta farmakologisesti aktiiviseksi päämetaboliitikseen norbuprenorfiiniksi, mitä seuraa glukuronidaatio. Norbuprenorfiinin katsottiin ensin muodostuvan CYP3A4:n avulla, mutta myöhemmät tutkimukset osoittivat myös CYP2C8:n osallisuuden. UDP‑glukuronyylitransferaasi voi katalysoida edelleen sekä buprenorfiinin että norbuprenorfiinin glukuronidaation.
Eliminaatio
Buprenorfiinin massatasapainotutkimuksessa osoitettiin radioaktiivisesti merkityn aineen täydellinen poistuminen virtsan (30 %) ja ulosteiden (69 %) mukana näytteissä, jotka oli kerätty 11 vuorokautta antamisen jälkeen. Annos erittyi lähes kokonaan buprenorfiinina, norbuprenorfiinina ja kahtena tunnistamattomana buprenorfiinin metaboliittina. Virtsassa lähes kaikki buprenorfiini ja norbuprenorfiini oli konjugoituneessa muodossa (buprenorfiini: 1 % vapaa ja 9,4 % konjugoitunut; norbuprenorfiini: 2,7 % vapaa ja 11 % konjugoitunut). Ulosteessa lähes kaikki buprenorfiini ja norbuprenorfiini oli vapaassa muodossa (buprenorfiini: 33 % vapaa ja 5 % konjugoitunut; norbuprenorfiini: 21 % vapaa ja 2 % konjugoitunut).
Buprenorfiinin eliminaation puoliintumisaika plasmassa oli keskimäärin 24–48 tuntia.
Erityisryhmät
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutuksia Sixmo-valmisteen farmakokinetiikkaan ei ole tutkittu.
Buprenorfiini metaboloituu pääasiassa maksassa, ja kohtalaista ja vaikeaa maksan vajaatoimintaa sairastavilla potilailla on havaittu kohonneita pitoisuuksia plasmassa.
Sixmo-hoito on vasta-aiheista vaikeaa maksan vajaatoimintaa sairastaville potilaille.
Munuaisten vajaatoiminta
Eliminaatio munuaisten kautta on melko vähäistä (noin 30 %) buprenorfiinin kokonaispuhdistumasta, eikä munuaisten vajaatoimintaa sairastavilla potilailla ole havaittu kohonneita pitoisuuksia plasmassa. Siksi Sixmo-annoksen säätämisen ei katsota olevan tarpeellista munuaisten vajaatoimintaa sairastavilla potilailla.
Iäkkäät
Sixmo-valmisteen kliinisiin tutkimuksiin ei ole osallistunut yli 65‑vuotiaita potilaita, joten valmisteen käyttöä tässä ikäryhmässä ei suositella. Buprenorfiinin tehoa ja turvallisuutta yli 65‑vuotiailla potilailla ei ole vielä varmistettu.
Prekliiniset tiedot turvallisuudesta
Sixmo-valmisteen ainesosien ja etyleeni-vinyyli-asetaatti-kopolymeerista valmistettujen lumelääkeimplantaattien tavanomaiset genotoksisuustestit olivat negatiivisia. Kirjallisuudesta saatavat tiedot eivät viittaa siihen, että buprenorfiinilla olisi genotoksisia ominaisuuksia.
Buprenorfiinin kliinisen käytön perusteella ei ole syytä epäillä karsinogeenisuutta.
Julkaisuja buprenorfiinin mahdollisista vaikutuksista miesten ja naisten hedelmällisyyteen ei ole saatavilla. Eläinkokeissa on havaittu lisääntymistoksisuutta.
Kun tiineenä olleet rotat altistettiin buprenorfiinille osmoottisten minipumppujen kautta 7. tiineyspäivästä alkaen, emon ruoan- ja vedenkulutus vähenivät tiineyspäivinä 7–20. Kuolleisuusindeksi oli merkitsevästi suurempi buprenorfiiniryhmissä, joissa alkioita kuoli enemmän ja kuolleena syntyneiden poikasten määrä lisääntyi. Syntyneiden poikasten paino oli yleensä pienempi 1. päivänä syntymän jälkeen kontrolliryhmään verrattuna. Ainoastaan prenataalikaudella buprenorfiinille altistuneiden poikasten paino oli samanlainen kuin kontrolliryhmässä ensimmäisten kolmen viikon aikana syntymän jälkeen. Syntymän jälkeen buprenorfiinille altistuneilla poikasilla havaittiin kuitenkin huomattavaa painon alenemista. Emon altistuminen buprenorfiinille lisäsi perinataalikuolleisuutta ja aiheutti joidenkin tärkeiden kehitysvaiheiden viivästymistä neonataaleilla rotilla.
Farmaseuttiset tiedot
Apuaineet
Etyleeni-vinyyli-asetaatti-kopolymeeri
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SIXMO implantaatti
74,2 mg (L:ei) 4 kpl (asetin) (2717,67 €)
PF-selosteen tieto
Sixmo-implantaatti on yksittäispakattu auki repäistävään PET-/LDPE-/alumiini/LDPE-annospussiin.
Implantaattipakkaus: 4 Sixmo-implantaattia ja 1 asetin
Valmisteen kuvaus:
Valkoinen/luonnonvalkoinen tai vaaleankeltainen sauvanmuotoinen implantaatti, joka on 26,5 mm pitkä, ja jonka läpimitta on 2,4 mm.
Käyttö- ja käsittelyohjeet
Poistetut implantaatit sisältävät merkittäviä määriä buprenorfiinijäännöksiä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SIXMO implantaatti
74,2 mg 4 kpl
- Ei korvausta.
ATC-koodi
N07BC01
Valmisteyhteenvedon muuttamispäivämäärä
17.12.2021
Yhteystiedot
 ACCORD HEALTHCARE OY
ACCORD HEALTHCARE OY Oksasenkatu 10 A 6
00100 Helsinki
Suomi
010 231 4180
