CRYSVITA injektioneste, liuos 10 mg, 20 mg, 30 mg
Vaikuttavat aineet ja niiden määrät
CRYSVITA 10 mg injektioneste, liuos
Yksi injektiopullo sisältää 10 mg burosumabia 1 ml:ssa liuosta.
CRYSVITA 20 mg injektioneste, liuos
Yksi injektiopullo sisältää 20 mg burosumabia 1 ml:ssa liuosta.
CRYSVITA 30 mg injektioneste, liuos
Yksi injektiopullo sisältää 30 mg burosumabia 1 ml:ssa liuosta.
CRYSVITA 10 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 10 mg burosumabia 0,33 ml:ssa liuosta.
CRYSVITA 20 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 20 mg burosumabia 0,67 ml:ssa liuosta.
CRYSVITA 30 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 30 mg burosumabia 1 ml:ssa liuosta.
Burosumabi on fibroblastikasvutekijä 23:n (FGF23) rekombinantti ihmisen monoklonaalinen IgG1-vasta-aine, joka on valmistettu yhdistelmä-DNA-tekniikalla käyttämällä kiinanhamsterin munasarjan (CHO) nisäkässoluviljelmää.
Apuaine(et), joiden vaikutus tunnetaan
Yksi injektiopullo sisältää 45,91 mg sorbitolia.
Yksi 10 mg esitäytetty ruisku sisältää 15,30 mg sorbitolia.
Yksi 20 mg esitäytetty ruisku sisältää 30,61 mg sorbitolia.
Yksi 30 mg esitäytetty ruisku sisältää 45,91 mg sorbitolia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste).
Kliiniset tiedot
Käyttöaiheet
CRYSVITA on tarkoitettu X‑kromosomaalisen hypofosfatemian hoitoon 1–17 vuoden ikäisille lapsille ja nuorille, joiden luustosairaudesta on röntgenologista näyttöä, ja aikuisille.
CRYSVITA on tarkoitettu FGF23:een liittyvän hypofosfatemian hoitoon tuumoriosteomalasiassa, johon liittyy fosfaturisia mesenkymaalisia kasvaimia, joita ei voi kuratiivisesti resekoida tai lokalisoida 1–17-vuotiailla lapsilla ja nuorilla ja aikuisilla.
Ehto
Hoidon saa aloittaa vain lääkäri, jolla on kokemusta aineenvaihdunta- tai luusairauksien hoidosta.
Annostus ja antotapa
Hoidon tulee aloittaa lääkäri, joka on perehtynyt metabolisten luustosairauksien hoitoon.
Annostus
Suun kautta otettavien fosfaattianalogien ja aktiivisten D‑vitamiinianalogien (esim. kalsitriolin) käyttö on lopetettava 1 viikko ennen hoidon aloitusta. Burosumabi lisää aktiivista D-vitamiinisynteesiä (ks. kohta Farmakodynamiikka), joten potilaiden inaktiivisella D-vitamiinilla toteutetun korvaushoidon tai ravintolisän tarve on arvioitava. D‑vitamiinikorvaushoito tai inaktiivisten muotojen täydentävä anto voidaan aloittaa tai sitä voidaan jatkaa paikallisten suositusten mukaisesti yhdistettynä seerumin kalsium- ja fosfaattipitoisuuksien seurantaan. Hoitoa aloitettaessa seerumin fosfaatin paastotason tulee olla iänmukaisen viitealueen alapuolella (ks. kohta Vasta-aiheet).
Seerumin kalsiumpitoisuutta on seurattava ennen hoidon aloittamista ja 1–2 viikkoa hoidon aloittamisen ja annosmuutosten jälkeen. Seerumin kalsiumpitoisuutta on seurattava säännöllisesti myös hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
X-kromosomaalinen hypofosfatemia
Annostus 1–17‑vuotiaille lapsille ja nuorille, joilla on X-kromosomaalinen hypofosfatemia
Suositeltu aloitusannos 1–17‑vuotiaille lapsille ja nuorille on 0,8 mg kehon painokiloa kohden 2 viikon välein annettuna. Annokset tulee pyöristää lähimpään 10 mg:aan. Enimmäisannos on 90 mg.
Seerumin fosfaatin paastopitoisuutta on seurattava asianmukaisesti burosumabihoidon aikana, mukaan lukien mahdollisen annoksen muuttamisen jälkeen, sen varmistamiseksi, että se pysyy iänmukaisen viitealueen sisällä. Seerumin fosfaattipitoisuuden mittaamiseksi otettavat verinäytteet on aina otettava noin 2 viikkoa annoksen saamisen jälkeen.
Burosumabihoidon aloituksen jälkeen seerumin fosfaatin paastopitoisuus tulee mitata 2 viikon välein ensimmäisenä hoitokuukautena, 4 viikon välein seuraavien 2 kuukauden ajan sekä tämän jälkeen tarpeen mukaan. Jos seerumin fosfaatin paastopitoisuus on iänmukaisella viitealueella, hoitoa jatketaan samalla annoksella.
Jos seerumin fosfaatin paastopitoisuus ei ole viitealueen sisällä, annoksen muuttaminen (annoksen suurentaminen/pienentäminen) voi olla tarpeen (ks. jäljempänä). Seerumin fosfaatin paastopitoisuus on mitattava 4 viikon kuluttua jokaisesta annosmuutoksesta. Jos seerumin fosfaatin paastopitoisuus on viitealueella uusintamittauksen kohdalla, uuden annoksen käyttöä jatketaan. Muussa tapauksessa on harkittava annoksen edelleen muuttamista.
Annoksen suurentaminen
Jos seerumin fosfaatin paastopitoisuus on iänmukaisen viitealueen alapuolella, annosta voidaan suurentaa asteittain 0,4 mg/kg kerrallaan enintään annokseen 2,0 mg/kg (enimmäisannos 90 mg). Seerumin fosfaatin paastopitoisuus tulee mitata 4 viikon kuluttua annosmuutoksesta. Burosumabiannosta ei saa muuttaa useammin kuin 4 viikon välein.
Annoksen pienentäminen
Jos seerumin fosfaatin paastopitoisuus on iänmukaisen viitealueen yläpuolella, seuraava annos on jätettävä väliin ja seerumin fosfaatin paastopitoisuus mitattava uudelleen 2 viikon kuluttua. Potilaan seerumin fosfaatin paastopitoisuuden tulee olla iänmukaisen viitealueen alapuolella, jotta burosumabihoito voidaan aloittaa uudelleen puolella aiemmasta annoksesta, edellä kuvatulla tavalla pyöristäen. Jos pitoisuus on edelleen viitealueen alapuolella ensimmäisen uudelleen aloittamisen yhteydessä annetun annoksen jälkeen, annosta voidaan suurentaa kohdassa Annoksen suurentaminen (edellä) kuvatulla tavalla.
Annoksen muuttaminen potilaan täyttäessä 18 vuotta
1–17‑vuotiaiden lasten ja nuorten hoidossa noudatetaan edellä annettuja annostusohjeita. Potilaan täyttäessä 18 vuotta annostus vaihdetaan aikuisten annokseksi ja hoito-ohjelmaksi, jotka on kuvattualla.
Annostus aikuisille, joilla on X-kromosomaalinen hypofosfatemia
Suositeltu aloitusannos aikuisille on 1,0 mg kehon painokiloa kohden 4 viikon välein annettuna. Annokset tulee pyöristää lähimpään 10 mg:aan. Enimmäisannos on 90 mg.
Burosumabihoidon aloituksen jälkeen seerumin fosfaatin paastopitoisuus tulee mitata 2 viikon välein ensimmäisenä hoitokuukautena, 4 viikon välein seuraavien 2 kuukauden ajan sekä tämän jälkeen tarpeen mukaan. Seerumin fosfaatin paastopitoisuus tulee mitata 2 viikon kuluttua edellisestä burosumabiannoksesta. Jos seerumin fosfaattipitoisuus on viitealueella, hoitoa jatketaan samalla annoksella.
Annoksen pienentäminen
Jos seerumin fosfaattipitoisuus on viitealueen yläpuolella, seuraava annos on jätettävä väliin ja seerumin fosfaattipitoisuus mitattava uudelleen 2 viikon kuluessa. Potilaan seerumin fosfaattipitoisuuden tulee olla viitealueen alapuolella, jotta burosumabihoito voidaan aloittaa uudelleen. Kun seerumin fosfaattipitoisuus on viitealueen alapuolella, hoito voidaan aloittaa uudelleen puolella alkuperäisestä aloitusannoksesta 4 viikon välein. Enimmäisannos on tällöin 40 mg. Seerumin fosfaattipitoisuus on mitattava uudelleen 2 viikon kuluttua jokaisesta annosmuutoksesta.
Jos pitoisuus on edelleen viitealueen alapuolella ensimmäisen uudelleen aloittamisen yhteydessä annetun annoksen jälkeen, annosta voidaan suurentaa lääkärin harkinnan perusteella enintään 1,0 mg:n/kg suurennuksin, pyöristettynä lähimpään 10 mg:aan (annettava [kokonais]annos on enintään 90 mg), 4 viikon välein annettuna. Seerumin fosfaattipitoisuus on mitattava uudelleen 2 viikon kuluttua annosmuutoksesta.
Tuumoriosteomalasia
Annostus 1–17-vuotiaille lapsille ja nuorille, joilla on tuumoriosteomalasia, on määritetty farmakokineettisellä mallintamisella ja simulaatiolla (ks. kohta Farmakokinetiikka)
Annostus 1–12-vuotiaille lapsille, joilla on tuumoriosteomalasia
Suositeltava aloitusannos 1–12-vuotiaille lapsille on 0,4 mg kehon painokiloa kohden 2 viikon välein annettuna. Annokset tulee pyöristää lähimpään 10 mg:aan. Enimmäisannos on 90 mg.
Annoksen suurentaminen
Jos seerumin fosfaattipitoisuus on iänmukaisen viitealueen alapuolella, annosta voidaan suurentaa asteittain. Annoksia tulee suurentaa seuraavasti: aluksi 0,6 mg/kg:lla ja tämän jälkeen suurennukset ovat potilaan hoitovasteesta riippuen 0,5 mg/kg (2,0 mg/kg:n enimmäisannokseen asti) pyöristäen määrää edellä kuvatulla tavalla enintään 90 mg:n enimmäisannokseen asti kahden viikon välein. Seerumin fosfaatin paastopitoisuus tulee mitata 4 viikon kuluttua annosmuutoksesta. Burosumabiannosta ei saa muuttaa useammin kuin 4 viikon välein.
Annostus 13–17-vuotiailla nuorilla, joilla on tuumoriosteomalasia
Suositeltava aloitusannos 13–17-vuotiaille nuorille on 0,3 mg kehon painokiloa kohden 2 viikon välein annettuna. Annokset tulee pyöristää lähimpään 10 mg:aan. Enimmäisannos on 180 mg.
Annoksen suurentaminen
Jos seerumin fosfaattipitoisuus on iänmukaisen viitealueen alapuolella, annosta voidaan suurentaa asteittain. Annoksia tulee suurentaa seuraavasti: aluksi 0,3 mg/kg:lla ja tämän jälkeen suurennukset ovat 0,2 mg/kg – 0,5 mg/kg (annoksen suurentamisen aste riippuu potilaan seerumin fosfaattipitoisuuden vasteesta hoitoon) pyöristäen määrää edellä kuvatulla tavalla 2,0 mg/kg:n enimmäisannokseen (enimmäisannos 180 mg) kahden viikon välein. Seerumin fosfaatin paastopitoisuus tulee mitata 4 viikon kuluttua annosmuutoksesta. Burosumabiannosta ei saa muuttaa useammin kuin 4 viikon välein.
Annostus 1–17-vuotiailla lapsilla ja nuorilla, joilla on tuumoriosteomalasia
Seerumin fosfaatin paastopitoisuutta on seurattava asianmukaisesti burosumabihoidon aikana, mukaan lukien mahdollisen annoksen muuttamisen jälkeen, sen varmistamiseksi, että se pysyy iänmukaisen viitealueen sisällä. Seerumin fosfaattipitoisuuden mittaamiseksi otettavat verinäytteet on otettava aina noin 2 viikkoa annoksen saamisen jälkeen.
Burosumabihoidon aloituksen jälkeen seerumin fosfaatin paastopitoisuus tulee mitata 2 viikon välein ensimmäisenä hoitokuukautena, 4 viikon välein seuraavien 2 kuukauden ajan sekä tämän jälkeen tarpeen mukaan. Jos seerumin fosfaatin paastopitoisuus on iänmukaisella viitealueella, sama annos on säilytettävä. Jos seerumin fosfaatin paastopitoisuus ei ole viitealueen sisällä, annoksen muuttaminen (annoksen suurentaminen/pienentäminen) voi olla tarpeen (ks. jäljempänä). Seerumin fosfaatin paastopitoisuus on mitattava 4 viikon kuluttua jokaisesta annosmuutoksesta. Jos seerumin fosfaatin paastopitoisuus on viitealueella uusintamittauksen kohdalla, uuden annoksen käyttöä jatketaan. Muussa tapauksessa on harkittava annoksen edelleen muuttamista.
Annoksen pienentäminen
Jos seerumin fosfaattipitoisuus on iänmukaisen viitealueen yläpuolella, seuraava annos on jätettävä väliin ja seerumin fosfaatin paastopitoisuus on mitattava uudelleen 2 viikon kuluttua. Seerumin fosfaattipitoisuuden tulee olla iänmukaisen viitealueen alapuolella, jotta hoito voidaan aloittaa uudelleen puolella aiemmasta annoksesta pyöristäen määrää edellä kuvatulla tavalla. Seerumin fosfaatin paastopitoisuus tulee mitata 4 viikon kuluttua annosmuutoksesta. Jos pitoisuus on iänmukaisen viitealueen alapuolella uudelleen aloitetun annoksen jälkeen, annosta voidaan muuttaa edelleen.
Annoksen muuttaminen potilaan täyttäessä 18 vuotta
Potilaan täyttäessä 18 vuotta annostus vaihdetaan aikuisten annokseksi ja hoito-ohjelmaksi, jotka on kuvattu alla.
Annostelu aikuisilla, joilla on tuumoriosteomalasia
Suositeltu aloitusannos aikuisille on 0,3 mg kehon painokiloa kohden 4 viikon välein annettuna. Annokset tulee pyöristää lähimpään 10 mg:aan.
Burosumabihoidon aloituksen jälkeen seerumin fosfaatin paastopitoisuus tulee mitata 4 viikon välein, 2 viikon kuluttua jokaisen annoksen jälkeen ensimmäisten 3 hoitokuukauden ajan sekä tämän jälkeen tarpeen mukaan. Jos seerumin fosfaattipitoisuus on viitealueella, hoitoa jatketaan samalla annoksella.
Annoksen suurentaminen
Jos seerumin fosfaattipitoisuus on viitealueen alapuolella, annosta voidaan suurentaa asteittain. Annoksia on suurennettava seuraavasti: aluksi 0,3 mg/kg:lla ja tämän jälkeen suurennukset ovat 0,2 mg/kg – 0,5 mg/kg (annos riippuu potilaan vasteesta hoitoon) 2,0 mg/kg:n enimmäisannokseen asti (enimmäisannos 180 mg) neljän viikon välein. Seerumin fosfaatin paastopitoisuus tulee mitata 2 viikkoa annoksen muuttamisen jälkeen.
Potilaille, joiden seerumin fosfaattipitoisuus on edelleen viitealueen alapuolella siitä huolimatta, että enimmäisannos on annettu 4 viikon välein, aikaisempi annos voidaan jakaa ja antaa 2 viikon välein asteittain suurentaen tarvittaessa edellä kuvatulla tavalla 2,0 mg/kg:n enimmäisannokseen asti 2 viikon välein (enimmäisannos 180 mg).
Annoksen pienentäminen
Jos seerumin fosfaattipitoisuus on viitealueen yläpuolella, seuraava annos on jätettävä väliin ja seerumin fosfaatin paastopitoisuus on mitattava uudelleen 2 viikon päästä. Potilaan seerumin fosfaattipitoisuuden on oltava viitealueen alapuolella ennen burosumabin aloittamista uudelleen. Kun seerumin fosfaattipitoisuus on viitealueen alapuolella, hoito voidaan aloittaa uudelleen noin puolella aikaisemmasta annoksesta, joka annetaan
- 4 viikon välein (potilaille, joille annetaan annos 4 viikon välein ennen annostelun keskeyttämistä)
- 2 viikon välein (potilaille, joille annetaan annos 2 viikon välein ennen annostelun keskeyttämistä).
Seerumin fosfaattipitoisuus tulee mitata uudelleen 2 viikon kuluttua jokaisen annosmuutoksen jälkeen.
Jos pitoisuus on viitealueen alapuolella uudelleen aloitetun annoksen jälkeen, annosta voidaan muuttaa edelleen.
Annoksen keskeyttäminen pediatrisilla ja aikuisilla potilailla, joilla on tuumoriosteomalasia
Jos potilaalle annetaan taustalla olevan tuumorin hoitoa (eli poisto leikkauksella tai sädehoito), burosumabihoito on keskeytettävä.
Kun taustalla olevan tuumorin hoito on saatu päätökseen, seerumin fosfaattipitoisuus on mitattava uudelleen ennen burosumabihoidon aloittamista uudelleen. Burosumabihoito on aloitettava uudelleen potilaan alkuperäisellä aloitusannoksella, jos seerumin fosfaattipitoisuus on normaalin viitealueen alapään alapuolella. Annosta pitää muuttaa edellä suositellulla tavalla, jotta seerumin fosfaattipitoisuus pysyy normaalilla viitealueella.
Kaikilla tuumoriosteomalasiapotilailla hoito on keskeytettävä, jos hoitavan lääkärin mielestä ei havaita merkityksellistä biokemiallisten tai kliinisten merkkiaineiden vasteisiin perustuvaa kohentumista annetusta enimmäisannoksesta huolimatta.
Kaikki potilaat
Ektooppisen mineralisaation riskin vähentämiseksi on suositeltavaa, että seerumin fosfaatin paastopitoisuuden tavoite on normaalin viitealueen alapäässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annoksen väliin jääminen
Hoidot voidaan tarvittaessa antaa myös aikataulun mukaista hoitopäivämäärää edeltävien tai sen jälkeisten 3 päivän aikana. Jos potilaan annos jää väliin, burosumabihoitoa tulee jatkaa määrätyllä annoksella mahdollisimman pian.
Erityisryhmät
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavista potilaista ei ole olemassa tietoja tai on vain vähän tietoja. Burosumabia ei pidä antaa potilaille, joilla on vaikea tai loppuvaiheen munuaissairaus (ks. kohta Vasta-aiheet).
Pediatriset potilaat
X-kromosomaalinen hypofosfatemia
Burosumabin turvallisuutta ja tehoa alle 1 vuoden ikäisten, X-kromosomaalista hypofosfatemiaa sairastavien pediatristen potilaiden hoidossa ei ole varmistettu kliinisissä tutkimuksissa.
Tuumoriosteomalasia
Burosumabin turvallisuutta ja tehoa tuumoriosteomalasiaa sairastavien pediatristen potilaiden hoidossa ei ole varmistettu kliinisissä tutkimuksissa.
Iäkkäät potilaat
Yli 65‑vuotiaista potilaista on niukasti tietoa saatavilla.
Antotapa
Ihon alle.
Burosumabi pistetään olkavarteen, vatsaan, pakaraan tai reiteen.
Enimmäismäärä lääkevalmistetta injektioaluetta kohden on 1,5 ml. Jos potilaalle on tarpeen antaa enemmän kuin 1,5 ml tiettynä antopäivänä, kokonaismäärä lääkevalmistetta on jaettava ja pistettävä kahdelle tai useammalle eri alueelle. Injektioalueita tulee vuorotella, ja niitä on tarkkailtava huolellisesti mahdollisten reaktioiden merkkien varalta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet burosumabin käsittelystä ennen lääkkeen antoa.
Osalle potilaista saattaa soveltua valmisteen anto itse tai hoitavan henkilön toimesta käyttämällä injektiopulloa ja/tai esitäytettyä ruiskua. Kun annoksen säätämiselle ei odoteta olevan välitöntä tarvetta, annon voi suorittaa henkilö, jolle on opetettu oikea injektiotekniikka. Hoidon aloituksen tai annosmuutoksen jälkeisen ensimmäisen itsenäisen annon on tapahduttava terveydenhuollon ammattilaisen valvonnassa. Potilaan kliinistä seurantaa, mukaan lukien fosfaattipitoisuuksien seurantaa, on jatkettava tarpeen mukaan ja jäljempänä annettujen ohjeiden mukaisesti. Pakkausselosteen lopussa on yksityiskohtainen potilaille tarkoitettu käyttöohje.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Samanaikainen anto suun kautta otettavien fosfaattianalogien tai aktiivisten D‑vitamiinianalogien kanssa (ks. kohta Yhteisvaikutukset).
Normaalin iänmukaisen viitealueen ylittävä seerumin fosfaatin paastopitoisuus hyperfosfatemian riskin vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vaikea munuaisten vajaatoiminta tai loppuvaiheen munuaissairaus.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi potilaan sairauskertomukseen.
Ektooppinen mineralisaatio
Nefrokalsinoosina ilmenevää ektooppista mineralisaatiota on havaittu X‑kromosomaalista hypofosfatemiaa sairastavilla potilailla, joita on hoidettu suun kautta otettavilla fosfaattianalogeilla ja aktiivisilla D‑vitamiinianalogeilla; tällaisten lääkevalmisteiden anto tulee lopettaa vähintään 1 viikko ennen burosumabihoidon aloittamista (ks. kohta Annostus ja antotapa).
Seuranta nefrokalsinoosin merkkien ja oireiden varalta, esim. munuaisten kaikukuvauksen avulla, on suositeltavaa hoidon alussa ja 6 kuukauden välein ensimmäisten 12 hoitokuukauden ajan sekä tämän jälkeen vuosittain. Plasman alkalisen fosfataasin, kalsiumin, lisäkilpirauhashormonin ja kreatiniinin pitoisuuksia on suositeltavaa seurata 6 kuukauden välein (1–2‑vuotiailla lapsilla 3 kuukauden välein) tai tarpeen mukaan.
Virtsan kalsium- ja fosfaattipitoisuuksia on suositeltavaa seurata 3 kuukauden välein.
Hyperfosfatemia
Seerumin fosfaatin paastopitoisuutta tulee seurata hyperfosfatemian riskin vuoksi. Ektooppisen mineralisaation riskin vähentämiseksi on suositeltavaa, että seerumin fosfaatin paastopitoisuuden tavoite on normaalin iänmukaisen viitealueen alapäässä. Hoidon tilapäinen keskeyttäminen ja/tai annoksen pienentäminen saattaa olla tarpeen (ks. kohta Annostus ja antotapa). Aterian jälkeisen seerumin fosfaattipitoisuuden säännöllistä mittaamista suositellaan.
Hyperfosfatemian estämiseksi burosumabihoito on keskeytettävä potilailla, joilla on tuumoriosteomalasia ja joille annetaan hoitoa taustalla olevaan tuumoriin. Burosumabihoito tulee aloittaa uudelleen vain, jos potilaan seerumin fosfaattipitoisuus pysyy normaalin viitealueen alapään alapuolella (ks. kohta Annostus ja antotapa).
Hyperkalsemia ja lisäkilpirauhasen liikatoiminta
Seerumin kalsium- tai lisäkilpirauhashormonipitoisuuden kohoamista on raportoitu potilailla burosumabihoidon aikana. Tietyt tekijät, kuten lisäkilpirauhasen liikatoiminta, pitkäaikaisempi immobilisaatio, nestehukka, D-hypervitaminoosi tai munuaisten vajaatoiminta, voivat lisätä hyperkalsemian riskiä. Erityisesti vaikeaa hyperkalsemiaa on raportoitu tutkittavilla, joilla on tertiäärinen lisäkilpirauhasen liikatoiminta. Seerumin kalsium- ja lisäkilpirauhashormonipitoisuutta on seurattava ennen burosumabihoitoa ja sen aikana (ks. kohta Annostus ja antotapa). Potilaille, joilla on kohtalainen tai vaikea hyperkalsemia (> 3 mmol/l), ei pidä antaa burosumabia ennen kuin hyperkalsemia on riittävästi hoidossa.
Pistoskohdan reaktiot
Burosumabin anto saattaa aiheuttaa paikallisia pistoskohdan reaktioita. Jos potilas saa vaikean pistoskohdan reaktion (ks. kohta Haittavaikutukset), anto on keskeytettävä ja reaktioon on annettava asianmukaista lääkärinhoitoa.
Yliherkkyys
Terapeuttisten proteiinien, kuten burosumabin, käyttöön saattaa liittyä yliherkkyysreaktioita. Kliinisissä tutkimuksissa on havaittu lieviä tai kohtalaisia yliherkkyysreaktioita (esim. ihottuma, pistoskohdan ihottuma, ks. kohta Haittavaikutukset). Vakavien yliherkkyysreaktioiden ilmaantuessa burosumabihoito on lopetettava ja reaktioon on annettava asianmukaista lääkärinhoitoa.
Apuaineet, joiden vaikutus tunnetaan
CRYSVITA injektioneste, liuos, injektiopullot
Tämä lääkevalmiste sisältää 45,91 mg sorbitolia per injektiopullo, mikä vastaa 45,91 mg:aa/ml.
Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Tämä lääkevalmiste sisältää 0,5 mg polysorbaatti 80:tä per injektiopullo, mikä vastaa 0,5 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
CRYSVITA 10 mg injektioneste, liuos, esitäytetty ruisku
Tämä lääkevalmiste sisältää 15,30 mg sorbitolia per esitäytetty ruisku, mikä vastaa 45,91 mg:aa/ml.
Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Tämä lääkevalmiste sisältää 0,165 mg polysorbaatti 80:tä per esitäytetty ruisku, mikä vastaa 0,5 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
CRYSVITA 20 mg injektioneste, liuos, esitäytetty ruisku
Tämä lääkevalmiste sisältää 30,61 mg sorbitolia per esitäytetty ruisku, mikä vastaa 45,91 mg:aa/ml.
Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Tämä lääkevalmiste sisältää 0,335 mg polysorbaatti 80:tä per esitäytetty ruisku, mikä vastaa 0,5 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
CRYSVITA 30 mg injektioneste, liuos, esitäytetty ruisku
Tämä lääkevalmiste sisältää 45,91 mg sorbitolia per esitäytetty ruisku, mikä vastaa 45,91 mg:aa/ml.
Tätä lääkevalmistetta ei pidä antaa potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI).
Tämä lääkevalmiste sisältää 0,5 mg polysorbaatti 80:tä per esitäytetty ruisku, mikä vastaa 0,5 mg:aa/ml. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Burosumabin samanaikainen anto suun kautta otettavien fosfaattianalogien ja aktiivisten D‑vitamiinianalogien kanssa on vasta-aiheista, sillä se saattaa lisätä hyperfosfatemian ja hyperkalsemian riskiä (ks. kohta Vasta-aiheet).
Varovaisuutta on noudatettava, kun burosumabia käytetään samanaikaisesti kalsimimeettisten lääkevalmisteiden kanssa (lääkeaineiden, jotka jäljittelevät kalsiumin vaikutusta kudoksiin aktivoimalla kalsiumreseptorin). Tällaisten lääkevalmisteiden samanaikaista antoa ei ole tutkittu kliinisissä tutkimuksissa, joten seerumin kalsiumpitoisuuksien tarkkaa seurantaa suositellaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä burosumabihoidon aikana ja vähintään 14 viikon ajan hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja burosumabin käytöstä raskaana oleville naisille.
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Burosumabin käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö burosumabi ihmisillä äidinmaitoon. Ihmisen IgG-aineiden tiedetään erittyvän äidinmaitoon ensimmäisten syntymän jälkeisten päivien aikana. Pitoisuudet muuttuvat pieniksi pian sen jälkeen. Tämän vuoksi imetettävään vastasyntyneeseen/ kohdistuvia riskejä ei voida poissulkea tämän lyhyen jakson aikana. Sen jälkeen burosumabin käyttöä voidaan harkita vain, jos se on kliinisesti tarpeen.
Hedelmällisyys
Eläinkokeissa on havaittu vaikutuksia urosten sukupuolielimiin (ks. kohta Prekliiniset tiedot turvallisuudesta). Ei ole olemassa kliinisiä tietoja burosumabin vaikutuksesta ihmisen hedelmällisyyteen. Burosumabilla ei tehty erityisiä hedelmällisyyttä koskevia eläinkokeita.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Burosumabilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Huimausta saattaa esiintyä burosumabin annon jälkeen.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kliinisissä tutkimuksissa yleisimmin (> 10 %) raportoidut lääkehaittavaikutukset pediatrisilla potilailla, joilla on X‑kromosomaalinen hypofosfatemia, perustuen loppuun vietyihin pitkäaikaisiin tutkimuksiin, joissa burosumabin enimmäisaltistus oli 214 viikkoa (turvallisuuspopulaatiossa altistumisaika vaihteli), olivat: yskä (55 %), pistoskohdan reaktiot (54 %), kuume (50 %), päänsärky (48 %), oksentelu (46 %), raajakipu (42 %), hammasabsessi (40 %), D‑vitamiinipitoisuuden laskeminen (28 %), ripuli (27 %), pahoinvointi (21 %), ihottuma (20 %), ummetus (12 %) ja hammaskaries (11 %).
Kliinisissä tutkimuksissa yleisimmin (> 10 %) raportoidut lääkehaittavaikutukset aikuispotilailla, joilla on X-kromosomaalinen hypofosfatemia, tai aikuispotilailla, joilla on tuumoriosteomalasia, perustuen loppuun vietyihin pitkäaikaisiin tutkimuksiin, joissa burosumabin enimmäisaltistus oli 300 viikkoa (turvallisuuspopulaatiossa altistumisaika vaihteli), olivat: selkäkipu (30 %), injektiokohdan reaktio (29 %), päänsärky (28 %), hammasinfektio (28 %), D-vitamiinipitoisuuden laskeminen (28 %), lihaskouristukset (18 %), levottomien jalkojen oireyhtymä (16 %), huimaus (16 %) ja ummetus (13 %) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet sekä ”Valittujen haittavaikutusten kuvaus” jäljempänä).
Haittavaikutukset taulukkomuodossa
Haittavaikutusten esiintyvyydet luetellaan taulukossa 1 (X-kromosomaalinen hypofosfatemia, pediatriset potilaat) ja taulukossa 2 (X-kromosomaalinen hypofosfatemia ja tuumoriosteomalasia, aikuispotilaat)
Haittavaikutukset on esitetty elinjärjestelmän ja yleisyysluokan mukaan. Yleisyysluokat ovat seuraavat: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on kussakin yleisyysluokassa esitetty vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: X-kromosomaalista hypofosfatemiaa sairastavilla 1–17‑vuotiailla pediatrisilla potilailla raportoidut, kliinisissä tutkimuksissa (N = 120) ja markkinoille tulon jälkeen havaitut haittavaikutukset
| MedDRA-elinjärjestelmäluokka | Yleisyysluokka | Haittavaikutus |
|---|---|---|
| Infektiot | Hyvin yleinen | Hammasabsessi1 |
| Umpieritys | Tuntematon | Lisäkilpirauhasen liikatoiminta2 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Aineenvaihdunta ja ravitsemus | Melko harvinainen | Hyperkalsemia3,4 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Tuntematon | Hyperkalsiuria5 | |
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Yskä6 |
| Hermosto | Hyvin yleinen | Päänsärky |
| Hyvin yleinen | Huimaus7 | |
| Ruoansulatuselimistö | Hyvin yleinen | Oksentelu Pahoinvointi Ripuli Ummetus Hammaskaries |
| Iho ja ihonalainen kudos | Hyvin yleinen | Ihottuma8 |
| Yleinen | Urtikaria4 | |
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Lihaskipu |
| Hyvin yleinen | Raajakipu | |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Pistoskohdan reaktio9 Kuume |
| Tutkimukset | Hyvin yleinen | D‑vitamiinipitoisuuden laskeminen10 |
| Yleinen | Veren lisäkilpirauhashormonipitoisuuden nouseminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)4 | |
| Tuntematon | Veren fosforipitoisuuden nouseminen11 |
1Hammasabsessi käsittää seuraavat: hammasabsessi, hammasinfektio ja hammassärky
2Lisäkilpirauhasen liikatoiminta käsittää seuraavat: lisäkilpirauhasen liikatoiminta, sekundaarinen lisäkilpirauhasen liikatoiminta ja tertiäärinen lisäkilpirauhasen liikatoiminta
3Hyperkalsemia käsittää seuraavat: hyperkalsemia ja veren kalsiumpitoisuuden nouseminen
4Havaittu kliinisissä tutkimuksissa, vahvistettu markkinoille tulon jälkeisen kokemuksen perusteella
5Hyperkalsiuria käsittää seuraavat: hyperkalsiuria ja virtsan kalsiumpitoisuuden nouseminen
6Yskä käsittää seuraavat: yskä, limaa tuottava yskä
7Huimaus käsittää seuraavat: huimaus, rasituksen yhteydessä esiintyvä huimaus
8Ihottuma käsittää seuraavat: ihottuma, punoittava ihottuma, yleistynyt ihottuma, kutiseva ihottuma, täpläinen ja näppyläinen ihottuma, märkärakkulainen ihottuma
9Pistoskohdan reaktio käsittää seuraavat: pistoskohdan reaktio, pistoskohdan punoitus, pistoskohdan kutina, pistoskohdan turvotus, pistoskohdan kipu, pistoskohdan ihottuma, pistoskohdan mustelma, pistoskohdan värimuutos, epämiellyttävät tuntemukset pistoskohdassa, pistoskohdan verenpurkauma, pistoskohdan verenvuoto, pistoskohdan kovettuma, pistoskohdan täplä ja pistoskohdan nokkosihottuma
10D‑vitamiinipitoisuuden laskeminen käsittää seuraavat: D‑vitamiinin puutos, veren 25‑hydroksikolekalsiferolipitoisuuden laskeminen ja D‑vitamiinipitoisuuden laskeminen
11Veren fosforipitoisuuden nouseminen käsittää seuraavat: veren fosforipitoisuuden nouseminen ja hyperfosfatemia
Taulukko 2: X-kromosomaalista hypofosfatemiaa sairastavilla (N = 176) ja tuumoriosteomalasiaa sairastavilla (N = 27) aikuisilla (N = 203) kliinisissä tutkimuksissa ja markkinoille tulon jälkeen havaitut haittavaikutukset
| MedDRA-elinjärjestelmäluokka | Yleisyysluokka | Haittavaikutus |
|---|---|---|
| Infektiot | Hyvin yleinen | Hammasinfektio1 |
| Umpieritys | Yleinen | Lisäkilpirauhasen liikatoiminta2,3 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Aineenvaihdunta ja ravitsemus | Yleinen | Hyperkalsemia3,4 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) Hyperkalsiuria5,6 |
| Hermosto | Hyvin yleinen | Päänsärky7 |
| Hyvin yleinen | Huimaus | |
| Hyvin yleinen | Levottomien jalkojen oireyhtymä | |
| Ruoansulatuselimistö | Hyvin yleinen | Ummetus |
| Iho ja ihonalainen kudos | Yleinen | Ihottuma8 Urtikaria5 |
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Selkäkipu |
| Lihaskouristukset | ||
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Pistoskohdan reaktio9 |
| Tutkimukset | Hyvin yleinen | D‑vitamiinipitoisuuden laskeminen10 |
| Yleinen | Veren fosforipitoisuuden nouseminen11 Veren lisäkilpirauhashormonipitoisuuden nouseminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)12 |
1Hammasinfektio käsittää seuraavat: hammasabsessi, hammasinfektio ja hammassärky
2Lisäkilpirauhasen liikatoiminta käsittää seuraavat: lisäkilpirauhasen liikatoiminta, sekundaarinen lisäkilpirauhasen liikatoiminta ja tertiäärinen lisäkilpirauhasen liikatoiminta
3Hyperkalsemia käsittää seuraavat: hyperkalsemia ja veren kalsiumpitoisuuden nouseminen
4Havaittu tuumoriosteomalasian kliinisissä tutkimuksissa, vahvistettu markkinoille tulon jälkeisen kokemuksen perusteella
5Havaittu X-kromosomaalisen hypofosfatemian kliinisissä tutkimuksissa, vahvistettu markkinoille tulon jälkeisen kokemuksen perusteella
6Hyperkalsiuria käsittää seuraavat: hyperkalsiuria ja virtsan kalsiumpitoisuuden nouseminen
7Päänsärky käsittää seuraavat: päänsärky ja epämiellyttävät tuntemukset päässä
8Ihottuma käsittää seuraavat: ihottuma, näppyläinen ihottuma ja punoittava ihottuma
9Pistoskohdan reaktio käsittää seuraavat: pistoskohdan reaktio, pistoskohdan punoitus, pistoskohdan kutina, pistoskohdan turvotus, pistoskohdan kipu, pistoskohdan ihottuma, pistoskohdan mustelma, pistoskohdan värimuutos, epämiellyttävät tuntemukset pistoskohdassa, pistoskohdan verenpurkauma, pistoskohdan verenvuoto, pistoskohdan kovettuma, pistoskohdan täplä, pistoskohdan nokkosihottuma, pistoskohdan yliherkkyys ja pistoskohdan tulehdus
10D‑vitamiinipitoisuuden laskeminen käsittää seuraavat: D‑vitamiinin puutos, veren 25‑hydroksikolekalsiferolipitoisuuden laskeminen ja D‑vitamiinipitoisuuden laskeminen
11Veren fosforipitoisuuden nouseminen käsittää seuraavat: veren fosforipitoisuuden nouseminen ja hyperfosfatemia
12Havaittu X-kromosomaalisen hypofosfatemian ja tuumoriosteomalasian kliinisissä tutkimuksissa, vahvistettu markkinoille tulon jälkeisen kokemuksen perusteella
Valittujen haittavaikutusten kuvaus
Pistoskohdan reaktiot
X-kromosomaalista hypofosfatemiaa sairastavat pediatriset potilaat:
Paikallisia pistoskohdan reaktioita (esim. nokkosihottuma, punoitus, ihottuma, turvotus, mustelma, kipu, kutina ja verenpurkauma) on esiintynyt. Pediatrisissa kliinisissä tutkimuksissa noin 54 % potilaista sai pistoskohdan reaktion. Pistoskohdan reaktiot olivat useimmiten vaikeusasteeltaan lieviä, ilmenivät 1 vuorokauden kuluessa lääkevalmisteen annosta, kestivät enimmäkseen 1–3 vuorokautta, eivät vaatineet hoitoa sekä hävisivät lähes kaikissa tapauksissa.
X-kromosomaalista hypofosfatemiaa tai tuumoriosteomalasiaa sairastavat aikuispotilaat:
Pistoskohdan reaktiot olivat useimmiten vaikeusasteeltaan lieviä, eivät vaatineet hoitoa ja hävisivät lähes kaikissa tapauksissa.
X-kromosomaalista hypofosfatemiaa sairastavilla potilailla tutkimuksen UX023‑CL303 lumekontrolloidussa hoitojaksossa pistoskohdan reaktioiden (pistoskohdan reaktio, punoitus, ihottuma, mustelma, kipu, kutina ja verenpurkauma) esiintyvyys oli 12 % sekä burosumabia saaneessa että lumelääkettä saaneessa hoitoryhmässä.
Tuumoriosteomalasiaa sairastavilla potilailla pistoskohdan reaktioiden esiintyvyys perustuen tietoihin loppuun saatetuista pitkistä kliinisistä tutkimuksista oli 22 % (pistoskohdan reaktio, pistoskohdan kipu ja pistoskohdan turvotus).
Yliherkkyys
X-kromosomaalista hypofosfatemiaa sairastavat pediatriset potilaat:
Yliherkkyysreaktioita (esim. pistoskohdan reaktiot, ihottuma, nokkosihottuma, kasvojen turvotus, ihotulehdus) raportoitiin kliinisissä tutkimuksissa 39 %:lla pediatrisista potilaista. Kaikki raportoidut reaktiot olivat vaikeusasteeltaan lieviä tai kohtalaisia.
X-kromosomaalista hypofosfatemiaa tai tuumoriosteomalasiaa sairastavat aikuispotilaat:
Yliherkkyysreaktiot olivat vaikeusasteeltaan lieviä tai kohtalaisia.
X-kromosomaalista hypofosfatemiaa sairastavilla potilailla tutkimuksen UX023‑CL303 lumekontrolloidussa hoitojaksossa mahdollisten yliherkkyysreaktioiden ilmaantuvuus oli samankaltainen (6 %) burosumabia ja lumelääkettä saaneilla aikuisilla.
Tuumoriosteomalasiaa sairastavilla potilailla yliherkkyysreaktioiden esiintyvyys (ihottuma, lääkeaineihottuma ja yliherkkyys) oli 30 % perustuen tietoihin loppuun saatetuista pitkistä kliinisistä tutkimuksista.
D‑vitamiinipitoisuuden laskeminen
X-kromosomaalista hypofosfatemiaa sairastavat pediatriset potilaat:
Burosumabihoidon aloittamisen jälkeistä seerumin 25‑hydroksi-D‑vitamiinin pitoisuuden laskemista on havaittu noin 8 %:lla pediatrisista potilaista. Sen mahdollisena syynä pidetään lisääntynyttä muuntumista aktivoituneeksi 1,25‑dihydroksi-D‑vitamiiniksi. Inaktiivisen D‑vitamiinin täydentävä anto normalisoi pitoisuudet plasmassa onnistuneesti.
Hyperfosfatemia
X-kromosomaalista hypofosfatemiaa sairastavat tai tuumoriosteomalasiaa sairastavat aikuispotilaat:
X-kromosomaalista hypofosfatemiaa sairastavilla potilailla UX023‑CL303-tutkimuksen lumekontrolloidun hoitojakson aikana 9:llä burosumabiryhmän potilaalla (13,2 %) mitattiin vähintään yksi korkea seerumin fosfaattiarvo. Näistä 9:stä viiden potilaan annosta oli tarpeen pienentää tutkimussuunnitelman mukaisesti. Kun burosumabihoito oli aloitettu avoimessa jatkohoitovaiheessa, 8:lla lumelääke→burosumabiryhmän potilaalla (12,1 %) mitattiin korkea seerumin fosfaattiarvo. Näistä 8:sta neljän potilaan annosta oli tarpeen pienentää tutkimussuunnitelman mukaisesti. Annoksen pienennys tutkimussuunnitelman kriteerit täyttäville potilaille oli 50 %. Yhden potilaan (1 %) annosta oli tarpeen pienentää toisen kerran hyperfosfatemian jatkumisen vuoksi.
Loppuun saatetuista pitkistä kliinisistä tutkimuksista saatuihin tietoihin perustuen tuumoriosteomalasiaa sairastavista potilaista 11 %:lla oli hyperfosfatemiatapahtumia, joita hoidettiin annosta pienentämällä.
Levottomien jalkojen oireyhtymä
X-kromosomaalista hypofosfatemiaa sairastavat tai tuumoriosteomalasiaa sairastavat aikuispotilaat:
X-kromosomaalista hypofosfatemiaa sairastavilla potilaillaUX023‑CL303-tutkimuksen lumekontrolloidun hoitojakson aikana noin 12 %:lla burosumabiryhmän ja 8 %:lla lumelääkeryhmän aikuisista levottomien jalkojen oireyhtymä paheni lähtötilanteesta tai ilmeni ensimmäistä kertaa tutkimuksen aikana. Ensimmäistä kertaa ilmenneet oireet olivat vaikeusasteeltaan lieviä tai kohtalaisia.
Loppuun saatetuista pitkistä kliinisistä tutkimuksista saatuihin tietoihin perustuen tuumoriosteomalasiaa sairastavista potilaista 11 %:lla ilmeni levottomien jalkojen oireyhtymän tapahtumia, jotka olivat vaikeusasteeltaan lieviä tai kohtalaisia.
Immunogeenisuus
X-kromosomaalista hypofosfatemiaa sairastavat pediatriset potilaat:
Burosumabille muodostuneiden lääkevasta-aineiden kokonaisilmaantuvuus kliinisissä tutkimuksissa burosumabia saaneilla pediatrisilla potilailla oli 10 %. Neutralisoivien lääkevasta-aineiden ilmaantuvuus pediatrisilla potilailla oli 3 %. Näihin löydöksiin ei liittynyt haittatapahtumia, tehon heikkenemistä eikä burosumabin farmakokineettisen profiilin muutoksia.
X-kromosomaalista hypofosfatemiaa ja tuumoriosteomalasiaa sairastavat aikuispotilaat:
Burosumabille muodostuneiden lääkevasta-aineiden kokonaisilmaantuvuus burosumabia saaneilla aikuispotilailla, jotka sairastivat X-kromosomaalista hypofosfatemiaa tai tuumoriosteomalasiaa, oli 15 % loppuun saatetuista pitkistä kliinisistä tutkimuksista saatujen tietojen mukaan. Yhdellekään näistä potilaista ei kehittynyt neutraloivia lääkevasta-aineita. Näihin löydöksiin ei liittynyt haittatapahtumia, tehon heikkenemistä eikä burosumabin farmakokineettisen profiilin muutoksia.
Haittavaikutukset tuumoriosteomalasiaa sairastavilla pediatrisilla potilailla
Tuumoriosteomalasiaa sairastavista pediatrisista potilaista ei ole saatavilla tietoja (ks. kohta Farmakodynamiikka).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Burosumabin yliannostuksesta ei ole kokemuksia. Burosumabia on annettu X-kromosomaalista hypofosfatemiaa koskevissa pediatrisissa kliinisissä tutkimuksissa ilman annosta rajoittavaa toksisuutta enintään 2,0 mg/painokg:n annoksina, enimmäisannoksena 90 mg, 2 viikon välein annettuna. Aikuisten X-kromosomaalista hypofosfatemiaa koskevissa kliinisissä tutkimuksissa ei ole havaittu annosta rajoittavaa toksisuutta enintään 1,0 mg/painokg:n annoksilla, enimmäisannoksena 128 mg, 4 viikon välein annettuna. Aikuisten tuumoriosteomalasiaa koskevissa kliinisissä tutkimuksissa ei ole havaittu annosta rajoittavaa toksisuutta enintään 2,0 mg/painokg:n annoksilla tai 184 mg:n enimmäisannoksella 4 viikon välein annettuna.
Hoito
Yliannostustapauksessa on suositeltavaa keskeyttää burosumabihoito ja seurata potilaan biokemiallista vastetta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Luukudokseen vaikuttavat lääkkeet, muut luukudokseen vaikuttavat lääkkeet, ATC‑koodi: M05BX05.
Vaikutusmekanismi
Burosumabi on rekombinantti ihmisen monoklonaalinen vasta-aine (IgG1), joka sitoutuu fibroblastikavutekijä 23:een (FGF23) ja estää sen toimintaa. Estämällä FGF23:a burosumabi lisää fosfaatin tubulaarista reabsorptiota munuaisissa ja suurentaa seerumin 1,25‑dihydroksi-D‑vitamiinipitoisuutta.
Kliininen teho X‑kromosomaalista hypofosfatemiaa sairastavilla pediatrisilla potilailla
Tutkimus UX023‑CL301
Pediatrisessa UX203‑CL301-tutkimuksessa 61 iältään 1–12‑vuotiasta potilasta (56 % tyttöjä, 44 % poikia, keski-ikä [SD] ensimmäisen annoksen yhteydessä: 6,3 [3,31] vuotta) satunnaistettiin saamaan burosumabia (n = 29) tai aktiiviseen verrokkiryhmään (n = 32; suun kautta annettava fosfaatti ja aktiivinen D‑vitamiini). Tutkimukseen otettaessa kaikkien potilaiden oli pitänyt saada hoitoa suun kautta annettava fosfaatilla tai aktiivisella D‑vitamiinilla vähintään 6 kuukauden ajan. Kaikilla potilailla oli röntgenologista näyttöä X‑kromosomaalisesta hypofosfatemiasta johtuvasta riisitaudista (riisitaudin RSS-vaikeusasteluokitus ≥ 2). Burosumabihoito aloitettiin annoksella 0,8 mg/kg 2 viikon välein, ja annos suurennettiin 1,2 mg/kg:aan, jos vaste oli riittämätön seerumin fosfaatin paastoarvona mitattuna. Aktiiviseen verrokkiryhmään satunnaistetut potilaat saivat suun kautta annettavaa fosfaattia ja aktiivista D‑vitamiinia useita päivittäisiä annoksia.
Ensisijainen tehon päätetapahtuma oli riisitaudin vaikeusasteen muutos burosumabiryhmässä viikolla 40 RGI-C (Radiographic Global Impression of Change) ‑vertailuasteikon pisteillä mitattuna aktiiviseen verrokkiryhmään verrattuna.
RGI-C-vertailuasteikko on 7‑kohtainen ordinaaliasteikko, jonka avulla verrataan potilaan riisitautia ennen hoitoa ja hoidon jälkeen samojen poikkeavuuksien osalta kuin alla kuvatussa RSS-luokituksessa. RGI-C-asteikon pisteiden skaala on -3–+3, jossa -3 tarkoittaa riisitaudin vaikeaa pahenemista ja +3 täydellistä paranemista.
Pediatrisen riisitaudin vaikeusastetta mitattiin käyttämällä RSS-luokitusta, röntgenologista pisteytysmenetelmää, joka perustuu metafyysin leviämisen ja kovertumisen asteeseen sekä kasvulevyn poikkeavan alueen kokoon. Tutkimuksessa UX023‑CL301 RSS-pisteet määritettiin käyttämällä ennalta laadittua asteikkoa, joka koski tiettyjä muutoksia ranteissa ja polvissa.
Kaikki potilaat (n = 61) olivat mukana 64 viikon pituisen satunnaistetun hoitojakson loppuun asti. Kenenkään potilaan annosta ei pienennetty, ja 8 burosumabihoitoa saavan potilaan (28 %) annos suurennettiin 1,2 mg/kg:aan. Yhteensä 51 potilasta osallistui jatkohoitojaksoon, 26 potilasta aktiivinen verrokki → burosumabi -ryhmässä ja 25 potilasta burosumabi → burosumabi -ryhmässä, ja potilaat saivat burosumabihoitoa enintään 124 viikon ajan.
Ensisijaiset tehon tulokset
Riisitauti oli viikolla 40 parantunut enemmän burosumabiryhmän potilailla kuin aktiivisen verrokkiryhmän potilailla, ja tämä vaikutus oli säilynyt viikolla 64, kuten kuvassa 1 on esitetty. Nämä tulokset säilyivät viikolle 88 (n = 21).
Kuva 1: RGI-C-kokonaispisteet (keskiarvo ± keskivirhe) – ensisijainen päätetapahtuma viikoilla 40 ja 64 (koko analyysijoukko)
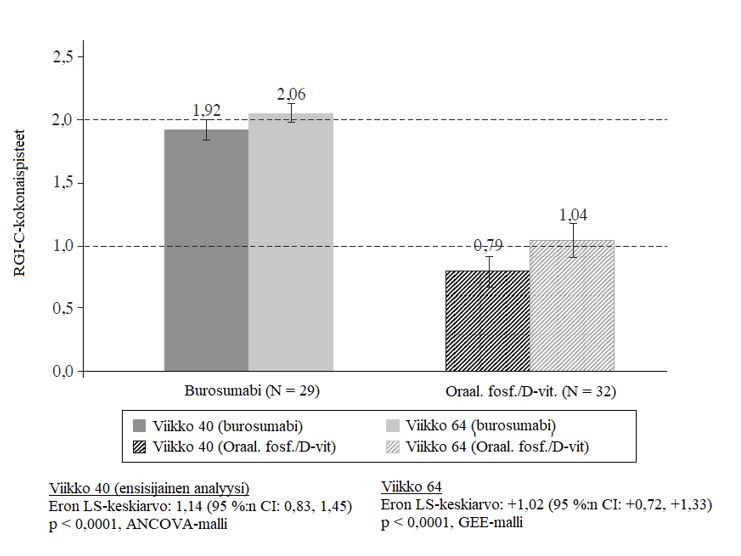
Toissijaiset tehon tulokset
Tärkeimmät toissijaisten tehon päätetapahtumien tulokset viikoilla 40 ja 64 on esitetty taulukossa 3. Nämä tulokset säilyivät viikolle 88 (n = 21).
Taulukko 3: Toissijaisten tehon päätetapahtumien tulokset
| Päätetapahtuma | Viikko | Aktiivinen verrokki LS Mean (SE) | Burosumabi LS Mean (SE) | Ero (burosumabi – aktiivinen verrokki) |
Alaraajojen epämuodostumat; arvioitiin RGI-C-asteikon avulla (GEE-malli) | 40 | +0,22 (0,080) | +0,62 (0,153) | +0,40 [95 %:n luottamusväli: 0,07, 0,72] p = 0,0162 |
| 64 | +0,29 (0,119) | +1,25 (0,170) | +0,97 [95 %:n luottamusväli: +0,57, +1,37] p < 0,0001 | |
| Pituus; Z-pisteet | Lähtötilanne | -2,05 (0,87) | -2,32 (1,17) | |
| 40 a | +0,03 (0,031) | +0,16 (0,052) | +0,12 [95 %:n luottamusväli: 0,01, 0,24] p = 0,0408 | |
| 64 b | +0,02 (0,035) | +0,17 (0,066) | +0,14 [95 %:n luottamusväli: 0,00, 0,29] p = 0,0490 | |
| Riisitaudin vaikeusaste; RSS-kokonaispisteet | Lähtötilanne | 3,19 (1,141) | 3,17 (0,975) | |
| 40 a | -0,72 (0,162) | -2,08 (0,104) | -1,34 [95 %:n luottamusväli: 1,74, -0,94] p < 0,0001 | |
| 64 b | -1,01 (0,151) | -2,23 (0,117) | -1,21 [95 %:n luottamusväli: -1,59, -0,83] p < 0,0001 | |
| Seerumin AFOS (U/l) | Lähtötilanne | 523 (154) | 511 (125) | |
| 40 a | 489 (189) | 381 (99) | -97 [95 %:n luottamusväli: -138, -56] p < 0,0001 | |
| 64 b | 495 (182) | 337 (86) | -147 [95 %:n luottamusväli: -192, -102] p < 0,0001 | |
| Kuuden minuutin kävelytesti (m) | Lähtötilanne | 450 (106) | 385 (86) | |
| 40 a | +4 (14) | +47 (16) | +43 [95 %:n luottamusväli: -0,3, 87] p = 0,0514 | |
| 64 b | +29 (17) | +75 (13) | +46 [95 %:n luottamusväli: 2, 89] p = 0,0399 |
a: Muutos lähtötilanteesta viikolle 40 ANCOVA-mallista.
b: Muutos lähtötilanteesta viikolle 64 GEE-mallista.
Seerumin fosfaatti
Kullakin niistä tutkimuskäynneistä, joilla seerumin fosfaatti arvioitiin kummassakin hoitoryhmässä, muutokset seerumin fosfaatissa lähtötilanteeseen nähden olivat suurempia burosumabiryhmässä kuin aktiivisessa verrokkiryhmässä (p < 0,0001; GEE-malli) (kuva 2).
Kuva 2: Seerumin fosfaattipitoisuus ja muutos lähtötilanteesta (mg/dl) (keskiarvo± keskivirhe) hoitoryhmittäin (farmakodynaaminen analyysijoukko)
Huomautus: Kuvassa oleva katkoviiva osoittaa seerumin fosfaatin normaalin viitealueen alarajan, 3,2 mg/dl (1,03 mmol/l)
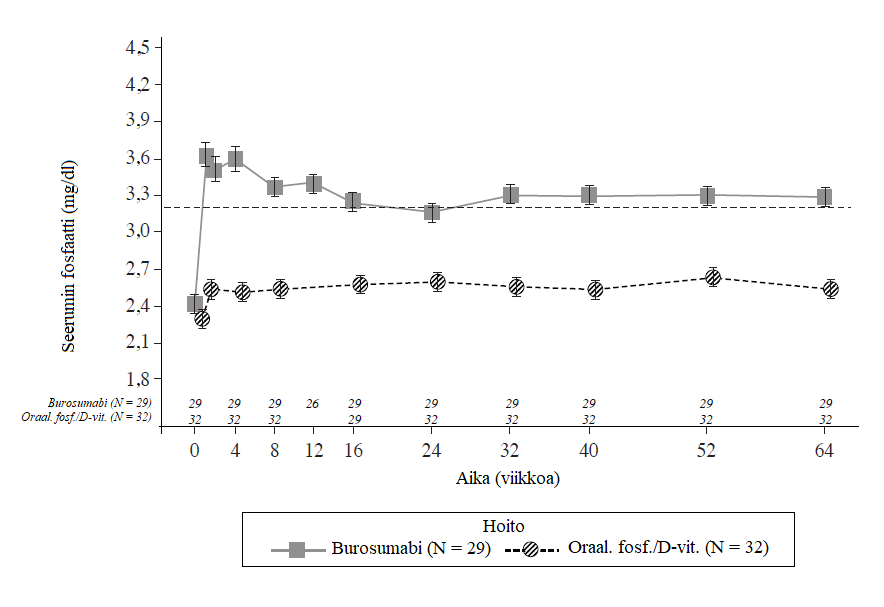
Tulokset säilyivät jatkohoitojakson (viikko 66 – viikko 140) ajan molemmissa hoitoryhmissä (burosumabi → burosumabi -ryhmässä [n = 25] ja aktiivinen verrokki → burosumabi -ryhmässä [n = 26]).
Tutkimus UX023‑CL201
Pediatrisessa UX023‑CL201-tutkimuksessa 52 X‑kromosomaalista hypofosfatemiaa sairastavaa
5–12 vuoden ikäistä potilasta (keski-ikä 8,5 vuotta; SD 1,87) sai hoitoa aluksi 64 viikon pituisen hoitojakson ajan joko 2 viikon välein tai 4 viikon välein. Tätä seurasi kaksi jatkohoitojaksoa, joissa kaikki potilaat saivat hoitoa 2 viikon välein. Ensimmäinen niistä oli 96 viikon pituinen (yhteensä 160 viikkoa hoitoa) ja toinen 56 viikon pituinen. Toisen jakson tarkoitus oli turvallisuuden analysoiminen.
Lähes kaikilla potilailla havaittiin lähtötilanteessa röntgenologista näyttöä riisitaudista, ja lähes kaikki potilaat olivat aikaisemmin saaneet suun kautta otettavia fosfaatti- ja D‑vitamiinianalogeja keskimäärin (SD) 7 (2,4) vuoden ajan. Tämä tavanomainen hoito lopetettiin 2–4 viikkoa ennen burosumabihoidon aloittamista. Burosumabiannosta säädettiin, kunnes saavutettiin seerumin fosfaatin paastopitoisuus 3,50–5,02 mg/dl (1,13–1,62 mmol/l). Ensimmäisten 64 viikon aikana puolet potilaista (26/52) sai burosumabia 4 viikon välein. Loput potilaista (26/52) saivat burosumabia 2 viikon välein; keskimääräiset annokset (pienin, suurin) viikoilla 16, 40 ja 64 olivat 0,73 (0,3, 1,5) mg/kg, 0,98 (0,4,2,0) mg/kg ja 1,04 (0,4, 2,0) mg/kg. Enimmäisannos oli 2,0 mg/kg.
Burosumabi suurensi seerumin fosfaattipitoisuutta sekä fosfaatin tubulaarisen reabsorption nopeutta munuaisissa suhteessa glomerulusten suodatusnopeuteen (TmP/GFR). Ryhmässä, joka sai burosumabia 2 viikon välein, keskimääräinen (SD) seerumin fosfaattipitoisuus suureni lähtötilanteen arvosta 2,38 (0,405) mg/dl (0,77 [0,131] mmol/l) arvoon 3,3 (0,396) mg/dl (1,07 [0,128] mmol/l) viikolla 40, jonka jälkeen se pysyi ennallaan viikolle 64 saakka, jolloin arvo oli 3,35 (0,445) mg/dl (1,08 [0,144] mmol/l). Suurentuneet seerumin fosfaattipitoisuudet säilyivät viikolle 160 (n = 52).
Alkalisen fosfataasin aktiivisuus
Keskimääräinen (SD) seerumin alkalisen fosfataasin kokonaisaktiivisuus oli 459 (105) U/l lähtötilanteessa ja oli laskenut arvoon 369 (76) U/l viikolla 64 (‑19,6 %, p < 0,0001); lasku oli samankaltainen molemmissa annosryhmissä. Laskeneet seerumin alkalisen fosfataasin pitoisuudet säilyivät yleisesti ottaen viikolle 160.
Keskimääräinen (SD) seerumin luustoperäisen alkalisen fosfataasin pitoisuus oli 165 (52) μg/l lähtötilanteessa ja 115 (31) μg/l viikolla 64 (keskimääräinen muutos ‑28,5 %); lasku oli samankaltainen molemmissa annosryhmissä. Laskeneet seerumin luustoperäisen alkalisen fosfataasin pitoisuudet säilyivät yleisesti ottaen viikolle 160.
Tutkimuksessa UX023‑CL201 pediatrisen riisitaudin vaikeusastetta mitattiin käyttämällä RSS‑luokitusta, kuten edellä on kuvattu. RSS‑pisteet määritettiin käyttämällä ennalta laadittua asteikkoa, joka koski tiettyjä muutoksia ranteissa ja polvissa. Lisänä RSS-arvioinnille käytettiin RGI‑C-vertailuasteikkoa. Yhteenveto tuloksista on esitetty taulukossa 4.
Taulukko 4: Muutokset riisitaudin vaikeusasteessa 5–12‑vuotiailla lapsilla, jotka saivat burosumabia tutkimuksessa UX023-CL201
| Päätetapahtuma | Burosumabi-hoidon kesto (viikkoa) | Vaikutuksen suuruus | |
| Anto 2 vk:n välein (N = 26) | Anto 4 vk:n välein (N = 26) | ||
RSS-kokonaispisteet Lähtötilanteen keskiarvo (SD) Lähtötilanteen kokonaispisteiden muutoksen pienimmän neliösumman keskiarvo (keskivirhe)a (pienentyneet RSS-pisteet tarkoittavat riisitaudin vaikeusasteen lievenemistä) | 40 | 1,92 (1,2) -1,06 (0,100) (p < 0,0001) | 1,67 (1,0) -0,73 (0,100) (p < 0,0001) |
| 64 | -1,00 (0,1) (p < 0,0001) | -0,84 (0,1) (p < 0,0001) | |
RGI-C-kokonaispisteet Pisteiden pienimmän neliösumman keskiarvo (keskivirhe)a (positiivinen tarkoittaa paranemista) | 40 | +1,66 (0,1) (p < 0,0001) | +1,47 (0,1) (p < 0,0001) |
| 64 | +1,56 (0,1) (p < 0,0001) | +1,58 (0,1) (p < 0,0001) | |
a: Pienimmän neliösumman keskiarvojen ja p-arvojen estimaatit ovat yleistetystä estimointiyhtälömallista, joka käsittää lähtötilanteen RSS-pisteet, käynnit ja hoito-ohjelman ja sen yhdysvaikutuksen.
Tutkimus UX023‑CL205
Pediatrisessa UX023‑CL205-tutkimuksessa burosumabia arvioitiin 13:lla X‑kromosomaalista hypofosfatemiaa sairastavalla 1–4‑vuotiaalla potilaalla (keski-ikä 2,9 vuotta; SD 1,1) 64 viikon pituisen hoitojakson ajan. Potilaista 12 jatkoi burosumabin saamista 96 pituisessa jatkohoitojaksossa, jolloin hoidon enimmäiskesto oli 160 viikkoa. Kaikilla potilailla havaittiin lähtötilanteessa röntgenologista näyttöä riisitaudista, ja 12 potilasta oli saanut suun kautta otettavia fosfaatti- ja D‑vitamiinianalogeja keskimäärin (SD) 16,7 (14,4) kuukauden ajan. Tämä tavanomainen hoito lopetettiin 2–6 viikkoa ennen burosumabihoidon aloittamista. Potilaat saivat burosumabia 0,8 mg/kg 2 viikon välein.
Keskimääräinen (SD) seerumin fosfaatin paastopitoisuus suureni lähtötilanteen arvosta 2,51 (0,284) mg/dl (0,81 [0,092] mmol/l) arvoon 3,47 (0,485) mg/dl (1,12 [0,158] mmol/l) viikolla 40, ja suurentuneet pitoisuudet säilyivät viikolle 160.
Seerumin alkalisen fosfataasin aktiivisuus
Keskimääräinen (SD) seerumin alkalisen fosfataasin kokonaisaktiivisuus oli 549 (193,8) U/l lähtötilanteessa ja oli laskenut arvoon 335 (87,6) U/l viikolla 40 (keskimääräinen muutos ‑36,3 %). Laskenut seerumin alkalisen fosfataasin kokonaisaktiivisuus säilyi pitkäkestoisessa hoidossa viikolle 160.
Riisitaudin vaikeusasteluokitus (Rickets Severity Score, RSS)
Keskimääräiset RSS-kokonaispisteet olivat parantuneet lähtötilanteen arvosta 2,92 (1,367) arvoon 1,19 (0,522) viikolla 40, mikä vastasi pienimmän neliösumman keskiarvon muutosta (keskivirhe) ‑1,73 (0,132) (p < 0,0001) lähtötilanteesta. RSS-kokonaispisteet säilyivät viikoille 64, 112 ja 160.
Muutoksen röntgenologinen kokonaisvaikutelma (Radiographic Global Impression of Change, RGI-C)
40 viikon burosumabihoidon jälkeen kaikkien 13 potilaan RGI-C-kokonaispisteiden pienimmän neliösumman keskiarvo (keskivirhe) oli +2,21 (0,071) (p < 0,0001), mikä osoitti riisitaudin parantumista. Kaikki 13 potilasta täyttivät hoitoon vastaamisen RGI-C-kriteerin saavuttamalla RGI-C-kokonaispistemäärän ≥ +2,0. RGI-C-kokonaispisteet säilyivät viikoille 64, 112 ja 160.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset burosumabin käytöstä X‑kromosomaalisen hypofosfatemian hoidossa kaikissa pediatrisissa potilasryhmissä. Ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa.
Kliininen teho X‑kromosomaalista hypofosfatemiaa sairastavilla aikuisilla
Tutkimus UX023‑CL303
Tutkimus UX023‑CL303 oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus, johon osallistui 134 X‑kromosomaalista hypofosfatemiaa sairastavaa aikuispotilasta. Tutkimus koostui 24 viikon pituisesta lumekontrolloidusta hoitovaiheesta ja sitä seuranneesta 24 viikon pituisesta avoimesta vaiheesta, jossa kaikki potilaat saivat burosumabia. Suun kautta otettavan fosfaatin ja aktiivisten D‑vitamiinianalogien käyttöä ei sallittu tutkimuksen aikana. Burosumabia annettiin 1 mg kehon painokiloa kohden 4 viikon välein. Tutkimuksen ensisijainen päätetapahtuma oli seerumin fosfaattipitoisuuden normalisoituminen 24 viikon pituisen kaksoissokkoutetun vaiheen kuluessa. Tärkeimmät toissijaiset päätetapahtumat olivat BPI (Brief Pain Inventory) -asteikon pahinta kipua mittaavan osion pistemäärä sekä jäykkyys ja fyysinen toimintakyky WOMAC (Western Ontario and McMaster Universities Osteoarthritis) -indeksillä mitattuna. Eksploratiivisia päätetapahtumia olivat murtumien ja valemurtumien paraneminen, entesopatia, kuuden minuutin kävelytesti, BPI-asteikon kivun haittaavuutta mittaavan osion pistemäärä sekä BFI (Brief Fatigue Inventory) -asteikon pahinta väsymystä mittaavan osion pistemäärä ja BFI-asteikon kaikkien osioiden pistekeskiarvo.
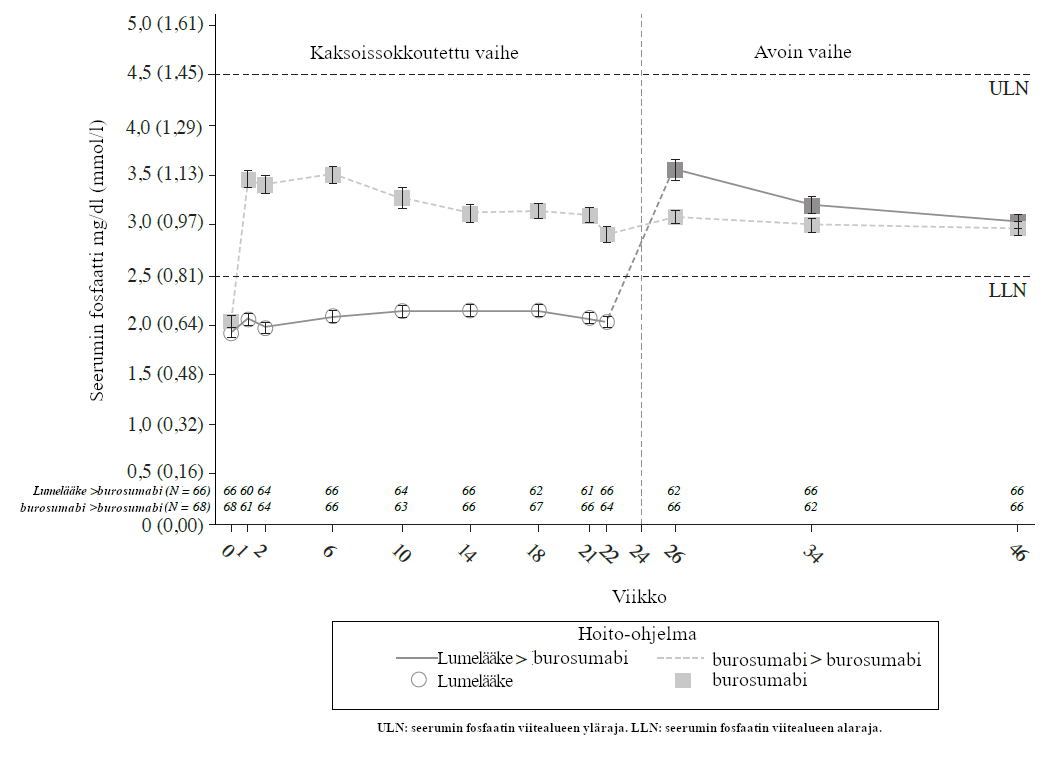
Tutkimukseen otettaessa potilaiden keski-ikä oli 40 vuotta (vaihteluväli 19–66 vuotta), ja 35 % potilaista oli miehiä. Lumelääkehoitoon satunnaistettiin 66 potilasta ja burosumabihoitoon 68 potilasta. Lähtötilanteen keskimääräinen (SD) seerumin fosfaattipitoisuus oli lumelääkeryhmässä 0,62 (0,10) mmol/l [1,92 (0,32) mg/dl] ja burosumabiryhmässä 0,66 (0,1 mmol/l) [2,03 (0,30) mg/dl].
Ensisijaisen tehon päätetapahtuman eli viitealueen alarajan ylittävän keskimääräisen seerumin fosfaattipitoisuuden viikon 24 loppuun mennessä saavutti suurempi osuus burosumabiryhmän potilaista kuin lumelääkeryhmän potilaista (taulukko 5 ja kuva 3).
Taulukko 5: Niiden aikuispotilaiden osuus, jotka saavuttivat viitealueen alarajan ylittävän keskimääräisen seerumin fosfaattipitoisuuden antovälien puolessa välissä mitattuna tutkimuksessa UX023‑CL303 (kaksoissokkoutettu vaihe)
| Lumelääke(N = 66) | Burosumabi (N = 68) | |
| Saavutti viitealueen alarajan ylittävän keskimääräisen seerumin fosfaattipitoisuuden antovälien puolessa välissä mitattuna viikon 24 loppuun mennessä - n (%) | 7,6 % (5/66) | 94,1 % (64/68) |
| 95 %:n luottamusväli | (3,3, 16,5) | (85,8, 97,7) |
| p-arvoa | < 0,0001 |
95 %:n luottamusvälit on laskettu Wilson Score -menetelmällä.
a P-arvo perustuu Cochran-Mantel-Haenszelin (CMH) testiin ensisijaisen päätapahtuman saavuttamisen ja hoitoryhmän väliselle yhteydelle, satunnaistamisen ositusten mukaan korjattuna.
Kuva 3:Keskimääräiset (± keskivirhe) seerumin fosfaatin huippupitoisuudet (mg/dl [mmol/l])
Potilaiden raportoima kipu, fyysinen toimintakyky ja jäykkyys
Muutos lähtötilanteesta viikolla 24 potilaiden raportoimassa kivussa (BPI-asteikko), fyysisessä toimintakyvyssä (WOMAC-indeksi) ja jäykkyydessä (WOMAC-indeksi) oli suurempi burosumabiryhmässä kuin lumelääkeryhmässä. Keskimääräinen (keskivirhe) ero viikolla 24 burosumabi- ja lumelääkeryhmien välillä saavutti tilastollisen merkitsevyyden WOMAC-indeksillä mitatun jäykkyyden osalta. Ks. tiedot taulukosta 6.
Taulukko 6: Potilaiden raportoimaa kipua, fyysistä toimintakykyä ja jäykkyyttä koskevien pisteiden muutokset lähtötilanteesta viikolle 24 sekä eroanalyysi viikolla 24
| Lumelääke | Burosumabi | |||
| N = 66 | N = 68 | |||
| BPI-asteikon pahinta kipua koskeva osioa | ||||
| Pienimmän neliösumman keskiarvo (keskivirhe) muutokselle lähtötilanteesta | -0,32 (0,2) | -0,79 (0,2) | ||
| [95 %:n luottamusväli] | [-0,76, 0,11] | [-1,20, -0,37] | ||
| Burosumabin ja lumelääkkeen välisen eron pienimmän neliösumman keskiarvo (keskivirhe) | -0,5 (0,28) | |||
| p-arvo | 0,0919c | |||
| WOMAC-indeksin fyysistä toimintakykyä koskeva osiob | ||||
Pienimmän neliösumman keskiarvo (keskivirhe) muutokselle lähtötilanteesta [95 %:n luottamusväli] | +1,79 (2,7) [-3,54, 7,13] | -3,11 (2,6) [-8,12, 1,89] | ||
| Burosumabin ja lumelääkkeen välisen eron pienimmän neliösumman keskiarvo (keskivirhe) | -4,9 (2,5) | |||
| p-arvo | 0,0478c | |||
| WOMAC-indeksin jäykkyyttä koskeva osiob | ||||
Pienimmän neliösumman keskiarvo (keskivirhe) muutokselle lähtötilanteesta [95 %:n luottamusväli] | +0,25 (3,1) [5,89, 6,39] | -7,87 (3,0) [-13,82, -1,91] | ||
| Burosumabin ja lumelääkkeen välisen eron pienimmän neliösumman keskiarvo (keskivirhe) | -8,12 (3,2) | |||
| p-arvo | 0,0122 | |||
a BPI-asteikon pahinta kipua koskevan osion pisteiden vaihteluväli oli 0 (ei kipua) – 10 (pahin kuviteltavissa oleva kipu) b WOMAC-indeksin fyysistä toimintakykyä ja jäykkyyttä koskevien osioiden pisteiden vaihteluväli oli 0 (paras terveydentila) – 100 (huonoin terveydentila) c Ei merkitsevä Hochberg-korjauksen jälkeen | ||||
Kuuden minuutin kävelytesti
Tämä liikuntatesti tehtiin kaikille potilaille lähtötilanteessa sekä viikoilla 12, 24, 36 ja 48 (pienimmän neliösumman keskiarvo burosumabin ja lumelääkkeen väliselle erolle muutoksessa lähtötilanteesta, ks. taulukko 7). Kävelytulosten paraneminen jatkui viikolle 48 saakka, jolloin lähtötilanteen 357 metrin matka oli pidentynyt 393 metriin. Lumelääkehoidosta burosumabihoitoon siirtyneiden potilaiden tulokset olivat samankaltaisia 24 hoitoviikon jälkeen.
Taulukko 7: Kuuden minuutin kävelytestin tulokset (SD) lähtötilanteessa ja viikolla 24, pienimmän neliösumman keskiarvo (keskivirhe)
| Kuuden minuutin kävelytesti, m (SD) | Lumelääke | Burosumabi |
| Lähtötilanne | 367 (103) | 357 (109) |
| Viikko 24 | 369 (103) | 382 (108) |
| Burosumabin ja lumelääkkeen välisen eron pienimmän neliösumman keskiarvo (keskivirhe) | 20 (7,7) | |
Murtumien ja valemurtumien röntgenologinen arviointi
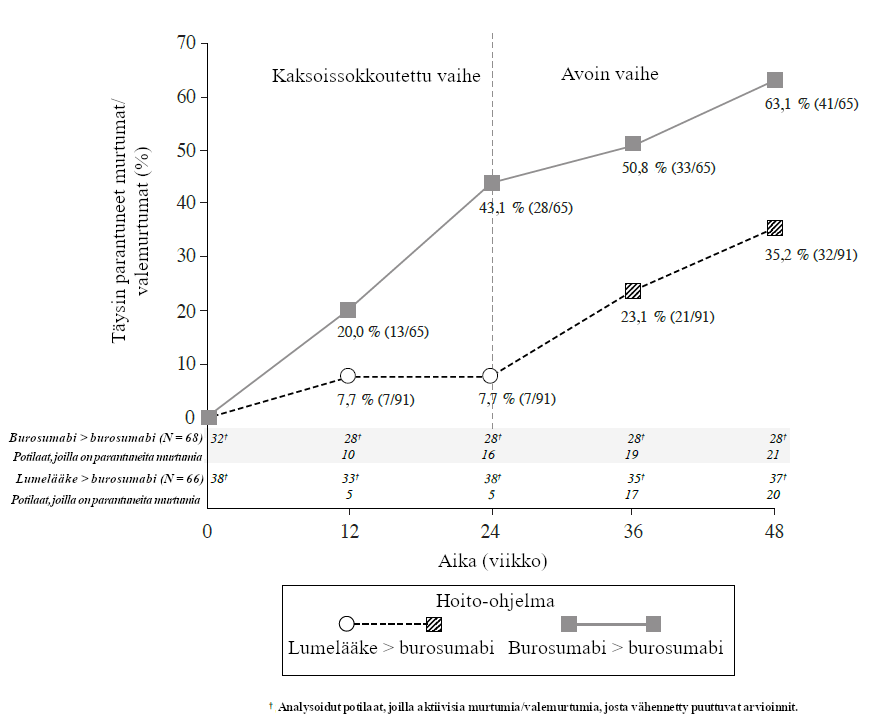
Tutkimuksen UX023‑CL303 lähtötilanteessa tehtiin luustoarviointi, jonka tarkoitus oli identifioida osteomalasiaan liittyvät murtumat ja valemurtumat. Potilaista 52 %:lla (70/134) oli aktiivisia murtumia (12 %, 16/134) tai aktiivisia valemurtumia (47 %, 63/134) lähtötilanteessa. Burosumabihoidon jälkeen murtumien ja valemurtumien paranemista havaittiin useammalla potilaalla kuin lumelääkeryhmässä (kuva 4). Viikolle 24 ulottuvan lumekontrolloidun vaiheen aikana burosumabia saavilla 68 potilaalla havaittiin yhteensä 6 uutta murtumaa tai valemurtumaa ja lumelääkettä saavilla 66 potilaalla 8 uutta poikkeavuutta. Ennen viikkoa 48 kehittyneistä uusista murtumista useimmat (10/18) olivat parantuneet tai osittain parantuneet tutkimuksen päättyessä.
Kuva 4: Parantuneiden aktiivisten murtumien ja valemurtumien prosenttiosuudet tutkimuksessa UX023‑CL303
Lähtötilanteessa keskimääräinen (SD) kantaluun kokonaisentesopatiataakka (superioristen ja inferioristen kantaluupiikkien yhteispituus) oli 5,64 (3,12) cm burosumabiryhmässä ja 5,54 (3,1) cm lumelääkeryhmässä. Viikolla 24 keskimääräinen (SD) kantaluun kokonaisentesopatiataakka oli burosumabi→burosumabiryhmässä 5,90 (3,56) cm ja lumelääke→burosumabiryhmässä 4,07 (2,38) cm.
Seuraavien eksploratiivisten päätetapahtumien suhteen ei havaittu merkittävää eroa hoitoryhmien välillä: BPI-asteikon kivun haittaavuutta mittaavan osion pistemäärän, BFI-asteikon pahinta väsymystä mittaavan osion pistemäärä ja BFI-asteikon kaikkien osioiden pistekeskiarvo.
Luun histomorfometria aikuisilla
Tutkimus UX023‑CL304
UX023‑CL304 oli 48 viikon pituinen avoin, yksihaarainen tutkimus X‑kromosomaalista hypofosfatemiaa sairastavilla aikuispotilailla, jossa arvioitiin burosumabin vaikutusta osteomalasian parantumiseen suoliluun harjusta otettujen biopsianäytteiden histologisen ja histomorfometrisen tutkimuksen avulla. Potilaat saivat 1,0 mg burosumabia kehon painokiloa kohden 4 viikon välein. Suun kautta otettavan fosfaatin ja aktiivisten D‑vitamiinianalogien käyttöä ei sallittu tutkimuksenaikana.
Tutkimukseen osallistui 14 potilasta, joiden keski-ikä tutkimukseen otettaessa oli 40 vuotta (vaihteluväli 25–52 vuotta) ja joista 43 % oli miehiä. Tutkimuksessa UX023‑CL304 annetun 48 viikon hoidon jälkeen paribiopsiat olivat saatavilla 11 potilaalta, joista 10 potilaan biopsiat olivat arviointikelpoisia. Kaikilla 10 potilaalla havaittiin osteomalasian parantumista, mikä ilmeni osteoidin tilavuuden ja luun tilavuuden suhteen (OV/BV) pienenemisenä lähtötilanteen keskimääräisestä (SD) arvosta 26,1 % (12,4) arvoon 11,9 % (6,6). Osteoidin paksuus (O.Th) arviointikelpoisilla 11 potilaalla pieneni keskimääräisestä arvosta (SD) 17,2 (4,1) mikrometriä keskimääräiseen arvoon (SD) 11,6 (3,1)mikrometriä.
Kliininen teho aikuispotilailla, jotka sairastavat tuumoriosteomalasiaa
Burosumabia on arvioitu kahdessa yksihaaraisessa avoimessa tutkimuksessa, joihin rekrytoitiin kaikkiaan 27 tuumoriosteomalasiaa sairastavaa aikuispotilasta. Suun kautta annettavan fosfaatin ja aktiivisten D-vitamiinianalogien käyttö keskeytettiin 2–10 viikkoa ennen burosumabihoidon aloittamista. Potilaat saivat burosumabia 4 viikon välein painoon perustuvalla aloitusannoksella 0,3 mg/kg ja saavuttivat seerumin paastofosfaattipitoisuuden 2,5–4,0 mg/dl [0,81–1,29 mmol/l].
Tutkimukseen UX023T-CL201 rekrytoitiin 14 aikuispotilasta, joilla oli vahvistettu sellaisen FGF23:een liittyvän hypofosfatemian diagnoosi, jonka aiheutti taustalla oleva tuumori, jota ei voitu poistaa leikkauksella tai jota ei voitu paikantaa. Potilaista kahdeksan oli miehiä, ja potilaiden iän vaihteluväli oli 33–68 vuotta (mediaani 59,5 vuotta). Burosumabin keskimääräinen (SD) annos oli 0,83 (0,41) mg/kg viikolla 20, 0,87 (0,49) mg/kg viikolla 48, 0,77 (0,52) mg/kg viikolla 96 ja 0,67(0,54) mg/kg viikolla 144.
Tutkimukseen KRN23-002 rekrytoitiin Japanista ja Etelä-Koreasta 13 aikuispotilasta, joilla oli vahvistettu tuumoriosteomalasian diagnoosi. Potilaista kuusi oli miehiä, ja potilaiden iän vaihteluväli oli 41–73 vuotta (mediaani 58,0 vuotta). Burosumabin keskimääräinen (SD) annos oli 0,91 (0,59) mg/kg viikolla 48 ja 0,96 (0,70) mg/kg viikolla 88.
Seerumin fosfaatti
Molemmissa tutkimuksissa burosumabi suurensi seerumin keskimääräisiä fosfaattipitoisuuksia, jotka pysyivät vakaina koko tutkimuksen ajan, kuten kuvissa 5 ja 6 on esitetty.
Kuva 5: Tutkimuksen UX023T-CL201 seerumin fosfaattipitoisuus (mg/dl) (keskiarvo ± SD)
Huomautus: Katkoviiva kuvassa osoittaa seerumin fosfaattipitoisuuden viitealueen alarajan, 2,5 mg/dl (0,81 mmol/l)
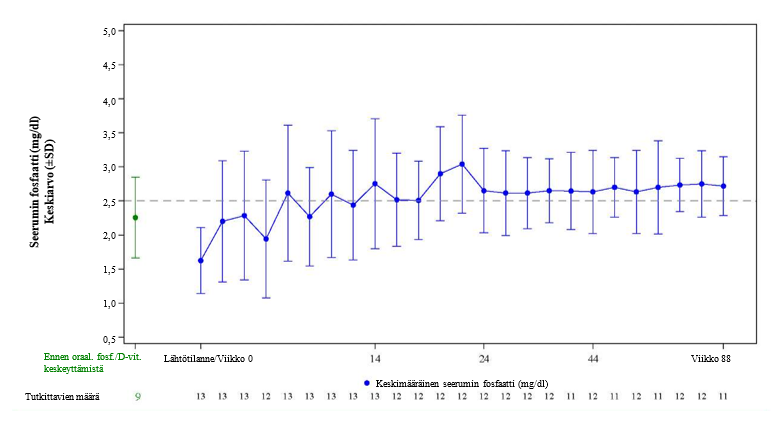
*Ennen suun kautta annettavan fosfaatin/D-vitamiinin käytön keskeyttämistä; nämä arvot otettiin ennen tutkimukseen rekrytoimista
Kuva 6: Tutkimus KRN23-002 seerumin fosfaattipitoisuus (mg/dl) (keskiarvo ± SD)
Huomautus: Katkoviiva kuvassa osoittaa seerumin fosfaattipitoisuuden viitealueen alarajan, 2,5 mg/dl (0,81 mmol/l)
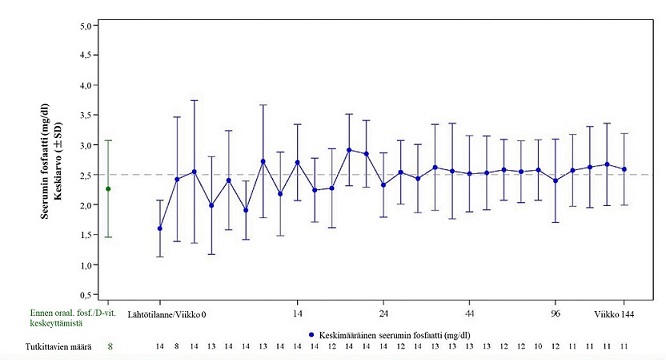
*Ennen suun kautta annettavan fosfaatin/D-vitamiinin käytön keskeyttämistä; nämä arvot otettiin ennen tutkimukseen rekrytoimista
Tutkimuksessa UX023T-CL201 näiden potilaiden TmP/GFR-suhde suureni lähtötilanteen keskiarvosta (SD) 1,12 (0,54) mg/dl [0,36 (0,17) mmol/l] arvoon 2,12 (0,64) mg/dl [0,68 (0,21) mmol/l] viikolla 48 ja pysyi vakaana viikkoon 144 asti. Tutkimuksessa KRN23-002 TmP/GFR-suhde suureni lähtötilanteen keskiarvosta (SD) 1,15 (0,43) mg/dl [0,46 (0,17) mmol/l] arvoon 2,30 (0,48) mg/dl [0,92 (0,19) mmol/l] viikkoon 48 asti.
Luun histomorfometria
UX023T-CL201-tutkimuksessa 11 potilaalle tehtiin parittaiset luubiopsiat; muutokset arvioitiin 48 viikon hoidon jälkeen. Histomorfologiset parametrit esitetään alla taulukossa 8 ryhmän keskimääräisinä mittauksina lähtötilanteessa ja viikolla 48, jota seuraa yksilöllisten mittausten suhteellisten muutosten keskiarvo.
Taulukko 8: Muutokset histomorfologiaparametreissa tutkimuksessa UX023T-CL201
| Parametri | Ryhmän keskimääräinen (SD) pistemäärä | Prosentuaalinen muutos ryhmän keskimääräisissä arvoissa | |
| Lähtötilanne | Viikko 48 | ||
| OV/BV (%) | 17,6 (19,5) | 12,1 (15,4) | -31,3 |
| OS/BS (%) | 56,8 (31,0) | 56,6 (26,3) | -0,004 |
| O,Th (μm) | 16,5 (12,0) | 11,3 (9,2) | -31,5 |
Radiografinen arviointi
99mteknetiumleimatut koko kehon luukuvaukset ja luuston röntgenkuvaukset suoritettiin lähtötilanteessa ja hoidon jälkeen enintään viikkoon 144 asti murtumien ja valemurtumien lukumäärän arvioimiseksi. Sekä luukuvauksissa että röntgenkuvissa havaittiin murtumien ja valemurtumien vähentyneen.
Tuumoriosteomalasiaa sairastavat pediatriset potilaat
Ei ole olemassa burosumabia koskevia kliinisiä tutkimuksia minkään ikäisillä tuumoriosteomalasiaa sairastavilla pediatrisilla potilailla. Burosumabin annostus pediatrisille tuumoriosteomalasiaa sairastaville potilaille on määritetty farmakokineettisestä mallinnuksesta ja simulaatiosta (ks.kohta Farmakokinetiikka).
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset burosumabin käytöstä tuumoriosteomalasian hoidossa kaikissa pediatrisissa potilasryhmissä. Ks. kohdasta Annostus ja antotapa ohjeet käyttöön pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Burosumabin imeytyminen ihonalaisista injektiokohdista verenkiertoon on lähes täydellistä. Ihon alle annon jälkeen seerumin burosumabin huippupitoisuuden saavuttamiseen kuluvan ajan (Tmax) mediaani on noin 7–13 vuorokautta. Burosumabin huippupitoisuus (Cmax) ja pitoisuus-aikakäyrän alla oleva pinta-ala (AUC) seerumissa suurenevat suhteessa annokseen annosvälillä 0,1–2,0 mg/kg.
Jakautuminen
X‑kromosomaalista hypofosfatemiaa sairastavilla potilailla havaittu jakautumistilavuus vastaa suunnilleen plasman tilavuutta, mikä viittaa niukkaan ekstravaskulaariseen jakautumiseen.
Biotransformaatio
Burosumabi on natiivi immunoglobuliini, joka koostuu pelkästään aminohapoista ja hiilihydraateista, ja sen eliminoituminen maksan metabolisten mekanismien kautta on epätodennäköistä. Metabolian ja eliminaation odotetaan noudattavan immunoglobuliinien puhdistumareittejä, jolloin tuloksena on hajoaminen pieniksi peptideiksi ja yksittäisiksi aminohapoiksi.
Eliminaatio
Molekyylikokonsa vuoksi burosumabin ei odoteta erittyvän sellaisenaan. Burosumabin puhdistuma on riippuvainen kehonpainosta, ja sen arvioidaan olevan 0,290 l/vrk tyypillisellä aikuisella (70 kg) ja 0,136 l/vrk tyypillisellä pediatrisella (30 kg) X‑kromosomaalista hypofosfatemiaa sairastavalla potilaalla; alkuvaiheen puoliintumisajan (t1/2) seerumissa odotetaan vastaavasti olevan noin 16–19 vuorokautta. Arvioitujen puoliintumisaikojen perusteella vakaan tilan altistus saavutetaan arviolta 67 vuorokaudessa. Useiden pediatrisille potilaille annettujen annosten jälkeen pienimmät seerumissa havaitut pitoisuudet tasaantuvat 8 viikon kuluessa hoidon aloittamisesta.
Lineaarisuus/ei-lineaarisuus
Burosumabin farmakokinetiikka on aikainvarianttia ja annoksen suhteen lineaarista ihonalaisella annosvälillä 0,1–2,0 mg/kg.
Farmakokineettiset/farmakodynaamiset suhteet
Ihon alle annossa X-kromosomaalista hypofosfatemiaa ja tuumoriosteomalasiaa sairastavilla potilailla seerumin burosumabipitoisuuden ja seerumin fosfaattipitoisuuden suurenemisen välillä on havaittavissa suora farmakokinetiikan ja farmakodynamiikan suhde, joka on kuvattu hyvin Emax/EC50-mallin avulla. Seerumin burosumabi- ja fosfaattipitoisuudet sekä tubulaarisen reabsorption nopeus munuaisissa suhteessa glomerulusten suodatusnopeuteen (TmP/GFR) suurenivat ja pienenivät ja saavuttivat korkeimman tasonsa suurin piirtein samana ajankohtana kunkin annoksen jälkeen, mikä puoltaa farmakokinetiikan ja farmakodynamiikan suoraa suhdetta. Seerumin fosfaattipitoisuuden, TmP/GFR-suhteen ja 1,25(OH)2D‑vitamiinipitoisuuden lähtötilanteen jälkeisen muutoksen AUC-arvo suureni lineaarisesti burosumabin AUC-arvon suurentuessa.
Farmakokinetiikka/farmakodynamiikka pediatrisilla potilailla
Farmakokinetiikassa ja farmakodynamiikassa ei ole havaittu merkittävää eroa pediatristen potilaiden ja aikuisten potilaiden välillä. Burosumabin puhdistuma ja jakautumistilavuus ovat riippuvaisia kehonpainosta.
Tuumoriosteomalasiaa sairastavat pediatriset potilaat
Burosumabin aloitusannos pediatrisille tuumoriosteomalasiaa sairastaville potilaille perustuu populaatiofarmakokineettiseen/populaatiofarmakodynaamiseen mallinnukseen ja simulaatioihin, joiden mukaan aloitusannoksen 0,4 mg/kg antamisen 2 viikon välein 1–12-vuotiaille lapsille ja aloitusannoksen 0,3 mg/kg antamisen 2 viikon välein 13–17-vuotiaille nuorille ennustetaan johtavan siihen, että osa tuumoriosteomalasiaa sairastavista pediatrisista potilaista saavuttaa seerumin normaalin fosfaattipitoisuuden. Nämä voidaan titrata ylöspäin enimmäisannokseen 2,0 mg/kg 2 viikon välein (suurin simuloitu annos).
Erityisryhmät
X‑kromosomaalista hypofosfatemiaa sairastavia pediatrisia ja aikuispotilaita ja tuumoriosteomalasiaa sairastavia aikuispotilaita koskevien populaatiofarmakokineettisten analyysien mukaan seuraavat eivät olleet burosumabin farmakokinetiikan merkittäviä ennusmerkkejä: ikä, sukupuoli, rotu, etninen tausta, seerumin albumiinipitoisuus lähtötilanteessa, seerumin AFOS-pitoisuus lähtötilanteessa, seerumin ALAT-pitoisuus lähtötilanteessa ja kreatiniinin puhdistuma ≥ 49,9 ml/min lähtötilanteessa. Populaatiofarmakokineettiseen analyysiin perustuen burosumabin farmakokineettiset ominaisuudet olivat samankaltaisia X-kromosomaalista hypofosfatemiaa ja tuumoriosteomalasiaa sairastavilla potilailla.
Aterian vaikutus seerumin fosfaatti- ja kalsiumpitoisuuksiin
Burosumabin vaikutusta seerumin fosfaatti- ja kalsium pitoisuuteen aterian jälkeen arvioitiin kahdessa alatutkimuksessa (tutkimukset UX023‑CL301 ja UX023‑CL303) 13 pediatrisella potilaalla (iältään > 3 vuotta) ja 26 aikuispotilaalla (iältään 24–65 vuotta). Seerumin fosfaatti- ja kalsiumpitoisuudet mitattiin pediatrisilla potilailla antovälin lopussa ja aikuispotilailla antovälin puolessa välissä. Verinäytteet otettiin paastojakson jälkeen sekä uudelleen 1–2 tuntia standardoidun aterian jälkeen.
Burosumabihoito ei aiheuttanut aterian jälkeisiä iänmukaisten viitealuiden ylärajojen ylityksiä seerumin fosfaatti- ja kalsiumarvoissa alatutkimusten pediatrisilla tai aikuispotilailla.
Prekliiniset tiedot turvallisuudesta
Normaaleilla eläimillä tehdyissä konventionaalisissa tutkimuksissa havaittiin haittavaikutuksia altistuksilla, jotka johtivat normaalia suurempaan seerumin fosfaattipitoisuuteen. Haittavaikutukset olivat yhdenmukaisia normaalin FGF23:n määrän eston aikaansaaman liiallisen vasteen kanssa, joka johti suprafysiologiseen, viitealueen ylärajan ylittävään seerumin fosfaattipitoisuuteen.
Kaniineilla sekä aikuisilla ja nuorilla cynomolgusapinoilla tehdyissä tutkimuksissa havaittiin annosriippuvaista seerumin fosfaatti- ja 1,25(OH)2D‑vitamiinipitoisuuksien kohoamista, mikä vahvisti burosumabin farmakologisen vaikutuksen kyseisissä lajeissa. Normaaleilla eläimillä havaittiin hyperfosfatemiasta johtuvaa useiden kudosten ja elinten (esim. munuaisten, sydämen, keuhkojen ja aortan) ektooppista mineralisaatiota, ja joissain tapauksissa siihen liittyviä sekundaarisia vaikutuksia (esim. nefrokalsinoosia) burosumabiannoksilla, jotka johtivat suurempiin kuin noin 8 mg/dl:n (2,6 mmol/l:n) fosfaattipitoisuuksiin eläinten seerumissa. X‑kromosomaalisen hypofosfatemian hiirimallissa havaittiin ektooppisen mineralisaation ilmaantuvuuden laskevan merkittävästi vastaavilla seerumin fosfaattipitoisuuksilla, mikä viittaa siihen, että mineralisaatioriski on pienempi, kun FGF23:n määrä on liiallinen.
Aikuisilla ja nuorilla apinoilla havaittuja luustovaikutuksia olivat muutokset luuston aineenvaihdunnan markkereissa, pintaluiden paksuuntuminen ja tiheyden suureneminen, koko luun tiheyden suureneminen ja putkiluiden paksuuntuminen. Nämä muutokset olivat seurausta normaalia suuremmasta seerumin fosfaattipitoisuudesta, joka nopeutti testatuilla annoksilla luun vaihtuvuutta ja johti aikuisilla (muttei nuorilla) eläimillä lisäksi luukalvon liikakasvuun ja luun lujuuden heikentymiseen. Burosumabi ei edistänyt poikkeavaa luuston kehittymistä, sillä muutoksia reisiluun pituudessa tai luuston lujuudessa ei havaittu nuorilla eläimillä. Luustomuutokset olivat yhdenmukaisia burosumabin farmakologian ja fosfaatin luun mineralisaatiota, aineenvaihduntaa ja vaihtuvuutta koskevan roolin kanssa.
Toistuvan altistuksen aiheuttamaa toksisuutta koskevissa enintään 40 viikon pituisissa tutkimuksissa cynomolgusapinoilla urosapinoilla esiintyi kivesverkon/siementiheyiden mineralisaatiota; siemennesteanalyysissa ei kuitenkaan havaittu muutoksia. Näissä tutkimuksissa ei havaittu naaraiden sukupuolielimiin kohdistuvia haittavaikutuksia.
Tiineinä olevilla cynomolgusapinoilla tehdyissä lisääntymis- ja kehitystoksisuutta koskevissa tutkimuksissa havaittiin kohtalaista istukan mineralisaatiota eläimillä, jotka saivat burosumabia 30 mg/kg ja joilla burosumabin huippupitoisuus seerumissa oli suurempi kuin noin 8 mg/dl (2,6 mmol/l). Tiineysajan lyhenemistä ja siihen liittyviä ennenaikaisia synnytyksiä esiintyi naarailla, jotka saivat ≥ 0,3 mg/kg:n annoksia, mikä vastasi ≥ 0,875–1,39-kertaista burosumabialtistusta suhteessa odotettuun kliiniseen altistukseen. Burosumabia havaittiin sikiöiden seerumissa, mikä osoitti, että burosumabia kulkeutui sikiöön istukan läpi. Teratogeenisistä vaikutuksista ei ollut näyttöä. Sikiöissä ja poikasissa ei havaittu ektooppista mineralisaatiota, eikä burosumabi vaikuttanut pre- tai postnataaliseen kasvuun tai poikasten eloonjääntiin.
Prekliinisissä tutkimuksissa on havaittu ektooppista mineralisaatiota normaaleilla eläimillä, yleisimmin munuaisissa, burosumabiannoksilla, jotka johtivat suurempiin kuin noin 8 mg/dl:n (2,6 mmol/l:n) pitoisuuksiin seerumissa. Kliinisissä tutkimuksissa ei ole havaittu uusia nefrokalsinooseja, olemassa olevien nefrokalsinoosien kliinisesti merkittävää pahentumista tai ektooppista mineralisaatiota X‑kromosomaalista hypofosfatasiaa sairastavilla potilailla, jotka saivat burosumabihoitoa seerumin normaalin fosfaattipitoisuuden saavuttamiseksi.
Farmaseuttiset tiedot
Apuaineet
L‑histidiini
D‑sorbitoli (E 420)
Polysorbaatti 80 (E 433)
L‑metioniini
Suolahappo, 10 % (pH:n säätöä varten)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
CRYSVITA-injektioneste, liuos, esitäytetty ruisku
Kemiallinen ja fysikaalinen käytönaikainen stabiilius on osoitettu 48 tunnin ajan 25 °C:n lämpötilassa valolta suojattuna.
Mikrobiologiselta kannalta valmiste on käytettävä välittömästi. Jos sitä ei käytetä välittömästi, käytönaikaiset säilytysajat ja olosuhteet ovat käyttäjän vastuulla.
Säilytys
Säilytä jääkaapissa (2–8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CRYSVITA injektioneste, liuos
10 mg (L:ei) 1 kpl (10 mg/ml) (2797,23 €)
20 mg (L:ei) 1 kpl (20 mg/ml) (5413,86 €)
30 mg (L:ei) 1 kpl (30 mg/ml) (8030,49 €)
PF-selosteen tieto
CRYSVITA-injektioneste, liuos, injektiopullot
Kirkasta lasia oleva injektiopullo, jossa on butyylikumitulppa ja alumiinisinetti.
Pakkauskoko: yksi injektiopullo.
CRYSVITA-injektioneste, liuos, esitäytetty ruisku
Kirkas tyypin I lasiruisku, jossa on esikiinnitetty, ruostumattomasta teräksestä valmistettu neula. Ruisku on suljettu jäykästä polypropeenista ja elastomeerista valmistetulla neulansuojuksella ja fluoripolymeerilla laminoidulla bromobutyylikumista valmistetulla mäntätulpalla.
Lääkevalmisteen eri vahvuudet voidaan tunnistaa erivärisestä männänvarresta; 10 mg (sininen), 20 mg (punainen) ja 30 mg (vihreä).
Pakkauskoko: yksi esitäytetty ruisku.
Valmisteen kuvaus:
Kirkas tai hieman opalisoiva, väritön tai vaalean kellanruskea liuos.
Käyttö- ja käsittelyohjeet
CRYSVITA-injektioneste, liuos, injektiopullot
Injektiopullot ovat kertakäyttöisiä.
Älä ravista injektiopulloa ennen käyttöä.
Ennen antoa liuos on tarkastettava silmämääräisesti. Nesteen on oltava kirkasta tai hieman opalisoivaa, väritöntä tai vaalean kellanruskeata. Jos liuos on samea, värjääntynyt tai se sisältää hiukkasia, liuosta ei pidä käyttää.
Kun injektiopullo on otettu jääkaapista, anna injektiopullon lämmetä huoneenlämpötilaan 30 minuutin ajan ennen burosumabin pistämistä.
Burosumabin annossa on käytettävä aseptista tekniikkaa ja steriilejä, kertakäyttöisiä ruiskuja ja injektioneuloja.
CRYSVITA-injektioneste, liuos, esitäytetty ruisku
Ennen antoa liuos on tarkastettava silmämääräisesti. Nesteen on oltava kirkasta tai hieman opalisoivaa, väritöntä tai vaalean kellanruskeata. Jos liuos on samea, värjääntynyt tai se sisältää hiukkasia, liuosta ei pidä käyttää.
Kun esitäytetty ruisku on otettu jääkaapista, anna ruiskun lämmetä huoneenlämpötilaan 45 minuutin ajan ennen burosumabin pistämistä.
Pakkausselosteen lopussa on kattavat ohjeet esitäytetyssä ruiskussa olevan burosumabin ihon alle antamisesta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
CRYSVITA injektioneste, liuos
10 mg 1 kpl
20 mg 1 kpl
30 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Burosumabi: X-kromosomaalisen hypofosfatemian hoito erityisin edellytyksin (1533).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Burosumabi: X-kromosomaalisen hypofosfatemian hoito vähintään vuoden ikäisille lapsille ja nuorille erityisin edellytyksin (3040).
ATC-koodi
M05BX05
Valmisteyhteenvedon muuttamispäivämäärä
21.11.2025
Yhteystiedot
Torshamnsgatan 39
164 40 Kista
Sweden
+358-10-2355560
www.kyowa-kirin.com
infofin@kyowakirin.com
Edustaja Suomessa: Kyowa Kirin AB. filial i Finland
