CALQUENCE kapsel, hård 100 mg
Kvalitativ och kvantitativ sammansättning
Varje hård kapsel innehåller 100 mg akalabrutinib.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Hård kapsel (kapsel).
Kliniska uppgifter
Terapeutiska indikationer
Calquence som monoterapi eller i kombination med obinutuzumab är avsett för behandling av vuxna patienter med tidigare obehandlad kronisk lymfatisk leukemi (KLL).
Calquence i kombination med venetoklax med eller utan obinutuzumab är avsett för behandling av vuxna patienter med tidigare obehandlad kronisk lymfatisk leukemi (KLL).
Calquence som monoterapi är avsett för behandling av vuxna patienter med kronisk lymfatisk leukemi (KLL) som har fått minst en tidigare behandling.
Calquence i kombination med bendamustin och rituximab (BR) är avsett för behandling av vuxna patienter med tidigare obehandlat mantelcellslymfom (MCL) som inte är lämpliga för autolog stamcellstransplantation.
Calquence som monoterapi är avsett för behandling av vuxna patienter med recidiverande eller refraktärt mantelcellslymfom (MCL) som inte tidigare har behandlats med BTK-hämmare.
Villkor
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Dosering och administreringssätt
Behandling med detta läkemedel ska initieras och övervakas av en läkare med erfarenhet av användning av cancerläkemedel.
Dosering
Rekommenderad dos av Calquence i monoterapi eller i kombination med andra läkemedel är 100 mg akalabrutinib två gånger dagligen (motsvarande en total daglig dos på 200 mg).
Dosintervallet för Calquence är cirka 12 timmar.
För kombinationsregimerna se förskrivarinformation för varje läkemedel för information om dosering (se information om kombinationsregimerna i avsnitt Farmakodynamiska egenskaper).
Calquence som monoterapi eller i kombination med obinutuzumab
Behandling med Calquence som monoterapi eller i kombination med obinutuzumab ska fortsätta till progression av sjukdomen eller oacceptabel toxicitet.
Calquence i kombination med venetoklax med eller utan obinutuzumab
Behandling med Calquence i kombination med venetoklax med eller utan obinutuzumab ska fortsätta fram till sjukdomsprogression, oacceptabel toxicitet eller till att 14 behandlingscykler slutförts (varje cykel är 28 dagar).
Calquence ska administreras från dag 1 i cykel 1 i totalt 14 cykler. Venetoklax ska administreras från dag 1 i cykel 3 i totalt 12 cykler med en startdos på 20 mg och en dosökning en gång i veckan till 50 mg, 100 mg, 200 mg och slutligen 400 mg.
Om Calquence ges i kombination med venetoklax och obinutuzumab ska obinutuzumab administreras i en dos på 100 mg dag 1 i cykel 2, följt av 900 mg som kan administreras dag 1 eller 2. Obinutuzumab ska administreras i en dos på 1 000 mg dag 8 och 15 i cykel 2, följt av 1 000 mg dag 1 i cykel 3 till 7. Obinutuzumab administreras i totalt 6 cykler.
Calquence i kombination med bendamustin och rituximab
Calquence ska administreras dag 1 i cykel 1 (varje cykel är 28 dagar) fram till sjukdomsprogression eller oacceptabel toxicitet. Bendamustin 90 mg/m2 ska administreras dag 1 och 2 i varje cykel i totalt 6 cykler. Rituximab 375 mg/m2 ska administreras dag 1 i varje cykel i totalt 6 cykler. Patienter som svarar på behandlingen (partiell respons [PR] eller komplett respons [CR]) efter de första 6 cyklerna kan få underhållsbehandling med rituximab 375 mg/m2 dag 1 i varannan cykel i maximalt 12 ytterligare doser, med start i cykel 8 fram till cykel 30.
Dosjusteringar
Biverkningar
Rekommenderade dosjusteringar av Calquence vid biverkningar av grad ≥ 3 hos patienter som får Calquence i monoterapi och Calquence i kombination med obinutuzumab finns i tabell 1.
Rekommenderade dosjusteringar vid biverkningar av grad ≥ 3 hos patienter som får Calquence i kombination med bendamustin och rituximab finns i tabell 2.
Tabell 1. Rekommenderade dosjusteringar vid biverkningar*
| Biverkning | Biverkningshändelse | Dosjustering (Startdos = 100 mg ungefär var 12:e timme) |
Trombocytopeni av grad 3 med blödning, Trombocytopeni av grad 4 eller Neutropeni av grad 4 som varar längre än 7 dagar Icke-hematologiska toxiciteter av grad 3 eller högre | Första och andra | Gör uppehåll i behandlingen med Calquence När toxiciteten har återgått till grad 1 eller baslinjen kan behandlingen med Calquence återupptas med 100 mg ungefär var 12:e timme |
| Tredje | Gör uppehåll i behandlingen med Calquence När toxiciteten har återgått till Grad 1 eller baslinjen kan behandlingen med Calquence återupptas med lägre frekvens: 100 mg en gång per dag | |
| Fjärde | Avbryt behandlingen med Calquence |
*Biverkningarna är graderade av the National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) version 4.03.
Tabell 2. Rekommenderade dosjusteringar vid biverkningar av grad ≥ 3* hos patienter som får Calquence i kombination med bendamustin och rituximab
| Biverkning | Dosjustering av bendamustin† | Dosjustering av Calquence |
| Neutropeni | Vid neutropeni av grad 3 eller 4‡: Gör uppehåll i behandlingen med bendamustin. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med bendamustin återupptas vid en dos på 70 mg/m2. Avbryt behandlingen med bendamustin om ytterligare dosreduktion krävs. | Gör uppehåll i behandlingen med Calquence om neutropeni av grad 4 varar längre än 7 dagar. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med Calquence återupptas med startdos (första biverkningshändelse) eller med lägre frekvens: 100 mg en gång per dag (andra och tredje biverkningshändelse).¶ Avbryt behandlingen med Calquence vid fjärde biverkningshändelse. |
| Trombocytopeni | Vid trombocytopeni av grad 3 eller 4: Gör uppehåll i behandlingen med bendamustin. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med bendamustin återupptas vid en dos på 70 mg/m2. Avbryt behandlingen med bendamustin om ytterligare dosreduktion krävs. | Gör uppehåll i behandlingen med Calquence vid trombocytopeni av grad 3 med signifikant blödning eller vid trombocytopeni av grad 4. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med Calquence återupptas med startdos (första biverkningshändelse) eller med lägre frekvens: 100 mg en gång per dag (andra och tredje biverkningshändelse).¶ Avbryt behandlingen med Calquence vid tredje biverkningshändelse vid trombocytopeni med signifikant blödning. Avbryt behandlingen med Calquence vid fjärde biverkningshändelse. |
| Annan hematologisk toxicitet av grad 4§ eller ohanterlig toxicitet av grad 3 | Gör uppehåll i behandlingen med bendamustin. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med bendamustin återupptas vid en dos på 70 mg/m2. Avbryt behandlingen med bendamustin om ytterligare dosreduktion krävs. | Gör uppehåll i behandlingen med Calquence. När toxiciteten har återgått till grad ≤ 2 eller baslinjen kan behandlingen med Calquence återupptas med startdos (första biverkningshändelse) eller med lägre frekvens: 100 mg en gång per dag (andra och tredje biverkningshändelse).¶ Avbryt behandlingen med Calquence vid fjärde biverkningshändelse. |
| Icke‑hematologiska toxiciteter av grad 3 eller högre | Gör uppehåll i behandlingen med bendamustin. När toxiciteten har återgått till grad 1 eller baslinjen kan behandlingen med bendamustin återupptas vid en dos på 70 mg/m2. Avbryt behandlingen med bendamustin om ytterligare dosreduktion krävs. | Gör uppehåll i behandlingen med Calquence. När toxiciteten har återgått till grad 2 eller baslinjen kan behandlingen med Calquence återupptas med startdos (första biverkningshändelse) eller med lägre frekvens: 100 mg en gång per dag (andra biverkningshändelse).¶ Avbryt behandlingen med Calquence vid tredje biverkningshändelse. |
*Biverkningarna är graderade av the National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) version 4.03.
†För eventuella toxiciteter som inte listas i denna tabell, se den lokala förskrivarinformationen för bendamustin.
‡Överväg användning av myeloida tillväxtfaktorer före dosjustering av bendamustin.
§Lymfopeni av grad 4 är ett förväntat resultat av behandling med bendamustin och rituximab. Dosjustering på grund av lymfopeni krävs enbart om det enligt läkaren är kliniskt viktigt, t.ex. vid relaterade återkommande infektioner.
¶Dosen kan trappas upp igen enligt läkarens bedömning om patienten tolererar en reducerad dos i ≥ 4 veckor.
Se förskrivarinformationen för varje läkemedel som används i kombination med Calquence för ytterligare information om hantering av toxiciteter.
Interaktioner
Rekommendationer angående användning av Calquence med CYP3A-hämmare eller ‑inducerare och magsyrereducerande läkemedel presenteras i tabell 3 (se avsnitt Interaktioner).
Tabell 3. Användning av Calquence med CYP3A-hämmare eller ‑inducerare och magsyrereducerande läkemedel
| Läkemedel som administreras samtidigt | Rekommenderad användning av Calquence | |
| CYP3A-hämmare | Stark CYP3A-hämmare | Undvik samtidig användning. Om dessa hämmare används under kort tid (såsom antiinfektiva i upp till sju dagar), gör uppehåll i behandlingen med Calquence. |
| Måttlig CYP3A-hämmare | Ingen dosjustering. Övervaka patienter noggrant avseende biverkningar vid intag av måttliga CYP3A-hämmare. | |
| Svag CYP3A-hämmare | Ingen dosjustering. | |
| CYP3A-inducerare | Stark CYP3A-inducerare | Undvik samtidig användning. |
| Magsyre-reducerande läkemedel | Protonpumpshämmare | Undvik samtidig användning. |
| H2-receptorantagonister | Ta Calquence 2 timmar före (eller 10 timmar efter) intag av en H2-receptorantagonist. | |
| Antacida | Intervallet mellan intag av läkemedlen ska vara minst 2 timmar. |
Missad dos
Om en patient missar en dos av Calquence med mer än 3 timmar, bör patienten instrueras att ta nästa dos på den planerade tiden. En missad dos ska inte kompenseras med en dubbel dos av Calquence.
Särskilda patientgrupper
Äldre
Ingen dosjustering krävs för äldre patienter (≥ 65 år) (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Inga specifika kliniska studier har utförts på patienter med nedsatt njurfunktion. Patienter med lätt till måttligt nedsatt njurfunktion behandlades i kliniska studier med Calquence. Ingen dosjustering behövs för patienter med lätt till måttligt nedsatt njurfunktion (kreatininclearance över 30 ml/min). Hydrering ska bibehållas och serumnivåer av kreatinin följas upp regelbundet. Calquence bör administreras till patienter med gravt nedsatt njurfunktion (kreatininclearance < 30 ml/min) endast om fördelarna uppväger riskerna och dessa patienter ska övervakas noga avseende tecken på toxicitet. Det finns inga data från patienter med gravt nedsatt njurfunktion eller patienter som får dialys (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering rekommenderas hos patienter med lätt till måttligt nedsatt leverfunktion (Child-Pugh A, Child-Pugh B eller totalt bilirubin mellan 1,5‑3 gånger den övre normalgränsen [ULN] och alla ASAT-värden). Patienter med måttligt nedsatt leverfunktion bör dock övervakas noggrant avseende tecken på toxicitet. Det rekommenderas inte att Calquence ges till patienter med kraftigt nedsatt leverfunktion (Child-Pugh klass C eller totalt bilirubin > 3 gånger ULN och alla ASAT-värden) (se avsnitt Farmakokinetiska egenskaper).
Svår hjärtsjukdom
Patienter med svår hjärt-kärlsjukdom var exkluderade från kliniska studier med Calquence.
Pediatrisk population
Säkerhet och effekt för Calquence för barn och ungdomar i åldern 0 till 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Calquence är avsett för oral användning. Kapslarna ska sväljas hela med vatten vid ungefär samma tidpunkt varje dag, med eller utan föda (se avsnitt Interaktioner). Kapslarna ska inte tuggas, lösas upp eller öppnas eftersom det kan påverka absorptionen av läkemedlet i kroppen.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Blödning
Kraftiga blödningar inklusive blödningar i centrala nervsystemet och gastrointestinala blödningar, vissa med dödlig utgång, har inträffat hos patienter med hematologiska maligniteter behandlade med Calquence monoterapi och i kombination med andra läkemedel. Dessa händelser inträffade hos patienter både med och utan trombocytopeni. Totalt sett var blödningarna mindre svåra, inklusive blåmärken och petekier (se avsnitt Biverkningar).
Mekanismen bakom blödningshändelserna är inte väl förstådd.
Patienter som får antitrombotiska läkemedel kan ha ökad risk för blödning. Iaktta försiktighet med antitrombotiska läkemedel och överväg ytterligare monitorering avseende tecken på blödning när samtidig behandling är medicinskt nödvändig. Warfarin eller andra vitamin K-antagonister ska inte administreras samtidigt med Calquence.
Överväg risk-nytta med att göra uppehåll i behandling med Calquence i minst 3 dagar före och efter kirurgi.
Infektioner
Allvarliga infektioner (bakterie-, virus- eller svampinfektioner), inklusive dödliga händelser, har inträffat hos patienter med hematologiska maligniteter behandlade med Calquence monoterapi och i kombination med andra läkemedel. Dessa infektioner inträffade huvudsakligen vid frånvaro av neutropeni, där neutropena infektioner rapporterades hos 10,1 % av patienter som fick monoterapi och hos 26,8 % av patienter som fick kombinationsbehandling. Infektioner på grund av hepatit B-virus (HBV) och reaktivering av herpes zoster-virus (HZV), aspergillos och progressiv multifokal leukoencefalopati (PML) har inträffat (se avsnitt Biverkningar).
Viral reaktivering
Fall av viral reaktivering av hepatit B-reaktivering har rapporterats hos patienter som fått Calquence. Hepatit B virus-status (HBV) bör fastställas innan behandling med Calquence påbörjas. Om patienter har positiv hepatit B-serologi bör en leverexpert konsulteras innan behandlingen påbörjas och patienten ska övervakas och behandlas enligt lokal medicinsk standard för att förhindra reaktivering av hepatit B.
Fall av progressiv multifokal leukoencefalopati (PML) inklusive dödliga fall har rapporterats efter användning av Calquence inom ramen för en tidigare eller samtidig immunsuppressiv terapi. Läkare ska överväga PML i differentialdiagnosen hos patienter med nya eller förvärrade neurologiska, kognitiva eller beteendemässiga tecken eller symtom. Om PML misstänks ska lämplig diagnostisk utvärdering göras och uppehåll i behandling med Calquence ska göras tills PML har uteslutits. Vid minsta tveksamhet ska remiss till neurolog och lämpliga diagnostiska åtgärder för PML övervägas, inklusive MRI företrädesvis med kontrast, undersökning av cerebrospinalvätska (CSF) avseende JC Viral DNA samt upprepade neurologiska utvärderingar.
Överväg profylax enligt standardbehandling hos patienter som har ökad risk för opportunistiska infektioner. Övervaka patienter avseende tecken och symtom på infektion och sätt in lämplig medicinsk behandling.
Cytopenier
Behandlingsorsakade cytopenier grad 3 eller 4, inklusive neutropeni, anemi och trombocytopeni, inträffade hos patienter med hematologiska maligniteter som behandlades med Calquence monoterapi och i kombination med andra läkemedel. Utför fullständig blodkroppsräkning om medicinskt befogat (se avsnitt Biverkningar).
Nya primära maligniteter
Nya primära maligniteter, inklusive hud- och icke-hudcancer, inträffade hos patienter med hematologiska maligniteter som behandlades med Calquence monoterapi och i kombination med andra läkemedel. Hudcancer rapporterades vanligen. Övervaka patienter avseende tecken på hudcancer och ge patienten råd att undvika solexponering (se avsnitt Biverkningar).
Förmaksflimmer
Förmaksflimmer/fladder inträffade hos patienter med hematologiska maligniteter som behandlades med Calquence monoterapi och i kombination med andra läkemedel. Övervaka patienten för symtom på förmaksflimmer och fladder (t.ex. palpitationer, yrsel, synkope, bröstsmärta, dyspné) och ta ett EKG om medicinskt befogat (se avsnitt Interaktioner och Dosering och administreringssätt). Hos patienter som utvecklar förmaksflimmer under behandling med Calquence ska en noggrann utvärdering av risken för tromboembolisk sjukdom göras. Hos patienter med ökad risk för tromboembolisk sjukdom ska noga övervakad behandling med antikoagulantia och alternativa möjligheter till behandling med Calquence övervägas.
Tumörlyssyndrom
Tumörlyssyndrom har rapporterats vid behandling med Calquence. Patienter som bedöms ha risk för tumörlyssyndrom (t.ex. stor tumörbörda vid baslinjen) ska undersökas med avseende på eventuell risk för tumörlyssyndrom och övervakas noggrant såsom kliniskt indicerat.
Interstitiell lungsjukdom/pneumonit
Interstitiell lungsjukdom/pneumonit har rapporterats hos patienter som behandlats med Calquence i kombination med bendamustin och rituximab vid MCL. Patienter ska övervakas för lungsymtom som tyder på insterstitiell lungsjukdom/pneumonit (t.ex. hosta, dyspné eller hypoxi) och interstitiell lungsjukdom/pneumonit ska hanteras såsom kliniskt indicerat.
Andra läkemedel
Samtidig administrering av starka CYP3A-hämmare och Calquence kan leda till ökad exponering för akalabrutinib och därmed öka risken för toxicitet. Tvärtom kan samtidig administrering av CYP3A-inducerare leda till minskad exponering för akalabrutinib och därmed risk för bristande effekt. Samtidig användning av starka CYP3A-hämmare ska undvikas. Om dessa hämmare används under kort tid (såsom antiinfektiva i upp till sju dagar), bör behandlingen med Calquence avbrytas. Patienter ska övervakas noga för tecken på toxicitet om en måttlig CYP3A-hämmare måste användas (se avsnitt Dosering och administreringssätt och Interaktioner). Samtidig användning av stark CYP3A4-inducerare bör undvikas på grund av risk för bristande effekt.
Calquence innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Akalabrutinib och dess aktiva metabolit metaboliseras huvudsakligen via cytokrom P450-enzym 3A4 (CYP3A4) och båda substanserna är substrat för P-gp och bröstcancerresistent protein (BCRP).
Aktiva substanser som kan öka plasmakoncentrationerna av akalabrutinib
CYP3A/P-gp hämmare
Samtidig administrering av en stark CYP3A/P-gp -hämmare (200 mg itrakonazol en gång dagligen i 5 dagar) ökade akalabrutinib Cmax och AUC 3,9 gånger respektive 5,0 gånger hos friska försökspersoner (N=17).
Samtidig användning av starka CYP3A/P-gp-hämmare ska undvikas. Om starka CYP3A/P-gp-hämmare (t.ex. ketokonazol, konivaptan, klaritromycin, indinavir, itrakonazol, ritonavir, telaprevir, posakonazol, vorikonazol) används under kort tid, ska uppehåll i behandlingen med Calquence göras (se avsnitt Dosering och administreringssätt).
Samtidig administrering av en måttlig CYP3A-hämmare (400 mg flukonazol som singeldos eller 200 mg isavukonazol som upprepad dos i 5 dagar) hos friska försökspersoner ökade Cmax och AUC för akalabrutinib 1,4 till 2 gånger medan Cmax och AUC för den aktiva metaboliten ACP-5862 minskade med 0,65 till 0,88 gånger jämfört med när akalabrutinib administrerades ensamt. Ingen dosjustering krävs i kombination med måttliga CYP3A-hämmare. Övervaka patienter noggrant avseende biverkningar (se avsnitt Dosering och administreringssätt).
Aktiva substanser som kan minska plasmakoncentrationerna av akalabrutinib
CYP3A-inducerare
Samtidig administrering av en stark CYP3A-inducerare (600 mg rifampicin en gång dagligen i 9 dagar) minskade Cmax och AUC för akalabrutinib med 68 % respektive 77 % hos friska försökspersoner (N=24).
Samtidig anvädning av starka inducerare av CYP3A-aktivitet (t.ex. fenytoin, rifampicin, karbamazepin) bör undvikas. Samtidig användning av johannesört som oförutsägbart kan minska plasmakoncentrationerna av akalabrutinib, bör undvikas.
Läkemedel som reducerar magsyra
Lösligheten av akalabrutinib minskar med ökande pH. Samtidig administrering av akalabrutinib med ett antacida (1 g kalciumkarbonat) minskade AUC för akalabrutinib med 53 % hos friska försökspersoner. Samtidig administrering med en protonpumpshämmare (40 mg omeprazol i 5 dagar) minskade AUC för akalabrutinib med 43 %.
Om behandling med ett läkemedel som reducerar magsyran krävs, överväg att använda ett antacida (t.ex. kalciumkarbonat) eller en H2-receptorantagonist (t.ex. ranitidin eller famotidin). Vid användning av antacida ska intervallet mellan intag av läkemedlen vara minst 2 timmar (se avsnitt Dosering och administreringssätt). För H2-receptorantagonister, ska Calquence tas 2 timmar före (eller 10 timmar efter) intag av H2-receptorantagonisten.
På grund av långtidseffekten av protonpumpshämmare kommer separation av doseringen eventuellt inte eliminera interaktionen med Calquence och därför bör samtidig användning undvikas (se avsnitt Dosering och administreringssätt).
Aktiva substanser vilkas plasmakoncentration kan påverkas av Calquence
CYP3A-substrat
Baserat på in vitro-data kan det inte uteslutas att akalabrutinib är en hämmare av CYP3A4 på intestinal nivå och kan öka exponeringen för CYP3A4-substrat som är känsliga för metabolism av CYP3A4 i tarm. Försiktighet bör iakttas vid samtidig administrering av akalabrutinib och CYP3A4-substrat med smalt terapeutiskt fönster vid oral administrering (t.ex. ciklosporin, ergotamin, pimozid).
Effekt av akalabrutinib på CYP1A2-substrat
Studier in vitro tyder på att akalabrutinib inducerar CYP1A2. Samtidig administrering av akalabrutinib med CYP1A2-substrat (t.ex. teofyllin, koffein) kan minska deras exponering.
Effekter av akalabrutinib och dess aktiva metabolit, ACP-5862, på transportsystem för läkemedel
Akalabrutinib kan öka exponeringen för BCRP-substrat som administreras samtidigt (t.ex. metotrexat), genom att hämma intestinal BCRP (se avsnitt Farmakokinetiska egenskaper). För att minska potentialen för en interaktion i mag-tarmkanalen ska orala BCRP-substrat med smalt terapeutiskt fönster som metotrexat tas minst 6 timmar före eller efter akalabrutinib.
ACP-5862 kan öka exponeringen för MATE1-substrat som administreras samtidigt (t.ex. metformin) genom hämning av MATE1 (se avsnitt Farmakokinetiska egenskaper). Patienter som samtidigt tar läkemedel med disposition beroende av MATE1 (t.ex. metformin) ska övervakas för tecken på ändrad tolerans som ett resultat av ökad exponering av läkemedel som administreras samtidigt med Calquence.
Fertilitet, graviditet och amning
Kvinnor i fertil ålder
Kvinnor i fertil ålder ska rådas att undvika att bli gravida medan de får Calquence.
Graviditet
Det finns inga eller begränsad mängd data från användning av akalabrutinib hos gravida kvinnor. Baserat på fynd från djurstudier kan det finnas en risk för fostret vid exponering för akalabrutinib under graviditeten. Dystoci (svår eller långdragen förlossning) observerades hos råttor och administration till dräktiga kaniner var associerat med minskad fostertillväxt (se avsnitt Prekliniska säkerhetsuppgifter).
Calquence ska användas under graviditet endast då tillståndet kräver att det är absolut nödvändigt att kvinnan behandlas med akalabrutinib.
Amning
Det är okänt om akalabrutinib utsöndras i bröstmjölk. Det finns inga data på effekten av akalabrutinib på det ammade barnet eller på mjölkproduktion. Akalabrutinib och dess aktiva metabolit förekom i mjölken hos diande råttor. En risk för det ammade barnet kan inte uteslutas. Ammande mödrar rekommenderas att inte amma under behandling med Calquence och i minst 2 dagar efter att ha fått den sista dosen.
Fertilitet
Det finns inga data på effekten av Calquence på fertilitet hos människa. I prekliniska studier med Calquence hos han- och honråttor observerades inga negativa effekter på fertilitetsparametrar (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Calquence har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Vid behandling med akalabrutinib har dock trötthet och yrsel rapporterats och patienter som upplever dessa symtom ska rådas att inte framföra fordon eller använda maskiner förrän symtomen avklingar.
Biverkningar
Sammanfattning av säkerhetsprofilen
Calquence som monoterapi
Av de 1 478 patienter som behandlades med Calquence som monoterapi var de vanligaste (≥ 20 %) biverkningarna av alla grader infektion, diarré, huvudvärk, muskuloskeletal smärta, blåmärken, hosta, artralgi, trötthet, illamående och utslag. De vanligast (≥ 5 %) rapporterade biverkningarna av grad ≥ 3 var infektion, leukopeni, neutropeni, anemi, ny primär malignitet och trombocytopeni.
Calquence i kombination med obinutuzumab
Av de 223 patienter som fick Calquence i kombination med obinutuzumab var de vanligaste (≥ 20 %) biverkningarna av alla grader infektion, muskuloskeletal smärta, diarré, huvudvärk, leukopeni, neutropeni, hosta, trötthet, artralgi, illamående, yrsel och förstoppning. De vanligast (≥ 5 %) rapporterade biverkningarna av grad ≥ 3 var leukopeni, neutropeni, infektion, trombocytopeni och anaemi.
Calquence i kombination med venetoklax
Av de 291 patienter som behandlades med Calquence i kombination med venetoklax var de vanligaste (≥ 20 %) biverkningarna av alla grader infektioner, neutropeni, huvudvärk, blåmärken, diarré och muskuloskeletal smärta. Den vanligast rapporterade (≥ 5 %) biverkningen av grad ≥ 3 var neutropeni.
Calquence i kombination med venetoklax och obinutuzumab
Av de 284 patienter som behandlades med Calquence i kombination med venetoklax och obinutuzumab var de vanligaste (≥ 20 %) biverkningarna av alla grader infektioner, neutropeni, huvudvärk, blåmärken, diarré, illamående och muskuloskeletal smärta. De vanligast rapporterade (≥ 5 %) biverkningarna av grad ≥ 3 var neutropeni och trombocytopeni.
Calquence i kombination med bendamustin och rituximab
Av de 297 patienter som behandlades med Calquence i kombination med bendamustin och rituximab var de vanligaste biverkningarna (≥ 20 %) av alla grader neutropeni, illamående, utslag, diarré, muskuloskeletal smärta, huvudvärk, trötthet, kräkningar, förstoppning, anemi och trombocytopeni. De vanligaste (≥ 5 %) rapporterade biverkningarna av grad ≥ 3 var neutropeni, utslag, trombocytopeni, anemi, pneumoni, nya primära maligniteter, hypertoni och nya primära maligniteter, exklusive icke-melanom hudmalignitet.
Tabell över biverkningar
Tabellerna nedan visar biverkningar som identifierats i kliniska studier med patienter som fick Calquence som monoterapi eller i kombinationsbehandling för hematologiska maligniteter. Medianvaraktighet av behandling med Calquence som monoterapi för den poolade datauppsättningen var 38,2 månader. Medianvaraktighet av behandling med Calquence hos patienter som behandlades med Calquence i kombination med bendamustin och rituximab var 28,6 månader. Medianvaraktighet av behandling med Calquence hos patienter som behandlades med Calquence i kombination med venetoklax med eller utan obinutuzumab var 12,9 månader.
Biverkningarna är listade enligt MedDRA-klassificering av organsystem (SOC). Inom varje organklass är biverkningarna rangordnade enligt frekvens, med den vanligaste biverkningen först. Motsvarande frekvenskategori för varje biverkning är dessutom definierad som: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgrupp presenteras biverkningarna i fallande ordning efter allvarlighetsgrad.
Tabell 4. Biverkningar* hos patienter med hematologiska maligniteter som behandlades med akalabrutinib monoterapi (N = 1 478)
| MedDRA-organklass | MedDRA-term | Alla grader (%) | Grad ≥ 3* (%) |
| Infektioner och infestationer | Övre luftvägsinfektion | Mycket vanliga (25,8) | 1,2 |
| Pneumoni | Mycket vanliga (15,8) | 8,7 | |
| Sinuit | Mycket vanliga (11,4) | 0,4 | |
| Urinvägsinfektion | Vanliga (9,9) | 1,8 | |
| Bronkit | Vanliga (9,7) | 0,6 | |
| Herpesvirusinfektioner † | Vanliga (9,1) | 0,9 | |
| Nasofaryngit | Vanliga (8,3) | 0 | |
| Aspergillusinfektioner † | Mindre vanliga (0,7) | 0,6 | |
| Hepatit B-reaktivering | Mindre vanliga (0,4) | 0,3 | |
| Neoplasier; benigna, maligna och ospecificerade | Ny primär malignitet † Icke-melanom hudmalignitet † Ny primär malignitet, exklusive icke-melanom hudmalignitet† | Mycket vanliga (17,6) Vanliga (9,9) Vanliga (9,7) | 6,7 1,4 5,5 |
| Blodet och lymfsystemet | Neutropeni † | Mycket vanliga (19,4) | 17,5 |
| Anemi † | Mycket vanliga (17,1) | 9,5 | |
| Trombocytopeni † | Mycket vanliga (11,5) | 6,2 | |
| Lymfocytos | Mindre vanliga (0,5) | 0,3 | |
| Metabolism och nutrition | Tumörlyssyndrom | Mindre vanliga (0,5) | 0,4 |
| Centrala och perifera nervsystemet | Huvudvärk | Mycket vanliga (36,5) | 1,2 |
| Yrsel | Mycket vanliga (13,9) | 0,1 | |
| Hjärtsjukdomar | Förmaksflimmer/fladder † | Vanliga (7,4) | 2,3 |
| Blodkärl | Blåmärken † Kontusion Petekier Ekkymoser | Mycket vanliga (30,9) Mycket vanliga (20,7) Vanliga (8,9) Vanliga (5,7) | 0 0 0 0 |
Blödningar/hematom † Gastrointestinal blödning Intrakraniell blödning | Mycket vanliga (16,3) Mindre vanliga (0,9) Mindre vanliga (0,1) | 3,2 0,7 0,1 | |
| Hypertoni† | Mycket vanliga (11,9) | 4,9 | |
| Epistaxis | Vanliga (8,0) | 0,3 | |
| Magtarmkanalen | Diarré | Mycket vanliga (36,7) | 2,6 |
| Illamående | Mycket vanliga (21,8) | 0,8 | |
| Förstoppning | Mycket vanliga (15,2) | 0,1 | |
| Buksmärta † | Mycket vanliga (14,5) | 1,2 | |
| Kräkningar | Mycket vanliga (14,0) | 0,7 | |
| Hud och subkutan vävnad | Utslag † | Mycket vanliga (20,3) | 0,9 |
| Muskuloskeletala systemet och bindväv | Muskuloskeletal smärta † | Mycket vanliga (31,9) | 1,8 |
| Artralgi | Mycket vanliga (24,0) | 0,9 | |
| Allmänna symtom och/eller symtom vid administrerings-stället | Fatigue | Mycket vanliga (23,6) | 2,0 |
| Asteni | Vanliga (7,0) | 0,9 | |
Undersökningar och provtagningar§ (Fynd baserade på testresultat) | Minskat hemoglobin± | Mycket vanliga (47,4) | 10,8 |
| Minskat absolut antal neutrofiler± | Mycket vanliga (43,9) | 24,0 | |
| Minskat antal trombocyter± | Mycket vanliga (36,9) | 9,5 |
*Enligt National Cancer Institute ”Common Terminology Criteria for Adverse Events” (NCI CTCAE) version 4.03.
†Inkluderar multipel ADR-term.
±Representerar incidensen av laboratoriefynd, inte av rapporterade biverkningar.
§Presenterade som värdena för CTCAE-grader.
Tabell 5. Biverkningar* hos patienter med hematologiska maligniteter och som fick kombinationsbehandling med akalabrutinib (N = 1 095)
| Calquence + obinutuzumab N = 223 | Calquence + BR N = 297 | Calquence + venetoklax N = 291 | Calquence + venetoklax + obinutuzumab N = 284 | |||||
|---|---|---|---|---|---|---|---|---|
| MedDRA-organklass och MedDRA-term |
Alla grader
| Grad ≥ 3* (%) |
Alla grader
| Grad ≥ 3* (%) |
Alla grader
| Grad ≥ 3* (%) |
Alla grader
| Grad ≥ 3* (%) |
| Infektioner och infestationer | ||||||||
| Övre luftvägsinfektion | Mycket vanliga (31,4) | 1,8 | Mycket vanliga (18,2) | 0,3 | Vanliga (8,2) | 0,3 | Vanliga (6,3) | 0 |
| Sinuit | Mycket vanliga (15,2) | 0,4 | Vanliga (6,4) | 0 | Vanliga (2,7) | 0 | Vanliga (2,5) | 0 |
| Nasofaryngit | Mycket vanliga (13,5) | 0,4 | Vanliga (5,4) | 0 | Vanliga (1,4) | 0 | Vanliga (1,1) | 0 |
| Urinvägsinfektion | Mycket vanliga (13) | 0,9 | Mycket vanliga (11,1) | 1,7 | Vanliga (3,1) | 0 | Vanliga (6,0) | 0,4 |
| Pneumoni | Mycket vanliga (10,8) | 5,4 | Mycket vanliga (16,2) | 8,8 | Vanliga (3,8) | 1,4 | Vanliga (5,3) | 3,9 |
| Bronkit | Vanliga (9,9) | 0 | Vanliga (6,4) | 0,3 | Vanliga (2,1) | 0 | Vanliga (2,5) | 0 |
| Herpesvirusinfektioner† | Vanliga (6,7) | 1,3 | Mycket vanliga (12,8) | 1,0 | Vanliga (4,8) | 0 | Vanliga (3,5) | 0,4 |
| Progressiv multifokal leukoencefalopati | Mindre vanliga (0,4) | 0,4 | Ingen känd frekvens | 0 | Ingen känd frekvens | 0 | Ingen känd frekvens | 0 |
| Hepatit B-reaktivering | Mindre vanliga (0,9) | 0,1 | Vanliga (1,3) | 0,3 | Ingen känd frekvens | 0 | Ingen känd frekvens | 0 |
| Aspergillusinfektioner† | Ingen känd frekvens | 0 | Mindre vanliga (0,3) | 0,3 | Ingen känd frekvens | 0 | Mindre vanliga (0,4) | 0,4 |
| Neoplasier; benigna, maligna och ospecificerade | ||||||||
Ny primär malignitet†
Icke-melanom hudmalignitet†
Ny primär malignitet, exklusive icke-melanom hudmalignitet† | Mycket vanliga (13)
Vanliga (7,6)
Vanliga (6,3) | 4,0
0,4
3,6 | Mycket vanliga (17,8)
Mycket vanliga (11,1)
Vanliga (9,8) | 7,4
2,0
5,4 | Vanliga (5,2)
Vanliga (3,1)
Vanliga (2,7) | 1,7
0
1,7 | Vanliga (4,2)
Vanliga (1,8)
Vanliga (2,5) | 1,8
0,4
1,4 |
| Blodet och lymfsystemet | ||||||||
| Neutropeni† | Mycket vanliga (31,8) | 30 | Mycket vanliga (54,9) | 50,2 | Mycket vanliga (37,1) | 32.3 | Mycket vanliga (50,4) | 46,1 |
| Trombocytopeni† | Mycket vanliga (13,9) | 9 | Mycket vanliga (22,9) | 9,8 | Vanliga (5,8) | 2.1 | Mycket vanliga (12,3) | 9,2 |
| Anemi† | Mycket vanliga (11,7) | 5,8 | Mycket vanliga (24,2) | 9,4 | Vanliga (6,9) | 3,8 | Vanliga (4,6) | 2,1 |
| Lymfocytos | Mindre vanliga (0,4) | 0,4 | Mindre vanliga (0,7) | 0 | Ingen känd frekvens | 0 | Mindre vanliga (0,7) | 0,4 |
| Metabolism och nutrition | ||||||||
| Tumörlyssyndrom | Vanliga (1,8) | 1,3 | Vanliga (1,3) | 1,3 | Mindre vanliga (0,3) | 0,3 | Mindre vanliga (0,4) | 0,4 |
| Centrala och perifera nervsystemet | ||||||||
| Huvudvärk | Mycket vanliga (43) | 0,9 | Mycket vanliga (30,3) | 1,3 | Mycket vanliga (35,1) | 1,4 | Mycket vanliga (28,2) | 0,4 |
| Yrsel | Mycket vanliga (23,8) | 0 | Mycket vanliga (14,5) | 0,7 | Vanliga (5,5) | 0 | Vanliga (6,7) | 0 |
| Hjärtat | ||||||||
| Förmaksflimmer/fladder† | Vanliga (3,1) | 0,9 | Vanliga (6,7) | 4,0 | Mindre vanliga (0,7) | 0,3 | Vanliga (2,1) | 0,7 |
| Blodkärl | ||||||||
Blåmärken†
Kontusion
Petekier
Ekkymoser | Mycket vanliga (38,6)
Mycket vanliga (27,4)
Mycket vanliga (11,2)
Vanliga (3,1) | 0
0
0
0 | Mycket vanliga (14,1)
Mycket vanliga (11,1)
Vanliga (2,0)
Vanliga (3,0) | 0,3
0
0
0,3 | Mycket vanliga (20,6)
Mycket vanliga (14,1)
Vanliga (4,8)
Vanliga (2,7) | 0
0
0
0 | Mycket vanliga (21,8)
Mycket vanliga (16,2)
Vanliga (5,3)
Vanliga (3,9) | 0
0
0
0 |
Blödningar/hematom†
Gastrointestinal blödning
Intrakraniell blödning | Mycket vanliga (17,5)
Vanliga (3,6)
Mindre vanliga (0,9) |
1,3
0,9
0 | Mycket vanliga (15,5)
Mindre vanliga (0,3)
Ingen känd frekvens |
1,0
0
0 | Vanliga (8,9)
Mindre vanliga (0,7)
Ingen känd frekvens | 0,7
0,3
0 | Vanliga (8,5)
Ingen känd frekvens
Ingen känd frekvens | 1,1
0
0 |
| Hypertoni† | Mycket vanliga (13,5) | 3,6 | Mycket vanliga (12,5) | 5,7 | Vanliga (4,1) | 2,7 | Vanliga (3,9) | 2,1 |
| Epistaxis | Vanliga (8,5) | 0 | Vanliga (2,7) | 0 | Vanliga (1,7) | 0 | Vanliga (4,2) | 0 |
| Andningsvägar, bröstkorg och mediastinum | ||||||||
| Pneumonit± | - | - | Vanliga (2,4) | 0,3 | - | - | - | - |
| Magtarmkanalen | ||||||||
| Diarré | Mycket vanliga (43,9) | 4,5 | Mycket vanliga (37,4) | 3,0 | Mycket vanliga (32,6) | 1,7 | Mycket vanliga (36,3) | 1,4 |
| Illamående | Mycket vanliga (26,9) | 0 | Mycket vanliga (42,8) | 1,3 | Mycket vanliga (14,8) | 0 | Mycket vanliga (21,8) | 0,7 |
| Förstoppning | Mycket vanliga (20,2) | 0 | Mycket vanliga (24,6) | 1,0 | Vanliga (6,5) | 0,3 | Vanliga (8,1) | 0 |
| Kräkningar | Mycket vanliga (19,3) | 0,9 | Mycket vanliga (25,6) | 0,7 | Vanliga (5,5) | 0 | Vanliga (6,7) | 0 |
| Buksmärta† | Mycket vanliga (14,8) | 1,3 | Mycket vanliga (12,1) | 2,0 | Vanliga (7,9) | 1,0 | Vanliga (8,1) | 0,7 |
| Hud och subkutan vävnad | ||||||||
| Utslag† | Mycket vanliga (30,9) | 1,8 | Mycket vanliga (39,1) | 9,8 | Mycket vanliga (12,0) | 0,3 | Mycket vanliga (16,2) | 1,1 |
| Muskuloskeletala systemet och bindväv | ||||||||
| Muskuloskeletal smärta† | Mycket vanliga (44,8) | 2,2 | Mycket vanliga (34,3) | 3,7 | Mycket vanliga (24,1) | 0,7 | Mycket vanliga (21,8) | 1,1 |
| Artralgi | Mycket vanliga (26,9) | 1,3 | Mycket vanliga (17,5) | 0,7 | Mycket vanliga (12,7) | 1,0 | Mycket vanliga (10,9) | 0,4 |
| Allmänna symtom och/eller symtom vid administreringsstället | ||||||||
| Trötthet | Mycket vanliga (30,5) | 1,8 | Mycket vanliga (29,3) | 2,7 | Mycket vanliga (14,8) | 0,3 | Mycket vanliga (14,4) | 0 |
| Asteni | Vanliga (7,6) | 0,4 | Mycket vanliga (10,4) | 1,0 | Vanliga (4,1) | 0 | Vanliga (3,2) | 0 |
| Undersökningar och provtagningar¶ | ||||||||
| Minskat absolut antal neutrofiler§ | Mycket vanliga (57,4) | 35 | Mycket vanliga (76,8) | 56,6 | Mycket vanliga (78,0) | 38,1 | Mycket vanliga (81,7) | 53,5 |
| Minskat antal trombocyter§ | Mycket vanliga (46,2) | 10,8 | Mycket vanliga (69,4) | 17,8 | Mycket vanliga (42,6) | 5,2 | Mycket vanliga (54,9) | 13,7 |
| Minskat hemoglobin§ | Mycket vanliga (43,9) | 9 | Mycket vanliga (79,5) | 10,8 | Mycket vanliga (34,7) | 6,5 | Mycket vanliga (45,8) | 3,5 |
| Förhöjt alaninaminotransferas‡ | - | - | Vanliga (9,1) | 4,4 | - | - | - | - |
| Förhöjt aspartataminotransferas‡ | - | - | Vanliga (8,1) | 3,0 | - | - | - | - |
*Enligt National Cancer Institute ”Common Terminology Criteria for Adverse Events” (NCI CTCAE) version 4.03.
†Inkluderar multipla ADR-termer.
±Ett fall med dödlig utgång rapporterades.
§Representerar incidensen av laboratoriefynd, inte av rapporterade biverkningar.
¶Presenterade som värdena för CTCAE-grader.
‡Biverkning endast i armen med Calquence + BR i ECHO-studien.
Beskrivning av utvalda biverkningar
Allvarliga infektioner vid behandling av patienter med Calquence i kombination med venetoklax med eller utan obinutuzumab
Av de 291 patienter som behandlades med Calquence i kombination med venetoklax rapporterades allvarliga (grad ≥ 3) infektioner hos 12,4 % av patienterna (oftast rapporterades covid-19 eller covid-19-pneumoni). Dödliga infektioner inträffade hos 3,1 % av patienterna (oftast rapporterades covid-19 eller covid-19-pneumoni).
Av de 284 patienter som behandlades med Calquence i kombination med venetoklax och obinutuzumab rapporterades allvarliga (grad ≥ 3) infektioner hos 23,6 % av patienterna (oftast rapporterades covid-19 eller covid-19-pneumoni). Dödliga infektioner inträffade hos 5,6 % av patienterna (oftast rapporterades covid-19 eller covid-19-pneumoni).
Utsättande och dosreduktion på grund av biverkningar
Av de 1 478 patienter som behandlades med Calquence monoterapi rapporterades utsättning på grund av biverkningar hos 14,6 % av patienterna. De huvudsakliga biverkningarna inkluderade pneumoni, trombocytopeni och diarré. Dosreduktion på grund av biverkningar rapporterades hos 5,9 % av patienterna. De huvudsakliga biverkningarna inkluderade hepatit B-reaktivering, sepsis och diarré.
Av de 223 patienter som behandlades med Calquence i kombination med obinutuzumab rapporterades utsättning av Calquence på grund av biverkningar hos 10,8 % av patienterna. De huvudsakliga biverkningarna inkluderade pneumoni, trombocytopeni och diarré. Dosreduktion på grund av biverkningar rapporterades hos 6,7 % av patienterna. De huvudsakliga biverkningarna inkluderade neutropeni, diarré och kräkningar.
Av de 291 patienter som behandlades med Calquence i kombination med venetoklax rapporterades utsättning av Calquence på grund av biverkningar hos 7,6 % av patienterna och dosreduktion av Calquence på grund av biverkningar hos 5,8 % av patienterna. De huvudsakliga biverkningarna som ledde till utsättning inkluderade covid‑19-pneumoni och covid‑19 och den biverkning som ledde till dosreduktion var neutropeni.
Av de 284 patienter som behandlades med Calquence i kombination med venetoklax och obinutuzumab rapporterades utsättning av Calquence på grund av biverkningar hos 13,7 % av patienterna och dosreduktioner av Calquence på grund av biverkningar rapporterades hos 6,3 % av patienterna. De huvudsakliga biverkningarna som ledde till utsättning inkluderade covid‑19-pneumoni och covid‑19 och den biverkning som ledde till dosreduktion var neutropeni.
Av de 297 patienter som behandlades med Calquence i kombination med bendamustin och rituximab rapporterades utsättning av Calquence på grund av biverkningar hos 42,8 % av patienterna. De huvudsakliga biverkningarna inkluderade covid-19, covid-19-pneumoni, neutropeni och pneumoni. Dosreduktion på grund av biverkningar rapporterades hos 10,1 % av patienterna. De huvudsakliga biverkningarna inkluderade neutropeni och illamående.
Äldre
Av de 1 478 patienterna i kliniska studier med Calquence monoterapi var 42 % över 65 år och under 75 år och 20,6 % var 75 år eller äldre. Inga kliniskt relevanta skillnader i säkerhet eller effekt observerades mellan patienter ≥ 65 år och yngre.
Av de 223 patienterna i kliniska studier med Calquence i kombination med obinutuzumab-behandling var 47 % över 65 år och under 75 år och 26 % var 75 år eller äldre. Inga kliniskt relevanta skillnader i säkerhet eller effekt observerades mellan patienter ≥ 65 år och yngre.
Av de 291 patienter som behandlades med Calquence i kombination med venetoklax var 28,9 % över 65 år och under 75 år och 4,5 % var 75 år eller äldre. Inga kliniskt relevanta skillnader i säkerhet eller effekt observerades mellan patienter ≥ 65 år och yngre.
Av de 284 patienter som behandlades med Calquence i kombination med venetoklax och obinutuzumab var 24 % över 65 år och under 75 år och 6,3 % var 75 år eller äldre. Inga kliniskt relevanta skillnader i säkerhet eller effekt observerades mellan patienter ≥ 65 år och yngre.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns ingen specifik behandling vid överdosering av akalabrutinib och symtom på överdos har inte fastställts. I händelse av överdos måste patienten övervakas noga för tecken eller symtom på biverkningar och lämplig behandling sättas in.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antineoplastiska medel, proteinkinashämmare, ATC-kod: L01EL02.
Verkningsmekanism
Akalabrutinib är en selektiv hämmare av Brutons tyrosinkinas (BTK). BTK är en signalmolekyl i B‑cellens antigenreceptor (BCR) och cytokinreceptorns signalvägar. Hos B-celler resulterar BTK‑signalering i överlevnad och proliferation av B-cellerna, och krävs för cell-adhesion, transport och kemotaxis.
Akalabrutinib och dess aktiva metabolit ACP-5862 bildar en kovalent bindning med en cysteinrest i BTK:s aktiva del (”active site”) vilket leder till en irreversibel inaktivering av BTK med minimala interaktioner utanför målet.
Farmakodynamisk effekt
Hos patienter med B-cellsmaligniteter som behandlats med akalabrutinib 100 mg två gånger dagligen bibehölls medianbeläggning av BTK i perifert blod på ≥ 95 % i 12 timmar vid steady state, vilket resulterade i inaktivering av BTK under hela det rekommenderade dosintervallet.
Hjärtelektrofysiologi
Effekten av akalabrutinib på QTc-intervallet utvärderades hos 46 friska frivilliga män och kvinnor i en grundlig, randomiserad, dubbelblind QT-studie med placebo och positiva kontroller. Vid en supraterapeutisk dos, 4 gånger den högsta rekommenderade dosen, förlängde Calquence inte QT/QTc‑intervallet i någon kliniskt relevant utsträckning (t.ex. inte 10 ms eller mer) (se avsnitt Varningar och försiktighet, Biverkningar och Prekliniska säkerhetsuppgifter).
Klinisk effekt och säkerhet
Patienter med tidigare obehandlad KLL
Calquence som monoterapi eller i kombination med obinutuzumab
Säkerhet och effekt av Calquence som monoterapi eller i kombination med obinutuzumab på tidigare obehandlad KLL utvärderades i en randomiserad, multicenter, öppen fas 3-studie (ELEVATE-TN) på 535 patienter. Patienterna fick Calquence plus obinutuzumab, Calquence monoterapi eller obinutuzumab plus klorambucil. Patienter som var 65 år eller äldre, eller mellan 18 och 65 år med samtidiga sjukdomar inkluderades i ELEVATE-TN, 27,9 % av patienterna hade kreatininclearance (CrCl) på < 60 ml/min. Av de patienter som var < 65 år hade 16,1 % en median CIRS-G (Cumulative Illness Rating Score for Geriatrics) poäng på 8. Studien tillät patienter att få antitrombotiska läkemedel. Patienter som krävde behandling med antikoagulantia med warfarin eller ekvivalenta vitamin K-antagonister exkluderades.
Patienterna randomiserades till en av tre armar i förhållandet 1:1:1 och fick:
- Calquence plus obinutuzumab (Calquence+G): Calquence 100 mg administrerades två gånger dagligen med start i cykel 1 dag 1 fram till sjukdomsprogression eller oacceptabel toxicitet. Obinutuzumab administrerades med start i cykel 2 dag 1 i maximalt 6 behandlingscykler. Obinutuzumab 1 000 mg administrerades på dag 1 och 2 (100 mg dag 1 och 900 mg dag 2), 8 och 15 i cykel 2 följt av 1 000 mg dag 1 i cykel 3 upp till 7. Varje cykel var 28 dagar.
- Calquence monoterapi: Calquence 100 mg administrerades två gånger dagligen fram till sjukdomsprogression eller oacceptabel toxicitet.
- Obinutuzumab plus klorambucil (GClb): Obinutuzumab och klorambucil administrerades i maximalt 6 behandlingscykler. Obinutuzumab 1 000 mg administrerades dag 1 och 2 (100 mg dag 1 och 900 mg dag 2), 8 and 15 i cykel 1 följt av 1 000 mg dag 1 i cykel 2 upp till 6. Klorambucil 0,5 mg/kg administrerades dag 1 och 15 i cykel 1 upp till 6. Varje cykel var 28 dagar.
Patienterna stratifierades med avseende på mutationsstatus för 17p-deletion (med eller utan), funktionsstatus enligt ECOG (0 eller 1 mot 2) och geografisk region (Nordamerika och västra Europa mot andra regioner). Efter bekräftad sjukdomsprogression hade 45 patienter som randomiserats till GClb-armen gått över till Calquence monoterapi. Tabell 6 sammanfattar demografi- och sjukdomskarakteristika för studiepopulationen vid baslinjen.
Tabell 6. Patientkarakteristika vid baslinjen hos (ELEVATE-TN) patienter med tidigare obehandlad KLL
| Karakteristika | Calquence plus obinutuzumab N=179 | Calquence monoterapi N=179 | Obinutuzumab plus klorambucil N=177 |
| Ålder, år; median (intervall) | 70 (41‑88) | 70 (44‑87) | 71 (46‑91) |
| Män; % | 62 | 62 | 59,9 |
| Kaukasier; % | 91,6 | 95 | 93,2 |
| ECOG funktionsstatus 0-1; % | 94,4 | 92,2 | 94,4 |
| Mediantid från diagnos (månader) | 30,5 | 24,4 | 30,7 |
| Stor tumörbörda med noder ≥ 5 cm; % | 25,7 | 38 | 31,1 |
| Cytogenetik/FISH-kategori; % | |||
| 17p-deletion | 9,5 | 8,9 | 9 |
| 11q-deletion | 17,3 | 17,3 | 18,6 |
| TP53-mutation | 11,7 | 10,6 | 11,9 |
| Omuterad IGHV | 57,5 | 66,5 | 65,5 |
| Komplex karyotyp (≥ 3 abnormaliteter) | 16,2 | 17,3 | 18,1 |
| Rai-stadium; % | |||
| 0 | 1,7 | 0 | 0,6 |
| I | 30,2 | 26,8 | 28,2 |
| II | 20,1 | 24,6 | 27,1 |
| III | 26,8 | 27,9 | 22,6 |
| IV | 21,2 | 20,7 | 21,5 |
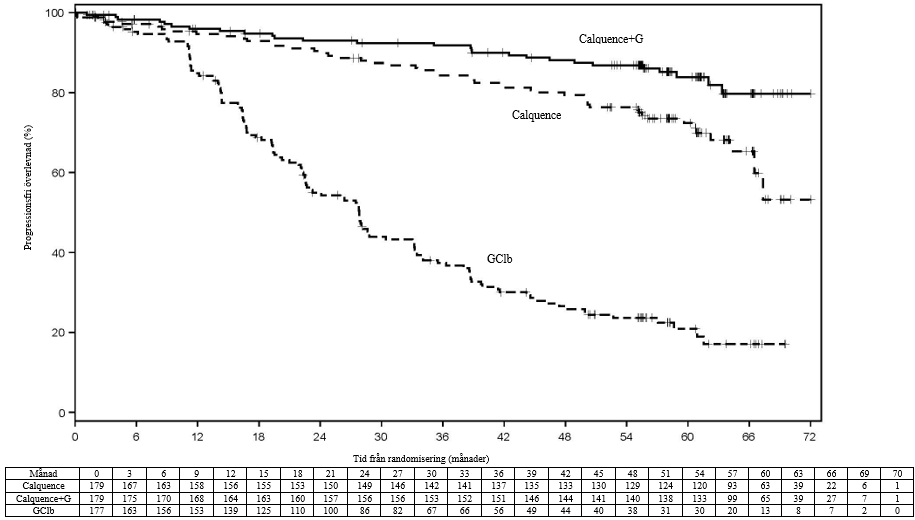
Primärt effektmått var progressionsfri överlevnad (PFS) med Calquence+G-arm jämfört med GClb-arm utvärderat av en oberoende granskningskommittee (Independent Review Committee, IRC) enligt International Workshop on Chronic Lymphocytic Leukaemia (IWCLL) 2008-kriterier med förtydligande om behandlingsrelaterad lymfocytos (Cheson 2012) inkorporerat. Med en median uppföljning på 28,3 månader, PFS enligt IRC visade på en 90 % statistiskt signifikant minskad risk för sjukdomsprogression eller död för tidigare obehandlade patienter i Calquence+G-armen jämfört med GClb-armen. Effektresultaten presenteras i tabell 7.
Tabell 7. Effektresultat enligt IRC-utvärdering för (ELEVATE-TN) patienter med KLL
Calquence plus obinutuzumab N=179 | Calquence monoterapi N=179 | Obinutuzumab plus klorambucil N=177 | |
| Progressionsfri överlevnad* | |||
| Antal händelser (%) | 14 (7,8) | 26 (14,5) | 93 (52,5) |
| PD, n (%) | 9 (5) | 20 (11,2) | 82 (46,3) |
| Antal dödsfall (%) | 5 (2,8) | 6 (3,4) | 11 (6,2) |
| Median (95 % KI), månader | NR | NR (34,2, NR) | 22,6 (20,2, 27,6) |
| HR† (95 % KI) | 0,10 (0,06, 0,17) | 0,20 (0,13, 0,30) | - |
| P-värde | < 0,0001 | < 0,0001 | - |
| 24 månaders uppskattning, % (95 % KI) | 92,7 (87,4, 95,8) | 87,3 (80,9, 91,7) | 46,7 (38,5, 54,6) |
| Total överlevnad (OS)a | |||
| Antal dödsfall (%) | 9 (5) | 11 (6,1) | 17 (9,6) |
| Riskkvot (Hazard Ratio) (95 % KI) † | 0,47 (0,21, 1,06) | 0,60 (0,28, 1,27) | - |
| Bästa totala respons* (CR + CRi + nPR + PR) | |||
ORR, n (%) (95 % KI) | 168 (93,9) (89,3, 96,5) | 153 (85,5) (79,6, 89,9) | 139 (78,5) (71,9, 83,9) |
| P-värde | < 0,0001 | 0,0763 | - |
| CR, n (%) | 23 (12,8) | 1 (0,6) | 8 (4,5) |
| CRi, n (%) | 1 (0,6) | 0 | 0 |
| nPR, n (%) | 1 (0,6) | 2 (1,1) | 3 (1,7) |
| PR, n (%) | 143 (79,9) | 150 (83,8) | 128 (72,3) |
| KI=konfidensintervall; HR=riskkvot (hazard ratio); NR=ej uppnådd (not reached); CR=komplett respons; CRi=komplett respons med ofullständig normalisering av blodvärden; nPR=nodulär partiell respons; PR=partiell respons; PD=progressiv sjukdom. *Enligt IRC-utvärdering. †Baserat på stratifierad Cox-Proportional-Hazards-modell. a Median OS uppnåddes ej i båda armarna. | |||
PFS-resultaten för Calquence med eller utan obinutuzumab var likvärdiga mellan subgrupperna, inklusive höga riskfaktorer. I KLL-populationen med hög risk (17p-deletion, 11q-deletion, TP53-mutation eller omuterad IGHV), var PFS HRs för Calquence med eller utan obinutuzumab jämfört med obinutuzumab plus klorambucil 0,08 [95 % KI (0,04, 0,15)] respektive 0,13 [95% KI (0,08, 0,21)].
Tabell 8. Subgruppsanalys av PFS (Studie ELEVATE-TN)
| Calquence monoterapi | Calquence+G | |||||
| N | Riskkvot (HR) | 95 % KI | N | Riskkvot (HR) | 95 % KI | |
| Alla patienter | 179 | 0,20 | (0,13, 0,30) | 179 | 0,10 | (0,06, 0,17) |
Del 17P Ja Nej | 19 160 | 0,20 0,20 | (0,06, 0,64) (0,12, 0,31) | 21 158 | 0,13 0,09 | (0,04, 0,46) (0,05, 0,17) |
TP53-mutation Ja Nej | 19 160 | 0,15 0,20 | (0,05, 0,46) (0,12, 0,32) | 21 158 | 0,04 0,11 | (0,01, 0,22) (0,06, 0,20) |
Del 17P och / eller TP53-mutation Ja Nej | 23 156 | 0,23 0,19 | (0,09, 0,61) (0,11, 0,31) | 25 154 | 0,10 0,10 | (0,03, 0,34) (0,05, 0,18) |
IGHV-mutation Muterad Omuterad | 58 119 | 0,69 0,11 | (0,31, 1,56) (0,07, 0,19) | 74 103 | 0,15 0,08 | (0,04, 0,52) (0,04, 0,16) |
Del 11q Ja Nej | 31 148 | 0,07 0,26 | (0,02, 0,22) (0,16, 0,41) | 31 148 | 0,09 0,10 | (0,03, 0,26) (0,05, 0,20) |
Komplex Karyotyp Ja Nej | 31 117 | 0,10 0,27 | (0,03, 0,33) (0,16, 0,46) | 29 126 | 0,09 0,11 | (0,03, 0,29) (0,05, 0,21) |
Avseende långtidsdata var mediantiden för uppföljning 58,2 månader för Calquence+G-armen, 58,1 månader för Calquence-armen och 58,2 månader för GClb-armen. Prövarutvärderad (INV-utvärderad) median PFS uppnåddes inte i Calquence+G-armen eller Calquence monoterapiarmen, och i GClb-armen var den 27,8 månader. Vid senaste brytdatum för datainsamling överfördes totalt 72 patienter (40,7 %) som ursprungligen hade randomiserats till GClb-armen till Calquence monoterapi. Median total överlevnad uppnåddes inte i någon arm, och det totala antalet dödsfall var 76: 18 (10,1 %) i Calquence+G-armen, 30 (16,8 %) i Calquence monoterapiarmen och 28 (15,8 %) i GClb-armen.
Tabell 9. Effektresultat enligt INV-utvärdering hos (ELEVATE-TN) patienter med KLL
Calquence plus obinutuzumab N=179 | Calquence monoterapi N=179 | Obinutuzumab plus klorambucil N=177 | ||
| Progressionsfri överlevnad | ||||
| Antal händelser (%) | 27 (15,1) | 50 (27,9) | 124 (70,1) | |
| PD, n (%) | 14 (7,8) | 30 (16,8) | 112 (63,3) | |
| Antal dödsfall (%) | 13 (7,3) | 20 (11,2) | 12 (6,8) | |
| Median (95 % KI), månader* | NR | NR (66,5, NR) | 27,8 (22,6, 33,2) | |
| HR† (95 % KI) | 0,11 (0,07, 0,16) | 0,21 (0,15, 0,30) | - | |
| Total överlevnad (OS) | ||||
| Antal dödsfall (%) | 18 (10,1) | 30 (16,8) | 28 (15,8) | |
| Riskkvot (95 % KI) † | 0,55 (0,30, 0,99) | 0,98 (0,58, 1,64) | - | |
KI=konfidensintervall; HR=riskkvot (hazard ratio); NR=ej uppnådd (not reached)
*95 % konfidensintervall baserat på Kaplan-Meier-utvärdering.
†Utvärdering baserad på stratifierad Cox-Proportional-Hazards-modell för riskkvot (95 % KI) stratifierad med avseende på 17p-deletionstatus (ja vs nej).
Figur 1. Kaplan-Meier-kurva över INV-utvärderad PFS hos (ELEVATE-TN) patienter med KLL (ITT-population)
Patienter med tidigare obehandlad KLL - fast behandlingstid
Calquence i kombination med venetoklax med eller utan obinutuzumab
Säkerhet och effekt av Calquence i kombination med venetoklax med eller utan obinutuzumab vid tidigare obehandlad KLL utvärderades i en randomiserad, öppen multicenterstudie i fas 3 (AMPLIFY) på 867 patienter. Patienterna fick Calquence plus venetoklax, Calquence plus venetoklax och obinutuzumab, eller prövarens val av kemoimmunterapi, antingen FCR (fludarabin plus cyklofosfamid plus rituximab) eller BR (bendamustin plus rituximab). AMPLIFY inkluderade patienter med tidigare obehandlad KLL utan del(17p)- eller TP53-mutation som var 18 år och äldre. Studien tillät patienter att få antitrombotiska läkemedel förutom warfarin och andra vitamin K-antagonister.
Patienterna randomiserades till en av tre armar i förhållandet 1:1:1 och fick:
- Calquence plus venetoklax (AV): Calquence 100 mg administrerades två gånger dagligen med start i cykel 1 dag 1 i totalt 14 cykler eller fram till sjukdomsprogression eller oacceptabel toxicitet. Dag 1 i cykel 3 påbörjade patienterna det 5 veckor långa dostitreringsschemat för venetoklax med en startdos på 20 mg och en dosökning en gång i veckan till 50 mg, 100 mg, 200 mg och slutligen 400 mg en gång dagligen. Venetoklax administrerades i totalt 12 cykler. Varje cykel var 28 dagar.
- Calquence plus venetoklax plus obinutuzumab (AVO): Calquence 100 mg administrerades två gånger dagligen med start i cykel 1 dag 1 i totalt 14 cykler eller fram till sjukdomsprogression eller oacceptabel toxicitet. Dag 1 i cykel 3 påbörjade patienterna det 5 veckor långa dostitreringsschemat för venetoklax med en startdos på 20 mg och en dosökning en gång i veckan till 50 mg, 100 mg, 200 mg och slutligen 400 mg en gång dagligen. Venetoklax administrerades i totalt 12 cykler. Obinutuzumab 1 000 mg administrerades på dag 1 eller dag 1 och 2 (100 mg dag 1 och 900 mg dag 1 eller 2), 8 och 15 i cykel 2 följt av 1 000 mg dag 1 i cykel 3‑7. Varje cykel var 28 dagar.
- Prövarens val av kemoimmunterapi (FCR/BR):
- Fludarabin plus cyklofosfamid plus rituximab (FCR): Fludarabin (25 mg/m2) och cyklofosfamid (250 mg/m2) administrerades dag 1‑3 i upp till maximalt 6 cykler. Rituximab administrerades i en dos på 375 mg/m2 dag 1 i cykel 1 och 500 mg/m2 dag 1 i cykel 2 upp till 6. Varje cykel var 28 dagar.
- Bendamustin plus rituximab (BR): Bendamustin 90 mg/m2 administrerades dag 1 och 2 i upp till maximalt 6 cykler. Rituximab administrerades i en dos på 375 mg/m2 dag 1 i cykel 1 och 500 mg/m2 dag 1 i cykel 2 upp till 6. Varje cykel var 28 dagar.
Patienterna stratifierades med avseende på ålder (> 65 år eller ≤ 65 år), IGHV-mutationsstatus (muterad mot omuterad), Rai-stadium (hög risk [≥ 3] mot icke-hög risk) och geografisk region (Nordamerika och västra Europa mot andra regioner). Tabell 10 sammanfattar demografi- och sjukdomskarakteristika för studiepopulationen vid baslinjen.
Tabell 10. Patientkarakteristika vid baslinjen hos (AMPLIFY) patienter med tidigare obehandlad KLL
| Karakteristika | AV N = 291 | AVO N = 286 | FCR/BR N = 290 |
| Ålder, år; median (intervall) | 61 (31‑84) | 61 (29‑81) | 61 (26‑86) |
| Män; % | 61,2 | 69,2 | 63,1 |
| Kaukasier; % | 91,1 | 86,7 | 86,9 |
| ECOG-funktionsstatus 0–1; % | 90,0 | 95,1 | 90,3 |
| Mediantid från diagnos till randomisering (månader) | 28,5 | 26,1 | 29,6 |
| Stor tumörbörda med noder ≥ 5 cm; % | 38,8 | 35,0 | 42,8 |
| Cytogenetik/FISH-kategori; % | |||
| 11q-deletion | 17,5 | 19,6 | 15,9 |
| Komplex karyotyp (≥ 3 abnormaliteter) | 15,5 | 16,1 | 14,5 |
| Omuterad IGHV; % | 57,4 | 59,1 | 59,3 |
| Rai-stadium; % | |||
| 0 | 1,0 | 0,3 | 1,4 |
| I | 16,2 | 21,3 | 21,4 |
| II | 35,7 | 37,8 | 33,4 |
| III | 23,7 | 17,8 | 20,3 |
| IV | 23,4 | 22,7 | 23,4 |
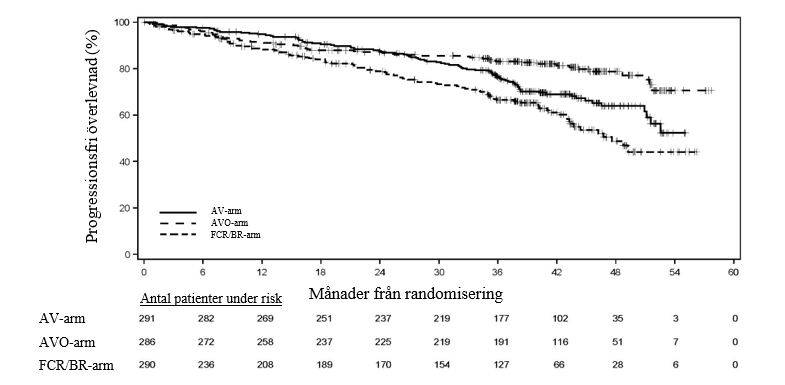
Primärt effektmått var PFS för AV jämfört med prövarens val av kemoimmunterapi (FCR/BR), IRC‑utvärderat enligt IWCLL 2018-kriterier. Ytterligare effektmått var IRC-utvärderat PFS för AVO jämfört med prövarens val (FCR/BR) samt OS för både AV jämfört med prövarens val (FCR/BR) och AVO jämfört med prövarens val (FCR/BR).
Effektresultaten presenteras i tabell 11. Kaplan-Meier-kurvan över IRC-PFS visas i figur 2.
Tabell 11. Effektresultat hos (AMPLIFY) patienter med tidigare obehandlad KLL
AV N = 291 | AVO N = 286 | FCR/BRa N = 290 | |
|---|---|---|---|
| Progressionsfri överlevnad* | |||
| Antal händelser (%) | 89 (30,6) | 56 (19,6) | 95 (32,8) |
| PD, n (%) | 77 (26,5) | 23 (8,0) | 66 (22,8) |
| Antal dödsfall (%) | 12 (4,1) | 33 (11,5) | 29 (10,0) |
| Median (95 % KI), månader | NC (51,1, NC) | NC (NC, NC) | 47,6 (43,3, NC) |
| HR† (95 % KI) | 0,65 (0,49, 0,87) | 0,42 (0,30, 0,59) | - |
| P-värde | 0,0038 | ˂ 0,0001 | - |
| Total överlevnadb | |||
| Antal dödsfall (%) | 23 (7,9) | 37 (12,9) | 44 (15,2) |
| HR† (95 % KI) | 0,42 (0,25, 0,70)c | 0,75 (0,48, 1,16) | - |
| NC = ej beräkningsbart (not calculable); KI=konfidensintervall; PD=progressiv sjukdom. *Enligt IRC-utvärdering. †Baserat på stratifierad Cox-Proportional-Hazards-modell. aEnligt prövarens val skulle 143 patienter få FCR och 147 patienter BR. bOS-data vid ytterligare 6 månaders uppföljning från interimsanalys av PFS. cP-värdet är inte signifikant efter justering för multiplicitet. | |||
Figur 2.Kaplan-Meier-kurva över IRC-utvärderad PFS hos (AMPLIFY) patienter med KLL (ITT-population)
Patienter med KLL som har fått åtminstone en tidigare behandling
Säkerhet och effekt av Calquence i återfallen eller refraktär KLL utvärderades i en randomiserad, multicenter, öppen fas 3-studie (ASCEND) på 310 patienter som hade fått minst en tidigare behandling utan BCL-2-hämmar eller B-cellsreceptorhämmare. Patienterna fick Calquence monoterapi eller prövarens val av antingen idelalisib plus rituximab eller bendamustin plus rituximab. Studien tillät patienter att få antitrombotiska läkemedel. Patienter som fick antingen antikoagulantia med warfarin eller ekvivalent vitamin K-antagonister exkluderades.
Patienterna randomiserades 1:1 och fick antingen:
- Calquence 100 mg två gånger dagligen fram till progression av sjukdom eller oacceptabel toxicitet, eller
- Prövarens val:
- Idelalisib 150 mg två gånger dagligen i kombination med rituximab 375 mg/m2 i.v. dag 1 i första cykeln, följt av 500 mg/m2 i.v. varannan vecka i 4 doser, sedan var 4:e vecka i 3 doser, totalt 8 infusioner
- Bendamustin 70 mg/m2 (dag 1 och 2 i varje 28-dagars cykel) i kombination med rituximab (375 mg/m2/500 mg/m2) dag 1 i varje 28-dagars cykel i upp till 6 cykler
Patienterna stratifierades med avseende på mutationsstatus för 17p-deletion (med eller utan), funktionsstatus enligt ECOG (0 eller 1 mot 2) och antal tidigare behandlingar (1 till 3 mot ≥ 4). Efter bekräftad progression av sjukdom övergick 35 patienter som randomiserats enligt prövarens val till antingen idelalisib plus rituximab eller bendamustin plus rituximab, att behandlas med Calquence. Demografi- och sjukdomskarakteristika för studiepopulationen vid baslinjen är sammanfattade i tabell 12.
Tabell 12. Patientkarakteristika vid baslinjen hos (ASCEND) patienter med KLL
| Karakteristika | Calquence monoterapi N=155
| Prövarens val av idelalisib + rituximab eller bendamustin + rituximab N=155 |
|---|---|---|
| Ålder, år; median (intervall) | 68 (32-89) | 67 (34-90) |
| Män; % | 69,7 | 64,5 |
| Kaukasier; % | 93,5 | 91,0 |
| ECOG funktionsstatus; % | ||
| 0 | 37,4 | 35,5 |
| 1 | 50,3 | 51,0 |
| 2 | 12,3 | 13,5 |
| Mediantid från diagnos (månader) | 85,3 | 79,0 |
| Stor tumörbörda med noder ≥ 5 cm; % | 49,0 | 48,4 |
| Medianantal tidigare KLL-behandlingar (intervall) | 1 (1-8) | 2 (1-10) |
| Antal tidigare KLL-behandlingar; % | ||
| 1 | 52,9 | 43,2 |
| 2 | 25,8 | 29,7 |
| 3 | 11,0 | 15,5 |
| ≥ 4 | 10,3 | 11,6 |
| Cytogenetik/FISH-kategori; % | ||
| 17p-deletion | 18,1 | 13,5 |
| 11q-deletion | 25,2 | 28,4 |
| TP53-mutation | 25,2 | 21,9 |
| Omuterad IGHV | 76,1 | 80,6 |
| Komplex karyotyp (≥ 3 abnormaliteter) | 32,3 | 29,7 |
| Rai Stage; % | ||
| 0 | 1,3 | 2,6 |
| I | 25,2 | 20,6 |
| II | 31,6 | 34,8 |
| III | 13,5 | 11,6 |
| IV | 28,4 | 29,7 |
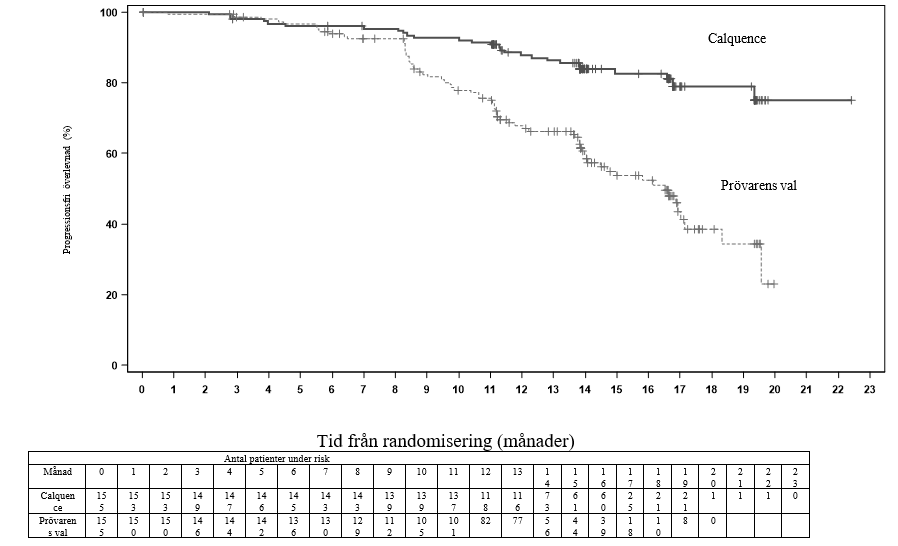
Primärt effektmått var PFS, utvärderat enligt IRC IWCLL 2008-kriterier med förtydligande om behandlingsrelaterad lymfocytos (Cheson 2012) inkorporerat. Med en median uppföljningstid på 16,1 månader visade PFS en statistiskt signifikant minskning i risk för död eller progression hos patienter i Calquence-armen. Effektresultat presenteras i tabell 13. Kaplan-Meierkurvan för PFS visas i figur 3.
Tabell 13. Effektresultat enligt IRC-utvärdering för (ASCEND) patienter med KLL
Calquence monoterapi N=155
| Prövarens val av idelalisib + rituximab eller bendamustin + rituximab N=155 | |
| Progressionsfri överlevnad* | ||
| Antal händelser (%) | 27 (17,4) | 68 (43,9) |
| PD, n (%) | 19 (12,3) | 59 (38,1) |
| Antal dödsfall (%) | 8 (5,2) | 9 (5,8) |
| Median (95 % KI), månader | NR | 16,5 (14,0, 17,1) |
| HR† (95 % KI) | 0,31 (0,20, 0,49) | |
| P-värde | < 0,0001 | |
| 15 månaders uppskattning, % (95 % KI) | 82,6 (75,0, 88,1) | 54,9 (45,4, 63,5) |
| Total överlevnad (OS)a | ||
| Antal dödsfall (%) | 15 (9,7) | 18 (11,6) |
| Riskkvot (Hazard Ratio) (95 % KI) † | 0,84 (0, 42, 1,66) | - |
| Bästa totala respons* (CR + CRi + nPR + PR)** | ||
ORR, n (%) (95 % KI) | 126 (81,3) (74,4, 86,6) | 117 (75,5) (68,1, 81,6) |
| P-värde | 0,2248 | - |
| CR, n (%) | 0 | 2 (1,3) |
| PR, n (%) | 126 (81,3) | 115 (74,2) |
| Varaktighet av respons (DoR) | ||
| Median (95 % KI), månader | NR | 13,6 (11,9, NR) |
| KI=konfidensintervall; HR=riskkvot (hazard ratio); NR=ej uppnådd (not reached); CR=komplett respons; CRi=komplett respons med ofullständig normalisering av blodvärden; nPR=nodulär partiell respons; PR=partiell respons; PD=progressiv sjukdom *Enligt IRC-utvärdering a Median OS uppnåddes ej i båda armarna. P<0,6089 för OS. **CRi och nPR har värdet 0. †Baserat på stratifierad Cox-Proportional-Hazards-modell | ||
Figur 3. Kaplan-Meier-kurva över IRC-utvärderad PFS hos (ASCEND) patienter med KLL (ITT-population)
PFS-resultaten för Calquence var likvärdiga mellan subgrupperna, inklusive högriskfaktorer. I KLL-populationen med hög risk (17p-deletion, 11q-deletion, TP53-mutation och omuterad IGHV), var PFS HR för Calquence 0,27 [95 % KI (0,17, 0,44)].
Tabell 14. Subgruppsanalys av IRC-utvärderad PFS (ASCEND studien)
| Calquence monoterapi | |||
|---|---|---|---|
| N | Riskkvot | 95 % KI | |
| Alla patienter | 155 | 0,30 | (0,19, 0,48) |
Del 17P Ja Nej |
28 127 |
0,21 0,33 |
(0,07, 0,68) (0,21, 0,54) |
TP53-mutation Ja Nej |
39 113 |
0,24 0,33 |
(0,11, 0,56) (0,20, 0,57) |
Del 17P eller TP53-mutation Ja Nej |
45 108 |
0,21 0,36 |
(0,09, 0,48) (0,21, 0,61) |
IGHV-mutation Muterad Omuterad |
33 118 |
0,32 0,32 |
(0,11, 0,94) (0,19, 0,52) |
Del 11q Ja Nej |
39 116 |
0,28 0,31 |
(0,11, 0,70) (0,19, 0,53) |
Komplex Karyotyp Ja Nej |
50 97 |
0,32 0,23 |
(0,16, 0,63) (0,12, 0,44) |
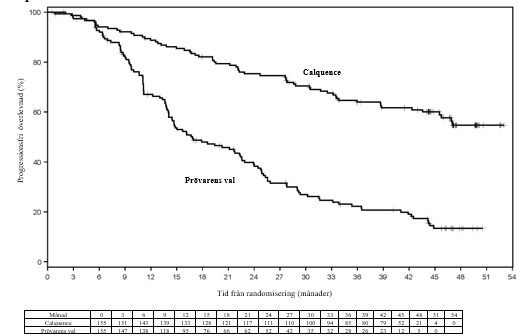
Vid slutlig analys, med en median uppföljningstid på 46,5 månader för Calquence och 45,3 månader för IR/BR, observerades en minskning med 72 % i risk för prövarutvärderad sjukdomsprogression eller död hos patienter i Calquence-armen. Den prövarutvärderade PFS medianen uppnåddes inte för Calquence och var 16,8 månader för IR/BR. Effektresultat enligt INV (Investigator assessments) presenteras i tabell 15. Kaplan-Meier-kurvan för INV-utvärderad PFS visas i figur 4.
Tabell 15. Effektresultat vid slutlig analys enligt INV-utvärdering för (ASCEND) patienter med KLL
Calquence monoterapi
| Prövarens val av idelalisib + rituximab eller bendamustin + rituximab N=155 | |
|---|---|---|
| Progressionsfri överlevnad* | ||
| Antal händelser (%) | 62 (40,0) | 119 (76,8) |
| PD, n (%) | 43 (27,7) | 102 (65,8) |
| Antal dödsfall (%) | 19 (12,3) | 17 (11,0) |
| Median (95 % KI), månader | NR | 16,8 (14,1, 22,5) |
| HR† (95 % KI) | 0,28 (0,20, 0,38) | |
| Total överlevnad (OS)a | ||
| Antal dödsfall (%) | 41 (26,5) | 54 (34,8) |
| Riskkvot (Hazard Ratio) (95 % KI) † | 0,69 (0,46, 1,04) | - |
| KI=konfidensintervall; HR=riskkvot (hazard ratio); NR=ej uppnådd (not reached); PD=progressiv sjukdom *Enligt INV-utvärdering. a Median OS uppnåddes ej i båda armarna. P=0,0783 för OS. †Baserat på stratifierad Cox-Proportional-Hazards-modell. | ||
Figur 4. Kaplan-Meier-kurva över INV-utvärderad PFS vid slutlig analys hos (ASCEND) patienter med KLL
Vid slutlig analys var de prövarutvärderade PFS-resultaten för Calquence likvärdiga mellan subgrupperna, inklusive hög-riskfaktorer, och likvärdiga med den primära analysen.
Patienter med tidigare obehandlat MCL
Säkerhet och effekt av Calquence hos patienter med tidigare obehandlat MCL utvärderades i ECHO, en randomiserad, dubbelblind, placebokontrollerad multicenterstudie i fas 3. ECHO inkluderade 598 patienter i åldern 65 år och äldre med bekräftat MCL som tidigare inte behandlats.
Patienterna randomiserades till två armar i förhållandet 1:1 och fick:
- Calquence plus bendamustin och rituximab (Calquence + BR)-armen: Calquence 100 mg administrerades två gånger dagligen från dag 1 i cykel 1 kontinuerligt. Bendamustin 90 mg/m2 administrerades intravenöst under 30 minuter dag 1 och 2 i varje 28-dagars cykel i 6 cykler. Rituximab 375 mg/m2 administrerades intravenöst dag 1 i varje 28-dagars cykel i 6 cykler. Calquence + BR administrerades i maximalt 6 behandlingscykler (induktionsbehandling).
- Placebo plus bendamustin och rituximab (placebo + BR)-armen: Placebo administrerades två gånger dagligen från dag 1 i cykel 1 kontinuerligt. Bendamustin 90 mg/m2 administrerades intravenöst under 30 minuter dag 1 och 2 i varje 28-dagars cykel i 6 cykler. Rituximab 375 mg/m2 administrerades intravenöst dag 1 i varje 28-dagars cykel i 6 cykler. Placebo + BR administrerades i maximalt 6 behandlingscykler (induktionsbehandling).
Calquence eller placebo administrerades kontinuerligt fram till sjukdomsprogression eller oacceptabel toxicitet. Efter induktionsbehandlingen fick patienter som svarade på behandlingen (PR eller CR) underhållsbehandling med rituximab vid en dos på 375 mg/m2 dag 1 i varannan cykel i maximalt 12 ytterligare doser upp till cykel 30. Patienter i armen med placebo + BR som hade bekräftad progressiv sjukdom (PD) var lämpliga att övergå till Calquence som monoterapi vid en dos på 100 mg två gånger dagligen fram till andra sjukdomsprogression eller oacceptabel toxicitet.
Randomiseringen av patienterna stratifierades med avseende på geografisk region (Nordamerika mot västra Europa mot andra regioner) och förenklat MIPI-poäng (Mantle Cell Lymphoma International Prognostic Index) (0–3 mot 4–5 mot 6–11).
Medianåldern var 71 år (65‑86), 70,7 % var män, 78,3 % var kaukasier, 93,1 % hade en ECOG-funktionsstatus på 0‑1. Det förenklade MIPI-poänget var lågt (0–3) hos 33,1 %, måttligt (4–5) hos 42,8 % och högt (6–11) hos 24,1 % av patienterna. Totalt 37,7 % av patienterna hade en tumörbörda ≥ 5 cm och 86 % var i Ann Arbor-stadium IV. Aggressiva varianter av MCL, såsom blastiska och pleomorfa former, sågs hos 7,7 % respektive 5,5 % av patienterna. Totalt hade 47,8 % av patienterna Ki-67-poäng ≥ 30 %. Baslinjekarakteristika var likartade i båda armarna.
Primärt effektmått var progressionsfri överlevnad (PFS) utvärderat av en oberoende granskningskommitté (Independent Review Committee, IRC) enligt 2014 Lugano-klassifikationen av non-Hodgkins lymfom (NHL) hos patienter med tidigare obehandlat MCL. Även total respons (ORR) bedömdes av en IRC.
IRC-utvärderad PFS utvärderades vid en medianuppföljning på 49,8 månader.
Med ytterligare 6 månaders uppföljning från den primära PFS-analysen och en medianuppföljning på 63,0 månader uppnåddes inte median total överlevnad i någon arm. Det totala antalet dödsfall var 218: 105 (35,1 %) i Calquence + BR-armen och 113 (37,8 %) i placebo + BR-armen. Effektresultaten presenteras i tabell 16. Kaplan-Meier-kurvorna över PFS visas i figur 5.
Tabell 16. Effektresultat hos patienter med tidigare obehandlat MCL i ECHO
| Calquence + BR N = 299 | Placebo + BR N = 299 | |
|---|---|---|
| IRC‑-utvärderad PFS | ||
| Median (95 % KI) | 66,4 (55,1, NE) | 49,6 (36,0, 64,1) |
| HR (95 % KI) (stratifierat)* | 0,73 (0,57, 0,94) | |
| p-värde‡ | 0,0160 | |
| IRC‑-utvärderad ORR | ||
| CR + PR n (%) | 272 (91,0) | 263 (88,0) |
| 95 % KI | 87,3, 93,8 | 83,9, 91,3 |
| CR n (%) | 199 (66,6) | 160 (53,5) |
| PR n (%) | 73 (24,4) | 103 (34,4) |
| p-värde | 0,2196 | - |
* HR=riskkvot, CR=komplett respons, PR=partiell respons, NE= icke-utvärderingsbar
*Stratifierat enligt stratifieringsfaktorer för randomisering: geografisk region (Nordamerika, västra Europa, annan) och förenklat MIPI-poäng (låg risk [0 till 3], måttlig risk [4 till 5], hög risk [6 till 11]) enligt insamling via IXRS. Utvärdering baserad på stratifierad Cox-Proportional-Hazards-modell för riskkvot (95 % KI).
‡ Utvärdering baserad på stratifierat log-rank-test för p-värde.
Figur 5. Kaplan-Meier-kurva över IRC-utvärderad PFS hos patienter med tidigare obehandlat MCL (ECHO)
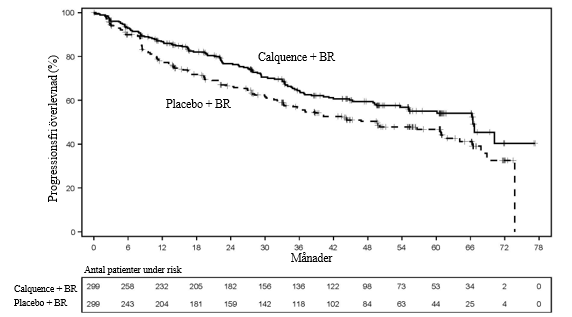
Patienter med MCL som har fått minst en tidigare behandling
Säkerheten och effekten av Calquence vid MCL utvärderades i en öppen, enarmad fas 2-multicenterstudie (ACE-LY-004) på 124 patienter som tidigare fått behandling. Alla patienter fick Calquence 100 mg oralt två gånger dagligen fram till sjukdomsprogression eller oacceptabel toxicitet. Studien inkluderade inte patienter som tidigare hade fått behandling antingen med BTK- eller BCL-2-hämmare. Det primära effektmåttet var prövarutvärderad total responsfrekvens (ORR) enligt Lugano-klassifikationen av non-Hodgkins lymfom (NHL). Varaktighet av respons (DoR) var ett ytterligare utfallsmått. Effektresultaten i den slutliga (54 månader) analysen visas i tabell 17.
Vid den slutliga analysen var medianåldern 68 år (intervall 42–90 år), 79,8 % var män och 74,2 % var kaukasier. Vid baslinjen hade 92,8 % av patienterna en ECOG funktionsstatus 0 eller 1. Mediantiden från diagnos var 46,3 månader och medianantalet tidigare behandlingar var 2 (intervall 1–5), inklusive 17,7 % med tidigare stamscellstransplantation. De vanligaste tidigare behandlingarna var CHOP-baserade (51,6 %) och Ara-C (33,9 %). Vid baslinjen hade 37,1 % av patienterna haft minst en tumör med störst diameter på ≥ 5 cm, 72,6 % hade extranodalt engagemang, inklusive 50,8 % med engagemang i benmärgen. Det förenklade MIPI-poänget (som inkluderar ålder och ECOG poäng samt laktatdehydrogenasnivå och antal vita blodkroppar vid baslinjen) var måttligt hos 43,5 % och högt hos 16,9 % av patienterna.
Tabell 17. ORR och DOR hos (ACE-LY-004) patienter med MCL vid den slutliga analysen vid 54 månader
Prövarutvärdering vid 54 månader N = 124 n (%) (95 % KI*) | |
|---|---|
Total responsfrekvens (ORR) | |
Total responsfrekvens | 101 (81,5 %) (73,5, 87,9) |
Komplett respons | 59 (47,6 %) (38,5, 56,7) |
Partiell respons | 42 (33,9 %) (25,6, 42,9) |
Icke-utvärderingsbar | 3 (2,4 %) (0,5, 6,9) |
Varaktighet av respons (DoR) | |
Median (månader) | 28,6 (17,5, 39,1) |
KI = konfidensintervall | |
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Calquence för alla grupper av den pediatriska populationen för behandling av mogna B-cellsneoplasmer (för information om pediatrisk användning, se avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Farmakokinetiken (PK) för akalabrutinib och dess aktiva metabolit ACP-5862 studerades hos friska försökspersoner och hos patienter med B-cellsmaligniteter. Akalabrutinib uppvisar dosproportionaliet och både akalabrutinib och ACP-5862 uppvisar näst intill linjär PK över ett dosintervall på 75 till 250 mg. Modeller för populations-PK tyder på att PK för akalabrutinib och ACP-5862 är jämförbara hos patienter med olika B-cellsmaligniteter. Vid den rekommenderade dosen på 100 mg två gånger dagligen hos patienter med B-cellsmaligniteter (inklusive KLL) var det geometriska medelvärdet för steady state av plasmakoncentrationen över tid AUC24h och maximal plasmakoncentration (Cmax) 1 679 ng•h/ml respektive 438 ng/ml för akalabrutinib och 4 166 ng•h/ml respektive 446 ng/ml för ACP-5862.
Absorption
Tiden till maximal plasmakoncentration (Tmax) var 0,5‑1,5 timmar för akalabrutinib och 1,0 timme för ACP-5862. Den absoluta biotillgängligheten för Calquence var 25 %.
Effekt av mat på akalabrutinib
Administrering av en singeldos på 75 mg akalabrutinib tillsammans med en måltid med högt fett- och kaloriinnehåll (cirka 918 kcal, 59 g kolhydrater, 59 g fett och 39 g protein) påverkade inte genomsnittlig AUC hos friska försökspersoner jämfört med dosering vid fastande tillstånd. Resulterande Cmax minskade med 69 % och Tmax fördröjdes med 1‑2 timmar.
Distribution
Reversibel bindning till humant plasmaprotein var 99,4 % för akalabrutinib och 98,8 % för ACP-5862. Genomsnittlig blod-plasmaförhållande in-vitro var 0,8 för akalabrutinib och 0,7 för ACP-5862. Genomsnittlig distributionsvolym vid steady state (Vss) var cirka 34 l för akalabrutinib.
Metabolism
Akalabrutinib metaboliseras huvudsakligen in vitro via CYP3A-enzymer och i mindre utsträckning genom glutationkonjugering och amidhydrolys. ACP-5862 identifierades som den huvudsakliga metaboliten i plasma, som ytterligare metaboliserades främst genom CYP3A-medierad oxidation, med en geometrisk genomsnittlig exponering (AUC) som var ungefär 2- till 3 gånger högre än exponeringen för akalabrutinib. ACP-5862 är ungefär 50 % mindre potent än akalabrutinib med avseende på BTK-hämning.
In vitro-studier tyder på att akalabrutinib inte hämmar CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, UGT1A1 eller UGT2B7 vid kliniskt relevanta koncentrationer och påverkar sannolikt inte clearance för substrat till dessa CYP-enzymer.
In vitro-studier tyder på att ACP-5862 inte hämmar CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4/5, UGT1A1 eller UGT2B7 vid kliniskt relevanta koncentrationer och påverkar sannolikt inte clearance för substrat till dessa CYP-enzymer.
Interaktioner med transportproteiner
In vitro-studier tyder på att akalabrutinib och ACP-5862 är substrat för P-gp- och BCRP. Samtidig administrering med BCRP-hämmare är dock osannolikt att det resulterar i kliniskt relevanta läkemedelsinteraktioner.Samtidig administrering med en OATP1B1/1B3-hämmare (600 mg rifampicin, singeldos) resulterade i en ökning av Cmax och AUC för akalabrutinib med 1,2 respektive 1,4 gånger (N=24, friska försökspersoner), vilket inte är kliniskt relevant.
Akalabrutinib och ACP-5862 hämmar inte P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 eller MATE2-K vid kliniskt relevanta koncentrationer. Akalabrutinib hämmar eventuellt BCRP i tarmen medan ACP-5862 eventuellt hämmar MATE1 vid kliniskt relevanta koncentrationer (se avsnitt Interaktioner). Akalabrutinib hämmar inte MATE1, och ACP-5862 hämmar inte BCRP vid kliniskt relevanta koncentrationer.
Eliminering
Efter en oral singeldos på 100 mg akalabrutinib var den terminala halveringstiden (t1/2) för akalabrutinib 1 till 2 timmar. T1/2 för den aktiva metaboliten, ACP-5862, var omkring 7 timmar.
Genomsnittlig skenbar oral clearance (CL/F) var 134 l/timme för akalabrutinib och 22 l/timme för ACP-5862 hos patienter med B-cellmaligniteter.
Efter administrering av en singeldos av 100 mg radiomärkt [14C]-akalabrutinib i friska försökspersoner återfanns 84 % av dosen i feces och 12 % av dosen återfanns i urinen, med mindre än 2 % av dosen utsöndrad som oförändrad akalabrutinib.
Särskilda patientgrupper
Baserat på PK-analys av populationen hade ålder (> 18 år), kön, ras (kaukasier, afroamerikaner) och kroppsvikt inte någon kliniskt relevant effekt på PK för akalabrutinib och dess aktiva metabolit ACP-5862.
Pediatrisk population
Inga farmakokinetiska studier har utförts med Calquence på patienter under 18 års ålder.
Nedsatt njurfunktion
Akalabrutinib genomgår minimal eliminering via njurarna. En farmakokinetisk studie på patienter med nedsatt njurfunktion har inte utförts.
Baserat på PK-analys av populationen observerades inga kliniskt relevanta skillnader i PK mellan 408 försökspersoner med lätt nedsatt njurfunktion (eGFR mellan 60 och 89 ml/min/1,73m2 enligt MDRD-uppskattning) och 109 försökspersoner med måttligt nedsatt njurfunktion (eGFR mellan 30 och 59 ml/min/1,73m2) jämfört med 192 försökspersoner med normal njurfunktion (eGFR större än eller lika med 90 ml/min/1,73m2). Farmkakokinetiken för akalabrutinib har inte karakteriserats hos patienter med gravt nedsatt njurfunktion (eGFR mindre än 29 ml/min/1,73m2) eller nedsatt njurfunktion som kräver dialys. Patienter med kreatininnivåer högre än 2,5 gånger institutionellt ULN inkluderades inte i de kliniska studierna (se avsnitt Dosering och administreringssätt).
Nedsatt leverfunktion
Akalabrutinib metaboliseras i levern. I riktade studier på patienter med nedsatt leverfunktion ökade exponeringen för akalabrutinib (AUC) med 1,9 gånger, 1,5 gånger respektive 5,3 gånger hos patienter med lätt (N = 6) (Child-Pugh A), måttligt (N = 6) (Child-Pugh B) respektive gravt nedsatt leverfunktion (N = 8) (Child-Pugh C), jämfört med försökspersoner med normal leverfunktion (N = 6). Försökspersoner med måttligt nedsatt leverfunktion var dock inte signifikant påverkade avseende markörer som är relevanta för elimineringskapacitet av läkemedel, och effekten av måttligt nedsatt njurfunktion var därmed sannolikt underskattad i denna studie. Baserat på PK-analys av populationen observerades inga kliniskt relevanta skillnader mellan patienter med lätt (N = 79) eller måttligt (N = 6) nedsatt leverfunktion (totalt bilirubin mellan 1,5 och 3 gånger ULN och alla AST-värden) jämfört med försökspersoner med normal (N = 613) leverfunktion (totalt bilirubin och AST inom ULN) (se avsnitt Dosering och administreringssätt).
Prekliniska säkerhetsuppgifter
Karcinogenicitet
Karcinogenicitetsstudier har inte utförts med akalabrutinib.
Gentoxicitet/mutagenicitet/fototoxicitet
Akalabrutinib var inte mutagent i en bakteriell omvänd mutationsanalys, i en in vitro-analys avseende kromosomavvikelser eller i en in vivo-benmärgsmikronukleusanalys på möss.
Baserat på fototoxisk analys med 3T3-cellinje in vitro anses akalabrutinib ha en låg risk för fototoxicitet hos människor.
Toxicitet vid upprepad dosering
Mikroskopiska fynd av minimal till mild svårighetsgrad observerades i pankreas (blödning/pigment/inflammation/fibros i cellöarna) vid alla dosnivåer i råtta. Icke-skadliga fynd av minimal till mild svårighetsgrad i njurarna (tubulär basofil, tubulär regenerering och inflammation) observerades i studier på råtta med varaktighet i upp till 6 månader med en No Observed Adverse Effect level (NOAEL) på 30 mg/kg/dag hos råttor. Genomsnittlig exponering (AUC) vid NOAEL i han- och honråttor mostvarade 0,6x respektive 1x klinisk exponering vid den rekommenderade dosen på 100 mg två gånger dagligen. Lägsta Adverse Observed Effect Level (LOAEL) vid vilken reversibla fynd i njure (måttlig tubulär regenerering) och lever (individuell hepatocytnekros) observerades i den kroniska råttstudien var 100 mg/kg/dag och gav en exponeringsmarginal som var 4,2 gånger högre än den kliniska exponeringen vid rekommendrad dos på 100 mg två gånger dagligen. I 9‑månadersstudier på hund var NOAEL 10 mg/kg/dag motsvarande en exponering på 3 gånger den kliniska AUC vid den rekommenderade kliniska dosen. Minimal tubulär nedbrytning i njurarna, något minskad vikt på mjälten och övergående minimal till lätt minskning av röd blodkroppsmassa och ökningar av ALT och ALP observerades vid 30 mg/kg/dag (9 gånger den kliniska AUC) hos hundar. Hjärttoxicitet hos råttor (hjärtblödning, inflammation, nekros) och hundar (perivaskulär/vaskulär inflammation) observerades endast hos djur som dog under studierna vid doser över maixmal tolererad dos (MTD). Exponeringarna hos råttor och hundar med hjärtfynd var minst 6,8 respektive 25 gånger den kliniska AUC. Reversibilitet av hjärtfynden kunde inte utvärderas eftersom dessa fynd endast observerades vid doser högre än MTD.
Reproduktionstoxikologiska effekter
Inga effekter på fertilitet observerades hos han- eller honråttor vid exponering 10 respektive 9 gånger den kliniska AUC vid den rekommenderade dosen.
Inga effekter på embryo-fetal utveckling och överlevnad observerades hos dräktiga råttor vid exponeringar ungefär 9 gånger AUC hos patienter vid den rekommenderade dosen på 100 mg två gånger dagligen. I två reproduktionsstudier på råtta observerades dystoci (långdragen/svår förlossning) vid exponeringar > 2,3 gånger den kliniska exponeringen vid 100 mg två gånger dagligen. Förekomst av akalabrutinib och dess aktiva metabolit bekräftades i plasma hos råttfoster. Akalabrutinib och dess aktiva metabolit förekom i mjölk från digivande råttor.
I en embryo-fetal studie på dräktiga kaniner observerades minskad fostervikt och försenad benbildning vid exponeringsnivåer som gav toxicitet hos modern som var 2,4 gånger högre än AUC hos människa vid den rekommenderade dosen.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Kapselinnehåll
Mikrokristallin cellulosa
Kiseldioxid, kolloidal, vattenfri
Delvis pregelatiniserad majsstärkelse
Magnesiumstearat (E470b)
Natriumstärkelseglykolat
Kapselhölje
Gelatin
Titandioxid (E171)
Gul järnoxid (E172)
Indigokarmin (E132)
Tryckfärg
Shellack
Svart järnoxid (E172)
Propylenglykol (E1520)
Ammoniumhydroxid
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
CALQUENCE kapseli, kova
100 mg (L:ei) 60 fol (6001,29 €)
PF-selosteen tieto
Aluminium/aluminiumblister med sol/månsymboler innehållande 6 eller 8 hårda kapslar. Kartonger med 56 eller 60 kapslar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Gul underdel, blå överdel, storlek 1 (20 mm) hård kapsel, märkt med “ACA 100 mg” i svart bläck.
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
CALQUENCE kapseli, kova
100 mg 60 fol
- Ylempi erityiskorvaus (100 %). Akalabrutinibi: Kroonisen lymfaattisen leukemian hoito erityisin edellytyksin (1532).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Akalabrutinibi: Aikuisten kroonisen lymfaattisen leukemian hoito erityisin edellytyksin (3059).
Atc-kod
L01EL02
Datum för översyn av produktresumén
28.07.2025
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
