SUBUTEX injektionsvätska, depotlösning 100 mg, 300 mg
Kvalitativ och kvantitativ sammansättning
100 mg injektionsvätska, depotlösning
En förfylld spruta (0,5 ml) innehåller 100 mg buprenorfin.
300 mg injektionsvätska, depotlösning
En förfylld spruta (1,5 ml) innehåller 300 mg buprenorfin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, depotlösning.
Kliniska uppgifter
Terapeutiska indikationer
Substitutionsbehandling för vuxna vid opioidberoende, inom ramen för medicinsk, social och psykologisk behandling.
Användningsbegränsning: Läkemedlet får användas endast i enlighet med det som anges i Social- och hälsovårdsministeriets förordning om ”avgiftning och substitutionsbehandling av opioidberoende personer med vissa läkemedel” och vid sådana enheter inom hälso- och sjukvården där läkemedlet administreras till patienten av hälso- och sjukvårdspersonal. Läkemedlet får inte ordineras för expediering till patienten på apotek.
Subutex depotlösning för injektion är avsedd för vuxna (i åldern 18 år eller äldre) som har samtyckt till behandling mot opioidberoende.
Villkor
Valmistetta voi käyttää vain sosiaali- ja terveysministeriön asetuksen opioidiriippuvuuden vieroitus- ja korvaushoidosta eräillä lääkkeillä mukaisesti ja niissä terveydenhuollon yksiköissä, joissa lääke luovutetaan käyttöön valvotusti tai yksiköissä, joissa lääkkeen annostelee potilaalle terveydenhuollon henkilökunta. Valmistetta ei saa toimittaa apteekista potilaalle.
Dosering och administreringssätt
- Behandling ska ordineras av läkare, som ser till att den opioidberoende patienten får en allsidig behandling.
- Endast hälso- och sjukvårdspersonal får administrera Subutex depotlösning för injektion. Patienterna får inte ta med sig preparatet hem eller administrera det själva.
Subutex depotlösning för injektion är en lösning som innehåller en poly(DL-laktid-coglykolid)polymer som bildar en fast depå innehållande buprenorfin i kroppen. Buprenorfin frisätts långsamt från denna läkemedelsdepå genom diffusion och biologisk nedbrytning av polymeren.
Dosering
Induktionsbehandling
Patienterna ska först genomgå induktionsbehandling, och deras tillstånd ska stabiliseras med ett sublingualt preparat innehållande buprenorfin som ges i minst 7 dagar (se även avsnitt Farmakodynamiska egenskaper).
Induktionsbehandling och dosering av buprenorfininnehållande preparat ska baseras på anvisningarna i respektive produktinformation.
Initiering av behandling och underhållsbehandling:
Den rekommenderade dosen efter induktionsbehandling är 300 mg under de två första månaderna, med 4 veckors mellanrum, följt av en underhållsdos om 100 mg en gång i månaden.
En dos om 300 mg kan övervägas för patienter som tolererar dosen 100 mg per månad, men som inte får tillräcklig klinisk respons med utgångspunkt från självrapporterad användning av illegala opioder eller positiv opioidscreening i urin. Maxdosen är 300 mg per månad.
Övergång från stabil långtidsbehandling med sublingualt buprenorfin till depotinjektion:
Patienter som har fått stabil långtidsbehandling med sublingualt buprenorfin och vars sjukdomssymtom är under kontroll kan övergå direkt till behandling med Subutex depotlösning för injektion (se tabell 1).
Vid steady-state ligger de koncentrationer av buprenorfin i plasma som uppnås med underhållsdosen 100 mg inom det intervall som erhålls med sublingual behandling. De maximala koncentrationerna kan dock vara lägre medan medel- och dalkoncentrationerna kan vara högre (se figur 1 i avsnitt Farmakokinetiska egenskaper). Dessa koncentrationer måste beaktas när en patient som fått stabil långtidsbehandling med sublingualt buprenorfin övergår till behandling med Subutex depotlösning för injektion.
Tabell 1. Behandlingsövergång för patienter som får stabil långtidsbehandling med sublingualt buprenorfin, när sjukdomssymtomen är under kontroll
Dos av sublingualt buprenorfin | Subutex depotlösning för injektion | ||
1:a injektionen | 2:a injektionen | Underhållsdos | |
8–18 mg/dygn | 300 mg | 100 mg* | 100 mg |
20–24 mg/dygn | 300 mg | 300 mg | 100 mg |
*Om patienten fortfarande uppvisar opioidbegär eller abstinenssymtom efter den första dosen om 300 mg kan en dos om 300 mg övervägas även vid den andra injektionen. | |||
Doseringsintervall:
På grund av den långa halveringstiden administreras Subutex depotlösning för injektion en gång i månaden. Dosintervallet bör vara minst 26 dygn.
Tillägg av extra doser buprenorfin under behandlingens initialfas:
I de flesta fall behöver patienterna inga extra buprenorfindoser i initialfasen under behandling med Subutex depotlösning för injektion, men tillägg av sublingualt buprenorfin i doser om högst 8 mg/dygn kan dock förskrivas för en kortare tid vid behov.
Missade doser:
En patient som missar en dos ska få nästa dos så snart som möjligt. Oundvikliga enstaka förseningar i administreringen på upp till 2 veckor förväntas inte ha någon kliniskt betydelsefull inverkan på behandlingseffekten.
Utsättning av behandling:
Eftersom opioidberoende är av kronisk natur ska behovet av fortsatt läkemedelsbehandling bedömas på nytt med jämna mellanrum och patientens kliniska status ska då beaktas. Det finns ingen rekommenderad maximal tid för underhållsbehandling.
Om behandlingen med Subutex depotlösning för injektion sätts ut ska preparatets depotegenskaper beaktas (se avsnitt Farmakokinetiska egenskaper). Patienten ska övervakas i flera månader med avseende på abstinenssymtom. När steady-state har uppnåtts kan patienter som slutar med behandlingen ha detekterbara nivåer av buprenorfin i plasma och urin i tolv månader efteråt eller längre.
Särskilda patientgrupper
Äldre patienter
Säkerhet och effekt för buprenorfin för patienter i åldern 65 år eller äldre har inte fastställts. Med tanke på eventuell nedsättning av lever-, njur- eller hjärtfunktion, andra samtidiga sjukdomar eller annan läkemedelsbehandling hos äldre patienter, ska beslutet att förskriva Subutex depotlösning för injektion fattas med försiktighet till personer som är 65 år eller äldre. Dessa patienter ska övervakas med avseende på tecken och symtom på toxicitet eller överdosering.
Patienter med nedsatt leverfunktion
Buprenorfinkoncentrationerna i plasma är högre hos patienter med medelsvår leverfunktionsnedsättning jämfört med hos friska personer. Subutex depotlösning för injektion ska användas med försiktighet hos patienter med medelsvår leverfunktionsnedsättning (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper). Patienterna ska övervakas med avseende på tecken och symtom på toxicitet eller överdos orsakad av en ökad buprenorfinkoncentration (se avsnitt Varningar och försiktighet). Användning av Subutex depotlösning för injektion är kontraindicerad hos patienter med svår leverfunktionsnedsättning (se avsnitt Kontraindikationer).
Patienter med nedsatt njurfunktion
Buprenorfindosen behöver inte justeras för patienter med nedsatt njurfunktion. Försiktighet rekommenderas när läkemedlet ges till patienter med svår njurfunktionsnedsättning (kreatininclearance < 30 ml/min) (se avsnitten Varningar och försiktighet och Farmakokinetiska egenskaper).
Pediatrisk population
Inga data finns tillgängliga om barn och ungdomar under 18 år. Därför ska Subutex depotlösning för injektion inte användas av barn och ungdomar.
Administreringssätt
Endast för subkutan användning i bukområdet.
Subutex depotlösning för injektion får inte administreras intravaskulärt, intramuskulärt eller i huden (se avsnitt Varningar och försiktighet).
Läkemedlet får endast administreras av hälso- och sjukvårdspersonal (läkare eller sjuksköterska).
För att undvika irritation bör ett nytt injektionsställe väljas vid varje administrering så att alla fyra bukkvadranter används, under förutsättning att det finns tillräckligt med subkutan vävnad. Injektionen får endast ges med den spruta och säkerhetskanyl som medföljer läkemedlet.
Läkemedelsrester i kanylen och sprutan ska kasseras på korrekt sätt enligt gällande anvisningar.
Detaljerade, stegvisa instruktioner om beredning och administrering av Subutex depotlösning för injektion finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering samt i bipacksedeln under rubriken FÖLJANDE UPPGIFTER ÄR AVSEDDA FÖR HÄLSO- OCH SJUKVÅRDSPERSONAL.
Avlägsnande av läkemedelsdepån
Om läkemedelsdepån måste avlägsnas kan detta ske kirurgiskt under lokalbedövning. På grund av den förväntade nedbrytningshastigheten för polymeren görs detta enklast inom cirka 14 dagar efter injektionen. Endast den senast injicerade läkemedelsdepån kan avlägsnas.
Den borttagna läkemedelsdepån innehåller buprenorfin, som är ett narkotikaklassat läkemedel och ska kasseras enligt gällande anvisningar. Patienter som har fått en läkemedelsdepå avlägsnad ska övervakas med avseende på abstinenssymtom (se avsnitt Varningar och försiktighet).
Kontraindikationer
- Överkänslighet mot buprenorfin eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
- Svår respiratorisk insufficiens
- Svår leverfunktionsnedsättning
- Alkohol berusning eller delirium tremens.
Varningar och försiktighet
Informera patienterna om vikten av att instruera sina närstående om att de i en nödsituation måste informera behandlande sjukvårdspersonal om att patienten har ett fysiskt beroende av opioider och får behandling med ett långverkande Subutex-preparat. Denna anvisning gäller tills det har gått 6 månader efter att patienten avslutade användningen av Subutex depotlösning för injektion.
Felaktig administrering
Subutex depotlösning för injektion får inte administreras intravaskulärt, intramuskulärt eller i huden. Intravaskulär injektion medför en betydande risk för allvarlig skada eller död eftersom Subutex depotlösning för injektion bildar en fast massa vid kontakt med kroppsvätskor.
Intravaskulär injektion kan leda till ocklusion, lokal vävnadsskada och tromboemboliska händelser, t.ex. livshotande lungemboli.
Oavsiktlig intramuskulär injektion eller injektion i huden kan öka sannolikheten för allvarliga reaktioner vid injektionsstället. Det finns rapporter efter marknadsintroduktion om fall där reaktioner vid injektionsstället har inkluderat bölder, sår och nekros. I vissa av fallen har det varit tvunget att kirurgiskt avlägsna produkten med depotlösning, rengöra injektionsstället, ge patienten antibiotika och avbryta injektionsbehandlingen med Subutex depotlösning. Allvarliga reaktioner vid injektionsstället ska bedömas och behandlas på lämpligt sätt. Korrekt injektionsteknik ska användas (se bipacksedeln, avsnitt INFORMATION FÖR SJUKVÅRDSPERSONAL).
Missbruk
Liksom andra opioider kan även buprenorfin missbrukas. Några av riskerna med missbruk är överdosering, spridning av blodburna virusinfektioner, lokala infektioner, andningsdepression och leverskador. Intravaskulär användning av detta läkemedel är även livshotande på grund av risken för kärlocklusion. Om någon annan än patienten som behandlingen är avsedd för använder buprenorfin, medför detta ytterligare en risk i form av ett ökat antal personer som är beroende av buprenorfin. Detta kan bli följden om läkemedlet överlåts för olagligt bruk eller om läkemedlet inte skyddas mot stöld.
Det finns en risk för att patienter som får för lite buprenorfin kan fortsätta att självmedicinera mot okontrollerade abstinenssymtom med illegala opioider, alkohol eller andra sedativa, såsom bensodiazepiner (se ”Andningsdepression” samt avsnitt Interaktioner).
Kliniska kontroller av eventuella skador vid injektionsstället eller tecken på att patienten har försökt avlägsna läkemedelsdepån ska utföras under hela behandlingen.
Smärtlindring
Det kan uppstå situationer när en patient som behandlas med Subutex depotlösning för injektion behöver akut smärtlindring eller anestesi (inklusive regional anestesi). Patienter som får Subutex depotlösning för injektion ska i första hand behandlas med smärtlindrande medel som inte innehåller opioider. Patienter som måste behandlas med opioider för smärtlindring kan behandlas med en fullständig opioidagonist med hög affinitet. Behandlingen ska genomföras under överinseende av sjukvårdspersonal, med särskild uppmärksamhet riktad mot andningsfunktionen. På grund av tolerans kan högre opioiddoser än normalt behövas för att uppnå analgesi. Om opioidbehandling används som en del av anestesi ska det finnas beredskap för att hantera opioidinducerad andningsdepression, i synnerhet för att säkerställa och upprätthålla fria luftvägar samt ge andningsstöd och ventilationsbehandling (se avsnitt Interaktioner).
Sannolikheten för lyckad behandling av patienter som behöver smärtlindring och behandling mot opioidberoende inom öppenvården är störst om ett multidisciplinärt team ansvarar för denna. Detta team ska omfatta specialister inom såväl smärtbehandling som behandling av opioidberoende.
Andningsstörningar under sömn
Opioider kan orsaka andningsstörningar under sömn, inklusive central sömnapné och hypoxi. Opioidanvändning ökar risken för central sömnapné på ett dosberoende sätt. Om en patient har central sömnapné bör en minskning av den totala dosen av opioider övervägas.
Andningsdepression
Dödsfall på grund av andningsdepression har rapporterats, särskilt när buprenorfin använts i kombination med bensodiazepiner eller när buprenorfin inte använts i enlighet med ordinationen. Dödsfall har även rapporterats vid samtidig användning av buprenorfin och andra dämpande substanser som alkohol, gabapentinoider (t.ex. pregabalin och gabapentin) eller andra opioider (se avsnitt Interaktioner). Buprenorfin kan orsaka svår, eventuellt dödlig, andningsdepression om det ges till barn eller används av en icke-opioidberoende person som inte har utvecklat tolerans mot opioideffekter.
Buprenorfin ska ges med försiktighet till patienter med respiratorisk insufficiens (t.ex. kronisk obstruktiv lungsjukdom, astma, cor pulmonale, nedsatt andningskapacitet, hypoxi, hyperkapni, befintlig andningsdepression eller kyfoskolios).
CNS-depression
Buprenorfin kan orsaka somnolens, särskilt om det kombineras med alkohol eller andra CNS-dämpande substanser (t.ex. bensodiazepiner, gabapentinoider, lugnande medel, sedativa eller hypnotika) (se avsnitt Interaktioner).
Beroende (abstinenssymtom)
Buprenorfin är en partiell agonist till my-opioidreceptorer. Långtidsanvändning av detta läkemedel ger opioidberoende. Djurstudier och klinisk erfarenhet har visat att buprenorfin kan leda till beroende, men dock i mindre grad än fullständiga agonister (t.ex. morfin).
Inga abstinenssymtom observerades under månaden efter utsättning av Subutex depotlösning för injektion. På grund av den långa halveringstiden förväntas eventuella abstinenssymtom uppträda med fördröjning.
Patienter som avslutar behandlingen med Subutex depotlösning för injektion ska följas upp under flera månader med avseende på abstinenssymtom och vid behov ges lämplig behandling.
Framkallande av opioidabstinenssyndrom
Eftersom buprenorfin är en partiell opioidagonist kan det framkalla symtom på opioidabstinens hos personer som har ett fysiskt beroende av fullständiga opioidagonister som heroin, morfin eller metadon. Kontrollera att patienten tolererar sublingualt buprenorfin och att dosen justerats till en lämplig nivå innan Subutex depotlösning för injektion injiceras subkutant. För att undvika att abstinenssymtom framkallas ska induktionsbehandling med sublingualt buprenorfin inledas först när lindriga eller medelsvåra abstinenssymtom kan iakttas objektivt.
Förlängning av QT-tiden
Försiktighet ska iakttas när buprenorfin används samtidigt med andra läkemedel som kan förlänga QT-tiden, samt hos patienter med förlängd QT-tid i anamnesen eller andra riskfaktorer för QT-förlängning.
Hepatit och leverpåverkan
Fall av akut leverskada har rapporterats hos opioidberoende patienter efter användning av sublinguala buprenorfinpreparat såväl i kliniska studier som i samband med klinisk användning. Spektrumet av avvikelser sträcker sig från övergående asymtomatiska förhöjningar av levertransaminasvärden till rapporter om cytolytisk hepatit, nedsatt leverfunktion, levernekros, hepatorenalt syndrom, hepatisk encefalopati och dödsfall. I många fall kan andra faktorer ha en bidragande roll, t.ex. redan befintliga avvikelser i leverenzymvärden, genetisk sjukdom, infektion med hepatit B- eller hepatit C-virus, alkoholism, anorexi, samtidig användning av andra potentiellt levertoxiska ämnen eller pågående injektionsmissbruk av droger. Dessa underliggande faktorer måste beaktas innan Subutex depotlösning för injektion ordineras och även under behandlingen. Levervärdena ska undersökas när behandlingen inleds, och om de stiger under behandlingen ska de kontrolleras regelbundet. Om leverskada misstänks ska en etiologisk utredning av skadan göras. Beroende på fynden kan behandlingen med Subutex depotlösning för injektion behöva avbrytas. I samband med avbrytandet ska risken för abstinenssymtom och återfall i användning av illegala droger beaktas. Om behandlingen fortsätter ska leverfunktionen följas noga.
Nedsatt leverfunktion
Effekten av nedsatt leverfunktion på farmakokinetiken för Subutex depotlösning för injektion har inte undersökts.
Effekten av nedsatt leverfunktion på farmakokinetiken för sublingualt buprenorfin har undersökts i en klinisk studie. Eftersom buprenorfin i stor utsträckning metaboliseras i levern, ökade koncentrationerna av buprenorfin i plasma hos patienter med medelsvår till svår leverfunktionsnedsättning jämfört med hos friska studiedeltagare (se avsnitt Farmakokinetiska egenskaper). Subutex depotlösning för injektion ska användas med försiktighet hos patienter med befintlig medelsvår leverfunktionsnedsättning, eftersom koncentrationerna av buprenorfin inte kan minskas snabbt.
Patienter med medelsvår leverfunktionsnedsättning eller som utvecklar en medelsvår leverfunktionsnedsättning medan de behandlas med Subutex depotlösning för injektion ska övervakas i flera månader med avseende på tecken och symtom på toxicitet eller överdos orsakad av en ökad buprenorfinkoncentration. Leverfunktionen måste kontrolleras med jämna mellanrum under behandlingen (se avsnitt Dosering och administreringssätt och Farmakokinetiska egenskaper). Användning av Subutex depotlösning för injektion är kontraindicerad hos patienter med svår leverfunktionsnedsättning (se avsnitt Kontraindikationer).
Nedsatt njurfunktion
Den renala elimineringen utgör en relativt liten andel (cirka 30 %) av total clearance av buprenorfin och dess metaboliter. Därför krävs ingen dosjustering baserat på njurfunktionen. Buprenorfinets metaboliter ackumuleras hos patienter med nedsatt njurfunktion. Försiktighet rekommenderas när läkemedlet ges till patienter med svår njurfunktionsnedsättning (kreatininclearance < 30 ml/min) (se avsnitt Dosering och administreringssätt och Farmakokinetiska egenskaper).
Kliniska studier av Subutex depotlösning för injektion omfattade inte personer med nedsatt njurfunktion.
Serotonergt syndrom
Samtidig användning av Subutex depotlösning för injektion och andra serotonerga läkemedel såsom MAO-hämmare, selektiva serotoninåterupptagshämmare (SSRI-läkemedel), serotonin- och noradrenalinåterupptagshämmare (SNRI-läkemedel) eller tricykliska antidepressiva läkemedel kan leda till serotonergt syndrom, som är ett potentiellt livshotande tillstånd (se avsnitt Interaktioner).
Om samtidig behandling med andra serotonerga läkemedel är kliniskt motiverad rekommenderas noggrann observation av patienten, särskilt vid behandlingsstart och vid dosökningar.
Symtom på serotonergt syndrom kan vara förändrad mental status, instabilitet i autonoma nervsystemet, neuromuskulära avvikelser och/eller gastrointestinala symtom.
Om serotonergt syndrom misstänks ska dosminskning eller avbrytande av behandlingen övervägas, beroende på symtomens svårighetsgrad.
Allmänna varningar angående behandling med opioider
Opioider kan orsaka ortostatisk hypotoni (se avsnitt Biverkningar).
Opioider kan öka det intrakraniella trycket, vilket kan leda till krampanfall. Opioider ska därför användas med försiktighet hos patienter med huvudskador, intrakraniella lesioner eller andra tillstånd som orsakar förhöjning av likvortrycket samt hos patienter med krampanfall i anamnesen.
Opioider ska användas med försiktighet hos patienter med hypotoni, prostatahypertrofi eller urinrörsförträngning.
Opioidinducerad mios, förändringar i medvetandegraden eller förändringar i smärtförnimmelsen orsakad av en annan sjukdom kan försvåra bedömningen av patientens status eller komplicera diagnostiseringen och uppföljningen av det kliniska förloppet av en samtidig sjukdom.
Opioider ska användas med försiktighet hos patienter med myxödem, hypotyreos eller binjurebarkssvikt (t.ex. Addisons sjukdom).
Opioider har visat sig öka trycket i koledokus och ska användas med försiktighet hos patienter med funktionsstörningar i gallgångarna.
Opioider ska ges med försiktighet till äldre eller patienter med nedsatt allmäntillstånd.
Interaktioner
Inga interaktionsstudier har utförts med Subutex depotlösning för injektion.
Subutex depotlösning för injektion ska användas med försiktighet tillsammans med:
-
Bensodiazepiner: Denna kombination ökar risken för andningsdepression, djup sedering, koma och död. Patienterna måste därför övervakas noga och kombinationen ska undvikas om det finns risk för missbruk. Patienterna ska varnas för att det är extremt farligt att använda bensodiazepiner samtidigt som de använder detta preparat. Patienter som använder bensodiazepiner samtidigt med detta preparat på ordination av läkare ska också uppmanas att använda dem endast i enlighet med ordinationen (se avsnitt Varningar och försiktighet).
-
Gabapentinoider (bl.a. pregabalin och gabapentin): Samtidig användning ökar risken för dödsfall på grund av andningsdepression. Doseringen ska därför övervakas noga, och denna kombination måste undvikas om det finns risk för missbruk. Patienterna ska varnas för att det är extremt farligt att använda gabapentinoider samtidigt som de använder detta preparat. Patienter som använder gabapentinoider samtidigt med detta preparat på ordination av läkare ska också uppmanas att använda dem endast i enlighet med ordinationen (se avsnitt Varningar och försiktighet).
-
Andra CNS-dämpande läkemedel: andra opioidderivat (t.ex. metadon, analgetika och hostdämpande läkemedel), vissa antidepressiva läkemedel, sederande H1-receptorantagonister, barbiturater, anxiolytika av annan typ än bensodiazepiner, psykosläkemedel samt klonidin och liknande substanser. Dessa kombinationer förstärker den CNS-dämpande effekten (se avsnitt Varningar och försiktighet).
-
Serotonerga läkemedel såsom MAO-hämmare, selektiva serotoninåterupptagshämmare (SSRI-läkemedel), serotonin- och noradrenalinåterupptagshämmare (SNRI-läkemedel) eller tricykliska antidepressiva läkemedel, eftersom samtidig användning av dessa läkemedel ökar risken för serotonergt syndrom, ett potentiellt livshotande tillstånd (se avsnitt Varningar och försiktighet).
-
Subutex depotlösning för injektion får inte tas tillsammans med alkoholhaltiga drycker eller läkemedel som innehåller alkohol. Alkohol förstärker den sederande effekten av buprenorfin och ökar risken för andningsdepression, djup sedering, koma och död.
-
Opioidanalgetika: Smärta hos patienter som får substitutionsbehandling ska i första hand behandlas med smärtlindrande medel som inte innehåller opioider. Det kan vara svårt att uppnå adekvat analgesi med en fullständig opioidagonist om patienten får buprenorfin. Högre doser kan då behövas, vilket i sin tur medför en risk för opioidöverdosering (se avsnitt Varningar och försiktighet).
-
Naltrexon, nalmefen och andra opioidantagonister: Eftersom buprenorfin är en partiell my-opioidagonist kan samtidigt administrerade opioidantagonister såsom naltrexon och nalmefen försvaga eller helt blockera effekterna av Subutex depotlösning för injektion. Hos patienter som får underhållsbehandling med Subutex depotlösning för injektion kan plötsliga utbrott av långvariga och intensiva symtom på opioidabstinens förekomma.
-
Monoaminoxidashämmare (MAO-hämmare): kan förstärka effekten av opioider.
-
CYP3A4-hämmare: Effekterna av samtidigt administrerade CYP3A4-hämmare på buprenorfinexponeringen hos patienter som får behandling med Subutex depotlösning för injektion har inte studerats, och effekterna kan bero på administreringsvägen.
I en interaktionsstudie med sublingualt buprenorfin och ketokonazol (en potent CYP3A4-hämmare) ökade Cmax och AUC för buprenorfin med cirka 50 % respektive 70 %. Motsvarande värden för metaboliten norbuprenorfin ökade i mindre grad. Subutex depotlösning för injektion genomgår inte förstapassagemetabolism och därför förväntas CYP3A4-hämmare (t.ex. proteashämmare som ritonavir, nelfinavir och indinavir; azolfungicider som ketokonazol, flukonazol och itrakonazol; makrolidantibiotika eller grapejuice) ha mindre effekt på buprenorfinmetabolismen när de administreras tillsammans med Subutex depotlösning för injektion än när de administreras tillsammans med sublingualt buprenorfin. Vid byte från sublingualt buprenorfin till Subutex depotlösning för injektion kan patienter som får kontinuerlig behandling med CYP3A4-hämmare behöva övervakas för att säkerställa att buprenorfinnivåerna i plasma är adekvata. Patienter som redan får behandling med Subutex depotlösning för injektion och påbörjar behandling med CYP3A4-hämmare ska övervakas med avseende på tecken och symtom på överdosering. Motsatt krävs övervakning med avseende på abstinenssymtom hos patienter som samtidigt får behandling med Subutex depotlösning för injektion och en CYP3A4-hämmare och slutar ta CYP3A4-hämmaren.
- CYP3A4-inducerare: Effekterna av samtidigt administrerade CYP3A4-inducerare på buprenorfinexponeringen hos patienter som får behandling med Subutex depotlösning för injektion har inte studerats. CYP3A4-inducerare kan öka buprenorfinmetabolismen, vilket leder till minskade koncentrationer av buprenorfin. Eftersom Subutex depotlösning för injektion inte genomgår förstapassagemetabolism förväntas CYP3A4-inducerare (t.ex. fenobarbital, karbamazepin, fenytoin eller rifampicin) ha mindre effekt på buprenorfinmetabolismen när de administreras tillsammans med Subutex depotlösning för injektion jämfört med när de administreras tillsammans med sublingualt buprenorfin. Vid byte från sublingualt buprenorfin till Subutex depotlösning för injektion ska patienter som får kontinuerlig behandling med CYP3A4-inducerare övervakas för att säkerställa att buprenorfinnivåerna i plasma är adekvata. Patienter som redan får behandling med Subutex depotlösning för injektion och påbörjar behandling med CYP3A4-inducerare ska övervakas med avseende på abstinenssymtom. Motsatt krävs övervakning med avseende på symtom på överdosering hos patienter som samtidigt får behandling med Subutex depotlösning för injektion och en CYP3A4-inducerare och slutar ta CYP3A4-induceraren.
Fertilitet, graviditet och amning
Fertilitet
I reproduktionstoxikologiska studier på råttor och kaniner konstaterades inga skadliga effekter på parning eller fertilitet med Subutex depotlösning för injektion.
Graviditet
Inga studier på gravida kvinnor har utförts med Subutex depotlösning för injektion. Höga doser orsakade ökad förekomst av postimplantationsförluster, embryoresorption och tidig fosterdöd i djurstudier (se avsnitt Prekliniska säkerhetsuppgifter).
Buprenorfin får användas under graviditet endast om den potentiella nyttan överväger de potentiella riskerna för fostret.
Buprenorfin passerar enkelt placenta och kan orsaka neonatal andningsdepression. Långvarig exponering för buprenorfin under graviditetens tre sista månader kan orsaka neonatalt abstinenssyndrom (t.ex. hypertoni, neonatal tremor, agitation, myoklonus eller konvulsioner). Syndromet uppträder i regel med fördröjning, och symtom observeras först flera timmar eller flera dagar efter födelsen.
Det nyfödda barnet ska övervakas under flera dagar på grund av buprenorfins långa halveringstid, så att eventuell andningsdepression eller neonatalt abstinenssyndrom kan undvikas.
Amning
Buprenorfin och dess metaboliter utsöndras i bröstmjölk.
Försiktighet rekommenderas om Subutex depotlösning för injektion ges till en ammande kvinna. Utvecklingsmässiga och hälsomässiga fördelar med amningen för barnet ska vägas mot moderns kliniska behov av Subutex depotlösning för injektion. Alla potentiella biverkningar som kan drabba spädbarnet till följd av läkemedelsbehandlingen eller moderns underliggande sjukdom ska beaktas.
Ammande kvinnor som använder buprenorfin ska uppmanas att övervaka barnet med avseende på ökad sömnighet och andningssvårigheter.
Effekter på förmågan att framföra fordon och använda maskiner
Buprenorfin har måttlig effekt på förmågan att framföra fordon och använda maskiner när det ges till opioidberoende patienter. Buprenorfin kan orsaka sömnighet och yrsel samt nedsatt kognitiv förmåga, särskilt i början av behandlingen och vid dosjustering. Om läkemedlet tas tillsammans med alkohol eller CNS-dämpande substanser är effekten sannolikt kraftigare (se avsnitt Varningar och försiktighet och Interaktioner). Patienterna ska uppmanas att undvika att köra bil eller använda farliga maskiner tills de är någorlunda säkra på att buprenorfinbehandlingen inte inverkar negativt på deras förmåga att utföra sådana aktiviteter.
Biverkningar
Sammanfattning av säkerhetsprofilen
De oftast rapporterade biverkningarna under de kliniska läkemedelsstudierna med sublingualt Subutex var relaterade till abstinenssymtom (t.ex. insomni, huvudvärk, illamående och hyperhidros) samt smärta. Biverkningsfrekvensen under de pivotala kliniska studierna med Subutex depotlösning för injektion överensstämde med de biverkningar som rapporterats med sublingualt Subutex, med undantag av reaktioner vid injektionsstället (t.ex. erytem, induration, smärta och pruritus).
Tabell över biverkningar
I tabell 2 sammanfattas följande:
- Biverkningar rapporterade i kliniska studier med sublingualt Subutex tillsammans med biverkningar som rapporterats i kliniska studier med Subutex depotlösning för injektion. Frekvenserna för de listade potentiella biverkningarna definieras enligt följande konvention: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
- De oftast rapporterade biverkningarna i uppföljningen efter godkännandet för försäljning av sublingualt Subutex. Händelser som nämnts i minst 1 % av rapporterna från hälso- och sjukvårdspersonal har inkluderats. Frekvensen för händelser som inte rapporterats i kliniska studier kan inte beräknas och anges som ”Ingen känd frekvens”.
Tabell 2: Biverkningar av buprenorfin observerade i kliniska studier och/eller i samband med uppföljning efter marknadsintroduktion, presenterade enligt organsystem
Organsystem | Mycket vanliga (≥ 1/10) | Vanliga (≥ 1/100, < 1/10) | Mindre vanliga (≥ 1/1 000, < 1/100) | Sällsynta (≥ 1/10 000, < 1/1 000) | Ingen känd frekvens |
Immunsystemet | Anafylaktisk chock | ||||
Infektioner och infestationer | Infektion Nasofaryngit* Övre luftvägsinfektion* | ||||
Metabolism och nutrition | Nedsatt aptit | ||||
Psykiska störningar | Ångest Depression Insomni | Hallucinationer | |||
Centrala och perifera nervsystemet | Yrsel Huvudvärk Letargi* Sedering* Somnolens Synkope | ||||
Hjärtat | Palpitationer | ||||
Blodkärl | Ortostatisk hypotoni | ||||
Andningsvägar, bröstkorg och mediastinum | Andningsdepression Bronkospasm | ||||
Magtarmkanalen | Buksmärta* Förstoppning Diarré Illamående Kräkningar | ||||
Hud och subkutan vävnad | Hyperhidros Pruritus* | Angioödem | |||
Allmänna symtom och/eller symtom vid administreringsstället | Asteni Abstinenssyndrom Trötthet* Erytem vid injektionsstället* Induration vid injektionsstället* Smärta vid injektionsstället* Klåda vid injektionsstället* | Blåmärke vid injektionsstället* Cellulit vid injektionsstället* Infektion vid injektionsstället* Svullnad/ödem vid injektionsstället* | Neonatalt abstinenssyndrom (se avsnitt Fertilitet, graviditet och amning) | ||
Lever och gallvägar | Levernekros Hepatit | ||||
Undersökningar | Förhöjda leverenzymvärden*† |
* Biverkningar observerade i kliniska studier med Subutex depotlösning för injektion.
† Termen förhöjda leverenzymvärden omfattar förhöjning av ALAT, ASAT och GGT samt alkaliskt fosfatas eller bilirubin. Inga fall av allvarlig läkemedelsinducerad leverskada konstaterades.
Beskrivning av utvalda biverkningar
De reaktioner vid injektionsstället som oftast rapporterades i de kliniska studierna med Subutex depotlösning för injektion var smärta, klåda, erytem och induration vid injektionsstället. Mindre vanliga reaktioner vid injektionsstället (< 1 %) som förekom hos fler än en studiedeltagare var svullnad, blåmärke, cellulit och infektion vid injektionsstället.
Två studiedeltagare fick läkemedelsdepån kirurgiskt avlägsnad under de kliniska studierna med Subutex depotlösning för injektion. Ingen av dessa fick någon komplikation efter borttagandet.
Nedan följer en sammanfattning av biverkningar som rapporterats i samband med användning av andra buprenorfininnehållande preparat efter godkännandet för försäljning och som bedömts vara allvarliga eller bör beaktas annan orsak:
- I samband med intravaskulärt missbruk har lokala, ibland septiska reaktioner (abscess, cellulit), samt potentiellt allvarlig akut hepatit och andra infektioner såsom pneumoni och endokardit rapporterats (se även avsnitt Varningar och försiktighet).
- Hos patienter med ett påtagligt drogberoende kan initialdosen av buprenorfin orsaka abstinenssymtom liknande de som förknippas med naloxon.
- Förhöjning av transaminasvärden, hepatit, akut hepatit, cytolytisk hepatit, ikterus, hepatorenalt syndrom, hepatisk encefalopati samt levernekros har förekommit (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom
Det viktigaste symtomet som kräver behandling vid överdosering är andningsdepression till följd av dämpning av centrala nervsystemet, vilket kan leda till andningsstillestånd och död. De första symtomen på akut överdosering kan också vara somnolens, mios, hypotension, illamående, kräkningar och talsvårigheter.
Behandling
Allmän behandling för upprätthållande av vitala funktioner, inklusive noggrann övervakning av patientens respiratoriska och kardiella status, ska sättas in. Om patienten uppvisar andningsdepression eller myokarddepression ska första prioritet vara att återställa andningen till en tillräcklig nivå genom att säkerställa öppna luftvägar samt assistera andningen eller sätta in ventilationsbehandling. Syrgasbehandling, intravenös hydrering, behandling med vasopressorer och andra stödåtgärder ska övervägas efter behov. Om patienten kräks måste åtgärder vidtas för att förhindra aspiration av kräkningen.
Användning av en opioidantagonist (t.ex. naloxon) rekommenderas, även om ett sådant medel inte är lika effektivt för att häva andningssymtom orsakade av buprenorfin, jämfört med förmågan att häva effekterna av fullständiga opioidagonister.
När det ska avgöras hur lång medicinsk övervakning och behandling som krävs för att häva effekterna av överdosering, ska den långa verkningstiden för buprenorfin och den långsamma frisättningen av Subutex depotlösning för injektion beaktas. Naloxon kan elimineras snabbare än buprenorfin, vilket kan leda till att tidigare kontrollerade symtom på överdos av buprenorfin återkommer.
Läkaren ska överväga hur buprenorfin, andra opioider och andra CNS-dämpande substanser eventuellt påverkar och bidrar till patientens kliniska status.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp
Medel vid opioidberoende, ATC-kod: N07BC01
Verkningsmekanism
Buprenorfin är en partiell agonist till my-opioidreceptorn och en antagonist till kappa-opioidreceptorn. Dess effekt vid underhållsbehandling av opioidberoende patienter bygger på den långsamt reversibla bindningen till my-opioidreceptorer, som under en längre tidsperiod kan minimera patienternas opioidbehov.
Klinisk effekt och säkerhet
Effekt och säkerhet för Subutex depotlösning för injektion vid behandling av opioidberoende undersöktes i en 24 veckor lång pivotal, randomiserad, dubbelblind, placebokontrollerad multicenterstudie i fas 3. I studien deltog 504 patienter som sökt vård och som hade ett medelsvårt till svårt opioidberoende. Före den första injektionen fick studiedeltagarna induktionsbehandling med en stabiliserad dos buprenorfin/naloxon (sublingual film) på 8/2–24/6 mg per dag i minst 7 dagar. Studiedeltagarna randomiserades till en av följande dosregimer: 300 mg en gång i månaden i 6 månader (300/300 mg; n = 201); 300 mg en gång i månaden i 2 månader följt av 100 mg en gång i månaden i 4 månader (300/100 mg; n = 203); eller subkutana volymmatchade placeboinjektioner en gång i månaden i 6 månader (n = 100). Alla patienter fick psykosocialt stöd minst en gång i veckan. Efter randomiseringen tilläts ingen tilläggsbehandling med sublingualt buprenorfin.
Effekt och säkerhet bedömdes vid besök på kliniken varje vecka. Avhållsamhet från opioidanvändning bedömdes med hjälp av urinscreening för opioider i kombination med egenrapportering om användning av illegala opioider. Saknade urinprover och/eller egenrapporter tolkades som positivt svar avseende användning av illegala opioider. Av de 504 studiedeltagarna slutförde 64 % (129/201) av deltagarna i 300/300 mg-gruppen och 62 % (125/203) av deltagarna i 300/100 mg-gruppen studien, jämfört med 34 % (34/100) av deltagarna i placebogruppen.
I studien nåddes den primära slutmätpunkten, som var bättre resultat än placebo vad gällde procentandelen patienter som avhållit sig från användning av opioider. Detta definierades som procentandelen negativa urinprover och egenrapporter om användning av illegala opioider för varje patient under veckorna 5–24 (tabell 3). Andelen patienter med framgångsrik behandling (definierat som studiedeltagare med ≥ 80 % opioidfria veckor) var statistiskt signifikant större i båda grupperna som fick Subutex depotlösning för injektion än i placebogruppen. Inga kliniskt betydelsefulla skillnader observerades i utfallet mellan de båda grupperna som fick aktivt läkemedel. Abstinenssymtom och opioidbegär dämpades under studien. Även undergruppsanalyser utfördes för den primära slutmätpunkten avseende effekt.
Tabell 3. Primära och centrala sekundära slutmätpunkter i en pivotal, randomiserad, dubbelblind, placebokontrollerad studie i fas 3 med patienter med medelsvårt till svårt opioidberoende
Subutex depotlösning för injektion300/100 mg (N = 194) | Subutex depotlösning för injektion 300/300 mg (N = 196) | Placebo (N = 99) | |
Avhållsamhet från opioidanvändning (opioidfria veckor; %) | |||
Median | 32,5 % | 30,0 % | 0,0 % |
Skillnad mellan medianvärden och placebogrupp (95 % konfidensintervall) | 27,5 % (15,0; 40,0 %) | 27,5 % (15,0 %; 40,0 %) | - |
p-värde | < 0,0001 | < 0,0001 | - |
Avhållsamhet från opioidanvändning ≥ 80 %(opioidfria veckor; responder) | |||
Framgångsrik behandling* | 28,4 % | 29,1 % | 2,0 % |
Skillnad mellan framgångsrik behandling och placebogrupp (95 % konfidensintervall) | 26,3 % (19,4 %; 33,3 %) | 27,1 % (20,1 %; 34,0 %) | - |
p-värde | < 0,0001 | < 0,0001 | - |
*Framgångsrik behandling definierades som att studiedeltagarens urinprover till ≥ 80 % var negativa avseende opioider och att studiedeltagarens egenrapporter till ≥ 80 % var negativa avseende användning av illegala opioider under veckorna 5–24. En ”respittid” beviljades för veckorna 1–4 för att kunna stabilisera patienternas behandling.
Långtidssäkerhet och -tolerabilitet för Subutex depotlösning för injektion undersöktes i en öppen multicenterstudie i fas 3 med patienter som sökt vård.
Till studien rekryterades 669 patienter med medelsvårt till svårt opioidberoende. Av studiedeltagarna hade 412 inte tidigare fått behandling med Subutex depotlösning för injektion. 257 deltagare fortsatte i denna studie efter att ha deltagit i den tidigare, 24 veckor långa effektstudien. Alla studiedeltagare fick först en dos om 300 mg Subutex depotlösning för injektion, följt av flexibla månadsdoser om 100 mg eller 300 mg tills totalt 12 injektioner (nya deltagare) respektive 6 injektioner (deltagarna från den tidigare studien) hade getts. Totalt 406 deltagare fullföljde studien. Endast ett fåtal studiedeltagare (2,2 %) avbröt behandlingen på grund av en biverkning. Effekten var bestående under den 48 veckor långa kontinuerliga injektionsbehandlingen. Procentandelen avseende effektens varaktighet efter 12 månader var 50,5 %, och 69,3 % av deltagarna använde inte opioider i slutet av den 12 månader långa behandlingsperioden.
Farmakokinetiska egenskaper
Absorption
Mediantiden tills det initiala toppvärdet för buprenorfin uppnåddes (Tmax) efter administrering av Subutex depotlösning för injektion var 24 timmar. Efter det första initiala toppvärdet för buprenorfin, sjönk koncentrationen av buprenorfin i plasma långsamt till en platå. Jämviktskoncentration (steady-state) nåddes efter 6 månader. Genomsnittliga Cavg-, Cmax- och Ctrough-värden för plasmakoncentrationerna av buprenorfin vid steady state i jämförelse med sublingualt buprenorfin redovisas i figur 1.
Figur 1. Jämförelse av buprenorfinexponering i plasma vid steady state mellan sublingualt buprenorfin och Subutex depotlösning för injektion: dalkoncentrationer (Ctrough), medelkoncentrationer (Cavg) och maximala koncentrationer (Cmax)
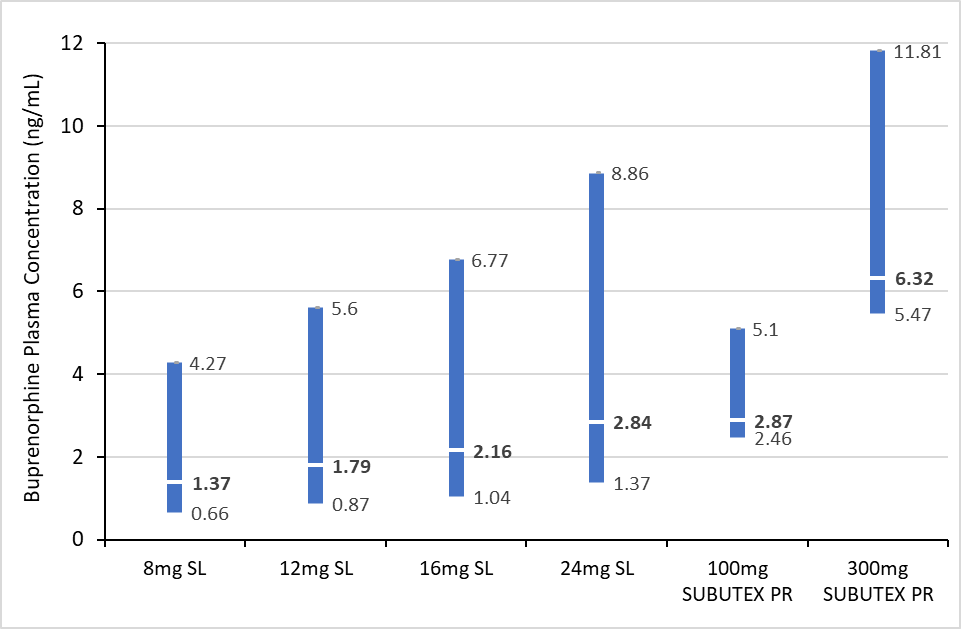
SL: sublingualt preparat, PR: depotpreparat
Varje stapel visar de geometriska medelvärdena för buprenorfinkoncentrationerna: dalkoncentration (längst ner), medelkoncentration i plasma (vit markering) och maximal plasmakoncentration (högst upp).
Koncentrationerna är baserade på prediktioner enligt en populationsfarmakokinetisk modell.
Distribution
Buprenorfin är till cirka 96 % proteinbundet, främst till alfa- och betaglobulin.
Metabolism
Buprenorfin metaboliseras till sin huvudmetabolit norbuprenorfin främst via CYP3A4 och i mindre grad via CYP2C8. Dessutom kan norbuprenorfin glukuronideras. Norbuprenorfin har konstaterats binda till opioidreceptorer in vitro men har dock inte studerats kliniskt med avseende på opioidliknande aktivitet.
Buprenorfin genomgår inte förstapassagemetabolism efter subkutan administrering av Subutex depotlösning för injektion.
Därför är kvoten mellan AUC-värdena för norbuprenorfin och buprenorfin (0,20–0,40) mycket lägre jämfört med sublingualt buprenorfin (0,70–2,11).
Eliminering
Skenbar terminal halveringstid i plasma för buprenorfin efter subkutan administrering av Subutex depotlösning för injektion var 43–60 dygn på grund av den långsamma frisättningen av buprenorfin från den subkutana läkemedelsdepån.
I en massbalansstudie där buprenorfin gavs till människa som en intravenös infusion konstaterades att det radioaktivt märkta läkemedlet utsöndrades i urin (30 %) och faeces (69 %) högst 11 dagar efter administrering. Nästan hela dosen utsöndrades som buprenorfin, norbuprenorfin och två oidentifierade buprenorfinmetaboliter. I urin förekom största delen av buprenorfin och norbuprenorfin i konjugerad form (buprenorfin: 1 % i fri och 8,4 % i konjugerad form; norbuprenorfin: 2,7 % i fri och 8,8 % i konjugerad form). I faeces förekom buprenorfin och norbuprenorfin nästan enbart i fri form (buprenorfin: 33 % i fri och 4,8 % i konjugerad form; norbuprenorfin: 21 % i fri och 2,1 % i konjugerad form).
En studie där buprenorfinexponering utvärderades 22 till 38 månader efter den senaste injektionen med Subutex depotlösning visade att detekterbara mängder buprenorfin kan finnas i plasma och urin under denna period. Buprenorfinkoncentrationerna som observerades var mindre än de som är kända för att lindra sjukdomssymtomen. Det var större variationer av koncentrationerna i urin och vid användning av en viss testmetod var koncentrationerna generellt högre än de i plasma. Det förväntas därför att patientens urin visar ett positivt resultat längre än patientens plasma.
Särskilda patientgrupper
I populationsfarmakokinetiska analyser hade varken ålder (medelvärde [standardavvikelse]: 38,8 [11,5], åldersintervall 19–64), kön eller ras (mörkhyade eller afroamerikanska jämfört med övriga) någon kliniskt betydelsefull inverkan på farmakokinetiken för Subutex depotlösning för injektion.
Nedsatt leverfunktion
Baserat på en studie med sublingualt preparat kan Subutex depotlösning för injektion ges till patienter med lindrig till medelsvår leverfunktionsnedsättning. Försiktighet ska iakttas om Subutex depotlösning för injektion används för behandling av patienter med befintlig medelsvår leverfunktionsnedsättning, eftersom koncentrationerna av buprenorfin inte kan minskas snabbt. Subutex depotlösning för injektion får inte ges till patienter med befintlig svår leverfunktionsnedsättning (se avsnitt Kontraindikationer). Patienter som utvecklar en medelsvår till svår leverfunktionsnedsättning medan de behandlas med Subutex depotlösning för injektion ska övervakas med avseende på tecken och symtom på toxicitet eller överdosering orsakad av en ökad buprenorfinkoncentration (se avsnitt Varningar och försiktighet.).
Nedsatt njurfunktion
Kliniska studier av Subutex depotlösning för injektion omfattade inte deltagare med svår njurfunktionsnedsättning. Den renala elimineringen utgör en relativt liten andel (cirka 30 %) av total clearance av buprenorfin och dess metaboliter. Därför krävs ingen dosjustering baserat på njurfunktionen. Buprenorfins metaboliter ackumuleras hos patienter med nedsatt njurfunktion. Försiktighet ska iakttas när läkemedlet ges till patienter med svår njurfunktionsnedsättning (kreatininclearance < 30 ml/min).
Pediatrisk population
Inga kliniska data finns tillgängliga.
Prekliniska säkerhetsuppgifter
Gängse studier av Subutex depotlösning för injektion avseende lokal tolerans, toxicitet vid engångsdoser och upprepade doser, allmäntoxicitet och gentoxicitet visade inte några särskilda risker för människa vid kliniskt relevanta buprenorfindoser.
I studier av reproduktionseffekter och effekter på utveckling, konstaterades inga biverkningar vid kliniskt relevanta doser. I studier på råtta ökade förekomsten av postimplantationsförluster, embryoresorption och fosterdödlighet vid höga doser. Vid höga doser Subutex depotlösning för injektion och buprenorfin konstaterades i huvudsak skelettmissbildningar.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
ATRIGEL-polymerlösningen innehåller poly(DL‑laktid‑coglykolid) (50:50), N-metyl-2-pyrrolidon
Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel.
Hållbarhet
100 mg: 21 månader
300 mg: 2 år
Särskilda förvaringsanvisningar
Förvaras vid 2 °C–8 °C. Får ej frysas.
Ta ut Subutex depotlösning för injektion ur kylskåpet före administreringen. Det tar minst 15 minuter för läkemedlet att anta rumstemperatur. Öppna inte foliepåsen förrän patienten har anlänt för att få sin injektion.
När läkemedlet tagits ut ur kylskåpet kan det förvaras i originalförpackningen i rumstemperatur (under 25 °C) i högst 7 dagar före administrering. Märk förpackningen med det datum när förpackningen togs ut i rumstemperatur.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
SUBUTEX depotinjektioneste, liuos
100 mg (L:ei) 1 kpl (turvaneula) (500,41 €)
300 mg (L:ei) 1 kpl (turvaneula) (500,41 €)
PF-selosteen tieto
Subutex 100 mg injektionsvätska, depotlösning: Levereras i en steril 1 ml-spruta av cyklisk olefinkopolymer med nålskydd och propp av brombutylgummi tillsammans med en 19 G 16 mm säkerhetskanyl i engångsförpackning.
Subutex 300 mg injektionsvätska, depotlösning: Levereras i en steril 2,25 ml-spruta av cyklisk olefinkopolymer med nålskydd och propp av brombutylgummi, tillsammans med en 19 G 16 mm säkerhetskanyl i engångsförpackning.
Varje förfylld spruta med polypropenkolv levereras i en påse av aluminiumfolie som innehåller en syreabsorbent. Påsen är förpackad i en märkt kartong tillsammans med den sterila säkerhetskanylen och bipacksedeln.
Läkemedlets utseende:
Klar, viskös, färglös till gul eller gulbrun steril lösning.
Särskilda anvisningar för destruktion och övrig hantering
Före injektionen
- Läs anvisningarna noga innan du hanterar läkemedlet.
- Som en allmän försiktighetsåtgärd ska handskar alltid användas.
- Ta ut Subutex depotlösning för injektion ur kylskåpet före administreringen.
- Det tar minst 15 minuter för läkemedlet att anta rumstemperatur. Öppna inte foliepåsen förrän patienten har anlänt för att få sin injektion.
- Subutex depotlösning för injektion ska kastas om den har legat i rumstemperatur i mer än 7 dagar.
1. FÖRBEREDELSER
Ta upp foliepåsen och säkerhetskanylen ur kartongen. Öppna påsen och ta upp sprutan. Kassera syreabsorbenten, den behövs inte längre.
2. KONTROLLERA LÖSNINGEN
Kontrollera visuellt att läkemedlet inte innehåller några föroreningar eller partiklar. Subutex depotlösning för injektion kan vara helt färglös till gul eller gulbrun. Dessa färgvariationer påverkar inte läkemedlets effekt.
3. MONTERA SÄKERHETSKANYLEN
Ta bort hättan från sprutan och ta upp säkerhetskanylen ur den sterila förpackningen.
Vrid försiktigt fast kanylen medurs tills den sitter säkert.
Behåll nålskyddet på nålen.
4. FÖRBERED INJEKTIONSSTÄLLET PÅ BUKEN
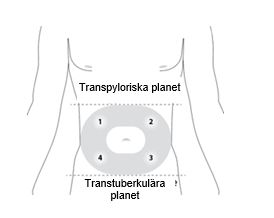
Välj ett injektionsställe på buken mellan det transpyloriska och transtuberkulära planet där det finns tillräckligt med subkutan vävnad och där det inte förekommer hudförändringar (t.ex. knutor, lesioner, kraftig pigmentering). Patienten bör ligga ner på rygg.
Injicera inte i ett område med hudirritation, rodnad, blåmärke, inflammation eller ärrbildning av något slag.
Rengör injektionsstället noga med en spritsudd.
För att undvika irritation ska ett nytt injektionsställe väljas vid varje administrering ungefär som bilden visar. Anteckna var injektionen ges så att ett annat ställe väljs vid nästa injektion.
5. AVLÄGSNA LUFT UR SPRUTAN
Håll sprutan upprätt i flera sekunder så att luftbubblorna stiger till ytan. Läkemedlet är en viskös vätska, så bubblorna stiger inte lika snabbt som i en vattenlösning.
Ta bort nålskyddet och tryck långsamt in kolven så att luften trycks ut ur sprutan. Låt det vikbara nålskyddet sitta kvar vid sidan av nålen.
- Det gör inget om små bubblor finns kvar i läkemedlet. Stora luftbubblor kan däremot minskas genom att kolven dras tillbaka så att bubblorna spricker och luften sedan trycks ut mycket långsamt. Luften ska tryckas ut med stor försiktighet så att inget läkemedel går förlorat.
Om läkemedel syns vid nålspetsen ska kolven dras tillbaka något för att undvika läkemedelsspill.
6. NYP IHOP HUDEN VID INJEKTIONSSTÄLLET
Nyp ihop huden runt injektionsstället. Tillräckligt mycket hud ska nypas ihop för att inrymma kanylen. Lyft upp fettvävnaden från underliggande muskel för att undvika oavsiktlig intramuskulär injektion.
7. INJICERA LÄKEMEDLET
Subutex depotlösning för injektion ska endast ges som subkutan injektion. Den får aldrig injiceras intravaskulärt eller intramuskulärt eftersom den fasta läkemedelsdepån som bildas kan medföra allvarlig skada och livsfara. Injicera inte läkemedlet intramuskulärt eller i huden.
Stick in kanylen helt i den subkutana vävnaden på buken. Injektionsvinkeln beror på mängden subkutan vävnad. Ge läkemedlet med en långsam och jämn injektion. Fortsätt trycka in kolven tills allt läkemedel har injicerats.
8. DRA UT KANYLEN
Dra ut kanylen i samma vinkel som den fördes in och släpp taget om huden.
Massera inte injektionsstället efter injektionen.
En liten mängd blod eller vävnadsvätska kan sippra ut från injektionsstället. Torka stället med en bomullstuss eller gasvävskompress innan du täcker det med ett gasvävsbandage eller en kompress. Tryck så lätt som möjligt på injektionsstället.
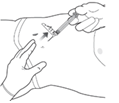
9. SÄTT FAST NÅLSKYDDET OCH KASSERA SPRUTAN
Sätt fast det vikbara nålskyddet genom att trycka det mot en hård yta, t.ex. ett bord.
Kasta alla sprutkomponenterna i en säker behållare för vassa föremål. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
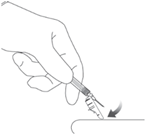
10. ANVISNINGAR TILL PATIENTEN
Berätta för patienten att det kanske kommer att finnas en knuta på injektionsstället i flera veckor, men att den blir mindre med tiden. Instruera patienten att inte gnida eller massera på injektionsstället och att tänka på att bälten/skärp och klädernas linning kan irritera injektionsstället.
Ersättning
SUBUTEX depotinjektioneste, liuos
100 mg 1 kpl
300 mg 1 kpl
- Ei korvausta.
Atc-kod
N07BC01
Datum för översyn av produktresumén
01.08.2022
Yhteystiedot
27 Windsor Place
Dublin 2
Irlanti
PatientSafetyRoW@indivior.com
