ATECTURA BREEZHALER inhalationspulver, hård kapsel 125/127,5 mikrog, 125/260 mikrog
Kvalitativ och kvantitativ sammansättning
Atectura Breezhaler 125 mikrogram/62,5 mikrogram inhalationspulver, hårda kapslar
Varje kapsel innehåller 150 mikrogram indakaterol (som acetat) och 80 mikrogram mometasonfuroat (indacaterol./mometason. Fur.).
Varje avgiven dos (den dos som lämnar inhalatorns munstycke) innehåller 125 mikrogram indakaterol (som acetat) och 62,5 mikrogram mometasonfuroat.
Atectura Breezhaler 125 mikrogram/127,5 mikrogram inhalationspulver, hårda kapslar
Varje kapsel innehåller 150 mikrogram indakaterol (som acetat) och 160 mikrogram mometasonfuroat.
Varje avgiven dos (den dos som lämnar inhalatorns munstycke) innehåller 125 mikrogram indakaterol (som acetat) och 127,5 mikrogram mometasonfuroat.
Atectura Breezhaler 125 mikrogram/260 mikrogram inhalationspulver, hårda kapslar
Varje kapsel innehåller 150 mikrogram indakaterol (som acetat) och 320 mikrogram mometasonfuroat.
Varje avgiven dos (den dos som lämnar inhalatorns munstycke) innehåller 125 mikrogram indakaterol (som acetat) och 260 mikrogram mometasonfuroat.
Hjälpämne med känd effekt
Varje kapsel innehåller cirka 24 mg laktos (som monohydrat).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Inhalationspulver, hård kapsel (inhalationspulver)
Kliniska uppgifter
Terapeutiska indikationer
Atectura Breezhaler är indicerad som underhållsbehandling av astma hos vuxna och ungdomar från 12 års ålder som inte uppnår adekvat symtomkontroll med inhalerade kortikosteroider och inhalerade kortverkande beta2‑agonister.
Dosering och administreringssätt
Dosering
Vuxna och ungdomar från 12 års ålder
Rekommenderad dos är inhalation av innehållet i en kapsel en gång dagligen.
Patienten ska få den styrka som innehåller lämplig dos mometasonfuroat utifrån sjukdomens svårighetsgrad och ska regelbundet kontrolleras av sjukvårdspersonal.
Maximal rekommenderad dos är 125 mikrogram/260 mikrogram en gång dagligen.
Behandlingen ska tas vid samma tidpunkt varje dag. Den kan tas oavsett tidpunkt på dygnet. Om en dos glöms bort, ska den tas så snart som möjligt. Patienterna ska informeras om att inte ta mer än en dos dagligen.
Särskilda populationer
Äldre
Ingen dosjustering behövs för äldre patienter (från 65 år och uppåt) (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Ingen dosjustering behövs för patienter med nedsatt njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering behövs för patienter med lätt eller måttligt nedsatt leverfunktion. Inga data finns tillgängliga om användning av läkemedlet hos patienter med gravt nedsatt leverfunktion. Därför bör användning hos dessa patienter endast ske om den förväntade nyttan uppväger den potentiella risken (se avsnitt Farmakokinetiska egenskaper).
Pediatrisk population
Dosen till barn från 12 års ålder är densamma som till vuxna.
Säkerhet och effekt för barn under 12 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Endast för inhalation. Kapslarna får inte sväljas.
Kapslarna får endast administreras med inhalatorn som medföljer varje ny förpackning (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Patienterna ska informeras om hur läkemedlet administreras korrekt. Patienter som inte upplever att andningen förbättras ska tillfrågas om de sväljer läkemedlet i stället för att inhalera det.
Kapslarna får inte tas upp ur blistret förrän omedelbart före användningen.
Efter inhalation ska patienten skölja munnen med vatten utan att svälja (se avsnitt Varningar och försiktighet och Särskilda anvisningar för destruktion och övrig hantering).
Anvisningar om hantering av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Försämring av sjukdomen
Detta läkemedel ska inte användas för att behandla akuta astmasymtom, t.ex. akuta episoder av bronkospasm. Istället ska en kortverkande bronkdilaterare användas vid dessa tillfällen. Ökad användning av kortverkande bronkdilaterare för att lindra symtomen tyder på försämrad sjukdomskontroll och patienten ska då undersökas av läkare.
Patienterna ska inte avsluta behandlingen utan överinseende av läkare, eftersom symtomen kan komma tillbaka efter behandlingsavbrott.
Behandling med läkemedlet bör inte avbrytas abrupt. Om patienter anser att behandlingen är ineffektiv, ska de fortsätta behandlingen men måste också uppsöka läkare. Ökad användning av snabbverkande bronkdilaterare indikerar försämring av den underliggande sjukdomen och motiverar förnyad utvärdering av terapin. Plötslig och tilltagande försämring av astmasymptom är potentiellt livshotande och patienten bör genomgå akut medicinsk bedömning.
Överkänslighet
Akuta överkänslighetsreaktioner har observerats efter administrering av detta läkemedel. Om tecken som tyder på allergiska reaktioner uppkommer, i synnerhet angioödem (svårigheter att andas eller svälja, svullnad av tunga, läppar och ansikte), urtikaria eller hudutslag, ska behandling avbrytas omedelbart och alternativ behandling sättas in.
Paradoxal bronkospasm
Liksom vid annan inhalationsbehandling kan administrering av detta läkemedel leda till paradoxal bronkospasm som kan vara livshotande. Om detta händer, ska behandlingen omedelbart sättas ut och alternativ behandling inledas.
Kardiovaskulära effekter av beta-agonister
I likhet med andra läkemedel som innehåller beta2‑agonister kan detta läkemedel orsaka en kliniskt signifikant kardiovaskulär effekt hos vissa patienter, såsom ökad puls, ökat blodtryck och/eller förvärrade symtom. Om sådana effekter uppträder kan det bli nödvändigt att avbryta behandlingen.
Detta läkemedel ska användas med försiktighet hos patienter med kardiovaskulära sjukdomar (kranskärlssjukdom, akut hjärtinfarkt, hjärtarytmier eller hypertoni), krampsjukdomar eller tyreotoxikos, samt till patienter som svarar ovanligt kraftigt på beta2‑agonister.
Patienter med instabil ischemisk hjärtsjukdom, anamnes på hjärtinfarkt under det senaste året, vänsterkammarsvikt av klass III/IV enligt New York Heart Association (NYHA), arytmi, okontrollerad hypertoni, cerebrovaskulär sjukdom, anamnes på långt QT-syndrom samt patienter som behandlas med läkemedel som förlänger QTc exkluderades från studier av indakaterol/mometasonfuroat i det kliniska utvecklingsprogrammet. Säkerhetsutfallet i dessa populationer är därför okänt.
Det har förekommit rapporter om att beta2‑agonister har orsakat elektrokardiografiska (EKG) förändringar, såsom avflackning av T-vågen, förlängning av QT-intervallet och sänkning av ST‑segmentet, men den kliniska betydelsen av dessa fynd är okänd.
Långverkande beta2-agonister (LABA) eller LABA-innehållande kombinationsprodukter såsom Atectura Breezhaler bör därför användas med försiktighet hos patienter med känd eller misstänkt förlängning av QT-intervallet eller som behandlas med läkemedel som påverkar QT-intervallet.
Hypokalemi med beta-agonister
Hos vissa patienter kan beta2‑agonister orsaka signifikant hypokalemi som kan ha ogynnsamma effekter på hjärtkärlsystemet. Sänkningen av serumkalium är vanligtvis övergående och kräver inte substitution. Hos patienter med svår astma kan hypokalemi förstärkas av hypoxi och annan samtidig behandling, vilket kan leda till ökad benägenhet för hjärtarytmier (se avsnitt Interaktioner).
Inga fall av kliniskt relevant hypokalemi har observerats i kliniska studier av indakaterol/mometasonfuroat vid den rekommenderade terapeutiska dosen.
Hyperglykemi
Inhalation av höga doser beta2‑agonister och kortikosteroider kan höja glukoshalten i plasma. När behandling inleds hos diabetespatienter, ska plasmaglukos kontrolleras extra noggrant.
Detta läkemedel har inte undersökts på patienter med diabetes mellitus typ 1 eller med okontrollerad diabetes mellitus typ 2.
Prevention av orofaryngeala infektioner
För att minska risken för orofaryngeal candida-infektion bör patienter rådas att skölja munnen eller gurgla med vatten utan att svälja, alternativt borsta tänderna, efter inhalering av den föreskrivna dosen.
Systemiska effekter av kortikosteroider
Inhalerade kortikosteroider kan ha systemiska effekter, särskilt vid användning av höga doser under längre tid. Sannolikheten för sådana effekter är mycket lägre än med orala kortikosteroider och kan variera såväl mellan patienter som mellan olika kortikosteroidpreparat.
Möjliga systemiska effekter kan inkludera Cushings syndrom, Cushingoida drag, binjurehämning, tillväxthämning hos barn och ungdomar, minskad benmineraldensitet, katarakt, glaukom och, mer sällan, en rad psykologiska eller beteendemässiga effekter inklusive psykomotorisk hyperaktivitet, sömnstörningar, ångest, depression eller aggression (särskilt hos barn). Det är därför viktigt att dosen av inhalerad kortikosteroid titreras till den lägsta dosen vid vilken effektiv kontroll av astma upprätthålls.
Synrubbningar kan uppkomma vid systemisk och topikal (inklusive intranasal, inhalerad och intraokulär) användning av kortikosteroider. Om en patient inkommer med symtom såsom dimsyn eller andra synrubbningar bör man överväga att remittera patienten till en ögonläkare för utredning av möjliga orsaker. Dessa kan innefatta katarakt, glaukom eller sällsynta sjukdomar såsom central serös korioretinopati (CSCR) som har rapporterats efter användning av systemiska och topikala kortikosteroider.
Detta läkemedel ska användas med försiktighet av patienter med lungtuberkulos och patienter med kroniska eller obehandlade infektioner.
Hjälpämnen
Detta läkemedel innehåller laktos. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Interaktioner
Inga specifika interaktionsstudier har genomförts med indakaterol/mometasonfuroat. Informationen om interaktioner bygger på risken för var och en av de aktiva substanserna.
Läkemedel som förlänger QTc-intervallet
Liksom andra läkemedel som innehåller en beta2‑agonist, ska detta läkemedel ges med försiktighet till patienter som behandlas med monoaminoxidashämmare, tricykliska antidepressiva, eller läkemedel som man vet förlänger QT-intervallet, eftersom deras effekt på QT-intervallet kan förstärkas. Läkemedel som förlänger QT-intervallet kan öka risken för kammararytmier (se avsnitt Varningar och försiktighet och Farmakodynamiska egenskaper).
Behandling av hypokalemi
Samtidig behandling av hypokalemi med metylxantinderivat, steroider eller icke-kaliumsparande diuretika kan förstärka den potentiella hypokalemiska effekten av beta2‑agonister (se avsnitt Varningar och försiktighet).
Betablockerare
Betablockerare kan försvaga eller motverka effekten av beta2‑agonister. Detta läkemedel ska därför inte ges tillsammans med betablockerare om inte tvingande skäl föreligger. Om sådan behandling är nödvändig, ska hjärtselektiva beta blockerare väljas i första hand och administreras med försiktighet.
Interaktion med hämmare av CYP3A4 och P‑glykoprotein
Hämning av CYP3A4 och P‑glykoprotein (P‑gp) påverkar inte säkerheten vid terapeutiska doser av Atectura Breezhaler.
Hämning av de mekanismer som framförallt bidrar till clearance av indakaterol (CYP3A4 och P‑gp) eller mometasonfuroat (CYP3A4) ökar den systemiska exponeringen för indakaterol respektive mometasonfuroat med upp till två gånger.
På grund av de mycket låga plasmakoncentrationerna efter inhalation är kliniskt signifikanta interaktioner med mometasonfuroat osannolika. Det kan dock finnas en potential för ökad systemisk exponering för mometasonfuroat när starka CYP3A4‑hämmare (t.ex. ketokonazol, itrakonazol, nelfinavir, ritonavir eller kobicistat) administreras samtidigt.
Andra långverkande beta2‑agonister
Samtidig administrering av detta läkemedel och andra läkemedel som innehåller långverkande beta2‑agonister har inte studerats och rekommenderas inte eftersom det kan leda till svårare biverkningar (se avsnitt Biverkningar och Överdosering).
Fertilitet, graviditet och amning
Graviditet
Det finns inte tillräckligt med information om användning av Atectura Breezhaler eller dess ingående komponenter (indakaterol och mometasonfuroat) till gravida kvinnor för att kunna avgöra om någon risk föreligger.
Indakaterol var inte teratogent hos råtta och kanin efter subkutan administrering (se avsnitt Prekliniska säkerhetsuppgifter). I reproduktionsstudier på dräktiga möss, råttor och kaniner gav mometasonfuroat upphov till ökade missbildningar samt minskad överlevnad och tillväxt hos fostren.
I likhet med andra läkemedel som innehåller beta2‑agonister kan indakaterol hämma värkarbetet på grund av en relaxerande effekt på den glatta muskulaturen i livmodern.
Detta läkemedel ska endast användas under graviditet om den förväntade nyttan för patienten överväger den potentiella risken för fostret.
Amning
Det finns ingen information om huruvida indakaterol eller mometasonfuroat utsöndras i bröstmjölk, om effekten på spädbarn som ammas, eller om effekterna på mjölkproduktionen. Andra inhalerade kortikosteroider av liknande typ som mometasonfuroat överförs till bröstmjölken. Indakaterol (och dess metaboliter) och mometasonfuroat har detekterats i mjölken hos lakterande råttor.
Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling efter att man tagit hänsyn till fördelen med amning för barnet och nyttan med behandling för kvinnan.
Fertilitet
Reproduktionsstudier och andra data från djur tyder inte på någon påverkan på fertiliteten hos vare sig män eller kvinnor.
Effekter på förmågan att framföra fordon och använda maskiner
Detta läkemedel har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste biverkningarna över 52 veckor var astma (exacerbation) (26,9%), nasofaryngit (12,9%), övre luftvägsinfektion (5,9%) samt huvudvärk (5,8%).
Sammanfattning av biverkningar i tabellform
Biverkningar redovisas enligt MedDRAs indelning av organsystem (tabell 1). Biverkningsfrekvensen bygger på PALLADIUM-studien. Inom varje organsystem rangordnas biverkningarna efter frekvens med den oftast förekommande biverkningen först. Inom varje frekvenskategori presenteras biverkningarna efter fallande allvarlighetsgrad.
Frekvenskategorierna baseras dessutom på följande princip (CIOMS III): mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000) och mycket sällsynta (<1/10 000).
Tabell 1 Biverkningar
| Organsystem | Biverkning | Frekvens-kategori |
| Infektioner och infestationer | Nasofaryngit | Mycket vanliga |
| Övre luftvägsinfektion | Vanliga | |
| Kandidos*1 | Mindre vanliga | |
| Immunsystemet | Överkänslighet*2 | Vanliga |
| Angioödem*3 | Mindre vanliga | |
| Metabolism och nutrition | Hyperglykemi*4 | Mindre vanliga |
| Centrala och perifera nervsystemet | Huvudvärk*5 | Vanliga |
| Ögon | Dimsyn | Mindre vanliga |
| Katarakt*6 | Mindre vanliga | |
| Hjärtat | Takykardi*7 | Mindre vanliga |
| Andningsvägar, bröstkorg och mediastinum | Astma (exacerbation) | Mycket vanliga |
| Orofaryngeal smärta*8 | Vanliga | |
| Dysfyoni | Vanliga | |
| Hud och subkutan vävnad | Hudutslag*9 | Mindre vanliga |
| Klåda*10 | Mindre vanliga | |
| Muskuloskeletala systemet och bindväv | Muskuloskeletal smärta*11 | Vanliga |
| Muskelspasmer | Mindre vanliga | |
* Indikerar grupper av rekommenderade termer (preferred terms, PT): 1 Oral kandidos, orofaryngeal kandidos. 2 Läkemedelsutslag, läkemedelsöverkänslighet, överkänslighet, utslag, erytematöst utslag, pruritiskt utslag, urtikaria. 3 Allergiskt ödem, angioödem, periorbital svullnad, svullna ögonlock. 4 Förhöjt blodsocker, hyperglykemi. 5 Huvudvärk, spänningshuvudvärk. 6 Katarakt, kortikal katarakt. 7 Ökad hjärtfrekvens, takykardi, sinustakykardi, supraventrikulär takykardi. 8 Oral smärta, orofaryngeala besvär, orofaryngeal smärta, svalgirritation, odynofagi. 9 Läkemedelsutslag, utslag, erytematöst utslag, pruritiskt utslag. 10 Analklåda, ögonklåda, nasal klåda, klåda, genital klåda. 11 Ryggvärk, muskuloskeletal smärta, myalgi, nacksmärta, muskuloskeletal bröstsmärta. | ||
Pediatrisk population
Läkemedlets säkerhetsprofil utvärderades i en fas III-studie hos ungdomar (12 år och äldre) och vuxna. Biverkningarnas frekvens, typ och svårighetsgrad hos ungdomar liknar den hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Allmänna stödjande åtgärder och symtomatisk behandling ska sättas in vid misstänkt överdosering.
Överdosering leder sannolikt till tecken, symptom eller biverkningar orsakade av de enskilda komponenternas farmakologiska verkningssätt (t.ex. takykardi, tremor, hjärtklappning, huvudvärk, illamående, kräkningar, dåsighet, kammararytmier, metabol acidos, hypokalemi, hyperglykemi, samt suppression av hypotalamus-hypofys-binjure-axelns funktion).
Användning av hjärtselektiva betablockerare kan övervägas för behandling av beta2‑adrenerga effekter, men endast under överinseende av läkare och med yttersta försiktighet, eftersom beta2‑adrenerga blockerare kan framkalla bronkospasm. I allvarliga fall bör patienten läggas in på sjukhus.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Medel vid obstruktiva luftvägssjukdomar, adrenergika i kombination med kortikosteroider eller andra läkemedel, exkl. antikolinergika, ATC-kod: R03AK14
Verkningsmekanism
Detta läkemedel är en kombination av indakaterol, en långverkande beta2‑agonist (LABA) och mometasonfuroat, en inhalationskortikosteroid (ICS).
Indakaterol
De farmakologiska effekterna av långverkande beta2‑agonister, inklusive indakaterol, kan åtminstone delvis tillskrivas ökade nivåer av cykliskt‑3’, 5’‑adenosinmonofosfat (cykliskt AMP), som leder till relaxation av den glatta muskulaturen i bronkerna.
Inhalerat indakaterol verkar lokalt i lungan som bronkvidgare. Indakaterol är en partiell agonist med nanomolär potens på humana beta2‑adrenerga receptorer. På isolat av humana bronker har indakaterol en snabbt insättande och långvarig verkan.
Även om beta2‑receptorer är de dominerande adrenerga receptorerna i bronkernas glatta muskulatur och beta1‑receptorer är de dominerande receptorerna i människans hjärta, finns det även beta2‑receptorer i hjärtat, där de utgör 10‑50 % av det totala antalet adrenerga receptorer.
Mometasonfuroat
Mometasonfuroat är en syntetisk kortikosteroid med hög affinitet till glukokortikoidreceptorer och med lokala antiinflammatoriska egenskaper. In vitro hämmar mometasonfuroat frisättning av leukotriener från leukocyter från allergiska patienter. I cellodling uppvisade mometasonfuroat hög potens beträffande hämning av syntes och frisättning av IL‑1, IL‑5, IL‑6 och TNF-alfa. Substansen är också en potent hämmare av leukotrienproduktionen och av produktionen av Th2‑cytokinerna IL-4 och IL-5 i CD4+ T-celler hos människa.
Farmakodynamisk effekt
Den farmakodynamiska responsen på detta läkemedel kännetecknas av snabbt insättande effekt inom 5 minuter efter inhalationen samt kvarstående effekt under hela doseringsintervallet på 24 timmar, vilket bevisas av ett förbättrat dalvärde för forcerad expiratorisk volym under den första sekunden (FEV1) jämfört med jämförelseläkemedel 24 timmar efter inhalation.
Ingen takyfylaxi observerades för den förbättrade lungfunktionen med detta läkemedel under perioden.
QTc-intervall
Effekten av detta läkemedel på QTc-intervallet har inte undersökt i någon noggrann QT-studie (TQT). Inga QTc-förlängande egenskaper hos mometasonfuroat är kända.
Klinisk effekt och säkerhet
Säkerhet och effekt av Atectura Breezhaler hos vuxna och ungdomar med persisterande astma har utvärderats i två randomiserade dubbelblindade fas III-studier (PALLADIUM och QUARTZ) med olika varaktighet.
PALLADIUM-studien var en 52 veckor lång pivotal studie där Atectura Breezhaler 125 mikrogram/127,5 mikrogram en gång dagligen (N=439) och 125 mikrogram/260 mikrogram en gång dagligen (N=445) jämfördes med mometasonfuroat 400 mikrogram en gång dagligen (N=444) och 800 mikrogram per dag (givet som 400 mikrogram två gånger dagligen) (N=442). I en tredje studiearm med aktiv kontroll deltog försökspersoner som fick salmeterol/flutikasonpropionat 50 mikrogram/500 mikrogram två gånger dagligen (N=446). Alla försökspersonerna hade symtomatisk astma (ACQ‑7 poäng ≥ 1,5) och stod på underhållsbehandling med en inhalationskortikosteroid (ICS), med eller utan LABA, sedan minst 3 månader före studiestart. Screeningen visade att 31 % av patienterna haft exacerbationer under det senaste året. Det vanligaste astmaläkemedlet vid studiestarten var medelhög dos ICS (20 %), hög dos ICS (7 %) eller låg dos ICS i kombination med en LABA (69 %).
Det primära syftet med studien var att visa att antingen Atectura Breezhaler 125 mikrogram/127,5 mikrogram en gång dagligen var bättre än mometasonfuroat 400 mikrogram en gång dagligen, eller att Atectura Breezhaler 125 mikrogram/260 mikrogram en gång dagligen var bättre än mometasonfuroat 400 mikrogram två gånger dagligen med avseende på dalvärdet för FEV1 vecka 26.
Vecka 26 uppvisade både Atectura Breezhaler 125 mikrogram/127,5 mikrogram och 125 mikrogram/260 mikrogram en gång dagligen statistiskt signifikanta förbättringar av dal-FEV1 och poäng på Asthma Control Questionnaire (ACQ‑7) jämfört med mometasonfuroat 400 mikrogram en respektive två gånger dagligen (se tabell 2). Värdena vecka 52 var desamma som vecka 26.
Atectura Breezhaler 125 mikrogram/127,5 mikrogram och 125 mikrogram/260 mikrogram gav båda en kliniskt betydelsefull minskning av antalet måttliga eller svåra exacerbationer per år (sekundärt effektmått), i jämförelse med mometasonfuroat 400 mikrogram en eller två gånger dagligen (se tabell 2).
Resultaten för de kliniskt mest relevanta effektmåtten beskrivs i tabell 2.
Lungfunktion, symtom och exacerbationer
Tabell 2 Resultat för primära och sekundära effektmått i PALLADIUM-studien vid vecka 26 och 52
| Effektmått | Tidpunkt/ varaktighet | Atectura Breezhaler1 vs MF2 | Atectura Breezhaler1 vs SAL/FP3 | |
Medelhög dos vs medelhög dos | Hög dos vs hög dos | Hög dos vs hög dos | ||
| Lungfunktion | ||||
| Dalvärde för FEV14 | ||||
Behandlingsskillnad P-värde (95 % CI) | Vecka 26 (primärt effektmått) | 211 ml <0,001 (167; 255) | 132 ml <0,001 (88; 176) | 36 ml 0,101 (‑7; 80) |
| Vecka 52 | 209 ml <0,001 (163; 255) | 136 ml <0,001 (90; 183) | 48 ml 0,040 (2; 94) | |
| Genomsnittligt max expiratoriskt flöde (PEF) på morgonen* | ||||
Behandlingsskillnad (95 % CI) | Vecka 52 | 30,2 l/min (24,2; 36,3) | 28,7 l/min (22,7; 34,8) | 13,8 l/min (7,7; 19,8) |
| Genomsnittligt max expiratoriskt flöde (PEF) på kvällen* | ||||
Behandlingsskillnad (95 % CI) | Vecka 52 | 29,1 l/min (23,3; 34,8) | 23,7 l/min (18,0; 29,5) | 9,1 l/min (3,3; 14,9) |
| Symtom | ||||
| ACQ‑7 | ||||
Behandlingsskillnad P-värde (95 % CI) | Vecka 26 (huvudsakligt sekundärt effektmått) | ‑0,248 <0,001 (‑0,334; ‑0,162) | ‑0,171 <0,001 (‑0,257; ‑0,086) | ‑0,054 0,214 (‑0,140; 0,031) |
| Vecka 52 | ‑0,266 (‑0,354; ‑0,177) | ‑0,141 (‑0,229; ‑0,053) | 0,010 (‑0,078; 0,098) | |
| ACQ-responders (procentandelen patienter med lägsta kliniskt betydelsefulla skillnad (MCID) från baslinjen med ACQ ≥ 0,5) | ||||
| Procentandel | Vecka 26 | 76% vs 67% | 76% vs 72% | 76% vs 76% |
Oddskvot (95 % CI) | Vecka 26 | 1,73 (1,26; 2,37) | 1,31 (0,95; 1,81) | 1,06 (0,76; 1,46) |
| Procentandel | Vecka 52 | 82% vs 69% | 78% vs 74% | 78% vs 77% |
Oddskvot (95 % CI) | Vecka 52 | 2,24 (1,58; 3,17) | 1,34 (0,96; 1,87) | 1,05 (0,75; 1,49) |
| Procentandel dagar utan undsättningsläkemedel* | ||||
Behandlingsskillnad (95 % CI) | Vecka 52 | 8,6 (4,7; 12,6) | 9,6 (5,7; 13,6) | 4,3 (0,3; 8,3) |
| Procentandel symtomfria dagar* | ||||
Behandlingsskillnad (95 % CI) | Vecka 52 | 9,1 (4,6; 13,6) | 5,8 (1,3; 10,2) | 3,4 (‑1,1; 7,9) |
| Annualiserad frekvens astmaexacerbationer | ||||
| Måttliga eller svåra exacerbationer | ||||
| AR | Vecka 52 | 0,27 vs 0,56 | 0,25 vs 0,39 | 0,25 vs 0,27 |
RR (95 % CI) | Vecka 52 | 0,47 (0,35; 0,64) | 0,65 (0,48; 0,89) | 0,93 (0,67; 1,29) |
| Svåra exacerbationer | ||||
| AR | Vecka 52 | 0,13 vs 0,29 | 0,13 vs 0,18 | 0,13 vs 0,14 |
RR (95 % CI) | Vecka 52 | 0,46 (0,31; 0,67) | 0,71 (0,47; 1,08) | 0,89 (0,58; 1,37) |
* Medelvärde för behandlingsdurationen ** RR <1,00 stödjer indakaterol/mometasonfuroat. 1 Atectura Breezhaler i medelhög dos: 125 mikrogram/127,5 mikrogram od; hög dos: 125 mikrogram/260 mikrogram od. 2 MF: mometasonfuroat i medelhög dos: 400 mikrogram od; hög dos: 400 mikrogram bid (innehåll i dos). Mometasonfuroat 127,5 mikrogram od och 260 mikrogram od i Atectura Breezhaler är jämförbart med mometasonfuroat 400 mikrogram od och 800 mikrogram per dag (givet som 400 mikrogram bid). 3 SAL/FP: salmeterol/flutikasonpropionat i hög dos: 50 mikrogram/500 mikrogram bid (innehåll i dos). 4 Dalvärde för FEV1: genomsnittet av två FEV1-värden uppmätta 23 timmar och 15 minuter respektive 23 timmar och 45 minuter efter kvällsdosen. Primära effektmåttet (dalvärde för FEV1 vecka 26) samt det viktigaste sekundära effektmåttet (ACQ‑7 poäng vecka 26) var del av den bekräftande teststrategin och därmed kontrollerad för multiplicitet. Samtliga andra effektmått var inte del av den bekräftande teststrategin. RR = frekvenskvot, AR = annualiserad frekvens od = en gång dagligen, bid = två gånger dagligen | ||||
Förspecificerad poolad analys
Atectura Breezhaler 125 mikrogram/260 mikrogram en gång dagligen studerades även som aktiv komparator i en annan fas III-studie (IRIDIUM), i vilken samtliga försökspersoner under det senaste året haft astmaexacerbationer som krävt behandling med systemiska kortikosteroider. En förspecificerad poolad analys av IRIDIUM- och PALLADIUM-studierna utfördes för att jämföra Atectura Breezhaler 125 mikrogram/260 mikrogram en gång dagligen med salmeterol/flutikason 50 mikrogram/500 mikrogram två gånger dagligen avseende effektmåtten dal-FEV1 och ACQ-7 vecka 26 samt annualiserad exacerbationsfrekvens. Den poolade analysen visade att Atectura Breezhaler förbättrat dalvärdet för FEV1 med 43 ml (95 % CI: 17, 69) och ACQ‑7-poäng med ‑0,091 (95 % CI: ‑0,153, ‑0,030) vecka 26 och minskade annualiserad frekvens måttliga eller svåra exacerbationer med 22 % (RR: 0,78; 95 % CI: 0,66, 0,93) och svåra exacerbationer med 26 % (RR: 0,74; 95 % CI: 0,61, 0,91) jämfört med salmeterol/flutikason.
QUARTZ-studien var en 12‑veckorsstudie där man jämförde Atectura Breezhaler 125 mikrogram/62,5 mikrogram en gång dagligen (N=398) med mometasonfuroat 200 mikrogram en gång dagligen (N=404). Samtliga försökspersoner måste vara symtomatiska och ha stått på underhållsbehandling mot astma med lågdos-ICS (med eller utan LABA) i minst 1 månad före studiestarten. Det astmaläkemedel som oftast användes vid studiestarten var lågdos-ICS (43 %) och LABA/lågdos-ICS (56 %). Primärt effektmått i studien var att visa att Atectura Breezhaler 125 mikrogram/62,5 mikrogram en gång dagligen var bättre än mometasonfuroat 200 mikrogram en gång dagligen vad gällde dalvärdet för FEV1 vecka 12.
Atectura Breezhaler 125 mikrogram/62,5 mikrogram en gång dagligen gav en statistiskt signifikant förbättring av dalvärdet för FEV1 vecka 12 och av ACQ‑7-poäng (Astma Control Questionnaire) jämfört med mometasonfuroat 200 mg en gång dagligen.
Resultat för de kliniskt mest relevanta effektmåtten beskrivs i tabell 3.
Tabell 3 Resultat för primära och sekundära effektmått i QUARTZ-studien vecka 12
| Effektmått | Atectura Breezhaler låg dos* vs MF låg dos** |
| Lungfunktion | |
| Dalvärde för FEV1 (primärt effektmått)*** | |
Behandlingsskillnad P värde (95% CI) | 182 ml <0,001 (148; 217) |
| Genomsnittligt PEF på morgonen | |
Behandlingsskillnad (95% CI) | 27,2 l/min (22,1; 32,4) |
| PEF på kvällen | |
Behandlingsskillnad (95% CI) | 26,1 l/min (21,0; 31,2) |
| Symtom | |
| ACQ‑7 (huvudsakligt sekundärt effektmått) | |
Behandlingsskillnad P värde (95% CI) | ‑0,218 <0,001 (‑0,293; ‑0,143) |
| Procentandel patienter som uppnått MCID från baslinjen med ACQ ≥0,5 | |
Percentage Oddskvot (95% CI) | 75 % vs 65 % 1,69 (1,23; 2,33) |
| Procentandel dagar utan undsättningsläkemedel | |
Behandlingsskillnad (95% CI) | 8,1 (4,3; 11,8) |
| Procentandel symtomfria dagar | |
Behandlingsskillnad (95% CI) | 2,7 (‑1,0; 6,4) |
* Atectura Breezhaler i låg dos: 125/62,5 mikrogram od. ** MF: mometasonfuroat i låg dos: 200 mikrogram od (innehåll i dos). Mometasonfuroat 62,5 mikrogram i Atectura Breezhaler od är jämförbart med mometasonfuroat 200 mikrogram od (innehåll i dos). *** Dalvärde för FEV1: genomsnittet av två FEV1-värden uppmätta 23 timmar och 15 minuter respektive 23 timmar och 45 minuter efter kvällsdosen. od = en gång dagligen, bid = två gånger dagligen | |
Pediatrisk population
I PALLADIUM-studien, som omfattade 106 ungdomar (12‑17 år), var förbättringen av dalvärdet för FEV1 vecka 26 0,173 liter (95 % CI: ‑0,021, 0,368) för Atectura Breezhaler 125 mikrogram/260 mikrogram en gång dagligen jämfört med mometasonfuroat 800 mikrogram (dvs. höga doser) och 0,397 liter (95 % CI: 0,195, 0,599) för Atectura Breezhaler 125 mikrogram/127,5 mikrogram en gång dagligen jämfört med mometasonfuroat 400 mikrogram en gång dagligen (dvs. medelhöga doser).
I QUARTZ-studien, som omfattade 63 ungdomar (12‑17 år), var minstakvadratmedelvärdet för behandlingsskillnaden för dal-FEV1 dag 85 (vecka 12) 0,251 liter (95 % CI: 0,130, 0,371).
Förbättring av lungfunktion, symtom och exacerbationer var densamma i undergruppen ungdomar som i den totala populationen.
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för indakaterol/mometasonfuroat för en eller flera grupper av den pediatriska populationen för astma (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Absorption
Efter inhalation av Atectura Breezhaler var mediantiden till maximala plasmakoncentrationer av indakaterol och mometasonfuroat cirka 15 minuter respektive 1 timme.
Baserat på data in vitro förväntas dosen av var och en av de ingående komponenterna som avges till lungan vara densamma för kombinationen indakaterol/mometasonfuroat och produkterna som monoterapi. Vid steady state var plasmaexponeringen för indakaterol och mometasonfuroat efter inhalation av kombinationen jämförbar med den systemiska exponeringen efter inhalation av indakaterolmaleat eller mometasonfuroat som monoterapiprodukter.
Efter inhalation av kombinationen beräknades den absoluta biotillgängligheten till cirka 45 % för indakaterol och mindre än 10 % för mometasonfuroat.
Indakaterol
Indakaterolkoncentrationen ökade vid upprepade administreringar en gång dagligen. Steady state uppnåddes inom 12‑14 dagar. Genomsnittlig ackumuleringskvot för indakaterol, dvs. AUC under 24 timmars dosintervall dag 14 jämfört med dag 1, låg mellan 2,9 och 3,8 vid doser på 60 till 480 mikrogram som inhalerades en gång dagligen (avgiven dos). Den systemiska exponeringen är ett resultat av såväl pulmonell som gastrointestinal absorption. Cirka 75 % av den systemiska exponeringen härrörde från pulmonell absorption och cirka 25 % från gastrointestinal absorption.
Mometasonfuroat
Koncentrationen av mometasonfuroat ökade vid upprepade administreringar en gång dagligen med Breezhaler-inhalatorn. Steady state uppnåddes efter 12 dagar. Genomsnittlig ackumuleringskvot för mometasonfuroat, dvs. AUC under 24 timmars dosintervall dag 14 jämfört med dag 1, låg mellan 1,61 och 1,71 vid doser på 62,5 till 260 mikrogram som inhalerades en gång dagligen i kombinationen indakaterol/mometasonfuroat.
Efter peroral administrering av mometasonfuroat bedömdes den absoluta orala systemiska biotillgängligheten för mometasonfuroat vara mycket låg (<2 %).
Distribution
Indakaterol
Efter intravenös infusion var indakaterols distributionsvolym (Vz) 2 361 till 2 557 liter, vilket visar på en omfattande distribution. Proteinbindningsgraden in vitro i humant serum och human plasma var 94,1 till 95,3 % respektive 95,1 till 96,2 %.
Mometasonfuroat
Efter intravenös administrering av en bolusdos är Vd 332 liter. Proteinbindningsgraden för mometasonfuroat in vitro är hög, 98 % till 99 % vid koncentrationer i intervallet 5 till 500 ng/ml.
Metabolism
Indakaterol
Efter oral administrering av radioaktivt märkt indakaterol i en ADME-studie (absorption, distribution, metabolism, eliminering) på människa var oförändrat indakaterol huvudkomponenten i serum och stod för cirka en tredjedel av total läkemedelsrelaterad AUC under 24 timmar. Huvudmetaboliten i serum var ett hydroxylerat derivat. Andra viktiga metaboliter var fenoliska O-glukuronider av indakaterol och hydroxylerat indakaterol. Andra metaboliter som identifierades var en diastereomer av det hydroxylerade derivatet, en N-glukuronid av indakaterol samt C- och N-dealkylerade produkter.
Undersökningar in vitro visade att UGT1A1 var den enda UGT-isoformen som metaboliserade indakaterol till den fenoliska O-glukuroniden. De oxidativa metaboliterna återfanns i inkubationer med rekombinant CYP1A1, CYP2D6 och CYP3A4. CYP3A4 antas vara det dominerande isoenzym som ansvarar för hydroxylering av indakaterol. Undersökningar in vitro tyder vidare på att indakaterol är ett lågaffinitetssubstrat för effluxpumpen P-gp.
In vitro är UGT1A1‑isoformen en viktig bidragande faktor till metabolt clearance av indakaterol. I en klinisk studie av populationer med olika UGT1A1‑genotyper visades emellertid att systemisk exponering för indakaterol inte nämnvärt påverkas av UGT1A1‑genotyp.
Mometasonfuroat
Den del av en inhalerad dos mometasonfuroat som sväljs ned och absorberas i magtarmkanalen genomgår omfattande nedbrytning till flera metaboliter. Inga betydande metaboliter kan detekteras i plasma. Hos människa metaboliseras mometasonfuroat av CYP3A4 i levermikrosomer.
Eliminering
Indakaterol
I kliniska studier med urinprover utgjorde mängden oförändrat indakaterol som utsöndrades via urinen generellt mindre än 2 % av dosen. Renal clearance av indakaterol var i genomsnitt mellan 0,46 och 1,20 liter/timme. Vid jämförelse med serumclearance av indakaterol, som var 18,8 till 23,3 liter/timme, är det uppenbart att renal clearance spelar en mindre roll (cirka 2 till 6 % av systemisk clearance) för eliminering av systemiskt tillgängligt indakaterol.
I en ADME-studie på människa där indakaterol gavs peroralt skedde utsöndringen i högre grad via feces än via urinen. Indakaterol utsöndrades i feces huvudsakligen som oförändrad modersubstans (54 % av dosen) och i mindre grad som hydroxylerade indakaterolmetaboliter (23 % av dosen). Massbalansen var fullständig och ≥ 90 % av dosen återfanns i exkretet.
Serumkoncentrationen av indakaterol minskade flerfasiskt med en genomsnittlig terminal halveringstid på 45,5 till 126 timmar. Den effektiva halveringstiden, beräknad på basis av ackumulering av indakaterol efter upprepad dosering, låg mellan 40 och 52 timmar, vilket överensstämmer med den observerade tiden till steady state på 12 till 14 dagar.
Mometasonfuroat
Efter administrering av en intravenös bolusdos är den terminala halveringstiden T½ för mometasonfuroat cirka 4,5 timmar. En radiomärkt, oralt inhalerad dos utsöndras främst via feces (74 %) och i mindre utsträckning via urinen (8 %).
Interaktioner
Samtidig administrering av oralt inhalerat indakaterol och mometasonfuroat vid steady state påverkade inte farmakokinetiken för någon av de aktiva substanserna.
Linjäritet/icke-linjäritet
Systemisk exponering för mometasonfuroat ökade proportionellt mot dosen efter engångsdoser och multipla doser av Atectura Breezhaler 125 mikrogram/62,5 mikrogram och 125 mikrogram/260 mikrogram till friska försökspersoner. En mindre än proportionell ökning av systemisk exponering vid steady state observerades hos patienter med astma i dosintervallet 125 mikrogram/62,5 mikrogram till 125 mikrogram/260 mikrogram. Inga analyser av dosproportionalitet utfördes för indakaterol eftersom endast en dos användes för alla styrkor.
Pediatrisk population
Atectura Breezhaler kan användas till ungdomar (12 år och äldre) med samma dos som till vuxna. Säkerhet och effekt för Atectura Breezhaler för barn under 12 år har inte fastställts.
Särskilda populationer
En populationsfarmakokinetisk analys utförd på astmapatienter efter inhalation av indakaterol/mometasonfuroat tyder på att ålder, kön, kroppsvikt, rökstatus, beräknad glomerulär filtrationshastighet (eGFR) vid baslinjen eller FEV1 vid baslinjen inte har någon signifikant effekt på systemisk exponering för indakaterol och mometasonfuroat.
Patienter med nedsatt njurfunktion
Eftersom den renala utsöndringen stod för en mycket liten andel av den totala elimineringen av indakaterol och mometasonfuroat har effekten av nedsatt njurfunktion på den systemiska exponeringen inte undersökts (se avsnitt Dosering och administreringssätt).
Patienter med nedsatt leverfunktion
Effekten av indakaterol/mometasonfuroat har inte undersökts hos försökspersoner med nedsatt leverfunktion. Studier har dock genomförts med monoterapikomponenterna (se avsnitt Dosering och administreringssätt).
Indakaterol
Patienter med lätt eller måttligt nedsatt leverfunktion visade inga relevanta förändringar av Cmax eller AUC för indakaterol. Inte heller sågs någon skillnad i proteinbindningsgrad mellan försökspersoner med lätt eller måttligt nedsatt leverfunktion och friska kontrollpersoner. Inga data finns tillgängliga beträffande försökspersoner med gravt nedsatt leverfunktion.
Mometasonfuroat
I en studie som undersökte administrering av en inhalerad engångsdos på 400 mikrogram mometasonfuroat via pulverinhalator hos försökspersoner med lätt (n=4), måttligt (n=4) och gravt (n=4) nedsatt leverfunktion fick endast 1 eller 2 personer i varje grupp detekterbara maximala plasmanivåer av mometasonfuroat (från 50 till 105 pikogram/ml). De observerade maximala plasmakoncentrationerna verkade öka med funktionsnedsättningens svårighetsgrad, men antalet detekterbara värden (analysens kvantifieringsgräns låg på 50 pikogram/ml) var få.
Andra särskilda populationer
Man såg inga större skillnader i total systemisk exponering (AUC) för de båda substanserna mellan japanska och kaukasiska försökspersoner. För andra etniska grupper eller raser är tillgängliga farmakokinetiska data otillräckliga.
Prekliniska säkerhetsuppgifter
Indakaterol och mometasonfuroat i kombination
Resultaten av de 13 veckor långa toxicitetsstudierna vid inhalation kunde främst hänföras till mometasonfuroatkomponenten och var typiska farmakologiska effekter av glukokortikoider. Ökad hjärtfrekvens på grund av indakaterol sågs hos hund efter administrering av indakaterol/mometasonfuroat eller enbart indakaterol.
Indakaterol
Effekter på hjärtkärlsystemet som kan tillskrivas indakaterols beta2‑agonistiska egenskaper inkluderade takykardi, arytmier och myokardlesioner hos hund. En lätt irritation i näshålan och larynx observerades hos gnagare.
Gentoxicitetsstudier visade ingen mutagen eller klastogen potential.
Karcinogeniciteten utvärderades i en tvåårig studie på råtta och en sexmånadersstudie på transgena möss. Den ökade incidensen av benigna leiomyom och fokal hyperplasi i glatt muskulatur i ovarier hos råtta överensstämde med liknande fynd för andra beta2‑agonister. Inga tecken på karcinogenicitet sågs hos mus.
Alla dessa fynd uppträdde vid exponeringar som var betydligt högre än de som förväntas hos människa.
Efter subkutan administrering till kanin kunde endast biverkningar av indakaterol på dräktighet och embryofetal utveckling visas vid doser som var mer än 500 gånger högre än de som uppnås hos människa vid daglig inhalation av 150 mikrogram (baserat på AUC0-24 h).
Även om indakaterol inte påverkade den allmänna reproduktionsförmågan i en fertilitetsstudie på råtta, observerades en minskning av antalet dräktigheter hos F1‑avkomman i en peri- och postnatal utvecklingsstudie på råtta vid en exponering som var 14 gånger högre än vid behandling med indakaterol hos människa. Indakaterol var inte embryotoxiskt eller teratogent hos råtta eller kanin.
Mometasonfuroat
Alla effekter som observerats är typiska för föreningar i glukokortikoidklassen och beror på förstärkta farmakologiska effekter av glukokortikoider.
Mometasonfuroat hade ingen gentoxisk aktivitet i standardtester in vitro och in vivo.
I karcinogenicitetsstudier på mus och råtta sågs inte någon statistiskt signifikant ökning av tumörincidensen efter inhalation av mometasonfuroat.
Liksom andra glukokortikoider är mometasonfuroat teratogent för gnagare och kanin. Observerade effekter var navelbråck hos råtta, gomspalt hos mus samt agenesi av gallblåsan, navelbråck och krökta framtassar hos kanin. Man såg även minskad viktökning hos moderdjuren, effekter på fostrens tillväxt (lägre kroppsvikt och/eller försenad ossifiering) hos råtta, kanin och mus, samt minskad överlevnad hos avkomman till mus. I studier av reproduktionsfunktionen förlängde subkutant mometasonfuroat 15 mikrogram/kg gestationen och försvårade värkarbetet, vilket ledde till minskad överlevnad och kroppsvikt hos avkomman.
Miljöriskbedömning
Miljöriskbedömningssudier har visat att mometason kan utgöra en risk för ytvatten (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Kapselns innehåll
Laktosmonohydrat
Kapselskal
Gelatin
Tryckbläck
Atectura Breezhaler 125 mikrogram/62,5 mikrogram inhalationspulver, hårda kapslar
Shellack
Briljantblått FCF (E133)
Propylenglykol (E1520)
Titandioxid (E171)
Svart järnoxid (E172)
Atectura Breezhaler 125 mikrogram/127,5 mikrogram inhalationspulver, hårda kapslar
Shellack
Titandioxid (E171)
Svart järnoxid (E172)
Propylenglykol (E1520)
Gul järnoxid (E172)
Ammoniumhydroxid (E527)
Atectura Breezhaler 125 mikrogram/260 mikrogram inhalationspulver, hårda kapslar
Shellack
Svart järnoxid (E172)
Propylenglykol (E1520)
Ammoniumhydroxid (E527)
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 30°C.
Förvaras i originalförpackningen. Ljus- och fuktkänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ATECTURA BREEZHALER inhalaatiojauhe, kapseli, kova
125/127,5 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (38,16 €)
125/260 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (45,23 €)
PF-selosteen tieto
Inhalatorn och dess lock är tillverkade av akrylnitrilbutadienstyren. Sidoknapparna är tillverkade av metylmetakrylat-akrylnitrilbutadienstyren. Nålar och fjädrar är tillverkade av rostfritt stål.
PA/Alu/PVC//Alu perforerat endosblister. Varje blister innehåller 10 hårda kapslar.
Atectura Breezhaler 125 mikrogram/62,5 mikrogram inhalationspulver, hårda kapslar
Förpackning innehållande 10 x 1 eller 30 x 1 hårda kapslar samt 1 inhalator.
Flerpack innehållande 90 (3 förpackningar med 30 x 1) hårda kapslar och 3 inhalatorer.
Flerpack innehållande 150 (15 förpackningar med 10 x 1) hårda kapslar och 15 inhalatorer.
Atectura Breezhaler 125 mikrogram/127,5 mikrogram inhalationspulver, hårda kapslar
Förpackning innehållande 10 x 1 eller 30 x 1 hårda kapslar samt 1 inhalator.
Flerpack innehållande 90 (3 förpackningar med 30 x 1) hårda kapslar och 3 inhalatorer.
Flerpack innehållande 150 (15 förpackningar med 10 x 1) hårda kapslar och 15 inhalatorer.
Atectura Breezhaler 125 mikrogram/260 mikrogram inhalationspulver, hårda kapslar
Förpackning innehållande 10 x 1 eller 30 x 1 hårda kapslar samt 1 inhalator.
Flerpack innehållande 90 (3 förpackningar med 30 x 1) hårda kapslar och 3 inhalatorer.
Flerpack innehållande 150 (15 förpackningar med 10 x 1) hårda kapslar och 15 inhalatorer.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Atectura Breezhaler 125 mikrogram/62,5 mikrogram inhalationspulver, hårda kapslar
Transparent kapsel innehållande ett vitt pulver, med produktkoden ”IM150‑80” tryckt med blått ovanför ett blått streck på underdelen och produktlogotypen tryckt med blått omgivet av två blå streck på överdelen.
Atectura Breezhaler 125 mikrogram/127,5 mikrogram inhalationspulver, hårda kapslar
Transparent kapsel innehållande ett vitt pulver, med produktkoden ”IM150‑160” tryckt med grått på underdelen och produktlogotypen tryckt med grått på överdelen.
Atectura Breezhaler 125 mikrogram/260 mikrogram inhalationspulver, hårda kapslar
Transparent kapsel innehållande ett vitt pulver, med produktkoden ”IM150‑320” tryckt med svart ovanför två svarta streck på underdelen och produktlogotypen tryckt med svart omgivet av två svarta streck på överdelen.
Särskilda anvisningar för destruktion och övrig hantering
Inhalatorn som medföljer varje ny förpackning ska användas. När förpackningen är slut ska den inhalator som medföljde i förpackningen kasseras.
Detta läkemedel kan utgöra en risk för miljön (se avsnitt Prekliniska säkerhetsuppgifter).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
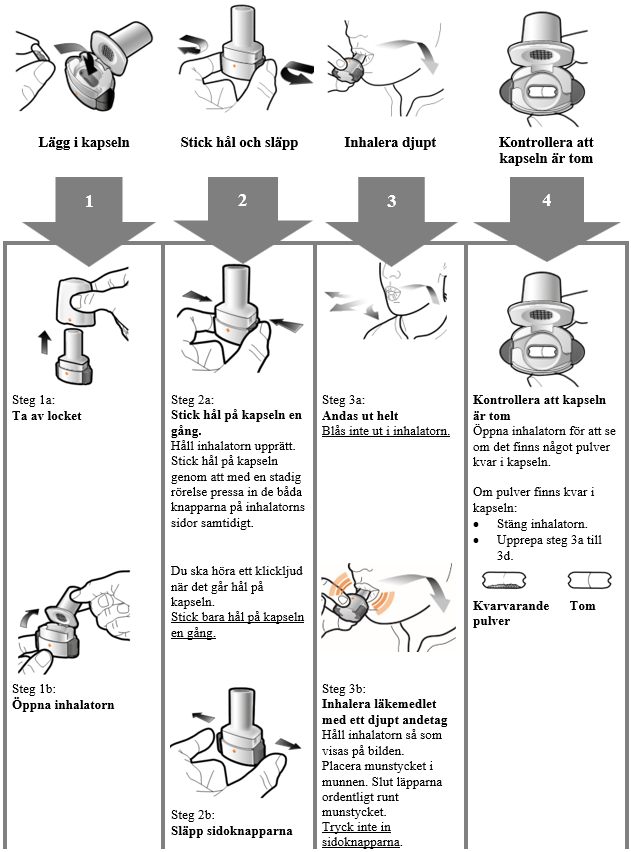
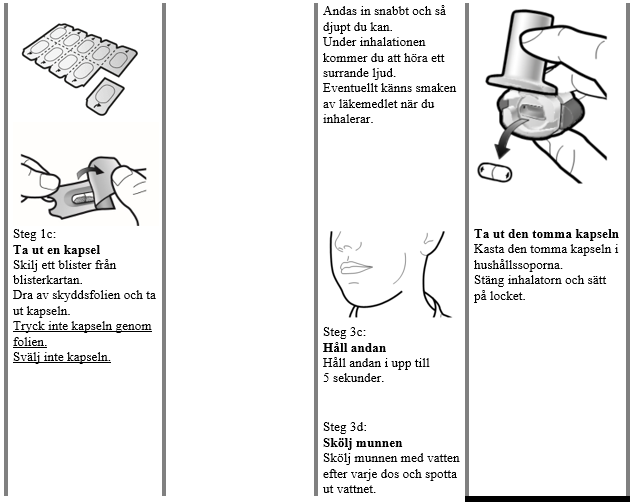
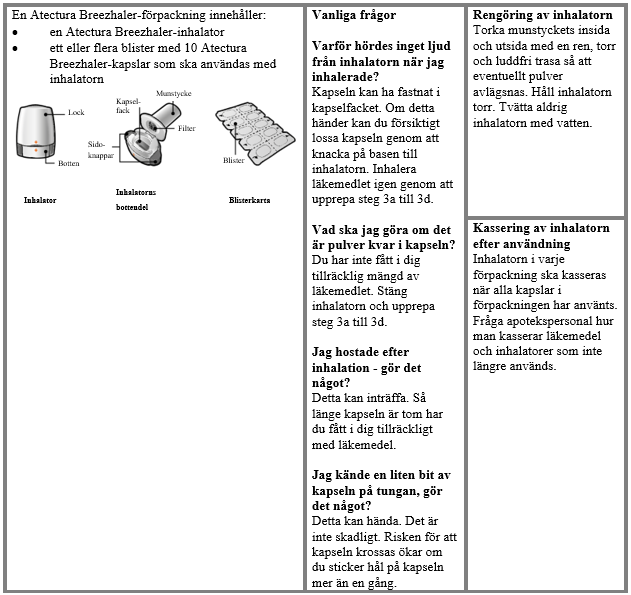
Anvisningar för användning och hantering
Läs igenom hela Bruksanvisningen innan Atectura Breezhaler används.

Ersättning
ATECTURA BREEZHALER inhalaatiojauhe, kapseli, kova
125/127,5 mikrog 30 x 1 fol
125/260 mikrog 30 x 1 fol
- Ei korvausta.
Atc-kod
R03AK14
Datum för översyn av produktresumén
20.11.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
