BAQSIMI nenäjauhe, kerta-annospakkaus 3 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Tietoa harjoittelulaitteesta
Potilasohje
Vaikuttavat aineet ja niiden määrät
Yksi kerta-annospakkaus nenäjauhetta sisältää 3 mg glukagonia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Nenäjauhe, kerta-annospakkaus.
Kliiniset tiedot
Käyttöaiheet
Baqsimi on tarkoitettu vaikean hypoglykemian hoitoon aikuisille, nuorille ja 4 vuotta täyttäneille lapsille, joilla on diabetes mellitus.
Annostus ja antotapa
Annostus
Aikuiset, nuoret ja 4 vuotta täyttäneet lapset
Suositeltu annos on 3 mg glukagonia yhteen sieraimeen.
Iäkkäät potilaat
Annosta ei tarvitse muuttaa iän perusteella.
Valmisteen tehosta ja turvallisuudesta 65 vuotta täyttäneillä potilailla on vain rajallisesti tietoa, ja tietoja 75 vuotta täyttäneistä potilaista ei ole.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa munuaisten toiminnan perusteella.
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa maksan toiminnan perusteella.
Pediatriset potilaat, ikä 0 – < 4 vuotta
Baqsimi-valmisteen turvallisuutta ja tehoa 0 – < 4 vuoden ikäisten imeväisten ja lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Annostelu ainoastaan nenään. Glukagoninenäjauhe annetaan yhteen sieraimeen. Glukagoni imeytyy passiivisesti nenän limakalvon läpi. Sisäänhengitys tai syvä hengenveto lääkkeen antamisen jälkeen ei ole tarpeen.
Potilaille ja heistä huolehtiville henkilöille pitää kertoa, mitkä ovat vaikea-asteisen hypoglykemian merkkejä ja oireita. Vaikea-asteisesta hypoglykemiasta toipuminen edellyttää muiden apua, joten potilasta pitää kehottaa kertomaan läheisilleen Baqsimi-hoidosta ja pakkausselosteen tiedoista. Kun vaikea-asteinen hypoglykemia on tunnistettu, Baqsimi-valmistetta pitää antaa mahdollisimman pian. Potilasta tai hänestä huolehtivaa henkilöä pitää kehottaa lukemaan pakkausseloste. Seuraavia ohjeita on syytä korostaa:
Glukagoninenäjauheen anto-ohjeet
- Poista suojapäällyste vetämällä punaisesta nauhasta.
- Ota kerta-annospakkaus kotelosta. Älä paina annospainiketta ennen kuin olet valmis antamaan annoksen.
- Pitele kerta-annospakkausta peukalon ja kahden sormen välissä. Älä kokeile ennen käyttöä, koska pakkaus sisältää vain yhden glukagoniannoksen, eikä sitä voida käyttää uudelleen.
- Vie kerta-annospakkauksen kärki hellävaraisesti toiseen sieraimeen, kunnes sormesi koskettaa nenän ulkopintaa.
- Paina annospainike pohjaan. Annos on kokonaan annettu, kun vihreä viiva ei ole enää näkyvissä.
- Jos potilas on tajuton, käännä hänet kylkiasentoon tukehtumisen estämiseksi.
- Annoksen antamisen jälkeen on heti soitettava hätänumeroon.
- Kun potilas on saanut hoidosta vasteen, anna hänelle hiilihydraatteja suun kautta, jotta maksan glykogeenivarastot täydentyvät ja estetään hypoglykemian uusiutuminen.
Ks. varoitukset ja käyttöön liittyvät varotoimet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Feokromosytooma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Feokromosytooma
Jos potilaalla on feokromosytooma, glukagoni voi stimuloida katekoliamiinien vapautumista kasvaimesta. Jos potilaan verenpaine suurenee voimakkaasti, epäselektiivisen α‑adrenergisen salpauksen on osoitettu alentavan verenpainetta tehokkaasti. Baqsimi on vasta-aiheinen potilaille, joilla on feokromosytooma (ks. kohta Vasta-aiheet).
Insulinooma
Potilailla, joilla on insulinooma, glukagonin antaminen voi aluksi suurentaa veren glukoosipitoisuutta. Glukagonin antaminen voi kuitenkin suoraan tai epäsuorasti (alkuvaiheen veren glukoosipitoisuuden suurenemisen kautta) stimuloida liiallista insuliinineritystä insulinoomasta ja johtaa hypoglykemiaan. Potilaalle, jolle kehittyy hypoglykemiaoireita glukagoniannoksen jälkeen, on annettava glukoosia suun kautta tai laskimoon.
Yliherkkyys ja allergiset reaktiot
Allergisia reaktioita, joita on ilmoitettu injisoitavan glukagonin annostelun yhteydessä, voi ilmetä myös tätä valmistetta käytettäessä. Allergisiin reaktioihin kuuluvat yleistynyt ihottuma ja joissakin tapauksissa anafylaktinen sokki, johon liittyy hengitysvaikeuksia ja hypotensio. Jos potilaalla on hengitysvaikeuksia, soita välittömästi hätänumeroon.
Glykogeenivarastot ja hypoglykemia
Glukagoni on tehokas hypoglykemian hoidossa vain, jos maksassa on riittävästi glykogeenia. Glukagonista on vain vähän tai ei lainkaan apua, jos kyseessä on nälkiintyminen, lisämunuaisten vajaatoiminta, krooninen alkoholin väärinkäyttö tai krooninen hypoglykemia, joten näitä tiloja on hoidettava glukoosilla.
Jotta estetään hypoglykemian uusiutuminen, potilaalle on annettava hiilihydraatteja suun kautta maksan glykogeenivarastojen täydentämiseksi, kun potilas on saanut hoidosta vasteen.
Yhteisvaikutukset
Interaktiotutkimuksia ei ole tehty.
Insuliini
Insuliini toimii glukagonin vastavaikuttajana.
Indometasiini
Indometasiinin kanssa käytettynä glukagoni ei välttämättä pysty suurentamaan veren glukoosipitoisuutta, tai se voi jopa aiheuttaa hypoglykemiaa.
Beetasalpaajat
Beetasalpaajia käyttävillä potilailla sekä syketiheyden että verenpaineen voidaan odottaa suurentuvan tavallista enemmän. Tämä on kuitenkin ohimenevää, sillä glukagonin puoliintumisaika on lyhyt.
Glukagonihoito johtaa katekoliamiinien vapautumiseen lisämunuaisista, ja samanaikainen beetasalpaajien käyttö voi johtaa yksipuoliseen alfa-adrenergiseen stimulaatioon ja siten voimakkaampaan verenpaineen suurenemiseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varfariini
Glukagoni saattaa voimistaa varfariinin antikoagulanttivaikutusta.
Raskaus ja imetys
Raskaus
Glukagoninenäjauheen vaikutusta lisääntymiseen tai hedelmällisyyteen ei ole tutkittu eläimillä.
Baqsimi-valmistetta voidaan käyttää raskauden aikana. Glukagoni ei läpäise istukkaa ihmisellä. Glukagonin käyttöä on ilmoitettu raskaana olevilla diabetesta sairastavilla naisilla, eikä raskauden kululle tai sikiön ja vastasyntyneen lapsen terveydelle haitallisia vaikutuksia ole tiedossa.
Imetys
Baqsimi-valmistetta voidaan käyttää imetyksen aikana. Glukagoni poistuu verenkierrosta hyvin nopeasti, joten vaikean hypoglykemiareaktion hoidon jälkeen imettävän äidin maitoon erittyvä määrä on odotettavasti erittäin pieni. Glukagoni hajoaa ruoansulatuskanavassa eikä voi imeytyä muuttumattomassa muodossa, joten se ei aiheuta lapselle minkäänlaisia metabolisia vaikutuksia.
Hedelmällisyys
Glukagoninenäjauheella ei ole tehty hedelmällisyystutkimuksia.
Rotilla tehdyt tutkimukset ovat osoittaneet, ettei glukagoni heikennä hedelmällisyyttä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Baqsimi-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Hypoglykemia, joka voi jatkua lyhyen aikaa hoidon jälkeen, saattaa heikentää potilaan keskittymis- ja reaktiokykyä. Tämä voi olla vaarallista tilanteissa, joissa nämä kyvyt ovat erityisen tärkeitä (kuten autolla ajettaessa tai käytettäessä koneita).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitetut haittavaikutukset ovat lisääntynyt kyynelnesteen eritys (36 %), ylähengitysteiden ärsytys (34 %), pahoinvointi (27 %), päänsärky (21 %) ja oksentelu (16 %).
Haittavaikutustaulukko
Haittavaikutukset luetellaan taulukossa 1 MedDRA-termeillä elinjärjestelmäluokan ja yleisyyden mukaan. Kunkin haittavaikutuksen kohdalla mainittava yleisyysluokka perustuu seuraavaan käytäntöön: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000).
Taulukko 1. Glukagoninenäjauheen haittavaikutusten yleisyys
| Elinjärjestelmäluokka | Hyvin yleinen | Yleinen | Melko harvinainen |
| Hermosto | Päänsärky | Dysgeusia | |
| Silmät | Lisääntynyt kyynelnesteen eritys | Silmien verekkyys Silmien kutina | |
| Hengityselimet, rintakehä ja välikarsina | Ylähengitysteiden ärsytysa | ||
| Ruoansulatuselimistö | Oksentelu Pahoinvointi | ||
| Iho ja ihonalainen kudos | Kutina | ||
| Tutkimukset | Systolisen verenpaineen suureneminenb Diastolisen verenpaineen suureneminenb | Sykkeen nopeutuminenb |
a Ylähengitysteiden ärsytys: voimakas nuha, epämukava tunne nenässä, nenän tukkoisuus, nenän kutina, aivastelu, nielun ärsytys, yskä, nenäverenvuoto ja parosmia
bSyketiheyden ja verenpaineen suureneminen: vitaalitoimintojen mittauksen perusteella. Yleisyydet perustuvat muutoksiin hoitoa edeltävistä arvoista hoidon jälkeisiin arvoihin.
Immunogeenisuus
Hoidon aikana kehittyi vasta-aineita glukagonille yhteensä 5,6 %:lle potilaista. Nämä vasta-aineet eivät olleet neutraloivia, eivätkä ne heikentäneet glukagonihoidon tehoa tai liittyneet hoidon aikana ilmenneiden haittavaikutusten kehittymiseen.
Pediatriset potilaat
Kliinisten tutkimusten tietojen perusteella haittavaikutusten yleisyyden, tyypin ja vaikeusasteen voidaan odottaa olevan samanlaisia vähintään 4‑vuotiailla lapsilla kuin aikuisillakin.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Yliannostus voi aiheuttaa pahoinvointia, oksentelua, ruoansulatuskanavan motiliteetin estymistä, verenpaineen suurenemista ja syketiheyden nousua. Epäillyissä yliannostustapauksissa seerumin kaliumpitoisuus voi pienentyä, ja sitä on seurattava ja tarvittaessa korjattava. Jos potilaan verenpaine suurenee rajusti, epäselektiivisen α‑adrenergisen salpauksen on osoitettu alentavan verenpainetta tehokkaasti tarvittavan lyhyen ajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: haiman hormonit, glykogenolyyttiset hormonit, ATC-koodi: H04AA01
Vaikutusmekanismi
Glukagoni suurentaa veren glukoosipitoisuutta aktivoimalla maksan glukagonireseptoreja ja stimuloimalla siten glykogeenin hajoamista ja glukoosin vapautumista maksasta. Jotta glukagoni voisi saada aikaan antihypoglykeemisen vaikutuksen, maksassa on oltava glykogeenivarastoja.
Farmakodynaamiset vaikutukset
Sukupuolella ja painolla ei ollut kliinisesti merkittävää vaikutusta glukagoninenäjauheen farmakodynamiikkaan.
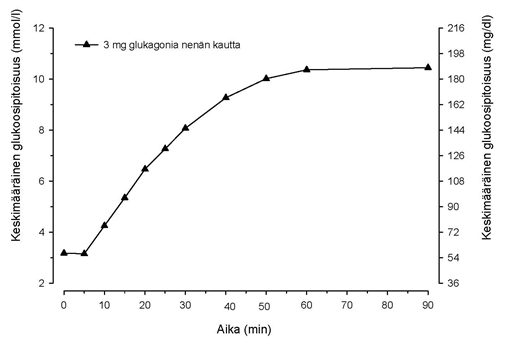
Kun tyypin 1 diabetesta sairastaville aikuispotilaille annosteltiin 3 mg glukagoninenäjauhetta, glukoosipitoisuudet alkoivat nousta jo 5 minuutin kuluttua (ks. kuva 1). 10 minuutin kuluttua glukoosipitoisuuden mediaani oli yli 3,9 mmol/l (70 mg/dl). Glukoosipitoisuuden keskimääräinen enimmäisnousu oli 7,8 mmol/l (140 mg/dl).
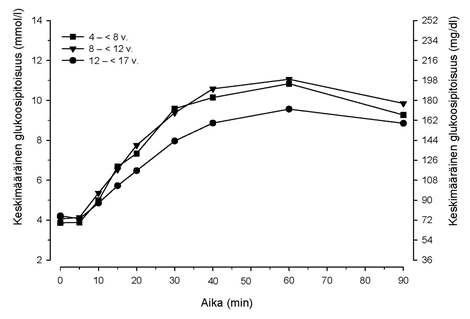
Kun tyypin 1 diabetesta sairastaville lapsipotilaille (ikä 4 – < 17 vuotta) annosteltiin 3 mg glukagoninenäjauhetta, glukoosipitoisuudet alkoivat nousta jo 5 minuutin kuluttua (ks. kuva 2), ja glukoosipitoisuuden keskimääräinen enimmäisnousu oli 5,7–7,7 mmol/l (102–138 mg/dl).
Nuhakuume ja nenän tukkoisuus eivät vaikuttaneet glukagoninenäjauheen farmakodynamiikkaan, riippumatta samanaikaisesta tukkoisuutta lievittävän valmisteen käytöstä.
Kuva 1. Keskimääräinen glukoosipitoisuus ajan myötä aikuispotilailla, joilla on tyypin 1 diabetes
Kuva 2. Keskimääräinen glukoosipitoisuus ajan myötä lapsipotilailla, joilla on tyypin 1 diabetes
Kliininen teho
Aikuisilla toteutettu avaintutkimus oli satunnaistettu, avoin, 2-jaksoinen vaihtovuoroinen monikeskustutkimus, johon osallistuneilla aikuispotilailla oli tyypin 1 diabetes tai tyypin 2 diabetes. Ensisijainen tavoite oli verrata 3 mg glukagoninenäjauheen tehoa lihakseen annetun 1 mg glukagoniannoksen tehoon aikuispotilailla, joilla oli tyypin 1 diabetes. Veren glukoosipitoisuus pienennettiin hypoglykemia-alueelle insuliinin avulla, ja tavoiteltu glukoosipitoisuuden matalin arvo oli < 2,8 mmol/l (< 50 mg/dl).
Avaintutkimukseen otettiin yhteensä 83 potilasta, jotka olivat iältään 18 – < 65 vuotta. Potilaista 77 sairasti tyypin 1 diabetesta, ja heidän ikäkeskiarvonsa oli 32,9 vuotta ja diabeteksen keskimääräinen kesto 18,1 vuotta. Näistä potilaista 45 (58 %) oli naisia. Tyypin 2 diabetesta sairastaneiden potilaiden (n=6) ikäkeskiarvo oli 47,8 vuotta ja diabeteksen keskimääräinen kesto 18,8 vuotta. Näistä potilaista 4 (67 %) oli naisia.
Ensisijainen tehon päätetapahtuma oli niiden potilaiden osuus, joilla hoito onnistui. Määritelmänä oli joko veren glukoosipitoisuuden nousu tasolle ≥ 3,9 mmol/l (≥ 70 mg/dl) tai ≥ 1,1 mmol/l (≥ 20 mg/dl) nousu glukoosipitoisuuden matalimmasta arvosta 30 minuutin kuluessa tutkimusglukagonivalmisteen saamisesta ilman muita veren glukoosipitoisuutta nostavia toimenpiteitä. Glukoosipitoisuuden matalimman arvon määritelmänä oli pienin mitattu glukoosiarvo glukagonin annostelun aikana tai 10 minuutin kuluessa sen jälkeen.
Tyypin 1 diabetesta sairastavilla veren glukoosipitoisuuden matalimman arvon keskiarvo oli glukagoninenäjauheryhmässä 2,5 mmol/l (44,2 mg/dl) ja lihakseen annetun glukagonin ryhmässä 2,7 mmol/l (48,9 mg/dl). Baqsimi-valmisteen osoitettiin olevan insuliinin aiheuttaman hypoglykemian korjaamisessa vähintään samanarvoinen kuin lihakseen annettu glukagoni: glukagoninenäjauhehoitoa saaneista 98,7 %:lla ja lihakseen annettua glukagonia saaneista 100 %:lla hoito onnistui 30 minuutin kuluessa (ks. taulukko 2). Hoidon onnistumiskriteeri glukoosipitoisuuden suhteen täyttyi kaikkien potilaiden kohdalla 40 minuutin kuluessa. Kaikilla tyypin 2 diabetesta sairastavilla potilailla (100 %) hoito onnistui 30 minuutin kuluessa.
Keskimääräinen aika hoidon onnistumiseen oli glukagoninenäjauheryhmässä 16,2 minuuttia ja 1 mg lihakseen annettavan glukagonin ryhmässä 12,2 minuuttia. Hoidon onnistumiseen kulunut aika tarkoittaa aikaa, joka kului glukagonin antamisesta hoidon onnistumiseen; verrokkiryhmässä lihakseen annettavan pistoksen käyttökuntoon saattamiseen ja valmisteluun kulunutta aikaa ei otettu huomioon.
30 minuutin kuluttua glukagonin annon jälkeen hypoglykemian oireet olivat lievittyneet glukagoninenäjauheryhmässä yhtä paljon kuin lihakseen annettavan glukagonin ryhmässä, Edinburgh Hypoglycaemia Symptom Questionnaire -kyselylomakkeella arvioituna.
Taulukko 2. Avaintutkimuksen potilaat, joilla hoidon onnistuminen ja muut glukoosikriteerit täyttyivät
| Tyypin 1 diabetes (n=75)a | Tyypin 1 ja tyypin 2 diabetes (n=80)a | |||
| glukagoninenäjauhe 3 mg | glukagoni lihakseen 1 mg | glukagoninenäjauhe 3 mg | glukagoni lihakseen 1 mg | |
| Hoidon onnistuminen - n (%) | 74 (98,7 %) | 75 (100 %) | 79 (98,8 %) | 80 (100 %) |
Hoitojen välinen ero (2-tahoinen 95 % luottamusväli)b,c | 1,3 % (-3,8 %, 7,2 %) | 1,3 % (-3,6 %, 6,8 %) | ||
| Glukoosikriteeri täyttyi - n (%)d | ||||
| (i) ≥ 3,9 mmol/l (≥ 70 mg/dl) | 72 (97 %) | 74 (99 %) | 77 (97 %) | 79 (99 %) |
| (ii) ≥ 1,1 mmol/l (≥ 20 mg/dl) nousu matalimmasta arvosta | 74 (100 %) | 75 (100 %) | 79 (100 %) | 80 (100 %) |
| Sekä (i) että (ii) | 72 (97 %) | 74 (99 %) | 77 (97 %) | 79 (99 %) |
a Tehoanalyysipopulaatio koostui kaikista potilaista, jotka saivat molemmat tutkimuslääkeannokset ja joiden kohdalla ensisijainen päätetapahtuma voitiin arvioida.
b Eron laskutapa: (niiden potilaiden prosenttiosuus, joilla lihakseen annettu glukagonihoito onnistui) – (niiden potilaiden prosenttiosuus, joilla nenäjauheena annettu glukagoni-hoito onnistui).
c 2-tahoinen 95 % luottamusväli (lv), täsmällisiin häntäalueisiin perustuva ehdoton profiiliuskottavuusmenetelmä; vähintään samanarvoisuuden raja-arvo = 10 %.
d Prosenttiosuus perustuu niiden potilaiden määrään, joilla hoito onnistui.
Tutkimusasetelmaltaan samanlaiseen kliiniseen vahvistavaan tutkimukseen otettiin mukaan 70 potilasta, joilla oli tyypin 1 diabetes. Potilaiden ikäkeskiarvo oli 41,7 vuotta (20–64 v.) ja diabeteksen keskimääräinen kesto oli 19,8 vuotta. Potilaista 27 (39 %) oli naisia. Veren glukoosipitoisuus pienennettiin insuliinin avulla tasolle < 3,3 mmol/l (< 60 mg/dl).
Veren glukoosipitoisuuden matalimman arvon keskiarvo oli glukagoninenäjauheryhmässä 3 mmol/l (54,2 mg/dl) ja lihakseen annetun glukagonin ryhmässä 3,1 mmol/l (55,7 mg/dl). Glukagoninenäjauheen osoitettiin olevan insuliinin aiheuttaman hypoglykemian korjaamisessa vähintään samanarvoinen kuin lihakseen annettu glukagoni: glukagoninenäjauhehoitoa saaneista 100 %:lla ja lihakseen annettua glukagonia saaneista 100 %:lla hoito onnistui (ks. taulukko 3). Hoidon onnistumiseen kuluneen ajan keskiarvo oli glukagoninenäjauheryhmässä 11,4 minuuttia ja 1 mg lihakseen annettavan glukagonin ryhmässä 9,9 minuuttia.
Taulukko 3. Vahvistavan tutkimuksen potilaat, joilla hoidon onnistuminen ja muut glukoosikriteerit täyttyivät
| Tyypin 1 diabetes (n = 66)a | ||
glukagoninenäjauhe 3 mg | glukagoni lihakseen 1 mg | |
| Hoidon onnistuminen – n (%) | 66 (100 %) | 66 (100 %) |
| Hoitojen välinen ero (2-tahoinen 95 % luottamusväli) b,c | 0 % (-5,4 %, 5,4 %) | |
| Glukoosikriteeri täyttyi – n (%) | ||
(i) ≥ 3,9 mmol/l (≥ 70 mg/dl) (ii) ≥ 1,1 mmol/l (≥ 20 mg/dl) suureneminen matalin arvosta Sekä (i) että (ii) | 66 (100 %) 66 (100 %) 66 (100 %) | 66 (100 %) 66 (100 %) 66 (100 %) |
a Tehoanalyysipopulaatio koostui kaikista potilaista, jotka saivat molemmat tutkimuslääkeannokset ja joiden kohdalla ensisijainen päätetapahtuma voitiin arvioida.
b Eron laskutapa: (niiden potilaiden prosenttiosuus, joilla lihakseen annettu glukagonihoito onnistui) – (niiden potilaiden prosenttiosuus, joilla nenäjauheena annettu glukagoni-hoito onnistui); vähintään samanarvoisuuden raja-arvo = 10 %.
c 2-tahoinen 95 % luottamusväli (lv), täsmällisiin häntäalueisiin perustuva ehdoton profiiliuskottavuusmenetelmä.
Aikuisilla tehty todellista käyttöä seurannut tutkimus kesti noin 6 kuukautta. Tutkimuksessa 129 potilaalle (ikäkeskiarvo 46,6 v.; vaihteluväli 18–71 v.), joilla oli tyypin 1 diabetes, ja heistä huolehtiville henkilöille toimitettiin glukagoninenäjauhetta keskivaikeiden tai vaikeiden, kotona tai työympäristössä tapahtuvien hypoglykemiatapahtumien hoitoon. Tehoanalyysiin otettiin yhteensä 157 keskivaikeaa tai vaikeaa hypoglykemiatapahtumaa 69 potilaan ilmoittamana. Vaikeaksi hypoglykemiatapahtumaksi määriteltiin tapahtuma, jossa diabetesta sairastava henkilö on kliinisesti toimintakyvytön (tajuttomuus, kouristuskohtaukset, vaikea desorientaatio) siinä määrin, että hän tarvitsee jonkun toisen apua hypoglykemian hoitoon. Keskivaikeaksi hypoglykemiatapahtumaksi määriteltiin tapahtuma, jossa diabetesta sairastavalla henkilöllä oli neuroglykopenian oireita (heikotus, puhevaikeus, kahtena näkeminen, uneliaisuus, keskittymisvaikeus, näön hämärtyminen, ahdistuneisuus, nälkä, väsymys tai sekavuus) ja verensokerimittarin lukema noin 60 mg/dl (3,3 mmol/l) tai vähemmän. Näistä tapahtumista 151:ssä (96,2 %) potilas heräsi tai hänen tilansa normalisoitui 30 minuutin kuluessa glukagoninenäjauheen annostelun jälkeen. Kaikissa 12 vaikeassa hypoglykemiatapauksessa (100 %) potilas palasi tajuihinsa, kouristuskohtaukset loppuivat (7 tapahtumaa 4 potilaalla, joilla oli kouristuskohtauksia ennen glukagoninenäjauheen antoa) tai potilaan tila normalisoitui 5–15 minuutin kuluessa glukagoninenäjauheen annostelun jälkeen.
Pediatriset potilaat
Pediatrisilla potilailla toteutettu avaintutkimus oli satunnaistettu, kliininen monikeskustutkimus, jossa arvioitiin glukagoninenäjauhetta verrattuna lihakseen annettuun glukagoniin lapsilla ja nuorilla, joilla oli tyypin 1 diabetes. Glukagonia annettiin sen jälkeen, kun glukoosipitoisuus saavutti tason < 4,4 mmol/l (< 80 mg/dl) annostelupäivänä. Tehoa arvioitiin niiden potilaiden prosenttiosuutena, joilla glukoosipitoisuus nousi matalimmasta arvosta ≥ 1,1 mmol/l (≥ 20 mg/dl) 30 minuutin kuluessa glukagonin annostelun jälkeen.
Tutkimukseen otettiin 48 potilasta, jotka saivat vähintään yhden annoksen tutkimuslääkevalmistetta. Pienten lasten ryhmässä (4 – < 8 v.) ikäkeskiarvo oli 6,5 vuotta. Lasten ryhmässä (8 – < 12 v.) ikäkeskiarvo oli 11,1 v, ja nuorten ryhmässä (12 – < 17 v.) 14,6 vuotta. Populaatio koostui lähinnä valkoihoisista pojista kaikissa ikäryhmissä.
Kaikissa ikäryhmissä 3 mg glukagoninenäjauheella ja lihakseen annetulla glukagonilla (alle 25 kg painoisille lapsille 0,5 mg ja vähintään 25 kg painaville lapsille 1 mg) saavutettu glykeeminen vaste oli samankaltainen. Kaikilla (100 %) kummankin hoitoryhmän potilailla ja kaikissa ikäryhmissä glukoosipitoisuus nousi matalimmasta arvosta ≥ 1,1 mmol/l (≥ 20 mg/dl) 20 minuutin kuluessa glukagonin annon jälkeen.
Keskimääräinen aika, jonka kuluessa saavutettiin glukoosipitoisuuden nousu ≥ 1,1 mmol/l (≥ 20 mg/dl), oli glukagoninenäjauheryhmässä ja lihakseen annetun glukagonin ryhmässä samaa luokkaa kaikissa ikäryhmissä (ks. taulukko 4).
Taulukko 4.Keskimääräinen aika, jonka kuluessa saavutettiin glukoosipitoisuuden nousu ≥ 1,1 mmol/l (≥ 20 mg/dl) matalimmasta arvosta pediatrisessa avaintutkimuksessa
| Nousu matalimmasta arvosta | Keskimääräinen aika glukagonin annon jälkeen (minuuttia) | |||||
| Pienet lapset (4 – < 8-vuotiaat) | Lapset (8 – < 12-vuotiaat) | Nuoret (12 – < 17-vuotiaat) | ||||
| glukagoni lihakseena n = 6 | glukagoninenäjauhe 3 mg n = 12 | glukagoni lihakseena n = 6 | glukagoninenäjauhe 3 mg n = 12 | glukagoni lihakseena n = 12 | glukagoninenäjauhe 3 mg n = 12 | |
| ≥ 1,1 mmol/l (≥ 20 mg/dl) | 10,0 | 10,8 | 12,5 | 11,3 | 12,5 | 14,2 |
a 0,5 mg tai 1 mg glukagonia lihakseen (painon perusteella)
Lapsilla tehty todellista käyttöä seurannut tutkimus kesti noin 6 kuukautta. Tutkimuksessa 26 potilaalle, joilla oli tyypin 1 diabetes (4 – < 18-vuotiaiden ikäryhmä; ikäkeskiarvo 11,7 v.; vaihteluväli 5–17 v.), ja heistä huolehtiville henkilöille toimitettiin 3 mg glukagoninenäjauhetta keskivaikeiden, myös merkittävien, kotona tai koulussa tapahtuvien hypoglykemiatapahtumien hoitoon. Tehoanalyysiin otettiin yhteensä 33 keskivaikeaa hypoglykemiatapahtumaa 14 potilaan ilmoittamana. Merkittävän hypoglykemiatapahtuman määritelmänä oli neuroglykopeniaoireita ja glukoosipitoisuus alle 50 mg/dl (2,8 mmol/l). Keskivaikean hypoglykemiatapahtuman määritelmänä oli diabetesta sairastava lapsi/nuori, jolla on neuroglykopenian oireita ja/tai löydöksiä ja veren glukoosipitoisuus ≤ 70 mg/dl (3,9 mmol/l). Kaikissa tapahtumissa, myös merkittävissä hypoglykemiatapahtumissa (8 tapahtumaa 5 potilaalla) potilaiden tila normalisoitui 5–30 minuutin kuluessa glukagoninenäjauheen annostelun jälkeen.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Baqsimi-valmisteen käytöstä yhden tai useamman pediatrisen potilasryhmän hoidossa vaikean hypoglykemian hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Nenän kautta imeytyneen glukagonin huippupitoisuus plasmassa oli 6 130 pg/ml (keskiarvo), ja se saavutettiin 15 minuutin kuluttua.
Jakautuminen
Nenän kautta annetun glukagonin näennäinen jakautumistilavuus oli noin 885 l.
Biotransformaatio
Glukagonin tiedetään hajoavan maksassa, munuaisissa ja plasmassa.
Eliminaatio
Nenän kautta annetun glukagonin puoliintumisajan keskiarvo oli noin 38 minuuttia.
Munuaisten vajaatoiminta
Muodollisia munuaisten vajaatoimintaa arvioivia tutkimuksia ei ole tehty.
Maksan vajaatoiminta
Muodollisia maksan vajaatoimintaa arvioivia tutkimuksia ei ole tehty.
Pediatriset potilaat
Pediatrisilla potilailla (ikä 4 – < 17 vuotta) nenän kautta imeytyneen glukagonin huippupitoisuus plasmassa saavutettiin 15–20 minuutin kuluttua (keskiarvo).
Nuhakuume ja tukkoisuutta lievittävän valmisteen käyttö
Nuhakuume ja nenän tukkoisuus eivät vaikuttaneet nenän kautta otetun valmisteen farmakokinetiikkaan, riippumatta samanaikaisesta tukkoisuutta lievittävän valmisteen käytöstä.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Beetadeksi (E459)
Dodekyylifosfokoliini
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Säilytä alle 30 °C.
Säilytä kerta-annospakkaus suojapäällysteisessä kotelossa käyttöön asti suojassa kosteudelta.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BAQSIMI nenäjauhe, kerta-annospakkaus
3 mg (L:ei) 1 annos (129,21 €)
PF-selosteen tieto
Kerta-annospakkaus koostuu polyeteenistä ja polypropeenista. Suojapäällysteinen kotelo koostuu polyeteenistä ja polypropeenista ja sisältää kuivausainetta.
Pakkauskoot: 1 tai 2 kerta-annospakkausta. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai melkein valkoinen jauhe.
Käyttö- ja käsittelyohjeet
Käsittely
Tämä on käyttövalmis lääkevalmiste, vain yhtä käyttökertaa varten.
Kerta-annospakkaus sisältää vain yhden annoksen, eikä sitä siis pidä valmistella eikä kokeilla ennen käyttöä.
Pakkausselosteen mukana olevia lääkevalmisteen käyttöohjeita on noudatettava tarkoin.
Jos kotelo on avattu, kerta-annospakkaus saattaa olla altistunut kosteudelle. Tällöin lääkevalmiste ei välttämättä tehoa odotetulla tavalla. Tarkista kotelo ja suojapäällyste säännöllisesti. Jos kotelo on avattu, vaihda lääkevalmiste uuteen.
Hävittäminen
Hävitä nenän kautta annettavan glukagonin kerta-annospakkaus ja kotelo käytön jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BAQSIMI nenäjauhe, kerta-annospakkaus
3 mg 1 annos
- Ei korvausta.
ATC-koodi
H04AA01
Valmisteyhteenvedon muuttamispäivämäärä
22.08.2024
Yhteystiedot
Orient Plads 1
2150 Nordhavn
Denmark
info@oresundpharma.com
