BAQSIMI näspulver i endosbehållare 3 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Tietoa harjoittelulaitteesta
Potilasohje
Kvalitativ och kvantitativ sammansättning
En endosbehållare avger näspulver innehållande 3 mg glukagon.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Näspulver, i endosbehållare (näspulver)
Kliniska uppgifter
Terapeutiska indikationer
Baqsimi är avsett för behandling av svår hypoglykemi hos vuxna, ungdomar och barn från 4 års ålder med diabetes mellitus.
Dosering och administreringssätt
Dosering
Vuxna, ungdomar och barn från 4 års ålder
Den rekommenderade dosen är 3 mg glukagon i ena näsborren.
Äldre
Ingen dosjustering krävs baserat på ålder.
Säkerhets- och effektdata är mycket begränsade för patienter i åldern 65 år och saknas helt för patienter 75 år och äldre.
Nedsatt njurfunktion
Ingen dosjustering behövs baserat på njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering behövs baserat på leverfunktion.
Pediatrisk population i åldern 0 till <4 år
Säkerhet och effekt för Baqsimi för spädbarn och barn i åldern 0 till <4 år har ännu inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Endast nasal användning. Glukagon näspulver ges i ena näsborren. Glukagon absorberas passivt genom nässlemhinnan. Patienten behöver inte andas in eller andas djupt efter doseringen.
Patienter och deras vårdgivare bör rådgivas om tecken och symtom på allvarlig hypoglykemi. Eftersom allvarlig hypoglykemi kräver hjälp av andra för att man ska återhämta sig, bör patienten rådgivas om att informera sin omgivning om Baqsimi och dess bipacksedel. Baqsimi bör administreras så snart som möjligt när allvarlig hypoglykemi identifieras. Patienten eller vårdgivaren bör rådgivas att läsa bipacksedeln. Följande instruktioner bör framhävas:
Anvisningar för administrering av glukagon näspulver
- Ta bort plastförseglingen genom att dra i den röda remsan.
- Ta upp endosbehållaren ur inre förpackningen. Tryck inte in kolven förrän det är dags att ge dosen.
- Håll endosbehållaren mellan fingrar och tumme. Testa den inte före användningen eftersom den endast innehåller en dos glukagon och inte kan återanvändas.
- För försiktigt in endosbehållarens spets i ena näsborren tills fingrarna rör vid näsans utsida.
- Tryck in kolven så långt det går. Dosen har avgetts när den gröna linjen inte längre syns.
- Om personen är medvetslös ska han/hon vändas på sidan för att undvika kvävning.
- När dosen har getts ska vårdaren omedelbart ringa efter medicinsk hjälp.
- När patienten svarat på behandlingen, ge kolhydrater peroralt för att återställa glykogennivån i levern och förhindra återfall i hypoglykemi.
För särskilda varningar och försiktighetsåtgärder vid användning, se avsnitt Varningar och försiktighet.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Feokromocytom (se avsnitt Varningar och försiktighet).
Varningar och försiktighet
Feokromocytom
Hos personer med feokromocytom kan glukagon stimulera till frisättning av katekolaminer från tumören. Om patientens blodtryck ökar dramatiskt, kan icke-selektiv α-adrenerg blockad ge en effektiv blodtryckssänkning. Baqsimi är kontraindicerat hos patienter med feokromocytom (se avsnitt Kontraindikationer).
Insulinom
Hos patienter med insulinom kan administrering av glukagon initialt leda till en blodsockerhöjning. Dock kan administrering av glukagon direkt eller indirekt (genom en initial ökning av blodsockret) stimulera till ökad insulinfrisättning från ett insulinom och orsaka hypoglykemi. En patient som får symtom på hypoglykemi efter en dos glukagon ska ges glukos peroralt eller intravenöst.
Överkänslighet och allergiska reaktioner
Allergiska reaktioner har rapporterats med injicerbart glukagon och omfattar generaliserat hudutslag, i vissa fall anafylaktisk chock med andningssvårigheter, samt hypotoni. Om patienten har svårigheter att andas, kontakta sjukvård omgående.
Glykogenreserv och hypoglykemi
Glukagon är endast effektivt för behandling av hypoglykemi om patienten har tillräckligt med glykogen i levern. Eftersom glukagon gör ringa eller ingen nytta vid svälttillstånd, binjuresvikt, alkoholism eller kronisk hypoglykemi, ska dessa tillstånd behandlas med glukos.
För att återställa glykogennivån i levern och förhindra återfall i hypoglykemi, ska kolhydrater ges peroralt när patienten har svarat på behandlingen.
Interaktioner
Inga studier av läkemedelsinteraktioner har utförts.
Insulin
Insulin reagerar som en antagonist mot glukagon
Indometacin
När glukagon används tillsammans med indometacin kan glukagon förlora sin förmåga att höja blodsockret och kan till och med förorsaka hypoglykemi.
Betablockerare
Patienter som tar betablockerare kan förväntas få en större ökning av både puls och blodtryck, men ökningen är övergående på grund av glukagonets korta halveringstid.
Glukagonbehandling leder till frisättning av katekolamin från binjurarna, och samtidig användning av betablockerare skulle kunna resultera i kraftigare effekter av alfaadrenerg stimulering och som följd därav en större blodtrycksökning (se avsnitt Varningar och försiktighet).
Warfarin
Glukagon kan förstärka den antikoagulerande effekten av warfarin.
Fertilitet, graviditet och amning
Graviditet
Inga reproduktions- eller fertilitetsstudier med glukagon näspulver har utförts på djur.
Baqsimi kan användas under graviditet. Glukagon passerar inte över placenta hos människa. Glukagonanvändning hos gravida kvinnor med diabetes har rapporterats, och inga skadliga effekter på graviditetsförloppet eller hälsan hos foster och nyfödda är kända.
Amning
Baqsimi kan användas under amning. Glukagon elimineras mycket snabbt från blodet, och mängden glukagon som utsöndras i bröstmjölken hos ammande mödrar efter behandling av svår hypoglykemi förväntas därför vara extremt liten. Eftersom glukagon bryts ner i magtarmkanalen och inte kan absorberas i intakt form, påverkar det inte barnets metabolism.
Fertilitet
Inga fertilitetsstudier har utförts med glukagon näspulver.
Studier på råtta har visat att glukagon inte leder till försämrad fertilitet.
Effekter på förmågan att framföra fordon och använda maskiner
Baqsimi har försumbar effekt på förmågan att framföra fordon och använda maskiner.
Patientens koncentrations- och reaktionsförmåga kan vara nedsatt på grund av hypoglykemi och detta kan kvarstå en kort tid efter behandlingen. Tillståndet kan utgöra en risk i situationer där dessa förmågor är särskilt viktiga, t.ex. vid framförande av fordon eller användning av maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De oftast rapporterade biverkningarna är ökat tårflöde (36%), irritation i övre luftvägarna (34%), illamående (27%), huvudvärk (21 %) och kräkningar (16%).
Tabell över biverkningar
Biverkningar redovisas i tabell 1 med rekommenderade termer enligt MedDRA, indelade efter organsystem och frekvens. Frekvenskategorierna är följande: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000) och mycket sällsynta (<1/10 000).
Tabell 1. Biverkningar av glukagon näspulver, frekvens
| Organsystem | Mycket vanliga | Vanliga | Mindre vanliga |
| Centrala och perifera nervsystemet | Huvudvärk | Dysgeusi | |
| Ögon | Ökat tårflöde | Okulär hyperemi Ögonklåda | |
| Andningsvägar, bröstkorg och mediastinum | Irritation i övre luftvägarnaa | ||
| Magtarmkanalen | Kräkningar Illamående | ||
| Hud och subkutan vävnad | Klåda | ||
| Undersökningar | Förhöjt systoliskt blodtryckb Förhöjt diastoliskt blodtryckb | Ökad pulsb |
a Irritation i övre luftvägarna: rinorré, obehag i näsan, nästäppa, klåda i näsan, nysningar, irritation i svalget, hosta, epistaxis och parosmi.
b Ökning av puls och blodtryck: Bedömt genom mätning av vitala tecken. Frekvensen baseras på jämförelse av värdena före och efter behandling.
Immunogenicitet
Totalt 5,6% av patienterna utvecklade anti-glukagonantikroppar. Antikropparna var inte neutraliserande och befanns inte minska effekten av glukagon, inte heller hade de något samband med behandlingsrelaterade biverkningar.
Pediatrisk population
Baserat på data från kliniska prövningar förväntas biverkningarnas frekvens, typ och allvarlighetsgrad hos barn som är 4 år eller äldre vara desamma som hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Vid överdosering kan patienten drabbas av illamående, kräkningar, nedsatt motilitet i magtarmkanalen, ökat blodtryck och ökad puls. Vid misstänkt överdosering kan serumkalium minska och ska övervakas och vid behov korrigeras. Om patienten får ett dramatiskt ökat blodtryck kan icke-selektiv α‑adrenerg blockad ge effektiv blodtryckssänkning under den korta tid som värdet behöver kontrolleras (se avsnitt Varningar och försiktighet).
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Pankreashormoner, glukogenolytiskt hormon, ATC-kod: H04AA01
Verkningsmekanism
Glukagon ökar blodsockerkoncentrationen genom att aktivera glukagonreceptorer i levern och därmed stimulera nedbrytning av glykogen och frisättning av glukos från levern. Glykogenreserver i levern är nödvändiga för att glukagon ska kunna utöva en glukoshöjande effekt.
Farmakodynamisk effekt
Kön och kroppsvikt hade ingen kliniskt betydelsefull effekt på farmakodynamiken hos glukagon näspulver.
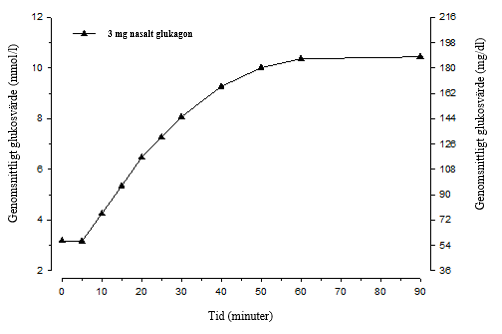
Efter administrering av 3 mg glukagon näspulver till vuxna patienter med typ 1-diabetes började glukosnivåerna öka redan efter 5 minuter (se figur 1). Efter 10 minuter låg medianglukosvärdet över 3,9 mmol/l (70 mg/dl). Den genomsnittliga maximala glukoshöjningen var 7,8 mmol/l (140 mg/dl).
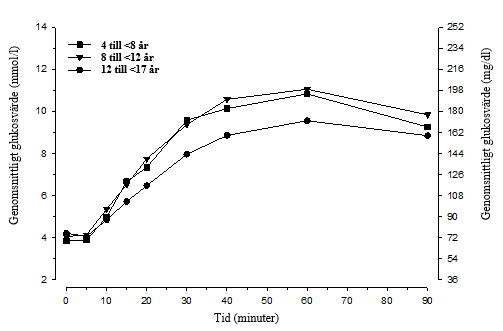
Hos pediatriska patienter med typ 1-diabetes (i åldern 4 till <17 år) började glukosnivåerna stiga redan 5 minuter efter administrering av 3 mg glukagon näspulver (se figur 2). Genomsnittlig maximal glukoshöjning var 5,7 mmol/l (102 mg/dl) till 7,7 mmol/l (138 mg/dl).
En vanlig förkylning med nästäppa, med eller utan samtidig användning av avsvällande näsdroppar, påverkade inte farmakodynamiken hos glukagon näspulver.
Figur 1. Genomsnittlig glukoskoncentration över tid hos vuxna patienter med typ 1-diabetes
Figur 2. Genomsnittlig glukoskoncentration över tid hos pediatriska patienter med typ 1‑diabetes
Klinisk effekt
Huvudstudien var en randomiserad, multicenter-, öppen överkorsningsstudie med 2 perioder på vuxna patienter med typ 1- eller typ 2-diabetes. Det primära målet vara att jämföra effekten av en engångsdos om 3 mg glukagon näspulver med en 1 mg-dos av intramuskulärt glukagon hos vuxna patienter med typ 1-diabetes. Insulin användes för att sänka blodsockervärdena till hypoglykemivärde, med ett lägsta målvärde för blodsockret på <2,8 mmol/l (<50 mg/dl).
Till denna huvudstudie rekryterades totalt 83 patienter i åldern 18 till <65 år. 77 patienter hade typ 1‑diabetes. Genomsnittsåldern var 32,9 år och medelduration för diabetes var 18,1 år. 45 (58%) av patienterna var kvinnor. Genomsnittsåldern för patienter med typ 2-diabetes (n=6) var 47,8 år och medelduration för diabetes var 18,8 år. Fyra (67%) av patienterna var kvinnor.
Det primära effektmåttet var andelen patienter med lyckad behandling, vilket definierades som antingen en ökning av blodsockervärdet till ≥3,9 mmol/l (≥ 70 mg/dl) eller en ökning på ≥1,1 mmol/l (≥20 mg/dl) från det lägsta glukosvärdet inom 30 minuter efter administrering av studieglukagon, utan att några ytterligare åtgärder vidtagits för att öka blodsockernivån. Lägsta glukosvärde definierades som det lägsta uppmätta glukosvärdet vid tiden för, eller inom 10 minuter, efter administrering av glukagon.
För patienter med typ 1-diabetes var det genomsnittliga lägsta glukosvärdet 2,5 mmol/l (44,2 mg/dl) med glukagon näspulver och 2,7 mmol/l (48,9 mg/dl) med intramuskulärt glukagon. Glukagon näspulver uppvisade non-inferiority jämfört med intramuskulärt glukagon vad gällde att vända den insulininducerade hypoglykemin. 98,7% av patienterna som fick glukagon näspulver och 100% av patienterna som fick intramuskulärt glukagon uppfyllde kriterierna för lyckad behandling inom 30 minuter (tabell 2). Samtliga patienter uppfyllde kriterierna för lyckad behandling inom 40 minuter. Samtliga patienter med typ 2-diabetes (100%) uppfyllde villkoren för lyckad behandling inom 30 minuter.
Genomsnittlig tid till lyckad behandling var 16,2 minuter för gruppen som fick glukagon näspulver och 12,2 minuter för gruppen som fick 1 mg glukagon intramuskulärt. Tid till lyckad behandling är tiden från administrering av glukagon tills patienten uppfyller villkoren för lyckad behandling. Det omfattar inte tid för beredning av den intramuskulära injektionen i kontrollgruppen.
30 minuter efter administreringen av glukagon hade patienterna i både gruppen med glukagon näspulver och i gruppen med intramuskulärt glukagon samma förbättringar av symtomen på hypoglykemi, bedömt med hjälp av frågeformuläret Edinburgh Hypoglykemi Symptom.
Tabell 2. Patienter som uppfyllde kriterierna för lyckad behandling och andra glukoskriterier i huvudstudien
| Typ 1-diabetes (n=75)a | Typ 1- och typ 2-diabetes (n=80)a | |||
| glukagon näspulver 3 mg | intramuskulärt glukagon 1 mg | glukagon näspulver 3 mg | intramuskulärt glukagon 1 mg | |
| Lyckad behandling - n (%) | 74 (98,7%) | 75 (100%) | 79 (98,8%) | 80 (100%) |
| Behandlingsdifferens (2-sidigt 95% konfidensintervall) b,c | 1,3 % (-3,8%, 7,2%) | 1,3 % (-3,6%, 6,8%) | ||
| Uppfyllt glukoskriterium – n (%)d | ||||
| (i) ≥3,9 mmol/l (≥70 mg/dl) | 72 (97%) | 74 (99%) | 77 (97%) | 79 (99%) |
| (ii) Ökning med ≥1,1 mmol/l (≥20 mg/dl) från lägsta värde | 74 (100%) | 75 (100%) | 79 (100%) | 80 (100%) |
| Både (i) och (ii) | 72 (97%) | 74 (99%) | 77 (97%) | 79 (99%) |
a Populationen för effektanalys utgjordes av alla patienter som fick båda doserna studieläkemedel och hade ett utvärderingsbart primärt utfall.
b Differens beräknad som (procenttal med lyckad behandling på intramuskulärt glukagon) – (procenttal med lyckad behandling på glukagon näspulver).
c 2-sidigt 95% konfidensintervall (CI) enligt metod för ovillkorlig sannolikhet baserat på exakt fördelad svansarea; marginal för non-inferiority = 10%.
d Procenttal baserat på antalet patienter med lyckad behandling.
Till en klinisk bekräftande studie med liknande design rekryterades 70 patienter med typ 1-diabetes. Genomsnittsåldern var 41,7 år (20‑64 år) och genomsnittlig duration för diabetes var 19,8 år. 27 (39%) var kvinnor. Insulin användes för att sänka blodsockervärdena till <3,3 mmol/l (<60 mg/dl).
Det genomsnittliga lägsta glukosvärdet var 3 mmol/l (54,2 mg/dl) med glukagon näspulver och 3,1 mmol/l (55,7 mg/dl) med intramuskulärt glukagon. Glukagon näspulver uppvisade non-inferiority jämfört med intramuskulärt glukagon vad gällde att vända den insulininducerade hypoglykemin. 100% av patienterna som fick glukagon näspulver och 100% av patienterna som fick intramuskulärt glukagon uppfyllde kriterierna för lyckad behandling (se tabell 3). Genomsnittlig tid till lyckad behandling var 11,4 minuter för gruppen som fick glukagon näspulver och 9,9 minuter för gruppen som fick 1 mg glukagon intramuskulärt.
Tabell 3. Patienter som uppfyllde kriterierna för lyckad behandling och andra glukoskriterier i den bekräftande studien
| Typ 1-diabetes (n=66)a | ||
| glukagon näspulver 3 mg | intramuskulärt glukagon 1 mg | |
| Lyckad behandling - n (%) | 66 (100%) | 66 (100%) |
| Behandlingsdifferens (2-sidigt 95% konfidensintervall)b | 0 % (-5,4%, 5,4%)c | |
| Uppfyllt glukoskriterium – n (%) | ||
(i) ≥3,9 mmol/l (≥70 mg/dl) (ii) Ökning med ≥1,1 mmol/l (≥20 mg/dl) från lägsta värde Både (i) och (ii) | 66 (100%) 66 (100%) 66 (100%) | 66 (100%) 66 (100%) 66 (100%) |
a Populationen för effektanalys utgjordes av alla patienter som fick båda doserna studieläkemedel och hade ett utvärderingsbart primärt utfall.
b Differens beräknad som (procenttal med lyckad behandling på intramuskulärt glukagon) – (procenttal med lyckad behandling på glukagon näspulver); marginal för non-inferiority = 10%.
c 2-sidigt 95% konfidensintervall (CI) enligt metod för ovillkorlig sannolikhet baserat på exakt fördelad svansarea.
I en användarstudie hos vuxna som pågick i cirka 6 månader, fick 129 patienter (genomsnittsålder 46,6 år, intervall 18 till 71 år) med typ 1-diabetes och deras närstående glukagon näspulver förskrivet för behandling av måttliga till svåra hypoglykemiska händelser i hemmet eller på arbetet. Totalt rapporterades 157 måttliga eller svåra hypoglykemiska händelser hos 69 patienter och ingick i effektanalysen. En episod med svår hypoglykemi definierades som en episod där personen med diabetes är så kliniskt oförmögen (dvs. medvetslös, har kramper, svår psykisk desorientering) att personen behöver hjälp av tredje part för att behandla hypoglykemin. En episod med måttlig hypoglykemi definierades som en episod där personen med diabetes visar tecken på neuroglykopeni (dvs. svaghet, talsvårigheter, dubbelseende, dåsighet, koncentrationssvårigheter, dimsyn, ångest, hunger, trötthet eller förvirring) och har ett värde (uppmätt med blodsockermätare) på cirka 60 mg/dl (3,3 mmol/l) eller lägre i blodprov taget vid eller nära tidpunkten för behandling. Vid 151 (96,2%) av dessa episoder vaknade patienterna eller återgick till normalt status inom 30 minuter efter administrering av glukagon näspulver. Vid samtliga (100%) 12 allvarliga hypoglykemiska episoder vaknade patienterna, kramperna upphörde (7 episoder hos 4 patienter som hade kramper innan de fick glukagon näspulver) eller återgick till normalt status inom 5 till 15 minuter efter administrering av glukagon näspulver.
Pediatrisk population
Den pediatriska huvudstudien var en randomiserad, klinisk multicenterstudie där man jämförde glukagon näspulver med intramuskulärt glukagon hos barn och ungdomar med typ 1-diabetes. Glukagon administrerades när glukosvärdet nådde <4,4 mmol/l (<80 mg/dl) på dagen för dosering. Effekt bedömdes baserat på procentandelen patienter med en glukosökning på ≥1,1 mmol/l (≥20 mg/dl) från lägsta värdet inom 30 minuter efter administrering av glukagon.
Till studien rekryterades 48 patienter. Dessa fick minst en dos studieläkemedel. Genomsnittsåldern i kohorten ”små barn” (4 till <8 år) var 6,5 år. I kohorten ”barn” (8 till <12 år) var genomsnittsåldern 11,1 år och i kohorten ”ungdomar” (12 till <17 år) var genomsnittsåldern 14,6 år. Populationen bestod huvudsakligen av kaukasiska pojkar i alla åldersgrupperna.
Baqsimi (3 mg glukagon näspulver) och intramuskulärt glukagon 0,5 mg (barn under 25 kg) eller 1 mg (barn 25 kg eller däröver) gav samma glykemiska respons i alla åldersgrupperna. Samtliga (100%) patienter i båda behandlingsarmarna i alla åldersgrupper fick en glukosökning på ≥1,1 mmol/l (≥20 mg/dl) från lägsta glukosvärdet inom 20 minuter efter administrering av glukagon.
Genomsnittstiden för att nå en glukosökning på ≥1,1 mmol/l (≥20 mg/dl) var liknande för glukagon näspulver som för intramuskulärt glukagon i alla åldersgrupper (se tabell 4).
Tabell 4.Genomsnittlig tid för att nå en glukosökning på 1,1 mmol/l (≥20 mg/dl) från lägsta värdet i den pediatriska huvudstudien
| Ökning från lägsta värde | Genomsnittlig tid från administrering av glukagon (minuter) | |||||
Små barn (4 till <8 år) | Barn (8 till <12 år) | Ungdomar (12 till <17 år) | ||||
intramuskulärt glukagona n = 6 | glukagon näspulver 3 mg n = 12 | intramuskulärt glukagona n = 6 | glukagon näspulver 3 mg n = 12 | intramuskulärt glukagona n = 12 | glukagon näspulver 3 mg n = 12 | |
| ≥1,1 mmol/l (≥20 mg/dl) | 10,0 | 10,8 | 12,5 | 11,3 | 12,5 | 14,2 |
a 0,5 mg eller 1 mg intramuskulärt glukagon (baserat på kroppsvikt).
I en studie av verklig användning hos barn som pågick i cirka 6 månader, fick 26 patienter i åldern 4 till <18 år (genomsnittsålder 11,7 år, intervall 5 till 17 år) med typ 1-diabetes och deras närstående 3 mg glukagon näspulver förskrivet för behandling av måttliga till svåra hypoglykemiska händelser i hemmet eller i skolan. Totalt rapporterades 33 måttliga hypoglykemiska händelser hos 14 patienter och ingick i effektanalysen. En episod av svår hypoglykemi definierades som en episod med neuroglykopenisymtom och ett glukosvärde under 50 mg/dl (2,8 mmol/l). En episod med måttlig hypoglykemi definierades som en episod där ett barn/en ungdom med diabetes hade symtom och/eller tecken på neuroglykopeni och ett blodsockervärde på <70 mg/dl (3,9 mmol/l). Vid samtliga episoder, även de med svår hypoglykemi (8 episoder hos 5 patienter), återgick patienterna till normalt status inom 5 till 30 minuter efter administrering av glukagon näspulver.
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för Baqsimi för en eller flera undergrupper av den pediatriska populationen för behandling av svår hypoglykemi (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Absorption
Vid glukagonabsorption via näsan uppnåddes genomsnittliga maximala plasmanivåer på 6 130 pg/ml efter 15 minuter.
Distribution
Skenbar distributionsvolym för glukagon var cirka 885 l vid nasal administrering.
Metabolism
Glukagon bryts ner i levern, njurarna och i plasma.
Eliminering
Genomsnittlig halveringstid för glukagon var cirka 38 minuter vid nasal administrering.
Njurinsufficiens
Inga formella studier har utförts för utvärdering vid nedsatt njurfunktion.
Leverinsufficiens
Inga formella studier har utförts för utvärdering vid nedsatt leverfunktion.
Pediatrisk population
Vid glukagonabsorption via näsan hos pediatriska patienter (i åldern 4 till <17 år) uppnåddes genomsnittliga maximala plasmanivåer efter 15 till 20 minuter.
Förkylning och användning av avsvällande näsdroppar
En vanlig förkylning med nästäppa, med eller utan samtidig användning av avsvällande näsdroppar, påverkade inte farmakodynamiken vid nasal administrering.
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Betadex (E459)
Dodecylfosfokolin
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Förvara endosbehållaren i den plastförseglade behållaren tills läkemedlet ska användas. Fuktkänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
BAQSIMI nenäjauhe, kerta-annospakkaus
3 mg (L:ei) 1 annos (129,21 €)
PF-selosteen tieto
Endosbehållaren består av polyeten och polypropen. Den plastförseglade innerförpackningen består av polyeten och polypropen och innehåller torkmedel.
Förpackningsstorlek: 1 eller 2 endosbehållare.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vitt till benvitt pulver.
Särskilda anvisningar för destruktion och övrig hantering
Bruksanvisning
Denna engångsprodukt är klar för användning.
Engångsbehållaren innehåller endast en dos och ska därför inte förberedas eller testas före administrering.
Anvisningar för användning av endosbehållaren medföljer bipacksedeln och måste följas noga.
Om den inre förpackningen har öppnats kan endosbehållaren ha utsatts för fukt. Det kan göra att läkemedlet inte fungerar som förväntat. Kontrollera den plastförseglade inre förpackningen med jämna mellanrum. Om behållaren har öppnats ska en annan endosbehållare användas.
Destruktion
Endosbehållaren med glukagon och innerförpackningen ska kastas efter användningen.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
BAQSIMI nenäjauhe, kerta-annospakkaus
3 mg 1 annos
- Ei korvausta.
Atc-kod
H04AA01
Datum för översyn av produktresumén
22.08.2024
Yhteystiedot
Orient Plads 1
2150 Nordhavn
Denmark
info@oresundpharma.com
