FIASP injektioneste, liuos 100 U/ml, FIASP FLEXTOUCH injektioneste, liuos, esitäytetty kynä 100 U/ml, FIASP PENFILL injektioneste, liuos, sylinteriampulli 100 U/ml, FIASP PUMPCART injektioneste, liuos, sylinteriampulli 100 U/ml
Vaikuttavat aineet ja niiden määrät
1 ml liuosta sisältää 100 yksikköä aspartinsuliinia* (vastaa 3,5 mg:aa).
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos esitäytetyssä kynässä
Jokainen esitäytetty kynä sisältää 300 yksikköä aspartinsuliinia 3 ml:ssa liuosta.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos sylinteriampullissa
Jokainen sylinteriampulli sisältää 300 yksikköä aspartinsuliinia 3 ml:ssa liuosta.
Fiasp 100 yksikköä/ml injektioneste, liuos injektiopullossa
Jokainen injektiopullo sisältää 1 000 yksikköä aspartinsuliinia 10 ml:ssa liuosta.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos sylinteriampullissa
Jokainen sylinteriampulli sisältää 160 yksikköä aspartinsuliinia 1,6 ml:ssa liuosta.
*Aspartinsuliini on valmistettu Saccharomyces cerevisiae -hiivassa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Injektioneste, liuos (FlexTouch).
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Injektioneste, liuos (Penfill).
Fiasp 100 yksikköä/ml injektioneste, liuos, injektiopullo
Injektioneste, liuos.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos, sylinteriampulli
Injektioneste, liuos (PumpCart).
Kliiniset tiedot
Käyttöaiheet
Aikuisten, nuorten ja 1‑vuotiaiden ja sitä vanhempien lasten diabetes mellituksen hoito.
Annostus ja antotapa
Annostus
Fiasp on ateriainsuliini, joka annetaan ihon alle 0–2 minuuttia ennen aterian aloittamista, tai vaihtoehtoisesti se voidaan antaa myös enintään 20 minuuttia aterian aloittamisen jälkeen (ks. kohta Farmakodynamiikka).
Fiasp-insuliinin annostus on yksilöllinen, ja se määritetään potilaan tarpeiden mukaisesti. Ihon alle annettavaa Fiasp-insuliinia tulee käyttää yhdessä vähintään kerran vuorokaudessa otettavan pitkä- tai ylipitkävaikutteisen insuliinin kanssa. Basaali-bolus-hoitomallissa noin 50 % insuliinin tarpeesta voidaan kattaa Fiasp-insuliinilla. Loput insuliinin tarpeesta katetaan pitkä- tai ylipitkävaikutteisella insuliinilla.
Yksilöllinen insuliinin päivittäinen kokonaistarve aikuisilla, nuorilla ja lapsilla voi vaihdella, mutta on yleensä 0,5–1 yksikköä/kg/vrk.
Verenglukoosin seurantaa ja insuliiniannoksen säätämistä suositellaan optimaalisen glukoositasapainon saavuttamiseksi.
Annoksen tarkistus voi olla tarpeen, jos potilaan fyysinen rasitus lisääntyy, tavanomainen ruokavalio muuttuu tai hänellä on muu samanaikainen sairaus. Verenglukoositasoja on seurattava näissä tilanteissa riittävästi.
Vaikutusaika vaihtelee annoksen suuruuden, pistoskohdan, verenkierron, lämpötilan ja fyysisen rasituksen mukaan.
Jos potilas unohtaa basaali-bolus-hoitomallissa ateria-annoksen, häntä neuvotaan seuraamaan verenglukoosia ja päättämään tulosten perusteella, onko insuliiniannoksen ottaminen tarpeen. Potilas jatkaa seuraavalla aterialla normaalin annostusaikataulun mukaista annostusta.
Insuliinianalogien, joihin Fiasp kuuluu, vahvuus ilmaistaan yksikköinä. Yksi (1) yksikkö Fiasp-insuliinia vastaa yhtä kansainvälistä yksikköä ihmisinsuliinia tai yhtä yksikköä muita pikavaikutteisia insuliinianalogeja.
Vaikutuksen varhainen alkaminen on otettava huomioon Fiasp-valmistetta määrättäessä (ks. kohta Farmakodynamiikka).
Aloitus
Tyypin 1 diabetes mellitusta sairastavat potilaat
Suositeltu aloitusannos tyypin 1 diabetesta sairastaville potilaille, jotka eivät ole saaneet insuliinia aiemmin, on noin 50 % insuliinin päivittäisestä kokonaisannoksesta, ja se tulee jakaa aterioille suhteessa aterian kokoon ja koostumukseen. Loput insuliinin päivittäisestä kokonaisannoksesta on pitkä- tai ylipitkävaikutteista insuliinia. Päivittäisen aloitusannoksen laskukaavana tyypin 1 diabetesta sairastaville potilaille, joilla ei ole ollut aiempaa insuliinihoitoa, on yleensä 0,2–0,4 yksikköä insuliinia painokiloa kohden.
Tyypin 2 diabetes mellitusta sairastavat potilaat
Ehdotettu aloitusannos on 4 yksikköä yhdellä tai useammalla aterialla. Pistosten lukumäärä ja myöhempi insuliiniannoksen säätäminen perustuu yksilölliseen verenglukoositavoitteeseen sekä aterioiden kokoon ja koostumukseen.
Annosta voi tarvittaessa säätää päivittäin Taulukossa 1 esitetyn, edellisen päivän itse mitatun plasman glukoosin (SMPG) perusteella.
- Aamiaista edeltävä annos säädetään edellisen päivän lounasta edeltävän SMPG-tuloksen mukaan
- Lounasta edeltävä annos säädetään edellisen päivän päivällistä edeltävän SMPG-tuloksen mukaan
- Päivällistä edeltävä annos säädetään edellisenä päivänä ennen nukkumaanmenoa mitatun SMPG-tuloksen mukaan
Taulukko 1 Annoksen säätäminen | ||
SMPG (selitetty yllä) | Annoksen säätäminen | |
mmol/l | mg/dl | Yksikköä |
alle 4 | alle 71 | -1 |
4–6 | 71–108 | Ei muutosta |
yli 6 | yli 108 | +1 |
Erityiset potilasryhmät
Iäkkäät potilaat (≥ 65-vuotiaat)
Fiasp-valmisteen turvallisuus ja teho iäkkäiden potilaiden (65–75 vuotta) hoidossa on varmistettu. Verenglukoosin tarkkaa seurantaa suositellaan ja insuliiniannosta on säädettävä yksilöllisesti (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka). 75-vuotiaiden ja sitä vanhempien hoidosta on vain vähän kokemusta.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta saattaa vähentää potilaan insuliinin tarvetta. Jos potilaalla on munuaisten vajaatoiminta, verenglukoosin seurantaa on tehostettava ja annosta säädettävä yksilöllisesti (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Maksan vajaatoiminta saattaa vähentää potilaan insuliinin tarvetta. Jos potilaalla on maksan vajaatoiminta, verenglukoosin seurantaa on tehostettava ja annosta säädettävä yksilöllisesti (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Fiasp-valmistetta voidaan käyttää nuorten ja 1‑vuotiaiden ja sitä vanhempien lasten hoitoon (ks. kohta Farmakodynamiikka). Fiasp-valmisteen käytöstä alle 2‑vuotiaiden lasten hoitoon ei ole kliinistä kokemusta.
Fiasp on suositeltavaa antaa ennen ateriaa (0–2 minuuttia), mutta sen voi antaa joustavasti enintään 20 minuuttia aterian aloittamisen jälkeen tilanteissa, joissa aterialla syötävä määrä on epävarma.
Siirtyminen muista insuliinivalmisteista
Siirtymisvaiheen aikana ja sitä seuraavina viikkoina verenglukoosin tarkka seuranta on suositeltavaa siirryttäessä muista ateriainsuliinivalmisteista. Siirryttäessä toisesta ateriainsuliinista voidaan käyttää samaa insuliinin yksikkömäärää kuin aiemmin. Kun potilas siirtyy käyttämään Fiasp-valmistetta toisentyyppisestä, toisenmerkkisestä tai toisen valmistajan insuliinista, on siirtyminen toteutettava lääkärin tarkassa valvonnassa ja annosta saattaa olla tarpeen muuttaa.
Samanaikaisesti käytettävän pitkä- tai ylipitkävaikutteisen insuliinivalmisteen annosta ja annoksen ajoitusta tai muuta samanaikaisesti annettavaa diabeteksen lääkehoitoa voidaan joutua säätämään.
Antotapa
Pistoksena ihon alle
Fiasp suositellaan pistettäväksi ihon alle vatsanpeitteisiin tai olkavarteen (ks. kohta Farmakokinetiikka). Pistoskohtia on vaihdeltava sovitun pistosalueen sisällä lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos, esitäytetty kynä
Esitäytetyllä kynällä (FlexTouch) voi pistää 1–80 yksikköä yhden yksikön välein.
FlexTouch-kynän yksityiskohtaiset käyttöohjeet on esitetty pakkausselosteessa. Katso anto-ohjeet kohdasta ”Käyttöohjeet” pakkausselosteen lopussa.
Esitäytetty kynä sopii vain ihon alle annettaviin pistoksiin. Jos anto ruiskulla tai pistoksena laskimoon on tarpeen, on käytettävä injektiopulloa. Jos anto infuusiopumpulla on tarpeen, on käytettävä injektiopulloa tai PumpCart-sylinteriampullia.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos, sylinteriampulli
Anto kestokäyttöisellä insuliinikynällä
Jos anto ruiskulla tai pistoksena laskimoon on tarpeen, on käytettävä injektiopulloa. Jos anto infuusiopumpulla on tarpeen, on käytettävä injektiopulloa tai PumpCart-sylinteriampullia (ks. kohta Käyttö- ja käsittelyohjeet).
Fiasp 100 yksikköä/ml injektioneste, liuos, injektiopullo
Anto ruiskulla
Injektiopulloa käytetään insuliiniyksikköruiskujen kanssa (yksikköä-100 tai 100 yksikköä/ml).
Jatkuva ihonalainen insuliini-infuusio (CSII)
Fiasp-injektionestettä, liuosta injektiopullossa voidaan käyttää insuliini-infuusioon soveltuvissa pumpuissa jatkuvaa ihonalaista insuliini-infuusiota (CSII) varten, jolloin se kattaa sekä bolusinsuliinin (noin 50 %) että perusinsuliinin tarpeen. Se voidaan antaa pumpun valmistajan ohjeiden mukaisesti, mieluiten vatsan alueelle. Kun Fiasp-insuliinia käytetään insuliini-infuusiopumpussa, sitä ei saa laimentaa eikä siihen saa sekoittaa mitään muuta insuliinivalmistetta.
Insuliinia jatkuvana ihonalaisena infuusiona käyttäville potilaille on annettava ohjeet pumpun käyttöä varten. Pumpussa pitää käyttää oikeaa sylinteriampullia ja letkua (ks. kohta Käyttö- ja käsittelyohjeet). Infuusiovälineet (letku ja kanyyli) tulee vaihtaa infuusiovälineiden tuoteinformaatiossa annettujen ohjeiden mukaisesti.
Fiasp-insuliinia insuliini-infuusiopumpussa käyttäville potilaille on neuvottava, miten insuliini annetaan pistoksena, ja heidän on pidettävä vaihtoehtoisella tavalla annosteltavaa insuliinia saatavilla siltä varalta, että pumppuun tulee toimintahäiriö.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos, sylinteriampullissa
Annostelu jatkuvana ihonalaisena insuliini-infuusiona (CSII)
Sylinteriampulli (PumpCart) on tarkoitettu käytettäväksi vain sellaisissa insuliinipumppujärjestelmissä, jotka on suunniteltu käytettäväksi tämän sylinteriampullin kanssa (ks. kohta Käyttö- ja käsittelyohjeet).
Fiasp kattaa sekä bolusinsuliinin (noin 50 %) että perusinsuliinin tarpeen. Se voidaan antaa pumpun valmistajan ohjeiden mukaisesti, mieluiten vatsan alueelle. Lipodystrofiariskin pienentämiseksi infuusiokohtaa tulee vaihdella saman alueen sisällä.
Insuliinia jatkuvana ihonalaisena infuusiona käyttäville potilaille on annettava ohjeet pumpun käyttöä varten. Pumpussa pitää käyttää oikeaa letkua (ks. kohta Käyttö- ja käsittelyohjeet). Infuusiovälineet (letku ja kanyyli) tulee vaihtaa infuusiovälineiden tuoteinformaatiossa annettujen ohjeiden mukaisesti.
Fiasp-insuliinia insuliini-infuusiopumpussa käyttäville potilaille on neuvottava, miten insuliini annetaan pistoksena, ja heidän on pidettävä vaihtoehtoisella tavalla annosteltavaa insuliinia saatavilla siltä varalta, että pumppuun tulee toimintahäiriö.
Sylinteriampulli (PumpCart) sopii vain insuliini-infuusioille soveltuvaan pumppujärjestelmään (CSII). Jos anto ruiskulla tai laskimonsisäisesti on tarpeen, on käytettävä injektiopulloa.
Laskimoon
Fiasp 100 yksikköä/ml, injektioneste, liuos, injektiopullo
Terveydenhuollon ammattilaiset voivat tarvittaessa antaa Fiasp-valmistetta myös laskimoon.
Laskimoon annettaessa sitä tulee käyttää pitoisuuksilla 0,5–1 yksikköä/ml aspartinsuliinia infuusionesteessä, käyttäen polypropyleeni-infuusiopusseja.
Fiasp-valmistetta ei saa sekoittaa muiden insuliinien eikä muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ennen lääkkeen antoa.
Verenglukoosin seuranta on tarpeen insuliini-infuusion aikana. On varmistettava, ettei insuliini jää porttiin, vaan ruiskutetaan infuusiopussin sisään.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Hypoglykemia
Aterian laiminlyöminen tai suunnittelematon, voimakas fyysinen rasitus voi johtaa hypoglykemiaan.
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen (ks. kohdat Haittavaikutukset ja Yliannostus).
Potilaat, joiden verenglukoositasapaino paranee huomattavasti, esimerkiksi tehostetun insuliinihoidon ansiosta, saattavat kokea muutoksen tavanomaisissa hypoglykemiasta varoittavissa oireissaan. Potilaille tulee kertoa asiasta ja antaa asianmukaista ohjausta. Tavanomaiset varoittavat oireet saattavat hävitä diabetesta pitkään sairastaneilta potilailta.
Annetun insuliinivalmisteen vaikutusprofiili heijastuu yleensä hypoglykemian esiintymisajankohtaan. Hypoglykemia saattaa ilmetä pistoksen/infuusion jälkeen nopeammin kuin muilla ateriainsuliineilla, koska Fiasp-insuliinin vaikutus alkaa aikaisemmin (ks. kohta Farmakodynamiikka).
Koska Fiasp tulee antaa 0–2 minuuttia ennen ateriointia, tai vaihtoehtoisesti enintään 20 minuuttia aterian aloittamisen jälkeen, on sen vaikutuksen alkamisaika otettava huomioon, jos sitä määrätään potilaalle, jonka muu sairaus tai hänen saamansa muu hoito hidastaa ruoan imeytymistä.
Pediatriset potilaat
Verenglukoositasojen tarkkaa seurantaa suositellaan yöllisen hypoglykemian välttämiseksi, jos tämä lääkevalmiste annetaan päivän viimeisen aterian aloittamisen jälkeen.
Hyperglykemia ja diabeettinen ketoasidoosi
Insuliinia tarvitsevilla potilailla riittämätön annos tai hoidon keskeytyminen saattavat johtaa hyperglykemiaan ja diabeettiseen ketoasidoosiin, jotka saattavat johtaa kuolemaan.
Jatkuva ihonalainen insuliini-infuusio (CSII)
Jos pumpussa tai infuusiovälineissä esiintyy toimintahäiriöitä, hyperglykemia ja ketoosi saattavat kehittyä nopeasti. Hyperglykemian tai ketoosin nopea tunnistaminen sekä niiden korjaaminen viipymättä on välttämätöntä. Hoitoa saatetaan väliaikaisesti joutua jatkamaan ihon alle annettavilla pistoksilla.
PumpCart-insuliinisylinteriampullin väärä käyttö
Sylinteriampullia (PumpCart) voidaan käyttää vain sellaisissa insuliinipumppujärjestelmissä, jotka on suunniteltu käytettäväksi tämän sylinteriampullin kanssa. Sitä ei saa käyttää antolaitteissa, joita ei ole suunniteltu tälle sylinteriampullille, koska se voi johtaa virheelliseen insuliinin annosteluun ja siitä voi olla seurauksena hyper- tai hypoglykemia (ks. kohta Käyttö- ja käsittelyohjeet).
Iho ja ihonalainen kudos
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen alueelta, jolla esiintyy muutoksia, terveelle alueelle, ja diabeteksen hoitoon käytettävien lääkevalmisteiden annoksen muuttamista voidaan harkita.
Siirtyminen muista insuliinivalmisteista
Kun potilas siirtyy käyttämään toisentyyppistä tai toisen valmistajan insuliinia, on siirtyminen toteutettava tarkassa lääkärin valvonnassa. Kun muutetaan insuliinin vahvuutta, tavaramerkkiä (valmistaja), tyyppiä, alkuperää (eläininsuliini, ihmisinsuliini tai ihmisinsuliinianalogi) ja/tai valmistusmenetelmää (yhdistelmä-DNA-tekniikalla valmistettu insuliini vs. eläinperäinen insuliini), annoksen muutos saattaa olla tarpeen. Toisentyyppisestä insuliinista Fiasp-insuliiniin siirtyvien potilaiden annosta saatetaan joutua muuttamaan verrattuna potilaan tavallisesti käyttämän insuliinin annokseen.
Muut samanaikaiset sairaudet
Muut sairaudet, varsinkin tulehdukset ja kuumetilat, yleensä lisäävät potilaan insuliinin tarvetta. Samanaikainen munuais- tai maksasairaus tai lisämunuaisen, aivolisäkkeen tai kilpirauhasen toimintaan vaikuttavat sairaudet voivat aiheuttaa muutoksia insuliiniannokseen.
Pioglitatsonin ja insuliinivalmisteiden yhteiskäyttö
Kongestiivisia sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia oli käytetty yhdessä insuliinin kanssa, erityisesti potilailla, joilla oli riskitekijöitä kongestiivisen sydämen vajaatoiminnan kehittymiselle. Tämä tulee pitää mielessä, jos harkitaan pioglitatsonin ja insuliinivalmisteiden yhteiskäyttöä. Jos valmisteita käytetään yhdessä, potilailta tulee seurata sydämen kongestiivisen vajaatoiminnan, painonnousun ja turvotuksen merkkejä ja oireita. Pioglitatsonihoito tulee lopettaa, jos sydänoireet pahenevat.
Insuliinin aloittaminen ja verenglukoosin tehostettu seuranta
Insuliinihoidon tehostamiseen tai nopeaan glukoositasapainon paranemiseen liittyy tilapäinen, itsestään korjaantuva silmän taittovirhe, diabeettisen retinopatian vaikeutuminen, akuutti, kivulias perifeerinen neuropatia ja perifeerinen turvotus. Pitkäaikainen glukoositasapainon paraneminen kuitenkin vähentää diabeettisen retinopatian ja neuropatian riskiä.
Insuliinin vasta-aineet
Insuliinin anto saattaa aiheuttaa insuliini-vasta-aineiden muodostusta. Tällaisten insuliinin vasta-aineiden olemassaolo saattaa harvoissa tapauksissa edellyttää insuliiniannoksen säätämistä korjaamaan hyper- tai hypoglykemiataipumusta.
Vahingossa tapahtuvien sekaannusten/lääkitysvirheiden välttäminen
Potilaat täytyy ohjeistaa tarkistamaan insuliinin etiketti ennen jokaista pistosta, jotta vältetään vahingossa tapahtuvat sekaannukset tämän lääkevalmisteen ja muiden insuliinilääkevalmisteiden välillä.
Potilaiden on katsomalla varmistettava annoksen yksikkömäärä ennen sen ottamista. Jotta potilas voi ottaa insuliinin itse, hänen on kyettävä lukemaan annosasteikkoa. Jos potilas on sokea tai hänellä on heikko näkö, häntä on kehotettava pyytämään aina apua sellaiselta henkilöltä, jolla on hyvä näkö ja joka on saanut opastuksen insuliinin antamiseen.
Matkustaminen aikavyöhykkeiden välillä'
Potilaan on pyydettävä ohjeet lääkäriltä ennen matkustamistaan eri aikavyöhykkeiden välillä.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan "natriumiton".
Yhteisvaikutukset
Useiden lääkkeiden tiedetään vaikuttavan glukoosiaineenvaihduntaan.
Seuraavat aineet saattavat vähentää insuliinin tarvetta:
Suun kautta otettavat diabeteslääkkeet, monoamiinioksidaasin (MAO:n) estäjät, beetasalpaajat, angiotensiinikonvertaasin (ACE:n) estäjät, salisylaatit, anaboliset steroidit, sulfonamidit ja GLP-1-reseptorin agonistit.
Seuraavat aineet saattavat lisätä insuliinin tarvetta:
Suun kautta otettavat ehkäisyvalmisteet, tiatsidit, glukokortikoidit, kilpirauhashormonit, sympatomimeetit, kasvuhormoni ja danatsoli.
Beetasalpaajat saattavat peittää hypoglykemian oireet.
Oktreotidi ja lanreotidi voivat joko lisätä tai vähentää insuliinin tarvetta.
Alkoholi saattaa tehostaa tai vähentää insuliinin verenglukoosia alentavaa vaikutusta.
Raskaus ja imetys
Raskaus
Fiasp-insuliinia voidaan käyttää raskauden aikana.
Tiedot kahdesta satunnaistetusta, kontrolloidusta kliinisestä aspartinsuliinitutkimuksesta (322 + 27 raskautta) eivät viittaa aspartinsuliinin haitallisiin vaikutuksiin raskauteen tai sikiön/vastasyntyneen terveyteen, kun sitä verrattiin liukenevaan ihmisinsuliiniin.
Raskaana olevien diabeetikkonaisten (tyyppi 1, tyyppi 2 tai raskausajan diabetes) tehostettua verenglukoosikontrollia ja hoidon seurantaa suositellaan raskautta suunniteltaessa ja koko raskauden ajan. Insuliinin tarve yleensä vähenee raskauden ensimmäisen kolmanneksen aikana ja lisääntyy myöhemmin toisen ja kolmannen kolmanneksen aikana. Synnytyksen jälkeen insuliinin tarve tavallisesti palautuu nopeasti ennen raskautta olleisiin arvoihin.
Imetys
Fiasp-insuliinin käyttöön ei liity mitään rajoituksia imetysaikana. Imettävän äidin insuliinihoito ei aiheuta vaaraa lapselle. Insuliinin annosta voidaan kuitenkin joutua tarkistamaan imetysaikana.
Hedelmällisyys
Hedelmällisyyttä koskevissa eläinten lisääntymistutkimuksissa ei ole havaittu eroa aspartinsuliinin ja ihmisinsuliinin välillä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaan keskittymis- ja reaktiokyky saattavat heikentyä hypoglykemian seurauksena. Tämä voi aiheuttaa vaaratilanteita silloin, kun keskittymis- ja reaktiokykyä erityisesti tarvitaan (esim. autolla ajo tai koneiden käyttö).
Potilaita tulee neuvoa ryhtymään varotoimiin hypoglykemian välttämiseksi ajon aikana. Tämä on erityisen tärkeää niille diabeetikoille, joiden tuntemukset hypoglykemiasta varoittavista oireista ovat vähentyneet tai puuttuvat tai joilla on usein ollut hypoglykemia. Tällaisissa tapauksissa autolla ajamisen tarkoituksenmukaisuutta on syytä harkita tarkkaan.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Hoidon aikana yleisimmin raportoitu haittavaikutus oli hypoglykemia (ks. alla oleva kohta "Valikoitujen haittavaikutusten kuvaus").
Taulukoitu haittavaikutusluettelo
Alla olevassa luettelossa (Taulukko 2) esitetyt haittavaikutukset perustuvat aikuisilla tehdyistä tutkimuksista saatuihin tietoihin. Tutkimuksiin kuului 6 päättynyttä varmistustutkimusta. Esiintymistiheydet on määritelty seuraavasti: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko 2 Haittavaikutukset kliinisistä tutkimuksista
MedDRA-elinjärjestelmäluokka | Hyvin yleinen | Yleinen | Melko harvinainen | Tuntematon |
Immuunijärjestelmä | Yliherkkyys | Anafylaktiset reaktiot | ||
Aineenvaihdunta ja ravitsemus | Hypoglykemia | |||
Iho ja ihonalainen kudos | Allergiset iho-oireet | Lipodystrofia | Ihoamyloidoosi† | |
Yleisoireet ja antopaikassa todettavat haitat | Pistos-/infuusiokohdan reaktiot |
† Myyntiintulon jälkeen ilmennyt lääkkeen aiheuttama haittavaikutus.
Tiettyjen haittavaikutusten kuvaus
Allergiset reaktiot
Fiasp-insuliinin käytön yhteydessä raportoituja iho-oireita (1,8 %; vertailuvalmisteella 1,5 %) olivat ekseema, ihottuma, kutiseva ihottuma, nokkosihottuma ja ihotulehdus.
Fiasp-insuliinin käytön yhteydessä raportoitiin yleistyneitä yliherkkyysreaktioita (oireina laajalle levinnyttä ihottumaa ja turvotusta kasvoissa) harvoin (0,2 %, vertailuvalmisteella 0,3 %).
Hypoglykemia
Hypoglykemiaa saattaa esiintyä, jos insuliiniannos on liian suuri suhteessa insuliinin tarpeeseen. Vakava hypoglykemia saattaa johtaa tajuttomuuteen ja/tai aiheuttaa kouristuksia, tilapäisen tai pysyvän aivojen toimintahäiriön tai jopa kuoleman. Hypoglykemian oireet ilmaantuvat yleensä yllättäen. Oireisiin saattaa sisältyä kylmänhikisyys, kalpea ja viileä iho, uupumus, hermostuneisuus tai vapina, ahdistus, epätavallinen väsymys tai heikkous, sekavuus, keskittymisvaikeudet, uneliaisuus, kova nälkä, näköhäiriöt, päänsärky, pahoinvointi ja sydämentykytys (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka). Aikaisemmasta vaikutuksen alkamisesta johtuen hypoglykemia voi ilmaantua Fiasp-pistoksen/infuusion jälkeen nopeammin kuin muilla ateriainsuliineilla.
Iho ja ihonalainen kudos
Lipodystrofiaa (mukaan lukien lipohypertrofiaa ja lipoatrofiaa) ja ihoamyloidoosia voi ilmaantua pistoskohtaan. Ne viivästyttävät insuliinin paikallista imeytymistä. Fiasp-insuliinilla hoidetuilla potilailla pistoskohdassa/infuusiokohdassa esiintyi lipodystrofiaa (0,5 %, vertailuvalmisteella 0,2 %). Pistoskohdan jatkuva vuorottelu sovitulla pistosalueella saattaa vähentää tai ehkäistä näitä muutoksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pistos-/infuusiokohdan reaktiot
Fiasp-insuliinilla hoidetuilla potilailla esiintyi pistoskohdan reaktioita (kuten ihottuma, punoitus, tulehdus, kipu ja mustelmat) (1,3 %, vertailuvalmisteella 1,0 %). Fiasp-insuliinilla hoidetuilla potilailla (N = 261), jotka käyttivät jatkuvaa ihonalaista insuliini-infuusiota (CSII), raportoitiin infuusiokohdan reaktioita (kuten punoitus, tulehdus, ärsytys, kipu, mustelmat ja kutina) (10,0 %, vertailuvalmisteella 8,3 %). Nämä oireet ovat yleensä lieviä ja ohimeneviä, ja tavallisesti ne häviävät hoitoa jatkettaessa.
Pediatriset potilaat
Turvallisuutta ja tehoa on tutkittu varmistavassa hoitotutkimuksessa, johon osallistui iältään vähintään 2- ja alle 18‑vuotiaita tyypin 1 diabetesta sairastavia lapsia. Tutkimuksessa 519 potilasta sai Fiasp-hoitoa. Pediatrisilla potilailla todettujen haittavaikutusten esiintymistiheydessä, tyypissä ja vaikeusasteessa ei yleisesti ottaen todettu eroja aikuisilla saatuun kokemukseen verrattuna. Pistoskohdan lipodystrofiaa (mukaan lukien lipohypertrofiaa ja lipoatropiaa) ilmoitettiin tässä pediatrisilla potilailla tehdyssä tutkimuksessa useammin kuin aikuisilla tehdyissä tutkimuksissa (ks. edellä). Pediatrisilla potilailla ilmoitettiin lipodystrofian esiintymistiheydeksi 2,1 % Fiasp-valmistetta saaneilla ja 1,6 % NovoRapid-valmistetta saaneilla.
Muut erityiset potilasryhmät
Yleisesti aspartinsuliinin kliinisissä tutkimuksissa iäkkäillä ja munuaisten tai maksan vajaatoimintaa sairastavilla potilailla havaittujen haittavaikutusten määrä, tyyppi ja vaikeusaste eivät ole eronneet väestössä yleensä havaituista haittavaikutuksista. Valmisteen turvallisuudesta erittäin iäkkäiden potilaiden (≥ 75-vuotiaat) tai keskivaikeaa tai vaikeaa munuaisten tai maksan vajaatoimintaa sairastavien potilaiden hoidossa on vain vähän tietoa. Fiasp-insuliinia on annettu iäkkäille potilaille farmakokineettisten ominaisuuksien tutkimista varten (ks. kohta Farmakokinetiikka).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Insuliinin yliannostukselle ei ole olemassa erityistä määritelmää. Hypoglykemia saattaa kuitenkin kehittyä vaiheittain, jos potilas saa enemmän insuliinia kuin hän tarvitsee:
- Lievä hypoglykemia voidaan hoitaa antamalla suun kautta rypälesokeria tai sokeria sisältäviä tuotteita. Siksi on suositeltavaa, että diabeetikko pitää aina mukanaan rypälesokeria sisältäviä tuotteita.
- Vakava hypoglykemia, jolloin potilas ei pysty itse hoitamaan itseään, voidaan hoitaa antamalla glukagonia (0,5–1 mg) lihakseen tai ihon alle tai antamalla glukoosia laskimoon. Lihaksensisäisen ja ihonalaisen glukagoni-injektion voi antaa riittävän koulutuksen saanut henkilö. Laskimonsisäisen glukoosin antaa terveydenhuollon ammattilainen. Glukoosia on annettava laskimoon, jos glukagonin antoon ei tule vastetta 10–15 minuutin kuluessa. On suositeltavaa, että tajunnan palattua potilaalle annetaan suun kautta hiilihydraatteja hypoglykemian uusiutumisen estämiseksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, insuliinit ja insuliinijohdokset, lyhytvaikutteiset.
ATC-koodi: A10AB05.
Vaikutusmekanismi
Fiasp on pikavaikutteinen aspartinsuliinivalmiste.
Fiasp-insuliini vaikuttaa ensisijaisesti säätelemällä glukoosiaineenvaihduntaa. Aspartinsuliinin (Fiasp-insuliinin vaikuttava aine), kuten muidenkin insuliinivalmisteiden, vaikutus perustuu insuliinin sitoutumiseen insuliinireseptoreihin. Reseptoriin sitoutunut insuliini alentaa veren glukoosipitoisuutta helpottamalla glukoosin soluunottoa luustolihaksissa ja rasvakudoksessa sekä estämällä maksan glukoosin tuotantoa. Insuliini estää rasvasolujen lipolyysiä, estää proteolyysiä sekä tehostaa proteiinisynteesiä.
Farmakodynaamiset vaikutukset
Fiasp-aspartinsuliinivalmiste on ateriainsuliini, johon on lisätty nikotiiniamidia (B3-vitamiini). Nikotiiniamidin vaikutuksesta insuliini imeytyy alkuvaiheessa nopeammin kuin NovoRapid-valmistetta käytettäessä.
Fiasp-insuliinin vaikutus alkoi 5 minuuttia aikaisemmin ja glukoosi-infuusion huippunopeus saavutettiin 11 minuuttia aikaisemmin kuin NovoRapid-insuliinilla. Fiasp-insuliinin glukoosipitoisuutta alentava vaikutus oli suurimmillaan 1–3 tunnin kuluttua pistoksesta. Fiasp-insuliinin glukoosipitoisuutta alentava vaikutus ensimmäisten 30 minuutin aikana (AUCGIR, 0–30 min) oli Fiasp-insuliinilla 51 mg/kg ja NovoRapid-insuliinilla 29 mg/kg (Fiasp/NovoRapid-suhde: 1,74 [1,47; 2,10]95% CI). Fiasp-insuliinin ja NovoRapid-valmisteen glukoosipitoisuutta alentava kokonaisvaikutus ja suurin glukoosipitoisuutta alentava vaikutus (GIRmax) olivat toisiinsa verrattavat. Fiasp-insuliinin glukoosipitoisuutta alentava kokonais- ja maksimivaikutus suurenee terapeuttisella annosalueella lineaarisesti annosten kasvaessa.
Fiasp-insuliinin vaikutus alkaa aiemmin kuin NovoRapid-insuliinin (ks. kohta Farmakokinetiikka), minkä seurauksena glukoosipitoisuutta alentava varhaisvaikutus on suurentunut. Tämä on otettava huomioon Fiasp-valmistetta määrättäessä.
Fiasp-insuliinin vaikutusaika oli lyhyempi kuin NovoRapid-valmisteella. Vaikutus kesti 3–5 tuntia.
Fiasp-insuliinilla glukoosipitoisuutta alentavan vaikutuksen potilaskohtainen vaihtelu päivästä toiseen oli vähäistä riippumatta siitä, oliko kyseessä glukoosipitoisuutta alentava varhaisvaikutus (AUCGIR, 0-1 h, CV ~26 %), kokonaisvaikutus (AUCGIR, 0-12 h, CV ~18 %) vai maksimivaikutus (GIRmax, CV ~19 %).
Kliininen teho ja turvallisuus
Fiasp-insuliinin tehoa ja turvallisuutta on tutkittu yhteensä 2 068 aikuispotilaalla. Kolmeen satunnaistettuun tutkimukseen (18–26 viikon hoitojakso) osallistui 1 143 potilasta, joilla oli tyypin 1 diabetes, ja 925 potilasta, joilla oli tyypin 2 diabetes. Fiasp-insuliinin tehoa ja turvallisuutta on lisäksi tutkittu satunnaistetussa tutkimuksessa (26 viikon hoitojakso), johon osallistui 777 pediatrista tutkittavaa, joilla oli tyypin 1 diabetes. Tutkimukseen ei satunnaistettu alle 2‑vuotiaita lapsia.
Tyypin 1 diabetes mellitusta sairastavat potilaat
Fiasp-hoidon tehoa glukoositasapainon saavuttamisessa arvioitiin, kun hoito annettiin ennen ateriaa tai aterian jälkeen. Ennen ateriaa annettu Fiasp-insuliini oli vertailukelpoinen (non-inferior) NovoRapid-valmisteeseen verrattuna HbA1c-pitoisuuden alentamisessa, ja HbA1c -pitoisuus parani tilastollisesti merkitsevästi enemmän käytettäessä Fiasp-insuliinia. Aterian jälkeen annettu Fiasp-insuliini alensi HbA1c-pitoisuutta vastaavasti kuin ennen ateriaa annettu NovoRapid (Taulukko 3).
Taulukko 3 Tulokset 26-viikkoisesta kliinisestä basaali-bolus-tutkimuksesta tyypin 1 diabetesta sairastavilla potilailla
Ennen ateriaa annettu Fiasp + detemirinsuliini | Aterian jälkeinen Fiasp + detemirinsuliini | Ennen ateriaa annettu NovoRapid + detemirinsuliini | |
N | 381 | 382 | 380 |
HbA1c (%) | |||
Lähtötaso → Tutkimuksen loppu | 7,6 → 7,3 | 7,6 → 7,5 | 7,6 → 7,4 |
Vakioitu muutos lähtötasosta | -0,32 | -0,13 | -0,17 |
Arvioitu hoitoero | -0,15 [-0,23; -0,07]CE | 0,04 [-0,04; 0,12]D | |
HbA1c (mmol/mol) | |||
Lähtötaso → Tutkimuksen loppu | 59,7 → 56,4 | 59,9 → 58,6 | 59,3 → 57,6 |
Vakioitu muutos lähtötasosta | -3,46 | -1,37 | -1,84 |
Arvioitu hoitoero | -1,62 [-2,50; -0,73]CE | 0,47 [-0,41; 1,36]D | |
Aterianjälkeinen glukoosipitoisuuden nousu (mmol/l) 2 tunnin kuluttuaA | |||
Lähtötaso → Tutkimuksen loppu | 6,1 → 5,9 | 6,1 → 6,7 | 6,2 → 6,6 |
Vakioitu muutos lähtötasosta | -0,29 | 0,67 | 0,38 |
Arvioitu hoitoero | -0,67 [-1,29; -0,04]CE | 0,30 [-0,34; 0,93]D | |
Aterianjälkeinen glukoosipitoisuuden nousu (mmol/l) 1 tunnin kuluttuaA | |||
Lähtötaso → Tutkimuksen loppu | 5,4 → 4,7 | 5,4 → 6,6 | 5,7 → 5,9 |
Vakioitu muutos lähtötasosta | -0,84 | 1,27 | 0,34 |
Arvioitu hoitoero | -1,18 [-1,65; -0,71]CE | 0,93 [0,46; 1,40]D | |
Paino (kg) | |||
Lähtötaso → Tutkimuksen loppu | 78,6 → 79,2 | 80,5 → 81,2 | 80,2 → 80,7 |
Vakioitu muutos lähtötasosta | 0,67 | 0,70 | 0,55 |
Arvioitu hoitoero | 0,12 [-0,30; 0,55]C | 0,16 [-0,27; 0,58]D | |
Vakavien tai verenglukoosista vahvistettujen hypoglykemioidenB määrä potilasaltistusvuotta kohti (% potilaista) | 59,0 (92,7) | 54,4 (95,0) | 58,7 (97,4) |
Arvioitu sairastuvuussuhde | 1,01 [0,88; 1,15]C | 0,92 [0,81; 1,06]D |
Lähtötason ja tutkimuksen lopun arvot on laskettu havaittujen viimeisten käytettävissä olevien arvojen keskiarvon perusteella. 95 %:n luottamusväli on mainittu kohdassa []
A Ateriatesti
B Vakava hypoglykemia (tapahtuma, joka edellyttää toisen henkilön apua) tai verenglukoosipitoisuuden perusteella vahvistettu hypoglykemia, kun plasman glukoosipitoisuus on alle 3,1 mmol/l oireista riippumatta
C Ero ennen ateriaa annetun Fiasp-insuliinin ja ennen ateriaa annetun NovoRapid-valmisteen välillä
D Ero aterianjälkeisen Fiasp-insuliinin ja ennen ateriaa annetun NovoRapid-valmisteen välillä
E Tilastollisesti merkitsevä ennen ateriaa annetun Fiasp-insuliinin eduksi
33,3 % ennen ateriaa Fiasp-insuliinia saaneista potilaista saavutti alle 7 prosentin HbA1c-pitoisuuden tavoitetason. Vastaava osuus oli 23,3 %, kun Fiasp annettiin aterian jälkeen, ja 28,2 %, kun potilaalle annettiin ennen ateriaa NovoRapid-valmistetta. Arvioitu todennäköisyys saavuttaa alle 7 prosentin HbA1c-pitoisuus ennen ateriaa annetulla Fiasp-insuliinilla oli tilastollisesti merkitsevästi suurempi kuin ennen ateriaa annetulla NovoRapid-valmisteella (kerroinsuhde: 1,47 [1,02; 2,13]95% CI). Aterianjälkeisen Fiasp-insuliinin ja ennen ateriaa annetun NovoRapid-valmisteen välillä ei todettu tilastollisesti merkitsevää eroa.
Ennen ateriaa annetun Fiasp-annoksen jälkeen 1 ja 2 tunnin kohdilla mitattu aterianjälkeinen verenglukoosiarvo (PPG) oli merkitsevästi alempi verrattuna ennen ateriaa annettuun NovoRapid-valmisteeseen. Aterian jälkeen annetulla Fiasp-insuliinilla PPG oli 1 tunnin kuluttua korkeampi ja 2 tunnin kuluttua vastaava ennen ateriaa annetun NovoRapid-valmisteen kanssa (Taulukko 3).
Ateriainsuliinin kokonaisannoksen mediaani oli tutkimuksen lopussa ennen ateriaa annetulla Fiasp-insuliinilla, aterianjälkeisellä Fiasp-insuliinilla ja ennen ateriaa annetulla NovoRapid-valmisteella samanlainen (muutos lähtötasosta tutkimuksen lopussa: ennen ateriaa annettu Fiasp: 0,33→0,39 yksikköä/kg/vrk; aterianjälkeinen Fiasp: 0,35→0,39 yksikköä/kg/vrk; ja ennen ateriaa annettu NovoRapid: 0,36→0,38 yksikköä/kg/vrk). Muutos perusinsuliinin kokonaisannoksen mediaaniarvossa lähtötasosta tutkimuksen loppuun oli samanlainen ennen ateriaa annetulla Fiasp-insuliinilla (0,41→0,39 yksikköä/kg/vrk), aterianjälkeisellä Fiasp-insuliinilla (0,43→0,42 yksikköä/kg/vrk) ja ennen ateriaa annetulla NovoRapid-valmisteella (0,43→0,43 yksikköä/kg/vrk).
Tyypin 2 diabetes mellitusta sairastavat potilaat
HbA1c-pitoisuuden lasku lähtötasosta tutkimuksen loppuun vahvistui vertailukelpoiseksi (non-inferior) NovoRapid-valmisteen kanssa (Taulukko 4).
Taulukko 4 Tulokset 26-viikkoisesta kliinisestä basaali-bolus-tutkimuksesta tyypin 2 diabetesta sairastavilla potilailla
Fiasp + glargininsuliini | NovoRapid + glargininsuliini | |
N | 345 | 344 |
HbA1c (%) | ||
Lähtötaso → Tutkimuksen loppu | 8,0 → 6,6 | 7,9 → 6,6 |
Vakioitu muutos lähtötasosta | -1,38 | -1,36 |
Arvioitu hoitoero | -0,02 [-0,15; 0,10] | |
HbA1c (mmol/mol) | ||
Lähtötaso → Tutkimuksen loppu | 63,5 → 49,0 | 62,7 → 48,6 |
Vakioitu muutos lähtötasosta | -15,10 | -14,86 |
Arvioitu hoitoero | -0,24 [-1,60; 1,11] | |
Aterianjälkeinen glukoosipitoisuuden nousu (mmol/l) 2 tunnin kuluttuaA | ||
Lähtötaso → Tutkimuksen loppu | 7,6 → 4,6 | 7,3 → 4,9 |
Vakioitu muutos lähtötasosta | -3,24 | -2,87 |
Arvioitu hoitoero | -0,36 [-0,81; 0,08] | |
Aterianjälkeinen glukoosipitoisuuden nousu (mmol/l) 1 tunnin kuluttuaA | ||
Lähtötaso → Tutkimuksen loppu | 6,0 → 4,1 | 5,9 → 4,6 |
Vakioitu muutos lähtötasosta | -2,14 | -1,55 |
Arvioitu hoitoero | -0,59 [-1,09; -0,09]C | |
Paino (kg) | ||
Lähtötaso → Tutkimuksen loppu | 89,0 → 91,6 | 88,3 → 90,8 |
Vakioitu muutos lähtötasosta | 2,68 | 2,67 |
Arvioitu hoitoero | 0,00 [-0,60; 0,61] | |
Vakavien tai verenglukoosista vahvistettujen hypoglykemioidenB määrä potilasaltistusvuotta kohti (% potilaista) | 17,9 (76,8) | 16,6 (73,3) |
Arvioitu sairastuvuussuhde | 1,09 [0,88; 1,36] | |
Lähtötason ja tutkimuksen lopun arvot on laskettu havaittujen viimeisten käytettävissä olevien arvojen keskiarvon perusteella. 95 %:n luottamusväli on mainittu kohdassa []
A Ateriatesti
B Vakava hypoglykemia (tapahtuma, joka edellyttää toisen henkilön apua) tai verenglukoosipitoisuuden perusteella vahvistettu hypoglykemia, kun plasman glukoosipitoisuus on alle 3,1 mmol/l oireista riippumatta
C Tilastollisesti merkitsevä Fiasp-insuliinin eduksi
Aterianjälkeistä annostusta ei ole tutkittu tyypin 2 diabetesta sairastavilla potilailla.
74,8 % Fiasp-insuliinilla hoidetuista potilaista saavutti alle 7 prosentin HbA1c-pitoisuuden tavoitetason. Vastaava osuus oli 75,9 % NovoRapid-valmistetta saaneilla potilailla. Arvioidussa todennäköisyydessä saavuttaa alle 7 prosentin HbA1c -pitoisuus ei ollut tilastollisesti merkitsevää eroa Fiasp-insuliinin ja NovoRapid-valmisteen välillä.
Ateriainsuliinin kokonaisannoksen mediaani oli tutkimuksen lopussa Fiasp-insuliinilla ja NovoRapid-valmisteella samanlainen (muutos lähtötasosta tutkimuksen lopussa: Fiasp: 0,21→0,49 yksikköä/kg/vrk; ja NovoRapid: 0,21→0,51 yksikköä/kg/vrk). Muutos perusinsuliinin kokonaisannoksen mediaaniarvossa lähtötasosta tutkimuksen loppuun oli samanlainen Fiasp-insuliinilla (0,56→0,53 yksikköä/kg/vrk) ja NovoRapid-valmisteella (0,52→0,48 yksikköä/kg/vrk).
Iäkkäät
Kolmessa kliinisessä kontrolloidussa tutkimuksessa Fiasp-insuliinilla hoidetuista, tyypin 1 tai 2 diabetesta sairastavista 1 219 potilaasta 192 (16 %) oli ≥ 65 vuotta ja 24 (2 %) ≥ 75 vuotta. Turvallisuudessa ja tehossa ei havaittu eroa iäkkäiden ja nuorempien potilaiden välillä.
Jatkuva ihonalainen insuliini-infuusio (CSII)
6 viikon satunnaistetussa (2:1), kaksoissokkoutetussa, kontrolloidussa rinnakkaisryhmätutkimuksessa arvioitiin Fiasp-insuliinin ja NovoRapid-valmisteen vertailukelpoisuutta annosteltaessa CSII-järjestelmässä tyypin 1 diabetesta sairastavissa aikuispotilaissa. Kummassakaan ryhmässä (Fiasp N = 25, NovoRapid N = 12) ei havaittu mikroskooppitutkimuksin vahvistettuja infuusiojärjestelmän tukoksia. Fiasp-ryhmässä oli kaksi potilasta, jotka kumpikin raportoivat kahdesta hoidon aikaisesta infuusiokohdan reaktiosta.
Kaksiviikkoisessa vaihtovuoroisessa tutkimuksessa havaittiin, että vakioidun ateriatestin jälkeen Fiasp-insuliinin vaikutus aterianjälkeisen glukoosipitoisuuden alenemiseen oli suurempi yhden ja kahden tunnin kuluttua ateriasta mitatun glukoosivasteen perusteella (hoitoero: -0,50 mmol/l [-1,07; 0,07]95 % CI ja -0,99 mmol/l, [-1,95; -0,03]95 % CI) NovoRapid-valmisteeseen verrattuna käytettäessä CSII-järjestelmää.
Pediatriset potilaat
Fiasp-insuliinin tehoa ja turvallisuutta on tutkittu 26 viikon pituisessa satunnaistetussa, aktiivikontrolloidussa kliinisessä tutkimuksessa, johon osallistui 1–18-vuotiaita tyypin 1 diabetesta sairastavia lapsia ja nuoria (N = 777). Tutkittavat satunnaistettiin suhteessa 1:1:1. Tutkimuksessa verrattiin aterian yhteydessä (0–2 minuuttia ennen ateriaa) tai aterian jälkeen (20 minuuttia aterian aloittamisen jälkeen) annetun Fiasp-insuliinin ja aterian yhteydessä annetun NovoRapid-insuliinin tehoa ja turvallisuutta. Kumpaakin valmistetta käytettiin yhdessä degludekinsuliinin kanssa.
Fiasp-valmistetta aterian yhteydessä saaneiden haarassa oli 16 iältään 2–5-vuotiasta lasta, 100 iältään 6–11-vuotiasta lasta ja 144 iältään 12–17-vuotiasta nuorta. Fiasp-valmistetta aterian jälkeen saaneiden haarassa oli 16 íältään 2–5-vuotiasta lasta, 100 iältään 6–11-vuotiasta lasta ja 143 iältään 12–17-vuotiasta nuorta.
Aterian yhteydessä annetulla Fiasp-valmisteella saavutettiin parempi glukoositasapaino verrattuna aterian yhteydessä annettuun NovoRapid-valmisteeseen, kun tarkasteltiin muutosta HbA1c-arvossa (arvioitu hoitoero: ‑0,17 % [‑0,30; ‑0,03]95 % CI). Aterian jälkeen annettu Fiasp-valmiste todettiin glukoositasapainon suhteen samanveroiseksi aterian yhteydessä annettuun NovoRapid-valmisteeseen nähden (arvioitu hoitoero: 0,13 % [-0,01; 0,26]95 % CI).
Aterian yhteydessä annettu Fiasp pienensi tilastollisesti merkitsevästi 1 tunti aterian jälkeen mitattua glukoosipitoisuuden keskimääräistä nousua kaikilla kolmella pääaterialla verrattuna NovoRapid-valmisteeseen (itse mitatun plasman glukoosin perusteella). Aterian jälkeen annetun Fiasp-valmisteen osalta tämä vertailu suosi aterian yhteydessä annettua NovoRapid-valmistetta.
Vakavan tai verenglukoosista vahvistetun hypoglykemian kokonaisriskin suurentumista NovoRapid-valmisteeseen verrattuna ei havaittu.
Havaitut vaikutukset ja turvallisuusprofiilit olivat vertailukelpoisia kaikkien ikäryhmien välillä.
Farmakokinetiikka
Imeytyminen
Fiasp-aspartinsuliinivalmiste on ateriainsuliini, johon on lisätty nikotiiniamidia (B3-vitamiini), minkä ansiosta insuliini imeytyy alkuvaiheessa nopeammin. Insuliini havaittiin verenkierrosta noin 4 minuuttia annostelun jälkeen (Kuva 1). NovoRapid-valmisteeseen verrattuna Fiasp-insuliini voitiin havaita kaksi kertaa nopeammin (5 minuuttia aikaisemmin) ja aika 50 prosenttiin enimmäispitoisuudesta oli 9 minuuttia lyhyempi eli ensimmäisen 15 minuutin aikana insuliinia on käytettävissä neljä kertaa enemmän ja ensimmäisen 30 minuutin aikana kaksinkertainen määrä.
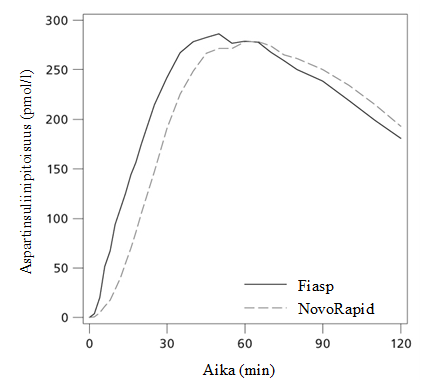
Kuva 1 Keskimääräinen insuliiniprofiili tyypin 1 diabetes mellitusta sairastavilla potilailla ihon alle annetun pistoksen jälkeen.
Insuliinin kokonaisaltistuminen oli Fiasp- ja NovoRapid-insuliineilla keskenään verrannollinen. Keskimääräinen Cmax, kun annos on 0,2 yksikköä/kg, on 298 pmol/l ja verrattavissa NovoRapid-valmisteeseen.
Fiasp-insuliinin kokonaisaltistus ja maksimipitoisuus kasvavat terapeuttisella annosalueella suhteessa ihon alle pistettyjen annosten suuruuteen.
Aspartinsuliinin absoluuttinen biologinen hyötyosuus Fiasp-insuliinin ihon alle vatsan, olkavarren tai reiden alueelle annetun pistoksen jälkeen oli noin 80 %.
Fiasp-insuliinin vaikutus alkaa annon jälkeen nopeasti pistoskohdasta riippumatta. Aika enimmäispitoisuuteen ja aspartinsuliinin kokonaisaltistus olivat toisiinsa verrattavissa vatsan alueelle, olkavarteen ja reiteen pistettäessä. Varhainen insuliinialtistus ja enimmäispitoisuus olivat toisiinsa verrattavissa vatsan alueelle ja olkavarteen pistettäessä, mutta alhaisempia pistettäessä annos reiteen.
Jatkuva ihonalainen insuliini-infuusio (CSII)
Altistumisen alkaminen (aika, joka kuluu enimmäispitoisuuden saavuttamiseen) käytettäessä CSII-järjestelmää oli Fiasp-insuliinilla 26 minuuttia lyhyempi NovoRapid-valmisteeseen verrattuna, minkä seurauksena insuliinia oli ensimmäisten 30 minuutin aikana käytettävissä noin kolmikertainen määrä (Kuva 2).
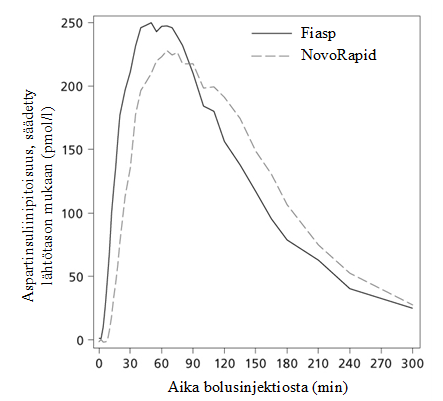
Kuva 2 Keskiarvoiset insuliiniprofiilit tyypin 1 diabetesta sairastavilla, CSII-järjestelmää käyttävillä potilailla (0–5 h), korjattuna lähtötason insuliini-infuusion mukaan
Jakautuminen
Aspartinsuliini sitoutuu heikosti plasman proteiineihin (< 10 %), samalla tavoin kuin tavallinen ihmisinsuliini.
Jakautumistilavuus (Vd) oli laskimonsisäisen annon jälkeen 0,22 l/kg (esim. 15,4 l, jos potilas painoi 70 kg) ja vastaa ihmiskehon solujen ulkopuolista nestetilavuutta.
Biotransformaatio
Aspartinsuliini hajoaa samalla tavoin kuin ihmisinsuliini. Kaikki muodostuvat metaboliitit ovat inaktiivisia.
Eliminaatio
Fiasp-insuliinin puoliintumisaika ihon alle annetun pistoksen jälkeen on 57 minuuttia, mikä on verrattavissa NovoRapid-valmisteen puoliintumisaikaan.
Laskimonsisäisen annostelun jälkeen Fiasp poistui elimistöstä nopeasti (1 l/h/kg) ja eliminaation puoliintumisaika oli 10 minuuttia.
Erityiset potilasryhmät
Iäkkäät
Tyypin 1 diabetesta sairastavilla iäkkäillä potilailla altistuminen alkoi Fiasp-insuliinia käytettäessä aikaisemmin ja korkeampana säilyttäen samalla kokonaisaltistuksen ja enimmäispitoisuuden, jotka olivat verrattavissa NovoRapid-valmisteeseen.
Kokonaisaltistus aspartinsuliinille ja enimmäispitoisuus Fiasp-insuliinin antamisen jälkeen oli 30 % korkeampi iäkkäissä potilaissa verrattuna nuorempiin aikuispotilaisiin.
Sukupuoli
Sukupuolen vaikutus Fiasp-insuliinin farmakokinetiikkaan selvitettiin analysoimalla kaikki farmakokineettiset tutkimukset. Tyypin 1 diabetesta sairastavilla potilailla altistuminen alkoi Fiasp-insuliinia käytettäessä aikaisemmin ja säilyi korkeampana ja samalla kokonaisaltistus ja enimmäispitoisuus olivat verrattavissa NovoRapid-valmisteeseen niin mies- kuin naispotilaillakin.
Varhainen altistuminen ja enimmäisaltistuminen olivat tyypin 1 diabetesta sairastavilla miehillä ja naisilla toisiinsa verrattavissa. Kokonaisaltistuminen oli kuitenkin suurempi tyypin 1 diabetesta sairastavilla naisilla kuin miehillä.
Lihavuus
Alkuvaiheen imeytymisnopeus oli hitaampaa, jos potilaalla oli suurempi painoindeksi (BMI), mutta kokonaisaltistus oli samantasoinen painoindeksistä riippumatta. Painoindeksin vaikutus Fiasp-insuliinin imeytymiseen oli NovoRapid-valmisteeseen verrattuna heikompi, minkä seurauksena alkuvaiheen altistuminen oli suhteellisesti hieman korkeampi.
Rotu ja etninen tausta
Rodun ja etnisen taustan (mustat vs. valkoihoiset, latinalaisamerikkalaiset vs. muut) vaikutus Fiasp-insuliinin kokonaisaltistukseen perustuu tyypin 1 diabetesta sairastavien potilaiden farmakokineettisen populaatioanalyysin tuloksiin. Altistumisessa Fiasp-insuliinille ei todettu eroja eri rotujen ja eri etnisiin ryhmiin kuuluvien ihmisten välillä.
Maksan vajaatoiminta
Aspartinsuliinin kerta-annoksen farmakokinetiikkaa tutkittiin 24 koehenkilöllä, joiden maksan toiminta vaihteli normaalista vaikeaan vajaatoimintaan, käyttämällä NovoRapid-valmistetta. Maksan vajaatoimintaa sairastavien imeytymisnopeus oli pienentynyt ja vaihtelevampi.
Munuaisten vajaatoiminta
Aspartinsuliinin kerta-annoksen farmakokinetiikkaa tutkittiin 18 koehenkilöllä, joiden munuaisten toiminta vaihteli normaalista vaikeaan vajaatoimintaan, käyttämällä NovoRapid-valmistetta. Kreatiniinipuhdistuman arvoilla ei ollut selvää vaikutusta aspartinsuliinin AUC-, Cmax-, CL/F- ja Tmax-arvoihin. Tietoa oli rajoitetusti potilaista, joilla on kohtalainen ja vaikea munuaisten vajaatoiminta. Potilaita, joiden munuaisten vajaatoiminta vaati dialyysihoitoa, ei tutkittu.
Pediatriset potilaat
Lapsilla (6–11 vuotta) ja nuorilla (12–18 vuotta) altistuminen alkoi Fiasp-insuliinia käytettäessä aikaisemmin ja varhainen insuliinialtistus oli suurempi, ja samalla kokonaisaltistus ja enimmäispitoisuus säilyivät samanlaisina kuin NovoRapid-valmisteella.
Fiasp-insuliinin vaikutuksen alkaminen ja varhainen altistuminen olivat lapsilla ja nuorilla samanlaiset kuin aikuisilla. Kokonaisaltistus käytettäessä Fiasp-insuliinia oli lapsilla ja nuorilla aikuisiin verrattuna alhaisempi, kun annostus oli 0,2 yksikköä/kg, mutta aspartinsuliinin suurin pitoisuus seerumissa oli kuitenkin vastaava kaikissa ikäryhmissä.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta sekä lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille aspartinsuliinille altistumisen jälkeen. In vitro -kokeissa, joissa testattiin myös sitoutumista insuliini- ja IGF-1-reseptoreihin sekä vaikutusta solujen kasvuun, aspartinsuliini käyttäytyi lähes samoin kuin ihmisinsuliini. Tulokset osoittavat myös, että aspartinsuliini irtosi insuliinireseptoreista kuten ihmisinsuliini.
Farmaseuttiset tiedot
Apuaineet
Fenoli, metakresoli, glyseroli, sinkkiasetaatti, dinatriumfosfaattidihydraatti, arginiinihydrokloridi, nikotiiniamidi (B3-vitamiini), kloorivetyhappo (pH:n säätöön), natriumhydroksidi (pH:n säätöön), injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa laimentaa tai sekoittaa muiden lääkevalmisteiden kuin kohdassa Käyttö- ja käsittelyohjeet mainittujen infuusionesteiden kanssa.
Kestoaika
30 kuukautta.
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos esitäytetyssä kynässä
Ensimmäisen avaamisen jälkeen tai mukana varalla kuljetettavaa lääkettä saa säilyttää enintään 4 viikkoa. Säilytä alle 30°C. Voidaan säilyttää jääkaapissa (2°C - 8°C). Ei saa jäätyä. Pidä kynän suojus paikallaan. Herkkä valolle.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos sylinteriampullissa
Ensimmäisen avaamisen jälkeen tai mukana varalla kuljetettavaa lääkettä saa säilyttää enintään 4 viikkoa. Säilytä alle 30°C. Älä säilytä kylmässä. Ei saa jäätyä. Mikäli käyttämätöntä varasylinteriampullia kuljetetaan mukana, se on säilytettävä ulkopakkauksessa. Herkkä valolle.
Fiasp 100 yksikköä/ml injektioneste, liuos injektiopullossa
Ensimmäisen avaamisen jälkeen lääkevalmistetta voi säilyttää enintään 4 viikon ajan (sisältäen ajan pumpun säiliössä, ks. kohta Käyttö- ja käsittelyohjeet). Säilytä alle 30°C. Voidaan säilyttää jääkaapissa (2°C - 8°C). Ei saa jäätyä. Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos sylinteriampullissa
Ensimmäisen avaamisen jälkeen tai mukana varalla kuljetettavaa lääkettä saa säilyttää enintään 2 viikkoa alle 30 °C:ssa. Sen jälkeen sitä voidaan käyttää enintään 7 päivää alle 37 °C:ssa sellaisessa insuliinipumppujärjestelmässä, joka on suunniteltu käytettäväksi tämän sylinteriampullin kanssa, (ks. kohta Käyttö- ja käsittelyohjeet). Älä säilytä kylmässä. Ei saa jäätyä. Mikäli käyttämätöntä varasylinteriampullia kuljetetaan mukana, se on säilytettävä ulkopakkauksessa. Herkkä valolle.
Säilytys
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos esitäytetyssä kynässä
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä. Älä säilytä liian lähellä jääkaapin kylmälevyä. Pidä kynän suojus paikallaan. Herkkä valolle.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos sylinteriampullissa
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä. Älä säilytä liian lähellä jääkaapin kylmälevyä. Pidä sylinteriampulli ulkopakkauksessa. Herkkä valolle.
Fiasp 100 yksikköä/ml injektioneste, liuos injektiopullossa
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä. Älä säilytä liian lähellä jääkaapin kylmälevyä. Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos sylinteriampullissa
Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä. Älä säilytä liian lähellä jääkaapin kylmälevyä. Pidä sylinteriampulli ulkopakkauksessa. Herkkä valolle.
Avatun tai mukana varalla kuljetettavan lääkevalmisteen säilytys, katso kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FIASP injektioneste, liuos
100 U/ml (L:ei) 10 ml (16,61 €)
FIASP FLEXTOUCH injektioneste, liuos, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (30,77 €)
FIASP PENFILL injektioneste, liuos, sylinteriampulli
100 U/ml (L:ei) 5 x 3 ml (27,85 €)
FIASP PUMPCART injektioneste, liuos, sylinteriampulli
100 U/ml (L:ei) 5 x 1,6 ml (15,13 €)
PF-selosteen tieto
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos esitäytetyssä kynässä
Sylinteriampulli (tyypin 1 lasia), joka sisältää halogeenibutyylistä valmistetun kumimännän ja halogeenibutyylistä/polyisopreenista valmistetun kumisulkimen. Sylinteriampulli on kertakäyttöisessä, esitäytetyssä, polypropeenista, polyoksimetyleenistä, polykarbonaatista ja akrylonitriilibutadieenistyreenistä valmistetussa moniannoskynässä.
Jokainen esitäytetty kynä sisältää 3 ml liuosta.
Pakkauskoot: 1 (neulojen kanssa tai ilman) esitäytetty kynä, 5 (ilman neuloja) esitäytettyä kynää ja monipakkaus, joka sisältää 10 (2 pakkausta, joissa 5 kynää) (ilman neuloja) esitäytettyä kynää.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos sylinteriampullissa
Pakkauksessa on sylinteriampulli (tyypin 1 lasia), joka sisältää halogeenibutyylistä valmistetun kumimännän ja halogeenibutyylistä/polyisopreenista valmistetun kumisulkimen.
Jokainen sylinteriampulli sisältää 3 ml liuosta.
Pakkauskoot: 5 ja 10 sylinteriampullia.
Fiasp 100 yksikköä/ml injektioneste, liuos injektiopullossa
Injektiopullo (tyypin 1 lasia) on suljettu halogeenibutyylistä/polyisopreenista valmistetulla kumilevyllä ja suojaavalla muovihatulla, joka paikoillaan ollessaan on osoitus pullon koskemattomuudesta.
Jokainen injektiopullo sisältää 10 ml liuosta.
Pakkauskoot: 1 tai 5 injektiopulloa tai viiden injektiopullon monipakkaus (kussakin pakkauksessa 5 x 1 injektiopulloa).
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos sylinteriampullissa
Pakkauksessa on sylinteriampulli (tyypin 1 lasia), joka sisältää halogeenibutyylistä valmistetun kumimännän ja halogeenibutyylistä/polyisopreenista valmistetun kumisulkimen.
Jokainen sylinteriampulli sisältää 1,6 ml liuosta.
Pakkauskoot: 5 sylinteriampullia ja 25 sylinteriampullin monipakkaus (kussakin pakkauksessa 5 x 5 sylinteriampullia.
Valmisteen kuvaus:
Kirkas, väritön vesiliuos.
Käyttö- ja käsittelyohjeet
Fiasp-insuliinia ei saa käyttää, ellei liuos ole kirkasta ja väritöntä.
Jäätynyttä Fiasp-insuliinia ei saa käyttää.
Fiasp 100 yksikköä/ml FlexTouch injektioneste, liuos esitäytetyssä kynässä
Esitäytetty kynä (FlexTouch) on suunniteltu käytettäväksi kynäneuloja koskevan ISO-standardin mukaisesti kehitettyjen, 4–8 mm:n pituisten ja kooltaan 30–32 G:n injektioneulojen kanssa vain ihon alle annettaviin pistoksiin.
Neulat ja esitäytetyt kynät on tarkoitettu vain henkilökohtaiseen käyttöön. Sylinteriampullia ei saa täyttää uudelleen.
Potilaan on hävitettävä neula jokaisen pistoksen jälkeen.
Fiasp 100 yksikköä/ml Penfill injektioneste, liuos sylinteriampullissa
Sylinteriampulli (Penfill) on suunniteltu käytettäväksi Novo Nordiskin kestokäyttöisten insuliinikynien ja kynäneuloja koskevan ISO-standardin mukaisesti kehitettyjen, 4–8 mm:n pituisten ja kooltaan 30–32 G:n injektioneulojen kanssa vain ihon alle annettaviin pistoksiin.
Neulat ja sylinteriampullit on tarkoitettu vain henkilökohtaiseen käyttöön. Sylinteriampullia ei saa täyttää uudelleen.
Potilaan on hävitettävä neula jokaisen pistoksen jälkeen.
Fiasp 100 yksikköä/ml injektioneste, liuos injektiopullossa
Neulat ja ruiskut on tarkoitettu vain henkilökohtaiseen käyttöön.
Potilaan on hävitettävä neula jokaisen pistoksen jälkeen.
Annostelu jatkuvana ihonalaisena insuliini-infuusiona (CSII)
Kun Fiasp-insuliini on otettu injektiopullosta, sitä voidaan käyttää infuusiopumppujärjestelmässä (jatkuva ihonalainen infuusio, CSII) enintään 6 vuorokauden ajan, kuten on kuvattu kohdassa Annostus ja antotapa ja pakkausselosteessa. Letkut, joiden sisäpintamateriaali on polyeteeniä tai polyolefiinia, on tutkittu ja todettu yhteensopiviksi pumppukäytön kanssa.
Anto laskimoon
Fiasp säilyy käyttökelpoisena huoneenlämmössä 24 tuntia infuusionesteissä, kuten natriumkloridi-injektioliuoksessa (9 mg/ml, 0,9 %) tai glukoosi-injektioliuoksessa (5 %).
Laskimoon annettaessa sitä tulee käyttää pitoisuuksilla 0,5–1 yksikköä/ml aspartinsuliinia infuusionesteessä, käyttäen polypropyleeni-infuusiopusseja.
Fiasp 100 yksikköä/ml PumpCart injektioneste, liuos sylinteriampullissa
Sylinteriampulli on tarkoitettu vain henkilökohtaiseen käyttöön eikä sitä saa täyttää uudelleen.
Sylinteriampulli (PumpCart) on tarkoitettu käytettäväksi vain seuraavissa insuliinipumppujärjestelmissä: Accu-Chek Insight- ja YpsoPump-insuliinipumppu. Letkut, joiden sisäpintamateriaali on polyeteeniä tai polyolefiinia, on tutkittu ja todettu yhteensopiviksi pumppukäytön kanssa.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
FIASP injektioneste, liuos
100 U/ml 10 ml
FIASP FLEXTOUCH injektioneste, liuos, esitäytetty kynä
100 U/ml 5 x 3 ml
FIASP PENFILL injektioneste, liuos, sylinteriampulli
100 U/ml 5 x 3 ml
FIASP PUMPCART injektioneste, liuos, sylinteriampulli
100 U/ml 5 x 1,6 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
ATC-koodi
A10AB05
Valmisteyhteenvedon muuttamispäivämäärä
18.08.2021
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
