CYSTADROPS silmätipat, liuos 3,8 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml valmistetta sisältää merkaptamiinihydrokloridia määrän, joka vastaa 3,8 mg merkaptamiinia (kysteamiinina).
Apuaineet, joiden vaikutus tunnetaan:
Yksi ml silmätippaliuosta sisältää 0,1 mg bentsalkoniumkloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Silmätippaliuos.
Kliiniset tiedot
Käyttöaiheet
Cystadrops on tarkoitettu sarveiskalvon kystiinikidejäämien hoitoon kystinoosista kärsivillä aikuisilla ja yli 6 kuukauden ikäisillä lapsilla.
Ehto
Hoito tulee aloittaa vain kystinoosin hoitoon erikoistuneen lääkärin valvonnassa.
Annostus ja antotapa
Cystadrops-hoito pitää aloittaa sellaisen lääkärin valvonnassa, jolla on kokemusta kystinoosin hoidosta.
Annostus
Suositeltu annos on yksi tippa kumpaankin silmään 4 kertaa päivässä valveillaoloaikana. Suositeltu väli antojen välillä on 4 tuntia. Annosta voidaan vähentää vaiheittain (vähintään 1 tipan kokonaispäiväannokseen kumpaankin silmään) silmäklinikkatutkimuksen (esimerkiksi sarveiskalvon kystiinikidejäämien, valonarkuuden) perusteella.
Jos anto jää väliin, potilasta pitää kehottaa jatkamaan hoitoa seuraavalla annolla.
Annos ei saa ylittää 4 tippaa päivässä silmää kohden.
Sarveiskalvon kystiinikiteiden kertyminen lisääntyy, jos Cystadrops-hoito keskeytetään. Hoitoa ei saisi lopettaa.
Pediatriset potilaat
Cystadrops-valmistetta voi käyttää yli 6 kuukauden ikäisillä lapsilla samoina annoksina kuin aikuisilla (katso kohta Farmakodynamiikka).
Cystadrops-valmisteen turvallisuutta ja tehoa alle 6 kuukauden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Annetaan silmään.
Ennen ensimmäistä antokertaa potilasta pitää neuvoa lämmittämään Cystadrops huonelämpöiseksi käytön helpottamiseksi. Potilasta pitää neuvoa pitämään avattu tiputinpullo huonelämpötilassa.
Tahmeiden silmien välttämiseksi aamuisin potilasta pitää neuvoa ottamaan päivän viimeisen tipan vähintään 30 minuuttia ennen nukkumaan menoa.
Pipetin ja liuoksen likaantumisen estämiseksi on varottamasta koskettamasta silmäluomia, ympäröiviä alueita tai muita pintoja tiputinpullon tiputtimella.
Potilasta pitää neuvoa hävittämään tiputinpullo 7 päivän käytön jälkeen.
Jos samanaikaisesti käytetään muita silmään annettavia lääkevalmisteita, antojen välillä pitää odottaa kymmenen minuuttia. Silmävoiteet pitää antaa viimeiseksi.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Piilolinssit
Bentsalkoniumkloridin tiedetään aiheuttavan värimuutoksia pehmeissä piilolinsseissä. Kosketusta pehmeitten piilolinssien kanssa pitäisi välttää. Potilaita pitäisi neuvoa poistamaan piilolinssit ennen silmätippojen antamista ja odottamaan vähintään 15 minuuttia, ennen kuin laittavat piilolinssit takaisin silmiin.
Apuaineet, joiden vaikutus tunnetaan:
Cystadrops sisältää bentsalkoniumkloridia, joka voi ärsyttää silmää.
Bentsalkoniumkloridin, jota yleisesti käytetään silmätuotteiden säilöntäaineena, on raportoitu aiheuttavan pistekeratopatiaa ja/tai toksista haavaista keratopatiaa. Seuranta on välttämätöntä.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Koska kysteamiinin suositeltu kokonaispäiväannos on vain noin 0,4 % suurimmasta suositellusta kysteamiinin suun kautta annettavasta annoksesta missä tahansa ikäryhmässä, mitään yhteisvaikutuksia suun kautta annettavien lääkevalmisteiden kanssa ei odoteta ilmenevän.
Raskaus ja imetys
Kysteamiinin suositeltu kokonaispäiväannos on vain noin 0,4 % suurimmasta suositellusta kysteamiinin suun kautta annettavasta annoksesta missä tahansa ikäryhmässä. Silmään antamisen kautta tapahtuva systeeminen altistuminen on siksi alhaisempi kuin suun kautta annettaessa. Vaikka mitään vaikutuksia ei odoteta ilmenevän raskauden tai imetyksen aikana, koska systeeminen altistuminen kysteamiinille on mitätön, varotoimiin pitäisi ryhtyä, kun kysteamiinia otetaan samanaikaisesti suun kautta.
Raskaus
Kysteamiinin käytöstä raskaana olevilla naisilla ei ole riittäviä tietoja. Eläinkokeet ovat osoittaneet lisääntymismyrkyllisyyttä, mukaan lukien teratogeenisuuden (katso kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta. Hoitamattoman kystinoosin vaikutusta raskauteen ei myöskään tunneta.
Siksi suun kautta annettavaa kysteamiinia ei pitäisi käyttää raskauden, erityisesti kolmen ensimmäisen kuukauden, aikana, ellei se ole selvästi välttämätöntä.
Jos raskaus todetaan tai sitä suunnitellaan, hoito on harkittava huolellisesti uudelleen ja potilasta on varoitettava kysteamiinin mahdollisesta teratogeenisuuden riskistä.
Imetys
Kysteamiinin erittymistä äidinmaitoon ei tunneta. Kuitenkin imettävillä emoilla ja vastasyntyneillä tehtyjen eläinkokeiden tulosten perusteella (katso kohta Prekliiniset tiedot turvallisuudesta) suun kautta kysteamiinia ottavien naisten ei pitäisi imettää.
Hedelmällisyys
Käytettävissä ei ole tietoja kysteamiinin vaikutuksesta ihmisen hedelmällisyyteen. Eläinkokeet ovat osoittaneet hedelmällisyyden vähenemistä (katso kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Cystadrops-valmisteella voi olla vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn.
Tilapäisesti (keskimäärin alle 1 minuutti) sumentunut näkö tai muut visuaaliset häiriöt voivat vaikuttaa ajokykyyn ja koneiden käyttökykyyn.
Jos näkö sumenee annon yhteydessä, potilaan pitää odottaa selkeän näön palautumista ennen ajamista tai koneiden käyttöä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat silmäkipu, silmän verekkyys, silmän kutina, lisääntynyt lakrimaatio, sumentunut näkö tai silmän ärsytys. Useimmat näistä haittavaikutuksista ovat tilapäisiä ja lieviä tai kohtalaisia.
Haittavaikutustaulukko
Cystadrops-valmisteella raportoitiin seuraavia haittavaikutuksia kliinisten kokeiden ja ranskalaisen NPU-ohjelman yhteydessä. Raportoidut haittavaikutukset luetellaan seuraavassa elinluokan ja yleisyyden mukaan järjestettynä.
Yleisyydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| Elinluokka | Haittavaikutukset |
| Silmät | Hyvin yleinen: silmäkipu, sumentunut näkö, silmän ärsytys, silmän verekkyys, silmän kutina, lisääntynyt lakrimaatio, silmän keräytymät Yleinen: epänormaali tunne silmässä, kuiva silmä, roskan tunne silmässä, silmäluomen ödeema, silmäluomen ärsytys, näön heikentyminen, näärännäppy |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen: epämukava tunne antopaikassa (lähinnä tahmeat silmät ja ripset) Yleinen: kipu antopaikassa |
Pediatriset potilaat
Haittavaikutusten yleisyys, tyyppi ja vakavuus ovat lapsilla samat kuin aikuisilla.
74 pediatrista potilasta seurattiin kliinisissä kokeissa ranskalaisessa NPU-ohjelmassa. 5 potilasta oli alle 2 vuoden ikäisiä (nuorin oli 13 kuukauden ikäinen), 19 potilasta oli alle 6 vuoden ikäisiä, 21 oli 6-12 vuoden ikäisiä ja 29 oli 12-18 vuoden ikäisiä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus on epätodennäköinen silmään annettaessa.
Jos lääkevalmistetta niellään vahingossa, pitää järjestää potilaan seuranta ja oireiden hoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: silmätautien lääkkeet, muut silmätautien lääkkeet, ATC-koodi: S01XA21.
Vaikutusmekanismi
Kysteamiini vähentää sarveiskalvon kystiinikiteiden kertymistä muuntamalla kystiinin kysteiiniksi sekä kysteiini-kysteamiinidisulfideiksi.
Kliininen teho ja turvallisuus
Cystadrops-valmisteella tehtiin kolme kliinistä tutkimusta:
- yksihaarainen kliininen tutkimus 8 lapsella ja aikuisella (OCT-1-tutkimus)
- satunnaistettu, avoin, aktiivisesti kontrolloitu vaiheen III kliininen monikeskustutkimus (CHOC-tutkimus) 32 potilaalla
- avoin, yhdellä hoitoryhmällä toteutettu monikeskustutkimus (CYT-C2-001) 5 potilaalla, jotka olivat alle 2 vuoden ikäisiä.
OCT-1-tutkimus
Tässä tutkimuksessa arvioitiin Cystadrops-valmisteen turvallisuutta ja tehoa 5 vuoden aikana. Annosta tarkistettiin silmätutkimusten jälkeen. Yksikään potilaista ei keskeyttänyt hoitoa 5 vuoden seuranta-aikana.
Tehoa arvioitiin in vivo -konfokaalimikroskopian kokonaispisteillä (IVCM-pisteillä) laskemalla kystiinikiteet sarveiskalvon 7 kerroksessa. 30 päivän hoidon jälkeen mediaanitaajuuden ollessa 4 antoa päivässä, havaittiin 30 %:n lasku IVCM-kokonaispisteissä. Keskimääräinen 30 %:n vähennys sarveiskalvon kystiinikidejäämissä verrattuna lähtötasoon säilyi ajan mukana mediaaniannostuksen ollessa 3 tippaa silmää kohden päivässä (vaihteluväli 1-3 tippaa) 7:llä 8 potilaasta. Valonarkuus yleisesti ottaen parani ajan mukana.
CHOC-tutkimus
Tämä tutkimus oli satunnaistettu, kontrolloitu tutkimus, jossa arvioitiin Cystadrops-valmisteen tehoa ja turvallisuutta 90 päivän hoidon jälkeen annostuksen ollessa 4 tippaa silmää kohden päivässä. IVCM-kokonaispisteet olivat ensisijainen tehon mitta. 15 potilasta käytti Cystadrops-valmistetta. Keskimääräiset IVCM-kokonaispisteet laskettiin 11 potilaalle. IVCM-kokonaispisteiden aleneminen Cystadrops-haarassa oli todettavissa 30. päivänä. Keskimääräinen 40 %:n väheneminen vahvistettiin Cystadrops-haarassa 90. päivänä. Cystadrops-valmisteen paremmuus verrattuna kontrollihaaraan tuli osoitetuksi (kysteamiinihydrokloridi 0,10 %) p<0,0001 95 % CI (2,11; 5,58). Tutkija osoitti Cystadrops-valmisteen paremmuuden kontrollihaaraan verrattuna myös valonarkuuden osalta (kysteamiinihydrokloridi 0,10 %) p=0,0048 95 % CI (0,23; 1,14).
Pediatriset potilaat
Kliinisiä tietoja turvallisuudesta ja tehosta kerättiin 3 kliinisen tutkimuksen aikana (OCT-1-, CHOC- ja CYT-C2-001-tutkimukset). Kaikkiaan 20 pediatrista potilasta käytti Cystadrops-valmistetta. Näistä 5 oli alle 2 vuoden ikäisiä. Nuorin tutkimukseen otettu potilas oli 13 kuukauden ikäinen. Tulokset tehon ja turvallisuuden osalta ovat samanlaiset sekä lapsi- että aikuisväestöllä.
Farmakokinetiikka
Ihmisen farmakokinetiikan arviointia Cystadrops-valmisteen silmään antamisen jälkeen ei suoritettu.
Samoin kuin muiden silmään annettavien silmätuotteiden kanssa systeeminen imeytyminen on todennäköistä.
Huomattakoon kuitenkin, että silmätippoina annettavan kysteamiinin suositeltu päiväannos on vain noin 0,4 % suurimmasta suositellusta kysteamiinin suun kautta annettavasta annoksesta missä tahansa ikäryhmässä.
Prekliiniset tiedot turvallisuudesta
Silmään annon jälkeisen systeemisen altistumisen odotetaan olevan vähäistä. Kun kysteamiinia käytetään samanaikaisesti annettuna silmään ja suun kautta, silmään annon vaikutuksen systeemiseen riskiin katsotaan olevan vähäinen.
Prekliiniset tiedot suun kautta annettavasta kysteamiinista:
Geenitoksisuustutkimuksia on tehty: kromosomimuutoksia viljellyissä aitotumallisissa solulinjoissa on raportoitu ja erityistutkimukset kysteamiinilla eivät osoittaneet mitään mutageenisia vaikutuksia Ames-testissä tai mitään klastogeenisia vaikutuksia hiiren mikrotumatestissä.
Lisääntymistutkimukset osoittivat embryofetotoksisia vaikutuksia (resorptioita ja kiinnittymisen jälkeisiä menetyksiä) rotilla 100 mg/kg/päivä -annostasolla ja kaneilla, jotka saivat kysteamiinia 50 mg kg:aa kohden päivässä. Teratogeenisia vaikutuksia on kuvattu rotilla, joille on annettu kysteamiinia organogeneesin aikana 100 mg kg:aa kohden päivässä.
Tämä vastaa rotalla annosta 0,6 g/m2/päivä, joka on alle puolet kysteamiinin suositellusta kliinisestä ylläpitoannoksesta 1,30 g/m2/päivä. Hedelmällisyyden vähentymistä havaittiin rotilla tasolla 375 mg/kg/päivä, annoksella, jossa kehon painon kasvu oli jälkeenjäänyttä. Tällä annoksella jälkeläisten painon kasvu ja henkiinjääminen imetyksen aikana väheni myös. Suuret kysteamiiniannokset heikentävät imettävien emojen kykyä ruokkia pentuja. Lääkkeen yksittäisannokset estävät prolaktiinin erittymisen eläimillä.
Kysteamiinin antaminen vastasyntyneille rotille aiheutti kaihia.
Suuret kysteamiiniannokset, joko suun kautta tai parenteraalisesti annettuina, aiheuttivat pohjukaissuolen haavoja rotilla ja hiirillä mutta ei apinoilla. Kokeellinen lääkkeen antaminen aiheuttaa somatostatiinin loppumista useilla eläinlajeilla. Tämän merkitystä lääkkeen kliiniselle käytölle ei tunneta.
Kysteamiinilla ei ole tehty karsinogeenisia tutkimuksia.
Farmaseuttiset tiedot
Apuaineet
Bentsalkoniumkloridi
Dinatriumedetaatti
Karmelloosinatrium
Sitruunahappomonohydraatti
Natriumhydroksidi (pH-arvon säätämistä varten)
Kloorivetyhappo (pH-arvon säätämistä varten)
Injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
6 kuukautta
Avaamisen jälkeen: 7 päivää. Säilytä alle 25°C. Älä säilytä kylmässä. Pidä silmätippapullo tiiviisti suljettuna ulkopakkauksessa valolta suojaamiseksi.
Säilytys
Ennen avaamista:
Säilytä jääkaapissa (2°C - 8°C).
Pidä pullo ulkopakkauksessa valolta suojaamiseksi.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CYSTADROPS silmätipat, liuos
3,8 mg/ml (L:ei) 4 x 5 ml (5174,60 €)
PF-selosteen tieto
5 ml:n liuos 10 ml:n keltaisessa lasipullossa, joka on suljettu bromobutyylitulpalla ja tiiviillä alumiinisella repäisykannella. PVC-muovinen tiputin, jossa on HDPE-suljin, on pakattu erikseen ja sisältyy jokaiseen ulkopakkaukseen.
Jokainen kartonkiulkopakkaus sisältää 1 pullon ja 1 tiputtimen.
Yhden kartonkilaatikon pakkaus tai neljä kartonkilaatikkoa sisältävä monipakkaus.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Viskoosi, väritön liuos.
Käyttö- ja käsittelyohjeet
Potilasta pitäisi neuvoa noudattamaan seuraavia pullon avaamista ja pipetin liittämistä koskevia ohjeita:
- Pese kätesi huolellisesti, jotta vältät pullon sisällön mikrobiologisen likaantumisen.
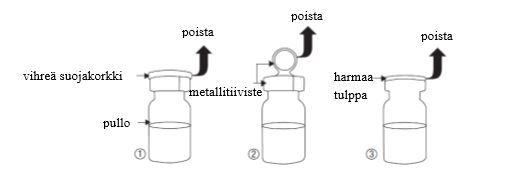
- Poista vihreä suojakorkki (kuva 1).
- Poista metallitiiviste (kuva 2).
- Poista harmaa tulppa (kuva 3) pullosta.
- Älä koske pullon aukkoon poistettuasi harmaan tulpan.
- Ota tiputin pussistaan koskettamatta pulloon liitettävää päätä, kiinnitä se pulloon (kuva 4) äläkä irrota sitä.
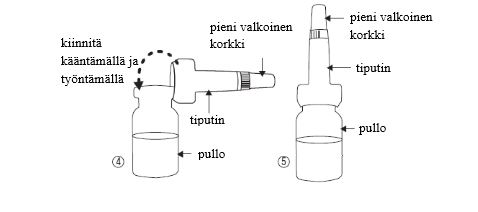
- Varmista, että et hukkaa pientä valkoista korkkia (kuva 5), joka tulee tiputtimen päällä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
CYSTADROPS silmätipat, liuos
3,8 mg/ml 4 x 5 ml
- Ei korvausta.
ATC-koodi
S01XA21
Valmisteyhteenvedon muuttamispäivämäärä
01.06.2025
Yhteystiedot
Berzelius väg 8
171 65 Solna
Sverige
+46 8 545 802 30
www.recordati.com
