LONSURF tabletti, kalvopäällysteinen 15/6,14 mg, 20/8,19 mg
Vaikuttavat aineet ja niiden määrät
Lonsurf 15 mg/6,14 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 15 mg trifluridiinia sekä tipirasiilihydrokloridia määrän, joka vastaa 6,14 mg tipirasiilia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 90,735 mg laktoosimonohydraattia.
Lonsurf 20 mg/8,19 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 20 mg trifluridiinia sekä tipirasiilihydrokloridia määrän, joka vastaa 8,19 mg tipirasiilia.
Apuaine, jonka vaikutus tunnetaan
Yksi kalvopäällysteinen tabletti sisältää 120,980 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Kolorektaalisyöpä
Lonsurf on tarkoitettu yhdessä bevasitsumabin kanssa metastasoituneen kolorektaalisyövän hoitoon aikuispotilaille, joita on aiemmin hoidettu kahdella syövän hoito-ohjelmalla, kuten fluoropyrimidiinejä, oksaliplatiinia ja irinotekaania sisältävillä solunsalpaajahoidoilla, VEGF-vasta-aineilla ja/tai EGFR-vasta-aineilla.
Lonsurf on tarkoitettu monoterapiana metastasoituneen kolorektaalisyövän hoitoon aikuispotilaille, jotka ovat aiemmin saaneet hoitoa käytettävissä olevilla lääkevalmisteilla, kuten fluoropyrimidiinejä, oksaliplatiinia ja irinotekaania sisältävillä solunsalpaajahoidoilla, VEGF-vasta-aineilla ja EGFR-vasta-aineilla, tai joille tällaisen hoidon ei katsota sopivan.
Mahasyöpä
Lonsurf on tarkoitettu monoterapiana metastasoituneen mahasyövän, mukaan lukien ruokatorven ja mahan liitoskohdan adenokarsinooman, hoitoon aikuispotilaille, jotka ovat aiemmin saaneet pitkälle edenneeseen tautiin hoitoa vähintään kahden systeemisen hoito-ohjelman mukaisesti (ks. kohta Farmakodynamiikka).
Ehto
Hoitavan lääkärin tulee olla perehtynyt syövän hoitoon.
Annostus ja antotapa
Lonsurf-hoidon määrää syövän hoitoon perehtynyt lääkäri.
Annostus
Lonsurf-hoidon suositeltu aloitusannos aikuisille monoterapiana tai yhdessä bevasitsumabin kanssa on 35 mg/m2/annos suun kautta kaksi kertaa vuorokaudessa kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1–5 ja päivinä 8–12 taudin etenemiseen saakka tai kunnes ilmaantuu toksisuutta, joka ei ole hyväksyttävissä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kun Lonsurf-valmistetta käytetään metastasoituneen kolorektaalisyövän hoitoon yhdessä bevasitsumabin kanssa, bevasitsumabia annetaan 5 mg/painokilo kahden viikon välein. Katso bevasitsumabin kaikki valmistetiedot.
Annos lasketaan kehon pinta-alan mukaan (ks. taulukko 1). Annosta 80 mg/annos ei saa ylittää.
Jos annoksia jää tai jätetään ottamatta, potilas ei saa korvata ottamatta jääneitä annoksia.
Taulukko 1 - Aloitusannoksen laskeminen kehon pinta-alan perusteella
Aloitusannos | Kehon pinta-ala | Annos mg | Tablettia/annos (2x vuorokaudessa) | Kokonais- | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
35 mg/m2 | < 1,07 | 35 | 1 | 1 | 70 |
1,07–1,22 | 40 | 0 | 2 | 80 | |
1,23–1,37 | 45 | 3 | 0 | 90 | |
1,38–1,52 | 50 | 2 | 1 | 100 | |
1,53–1,68 | 55 | 1 | 2 | 110 | |
1,69–1,83 | 60 | 0 | 3 | 120 | |
1,84–1,98 | 65 | 3 | 1 | 130 | |
1,99–2,14 | 70 | 2 | 2 | 140 | |
2,15–2,29 | 75 | 1 | 3 | 150 | |
≥ 2,30 | 80 | 0 | 4 | 160 | |
Suositellut annosmuutokset
Annostusta saattaa olla tarpeen muuttaa yksilöllisen turvallisuuden ja siedettävyyden mukaan.
Annosta saa pienentää enintään kolme kertaa pienimpään annokseen 20 mg/m2 kaksi kertaa vuorokaudessa saakka. Annosta ei saa enää suurentaa sen jälkeen, kun sitä on pienennetty.
Jos potilaalla on hematologista ja/tai muuta kuin hematologista toksisuutta, on noudatettava taulukossa 2, taulukossa 3 ja taulukossa 4 annettuja ohjeita hoidon keskeyttämisestä ja jatkamisesta sekä annoksen pienentämisestä.
Taulukko 2 - Hoidon keskeyttäminen ja jatkaminen, jos potilaalla on luuydinlamaan liittyvää hematologista toksisuutta
Parametri | Hoidon keskeyttämisen kriteerit | Hoidon jatkamisen kriteerita |
Neutrofiilit | < 0,5 x 109/l | ≥ 1,5 x 109/l |
Trombosyytit | < 50 x 109/l | ≥ 75 x 109/l |
a Hoidon jatkamisen kriteerejä noudatetaan kaikilla potilailla seuraavaa hoitosykliä aloitettaessa riippumatta siitä, täyttyivätkö hoidon keskeyttämisen kriteerit.
Taulukko 3 - Lonsurf-annoksen suositellut muutokset, jos potilaalla on hematologisia ja muita kuin hematologisia haittavaikutuksia
Haittavaikutus | Suositellut annosmuutokset |
|
|
* Common terminology criteria for adverse events
Taulukko 4 - Annoksen pienentäminen kehon pinta-alan perusteella
Pienennetty annos | Kehon pinta-ala | Annos mg | Tablettia/annos (2x vuorokaudessa) | Kokonais- | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
1. annoksen pienentäminen: Annoksesta 35 mg/m2 annokseen 30 mg/m2 | |||||
30 mg/m2 | < 1,09 | 30 | 2 | 0 | 60 |
1,09–1,24 | 35 | 1 | 1 | 70 | |
1,25–1,39 | 40 | 0 | 2 | 80 | |
1,40–1,54 | 45 | 3 | 0 | 90 | |
1,55–1,69 | 50 | 2 | 1 | 100 | |
1,70–1,94 | 55 | 1 | 2 | 110 | |
1,95–2,09 | 60 | 0 | 3 | 120 | |
2,10–2,28 | 65 | 3 | 1 | 130 | |
≥ 2,29 | 70 | 2 | 2 | 140 | |
2. annoksen pienentäminen: Annoksesta 30 mg/m2 annokseen 25 mg/m2 | |||||
25 mg/m2 | < 1,10 | 25a | 2a | 1a | 50a |
1,10–1,29 | 30 | 2 | 0 | 60 | |
1,30–1,49 | 35 | 1 | 1 | 70 | |
1,50–1,69 | 40 | 0 | 2 | 80 | |
1,70–1,89 | 45 | 3 | 0 | 90 | |
1,90–2,09 | 50 | 2 | 1 | 100 | |
2,10–2,29 | 55 | 1 | 2 | 110 | |
≥ 2,30 | 60 | 0 | 3 | 120 | |
3. annoksen pienentäminen: Annoksesta 25 mg/m2 annokseen 20 mg/m2 | |||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 |
1,14–1,34 | 25a | 2a | 1a | 50a | |
1,35 – 1,59 | 30 | 2 | 0 | 60 | |
1,60–1,94 | 35 | 1 | 1 | 70 | |
1,95–2,09 | 40 | 0 | 2 | 80 | |
2,10–2,34 | 45 | 3 | 0 | 90 | |
≥ 2,35 | 50 | 2 | 1 | 100 | |
a Jos kokonaisvuorokausiannos on 50 mg, potilaan pitää ottaa 1 x 20 mg:n/8,19 mg:n tabletti aamulla ja 2 x 15 mg:n/6,14 mg:n tablettia illalla.
Erityiset potilasryhmät
Munuaisten vajaatoiminta
-
Lievä munuaisten vajaatoiminta (CrCl 60–89 ml/min) tai keskivaikea munuaisten vajaatoiminta (CrCl 30–59 ml/min)
Lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavien potilaiden aloitusannoksen muuttamista ei suositella (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
- Vaikea munuaisten vajaatoiminta (CrCl 15–29 ml/min)
Vaikeaa munuaisten vajaatoimintaa sairastaville potilaille suositeltu aloitusannos on 20 mg/m2 kaksi kertaa vuorokaudessa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Annosta on sallittua pienentää kerran minimiannokseen 15 mg/m2 kaksi kertaa vuorokaudessa yksilöllisen turvallisuuden ja siedettävyyden perusteella (ks. taulukko 5). Kun annosta on pienennetty, sitä ei saa enää suurentaa. Jos potilaalla on hematologista ja/tai ei-hematologista toksisuutta, taulukossa 2, taulukossa 3 ja taulukossa 5 mainittuja kriteerejä hoidon keskeyttämisestä ja jatkamisesta ja annoksen pienentämisestä pitää noudattaa.
Taulukko 5 – Vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden aloitusannos ja annoksen pienentäminen kehon pinta-alan perusteella
Pienennetty annos | Kehon pinta-ala | Annos mg | Tablettia/annos (2x vuorokaudessa) | Kokonais- | |
15 mg/6,14 mg | 20 mg/8,19 mg | ||||
Aloitusannos | |||||
20 mg/m2 | < 1,14 | 20 | 0 | 1 | 40 |
1,14–1,34 | 25a | 2a | 1a | 50a | |
1,35–1,59 | 30 | 2 | 0 | 60 | |
1,60–1,94 | 35 | 1 | 1 | 70 | |
1,95–2,09 | 40 | 0 | 2 | 80 | |
2,10–2,34 | 45 | 3 | 0 | 90 | |
≥ 2,35 | 50 | 2 | 1 | 100 | |
Annoksen pienentäminen: Annoksesta 20 mg/m2 annokseen 15 mg/m2 | |||||
15 mg/m2 | < 1,15 | 15 | 1 | 0 | 30 |
1,15–1,49 | 20 | 0 | 1 | 40 | |
1,50–1,84 | 25a | 2a | 1a | 50a | |
1,85–2,09 | 30 | 2 | 0 | 60 | |
2,10–2,34 | 35 | 1 | 1 | 70 | |
≥ 2,35 | 40 | 0 | 2 | 80 | |
a Jos kokonaisvuorokausiannos on 50 mg, potilaan pitää ottaa 1 x 20 mg:n/8,19 mg:n tabletti aamulla ja 2 x 15 mg:n/6,14 mg:n tablettia illalla.
- Loppuvaiheen munuaissairaus (CrCl alle 15 ml/min tai dialyysihoidon tarve)
Valmisteen antamista loppuvaiheen munuaissairautta sairastaville potilaille ei suositella, koska tästä potilasryhmästä ei ole tietoja saatavilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
-
Lievä maksan vajaatoiminta
Lievää maksan vajaatoimintaa sairastavien potilaiden aloitusannoksen muuttamista ei suositella (ks. kohta Farmakokinetiikka).
-
Keskivaikea tai vaikea maksan vajaatoiminta
Valmisteen antamista keskivaikeaa tai vaikeaa maksan vajaatoimintaa (National Cancer Institute [NCI] ‑kriteerien ryhmä C ja D kokonaisbilirubiinipitoisuuden > 1,5 x ULN perusteella määriteltynä) lähtötilanteessa sairastaville potilaille ei suositella, koska graduksen 3 tai 4 hyperbilirubinemian ilmaantuvuuden on havaittu olevan suurempi, jos potilaalla on lähtötilanteessa keskivaikeaa maksan vajaatoimintaa. Tämä perustuu kuitenkin hyvin suppeisiin tietoihin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Iäkkäät
Vähintään 65-vuotiaiden potilaiden aloitusannosta ei tarvitse muuttaa (ks. kohdat Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka).
Tehosta ja turvallisuudesta yli 75-vuotiaille potilaille on vähän tietoja.
Pediatriset potilaat
Ei ole asianmukaista käyttää Lonsurf-valmistetta pediatrisille potilaille metastasoituneen kolorektaalisyövän ja metastasoituneen mahasyövän hoitoon.
Rotu
Aloitusannosta ei tarvitse muuttaa potilaan rodun perusteella (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka). Lonsurf-valmisteen käytöstä mustaihoisten/afroamerikkalaisten potilaiden hoitoon on vähän tietoja, mutta sellaisia biologisia perusteita ei ole, että tämän potilasjoukon ja koko potilasjoukon välillä voisi olettaa olevan eroja.
Antotapa
Lonsurf otetaan suun kautta. Tabletit pitää ottaa vesilasillisen kanssa yhden tunnin kuluessa aamupalan ja ilta-aterian syömisestä.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Luuydinlama
Lonsurf lisäsi luuydinlaman, anemia, neutropenia, leukopenia ja trombosytopenia mukaan lukien, ilmaantuvuutta.
Potilaan täydellinen verenkuva pitää määrittää ennen hoidon aloittamista ja tarvittaessa toksisuuden seuraamiseksi, mutta kuitenkin vähintään ennen jokaista hoitosykliä.
Hoitoa ei saa aloittaa, jos absoluuttinen neutrofiilimäärä (absolute neutrophil count, ANC) on < 1,5 x 109/l, jos trombosyyttimäärä on < 75 x 109/l, tai jos potilaalla on aiemmista hoidoista aiheutunutta kliinisesti oleellista graduksen 3 tai 4 muuta kuin hematologista toksisuutta, joka ei ole korjautunut.
Lonsurf-hoidon jälkeen on raportoitu vakavia infektioita (ks. kohta Haittavaikutukset). Suurin osa tapauksista raportoitiin luuydinlaman yhteydessä, joten potilaan vointia pitää seurata tarkoin, ja kliinisen tarpeen mukaan pitää ryhtyä asianmukaisiin toimenpiteisiin, kuten aloittaa hoito mikrobilääkkeillä ja granulosyyttiryhmiä stimuloivilla kasvutekijöillä (G-CSF). RECOURSE-tutkimuksessa 9,4 %, TAGS-tutkimuksessa 17,3 % ja SUNLIGHT-tutkimuksessa 19,5 % Lonsurf-ryhmän potilaista sai granulosyyttiryhmiä stimuloivia kasvutekijöitä lähinnä hoitotarkoitukseen. SUNLIGHT-tutkimuksessa Lonsurf+ bevasitsumabi-ryhmässä 29,3 % potilaista sai G-CSF:ää, mukaan lukien 16,3 % hoitotarkoitukseen.
Maha-suolikanavan toksisuus
Lonsurf lisäsi maha-suolikanavan toksisuuden, pahoinvointi, oksentelu ja ripuli mukaan lukien, ilmaantuvuutta.
Jos potilaalla esiintyy pahoinvointia, oksentelua, ripulia ja muuta maha-suolikanavan toksisuutta, potilasta pitää seurata tarkoin ja antaa kliinisen tarpeen mukaan hoitoa pahoinvointilääkkeillä, ripulilääkkeillä ja muilla hoitomenetelmillä, kuten nesteytystä/elektrolyyttikorvaushoitoa. Annosta pitää tarvittaessa muuttaa (siirtää antoajankohtaa myöhemmäksi ja/tai pienentää annosta) (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Lonsurf-hoitoa ei suositella, jos potilaalla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma [CrCl] < 15 ml/min tai potilas tarvitsee dialyysihoitoa), sillä Lonsurf-valmistetta ei ole tutkittu näissä potilasryhmissä (ks. kohta Farmakokinetiikka).
Haittavaikutusten yleinen ilmaantuvuus on samankaltainen niiden alaryhmien potilailla, joilla munuaisten toiminta on normaali (CrCl ≥ 90 ml/min) tai joilla on lievää (CrCl = 60–89 ml/min) tai keskivaikeaa (CrCl = 30–59 ml/min) munuaisten vajaatoimintaa. Vakavien, vaikea-asteisten ja annoksen muuttamista edellyttävien haittavaikutusten ilmaantuvuus kuitenkin lisääntyy, kun munuaisten vajaatoiminnan vaikeusaste lisääntyy. Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla havaittiin lisäksi suurempi trifluridiini- ja tipirasiilihydrokloridialtistus verrattuna potilaisiin, joiden munuaisten toiminta oli normaali tai joilla oli lievää munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka).
Potilailla, joilla oli vaikeaa munuaisten vajaatoimintaa (CrCl = 15–29 ml/min) ja joiden aloitusannokseksi oli säädetty 20 mg/m2 kaksi kertaa vuorokaudessa, turvallisuusprofiili oli yhdenmukainen niiden Lonsurf-hoitoa saaneiden potilaiden turvallisuusprofiilin kanssa, joiden munuaisten toiminta oli normaali tai joilla oli lievää munuaisten vajaatoimintaa. Heidän altistuksensa trifluridiinille oli samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali, ja heidän altistuksensa tipirasiilihydrokloridille oli suurempi kuin potilailla, joiden munuaisten toiminta oli normaali tai joilla oli lievää tai keskivaikeaa munuaisten vajaatoimintaa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Potilaita, joilla on munuaisten vajaatoimintaa, pitää seurata tarkoin Lonsurf-hoidon aikana, ja potilaita, joilla on keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa, pitää seurata tiheämmin hematologisen toksisuuden havaitsemiseksi.
Maksan vajaatoiminta
Lonsurf-hoitoa ei suositella, jos potilaalla on lähtötilanteessa keskivaikeaa tai vaikeaa maksan vajaatoimintaa (National Cancer Institute [NCI] ‑kriteerien ryhmä C ja D kokonaisbilirubiinipitoisuuden > 1,5 x ULN perusteella määriteltynä), koska graduksen 3 tai 4 hyperbilirubinemian ilmaantuvuuden on havaittu olevan suurempi, jos potilaalla on lähtötilanteessa keskivaikeaa maksan vajaatoimintaa. Tämä perustuu kuitenkin hyvin suppeisiin tietoihin (ks. kohta Farmakokinetiikka).
Proteinuria
Proteinuriaa suositellaan seuraamaan virtsan liuskakokeella ennen hoidon aloittamista ja sen aikana (ks. kohta Haittavaikutukset).
Laktoosi-intoleranssi
Lonsurf sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
In vitro ‑tutkimukset osoittivat, että trifluridiini, tipirasiilihydrokloridi ja 5-(trifluorimetyyli)urasiili (FTY) eivät estäneet ihmisen sytokromi P450 (CYP) ‑isoformien aktiivisuutta. In vitro ‑selvitys osoitti, että trifluridiini, tipirasiilihydrokloridi ja 5-(trifluorimetyyli)urasiili eivät indusoi ihmisen CYP-isoformeja (ks. kohta Farmakokinetiikka).
In vitro ‑tutkimukset osoittivat, että trifluridiini on nukleosidikuljettajien CNT1, ENT1 ja ENT2 substraatti. Siksi sellaisten lääkevalmisteiden käytössä, joilla on yhteisvaikutuksia näiden kuljettajien kanssa, on tarpeen noudattaa varovaisuutta. Tipirasiilihydrokloridi oli OCT2:n ja MATE1:n substraatti, joten sen pitoisuudet saattavat suurentua, jos Lonsurf-valmistetta otetaan samanaikaisesti OCT2:n ja MATE1:n estäjien kanssa.
Ihmisen tymidiinikinaasin substraattien, esim. tsidovudiinin, käytössä pitää olla varovainen. Jos tällaisia lääkevalmisteita käytetään samanaikaisesti Lonsurf-valmisteen kanssa, ne saattavat kilpailla vaikuttavan aineen trifluridiinin kanssa tymidiinikinaasivälitteisestä aktivaatiosta. Siksi sellaisten viruslääkkeiden käytössä, jotka ovat ihmisen tymidiinikinaasin substraatteja, pitää seurata viruslääkkeen tehon mahdollista heikentymistä ja harkita hoidon vaihtamista vaihtoehtoiseen viruslääkkeeseen, joka ei ole ihmisen tymidiinikinaasin substraatti, kuten lamivudiini, didanosiini ja abakaviiri (ks. kohta Farmakodynamiikka).
Ei tiedetä, heikentääkö Lonsurf hormonaalisten ehkäisyvalmisteiden tehoa. Hormonaalista ehkäisyä käyttävien naisten on siksi käytettävä ehkäisynä myös estemenetelmää.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi/Ehkäisy miehille ja naisille
Trifluridiini saattaa eläimillä todettujen löydösten perusteella raskauden aikana käytettynä vahingoittaa sikiötä. Naisten pitää välttää raskaaksi tulemista Lonsurf-hoidon aikana ja kuuden kuukauden ajan hoidon päättymisen jälkeen. Naisten, jotka voivat tulla raskaaksi, on käytettävä erittäin tehokasta ehkäisymenetelmää Lonsurf-hoidon aikana ja kuuden kuukauden ajan hoidon lopettamisen jälkeen. Tällä hetkellä ei tiedetä, heikentääkö Lonsurf hormonaalisten ehkäisymenetelmien tehoa, joten hormonaalista ehkäisyä käyttävien naisten pitää sen lisäksi käyttää ehkäisynä estemenetelmää.
Miespotilaan, jonka kumppani voi tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja kuuden kuukauden ajan hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja Lonsurf-valmisteen käytöstä raskaana oleville naisille. Raskauden aikana käytetyn trifluridiinin epäillään sen vaikutusmekanismin perusteella aiheuttavan synnynnäisiä epämuodostumia. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Lonsurf-valmistetta ei pidä käyttää raskauden aikana, ellei raskaana olevan potilaan kliininen tilanne edellytä Lonsurf-hoitoa.
Imetys
Ei tiedetä, erittyykö Lonsurf tai sen metaboliitit ihmisen rintamaitoon. Eläinkokeet ovat osoittaneet, että trifluridiini, tipirasiilihydrokloridi ja/tai niiden metaboliitit erittyvät maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Imeväiseen kohdistuvia riskejä ei voida poissulkea. Rintaruokinta on lopetettava Lonsurf-hoidon ajaksi.
Hedelmällisyys
Lonsurf-valmisteen vaikutuksista ihmisen hedelmällisyyteen ei ole tietoa. Lonsurf-valmisteella ei ole eläinkokeiden tuloksissa todettu vaikutuksia uroksen tai naaraan hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta). Potilaita, joiden toiveissa on saada lapsia, tulee ohjeistaa hakemaan lisääntymisneuvontaa ja pakastamaan munasoluja tai siemennestettä ennen Lonsurf-hoidon aloittamista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Lonsurf-valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Hoidon aikana saattaa esiintyä uupumusta, heitehuimausta tai sairaudentunnetta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Vakavimmat Lonsurf-hoitoa saaneilla potilaillahavaituthaittavaikutuksetovat luuydinlama ja maha-suolikanavan toksisuus (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lonsurf monoterapiana
Lonsurf-valmisteen turvallisuusprofiili monoterapiana perustuu kontrolloiduista vaiheen III kliinisistä tutkimuksista saatuihin yhdistettyihin tietoihin 1 114 potilaasta, jotka sairastivat metastasoitunutta kolorektaalisyöpää tai mahasyöpää.
Yleisimmät haittavaikutukset (≥ 30 %) ovat neutropenia (53 % [34 % gradus ≥ 3]), pahoinvointi (31 % [1 % gradus ≥ 3]), uupumus (31 % [4 % gradus ≥ 3]) ja anemia (30 % [11 % gradus ≥ 3]).
Yleisimpiä haittavaikutuksia (≥ 2 %), jotka johtivat hoidon lopettamiseen, annoksen pienentämiseen, annoksen ottamisen siirtämiseen myöhempään ajankohtaan tai hoidon keskeyttämiseen olivat neutropenia, anemia, uupumus, leukopenia, trombosytopenia, ripuli ja pahoinvointi.
Lonsurf yhdessä bevasitsumabin kanssa
Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoidon turvallisuusprofiili perustuu kontrolloidusta vaiheen III kliinisestä tutkimuksesta (SUNLIGHT) saatuihin tietoihin 246 potilaasta, jotka sairastivat metastasoitunutta kolorektaalisyöpää.
Yleisimmät haittavaikutukset (≥ 30 %) ovat neutropenia (69 % [48 % gradus ≥ 3]), uupumus (35 % [3 % gradus ≥ 3]), pahoinvointi (33 % [1 % gradus ≥ 3]).
Yleisimpiä Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoitoa saaneilla potilailla esiintyneitä haittavaikutuksia (≥ 2 %), jotka johtivat hoidon lopettamiseen, annoksen pienentämiseen, annoksen ottamisen siirtämiseen myöhempään ajankohtaan tai hoidon keskeyttämiseen, olivat neutropenia, uupumus, trombosytopenia, pahoinvointi ja anemia.
Kun Lonsurf-valmistetta käytetään yhdessä bevasitsumabin kanssa, seuraavien haittavaikutusten yleisyys suureni verrattuna Lonsurf-valmisteeseen monoterapiana: neutropenia (69 % vs. 53 %), vakava neutropenia (48 % vs. 34 %), trombosytopenia (24 % vs. 16 %), stomatiitti (11 % vs. 6 %).
Haittavaikutustaulukko
533 metastasoitunutta kolorektaalisyöpää sairastavaa potilasta sai hoitoa lumekontrolloidussa vaiheen III kliinisessä tutkimuksessa (RECOURSE), 335 metastasoitunutta mahasyöpää sairastavaa potilasta sai hoitoa lumekontrolloidussa vaiheen III kliinisessä tutkimuksessa (TAGS), 246 potilasta sai Lonsurf-hoitoa monoterapiana ja 246 potilasta sai Lonsurf-valmistetta yhdessä bevasitsumabin kanssa metastasoituneen kolorektaalisyövän hoitoon kontrolloidussa vaiheen III kliinisessä tutkimuksessa (SUNLIGHT). Näillä potilailla havaitut haittavaikutukset esitetään taulukossa 6. Haittavaikutukset on luokiteltu elinjärjestelmän mukaan (System Organ Class, SOC), ja tiettyä haittavaikutusta ja sen synonyymejä ja siihen liittyviä sairauksia kuvataan sopivalla MedDRA (Medical Dictionary for Regulatory Activities) ‑termillä.
Haittavaikutuksia, joita tiedetään ilmenevän, kun Lonsurf-valmistetta annetaan monoterapiana tai kun bevasitsumabia annetaan monoterapiana, voi ilmetä näiden lääkevalmisteiden yhdistelmähoidon aikana, vaikka näitä haittavaikutuksia ei olisi raportoitu yhdistelmähoidon kliinisissä tutkimuksissa.
Haittavaikutukset on ryhmitelty niiden esiintyvyyden mukaan. Esiintymistiheydet on määritelty seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100) ja harvinaiset (≥ 1/10 000, < 1/1 000).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 6 – Kliinisissä tutkimuksissa Lonsurf-hoitoa saaneilla potilailla raportoidut haittavaikutukset
Elinjärjestelmä (MedDRA)a | Haittavaikutukset | Esiintyvyys | |
| Monoterapia
| Yhdistelmänä bevasitsumabin kanssa | |
Infektiot | Alahengitystieinfektio | Yleinen | – |
| Neutropeeninen sepsis | Melko harvinainen | – |
| Sappitieinfektio | Melko harvinainen | – |
| Infektio | Melko harvinainen | Yleinen |
| Virtsatieinfektio | Melko harvinainen | Melko harvinainen |
| Bakteeri-infektio | Melko harvinainen | – |
| Candida-infektio | Melko harvinainen | – |
| Konjunktiviitti | Melko harvinainen | – |
| Herpes zoster | Melko harvinainen | – |
| Influenssa | Melko harvinainen | – |
| Ylähengitystieinfektio | Melko harvinainen | – |
| Infektioosi enteriitti | Harvinainen | – |
| Septinen sokkib | Harvinainen | – |
| Ientulehdus | Harvinainen | Melko harvinainen |
| Jalkasilsa | Harvinainen | – |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Syöpäkipu | Melko harvinainen | – |
Veri ja imukudos | Anemia | Hyvin yleinen | Hyvin yleinen |
Neutropenia | Hyvin yleinen | Hyvin yleinen | |
| Leukopenia | Hyvin yleinen | Yleinen |
| Trombosytopenia | Hyvin yleinen | Hyvin yleinen |
| Kuumeinen neutropenia | Yleinen | Melko harvinainen |
| Lymfopenia | Yleinen | Yleinen |
| Pansytopenia | Melko harvinainen | Melko harvinainen |
| Erytropenia | Melko harvinainen | – |
| Leukosytoosi | Melko harvinainen | – |
| Monosytopenia | Melko harvinainen | – |
| Monosytoosi | Melko harvinainen | – |
| Granulosytopenia | Harvinainen | – |
Aineenvaihdunta ja ravitsemus | Heikentynyt ruokahalu | Hyvin yleinen | Hyvin yleinen |
Hypoalbuminemia | Yleinen | Melko harvinainen | |
| Dehydraatio | Melko harvinainen | – |
| Hyperglykemia | Melko harvinainen | Melko harvinainen |
| Hyperkalemia | Melko harvinainen | – |
| Hypokalsemia | Melko harvinainen | – |
| Hypokalemia | Melko harvinainen | – |
| Hyponatremia | Melko harvinainen | – |
| Hypofosfatemia | Melko harvinainen | – |
| Kihti | Harvinainen | – |
| Hypernatremia | Harvinainen | – |
Psyykkiset häiriöt | Ahdistuneisuus | Melko harvinainen | – |
| Unettomuus | Melko harvinainen | – |
Hermosto | Makuaistin häiriöt | Yleinen | Yleinen |
| Heitehuimaus | Melko harvinainen | Yleinen |
| Päänsärky | Melko harvinainen | Yleinen |
| Perifeerinen neuropatia | Melko harvinainen | Melko harvinainen |
| Parestesia | Melko harvinainen | Melko harvinainen |
| Letargia | Melko harvinainen | – |
| Neurotoksisuus | Melko harvinainen | – |
| Kirvelyn tunne | Harvinainen | – |
| Dysestesia | Harvinainen | – |
| Hyperestesia | Harvinainen | – |
| Hypestesia | Harvinainen | – |
| Synkopee | Harvinainen | – |
Silmät | Kaihi | Harvinainen | – |
| Diplopia | Harvinainen | – |
| Kuivat silmät | Harvinainen | – |
| Näön sumeneminen | Harvinainen | – |
| Heikentynyt näöntarkkuus | Harvinainen | – |
Kuulo ja tasapainoelin | Kiertohuimaus | Melko harvinainen | – |
| Epämukava tunne korvassa | Harvinainen | – |
Sydän | Angina pectoris | Melko harvinainen | – |
| Sydämen rytmihäiriöt | Melko harvinainen | – |
| Sydämentykytys | Melko harvinainen | – |
Verisuonisto | Hypertensio | Melko harvinainen | Yleinen |
| Kasvojen ja kaulan punoitus | Melko harvinainen | – |
| Hypotensio | Melko harvinainen | – |
| Embolia | Harvinainen | – |
Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Yleinen | Yleinen |
Keuhkoemboliab | Melko harvinainen | – | |
| Dysfonia | Melko harvinainen | Melko harvinainen |
| Yskä | Melko harvinainen | – |
| Nenäverenvuoto | Melko harvinainen | – |
| Nuha | Harvinainen | Melko harvinainen |
| Suun ja nielun kipu | Harvinainen | – |
| Pleuraeffuusio | Harvinainen | – |
Ruoansulatuselimistö | Ripuli | Hyvin yleinen | Hyvin yleinen |
| Oksentelu | Hyvin yleinen | Hyvin yleinen |
| Pahoinvointi | Hyvin yleinen | Hyvin yleinen |
| Vatsakipu | Yleinen | Yleinen |
| Stomatiitti | Yleinen | Hyvin yleinen |
| Ummetus | Yleinen | Yleinen |
| Ileus | Melko harvinainen | – |
| Maha-suolikanavan verenvuoto | Melko harvinainen | – |
| Koliitti | Melko harvinainen | Melko harvinainen |
| Suun haavaumat | Melko harvinainen | Yleinen |
| Suun sairaudet | Melko harvinainen | Yleinen |
| Vatsan pingottuneisuus | Melko harvinainen | Melko harvinainen |
| Peräaukon tulehdus | Melko harvinainen | Melko harvinainen |
| Ruoansulatushäiriöt | Melko harvinainen | Melko harvinainen |
| Ilmavaivat | Melko harvinainen | Melko harvinainen |
| Gastriitti | Melko harvinainen | – |
| Ruokatorven refluksitauti | Melko harvinainen | – |
| Kielitulehdus | Melko harvinainen | – |
| Heikentynyt mahan tyhjeneminen | Melko harvinainen | – |
| Yökkäily | Melko harvinainen | – |
| Hammassairaus | Melko harvinainen | – |
| Askites | Harvinainen | – |
| Akuutti haimatulehdus | Harvinainen | – |
| Subileus | Harvinainen | – |
| Pahanhajuinen hengitys | Harvinainen | – |
| Posken polyyppi | Harvinainen | – |
| Hemorraginen enterokoliitti | Harvinainen | – |
| Ienverenvuoto | Harvinainen | – |
| Ruokatorvitulehdus | Harvinainen | – |
| Periodontaalinen sairaus | Harvinainen | – |
| Proktalgia | Harvinainen | – |
| Refluksigastriitti | Harvinainen | – |
Maksa ja sappi | Hyperbilirubinemia | Yleinen | Yleinen |
| Maksatoksisuus | Melko harvinainen | – |
| Sappiteiden laajeneminen | Harvinainen | – |
Iho ja ihonalainen kudos | Hiustenlähtö | Yleinen | Yleinen |
Kuiva iho | Yleinen | Yleinen | |
| Kutina | Yleinen | Melko harvinainen |
| Ihottuma | Yleinen | Melko harvinainen |
| Kynsien häiriöt | Melko harvinainen | Melko harvinainen |
| Käsi-jalkaoireyhtymäc | Melko harvinainen | Melko harvinainen |
| Akne | Melko harvinainen | – |
| Liikahikoilu | Melko harvinainen | – |
| Urtikaria | Melko harvinainen | – |
| Rakkulat | Harvinainen | – |
| Eryteema | Harvinainen | – |
| Valoyliherkkyysreaktio | Harvinainen | – |
| Ihon kesiminen | Harvinainen | – |
Luusto, lihakset ja sidekudos | Nivelkipu | Melko harvinainen | Yleinen |
Lihassärky | Melko harvinainen | Yleinen | |
| Lihasheikkous | Melko harvinainen | Melko harvinainen |
| Raajakipu | Melko harvinainen | Melko harvinainen |
| Luukipu | Melko harvinainen | - |
| Vaivat raajoissa | Melko harvinainen | - |
| Lihaskrampit | Melko harvinainen | - |
| Nivelten turvotus | Harvinainen | - |
Munuaiset ja virtsatiet | Proteinuria | Yleinen | Melko harvinainen |
| Munuaisten vajaatoiminta | Melko harvinainen | – |
| Hematuria | Melko harvinainen | – |
| Virtsaamishäiriöt | Melko harvinainen | – |
| Infektioon liittymätön virtsarakkotulehdus | Harvinainen | – |
| Leukosyturia | Harvinainen | – |
Sukupuolielimet ja rinnat | Kuukautishäiriöt | Harvinainen | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Hyvin yleinen | Hyvin yleinen |
Kuume | Yleinen | Melko harvinainen | |
| Limakalvotulehdus | Yleinen | Melko harvinainen |
| Sairaudentunne | Yleinen | – |
| Turvotus | Yleinen | – |
| Yleisen fyysisen terveyden heikkeminen | Melko harvinainen | – |
| Kipu | Melko harvinainen | Melko harvinainen |
| Kehon lämpötilamuutosten tunne | Melko harvinainen | – |
| Kseroosi | Harvinainen | – |
Tutkimukset | Painon lasku | Yleinen | Yleinen |
| Maksaentsyymiarvojen suureneminen | Yleinen | Yleinen |
| Suurentunut veren alkalisen fosfataasin pitoisuus | Yleinen | Melko harvinainen |
| Suurentunut veren laktaattidehydrogenaasi-pitoisuus | Melko harvinainen | – |
| Suurentunut C-reaktiivisen proteiinin (CRP) pitoisuus | Melko harvinainen | – |
| Suurentunut veren kreatiniinipitoisuus | Melko harvinainen | – |
| Suurentunut veren ureapitoisuus | Melko harvinainen | – |
| Pienentynyt hematokriitti | Melko harvinainen | – |
| Suurentunut INR-arvo | Melko harvinainen | – |
| Pidentynyt aktivoitu partiaalinen tromboplastiiniaika (aPTT) | Harvinainen | – |
| EKG:ssä todettu pidentynyt QT-aika | Harvinainen | – |
| Pienentynyt kokonaisproteiinipitoisuus | Harvinainen | – |
a. Kliinisesti samankaltaisiksi katsotut eri MedDRA preferred terms ‑termit on ryhmitelty yhdeksi termiksi.
b. Kuolemaan johtaneita tapauksia on raportoitu.
c. Kämmenten ja jalkapohjien ihoreaktio
Iäkkäät
Seuraavien hoitoon liittyvien haittatapahtumien ilmaantuvuus oli 65-vuotiailla ja vanhemmilla Lonsurf-hoitoa monoterapiana saaneilla potilailla suurempi (≥ 5 %) kuin alle 65-vuotiailla potilailla: neutropenia (58,9 % vs. 48,2 %), vakava neutropenia (41,3 % vs. 27,9 %), anemia (36,5 % vs. 25,2 %), vakava anemia (14,1 % vs. 8,9 %), vähentynyt ruokahalu (22,6 % vs. 17,4 %) ja trombosytopenia (21,4 % vs. 12,1 %). Kun Lonsurf-valmistetta käytettiin yhdessä bevasitsumabin kanssa, seuraavien hoitoon liittyvien haittatapahtumien ilmaantuvuus oli 65-vuotiailla ja vanhemmilla potilailla suurempi (≥ 5 %) kuin alle 65-vuotiailla potilailla: neutropenia (75,0 % vs. 65,1 %), vakava neutropenia (57,0 % vs. 41,8 %), uupumus (39,0 % vs. 32,2 %), trombosytopenia (28,0 % vs. 20,5 %) ja stomatiitti (14,0 % vs. 8,9 %).
Infektiot
Hoitoon liittyneitä infektioita esiintyi lumekontrolloiduissa vaiheen III kliinisissä tutkimuksissa yleisemmin Lonsurf-hoitoa saaneilla potilailla (5,8 %) kuin lumehoitoa saaneilla potilailla (1,8 %).
Kliinisessä tutkimuksessa, jossa tutkittiin yhdistelmähoitoa bevasitsumabin kanssa, hoitoon liittyneitä infektioita esiintyi samalla tavalla Lonsurf-valmistetta bevasitsumabin kanssa saaneilla potilailla (2,8 %) verrattuna Lonsurf-hoitoa saaneisiin potilaisiin (2,4 %).
Proteinuria
Lumekontrolloiduissa vaiheen III kliinisissä tutkimuksissa hoitoon liittyvää proteinuriaa esiintyi yleisemmin Lonsurf-hoitoa saaneilla potilailla (1,8 %) verrattuna lumehoitoa saaneisiin potilaisiin (0,9 %). Kaikkien proteinuriatapausten vaikeusaste oli gradus 1 tai 2 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisessä tutkimuksessa, jossa tutkittiin yhdistelmähoitoa bevasitsumabin kanssa, yksi Lonsurf-valmistetta bevasitsumabin kanssa saanut potilas (0,4 %) raportoi hoitoon liittyvästä graduksen 2 proteinuriasta. Yksikään Lonsurf-valmisteella hoidetuista potilaista ei raportoinut proteinuriasta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sädehoito
Kaikkien hematologisten ja luuydinlamaan liittyvien haittavaikutusten ilmaantuvuus RECOURSE-tutkimuksessa oli sädehoitoa aiemmin saaneilla potilailla hieman suurempi kuin potilailla, jotka eivät olleet saaneet aiemmin sädehoitoa (54,6 % versus 49,2 %). Huomioitavaa on myös, että kuumeista neutropeniaa esiintyi yleisemmin Lonsurf-potilailla, jotka olivat aiemmin saaneet sädehoitoa, verrattuna niihin, jotka eivät olleet aiemmin saaneet sädehoitoa.
Kliinisessä tutkimuksessa, jossa tutkittiin yhdistelmähoitoa bevasitsumabin kanssa, kaikkien hematologisten ja luuydinlamaan liittyvien haittavaikutusten ilmaantuvuus ei ollut suurempi sädehoitoa aiemmin saaneilla potilailla kuin potilailla, jotka eivät olleet saaneet aiemmin sädehoitoa, SUNLIGHT-tutkimuksen kummassakaan haarassa: Lonsurf-valmistetta bevasitsumabin kanssa saaneet potilaat (73,7 % vs. 77,4 %) ja Lonsurf-hoitoa saaneet potilaat (64,7 % vs. 67,7 %).
Valmisteen markkinoille tulon jälkeinen kokemus potilaista, joilla on leikkaukseen soveltumaton pitkälle edennyt tai uusiutunut kolorektaalisyöpä
Lonsurf-valmistetta valmisteen markkinoille tulon jälkeen saaneilla potilailla on raportoitu interstitiaalista keuhkosairautta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta: www.fimea.fi.
Yliannostus
Suurin kliinisissä tutkimuksissa annettu Lonsurf-annos oli 180 mg/m2/vrk.
Yliannosten yhteydessä raportoidut haittavaikutukset olivat yhdenmukaisia varmistetun turvallisuusprofiilin kanssa.
Yliannoksen ensisijaisen komplikaation oletetaan olevan luuydinlama.
Lonsurf-yliannokselle ei tunneta vastalääkettä.
Yliannoksen lääkehoidon pitää koostua tavanomaisista hoito- ja tukitoimista, joilla pyritään korjaamaan kliiniset oireet ja estämään niiden mahdolliset komplikaatiot.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: solunsalpaajat, antimetaboliitit, ATC-koodi: L01BC59
Vaikutusmekanismi
Lonsurf sisältää trifluridiinia, joka on tymidiinipohjainen nukleosidianalogisolunsalpaaja, ja tipirasiilihydrokloridia, joka on tymidiinifosforylaasin (TPaasin) estäjä. Se sisältää näitä vaikuttavia aineita molaarisessa suhteessa 1:0,5 (painosuhteessa 1:0,471).
Kun trifluridiini on päässyt syöpäsoluun, tymidiinikinaasi fosforyloi sen, minkä jälkeen se metaboloituu soluissa deoksiribonukleiinihapon (DNA) substraatiksi ja inkorporoituu suoraan DNA:han. Se häiritsee siten DNA:n toimintaa ja estää solujen proliferaatiota.
TPaasi kuitenkin hajottaa trifluridiinin nopeasti, ja se metaboloituu suun kautta otettuna laajasti ensikierrossa. Tämän vuoksi valmisteeseen on yhdistetty TPaasin estäjä tipirasiilihydrokloridi.
Trifluridiinin ja tipirasiilihydrokloridin yhdistelmällä osoitettiin nonkliinisissä tutkimuksissa olevan antituumoriaktiivisuutta sekä 5-fluorourasiilille (5-FU) herkissä että resistenteissä kolorektaalisyövän solulinjoissa.
Trifluridiinin ja tipirasiilihydrokloridin sytotoksinen aktiivisuus useita ihmisen kasvaimen ksenografteja vastaan korreloi voimakkaasti DNA:han inkorporoituneen trifluridiinin määrän kanssa. Tämä viittaa siihen, että kyseessä on ensisijainen vaikutusmekanismi.
Farmakodynaamiset vaikutukset
Lonsurf-valmisteella ei ollut kliinisesti oleellista vaikutusta QT-/QTc-ajan pitenemiseen lumehoitoon verrattuna, mitä selvitettiin avoimessa tutkimuksessa potilailla, joilla oli pitkälle edenneitä kiinteitä kasvaimia.
Kliininen teho ja turvallisuus
Metastasoitunut kolorektaalisyöpä
Lonsurf-valmistetta monoterapiana ja lumelääkettä vertaileva satunnaistettu, vaiheen III tutkimus
Lonsurf-valmisteen kliinistä tehoa ja turvallisuutta tutkittiin kansainvälisessä, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen III tutkimuksessa (RECOURSE), jossa oli mukana aiempaa hoitoa saaneita metastasoitunutta kolorektaalisyöpää sairastavia potilaita. Tehon ensisijainen päätetapahtuma oli kokonaiselossaolo (overall survival, OS) ja sitä tukevia tehon päätetapahtumia olivat etenemättömyysaika (progression-free survival, PFS), kokonaisvasteluku (overall response rate, ORR) ja taudin hallinnassa pysymistä kuvaava luku (disease control rate, DCR).
Tutkimuksessa yhteensä 800 potilasta satunnaistettiin suhteessa 2:1 saamaan Lonsurf-hoitoa (N = 534) yhdistelmänä parhaan tukihoidon (best supportive care, BSC) kanssa tai kaltaistettua lumehoitoa (N = 266) yhdistelmänä parhaan tukihoidon kanssa. Lonsurf-annostus perustui potilaan kehon pinta-alaan, ja aloitusannos oli 35 mg/m2/annos. Tutkimushoito annettiin suun kautta kaksi kertaa vuorokaudessa, aamu- ja ilta-aterioiden jälkeen, viitenä päivänä viikossa, mitä seurasi kahden päivän hoitotauko. Tätä hoitoa annettiin kahden viikon ajan, mitä seurasi 14 päivän hoitotauko, ja tätä toistettiin neljän viikon jaksoina. Potilaat jatkoivat hoitoa taudin etenemiseen saakka tai kunnes heille ilmaantui toksisuutta, joka ei ollut hyväksyttävissä (ks. kohta Annostus ja antotapa).
Näiden 800 satunnaistetun potilaan iän mediaani oli 63 vuotta, heistä 61 % oli miehiä, 58 % oli valkoihoisia, 35 % oli etniseltä taustaltaan aasialaisia ja 1 % oli mustaihoisia/afroamerikkalaisia. Kaikkien potilaiden ECOG-toimintakykyluokka (Eastern Cooperative Oncology Group) oli lähtötilanteessa 0 tai 1. Kasvain sijaitsi pääasiassa koolonissa (62 %) tai peräsuolessa (38 %) Tutkimukseen tullessa potilaiden KRAS-status oli villityyppi (49 %) tai mutatoitunut (51 %). Metastasoituneeseen tautiin aiemmin annettujen hoitojen lukumäärän mediaani oli 3. Kaikki potilaat saivat aiempana hoitona fluoropyrimidiini-, oksaliplatiini- tai irinotekaanipohjaista solunsalpaajahoitoa. Yhtä potilasta lukuun ottamatta kaikki saivat bevasitsumabia, ja kahta potilasta lukuun ottamatta kaikki potilaat, joiden kasvaimen KRAS-status oli villityyppi, saivat panitumumabia tai setuksimabia. Nämä kaksi hoitoryhmää olivat demografisten ja taudin lähtötilanteen ominaisuuksien suhteen samankaltaiset.
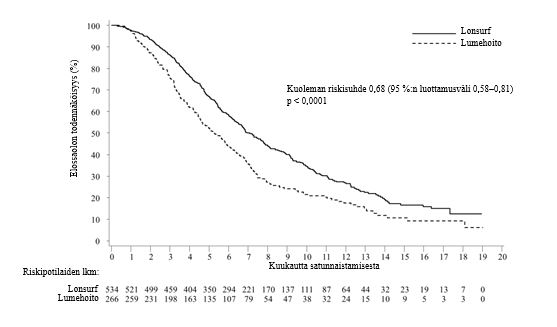
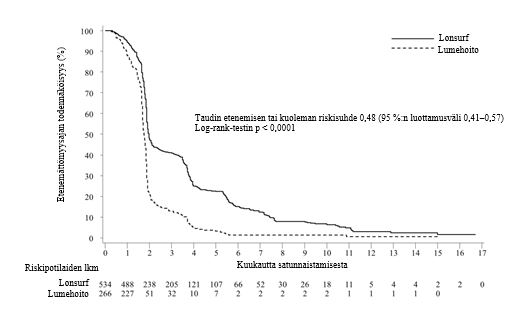
Tutkimuksen kokonaiselossaoloanalyysi tehtiin suunnitellusti 72 %:sta (N = 574) tapahtumia. Analyysi osoitti potilaiden hyötyneen elossaolon suhteen kliinisesti merkittävästi ja tilastollisesti merkitsevästi Lonsurf-hoidon ja parhaan tukihoidon yhdistelmästä verrattuna lumehoidon ja parhaan tukihoidon yhdistelmään (riskisuhde: 0,68; 95 %:n luottamusväli [0,58–0,81]; p < 0,0001). Kokonaiselossaolon mediaani oli vastaavasti 7,1 kuukautta verrattuna 5,3 kuukauteen, ja 1 vuoden elossaoloprosentti oli vastaavasti 26,6 % ja 17,6 %. Lonsurf-hoidon ja parhaan tukihoidon yhdistelmää saaneiden potilaiden taudin etenemättömyysaika parani merkittävästi (riskisuhde: 0,48, 95 %:n luottamusväli [0,41–0,57]; p < 0,0001 (ks. taulukko 7, kuva 1 ja kuva 2).
Taulukko 7 - Metastasoitunutta kolorektaalisyöpää sairastavilla potilailla tehdyn vaiheen III kliinisen tutkimuksen (RECOURSE) hoidon tehoa koskevat tulokset
| Lonsurf + paras tukihoito | Lumehoito + paras tukihoito |
Kokonaiselossaolo | ||
Kuolemien lukumäärä, N (%) | 364 (68,2) | 210 (78,9) |
Kokonaiselossaolon mediaani (kk)a [95 %:n luottamusväli]b | 7,1 [6,5, 7,8] | 5,3 [4,6, 6,0] |
Riskisuhde [95 %:n luottamusväli] | 0,68 [0,58, 0,81] | |
P-arvoc | < 0,0001 (yksitahoinen ja kaksitahoinen) | |
Etenemättömyysaika | ||
Taudin etenemisen tai kuolemien lukumäärä, N (%) | 472 (88,4) | 251 (94,4) |
Etenemättömyysajan mediaani (kk)a [95 %:n luottamusväli]b | 2,0 [1,9, 2,1] | 1,7 [1,7, 1,8] |
Riskisuhde [95 %:n luottamusväli] | 0,48 [0,41, 0,57] | |
P-arvoc | < 0,0001 (yksitahoinen ja kaksitahoinen) | |
a Kaplan–Meierin estimaatit
b Brookmeyerin ja Crowleyn menetelmä
c Ositettu log-rank-testi (ositteet: KRAS-status, aika diagnoosista ensimmäiseen metastaasiin, kasvaimen sijainti)
Kuva 1 - Metastasoitunutta kolorektaalisyöpää sairastavien potilaiden kokonaiselossaolon Kaplan–Meierin käyrät (RECOURSE)
Kuva 2 - Metastasoitunutta kolorektaalisyöpää sairastavien potilaiden etenemättömyysajan Kaplan–Meierin käyrät (RECOURSE)
Tutkimuksen päivitetty kokonaiselossaoloanalyysi tehtiin 89 %:sta (N = 712) tapahtumia. Analyysi vahvisti potilaiden hyötyneen elossaolon suhteen kliinisesti merkittävästi ja tilastollisesti merkitsevästi Lonsurf-hoidon ja parhaan tukihoidon yhdistelmästä verrattuna lumehoidon ja parhaan tukihoidon yhdistelmään (riskisuhde: 0,69; 95 %:n luottamusväli [0,59–0,81]; p < 0,0001). Kokonaiselossaolon mediaani oli vastaavasti 7,2 kuukautta verrattuna 5,2 kuukauteen, ja 1 vuoden elossaoloprosentti oli vastaavasti 27,1 % ja 16,6 %.
Kokonaiselossaoloa ja etenemättömyysaikaa koskeva hyöty havaittiin yhdenmukaisesti kaikissa oleellisissa ennalta määritellyissä potilaiden osajoukoissa, mukaan lukien rotu, maantieteellinen alue, ikä (< 65 vuotta; ≥ 65 vuotta), sukupuoli, ECOG-toimintakykyluoka, KRAS-status, aika diagnoosista ensimmäiseen metastaasiin, metastaasien sijaintikohtien lukumäärä ja primaarikasvaimen sijaintikohta. Lonsurf-hoidon hyöty elossaolon suhteen säilyi vielä sen jälkeen, kun kaikkia merkittäviä ennustetekijöitä korjattiin. Näitä ennustetekijöitä olivat aika diagnoosista ensimmäiseen metastaasiin, ECOG-toimintakykyluokka ja metastaasien sijaintikohtien lukumäärä (riskisuhde; 0,69; 95 %:n luottamusväli [0,58–0,81]).
Kuusikymmentäyksi prosenttia (61 %, N = 485) kaikista satunnaistetuista potilaista sai fluoropyrimidiiniä osana viimeistä satunnaistamista edeltävää hoitoa, ja 455:llä (94 %) näistä potilaista tauti ei kyseisenä ajankohtana reagoinut fluoropyrimidiinihoitoon. Näiden potilaiden kokonaiselossaoloa koskeva hyöty säilyi Lonsurf-hoidossa (riskisuhde: 0,75, 95 %:n luottamusväli [0,59–0,94]).
Kahdeksantoista prosenttia (18 %, N = 144) kaikista satunnaistetuista potilaista sai ennen satunnaistamista regorafenibiä. Näiden potilaiden kokonaiselossaoloa koskeva hyöty säilyi Lonsurf-hoidossa (riskisuhde: 0,69, 95 %:n luottamusväli [0,45–1,05]). Teho säilyi myös potilailla, jotka eivät olleet aiemmin saaneet regorafenibihoitoa (riskisuhde: 0,69, 95 %:n luottamusväli [0,57–0,83]).
Taudin hallinnassa pysymistä kuvaava luku (täydellinen vaste tai osittainen vaste tai stabiili tauti) oli Lonsurf-hoitoa saaneilla potilailla merkitsevästi suurempi (44 % vs 16 %, p < 0,0001).
Lonsurf-hoidon ja parhaan tukihoidon yhdistelmä piti toimintakykyluokan alle 2:ssa tilastollisesti merkitsevästi pidempään verrattuna lumehoidon ja parhaan tukihoidon yhdistelmään. Ajan mediaani toimintakykyluokan huononemisessa ≥ 2:een oli Lonsurf-ryhmässä 5,7 kuukautta ja lumeryhmässä 4,0 kuukautta, ja riskisuhde oli 0,66 (95 %:n luottamusväli: [0,56; 0,78]), p < 0,0001.
Satunnaistettu, vaiheen III tutkimus, jossa verrattiin Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoitoa Lonsurf-hoitoon
Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoidon kliinistä tehoa ja turvallisuutta verrattuna Lonsurf-monoterapiaan tutkittiin kansainvälisessä, satunnaistetussa, avoimessa vaiheen III tutkimuksessa (SUNLIGHT), jossa oli mukana metastasoitunutta kolorektaalisyöpää sairastavia potilaita, jotka olivat saaneet pitkälle edenneeseen tautiin aiemmin hoitoa enintään kahden edeltävän systeemisen hoito-ohjelman mukaisesti, mukaan lukien fluoropyrimidiinejä, irinotekaania, oksaliplatiinia, monoklonaalisia VEGF-vasta-aineita ja/tai monoklonaalisia EGFR-vasta-aineita potilaille, joilla oli villityypin RAS-kasvain. Tehon ensisijainen päätetapahtuma oli kokonaiselossaolo (overall survival, OS), ja tehon toissijainen päätetapahtuma oli etenemättömyysaika (progression-free survival, PFS).
Yhteensä 492 potilasta satunnaistettiin suhteessa 1:1 saamaan Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoitoa (N = 246) tai Lonsurf-valmistetta monoterapiana (N = 246).
Potilaat saivat Lonsurf-valmistetta (aloitusannos 35 mg/m2) suun kautta kaksi kertaa vuorokaudessa kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1–5 ja päivinä 8–12 yksin tai yhdessä bevasitsumabin (5 mg/kg) kanssa, jota annettiin laskimoon kahden viikon välein (päivinä 1 ja 15) kunkin 4 viikon hoitosyklin aikana. Potilaat jatkoivat hoitoa taudin etenemiseen saakka tai kunnes heille ilmaantui toksisuutta, joka ei ollut hyväksyttävissä (ks. kohta Annostus ja antotapa). Bevasitsumabia monoterapiana ei sallittu.
Nämä kaksi ryhmää olivat lähtötilanteen ominaisuuksien suhteen yleisesti ottaen samankaltaiset. Iän mediaani oli 63 vuotta (vaihteluväli: 20–90), 44 % oli ≥ 65-vuotiaita ja 12 % ≥ 75-vuotiaita. Potilaista 52 % oli miehiä, 95 % oli valkoihoisia, 46 %:lla ECOG-toimintakykyluokka oli 0, ja 54 %:lla ECOG-toimintakykyluokka oli 1. Kasvain sijaitsi pääasiassa koolonissa (73 %) tai peräsuolessa (27 %). Kaiken kaikkiaan 71 %:lla potilaista oli kasvaimen RAS-mutaatio. Hoidon keston mediaani Lonsurf+bevasitsumabi-ryhmässä oli viisi kuukautta ja Lonsurf-ryhmässä kaksi kuukautta. Yhteensä 92 %:lla potilaista pitkälle edennyttä kolorektaalisyöpää hoidettiin aiemmin kahden syövän hoito-ohjelman mukaisesti. 5 %:a hoidettiin yhdellä ja 3 %:a hoidettiin yli kahdella hoito-ohjelmalla. Kaikki potilaat olivat aiemmin saaneet fluoropyrimidiinejä, oksaliplatiinia ja irinotekaania. 72 % oli aiemmin saanut monoklonaalisia VEGF-vasta-aineita, ja 94 %potilaista, joilla oli villityypin RAS-kasvain, oli aiemmin saanut monoklonaalisia EGFR-vasta-aineita.
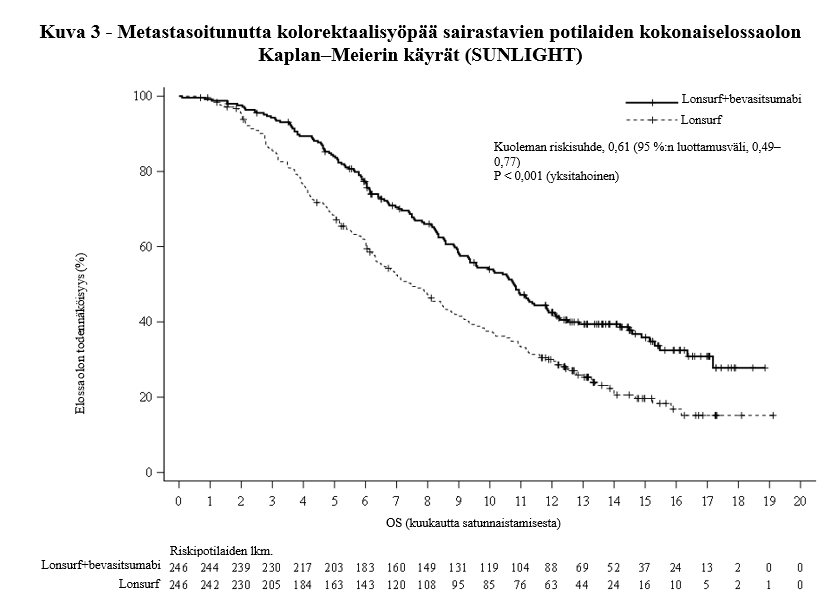
Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoito johti tilastollisesti merkitsevään paranemiseen kokonaiselossaolossa ja etenemättömyysajassa verrattuna Lonsurf-monoterapiaan (ks. taulukko 8 ja kuvat 3 ja 4).
Taulukko 8 - Metastasoitunutta kolorektaalisyöpää sairastavilla potilailla tehdyn vaiheen III kliinisen tutkimuksen (SUNLIGHT) hoidon tehoa koskevat tulokset
| Lonsurf + bevasitsumabi | Lonsurf |
Kokonaiselossaolo | ||
Kuolemien lukumäärä, N (%) | 148 (60,2) | 183 (74,4) |
Kokonaiselossaolon mediaani (kk)a [95 %:n luottamusväli]b | 10,8 [9,4, 11,8] | 7,5 [6,3, 8,6] |
Riskisuhde [95 %:n luottamusväli] | 0,61 [0,49, 0,77] | |
P-arvoc | < 0,001 (yksitahoinen) | |
Etenemättömyysaika (tutkijan mukaan) | ||
Taudin etenemisen tai kuolemien lukumäärä, N (%) | 206 (83,7) | 236 (95,9) |
Etenemättömyysajan mediaani (kk)a [95 %:n luottamusväli]b | 5,6 [4,5, 5,9] | 2,4 [2,1, 3,2] |
Riskisuhde [95 %:n luottamusväli] | 0,44 [0,36, 0,54] | |
P-arvoc | < 0,001 (yksitahoinen) | |
a Kaplan–Meierin estimaatit
b Brookmeyerin ja Crowleyn menetelmä
c Ositettu log-rank-testi (ositteet: alue, aika diagnoosista ensimmäiseen metastaasiin, RAS-status)
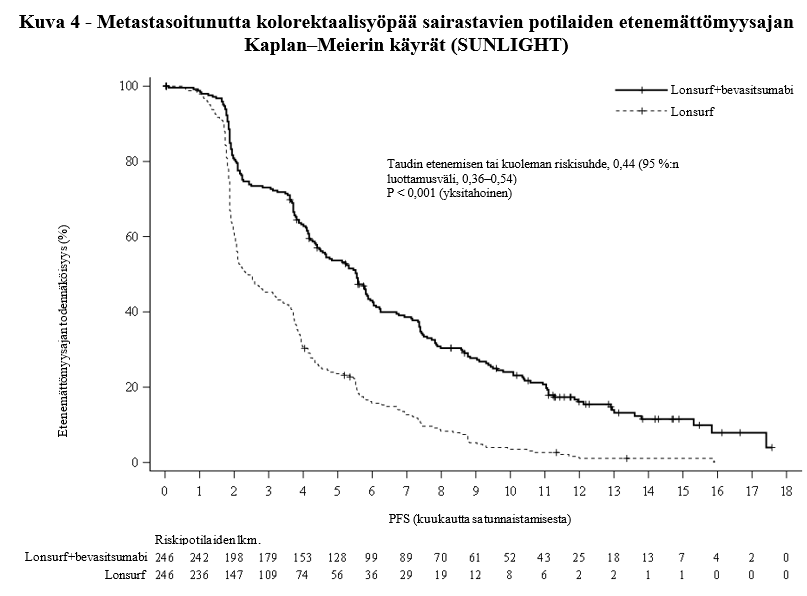
Kokonaiselossaoloa ja etenemättömyysaikaa koskeva hyöty havaittiin yhdenmukaisesti kaikissa satunnaistamisositteissa ja ennalta määritellyissä potilaiden osajoukoissa, mukaan lukien sukupuoli, ikä (< 65 vuotta, ≥ 65 vuotta), primaarisairauden sijaintikohta (oikea, vasen), ECOG-toimintakykyluokka (0, ≥1), aiempi kirurginen resektio, metastaasien sijaintikohtien lukumäärä (1–2, ≥ 3), neutrofiili/lymfosyyttisuhde (NLR < 3, NLR ≥ 3), aiempien metastaattisten lääkkeiden hoito-ohjelmien määrä (1, ≥ 2), BRAF-status, MSI-status, aiempi bevasitsumabi ja myöhempi regorafenibi.
Metastasoitunut mahasyöpä
Lonsurf-valmisteen kliinistä tehoa ja turvallisuutta tutkittiin kansainvälisessä, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen III tutkimuksessa (TAGS), jossa oli mukana aiempaa hoitoa saaneita metastasoitunutta mahasyöpää (mukaan lukien ruokatorven ja mahan liitoskohdan adenokarsinoomaa) sairastavia potilaita. Potilaat olivat saaneet pitkälle edenneeseen tautiin aiemmin hoitoa vähintään kahden edeltävän systeemisen hoito-ohjelman mukaisesti, mukaan lukien fluoropyrimidiini-, platina- ja joko taksaani- tai irinotekaanipohjaista solunsalpaajahoitoa sekä ihmisen epidermaalisen kasvutekijän reseptoriin 2 (HER2) kohdennettua hoitoa, jos se oli tarkoituksenmukaista. Tehon ensisijainen päätetapahtuma oli kokonaiselossaolo (overall survival, OS), ja sitä tukevia tehon päätetapahtumia olivat etenemättömyysaika (progression-free survival, PFS), kokonaisvasteluku (overall response rate, ORR), taudin hallinnassa pysymistä kuvaava luku (disease control rate, DCR), aika ECOG-toimintakykyluokan huononemiseen tasolle ≥ 2 ja elämänlaatu. Tutkija tai paikallinen radiologian erikoislääkäri tutki kasvaimen RECIST-kriteerien (Response Evaluation Criteria in Solid Tumours) version 1.1 mukaisesti 8 viikon välein.
Yhteensä 507 potilasta satunnaistettiin suhteessa 2:1 saamaan Lonsurf-hoitoa (N = 337) yhdistelmänä parhaan tukihoidon (best supportive care, BSC) kanssa tai lumelääkettä (N = 170) yhdistelmänä parhaan tukihoidon kanssa. Lonsurf-annostus perustui potilaan kehon pinta-alaan, ja aloitusannos oli 35 mg/m2/annos. Tutkimushoito annettiin suun kautta kaksi kertaa vuorokaudessa, aamu- ja ilta-aterioiden jälkeen, viitenä päivänä viikossa, mitä seurasi kahden päivän hoitotauko. Hoitoa annettiin näin kahden viikon ajan, jonka jälkeen oli 14 päivän hoitotauko, ja tätä toistettiin 4 viikon jaksoina. Potilaat jatkoivat hoitoa taudin etenemiseen saakka tai kunnes heille ilmaantui toksisuutta, joka ei ollut hyväksyttävissä (ks. kohta Annostus ja antotapa).
Näiden 507 satunnaistetun potilaan iän mediaani oli 63 vuotta, heistä 73 % oli miehiä, 70 % oli valkoihoisia, 16 % oli etniseltä taustaltaan aasialaisia ja < 1 % oli mustaihoisia/afroamerikkalaisia. Kaikkien potilaiden ECOG-toimintakykyluokka (Eastern Cooperative Oncology Group) oli lähtötilanteessa 0 tai 1. Primaarikasvain sijaitsi mahalaukussa (71,0 %) tai ruokatorven ja mahan liitoskohdassa (28,6 %) tai kummassakin (0,4 %). Metastasoituneeseen tautiin aiemmin annettujen hoitojen lukumäärän mediaani oli 3. Lähes kaikki (99,8 %) potilaat olivat saaneet aiemmin fluoropyrimidiiniä, 100 % oli saanut aiemmin platinahoitoa ja 90,5 % oli saanut aiemmin taksaanihoitoa. Noin puolet (55,4 %) potilaista oli saanut aiemmin irinotekaania, 33,3 % potilaista oli saanut aiemmin ramusirumabia ja 16,6 % oli saanut aiemmin HER2-kohdennettua hoitoa. Nämä kaksi hoitoryhmää olivat demografisten ja taudin lähtötilanteen ominaisuuksien suhteen samankaltaiset.
Tutkimuksen kokonaiselossaoloanalyysi tehtiin suunnitellusti, kun 76 % (N = 384) tapahtumista oli tapahtunut. Analyysi osoitti potilaiden hyötyneen kokonaiselossaolon suhteen tilastollisesti merkitsevästi Lonsurf-hoidon ja parhaan tukihoidon yhdistelmästä verrattuna lumehoidon ja parhaan tukihoidon yhdistelmään (riskisuhde: 0,69 (95 %:n luottamusväli [0,56–0.85]; yksitahoinen p-arvo oli 0,0003 ja kaksitahoinen p-arvo oli 0,0006), ja vastasi kuoleman riskin 31 %:n vähenemää Lonsurf-ryhmässä. Kokonaiselossaolon mediaani oli Lonsurf-ryhmässä 5,7 kuukautta (95 %:n luottamusväli [4,8–6,2]) verrattuna lumeryhmän 3,6 kuukauteen (95 %:n luottamusväli [3,1–4,1]), ja 1 vuoden elossaoloprosentti oli vastaavasti 21,2 % ja 13,0 %.
Lonsurf-hoidon ja parhaan tukihoidon yhdistelmää saaneiden potilaiden taudin etenemättömyysaika parani merkittävästi lumehoidon ja parhaan tukihoidon yhdistelmään verrattuna (riskisuhde: 0,57, 95 %:n luottamusväli [0,47–0,70]; p < 0,0001 (ks. taulukko 9, kuva 5 ja kuva 6).
Taulukko 9 – Metastasoitunutta mahasyöpää sairastavilla potilailla tehdyn vaiheen III kliinisen tutkimuksen (TAGS) hoidon tehoa koskevat tulokset
| Lonsurf + paras tukihoito | Lumehoito + paras tukihoito |
Kokonaiselossaolo | ||
Kuolemien lukumäärä, N (%) | 244 (72,4) | 140 (82,4) |
Kokonaiselossaolon mediaani (kk)a [95 %:n luottamusväli]b | 5,7 [4,8, 6,2] | 3,6 [3,1, 4,1] |
Riskisuhde [95 %:n luottamusväli] | 0,69 [0,56, 0,85] | |
P-arvoc | 0,0003 (yksitahoinen), 0,0006 (kaksitahoinen) | |
Etenemättömyysaika | ||
Taudin etenemisen tai kuolemien lukumäärä, N (%) | 287 (85,2)
| 156 (91,8) |
Etenemättömyysajan mediaani (kk)a [95 %:n luottamusväli]b | 2,0 [1,9, 2,3] | 1,8 [1,7, 1,9] |
Riskisuhde [95 %:n luottamusväli] | 0,57 [0,47, 0,70] | |
P-arvoc | < 0,0001 (yksitahoinen ja kaksitahoinen) | |
a Kaplan–Meierin estimaatit
b Brookmeyerin ja Crowleyn menetelmä
c Ositettu log-rank-testi (ositteet: kasvaimen sijainti, lähtötilanteen ECOG-toimintakykyluokka, aiempi ramusirumabihoito)
Kuva 5 – Metastasoitunutta mahasyöpää sairastavien potilaiden kokonaiselossaolon Kaplan–Meierin käyrät (TAGS)
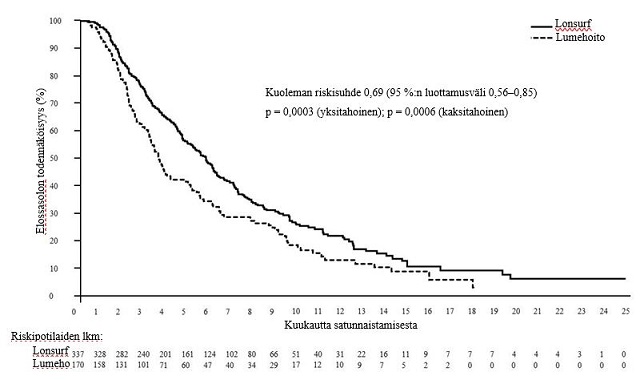
Kuva 6 – Metastasoitunutta mahasyöpää sairastavien potilaiden etenemättömyysajan Kaplan–Meierin käyrät (TAGS)
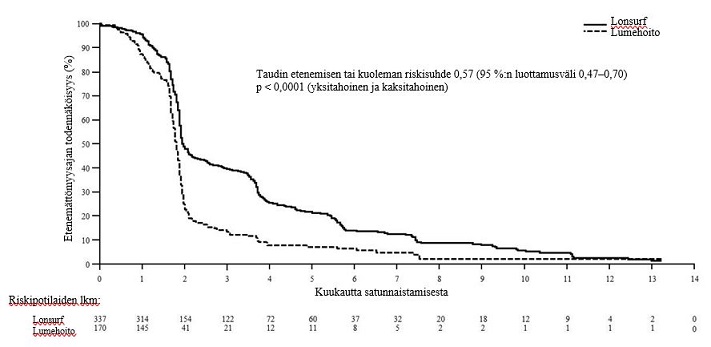
Kokonaiselossaoloa ja etenemättömyysaikaa koskeva hyöty havaittiin yhdenmukaisesti kaikissa satunnaistamisositteissa ja useimmissa ennalta määritellyissä potilaiden osajoukoissa, mukaan lukien sukupuoli, ikä (< 65 vuotta, ≥ 65 vuotta), etninen alkuperä, ECOG-toimintakykyluokka, aiempi ramusirumabihoito, aiempi irinotekaanihoito, aiempien hoito-ohjelmien lukumäärä (2, 3, ≥ 4), aiemmin tehty gastrektomia, primaarikasvaimen sijaintikohta (mahalaukku, ruokatorven ja mahan liitoskohta) ja HER2-status.
Kokonaisvasteluku (täydellinen vaste + osittainen vaste) ei ollut Lonsurf-hoitoa saaneilla potilailla merkitsevästi suurempi (4,5 % vs 2,1 %, p-arvo = 0,2833), mutta taudin hallinnassa pysymistä kuvaava luku (täydellinen vaste tai osittainen vaste tai stabiili tauti) oli Lonsurf-hoitoa saaneilla potilailla merkitsevästi suurempi (44,1 % vs 14,5 %, p < 0,0001).
Ajan mediaani ECOG-toimintakykyluokan huononemisessa ≥ 2:een oli Lonsurf-ryhmässä 4,3 kuukautta ja lumeryhmässä 2,3 kuukautta, ja riskisuhde oli 0,69 (95 %:n luottamusväli [0,562–0,854]), p‑arvo = 0,0005.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Lonsurf-valmisteen käytöstä hoitoon reagoimattoman metastasoituneen kolorektaalisyövän ja hoitoon reagoimattoman metastasoituneen mahasyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Iäkkäät
Vähintään 75-vuotiaista Lonsurf-hoitoa saaneista potilaista on vähän tietoja:
- Yhdistetyissä RECOURSE- ja TAGS-tutkimuksissa 87 potilasta [10 %], joista kaksi potilasta oli 85-vuotiaita tai vanhempia. Lonsurf-hoidon vaikutus kokonaiselossaoloon oli samankaltainen < 65-vuotiailla ja ≥ 65‑vuotiailla potilailla.
- SUNLIGHT-tutkimuksessa 58 potilasta (12 %) oli vähintään 75-vuotiaita, ja näistä yksi potilas oli 85-vuotias tai vanhempi. Lonsurf-valmisteen ja bevasitsumabin yhdistelmähoidon vaikutus kokonaiselossaoloon oli samankaltainen < 65-vuotiailla ja ≥ 65‑vuotiailla potilailla.
Farmakokinetiikka
Imeytyminen
Kun Lonsurf-valmisteen ja [14C]-trifluridiinin yhdistelmää annettiin suun kautta, vähintään 57 % annetusta trifluridiinista imeytyi ja vain 3 % annoksesta erittyi ulosteisiin. Kun Lonsurf-valmisteen ja [14C]-tipirasiilihydrokloridin yhdistelmää annettiin suun kautta, vähintään 27 % annetusta tipirasiilihydrokloridista imeytyi ja 50 % kokonaisradioaktiivisuusannoksesta mitattiin ulosteista. Tämä viittaa siihen, että tipirasiilihydrokloridi imeytyy kohtalaisesti maha-suolikanavasta.
Kun potilaille, joilla oli pitkälle edenneitä kiinteitä kasvaimia, annettiin Lonsurf-kerta-annos (35 mg/m2), huippupitoisuuden (tmax) saavuttamiseen kuluva keskimääräinen aika oli trifluridiinin osalta noin 2 tuntia ja tipirasiilihydrokloridin osalta noin 3 tuntia.
Useiden Lonsurf-annosten (35 mg/m2/annos kaksi kertaa vuorokaudessa viiden päivän ajan, minkä jälkeen kahden päivän hoitotauko; hoitoa annettiin näin kahden viikon ajan, minkä jälkeen oli 14 vuorokauden hoitotauko; tätä hoito-ohjelmaa toistettiin neljän viikon jaksoina) antamisen jälkeen tehdyssä farmakokineettisessä analyysissä trifluridiinin pitoisuus–aika-käyrän alle jäävä pinta-ala ajankohdasta 0 viimeisimpään mitattavissa olleeseen pitoisuuteen (AUC0-last) oli noin kolminkertainen ja huippupitoisuus (Cmax) oli noin kaksinkertainen, kun Lonsurf-valmisteen toistuvaa antoa (1. hoitosyklin päivänä 12) verrattiin kerta-annoksen antamiseen (1. hoitosyklin päivänä 1).
Tipirasiilihydrokloridi ei kuitenkaan kumuloitunut eikä trifluridiini kumuloitunut enää edelleen Lonsurf-hoidon seuraavissa hoitosykleissä (2. ja 3. hoitosyklin päivänä 12). Kun potilaille, joilla oli pitkälle edenneitä kiinteitä kasvaimia, annettiin toistuvasti Lonsurf-annoksia (35 mg/m2/annos kaksi kertaa vuorokaudessa), huippupitoisuuden (tmax) saavuttamiseen kuluva keskimääräinen aika oli trifluridiinin osalta noin 2 tuntia ja tipirasiilihydrokloridin osalta noin 3 tuntia.
Tipirasiilihydrokloridin vaikutus
Lonsurf-kerta-annoksen (35 mg/m2/annos) antaminen suurensi trifluridiinin AUC0-last‑arvon keskimäärin 37-kertaiseksi ja Cmax-arvon 22-kertaiseksi, missä vaihtelu oli pelkän trifluridiinin (35 mg/m2/annos) antamiseen verrattuna vähäistä.
Ruoan vaikutus
Kun 14 potilaalle, joilla oli kiinteitä kasvaimia, annettiin Lonsurf-kerta-annos 35 mg/m2 standardoidun runsasrasvaisen ja runsaskalorisen aterian jälkeen, trifluridiinin pitoisuus–aika-käyrän alle jäävä pinta-ala (AUC-arvo) ei muuttunut, mutta trifluridiinin Cmax-arvo, tipirasiilihydrokloridin Cmax-arvo ja AUC-arvo pienenivät noin 40 % verrattuna paastotilassa olleisiin potilaisiin. Lonsurf-valmiste annettiin kliinisissä tutkimuksissa yhden tunnin kuluessa aamu- ja ilta-aterian päättymisestä (ks. kohta Annostus ja antotapa).
Jakautuminen
Trifluridiinista sitoutui ihmisen plasman proteiineihin yli 96 %, ja trifluridiini sitoutui pääasiassa ihmisen seerumin albumiiniin. Tipirasiilihydrokloridista sitoutui plasman proteiineihin alle 8 %. Kun potilaille, joilla oli pitkälle edenneitä kiinteitä kasvaimia, annettiin Lonsurf-kerta-annos (35 mg/m2), trifluridiinin näennäinen jakautumistilavuus (Vd/F) oli 21 l ja tipirasiilihydrokloridin 333 l.
Biotransformaatio
Trifluridiini eliminoitui pääasiassa metaboloitumalla TPaasin välityksellä inaktiiviseksi metaboliitiksi FTY:ksi. Imeytynyt trifluridiini metaboloitui ja erittyi virtsaan FTY:nä ja trifluridiinin glukuronidi-isomeereinä. Myös vähäisempiä metaboliitteja (5-karboksiurasiili ja 5-karboksi-2'-deoksiuridiini) havaittiin, mutta niiden pitoisuus plasmassa ja virtsassa on pieni tai niistä havaitaan vain jäämiä.
Tipirasiilihydrokloridi ei metaboloitunut ihmisen maksan S9-fraktiossa eikä pakastetuissa ihmisen maksasoluissa. Tipirasiilihydrokloridi oli tärkein komponentti ja 6-hydroksimetyyliurasiili oli tärkein metaboliitti, joita havaittiin johdonmukaisesti ihmisen plasmassa, virtsassa ja ulosteissa.
Eliminaatio
Kun Lonsurf-valmistetta annetaan suositusannoksina ja suositellun hoito-ohjelman mukaisesti, trifluridiinin eliminaation keskimääräinen puoliintumisaika (t1/2) on 1,4 tuntia 1. hoitosyklin päivänä 1 ja 2,1 tuntia 1. hoitosyklin päivänä 12. Tipirasiilihydrokloridin keskimääräiset t1/2-arvot ovat 2,1 tuntia 1. hoitosyklin päivänä 1 ja 2,4 tuntia 1. hoitosyklin päivänä 12.
Kun potilaille, joilla oli pitkälle edenneitä kiinteitä kasvaimia, annettiin Lonsurf-kerta-annos (35 mg/m2), trifluridiinin oraalinen puhdistuma (Cl/F) oli 10,5 l/h ja tipirasiilihydrokloridin 109 l/h. Kun Lonsurf-valmistetta ja [14C]-trifluridiinia annettiin kerta-annos suun kautta, annetusta radioaktiivisuusannoksesta erittyi kumulatiivisesti yhteensä 60 %. Suurin osa havaitusta radioaktiivisuudesta eliminoitui virtsaan (55 % annoksesta) 24 tunnin kuluessa, ja ulosteisiin ja uloshengitysilmaan erittyi kumpaankin alle 3 %. Kun Lonsurf-valmistetta ja [14C]-tipirasiilihydrokloridia annettiin kerta-annos suun kautta, annetusta radioaktiivisuusannoksesta havaittiin 77 %, mikä oli yhdenmukainen virtsaan erittyneen 27 %:n ja ulosteisiin erittyneen 50 %:n kanssa.
Lineaarisuus/ei-lineaarisuus
Annoshakututkimuksessa (15–35 mg/m2 kaksi kertaa vuorokaudessa) trifluridiinin AUC-arvo suureni 0–10 tunnin välillä (AUC0–10) yleensä annoksen suurentamisen perusteella oletettua enemmän, mutta trifluridiinin oraalinen puhdistuma (Cl/F) ja näennäinen jakautumistilavuus (Vd/F) pysyivät tavallisesti vakioina, kun annos oli 20–35 mg/m2. Trifluridiini- ja tipirasiilihydrokloridialtistusta kuvaavat muut parametrit vaikuttavat olevan suhteessa annokseen.
Farmakokinetiikka erityispotilasryhmissä
Ikä, sukupuoli ja rotu
Ikä, sukupuoli tai rotu eivät populaatiofarmakokineettisen analyysin perusteella vaikuta trifluridiinin tai tipirasiilihydrokloridin farmakokinetiikkaan.
Munuaisten vajaatoiminta
RECOURSE-tutkimuksessa Lonsurf-hoitoa saaneista 533 potilaasta 306 (57 %) potilaan munuaisten toiminta oli normaali (CrCl ≥ 90 ml/min), 178 (33 %) potilaalla oli lievää munuaisten vajaatoimintaa (CrCl 60–89 ml/min) ja 47 (9 %) potilaalla oli kohtalaista munuaisten vajaatoimintaa (CrCl 30–59 ml/min). Kahden potilaan tiedot puuttuivat. Vaikeaa munuaisten vajaatoimintaa sairastavia potilaita ei otettu mukaan tutkimukseen.
Lonsurf-altistus oli populaatiofarmakokineettisen analyysin peruusteella lievää munuaisten vajaatoimintaa (CrCl = 60–89 ml/min) sairastavilla potilailla samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali (CrCl ≥ 90 ml/min). Keskivaikeaa munuaisten vajaatoimintaa (CrCl = 30–59 ml/min) sairastavien potilaiden Lonsurf-altistuksen havaittiin olevan suurempi. Arvio (CrCl) oli oraalisen puhdistuman (Cl/F) merkittävä kovariaatti sekä trifluridiinin että tipirasiilihydrokloridin lopullisissa malleissa. Kun lievää (n = 38) tai keskivaikeaa (n = 16) munuaisten vajaatoimintaa sairastavia potilaita verrattiin potilaisiin, joiden munuaisten toiminta oli normaali (n = 84), trifluridiinin AUC-arvojen keskimääräinen suhde oli 1,31 (lievä vajaatoiminta vs normaali munuaistoiminta) ja 1,43 (keskivaikea vajaatoiminta vs normaali munuaistoiminta), ja tipirasiilihydrokloridin AUC-arvojen keskimääräinen suhde oli 1,34 (lievä vajaatoiminta vs normaali munuaistoiminta) ja 1,65 (keskivaikea vajaatoiminta vs normaali munuaistoiminta).
Trifluridiinin ja tipirasiilihydrokloridin farmakokinetiikkaa selvittäneessä tutkimuksessa oli mukana syöpäpotilaita, joiden munuaisten toiminta oli normaali (CrCl ≥ 90 ml/min, N = 12) tai joilla oli lievää munuaisten vajaatoimintaa (CrCl = 60–89 ml/min, N = 12), keskivaikeaa munuaisten vajaatoimintaa (CrCl = 30–59 ml/min, N = 11) tai vaikeaa munuaisten vajaatoimintaa (CrCl = 15–29 ml/min, N = 8). Vaikeaa munuaisten vajaatoimintaa sairastavat potilaat saivat mukautettua aloitusannosta 20 mg/m2 kaksi kertaa vuorokaudessa (pienennettiin annokseen 15 mg/m2 kaksi kertaa vuorokaudessa yksilöllisen turvallisuuden ja siedettävyyden perusteella). Toistuvan annon jälkeen munuaisten vajaatoiminta vaikutti siten, että kokonaisaltistus trifluridiinille suureni keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 1,6-kertaiseksi ja vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 1,4-kertaiseksi verrattuna potilaisiin, joiden munuaisten toiminta oli normaali; Cmax säilyi samankaltaisena. Kokonaisaltistus tipirasiilihydrokloridille oli toistuvan annon jälkeen keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 2,3 kertaa ja vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla 4,1 kertaa suurempi verrattuna potilaisiin, joiden munuaisten toiminta oli normaali; tämä liittyy munuaisten vajaatoiminnan pahenemisen myötä tapahtuvaan puhdistuman pienentymiseen. Trifluridiinin ja tipirasiilihydrokloridin farmakokinetiikkaa ei ole tutkittu loppuvaiheen munuaissairautta sairastavilla potilailla (CrCl < 15 ml/min tai vaatii dialyysihoitoa) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta
Populaatiofarmakokineettinen analyysi osoittaa, että maksan toimintaa kuvaavat parametrit, mukaan lukien alkalinen fosfataasi (AFOS, 36–2322 U/l), aspartaattiaminotransferaasi (ASAT, 11–197 U/l), alaniiniaminotransferaasi (ALAT, 5–182 U/l) ja kokonaisbilirubiini (0,17–3,20 mg/dl), eivät olleet merkittäviä trifluridiinin tai tipirasiilihydrokloridin farmakokinetiikka kuvaavia kovariaatteja. Seerumin albumiinin todettiin vaikuttavan merkittävästi trifluridiinin puhdistumaan, ja niiden välillä vallitsee negatiivinen korrelaatio. Pieni albumiinipitoisuus 2,2–3,5 g/dl vastaa puhdistumaa 4,2–3,1 l/h.
Trifluridiinia ja tipirasiilihydrokloridia tutkittiin näihin lääkeaineisiin keskittyneessä farmakokineettisessä tutkimuksessa syöpäpotilailla, joilla oli lievää tai keskivaikeaa maksan vajaatoimintaa (National Cancer Institute [NCI] ‑kriteerien ryhmät B [lievä maksan vajaatoiminta] ja C [keskivaikea maksan vajaatoiminta]), sekä potilailla, joiden maksan toiminta oli normaali. Suppeissa tiedoissa, joissa oli huomattavaa vaihtelua, ei havaittu farmakokinetiikassa tilastollisesti merkitseviä eroja niiden potilaiden välillä, joiden maksan toiminta oli normaali tai joilla oli lievää tai keskivaikeaa maksan vajaatoimintaa. Trifluridiinilla ja tipirasiilihydrokloridilla ei havaittu korrelaatiota farmakokineettisten parametrien ja ASAT-arvojen ja/tai veren kokonaisbilirubiinipitoisuuden välillä. Trifluridiinin ja tipirasiilihydrokloridin puoliintumisaika (t1/2) ja kumuloitumissuhde olivat samankaltaiset potilailla, joilla oli keskivaikeaa tai lievää maksan vajaatoimintaa tai joiden maksan toiminta oli normaali.
Aloitusannosta ei tarvitse muuttaa, jos potilaalla on lievää maksan vajaatoimintaa (ks. kohta Annostus ja antotapa).
Mahalaukun poisto
Mahalaukun poiston vaikutusta farmakokineettisiin parametreihin ei voitu tutkia populaatiofarmakokineettisessä analyysissä, koska potilaita, jolta mahalaukku oli poistettu, oli liian vähän (yhteensä 1 %).
In vitro ‑yhteisvaikutustutkimukset
Trifluridiini on TPaasin substraatti, mutta se ei metaboloidu sytokromi P450:n (CYP) välityksellä. Tipirasiilihydrokloridi ei metaboloidu ihmisen maksan S9-fraktiossa eikä pakastetuissa maksasoluissa.
In vitro ‑tutkimukset osoittivat, että trifluridiini, tipirasiilihydrokloridi ja FTY (trifluridiinin inaktiivinen metaboliitti) eivät estäneet testattuja CYP-isoformeja (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ja CYP3A4/5). In vitro ‑selvitys osoitti, että trifluridiini, tipirasiilihydrokloridi ja FTY eivät indusoi ihmisen CYP1A2:ta, CYP2B6:tta eikä CYP3A4/5:ttä. Trifluridiinilla ja tipirasiilihydrokloridilla ei siten oletettavasti ole merkittäviä CYP-välitteisiä lääkeyhteisvaikutuksia.
Trifluridiinia ja tipirasiilihydrokloridia koskeva in vitro ‑selvitys tehtiin lääkeaineita ihmisen soluihin kuljettavilla ja niistä pois pumppaavilla kuljettajaproteiineilla (trifluridiinia tutkittiin MDR1-, OATP1B1-, OATP1B3- ja BCRP-kuljettajilla; tipirasiilihydrokloridia OAT1-, OAT3-, OCT2-, MATE1-, MDR1- ja BCRP-kuljettajilla). Trifluridiini tai tipirasiilihydrokloridi eivät in vitro ‑tutkimusten perusteella ole lääkeaineita ihmisen soluihin kuljettavien ja niistä pois pumppaavien kuljettajaproteiinien estäjiä tai substraatteja, lukuun ottamatta OCT2- ja MATE1-kuljettajia. Tipirasiilihydrokloridi oli OCT2:n ja MATE1:n estäjä in vitro, mutta pitoisuuksilla, jotka ovat merkittävästi suurempia kuin vakaan tilan Cmax ihmisen plasmassa. Yhteisvaikutukset sen ja muiden lääkevalmisteiden välillä ovat suositeltuina annoksina käytettäessä epätodennäköisiä, koska OCT2:n ja MATE1:n toiminta estyy. Lonsurf-valmisteen samanaikainen käyttö OCT2:n ja MATE1:n estäjien kanssa saattaa vaikuttaa tipirasiilihydrokloridin kuljetukseen OCT2:n ja MATE1:n välityksellä.
Farmakokineettiset/farmakodynaamiset suhteet
Lonsurf-valmisteen tehoa ja turvallisuutta metastasoituneen kolorektaalisyövän hoidossa verrattiin trifluridiinin AUC-arvon mediaanin perusteella suuren altistuksen (> mediaani) ja pienen altistuksen (≤ mediaani) ryhmien välillä. Kokonaiselossaolo vaikutti suotuisammalta suuren AUC-arvon ryhmässä verrattuna pienen AUC-arvon ryhmään (kokonaiselossaolon mediaani 9,3 kuukautta vs. 8,1 kuukautta). Kaikki AUC-ryhmät hyötyivät hoidosta seurantajakson aikana enemmän kuin lumeryhmä. Graduksen ≥ 3 neutropenian ilmaantuvuus oli suurempi ryhmässä, jossa trifluridiinin AUC-arvo oli suuri (47,8 %), verrattuna ryhmään, jossa trifluridiinin AUC-arvo oli pieni (30,4 %).
Prekliiniset tiedot turvallisuudesta
Toistettujen annosten toksisuus
Trifluridiinin ja tipirasiilihydrokloridin toksisuutta tutkittiin rotalla, koiralla ja apinalla. Kohde-elimiksi tunnistettiin imukudos ja hematopoieettinen järjestelmä sekä maha-suolikanava. Kaikki muutokset eli leukopenia, anemia, luuytimen hypoplasia, imukudoksen ja hematopoieettisen kudoksen sekä maha-suolikanavan atrofiset muutokset korjautuivat 9 viikon kuluessa lääkkeen annon lopettamisesta. Trifluridiinilla ja tipirasiilihydrokloridilla hoitoa saaneiden rottien hampaissa havaittiin värin muuttumista valkoiseksi, murtumista ja purentavikoja, joiden katsottiin olevan jyrsijöille spesifisiä eikä ihmisen kannalta oleellisia.
Karsinogeenisuus ja mutageenisuus
Trifluridiinin ja tipirasiilihydrokloridin karsinogeenisuutta ei ole tutkittu pitkäkestoisissa eläinkokeissa. Trifluridiinin osoitettiin bakteerien takaisinmutaatiokokeessa, nisäkässoluviljelmässä tehdyssä kromosomipoikkeamatestissä ja hiiren mikrotumatestissä olevan geenitoksinen. Lonsurf-valmistetta pitää siksi pitää mahdollisesti karsinogeenisena.
Lisääntymistoksisuus
Eläinkokeiden tulokset eivät viittaa siihen, että trifluridiini ja tipirasiilihydrokloridi vaikuttaisivat uroksen tai naaraan hedelmällisyyteen. Naarasrotilla havaittua keltarauhasmäärän ja kiinnittyneiden alkioiden määrän lisääntymistä suurten annosten yhteydessä ei katsottu haitalliseksi (ks. kohta Raskaus ja imetys). Lonsurf-valmisteen on osoitettu aiheuttavan tiineille rotille alkio- ja sikiökuolleisuutta sekä alkio- ja sikiötoksisuutta, kun sitä on annettu kliinistä altistusta pienempinä annoksina. Peri- ja postnataalista kehitystoksisuutta koskevia tutkimuksia ei ole tehty.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Laktoosimonohydraatti
Tärkkelys, esigelatinoitu (maissi)
Steariinihappo
Kalvopäällyste
Lonsurf 15 mg/6,14 mg kalvopäällysteiset tabletit
Hypromelloosi
Makrogoli (8000)
Titaanidioksidi (E 171)
Magnesiumstearaatti
Lonsurf 20 mg/8,19 mg kalvopäällysteiset tabletit
Hypromelloosi
Makrogoli (8000)
Titaanidioksidi (E 171)
Rautaoksidi, punainen (E 172)
Magnesiumstearaatti
Painomuste
Shellakka
Rautaoksidi, punainen (E 172)
Rautaoksidi, keltainen (E 172)
Titaanidioksidi (E 171)
Indigokarmiinialumiinilakka (E 132)
Karnaubavaha
Talkki
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LONSURF tabletti, kalvopäällysteinen
15/6,14 mg (L:kyllä) 20 fol (702,66 €), 60 fol (2009,10 €)
20/8,19 mg (L:kyllä) 20 fol (922,07 €), 60 fol (2616,54 €)
PF-selosteen tieto
Alumiini/alumiiniläpipainopakkaus,jossa laminoitua kuivausainetta (kalsiumoksidia) ja joka sisältää 10 tablettia.
Yksi pakkaus sisältää 20, 40 tai 60 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Lonsurf 15 mg/6,14 mg kalvopäällysteiset tabletit
Tabletti on valkoinen, kaksoiskupera, pyöreä, kalvopäällysteinen tabletti, jonka halkaisija on 7,1 mm ja paksuus on 2,7 mm ja jonka toiselle puolelle on painettu harmaalla musteella ”15” ja vastakkaiselle puolelle ”102” ja ”15 mg”.
Lonsurf 20 mg/8,19 mg kalvopäällysteiset tabletit
Tabletti on vaalean punainen, kaksoiskupera, pyöreä, kalvopäällysteinen tabletti, jonka halkaisija on 7,6 mm ja paksuus on 3,2 mm ja jonka toiselle puolelle on painettu harmaalla musteella ”20” ja vastakkaiselle puolelle ”102” ja ”20 mg”.
Käyttö- ja käsittelyohjeet
Kädet on pestävä tablettien käsittelyn jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
LONSURF tabletti, kalvopäällysteinen
15/6,14 mg 20 fol, 60 fol
20/8,19 mg 20 fol, 60 fol
- Ylempi erityiskorvaus (100 %). Trifluridiinin ja tipirasiilin yhdistelmävalmiste: Kolorektaalisyövän ja mahasyövän hoito erityisin edellytyksin (1506).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Trifluridiinin ja tipirasiilin yhdistelmävalmiste: Kolorektaalisyövän hoito erityisin edellytyksin (3018).
ATC-koodi
L01BC59
Valmisteyhteenvedon muuttamispäivämäärä
26.07.2023
Yhteystiedot
Äyritie 22
01510 Vantaa
09 279 8080
www.servierfinland.fi
info.finland@servier.com
