LEVESIA tabletti, kalvopäällysteinen 100/20 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista
Terveydenhuollon ammattilainen
Tärkeää tietoa yhdistelmäehkäisyvalmisteesta ja veritulppariskistä
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Vaikuttavat aineet ja niiden määrät
Vaaleanpunaiset tabletit (aktiiviset tabletit):
Yksi kalvopäällysteinen tabletti sisältää 100 mikrogrammaa levonorgestreelia ja 20 mikrogrammaa etinyyliestradiolia.
Apuaineet, joiden vaikutus tunnetaan:
Yksi tabletti sisältää 89,38 mg laktoosia.
Kalvopäällysteessä on alluranpunainen AC alumiinilakkaa (E129) ja soijalesitiiniä.
Valkoiset tabletit (lumetabletit):
Tabletit eivät sisällä vaikuttavia aineita.
Apuaineet, joiden vaikutus tunnetaan:
Yksi tabletti sisältää 89,50 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy suun kautta.
Levesia-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Levesia-käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Antotapa: suun kautta
Levesia-tablettien käyttö
Tabletit on otettava joka päivä suunnilleen samaan aikaan, tarvittaessa pienen nestemäärän kera, läpipainopakkaukseen merkityssä järjestyksessä. Tabletteja käytetään jatkuvasti. Yksi tabletti otetaan joka päivä 28 peräkkäisenä päivänä. Jokainen uusi pakkaus aloitetaan edellisen pakkauksen viimeisen tabletin jälkeisenä päivänä. Tyhjennysvuoto alkaa tavallisesti 2–3 päivän kuluttua lumetablettien käytön aloittamisesta, eikä se välttämättä ole päättynyt ennen seuraavan pakkauksen aloittamista.
Levesia-valmisteen käytön aloittaminen
- Ei aiempaa hormonaalista ehkäisyä (edeltäneen kuukauden aikana):
Tablettien käyttö on aloitettava luonnollisen kuukautiskierron ensimmäisenä päivänä (ensimmäinen vuotopäivä).
Käytön voi aloittaa päivinä 2–5, mutta siinä tapauksessa on suositeltavaa, että ensimmäisen kuukautiskierron 7 ensimmäisenä päivänä käytetään lisäehkäisynä jotakin estemenetelmää.
- Vaihto yhdistelmäehkäisyvalmisteesta (yhdistelmäehkäisytabletit, ehkäisyrengas tai ehkäisylaastari):
Levesia-valmisteen käyttö aloitetaan mieluiten seuraavana päivänä siitä, kun aiempien yhdistelmäehkäisytablettien viimeinen hormonia sisältävä tabletti (viimeinen vaikuttavia aineita sisältävä tabletti) otetaan, kuitenkin viimeistään aiempien yhdistelmäehkäisytablettien tavanomaista tablettitaukoa tai lumetablettijaksoa seuraavana päivänä. Jos käytössä on ollut ehkäisyrengas tai ehkäisylaastari, Levesia-valmisteen käyttö on aloitettava mieluiten renkaan tai laastarin poistamispäivänä, mutta kuitenkin viimeistään päivänä, jona uusi ehkäisyrengas tai ehkäisylaastari pitäisi asettaa paikalleen.
- Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (pelkkää progestiinia sisältävä ehkäisytabletti, injektio, implantaatti) tai progestiinia vapauttavasta kohdunsisäisestä ehkäisimestä
Pelkkää progestiinia sisältävästä ehkäisytabletista voidaan siirtyä käyttämään Levesia-valmistetta koska tahansa (siirtyminen implantaatista sekä kohdunsisäisestä ehkäisimestä sen poistopäivänä ja injektiosta seuraavana suunniteltuna injektiopäivänä), mutta kaikissa näissä tapauksissa naisen on käytettävä lisäehkäisynä jotakin estemenetelmää 7 ensimmäisen Levesia-tablettipäivän ajan.
- Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Käytön voi aloittaa välittömästi. Muita ehkäisymenetelmiä ei tällöin tarvita.
- Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Imetys, ks. kohta Raskaus ja imetys.
Koska tromboembolisten tapahtumien riski on suurentunut synnytyksen jälkeen, tablettien käytön saa aloittaa aikaisintaan 28 vuorokautta synnytyksen jälkeen (koskee naisia, jotka eivät imetä) tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. 7 ensimmäisen tablettipäivän ajan on käytettävä hormonitonta lisäehkäisyä. Jos nainen on jo ollut yhdynnässä, raskaus on suljettava pois ennen yhdistelmäehkäisytablettien käytön varsinaista aloittamista tai naisen on odotettava seuraavien kuukautisten alkamista.
Hoidon kesto
Levesia-valmistetta voidaan käyttää niin kauan kuin hormonaalista ehkäisyä halutaan käyttää ja hormonaalisen ehkäisyn hyödyt ovat terveysriskejä suuremmat (säännölliset seurantatutkimukset, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tabletin unohtaminen
Levesia-valmisteen sisältämät hormoniannokset ovat hyvin pieniä. Näin ollen ehkäisyteho vaarantuu helposti, jos tabletti unohtuu.
Jos tabletin unohtamisesta on kulunut alle 12 tuntia, valmisteen ehkäisyteho ei ole heikentynyt. Unohtunut tabletti on otettava heti muistettaessa. Seuraavat tabletit otetaan tavanomaiseen aikaan.
Jos tabletin unohtamisesta on kulunut yli 12 tuntia, valmisteen ehkäisyteho voi olla heikentynyt. Seuraavat kaksi perussääntöä pätevät tapauksissa, joissa tablettien ottaminen on unohtunut:
- Aktiivisten tablettien ottamista ei saa koskaan keskeyttää yli 7 päivän ajaksi.
- Hypotalamus-aivolisäke-munasarja-akselin riittävän suppression saavuttaminen edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Yllä olevan perusteella voidaan antaa seuraavat käytännön ohjeet:
Viikko 1
Viimeinen unohtunut tabletti on otettava heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Lisäksi seuraavien 7 päivän ajan on käytettävä jotakin estemenetelmää, kuten kondomia. Jos nainen on ollut yhdynnässä tabletin unohtamista edeltävien 7 päivän aikana, raskauden mahdollisuus on otettava huomioon. Raskauden mahdollisuus on sitä suurempi, mitä useampi tabletti on unohtunut ja mitä lähempänä lumetablettijaksoa unohtuneet tabletit ovat.
Viikko 2
Viimeinen unohtunut tabletti on otettava heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Jos tabletteja on otettu ohjeen mukaan 7 päivän ajan ennen ensimmäistä unohtunutta tablettia, lisäehkäisyä ei tarvita. Jos nainen on kuitenkin unohtanut useampia tabletteja, häntä on neuvottava käyttämään lisäehkäisyä 7 päivän ajan.
Viikko 3
Ehkäisytehoa heikentää lähenevä 7 päivän lumetablettijakso. Ehkäisytehon heikkeneminen voidaan kuitenkin estää muuttamalla tablettien ottoaikataulua. Jos tabletteja on otettu oikein 7 päivän ajan ennen ensimmäistä unohtunutta tablettia, voidaan toimia jommankumman alla olevan ohjeen mukaan eikä lisäehkäisyä tarvita. Jos tabletteja ei ole otettu oikein, on toimittava ensimmäisen ohjeen mukaan ja samalla käytettävä lisäehkäisyä seuraavien 7 päivän ajan.
- Viimeinen unohtunut tabletti on otettava heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan, kunnes kaikki aktiiviset tabletit on otettu. Läpipainopakkauksen viimeisen rivin 7 lumetablettia on hävitettävä. Seuraava läpipainopakkaus on aloitettava heti. Tyhjennysvuoto jää todennäköisesti tulematta ennen uuden läpipainopakkauksen aktiivisten tablettien loppumista, mutta tiputtelu- tai läpäisyvuotoa voi esiintyä.
- Aktiivisten tablettien ottaminen käytössä olevasta läpipainopakkauksesta voidaan myös keskeyttää. Tällöin on otettava viimeisen rivin lumetabletteja 7 päivän ajan, mukaan lukien päivät, joina tablettien otto unohtui. Tämän jälkeen tablettien ottamista jatketaan uudesta läpipainopakkauksesta.
Jos useampi tabletti on jäänyt ottamatta eikä tyhjennysvuotoa tule lumetablettijakson aikana, raskauden mahdollisuus on otettava huomioon.
Ohjeet ruoansulatuskanavan häiriöiden yhteydessä
Vaikeiden ruoansulatushäiriöiden yhteydessä imeytyminen saattaa olla epätäydellistä ja tällöin on käytettävä lisäehkäisyä.
Jos oksentelua tai vaikeaa ripulia esiintyy 3–4 tunnin sisällä aktiivisen tabletin ottamisesta, sovelletaan tablettien unohtamista koskevia ohjeita kohdasta Annostus ja antotapa ”Tabletin unohtaminen” (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos nainen ei halua muuttaa tablettien normaalia käyttöaikataulua, hänen on otettava ylimääräinen tabletti / ylimääräisiä tabletteja toisesta läpipainopakkauksesta. Jos ruoansulatuskanavan häiriöt ovat pitkäkestoisia tai toistuvia, naisen on käytettävä hormonitonta lisäehkäisyä ja kerrottava asiasta lääkärille.
Tyhjennysvuodon siirtäminen eteenpäin ja kuukautisten alkamispäivän muuttaminen
Jos nainen haluaa siirtää tyhjennysvuotoa eteenpäin, hänen on jätettävä nykyisen läpipainopakkauksen lumetabletit ottamatta ja siirryttävä uuteen Levesia-läpipainopakkaukseen. Vuotoa voidaan siirtää niin pitkälle kuin halutaan, aina toisen läpipainopakkauksen aktiivisten tablettien loppumiseen asti. Tänä aikana voi esiintyä läpäisy- tai tiputteluvuotoa. Levesia-tablettien säännöllinen käyttö aloitetaan uudelleen lumetablettijakson jälkeen.
Jos nainen haluaa muuttaa tyhjennysvuodon alkamispäivää joksikin toiseksi viikonpäiväksi, häntä voidaan neuvoa lyhentämään seuraavaa lumetablettijaksoa niin monella päivällä kuin hän haluaa. Mitä lyhyempi jakso on, sitä suurempi on riski, että tyhjennysvuotoa ei lyhennetyn jakson aikana tule ja että seuraavan pakkauksen käytön aikana esiintyy läpäisy- ja tiputteluvuotoa (kuten siirrettäessä tyhjennysvuotoa eteenpäin).
Vasta-aiheet
Yhdistelmäehkäisytabletteja ei pidä käyttää seuraavien tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäistä kertaa yhdistelmäehkäisytablettien käytön aikana, valmisteen käyttö on lopetettava välittömästi.
- raskaus tai raskauden epäily
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC-resistenssi (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C‑proteiinin puutos, S‑proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
valtimotromboembolia tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia
- tupakointi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- tällä hetkellä esiintyvä tai aiemmin esiintynyt haimatulehdus, johon liittyy vaikea hypertriglyseridemia
- tällä hetkellä esiintyvä tai aiemmin esiintynyt vaikea maksasairaus niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi (mukaan lukien Dubin–Johnsonin oireyhtymä ja Rotorin oireyhtymä)
- tällä hetkellä esiintyvä tai aiemmin esiintynyt hyvän- tai pahanlaatuinen maksakasvain
- sukupuolihormoniriippuvaiset kasvaimet tai niiden epäily (esim. sukupuolielimissä tai rinnoissa)
- emätinverenvuoto, jonka syy on selvittämättä
- tuntemattomasta syystä johtuva amenorrea
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
- Levesia sisältää soijaöljyä. Maapähkinälle tai soijalle allergisten potilaiden ei pidä käyttää tätä lääkevalmistetta.
- Levesia on vasta-aiheinen, jos samanaikaisesti käytetään ombitasviiria/paritapreviiria/ritonaviiria, ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältäviä lääkevalmisteita (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
Levesia-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Levesia-valmisteen käyttö keskeyttää.
Levesia sisältää alluranpunainen AC alumiinilakka ‑atsoväriainetta (E129) ja indigokarmiinin alumiinilakkaa (E132), jotka saattavat aiheuttaa allergisia reaktioita.
Verenkiertohäiriöt
Myös laskimo- tai valtimosairauksien yhden vakavan riskitekijän tai useamman kuin yhden riskitekijän olemassaolo voi olla hoidon vasta-aihe. Antikoagulanttihoidon mahdollisuus on myös otettava huomioon. Yhdistelmäehkäisytablettien käyttäjiä on nimenomaisesti kehotettava ottamaan yhteys lääkäriin, jos heille kehittyy mahdollisia tromboosioireita. Jos potilaalla epäillään tromboosia tai todetaan sellainen, yhdistelmäehkäisytablettien käyttö on lopetettava. Potilaan on aloitettava sopivan vaihtoehtoisen ehkäisymenetelmän käyttö, sillä antikoagulanttihoito (kumariinit) on teratogeenista.
Lapsivuodeajan suurentunut tromboemboliariski on otettava huomioon (ks. kohta Raskaus ja imetys).
Laskimotromboembolian (VTE) riski
Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Päätöksen Levesia-valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Levesia‑valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
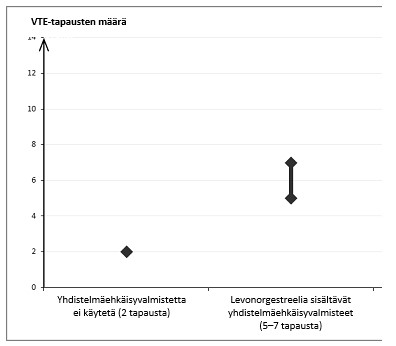
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistään (ks. jäljempänä).
Arviolta noin 6 naiselle1 10 000:sta, jotka käyttävät levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana.
1 Vaihteluvälin 5–7 keskipiste 10 000:ta naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
VTE-tapausten määrä 10 000:ta naista kohti yhden vuoden aikana
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Levesia-valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Levesia‑valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkin näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö [TIA], aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Levesia-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
Kasvaimet
Joissakin epidemiologisissa tutkimuksissa on raportoitu kohdunkaulan syövän riskin suurentuneen yhdistelmäehkäisytablettien pitkäaikaiskäytön yhteydessä, mutta vieläkään ei ole yksimielisyyttä siitä, missä määrin tähän havaintoon vaikuttavat sukupuolikäyttäytymisen sekoittavat vaikutukset ja muut tekijät, kuten papilloomavirus (HPV).
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien käyttäjien suhteellinen rintasyöpäriski on hieman suurentunut (suhteellinen riski 1,24). Tämä riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisesta. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, yhdistelmäehkäisytabletteja käyttävillä tai hiljattain niitä käyttäneillä todettu rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyöpäriskiin koko elinaikana. Tutkimukset eivät anna näyttöä syy-seuraussuhteesta.
Havaittu riskin suureneminen voi johtua rintasyövän varhaisemmasta diagnoosista yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista. Lisäksi ehkäisytablettien käyttäjiltä diagnosoidut rintasyöpätapaukset ovat yleensä kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömiltä diagnosoidut tapaukset.
Harvinaisissa tapauksissa yhdistelmäehkäisytablettien käyttäjillä on todettu hyvänlaatuisia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Yksittäistapauksissa nämä kasvaimet ovat johtaneet hengenvaarallisiin sisäisiin vatsaonteloverenvuotoihin. Erotusdiagnostisesti maksakasvaimen mahdollisuutta on harkittava, kun yhdistelmäehkäisytablettien käyttäjällä on vaikeaa ylävatsakipua, suurentunut maksa tai merkkejä vatsaontelonsisäisestä verenvuodosta.
Muut sairaudet
Naisilla, joilla on hypertriglyseridemia tai sitä esiintyy suvussa, saattaa olla suurentunut haimatulehduksen riski yhdistelmäehkäisytablettien käytön aikana.
Vähäistä verenpaineen kohoamista on raportoitu monilla yhdistelmäehkäisytablettien käyttäjillä. Kliinisesti merkitsevä verenpaineen kohoaminen on harvinaista, ja vain näissä harvinaisissa tapauksissa yhdistelmäehkäisytablettien käyttö on aiheellista lopettaa välittömästi. Yhdistelmäehkäisytablettien käyttö on keskeytettävä, jos niiden käytön aikana hypertensiopotilaan jatkuvasti koholla olevat verenpainearvot tai verenpaineen merkittävä nousu eivät reagoi riittävästi verenpainelääkitykseen. Tablettien käyttöä voidaan tarvittaessa jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio.
Seuraavia tiloja tai niiden pahenemista on raportoitu esiintyneen sekä raskauden että yhdistelmäehkäisytablettien käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole pitävää näyttöä: kolestaasiin liittyvä ikterus ja/tai kutina, sappikivet, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis ja otoskleroosiin liittyvä kuulon heikentyminen.
Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Yhdistelmäehkäisytablettien käytön keskeyttäminen voi olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksan toimintakoearvot ovat normalisoituneet. Yhdistelmäehkäisytablettien käyttö on lopetettava, jos aiemmin raskausaikana tai aiemman sukupuolihormonien käytön aikana ilmennyt kolestaasiin liittyvä ikterus ja/tai kutina uusiutuu.
Vaikka yhdistelmäehkäisytabletit voivat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon, pieniannoksisia yhdistelmäehkäisytabletteja (< 0,05 mg etinyyliestradiolia) käyttävien naisten diabeteshoidon muuttamistarpeesta ei ole näyttöä. Yhdistelmäehkäisytabletteja käyttäviä diabeetikkoja on kuitenkin seurattava tarkoin erityisesti tablettien käytön alkuvaiheessa.
Endogeenisen depression, epilepsian, Crohnin taudin ja haavaisen paksusuolitulehduksen pahenemista on raportoitu yhdistelmäehkäisytablettien käytön aikana.
Maksaläiskiä voi joskus esiintyä, erityisesti jos niitä on esiintynyt raskausaikana. Maksaläiskiin taipuvaisten käyttäjien on vältettävä altistumista auringolle ja ultraviolettisäteilylle yhdistelmäehkäisytablettien käytön aikana.
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Tämä lääkevalmiste sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Lääkärintarkastus
Ennen Levesia-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Levesia-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
Tehon heikkeneminen
Levesia-yhdistelmäehkäisytablettien teho voi heikentyä esimerkiksi unohdettaessa ottaa aktiivisia tabletteja (ks. kohta Annostus ja antotapa), ruoansulatuskanavan häiriöiden yhteydessä aktiivisen tablettivaiheen aikana (ks. kohta Annostus ja antotapa) tai muun samanaikaisen lääkityksen yhteydessä (ks. kohta Yhteisvaikutukset).
Syklikontrollin heikentyminen
Kaikki yhdistelmäehkäisytabletit voivat aiheuttaa epäsäännöllistä verenvuotoa emättimestä (tiputtelu- tai läpäisyvuotoa), etenkin ensimmäisten käyttökuukausien aikana. Siksi epäsäännöllistä vuotoa kannattaa alkaa tutkia vasta noin kolme kuukautiskiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat tai niitä ilmaantuu kiertojen oltua aiemmin säännölliset, ei-hormonaaliset syyt on otettava huomioon. Asianmukaiset diagnostiset toimenpiteet ovat perusteltuja maligniteetin tai raskauden poissulkemiseksi. Näihin voi sisältyä myös kaavinta.
Joillakin naisilla lumetablettijakson aikana ei välttämättä tule tyhjennysvuotoa. Jos yhdistelmäehkäisytabletteja on käytetty kohdassa Annostus ja antotapa annettujen ohjeiden mukaan, raskaus on epätodennäköinen. Jos tabletteja ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä tai jos jo kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisytablettien käytön jatkamista.
Yhteisvaikutukset
Huom. Mahdollisten yhteisvaikutusten varalta on tutustuttava samanaikaisesti käytettävien lääkkeiden valmisteyhteenvetoihin.
Muiden lääkevalmisteiden vaikutus Levesia-valmisteeseen
Yhteisvaikutuksia voi esiintyä käytettäessä mikrosomaalisia entsyymejä indusoivia lääkkeitä, mikä voi suurentaa sukupuolihormonien puhdistumaa ja aiheuttaa läpäisyvuotoa ja/tai ehkäisyn pettämisen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän kuluttua. Maksimaalinen entsyymi-induktio havaitaan yleensä muutaman viikon kuluttua. Lääkehoidon lopettamisen jälkeen entsyymi-induktio voi jatkua vielä noin 4 viikon ajan.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä yhdistelmäehkäisytablettien lisänä on käytettävä tilapäisesti estemenetelmää tai jotain muuta ehkäisymenetelmää. Estemenetelmää on käytettävä koko samanaikaisen lääkehoidon ajan ja vielä 28 päivän ajan sen loppumisen jälkeen. Jos lääkehoito kestää kauemmin kuin yhdistelmäehkäisytablettipakkauksen aktiiviset tabletit, lumetabletit on hävitettävä ja seuraava yhdistelmäehkäisytablettipakkaus on aloitettava heti.
Pitkäaikainen hoito
Käytettäessä pitkäaikaista lääkehoitoa, jossa vaikuttavina aineina on entsyymejä indusoivia aineita, suositellaan toisen luotettavan, ei-hormonaalisen ehkäisymenetelmän käyttöä.
Seuraavia yhteisvaikutuksia on ilmoitettu kirjallisuudessa.
Aineet, jotka lisäävät yhdistelmäehkäistytablettien puhdistumaa (entsyymi-induktion aiheuttama yhdistelmäehkäisytablettien tehon heikkeneminen), kuten:
Rifampisiinia, rifabutiinia, barbituraatteja, epilepsialääkkeitä (kuten barbeksaklonia, karbamatsepiinia, fenytoiinia, primidonia, okskarbatsepiinia, topiramaattia ja felbamaattia), griseofulviinia, modafiniilia ja joitakin proteaasinestäjiä (esim. ritonaviiria) sekä mäkikuismaa (Hypericum perforatum) sisältäviä rohdosvalmisteita ei pidä käyttää samanaikaisesti Levesia-valmisteen kanssa, sillä ne saattavat heikentää Levesia-valmisteen ehkäisytehoa. Läpäisyvuotoa ja vahinkoraskauksia on raportoitu. Entsyymejä indusoiva vaikutus saattaa säilyä jopa 2 viikkoa mäkikuisman käytön lopettamisen jälkeen.
Aineet, joilla on vaihteleva vaikutus yhdistelmäehkäisytablettien puhdistumaan:
Monet HIV/HCV-proteaasinestäjien (esim. indinaviiri) ja ei-nukleosidirakenteisten käänteiskopioijaentsyymien estäjien yhdistelmät voivat suurentaa tai pienentää estrogeenin tai progestiinien pitoisuutta plasmassa, kun yhdistelmäehkäisytabletteja käytetään samanaikaisesti. Näiden muutosten nettovaikutus voi joissain tapauksissa olla kliinisesti merkittävä.
Tästä syystä on perehdyttävä samanaikaisen HIV/HCV-lääkityksen valmisteyhteenvetoon mahdollisten yhteisvaikutusten ja mahdollisten niihin liittyvien suositusten osalta. Epävarmoissa tapauksissa proteaasinestäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää käyttävän naisen on käytettävä lisäksi jotakin estemenetelmää.
Aineet, jotka vähentävät yhdistelmäehkäisytablettien puhdistumaa (entsyymi-inhibiittorit):
- vaikuttavat aineet, jotka estävät etinyyliestradiolin sulfaatiota ruoansulatuskanavan seinämässä, esim. askorbiinihappo tai parasetamoli
- atorvastatiini (suurentaa etinyyliestradiolin AUC-arvoa 20 %)
- vahvojen ja keskivahvojen CYP3A4:n estäjien, kuten imidatsolisienilääkkeiden (esim. itrakonatsoli, vorikonatsoli, flukonatsoli), verapamiilin, makrolidien (esim. klaritromysiini, erytromysiini, troleandomysiini), diltiatseemin ja greippimehun, samanaikainen käyttö voi suurentaa estrogeenin, progestiinin tai niiden molempien pitoisuutta plasmassa.
60–120 mg/vrk -etorikoksibiannosten on todettu suurentavan etinyyliestradiolin pitoisuutta 1,4–1,6-kertaiseksi plasmassa, kun etorikoksibia käytetään etinyyliestradiolia 0,035 mg sisältävien yhdistelmäehkäisyvalmisteiden kanssa.
Imeytymisen väheneminen
Ruoansulatuskanavan motiliteettia lisäävät lääkevalmisteet, esim. metoklopramidi, voivat vähentää hormonien imeytymistä.
Levesia-valmisteen vaikutus muihin lääkevalmisteisiin
Troleandomysiini voi suurentaa intrahepaattisen kolestaasin riskiä, jos sitä käytetään samanaikaisesti yhdistelmäehkäisytablettien kanssa.
Levonorgestreeli ja etinyyliestradioli voivat vaikuttaa tiettyjen muiden vaikuttavien aineiden metaboliaan:
- estämällä maksan mikrosomaalisten entsyymien toimintaa, mikä suurentaa tiettyjen vaikuttavien aineiden, kuten diatsepaamin (ja joidenkin muiden bentsodiatsepiinien), siklosporiinin, teofylliinin, melatoniinin, titsanidiinin ja glukokortikoidien pitoisuuksia seerumissa.
- indusoimalla maksassa tapahtuvaa glukuronidaatiota, mikä pienentää esim. klofibraatin, morfiinin, loratsepaamin (ja joidenkin muiden bentsodiatsepiinien) ja lamotrigiinin pitoisuuksia seerumissa.
In vitro etinyyliestradioli on CYP 2C19:n, CYP 1A1:n ja CYP 1A2:n reversiibeli estäjä sekä mekanismiin perustuvasti CYP 3A4/5:n, CYP 2C8:n ja CYP 2J2:n estäjä. Kliinisissä tutkimuksissa etinyyliestradiolia sisältävän hormonaalisen ehkäisyn käyttö ei suurentanut CYP 3A4:n substraattien (esim. midatsolaamin) pitoisuuksia plasmassa tai suurensi niitä vain vähän, kun taas CYP 1A2:n substraattien pitoisuudet plasmassa saattoivat suurentua hieman (esim. teofylliini) tai kohtalaisesti (esim. melatoniini, titsanidiini).
Glukoosinsietoon kohdistuvan vaikutuksen vuoksi insuliinin tai suun kautta otettavien diabeteslääkkeiden tarve voi muuttua.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet).
Tästä syystä Levesia-valmistetta käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Levesia käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
Laboratoriotutkimukset
Steroidiehkäisyn käyttö voi vaikuttaa eräiden laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisten ja munuaisten toimintakokeiden biokemiallisiin parametreihin, (kantaja)proteiinien (esim. kortikosteroideja sitovan globuliinin ja lipidi/lipoproteiinifraktioiden) pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin, ja seerumin foolihappopitoisuudet voivat pienentyä. Näiden muutosten luonne ja laajuus riippuvat osittain käytettyjen hormonien annostuksesta.
Raskaus ja imetys
Raskaus
Levesia on vasta-aiheinen raskauden aikana.
Jos nainen tulee raskaaksi Levesia-valmisteen käytön aikana, valmisteen käyttö on lopetettava välittömästi.
Tiedot pienestä määrästä raskauksia eivät viittaa siihen, että pelkällä levonorgestreelilla olisi haitallisia vaikutuksia sikiöön.
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Virtsateiden ja sukupuolielinten kehittymiseen kohdistuvien hormonaalisten haittavaikutusten riskiä ei voida täysin poissulkea. Siitä huolimatta useimmat tällä hetkellä saatavana olevat epidemiologiset tutkimukset, jotka ovat relevantteja sikiön tahattoman progestiini-/estrogeenialtistuksen suhteen, eivät ole paljastaneet teratogeenisia tai sikiötoksisia vaikutuksia.
Kun Levesia-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisytabletit saattavat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Pieniä määriä kontraseptiivisia steroideja ja/tai niiden metaboliitteja voi erittyä yhdistelmäehkäisytabletteja käytettäessä rintamaitoon. Rintaruokituilla lapsilla on raportoitu keltaisuuden ja rintojen turvotuksen kaltaisia haittavaikutuksia.
Mikäli mahdollista, imettävän äidin on käytettävä hormonitonta ehkäisyä imetyksen täydelliseen lopettamiseen saakka.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Levesia-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhdistelmäehkäisytablettien käyttöön on liittynyt seuraavien haittavaikutusten riskin suurenemista:
- valtimoiden ja laskimoiden tromboemboliset häiriöt (esim. laskimotukos, keuhkoembolia, aivoverisuonitapahtumat [iskeeminen ja hemorraginen aivohalvaus, ohimenevä aivoverenkiertohäiriö], sydäninfarkti)
- hyvänlaatuiset maksakasvaimet (esim. fokaalinen nodulaarinen hyperplasia, maksa-adenooma)
- kohdunkaulan intraepiteliaalinen neoplasia ja kohdunkaulan syöpä
- rintasyöpä.
Lisätiedot, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Yleisimpiä Levesia-valmisteen käyttöön liittyviä haittavaikutuksia (≥ 1/10) ovat päänsärky (mukaan lukien migreeni), tiputteluvuoto ja välivuodot.
Seuraavia haittavaikutuksia on ilmoitettu etinyyliestradiolin/levonorgestreelin käytön aikana:
Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000, < 1/100) | Harvinainen | Hyvin harvinainen (< 1/10 000)
|
Infektiot |
| emätintulehdus, mukaan lukien kandidiaasi |
|
| |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) |
|
| maksasolusyövät | ||
Immuunijärjestelmä |
|
|
| allergiset reaktiot, angioedeema*, vaikeat anafylaktiset/ anafylaktoidiset reaktiot, joihin liittyy hengitys- ja verenkierto-oireita |
|
Aineenvaihdunta ja ravitsemus |
|
| ruokahalun muutokset (lisääntyminen tai väheneminen), glukoosi-intoleranssi |
|
|
Psyykkiset häiriöt |
| mielialamuutokset, mukaan lukien masennus; seksuaalisen halukkuuden muutokset |
| ||
Hermosto | päänsärky (mukaan lukien migreeni) | hermostuneisuus, pyörrytys, huimaus |
|
| |
Silmät |
|
| huono piilolinssien sieto |
| |
Verisuonisto |
|
| Laskimotromboembolia (VTE), valtimotromboembolia (ATE) |
| |
Ruoansulatuselimistö |
| pahoinvointi, oksentelu, vatsakipu | vatsakrampit, ilmavaivat, ripuli |
| |
Maksa ja sappi |
|
| kolestaattinen ikterus |
| |
Iho ja ihonalainen kudos |
| akne | ihottuma, mahdollisesti pitkäkestoiset maksaläiskät (melasma), hirsutismi, alopesia, nokkosihottuma | erythema nodosum, erythema multiforme |
|
Sukupuolielimet ja rinnat |
| rintojen arkuus, rintojen kipu, rintojen eritevuoto, kuukautishäiriöt, kuukautisvuodon muutokset, kohdunkaulan muuntumisalueen ja kohdunkaulan eritteiden muutokset, amenorrea | rintojen turvotus |
|
|
Yleisoireet ja antopaikassa todettavat haitat |
| nesteen kertyminen elimistöön / turvotus |
|
|
|
Tutkimukset |
| painon muutokset (nousu tai lasku) | verenpaineen nousu, seerumin lipidipitoisuuksien muutokset, mukaan lukien hypertriglyseridemia | seerumin foolihappopitoisuuksien pieneneminen** |
|
* Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
** Yhdistelmäehkäisytablettien käyttö voi pienentää seerumin foolihappopitoisuuksia. Matalat seerumin folaattipitoisuudet voivat olla kliinisesti relevantteja, mikäli nainen tulee raskaaksi pian ehkäisytablettien käytön lopettamisen jälkeen.
Lisäksi yhdistelmäehkäisytabletteja käyttävillä naisilla on ilmoitettu seuraavia vakavia haittavaikutuksia, joita käsitellään kohdassa Varoitukset ja käyttöön liittyvät varotoimet:
- optinen neuriitti (voi johtaa osittaiseen tai täydelliseen näönmenetykseen), verkkokalvon laskimotukos
- suonikohjujen paheneminen
- haimatulehdus ja samanaikainen vaikea hypertriglyseridemia
- iskeeminen koliitti
- maksavaurio (esim. hepatiitti, maksan toimintahäiriö)
- sappirakkosairaus, mukaan lukien sappikivet (yhdistelmäehkäisytabletit voivat aiheuttaa sappirakkosairauden tai pahentaa olemassa olevaa sappirakkosairautta)
- hemolyyttis-ureeminen oireyhtymä
- herpes gestationis
- otoskleroosi
- systeemisen lupus erythematosuksen paheneminen
- porfyrian paheneminen
- Sydenhamin korean (chorea minor) paheneminen
- masennuksen paheneminen
- krooniset tulehdukselliset suolistosairaudet (Crohnin tauti ja haavainen paksusuolitulehdus).
Yhteisvaikutukset
Läpäisyvuotoa ja/tai ehkäisytehon pettämistä voi esiintyä muiden lääkkeiden (entsyymien indusoijien) ja ehkäisytablettien yhteisvaikutusten seurauksena (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen ei ole raportoitu aiheuttavan vakavia haittavaikutuksia. Yhdistelmäehkäisytableteista saadun yleisen kokemuksen perusteella mahdollisia yliannostusoireita ovat pahoinvointi, oksentelu ja nuorilla tytöillä vähäinen verenvuoto emättimestä. Antidoottia ei ole. Hoidon on oltava oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet, ATC-koodi: G03AA07
Yhdistelmäehkäisytablettien vaikutus perustuu useiden tekijöiden yhteisvaikutukseen. Näistä tekijöistä tärkeimmät ovat ovulaation estyminen ja kohdunkaulan limakalvon muuttuminen.
Kliinisiä tutkimuksia on toteutettu 1 477 naisella, jotka olivat 17–49-vuotiaita. Näistä tutkimuksista laskettu Pearlin kokonaisindeksi oli 13 vuosittaisen hoitojakson perusteella 0,84.
Farmakokinetiikka
Etinyyliestradioli
Imeytyminen
Suun kautta otettu etinyyliestradioli imeytyy nopeasti ja täydellisesti. Huippupitoisuus seerumissa, noin 50 pg/ml, saavutetaan etinyyliestradioli/levonorgestreelitabletin oton jälkeen 1–2 tunnissa. Imeytymisen ja maksan ensikierron aikana etinyyliestradioli metaboloituu voimakkaasti, minkä johdosta suun kautta otetun lääkkeen keskimääräinen biologinen hyötyosuus on noin 45 % (yksilöllinen vaihtelu noin 20–65 %).
Jakautuminen
Etinyyliestradioli sitoutuu voimakkaasti (noin 98 %:sti) mutta epäspesifisesti seerumin albumiiniin ja indusoi SHBG-pitoisuuden suurenemista seerumissa. Etinyyliestradiolin näennäinen jakautumistilavuus on 2,8–8,6 l/kg.
Biotransformaatio
Etinyyliestradiolin presysteeminen konjugaatio tapahtuu sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta. Reaktiossa muodostuu laajasti erilaisia hydroksyloituja ja metyloituja metaboliitteja, jotka esiintyvät seerumissa vapaina metaboliitteina tai konjugoituneina glukuronidien tai sulfaattien kanssa. Etinyyliestradioli käy läpi enterohepaattisen kierron.
Eliminaatio
Etinyyliestradiolin pitoisuus seerumissa pienenee kahdessa vaiheessa, joiden puoliintumisajat ovat noin 1 tunti ja 10–20 tuntia.
Etinyyliestradioli ei erity muuttumattomassa muodossa. Sen metaboliitit erittyvät virtsaan ja sappeen suhteessa 4:6. Puoliintumisaika on noin 1 vrk.
Vakaa tila
Etinyyliestradiolipitoisuus seerumissa suurenee noin kaksinkertaiseksi etinyyliestradioli/levonorgestreeli-tablettien jatkuvan käytön yhteydessä. Johtuen seerumin puhdistuman terminaalivaiheen vaihtelevasta puoliintumisajasta ja päivittäisestä annostelusta vakaa tila saavutetaan noin viikossa.
Levonorgestreeli
Imeytyminen
Suun kautta otettu levonorgestreeli imeytyy nopeasti ja täydellisesti. Huippupitoisuus seerumissa, noin 2,3 ng/ml, saavutetaan noin 1,3 tunnin kuluttua etinyyliestradioli/levonorgestreelitabletin ottamisesta. Biologinen hyötyosuus on lähes 100 %.
Jakautuminen
Levonorgestreeli sitoutuu seerumin albumiiniin ja sukupuolihormonia sitovaan globuliiniin (SHBG). Vain 1,1 % lääkkeen kokonaismäärästä seerumissa esiintyy vapaana steroidina, noin 65 % on spesifisesti sitoutuneena SHBG:hen ja noin 35 % epäspesifisesti sitoutuneena albumiiniin. Etinyyliestradiolin indusoima SHBG-pitoisuuden suureneminen vaikuttaa levonorgestreelin suhteelliseen jakautumiseen eri proteiinifraktioihin. Sitojaproteiinin induktion seurauksena SHBG:hen sitoutunut fraktio lisääntyy ja albumiiniin sitoutunut fraktio vähenee. Levonorgestreelin näennäinen jakautumistilavuus on 129 l kerta-annoksen jälkeen.
Biotransformaatio
Levonorgestreeli metaboloituu pääasiassa ∆4-3-oksoryhmän pelkistymisen ja positioissa 2α, 1β ja 16β tapahtuvan hydroksylaation ja sitä seuraavan konjugaation kautta. Suurin osa verenkierrossa olevista metaboliiteista on 3α, 5β-tetrahydrolevonorgestreelin sulfaatteja, ja lääkeaine eliminoituu pääasiassa glukuronideina.
Osa muuttumattomassa muodossa olevasta levonorgestreelista on verenkierrossa myös 17β-sulfaatteina. Monet yksilöiden väliset erot voivat vaikuttaa metaboliseen puhdistumaan, mikä saattaa osittain selittää, miksi levonorgestreelipitoisuuksissa todetaan suurta vaihtelua eri käyttäjien välillä.
Eliminaatio
Levonorgestreelin pitoisuus seerumissa pienenee kahdessa vaiheessa. Terminaalivaiheen puoliintumisaika on noin 25 tuntia. Levonorgestreeli ja sen metaboliitit erittyvät ensisijaisesti virtsaan (40–68‑prosenttisesti); noin 16–48 % erittyy ulosteeseen.
Vakaa tila
Etinyyliestradioli/levonorgestreelitablettien jatkuvan käytön yhteydessä levonorgestreelipitoisuus seerumissa suurenee noin kolminkertaiseksi ja vakaa tila saavutetaan hoitosyklin toisella puoliskolla. SHBG:n pitoisuus seerumissa, joka estradiolia käytettäessä suurenee 1,5–1,6-kertaiseksi, vaikuttaa levonorgestreelin farmakokinetiikkaan. Tämän seurauksena puhdistuma seerumista ja jakautumistilavuus ovat vakaassa tilassa hieman alhaisempia (0,7 ml/min/kg ja noin 100 l).
Prekliiniset tiedot turvallisuudesta
Etinyyliestradiolin ja levonorgestreelin toksisuusprofiili tunnetaan hyvin. Koska lajien väliset erot ovat huomattavan suuria, estrogeeneillä tehtyjen eläinkokeiden tuloksilla on vain rajallisesti ennustearvoa ihmisiin.
Eläinkokeissa etinyyliestradiolilla on todettu embryoletaalisia vaikutuksia jo suhteellisen pieninä annoksina. Virtsateiden ja sukupuolielinten epämuodostumia ja urospuolisten sikiöiden feminisaatiota on todettu. Levonorgestreelillä on todettu embryoletaalisia vaikutuksia eläinkokeissa ja suurina annoksina virilisoivia vaikutuksia naaraspuolisissa sikiöissä.
Rotilla, hiirillä ja kaniineilla tehdyistä lisääntymistoksisuustutkimuksista ei saatu näyttöä teratogeenisistä vaikutuksista.
Prekliinisissä tutkimuksissa (yleinen toksisuus, geenitoksisuus, karsinogeenisuus ja lisääntymistoksisuus) ei ole havaittu muita kuin etinyyliestradiolin ja levonorgestreelin hormoniprofiilin perusteella selittyviä vaikutuksia.
On kuitenkin muistettava, että sukupuolisteroidit voivat edistää tiettyjen hormoniriippuvaisten kudosten ja kasvainten kasvua.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvien riskien arviointitutkimuksissa on todettu, että levonorgestreelilla ja etinyyliestradiolilla on lisääntymiseen kohdistuvia vaikutuksia ja ne voivat aiheuttaa vaaraa vesiympäristössä (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Aktiiviset tabletit (vaaleanpunaiset tabletit)
Laktoosi
Povidoni K-30 (E1201)
Magnesiumstearaatti (E470b)
Vaaleanpunainen päällyste:
- Osittain hydrolysoitu polyvinyylialkoholi (E1203)
- Talkki (E553b)
- Titaanidioksidi (E171)
- Makrogoli 3350
- Alluranpunainen AC alumiinilakka (E129)
- Soijalesitiini (E322)
- Punainen rautaoksidi (E172)
- Indigokarmiinin alumiinilakka (E132)
Lumetabletit (valkoiset tabletit)
Laktoosi
Povidoni K-30 (E1201)
Magnesiumstearaatti (E470b)
Valkoinen päällyste:
- Osittain hydrolysoitu polyvinyylialkoholi (E1203)
- Titaanidioksidi (E171)
- Makrogoli 3350
- Talkki (E553b)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LEVESIA tabletti, kalvopäällysteinen
100/20 mikrog (L:kyllä) 3 x 28 fol (12,36 €)
PF-selosteen tieto
Valmiste on saatavilla 1 x 28 tabletin, 3 x 28 tabletin, 6 x 28 tabletin ja 13 x 28 tabletin rasioissa.
PVC-PVDC/Alu-läpipainopakkaukset ovat hieman läpinäkyviä.
Jokainen läpipainopakkaus sisältää 21 vaaleanpunaista, aktiivista tablettia ja 7 valkoista lumetablettia.
Ei kalenteriläpipainopakkauksia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Aktiiviset tabletit ovat vaaleanpunaisia ja pyöristettyjä, ja niiden halkaisija on noin 5,7 mm.
Lumetabletit ovat valkoisia ja pyöristettyjä, ja niiden halkaisija on noin 5,7 mm.
Käyttö- ja käsittelyohjeet
Levonorgestreeli ja etinyyliestradioli voivat aiheuttaa vaaraa ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta). Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
LEVESIA tabletti, kalvopäällysteinen
100/20 mikrog 3 x 28 fol
- Ei korvausta.
ATC-koodi
G03AA07
Valmisteyhteenvedon muuttamispäivämäärä
17.07.2023
Yhteystiedot
Strandvägen 7 A
114 56 Stockholm
Sweden
