KEYTRUDA infuusiokonsentraatti, liuosta varten 25 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Yleinen
Vaikuttavat aineet ja niiden määrät
Yksi 4 ml:n injektiopullo konsentraattia sisältää 100 mg pembrolitsumabia.
Yksi millilitra konsentraattia sisältää 25 mg pembrolitsumabia.
Pembrolitsumabi on humanisoitu monoklonaalinen PD‑1:n (programmed death‑1) vasta-aine (IgG4/kappa-isotyyppi, jossa on stabiloiva sekvenssin muutos Fc-osassa). Pembrolitsumabi on tuotettu yhdistelmä-DNA-tekniikalla kiinanhamsterin munasarjasoluissa (CHO-soluissa).
Apuaine, jonka vaikutus tunnetaan
Tämä lääkevalmiste sisältää 0,2 mg polysorbaatti 80:tä per millilitra konsentraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Melanooma
KEYTRUDA monoterapiana on tarkoitettu aikuisille ja vähintään 12‑vuotiaille nuorille edenneen (leikkaukseen soveltumattoman tai metastasoituneen) melanooman hoitoon.
KEYTRUDA monoterapiana on tarkoitettu levinneisyysasteen IIB, IIC tai III melanooman adjuvanttihoitoon aikuisille ja vähintään 12‑vuotiaille nuorille, joille on tehty täydellinen poistoleikkaus (ks. kohta Farmakodynamiikka).
Ei-pienisoluinen keuhkosyöpä
KEYTRUDA on tarkoitettu leikkaukseen soveltuvan ei-pienisoluisen keuhkosyövän hoitoon aikuisille, joilla on suuri taudin uusiutumisriski (ks. valintakriteerit kohdasta Farmakodynamiikka). KEYTRUDA annetaan tällöin ensin yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa neoadjuvanttihoitona, minkä jälkeen valmisteen käyttöä jatketaan adjuvanttihoidossa monoterapiana.
KEYTRUDA monoterapiana on tarkoitettu ei-pienisoluisen keuhkosyövän adjuvanttihoitoon aikuisille, joilla on suuri taudin uusiutumisriski kasvaimen täydellisen poiston ja platinapohjaisen solunsalpaajahoidon jälkeen (ks. valintakriteerit kohdasta Farmakodynamiikka).
KEYTRUDA monoterapiana on tarkoitettu metastasoituneen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille, joiden kasvaimet ilmentävät PD-L1-ligandia ja joiden TPS (tumour proportion score) on ≥ 50 % ja joiden kasvaimessa ei ole EGFR- tai ALK-positiivisia mutaatioita.
KEYTRUDA yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa on tarkoitettu metastasoituneen, ei-levyepiteeliperäisen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille, joiden kasvaimissa ei ole EGFR- tai ALK-positiivisia mutaatioita.
KEYTRUDA yhdistelmänä karboplatiinin ja joko paklitakselin tai nab-paklitakselin kanssa on tarkoitettu metastasoituneen, levyepiteeliperäisen ei-pienisoluisen keuhkosyövän ensilinjan hoitoon aikuisille.
KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen ei-pienisoluisen keuhkosyövän hoitoon aikuisille, joiden kasvaimet ilmentävät PD-L1-ligandia ja joiden TPS on ≥ 1 % ja jotka ovat saaneet aiemmin ainakin yhtä solunsalpaajahoitoa. KEYTRUDA-hoidon aloittamisen edellytyksenä on myös, että potilaat, joiden kasvaimessa on EGFR- tai ALK-positiivisia mutaatioita, ovat aiemmin saaneet täsmähoitoa.
Pahanlaatuinen keuhkopussin mesoteliooma
KEYTRUDA yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa on tarkoitettu leikkaukseen soveltumattoman ei-epitelioidisen pahanlaatuisen keuhkopussin mesoteliooman ensilinjan hoitoon aikuisille.
Klassinen Hodgkinin lymfooma
KEYTRUDA monoterapiana on tarkoitettu sellaisten aikuisten ja vähintään 3‑vuotiaiden pediatristen potilaiden hoitoon, joilla on relapsoitunut tai refraktorinen klassinen Hodgkinin lymfooma ja joilla autologinen kantasolujen siirto on epäonnistunut tai jotka ovat saaneet vähintään kahta aiempaa hoitoa ja joille autologista kantasolujen siirtoa ei voida tehdä.
Uroteelikarsinooma
KEYTRUDA yhdistelmänä enfortumabi-vedotiinin kanssa on tarkoitettu leikkaukseen soveltumattoman tai metastasoituneen uroteelikarsinooman ensilinjan hoitoon aikuisille.
KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoitoon aikuisille, jotka ovat aiemmin saaneet platinapohjaista solunsalpaajahoitoa (ks. kohta Farmakodynamiikka).
KEYTRUDA monoterapiana on tarkoitettu paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoitoon aikuisille, jotka eivät sovellu saamaan sisplatiinia sisältävää solunsalpaajahoitoa ja joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä (Combined Positive Score) on ≥ 10 (ks. kohta Farmakodynamiikka).
Pään ja kaulan alueen levyepiteelikarsinooma
KEYTRUDA monoterapiana on tarkoitettu leikkaukseen soveltuvan, paikallisesti edenneen pään ja kaulan alueen levyepiteelikarsinooman neoadjuvanttihoitoon, jota jatketaan adjuvanttihoitona yhdistelmänä sädehoidon sekä mahdollisen samanaikaisen sisplatiinihoidon kanssa ja tämän jälkeen monoterapiana, aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1.
KEYTRUDA monoterapiana tai yhdistelmänä platinaa ja 5‑fluorourasiilia (5‑FU) sisältävän solunsalpaajahoidon kanssa on tarkoitettu pään ja kaulan alueen metastasoituneen tai leikkaukseen soveltumattoman uusiutuneen levyepiteelikarsinooman ensilinjan hoitoon aikuisille, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1 (ks. kohta Farmakodynamiikka).
KEYTRUDA monoterapiana on tarkoitettu pään ja kaulan alueen uusiutuneen tai metastasoituneen levyepiteelikarsinooman hoitoon aikuisille, joilla kasvaimet ilmentävät PD‑L1-ligandia ja joiden TPS on ≥ 50 % ja joilla tauti on edennyt platinapohjaisen solunsalpaajahoidon aikana tai sen jälkeen (ks. kohta Farmakodynamiikka).
Munuaissolukarsinooma
KEYTRUDA yhdistelmänä aksitinibin kanssa on tarkoitettu edenneen munuaissolukarsinooman ensilinjan hoitoon aikuisille (ks. kohta Farmakodynamiikka).
KEYTRUDA yhdistelmänä lenvatinibin kanssa on tarkoitettu edenneen munuaissolukarsinooman ensilinjan hoitoon aikuisille (ks. kohta Farmakodynamiikka).
KEYTRUDA monoterapiana on tarkoitettu munuaissolukarsinooman adjuvanttihoitoon aikuisille nefrektomian jälkeen, kun uusiutumisriski on suurentunut, tai nefrektomian ja metastaattisten leesioiden poistoleikkauksen jälkeen (ks. valintakriteerit kohdasta Farmakodynamiikka).
Syövät, joihin liittyy mikrosatelliitti-instabiliteetti (MSI-H) tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi (dMMR)
Kolorektaalisyöpä
KEYTRUDA monoterapiana on tarkoitettu aikuisille sellaisen kolorektaalisyövän hoitoon, johon liittyy mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi, seuraavissa tilanteissa:
- metastasoituneen kolorektaalisyövän ensilinjan hoito
- leikkaukseen soveltumattoman tai metastasoituneen kolorektaalisyövän hoito, jota on aiemmin hoidettu fluoropyrimidiinipohjaisella yhdistelmähoidolla.
Muut kuin kolorektaalisyövät
KEYTRUDA monoterapiana on tarkoitettu aikuisille sellaisten seuraavien kasvaimien hoitoon, joihin liittyy mikrosatelliitti-instabiliteetti (MSI-H) tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi (dMMR):
- edennyt tai uusiutunut endometriumkarsinooma, kun tauti on edennyt aiemmin missä tahansa tilanteessa annetun platinapohjaisen hoidon aikana tai sen jälkeen eikä potilas sovellu saamaan parantavaa leikkaus- tai sädehoitoa
- leikkaukseen soveltumaton tai metastasoitunut maha-, ohutsuoli- tai sappitiesyöpä, kun tauti on edennyt vähintään yhden aiemman hoidon aikana tai sen jälkeen.
Ruokatorvisyöpä
KEYTRUDA yhdistelmänä platinaa ja fluoropyrimidiinia sisältävän solunsalpaajahoidon kanssa on tarkoitettu paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen ruokatorvisyövän ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10 (ks. kohta Farmakodynamiikka).
Kolmoisnegatiivinen rintasyöpä
KEYTRUDA on tarkoitettu paikallisesti edenneen tai varhaisvaiheen kolmoisnegatiivisen rintasyövän hoitoon aikuisille, kun taudin uusiutumisriski on suuri. KEYTRUDA annetaan ensin yhdistelmänä solunsalpaajahoidon kanssa neoadjuvanttihoitona, ja leikkauksen jälkeen valmisteen käyttöä jatketaan adjuvanttihoidossa monoterapiana (ks. kohta Farmakodynamiikka).
KEYTRUDA yhdistelmänä solunsalpaajahoidon kanssa on tarkoitettu paikallisesti uusiutuneen ja leikkaukseen soveltumattoman tai metastasoituneen kolmoisnegatiivisen rintasyövän hoitoon aikuisille, joilla kasvaimen PD‑L1‑ligandin ilmentymisen CPS-pistemäärä on ≥ 10 ja jotka eivät ole aiemmin saaneet solunsalpaajia metastasoituneen taudin hoitoon (ks. kohta Farmakodynamiikka).
Endometriumkarsinooma
KEYTRUDA yhdistelmänä karboplatiinin ja paklitakselin kanssa on tarkoitettu primaaristi edenneen tai uusiutuneen endometriumkarsinooman ensilinjan hoitoon aikuisille, jotka soveltuvat saamaan systeemistä hoitoa.
KEYTRUDA yhdistelmänä lenvatinibin kanssa on tarkoitettu edenneen tai uusiutuneen endometriumkarsinooman hoitoon aikuisille, joilla tauti on edennyt aiemmin missä tahansa tilanteessa annetun platinapohjaisen hoidon aikana tai sen jälkeen ja jotka eivät sovellu saamaan parantavaa leikkaus- tai sädehoitoa.
Kohdunkaulan syöpä
KEYTRUDA yhdistelmänä kemosädehoidon (ulkoinen sädehoito ja sen jälkeen brakyterapia) kanssa on tarkoitettu paikallisesti edenneen, FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA kohdunkaulan syövän hoitoon aikuisille, jotka eivät ole aiemmin saaneet definitiivistä hoitoa.
KEYTRUDA yhdistelmänä solunsalpaajahoidon (sekä mahdollisen bevasitsumabihoidon) kanssa on tarkoitettu persistoivan, uusiutuneen tai metastasoituneen kohdunkaulan syövän hoitoon aikuisille, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1.
Mahalaukun tai ruokatorvi-mahalaukkurajan adenokarsinooma
KEYTRUDA yhdistelmänä trastutsumabin, fluoropyrimidiinin ja platinapohjaisen solunsalpaajahoidon kanssa on tarkoitettu paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen mahalaukun tai ruokatorvi-mahalaukkurajan HER2-positiivisen adenokarsinooman ensilinjan hoitoon aikuisille, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1.
KEYTRUDA yhdistelmänä fluoropyrimidiinin ja platinapohjaisen solunsalpaajahoidon kanssa on tarkoitettu paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen mahalaukun tai ruokatorvi-mahalaukkurajan HER2-negatiivisen adenokarsinooman ensilinjan hoitoon aikuisille, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 1 (ks. kohta Farmakodynamiikka).
Sappitiesyöpä
KEYTRUDA yhdistelmänä gemsitabiinin ja sisplatiinin kanssa on tarkoitettu paikallisesti edenneen ja leikkaukseen soveltumattoman tai metastasoituneen sappitiesyövän ensilinjan hoitoon aikuisille.
Ehto
Hoito tulee aloittaa ja hoitoa tulee jatkaa syöpähoitoihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Syövän hoitoon perehtyneen erikoislääkärin on aloitettava hoito ja valvottava sen toteuttamista.
Potilaat, jotka saavat ihon alle annettavaa pembrolitsumabi-injektionestettä, voivat siirtyä seuraavalla suunnitellulla annoskerralla laskimoon annettavaan pembrolitsumabihoitoon. Potilaat, jotka saavat laskimoon annettavaa pembrolitsumabihoitoa, voivat siirtyä seuraavalla suunnitellulla annoskerralla ihon alle annettavaan pembrolitsumabi-injektionesteeseen.
PD-L1-määritys
Jos kyseisessä käyttöaiheessa näin mainitaan, potilaat valitaan saamaan KEYTRUDA-valmistetta sen perusteella, todetaanko heillä validoidulla testillä varmistettu PD-L1-ligandin ilmentyminen (ks. kohdat Käyttöaiheet, Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka).
MSI/MMR-määritys
Jos kyseisessä käyttöaiheessa näin mainitaan, potilaat valitaan saamaan KEYTRUDA-valmistetta sen perusteella, todetaanko heillä validoidulla testillä varmistettu mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi (ks. kohdat Käyttöaiheet ja Farmakodynamiikka).
Annostus
Suositeltu KEYTRUDA-annos aikuisilla on joko 200 mg kolmen viikon välein tai 400 mg kuuden viikon välein annettuna 30 minuutin infuusiona laskimoon.
Suositeltu KEYTRUDA-annos monoterapiana vähintään 3-vuotiailla, klassista Hodgkinin lymfoomaa sairastavilla pediatrisilla potilailla tai vähintään 12-vuotiailla, melanoomaa sairastavilla potilailla on 2 mg/kg (enintään 200 mg) kolmen viikon välein annettuna 30 minuutin infuusiona laskimoon.
Kun käytetään yhdistelmähoitoa, on tutustuttava samanaikaisesti annettavien lääkkeiden valmisteyhteenvetoihin.
KEYTRUDA-hoitoa jatketaan taudin etenemiseen saakka tai kunnes ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä (ja enintään hoidon enimmäiskeston ajan, jos se on mainittu kyseisen käyttöaiheen kohdalla). Epätyypillisiä vasteita on havaittu (kasvaimen ohimenevää kasvua alkuvaiheessa tai pieniä uusia leesioita ensimmäisten kuukausien aikana, minkä jälkeen kasvain alkaa pienentyä). Jos potilaan kliininen tila on vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaitaan, suositellaan hoidon jatkamista, kunnes taudin eteneminen on varmistunut.
Melanooman, ei-pienisoluisen keuhkosyövän tai munuaissolukarsinooman adjuvanttihoidossa KEYTRUDA-valmistetta annetaan sairauden uusiutumiseen asti tai kunnes ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä, tai enintään vuoden ajan.
Leikkaukseen soveltuvan ei-pienisoluisen keuhkosyövän hoidossa neoadjuvantti- ja adjuvanttihoito toteutetaan seuraavasti: potilaat saavat yhdistelmänä solunsalpaajahoidon kanssa KEYTRUDA-neoadjuvanttihoitoa neljä 200 mg:n annosta kolmen viikon välein tai kaksi 400 mg:n annosta kuuden viikon välein tai kunnes taudin eteneminen sulkee pois parantavan leikkaushoidon tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Tämän jälkeen annetaan adjuvanttihoitona KEYTRUDA-monoterapiaa kolmetoista 200 mg:n annosta kolmen viikon välein tai seitsemän 400 mg:n annosta kuuden viikon välein tai kunnes tauti uusiutuu tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Potilaille, joilla taudin eteneminen sulkee pois parantavan leikkaushoidon tai joilla yhdistelmänä solunsalpaajahoidon kanssa annettuun KEYTRUDA-neoadjuvanttihoitoon liittyy toksisia vaikutuksia, joita ei voida hyväksyä, ei pidä antaa adjuvanttihoitona KEYTRUDA-monoterapiaa.
Leikkaukseen soveltuvan, paikallisesti edenneen pään ja kaulan alueen levyepiteelikarsinooman neoadjuvantti- ja adjuvanttihoito toteutetaan seuraavasti: potilaat saavat monoterapiana KEYTRUDA-neoadjuvanttihoitoa kaksi 200 mg:n annosta kolmen viikon välein tai yhden 400 mg:n annoksen tai kunnes taudin eteneminen sulkee pois parantavan leikkaushoidon tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Tämän jälkeen annetaan adjuvanttihoitona KEYTRUDA-valmistetta yhdistelmänä sädehoidon sekä mahdollisen samanaikaisen sisplatiinihoidon kanssa kolme 200 mg:n annosta kolmen viikon välein tai kaksi 400 mg:n annosta kuuden viikon välein ja tämän jälkeen KEYTRUDA-valmistetta monoterapiana kaksitoista 200 mg:n annosta kolmen viikon välein tai kuusi 400 mg:n annosta kuuden viikon välein tai kunnes tauti uusiutuu tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Potilaille, joilla taudin eteneminen sulkee pois parantavan leikkaushoidon tai joilla neoadjuvanttihoitona annettuun KEYTRUDA-monoterapiaan liittyy toksisia vaikutuksia, joita ei voida hyväksyä, ei pidä antaa adjuvanttihoitona KEYTRUDA-valmistetta yhdistelmänä sädehoidon sekä mahdollisen samanaikaisen sisplatiinihoidon kanssa.
Kolmoisnegatiivisen rintasyövän neoadjuvantti- ja adjuvanttihoito toteutetaan seuraavasti: potilaat saavat yhdistelmänä solunsalpaajahoidon kanssa KEYTRUDA-neoadjuvanttihoitoa kahdeksan 200 mg:n annosta kolmen viikon välein tai neljä 400 mg:n annosta kuuden viikon välein tai kunnes taudin eteneminen sulkee pois parantavan leikkaushoidon tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Tämän jälkeen annetaan adjuvanttihoitona KEYTRUDA-monoterapiaa yhdeksän 200 mg:n annosta kolmen viikon välein tai viisi 400 mg:n annosta kuuden viikon välein tai kunnes tauti uusiutuu tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä. Potilaille, joilla taudin eteneminen sulkee pois parantavan leikkaushoidon tai joilla yhdistelmänä solunsalpaajahoidon kanssa annettuun KEYTRUDA-neoadjuvanttihoitoon liittyy toksisia vaikutuksia, joita ei voida hyväksyä, ei pidä antaa adjuvanttihoitona KEYTRUDA-monoterapiaa.
Hoidettaessa paikallisesti edennyttä kohdunkaulan syöpää potilaat saavat KEYTRUDA-valmistetta samanaikaisesti kemosädehoidon kanssa ja sen jälkeen KEYTRUDA-monoterapiaa. KEYTRUDA-valmistetta voidaan antaa joko 200 mg kolmen viikon välein tai 400 mg kuuden viikon välein, kunnes tauti etenee tai ilmaantuu toksisia vaikutuksia, joita ei voida hyväksyä, tai enintään 24 kuukauden ajan.
Annostuksen lykkääminen tai lopettaminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet)
KEYTRUDA-annoksen pienentämistä ei suositella. Haittavaikutusten hallitsemiseksi KEYTRUDA-hoidosta on pidättäydyttävä tai käyttö lopetettava pysyvästi, kuten taulukossa 1 on kuvattu.
Taulukko 1: KEYTRUDA-hoidon muuttamista koskevat suositukset
| Immuunivälitteiset haittavaikutukset | Vaikeusaste | Hoidon muutos |
| Pneumoniitti | 2. aste | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| 3. tai 4. aste tai uusiutunut 2. aste | Pysyvä lopettaminen | |
| Paksusuolitulehdus | 2. tai 3. aste | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| 4. aste tai uusiutunut 3. aste | Pysyvä lopettaminen | |
| Munuaistulehdus | 2. aste, kreatiniiniarvo > 1,5 - ≤ 3 kertaa normaalin yläraja (ULN) | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| Vaikeusaste ≥ 3, kreatiniiniarvo > 3 kertaa ULN | Pysyvä lopettaminen | |
| Umpierityssairaudet | 2. asteen lisämunuaisten vajaatoiminta ja hypofysiitti | Hoidosta pidättäytyminen, kunnes nämä ovat hallinnassa hormonikorvaushoidolla. |
3. tai 4. asteen lisämunuaisten vajaatoiminta tai oireinen hypofysiitti Tyypin 1 diabetes, johon liittyy vaikeusasteen ≥ 3 hyperglykemia (glukoosiarvo > 250 mg/dl tai > 13,9 mmol/l) tai ketoasidoosi Vaikeusasteen ≥ 3 hypertyreoosi | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* Jos potilaalla on 3. tai 4. asteen umpierityssairauksia, jotka ovat lievittyneet vaikeusasteelle 2 tai enemmän ja pysyvät hallinnassa hormonikorvaushoidolla (kliinisen tarpeen mukaan), voidaan tarvittaessa harkita pembrolitsumabihoidon jatkamista, kortikosteroidin asteittaisen vähentämisen jälkeen. Muutoin hoito on lopetettava. | |
| Hypotyreoosi | Hypotyreoosia voidaan hoitaa korvaushoidolla ilman hoidon keskeyttämistä. | |
Maksatulehdus HUOM.: Ks. tämän taulukon jälkeen esitetyt annostusohjeet pembrolitsumabia yhdistelmänä aksitinibin kanssa saaville munuaissolukarsinoomaa sairastaville potilaille, joiden maksaentsyymiarvot ovat kohonneet. | 2. aste, aspartaattiaminotransferaasi (ASAT) tai alaniiniaminotransferaasi (ALAT) > 3−5 kertaa normaalialueen yläraja (ULN) tai kokonaisbilirubiini > 1,5−3 kertaa ULN | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| Vaikeusaste ≥ 3, ASAT tai ALAT > 5 kertaa ULN tai kokonaisbilirubiini > 3 kertaa ULN | Pysyvä lopettaminen | |
| Maksametastaasitapaukset, joihin liittyy hoidon alussa vaikeusasteen 2 koholla oleva ASAT- tai ALAT-arvo, maksatulehdus, jossa ASAT- tai ALAT-arvo nousee ≥ 50 % lähtöarvosta ja nousu kestää ≥ 1 viikon | Pysyvä lopettaminen | |
| Ihoreaktiot | 3. aste tai epäilty Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| 4. aste tai varmistettu Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi | Pysyvä lopettaminen | |
| Muut immuunivälitteiset haittavaikutukset | Haittavaikutuksen vaikeusasteen ja tyypin mukaan (2. aste tai 3. aste) | Hoidosta pidättäytyminen, kunnes haittavaikutukset ovat lievittyneet asteeseen 0–1* |
| 3. tai 4. asteen sydänlihastulehdus 3. tai 4. asteen enkefaliitti 3. tai 4. asteen Guillain–Barrén oireyhtymä | Pysyvä lopettaminen | |
| 4. aste tai uusiutunut 3. aste | Pysyvä lopettaminen | |
| Infuusioon liittyvät reaktiot | 3. tai 4. aste | Pysyvä lopettaminen |
Huom.: Haittavaikutusten vaikeusasteluokat ovat NCI-CTCAE v.4 -kriteerien (National Cancer Institute Common Terminology Criteria for Adverse Events Version 4.0) mukaiset * Elleivät hoitoon liittyvät toksiset vaikutukset lievity vaikeusasteen 0–1 tasolle 12 viikon kuluessa viimeksi annetusta KEYTRUDA-annoksesta tai ellei kortikosteroidiannosta voida pienentää korkeintaan 10 mg:aan prednisonia vuorokaudessa tai vastaavalle tasolle 12 viikon kuluessa, KEYTRUDA-hoito on lopetettava pysyvästi. | ||
Pembrolitsumabihoidon uudelleen aloittamisen turvallisuudesta potilailla, joilla on aiemmin ollut immuunivälitteinen sydänlihastulehdus, ei ole tietoa.
KEYTRUDA-hoito, sekä monoterapiana että yhdistelmähoitona, on lopetettava pysyvästi, jos ilmaantuu 4. asteen tai uusiutuneita 3. asteen immuunivälitteisiä haittavaikutuksia, ellei taulukossa 1 ole toisin ilmoitettu.
Jos ilmaantuu 4. asteen hematologista toksisuutta, KEYTRUDA-hoito on keskeytettävä, kunnes haittavaikutukset ovat lievittyneet vaikeusasteluokkaan 0–1. Tämä koskee ainoastaan klassista Hodgkinin lymfoomaa sairastavia potilaita.
KEYTRUDA yhdistelmänä aksitinibin kanssa munuaissolukarsinooman hoidossa
Katso valmisteyhteenvedosta tiedot aksitinibin annostuksesta munuaissolukarsinoomaa sairastaville potilaille, jotka saavat KEYTRUDA-valmistetta yhdistelmänä aksitinibin kanssa. Kun aksitinibia käytetään yhdistelmänä pembrolitsumabin kanssa, aksitinibiannoksen suurentamista 5 mg:n aloitusannoksesta voidaan harkita, kun edellisestä muutoksesta on kulunut vähintään kuusi viikkoa (ks. kohta Farmakodynamiikka).
Maksaentsyymiarvojen kohoaminen munuaissolukarsinoomaa sairastavilla potilailla, jotka saavat KEYTRUDA-valmistetta yhdistelmänä aksitinibin kanssa:
- Jos ALAT tai ASAT on ≥ 3 kertaa ULN mutta < 10 kertaa ULN ilman, että kokonaisbilirubiini on samanaikaisesti ≥ 2 kertaa ULN, sekä KEYTRUDA- että aksitinibihoito on keskeytettävä, kunnes haittavaikutukset ovat lievittyneet vaikeusasteeseen 0–1. Kortikosteroidihoitoa voidaan harkita. Hoidon aloittamista uudelleen yhdellä lääkkeellä tai peräkkäin molemmilla lääkkeillä voidaan harkita haittavaikutusten lievityttyä. Jos hoito aloitetaan uudelleen aksitinibilla, voidaan harkita annoksen pienentämistä aksitinibin valmisteyhteenvedon mukaisesti.
- Jos ALAT tai ASAT on ≥ 10 kertaa ULN tai > 3 kertaa ULN siten, että kokonaisbilirubiini on samanaikaisesti ≥ 2 kertaa ULN, sekä KEYTRUDA- että aksitinibihoito on lopetettava pysyvästi ja kortikosteroidihoitoa voidaan harkita.
KEYTRUDA yhdistelmänä lenvatinibin kanssa
Kun KEYTRUDA-valmistetta käytetään yhdistelmänä lenvatinibin kanssa, toisen lääkkeen tai molempien lääkkeiden käyttö on keskeytettävä tarpeen mukaan. Lenvatinibihoidosta on pidättäydyttävä, sen annosta on pienennettävä tai hoito on lopetettava lenvatinibin valmisteyhteenvedon ohjeiden mukaisesti, kun sitä käytetään pembrolitsumabin kanssa yhdistelmänä. KEYTRUDA-annoksen pienentämistä ei suositella.
KEYTRUDA-valmisteella hoidetuille potilaille on annettava potilaskortti ja heille on kerrottava KEYTRUDA-hoitoon liittyvistä riskeistä (ks. myös pakkausseloste).
Erityisryhmät
Iäkkäät potilaat
Annoksen muuttaminen ei ole tarpeen ≥ 65-vuotiaille potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Munuaisten vajaatoiminta
Annoksen sovittaminen ei ole tarpeen lievässä tai kohtalaisessa munuaisten vajaatoiminnassa. KEYTRUDA-valmistetta ei ole tutkittu vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen sovittaminen ei ole tarpeen lievässä tai kohtalaisessa maksan vajaatoiminnassa. KEYTRUDA-valmistetta ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
KEYTRUDA-valmisteen turvallisuutta ja tehoa alle 18-vuotiaiden lasten hoidossa ei ole varmistettu, lukuun ottamatta pediatrisia potilaita, joilla on melanooma tai klassinen Hodgkinin lymfooma. Tällä hetkellä saatavilla olevat tiedot on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka.
Antotapa
Lääkitysvirheiden riskin vähentämiseksi on tärkeää varmistaa injektiopullon etiketistä, että potilaalle valmistellaan ja annetaan lääkemääräyksen mukaista oikeaa lääkemuotoa (laskimoon tai ihon alle).
KEYTRUDA infuusiokonsentraatti, liuosta varten on tarkoitettu annettavaksi vain laskimoon.KEYTRUDA infuusiokonsentraatti, liuosta varten, ei ole tarkoitettu annettavaksi ihon alle. KEYTRUDA infuusiokonsentraatti, liuosta varten annetaan 30 minuutin infuusiona. Laskimoon annettavaa KEYTRUDA-valmistetta ei saa antaa nopeana infuusiona eikä boluksena laskimoon.
Laskimoon annettavaa KEYTRUDA-lääkemuotoa (infuusiokonsentraatti, liuosta varten) ei saa korvata ihon alle annettavalla pembrolitsumabi-injektionesteellä eikä vaihtaa siihen, koska niiden suositellut annokset ja antoreitit ovat erilaiset.
Kun KEYTRUDA annetaan osana yhdistelmähoitoa laskimoon annettavan solunsalpaajahoidon kanssa, KEYTRUDA on annettava ensin.
Kun KEYTRUDA annetaan osana yhdistelmähoitoa enfortumabi-vedotiinin kanssa, KEYTRUDA on annettava enfortumabi-vedotiinin jälkeen, jos ne annetaan samana päivänä.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
PD-L1-statuksen arviointi
Kasvaimen PD-L1-statuksen määritykseen on tärkeää valita hyvin validoitu ja luotettava menetelmä, jotta vääriä negatiivisia tai vääriä positiivisia tuloksia saadaan mahdollisimman vähän.
Immuunivälitteiset haittavaikutukset
Pembrolitsumabia saaneilla potilailla on ilmennyt immuunivälitteisiä haittavaikutuksia, myös vaikeita ja kuolemaan johtaneita tapauksia. Useimmat pembrolitsumabihoidon aikana ilmenevät immuunivälitteiset haittavaikutukset olivat korjautuvia, ja niitä hoidettiin keskeyttämällä pembrolitsumabihoito sekä antamalla kortikosteroideja ja/tai tukihoitoa. Immuunivälitteisiä haittavaikutuksia on ilmennyt myös pembrolitsumabin viimeisen annoksen jälkeen. Useampaan kuin yhteen elinjärjestelmään vaikuttavia immuunivälitteisiä haittavaikutuksia voi ilmetä samanaikaisesti.
Epäillyt immuunivälitteiset haittavaikutukset on tutkittava asianmukaisesti etiologian varmistamiseksi tai muiden syiden poissulkemiseksi. Haittavaikutuksen vaikeusasteen mukaan pembrolitsumabihoidosta pidättäydytään toistaiseksi ja annetaan kortikosteroideja. Kun oireet ovat lievittyneet vaikeusasteelle, joka on enintään 1, aloitetaan kortikosteroidin asteittainen vähentäminen, jota jatketaan vähintään 1 kuukauden ajan. Niiden rajallisten tietojen perusteella, joita on saatu kliinisistä tutkimuksista potilailla, joiden immuunivälitteisiä haittavaikutuksia ei saatu hallintaan käyttämällä kortikosteroideja, muiden systeemisten immunosuppressiivisten lääkeaineiden antamista voidaan harkita.
Pembrolitsumabihoito voidaan aloittaa uudelleen 12 viikon kuluessa viimeksi annetusta KEYTRUDA-annoksesta, jos haittavaikutus lievittyy vaikeusasteelle, joka on enintään 1 ja kortikosteroidiannos on pienennetty korkeintaan 10 mg:aan prednisonia vuorokaudessa tai vastaavalle tasolle.
Pembrolitsumabihoito täytyy lopettaa pysyvästi, jos mikä tahansa vaikeusasteen 3 immuunivälitteinen haittavaikutus ilmaantuu uudelleen tai jos ilmaantuu mikä tahansa vaikeusasteen 4 immuunivälitteinen toksinen haittavaikutus, lukuun ottamatta umpierityssairauksia, joita hoidetaan hormonikorvaushoidoilla (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Havainnoivista tutkimuksista saadut tiedot viittaavat siihen, että immuunivälitteisten haittavaikutusten ilmenemisen riski tarkistuspisteen estäjien saamisen jälkeen saattaa olla suurentunut potilailla, joilla on ennestään jokin autoimmuunisairaus, verrattuna potilaisiin, joilla ei ole ennestään autoimmuunisairautta. Lisäksi taustalla olevan autoimmuunisairauden tilapäinen paheneminen oli yleistä, mutta suurimmassa osassa tapauksista paheneminen oli lievää ja hallittavissa olevaa.
Immuunivälitteinen pneumoniitti
Pembrolitsumabihoitoa saavilla potilailla on raportoitu pneumoniittia (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava mahdollisten pneumoniittiin viittaavien oireiden ja löydösten varalta. Pneumoniittiepäily on varmistettava kuvantamistutkimuksella ja muut syyt on suljettava pois. Kortikosteroidihoitoa on annettava vaikeusasteen ≥ 2 tapahtumissa (prednisonia tai vastaavaa 1–2 mg/kg/vrk aloitusannoksena, ja annosta pienennetään asteittain); pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi, jos pneumoniitin vaikeusaste on 2, ja pembrolitsumabihoito on lopetettava pysyvästi, jos pneumoniitin vaikeusaste on 3 tai 4 tai kyseessä on uusiutunut vaikeusasteen 2 pneumoniitti (ks. kohta Annostus ja antotapa).
Immuunivälitteinen paksusuolitulehdus
Pembrolitsumabihoitoa saavilla potilailla on raportoitu paksusuolitulehdusta (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava mahdollisten paksusuolitulehdukseen viittaavien oireiden ja löydösten varalta ja muut syyt on suljettava pois. Kortikosteroidihoitoa on annettava vaikeusasteen ≥ 2 tapahtumissa (prednisonia tai vastaavaa 1–2 mg/kg/vrk aloitusannoksena, ja annosta pienennetään asteittain); pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi, jos paksusuolitulehduksen vaikeusaste on 2 tai 3, ja pembrolitsumabihoito on lopetettava pysyvästi, jos paksusuolitulehduksen vaikeusaste on 4 tai sen uusiutuessa 3 (ks. kohta Annostus ja antotapa). Mahdollinen maha-suolikanavan puhkeaman riski on otettava huomioon.
Immuunivälitteinen maksatulehdus
Pembrolitsumabihoitoa saavilla potilailla on raportoitu maksatulehdusta (ks. kohta Haittavaikutukset). Potilaiden maksan toiminnan muutoksia on seurattava (hoidon alkaessa, säännöllisesti hoidon aikana ja kliiniseen arvioon perustuvan tarpeen mukaan), ja mahdollisia maksatulehduksen oireita on tarkkailtava ja muut syyt on suljettava pois. Kortikosteroidihoitoa on annettava (prednisonia tai vastaavaa 0,5–1 mg/kg/vrk [vaikeusasteen 2 tapahtumissa] ja 1–2 mg/kg/vrk [vaikeusasteen ≥ 3 tapahtumissa] aloitusannoksena, ja annosta pienennetään asteittain), ja pembrolitsumabi hoidosta on pidättäydyttävä toistaiseksi tai se on lopetettava pysyvästi sen mukaan, kuinka voimakkaasti maksaentsyymiarvot ovat kohonneet (ks. kohta Annostus ja antotapa).
Immuunivälitteinen munuaistulehdus
Pembrolitsumabihoitoa saavilla potilailla on raportoitu munuaistulehdusta (ks. kohta Haittavaikutukset). Potilaiden munuaistoiminnan muutoksia on tarkkailtava ja munuaisten toimintahäiriön muut syyt on suljettava pois. Kortikosteroidihoitoa on annettava vaikeusasteen ≥ 2 tapahtumissa (prednisonia tai vastaavaa 1–2 mg/kg/vrk aloitusannoksena, ja annosta pienennetään asteittain), ja sen mukaan, kuinka voimakkaasti kreatiniiniarvot ovat kohonneet, pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi, jos munuaistulehduksen vaikeusaste on 2 ja pembrolitsumabihoito on lopetettava pysyvästi, jos munuaistulehduksen vaikeusaste on 3 tai 4 (ks. kohta Annostus ja antotapa).
Immuunivälitteiset umpierityssairaudet
Pembrolitsumabihoidon yhteydessä on todettu vaikeita umpierityssairauksia, kuten lisämunuaisten vajaatoimintaa, hypofysiittiä, tyypin 1 diabetesta, diabeettista ketoasidoosia, hypotyreoosia ja hypertyreoosia.
Kun kyseessä ovat immuunivälitteiset umpierityssairaudet, pitkäaikainen hormonikorvaushoito saattaa olla tarpeellinen.
Pembrolitsumabihoitoa saavilla potilailla on raportoitu lisämunuaisten vajaatoimintaa (primaarista ja sekundaarista). Pembrolitsumabihoitoa saavilla potilailla on raportoitu myös hypofysiittiä (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava lisämunuaisten vajaatoimintaan ja hypofysiittiin viittaavien mahdollisten oireiden ja löydösten varalta (aivolisäkkeen etulohkon vajaatoiminta mukaan lukien) ja muut syyt on suljettava pois. Kortikosteroidihoitoa on annettava lisämunuaisten vajaatoimintaan ja muuta hormonikorvaushoitoa on annettava kliinisen tarpeen mukaan. Pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi, jos potilaalla on vaikeusasteen 2 lisämunuaisten vajaatoiminta tai hypofysiitti, kunnes se on saatu hallintaan hormonikorvaushoidolla. Pembrolitsumabihoidosta on pidättäydyttävä tai hoito on lopetettava pysyvästi, jos potilaalla on vaikeusasteen 3 tai 4 lisämunuaisen vajaatoiminta tai oireinen hypofysiitti. Pembrolitsumabihoidon jatkamista voidaan tarpeen mukaan harkita, kun kortikosteroidihoito on asteittain lopetettu (ks. kohta Annostus ja antotapa). Aivolisäkkeen toimintaa ja hormonien pitoisuuksia on seurattava asianmukaisen hormonikorvaushoidon varmistamiseksi.
Pembrolitsumabihoitoa saavilla potilailla on raportoitu tyypin 1 diabetesta, myös diabeettista ketoasidoosia (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava verensokeriarvon nousun tai muiden diabetekseen viittaavien oireiden ja löydösten varalta. Insuliinihoitoa on annettava tyypin 1 diabetekseen, ja jos tyypin 1 diabetekseen liittyy hyperglykemia, jonka vaikeusaste on ≥ 3 tai ketoasidoosi, pembrolitsumabihoidosta on pidättäydyttävä, kunnes aineenvaihdunta on saatu tasapainoon (ks. kohta Annostus ja antotapa).
Pembrolitsumabihoitoa saavilla potilailla on raportoitu kilpirauhasen toimintahäiriöitä, kuten hypotyreoosia, hypertyreoosia ja tyreoidiittia, ja niitä voi esiintyä milloin tahansa hoidon aikana. Hypotyreoosia on ilmoitettu useammin pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla, jotka ovat aiemmin saaneet sädehoitoa. Potilaiden kilpirauhasen toiminnan muutoksia on seurattava (hoidon alkaessa, säännöllisesti hoidon aikana ja kliiniseen arvioon perustuvan tarpeen mukaan), ja potilaita on tarkkailtava mahdollisten kilpirauhasen toimintahäiriön kliinisten oireiden ja löydösten varalta. Hypotyreoosiin voidaan antaa hormonikorvaushoitoa pembrolitsumabia keskeyttämättä ja ilman kortikosteroideja. Hypertyreoosia voidaan hoitaa oireidenmukaisesti. Pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi, jos hypertyreoosin vaikeusaste on ≥ 3, kunnes hypertyreoosi on lievittynyt vaikeusasteeseen ≤ 1. Kilpirauhasen toimintaa ja hormonien pitoisuuksia on seurattava asianmukaisen hormonikorvaushoidon varmistamiseksi.
Potilaille, joilla on ollut vaikeusasteen 3 tai 4 umpierityssairauksia, jotka ovat lievittyneet korkeintaan vaikeusasteen 2 tasolle ja ovat hallinnassa hormonikorvaushoidolla (kliinisen tarpeen mukaan), voidaan tarpeen mukaan harkita pembrolitsumabihoidon jatkamista kortikosteroidihoidon asteittaisen vähentämisen jälkeen. Muuten hoito on lopetettava (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Immuunivälitteiset haittavaikutukset iholla
Pembrolitsumabihoitoa saavilla potilailla on raportoitu immuunivälitteisiä vaikeita ihoreaktioita (ks. kohta Haittavaikutukset). Potilaita on tarkkailtava epäiltyjen vaikeiden ihoreaktioiden varalta ja muut syyt on suljettava pois. Haittavaikutuksen vaikeusasteen mukaan pembrolitsumabihoidosta pidättäydytään toistaiseksi vaikeusasteen 3 ihoreaktioissa, kunnes reaktio on lievittynyt vaikeusasteeseen ≤ 1 tai hoito lopetetaan pysyvästi vaikeusasteen 4 ihoreaktioissa, ja annetaan kortikosteroideja (ks. kohta Annostus ja antotapa).
Pembrolitsumabihoitoa saavilla potilailla on raportoitu Stevens-Johnsonin oireyhtymä- ja toksinen epidermaalinen nekrolyysi -tapauksia (ks. kohta Haittavaikutukset). Jos Stevens-Johnsonin oireyhtymää tai toksista epidermaalista nekrolyysiä epäillään, pembrolitsumabihoidosta on pidättäydyttävä toistaiseksi ja potilas ohjataan erikoisterveydenhoidon piiriin hoidon arvioimista ja hoitoa varten. Jos Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi on varmistettu, pembrolitsumabihoito lopetetaan pysyvästi (ks. kohta Annostus ja antotapa).
On noudatettava varovaisuutta arvioitaessa pembrolitsumabin käyttöä potilaalle, jolla on ollut vaikea tai henkeä uhkaava haittavaikutus iholla muiden immuunijärjestelmää stimuloivien syöpälääkkeiden aikaisemman käytön yhteydessä.
Muut immuunivälitteiset haittavaikutukset
Kliinisissä tutkimuksissa tai markkinoilletulon jälkeisessä käytössä on raportoitu myös seuraavia kliinisesti merkittäviä immuunivälitteisiä haittavaikutuksia: uveiitti, niveltulehdus, myosiitti, sydänlihastulehdus, haimatulehdus, Guillain⎼Barrén oireyhtymä, myasteeninen oireyhtymä, hemolyyttinen anemia, sarkoidoosi, enkefaliitti, myeliitti, vaskuliitti, sklerosoiva sappitietulehdus, gastriitti, ei-infektiivinen virtsarakkotulehdus, lisäkilpirauhasen vajaatoiminta ja sydänpussitulehdus (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Haittavaikutuksen vaikeusasteen ja tyypin mukaan pembrolitsumabihoidosta pidättäydytään toistaiseksi vaikeusasteen 2 ja 3 tapahtumissa ja annetaan kortikosteroideja.
Pembrolitsumabihoito voidaan aloittaa uudelleen 12 viikon kuluessa viimeksi annetusta KEYTRUDA-annoksesta, jos haittavaikutus lievittyy vaikeusasteeseen ≤ 1 ja kortikosteroidiannos on pienennetty korkeintaan 10 mg:aan prednisonia vuorokaudessa tai vastaavalle tasolle.
Pembrolitsumabihoito täytyy lopettaa pysyvästi, jos mikä tahansa vaikeusasteen 3 immuunivälitteinen haittavaikutus ilmaantuu uudelleen tai jos ilmaantuu mikä tahansa vaikeusasteen 4 immuunivälitteinen haittavaikutus.
Vaikeusasteen 3 ja 4 sydänlihastulehduksessa, enkefaliitissa tai Guillain⎼Barrén oireyhtymässä pembrolitsumabihoito on lopetettava pysyvästi (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Elimen siirtoihin liittyvät haittavaikutukset
Kiinteän elimen siirron jälkeiset hyljintäreaktiot
PD-1:n estäjillä hoidetuilta potilailta on ilmoitettu hyljintäreaktioita kiinteän elimen siirron jälkeen valmisteen markkinoilletulon jälkeen. Pembrolitsumabihoito saattaa suurentaa hyljintäreaktion riskiä kiinteän elimen saaneilla potilailla. Näillä potilailla pembrolitsumabihoidon hyötyjä mahdollisen hyljintäreaktion riskiin nähden on arvioitava huolellisesti.
Allogeenisen hematopoieettisen kantasolujen siirron komplikaatiot
Allogeeninen hematopoieettinen kantasolujen siirto pembrolitsumabihoidon jälkeen
Käänteishyljintää ja maksan veno-okklusiivista tautia on havaittu klassisen Hodgkinin lymfooman yhteydessä allogeenisen hematopoieettisen kantasolusiirteen saaneilla potilailla, jotka ovat aiemmin altistuneet pembrolitsumabille. Ennen kuin saadaan lisätietoa, hematopoieettisen kantasolujen siirron mahdollisia hyötyjä ja siirteeseen liittyviä mahdollisia riskejä on harkittava huolellisesti ja tapauskohtaisesti (ks. kohta Haittavaikutukset).
Allogeeninen hematopoieettinen kantasolujen siirto ennen pembrolitsumabihoitoa
Aiemmin allogeenisen hematopoieettisen kantasolusiirteen saaneilla potilailla on raportoitu pembrolitsumabihoidon jälkeen akuuttia käänteishyljintää, joka on joissakin tapauksissa johtanut kuolemaan. Potilailla, joilla esiintyi käänteishyljintää kantasolusiirron jälkeen, voi olla suurentunut käänteishyljinnän riski pembrolitsumabihoidon jälkeen. Pembrolitsumabihoidon hyötyjä mahdollisen käänteishyljinnän riskiin nähden on arvioitava, jos potilas on aiemmin saanut allogeenisen hematopoieettisen kantasolujen siirron.
Infuusioreaktiot
Pembrolitsumabihoitoa saavilla potilailla on raportoitu vaikeita infuusioreaktioita, kuten yliherkkyyttä ja anafylaksiaa (ks. kohta Haittavaikutukset). Vaikeusasteen 3 ja 4 infuusioreaktioissa infuusion anto on lopetettava ja pembrolitsumabihoito on lopetettava pysyvästi (ks. kohta Annostus ja antotapa). Vaikeusasteen 1 ja 2 infuusioreaktioissa pembrolitsumabihoitoa voidaan jatkaa tarkassa valvonnassa. Esilääkitystä kuumelääkkeellä ja antihistamiinilla voidaan harkita.
Pembrolitsumabin käyttö yhdistelmänä solunsalpaajahoidon kanssa
Pembrolitsumabin ja solunsalpaajahoidon yhdistelmää on käytettävä ≥ 75‑vuotiailla potilailla varovaisuutta noudattaen huolellisen harkinnan jälkeen ottaen huomioon mahdolliset potilaskohtaiset hyödyt ja riskit (ks. kohta Farmakodynamiikka).
Tautikohtaiset varotoimet
Pembrolitsumabin käyttö uroteelikarsinoomaa sairastaville potilaille, jotka ovat aiemmin saaneet platinapohjaista solunsalpaajahoitoa
Lääkärin on otettava huomioon pembrolitsumabin vaikutuksen alkamisen viive ennen hoidon aloittamista potilaalle, jolla on huonompaan ennusteeseen viittaavia ominaisuuksia ja/tai aggressiivinen tauti. Uroteelikarsinooman pembrolitsumabihoidon yhteydessä havaittiin solunsalpaajahoitoa enemmän kuolemantapauksia 2 kuukauden kuluessa (ks. kohta Farmakodynamiikka). Varhaisiin kuolemiin liittyviä tekijöitä olivat nopeasti etenevä tauti potilailla, jotka olivat aiemmin saaneet platinapohjaista hoitoa, sekä maksametastaasit.
Pembrolitsumabin käyttö uroteelikarsinooman hoidossa potilaille, joiden ei katsota soveltuvan saamaan sisplatiinia sisältävää solunsalpaajahoitoa ja joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä on ≥ 10
Lähtötilanteen tietojen ja taudin etenemistä ennustavien ominaispiirteiden perusteella KEYNOTE‑052-tutkimuspopulaatioon sisältyi myös joukko potilaita, jotka soveltuivat saamaan karboplatiinipohjaista yhdistelmähoitoa. Näiden potilaiden saamaa hyötyä on arvioitu vertailututkimuksella (KEYNOTE-361). KEYNOTE-361-tutkimuksessa pembrolitsumabimonoterapian yhteydessä havaittiin enemmän kuolemantapauksia solunsalpaajahoitoon verrattuna 6 kuukauden kuluessa hoidon aloittamisesta. Sen jälkeen pitkän aikavälin seurannassa elossaoloajan todettiin pidentyneen (ks. kohta Farmakodynamiikka). Mitään tiettyjä varhaisiin kuolemiin liittyviä tekijöitä ei tunnistettu. Lääkärin on otettava huomioon pembrolitsumabin vaikutuksen alkamisen viive ennen hoidon aloittamista uroteelikarsinoomaa sairastaville potilaille, joiden katsotaan soveltuvan saamaan karboplatiinipohjaista yhdistelmäsolunsalpaajahoitoa. Lisäksi KEYNOTE‑052-tutkimuksen tutkimuspopulaatioon sisältyi potilaita, jotka soveltuivat saamaan monokemoterapiaa ja joista ei ole saatavilla satunnaistettuja tietoja. Heikkokuntoisista potilaista (esim. ECOG-toimintakykyluokka 3), joiden ei katsota soveltuvan saamaan solunsalpaajahoitoa, ei ole myöskään saatavilla turvallisuutta ja tehoa koskevia tietoja. Koska näitä tietoja ei ole saatavilla, pembrolitsumabia on käytettävä tässä potilasryhmässä varovaisuutta noudattaen ja mahdollisten riskien ja hyötyjen huolellisen potilaskohtaisen harkinnan jälkeen.
Pembrolitsumabin käyttö ei-pienisoluista keuhkosyöpää sairastavien potilaiden ensilinjan hoitoon
Yleisesti pembrolitsumabiyhdistelmähoidon yhteydessä havaittujen haittavaikutusten esiintymistiheys on suurempi pembrolitsumabimonoterapiaan tai pelkkään solunsalpaajahoitoon verrattuna, mikä johtuu näihin yksittäisiin komponentteihin liittyvistä haittavaikutuksista (ks. kohdat Annostus ja antotapa ja Haittavaikutukset). Suoraa vertailua solunsalpaajahoidon kanssa yhdistelmänä käytettävästä pembrolitsumabista pembrolitsumabimonoterapiaan verrattuna ei ole saatavilla.
Lääkärin on arvioitava saatavilla olevien hoitovaihtoehtojen (pembrolitsumabimonoterapia tai pembrolitsumabi yhdistelmänä solunsalpaajahoidon kanssa) hyöty-riskisuhdetta ennen hoidon aloittamista potilaalle, joka ei ole aiemmin saanut hoitoa ja jolla on ei-pienisoluinen keuhkosyöpä, jonka kasvaimet ilmentävät PD-L1:tä.
KEYNOTE-042-tutkimuksessa pembrolitsumabimonoterapian yhteydessä havaittiin enemmän kuolemantapauksia solunsalpaajahoitoon verrattuna 4 kuukauden kuluessa hoidon aloittamisesta. Sen jälkeen pitkän aikavälin seurannassa elossaoloajan todettiin pidentyneen (ks. kohta Farmakodynamiikka).
Pembrolitsumabin käyttö pään ja kaulan alueen levyepiteelikarsinoomaa sairastavien potilaiden ensilinjan hoitoon
Yleisesti pembrolitsumabiyhdistelmähoidon yhteydessä havaittujen haittavaikutusten esiintymistiheys on suurempi pembrolitsumabimonoterapiaan tai pelkkään solunsalpaajahoitoon verrattuna, mikä johtuu näihin yksittäisiin komponentteihin liittyvistä haittavaikutuksista (ks. kohta Haittavaikutukset).
Lääkärin on arvioitava saatavilla olevien hoitovaihtoehtojen (pembrolitsumabimonoterapia tai pembrolitsumabi yhdistelmänä solunsalpaajahoidon kanssa) hyöty-riskisuhdetta ennen hoidon aloittamista potilaalle, jolla on pään ja kaulan alueen levyepiteelikarsinooma ja jolla kasvaimet ilmentävät PD-L1:tä (ks. kohta Farmakodynamiikka).
Pembrolitsumabin käyttö sellaisten edennyttä tai uusiutunutta endometriumkarsinoomaa sairastavien potilaiden hoitoon, joiden syöpään liittyy mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi
Pembrolitsumabin ja lenvatinibin yhdistelmän ja pembrolitsumabimonoterapian suoraa vertailua ei ole saatavilla. Lääkärin on arvioitava saatavilla olevien hoitovaihtoehtojen (pembrolitsumabimonoterapia tai pembrolitsumabi yhdistelmänä lenvatinibin kanssa) hyöty-riskisuhdetta ennen hoidon aloittamista potilaalle, jolla on edennyt tai uusiutunut endometriumkarsinooma, johon liittyy mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi.
Pembrolitsumabin käyttö melanoomaa sairastavien potilaiden adjuvanttihoitona
Vaikeiden ja vakavien haittavaikutusten esiintymistiheydellä havaittiin olevan taipumus suurentua ≥ 75‑vuotiailla potilailla. Turvallisuutta koskevia tietoja pembrolitsumabista melanooman adjuvanttihoidossa ≥ 75-vuotiailla potilailla on vain vähän.
Pembrolitsumabin käyttö yhdistelmänä aksitinibin kanssa munuaissolukarsinoomaa sairastavien potilaiden ensilinjan hoitoon
Kun pembrolitsumabia on annettu aksitinibin kanssa, edennyttä munuaissolukarsinoomaa sairastavilla potilailla on ilmoitettu odotettua enemmän ALAT- ja ASAT-arvojen kohoamista, joka on ollut vaikeusastetta 3 tai 4 (ks. kohta Haittavaikutukset). Maksaentsyymiarvoja on seurattava ennen hoidon aloittamista ja säännöllisesti koko hoidon ajan. Voidaan harkita tiheämpää maksaentsyymiarvojen seurantaa kuin silloin, kun lääkkeitä käytetään monoterapiana. Molempien lääkkeiden käyttöä koskevia ohjeita on noudatettava (ks. kohta Annostus ja antotapa ja aksitinibin valmisteyhteenveto).
Pembrolitsumabin käyttö sellaisten kolorektaalisyöpää sairastavien potilaiden ensilinjan hoitoon, joiden syöpään liittyy mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi
KEYNOTE-177-tutkimuksessa kokonaiselinaikaan liittyvien tapahtumien riskitiheydet olivat suuremmat pembrolitsumabia saaneilla verrattuna solunsalpaajahoitoa saaneisiin hoidon ensimmäisten 4 kuukauden aikana, minkä jälkeen pitkän aikavälin seurannassa todettiin elossaoloajan olevan pidempi pembrolitsumabia saaneilla (ks. kohta Farmakodynamiikka).
Pembrolitsumabin käyttö sappitiesyöpää sairastavien potilaiden ensilinjan hoitoon
Sappitietulehdukset ja sappitieinfektiot eivät ole harvinaisia sappitiesyöpää sairastavilla potilailla. Sappitietulehdustapahtumia ilmoitettiin KEYNOTE‑966‑tutkimuksen molemmissa hoitohaaroissa (11,2 %:lla [n = 59] pembrolitsumabia ja solunsalpaajahoitoa saaneiden haarassa ja 10,3 %:lla [n = 55] lumelääkettä ja solunsalpaajahoitoa saaneiden haarassa). KEYNOTE-966‑tutkimuksessa sappitietulehduksen ja ‑infektion riski oli suurentunut potilailla, joilla oli sappitiestentti tai ‑dreeni (n = 74) (39,4 % [n = 13] pembrolitsumabia ja solunsalpaajahoitoa saaneiden haarassa vs. 29,3 % [n = 12] lumelääkettä ja solunsalpaajahoitoa saaneiden haarassa). Sappitiesyöpää sairastavia potilaita (etenkin potilaita, joilla on sappitiestentti) on seurattava tarkasti sappitietulehduksen ja ‑infektion kehittymisen varalta ennen hoidon aloittamista ja säännöllisesti hoidon aloittamisen jälkeen.
Kliinisistä tutkimuksista pois suljetut potilaat
Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli seuraavia sairauksia: aktiivisia etäpesäkkeitä keskushermostossa, ECOG-toimintakykyluokka ≥ 2 (uroteelikarsinoomaa ja munuaissolukarsinoomaa lukuun ottamatta), HIV‑infektio, B- tai C-hepatiitti‑infektio (sappitiesyöpää lukuun ottamatta), aktiivinen systeeminen autoimmuunisairaus, interstitiaalinen keuhkosairaus, aiemmin sairastettu pneumoniitti, joka on vaatinut systeemistä kortikosteroidihoitoa, aiemmin ilmennyt vaikea yliherkkyys jollekin muulle monoklonaaliselle vasta-aineelle, immunosuppressiivinen hoito tai aiemmin ipilimumabihoidosta saatuja vaikeita immuunivälitteisiä haittavaikutuksia (mikä tahansa vaikeusasteen 4 tai vaikeusasteen 3 toksinen vaikutus, joka vaati kortikosteroidihoitoa [prednisonia tai vastaavaa yli 10 mg/vrk] yli 12 viikon ajan). Kliinisiin tutkimuksiin ei otettu mukaan potilaita, joilla oli aktiivinen infektio, ja pembrolitsumabin saaminen edellytti, että infektio oli ensin hoidettu. Potilaat, joille kehittyi aktiivinen infektio pembrolitsumabihoidon aikana, saivat asianmukaista hoitoa. Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli lähtötilanteessa kliinisesti merkittäviä munuaisten (kreatiniiniarvo > 1,5 kertaa ULN) tai maksan (bilirubiiniarvo > 1,5 kertaa ULN, ALAT ja ASAT > 2,5 kertaa ULN, ei maksametastaaseja) poikkeavuuksia, joten vaikeaa munuaisten vajaatoimintaa ja kohtalaista tai vaikeaa maksan vajaatoimintaa sairastavista potilaista on rajallisesti tietoa.
On vain vähän tietoa KEYTRUDA-valmisteen turvallisuudesta ja tehosta silmän melanoomaa sairastavilla potilailla (ks. kohta Farmakodynamiikka).
Pembrolitsumabia voidaan käyttää näille potilaille yhdessä asianmukaisen lääketieteellisen hoidon kanssa, kun mahdolliset riskit on huolellisesti arvioitu.
Apuaineet, joiden vaikutus tunnetaan
Tämä lääkevalmiste sisältää 0,2 mg polysorbaatti 80:tä per millilitra konsentraattia. Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Potilaskortti
Kaikkien KEYTRUDA-valmistetta määräävien henkilöiden täytyy tutustua lääkäreille tarkoitettuihin tietoihin ja hoito-ohjeisiin ja keskustella potilaan kanssa KEYTRUDA-hoidon riskeistä. Potilaalle on jokaisen lääkemääräyksen yhteydessä annettava potilaskortti.
Yhteisvaikutukset
Pembrolitsumabilla ei ole tehty varsinaisia farmakokineettisiä yhteisvaikutustutkimuksia. Koska pembrolitsumabi poistuu verenkierrosta katabolian kautta, metabolisia yhteisvaikutuksia muiden lääkkeiden kanssa ei ole odotettavissa.
Systeemisten kortikosteroidien tai immunosuppressiivisten lääkeaineiden käyttöä on vältettävä ennen pembrolitsumabihoidon aloittamista, koska ne saattavat heikentää pembrolitsumabin farmakodynaamista vaikutusta ja tehoa. Systeemisiä kortikosteroideja tai muita immunosuppressiivisia lääkeaineita voidaan kuitenkin käyttää pembrolitsumabihoidon aloittamisen jälkeen immuunivälitteisten haittavaikutusten hoitoon (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Kortikosteroideja voidaan myös käyttää esilääkityksenä, kun pembrolitsumabia käytetään yhdistelmänä solunsalpaajien kanssa, pahoinvoinnin ehkäisyyn ja/tai lievittämään solunsalpaajahoitoon liittyviä haittavaikutuksia.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä pembrolitsumabihoidon aikana ja vähintään 4 kuukauden ajan viimeisen pembrolitsumabiannoksen jälkeen.
Raskaus
Ei ole olemassa tietoja pembrolitsumabin käytöstä raskaana oleville naisille. Pembrolitsumabilla ei ole tehty lisääntymistutkimuksia eläimillä. Tiineiden hiirten eläinmalleissa PD-L1:n signaalinvälityksen salpauksen on kuitenkin todettu häiritsevän toleranssia sikiötä kohtaan ja lisäävän sikiönmenetyksiä (ks. kohta Prekliiniset tiedot turvallisuudesta). Nämä tulokset viittaavat siihen, että pembrolitsumabin vaikutusmekanismin vuoksi valmisteen käyttö raskauden aikana saattaa olla haitallista sikiölle, ja se voi lisätä keskenmenojen tai sikiökuolemien riskiä. Ihmisen immunoglobuliini G4:n (IgG4:n) tiedetään läpäisevän istukan. Pembrolitsumabi on IgG4, joten pembrolitsumabi saattaa siirtyä äidistä kehittyvään sikiöön. Pembrolitsumabia ei pidä käyttää raskauden aikana, paitsi jos naisen kliininen tila vaatii pembrolitsumabihoitoa.
Imetys
Ei tiedetä, erittyykö pembrolitsumabi ihmisen rintamaitoon. Vasta-aineiden tiedetään voivan erittyä ihmisen rintamaitoon, joten vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko pembrolitsumabihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja pembrolitsumabihoidosta koituvat hyödyt äidille.
Hedelmällisyys
Pembrolitsumabin mahdollisista vaikutuksista hedelmällisyyteen ei ole kliinisiä tietoja. Toistuvilla annoksilla tehdyissä yhden kuukauden ja kuuden kuukauden toksisuustutkimuksissa ei havaittu uros- tai naarasapinoiden lisääntymiselimiin kohdistuvia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Pembrolitsumabihoidolla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Joillakin potilailla on raportoitu huimausta ja väsymystä pembrolitsumabin antamisen jälkeen (ks. kohta Haittavaikutukset).
Haittavaikutukset
Tiivistelmä turvallisuustiedoista
Yleisimmät pembrolitsumabihoidon yhteydessä ilmenevät haittavaikutukset ovat immuunivälitteisiä. Useimmat niistä, vaikeat reaktiot mukaan lukien, häviävät asianmukaisen hoidon aloittamisen tai pembrolitsumabihoidon lopettamisen jälkeen (ks. Valikoitujen haittavaikutusten kuvaus jäljempänä). Jäljempänä ja taulukossa 2 esitetyt esiintymistiheydet perustuvat kaikkiin raportoituihin lääkkeen haittavaikutuksiin tutkijalääkärin syy-yhteysarviosta riippumatta.
Pembrolitsumabi monoterapiana (ks. kohta Annostus ja antotapa)
Neljän monoterapiana käytetyn pembrolitsumabiannoksen (2 mg/kg kolmen viikon välein, 200 mg kolmen viikon välein ja 10 mg/kg kahden tai kolmen viikon välein) turvallisuutta on arvioitu kliinisissä tutkimuksissa yhteensä 7 631 potilaalla, joilla oli erityyppisiä kasvaimia. Tässä potilasjoukossa seuranta-ajan mediaani oli 8,5 kuukautta (vaihteluväli: 1 vuorokausi – 39 kuukautta), ja pembrolitsumabin yleisimmät haittavaikutukset olivat väsymys (31 %), ripuli (22 %) ja pahoinvointi (20 %). Suurin osa monoterapiaa koskevista raportoiduista haittavaikutuksista kuului vaikeusasteluokkaan 1 tai 2. Vakavimmat haittavaikutukset olivat immuunivälitteisiä haittavaikutuksia ja vaikeita infuusioon liittyviä reaktioita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Immuunivälitteisten haittavaikutusten ilmaantuvuus oli 37 % kaikkien vaikeusasteiden kohdalla ja 9 % vaikeusasteiden 3–5 kohdalla, kun pembrolitsumabimonoterapiaa käytettiin adjuvanttihoitona, ja 25 % kaikkien vaikeusasteiden kohdalla ja 6 % vaikeusasteiden 3–5 kohdalla, kun kyseessä oli metastasoituneen taudin hoito. Adjuvanttihoidon yhteydessä ei todettu uusia immuunivälitteisiä haittavaikutuksia.
Pembrolitsumabi yhdistelmänä solunsalpaajahoidon, sädehoidon tai kemosädehoidon kanssa (ks. kohta Annostus ja antotapa)
Kun pembrolitsumabia annetaan osana yhdistelmähoitoa, ennen hoidon aloittamista on tutustuttava yhdistelmähoidon yksittäisten komponenttien valmisteyhteenvetoihin.
Pembrolitsumabin turvallisuutta yhdistelmänä solunsalpaajahoidon, sädehoidon tai kemosädehoidon kanssa on arvioitu kliinisissä tutkimuksissa 6 695 potilaalla, joilla oli erityyppisiä kasvaimia ja jotka saivat pembrolitsumabia 200 mg, 2 mg/kg tai 10 mg/kg kolmen viikon välein. Tässä potilasjoukossa yleisimmät haittavaikutukset olivat pahoinvointi (51 %), anemia (50 %), ripuli (35 %), väsymys (35 %), ummetus (32 %), oksentelu (27 %), neutrofiiliarvon pieneneminen (26 %) ja heikentynyt ruokahalu (26 %). Vaikeusasteluokkiin 3–5 kuuluvien haittavaikutusten ilmaantuvuus oli ei-pienisoluista keuhkosyöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 69 % ja pelkän solunsalpaajahoidon yhteydessä 61 %, pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla pembrolitsumabiyhdistelmähoidon (solunsalpaajahoito tai sädehoito sekä mahdollinen solunsalpaajahoito) yhteydessä 80 % ja solunsalpaaja- ja setuksimabihoidon yhdistelmän tai sädehoidon sekä mahdollisen solunsalpaajahoidon yhteydessä 79 %, ruokatorvisyöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 86 % ja pelkän solunsalpaajahoidon yhteydessä 83 %, kolmoisnegatiivista rintasyöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 80 % ja pelkän solunsalpaajahoidon yhteydessä 77 %, kohdunkaulan syöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon (solunsalpaaja ja mahdollinen bevasitsumabi tai yhdistelmä kemosädehoidon kanssa) yhteydessä 77 % ja solunsalpaajahoidon ja mahdollisen bevasitsumabihoidon yhdistelmän tai pelkän kemosädehoidon yhteydessä 71 %, mahasyöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon (solunsalpaaja ja mahdollinen trastutsumabi) yhteydessä 74 % ja solunsalpaajahoidon ja mahdollisen trastutsumabihoidon yhteydessä 68 %, sappitiesyöpää sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 85 % ja pelkän solunsalpaajahoidon yhteydessä 84 %, endometriumkarsinoomaa sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 59 % ja pelkän solunsalpaajahoidon yhteydessä 46 % sekä pahanlaatuista keuhkopussin mesotelioomaa sairastavilla potilailla pembrolitsumabiyhdistelmähoidon yhteydessä 44 % ja pelkän solunsalpaajahoidon yhteydessä 30 %.
Pembrolitsumabi yhdistelmänä tyrosiinikinaasin estäjän kanssa (ks. kohta Annostus ja antotapa)
Kun pembrolitsumabia annetaan yhdistelmänä aksitinibin tai lenvatinibin kanssa, ennen hoidon aloittamista on tutustuttava aksitinibin tai lenvatinibin valmisteyhteenvetoon. Lisätietoa lenvatinibin turvallisuudesta edenneen munuaissolukarsinooman hoidossa löytyy Kisplyx-valmisteen valmisteyhteenvedosta ja edenneen endometriumkarsinooman hoidossa Lenvima-valmisteen valmisteyhteenvedosta. Lisätietoa aksitinibin turvallisuudesta liittyen kohonneisiin maksaentsyymiarvoihin, ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet.
Pembrolitsumabin turvallisuutta yhdistelmänä aksitinibin tai lenvatinibin kanssa edenneen munuaissolukarsinooman hoidossa sekä yhdistelmänä lenvatinibin kanssa edenneen endometriumkarsinooman hoidossa on arvioitu kliinisissä tutkimuksissa yhteensä 1 456 potilaalla, joilla oli edennyt munuaissolukarsinooma tai edennyt endometriumkarsinooma ja jotka saivat pembrolitsumabia 200 mg kolmen viikon välein tilanteen mukaan joko aksitinibin kanssa, jota annettiin 5 mg kaksi kertaa vuorokaudessa, tai lenvatinibin kanssa, jota annettiin 20 mg kerran vuorokaudessa. Näissä potilasjoukoissa yleisimmät haittavaikutukset olivat ripuli (58 %), hypertensio (54 %), hypotyreoosi (46 %), väsymys (41 %), heikentynyt ruokahalu (40 %), pahoinvointi (40 %), nivelsärky (30 %), oksentelu (28 %), painon lasku (28 %), dysfonia (28 %), vatsakipu (28 %), proteinuria (27 %), käsi-jalkaoireyhtymä (26 %), ihottuma (26 %), suutulehdus (25 %), ummetus (25 %), lihas- ja luukipu (23 %), päänsärky (23 %) ja yskä (21 %). Vaikeusasteluokkiin 3–5 kuuluvien haittavaikutusten ilmaantuvuus oli munuaissolukarsinoomaa sairastavilla potilailla 80 %, kun potilaat saivat pembrolitsumabia yhdistelmänä joko aksitinibin tai lenvatinibin kanssa, ja pelkän sunitinibihoidon yhteydessä 71 %. Endometriumkarsinoomaa sairastavilla potilailla vaikeusasteluokkiin 3–5 kuuluvien haittavaikutusten ilmaantuvuus oli 89 %, kun potilaat saivat pembrolitsumabia yhdistelmänä lenvatinibin kanssa, ja pelkän solunsalpaajahoidon yhteydessä 73 %.
Yhteenvetotaulukko haittavaikutuksista
Taulukossa 2 esitetään haittavaikutukset, joita on todettu pembrolitsumabilla monoterapiana tai yhdistelmänä solunsalpaajahoidon, sädehoidon tai kemosädehoidon tai muiden syöpälääkkeiden kanssa tehdyissä kliinisissä tutkimuksissa tai raportoitu valmisteen markkinoille tulon jälkeen. Haittavaikutukset on esitetty elinjärjestelmän ja yleisyyden mukaan. Yleisyysluokat on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Kunkin yleisyysluokan haittavaikutukset on esitetty alenevassa järjestyksessä vakavimmasta alkaen. Haittavaikutuksia, joita tiedetään ilmenevän annettaessa pembrolitsumabia tai yhdistelmähoidon yksittäisiä komponentteja yksinään, saattaa ilmetä näillä lääkevalmisteilla toteutetun yhdistelmähoidon aikana, vaikka tällaisia haittavaikutuksia ei olisi raportoitu yhdistelmähoitoa koskevissa kliinisissä tutkimuksissa.
Lisätietoa turvallisuudesta, kun pembrolitsumabia annetaan osana yhdistelmähoitoa, on yhdistelmähoidon yksittäisten komponenttien valmisteyhteenvedoissa.
| Taulukko 2: Pembrolitsumabia saaneilla potilailla todetut haittavaikutukset† | |||
| MedDRA:n elinjärjestelmäluokka ja yleisyysluokka | Monoterapia | Yhdistelmähoito solunsalpaajahoidon, sädehoidon tai kemosädehoidon kanssa | Yhdistelmähoito aksitinibin tai lenvatinibin kanssa |
| Infektiot | |||
| Hyvin yleinen | virtsatieinfektio | ||
| Yleinen | keuhkokuume | keuhkokuume | keuhkokuume |
| Veri ja imukudos | |||
| Hyvin yleinen | anemia | anemia, neutropenia, trombosytopenia | anemia |
| Yleinen | trombosytopenia, neutropenia, lymfopenia | kuumeinen neutropenia, leukopenia, lymfopenia | neutropenia, trombosytopenia, lymfopenia, leukopenia |
| Melko harvinainen | leukopenia, immuuni trombosytopenia, eosinofilia | hemolyyttinen anemia*, eosinofilia | eosinofilia |
| Harvinainen | hemolyyttinen anemia*, hemofagosyyttinen lymfohistiosytoosi, puhdas punasoluaplasia | immuuni trombosytopenia | |
| Immuunijärjestelmä | |||
| Yleinen | infuusioon liittyvä reaktio* | infuusioon liittyvä reaktio* | infuusioon liittyvä reaktio* |
| Melko harvinainen | sarkoidoosi* | ||
| Harvinainen | sarkoidoosi | ||
| Tuntematon | hyljintäreaktio kiinteän elimen siirron jälkeen | ||
| Umpieritys | |||
| Hyvin yleinen | hypotyreoosi* | hypotyreoosi* | hypotyreoosi |
| Yleinen | hypertyreoosi | lisämunuaisen vajaatoiminta*, hypertyreoosi*, tyreoidiitti* | lisämunuaisen vajaatoiminta*, hypertyreoosi, tyreoidiitti* |
| Melko harvinainen | lisämunuaisen vajaatoiminta*, hypofysiitti*, tyreoidiitti* | hypofysiitti* | hypofysiitti* |
| Harvinainen | lisäkilpirauhasen vajaatoiminta | lisäkilpirauhasen vajaatoiminta | lisäkilpirauhasen vajaatoiminta |
| Aineenvaihdunta ja ravitsemus | |||
| Hyvin yleinen | heikentynyt ruokahalu | hypokalemia, heikentynyt ruokahalu | heikentynyt ruokahalu |
| Yleinen | hyponatremia, hypokalemia, hypokalsemia | hyponatremia, hypokalsemia | hyponatremia, hypokalemia, hypokalsemia |
| Melko harvinainen | tyypin 1 diabetes* | tyypin 1 diabetes* | tyypin 1 diabetes* |
| Psyykkiset häiriöt | |||
| Hyvin yleinen | unettomuus | ||
| Yleinen | unettomuus | unettomuus | |
| Hermosto | |||
| Hyvin yleinen | päänsärky | perifeerinen neuropatia, päänsärky | päänsärky, makuhäiriö |
| Yleinen | heitehuimaus, perifeerinen neuropatia, letargia, makuhäiriö | heitehuimaus, makuhäiriö | heitehuimaus, perifeerinen neuropatia, letargia |
| Melko harvinainen | myasteeninen oireyhtymä*, epilepsia | enkefaliitti*, epilepsia, letargia | myasteeninen oireyhtymä*, enkefaliitti* |
| Harvinainen | Guillain-Barrén oireyhtymä*, enkefaliitti*, myeliitti*, näköhermotulehdus, aivokalvotulehdus (aseptinen)* | myasteeninen oireyhtymä*, Guillain-Barrén oireyhtymä*, myeliitti, näköhermotulehdus, aivokalvotulehdus (aseptinen) | näköhermotulehdus |
| Silmät | |||
| Yleinen | kuivasilmäisyys | kuivasilmäisyys | kuivasilmäisyys |
| Melko harvinainen | uveiitti* | uveiitti* | uveiitti* |
| Harvinainen | uveomeningoenkefaliittioireyhtymä | uveomeningoenkefaliittioireyhtymä | |
| Sydän | |||
| Yleinen | sydämen rytmihäiriö‡ (mukaan lukien eteisvärinä) | sydämen rytmihäiriö‡ (mukaan lukien eteisvärinä) | sydämen rytmihäiriö‡ (mukaan lukien eteisvärinä) |
| Melko harvinainen | sydänlihastulehdus, sydänpussitulehdus*, perikardiumeffuusio | sydänlihastulehdus*, sydänpussitulehdus*, perikardiumeffuusio | sydänlihastulehdus, perikardiumeffuusio |
| Verisuonisto | |||
| Hyvin yleinen | hypertensio | ||
| Yleinen | hypertensio | hypertensio | |
| Melko harvinainen | vaskuliitti* | vaskuliitti* | |
| Harvinainen | vaskuliitti* | ||
| Hengityselimet, rintakehä ja välikarsina | |||
| Hyvin yleinen | hengenahdistus, yskä | hengenahdistus, yskä | hengenahdistus, yskä |
| Yleinen | pneumoniitti* | pneumoniitti* | pneumoniitti* |
| Ruoansulatuselimistö | |||
| Hyvin yleinen | ripuli, vatsakipu*, pahoinvointi, oksentelu, ummetus | ripuli, pahoinvointi, oksentelu, vatsakipu*, ummetus | ripuli, vatsakipu*, pahoinvointi, oksentelu, ummetus |
| Yleinen | paksusuolitulehdus*, suun kuivuminen | paksusuolitulehdus*, gastriitti*, suun kuivuminen | paksusuolitulehdus*, haimatulehdus*, gastriitti*, suun kuivuminen |
| Melko harvinainen | haimatulehdus*, gastriitti*, maha-suolikanavan haavauma* | haimatulehdus*, maha-suolikanavan haavauma* | maha-suolikanavan haavauma* |
| Harvinainen | haiman eksokriininen vajaatoiminta, ohutsuolen puhkeaminen, keliakia | haiman eksokriininen vajaatoiminta, ohutsuolen puhkeaminen, keliakia | ohutsuolen puhkeaminen |
| Tuntematon | haiman eksokriininen vajaatoiminta, keliakia | ||
| Maksa ja sappi | |||
| Yleinen | maksatulehdus* | maksatulehdus* | maksatulehdus* |
| Harvinainen | sklerosoiva sappitietulehdus | sklerosoiva sappitietulehdus* | |
| Iho ja ihonalainen kudos | |||
| Hyvin yleinen | kutina*, ihottuma* | ihottuma*, hiustenlähtö, kutina* | ihottuma*, kutina* |
| Yleinen | vaikeat ihoreaktiot*, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, valkopälvi*, ekseema, hiustenlähtö, aknetyyppinen ihottuma | vaikeat ihoreaktiot*, ihon punoitus, ihottuma/ihotulehdus, kuiva iho, aknetyyppinen ihottuma, ekseema | vaikeat ihoreaktiot*, ihottuma/ihotulehdus, kuiva iho, ihon punoitus, aknetyyppinen ihottuma, hiustenlähtö |
| Melko harvinainen | psoriaasi, likenoidinen keratoosi*, papula, hiusten värinmuutokset | psoriaasi, likenoidinen keratoosi*, valkopälvi*, papula | ekseema, likenoidinen keratoosi*, psoriaasi, valkopälvi*, papula, hiusten värinmuutokset |
| Harvinainen | Stevens-Johnsonin oireyhtymä, kyhmyruusu, toksinen epidermaalinen nekrolyysi | Stevens-Johnsonin oireyhtymä, kyhmyruusu, hiusten värinmuutokset | toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä |
| Luusto, lihakset ja sidekudos | |||
| Hyvin yleinen | lihas‑ ja luukipu*, nivelsärky | lihas- ja luukipu*, nivelsärky | nivelsärky, lihas- ja luukipu*, myosiitti*, raajakipu |
| Yleinen | myosiitti*, raajakipu, niveltulehdus* | myosiitti*, raajakipu, niveltulehdus* | niveltulehdus* |
| Melko harvinainen | jännetuppitulehdus* | jännetuppitulehdus* | jännetuppitulehdus* |
| Harvinainen | Sjögrenin oireyhtymä | Sjögrenin oireyhtymä | Sjögrenin oireyhtymä |
| Munuaiset ja virtsatiet | |||
| Yleinen | akuutti munuaisvaurio | munuaistulehdus* | |
| Melko harvinainen | munuaistulehdus* | munuaistulehdus*, ei-infektiivinen virtsarakkotulehdus | |
| Harvinainen | ei-infektiivinen virtsarakkotulehdus | ei-infektiivinen virtsarakkotulehdus | |
| Yleisoireet ja antopaikassa todettavat haitat | |||
| Hyvin yleinen | väsymys, voimattomuus, turvotus*, kuume | väsymys, voimattomuus, kuume, turvotus* | väsymys, voimattomuus, turvotus*, kuume |
| Yleinen | influenssan kaltainen sairaus, vilunväristykset | influenssan kaltainen sairaus, vilunväristykset | influenssan kaltainen sairaus, vilunväristykset |
| Tutkimukset | |||
| Hyvin yleinen | kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo | kohonnut lipaasiarvo, kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren kreatiniiniarvo | |
| Yleinen | kohonnut alaniiniaminotransferaasiarvo, kohonnut aspartaattiaminotransferaasiarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kalsiumarvo, kohonnut veren bilirubiiniarvo, kohonnut veren kreatiniiniarvo | kohonnut veren bilirubiiniarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kreatiniiniarvo, kohonnut veren kalsiumarvo | kohonneet amylaasiarvot, kohonnut veren bilirubiiniarvo, kohonnut veren alkalisen fosfataasin arvo, kohonnut veren kalsiumarvo |
| Melko harvinainen | kohonneet amylaasiarvot | kohonneet amylaasiarvot | |
†Taulukossa 2 esitetyt haittavaikutusten esiintymistiheydet eivät välttämättä liity täysin pelkästään pembrolitsumabiin, vaan niihin voivat vaikuttaa myös perussairaudet ja muut yhdistelmänä käytetyt lääkevalmisteet.
| |||
Pembrolitsumabi yhdistelmänä enfortumabi-vedotiinin kanssa (ks. kohta Annostus ja antotapa)
Kun pembrolitsumabia annetaan yhdistelmänä enfortumabi-vedotiinin kanssa, ennen hoidon aloittamista on tutustuttava enfortumabi-vedotiinin valmisteyhteenvetoon.
Pembrolitsumabin turvallisuutta yhdistelmänä enfortumabi-vedotiinin kanssa on arvioitu 564 potilaalla, joilla oli leikkaukseen soveltumaton tai metastasoitunut uroteelikarsinooma ja jotka saivat kunkin 21 päivän hoitosyklin aikana pembrolitsumabia 200 mg päivänä 1 ja enfortumabi-vedotiinia 1,25 mg/kg päivinä 1 ja 8.
Kun pembrolitsumabia annettiin yhdistelmänä enfortumabi-vedotiinin kanssa, havaittujen haittavaikutusten ilmaantuvuus oli kaiken kaikkiaan suurempi pembrolitsumabimonoterapiaan verrattuna, mikä liittyy enfortumabi-vedotiinin käyttöön ja yhdistelmähoidon pidempään kestoon.
Haittavaikutukset olivat yleisesti ottaen samanlaisia kuin on havaittu pembrolitsumabia tai enfortumabi-vedotiinia monoterapiana saaneilla potilailla. Makulopapulaarisen ihottuman ilmaantuvuus oli 36 % kaikkien vaikeusasteiden kohdalla (10 % vaikeusasteiden 3–4 kohdalla), eli ilmaantuvuus oli suurempi kuin pembrolitsumabimonoterapian yhteydessä on havaittu.
Yleisesti haittatapahtumien esiintymistiheydet olivat ≥ 65‑vuotiailla potilailla suurempia kuin < 65‑vuotiailla, etenkin kun kyseessä olivat vakavat haittatapahtumat (≥ 65‑vuotiailla 56,3 % ja < 65‑vuotiailla 35,3 %) tai vähintään asteen 3 tapahtumat (≥ 65‑vuotiailla 80,3 % ja < 65‑vuotiailla 64,2 %). Nämä tulokset vastasivat vertailuhoitona käytettyä solunsalpaajahoitoa koskevia havaintoja.
Valikoitujen haittavaikutusten kuvaus
Tiedot seuraavista immuunivälitteisistä haittavaikutuksista perustuvat potilaisiin, jotka saivat kliinisissä tutkimuksissa pembrolitsumabia neljää eri annosta (2 mg/kg 3 viikon välein, 10 mg/kg 2 tai 3 viikon välein tai 200 mg 3 viikon välein) (ks. kohta Farmakodynamiikka). Näiden haittavaikutusten hoitoa koskevat ohjeet on kerrottu kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Immuunivälitteiset haittavaikutukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Immuunivälitteinen pneumoniitti
Pembrolitsumabia saaneista potilaista 324:llä (4,2 %) esiintyi pneumoniittia, ja heistä 143:lla (1,9 %) oli 2. asteen, 81:llä (1,1 %) 3. asteen, 19:llä (0,2 %) 4. asteen ja 9:llä (0,1 %) 5. asteen pneumoniitti. Mediaaniaika pneumoniitin ilmaantumiseen oli 3,9 kuukautta (vaihteluväli: 2 vuorokautta - 27,2 kuukautta). Pneumoniitin keston mediaani oli 2,0 kuukautta (vaihteluväli: 1 vuorokausi - yli 51,0 kuukautta). Pneumoniittia ilmeni useammin potilailla, jotka olivat aiemmin saaneet sädehoitoa rintakehän alueelle (8,1 %), kuin potilailla, jotka eivät olleet aiemmin saaneet sädehoitoa rintakehän alueelle (3,9 %). Pneumoniitti johti pembrolitsumabihoidon lopettamiseen 131 potilaalla (1,7 %). Pneumoniitti parani 196 potilaalla, joista kuudella oli jälkiseurauksia.
Ei-pienisoluista keuhkosyöpää sairastavista potilaista 230:lla (6,1 %) esiintyi pneumoniittia, ja heistä 103:lla (2,7 %) oli 2. asteen, 63:lla (1,7 %) 3. asteen, 17:llä (0,4 %) 4. asteen ja 10:llä (0,3 %) 5. asteen pneumoniitti. Paikallisesti edennyttä tai metastasoitunutta ei-pienisoluista keuhkosyöpää sairastavista potilaista pneumoniittia ilmeni 8,9 %:lla potilaista, jotka olivat aiemmin saaneet sädehoitoa rintakehän alueelle. Klassista Hodgkinin lymfoomaa sairastavilla potilailla pneumoniitin ilmaantuvuus (kaikki vaikeusasteet) vaihteli 5,2 %:sta (KEYNOTE-087, n = 210) 10,8 %:iin (KEYNOTE-204, n = 148).
Immuunivälitteinen paksusuolitulehdus
Pembrolitsumabia saaneista potilaista 158:lla (2,1 %) esiintyi paksusuolitulehdusta, ja heistä 49:llä (0,6 %) oli 2. asteen, 82:lla (1,1 %) 3. asteen ja 6:lla (0,1 %) 4. asteen paksusuolitulehdus. Mediaaniaika paksusuolitulehduksen ilmaantumiseen oli 4,3 kuukautta (vaihteluväli: 2 vuorokautta - 24,3 kuukautta). Paksusuolitulehduksen keston mediaani oli 1,1 kuukautta (vaihteluväli: 1 vuorokausi - 45,2 kuukautta). Paksusuolitulehdus johti pembrolitsumabihoidon lopettamiseen 48 potilaalla (0,6 %). Paksusuolitulehdus parani 132 potilaalla, joista kahdella oli jälkiseurauksia. Kolorektaalisyöpää sairastavilla potilailla, jotka saivat pembrolitsumabia monoterapiana (n = 153), paksusuolitulehduksen ilmaantuvuus oli 6,5 % (kaikki vaikeusasteet). Vaikeusasteen 3 paksusuolitulehduksen ilmaantuvuus oli 2,0 % ja vaikeusasteen 4 paksusuolitulehduksen ilmaantuvuus 1,3 %.
Immuunivälitteinen maksatulehdus
Pembrolitsumabia saaneista potilaista 80:llä (1,0 %) esiintyi maksatulehdusta, ja heistä 12:lla (0,2 %) oli 2. asteen, 55:llä (0,7 %) 3. asteen ja 8:lla (0,1 %) 4. asteen maksatulehdus. Mediaaniaika maksatulehduksen ilmaantumiseen oli 3,5 kuukautta (vaihteluväli: 8 vuorokautta - 26,3 kuukautta). Maksatulehduksen keston mediaani oli 1,3 kuukautta (vaihteluväli: 1 vuorokausi - yli 29,0 kuukautta). Maksatulehdus johti pembrolitsumabihoidon lopettamiseen 37 potilaalla (0,5 %). Maksatulehdus parani 60 potilaalla.
Immuunivälitteinen munuaistulehdus
Pembrolitsumabia monoterapiana saaneista potilaista 37:llä (0,5 %) esiintyi munuaistulehdusta, ja heistä 11:llä (0,1 %) oli 2. asteen, 19:llä (0,2 %) 3. asteen ja 2:lla (< 0,1 %) 4. asteen munuaistulehdus. Mediaaniaika munuaistulehduksen ilmaantumiseen oli 4,2 kuukautta (vaihteluväli: 12 vuorokautta - 21,4 kuukautta). Munuaistulehduksen keston mediaani oli 3,3 kuukautta (vaihteluväli: 6 vuorokautta - yli 28,2 kuukautta). Munuaistulehdus johti pembrolitsumabihoidon lopettamiseen 17 potilaalla (0,2 %). 25 potilaan munuaistulehdus parani, ja heistä viidellä oli jälkiseurauksia. Ei-levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavilla potilailla, jotka saivat pembrolitsumabia yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa (n = 488), munuaistulehduksen ilmaantuvuus oli 1,4 % (kaikki vaikeusasteet); 3. asteen munuaistulehduksen ilmaantuvuus oli 0,8 % ja 4. asteen munuaistulehduksen ilmaantuvuus oli 0,4 %.
Immuunivälitteiset umpierityssairaudet
Pembrolitsumabia saaneista potilaista 74:llä (1,0 %) esiintyi lisämunuaisten vajaatoimintaa, ja heistä 34:llä (0,4 %) oli 2. asteen, 31:llä (0,4 %) 3. asteen ja 4:llä (0,1 %) 4. asteen lisämunuaisten vajaatoiminta. Mediaaniaika lisämunuaisten vajaatoiminnan ilmaantumiseen oli 5,4 kuukautta (vaihteluväli: 1 vuorokausi - 23,7 kuukautta). Keston mediaania ei saavutettu (vaihteluväli: 3 vuorokautta - yli 40,1 kuukautta). Lisämunuaisten vajaatoiminta johti pembrolitsumabihoidon lopettamiseen 13 potilaalla (0,2 %). Lisämunuaisten vajaatoiminta parani 28 potilaalla, joista 11:llä oli jälkiseurauksia.
Pembrolitsumabia saaneista potilaista 52:lla (0,7 %) esiintyi hypofysiittiä, ja heistä 23:lla (0,3 %) oli 2. asteen, 24:llä (0,3 %) 3. asteen ja 1:llä (< 0,1 %) 4. asteen hypofysiitti. Mediaaniaika hypofysiitin ilmaantumiseen oli 5,9 kuukautta (vaihteluväli: 1 vuorokausi - 17,7 kuukautta). Hypofysiitin keston mediaani oli 3,6 kuukautta (vaihteluväli: 3 vuorokautta - yli 48,1 kuukautta). Hypofysiitti johti pembrolitsumabihoidon lopettamiseen 14 potilaalla (0,2 %). Hypofysiitti parani 23 potilaalla, joista kahdeksalla oli jälkiseurauksia.
Pembrolitsumabia saaneista potilaista 394:llä (5,2 %) esiintyi hypertyreoosia, ja heistä 108:lla (1,4 %) oli 2. asteen ja 9:llä (0,1 %) 3. asteen hypertyreoosi. Mediaaniaika hypertyreoosin ilmaantumiseen oli 1,4 kuukautta (vaihteluväli: 1 vuorokausi - 23,2 kuukautta). Hypertyreoosin keston mediaani oli 1,6 kuukautta (vaihteluväli: 4 vuorokautta - yli 43,1 kuukautta). Hypertyreoosi johti pembrolitsumabihoidon lopettamiseen 4 potilaalla (0,1 %). Hypertyreoosi parani 326 potilaalla (82,7 %), joista yhdellätoista oli jälkiseurauksia.
Melanoomaa, ei-pienisoluista keuhkosyöpää tai munuaissolukarsinoomaa sairastaneilla potilailla, jotka saivat pembrolitsumabimonoterapiaa adjuvanttihoitona (n = 2 060), hypertyreoosin ilmaantuvuus oli 11,0 % ja useimmat tapaukset olivat vaikeusastetta 1 tai 2.
Pembrolitsumabia saaneista potilaista 939:llä (12,3 %) esiintyi hypotyreoosia, ja heistä 687:llä (9,0 %) oli 2. asteen ja kahdeksalla (0,1 %) oli 3. asteen hypotyreoosi. Mediaaniaika hypotyreoosin ilmaantumiseen oli 3,4 kuukautta (vaihteluväli: 1 vuorokausi - 25,9 kuukautta). Hypotyreoosin keston mediaania ei saavutettu (vaihteluväli: 2 vuorokautta - yli 63,0 kuukautta). Hypotyreoosi johti pembrolitsumabihoidon lopettamiseen kuudella potilaalla (0,1 %). Hypotyreoosi parani 216 potilaalla (23,0 %), joista 16:lla oli jälkiseurauksia. Klassista Hodgkinin lymfoomaa sairastavilla potilailla (n = 389) hypotyreoosin ilmaantuvuus oli 17 %, ja kaikki tapaukset olivat vaikeusastetta 1 tai 2. Pään ja kaulan alueen uusiutunutta tai metastasoitunutta levyepiteelikarsinoomaa sairastavilla potilailla, jotka saivat pembrolitsumabimonoterapiaa (n = 909), hypotyreoosin ilmaantuvuus oli 16,1 % (kaikki vaikeusasteet); 3. asteen hypotyreoosin ilmaantuvuus oli 0,3 %. Pembrolitsumabia yhdistelmänä platinaa ja 5‑fluorourasiilia sisältävän solunsalpaajahoidon kanssa saaneilla potilailla, joilla oli pään ja kaulan alueen uusiutunut tai metastasoitunut levyepiteelikarsinooma (n = 276), hypotyreoosin ilmaantuvuus oli 15,2 %, ja kaikki tapaukset olivat vaikeusastetta 1 tai 2. Leikkaukseen soveltuvaa, paikallisesti edennyttä pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla, jotka saivat pembrolitsumabia neoadjuvanttihoitona ja yhdistelmänä sädehoidon sekä mahdollisen samanaikaisen sisplatiinihoidon kanssa adjuvanttihoitona (n = 361), hypotyreoosin ilmaantuvuus oli 24,7 %, ja kaikki tapaukset olivat vaikeusastetta 1 tai 2. Pembrolitsumabia yhdistelmänä aksitinibin tai lenvatinibin kanssa saaneilla potilailla (n = 1 456) hypotyreoosin ilmaantuvuus oli 46,2 % (kaikki vaikeusasteet), ja 0,8 % tapauksista oli vaikeusastetta 3 tai 4. Melanoomaa, ei-pienisoluista keuhkosyöpää tai munuaissolukarsinoomaa sairastaneilla potilailla, jotka saivat pembrolitsumabimonoterapiaa adjuvanttihoitona (n = 2 060), hypotyreoosin ilmaantuvuus oli 18,5 % ja useimmat tapaukset olivat vaikeusastetta 1 tai 2.
Immuunivälitteiset haittavaikutukset iholla
Pembrolitsumabia saaneista potilaista 130:llä (1,7 %) esiintyi immuunivälitteisiä vaikeita ihoreaktioita, ja heistä 11:llä (0,1 %) oli 2. asteen, 103:lla (1,3 %) 3. asteen, yhdellä (< 0,1 %) 4. asteen ja yhdellä (< 0,1 %) 5. asteen immuunijärjestelmään liittyviä vaikeita ihoreaktioita. Mediaaniaika vaikeiden ihoreaktioiden ilmaantumiseen oli 2,8 kuukautta (vaihteluväli: 2 päivää - 25,5 kuukautta). Keston mediaani oli 1,9 kuukautta (vaihteluväli: 1 päivä - yli 47,1 kuukautta). Vaikeat ihoreaktiot johtivat pembrolitsumabihoidon lopettamiseen 18 potilaalla (0,2 %). Vaikeat ihoreaktiot paranivat 95 potilaalla, joista kahdella oli jälkiseurauksia.
Harvinaisia Stevens-Johnsonin oireyhtymä- ja toksinen epidermaalinen nekrolyysi -tapauksia on todettu (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Jotkut näistä ovat johtaneet kuolemaan.
Allogeenisen hematopoieettisen kantasolujen siirron komplikaatiot klassisen Hodgkinin lymfooman yhteydessä
KEYNOTE‑013-tutkimuksessa 14 potilasta sai allogeenisen hematopoieettisen kantasolusiirteen pembrolitsumabihoidon jälkeen. Heistä kuudella raportoitiin akuutti käänteishyljintä ja yhdellä krooninen käänteishyljintä. Yksikään tapauksista ei johtanut kuolemaan. Kahdella potilaalla ilmeni maksan veno-okklusiivinen tauti. Toinen näistä tapauksista johti kuolemaan. Yhdellä potilaalla ilmeni engraftment-oireyhtymä kantasolujen siirron jälkeen.
KEYNOTE‑087-tutkimuksessa 32 potilasta sai allogeenisen hematopoieettisen kantasolusiirteen pembrolitsumabihoidon jälkeen. Heistä 16:lla raportoitiin akuutti käänteishyljintä ja 7:llä krooninen käänteishyljintä. Kaksi näistä tapauksista johti kuolemaan. Yhdelläkään potilaalla ei ilmennyt maksan veno-okklusiivista tautia. Yhdelläkään potilaalla ei ilmennyt engraftment-oireyhtymää kantasolujen siirron jälkeen.
KEYNOTE‑204-tutkimuksessa 14 potilasta sai allogeenisen hematopoieettisen kantasolusiirteen pembrolitsumabihoidon jälkeen. Heistä kahdeksalla raportoitiin akuutti käänteishyljintä ja kolmella krooninen käänteishyljintä. Yksikään näistä tapauksista ei johtanut kuolemaan. Yhdelläkään potilaalla ei ilmennyt maksan veno-okklusiivista tautia. Yhdellä potilaalla ilmeni engraftment-oireyhtymä kantasolujen siirron jälkeen.
Maksaentsyymiarvojen kohoaminen, kun pembrolitsumabia käytetään yhdessä aksitinibin kanssa munuaissolukarsinooman hoidossa
Kliinisessä tutkimuksessa, jossa pembrolitsumabia annettiin yhdistelmänä aksitinibin kanssa munuaissolukarsinoomaa sairastaville potilaille, jotka eivät olleet aiemmin saaneet hoitoa, havaittiin odotettua suuremmalla ilmaantuvuudella ALAT-arvon kohoamista (20 %) ja ASAT-arvon kohoamista (13 %), jotka olivat vaikeusastetta 3 tai 4. Mediaaniaika ALAT-arvon nousun ilmaantumiseen oli 2,3 kuukautta (vaihteluväli 7 vuorokautta – 19,8 kuukautta). 94 %:lla potilaista, joiden ALAT-arvo oli ≥ 3 kertaa ULN (vaikeusasteet 2–4, n = 116), ALAT-arvo laski vaikeusasteeseen 0 tai 1. 59 % potilaista, joiden ALAT-arvo kohosi, sai systeemisiä kortikosteroideja. Potilaista, joilla arvot palautuivat, 92:lla (84 %) hoito aloitettiin uudelleen joko pembrolitsumabimonoterapiana (3 %) tai aksitinibimonoterapiana (31 %) tai molemmilla valmisteilla (50 %). Näistä potilaista 55 %:lla ALAT-arvo ei kohonnut uudelleen suuremmaksi kuin 3 kertaa ULN, ja kaikilla potilailla, joiden ALAT-arvo kohosi uudelleen suuremmaksi kuin 3 kertaa ULN, arvot palautuivat. Maksaan liittyviä 5. asteen tapahtumia ei ilmennyt.
Laboratorioarvojen poikkeavuudet
Pembrolitsumabimonoterapiaa saaneilla potilailla niiden potilaiden osuudet, joiden laboratorioarvot muuttuivat lähtötilanteesta vaikeusasteen 3 tai 4 poikkeavuuksiksi, olivat seuraavat: vähentynyt lymfosyyttien määrä 9,9 %, pienentynyt natriumarvo 7,3 %, pienentynyt hemoglobiiniarvo 5,7 %, kohonnut glukoosiarvo 4,6 %, pienentynyt fosfaattiarvo 4,5 %, kohonnut ALAT-arvo 3,1 %, kohonnut ASAT-arvo 2,9 %, kohonnut alkalisen fosfataasin arvo 2,6 %, pienentynyt kaliumarvo 2,2 %, vähentynyt neutrofiilien määrä 2,1 %, kohonnut bilirubiiniarvo 1,7 %, vähentynyt verihiutaleiden määrä 1,7 %, kohonnut kaliumarvo 1,7 %, kohonnut kalsiumarvo 1,6 %, pienentynyt albumiiniarvo 1,4 %, pienentynyt kalsiumarvo 1,3 %, kohonnut kreatiniiniarvo 1,2 %, vähentynyt leukosyyttien määrä 0,8 %, kohonnut magnesiumarvo 0,8 %, pienentynyt glukoosiarvo 0,6 %, pienentynyt magnesiumarvo 0,2 % ja kohonnut natriumarvo 0,2 %.
Pembrolitsumabin ja solunsalpaajan, sädehoidon tai kemosädehoidon yhdistelmää saaneilla potilailla niiden potilaiden osuudet, joiden laboratorioarvot muuttuivat lähtötilanteesta vaikeusasteen 3 tai 4 poikkeavuuksiksi, olivat seuraavat: vähentynyt neutrofiilien määrä 36,2 %, vähentynyt lymfosyyttien määrä 31,9 %, vähentynyt leukosyyttien määrä 23,7 %, pienentynyt hemoglobiiniarvo 20,3 %, vähentynyt verihiutaleiden määrä 11,8 %, pienentynyt natriumarvo 9,6 %, pienentynyt kaliumarvo 7,8 %, pienentynyt fosfaattiarvo 7,2 %, kohonnut glukoosiarvo 5,5 %, kohonnut ALAT-arvo 5,2 %, kohonnut ASAT-arvo 4,6 %, pienentynyt kalsiumarvo 3,4 %, kohonnut bilirubiiniarvo 3,0 %, kohonnut kaliumarvo 3,0 %, kohonnut kreatiniiniarvo 2,9 %, kohonnut alkalisen fosfataasin arvo 2,4 %, pienentynyt albumiiniarvo 2,2 %, kohonnut kalsiumarvo 1,6 %, pienentynyt glukoosiarvo 0,8 % ja kohonnut natriumarvo 0,4 %.
Pembrolitsumabia yhdistelmänä aksitinibin tai lenvatinibin kanssa saaneilla potilailla niiden potilaiden osuudet, joiden laboratorioarvot muuttuivat lähtötilanteesta vaikeusasteen 3 tai 4 poikkeavuuksiksi, olivat seuraavat: kohonnut lipaasiarvo 23,0 % (ei mitattu pembrolitsumabia ja aksitinibia saaneilta potilailta), vähentynyt lymfosyyttien määrä 12,3 %, pienentynyt natriumarvo 11,4 %, kohonneet amylaasiarvot 11,2 %, kohonneet triglyseridiarvot 11,2 %, kohonnut ALAT-arvo 10,4 %, kohonnut ASAT-arvo 8,9 %, kohonnut glukoosiarvo 7,8 %, pienentynyt fosfaattiarvo 6,8 %, pienentynyt kaliumarvo 6,1 %, kohonnut kaliumarvo 5,1 %, kohonneet kolesteroliarvot 4,5 %, kohonnut kreatiniiniarvo 4,4 %, pienentynyt hemoglobiiniarvo 4,2 %, vähentynyt neutrofiilien määrä 4,0 %, kohonnut alkalisen fosfataasin arvo 3,1 %, vähentynyt verihiutaleiden määrä 3,0 %, kohonnut bilirubiiniarvo 2,8 %, pienentynyt kalsiumarvo 2,2 %, kohonnut magnesiumarvo 2,2 %, vähentynyt leukosyyttien määrä 1,7 %, pienentynyt magnesiumarvo 1,5 %, kohonnut protrombiini-INR 1,5 %, pienentynyt glukoosiarvo 1,4 %, pienentynyt albumiiniarvo 1,2 %, kohonnut kalsiumarvo 1,0 %, kohonnut natriumarvo 0,4 % ja kohonnut hemoglobiiniarvo 0,1 %.
Immunogeenisuus
Kliinisissä tutkimuksissa, joihin osallistuneet potilaat saivat pembrolitsumabia monoterapiana annoksella 2 mg/kg kolmen viikon välein, 200 mg kolmen viikon välein tai 10 mg/kg kahden tai kolmen viikon välein, arvioitavissa olleista 2 034 potilaasta 36 potilaalla (1,8 %) todettiin hoidon aikana ilmaantuneita pembrolitsumabin vasta-aineita, ja näistä 9 potilaalla (0,4 %) oli neutraloivia vasta-aineita pembrolitsumabia vastaan. Pembrolitsumabia sitovan tai neutraloivan vasta-aineen kehittymiseen liittyvästä muuttuneesta farmakokinetiikasta tai turvallisuusprofiilista ei ollut näyttöä.
Pediatriset potilaat
Pembrolitsumabin turvallisuutta monoterapiana on arvioitu vaiheen I/II KEYNOTE-051-tutkimuksessa 161 pediatrisella potilaalla, jotka olivat 9 kuukautta – 17 vuotta vanhoja ja joilla oli edennyt melanooma, lymfooma tai PD-L1-positiivisia, edenneitä, relapsoituneita tai refraktorisia kiinteitä kasvaimia, annoksella 2 mg/kg 3 viikon välein. Klassista Hodgkinin lymfoomaa sairastavaan potilasjoukkoon (n = 22) kuului 11–17-vuotiaita potilaita. Turvallisuusprofiili pediatrisilla potilailla oli yleisesti ottaen samanlainen kuin on todettu pembrolitsumabilla hoidetuilla aikuisilla. Yleisimpiä haittavaikutuksia (ilmoitettiin vähintään 20 %:lla pediatrisista potilaista) olivat kuume (33 %), oksentelu (30 %), päänsärky (26 %), vatsakipu (22 %), anemia (21 %), yskä (21 %) ja ummetus (20 %). Suurin osa monoterapian yhteydessä ilmoitetuista haittavaikutuksista oli vaikeusastetta 1 tai 2. Seitsemälläkymmenelläkuudella (47,2 %) potilaalla oli vähintään 1 asteen 3-5 haittavaikutus, ja näistä potilaista viidellä (3,1 %) oli vähintään 1 kuolemaan johtanut haittavaikutus. Esiintymistiheydet perustuvat kaikkiin ilmoitettuihin haittavaikutuksiin riippumatta tutkijalääkärin arvioimasta syy-yhteydestä. Tällä hetkellä ei ole saatavilla pitkän aikavälin turvallisuustietoja pembrolitsumabin käytöstä adjuvanttihoitona levinneisyysasteen IIB, IIC tai III melanoomaa sairastavilla nuorilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Pembrolitsumabin yliannostuksesta ei ole tietoja.
Yliannostustapauksissa potilaan tilaa on seurattava tarkoin haittavaikutuksiin viittaavien oireiden tai löydösten havaitsemiseksi, ja oireenmukainen hoito on aloitettava tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, PD-1/PDL-1 (ohjelmoitunut solukuolema) proteiini 1 / ligandi 1) estäjät. ATC-koodi: L01FF02
Vaikutusmekanismi
KEYTRUDA on humanisoitu monoklonaalinen vasta-aine, joka sitoutuu PD‑1 (programmed cell death‑1) ‑reseptoriin ja salpaa sen vuorovaikutuksen ligandien PD‑L1 ja PD‑L2 kanssa. PD-1-reseptori on T-solujen aktiivisuuden negatiivinen säätelijä, jonka on osoitettu osallistuvan T-soluihin liittyvien immuunivasteiden säätelyyn. KEYTRUDA tehostaa T-soluvasteita, kuten kasvainten kasvua ehkäiseviä vasteita, estämällä PD-1-reseptoria sitoutumasta PD‑L1- ja PD‑L2-ligandeihin, joita ilmentyy antigeeneja esittelevissä soluissa ja saattaa ilmentyä kasvaimissa tai muissa soluissa kasvaimen mikroympäristössä.
Lenvatinibin (monikohdennettu tyrosiinikinaasin estäjä) antiangiogeeninen vaikutus yhdistettynä pembrolitsumabin (PD‑1-vasta-aine) immuunijärjestelmää stimuloivaan vaikutukseen johtaa T-solujen aktivaation lisääntymiseen kasvaimen mikroympäristössä. Tämä auttaa ohittamaan primaarisen ja hankitun resistenssin immuunihoidolle ja saattaa parantaa kasvaimissa todettavia vasteita verrattuna kumpaan tahansa hoitoon käytettynä yksinään. Prekliinisissä hiirimalleissa PD‑1-reseptorin estäjien ja tyrosiinikinaasin estäjien yhdistelmillä on osoitettu olevan tehokkaampi kasvaimen kasvua ehkäisevä vaikutus kuin kummallakaan lääkeaineella yksinään.
Kliininen teho ja turvallisuus
Pembrolitsumabia arvioitiin kolmen viikon välein annetulla annoksella 2 mg/kg, kolmen viikon välein annetulla annoksella 10 mg/kg ja kahden viikon välein annetulla annoksella 10 mg/kg melanoomaa tai aiemmin hoidettua ei-pienisoluista keuhkosyöpää koskeneissa kliinisissä tutkimuksissa. Pembrolitsumabin tehoon ja turvallisuuteen liittyvien annos-altistussuhteiden mallintamisen ja simulaation perusteella tehossa tai turvallisuudessa ei havaittu kliinisesti merkittäviä eroja seuraavien annosten välillä: 200 mg kolmen viikon välein, 2 mg/kg kolmen viikon välein ja 400 mg kuuden viikon välein (ks. kohta Annostus ja antotapa).
Melanooma
KEYNOTE-006: Kontrolloitu tutkimus melanoomapotilailla, jotka eivät olleet aiemmin saaneet ipilimumabia
Pembrolitsumabin turvallisuutta ja tehoa selvitettiin kontrolloidussa avoimessa, vaiheen III KEYNOTE-006-monikeskustutkimuksessa edenneen melanooman hoidossa potilailla, jotka eivät olleet aiemmin saaneet ipilimumabia. Potilaat satunnaistettiin (1:1:1) saamaan pembrolitsumabia annoksella 10 mg/kg kahden (n = 279) tai kolmen viikon (n = 277) välein tai ipilimumabia annoksella 3 mg/kg kolmen viikon välein (n = 278). BRAF V600E ‑mutaatiopositiivista melanoomaa sairastavilta potilailta ei vaadittu edeltävää hoitoa BRAF-estäjällä.
Pembrolitsumabihoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Potilaat, joiden kliininen tila oli vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaittiin, saivat jatkaa hoitoa, kunnes taudin eteneminen varmistui. Kasvaimen tila arvioitiin viikolla 12, sen jälkeen 6 viikon välein viikolle 48 asti ja tämän jälkeen 12 viikon välein.
Tutkimuksen 834 potilaasta 60 % oli miehiä, 44 % oli ≥ 65-vuotiaita (mediaani-ikä oli 62 vuotta [ikäjakauma: 18–89 vuotta]) ja 98 % oli valkoihoisia. Potilaista 65 %:lla oli levinneisyysluokan M1c tauti, 9 %:lla oli aiemmin todettu etäpesäkkeitä aivoissa, 66 % ei ollut saanut aiemmin hoitoa ja 34 % oli saanut yhden aiemman hoidon. Potilaista 31 %:lla ECOG-toimintakykyluokka oli 1, 69 %:lla ECOG-toimintakykyluokka oli 0 ja 32 %:lla LDH-arvo oli koholla ja 302 potilaalla (36 %) ilmoitettiin olevan BRAF-mutaatio. Potilaista, joiden kasvaimessa oli BRAF-mutaatio, 139 (46 %) oli saanut aiemmin hoitoa BRAF-estäjällä.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS [Progression Free Survival], joka perustui RECIST 1.1 ‑kriteeristöä [Response Evaluation Criteria in Solid Tumours] käyttäen tehtyyn IRO-arvioon [Integrated Radiology and Oncology Assessment, yhdistetty radiologinen ja onkologinen arvio]), ja kokonaiselinaika (OS, Overall Survival). Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR, Objective Response Rate) ja vasteen kesto. Taulukossa 3 on tiivistelmä keskeisistä tehon mittareista potilailla, jotka eivät olleet aiemmin saaneet ipilimumabia lopullisessa analyysissä, joka tehtiin vähintään 21 kuukautta kestäneen seurannan jälkeen. Lopulliseen analyysiin perustuvat Kaplan-Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä on esitetty kuvissa 1 ja 2.
Taulukko 3: KEYNOTE-006-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 10 mg/kg 3 viikon välein n = 277 | Pembrolitsumabi 10 mg/kg 2 viikon välein n = 279 | Ipilimumabi 3 mg/kg 3 viikon välein n = 278 |
| OS | |||
| Potilaat (%), joilla todettiin tapahtuma | 119 (43 %) | 122 (44 %) | 142 (51 %) |
| Riskisuhde* (95 % CI) | 0,68 (0,53, 0,86) | 0,68 (0,53, 0,87) | --- |
| p-arvo† | < 0,001 | < 0,001 | --- |
| Mediaani, kk (95 % CI) | Ei saavutettu (24, NA) | Ei saavutettu (22, NA) | 16 (14, 22) |
| PFS | |||
| Potilaat (%), joilla todettiin tapahtuma | 183 (66 %) | 181 (65 %) | 202 (73 %) |
| Riskisuhde* (95 % CI) | 0,61 (0,50, 0,75) | 0,61 (0,50, 0,75) | --- |
| p-arvo† | < 0,001 | < 0,001 | --- |
| Mediaani, kk (95 % CI) | 4,1 (2,9, 7,2) | 5,6 (3,4, 8,2) | 2,8 (2,8, 2,9) |
| Paras objektiivinen vaste | |||
| ORR % (95 % CI) | 36 % (30, 42) | 37 % (31, 43) | 13 % (10, 18) |
| Täydellinen vaste | 13 % | 12 % | 5 % |
| Osittainen vaste | 23 % | 25 % | 8 % |
| Vasteen kesto‡ | |||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,0, 22,8+) | Ei saavutettu (1,8, 22,8+) | Ei saavutettu (1,1+, 23,8+) |
| Jatkuu edelleen 18 kk:n kuluttua, % | 68 %§ | 71 %§ | 70 %§ |
| * Riskisuhde (pembrolitsumabi ipilimumabiin verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank -testin perusteella ‡ Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena § Perustuu Kaplan-Meier-arvioon NA = ei käytettävissä | |||
Kuva 1: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE-006-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
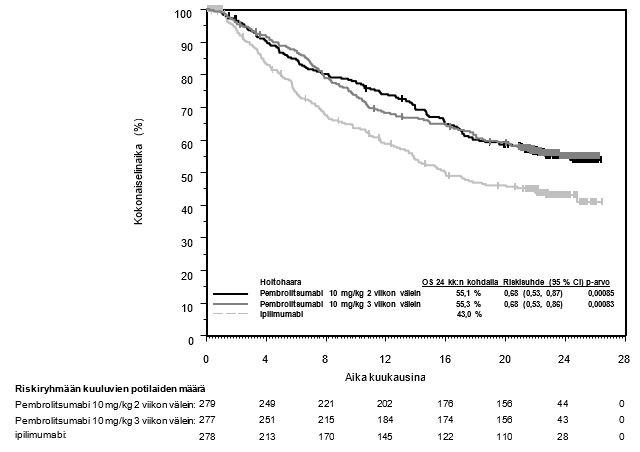
Kuva 2: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE-006-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
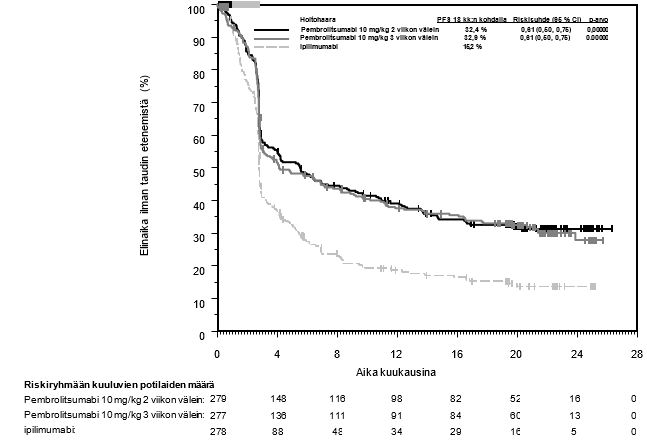
KEYNOTE-002: Kontrolloitu tutkimus aiemmin ipilimumabia saaneilla melanoomapotilailla
Pembrolitsumabin turvallisuutta ja tehoa tutkittiin kontrolloidussa kaksoissokkoutetussa KEYNOTE‑002-monikeskustutkimuksessa edenneen melanooman hoidossa potilailla, jotka olivat aikaisemmin saaneet ipilimumabia ja, jos melanooma oli BRAF V600 ‑mutaatiopositiivinen, BRAF- tai MEK-estäjää. Potilaat jaettiin satunnaistetusti (1:1:1) ryhmiin, jotka saivat pembrolitsumabia 2 mg/kg (n = 180) tai 10 mg/kg (n = 181) kolmen viikon välein tai solunsalpaajahoitoa (n = 179; solunsalpaajat olivat dakarbatsiini, temotsolomidi, karboplatiini, paklitakseli tai karboplatiini + paklitakseli). Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai jotka saivat immunosuppressiivista hoitoa. Muita poissulkukriteerejä olivat aiemmin ipilimumabihoidosta saadut vaikeat tai hengenvaaralliset immuunivälitteiset haittavaikutukset (mikä tahansa 4. asteen toksinen vaikutus tai 3. asteen toksinen vaikutus, joka vaati kortikosteroidihoitoa [prednisonia tai vastaavaa yli 10 mg/vrk] yli 12 viikon ajan); edelleen jatkuvat aiemman ipilimumabihoidon aiheuttamat vähintään 2. asteen haittavaikutukset; aikaisemmin todettu vaikea yliherkkyys muille monoklonaalisille vasta-aineille; aiemmin todettu pneumoniitti tai interstitiaalinen keuhkosairaus, tai HIV-, B-hepatiitti- tai C-hepatiitti-infektio ja ECOG-toimintakykyluokka ≥ 2.
Pembrolitsumabihoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Potilaat, joiden kliininen tila oli vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaittiin, saivat jatkaa hoitoa, kunnes taudin eteneminen varmistui. Kasvaimen tila arvioitiin viikolla 12, sen jälkeen 6 viikon välein viikolle 48 asti ja tämän jälkeen 12 viikon välein. Solunsalpaajahoitoa saavat potilaat, joilla taudin eteneminen oli vahvistettu riippumattomasti ensimmäisen aikataulunmukaisen taudin arvioinnin jälkeen, saivat siirtyä toiseen hoitohaaraan, jossa heille annettiin pembrolitsumabia kaksoissokkoutetusti joko 2 mg/kg tai 10 mg/kg kolmen viikon välein.
Tutkimuksen 540 potilaasta 61 % oli miehiä, 43 % oli ≥ 65-vuotiaita (mediaani-ikä oli 62 vuotta [ikäjakauma: 15–89 vuotta]) ja 98 % oli valkoihoisia. Potilaista 82 prosentilla oli levinneisyysluokan M1c tauti, 73 % oli saanut aikaisemmin vähintään kahta ja 32 % vähintään kolmea systeemistä hoitoa edenneeseen melanoomaan. Potilaista 45 prosentilla ECOG-toimintakykyluokka oli 1, 40 prosentilla LDH-arvo oli koholla ja 23 prosentilla kasvaimessa oli BRAF-mutaatio.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS [Progression Free Survival], joka perustui RECIST 1.1 ‑kriteeristöä [Response Evaluation Criteria in Solid Tumours] käyttäen tehtyyn IRO-arvioon [Integrated Radiology and Oncology Assessment, yhdistetty radiologinen ja onkologinen arvio]), ja kokonaiselinaika (OS, Overall Survival). Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR, Objective Response Rate) ja vasteen kesto. Taulukossa 4 on tiivistelmä keskeisistä tehon mittareista lopullisessa analyysissä aiemmin ipilimumabia saaneilla potilailla, ja kuvassa 3 on Kaplan-Meier-kuvaaja elinajasta ilman taudin etenemistä. Tulokset kummassakin pembrolitsumabin hoitohaarassa olivat paremmat kuin solunsalpaajahoitohaarassa elinajassa ilman taudin etenemistä eikä pembrolitsumabin annosten välillä ollut eroa. Pembrolitsumabin ja solunsalpaajahoidon välillä ei ollut tilastollisesti merkitsevää eroa kokonaiselinajan lopullisessa analyysissä, jossa ei otettu huomioon hoitohaarasta toiseen siirtymisen mahdollisia sekoittavia vaikutuksia. Solunsalpaajahoitohaaraan satunnaistetuista potilaista 55 % siirtyi toiseen hoitohaaraan ja hoitoa jatkettiin pembrolitsumabilla.
Taulukko 4: KEYNOTE-002-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 2 mg/kg 3 viikon välein n = 180 | Pembrolitsumabi 10 mg/kg 3 viikon välein n = 181 | Solunsalpaajahoito n = 179 |
| PFS | |||
| Potilaat (%), joilla todettiin tapahtuma | 150 (83 %) | 144 (80 %) | 172 (96 %) |
| Riskisuhde* (95 % CI) | 0,58 (0,46, 0,73) | 0,47 (0,37, 0,60) | --- |
| p-arvo† | < 0,001 | < 0,001 | --- |
| Mediaani, kk (95 % CI) | 2,9 (2,8, 3,8) | 3,0 (2,8, 5,2) | 2,8 (2,6, 2,8) |
| OS | |||
| Potilaat (%), joilla todettiin tapahtuma | 123 (68 %) | 117 (65 %) | 128 (72 %) |
| Riskisuhde* (95 % CI) | 0,86 (0,67, 1,10) | 0,74 (0,57, 0,96) | --- |
| p-arvo† | 0,1173 | 0,0106‡ | --- |
| Mediaani, kk (95 % CI) | 13,4 (11,0, 16,4) | 14,7 (11,3, 19,5) | 11,0 (8,9, 13,8) |
| Paras objektiivinen vaste | |||
| ORR % (95 % CI) | 22 % (16, 29) | 28 % (21, 35) | 5 % (2, 9) |
| Täydellinen vaste | 3 % | 7 % | 0 % |
| Osittainen vaste | 19 % | 20 % | 5 % |
| Vasteen kesto§ | |||
| Mediaani, kk (vaihteluväli) | 22,8 (1,4+, 25,3+) | Ei saavutettu (1,1+, 28,3+) | 6,8 (2,8, 11,3) |
| Jatkuu edelleen 12 kk:n kuluttua, % | 73 % ¶ | 79 % ¶ | 0 % ¶ |
| * Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank ‑testin perusteella ‡ Ei tilastollista merkitsevyyttä kerrannaisuuden suhteen tehdyn korjauksen jälkeen § Perustuu lopullisen analyysin tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena ¶ Perustuu Kaplan-Meier-arvioon | |||
Kuva 3: Kaplan-Meier-kuvaaja elinajasta ilman taudin etenemistä hoitohaaroittain KEYNOTE-002-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
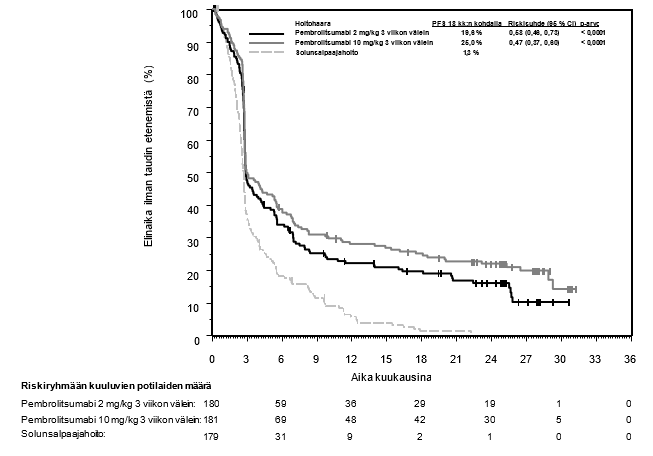
KEYNOTE-001: Avoin tutkimus aikaisemmin ipilimumabihoitoa saaneilla melanoomapotilailla jamelanoomapotilailla, jotka eivät olleet aiemmin saaneet ipilimumabihoitoa
Pembrolitsumabin turvallisuutta ja tehoa tutkittiin ei-kontrolloidussa avoimessa KEYNOTE-001-tutkimuksessa potilailla, joilla oli edennyt melanooma. Tehon arviointi tehtiin kahden määritellyn tutkimushaaran 276 potilaasta. Toisen tutkimushaaran potilaat olivat saaneet aikaisemmin ipilimumabihoitoa (ja BRAF- tai MEK-estäjää, jos kasvain oli BRAF V600 ‑mutaatiopositiivinen), ja toisen haaran potilaat eivät olleet saaneet ipilimumabia. Potilaille annettiin satunnaistetusti pembrolitsumabia 2 mg/kg kolmen viikon välein tai 10 mg/kg kolmen viikon välein. Pembrolitsumabihoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Potilaat, joiden kliininen tila oli vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaittiin, saivat jatkaa hoitoa, kunnes taudin eteneminen varmistui. Poissulkukriteerit olivat samat kuin KEYNOTE‑002-tutkimuksessa.
Pembrolitsumabiannosta 2 mg/kg saaneista 89 potilaasta, jotka olivat aikaisemmin saaneet ipilimumabihoitoa, 53 % oli miehiä, 33 % oli ≥ 65-vuotiaita ja mediaani-ikä oli 59 vuotta (ikäjakauma: 18–88 vuotta). Kahta potilasta lukuun ottamatta kaikki potilaat olivat valkoihoisia. Potilaista 84 prosentilla oli levinneisyysluokan M1c tauti ja 8 prosentilla oli aikaisemmin todettu aivometastaasi. Potilaista 70 % oli saanut aikaisemmin vähintään kahta ja 35 % vähintään kolmea systeemistä hoitoa edenneeseen melanoomaan. BRAF-mutaatioita raportoitiin 13 prosentilla tutkimuspopulaatiosta. Kaikki potilaat, joiden kasvaimessa oli BRAF-mutaatio, olivat saaneet aiemmin BRAF-estäjää.
Pembrolitsumabiannosta 2 mg/kg saaneista 51 potilaasta, jotka eivät olleet aikaisemmin saaneet ipilimumabihoitoa, 63 % oli miehiä, 35 % oli ≥ 65-vuotiaita ja mediaani-ikä oli 60 vuotta (ikäjakauma: 35–80 vuotta). Yhtä potilasta lukuun ottamatta kaikki potilaat olivat valkoihoisia. Potilaista 63 prosentilla oli levinneisyysluokan M1c tauti ja 2 prosentilla oli aikaisemmin todettu aivometastaasi. Potilaista 45 % ei ollut saanut aikaisemmin hoitoa edenneeseen melanoomaan. BRAF-mutaatioita raportoitiin 20 potilaalla (39 %). Potilaista, joiden kasvaimessa oli BRAF-mutaatio, 10 (50 %) oli saanut aiemmin hoitoa BRAF-estäjällä.
Tehoa mittaava ensisijainen lopputulosmuuttuja oli riippumattomaan arviointiin perustuva objektiivisten vasteiden osuus (ORR). Riippumattomassa arvioinnissa käytettiin RECIST 1.1 ‑kriteeristöä. Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat niiden potilaiden osuus, joilla oli hallinnassa oleva tauti (DCR, sisältää täydellisen vasteen, osittaisen vasteen ja vakaan taudin), vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika (OS). Kasvaimen vaste arvioitiin 12 viikon välein. Taulukossa 5 on tiivistelmä tärkeimmistä tehon mittareista aikaisemmin ipilimumabihoitoa saaneilla potilailla ja potilailla, jotka eivät olleet aiemmin saaneet ipilimumabihoitoa. Potilaat saivat pembrolitsumabia annoksena 2 mg/kg. Taulukon tiedot perustuvat vähintään 30 kuukauden seuranta-aikaan, joka koski kaikkia potilaita.
Taulukko 5: KEYNOTE-001-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 2 mg/kg kolmen viikon välein – aikaisemmin ipilimumabia saaneet potilaat n = 89 | Pembrolitsumabi 2 mg/kg kolmen viikon välein – potilaat, jotka eivät olleet aikaisemmin saaneet ipilimumabia n = 51 |
| IRO-arvioon†perustuva paras objektiivinen vaste* | ||
| ORR % (95 % CI) | 26 % (17, 36) | 35 % (22, 50) |
| Täydellinen vaste | 7 % | 12 % |
| Osittainen vaste | 19 % | 24 % |
| Hallinnassa oleva tauti, %‡ | 48 % | 49 % |
| Vasteen kesto§ | ||
| Mediaani, kk (vaihteluväli) | 30,5 (2,8+, 30,6+) | 27,4 (1,6+, 31,8+) |
| Jatkuu edelleen 24 kk:n kuluttua¶, % | 75 % | 71 % |
| PFS | ||
| Mediaani, kk (95 % CI) | 4,9 (2,8, 8,3) | 4,7 (2,8, 13,8) |
| PFS-osuus 12 kk:n kuluttua | 34 % | 38 % |
| Kokonaiselinaika (OS) | ||
| Mediaani, kk (95 % CI) | 18,9 (11, ei käytettävissä) | 28,0 (14, ei käytettävissä) |
| Kokonaiselossaolo-osuus 24 kk:n kuluttua | 44 % | 56 % |
| * Sisältää potilaita, joilla ei lähtötilanteessa ollut mitattavissa olevaa tautia riippumattoman radiologisen arvion mukaan † IRO = Yhdistetty radiologinen ja onkologinen arvio (Integrated radiology and oncologist assessment) RECIST 1.1 ‑kriteeristöä käyttäen ‡ Perustuu parhaaseen vasteeseen, joka on stabiili tauti tai parempi § Perustuu potilaisiin, joiden hoitovaste on vahvistettu riippumattomassa arvioinnissa, alkaen päivästä, jona vaste ensimmäisen kerran rekisteröitiin; aiemmin ipilimumabihoitoa saaneet potilaat, n = 23; potilaat, jotka eivät olleet aiemmin saaneet ipilimumabia, n = 18 ¶ Perustuu Kaplan-Meier-arvioon | ||
Sekä aikaisemmin ipilimumabihoitoa saaneiden (n = 84) että niiden potilaiden, jotka eivät olleet saaneet ipilimumabia (n = 52), hoitotulokset olivat samanlaiset ryhmässä, joka sai pembrolitsumabia 10 mg/kg kolmen viikon välein, ja ryhmässä, joka sai pembrolitsumabia 2 mg/kg kolmen viikon välein.
Alaryhmäanalyysit
BRAF-mutaatiostatus melanoomassa
KEYNOTE-002-tutkimuksen lopullisen analyysin osana tehtiin alaryhmäanalyysi potilailla, joilla oli villityypin BRAF (n = 414; 77 %) tai potilailla, joilla oli BRAF-mutaatio ja jotka olivat aiemmin saaneet BRAF-hoitoa (n = 126; 23 %). Tiivistelmä alaryhmäanalyysistä on taulukossa 6.
Taulukko 6: KEYNOTE-002-tutkimuksen tehoa koskevat tulokset BRAF-mutaatiostatuksen mukaan
| BRAF-villityyppi | BRAF-mutaatiopositiivinen potilas, joka oli aiemmin saanut BRAF-hoitoa | |||
| Päätetapahtuma | Pembrolitsumabi 2 mg/kg 3 viikon välein (n = 136) | Solunsalpaajahoito (n = 137) | Pembrolitsumabi 2 mg/kg 3 viikon välein (n = 44) | Solunsalpaajahoito (n = 42) |
| PFS riskisuhde* (95 % CI) | 0,50 (0,39, 0,66) | --- | 0,79 (0,50, 1,25) | --- |
| OS riskisuhde* (95 % CI) | 0,78 (0,58, 1,04) | --- | 1,07 (0,64, 1,78) | --- |
| ORR % | 26 % | 6 % | 9 % | 0 % |
| * Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||
KEYNOTE-006-tutkimuksen lopullisen analyysin osana tehtiin alaryhmäanalyysi potilailla, joilla oli villityypin BRAF (n = 525; 63 %) tai joilla oli BRAF-mutaatio eivätkä he olleet aiemmin saaneet BRAF-hoitoa (n = 163; 20 %) tai joilla oli BRAF-mutaatio ja he olivat aiemmin saaneet BRAF-hoitoa (n = 139; 17 %). Tiivistelmä alaryhmäanalyysistä on taulukossa 7.
Taulukko 7: KEYNOTE-006-tutkimuksen tehoa koskevat tulokset BRAF-mutaatiostatuksen mukaan
| BRAF-villityyppi | BRAF-mutaatiopositiivinen potilas, joka ei ollut aiemmin saanut BRAF-hoitoa | BRAF-mutaatiopositiivinen potilas, joka oli aiemmin saanut BRAF-hoitoa | ||||
| Päätetapahtuma | Pembrolitsumabi 10 mg/kg 2 tai 3 viikon välein (yhdistetty) | Ipilimumabi (n = 170) | Pembrolitsumabi 10 mg/kg 2 tai 3 viikon välein (yhdistetty) | Ipilimumabi (n = 55) | Pembrolitsumabi 10 mg/kg 2 tai 3 viikon välein (yhdistetty) | Ipilimumabi (n = 52) |
| PFS riskisuhde* (95 % CI) | 0,61 (0,49, 0,76) | --- | 0,52 (0,35, 0,78) | --- | 0,76 (0,51, 1,14) | --- |
| OS riskisuhde* (95 % CI) | 0,68 (0,52, 0,88) | --- | 0,70 (0,40, 1,22) | --- | 0,66 (0,41, 1,04) | --- |
| ORR % | 38 % | 14 % | 41 % | 15 % | 24 % | 10 % |
| * Riskisuhde (pembrolitsumabi ipilimumabiin verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||||
PD-L1-status melanoomassa
KEYNOTE-002-tutkimuksen lopullisen analyysin osana tehdyssä alaryhmäanalyysissä verrattiin PD-L1-positiivisia potilaita (PD-L1 ilmentyy vähintään 1 %:ssa kasvainsoluista ja kasvaimeen liittyvistä immuunisoluista suhteessa kaikkiin elinkykyisiin kasvainsoluihin – MEL-pistemäärä (MEL Score)) PD‑L1-negatiivisiin potilaisiin. PD‑L1:n ilmentymistä tutkittiin retrospektiivisesti immunohistokemiallisella analyysillä (IHC-analyysillä) käyttäen 22C3 PD-L1 ‑vasta-ainetta. Niistä potilaista, joista voitiin arvioida PD-L1:n ilmentyminen (79 %), 69 % (n = 294) oli PD‑L1-positiivisia ja 31 % (n = 134) oli PD-L1-negatiivisia. Taulukossa 8 on tiivistelmä tehoa koskevista tuloksista PD-L1:n ilmentymisen mukaan.
Taulukko 8: KEYNOTE-002-tutkimuksen tehoa koskevat tulokset PD-L1:n ilmentymisen mukaan
| Päätetapahtuma | Pembrolitsumabi 2 mg/kg 3 viikon välein | Solunsalpaajahoito | Pembrolitsumabi 2 mg/kg 3 viikon välein | Solunsalpaajahoito |
| PD‑L1-positiiviset | PD‑L1-negatiiviset | |||
| PFS riskisuhde* (95 % CI) | 0,55 (0,40, 0,76) | --- | 0,81 (0,50, 1,31) | --- |
| OS riskisuhde* (95 % CI) | 0,90 (0,63, 1,28) | --- | 1,18 (0,70, 1,99) | --- |
| ORR % | 25 % | 4 % | 10 % | 8 % |
| * Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||
KEYNOTE-006-tutkimuksen lopullisen analyysin osana tehdyssä alaryhmäanalyysissä verrattiin PD-L1-positiivisia potilaita (n = 671; 80 %) PD-L1-negatiivisiin potilaisiin (n = 150; 18 %). Potilaista, joista voitiin arvioida PD-L1:n ilmentyminen (98 %), 82 % oli PD‑L1-positiivisia ja 18 % oli PD-L1-negatiivisia. Taulukossa 9 on tiivistelmä tehoa koskevista tuloksista PD-L1:n ilmentymisen mukaan.
Taulukko 9: KEYNOTE-006-tutkimuksen tehoa koskevat tulokset PD-L1:n ilmentymisen mukaan
| Päätetapahtuma | Pembrolitsumabi 10 mg/kg 2 tai 3 viikon välein (yhdistetty) | Ipilimumabi | Pembrolitsumabi 10 mg/kg 2 tai 3 viikon välein (yhdistetty) | Ipilimumabi |
| PD‑L1-positiiviset | PD‑L1-negatiiviset | |||
| PFS riskisuhde* (95 % CI) | 0,53 (0,44, 0,65) | --- | 0,87 (0,58, 1,30) | --- |
| OS riskisuhde* (95 % CI) | 0,63 (0,50, 0,80) | --- | 0,76 (0,48, 1,19) | --- |
| ORR % | 40 % | 14 % | 24 % | 13 % |
| * Riskisuhde (pembrolitsumabi ipilimumabiin verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||
Silmän melanooma
KEYNOTE-001-tutkimukseen osallistuneilla 20 tutkittavalla, joilla oli silmän melanooma, ei raportoitu objektiivisia vasteita. Kuudella potilaalla taudin ilmoitettiin olevan vakaa.
KEYNOTE‑716: Lumekontrolloitu tutkimus, jossa arvioitiin adjuvanttihoitoa potilailla, joiden levinneisyysasteen IIB tai IIC melanooma oli poistettu leikkauksella
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑716-monikeskustutkimuksessa arvioitiin pembrolitsumabin tehoa potilailla, joiden levinneisyysasteen IIB tai IIC melanooma oli poistettu leikkauksella. Yhteensä 976 potilasta satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg 3 viikon välein (tai pediatrista [12–17-vuotiaille tarkoitettua] annosta 2 mg/kg [enintään 200 mg] laskimoon 3 viikon välein) (n = 487) tai lumelääkettä (n = 489) enintään vuoden ajan tai kunnes tauti uusiutui tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Satunnaistaminen stratifioitiin AJCC:n (American Joint Committee on Cancer) julkaiseman luokituskäsikirjan 8. painoksen mukaisen T-luokan mukaan. Potilaat, joilla oli aktiivinen autoimmuunisairaus, immunosuppressiota edellyttävä sairaus tai limakalvon tai silmän melanooma, eivät soveltuneet tutkimukseen. Potilaat eivät soveltuneet tutkimukseen, jos melanoomaa oli aiemmin hoidettu muilla tavoilla kuin kirurgisesti. Satunnaistamisen jälkeen potilaille tehtiin kuvantamistutkimus kuuden kuukauden välein, kunnes satunnaistamisesta oli kulunut neljä vuotta, ja tämän jälkeen kerran viidentenä vuonna satunnaistamisesta; mikäli tauti uusiutui tätä aiemmin, kuvantamistutkimukset lopetettiin taudin uusiutumisen yhteydessä.
976 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 61 vuotta (vaihteluväli: 16–87; 39 % oli vähintään 65-vuotiaita; 2 potilasta oli nuoria [yksi kummassakin hoitohaarassa]); 60 % oli miehiä; ja 93 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 7 %:lla ECOG-toimintakykyluokka oli 1. 64 %:lla potilaista taudin levinneisyysaste oli IIB ja 35 %:lla IIC.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli tutkijalääkärin arvioima elinaika ilman taudin uusiutumista (recurrence free survival, RFS) koko tutkimuspopulaatiossa. Elinaika ilman taudin uusiutumista määriteltiin ajaksi satunnaistamispäivästä päivään, jolloin tauti uusiutui ensimmäisen kerran (paikallinen uusiutuma, alueellinen uusiutuma tai systeeminen etäpesäke), tai kuolemaan, sen mukaan, kumpi tapahtui ensin. Toissijaiset lopputulosmuuttujat olivat elinaika ilman systeemisiä etäpesäkkeitä (distant metastasis‑free survival, DMFS) ja kokonaiselinaika (OS) koko tutkimuspopulaatiossa. Kokonaiselinaikaa ei arvioitu muodollisesti tämän analyysin tekovaiheessa. Tutkimus osoitti ensin, että pembrolitsumabihaaraan satunnaistetuilla potilailla elinajat ilman taudin uusiutumista (riskisuhde 0,65; 95 %:n luottamusväli 0,46, 0,92; p‑arvo = 0,00658) olivat lumehaaraan verrattuna tilastollisesti merkitsevästi parantuneet etukäteen määritellyn välianalyysin kohdalla. Taulukossa 10 on esitetty yhteenveto elinaikaa ilman taudin uusiutumista koskevan ennalta määritellyn lopullisen analyysin tuloksista, kun seuranta-ajan mediaani oli 20,5 kuukautta. Elinaikaa ilman taudin uusiutumista koskevat tulokset päivitettiin, kun seuranta-ajan mediaani oli 38,5 kuukautta. Päivitetyt tulokset vastasivat tuloksia elinaikaa ilman taudin uusiutumista koskevasta lopullisesta analyysistä, jossa verrattiin pembrolitsumabihaaraan ja lumehaaraan satunnaistettuja potilaita (riskisuhde 0,62; 95 %:n luottamusväli 0,49, 0,79) (ks. kuva 4). Etukäteen määritelty välianalyysi tehtiin, kun seuranta-ajan mediaani oli 26,9 kuukautta. Tällöin tutkimuksessa osoitettiin, että elinaika ilman systeemisiä etäpesäkkeitä oli tilastollisesti merkitsevästi pidempi (riskisuhde 0,64 [95 %:n luottamusväli 0,47, 0,88; p-arvo = 0,00292]) pembrolitsumabihaaraan satunnaistetuilla potilailla verrattuna lumehaaraan satunnaistettuihin potilaisiin. Taulukossa 10 ja kuvassa 5 esitetään yhteenveto etukäteen määritellyn lopullisen analyysin DMFS‑tuloksista, kun seuranta-ajan mediaani oli 38,5 kuukautta.
Taulukko 10: KEYNOTE‑716-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 487 | Lumelääke
n = 489 |
| RFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 72 (15 %) | 115 (24 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (29,9, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,61 (0,45, 0,82) | |
| p-arvo (ositettu log rank)† | 0,00046 | |
| DMFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 74 (15,2 %) | 119 (24,3 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (ei saavutettu, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,59 (0,44, 0,79) | |
* Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan
† Nimellinen p-arvo; perustuu log rank ‑testiin; ositettu AJCC:n (American Joint Committee on Cancer) julkaiseman luokituskäsikirjan 8. painoksen mukaisen T-luokan mukaan.
Kuva 4: Kaplan–Meier‑kuvaaja elinajasta ilman taudin uusiutumista hoitohaaroittain KEYNOTE‑716-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
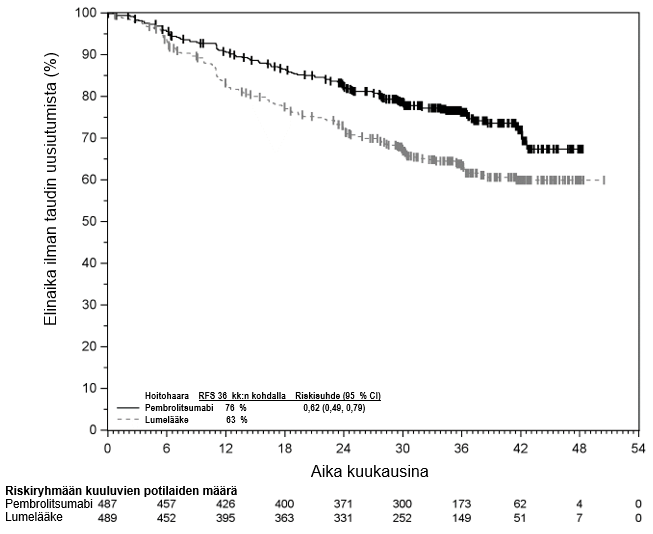
Kuva 5: Kaplan–Meier‑kuvaaja elinajasta ilman systeemisiä etäpesäkkeitä hoitohaaroittain KEYNOTE‑716-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
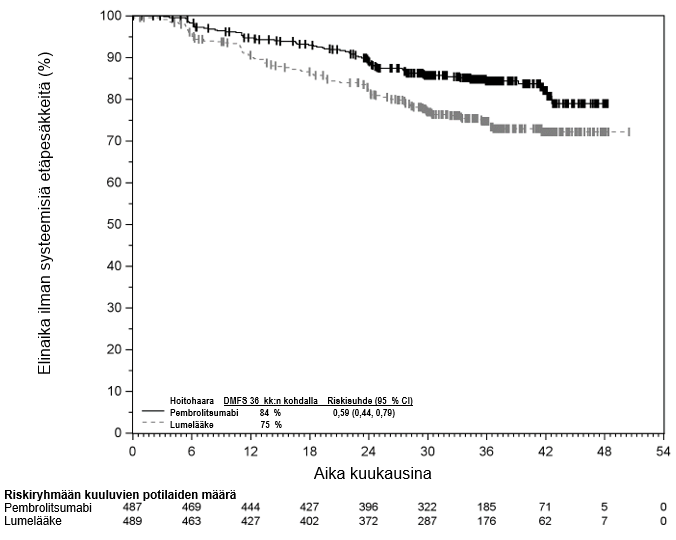
KEYNOTE-054: Lumekontrolloitu tutkimus, jossa arvioitiin adjuvanttihoitoa potilailla, joille on tehty levinneisyysasteen III melanooman täydellinen poistoleikkaus
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa KEYNOTE‑054 arvioitiin pembrolitsumabin tehoa potilailla, joille oli tehty levinneisyysasteen IIIA (imusolmuke-etäpesäke > 1 mm), IIIB tai IIIC melanooman täydellinen poistoleikkaus. Yhteensä 1 019 aikuista potilasta satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg 3 viikon välein (n = 514) tai lumelääkettä (n = 505) enintään vuoden ajan, kunnes tauti uusiutui tai ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä. Satunnaistaminen stratifioitiin AJCC:n julkaiseman luokituskäsikirjan 7. painoksen mukaisen levinneisyysasteen (IIIA tai IIIB tai IIIC, 1–3 positiivista imusolmuketta, tai IIIC, ≥ 4 positiivista imusolmuketta) ja maantieteellisen alueen (Pohjois-Amerikka, Euroopan maat, Australia ja muut mainitut maat) mukaan. Edellytyksenä oli, että potilaille oli tehty imusolmukedissektio, ja he olivat tarvittaessa saaneet sädehoitoa hoidon aloitusta edeltävien 13 viikon aikana. Potilaat, joilla oli aktiivinen autoimmuunisairaus, immunosuppressiota edellyttävä sairaus tai limakalvon tai silmän melanooma, eivät soveltuneet tutkimukseen. Potilaat eivät soveltuneet tutkimukseen, jos melanoomaa oli aiemmin hoidettu muilla tavoilla kuin kirurgisesti tai interferoneilla, kun kyseessä olivat paksut primaarimelanoomat eikä imusolmukkeiden osallisuudesta ollut näyttöä. Potilaille tehtiin kuvantamistutkimus 12 viikon välein ensimmäisen pembrolitsumabiannoksen antamisen jälkeen kahden ensimmäisen vuoden ajan, sitten 6 kuukauden välein vuosina 3–5 ja sen jälkeen kerran vuodessa.
1 019 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 54 vuotta (25 % oli vähintään 65‑vuotiaita), miehiä 62 %, ja 94 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 6 %:lla ECOG-toimintakykyluokka oli 1. 16 %:lla potilaista taudin levinneisyysaste oli IIIA; 46 %:lla IIIB; 18 %:lla IIIC (1–3 positiivista imusolmuketta) ja 20 %:lla IIIC (≥ 4 positiivista imusolmuketta); 50 % potilaista oli BRAF V600 ‑mutaatiopositiivisia ja 44 %:lla oli villityypin BRAF. PD‑L1:n ilmentymistä tutkittiin retrospektiivisesti immunohistokemiallisella analyysillä käyttäen 22C3 PD‑L1 ‑vasta-ainetta; 84 %:lla potilaista oli PD‑L1-positiivinen melanooma (PD‑L1 ilmentyy vähintään 1 %:ssa kasvainsoluista ja kasvaimeen liittyvistä immuunisoluista suhteessa kaikkiin elinkykyisiin kasvainsoluihin). Samaa pisteytysjärjestelmää (MEL-pistemäärä) käytettiin metastasoituneen melanooman yhteydessä.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat tutkijalääkärin arvioima elinaika ilman taudin uusiutumista (RFS) koko tutkimuspopulaatiossa ja populaatiossa, jossa potilailla oli PD‑L1-positiivisia kasvaimia. Elinaika ilman taudin uusiutumista määriteltiin ajaksi satunnaistamispäivästä päivään, jolloin tauti uusiutui ensimmäisen kerran (paikallinen, alueellinen tai systeeminen etäpesäke), tai kuolemaan, sen mukaan, kumpi tapahtui ensin. Toissijaiset lopputulosmuuttujat olivat elinaika ilman systeemisiä etäpesäkkeitä (DMFS) ja kokonaiselinaika (OS) koko tutkimuspopulaatiossa ja populaatiossa, jossa potilailla oli PD‑L1-positiivisia kasvaimia. Kokonaiselinaikaa ei arvioitu muodollisesti näiden analyysien tekovaiheessa. Tutkimus osoitti ensin, että pembrolitsumabihaaraan satunnaistetuilla potilailla elinajat ilman taudin uusiutumista (riskisuhde 0,57; 98,4 %:n luottamusväli 0,43, 0,74; p-arvo < 0,0001) olivat lumehaaraan verrattuna tilastollisesti merkitsevästi parantuneet etukäteen määritellyn välianalyysin kohdalla. Taulukossa 11 ja kuvissa 6 ja 7 on esitetty yhteenveto päivitetyistä tehoa koskevista tuloksista, kun seuranta-ajan mediaani oli 45,5 kuukautta.
Taulukko 11: KEYNOTE‑054-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 514 | Lumelääke
n = 505 |
| RFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 203 (40 %) | 288 (57 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu | 21,4 (16,3, 27,0) |
| Riskisuhde* (95 % CI) | 0,59 (0,49, 0,70) | |
| DMFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 173 (34 %) | 245 (49 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu | 40,0 (27,7, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,60 (0,49, 0,73) | |
| p-arvo(ositettu log rank) | < 0,0001 | |
| * Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||
Kuva 6: Kaplan-Meier-kuvaaja elinajalle ilman taudin uusiutumista hoitohaaroittain KEYNOTE-054-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
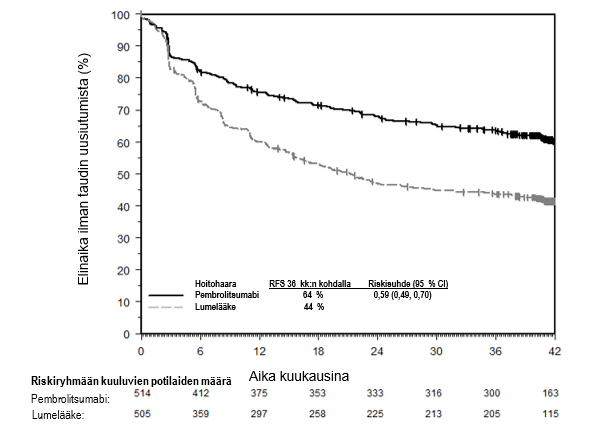
Kuva 7: Kaplan-Meier-kuvaaja elinajalle ilman systeemisiä etäpesäkkeitä hoitohaaroittain KEYNOTE-054-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
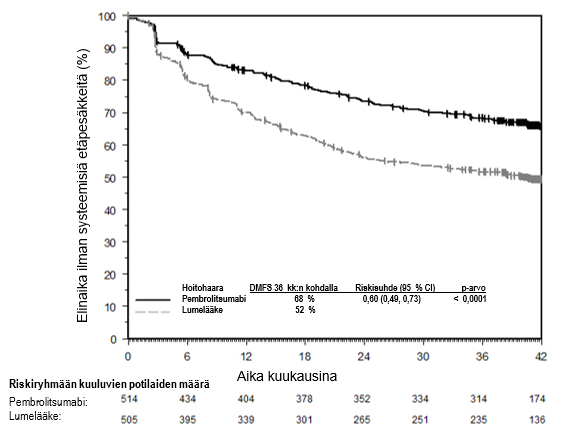
Hyöty elinajassa ilman taudin uusiutumista ja elinajassa ilman systeemisiä etäpesäkkeitä osoitettiin johdonmukaisesti kaikissa alaryhmissä, mukaan lukien PD‑L1:n ilmentyminen, BRAF-mutaatiostatus ja taudin levinneisyysaste (AJCC-käsikirjan 7. painoksen mukaisesti). Nämä tulokset olivat yhdenmukaisia post hoc -analyysissä, jossa luokitus tehtiin uudelleen nykyisen AJCC-käsikirjan 8. painoksen luokituksen mukaisesti.
Ei-pienisoluinen keuhkosyöpä
KEYNOTE-671: Kontrolloitu tutkimus, jossa arvioitiin neoadjuvantti- ja adjuvanttihoitoa potilailla, joilla on leikkaukseen soveltuva ei-pienisoluinen keuhkosyöpä
KEYNOTE-671 oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus. Tutkimuksessa arvioitiin pembrolitsumabin tehoa, kun sitä annettiin yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa neoadjuvanttihoitona ja valmisteen käyttöä jatkettiin sen jälkeen adjuvanttihoidossa monoterapiana. Keskeiset sisäänottokriteerit olivat aiemmin hoitamaton, leikkaukseen soveltuva ei-pienisoluinen keuhkosyöpä ja suuri taudin uusiutumisriski (levinneisyysaste II, IIIA tai IIIB (N2) AJCC:n 8. painoksen mukaan), riippumatta kasvaimen PD-L1-ligandin ilmentymisestä PD-L1 IHC 22C3 pharmDxTM -testin perusteella. Kasvaimen genomipoikkeavuuksien tai onkogeenisten ajurimutaatioiden määritys ei ollut edellytys osallistumiselle.
Seuraavien valintakriteerien perusteella määrittyvät potilaat, joilla on käyttöaiheen mukainen tauti ja suuri taudin uusiutumisen riski; kriteerit kuvastavat levinneisyysluokituksen 8. painoksen mukaan määriteltyä levinneisyysasteiden II–IIIB (N2) potilaspopulaatiota: kasvaimen koko > 4 cm; tai minkä tahansa kokoiset kasvaimet, jos potilaan imusolmukkeiden etäpesäkestatus on N1 tai N2; tai kasvaimet, jotka ovat tunkeutuneet rintakehän rakenteisiin (suora invaasio ulompaan keuhkopussinlehteen, rintakehän seinämään, palleaan, palleahermoon, välikarsinanmyötäiseen keuhkopussiin, parietaaliseen sydänpussiin, välikarsinaan, sydämeen, suuriin verisuoniin, henkitorveen, palaavahermoon, ruokatorveen, nikamansolmuun tai henkitorven harjuun); tai pääkeuhkoputkea affisioivat > 4 cm:n kokoiset kasvaimet; tai > 4 cm:n kokoiset kasvaimet, joiden aiheuttama obstruktiivinen atelektaasi ulottuu keuhkoporttiin; tai yksi tai useampia erillisiä kasvainnoduluksia samassa lohkossa tai eri lohkossa mutta samassa keuhkossa kuin primaarikasvain.
Potilaat saivat tarvittaessa adjuvanttisädehoitoa ennen adjuvanttihoitona annettua pembrolitsumabia tai lumelääkettä. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin levinneisyysasteen (II vs. III), kasvaimen PD-L1:n ilmentymisen (TPS ≥ 50 % tai < 50 %), histologian (levyepiteeliperäinen vs. ei-levyepiteeliperäinen) ja maantieteellisen alueen (Itä-Aasia vs. ei Itä-Aasia) mukaan.
Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- Hoitohaara A: neoadjuvanttihoitona 200 mg pembrolitsumabia kunkin 21 päivän hoitosyklin päivänä 1 yhdistettynä sisplatiiniin 75 mg/m2 ja joko pemetreksediin (500 mg/m2 päivänä 1) tai gemsitabiiniin (1 000 mg/m2 päivinä 1 ja 8) enintään neljän hoitosyklin ajan. Leikkauksen jälkeen annettiin 200 mg pembrolitsumabia kolmen viikon välein enintään 13 hoitosyklin ajan.
- Hoitohaara B: neoadjuvanttihoitona lumelääkettä kunkin 21 päivän hoitosyklin päivänä 1 yhdistettynä sisplatiiniin 75 mg/m2 ja joko pemetreksediin (500 mg/m2 päivänä 1) tai gemsitabiiniin (1 000 mg/m2 päivinä 1 ja 8) enintään neljän hoitosyklin ajan. Leikkauksen jälkeen annettiin lumelääkettä kolmen viikon välein enintään 13 hoitosyklin ajan.
Kaikki tutkimuslääkitykset annettiin infuusiona laskimoon. Hoitoa pembrolitsumabilla tai lumelääkkeellä jatkettiin, kunnes hoito oli saatu päätökseen (17 hoitosykliä), taudin eteneminen sulki pois parantavan leikkaushoidon, tauti uusiutui adjuvanttihoitovaiheessa, tauti eteni potilailla, jotka eivät saaneet leikkaushoitoa tai joille tehtiin epätäydellinen resektio, ja jotka epätäydellisen resektion jälkeen siirtyivät adjuvanttivaiheeseen, tai joille ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Kasvaimen tila arvioitiin neoadjuvanttivaiheen aikana lähtötilanteessa, viikolla 7 ja viikolla 13 sekä 4 viikon sisällä ennen adjuvanttivaiheen alkua. Adjuvanttivaiheen alkamisen jälkeen kasvaimen tila arvioitiin 16 viikon välein 3 vuoden ajan ja sen jälkeen 6 kuukauden välein.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika ja tutkijalääkärin arvioima tapahtumavapaa elinaika (EFS, event-free survival). Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat patologisesti todettujen täydellisten vasteiden osuus (pCR) ja patologisesti todettujen merkittävien vasteiden osuus (mPR), jotka arvioi sokkoutettu riippumaton patologinen arviointitoimikunta (BIPR).
KEYNOTE-671-tutkimuksessa satunnaistettiin yhteensä 797 potilasta: 397 potilasta pembrolitsumabihaaraan ja 400 potilasta lumelääkehaaraan. Lähtötilanteen tiedot olivat: mediaani-ikä 64 vuotta (vaihteluväli: 26–83); 45 % vähintään 65-vuotiaita; 71 % miehiä; 61 % valkoihoisia, 31 % aasialaisia ja 2 % mustaihoisia. 63 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 37 %:lla 1; 30 %:lla oli levinneisyysasteen II ja 70 %:lla levinneisyysasteen III tauti; 33 %:lla TPS-pistemäärä oli ≥ 50 % ja 67 %:lla < 50 %; 43 %:lla kasvain oli histologisesti levyepiteeliperäinen ja 57 %:lla histologisesti ei-levyepiteeliperäinen; 31 % potilaista oli kotoisin Itä-Aasian alueelta. Neljällä prosentilla potilaista oli EGFR-mutaatioita ja 66 %:lla EGFR-mutaatiostatus ei ollut tiedossa. Kolmella prosentilla potilaista oli ALK:n translokaatio ja 68 %:lla ALK:n translokaatiostatus ei ollut tiedossa.
Pembrolitsumabia ja platinapohjaista solunsalpaajahoitoa saaneiden haarassa 81 %:lle potilaista tehtiin parantava leikkaus, kun taas platinapohjaista solunsalpaajahoitoa saaneiden haarassa 76 %:lle potilaista tehtiin parantava leikkaus.
Tutkimus osoitti, että kokonaiselinaika (OS), tapahtumavapaa elinaika (EFS), patologisesti todettujen täydellisten vasteiden osuus (pCR) ja patologisesti todettujen merkittävien vasteiden osuus (mPR) olivat tilastollisesti merkitsevästi paremmat potilailla, jotka satunnaistettiin saamaan pembrolitsumabia yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa ja sen jälkeistä pembrolitsumabimonoterapiaa, verrattuna potilaisiin, jotka saivat lumelääkettä yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa ja sen jälkeen pelkkää lumelääkettä. Ennalta määritellyssä välianalyysissa (seuranta-ajan mediaani 21,4 kuukautta [vaihteluväli: 0,4–50,6 kuukautta]) EFS:n riskisuhde oli 0,58 (95 %:n luottamusväli 0,46, 0,72; p < 0,0001) potilailla, jotka satunnaistettiin saamaan pembrolitsumabia yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa ja sen jälkeistä pembrolitsumabimonoterapiaa, verrattuna potilaisiin, jotka saivat lumelääkettä yhdistelmänä platinapohjaisen solunsalpaajahoidon kanssa ja sen jälkeen pelkkää lumelääkettä. Analyysin tekohetkellä kokonaiselinaikaa koskevien tulosten täyttä maturiteettia ei ollut vielä saavutettu.
Taulukossa 12 on yhteenveto keskeisistä tehon mittareista ennalta määritellyssä välianalyysissa, kun seuranta-ajan mediaani oli 29,8 kuukautta (vaihteluväli: 0,4–62,0 kuukautta). Kaplan–Meier-kuvaajat kokonaiselinajasta ja tapahtumavapaasta elinajasta on esitetty kuvissa 8 ja 9.
Taulukko 12: KEYNOTE-671-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi ja solunsalpaajahoito/pembrolitsumabi n = 397 | Lumelääke ja solunsalpaajahoito/lumelääke n = 400 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 110 (28 %) | 144 (36 %) |
| Mediaani, kk* (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | 52,4 (45,7, ei saavutettu) |
| Riskisuhde† (95 % CI) | 0,72 (0,56, 0,93) | |
| p-arvo‡ | 0,00517 | |
| EFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 174 (44 %) | 248 (62 %) |
| Mediaani, kk* (95 % CI) | 47,2 (32,9, ei saavutettu) | 18,3 (14,8, 22,1) |
| Riskisuhde† (95 % CI) | 0,59 (0,48, 0,72) | |
| * Perustuu Kaplan–Meier‑estimaatteihin † Perustuu Coxin regressiomalliin, jossa kovariaattina on hoito; ositus levinneisyysasteen, kasvaimen PD‑L1:n ilmentymisen, histologian ja maantieteellisen alueen mukaan ‡ Perustuu ositettuun log rank ‑testiin | ||
Kuva 8: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE-671-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
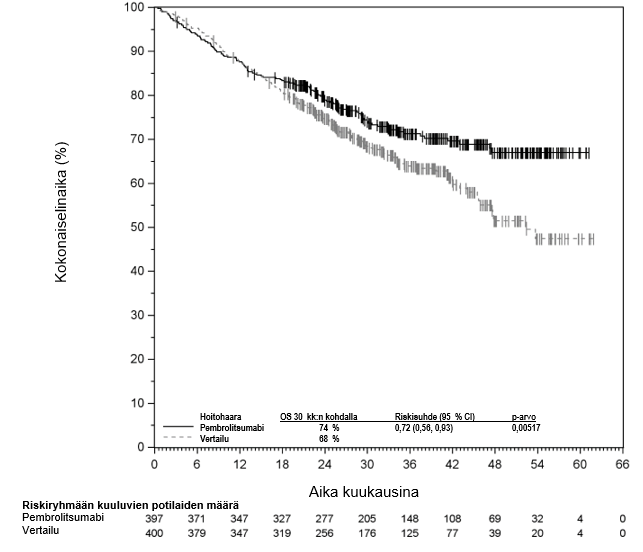
Kuva 9: Kaplan–Meier-kuvaaja tapahtumavapaalle elinajalle hoitohaaroittain KEYNOTE-671-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
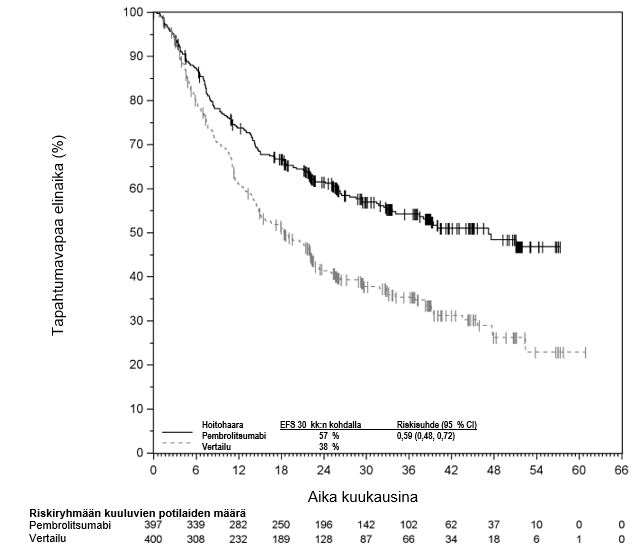
KEYNOTE-671-tutkimuksessa tehtiin eksploratiivinen post-hoc alaryhmäanalyysi potilailla, joiden PD-L1:n TPS oli ≥ 50 % (pembrolitsumabihaara [n = 132; 33 %] vs. lumelääkehaara [n = 134; 34 %]); 1–49 % (pembrolitsumabihaara [n = 127; 32 %] vs. lumelääkehaara [n = 115; 29 %]) tai < 1 % (pembrolitsumabihaara [n = 138; 35 %] vs. lumelääkehaara [n = 151; 38 %]). Tapahtumavapaan elinajan riskisuhde oli 0,48 (95 %:n luottamusväli 0,33, 0,71) potilailla, joiden TPS oli ≥ 50 %, 0,52 (95 %:n luottamusväli 0,36, 0,73) potilailla, joiden TPS oli 1–49 %, ja 0,75 (95 %:n luottamusväli 0,56, 1,01) potilailla, joiden TPS oli < 1 %. Kokonaiselinajan riskisuhde oli 0,55 (95 %:n luottamusväli 0,33, 0,92) potilailla, joiden TPS oli ≥ 50 %, 0,69 (95 %:n luottamusväli 0,44, 1,07) potilailla, joiden TPS oli 1–49 %, ja 0,91 (95 %:n luottamusväli 0,63, 1,32) potilailla, joiden TPS oli < 1 %.
KEYNOTE-091: Lumekontrolloitu tutkimus, jossa arvioitiin adjuvanttihoitoa potilailla, joiden ei-pienisoluinen keuhkosyöpä on poistettu leikkauksella
Pembrolitsumabin tehoa tutkittiin satunnaistetussa, kolmoissokkoutetussa, lumelääkekontrolloidussa KEYNOTE-091-monikeskustutkimuksessa, johon osallistuneilla ei-pienisoluista keuhkosyöpää sairastavilla potilailla oli suuri taudin uusiutumisriski (levinneisyysaste IB [T2a ≥ 4 cm], II tai IIIA AJCC:n 7. painoksen mukaan) kasvaimen täydellisen poiston jälkeen riippumatta kasvaimen PD-L1-ilmentymisstatuksesta. Potilaat eivät olleet saaneet neoadjuvanttihoitona aiempaa sädehoitoa ja/tai solunsalpaajahoitoa eivätkä he olleet saaneet aiempaa sädehoitoa nykyisen maligniteetin adjuvanttihoitona eikä tällaista sädehoitoa ollut suunnitteilla. Kasvaimen genomipoikkeavuuksien tai onkogeenisten ajurimutaatioiden määritys ei ollut edellytys osallistumiselle.
Seuraavien valintakriteerien perusteella määrittyvät potilaat, joilla on käyttöaiheen mukainen tauti ja suuri taudin uusiutumisen riski; kriteerit kuvastavat levinneisyysluokituksen 7. painoksen mukaan määriteltyä levinneisyysasteiden IB [T2a ≥ 4 cm], II tai IIIA potilaspopulaatiota: kasvaimen koko ≥ 4 cm; tai minkä tahansa kokoiset kasvaimet, jos potilaan imusolmukkeiden etäpesäkestatus on N1 tai N2; tai kasvaimet, jotka ovat tunkeutuneet rintakehän rakenteisiin (suora invaasio ulompaan keuhkopussinlehteen, rintakehän seinämään, palleaan, palleahermoon, välikarsinanmyötäiseen keuhkopussiin, parietaaliseen sydänpussiin, välikarsinaan, sydämeen, suuriin verisuoniin, henkitorveen, palaavahermoon, ruokatorveen, nikamansolmuun tai henkitorven harjuun); tai pääkeuhkoputkessa < 2 cm:n päässä henkitorven harjusta sijaitsevat kasvaimet, jotka eivät kuitenkaan ulotu henkitorven harjuun; tai kasvaimet, joihin liittyy atelektaasi tai obstruktiivinen pneumoniitti koko keuhkossa; tai yksi tai useampia erillisiä kasvainnoduluksia samassa lohkossa tai eri lohkossa mutta samassa keuhkossa kuin primaarikasvain. Tutkimuksessa ei ollut mukana potilaita, joiden imusolmukkeiden etäpesäkestatus oli N2 ja joilla oli myös välikarsinaan, sydämeen, suuriin verisuoniin, henkitorveen, palaavahermoon, ruokatorveen, nikamansolmuun tai henkitorven harjuun tunkeutuvia kasvaimia tai erillisiä kasvainnoduluksia eri lohkossa mutta samassa keuhkossa.
Potilaat olivat voineet saada tai olla saamatta solunsalpaajia adjuvanttihoitona lääkärin suosituksen mukaisesti. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, potilaat, joilla oli immunosuppressiota edellyttävä sairaus, sekä potilaat, jotka olivat saaneet yli 4 hoitosykliä solunsalpaajia adjuvanttihoitona. Satunnaistaminen stratifioitiin levinneisyysasteen (IB vs. II vs. IIIA), adjuvanttihoitona annetun solunsalpaajahoidon (ei adjuvanttisolunsalpaajahoitoa vs. adjuvanttisolunsalpaajahoito), PD-L1-statuksen (TPS < 1 % [negatiivinen] vs. TPS 1–49 % vs. TPS ≥ 50 %) ja maantieteellisen alueen (Länsi-Eurooppa vs. Itä-Eurooppa vs. Aasia vs. muu maailma) mukaan. Potilaat satunnaistettiin (1:1) saamaan 200 mg pembrolitsumabia (n = 590) tai lumelääkettä (n = 587) laskimoon 3 viikon välein.
Hoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST 1.1 ‑kriteerien mukaan taudin uusiutuneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai noin 1 vuoden (18 annoksen) ajan. Potilaille tehtiin kuvantamistutkimus 12 viikon välein ensimmäisen pembrolitsumabiannoksen antamisen jälkeen ensimmäisen vuoden ajan, sen jälkeen 6 kuukauden välein vuosina 2–3 ja sen jälkeen vuosittain vuoden 5 loppuun asti. Vuoden 5 jälkeen kuvantamistutkimuksia tehdään tavanomaisen paikallisen hoitokäytännön mukaisesti.
Satunnaistetuista 1 177 potilaasta 1 010 (86 %) sai adjuvanttihoitona platinapohjaista solunsalpaajahoitoa kasvaimen täydellisen poiston jälkeen. Näiden KEYNOTE-091-tutkimukseen osallistuneiden 1 010 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 64 vuotta (vaihteluväli 35–84), 49 % vähintään 65-vuotiaita, 68 % miehiä, 77 % valkoihoisia, 18 % aasialaisia, ja 86 % oli aiemmin tupakoinut tai tupakoi edelleen. 61 %:lla ECOG-suorituskykyluokka oli 0 ja 39 %:lla 1. 12 %:lla potilaista taudin levinneisyysaste oli IB (T2a ≥ 4 cm), 57 %:lla levinneisyysaste oli II ja 31 %:lla levinneisyysaste oli IIIA. 39 %:lla potilaista kasvaimen PD-L1-ilmentymisen TPS-pistemäärä oli < 1 % (negatiivinen), 33 %:lla potilaista TPS-pistemäärä oli 1–49 % ja 28 %:lla potilaista ≥ 50 %. 7 %:lla oli tiedossa olevia EGFR-mutaatioita, 38 %:lla ei ollut EGFR-mutaatiota ja 56 %:lla EGFR-mutaatiostatus ei ollut tiedossa. 52 % oli Länsi-Euroopasta, 20 % Itä-Euroopasta, 17 % Aasiasta ja 11 % muualta maailmasta.
Ensisijaisia tehoa mittaavia lopputulosmuuttujia olivat tutkijalääkärin arvioima elinaika ilman tautia (disease-free survival, DFS) koko tutkimuspopulaatiossa ja populaatiossa, jolla kasvaimen PD-L1-ilmentymisen TPS-pistemäärä oli ≥ 50 %. Elinaika ilman tautia määriteltiin ajaksi satunnaistamispäivästä päivään, jolloin tauti uusiutui ensimmäisen kerran (paikallinen/alueellinen uusiutuma tai systeeminen etäpesäke), toisen maligniteetin ilmenemiseen tai kuolemaan, sen mukaan, mikä tapahtui ensin. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat tutkijalääkärin arvioima elinaika ilman tautia populaatiossa, jolla kasvaimen PD-L1-ilmentymisen TPS-pistemäärä oli ≥ 1 %, ja kokonaiselinaika koko populaatiossa sekä populaatioissa, joilla kasvaimen PD-L1-ilmentymisen TPS-pistemäärä oli ≥ 50 % tai ≥ 1 %.
Etukäteen määritelty välianalyysi tehtiin, kun seuranta-ajan mediaani oli 32,4 kuukautta (vaihteluväli 0,6–68 kuukautta). Tällöin tutkimuksessa osoitettiin, että elinaika ilman tautia oli koko populaatiossa tilastollisesti merkitsevästi pidempi (riskisuhde 0,76 [95 %:n luottamusväli 0,63, 0,91; p-arvo = 0,0014]) pembrolitsumabihaaraan satunnaistetuilla potilailla verrattuna lumehaaraan satunnaistettuihin potilaisiin. Taulukossa 13 ja kuvassa 10 esitetään yhteenveto tehoa koskevista tuloksista DFS-loppuanalyysin kohdalla niillä potilailla, jotka saivat solunsalpaajia adjuvanttihoitona, kun seuranta-ajan mediaani oli 46,7 kuukautta (vaihteluväli: 0,6–84,2). Analyysin tekohetkellä kokonaiselinaikaa koskevien tulosten täyttä maturiteettia ei ollut vielä saavutettu, ja koko populaatiossa ilmeni vain 58 % ennalta määritellyistä kokonaiselinajan tapahtumista. Kokonaiselinajan eksploratiivinen analyysi viittasi suuntaukseen, jonka mukaan pembrolitsumabi oli parempi kuin lumelääke potilailla, jotka olivat saaneet solunsalpaajia adjuvanttihoitona: riskisuhde oli 0,79 (95 %:n luottamusväli 0,62, 1,01).
Taulukko 13: KEYNOTE‑091-tutkimuksen tehoa koskevat tulokset solunsalpaajia adjuvanttihoitona saaneilla potilailla
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 506 | Lumelääke n = 504 |
| DFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 225 (44 %) | 262 (52 %) |
| Riskisuhde* (95 % CI) | 0,76 (0,64, 0,91) | |
| Mediaani, kk (95 % CI) | 53,8 (46,2, 70,4) | 40,5 (32,9, 47,4) |
* Perustuu Coxin monimuuttujaregressiomalliin
Kuva 10: Kaplan–Meier-kuvaaja elinajalle ilman tautia KEYNOTE‑091-tutkimuksessa (potilailla, jotka saivat solunsalpaajia adjuvanttihoitona) hoitohaaroittain
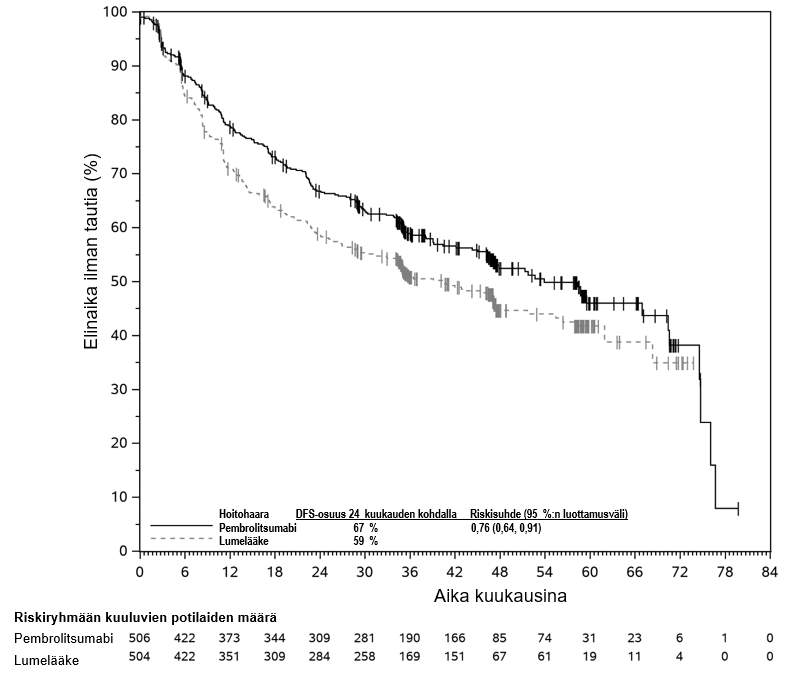
KEYNOTE-024: Kontrolloitu tutkimus ei-pienisoluista keuhkosyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Kontrolloidussa avoimessa monikeskustutkimuksessa KEYNOTE-024 arvioitiin pembrolitsumabin turvallisuutta ja tehoa metastasoituneen ei-pienisoluisen keuhkosyövän hoidossa potilailla, jotka eivät olleet aiemmin saaneet hoitoa. Potilailla oli todettu PD-L1:n ilmentyminen; PD-L1 IHC 22C3 pharmDx TM -testin mukaan tumour proportion score (TPS) oli ≥ 50 %. Potilaat satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg:n annoksella kolmen viikon välein (n = 154) tai tutkijalääkärin valitsemaa platinapohjaista solunsalpaajahoitoa (n = 151; hoitoja olivat pemetreksedin ja karboplatiinin yhdistelmä, pemetreksedin ja sisplatiinin yhdistelmä, gemsitabiinin ja sisplatiinin yhdistelmä, gemsitabiinin ja karboplatiinin yhdistelmä sekä paklitakselin ja karboplatiinin yhdistelmä. Ei-levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavat potilaat saattoivat saada pemetreksediylläpitohoitoa.). Potilaat saivat pembrolitsumabia, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tauti eteni. Hoitoa voitiin jatkaa taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Hoitoa voitiin jatkaa enintään 24 kuukauden ajan potilailla, joiden tauti ei edennyt. Tutkimuksesta suljettiin pois potilaat, joiden kasvaimessa oli EGFR- tai ALK-genomipoikkeavuuksia tai joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus tai jotka olivat saaneet rintakehän alueelle yli 30 Gy:n säteilyannoksen viimeksi kuluneiden 26 viikon aikana. Kasvaimen status arvioitiin 9 viikon välein. Solunsalpaajahoitoa saavat potilaat, joilla taudin eteneminen oli vahvistettu riippumattomasti, saivat siirtyä toiseen hoitohaaraan, jossa heille annettiin pembrolitsumabia.
KEYNOTE-024-tutkimuksen 305 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 65 vuotta (54 % oli vähintään 65-vuotiaita); miehiä 61 %; valkoihoisia 82 % ja aasialaisia 15 %, 35 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 65 %:lla ECOG-toimintakykyluokka oli 1. Sairauden ominaisuudet olivat: levyepiteelikarsinooma (18 %), muu kuin levyepiteelikarsinooma (82 %); M1-luokka (99 %) ja aivojen etäpesäkkeet (9 %).
Ensisijainen tehoa mittaava lopputulosmuuttuja oli elinaika ilman taudin etenemistä (PFS, Progression Free Survival), jonka arvioi sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) käyttämällä RECIST 1.1 ‑kriteerejä. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat kokonaiselinaika (OS) ja objektiivisten vasteiden osuus (ORR) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Taulukossa 14 on tiivistelmä keskeisistä tehon mittareista hoitoaikeen mukaiselle (ITT) potilasjoukolle. Välianalyysin tulokset, jotka koskivat elinaikaa ilman taudin etenemistä ja objektiivisten vasteiden osuutta, on raportoitu, kun seuranta-ajan mediaani oli 11 kuukautta. Lopullisen analyysin tulokset, jotka koskivat kokonaiselinaikaa, on raportoitu, kun seuranta-ajan mediaani oli 25 kuukautta.
Taulukko 14: KEYNOTE-024-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 154 | Solunsalpaajahoito n = 151 |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 73 (47 %) | 116 (77 %) |
| Riskisuhde* (95 % CI) | 0,50 (0,37, 0,68) | |
| p-arvo† | < 0,001 | |
| Mediaani, kk (95 % CI) | 10,3 (6,7, NA) | 6,0 (4,2, 6,2) |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 73 (47 %) | 96 (64 %) |
| Riskisuhde* (95 % CI) | 0,63 (0,47, 0,86) | |
| p-arvo† | 0,002 | |
| Mediaani, kk (95 % CI) | 30,0 (18,3, NA) | 14,2 (9,8, 19,0) |
| Objektiivisten vasteiden osuus | ||
| ORR % (95 % CI) | 45 % (37, 53) | 28 % (21, 36) |
| Täydellinen vaste | 4 % | 1 % |
| Osittainen vaste | 41 % | 27 % |
| Vasteen kesto‡ | ||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (1,9+, 14,5+) | 6,3 (2,1+, 12,6+) |
| %-osuus potilaita, joilla kesto on ≥ 6 kk | 88 %§ | 59 %¶ |
| * Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank ‑testin perusteella ‡ Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena § Perustuu Kaplan-Meierin estimaatteihin; sisältää 43 potilasta, joiden vasteiden kesto oli vähintään 6 kuukautta ¶ Perustuu Kaplan-Meierin estimaatteihin; sisältää 16 potilasta, joiden vasteiden kesto oli vähintään 6 kuukautta NA = ei käytettävissä | ||
Kuva 11: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE-024-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
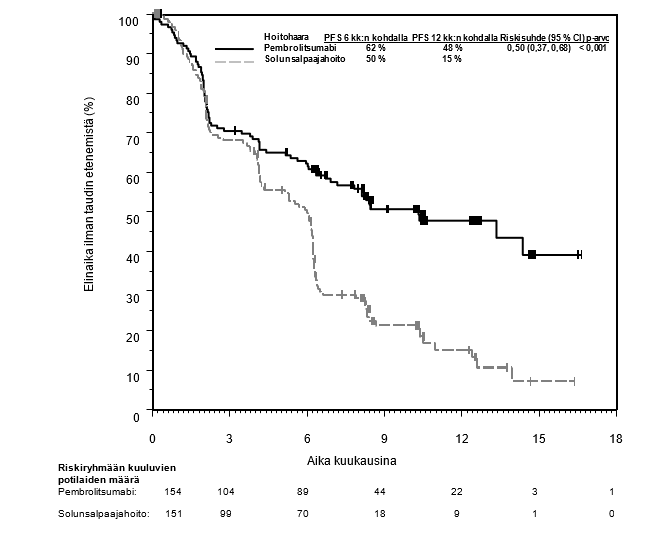
Kuva 12: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE-024-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
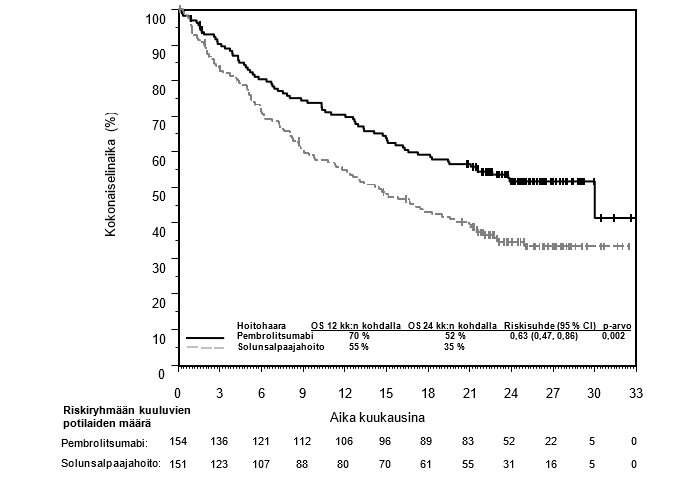
Alaryhmäanalyysissä pembrolitsumabista havaittiin olevan vähemmän hyötyä elossaoloaikaan kemoterapiaan verrattuna sillä pienellä määrällä potilaita, jotka eivät koskaan olleet tupakoineet. Potilaiden pienen määrän vuoksi näistä tuloksista ei kuitenkaan voi tehdä varmoja johtopäätöksiä.
KEYNOTE-042: Kontrolloitu tutkimus ei-pienisoluista keuhkosyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Pembrolitsumabin turvallisuutta ja tehoa arvioitiin myös kontrolloidussa monikeskustutkimuksessa KEYNOTE‑042 paikallisesti edenneen tai metastasoituneen ei-pienisoluisen keuhkosyövän hoidossa potilailla, jotka eivät olleet aiemmin saaneet hoitoa. Tutkimusasetelma oli samankaltainen kuin KEYNOTE‑024-tutkimuksessa, paitsi että potilailla todettu PD-L1:n ilmentymisen TPS oli ≥ 1 % PD-L1 IHC 22C3 pharmDxTM ‑testin mukaan. Potilaat satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg:n annoksella kolmen viikon välein (n = 637) tai tutkijalääkärin valitsemaa platinapohjaista solunsalpaajahoitoa (n = 637; hoitoja olivat pemetreksedin ja karboplatiinin yhdistelmä sekä paklitakselin ja karboplatiinin yhdistelmä. Ei-levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavat potilaat saattoivat saada pemetreksediylläpitohoitoa.). Kasvaimen status arvioitiin ensimmäisten 45 viikon aikana 9 viikon välein ja sen jälkeen 12 viikon välein.
KEYNOTE‑042-tutkimukseen osallistuneista 1 274 potilaasta 599:llä (47 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen TPS oli ≥ 50 % PD-L1 IHC 22C3 pharmDxTM ‑testin mukaan. Näiden 599 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 63 vuotta (45 % oli vähintään 65-vuotiaita); miehiä 69 %; valkoihoisia 63 %, aasialaisia 32 % ja taustaltaan espanjankielisiä tai latinalaisamerikkalaisia 17 %, 31 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 69 %:lla ECOG-toimintakykyluokka oli 1. Sairauden ominaisuudet olivat: levyepiteelikarsinooma (37 %), muu kuin levyepiteelikarsinooma (63 %); levinneisyysaste IIIA (0,8 %); levinneisyysaste IIIB (9 %); levinneisyysaste IV (90 %); ja hoidetut aivojen etäpesäkkeet (6 %).
Ensisijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS). Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat elinaika ilman taudin etenemistä (PFS) ja objektiivisten vasteiden osuus (ORR) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Tutkimus osoitti, että solunsalpaajahoitoon verrattuna kokonaiselinajat olivat tilastollisesti merkitsevästi parantuneet pembrolitsumabimonoterapiahaaraan satunnaistetuilla potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen TPS oli ≥ 1 % (riskisuhde 0,82; 95 %:n luottamusväli 0,71–0,93 lopullisessa analyysissä), ja pembrolitsumabimonoterapiahaaraan satunnaistetuilla potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen TPS oli ≥ 50 %. Taulukossa 15 on tiivistelmä keskeisistä tehon mittareista populaatiolle, jossa TPS oli ≥ 50 %, lopullisessa analyysissä, joka tehtiin, kun seuranta-ajan mediaani oli 15,4 kuukautta. Lopulliseen analyysiin perustuvat Kaplan-Meier-kuvaajat kokonaiselinajalle populaatiossa, jossa TPS oli ≥ 50 %, on esitetty kuvassa 13.
Taulukko 15: KEYNOTE‑042-tutkimuksen tehoa koskevat tulokset (PD-L1:n TPS ≥ 50 %)
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 299 | Solunsalpaajahoito
n = 300 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 180 (60 %) | 220 (73 %) |
| Riskisuhde* (95 % CI) | 0,70 (0,58, 0,86) | |
| p-arvo† | 0,0003 | |
| Mediaani, kk (95 % CI) | 20,0 (15,9, 24,2) | 12,2 (10,4, 14,6) |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 238 (80 %) | 250 (83 %) |
| Riskisuhde* (95 % CI) | 0,84 (0,70, 1,01) | |
| Mediaani, kk (95 % CI) | 6,5 (5,9, 8,5) | 6,4 (6,2, 7,2) |
| Objektiivisten vasteiden osuus | ||
| ORR % (95 % CI) | 39 % (34, 45) | 32 % (27, 38) |
| Täydellinen vaste | 1 % | 0,3 % |
| Osittainen vaste | 38 % | 32 % |
| Vasteen kesto‡ | ||
| Mediaani, kk (vaihteluväli) | 22,0 (2,1+, 36,5+) | 10,8 (1,8+, 30,4+) |
| %-osuus potilaista, joilla kesto on ≥ 18 kk | 57 % | 34 % |
* Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank ‑testin perusteella ‡ Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena | ||
Kuva 13: Kaplan-Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑042-tutkimuksessa (potilailla, joilla PD-L1:n ilmentymistä kuvaava TPS oli ≥ 50 %, hoitoaikeen mukainen potilasjoukko)
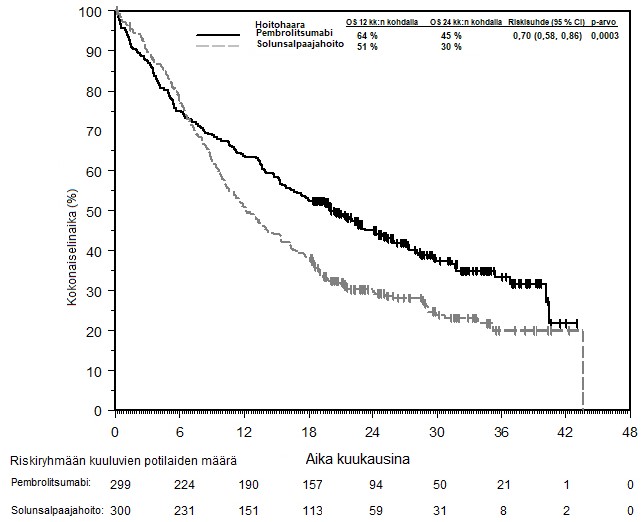
Eksploratiivisen post hoc ‑alaryhmäanalyysin tulokset viittasivat siihen, että pembrolitsumabihoidon yhteydessä elossaoloajalla oli taipumus pidentyä vähemmän solunsalpaajahoitoon verrattuna sekä ensimmäisten neljän kuukauden aikana että koko hoidon keston ajan potilailla, jotka eivät olleet koskaan tupakoineet. Koska tämä alaryhmäanalyysi oli luonteeltaan eksploratiivinen, lopullisia johtopäätöksiä ei kuitenkaan voida tehdä.
KEYNOTE-189: Yhdistelmähoitoa koskeva kontrolloitu tutkimus ei-levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Satunnaistetussa, aktiivikontrolloidussa, kaksoissokkoutetussa monikeskustutkimuksessa KEYNOTE‑189 arvioitiin pembrolitsumabin tehoa yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa. Keskeiset sisäänottokriteerit olivat metastasoitunut ei-levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä, ei aiempaa systeemistä hoitoa metastasoituneeseen ei-pienisoluiseen keuhkosyöpään eikä EGFR- tai ALK-genomipoikkeavuuksia kasvaimessa. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus tai jotka olivat saaneet rintakehän alueelle yli 30 Gy:n säteilyannoksen viimeksi kuluneiden 26 viikon aikana. Potilaat satunnaistettiin (2:1) saamaan jotakin seuraavista hoidoista:
- pembrolitsumabia 200 mg pemetreksedin (500 mg/m2) ja tutkijalääkärin valinnan mukaan sisplatiinin (75 mg/m2) tai karboplatiinin (AUC 5 mg/ml/min) kanssa laskimoon kolmen viikon välein neljän hoitosyklin ajan ja sen jälkeen pembrolitsumabia 200 mg ja pemetreksedia 500 mg/m2 laskimoon kolmen viikon välein (n = 410)
- lumelääkettä pemetreksedin (500 mg/m2) ja tutkijalääkärin valinnan mukaan sisplatiinin (75 mg/m2) tai karboplatiinin (AUC 5 mg/ml/min) kanssa laskimoon kolmen viikon välein neljän hoitosyklin ajan ja sen jälkeen lumelääkettä ja pemetreksedia 500 mg/m2 laskimoon kolmen viikon välein (n = 206)
Pembrolitsumabihoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST 1.1 ‑kriteerien mukaan taudin edenneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Pembrolitsumabihoitoa voitiin jatkaa sokkoutetun riippumattoman keskitetyn arvioijatahon (BICR) RECIST-kriteerejä käyttämällä arvioiman taudin etenemisenkin jälkeen tai pemetreksedihoidon lopettamisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Potilailla, jotka saivat koko 24 kuukauden hoidon tai joilla todettiin täydellinen vaste, pembrolitsumabihoito voitiin aloittaa uudelleen taudin edettyä ja sitä voitiin antaa vielä enintään vuoden ajan. Kasvaimen tila arvioitiin viikolla 6 ja viikolla 12 ja sen jälkeen 9 viikon välein. Potilaille, jotka saivat lumelääkettä ja solunsalpaajahoitoa ja joilla riippumaton taho vahvisti taudin edenneen, tarjottiin mahdollisuutta saada pembrolitsumabia monoterapiana.
KEYNOTE‑189-tutkimuksen 616 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 64 vuotta (49 % oli vähintään 65‑vuotiaita); miehiä 59 %; valkoihoisia 94 % ja aasialaisia 3 %; 43 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 56 %:lla ECOG-toimintakykyluokka oli 1; 31 % potilaista oli PD‑L1-negatiivisia (TPS < 1 %); ja 18 %:lla oli hoidettuja tai hoitamattomia aivojen etäpesäkkeitä lähtötilanteessa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika ja elinaika ilman taudin etenemistä (PFS) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Taulukossa 16 on tiivistelmä keskeisistä tehon mittareista, ja kuvissa 14 ja 15 on esitetty Kaplan-Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä. Kuvaajat perustuvat lopulliseen analyysiin, jossa seuranta-ajan mediaani oli 18,8 kuukautta.
Taulukko 16: KEYNOTE-189-tutkimuksessa todetut tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi, pemetreksedi ja platinasolunsalpaajahoito n = 410 | Lumelääke, pemetreksedi ja platinasolunsalpaajahoito n = 206 |
| OS* | ||
| Potilaat (%), joilla todettiin tapahtuma | 258 (63 %) | 163 (79 %) |
| Riskisuhde† (95 % CI) | 0,56 (0,46, 0,69) | |
| p-arvo‡ | < 0,00001 | |
| Mediaani, kk (95 % CI) | 22,0 (19,5, 24,5) | 10,6 (8,7, 13,6) |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 337 (82 %) | 197 (96 %) |
| Riskisuhde† (95 % CI) | 0,49 (0,41, 0,59) | |
| p-arvo‡ | < 0,00001 | |
| Mediaani, kk (95 % CI) | 9,0 (8,1, 10,4) | 4,9 (4,7, 5,5) |
| Objektiivisten vasteiden osuus | ||
| ORR§ % (95 % CI) | 48 % (43, 53) | 20 % (15, 26) |
| Täydellinen vaste | 1,2 % | 0,5 % |
| Osittainen vaste | 47 % | 19 % |
| p-arvo¶ | < 0,0001 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 12,5 (1,1+, 34,9+) | 7,1 (2,4, 27,8+) |
| %-osuus potilaita, joilla kesto on ≥ 12 kk# | 53 % | 27 % |
| * Yhteensä 113 potilasta (57 %), jotka keskeyttivät tutkimushoidon lumelääkettä ja solunsalpaajahoitoa saaneiden hoitohaarassa ja siirtyivät saamaan pembrolitsumabimonoterapiaa tai saivat seuraavana hoitona tarkistuspisteen estäjää. † Perustuu ositettuun Coxin verrannollisten riskitiheyksien malliin ‡ Ositetun log rank ‑testin perusteella § Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena ¶ Perustuu Miettisen ja Nurmisen menetelmään, ositus PD‑L1-statuksen, platinasolunsalpaajahoidon ja tupakointistatuksen mukaan # Perustuu Kaplan-Meier-arvioon | ||
Kuva 14: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE‑189-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
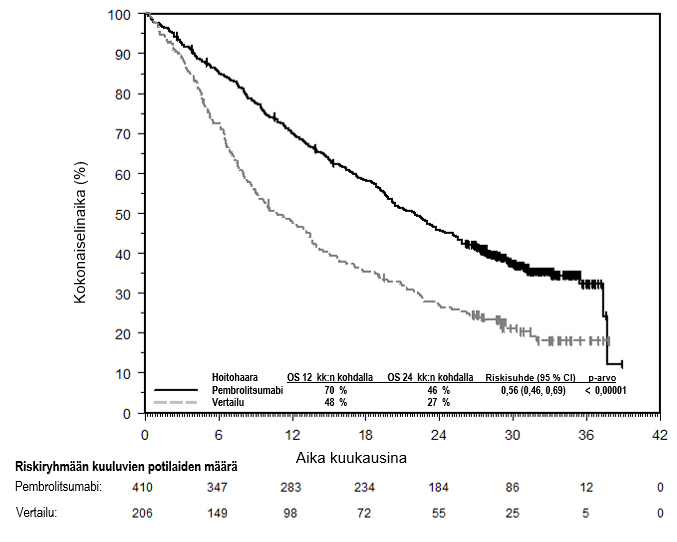
Kuva 15: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑189-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
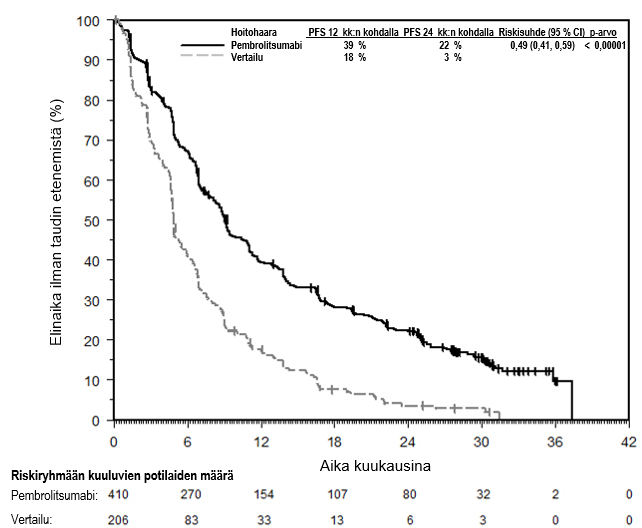
KEYNOTE‑189-tutkimuksessa tehtiin analyysi potilaista, joiden PD‑L1:n TPS oli < 1 %
[pembrolitsumabiyhdistelmä: n = 127 (31 %) vs. solunsalpaajahoito: n = 63 (31 %)], TPS 1–49 %
[pembrolitsumabiyhdistelmä: n = 128 (31 %) vs. solunsalpaajahoito: n = 58 (28 %)] tai TPS ≥ 50 %
[pembrolitsumabiyhdistelmä: n = 132 (32 %) vs. solunsalpaajahoito: n = 70 (34 %)] (ks. taulukko 17).
Taulukko 17: KEYNOTE-189-tutkimuksessa todetut tehoa koskevat tulokset PD‑L1:n ilmentymisen mukaan*
| Päätetapahtuma | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito |
|---|---|---|---|---|---|---|
| TPS < 1 % | TPS 1–49 % | TPS ≥ 50 % | ||||
OS riskisuhde† (95 % CI) | 0,51 (0,36, 0,71) | 0,66 (0,46, 0,96) | 0,59 (0,40, 0,86) | |||
PFS riskisuhde† (95 % CI) | 0,67 (0,49, 0,93) | 0,53 (0,38, 0,74) | 0,35 (0,25, 0,49) | |||
| ORR % | 33 % | 14 % | 50 % | 21 % | 62 % | 26 % |
| * Perustuu lopulliseen analyysiin † Riskisuhde (pembrolitsumabiyhdistelmähoito solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||||
Lopullisen analyysin kohdalla KEYNOTE-189-tutkimuksessa oli mukana yhteensä 57 potilasta, joilla oli ei-pienisoluinen keuhkosyöpä ja jotka olivat ≥ 75‑vuotiaita (pembrolitsumabiyhdistelmän ryhmässä 35 potilasta ja vertailuryhmässä 22 potilasta). Tässä tutkimuksen alaryhmässä ilmoitettu kokonaiselinaikaa koskeva riskisuhde oli 1,54 [95 %:n luottamusväli 0,76, 3,14] ja elinaikaa ilman taudin etenemistä koskeva riskisuhde oli 1,12 [95 %:n luottamusväli 0,56, 2,22] pembrolitsumabiyhdistelmähoitoa saaneilla potilailla verrattuna solunsalpaajahoitoa saaneisiin. Pembrolitsumabin tehosta yhdistelmänä platinasolunsalpaajahoidon kanssa tässä potilasryhmässä on vain vähän tietoja.
KEYNOTE-407: Yhdistelmähoitoa koskeva kontrolloitu tutkimus levyepiteeliperäistä ei-pienisoluista keuhkosyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Pembrolitsumabin tehoa yhdistelmänä karboplatiinin ja joko paklitakselin tai nab-paklitakselin kanssa arvioitiin KEYNOTE‑407-tutkimuksessa, joka oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikeskustutkimus. Tämän tutkimuksen keskeiset sisäänottokriteerit olivat metastasoitunut levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä riippumatta kasvaimen PD-L1:n ilmentymisstatuksesta ja ei aiempaa systeemistä hoitoa metastasoituneeseen tautiin. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus tai jotka olivat saaneet rintakehän alueelle yli 30 Gy:n säteilyannoksen viimeksi kuluneiden 26 viikon aikana. Satunnaistaminen stratifioitiin kasvaimen PD-L1:n ilmentymisen (TPS < 1 % [negatiivinen] vs. TPS ≥ 1 %), tutkijan valitseman paklitakseli- tai nab-paklitakselihoidon ja maantieteellisen alueen mukaan (Itä-Aasia vs. ei Itä-Aasia). Potilaat satunnaistettiin (1:1) jompaankumpaan hoitohaaraan, joissa hoito annettiin infuusiona laskimoon:
- pembrolitsumabia 200 mg ja karboplatiinia (AUC 6 mg/ml/min) kunkin 21 päivän hoitosyklin päivänä 1 neljän hoitosyklin ajan, paklitakselia 200 mg/m2 kunkin 21 päivän hoitosyklin päivänä 1 neljän hoitosyklin ajan tai nab-paklitakselia 100 mg/m2 kunkin 21 päivän hoitosyklin päivinä 1, 8 ja 15 neljän hoitosyklin ajan ja sen jälkeen pembrolitsumabia 200 mg kolmen viikon välein. Pembrolitsumabi annettiin ennen solunsalpaajahoitoa päivänä 1.
- lumelääkettä ja karboplatiinia (AUC 6 mg/ml/min) kunkin 21 päivän hoitosyklin päivänä 1 neljän hoitosyklin ajan, paklitakselia 200 mg/m2 kunkin 21 päivän hoitosyklin päivänä 1 neljän hoitosyklin ajan tai nab-paklitakselia 100 mg/m2 kunkin 21 päivän hoitosyklin päivinä 1, 8 ja 15 neljän hoitosyklin ajan ja sen jälkeen lumelääkettä kolmen viikon välein.
Pembrolitsumabi- tai lumelääkehoitoa jatkettiin, kunnes tauti eteni sokkoutetun riippumattoman keskitetyn arvioijatahon (BICR) RECIST 1.1-kriteerejä käyttäen tekemän arvion mukaan, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Pembrolitsumabihoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä.
Lumehaaran potilaille tarjottiin mahdollisuutta saada pembrolitsumabia monoterapiana, kun tauti eteni.
Kasvaimen tila arvioitiin 6 viikon välein viikkoon 18 asti, 9 viikon välein viikkoon 45 asti ja sen jälkeen 12 viikon välein.
Yhteensä 559 potilasta satunnaistettiin. Tutkimuspopulaation tiedot olivat: mediaani-ikä 65 vuotta (vaihteluväli: 29–88), potilaista 55 % oli vähintään 65-vuotiaita, 81 % miehiä; 77 % valkoihoisia, ECOG-toimintakykyluokka oli 0 (29 %) ja 1 (71 %), ja 8 %:lla tutkittavista oli hoidettuja aivojen etäpesäkkeitä lähtötilanteessa. 35 %:lla tutkittavista kasvaimen PD-L1:n ilmentymistatus oli TPS < 1 % [negatiivinen], 19 % oli itäaasialaisia ja 60 % sai paklitakselia.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka arvioi BICR käyttämällä RECIST 1.1-kriteerejä. Taulukossa 18 on tiivistelmä keskeisistä tehon mittareista, ja kuvissa 16 ja 17 on esitetty Kaplan-Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä. Kuvaajat perustuvat lopulliseen analyysiin, jossa seuranta-ajan mediaani oli 14,3 kuukautta.
Taulukko 18: KEYNOTE‑407-tutkimuksessa todetut tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi Karboplatiini Paklitakseli/Nab-paklitakseli n = 278 | Lumelääke Karboplatiini Paklitakseli/Nab-paklitakseli n = 281 |
| OS* | ||
| Potilaat (%), joilla todettiin tapahtuma | 168 (60 %) | 197 (70 %) |
| Mediaani, kk (95 % CI) | 17,1 (14,4, 19,9) | 11,6 (10,1, 13,7) |
| Riskisuhde† (95 % CI) | 0,71 (0,58, 0,88) | |
| p-arvo‡ | 0,0006 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 217 (78 %) | 252 (90 %) |
| Mediaani, kk (95 % CI) | 8,0 (6,3, 8,4) | 5,1 (4,3, 6,0) |
| Riskisuhde† (95 % CI) | 0,57 (0,47, 0,69) | |
| p-arvo‡ | < 0,0001 | |
| Objektiivisten vasteiden osuus | ||
| ORR % (95 % CI) | 63 % (57, 68) | 38 % (33, 44) |
| Täydellinen vaste | 2,2 % | 3,2 % |
| Osittainen vaste | 60 % | 35 % |
| p-arvo§ | < 0,0001 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 8,8 (1,3+, 28,4+) | 4,9 (1,3+, 28,3+) |
| Kesto on ≥ 12 kk, %¶ | 38 % | 25 % |
* Yhteensä 138 potilasta (51 %), jotka keskeyttivät tutkimushoidon lumelääkettä ja solunsalpaajahoitoa saaneiden hoitohaarassa ja siirtyivät saamaan pembrolitsumabimonoterapiaa tai saivat seuraavana hoitona tarkistuspisteen estäjää. † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Ositetun log rank -testin perusteella § Perustuu Miettisen ja Nurmisen menetelmään ¶ Perustuu Kaplan-Meier-arvioon | ||
Kuva 16: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE-407-tutkimuksessa
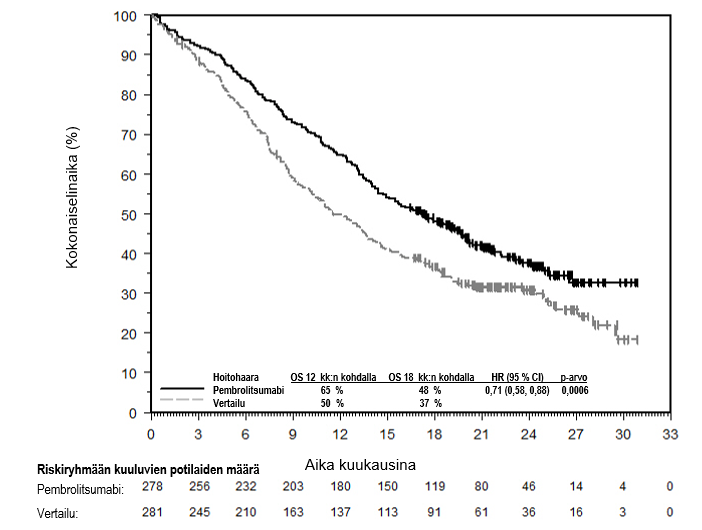
Kuva 17: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE-407-tutkimuksessa
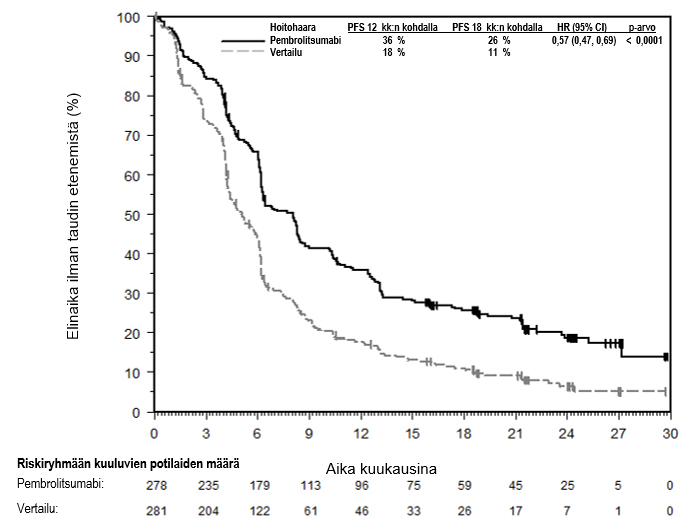
KEYNOTE-407-tutkimuksessa tehtiin analyysi potilaista, joiden PD‑L1:n TPS oli < 1 % [pembrolitsumabia ja solunsalpaajaa saaneiden haara: n = 95 (34 %) vs. lumelääkettä ja solunsalpaajaa saaneiden haara: n = 99 (35 %)], TPS 1–49 % [pembrolitsumabia ja solunsalpaajaa saaneiden haara: n = 103 (37 %) vs. lumelääkettä ja solunsalpaajaa saaneiden haara: n = 104 (37 %)] tai TPS ≥ 50 % [pembrolitsumabia ja solunsalpaajaa saaneiden haara: n = 73 (26 %) vs. lumelääkettä ja solunsalpaajaa saaneiden haara: n = 73 (26 %)] (ks. taulukko 19).
Taulukko 19: KEYNOTE‑407-tutkimuksessa todetut tehoa koskevat tulokset PD-L1:n ilmentymisen mukaan*
| Päätetapahtuma | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito | Pembrolitsumabiyhdistelmähoito | Solunsalpaajahoito |
|---|---|---|---|---|---|---|
| TPS < 1 % | TPS 1–49 % | TPS ≥ 50 % | ||||
OS riskisuhde† (95 % CI) | 0,79 (0,56, 1,11) | 0,59 (0,42, 0,84) | 0,79 (0,52, 1,21) | |||
PFS riskisuhde† (95 % CI) | 0,67 (0,49, 0,91) | 0,52 (0,38, 0,71) | 0,43 (0,29, 0,63) | |||
| ORR % | 67 % | 41 % | 55 % | 42 % | 64 % | 30 % |
* Perustuu lopulliseen analyysiin † Riskisuhde (pembrolitsumabiyhdistelmähoito solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | ||||||
Lopullisen analyysin kohdalla KEYNOTE-407-tutkimuksessa oli mukana yhteensä 65 potilasta, joilla oli ei-pienisoluinen keuhkosyöpä ja jotka olivat ≥ 75‑vuotiaita (pembrolitsumabiyhdistelmän ryhmässä 34 potilasta ja vertailuryhmässä 31 potilasta). Tässä tutkimuksen alaryhmässä ilmoitettu kokonaiselinaikaa koskeva riskisuhde oli 0,81 [95 %:n luottamusväli 0,43, 1,55] ja elinaikaa ilman taudin etenemistä koskeva riskisuhde oli 0,61 [95 %:n luottamusväli 0,34, 1,09] pembrolitsumabiyhdistelmähoitoa saaneilla potilailla verrattua solunsalpaajahoitoa saaneisiin. Objektiivisten vasteiden osuus oli 62 % pembrolitsumabiyhdistelmähoitoa saaneilla potilailla ja 45 % solunsalpaajahoitoa saaneilla. Pembrolitsumabin tehosta yhdistelmänä platinasolunsalpaajahoidon kanssa tässä potilasryhmässä on vain vähän tietoja.
KEYNOTE-010: Kontrolloitu tutkimus aiemmin solunsalpaajahoitoa saaneilla ei-pienisoluista keuhkosyöpää sairastavilla potilailla
Pembrolitsumabin turvallisuutta ja tehoa tutkittiin avoimessa, kontrolloidussa KEYNOTE‑010-monikeskustutkimuksessa edenneen ei-pienisoluisen keuhkosyövän hoidossa potilailla, jotka olivat aiemmin saaneet platinaa sisältävää solunsalpaajahoitoa. Potilailla oli todettu PD-L1:n ilmentyminen; tumour proportion score (TPS) oli ≥ 1 % PD-L1 IHC 22C3 pharmDxTM ‑testin mukaan eli PD-L1-ilmentyminen havaittiin vähintään yhdessä prosentissa kasvainsoluja. Potilailla, joilla oli EGFR:ää aktivoivia mutaatioita tai ALK:n translokaatio, tauti oli myös edennyt tällaisten mutaatioiden yhteydessä annetun hyväksytyn hoidon aikana ennen pembrolitsumabihoidon saamista. Potilaat satunnaistettiin (1:1:1) saamaan pembrolitsumabia annoksella 2 mg/kg (n = 344) tai 10 mg/kg (n = 346) 3 viikon välein tai dosetakselia annoksella 75 mg/m2 3 viikon välein (n = 343), kunnes tauti eteni tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai joilla oli immunosuppressiivista hoitoa edellyttävä sairaus tai jotka olivat saaneet rintakehän alueelle yli 30 Gy:n säteilyannoksen viimeksi kuluneiden 26 viikon aikana. Kasvaimen status arvioitiin 9 viikon välein.
Tutkimuspopulaation tiedot lähtötilanteessa olivat: mediaani-ikä 63 vuotta (42 % oli vähintään 65-vuotiaita); miehiä 61 %; valkoihoisia 72 % ja aasialaisia 21 %, 34 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 66 %:lla ECOG-toimintakykyluokka oli 1. Sairauden ominaisuudet olivat: levyepiteelikarsinooma (21 %), muu kuin levyepiteelikarsinooma (70 %); levinneisyysaste IIIA (2 %); levinneisyysaste IIIB (7 %); levinneisyysaste IV (91 %); aivojen vakaat etäpesäkkeet (15 %) ja EGFR-mutaatioiden esiintyvyys (8 %) ja ALK-mutaatioiden esiintyvyys (1 %). Kaikki potilaat (100 %) olivat aiemmin saaneet platinapohjaista yhdistelmähoitoa; 69 % potilaista oli aiemmin saanut yhtä ja 29 % kahta tai useampaa hoitolinjaa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS, Overall Survival) ja elinaika ilman taudin etenemistä (PFS, Progression Free Survival), jotka arvioi sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) käyttämällä RECIST 1.1 ‑kriteerejä. Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR, Objective Response Rate) ja vasteen kesto. Taulukossa 20 on tiivistelmä keskeisistä tehon mittareista koko tutkimuspopulaatiolle (TPS ≥ 1 %) ja sellaisten potilaiden alaryhmälle, joiden TPS oli ≥ 50 %, ja kuvassa 18 on esitetty kokonaiselinajan (TPS ≥ 1 %) Kaplan-Meier-kuvaaja, joka perustuu lopulliseen analyysiin, jossa seuranta-ajan mediaani oli 42,6 kuukautta.
Taulukko 20: KEYNOTE-010-tutkimuksessa todettu hoitovaste pembrolitsumabin annokselle 2 tai 10 mg/kg 3 viikon välein potilailla, jotka olivat aiemmin saaneet hoitoa ja joilla oli ei-pienisoluinen keuhkosyöpä
| Päätetapahtuma | Pembrolitsumabi 2 mg/kg 3 viikon välein | Pembrolitsumabi 10 mg/kg 3 viikon välein | Dosetakseli 75 mg/m2 3 viikon välein | |
| TPS ≥ 1 % | ||||
| Potilaiden määrä | 344 | 346 | 343 | |
| OS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 284 (83 %) | 264 (76 %) | 295 (86 %) | |
| Riskisuhde* (95 % CI) | 0,77 (0,66, 0,91) | 0,61 (0,52, 0,73) | --- | |
| p-arvo† | 0,00128 | < 0,001 | --- | |
| Mediaani, kk (95 % CI) | 10,4 (9,5, 11,9) | 13,2 (11,2, 16,7) | 8,4 (7,6, 9,5) | |
| PFS‡ | ||||
| Potilaat (%), joilla todettiin tapahtuma | 305 (89 %) | 292 (84 %) | 314 (92 %) | |
| Riskisuhde* (95 % CI) | 0,88 (0,75, 1,04) | 0,75 (0,63, 0,89) | --- | |
| p-arvo† | 0,065 | < 0,001 | --- | |
| Mediaani, kk (95 % CI) | 3,9 (3,1, 4,1) | 4,0 (2,7, 4,5) | 4,1 (3,8, 4,5) | |
| Objektiivisten vasteiden osuus‡ | ||||
| ORR % (95 % CI) | 20 % (16, 25) | 21 % (17, 26) | 9 % (6, 13) | |
| Täydellinen vaste | 2 % | 3 % | 0 % | |
| Osittainen vaste | 18 % | 18 % | 9 % | |
| Vasteen kesto‡,§ | ||||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,8, 46,2+) | 37,8 (2,0+, 49,3+) | 7,1 (1,4+, 16,8) | |
| Jatkuu edelleen, %¶ | 42 % | 43 % | 6 % | |
| TPS ≥ 50 % | ||||
| Potilaiden määrä | 139 | 151 | 152 | |
| OS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 97 (70 %) | 102 (68 %) | 127 (84 %) | |
| Riskisuhde* (95 % CI) | 0,56 (0,43, 0,74) | 0,50 (0,38, 0,65) | --- | |
| p-arvo† | < 0,001 | < 0,001 | --- | |
| Mediaani, kk (95 % CI) | 15,8 (10,8, 22,5) | 18,7 (12,1, 25,3) | 8,2 (6,4, 9,8) | |
| PFS‡ | ||||
| Potilaat (%), joilla todettiin tapahtuma | 107 (77 %) | 115 (76 %) | 138 (91 %) | |
| Riskisuhde* (95 % CI) | 0,59 (0,45, 0,77) | 0,53 (0,41, 0,70) | --- | |
| p-arvo† | < 0,001 | < 0,001 | --- | |
| Mediaani, kk (95 % CI) | 5,3 (4,1, 7,9) | 5,2 (4,1, 8,1) | 4,2 (3,8, 4,7) | |
| Objektiivisten vasteiden osuus‡ | ||||
| ORR % (95 % CI) | 32 % (24, 40) | 32 % (25, 41) | 9 % (5, 14) | |
| Täydellinen vaste | 4 % | 4 % | 0 % | |
| Osittainen vaste | 27 % | 28 % | 9 % | |
| Vasteen kesto‡,§ | ||||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,8, 44,0+) | 37,5 (2,0+, 49,3+) | 8,1 (2,6, 16,8) | |
| Jatkuu edelleen, %¶ | 55 % | 47 % | 8 % | |
| * Riskisuhde (pembrolitsumabi dosetakseliin verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank ‑testin perusteella ‡ Arvioinut sokkoutettu riippumaton keskitetty arvioijataho (BICR) käyttämällä RECIST 1.1 ‑kriteerejä § Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena ¶ Edelleen jatkuva vaste sisältää kaikki vastaajat, jotka analyysihetkellä olivat elossa, sairaus ei ollut edennyt, jotka eivät aloittaneet uutta syöpälääkistystä ja joiden ei oltu katsottu kadonneen seurannasta | ||||
Kuva 18: Kaplan-Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE-010-tutkimuksessa (potilailla, joilla PD-L1:n ilmentymistä kuvaava TPS oli ≥ 1%, hoitoaikeen mukainen potilasjoukko)
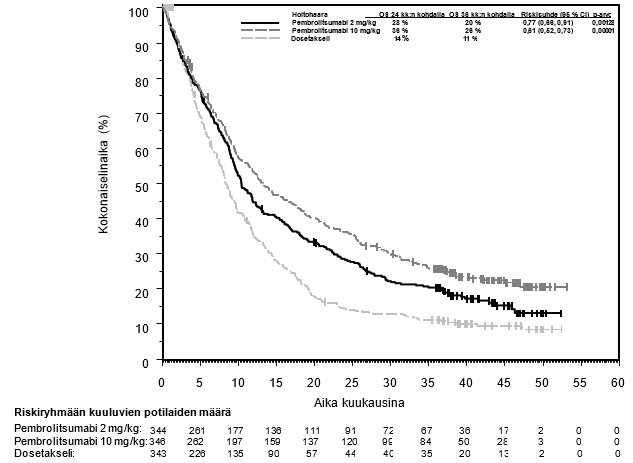
Tehoa koskevat tulokset olivat samanlaiset sekä 2 mg/kg että 10 mg/kg pembrolitsumabia saaneiden hoitohaaroissa. Tehoa koskevat tulokset olivat ryhmien välisen vertailun perusteella kokonaiselinajan osalta yhdenmukaiset kasvainnäytteen iästä riippumatta (uusi tai arkistoitu kasvainnäyte).
Alaryhmäanalyyseissä pembrolitsumabista havaittiin olevan vähemmän hyötyä elossaoloaikaan dosetakseliin verrattuna potilailla, jotka eivät koskaan olleet tupakoineet tai joilla oli kasvaimessa EGFR:ää aktivoivia mutaatioita ja jotka saivat vähintään platinapohjaista solunsalpaajahoitoa ja tyrosiinikinaasin estäjää. Potilaiden vähäisestä määrästä johtuen näistä tuloksista ei kuitenkaan voida vetää lopullisia johtopäätöksiä.
Pembrolitsumabin tehoa ja turvallisuutta ei ole vahvistettu potilaille, joiden kasvaimet eivät ilmennä PD-L1-ligandia.
Pahanlaatuinen keuhkopussin mesoteliooma
KEYNOTE‑483: Kontrolloitu tutkimus, jossa arvioitiin yhdistelmähoitoa potilailla, joilla oli hoitamaton, leikkaukseen soveltumaton edennyt tai metastasoitunut pahanlaatuinen keuhkopussin mesoteliooma
Pembrolitsumabin tehoa yhdistelmänä pemetreksedin ja platinasolunsalpaajahoidon kanssa arvioitiin satunnaistetussa, avoimessa, aktiivikontrolloidussa KEYNOTE‑483-monikeskustutkimuksessa. Keskeiset sisäänottokriteerit olivat leikkaukseen soveltumaton edennyt tai metastasoitunut pahanlaatuinen keuhkopussin mesoteliooma ja se, ettei potilas ollut saanut aiemmin systeemistä hoitoa edenneeseen tai metastasoituneeseen tautiin. Tutkimukseen otettiin potilaita kasvaimen PD‑L1:n ilmentymisestä riippumatta. Potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa 3 vuoden sisällä ennen hoitoa, tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin histologisen alatyypin (epitelioidinen vs. ei-epitelioidinen) mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista, joissa kaikki tutkimuslääkkeet annettiin infuusiona laskimoon:
- pembrolitsumabia 200 mg pemetreksedin (500 mg/m2) ja sisplatiinin (75 mg/m2) tai karboplatiinin (AUC 5–6 mg/ml/min) kanssa kunkin 21 päivän hoitosyklin päivänä 1 enintään kuuden hoitosyklin ajan ja sen jälkeen pembrolitsumabia 200 mg kolmen viikon välein (n = 222). Pembrolitsumabi annettiin ennen solunsalpaajahoitoa päivänä 1.
- pemetreksedia (500 mg/m2) ja sisplatiinia (75 mg/m2) tai karboplatiinia (AUC 5–6 mg/ml/min) kunkin 21 päivän hoitosyklin päivänä 1 enintään kuuden hoitosyklin ajan (n = 218).
Pembrolitsumabihoitoa jatkettiin, kunnes tutkijalääkäri määritti mesoteliooman arviointiin muokattujen RECIST 1.1 ‑kriteerien (mRECIST) mukaan taudin edenneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Kasvaimen tila arvioitiin 6 viikon välein 18 viikon ajan ja sen jälkeen 12 viikon välein.
KEYNOTE‑483-tutkimukseen osallistuneista potilaista 95:llä kasvain oli histologisesti ei‑epitelioidinen. Näiden potilaiden tiedot lähtötilanteessa olivat: mediaani-ikä oli 71 vuotta (ikäjakauma 48–85 vuotta) ja 76 % oli vähintään 65‑vuotiaita; 83 % oli miehiä; 85 % oli valkoihoisia ja 15 %:n etnisyyttä ei ilmoitettu tai se ei ollut tiedossa; 1 % oli taustaltaan espanjankielisiä tai latinalaisamerikkalaisia; ja 44 %:lla ECOG-toimintakykyluokka oli 0 ja 56 %:lla ECOG-toimintakykyluokka oli 1.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS). Muita tehoa mittaavia lopputulosmuuttujia olivat elinaika ilman taudin etenemistä (PFS), objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DoR), jotka arvioi BICR käyttämällä mRECIST-kriteerejä. Tutkimus osoitti, että koko populaation kokonaiselinaika (riskisuhde 0,79; 95 %:n luottamusväli 0,64, 0,98; p‑arvo 0,0162) ja elinaika ilman taudin etenemistä (riskisuhde 0,80; 95 %:n luottamusväli 0,65, 0,99; p‑arvo 0,0194) lopullisen analyysin kohdalla ja objektiivisten vasteiden osuus (52 % [95 %:n luottamusväli 45, 59] vs. 29 % [95 %:n luottamusväli 23, 35]; p‑arvo < 0,00001) välianalyysin kohdalla olivat tilastollisesti merkitsevästi paremmat potilailla, jotka satunnaistettiin saamaan pembrolitsumabia yhdistelmänä solunsalpaajahoidon kanssa, verrattuna potilaisiin, jotka satunnaistettiin saamaan pelkkää solunsalpaajahoitoa. Taulukossa 21 on tiivistelmä keskeisistä tehon mittareista, ja kuvissa 19 ja 20 on esitetty Kaplan–Meier-kuvaajat ei-epitelioidista pahanlaatuista keuhkopussin mesotelioomaa sairastaneiden potilaiden kokonaiselinajasta ja elinajasta ilman taudin etenemistä lopullisen analyysin perusteella, kun seuranta-ajan mediaani oli 9,8 kuukautta (vaihteluväli 0,9–60,3 kuukautta).
Taulukko 21: KEYNOTE‑483-tutkimuksen tehoa koskevat tulokset ei‑epitelioidista pahanlaatuista keuhkopussin mesotelioomaa sairastavilla potilailla
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein + pemetreksedi + platinasolunsalpaajahoito (n = 46) | Pemetreksedi + platinasolunsalpaajahoito (n = 49) |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 37 (80 %) | 44 (90 %) |
| Riskisuhde* (95 % CI) | 0,57 (0,36, 0,89) | |
| Mediaani, kk† (95 % CI) | 12,3 (8,7, 21,2) | 8,2 (5,8, 9,8) |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 36 (78 %) | 38 (78 %) |
| Riskisuhde* (95 % CI) | 0,47 (0,29, 0,77) | |
| Mediaani, kk† (95 % CI) | 7,1 (4,5, 9,8) | 4,5 (4,0, 6,4) |
| Objektiivisten vasteiden osuus | ||
| ORR, % (95 % CI)‡ | 41 % (27, 57) | 6 % (1, 17) |
| Vasteen kesto† | ||
| Mediaani, kk (vaihteluväli) | 11,1 (1,3+, 38,9+) | 4,0 (2,4+, 5,2) |
| * Perustuu Coxin regressiomalliin, jossa on käytetty tasatulosten käsittelyyn Efronin menetelmää ja jossa kovariaattina on hoito. † Perustuu sensuroidulle tietojoukolle johdettuun rajatulomenetelmään (Kaplan–Meier-menetelmään). ‡ Perustuu tarkkaan binomimenetelmään. | ||
Kuva 19: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE‑483-tutkimuksessa potilailla, joilla oli ei‑epitelioidinen pahanlaatuinen keuhkopussin mesoteliooma
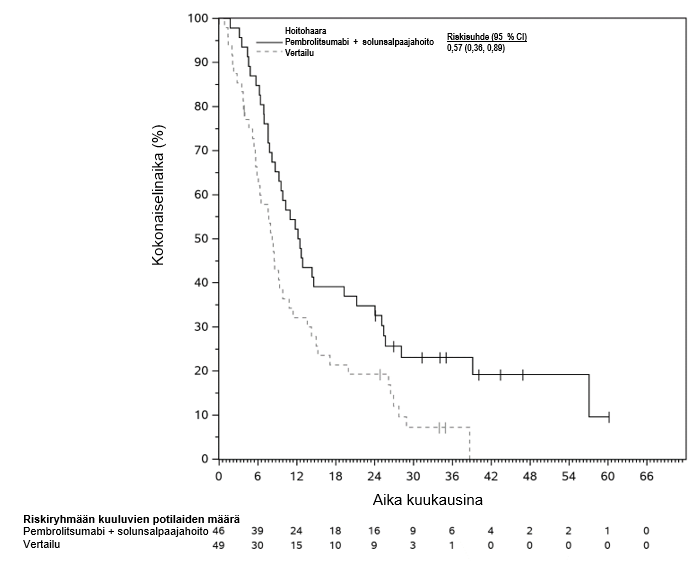
Kuva 20: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑483-tutkimuksessa potilailla, joilla oli ei‑epitelioidinen pahanlaatuinen keuhkopussin mesoteliooma
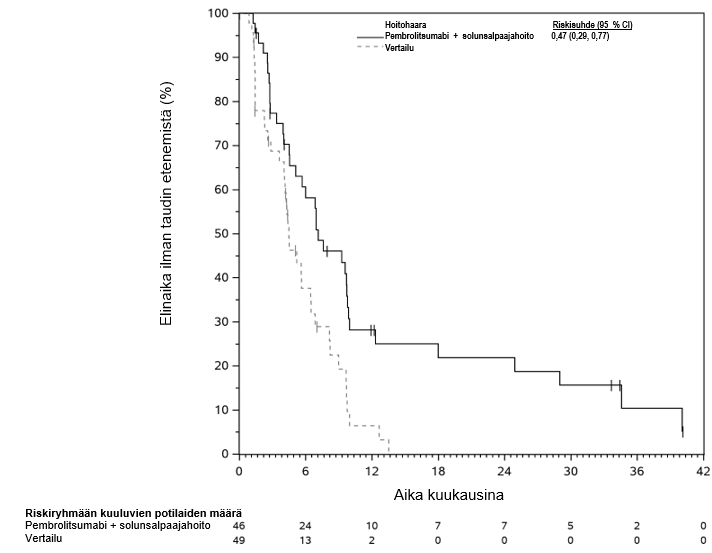
Klassinen Hodgkinin lymfooma
KEYNOTE‑204: Kontrolloitu tutkimus relapsoitunutta tai refraktorista klassista Hodgkinin lymfoomaa sairastavilla potilailla
Satunnaistetussa, avoimessa, aktiivikontrolloidussa KEYNOTE-204‑tutkimuksessa arvioitiin pembrolitsumabin tehoa 304 potilaalla, joilla oli relapsoitunut tai refraktorinen klassinen Hodgkinin lymfooma. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen, ei-tulehduksellinen pneumoniitti, potilaat, joille oli tehty allogeeninen hematopoieettinen kantasolujen siirto viimeksi kuluneiden 5 vuoden aikana (tai yli 5 vuotta aiemmin, mutta siirteeseen oli liittynyt käänteishyljinnän oireita), sekä potilaat, joilla oli aktiivinen autoimmuunisairaus, immunosuppressiota edellyttävä sairaus tai systeemistä hoitoa vaativa aktiivinen infektio. Satunnaistaminen stratifioitiin aiemman autologisen kantasolujen siirron (tehty vai ei) ja ensilinjan hoidon jälkeisen taudin tilan (primaarinen refraktorinen vs. relapsi alle 12 kuukauden kuluttua hoidon päättymisestä vs. relapsi vähintään 12 kuukauden kuluttua hoidon päättymisestä) mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- 200 mg pembrolitsumabia laskimoon kolmen viikon välein
- 1,8 mg/kg brentuksimabivedotiinia (BV) laskimoon kolmen viikon välein.
Potilaat saivat 200 mg pembrolitsumabia laskimoon kolmen viikon välein, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, kunnes taudin dokumentoitiin edenneen, tai enintään 35 hoitosyklin ajan. On vain vähän tietoa vasteen kestosta sen jälkeen, kun pembrolitsumabihoito lopetettiin hoitosyklin 35 kohdalla. Vaste arvioitiin 12 viikon välein siten, että ensimmäinen suunniteltu lähtötilanteen jälkeinen arviointi tehtiin viikolla 12.
KEYNOTE‑204-tutkimuksen 304 potilaan joukossa oli alapopulaatio, joka koostui 112 potilaasta, joille tehty kantasolujen siirto oli epäonnistunut ennen tutkimukseen osallistumista, ja 137 potilaasta, joilla vähintään 2 aiempaa hoitoa oli epäonnistunut ja jotka eivät tutkimukseen ottamishetkellä soveltuneet saamaan autologista kantasolujen siirtoa. Näiden 249 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 34 vuotta (11 % oli vähintään 65-vuotiaita); miehiä 56 %; valkoihoisia 80 %; aasialaisia 7 %; 58 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 41 %:lla 1. Noin 30 % oli refraktorisia ensilinjan solunsalpaajahoidolle ja noin 45 %:lle oli aiemmin tehty autologinen kantasolujen siirto. Klassisen Hodgkinin lymfooman yleisin histologinen alatyyppi oli sidekudoskyhmyinen (noin 81 %), noin 21 %:lla potilaista kasvainmassa oli suuri, noin 28 %:lla oli B-oireita ja noin 4 %:lla tauti oli levinnyt luuytimeen.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli elinaika ilman taudin etenemistä (PFS) ja toissijainen tehoa mittaava lopputulosmuuttuja oli objektiivisten vasteiden osuus (ORR). Ne arvioi BICR vuonna 2007 tarkistettujen IWG-kriteerien (Internationational Working Group) mukaan. Kokonaiselinaikaa (OS), joka oli toinen ensisijainen tehoa mittaava lopputulosmuuttuja, ei arvioitu muodollisesti analyysin tekovaiheessa. Hoitoaikeen mukaisessa (ITT) potilasjoukossa 151 pembrolitsumabihoitoa saaneen potilaan seuranta-ajan mediaani oli 24,9 kuukautta (vaihteluväli 1,8–42,0 kuukautta). Ensimmäisen analyysin mukaan elinaikaa ilman taudin etenemistä koskeva riskisuhde oli 0,65 (95 %:n luottamusväli: 0,48, 0,88) yksitahoisella p‑arvolla 0,0027. Objektiivisten vasteiden osuus oli pembrolitsumabia saaneilla 66 % ja tavanomaista hoitoa saaneilla 54 % p-arvolla 0,0225. Yhteenveto tehoa koskevista tuloksista alapopulaatiolle on esitetty taulukossa 22. Tehoa koskevat tulokset tässä alapopulaatiossa olivat yhdenmukaiset hoitoaikeen mukaisen (ITT) potilasjoukon tulosten kanssa. Kuvassa 21 on esitetty Kaplan-Meier-kuvaaja elinajasta ilman taudin etenemistä tälle alapopulaatiolle.
Taulukko 22: KEYNOTE‑204-tutkimuksen tehoa koskevat tulokset klassista Hodgkinin lymfoomaa sairastavilla potilailla, joille tehty kantasolujen siirto oli epäonnistunut ennen tutkimukseen osallistumista, ja potilailla, joilla vähintään 2 aiempaa hoitoa oli epäonnistunut ja jotka eivät soveltuneet saamaan autologista kantasolujen siirtoa
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein | Brentuksimabivedotiini 1,8 mg/kg 3 viikon välein |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 68 (55 %) | 75 (60 %) |
| Riskisuhde* (95 % CI) | 0,66 (0,47, 0,92) | |
| Mediaani, kk (95 % CI) | 12,6 (8,7, 19,4) | 8,2 (5,6, 8,8) |
| Objektiivisten vasteiden osuus | ||
| ORR‡ % (95 % CI) | 65 % (56,3, 73,6) | 54 % (45,3, 63,3) |
| Täydellinen vaste | 27 % | 22 % |
| Osittainen vaste | 39 % | 33 % |
| Vakaa tauti | 12 % | 23 % |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 20,5 (0,0+, 33,2+) | 11,2 (0,0+, 33,9+) |
| Potilaat (%¶), joilla kesto on ≥ 6 kk | 53 (80,8 %) | 28 (61,2 %) |
| Potilaat (%¶), joilla kesto on ≥ 12 kk | 37 (61,7 %) | 17 (49,0 %) |
| * Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Perustuu tietoihin parhaasta kokonaisvasteesta, täydellisenä tai osittaisena vasteena ¶ Perustuu Kaplan‑Meier-arvioon | ||
Kuva 21: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE-204-tutkimuksessa klassista Hodgkinin lymfoomaa sairastavilla potilailla, joille tehty kantasolujen siirto oli epäonnistunut ennen tutkimukseen osallistumista, ja potilailla, joilla vähintään 2 aiempaa hoitoa oli epäonnistunut ja jotka eivät soveltuneet saamaan autologista kantasolujen siirtoa
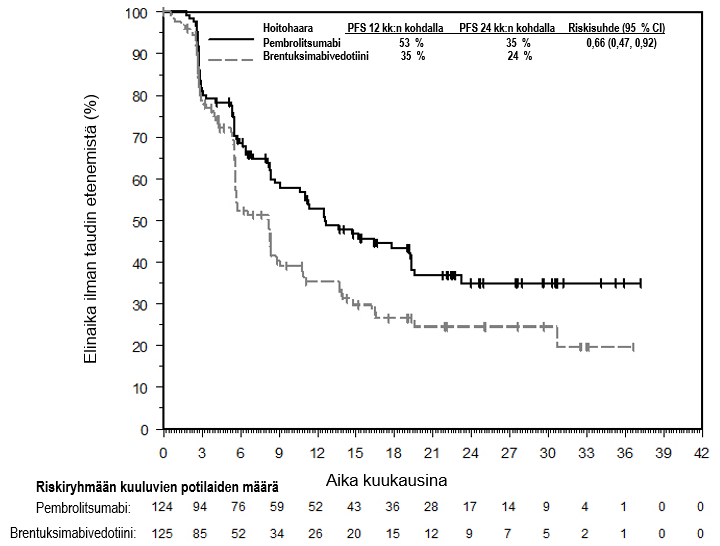
KEYNOTE-087 ja KEYNOTE-013: Avoimet tutkimukset relapsoitunutta tai refraktorista klassista Hodgkinin lymfoomaa sairastavilla potilailla
Kahdessa avoimessa monikeskustutkimuksessa, KEYNOTE-087 ja KEYNOTE-013, arvioitiin pembrolitsumabin tehoa 241:n klassista Hodgkinin lymfoomaa sairastavan potilaan hoidossa. Näihin tutkimuksiin otettiin mukaan potilaita, joilla autologinen kantasolujen siirto ja hoito brentuksimabivedotiinilla olivat epäonnistuneet tai jotka eivät soveltuneet autologiseen kantasolujen siirtoon, koska heillä ei saavutettu täydellistä tai osittaista remissiota salvage-solunsalpaajahoidolla ja brentuksimabivedotiinihoito oli epäonnistunut, tai joilla autologinen kantasolujen siirto oli epäonnistunut ja jotka eivät saaneet brentuksimabivedotiinia. Viisi tutkittavaa ei soveltunut autologiseen kantasolujen siirtoon muista syistä kuin salvage-solunsalpaajahoidon epäonnistumisen vuoksi. Molempiin tutkimuksiin otettiin mukaan potilaita riippumatta PD-L1-ligandin ilmentymisestä. Molemmista tutkimuksista suljettiin pois potilaat, joilla oli aktiivinen, ei-tulehduksellinen pneumoniitti, potilaat, joille oli tehty allogeeninen kantasolujen siirto viimeksi kuluneiden 5 vuoden aikana (tai yli 5 vuotta aiemmin, mutta siirteeseen oli liittynyt käänteishyljintä), sekä potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Potilaat saivat 200 mg pembrolitsumabia kolmen viikon välein (n = 210; KEYNOTE-087-tutkimus) tai 10 mg/kg kahden viikon välein (n = 31; KEYNOTE-013-tutkimus), kunnes lääkkeen toksisuus ei enää ollut hyväksyttävällä tasolla tai taudin dokumentoitiin edenneen.
KEYNOTE-087-tutkimukseen osallistuneiden potilaiden ominaisuudet lähtötilanteessa olivat: mediaani-ikä 35 vuotta (9 % vähintään 65-vuotiaita), 54 % miehiä, 88 % valkoihoisia; ECOG-toimintakykyluokka oli 49 %:lla 0 ja 51 %:lla 1. Klassisen Hodgkinin lymfooman aiempien hoitolinjojen lukumäärän mediaani oli 4 (vaihteluväli: 1–12). Vähintään yhdelle aiemmalle hoidolle refraktorisia potilaita oli 81 %, ja heistä 34 % oli refraktorisia ensilinjan hoidolle. Potilaista 61 % oli saanut autologisen kantasolusiirteen, 38 % oli kantasolujen siirtoon soveltumattomia, 17 % ei ollut saanut aiemmin brentuksimabivedotiinia ja 37 % oli aiemmin saanut sädehoitoa. Sairauden alatyypit olivat: sidekudoskyhmyinen (81 %), sekasoluinen (11 %), runsaslymfosyyttinen (4 %) ja vähälymfosyyttinen (2 %).
KEYNOTE-013-tutkimukseen osallistuneiden potilaiden ominaisuudet lähtötilanteessa olivat: mediaani-ikä 32 vuotta (7 % vähintään 65‑vuotiaita), 58 % miehiä, 94 % valkoihoisia, ECOG-toimintakykyluokka oli 45 %:lla 0 ja 55 %:lla 1. Klassisen Hodgkinin lymfooman aiempien hoitolinjojen lukumäärän mediaani oli 5 (vaihteluväli: 2–15). Vähintään yhdelle aiemmalle hoidolle refraktorisia potilaita oli 84 %, ja heistä 35 % oli refraktorisia ensilinjan hoidolle. Potilaista 74 % oli saanut autologisen kantasolusiirteen, 26 % oli kantasolusiirtoon soveltumattomia ja 45 % oli aiemmin saanut sädehoitoa. Sairauden alatyypit olivat: sidekudoskyhmyinen (97 %) ja sekasoluinen (3 %).
Sokkoutettu riippumaton keskitetty arvioijataho antoi arviot ensisijaisista tehoa mittaavista lopputulosmuuttujista (objektiivisten vasteiden osuus, ORR, ja täydellisten remissioiden määrä, CRR) IWG 2007 -kriteerien mukaan. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika (OS). Vaste arvioitiin KEYNOTE-087-tutkimuksessa 12 viikon ja KEYNOTE-013-tutkimuksessa 8 viikon välein. Ensimmäinen suunniteltu lähtötilanteen jälkeinen arviointi tehtiin viikolla 12. Keskeisistä tehoa koskevista tuloksista on esitetty yhteenveto taulukossa 23.
Taulukko 23: Tutkimusten KEYNOTE-087 ja KEYNOTE-013 tehoa koskevat tulokset
| KEYNOTE-087* | KEYNOTE-013† | |
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 210 | Pembrolitsumabi 10 mg/kg 2 viikon välein n =31 |
| Objektiivisten vasteiden osuus‡ | ||
| ORR % (95 % CI) | 71 % (64,8, 77,4) | 58 % (39,1, 75,5) |
| Täydellinen remissio | 28 % | 19 % |
| Osittainen remissio | 44 % | 39 % |
| Vasteen kesto‡ | ||
| Mediaani, kk (vaihteluväli) | 16,6 (0,0+, 62,1+)§ | Ei saavutettu (0,0+, 45,6+)¶ |
| Kesto ≥ 12 kuukautta, % | 59 %# | 70 %Þ |
| Kesto ≥ 24 kuukautta, % | 45 %ß | --- |
| Kesto ≥ 60 kuukautta, % | 25 %à | --- |
| Aika vasteen saavuttamiseen | ||
| Mediaani, kk (vaihteluväli) | 2,8 (2,1, 16,5)§ | 2,8 (2,4, 8,6)¶ |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 59 (28 %) | 6 (19 %) |
| 12 kuukauden OS-osuus | 96 % | 87 % |
| 24 kuukauden OS-osuus | 91 % | 87 % |
| 60 kuukauden OS-osuus | 71 % | --- |
* Seuranta-ajan mediaani 62,9 kuukautta
† Seuranta-ajan mediaani 52,8 kuukautta
‡ Sokkoutettu riippumaton keskitetty arvioijataho teki arvion IWG 2007 -kriteerien mukaan käyttäen PET-TT-kuvantamista
§ Perustuu potilaisiin (n = 150), jotka riippumattoman arvioijatahon mukaan saivat vasteen
¶ Perustuu potilaisiin (n = 18), jotka riippumattoman arvioijatahon mukaan saivat vasteen
# Perustuu Kaplan-Meier-arvioon; sisältää 62 potilasta, joiden vaste kesti vähintään 12 kuukautta
Þ Perustuu Kaplan‑Meier-arvioon; mukana 7 potilasta, joilla vasteen kesto oli vähintään 12 kuukautta
ß Perustuu Kaplan‑Meier-arvioon; mukana 37 potilasta, joilla vasteen kesto oli vähintään 24 kuukautta
à Perustuu Kaplan‑Meier-arvioon; mukana 4 potilasta, joilla vasteen kesto oli vähintään 60 kuukautta
Teho iäkkäillä potilailla
KEYNOTE-087-, KEYNOTE-013- ja KEYNOTE‑204‑tutkimuksissa pembrolitsumabia sai kaiken kaikkiaan 46 klassista Hodgkinin lymfoomaa sairastavaa, iältään vähintään 65‑vuotiasta potilasta. Tiedot käytöstä näille potilaille ovat liian vähäiset, jotta voitaisiin tehdä johtopäätöksiä tehosta tässä potilasryhmässä.
Uroteelikarsinooma
KEYNOTE‑A39: Kontrolloitu tutkimus, joka koski enfortumabi-vedotiinia sisältävää yhdistelmähoitoa leikkaukseen soveltumattoman tai metastasoituneen uroteelikarsinooman ensilinjan hoidossa
Pembrolitsumabin ja enfortumabi-vedotiinin yhdistelmän tehoa tutkittiin avoimessa, satunnaistetussa, aktiivikontrolloidussa KEYNOTE‑A39-monikeskustutkimuksessa. Tutkimukseen otettiin 886 potilasta, joilla oli leikkaukseen soveltumaton tai metastasoitunut uroteelikarsinooma. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus, aktiivisia etäpesäkkeitä keskushermostossa, vähintään 2. asteen edelleen jatkuva sensorinen tai motorinen neuropatia tai huonossa hoitotasapainossa oleva diabetes (hemoglobiini A1c [HbA1c] ≥ 8 % tai HbA1c ≥ 7 % ja tähän liittyviä diabeteksen oireita), pneumoniitti tai jokin muu interstitiaalisen keuhkosairauden muoto. Potilaat, jotka saivat solunsalpaajia neoadjuvanttihoitona, tai potilaat, jotka saivat solunsalpaajia adjuvanttihoitona kystektomian jälkeen, otettiin mukaan tutkimukseen, jos hoidon päättymisestä oli kulunut > 12 kuukautta ennen taudin uusiutumista. Potilaiden katsottiin olevan soveltumattomia saamaan sisplatiinia, jos he täyttivät ainakin yhden seuraavista kriteereistä: glomerulusten suodatusnopeus 30–59 ml/min, ECOG-toimintakykyluokka ≥ 2, vähintään vaikeusasteen 2 huonokuuloisuus tai NYHA-luokan III sydämen vajaatoiminta. Gemsitabiinin ja platinapohjaisen solunsalpaajahoidon haaraan satunnaistetuille potilaille voitiin antaa ylläpitohoitona immuunihoitoa. Satunnaistaminen stratifioitiin sen mukaan, soveltuiko potilas saamaan sisplatiinia (soveltui tai ei soveltunut), sekä PD‑L1:n ilmentymisen (CPS ≥ 10 tai CPS < 10 PD‑L1 IHC 22C3 pharmDxTM ‑testin mukaan) ja maksametastaasien (oli tai ei ollut) mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista, joissa kaikki tutkimuslääkkeet annettiin infuusiona laskimoon:
- kunkin 21 päivän hoitosyklin aikana pembrolitsumabia 200 mg 30 minuutin aikana päivänä 1 ja enfortumabi-vedotiinia 1,25 mg/kg päivinä 1 ja 8
- kunkin 21 päivän hoitosyklin aikana gemsitabiinia 1 000 mg/m2 päivinä 1 ja 8 ja tutkijalääkärin valinnan mukaan sisplatiinia 70 mg/m2 tai karboplatiinia (AUC 4,5 tai 5 mg/ml/min paikallisten ohjeiden mukaisesti) päivänä 1.
Pembrolitsumabi- ja enfortumabi-vedotiinihoitoa jatkettiin RECIST v1.1 ‑kriteerien mukaiseen taudin etenemiseen asti, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai pembrolitsumabin osalta enintään 35 hoitosyklin (enintään noin 2 vuoden) ajan. Kasvaimen tila arvioitiin 9 viikon välein 18 kuukauden ajan ja sitten 12 viikon välein.
Uroteelikarsinoomaa sairastavien 886 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 69 vuotta; 77 % miehiä ja 67 % valkoihoisia. 95 %:lla potilaista oli levinneisyysluokan M1 ja 5 %:lla levinneisyysluokan M0 tauti. 73 %:lla potilaista oli alavirtsatien primaarikasvain ja 27 %:lla ylävirtsatien primaarikasvain. 54 % potilaista soveltui saamaan sisplatiinia, ja 58 %:lla potilaista PD‑L1-ligandin CPS-pistemäärä oli ≥ 10. 72 %:lla potilaista oli sisäelimissä etäpesäkkeitä, ja 22 %:lla nämä olivat maksametastaaseja. 20 %:lla potilaista munuaisten toiminta oli normaalia, ja lievää munuaisten vajaatoimintaa katsottiin olevan 37 %:lla, kohtalaista 41 %:lla ja vaikeaa 2 %:lla potilaista. Potilaista 97 %:lla ECOG-toimintakykyluokka oli 0–1 ja 3 %:lla ECOG-toimintakykyluokka oli 2. 85 %:lla potilaista oli histologialtaan transitiosellulaarinen karsinooma, 2 %:lla oli transitiosellulaarinen karsinooma, jolla oli muu histologia, ja 6 %:lla oli transitiosellulaarinen karsinooma, johon liittyi levyepiteelidifferentiaatiota. 32 %:lle potilaista gemsitabiinia ja platinapohjaista solunsalpaajahoitoa saavien haarassa annettiin ylläpitohoitona immuunihoitoa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS), jonka arvioi BICR käyttämällä RECIST v1.1 ‑kriteerejä, ja kokonaiselinaika (OS). Toissijaisia lopputulosmuuttujia olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DoR), jotka arvioi BICR käyttämällä RECIST v1.1 ‑kriteerejä, sekä aika kivun pahenemiseen (time to pain progression, TTPP).
Tutkimus osoitti, että kokonaiselinaika, elinaika ilman taudin etenemistä ja objektiivisten vasteiden osuus olivat tilastollisesti merkitsevästi parantuneet potilailla, jotka oli satunnaistettu saamaan pembrolitsumabia yhdistelmänä enfortumabi-vedotiinin kanssa, verrattuna potilaisiin, jotka oli satunnaistettu saamaan gemsitabiinia ja platinapohjaista solunsalpaajahoitoa.
442:n pembrolitsumabia ja enfortumabi-vedotiinia saaneen potilaan seuranta-ajan mediaani oli 17,3 kuukautta (vaihteluväli 0,3–37,2 kuukautta). Keskeisistä tehoa koskevista tuloksista on esitetty yhteenveto taulukossa 24 ja kuvissa 22 ja 23.
Taulukko 24: KEYNOTE‑A39-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein yhdistelmänä Enfortumabi-vedotiinin kanssa n = 442 | Gemsitabiini + platinasolunsalpaajahoito ylläpitohoitona annettavan immuunihoidon kanssa tai ilman sitä |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 133 (30 %) | 226 (51 %) |
| Mediaani, kk (95 % CI) | 31,5 (25,4, ei saavutettu) | 16,1 (13,9, 18,3) |
| Riskisuhde* (95 % CI) | 0,47 (0,38, 0,58) | |
| p‑arvo† | < 0,00001 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 223 (50 %) | 307 (69 %) |
| Mediaani, kk (95 % CI) | 12,5 (10,4, 16,6) | 6,3 (6,2, 6,5) |
| Riskisuhde* (95 % CI) | 0,45 (0,38, 0,54) | |
| p‑arvo† | < 0,00001 | |
| Objektiivisten vasteiden osuus‡ | ||
| ORR§ % (95 % CI) | 68 % (63,1, 72,1) | 44 % (39,7, 49,2) |
| p‑arvo¶ | < 0,00001 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,0+, 28,3+) | 7,0 (1,5+, 30,9+) |
| * Ositetun Coxin verrannollisten riskitiheyksien regressiomallin mukaan † Kaksitahoinen p‑arvo ositetun log rank ‑testin perusteella ‡ Sisältää vain potilaat, joilla on mitattavissa oleva tauti lähtötilanteessa § Perustuu tietoihin parhaasta kokonaisvasteesta, vahvistettuna täydellisenä tai osittaisena vasteena ¶ Kaksitahoinen p‑arvo Cochran–Mantel–Haenszelin testin perusteella, ositus sen mukaan, soveltuuko potilas saamaan sisplatiinia, sekä PD‑L1:n ilmentymisen ja maksametastaasien mukaan | ||
Kuva 22: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE‑A39-tutkimuksessa
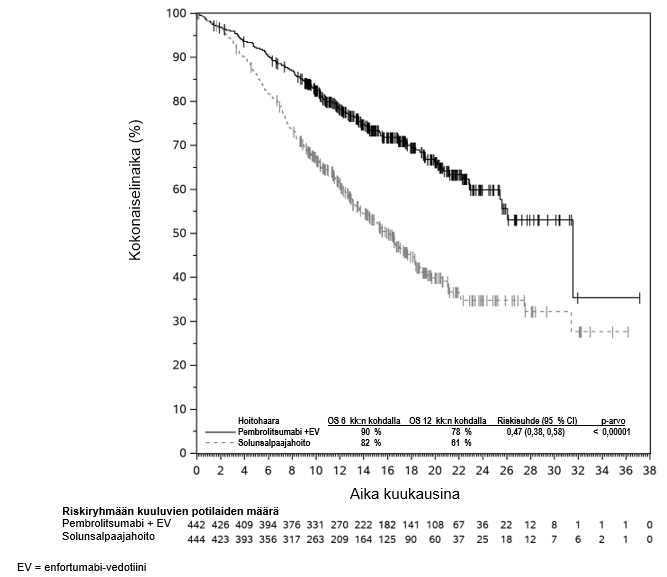
Kuva 23: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑A39-tutkimuksessa
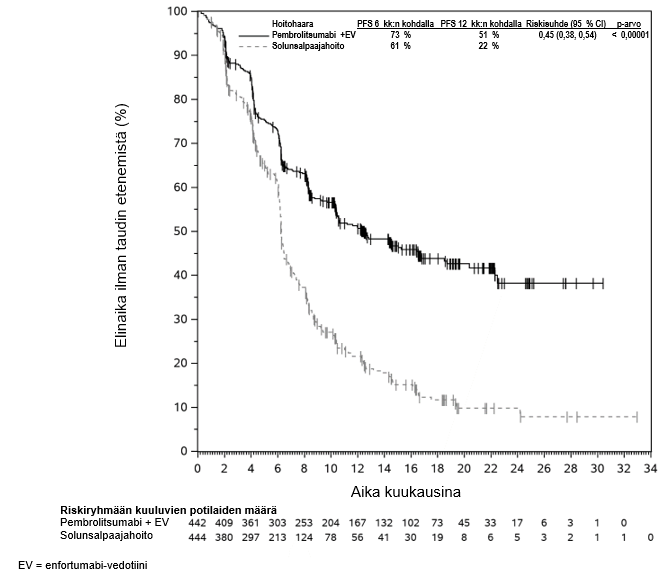
KEYNOTE-045: Kontrolloitu tutkimus platinapohjaista solunsalpaajahoitoa aiemmin saaneilla uroteelikarsinoomaa sairastavilla potilailla
Pembrolitsumabin turvallisuutta ja tehoa arvioitiin satunnaistetussa (1:1), avoimessa, kontrolloidussa KEYNOTE‑045-monikeskustutkimuksessa paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoidossa potilailla, joilla tauti oli edennyt platinapohjaisen solunsalpaajahoidon aikana tai sen jälkeen. Edellytyksenä oli, että potilaat olivat saaneet ensilinjan hoitona platinapohjaista hoitoa paikallisesti edenneen tai metastasoituneen taudin vuoksi tai neoadjuvantti- tai adjuvanttihoitona ja potilaiden sairaus oli uusiutunut tai edennyt korkeintaan 12 kuukauden kuluessa hoidon päättymisestä. Potilaat satunnaistettiin (1:1) saamaan joko pembrolitsumabia 200 mg:n annoksella kolmen viikon välein (n = 270) tai jotakin seuraavista tutkijalääkärin valitsemista solunsalpaajahoidoista laskimoon kolmen viikon välein (n = 272): paklitakseli 175 mg/m2 (n = 84), dosetakseli 75 mg/m2 (n = 84) tai vinfluniini 320 mg/m2 (n = 87). Potilaat saivat pembrolitsumabia, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tauti eteni. Hoitoa voitiin jatkaa taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Hoitoa voitiin jatkaa enintään 24 kuukauden ajan potilailla, joiden tauti ei edennyt. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus tai jotka olivat saaneet systeemistä solunsalpaajahoitoa useampana kuin kahtena aiemman linjan hoitona metastasoituneeseen uroteelikarsinoomaan. Jos potilaan ECOG-toimintakykyluokka oli 2, hemoglobiinin täytyi olla ≥ 10 g/dl, potilaalla ei saanut olla maksametastaaseja ja viimeksi annetun solunsalpaajahoidon viimeisestä annoksesta täytyi olla kulunut ≥ 3 kuukautta ennen tutkimukseen osallistumista. Kasvaimen tila arvioitiin 9 viikon kuluttua ensimmäisen annoksen antamisesta, sen jälkeen 6 viikon välein ensimmäisen vuoden ajan ja sitten 12 viikon välein.
KEYNOTE‑045-tutkimuksessa satunnaistettujen 542 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 66 vuotta (vaihteluväli: 26–88), 58 % oli vähintään 65-vuotiaita, miehiä 74 %, valkoihoisia 72 % ja aasialaisia 23 %, 56 %:lla potilaista ECOG-toimintakykyluokka oli 1 ja 1 %:lla ECOG-toimintakykyluokka oli 2, 96 %:lla oli levinneisyysluokan M1 ja 4 %:lla levinneisyysluokan M0 tauti. 87 %:lla potilaista oli sisäelimissä etäpesäkkeitä, ja 34 %:lla nämä olivat maksametastaaseja. 86 %:lla potilaista oli alavirtsatien primaarikasvain ja 14 %:lla oli ylävirtsatien primaarikasvain. 15 %:lla potilaista tauti oli edennyt aiemman neoadjuvantti- tai adjuvanttihoitona annetun platinapohjaisen solunsalpaajahoidon jälkeen. 21 % potilaista oli saanut kahta aiempaa systeemistä hoitoa metastasoituneen taudin yhteydessä. 76 % potilaista oli saanut aiemmin sisplatiinia, 23 % karboplatiinia ja 1 % potilaista oli saanut muita platinapohjaisia hoitoja.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS). Ne arvioi sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) käyttämällä RECIST 1.1 ‑kriteerejä. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat objektiivisten vasteiden osuus (ORR) (jonka arvioi BICR käyttämällä RECIST v1.1 ‑kriteerejä) ja vasteen kesto. Taulukossa 25 on tiivistelmä keskeisistä tehon mittareista lopullisessa analyysissä hoitoaikeen mukaiselle (ITT) potilasjoukolle. Lopulliseen analyysiin perustuva Kaplan-Meier-kuvaaja kokonaiselinajalle on esitetty kuvassa 24. Tutkimus osoitti, että pembrolitsumabiryhmään satunnaistettujen potilaiden kokonaiselinajat ja objektiivisten vasteiden osuudet olivat tilastollisesti merkitsevästi parantuneet solunsalpaajahoitoon verrattuna. Elinajassa ilman taudin etenemistä ei todettu tilastollisesti merkitsevää eroa pembrolitsumabin ja solunsalpaajahoidon välillä.
Taulukko 25: KEYNOTE‑045-tutkimuksessa todettu hoitovaste pembrolitsumabin annokselle 200 mg 3 viikon välein uroteelikarsinoomaa sairastavilla potilailla, jotka olivat aiemmin saaneet solunsalpaajahoitoa
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 270 | Solunsalpaajahoito n = 272 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 200 (74 %) | 219 (81 %) |
| Riskisuhde* (95 % CI) | 0,70 (0,57, 0,85) | |
| p-arvo† | < 0,001 | |
| Mediaani, kk (95 % CI) | 10,1 (8,0, 12,3) | 7,3 (6,1, 8,1) |
| PFS‡ | ||
| Potilaat (%), joilla todettiin tapahtuma | 233 (86 %) | 237 (87 %) |
| Riskisuhde* (95 % CI) | 0,96 (0,79, 1,16) | |
| p-arvo† | 0,313 | |
| Mediaani, kk (95 % CI) | 2,1 (2,0, 2,2) | 3,3 (2,4, 3,6) |
| Objektiivisten vasteiden osuus ‡ | ||
| ORR % (95 % CI) | 21 % (16, 27) | 11 % (8, 15) |
| p-arvo§ | < 0,001 | |
| Täydellinen vaste | 9 % | 3 % |
| Osittainen vaste | 12 % | 8 % |
| Vakaa tauti | 17 % | 34 % |
| Vasteen kesto‡,¶ | ||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (1,6+, 30,0+) | 4,4 (1,4+, 29,9+) |
| Potilaat (%#), joilla kesto on ≥ 6 kk | 46 (84 %) | 8 (47 %) |
| Potilaat (%#), joilla kesto on ≥ 12 kk | 35 (68 %) | 5 (35 %) |
| * Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Ositetun log rank ‑testin perusteella ‡ Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi käyttämällä RECIST 1.1 ‑kriteerejä §Perustuu Miettisen ja Nurmisen menetelmään ¶ Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena # Perustuu Kaplan-Meier-arvioon | ||
Kuva 24: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE‑045-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
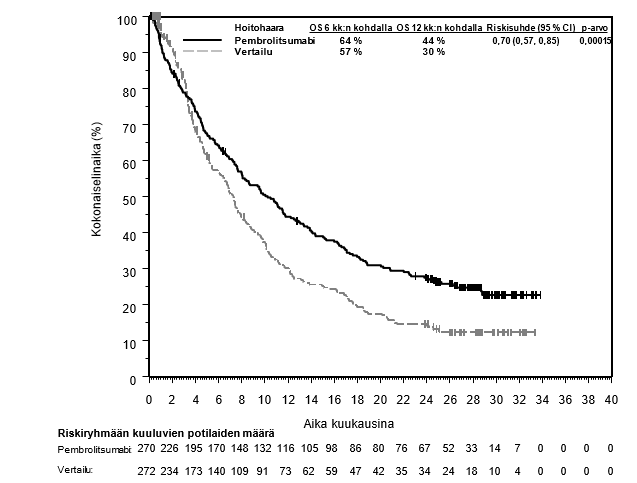
KEYNOTE‑045-tutkimuksessa tehtiin analyysi potilailla, joilla PD‑L1-ligandin CPS-pistemäärä oli < 10 [pembrolitsumabi: n = 186 (69 %), solunsalpaajahoito: n = 176 (65 %)] tai ≥ 10 [pembrolitsumabi: n = 74 (27 %), solunsalpaajahoito: n = 90 (33 %)], sekä pembrolitsumabi- että solunsalpaajahoitohaaroissa (ks. taulukko 26).
Taulukko 26: Kokonaiselinaika (OS) PD‑L1:n ilmentymisen mukaan
| PD-L1:n ilmentyminen | Pembrolitsumabi | Solunsalpaajahoito | |
OS PD‑L1:n ilmentymisen mukaan Niiden potilaiden määrä (%), joilla ilmeni tapahtuma* | Riskisuhde†(95 % CI) | ||
| CPS < 10 | 140 (75 %) | 144 (82 %) | 0,75 (0,59, 0,95) |
| CPS ≥ 10 | 53 (72 %) | 72 (80 %) | 0,55 (0,37, 0,81) |
| * Perustuu lopulliseen analyysiin † Riskisuhde (pembrolitsumabi solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan | |||
Potilaiden ilmoittamat hoitotulokset arvioitiin käyttämällä EORTC QLQ‑C30 ‑kyselyä. EORTC QLC‑C30-mittarilla todettiin pidentynyt aika yleisen terveydentilan / elämänlaadun heikkenemiseen potilailla, jotka olivat saaneet pembrolitsumabia, verrattuna tutkijalääkärin valitsemaan solunsalpaajahoitoon (riskisuhde 0,70; 95 %:n luottamusväli 0,55–0,90). 15 viikon mittaisen seurannan aikana pembrolitsumabia saaneiden potilaiden yleinen terveydentila / elämänlaatu pysyi vakaana, kun taas tutkijalääkärin valitsemaa solunsalpaajahoitoa saaneilla yleinen terveydentila / elämänlaatu heikkeni. Näitä tuloksia on tulkittava ottaen huomioon, että kyseessä oli avoin tutkimusasetelma, ja siksi tuloksiin on suhtauduttava varauksella.
KEYNOTE-052: Avoin tutkimus uroteelikarsinoomaa sairastavilla potilailla, jotka eivät sovellu saamaan sisplatiinia sisältävää solunsalpaajahoitoa
Pembrolitsumabin turvallisuutta ja tehoa arvioitiin avoimessa KEYNOTE‑52-monikeskustutkimuksessa paikallisesti edenneen tai metastasoituneen uroteelikarsinooman hoidossa potilailla, jotka eivät soveltuneet saamaan sisplatiinia sisältävää solunsalpaajahoitoa. Potilaat saivat pembrolitsumabia 200 mg:n annoksella kolmen viikon välein, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tauti eteni. Hoitoa voitiin jatkaa taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Hoitoa voitiin jatkaa enintään 24 kuukauden ajan potilailla, joiden tauti ei edennyt. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Kasvaimen tila arvioitiin 9 viikon kuluttua ensimmäisen annoksen antamisesta, sen jälkeen 6 viikon välein ensimmäisen vuoden ajan ja sitten 12 viikon välein.
Uroteelikarsinoomaa sairastavilla 370 potilaalla, jotka eivät soveltuneet saamaan sisplatiinia sisältävää solunsalpaajahoitoa, tiedot lähtötilanteessa olivat: mediaani-ikä 74 vuotta (82 % oli vähintään 65‑vuotiaita); miehiä 77 %, valkoihoisia 89 % ja aasialaisia 7 %. 88 %:lla potilaista oli levinneisyysluokan M1 tauti ja 12 %:lla levinneisyysluokan M0 tauti. 85 %:lla potilaista oli sisäelimissä etäpesäkkeitä, ja 21 %:lla nämä olivat maksametastaaseja. Sisplatiinihoitoon soveltumattomuuden syitä olivat: lähtötilanteen kreatiniinipuhdistuma oli < 60 ml/min (50 %), ECOG-toimintakykyluokka oli 2 (32 %), ECOG-toimintakykyluokka oli 2 ja lähtötilanteen kreatiniinipuhdistuma oli < 60 ml/min (9 %) tai jokin muu syy (luokan III sydämen vajaatoiminta, vähintään vaikeusasteen 2 perifeerinen neuropatia ja vähintään vaikeusasteen 2 huonokuuloisuus; 9 %). 90 % potilaista ei ollut saanut aiempaa hoitoa ja 10 % potilaista oli aiemmin saanut platinapohjaista solunsalpaajahoitoa adjuvantti- tai neoadjuvanttihoitona. 81 %:lla potilaista oli alavirtsatien primaarikasvain ja 19 %:lla potilaista oli ylävirtsatien primaarikasvain.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli objektiivisten vasteiden osuus (ORR), jonka arvioi sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) käyttämällä RECIST 1.1 ‑kriteerejä. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika (OS). Taulukossa 27 on esitetty tiivistelmä keskeisistä tehon mittareista tutkimuspopulaatioille lopullisessa analyysissä. Tulokset perustuvat seuranta-ajan 11,4 kuukauden mediaaniin (vaihteluväli 0,1–41,2 kuukautta) kaikilla potilailla.
Taulukko 27: KEYNOTE‑052-tutkimuksessa todettu hoitovaste pembrolitsumabin annokselle 200 mg 3 viikon välein uroteelikarsinoomaa sairastavilla potilailla, jotka eivät sovellu saamaan sisplatiinia sisältävää solunsalpaajahoitoa
| Päätetapahtuma | n = 370 |
| Objektiivisten vasteiden osuus* | |
| ORR % (95 % CI) | 29 % (24, 34) |
| Hallinnassa oleva tauti † | 47 % |
| Täydellinen vaste | 9 % |
| Osittainen vaste | 20 % |
| Vakaa tauti | 18 % |
| Vasteen kesto | |
| Mediaani, kk (vaihteluväli) | 30,1 (1,4+, 35,9+) |
| %-osuus potilaita, joilla kesto on ≥ 6 kk | 81 %‡ |
| Aika vasteen saavuttamiseen | |
| Mediaani, kk (vaihteluväli) | 2,1 (1,3, 9,0) |
| PFS* | |
| Mediaani, kk (95 % CI) | 2,2 (2,1, 3,4) |
| 6 kuukauden PFS-osuus | 33 % |
| 12 kuukauden PFS-osuus | 22 % |
| OS | |
| Mediaani, kk (95 % CI) | 11,3 (9,7, 13,1) |
| 6 kuukauden OS-osuus | 67 % |
| 12 kuukauden OS-osuus | 47 % |
| * Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi käyttämällä RECIST 1.1 ‑kriteerejä † Perustuu parhaaseen vasteeseen, joka on stabiili tauti tai parempi ‡ Perustuu Kaplan-Meierin estimaatteihin; sisältää 84 potilasta, joiden vasteiden kesto oli vähintään 6 kuukautta | |
KEYNOTE‑052-tutkimuksessa tehtiin analyysi potilailla, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli < 10 (n = 251; 68 %) tai ≥ 10 (n = 110; 30 %) mitattuna PD-L1 IHC 22C3 pharmDxTM Kit -testillä (ks. taulukko 28).
Taulukko 28: Objektiivisten vasteiden osuus (ORR) ja kokonaiselinaika (OS) PD‑L1:n ilmentymisen mukaan
| Päätetapahtuma | CPS < 10 n = 251 | CPS ≥ 10 n = 110 |
| Objektiivisten vasteiden osuus* | ||
| ORR % (95 % CI) | 20 % (16, 26) | 47 % (38, 57) |
| OS | ||
| Mediaani, kk (95 % CI) | 10 (8, 12) | 19 (12, 29) |
| 12 kuukauden OS-osuus | 41 % | 61 % |
| * Sokkoutettu riippumaton keskitetty arviointi (Blinded Independent Central Review, BICR) RECIST 1.1 ‑kriteereillä | ||
KEYNOTE-361 on vaiheen III satunnaistettu, kontrolloitu, avoin kliininen tutkimus, jossa arvioidaan pembrolitsumabia yhdessä platinapohjaisen yhdistelmäsolunsalpaajahoidon (joko sisplatiinin tai karboplatiinin ja gemsitabiinin yhdistelmän) kanssa tai ilman sitä verrattuna solunsalpaajahoitoon ensilinjan hoitona edennyttä tai metastasoitunutta uroteelikarsinoomaa sairastavilla tutkittavilla. KEYNOTE‑361-tutkimuksessa pembrolitsumabin ja solunsalpaajahoidon yhdistelmä ei pidentänyt tilastollisesti merkitsevästi elinaikaa ilman taudin etenemistä, jonka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä (riskisuhde 0,78; 95 %:n luottamusväli 0,65, 0,93; p = 0,0033), eikä kokonaiselinaikaa (riskisuhde 0,86; 95 %:n luottamusväli 0,72, 1,02; p = 0,0407) verrattuna pelkkään solunsalpaajahoitoon. Ennalta määritellyn hierarkkisen testausjärjestyksen mukaisesti tilastollista merkitsevyyttä pembrolitsumabin ja solunsalpaajahoidon välillä ei voitu muodollisesti testata. Keskeiset pembrolitsumabimonoterapian tehoa koskevat tulokset potilailla, joille tutkijalääkäri valitsi solunsalpaajaksi karboplatiinin, koska katsoi sen olevan sisplatiinia parempi hoitovaihtoehto, olivat yhdenmukaiset KEYNOTE‑052-tutkimuksen tulosten kanssa. Tehoa koskevat tulokset potilailla, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10, olivat samankaltaiset kuin koko potilasjoukossa, jonka solunsalpaajahoidoksi valittiin karboplatiini. Ks. taulukko 29 ja kuvat 25 ja 26.
Taulukko 29: KEYNOTE‑361-tutkimuksessa todettu hoitovaste pembrolitsumabin annokselle 200 mg 3 viikon välein tai solunsalpaajahoidolle aiemmin hoitamatonta uroteelikarsinoomaa sairastavilla potilailla, joille tutkijalääkäri valitsi solunsalpaajaksi karboplatiinin, koska katsoi sen olevan sisplatiinia parempi hoitovaihtoehto
| Päätetapahtuma | Pembrolitsumabi n = 170 | Solunsalpaajahoito n = 196 | Pembrolitsumabi n = 84 | Solunsalpaajahoito n = 89 |
| Objektiivisten vasteiden osuus* | ||||
| ORR % (95 % CI) | 28 % (21,1, 35,0) | 42 % (34,8, 49,1) | 30 % (20,3, 40,7) | 46 % (35,4, 57,0) |
| Täydellinen vaste | 10 % | 11 % | 12 % | 18 % |
| Osittainen vaste | 18 % | 31 % | 18 % | 28 % |
| Vasteen kesto* | ||||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (3,2+, 36,1+) | 6,3 (1,8+, 33,8+) | Ei saavutettu (4,2, 36,1+) | 8,3 (2,1+, 33,8+) |
| %-osuus potilaita, joilla kesto on ≥ 12 kk† | 57 % | 30 % | 63 % | 38 % |
| PFS* | ||||
| Mediaani, kk (95 % CI) | 3,2 (2,2, 5,5) | 6,7 (6,2, 8,1) | 3,9 (2,2, 6,8) | 7,9 (6,1, 9,3) |
| 12 kuukauden PFS-osuus | 25 % | 24 % | 26 % | 31 % |
| OS | ||||
| Mediaani, kk (95 % CI) | 14,6 (10,2, 17,9) | 12,3 (10,0, 15,5) | 15,6 (8,6, 19,7) | 13,5 (9,5, 21,0) |
| 12 kuukauden OS‑osuus | 54 % | 51 % | 57 % | 54 % |
| * Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi käyttämällä RECIST 1.1 ‑kriteerejä † Perustuu Kaplan–Meier‑arvioon | ||||
Kuva 25: Kaplan–Meier‑kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑361-tutkimuksessa (hoitoaikeen mukainen potilasjoukko, valittuna hoitona karboplatiini)
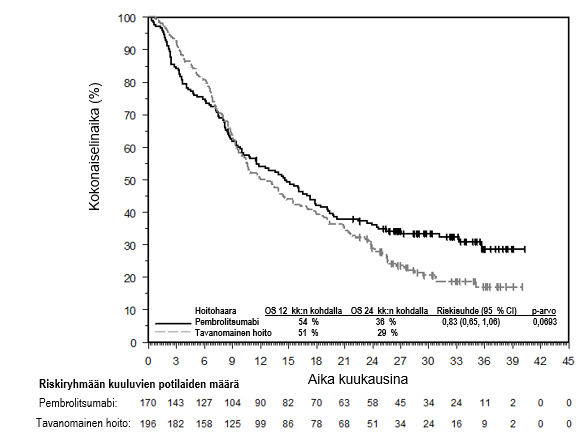
Kuva 26: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑361-tutkimuksessa (potilailla, joilla PD‑L1:n ilmentymistä kuvaava CPS-pistemäärä oli ≥ 10, hoitoaikeen mukainen potilasjoukko, valittuna hoitona karboplatiini)
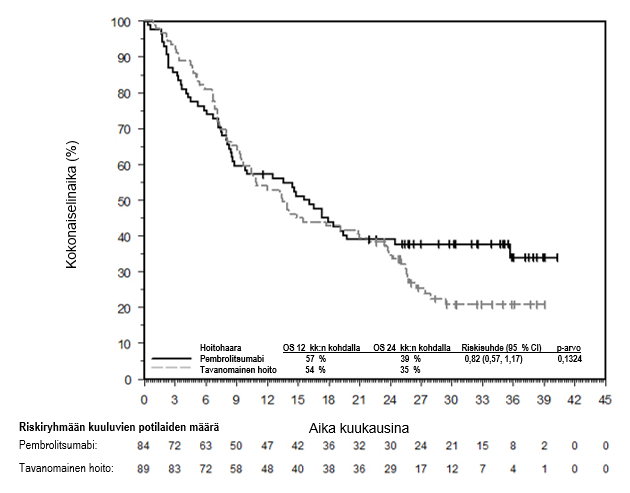
Pään ja kaulan alueen levyepiteelikarsinooma
KEYNOTE-689: Kontrolloitu tutkimus, jossa arvioitiin neoadjuvantti- ja adjuvanttihoitoa potilailla, joilla on leikkaukseen soveltuva, paikallisesti edennyt pään ja kaulan alueen levyepiteelikarsinooma
Satunnaistetussa, avoimessa, aktiivikontrolloidussa monikeskustutkimuksessa KEYNOTE-689 arvioitiin pembrolitsumabin tehoa 714 potilaalla, joilla oli leikkaukseen soveltuva, paikallisesti edennyt (levinneisyysaste III–IVA) pään ja kaulan alueen levyepiteelikarsinooma. Tutkimukseen eivät soveltuneet potilaat, joilla oli aktiivinen autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin primaarikasvaimen sijainnin (suunielu/suuontelo tai kurkunpää tai alanielu), AJCC-käsikirjan 8. painoksen mukaisesti arvioidun kasvaimen levinneisyysasteen (III tai IVA) ja PD-L1:n ilmentymisen (TPS ≥ 50 % tai < 50 %) mukaan.
Potilaat satunnaistettiin suhteessa 1:1 jompaankumpaan seuraavista hoitohaaroista:
-
Hoitohaara A: neoadjuvanttihoitona 200 mg pembrolitsumabia kahden hoitosyklin ajan ennen poistoleikkausta. 6 viikon kuluessa leikkauksen jälkeen 200 mg pembrolitsumabia kolmen hoitosyklin ajan joko yhdistelmänä sädehoidon ja samanaikaisen sisplatiinihoidon (3 hoitosykliä, 100 mg/m2 kolmen viikon välein) kanssa potilailla, joilla oli suuren riskin patologisia piirteitä leikkauksen jälkeen, tai yhdistelmänä pelkän sädehoidon kanssa potilailla, joilla ei ollut suuren riskin patologisia piirteitä leikkauksen jälkeen. Tämän jälkeen annettiin 200 mg pembrolitsumabia kolmen viikon välein enintään 12 hoitosyklin ajan.
• Hoitohaara B: ei neoadjuvanttihoitoa ennen leikkausta. 6 viikon kuluessa leikkauksen jälkeen joko sädehoitoa ja samanaikaista sisplatiinihoitoa (3 hoitosykliä, 100 mg/m2 kolmen viikon välein) potilailla, joilla oli suuren riskin patologisia piirteitä leikkauksen jälkeen, tai pelkkää sädehoitoa potilailla, joilla ei ollut suuren riskin patologisia piirteitä leikkauksen jälkeen.
Suuren riskin patologiset piirteet määriteltiin näytöksi positiivisista leikkausmarginaaleista tai kasvaimen ulottumisesta imusolmukkeen ulkopuolelle poistoleikkauksen jälkeen.
Pembrolitsumabihoitoa jatkettiin, kunnes BICR arvioi RECIST 1.1 -kriteerien mukaan taudin edenneen, hoito oli saatu päätökseen (17 hoitosykliä), taudin eteneminen sulki pois parantavan leikkaushoidon, tauti uusiutui adjuvanttihoitovaiheessa, tauti eteni potilailla, jotka eivät saaneet leikkaushoitoa tai joille tehtiin epätäydellinen resektio ja jotka siirtyivät adjuvanttivaiheeseen, tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Kasvaimen tila arvioitiin ennen leikkausta neoadjuvanttihoitovaiheen viikolla 6. Adjuvanttihoitovaiheen alkamisen jälkeen kasvaimen tila arvioitiin 12 viikon kuluttua sädehoidon ja mahdollisen sisplatiinihoidon päättymisestä, sen jälkeen 3 kuukauden välein vuoden 3 loppuun asti ja tämän jälkeen 6 kuukauden välein vuoden 5 loppuun asti. Hoitohaarassa A 89 %:lle potilaista tehtiin leikkaus, kun taas hoitohaarassa B leikkaus tehtiin 88 %:lle potilaista. Hoitohaarassa A 29 % potilaista sai sisplatiinia ja sädehoitoa ja 46 % sai pelkkää sädehoitoa. Hoitohaarassa B 40 % potilaista sai sisplatiinia ja sädehoitoa ja 39 % sai pelkkää sädehoitoa.
KEYNOTE-689-tutkimukseen osallistuneista 714 potilaasta 682:lla (96 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 PD-L1 IHC 22C3 pharmDxTM -testin mukaan. Näiden 682 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 60 vuotta (vaihteluväli: 22–87), 33 % oli vähintään 65-vuotiaita, 79 % miehiä, 78 % valkoihoisia, 13 % aasialaisia ja 2,5 % mustaihoisia, 43 %:lla ECOG-toimintakykyluokka oli 1 ja 79 % oli aiemmin tupakoinut tai tupakoi edelleen. Potilaiden kasvaimista 4 % oli HPV-positiivisia, ja 26 %:lla potilaista taudin levinneisyysaste oli III ja 74 %:lla taudin levinneisyysaste oli IVA.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli BICR:n arvioima tapahtumavapaa elinaika (EFS). Tapahtumavapaa elinaika oli määritelty ajaksi satunnaistamisesta siihen asti, kunnes mikä tahansa seuraavista tapahtumista ilmeni ensimmäisen kerran: parantavan leikkauksen poissulkeva taudin eteneminen, paikallinen tai etäpesäkkeinen taudin eteneminen tai uusiutuminen tai mistä tahansa syystä johtunut kuolema. Toista primaaria maligniteettia ei katsottu tapahtumaksi. Muita tehoa mittaavia lopputulosmuuttujia olivat BIPR:n arvioima patologisesti todettujen merkittävien vasteiden osuus (mPR), kokonaiselinaika (OS) ja BIPR:n arvioima patologisesti todettujen täydellisten vasteiden osuus (pCR).
Tutkimus osoitti, että tapahtumavapaa elinaika oli tilastollisesti merkitsevästi parantunut (riskisuhde 0,73; 95 %:n luottamusväli 0,58–0,92; p-arvo 0,00411) potilailla, jotka oli satunnaistettu saamaan pembrolitsumabia yhdistelmänä sädehoidon ja mahdollisen samanaikaisen sisplatiinihoidon kanssa, verrattuna potilaisiin, jotka oli satunnaistettu saamaan sädehoitoa ja mahdollista samanaikaista sisplatiinihoitoa, koko populaatiossa ensimmäisen etukäteen määritellyn välianalyysin kohdalla. Kokonaiselinaikaa välianalyysin kohdalla ei arvioitu muodollisesti. Taulukossa 30 on tiivistelmä keskeisistä tehoa koskevista tuloksista etukäteen määritellyssä potilaiden alaryhmässä, jossa kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, kun seuranta-ajan mediaani oli 27,0 kuukautta (vaihteluväli: 0,5–66,5 kuukautta). Kaplan–Meier-kuvaajat kokonaiselinajasta ja tapahtumavapaasta elinajasta on esitetty kuvissa 27 ja 28.
Taulukko 30: KEYNOTE-689-tutkimuksen tehoa koskevat tulokset potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS ≥ 1)
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein + sädehoito ja mahdollinen sisplatiini n = 347 | Sädehoito ja mahdollinen sisplatiini n = 335 |
| EFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 128 (37 %) | 156 (47 %) |
| Mediaani, kk* (95 % CI) | 59,7 (37,9, ei saavutettu) | 29,6 (19,5, 41,9) |
| Riskisuhde† (95 % CI) | 0,70 (0,55, 0,89) | |
| p-arvo‡ | 0,00140 | |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 106 (31 %) | 128 (38 %) |
| Mediaani, kk* (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | 61,8 (49,2, ei saavutettu) |
| Riskisuhde† (95 % CI) | 0,72 (0,56, 0,94) | |
| * Perustuu sensuroidulle tietojoukolle johdettuun rajatulomenetelmään (Kaplan–Meier-menetelmään). † Perustuu Coxin regressiomalliin, jossa on käytetty tasatulosten käsittelyyn Efronin menetelmää ja jossa kovariaattina on hoito, ositus primaarikasvaimen sijainnin ja kasvaimen levinneisyysasteen mukaan ‡ Yksitahoinen p-arvo log rank-testin perusteella, ositus primaarikasvaimen sijainnin ja kasvaimen levinneisyysasteen mukaan: vertailukohtana yksitahoisen p-arvon raja 0,0124 | ||
Kuva 27: Kaplan–Meier-kuvaaja tapahtumavapaalle elossaololle hoitohaaroittain KEYNOTE-689-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
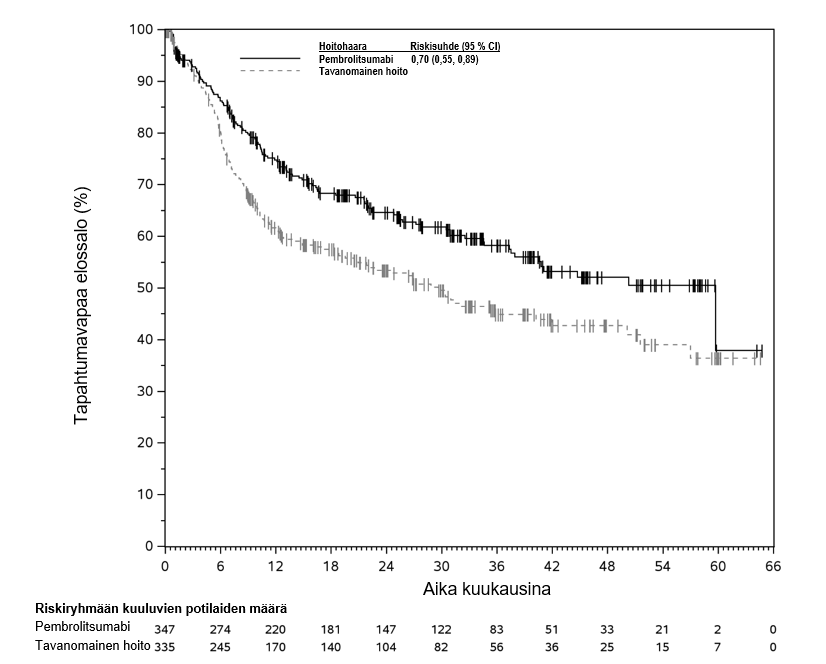
Kuva 28: Kaplan–Meier-kuvaaja kokonaiselossaololle hoitohaaroittain KEYNOTE‑689-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
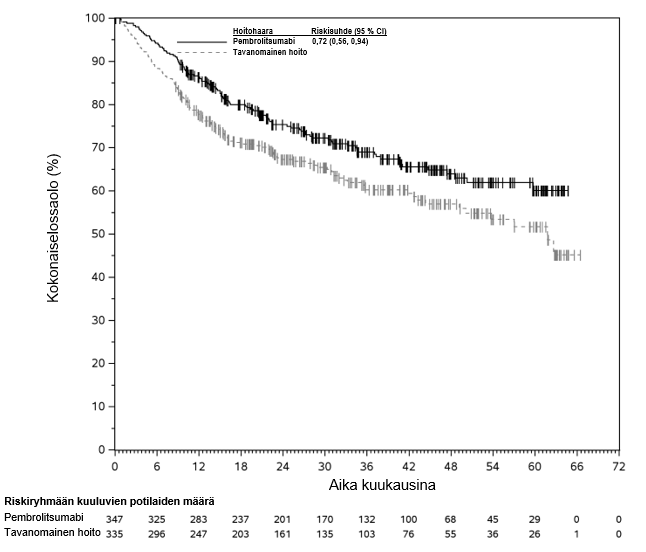
KEYNOTE-048: Monoterapiaa ja yhdistelmähoitoa koskeva kontrolloitu tutkimus pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa uusiutuneen tai metastasoituneen taudin yhteydessä
Satunnaistetussa, avoimessa, aktiivikontrolloidussa monikeskustutkimuksessa KEYNOTE-048 arvioitiin pembrolitsumabin tehoa potilailla, joilla oli histologisesti vahvistettu metastasoitunut tai uusiutunut pään ja kaulan alueen (suuontelon, nielun tai kurkunpään) levyepiteelikarsinooma, jotka eivät olleet aiemmin saaneet systeemistä hoitoa uusiutuneeseen tai metastasoituneeseen tautiin ja joiden taudin parantamista paikallisilla hoidoilla ei pidetty mahdollisena. Potilaat, joilla oli nenänielukarsinooma, aktiivinen autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin kasvaimen PD-L1:n ilmentymisen (TPS ≥ 50 % tai < 50 %), HPV-statuksen (positiivinen tai negatiivinen) ja ECOG-toimintakykyluokan (0 vs. 1) mukaan. Potilaat satunnaistettiin suhteessa 1:1:1 johonkin seuraavista hoitohaaroista:
- Pembrolitsumabia 200 mg 3 viikon välein
- Pembrolitsumabia 200 mg 3 viikon välein, karboplatiinia (AUC 5 mg/ml/min) 3 viikon välein tai sisplatiinia 100 mg/m2 3 viikon välein ja 5‑fluorourasiilia 1 000 mg/m2/vrk jatkuvasti 4 vuorokauden ajan 3 viikon välein (enintään 6 hoitosykliä platinaa ja 5‑fluorourasiilia)
- Setuksimabia latausannos 400 mg/m2 ja sen jälkeen 250 mg/m2 kerran viikossa, karboplatiinia (AUC 5 mg/ml/min) 3 viikon välein tai sisplatiinia 100 mg/m2 3 viikon välein ja 5‑fluorourasiilia 1 000 mg/m2/vrk jatkuvasti 4 vuorokauden ajan 3 viikon välein (enintään 6 hoitosykliä platinaa ja 5‑fluorourasiilia).
Pembrolitsumabihoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST 1.1 ‑kriteerien mukaan taudin edenneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Pembrolitsumabihoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Kasvaimen tila arvioitiin viikolla 9, sen jälkeen 6 viikon välein ensimmäisen vuoden ajan ja tämän jälkeen 9 viikon välein 24 kuukauden ajan.
KEYNOTE-048-tutkimukseen osallistuneista 882 potilaasta 754:llä (85 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 PD-L1 IHC 22C3 pharmDx TM -testin mukaan. Näiden 754 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 61 vuotta (vaihteluväli: 20–94), 36 % oli vähintään 65-vuotiaita, 82 % miehiä, 74 % valkoihoisia ja 19 % aasialaisia, 61 %:lla ECOG-toimintakykyluokka oli 1, ja 77 % oli aiemmin tupakoinut tai tupakoi edelleen. Sairauden ominaisuudet olivat: 21 % kasvaimista oli HPV-positiivisia, ja 95 %:lla potilaista taudin levinneisyysaste oli IV (21 % astetta IVa, 6 % astetta IVb ja 69 % astetta IVc).
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Tutkimus osoitti, että kokonaiselinaika oli tilastollisesti merkitsevästi parantunut kaikilla pembrolitsumabin ja solunsalpaajahoidon yhdistelmähaaraan satunnaistetuilla potilailla verrattuna tavanomaiseen hoitoon (riskisuhde 0,72; 95 %:n luottamusväli 0,60–0,87) ja pembrolitsumabimonoterapiahaaraan satunnaistetuilla potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, verrattuna tavanomaiseen hoitoon. Taulukoissa 31 ja 32 on tiivistelmä KEYNOTE-048-tutkimuksen keskeisistä tehoa koskevista tuloksista pembrolitsumabille potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, lopullisessa analyysissä, joka tehtiin, kun seuranta-ajan mediaani oli 13 kuukautta pembrolitsumabia yhdistelmänä solunsalpaajahoidon kanssa saaneilla ja 11,5 kuukautta pembrolitsumabimonoterapiaa saaneilla. Lopulliseen analyysiin perustuvat Kaplan-Meier-kuvaajat kokonaiselinajalle on esitetty kuvissa 29 ja 30.
Taulukko 31: Pembrolitsumabin ja solunsalpaajahoidon yhdistelmän tehoa koskevat tulokset KEYNOTE‑048-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
| Päätetapahtuma | Pembrolitsumabi + platinasolunsalpaajahoito + 5-fluorourasiili n = 242 | Tavanomainen hoito* n = 235 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 177 (73 %) | 213 (91 %) |
| Mediaani, kk (95 % CI) | 13,6 (10,7, 15,5) | 10,4 (9,1, 11,7) |
| Riskisuhde† (95 % CI) | 0,65 (0,53, 0,80) | |
| p-arvo‡ | 0,00002 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 212 (88 %) | 221 (94 %) |
| Mediaani, kk (95 % CI) | 5,1 (4,7, 6,2) | 5,0 (4,8, 6,0) |
| Riskisuhde† (95 % CI) | 0,84 (0,69, 1,02) | |
| p-arvo‡ | 0,03697 | |
| Objektiivisten vasteiden osuus | ||
| ORR§ % (95 % CI) | 36 % (30,3, 42,8) | 36 % (29,6, 42,2) |
| Täydellinen vaste | 7 % | 3 % |
| Osittainen vaste | 30 % | 33 % |
| p-arvo¶ | 0,4586 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 6,7 (1,6+, 39,0+) | 4,3 (1,2+, 31,5+) |
| Kesto ≥ 6 kuukautta, % | 54 % | 34 % |
| * Setuksimabi, platina ja 5‑fluorourasiili † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Ositetun log rank -testin perusteella § Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena ¶ Perustuu Miettisen ja Nurmisen menetelmään, ositus ECOG-toimintakykyluokan (0 vs. 1), HPV-statuksen (positiivinen vs. negatiivinen) ja PD-L1-statuksen (vahvasti positiivinen vs. ei vahvasti positiivinen) mukaan | ||
Kuva 29: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE-048-tutkimuksessa pembrolitsumabin ja solunsalpaajahoidon yhdistelmää saaneilla potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
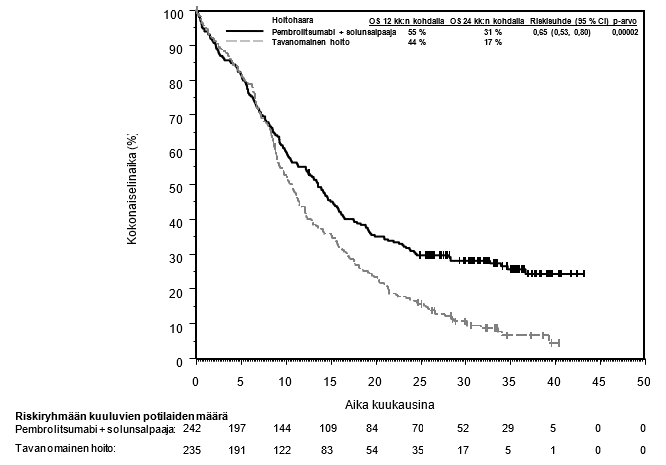
Taulukko 32: Pembrolitsumabimonoterapian tehoa koskevat tulokset KEYNOTE‑048-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
| Päätetapahtuma | Pembrolitsumabi n = 257 | Tavanomainen hoito* n = 255 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 197 (77 %) | 229 (90 %) |
| Mediaani, kk (95 % CI) | 12,3 (10,8, 14,3) | 10,3 (9,0, 11,5) |
| Riskisuhde† (95 % CI) | 0,74 (0,61, 0,90) | |
| p-arvo‡ | 0,00133 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 228 (89 %) | 237 (93 %) |
| Mediaani, kk (95 % CI) | 3,2 (2,2, 3,4) | 5,0 (4,8, 6,0) |
| Riskisuhde† (95 % CI) | 1,13 (0,94, 1,36) | |
| p-arvo‡ | 0,89580 | |
| Objektiivisten vasteiden osuus | ||
| ORR§ % (95 % CI) | 19,1 % (14,5, 24,4) | 35 % (29,1, 41,1) |
| Täydellinen vaste | 5 % | 3 % |
| Osittainen vaste | 14 % | 32 % |
| p-arvo¶ | 1,0000 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 23,4 (1,5+, 43,0+) | 4,5 (1,2+, 38,7+) |
| Kesto ≥ 6 kuukautta, % | 81 % | 36 % |
| * Setuksimabi, platina ja 5‑fluorourasiili † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Ositetun log rank -testin perusteella § Vaste: Paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena ¶ Perustuu Miettisen ja Nurmisen menetelmään, ositus ECOG-toimintakykyluokan (0 vs. 1), HPV-statuksen (positiivinen vs. negatiivinen) ja PD-L1-statuksen (vahvasti positiivinen vs. ei vahvasti positiivinen) mukaan | ||
Kuva 30: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE-048-tutkimuksessa pembrolitsumabimonoterapiaa saaneilla potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
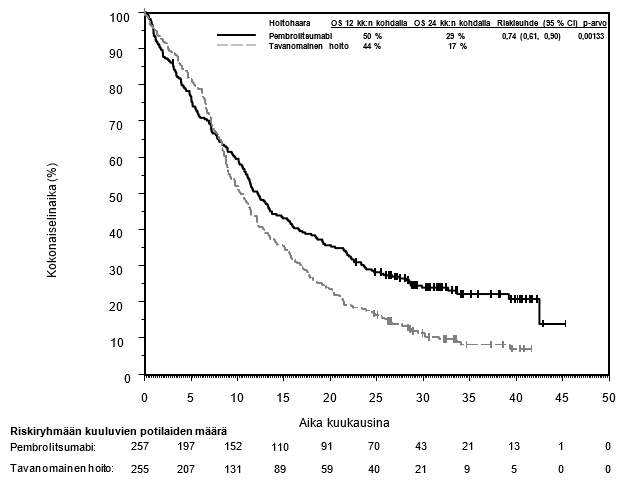
KEYNOTE‑048-tutkimuksessa tehtiin analyysi potilailla, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 20 [pembrolitsumabi ja solunsalpaaja: n = 126 (49 %) vs. tavanomainen hoito: n = 110 (43 %) ja pembrolitsumabimonoterapia: n = 133 (52 %) vs. tavanomainen hoito: n = 122 (48 %)] (ks. taulukko 33).
Taulukko 33: Pembrolitsumabin ja solunsalpaajahoidon yhdistelmän sekä pembrolitsumabimonoterapian tehoa koskevat tulokset KEYNOTE‑048-tutkimuksessa PD-L1:n ilmentymisen mukaan (CPS-pistemäärä ≥ 20)
| Päätetapahtuma | Pembrolitsumabi + platina- solunsalpaajahoito + 5-fluorourasiili n = 126 | Tavanomainen hoito* n = 110 | Pembrolitsumabi- monoterapia n = 133 | Tavanomainen hoito* n = 122 |
| OS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 84 (66,7 %) | 98 (89,1 %) | 94 (70,7 %) | 108 (88,5 %) |
| Mediaani, kk (95 % CI) | 14,7 (10,3, 19,3) | 11,0 (9,2, 13,0) | 14,8 (11,5, 20,6) | 10,7 (8,8, 12,8) |
| Riskisuhde† (95 % CI) | 0,60 (0,45, 0,82) | 0,58 (0,44, 0,78) | ||
| p-arvo‡ | 0,00044 | 0,00010 | ||
| OS-osuus 6 kuukauden kuluttua (95 % CI) | 74,6 (66,0, 81,3) | 80,0 (71,2, 86,3) | 74,4 (66,1, 81,0) | 79,5 (71,2, 85,7) |
| OS-osuus 12 kuukauden kuluttua (95 % CI) | 57,1 (48,0, 65,2) | 46,1 (36,6, 55,1) | 56,4 (47,5, 64,3) | 44,9 (35,9, 53,4) |
| OS-osuus 24 kuukauden kuluttua (95 % CI) | 35,4 (27,2, 43,8) | 19,4 (12,6, 27,3) | 35,3 (27,3, 43,4) | 19,1 (12,7, 26,6) |
| PFS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 106 (84,1 %) | 104 (94,5 %) | 115 (86,5 %) | 114 (93,4 %) |
| Mediaani, kk (95 % CI) | 5,8 (4,7, 7,6) | 5,3 (4,9, 6,3) | 3,4 (3,2, 3,8) | 5,3 (4,8, 6,3) |
| Riskisuhde† (95 % CI) | 0,76 (0,58, 1,01) | 0,99 (0,76, 1,29) | ||
| p-arvo‡ | 0,02951 | 0,46791 | ||
| PFS-osuus 6 kuukauden kuluttua (95 % CI) | 49,4 (40,3, 57,9) | 47,2 (37,5, 56,2) | 33,0 (25,2, 41,0) | 46,6 (37,5, 55,2) |
| PFS-osuus 12 kuukauden kuluttua (95 % CI) | 23,9 (16,7, 31,7) | 14,0 (8,2, 21,3) | 23,5 (16,6, 31,1) | 15,1 (9,3, 22,2) |
| PFS-osuus 24 kuukauden kuluttua (95 % CI) | 14,6 (8,9, 21,5) | 5,0 (1,9, 10,5) | 16,8 (10,9, 23,8) | 6,1 (2,7, 11,6) |
| Objektiivisten vasteiden osuus | ||||
| ORR§ % (95 % CI) | 42,9 (34,1, 52,0) | 38,2 (29,1, 47,9) | 23,3 (16,4, 31,4) | 36,1 (27,6, 45,3) |
| Vasteen kesto |
| |||
| Vasteen saaneiden lukumäärä | 54 | 42 | 31 | 44 |
| Mediaani, kk (vaihteluväli) | 7,1 (2,1+, 39,0+) | 4,2 (1,2+, 31,5+) | 22,6 (2,7+, 43,0+) | 4,2 (1,2+, 31,5+) |
| * Setuksimabi, platina ja 5‑fluorourasiili † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Ositetun log rank -testin perusteella § Vaste: Paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena | ||||
KEYNOTE‑048-tutkimuksessa tehtiin eksploratiivinen alaryhmäanalyysi potilailla, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 ja < 20 [pembrolitsumabi ja solunsalpaaja: n = 116 (45 %) vs. tavanomainen hoito: n = 125 (49 %) ja pembrolitsumabimonoterapia: n = 124 (48 %) vs. tavanomainen hoito: n = 133 (52 %)] (ks. taulukko 34).
Taulukko 34: Pembrolitsumabin ja solunsalpaajahoidon yhdistelmän sekä pembrolitsumabimonoterapian tehoa koskevat tulokset KEYNOTE‑048-tutkimuksessa PD-L1:n ilmentymisen mukaan (CPS-pistemäärä ≥ 1 ja < 20)
| Päätetapahtuma | Pembrolitsumabi + platina- solunsalpaajahoito + 5-fluorourasiili n = 116 | Tavanomainen hoito* n = 125 | Pembrolitsumabi-monoterapia n = 124 | Tavanomainen hoito* n = 133 |
| OS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 93 (80,2 %) | 115 (92,0 %) | 103 (83,1 %) | 121 (91,0 %) |
| Mediaani, kk (95 % CI) | 12,7 (9,4, 15,3) | 9,9 (8,6, 11,5) | 10,8 (9,0, 12,6) | 10,1 (8,7, 12,1) |
| Riskisuhde† (95 % CI) | 0,71 (0,54, 0,94) | 0,86 (0,66, 1,12) | ||
| OS-osuus 6 kuukauden kuluttua (95 % CI) | 76,7 (67,9, 83,4) | 77,4 (69,0, 83,8) | 67,6 (58,6, 75,1) | 78,0 (70,0, 84,2) |
| OS-osuus 12 kuukauden kuluttua (95 % CI) | 52,6 (43,1, 61,2) | 41,1 (32,4, 49,6) | 44,0 (35,1, 52,5) | 42,4 (33,9, 50,7) |
| OS-osuus 24 kuukauden kuluttua (95 % CI) | 25,9 (18,3, 34,1) | 14,5 (9,0, 21,3) | 22,0 (15,1, 29,6) | 15,9 (10,3, 22,6) |
| PFS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 106 (91,4 %) | 117 (93,6 %) | 113 (91,1 %) | 123 (92,5 %) |
| Mediaani, kk (95 % CI) | 4,9 (4,2, 5,3) | 4,9 (3,7, 6,0) | 2,2 (2,1, 2,9) | 4,9 (3,8, 6,0) |
| Riskisuhde† (95 % CI) | 0,93 (0,71, 1,21) | 1,25 (0,96, 1,61) | ||
| PFS-osuus 6 kuukauden kuluttua (95 % CI) | 40,1 (31,0, 49,0) | 40,0 (31,2, 48,5) | 24,2 (17,1, 32,0) | 41,4 (32,8, 49,7) |
| PFS-osuus 12 kuukauden kuluttua (95 % CI) | 15,1 (9,1, 22,4) | 11,3 (6,4, 17,7) | 17,5 (11,4, 24,7) | 12,1 (7,2, 18,5) |
| PFS-osuus 24 kuukauden kuluttua (95 % CI) | 8,5 (4,2, 14,7) | 5,0 (1,9, 10,1) | 8,3 (4,3, 14,1) | 6,3 (2,9, 11,5) |
| Objektiivisten vasteiden osuus | ||||
| ORR‡ % (95 % CI) | 29,3 (21,2, 38,5) | 33,6 (25,4, 42,6) | 14,5 (8,8, 22,0) | 33,8 (25,9, 42,5) |
| Vasteen kesto | ||||
| Vasteen saaneiden lukumäärä | 34 | 42 | 18 | 45 |
| Mediaani, kk (vaihteluväli) | 5,6 (1,6+, 25,6+) | 4,6 (1,4+, 31,4+) | Ei saavutettu (1,5+, 38,9+) | 5,0 (1,4+, 38,7+) |
| * Setuksimabi, platina ja 5‑fluorourasiili † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Vaste: Paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena | ||||
KEYNOTE-040: Kontrolloitu tutkimus pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla, jotka olivat aiemmin saaneet platinapohjaista solunsalpaajahoitoa
Kontrolloidussa, avoimessa, satunnaistetussa monikeskustutkimuksessa KEYNOTE‑040 arvioitiin pembrolitsumabin turvallisuutta ja tehoa histologisesti vahvistetun pään ja kaulan alueen (suuontelon, nielun tai kurkunpään) uusiutuneen tai metastasoituneen levyepiteelikarsinooman hoidossa potilailla, joilla tauti oli edennyt pään ja kaulan alueen uusiutuneen tai metastasoituneen levyepiteelikarsinooman hoitoon annetun platinapohjaisen solunsalpaajahoidon aikana tai sen jälkeen tai induktio‑, samanaikaisen tai adjuvanttihoidon osana annetun platinapohjaisen solunsalpaajahoidon jälkeen, eivätkä potilaat soveltuneet saamaan paikallista parantavassa tarkoituksessa annettavaa hoitoa. Potilaat stratifioitiin PD‑L1:n ilmentymisen (TPS ≥ 50 %), HPV-statuksen (papilloomavirusstatuksen) ja ECOG-toimintakykyluokan mukaan ja sen jälkeen satunnaistettiin (1:1) saamaan joko pembrolitsumabia 200 mg 3 viikon välein (n = 247) tai jotakin kolmesta tavanomaisesta hoidosta (n = 248): metotreksaattia 40 mg/m2 kerran viikossa (n = 64), dosetakselia 75 mg/m2 3 viikon välein (n = 99) tai setuksimabia latausannoksen 400 mg/m2 ja sen jälkeen 250 mg/m2 kerran viikossa (n = 71). Hoitoa voitiin jatkaa taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Tutkimuksesta suljettiin pois potilaat, joilla oli nenänielukarsinooma, autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus tai jotka olivat saaneet aikaisemmin vähintään kolmea systeemistä hoitoa pään ja kaulan alueen uusiutuneeseen ja/tai metastasoituneeseen levyepiteelikarsinoomaan. Kasvaimen tila arvioitiin viikolla 9, sen jälkeen 6 viikon välein viikolle 52 asti ja tämän jälkeen 9 viikon välein 24 kuukauden ajan.
KEYNOTE‑040-tutkimukseen osallistuneista 495 potilaasta 129 potilaalla (26 %) oli kasvain, joka ilmensi PD‑L1-ligandia, ja PD‑L1 IHC 22C3 pharmDxTM ‑testillä mitattu TPS oli ≥ 50 %. Näiden 129 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 62 vuotta (40 % oli vähintään 65‑vuotiaita); miehiä 81 %; valkoihoisia 78 %, aasialaisia 11 % ja mustaihoisia 2 %; 23 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 77 %:lla ECOG-toimintakykyluokka oli 1. 19 %:lla potilaista kasvain oli HPV-positiivinen. 67 %:lla potilaista oli levinneisyysluokan M1 tauti, ja suurimmalla osalla taudin levinneisyysaste oli IV (32 % astetta IV, 14 % astetta IVa, 4 % astetta IVb ja 44 % astetta IVc). 16 %:lla potilaista tauti oli edennyt neoadjuvantti- tai adjuvanttihoitona annetun platinapohjaisen solunsalpaajahoidon jälkeen, ja 84 % potilaista oli saanut yhtä tai kahta aiempaa systeemistä hoitoa metastasoituneeseen tautiin.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS) hoitoaikeen mukaisessa (ITT) potilasjoukossa. Ensimmäisen analyysin mukaan kokonaiselinaikaa koskeva riskisuhde oli 0,82 (95 %:n luottamusväli: 0,67, 1,01) yksitahoisella p‑arvolla 0,0316. Kokonaiselinajan mediaani oli pembrolitsumabia saaneilla 8,4 kuukautta ja tavanomaista hoitoa saaneilla 7,1 kuukautta. Taulukossa 35 on tiivistelmä keskeisistä tehon mittareista populaatiolle, jossa TPS on ≥ 50 %. Kuvassa 31 on esitetty Kaplan-Meier-kuvaaja kokonaiselinajalle populaatiossa, jossa TPS on ≥ 50 %.
Taulukko 35: KEYNOTE-040-tutkimuksessa todettu pembrolitsumabin teho annoksella 200 mg 3 viikon välein pään ja kaulan alueen levyepiteelikarsinoomaa sairastavilla potilailla, joiden TPS oli ≥ 50 % ja jotka olivat aiemmin saaneet platinasolunsalpaajahoitoa
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 64 | Tavanomainen hoito* n = 65 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 41 (64 %) | 56 (86 %) |
| Riskisuhde† (95 % CI) | 0,53 (0,35, 0,81) | |
| p-arvo‡ | 0,001 | |
| Mediaani, kk (95 % CI) | 11,6 (8,3, 19,5) | 6,6 (4,8, 9,2) |
| PFS§ | ||
| Potilaat (%), joilla todettiin tapahtuma | 52 (81 %) | 58 (89 %) |
| Riskisuhde† (95 % CI) | 0,58 (0,39, 0,86) | |
| p-arvo‡ | 0,003 | |
| Mediaani, kk (95 % CI) | 3,5 (2,1, 6,3) | 2,1 (2,0, 2,4) |
| Osuus (%) 6 kk:n kohdalla (95 % CI) | 40,1 (28,1, 51,9) | 17,1 (8,8, 27,7) |
| Objektiivisten vasteiden osuus§ | ||
| ORR % (95 % CI) | 26,6 (16,3, 39,1) | 9,2 (3,5, 19,0) |
| p-arvo¶ | 0,0009 | |
| Täydellinen vaste | 5 % | 2 % |
| Osittainen vaste | 22 % | 8 % |
| Vakaa tauti | 23 % | 23 % |
| Vasteen kesto§,# | ||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,7, 13,8+) | 6,9 (4,2, 18,8) |
| Potilaat (%Þ), joilla kesto on ≥ 6 kk | 9 (66 %) | 2 (50 %) |
| * Metotreksaatti, dosetakseli tai setuksimabi † Riskisuhde (pembrolitsumabi tavanomaiseen hoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Yksitahoinen p-arvo log rank ‑testin perusteella § Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi käyttämällä RECIST 1.1 ‑kriteerejä ¶ Perustuu Miettisen ja Nurmisen menetelmään # Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena Þ Perustuu Kaplan-Meier-arvioon | ||
Kuva 31: Kaplan-Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑040-tutkimuksessa potilailla, joilla oli todettu PD‑L1:n ilmentyminen (TPS ≥ 50 %)
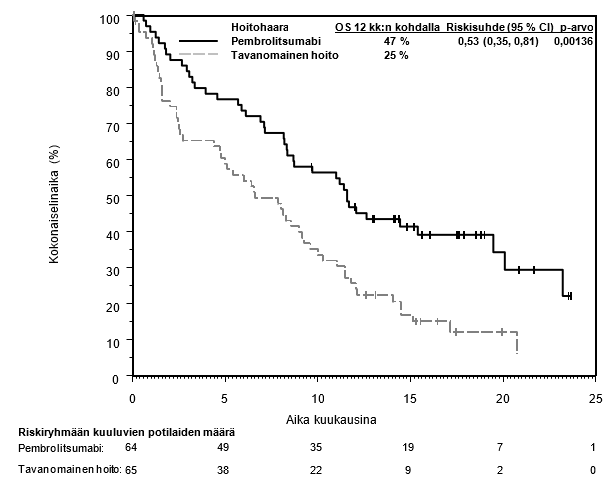
Munuaissolukarsinooma
KEYNOTE-426: Aksitinibia sisältävää yhdistelmähoitoa koskeva kontrolloitu tutkimus munuaissolukarsinoomaa sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Satunnaistetussa, avoimessa, aktiivikontrolloidussa monikeskustutkimuksessa KEYNOTE‑426 arvioitiin pembrolitsumabin tehoa yhdistelmänä aksitinibin kanssa potilailla, joilla oli edennyt munuaissolukarsinooma, jossa oli kirkassolukomponentti, riippumatta kasvaimen PD-L1:n ilmentymisstatuksesta ja IMDC:n (International Metastatic RCC Database Consortium) riskiryhmäluokituksesta. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin riskiluokkien (suotuisa, kohtalainen tai huono ennuste) ja maantieteellisen alueen (Pohjois-Amerikka, Länsi-Eurooppa ja "muu maailma") mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- pembrolitsumabia 200 mg laskimoon kolmen viikon välein yhdistelmänä aksitinibin kanssa, joka annettiin 5 mg:n annoksella suun kautta kaksi kertaa vuorokaudessa. Potilaille, jotka sietivät aksitinibia 5 mg:n annoksella kaksi kertaa vuorokaudessa kahden peräkkäisen hoitosyklin ajan (6 viikkoa), joilla ei ilmennyt vaikeusasteen 2 ylittäviä aksitinibihoitoon liittyviä haittavaikutuksia ja joiden verenpaine oli hyvässä hoitotasapainossa (≤ 150/90 mmHg), aksitinibiannos voitiin suurentaa 7 mg:aan kaksi kertaa vuorokaudessa. Annoksen suurentaminen 10 mg:aan kaksi kertaa vuorokaudessa oli sallittua samoin ehdoin. Aksitinibihoito voitiin keskeyttää tai annos pienentää 3 mg:aan kaksi kertaa vuorokaudessa ja seuraavaksi 2 mg:aan kaksi kertaa vuorokaudessa toksisten vaikutusten pitämiseksi hallinnassa.
- sunitinibia 50 mg suun kautta kerran vuorokaudessa 4 viikon ajan ja sen jälkeen kahden viikon hoitotauko.
Pembrolitsumabi- ja aksitinibihoitoa jatkettiin BICR:n tai tutkijalääkärin vahvistamaan RECIST v1.1 ‑kriteerien mukaiseen taudin etenemiseen asti, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai pembrolitsumabin osalta enintään 24 kuukauden ajan. Pembrolitsumabi- ja aksitinibihoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Kasvaimen tila arvioitiin lähtötilanteessa, satunnaistamisen jälkeen viikolla 12, sen jälkeen 6 viikon välein viikolle 54 asti ja tämän jälkeen 12 viikon välein.
Yhteensä 861 potilasta satunnaistettiin. Tutkimuspopulaation tiedot olivat: mediaani-ikä 62 vuotta (vaihteluväli: 26–90), potilaista 38 % oli vähintään 65-vuotiaita, 73 % miehiä, 79 % valkoihoisia ja 16 % aasialaisia, 80 %:lla potilaista Karnofskyn asteikolla mitattu toimintakyky (KPS) oli 90–100 ja 20 %:lla KPS oli 70–80, potilaat jakautuivat IMDC:n riskiluokkiin siten, että 31 %:lla oli suotuisa, 56 %:lla kohtalainen ja 13 %:lla huono ennuste.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Tutkimus osoitti, että pembrolitsumabiyhdistelmähoidon haaraan satunnaistetuilla potilailla kokonaiselinajat (riskisuhde 0,53; 95 %:n luottamusväli 0,38, 0,74; p‑arvo = 0,00005) ja elinajat ilman taudin etenemistä (riskisuhde 0,69; 95 %:n luottamusväli 0,56, 0,84; p‑arvo = 0,00012) olivat sunitinibihaaraan verrattuna parantuneet tilastollisesti merkitsevästi etukäteen määritellyn välianalyysin kohdalla. Taulukossa 36 on tiivistelmä keskeisistä tehon mittareista ja kuvissa 32 ja 33 esitetään Kaplan–Meier‑kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä; tiedot perustuvat lopulliseen analyysiin, joka tehtiin, kun seuranta-ajan mediaani oli 37,7 kuukautta.
Taulukko 36: KEYNOTE‑426-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi Aksitinibi n = 432 | Sunitinibi n = 429 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 193 (45 %) | 225 (52 %) |
| Mediaani, kk (95 % CI) | 45,7 (43,6, NA) | 40,1 (34,3, 44,2) |
| Riskisuhde* (95 % CI) | 0,73 (0,60, 0,88) | |
| p-arvo† | 0,00062 | |
| PFS‡ | ||
| Potilaat (%), joilla todettiin tapahtuma | 286 (66 %) | 301 (70 %) |
| Mediaani, kk (95 % CI) | 15,7 (13,6, 20,2) | 11,1 (8,9, 12,5) |
| Riskisuhde* (95 % CI) | 0,68 (0,58, 0,80) | |
| p-arvo† | < 0,00001 | |
| Objektiivisten vasteiden osuus | ||
| ORR§ % (95 % CI) | 60 (56, 65) | 40 (35, 44) |
| Täydellinen vaste | 10 % | 3 % |
| Osittainen vaste | 50 % | 36 % |
| p-arvo¶ | < 0,0001 | |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | 23,6 (1,4+, 43,4+) | 15,3 (2,3, 42,8+) |
| Potilaat (%#), joilla kesto on ≥ 30 kk | 87 (45 %) | 29 (32 %) |
| * Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Nimellinen p-arvo ositetun log rank -testin perusteella ‡ Sokkoutettu riippumaton keskitetty arvioijataho (Blinded Independent Central Review, BICR) arvioi käyttämällä RECIST 1.1 -kriteerejä § Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena ¶ Nimellinen p-arvo; perustuu Miettisen ja Nurmisen menetelmään, ositus IMDC:n riskiryhmän ja maantieteellisen alueen mukaan. Etukäteen määritellyssä objektiivisten vasteiden osuuden välianalyysissä (seuranta-ajan mediaani 12,8 kuukautta) saavutettiin tilastollisesti merkitsevästi parempi objektiivisten vasteiden osuus, kun verrattiin pembrolitsumabin ja aksitinibin yhdistelmää sunitinibiin (p‑arvo < 0,0001). # Perustuu Kaplan-Meier-arvioon NA = ei käytettävissä | ||
Kuva 32: Kaplan-Meier-kuvaaja kokonaiselinajalle KEYNOTE-426-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
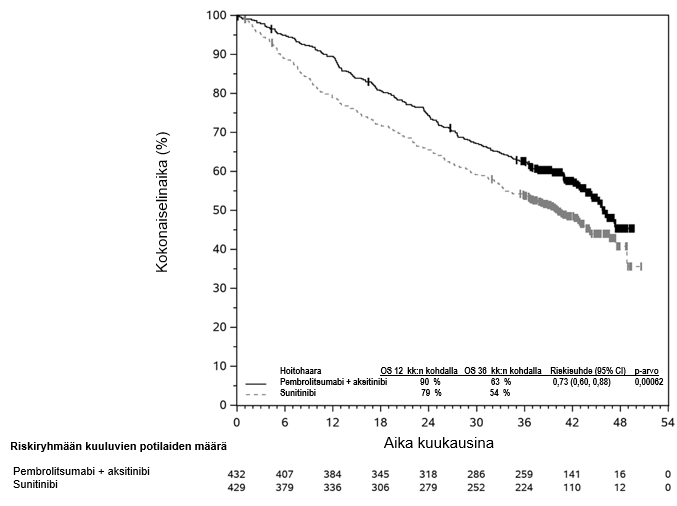
Kuva 33: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE-426-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
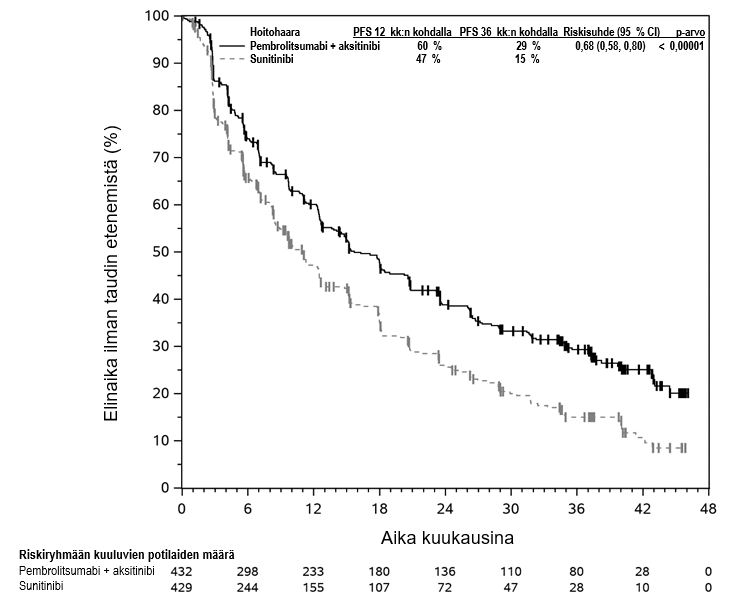
KEYNOTE‑426-tutkimuksesta tehtiin alaryhmäanalyysejä, joissa olivat mukana potilaat, joilla PD‑L1-ligandin CPS-pistemäärä oli ≥ 1 [pembrolitsumabin ja aksitinibin yhdistelmä: n = 243 (56 %) vs. sunitinibi: n = 254 (59 %)], ja potilaat, joilla CPS-pistemäärä oli < 1 [pembrolitsumabin ja aksitinibin yhdistelmä: n = 167 (39 %) vs. sunitinibi: n = 158 (37 %)]. Kokonaiselinajan ja elinajan ilman taudin etenemistä havaittiin pidentyneen riippumatta PD‑L1:n ilmentymisen tasosta.
KEYNOTE-426-tutkimusta ei ollut suunniteltu tehon arviointiin yksittäisissä alaryhmissä.
Taulukossa 37 on tiivistelmä tehon mittareista IMDC:n riskiluokan mukaan; se perustuu kokonaiselinajan lopulliseen analyysiin, kun seuranta-ajan mediaani oli 37,7 kuukautta.
Taulukko 37: KEYNOTE‑426-tutkimuksen tehoa koskevat tulokset IMDC:n riskiluokan mukaan
| Päätetapahtuma* | Pembrolitsumabi + aksitinibi n = 432 | Sunitinibi n = 429 | Pembrolitsumabi + aksitinibi vs. sunitinibi |
| OS | 12 kuukauden OS-osuus, % (95 % CI) | OS:n riskisuhde (95 % CI) | |
| Suotuisa | 95,6 (90,5, 98,0) | 94,6 (89,0, 97,4) | 1,17 (0,76, 1,80) |
| Kohtalainen | 90,7 (86,2, 93,8) | 77,6 (71,8, 82,3) | 0,67 (0,52, 0,86) |
| Huono | 69,6 (55,8, 79,9) | 45,1 (31,2, 58,0) | 0,51 (0,32, 0,81) |
| PFS | Mediaani (95 % CI), kk | PFS:n riskisuhde (95 % CI) | |
| Suotuisa | 20,7 (15,2, 28,9) | 17,8 (12,5, 20,7) | 0,76 (0,56, 1,03) |
| Kohtalainen | 15,3 (12,5, 20,8) | 9,7 (8,0, 12,4) | 0,69 (0,55, 0,86) |
| Huono | 4,9 (2,8, 12,4) | 2,9 (2,7, 4,2) | 0,53 (0,33, 0,84) |
| Vahvistettu ORR | % (95 %:n CI) | ORR:n erotus, % (95 %:n CI) | |
| Suotuisa | 68,8 (60,4, 76,4) | 50,4 (41,5, 59,2) | 18,5 (6,7, 29,7) |
| Kohtalainen | 60,5 (54,0, 66,8) | 39,8 (33,7, 46,3) | 20,7 (11,8, 29,2) |
| Huono | 39,3 (26,5, 53,2) | 11,5 (4,4, 23,4) | 27,7 (11,7, 42,8) |
* n (%) pembrolitsumabin ja aksitinibin yhdistelmää saaneilla vs. sunitinibia saaneilla oli suotuisan ennusteen ryhmässä 138 (32 %) vs. 131 (31 %), kohtalaisen ennusteen ryhmässä 238 (55 %) vs. 246 (57 %) ja huonon ennusteen ryhmässä 56 (13 %) vs. 52 (12 %)
KEYNOTE‑581 (CLEAR): Lenvatinibia sisältävää yhdistelmähoitoa koskeva kontrolloitu tutkimus munuaissolukarsinoomaa sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Avoimessa, satunnaistetussa monikeskustutkimuksessa KEYNOTE‑581 (CLEAR) arvioitiin pembrolitsumabin tehoa yhdistelmänä lenvatinibin kanssa ensilinjan hoidon yhteydessä 1 069 potilaalla, joilla oli edennyt munuaissolukarsinooma, jossa oli kirkassolukomponentti ja muita histologisia piirteitä, kuten sarkomatoidisia ja papillaarisia piirteitä. Tutkimukseen otettiin potilaita kasvaimen PD‑L1:n ilmentymisstatuksesta riippumatta. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin maantieteellisen alueen (Pohjois-Amerikka, Länsi-Eurooppa ja ”muu maailma”) ja MSKCC:n (Memorial Sloan Kettering Cancer Center) kriteereillä määriteltyjen ennusteryhmien (suotuisa, kohtalainen tai huono ennuste) mukaan.
Potilaat satunnaistettiin (1:1:1) johonkin seuraavista hoitohaaroista:
- pembrolitsumabia 200 mg laskimoon kolmen viikon välein enintään 24 kuukauden ajan yhdistelmänä lenvatinibin kanssa, joka annettiin 20 mg:n annoksella suun kautta kerran vuorokaudessa
- lenvatinibia 18 mg suun kautta kerran vuorokaudessa yhdistelmänä everolimuusin kanssa, joka annettiin 5 mg:n annoksella suun kautta kerran vuorokaudessa
- sunitinibia 50 mg suun kautta kerran vuorokaudessa 4 viikon ajan ja sen jälkeen kahden viikon hoitotauko.
Hoitoa jatkettiin, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tutkijalääkärin määrittämään ja BICR:n vahvistamaan taudin etenemiseen asti. Arvioinnissa käytettiin RECIST1.1 ‑kriteeristöä. Pembrolitsumabihoitoa yhdessä lenvatinibin kanssa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisen jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Pembrolitsumabihoitoa jatkettiin enintään 24 kuukauden ajan, mutta lenvatinibihoitoa voitiin jatkaa pidempään kuin 24 kuukautta. Kasvaimen tila arvioitiin lähtötilanteessa ja sen jälkeen 8 viikon välein.
Tutkimuspopulaation (355 potilasta pembrolitsumabin ja lenvatinibin yhdistelmää saaneiden haarassa ja 357 potilasta sunitinibia saaneiden haarassa) tiedot lähtötilanteessa olivat: mediaani-ikä 62 vuotta (vaihteluväli 29–88 vuotta), potilaista 41 % oli vähintään 65‑vuotiaita, 74 % miehiä, 75 % valkoihoisia, 21 % aasialaisia, 1 % mustaihoisia ja 2 % muuta etnistä taustaa, 17 %:lla potilaista KPS oli lähtötilanteessa 70–80 ja 83 %:lla 90–100. Potilaat jakautuivat IMDC:n riskiluokkiin siten, että 33 %:lla oli suotuisa, 56 %:lla kohtalainen ja 10 %:lla huono ennuste, ja MSKCC:n kriteereillä määriteltyihin ennusteryhmiin siten, että 27 %:lla oli suotuisa, 64 %:lla kohtalainen ja 9 %:lla huono ennuste. 99 %:lla potilaista oli metastasoitunut tauti ja 1 %:lla paikallisesti edennyt tauti. Etäpesäkkeitä esiintyi yleisesti keuhkoissa (69 %), imusolmukkeissa (46 %) ja luustossa (26 %).
Ensisijainen tehoa mittaava lopputulosmuuttuja oli elinaika ilman taudin etenemistä (PFS), jonka arvioi BICR käyttämällä RECIST 1.1 -kriteerejä. Keskeisiä toissijaisia tehoa mittaavia lopputulosmuuttujia olivat kokonaiselinaika (OS) ja objektiivisten vasteiden osuus (ORR). Tutkimus osoitti, että pembrolitsumabia yhdistelmänä lenvatinibin kanssa saamaan satunnaistettujen potilaiden elinajat ilman taudin etenemistä (riskisuhde 0,39; 95 %:n luottamusväli 0,32, 0,49; p-arvo < 0,0001), kokonaiselinajat (riskisuhde 0,66; 95 %:n luottamusväli 0,49, 0,88; p-arvo 0,0049) ja objektiivisten vasteiden osuudet (71 % [95 %:n luottamusväli 66, 76] vs. 36 % [95 %:n luottamusväli 31, 41]; p-arvo < 0,0001) olivat tilastollisesti merkitsevästi paremmat kuin sunitinibia saaneilla ennalta määritellyssä välianalyysissä, jossa elossaolon seuranta-ajan mediaani oli 26,5 kuukautta ja pembrolitsumabilla ja lenvatinibilla toteutetun yhdistelmähoidon keston mediaani oli 17,0 kuukautta. Kokonaiselinaikaa koskevaa primaarianalyysiä ei korjattu seuraavien hoitojen suhteen.
Taulukossa 38 ja kuvissa 34 ja 35 on esitetty yhteenveto KEYNOTE-581-tutkimuksen (CLEAR) tehoa koskevista tuloksista tutkimussuunnitelman mukaisessa lopullisessa analyysissa, jossa seuranta-ajan mediaani oli 49,4 kuukautta. Tulokset elinajalle ilman taudin etenemistä olivat yhdenmukaiset kaikissa etukäteen määritellyissä alaryhmissä, kaikissa MSKCC:n kriteereillä määritellyissä ennusteryhmissä ja kasvaimen PD-L1:n ilmentymisstatukseen perustuvissa ryhmissä. Taulukossa 39 on esitetty yhteenveto tehoa koskevista tuloksista MSKCC:n kriteereillä määritellyn prognostisen ryhmän mukaan.
Taulukko 38: KEYNOTE‑581-tutkimuksen (CLEAR) tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein ja lenvatinibi n = 355 | Sunitinibi
n = 357 |
| PFS* | ||
| Potilaat (%), joilla todettiin tapahtuma | 207 (58 %) | 214 (60 %) |
| Mediaani, kk (95 % CI) | 23,9 (20,8, 27,7) | 9,2 (6,0, 11,0) |
| Riskisuhde† (95 % CI) | 0,47 (0,38, 0,57) | |
| p-arvo‡ | < 0,0001 | |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 149 (42 %) | 159 (45 %) |
| Mediaani, kk (95 % CI) | 53,7 (48,7, ei saavutettu) | 54,3 (40,9, ei saavutettu) |
| Riskisuhde† (95 % CI) | 0,79 (0,63, 0,99) | |
| p-arvo‡ | 0,0424 | |
| Objektiivisten vasteiden osuus | ||
| ORR§ % (95 % CI) | 71 % (66,6, 76,0) | 37 % (31,7, 41,7) |
| Täydellinen vaste | 18 % | 5 % |
| Osittainen vaste | 53 % | 32 % |
| p-arvo¶ | < 0,0001 | |
| Vasteen kesto# | ||
| Mediaani, kk (vaihteluväli) | 26,7 (1,64+, 55,92+) | 14,7 (1,64+, 54,08+) |
| * PFS:n primaarianalyysiin sisältyi uuden syöpähoidon sensurointi. Elinaikaa ilman taudin etenemistä koskevat sensuroidut ja sensuroimattomat tulokset olivat uuden syöpähoidon osalta yhdenmukaiset. † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Nimellinen p-arvo, kaksitahoinen ositetun log‑rank-testin perusteella § Vaste: paras objektiivinen vaste vahvistettuna täydellisenä tai osittaisena vasteena ¶ Nimellinen kaksitahoinen p‑arvo ositetun Cochran–Mantel–Haenszelin (CMH) testin mukaan. Aiemmassa etukäteen määritellyssä objektiivisten vasteiden osuuden lopullisessa analyysissä (seuranta-ajan mediaani 17,3 kuukautta) saavutettiin tilastollisesti merkitsevä paremmuus objektiivisten vasteiden osuuden suhteen, kun verrattiin pembrolitsumabin ja lenvatinibin yhdistelmää sunitinibiin (kerroinsuhde: 3,84 [95 %:n luottamusväli: 2,81, 5,26], p‑arvo < 0,0001). # Perustuu Kaplan–Meierin estimaatteihin | ||
Kokonaiselinaikaa koskevaa lopullista analyysiä ei korjattu seuraavien hoitojen suhteen, ja 195/357 potilasta (54,6 %) sunitinibihaarassa ja 56/355 potilasta (15,8 %) pembrolitsumabin ja lenvatinibin yhdistelmää saaneiden haarassa sai myöhemmin PD-1/PD-L1-vasta-aineita.
Kuva 34: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑581-tutkimuksessa (CLEAR) hoitohaaroittain
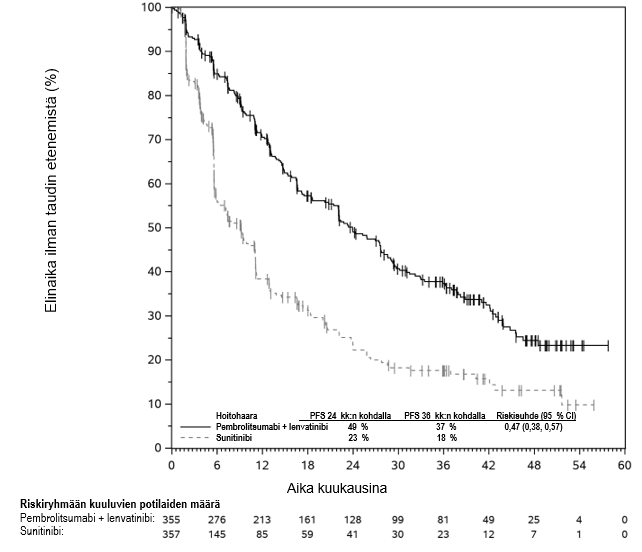
Kuva 35: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑581-tutkimuksessa (CLEAR)
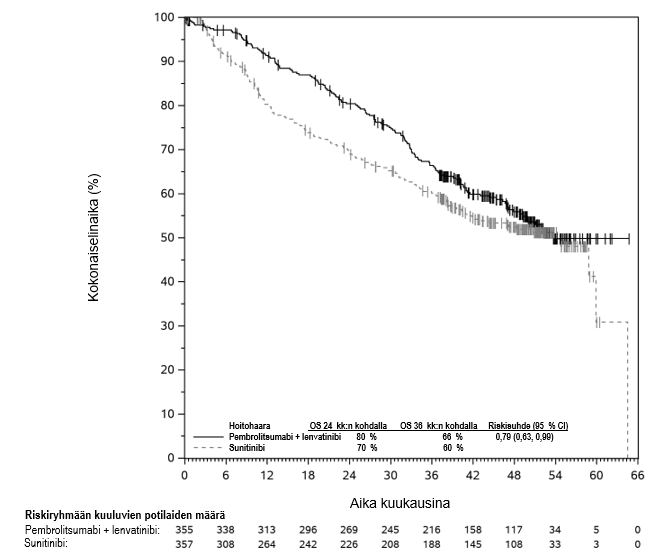
KEYNOTE-581-tutkimusta (CLEAR) ei ollut suunniteltu tehon arviointiin yksittäisissä alaryhmissä.
Alaryhmäanalyysit tehtiin MSKCC:n kriteereillä määriteltyjen ennusteryhmien perusteella.
Taulukossa 39 on tiivistelmä kokonaiselinaikaa koskevan lopullisen analyysin tehon mittareista MSKCC:n kriteereillä määritellyn ennusteryhmän mukaan, kun seuranta-ajan mediaani oli 49,4 kuukautta.
Taulukko 39: KEYNOTE‑581-tutkimuksen (CLEAR) tehoa koskevat tulokset MSKCC:n kriteereillä määritellyn ennusteryhmän mukaan
Pembrolitsumabi + lenvatinibi
(n = 355) | Sunitinibi
(n = 357) | Pembrolitsumabi + lenvatinibi vs. sunitinibi | |||
| Potilaiden määrä | Tapahtumien määrä | Potilaiden määrä | Tapahtumien määrä | ||
| Elinaika ilman taudin etenemistä (PFS) sokkoutetun riippumattoman keskitetyn arvioijatahon (Blinded Independent Central Review, BICR) mukaan* | PFS:n riskisuhde (95 % CI) | ||||
| Suotuisa | 96 | 56 | 97 | 65 | 0,46 (0,32, 0,67) |
| Kohtalainen | 227 | 129 | 228 | 130 | 0,51 (0,40, 0,65) |
| Huono | 32 | 22 | 32 | 19 | 0,18 (0,08, 0,42) |
| Kokonaiselinaika (OS)* | OS:n riskisuhde (95 % CI) | ||||
| Suotuisa | 96 | 27 | 97 | 31 | 0,89 (0,53, 1,50) |
| Kohtalainen | 227 | 104 | 228 | 108 | 0,81 (0,62, 1,06) |
| Huono | 32 | 18 | 32 | 20 | 0,59 (0,31, 1,12) |
* Seuranta-ajan mediaani: 49,4 kuukautta (tiedonkeruun päättymispäivä – 31. heinäkuuta 2022)
KEYNOTE-B61: Avoin yksihaarainen vaiheen II tutkimus
Lisätietoja on saatavilla avoimesta yksihaaraisesta vaiheen II tutkimuksesta KEYNOTE-B61, jossa arvioitiin pembrolitsumabia (400 mg 6 viikon välein) yhdistelmänä lenvatinibin (20 mg kerran vuorokaudessa) kanssa. Tätä yhdistelmää annettiin ensilinjan hoitona potilaille, joilla oli edennyt tai metastasoitunut munuaissolukarsinooma, joka oli histologialtaan muu kuin kirkassoluinen (n = 158). 59 %:lla potilaista oli todettu papillaarinen, 18 %:lla kromofobinen, 4 %:lla translokaatio‑, 1 %:lla medullaarinen, 13 %:lla luokittelematon ja 6 %:lla muu histologia. Objektiivisten vasteiden osuus (ORR) oli 50,6 % (95 %:n luottamusväli 42,6, 58,7), ja vasteen keston mediaani oli 19,5 kuukautta (95 %:n luottamusväli 15,3, ei saavutettu).
KEYNOTE‑564: Lumekontrolloitu tutkimus, jossa arvioitiin adjuvanttihoitoa potilailla, joille on tehty munuaissolukarsinooman poistoleikkaus
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa KEYNOTE‑564 arvioitiin pembrolitsumabin tehoa munuaissolukarsinooman adjuvanttihoitona 994 potilaalla, joilla uusiutumisriski oli suurentunut eli määritelmän mukaan keskisuuri tai suuri tai joilla levinneisyysluokka oli M1 eikä taudista ollut näyttöä (no evidence of disease, NED). Keskisuuren riskin luokka määriteltiin seuraavasti: pT2 ja erilaistumisaste 4 tai sarkomatoidisia piirteitä; pT3, mikä tahansa erilaistumisaste, ei etäpesäkkeitä imusolmukkeissa (N0) eikä kauempana (M0). Suuren riskin luokka määriteltiin seuraavasti: pT4, mikä tahansa erilaistumisaste, N0 ja M0; mikä tahansa pT, mikä tahansa erilaistumisaste, etäpesäkkeitä imusolmukkeissa ja M0. M1‑NED-luokkaan kuuluivat potilaat, joilla oli metastasoitunut tauti ja joille oli tehty primaaristen ja metastaattisten leesioiden täydellinen poistoleikkaus. Edellytyksenä oli, että potilaille oli tehty osittainen nefroprotektiivinen tai radikaali täydellinen nefrektomia (ja M1‑NED-luokkaan kuuluvilla tutkittavilla kiinteiden, yksittäisten, metastaattisten pehmytkudosleesioiden täydellinen poistoleikkaus) negatiivisin leikkausmarginaalein vähintään 4 viikkoa ennen seulonta-ajankohtaa. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Potilaat, joiden munuaissolukarsinoomassa oli kirkassolukomponentti, satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg 3 viikon välein (n = 496) tai lumelääkettä (n = 498) enintään vuoden ajan, kunnes tauti uusiutui tai ilmeni toksisia vaikutuksia, joita ei voitu hyväksyä. Satunnaistaminen stratifioitiin etäpesäkestatuksen mukaan (M0 tai M1‑NED), ja M0‑ryhmässä stratifiointitekijöinä olivat myös ECOG-toimintakykyluokka (0 tai 1) ja maantieteellinen alue (Yhdysvallat tai muu kuin Yhdysvallat). Satunnaistamisesta alkaen potilaille tehtiin kuvantamistutkimus 12 viikon välein kahden ensimmäisen vuoden ajan, sitten 16 viikon välein vuosina 3–5 ja sen jälkeen 24 viikon välein joka vuosi.
994 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 60 vuotta (vaihteluväli 25–84), 33 % oli vähintään 65‑vuotiaita, 71 % oli miehiä ja 85 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 15 %:lla ECOG-toimintakykyluokka oli 1. 94 % potilaista kuului luokkaan N0, 83 %:lla potilaista kasvaimessa ei ollut sarkomatoidisia piirteitä, 86 % potilaista kuului luokkaan pT2, jossa erilaistumisaste oli 4 tai kasvaimessa oli sarkomatoidisia piirteitä, tai luokkaan pT3; 8 % potilaista kuului luokkaan pT4 tai heillä oli etäpesäkkeitä imusolmukkeissa, ja 6 % potilaista kuului luokkaan M1‑NED. Potilaiden tiedot lähtötilanteessa ja demografiset tiedot olivat yleisesti vastaavanlaiset pembrolitsumabi- ja lumehaaroissa.
Tehoa mittaava ensisijainen lopputulosmuuttuja oli tutkijalääkärin arvioima elinaika ilman tautia (disease-free survival, DFS). Keskeinen toissijainen lopputulosmuuttuja oli kokonaiselinaika (OS). Tutkimuksessa osoitettiin, että elinaika ilman tautia ja kokonaiselinaika olivat tilastollisesti merkitsevästi pidemmät pembrolitsumabihaaraan satunnaistetuilla potilailla verrattuna lumehaaraan. Etukäteen määritelty välianalyysi tehtiin, kun seuranta-ajan mediaani oli 23,9 kuukautta. Tällöin riskisuhde elinajalle ilman tautia oli 0,68 (95 %:n luottamusväli 0,53, 0,87; p-arvo = 0,0010). Taulukossa 40 ja kuvissa 36 ja 37 esitetään tehoa koskevat tulokset analyysistä, joka tehtiin kun seuranta-ajan mediaani oli 55,8 kuukautta.
Taulukko 40: KEYNOTE‑564-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 496 | Lumelääke n = 498 |
| DFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 174 (35 %) | 224 (45 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (54,9, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,72 (0,59, 0,87) | |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 55 (11 %) | 86 (17 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (ei saavutettu, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,62 (0,44, 0,87) | |
| p‑arvo† | 0,0024 | |
| * Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan † Yksitahoinen p-arvo ositetun log rank ‑testin perusteella | ||
Kuva 36: Kaplan–Meier-kuvaaja elinajalle ilman tautia KEYNOTE‑564-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain*
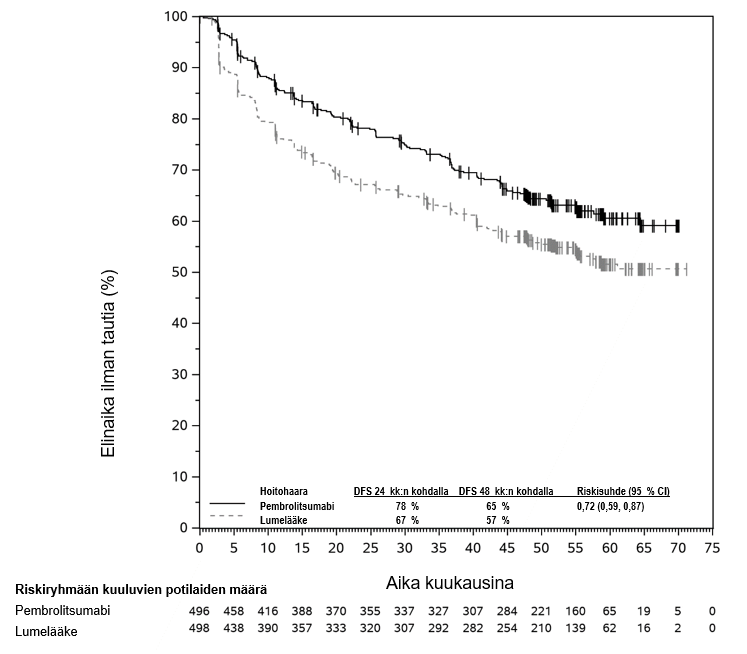
Kuva 37: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE‑564-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
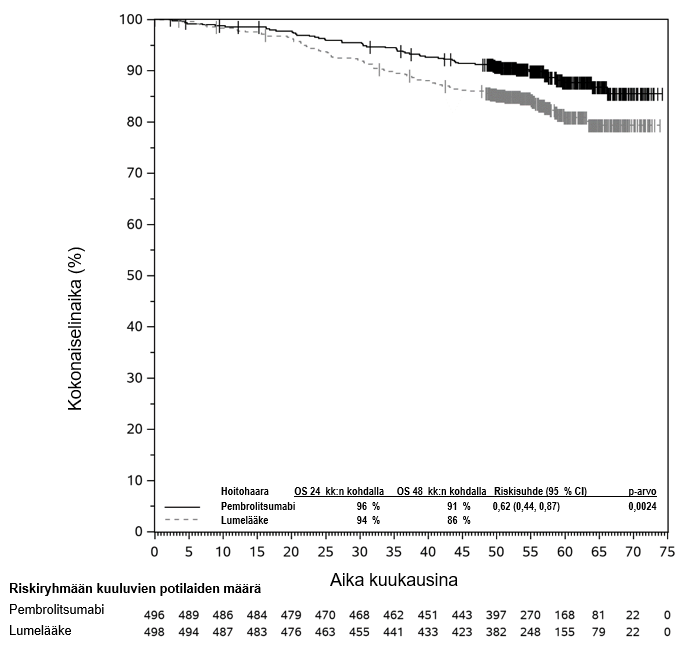
Syövät, joihin liittyy mikrosatelliitti-instabiliteetti (MSI-H) tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi (dMMR)
Kolorektaalisyöpä
KEYNOTE‑177: Kontrolloitu tutkimus kolorektaalisyöpää sairastavilla potilailla, joiden syöpään liittyi mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi ja jotka eivät olleet aiemmin saaneet hoitoa metastasoituneen taudin yhteydessä
Satunnaistetussa, avoimessa, aktiivikontrolloidussa KEYNOTE‑177‑monikeskustutkimuksessa arvioitiin pembrolitsumabin tehoa aiemmin hoitamatonta metastasoitunutta kolorektaalisyöpää sairastavilla potilailla, joiden syöpään liittyi mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi. Kasvaimen mikrosatelliitti-instabiliteetti määritettiin paikallisesti polymeraasiketjureaktiolla (PCR), ja puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi määritettiin paikallisesti immunohistokemiallisella analyysillä (IHC-analyysillä). Potilaat, joilla oli autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen.
Potilaat satunnaistettiin (1:1) saamaan pembrolitsumabia 200 mg laskimoon 3 viikon välein tai tutkijalääkärin valinnan mukaan jotakin seuraavista solunsalpaajahoidoista laskimoon kahden viikon välein:
- mFOLFOX6 (oksaliplatiini, leukovoriini ja fluorourasiili) tai mFOLFOX6 yhdessä joko bevasitsumabin tai setuksimabin kanssa: oksaliplatiinia 85 mg/m2, leukovoriinia 400 mg/m2 (tai levoleukovoriinia 200 mg/m2) ja fluorourasiilia 400 mg/m2 boluksena päivänä 1 ja tämän jälkeen fluorourasiilia 2 400 mg/m2 46–48 tunnin aikana. Bevasitsumabia 5 mg/kg päivänä 1 tai setuksimabia 400 mg/m2 ensimmäisellä infuusiokerralla ja tämän jälkeen 250 mg/m2 kerran viikossa.
- FOLFIRI (irinotekaani, leukovoriini ja fluorourasiili) tai FOLFIRI yhdessä joko bevasitsumabin tai setuksimabin kanssa: irinotekaania 180 mg/m2, leukovoriinia 400 mg/m2 (tai levoleukovoriinia 200 mg/m2) ja fluorourasiilia 400 mg/m2 boluksena päivänä 1 ja tämän jälkeen fluorourasiilia 2 400 mg/m2 46–48 tunnin aikana. Bevasitsumabia 5 mg/kg päivänä 1 tai setuksimabia 400 mg/m2 ensimmäisellä infuusiokerralla ja tämän jälkeen 250 mg/m2 kerran viikossa.
Pembrolitsumabihoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST v1.1 ‑kriteerien mukaan taudin edenneen tai kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Pembrolitsumabihoitoa voitiin jatkaa enintään 24 kuukauden ajan potilailla, joiden tauti ei edennyt. Kasvaimen tila arvioitiin 9 viikon välein. Potilaille, jotka oli satunnaistettu saamaan solunsalpaajahoitoa, tarjottiin mahdollisuus saada pembrolitsumabihoitoa taudin edettyä.
Tutkimukseen otettiin yhteensä 307 potilasta, jotka satunnaistettiin saamaan joko pembrolitsumabia (n = 153) tai solunsalpaajahoitoa (n = 154). Näiden potilaiden tiedot lähtötilanteessa olivat: mediaani-ikä 63 vuotta (vaihteluväli: 24–93), potilaista 47 % oli vähintään 65-vuotiaita, 50 % miehiä, 75 % valkoihoisia ja 16 % aasialaisia, 52 %:lla ECOG-toimintakykyluokka oli 0 ja 48 %:lla 1. Mutaatiostatus: 25 %:lla BRAF V600E, 24 %:lla KRAS/NRAS. Solunsalpaajahoitoa saaneista 143 potilaasta 56 % sai mFOLFOX6-hoitoa joko yksinään tai yhdessä bevasitsumabin tai setuksimabin kanssa ja 44 % sai FOLFIRI-hoitoa joko yksinään tai yhdessä bevasitsumabin tai setuksimabin kanssa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS), jonka arvioi BICR käyttämällä RECIST v1.1 -kriteerejä, ja kokonaiselinaika (OS). Toissijaiset lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto. Tutkimuksessa pembrolitsumabihaaraan satunnaistetuilla potilailla todettiin tilastollisesti merkitsevä pidentyminen elinajassa ilman taudin etenemistä verrattuna solunsalpaajahoitoon (riskisuhde 0,60; 95 %:n luottamusväli 0,45, 0,80; p‑arvo 0,0002) ennalta määritellyssä lopullisessa analyysissa, joka koski elinaikaa ilman taudin etenemistä. Pembrolitsumabin ja solunsalpaajahoidon välillä ei ollut tilastollisesti merkitsevää eroa kokonaiselinaikaa arvioivassa lopullisessa analyysissa, jossa 60 % solunsalpaajahoitoa saamaan satunnaistetuista potilaista oli siirtynyt saamaan seuraavana hoitona PD‑1/PD‑L1-vasta-aineita, myös pembrolitsumabia. Taulukossa 41 on tiivistelmä keskeisistä tehon mittareista, ja kuvissa 38 ja 39 esitetään Kaplan–Meier-kuvaajat päivitetylle elinajalle ilman taudin etenemistä ja kokonaiselinajalle lopullisen analyysin perusteella, kun seuranta-ajan mediaani oli 38,1 kuukautta (vaihteluväli 0,2–58,7 kuukautta).
Taulukko 41: KEYNOTE‑177-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein n = 153 | Solunsalpaajahoito n = 154 |
| PFS* | ||
| Potilaat (%), joilla todettiin tapahtuma | 86 (56 %) | 117 (76 %) |
| Mediaani, kk (95 % CI) | 16,5 (5,4, 38,1) | 8,2 (6,1, 10,2) |
| Riskisuhde† (95 % CI) | 0,59 (0,45, 0,79) | |
| p-arvo‡ | 0,0001 | |
| OS§ | ||
| Potilaat (%), joilla todettiin tapahtuma | 62 (41 %) | 78 (51 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (49,2, ei saavutettu) | 36,7 (27,6, ei saavutettu) |
| Riskisuhde† (95 % CI) | 0,74 (0,53, 1,03) | |
| p-arvo§ | 0,0359 | |
| Objektiivisten vasteiden osuus | ||
| ORR % (95 % CI) | 45 % (37,1, 53,3) | 33 % (25,8, 41,1) |
| Täydellinen vaste | 13 % | 4 % |
| Osittainen vaste | 32 % | 29 % |
| Vasteen kesto | ||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,3+, 53,5+) | 10,6 (2,8, 48,3+) |
| Kesto ≥ 24 kk¶, % | 84 % | 34 % |
| * 12 kuukauden lisäseuranta ennalta määritellyn lopullisen analyysin jälkeen, jossa arvioitiin elinaikaa ilman taudin etenemistä † Perustuu Coxin regressiomalliin ‡ p-arvo on nimellinen § Ei tilastollista merkitsevyyttä kerrannaisuuden suhteen tehdyn korjauksen jälkeen ¶ Perustuu Kaplan-Meier-arvioon | ||
Kuva 38: Kaplan‑Meier-kuvaaja elinajasta ilman taudin etenemistä hoitohaaroittain KEYNOTE‑177-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
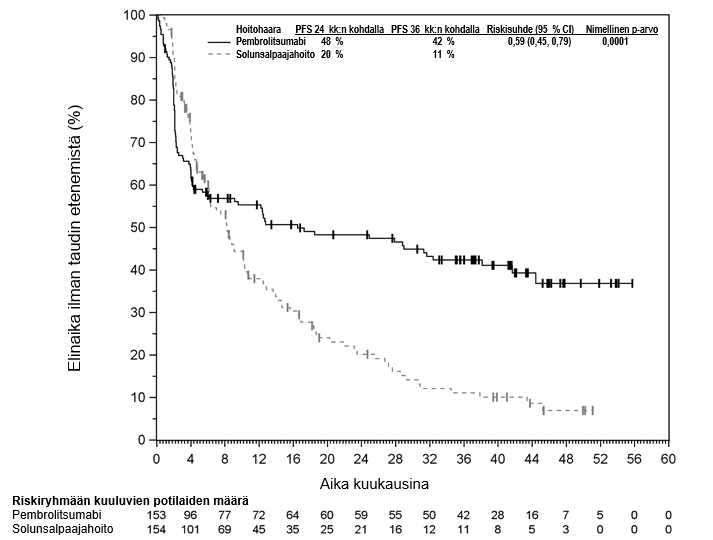
Kuva 39: Kaplan‑Meier-kuvaaja kokonaiselinajasta hoitohaaroittain KEYNOTE‑177-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
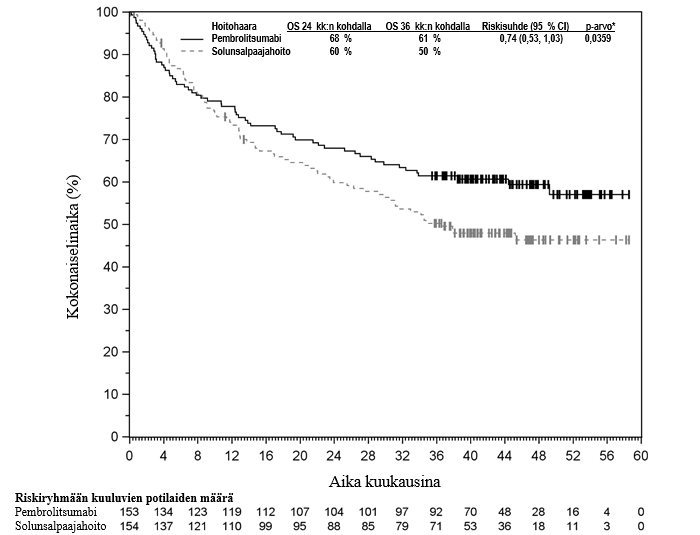
* Ei tilastollista merkitsevyyttä kerrannaisuuden suhteen tehdyn korjauksen jälkeen
KEYNOTE‑164: Avoin tutkimus potilailla, joilla oli leikkaukseen soveltumaton tai metastasoitunut kolorektaalisyöpä, johon liittyy mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi, ja jotka olivat saaneet aiempaa hoitoa
Pembrolitsumabin tehoa arvioitiin KEYNOTE‑164-tutkimuksessa, joka oli satunnaistamaton, avoin, useita kohortteja sisältänyt vaiheen II monikeskustutkimus. Tähän tutkimukseen otettiin potilaita, joiden leikkaukseen soveltumattomaan tai metastasoituneeseen kolorektaalisyöpään liittyi mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi ja joiden syöpä oli edennyt heidän saatuaan aiempaa fluoropyrimidiinipohjaista hoitoa yhdistettynä irinotekaaniin ja/tai oksaliplatiiniin.
Potilaat saivat 200 mg pembrolitsumabia 3 viikon välein, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tauti eteni. Potilaat, joiden kliininen tila oli vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaittiin, saivat jatkaa hoitoa, kunnes taudin eteneminen varmistui. Hoitoa jatkettiin enintään 24 kuukauden (enintään 35 hoitosyklin) ajan potilailla, joiden tauti ei edennyt. Kasvaimen tila arvioitiin 9 viikon välein.
KEYNOTE‑164-tutkimukseen otettujen 124 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 56 vuotta (35 % oli vähintään 65-vuotiaita); miehiä 56 %; valkoihoisia 68 % ja aasialaisia 27 %; 41 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 59 %:lla potilaista ECOG-toimintakykyluokka oli 1. Potilaista 12 %:lla oli BRAF-mutaatioita ja 36 %:lla oli RAS-mutaatioita; 39 %:lla BRAF-mutaatioita ja 34 %:lla RAS-mutaatioita ei ollut määritetty. 97 %:lla oli levinneisyysluokan M1 tauti ja 3 %:lla levinneisyysluokan M0 tauti (paikallisesti edennyt, leikkaukseen soveltumaton). 76 % potilaista oli saanut vähintään kahden aiemman linjan hoitoa.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli objektiivisten vasteiden osuus (ORR), jonka arvioi BICR käyttämällä RECIST 1.1 -kriteerejä. Toissijaisiin tehoa mittaaviin lopputulosmuuttujiin kuuluivat vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika (OS). Seuranta‑ajan mediaani oli 37,3 kuukautta (vaihteluväli 0,1–65,2 kuukautta). Tehoa koskevista tuloksista on esitetty yhteenveto taulukossa 42.
Taulukko 42: KEYNOTE‑164-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | n = 124 |
| Objektiivisten vasteidenosuus* | |
| ORR % (95 % CI) | 34 % (25,6, 42,9) |
| Täydellinen vaste | 10 % |
| Osittainen vaste | 24 % |
| Vasteen kesto* | |
| Mediaani, kk (vaihteluväli) | Ei saavutettu (4,4, 58,5+) |
| Kesto ≥ 36 kk#, % | 92 % |
| * Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena # Perustuu Kaplan–Meier‑arvioon + Ilmaisee, ettei viimeiseen taudin arviointiin mennessä ollut todettu taudin etenemistä | |
Objektiivisia vasteita todettiin riippumatta BRAF- ja RAS-mutaatiostatuksesta.
Muut kuin kolorektaalisyövät
KEYNOTE‑158: Avoin tutkimus potilailla, joilla oli leikkaukseen soveltumaton tai metastasoitunut endometriumkarsinooma tai maha-, ohutsuoli- tai sappitiesyöpä, johon liittyi mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi, ja jotka olivat saaneet aiempaa hoitoa
Satunnaistamattomassa, avoimessa vaiheen II monikeskustutkimuksessa (KEYNOTE‑158) arvioitiin pembrolitsumabin tehoa 377 potilaalla, joilla oli leikkaukseen soveltumaton tai metastasoitunut kiinteä kasvain (muu kuin kolorektaalisyöpä), johon liittyi mikrosatelliitti-instabiliteetti tai puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi. Mukana oli potilaita, joilla oli endometriumkarsinooma tai maha-, ohutsuoli- tai sappitiesyöpä. Kasvaimen mikrosatelliitti-instabiliteetti määritettiin prospektiivisesti polymeraasiketjureaktiolla (PCR), ja puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi määritettiin prospektiivisesti immunohistokemiallisella analyysillä (IHC-analyysillä).
Potilaat saivat 200 mg pembrolitsumabia 3 viikon välein, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai tauti eteni. Potilaat, joiden kliininen tila oli vakaa, kun ensimmäisiä viitteitä taudin etenemisestä havaittiin, saivat jatkaa hoitoa, kunnes taudin eteneminen varmistui. Hoitoa jatkettiin enintään 24 kuukauden (enintään 35 hoitosyklin) ajan potilailla, joiden tauti ei edennyt. Kasvaimen tila arvioitiin 9 viikon välein ensimmäisen vuoden aikana ja sen jälkeen 12 viikon välein.
Endometriumkarsinoomaa sairastavilla 83 potilaalla tiedot lähtötilanteessa olivat: mediaani-ikä 64 vuotta (vaihteluväli 42–86), 46 % oli vähintään 65-vuotiaita; 84 % oli valkoihoisia, 6 % aasialaisia ja 4 % mustaihoisia; ja 46 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 54 %:lla ECOG-toimintakykyluokka oli 1. 98 %:lla oli levinneisyysluokan M1 tauti ja 2 %:lla levinneisyysluokan M0 tauti. 47 % potilaista oli saanut vähintään kahden aiemman linjan hoitoa.
Mahasyöpää sairastavilla 67 potilaalla tiedot lähtötilanteessa olivat: mediaani-ikä 68 vuotta (vaihteluväli 41–89), 61 % oli vähintään 65-vuotiaita; 64 % oli miehiä, 61 % oli valkoihoisia ja 25 % aasialaisia; ja 43 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 57 %:lla ECOG-toimintakykyluokka oli 1. Kaikilla potilailla oli levinneisyysluokan M1 tauti. 45 % potilaista oli saanut vähintään kahden aiemman linjan hoitoa.
Ohutsuolisyöpää sairastavilla 33 potilaalla tiedot lähtötilanteessa olivat: mediaani-ikä 60 vuotta (vaihteluväli 21–78), 39 % oli vähintään 65-vuotiaita; 58 % oli miehiä, 85 % oli valkoihoisia ja 9 % aasialaisia; ja 52 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 48 %:lla ECOG-toimintakykyluokka oli 1. 97 %:lla oli levinneisyysluokan M1 tauti ja 3 %:lla levinneisyysluokan M0 tauti. 33 % potilaista oli saanut vähintään kahden aiemman linjan hoitoa. Kaikkien potilaiden kasvain oli histologisesti adenokarsinooma.
Sappitiesyöpää sairastavilla 22 potilaalla tiedot lähtötilanteessa olivat: mediaani-ikä 61 vuotta (vaihteluväli 40–77), 41 % oli vähintään 65-vuotiaita; 73 % oli miehiä, 91 % oli valkoihoisia ja 9 % aasialaisia; 45 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 55 %:lla ECOG-toimintakykyluokka oli 1; ja 82 %:lla oli levinneisyysluokan M1 ja 18 %:lla levinneisyysluokan M0 tauti. 41 % potilaista oli saanut vähintään kahden aiemman linjan hoitoa.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli objektiivisten vasteiden osuus (ORR), jonka arvioi BICR käyttämällä RECIST 1.1 -kriteerejä. Toissijaisiin tehoa mittaaviin lopputulosmuuttujiin kuuluivat vasteen kesto, elinaika ilman taudin etenemistä (PFS) ja kokonaiselinaika (OS). Seuranta‑ajan mediaani oli 53,5 kuukautta (vaihteluväli 1,5–99,4 kuukautta) endometriumkarsinoomaa sairastavilla, 12,9 kuukautta (vaihteluväli 1,0–102,6 kuukautta) mahasyöpää sairastavilla, 39,4 kuukautta (vaihteluväli 4,2–103,0 kuukautta) ohutsuolisyöpää sairastavilla ja 19,4 kuukautta (vaihteluväli 1,1–97,1) sappitiesyöpää sairastavilla. Tehoa koskevista tuloksista on esitetty yhteenveto taulukossa 43.
Taulukko 43: KEYNOTE‑158-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Endometriumkarsinooma n = 83 | Mahasyöpä¶ n = 65 | Ohutsuolisyöpä¶ n = 32 | Sappitiesyöpä n = 22 |
| Objektiivisten vasteiden osuus* | ||||
ORR % (95 % CI) | 52 % (40,6, 62,9) | 40 % (28,0, 52,9) | 63 % (43,7, 78,9) | 45 % (24,4, 67,8) |
| Täydellinen vaste | 18 % | 18 % | 19 % | 14 % |
| Osittainen vaste | 34 % | 22 % | 44 % | 32 % |
| Vasteen kesto* | ||||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (2,9, 91,9+) | Ei saavutettu (1,9+, 96,1+) | Ei saavutettu (3,7+, 91,4+) | Ei saavutettu (6,2, 92,1+) |
| Kesto ≥ 12 kk#, % | 86 % | 88 % | 87 % | 90 % |
| Kesto ≥ 60 kk#, % | 64 % | 72 % | 72 % | 50 % |
| * Perustuu tietoihin parhaasta objektiivisesta vasteesta, vahvistettuna täydellisenä tai osittaisena vasteena # Perustuu Kaplan–Meier‑arvioon + Ilmaisee, ettei viimeiseen taudin arviointiin mennessä ollut todettu taudin etenemistä ¶ Tehoa koskevan analyysin populaatio koostuu kaikista hoitoa saaneista osallistujista (APaT, All Participants as Treated). Potilaat otettiin tutkimukseen vähintään 26 viikkoa ennen tiedonkeruun päättymispäivää. | ||||
Ruokatorvisyöpä
KEYNOTE-590: Yhdistelmähoitoa koskeva kontrolloitu tutkimus ruokatorvisyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa KEYNOTE-590 arvioitiin pembrolitsumabin ja solunsalpaajahoidon yhdistelmän tehoa potilailla, joilla oli paikallisesti edennyt, leikkaukseen soveltumaton tai metastasoitunut ruokatorvisyöpä tai ruokatorvi-mahalaukkurajan syöpä (Siewertin luokka I). Tutkimukseen ei otettu potilaita, joilla oli aktiivinen autoimmuunisairaus, immunosuppressiota edellyttävä sairaus tai tiedossa oleva HER-2-positiivinen ruokatorvi-mahalaukkurajan adenokarsinooma. Satunnaistaminen stratifioitiin kasvaimen histologisen tyypin (levyepiteelikarsinooma vs. adenokarsinooma), maantieteellisen alueen (Aasia vs. ei Aasia) ja ECOG-toimintakykyluokan (0 vs. 1) perusteella.
Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- Pembrolitsumabi 200 mg kunkin 3 viikon pituisen hoitosyklin päivänä 1 yhdistettynä sisplatiiniin, jota annettiin 80 mg/m2 laskimoon kunkin 3 viikon pituisen hoitosyklin päivänä 1 enintään kuuden hoitosyklin ajan, ja 5‑fluorourasiiliin, jota annettiin 800 mg/m2 vuorokaudessa laskimoon kunkin 3 viikon pituisen hoitosyklin päivinä 1–5 tai 5‑fluorourasiilin antoa koskevien paikallisten ohjeiden mukaisesti.
- Lumelääke kunkin 3 viikon pituisen hoitosyklin päivänä 1 yhdistettynä sisplatiiniin, jota annettiin 80 mg/m2 laskimoon kunkin 3 viikon pituisen hoitosyklin päivänä 1 enintään kuuden hoitosyklin ajan, ja 5‑fluorourasiiliin, jota annettiin 800 mg/m2 vuorokaudessa laskimoon kunkin 3 viikon pituisen hoitosyklin päivinä 1–5 tai 5‑fluorourasiilin antoa koskevien paikallisten ohjeiden mukaisesti.
Potilaat saivat pembrolitsumabia tai solunsalpaajahoitoa, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai kunnes tauti eteni tai enintään 24 kuukauden ajan. Potilailla, jotka oli satunnaistettu saamaan pembrolitsumabia, hoitoa voitiin jatkaa RECIST v1.1 -kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa, kunnes taudin etenemisestä saatu ensimmäinen näyttö oli vahvistettu uudessa kuvantamistutkimuksessa vähintään 4 viikkoa myöhemmin. Kasvaimen tila arvioitiin 9 viikon välein.
KEYNOTE-590-tutkimukseen osallistuneista 749 potilaasta 383:lla (51 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10 PD-L1 IHC 22C3 pharmDxTM -testin mukaan. Näiden 383 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 63 vuotta (vaihteluväli 28–89), 41 % oli vähintään 65-vuotiaita; miehiä 82 %; valkoihoisia 34 % ja aasialaisia 56 %; 43 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 57 %:lla ECOG-toimintakykyluokka oli 1. 93 prosentilla oli levinneisyysluokan M1 tauti. 75 prosentilla kasvain oli histologisesti levyepiteelikarsinooma ja 25 %:lla adenokarsinooma.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja tutkijan RECIST v1.1 ‑kriteereillä arvioima elinaika ilman taudin etenemistä (PFS) levyepiteelikarsinoomapotilailla, joiden CPS-pistemäärä oli ≥ 10, ja kaikilla potilailla. Tutkimus osoitti, että kokonaiselinaika ja elinaika ilman taudin etenemistä olivat tilastollisesti merkitsevästi parantuneet kaikissa etukäteen määritellyissä tutkimuspopulaatioissa. Kaikilla potilailla, jotka satunnaistettiin saamaan pembrolitsumabin ja solunsalpaajahoidon yhdistelmää, kokonaiselinajan riskisuhde oli 0,73 (95 %:n luottamusväli 0,62, 0,86) ja riskisuhde elinajalle ilman taudin etenemistä oli 0,65 (95 %:n luottamusväli 0,55, 0,76) verrattuna solunsalpaajahoitoon. Toissijaiset lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka tutkija arvioi RECIST 1.1 -kriteerien perusteella. Taulukossa 44 on tiivistelmä keskeisistä tehon mittareista etukäteen määritellyn analyysin perusteella potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10 KEYNOTE-590-tutkimuksessa, kun seuranta-ajan mediaani oli 13,5 kuukautta (vaihteluväli 0,5–32,7 kuukautta). Kaplan–Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä on esitetty kuvissa 40 ja 41.
Taulukko 44: Pembrolitsumabin ja solunsalpaajahoidon yhdistelmän tehoa koskevat tulokset KEYNOTE-590-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 10)
| Päätetapahtuma | Pembrolitsumabi Sisplatiinisolunsalpaajahoito 5-fluorourasiili n = 186 | Tavanomainen hoito*
n = 197 |
|---|---|---|
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 124 (66,7 %) | 165 (83,8 %) |
| Mediaani, kk† (95 % CI) | 13,5 (11,1, 15,6) | 9,4 (8,0, 10,7) |
| Riskisuhde‡ (95 % CI) | 0,62 (0,49, 0,78) | |
| p-arvo§ | < 0,0001 | |
| PFS¶ | ||
| Potilaat (%), joilla todettiin tapahtuma | 140 (75,3 %) | 174 (88,3 %) |
| Mediaani, kk† (95 % CI) | 7,5 (6,2, 8,2) | 5,5 (4,3, 6,0) |
| Riskisuhde‡ (95 % CI) | 0,51 (0,41, 0,65) | |
| p-arvo§ | < 0,0001 | |
| Objektiivisten vasteiden osuus¶ | ||
| ORR§ % (95 % CI) | 51,1 (43,7, 58,5) | 26,9 (20,8, 33,7) |
| Täydellinen vaste | 5,9 % | 2,5 % |
| Osittainen vaste | 45,2 % | 24,4 % |
| p-arvo# | < 0,0001 | |
| Vasteen kesto¶,Þ | ||
| Mediaani, kk (vaihteluväli) | 10,4 (1,9, 28,9+) | 5,6 (1,5+, 25,0+) |
| Potilaat (%), joilla kesto on ≥ 6 kk† | 80,2 % | 47,7 % |
| Potilaat (%), joilla kesto on ≥ 12 kk† | 43,7 % | 23,2 % |
| Potilaat (%), joilla kesto on ≥ 18 kk† | 33,4 % | 10,4 % |
| *Sisplatiini ja 5-fluorourasiili † Perustuu Kaplan–Meier-arvioon ‡ Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan § Yksitahoinen p-arvo log rank -testin perusteella, ositus maantieteellisen alueen (Aasia vs. muu maailma), kasvaimen histologisten piirteiden (adenokarsinooma vs. levyepiteelikarsinooma) ja ECOG-toimintakykyluokan (0 vs. 1) mukaan ¶ Tutkija arvioi käyttämällä RECIST 1.1 -kriteerejä # Yksitahoinen p-arvo testausta varten. H0: ero prosentteina = 0 vs. H1: ero prosentteina > 0 Þ Paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena. | ||
KEYNOTE‑590-tutkimukseen otettiin yhteensä 32 potilasta, joiden ikä oli ≥ 75 vuotta ja joilla PD-L1-ligandin CPS-pistemäärä oli ≥ 10 (18 potilasta pembrolitsumabiyhdistelmähoidon haaraan ja 14 verrokkihaaraan). Pembrolitsumabin ja solunsalpaajahoidon yhdistelmän tehosta on liian niukasti tietoa tässä potilasjoukossa.
Kuva 40: Kaplan–Meier‑kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑590-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥10)
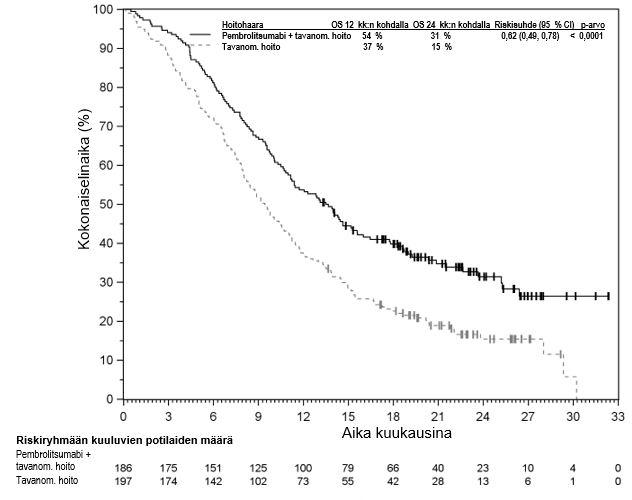
Kuva 41: Kaplan–Meier‑kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE‑590‑tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥10)
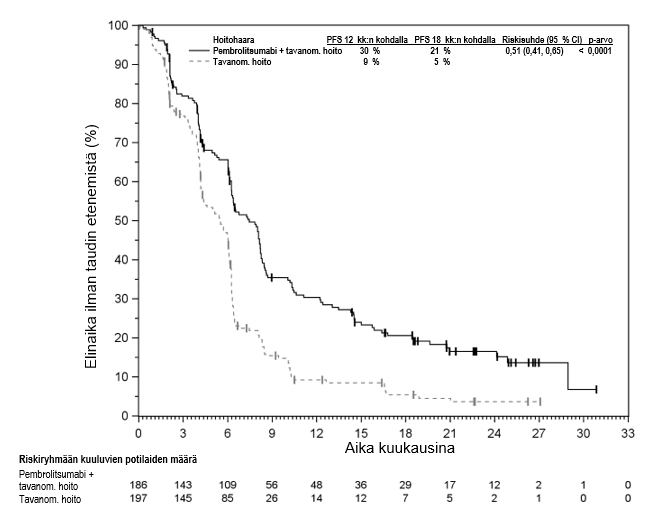
Kolmoisnegatiivinen rintasyöpä
KEYNOTE‑522: Neoadjuvantti- ja adjuvanttihoitoa koskeva kontrolloitu tutkimus paikallisesti edennyttä, inflammatorista tai varhaisvaiheen kolmoisnegatiivista rintasyöpää sairastavilla potilailla, joilla taudin uusiutumisriski on suuri
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑522-monikeskustutkimuksessa tutkittiin pembrolitsumabin tehoa, kun sitä annettiin ensin yhdistelmänä solunsalpaajahoidon kanssa neoadjuvanttihoitona ja käyttöä jatkettiin leikkauksen jälkeen monoterapiana adjuvanttihoitona. Potilaat saivat tarvittaessa adjuvanttisädehoitoa ennen adjuvanttihoitona annettua pembrolitsumabia tai lumelääkettä tai samanaikaisesti näiden kanssa. Tämän tutkimuksen keskeiset sisäänottokriteerit olivat paikallisesti edennyt, inflammatorinen tai varhaisvaiheen kolmoisnegatiivinen rintasyöpä, jonka uusiutumisriski oli suuri (kasvaimen halkaisija > 1 cm mutta ≤ 2 cm ja etäpesäkkeitä imusolmukkeissa tai kasvaimen halkaisija > 2 cm riippumatta imusolmukkeiden etäpesäkestatuksesta), riippumatta kasvaimen PD‑L1:n ilmentymisstatuksesta. Potilaat, joilla oli aktiivinen autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin imusolmukestatuksen (positiivinen vs. negatiivinen), kasvaimen koon (T1/T2 vs. T3/T4), ja karboplatiinin annostelun (kolmen viikon välein vs. kerran viikossa) mukaan. Potilaat satunnaistettiin (2:1) saamaan joko pembrolitsumabia tai lumelääkettä laskimoon seuraavasti:
-
neljän hoitosyklin ajan neoadjuvanttihoitona 200 mg pembrolitsumabia tai lumelääkettä kolmen viikon välein hoitosyklien 1–4 päivänä 1 yhdistettynä
- karboplatiiniin
- AUC 5 mg/ml/min kolmen viikon välein hoitosyklien 1–4 päivänä 1 tai AUC 1,5 mg/ml/min kerran viikossa hoitosyklien 1–4 päivinä 1, 8 ja 15 ja
- paklitakseliin 80 mg/m2 kerran viikossa hoitosyklien 1–4 päivinä 1, 8 ja 15
- karboplatiiniin
-
minkä jälkeen neljän ylimääräisen hoitosyklin ajan neoadjuvanttihoitona 200 mg pembrolitsumabia kolmen viikon välein tai lumelääkettä hoitosyklien 5–8 päivänä 1 yhdistettynä
- doksorubisiiniin 60 mg/m2tai epirubisiiniin 90 mg/m2 kolmen viikon välein hoitosyklien 5–8 päivänä 1 ja
- syklofosfamidiin 600 mg/m2 kolmen viikon välein hoitosyklien 5–8 päivänä 1.
- Leikkauksen jälkeen annettiin adjuvanttihoitona 200 mg pembrolitsumabia tai lumelääkettä kolmen viikon välein yhdeksän hoitosyklin ajan.
Hoitoa pembrolitsumabilla tai lumelääkkeellä jatkettiin, kunnes hoito oli saatu päätökseen (17 hoitosykliä), taudin eteneminen sulki pois parantavan leikkaushoidon, tauti uusiutui adjuvanttihoitovaiheessa tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä.
Yhteensä 1 174 potilasta satunnaistettiin. Tutkimuspopulaation tiedot lähtötilanteessa olivat: mediaani-ikä 49 vuotta (vaihteluväli 22–80); 11 % oli vähintään 65-vuotiaita; 99,9 % naisia; 64 % valkoihoisia, 20 % aasialaisia, 5 % mustaihoisia ja 2 % Amerikan tai Alaskan alkuperäisväestöön kuuluvia; 87 %:lla ECOG-toimintakykyluokka oli 0 ja 13 %:lla ECOG-toimintakykyluokka oli 1; 56 % oli premenopausaalisia ja 44 % oli postmenopausaalisia; 7 %:lla primaarikasvaimen koko oli T1, 68%:lla T2, 19%:lla T3 ja 7 %:lla T4; 49 %:lla imusolmukkeiden etäpesäkestatus oli 0 (N0), 40 %:lla N1, 11 %:lla N2 ja 0,2 %:lla N3; 1,4 %:lla potilaista oli inflammatorinen rintasyöpä; 75 %:lla syövän levinneisyysaste oli II ja 25 %:lla levinneisyysaste oli III.
Kaksi ensisijaista tehoa mittaavaa lopputulosmuuttujaa olivat patologisesti todettu täydellinen vaste (pCR) ja tapahtumavapaa elinaika (EFS). Patologisesti todetun täydellisen vasteen määritelmä oli, ettei invasiivista syöpää ollut rinnassa eikä imusolmukkeissa (neoadjuvanttihoidon jälkeen T0/Tis ja N0), ja arvioinnin teki paikallinen patologi sokkoutetusti parantavan leikkauksen yhteydessä. Tapahtumavapaa elinaika oli määritelty ajaksi satunnaistamisesta minkä tahansa seuraavista tapahtumista ensimmäiseen ilmenemiseen: parantavan leikkauksen poissulkeva taudin eteneminen, paikallinen tai etäpesäkkeinen uusiutuminen, toinen primaari maligniteetti tai mistä tahansa syystä johtunut kuolema. Toissijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS).
Tutkimus osoitti, että patologisesti todettujen täydellisten vasteiden osuuksien erot olivat tilastollisesti merkitsevästi parantuneet tutkimuksen ennalta määritellyssä primaarianalyysissa (n = 602); pCR-osuudet olivat 64,8 % (95 %:n luottamusväli: 59,9 %, 69,5 %) pembrolitsumabihaarassa ja 51,2 % (95 %:n luottamusväli: 44,1 %, 58,3 %) lumelääkehaarassa; hoitojen välinen ero oli 13,6 % (95 %:n luottamusväli: 5,4 %, 21,8 %; p‑arvo 0,00055). Tutkimus osoitti myös, että tapahtumavapaa elinaika oli tilastollisesti merkitsevästi parantunut tutkimuksen ennalta määritellyssä välianalyysissä (kaikkien potilaiden seuranta-ajan mediaani 37,8 kuukautta [vaihteluväli: 2,7–48,0 kuukautta], riskisuhde 0,63 [95 %:n luottamusväli: 0,48, 0,82; p‑arvo 0,00031]). Kun kaikkien potilaiden seuranta-ajan mediaani oli 73,1 kuukautta (vaihteluväli: 2,7–83,9 kuukautta), tutkimuksessa osoitettiin myös, että kokonaiselinaika oli pidentynyt tilastollisesti merkitsevästi.
Taulukossa 45 on tiivistelmä tuloksista, jotka on raportoitu pCR:n ennalta määritellystä lopullisesta analyysistä (n = 1 002), sekä keskeisistä tehon mittareista, joita käytettiin tapahtumavapaata elinaikaa ja kokonaiselinaikaa koskevassa ennalta määritellyssä välianalyysissä, kun kaikkien potilaiden seuranta-ajan mediaani oli 73,1 kuukautta (vaihteluväli: 2,7–83,9 kuukautta). Kuvissa 42 ja 43 esitetään Kaplan–Meier-kuvaajat tapahtumavapaalle elinajalle ja kokonaiselinajalle.
Taulukko 45: KEYNOTE‑522-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi ja solunsalpaajahoito / pembrolitsumabi | Lumelääke ja solunsalpaajahoito / lumelääke | |
| pCR (neoadjuvanttihoidon jälkeen T0/Tis ja N0)* | n = 669 | n = 333 | |
| pCR-vasteen saavuttaneiden potilaiden määrä | 428 | 182 | |
| pCR-osuus (%) (95 % CI) | 64,0 (60,2, 67,6) | 54,7 (49,1, 60,1) | |
| Hoitojen välinen ero (%), arvio (95 % CI)† | 9,2 (2,8, 15,6) | ||
| p-arvo‡ | 0,00221 | ||
| EFS | n = 784 | n = 390 | |
| Potilaat (%), joilla todettiin tapahtuma | 159 (20,3 %) | 114 (29,2 %) | |
| Riskisuhde (95 % CI)¶ | 0,65 (0,51, 0,83) | ||
| OSÞ | n = 784 | n = 390 | |
| Potilaat (%), joilla todettiin tapahtuma | 115 (14,7 %) | 85 (21,8 %) | |
| Riskisuhde (95 % CI)¶ | 0,66 (0,50, 0,87) | ||
| p-arvo# | 0,00150 | ||
| * Perustuu ennalta määriteltyyn lopulliseen analyysiin (jossa vertailun merkitsevyystaso oli 0,0028) † Perustuu Miettisen ja Nurmisen menetelmään, ositus imusolmukestatuksen, kasvaimen koon ja karboplatiinin annostelun mukaan ‡ Yksitahoinen p-arvo testausta varten. H0: ero prosentteina = 0 vs. H1: ero prosentteina > 0 ¶ Perustuu Coxin regressiomalliin, jossa on käytetty tasatulosten käsittelyyn Efronin menetelmää ja jossa kovariaattina on hoito, ositus imusolmukestatuksen, kasvaimen koon ja karboplatiinin annostelun mukaan Þ Perustuu kokonaiselinaikaa koskevaan ennalta määriteltyyn välianalyysiin (jossa vertailun merkitsevyystaso oli 0,00503) # Yksitahoinen p‑arvo log rank ‑testin perusteella, ositus imusolmuksestatuksen, kasvaimen koon ja karboplatiinin annostelun mukaan | |||
Kuva 42: Kaplan–Meier‑kuvaaja tapahtumavapaalle elinajalle hoitohaaroittain KEYNOTE‑522-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
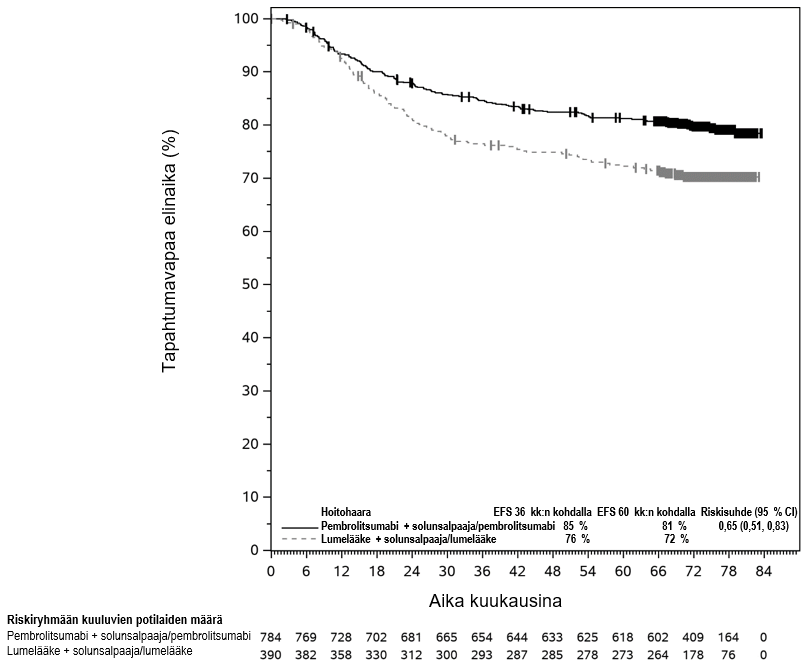
Kuva 43: Kaplan–Meier‑kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑522-tutkimuksessa (hoitoaikeen mukainen potilasjoukko)
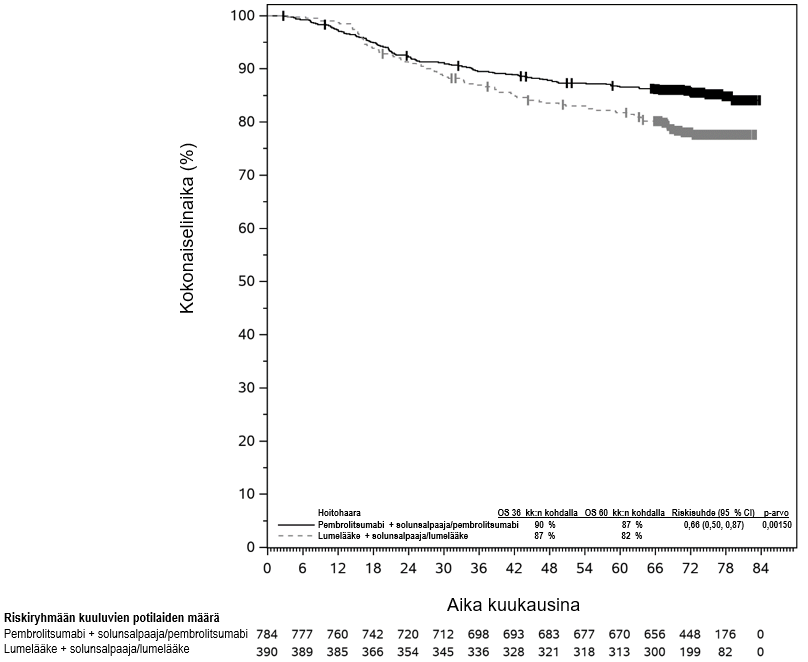
KEYNOTE‑355: Yhdistelmähoitoa koskeva kontrolloitu tutkimus kolmoisnegatiivista rintasyöpää sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa metastasoituneeseen tautiin
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑355-monikeskustutkimuksessa arvioitiin pembrolitsumabin tehoa, kun sitä annettiin yhdistelmänä paklitakselin, nab-paklitakselin tai gemsitabiinin ja karboplatiinin kanssa. Keskeiset sisäänottokriteerit olivat paikallisesti uusiutunut ja leikkaukseen soveltumaton tai metastasoitunut kolmoisnegatiivinen rintasyöpä riippumatta kasvaimen PD‑L1:n ilmentymisestä ja se, ettei potilas ollut saanut aiempaa solunsalpaajahoitoa edenneeseen tautiin. Potilaat, joilla oli aktiivinen autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa 2 vuoden sisällä hoidosta, tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin solunsalpaajahoidon (paklitakseli tai nab‑paklitakseli vs. gemsitabiini ja karboplatiini), kasvaimen PD‑L1:n ilmentymisen (CPS ≥ 1 vs. CPS < 1) ja samaan luokkaan kuuluvalla solunsalpaajalla annetun aiemman neoadjuvanttihoidon (annettu vs. ei annettu) mukaan. Potilaat satunnaistettiin (2:1) jompaankumpaan seuraavista hoitohaaroista, joissa hoito annettiin infuusiona laskimoon:
- pembrolitsumabia 200 mg 3 viikon välein päivänä 1 ja lisäksi nab-paklitakselia 100 mg/m2 28 päivän välein päivinä 1, 8 ja 15 tai paklitakselia 90 mg/m2 28 päivän välein päivinä 1, 8 ja 15 tai gemsitabiinia 1 000 mg/m2 ja karboplatiinia (AUC 2 mg/ml/min) 21 päivän välein päivinä 1 ja 8
- lumelääkettä 3 viikon välein päivänä 1 ja lisäksi nab-paklitakselia 100 mg/m2 28 päivän välein päivinä 1, 8 ja 15 tai paklitakselia 90 mg/m2 28 päivän välein päivinä 1, 8 ja 15 tai gemsitabiinia 1 000 mg/m2 ja karboplatiinia (AUC 2 mg/ml/min) 21 päivän välein päivinä 1 ja 8.
Solunsalpaajahoitoon yhdistettyä pembrolitsumabi- tai lumelääkehoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST 1.1 ‑kriteerien mukaan taudin edenneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Solunsalpaajahoitoa voitiin jatkaa tavanomaisen hoitokäytännön mukaisesti. Pembrolitsumabihoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Kasvaimen tila arvioitiin viikoilla 8, 16 ja 24, sen jälkeen 9 viikon välein ensimmäisen vuoden ajan ja tämän jälkeen 12 viikon välein.
KEYNOTE-355-tutkimuksessa satunnaistetuista 847 potilaasta 636:lla (75 %:lla) oli kasvaimia, joissa PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, ja 323:lla (38 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10 PD-L1 IHC 22C3 pharmDxTM -testin mukaan. Niiden 323 potilaan, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10, tiedot lähtötilanteessa olivat: mediaani-ikä 53 vuotta (vaihteluväli 22–83); 20 % vähintään 65-vuotiaita; 100 % naisia; 69 % valkoisia, 20 % aasialaisia ja 5 % mustaihoisia; 61 %:lla ECOG-toimintakykyluokka oli 0 ja 39 %:lla 1; 67 % oli postmenopausaalisia; 3 %:lla oli todettu etäpesäkkeitä aivoissa ja 20 %:lla oli ollut < 12 kuukauden tauditon jakso.
Kaksi tehoa mittaavaa ensisijaista lopputulosmuuttujaa olivat elinaika ilman taudin etenemistä (PFS), jonka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä, ja kokonaiselinaika (OS). Toissijaiset tehoa mittaavat lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Tutkimuksessa todettiin tilastollisesti merkitsevä pidentyminen elinajassa ilman taudin etenemistä etukäteen määritellyn välianalyysin kohdalla (riskisuhde 0,65; 95 %:n CI 0,49, 0,86; p‑arvo 0,0012) ja kokonaiselinajassa lopullisen analyysin kohdalla potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10 ja jotka oli satunnaistettu pembrolitsumabin ja solunsalpaajahoidon yhdistelmää saaneiden haaraan, verrattuna lumelääkkeen ja solunsalpaajahoidon yhdistelmää saaneisiin potilaisiin. Taulukossa 46 on tiivistelmä keskeisistä tehon mittareista, ja kuvissa 44 ja 45 on esitetty lopulliseen analyysiin perustuvat Kaplan–Meier-kuvaajat elinajasta ilman taudin etenemistä ja kokonaiselinajasta potilailla, joilla kasvaimien PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 10, kun seuranta-ajan mediaani oli 20,2 kuukautta (vaihteluväli 0,3–53,1 kuukautta).
Taulukko 46: KEYNOTE‑355-tutkimuksen tehoa koskevat tulokset potilailla, joilla CPS-pistemäärä oli ≥ 10
| Päätetapahtuma | Pembrolitsumabi ja solunsalpaajahoito* n = 220 | Lumelääke ja solunsalpaajahoito* n = 103 |
| PFS† | ||
| Potilaat (%), joilla todettiin tapahtuma | 144 (65 %) | 81 (79 %) |
| Riskisuhde‡ (95 % CI) | 0,66 (0,50, 0,88) | |
| p‑arvo§ | 0,0018 | |
| Mediaani, kk (95 % CI) | 9,7 (7,6, 11,3) | 5,6 (5,3, 7,5) |
| Kokonaiselinaika | ||
| Potilaat (%), joilla todettiin tapahtuma | 155 (70 %) | 84 (82 %) |
| Riskisuhde‡ (95 % CI) | 0,73 (0,55, 0,95) | |
| p-arvo¶ | 0,0093 | |
| Mediaani, kk (95 % CI) | 23,0 (19,0, 26,3) | 16,1 (12,6, 18,8) |
| Objektiivisten vasteiden osuus† | ||
| ORR % (95 % CI) | 53 % (46, 59) | 41 % (31, 51) |
| Täydellinen vaste | 17 % | 14 % |
| Osittainen vaste | 35 % | 27 % |
| Vasteen kesto† | ||
| Mediaani, kk (vaihteluväli) | 12,8 (1,6+, 45,9+) | 7,3 (1,5, 46,6+) |
| %-osuus potilaita, joilla kesto on ≥ 6 kk# | 82 % | 60 % |
| %-osuus potilaita, joilla kesto on ≥ 12 kk# | 56 % | 38 % |
| * Solunsalpaajahoito: paklitakseli, nab-paklitakseli tai gemsitabiini ja karboplatiini † Arvioinut sokkoutettu riippumaton keskitetty arvioijataho (BICR) käyttämällä RECIST 1.1 ‑kriteerejä ‡ Perustuu Coxin regressiomalliin, jossa on käytetty tasatulosten käsittelyyn Efronin menetelmää ja jossa kovariaattina on hoito, ositus tutkimuksessa annetun solunsalpaajahoidon (taksaani vs. gemsitabiini ja karboplatiini) ja samaan luokkaan kuuluvalla solunsalpaajalla annetun aiemman neoadjuvanttihoidon (annettu vs. ei annettu) mukaan. § Nimellinen p-arvo log rank -testin perusteella, ositus tutkimuksessa annetun solunsalpaajahoidon (taksaani vs. gemsitabiini ja karboplatiini) ja samaan luokkaan kuuluvalla solunsalpaajalla annetun aiemman neoadjuvanttihoidon (annettu vs. ei annettu) mukaan. Elinaikaa ilman taudin etenemistä koskeneen etukäteen määritellyn välianalyysin kohdalla (seuranta-ajan mediaani 19,2 kuukautta) pembrolitsumabia ja solunsalpaajahoitoa saaneilla potilailla saavutettiin tilastollisesti merkitsevästi pidempi elinaika ilman taudin etenemistä kuin lumelääkettä ja solunsalpaajahoitoa saaneilla potilailla, p-arvo 0,0012. ¶ Yksitahoinen p‑arvo log rank -testin perusteella, ositus tutkimuksessa annetun solunsalpaajahoidon (taksaani vs. gemsitabiini ja karboplatiini) ja samaan luokkaan kuuluvalla solunsalpaajalla annetun aiemman neoadjuvanttihoidon (annettu vs. ei annettu) mukaan. Kokonaiselinaikaa koskevat tulokset saavuttivat tehoa koskevien tulosten tilastolliselle merkitsevyydelle etukäteen määritellyn raja-arvon 0,0113. # Perustuu sensuroidulle tietojoukolle johdettuun rajatulomenetelmään (Kaplan–Meier-menetelmään) + Ilmaisee, ettei viimeiseen taudin arviointiin mennessä ollut todettu taudin etenemistä | ||
Kuva 44: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE‑355-tutkimuksessa potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 10)
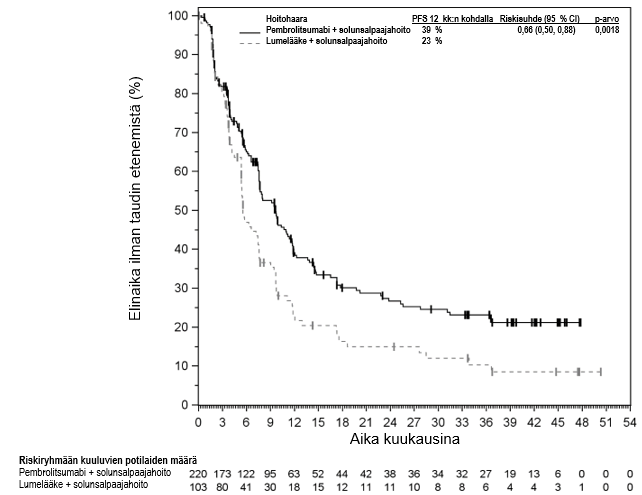
Kuva 45: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑355-tutkimuksessa potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 10)
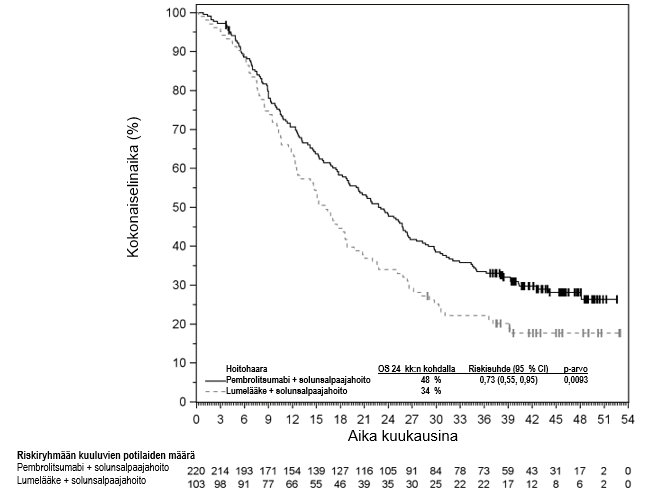
Endometriumkarsinooma
KEYNOTE‑868 (NRG‑GY018): Primaaristi edennyttä tai uusiutunutta endometriumkarsinoomaa sairastavien potilaiden yhdistelmähoitoa koskeva kontrolloitu tutkimus
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑868-monikeskustutkimuksessa (NRG‑GY018) arvioitiin pembrolitsumabin tehoa, kun sitä annettiin yhdistelmänä paklitakselin ja karboplatiinin kanssa. Tutkimuksessa oli mukana 810 potilasta, joilla oli edennyt tai uusiutunut endometriumkarsinooma, ja potilaista osalla kasvaimen status oli dMMR ja osalla pMMR. Potilaat eivät olleet aiemmin saaneet systeemistä hoitoa tai he olivat saaneet aiemmin solunsalpaajia adjuvanttihoitona. Aiemmin solunsalpaajia adjuvanttihoitona saaneet potilaat soveltuivat tutkimukseen, jos solunsalpaajien saamisesta oli kulunut vähintään 12 kuukautta. Potilaat, joilla oli endometriumin sarkooma, mukaan lukien karsinosarkooma, ja potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin MMR-statuksen, ECOG-toimintakykyluokan (0 tai 1 vs. 2) ja aiemman adjuvanttihoitona annetun solunsalpaajahoidon mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- pembrolitsumabia 200 mg kolmen viikon välein, paklitakselia 175 mg/m2 ja karboplatiinia (AUC 5 mg/ml/min) kuuden hoitosyklin ajan ja sen jälkeen pembrolitsumabia 400 mg kuuden viikon välein enintään 14 hoitosyklin ajan
- lumelääkettä kolmen viikon välein, paklitakselia 175 mg/m2 ja karboplatiinia (AUC 5 mg/ml/min) kuuden hoitosyklin ajan ja sen jälkeen lumelääkettä kuuden viikon välein enintään 14 hoitosyklin ajan.
Kaikki tutkimuslääkkeet annettiin infuusiona laskimoon kunkin hoitosyklin päivänä 1. Hoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 20 hoitosyklin ajan (enintään noin 24 kuukauden ajan). Potilaat, joilla oli mitattavissa oleva tauti ja joilla oli RECIST-kriteerien mukaan vakaa tauti tai osittainen vaste hoitosyklin 6 päätyttyä, saivat tutkijalääkärin harkinnan mukaan jatkaa paklitakselin ja karboplatiinin käyttöä pembrolitsumabin tai lumelääkkeen kanssa enintään 10 hoitosyklin ajan. Kasvaimen tila arvioitiin 9 viikon välein ensimmäisten 9 kuukauden ajan ja tämän jälkeen 12 viikon välein.
Satunnaistetuista 810 potilaasta 222:lla (27 %:lla) kasvaimen status oli dMMR ja 588:lla (73 %:lla) pMMR.
dMMR-populaation tiedot olivat: mediaani-ikä 66 vuotta (vaihteluväli 37–86), 55 % oli vähintään 65‑vuotiaita; 79 % oli valkoihoisia, 9 % mustaihoisia ja 3 % aasialaisia; 5 % oli taustaltaan espanjankielisiä tai latinalaisamerikkalaisia; 64 %:lla potilaista ECOG-toimintakykyluokka oli 0, 33 %:lla ECOG-toimintakykyluokka oli 1 ja 3 %:lla ECOG-toimintakykyluokka oli 2. 61 %:lla oli uusiutunut tauti ja 39 %:lla primaari tai persistoiva tauti; 5 % oli saanut aiemmin solunsalpaajia adjuvanttihoitona ja 43 % oli saanut aiemmin sädehoitoa. Histologisia alatyyppejä olivat endometrioidi karsinooma (24 %:lla potilaista astetta 1, 43 %:lla astetta 2 ja 14 %:lla astetta 3), tarkemmin määrittelemätön adenokarsinooma (11 %:lla potilaista) ja muu (8 %:lla potilaista, mukaan lukien dedifferentoitunut/erilaistumaton, seroosinen ja sekamuotoinen epiteliaalinen).
pMMR-populaation tiedot olivat: mediaani-ikä 66 vuotta (vaihteluväli: 29–94), 54 % oli vähintään 65‑vuotiaita; 72 % oli valkoihoisia, 16 % mustaihoisia ja 5 % aasialaisia; 6 % oli taustaltaan espanjankielisiä tai latinalaisamerikkalaisia; 67 %:lla potilaista ECOG-toimintakykyluokka oli 0, 30 %:lla ECOG-toimintakykyluokka oli 1 ja 3 %:lla ECOG-toimintakykyluokka oli 2. 56 %:lla oli uusiutunut tauti ja 44 %:lla primaari tai persistoiva tauti; 26 % oli saanut aiemmin solunsalpaajia adjuvanttihoitona ja 41 % oli saanut aiemmin sädehoitoa. Histologisia alatyyppejä olivat endometrioidi karsinooma (17 %:lla potilaista astetta 1, 19 %:lla astetta 2 ja 16 %:lla astetta 3), seroosinen (26 %:lla potilaista), tarkemmin määrittelemätön adenokarsinooma (10 %:lla potilaista), kirkassolukarsinooma (7 %:lla potilaista) ja muu (5 %:lla potilaista, mukaan lukien sekamuotoinen epiteliaalinen ja dedifferentoitunut/erilaistumaton).
Tehoa mittaava ensisijainen lopputulosmuuttuja oli tutkijalääkärin RECIST 1.1 ‑kriteereillä arvioima elinaika ilman taudin etenemistä (PFS) dMMR- ja pMMR-populaatioissa. Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat kokonaiselinaika (OS), objektiivisten vasteiden osuus (ORR) ja vasteen kesto dMMR- ja pMMR-populaatioissa. Tutkimuksessa todettiin tilastollisesti merkitsevä pidentyminen elinajassa ilman taudin etenemistä potilailla, jotka oli satunnaistettu saamaan pembrolitsumabin ja solunsalpaajahoidon yhdistelmää, verrattuna lumelääkkeen ja solunsalpaajahoidon yhdistelmää saaneisiin potilaisiin. Pidentyminen todettiin sekä dMMR- että pMMR-populaatioissa. Seuranta-ajan mediaani oli dMMR-populaatiossa 13,6 kuukautta (vaihteluväli 0,6–39,4 kuukautta) ja pMMR-populaatiossa 8,7 kuukautta (vaihteluväli 0,1–37,2 kuukautta). Kokonaiselinajan päätetapahtumaa ei arvioitu muodollisesti monivertailukorjauksella. Kokonaiselinaikaa koskevien tulosten täyttä maturiteettia ei saavutettu. Taulukossa 47 on esitetty yhteenveto tehoa koskevista tuloksista MMR-statuksen mukaan. Kuvissa 46 ja 47 on esitetty Kaplan–Meier-kuvaajat elinajasta ilman taudin etenemistä MMR-statuksen mukaan.
Taulukko 47: KEYNOTE‑868-tutkimuksen (NRG‑GY018) tehoa koskevat tulokset
| Päätetapahtuma | dMMR-populaatio | pMMR-populaatio | ||
Pembrolitsumabi ja solunsalpaajahoito* n = 110 | Lumelääke ja solunsalpaajahoito* n = 112 | Pembrolitsumabi ja solunsalpaajahoito* n = 294 | Lumelääke ja solunsalpaajahoito* n = 294 | |
| PFS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 29 (26 %) | 60 (54 %) | 95 (32 %) | 138 (47 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (30,7, ei saavutettu) | 8,3 (6,5, 12,3) | 13,1 (10,6, 19,5) | 8,7 (8,4, 11,0) |
| Riskisuhde† (95 % CI) | 0,34 (0,22, 0,53) | 0,57 (0,44, 0,74) | ||
| p‑arvo‡ | < 0,0001 | < 0,0001 | ||
| OS | ||||
| Potilaat (%), joilla todettiin tapahtuma | 10 (9 %) | 17 (15 %) | 45 (15 %) | 54 (18 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (ei saavutettu, ei saavutettu) | 28,0 (21,4, ei saavutettu) | 27,4 (19,5, ei saavutettu) |
| Riskisuhde† (95 % CI) | 0,55 (0,25, 1,19) | 0,79 (0,53, 1,17) | ||
| Objektiivisten vasteiden osuus | ||||
| Osallistujat, joilla oli mitattavissa oleva tauti lähtötilanteessa | n = 95 | n = 95 | n = 220 | n = 235 |
| ORR¶ % (95 % CI) | 78 % (68, 86) | 69 % (59, 79) | 61 % (55, 68) | 51 % (45, 58) |
| Vasteen kesto | ||||
| Mediaani, kk (vaihteluväli) | Ei saavutettu (0,0+, 33,0+) | 4,4 (0,0+, 32,8+) | 7,1 (0,0+, 32,8+) | 6,4 (0,0+, 20,1+) |
| * Solunsalpaajahoito (paklitakseli ja karboplatiini) † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Yksitahoinen p‑arvo ositetun log rank ‑testin perusteella (vertailukohtana alfa-arvon raja 0,00207 dMMR:n kohdalla ja 0,00116 pMMR:n kohdalla) ¶ Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena. | ||||
Kuva 46: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑868-tutkimuksessa (NRG‑GY018) dMMR-populaatiossa
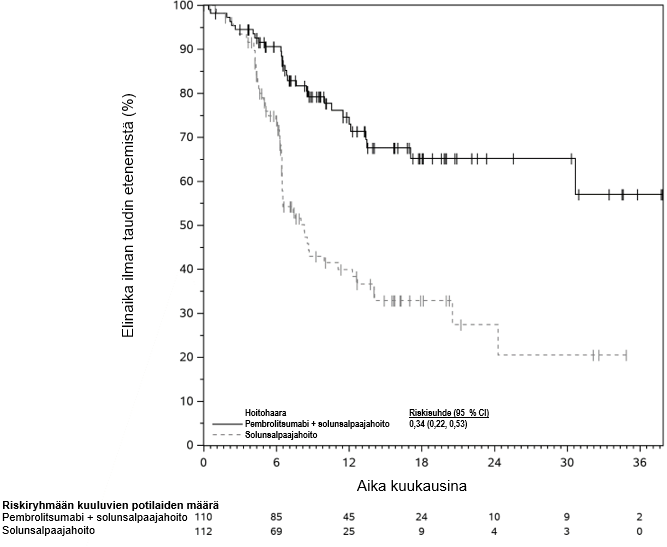
Kuva 47: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑868-tutkimuksessa (NRG‑GY018) pMMR-populaatiossa
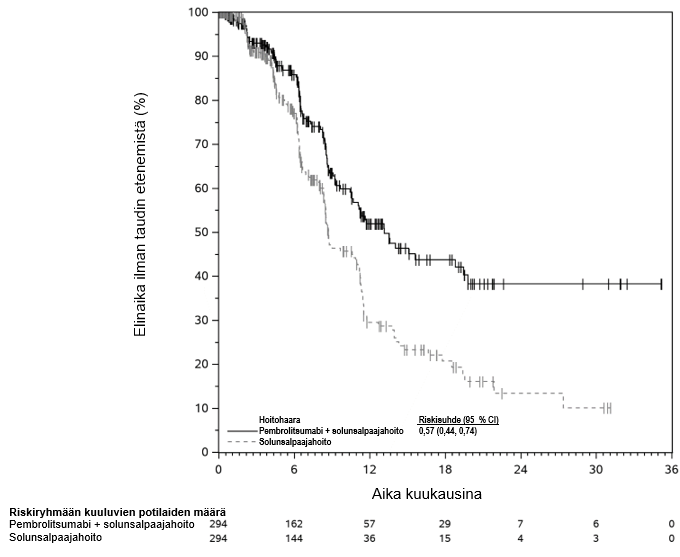
KEYNOTE‑775: Yhdistelmähoitoa koskeva kontrolloitu tutkimus edennyttä endometriumkarsinoomaa sairastavilla potilailla, jotka olivat aiemmin saaneet systeemistä solunsalpaajahoitoa
Satunnaistetussa, avoimessa, aktiivikontrolloidussa monikeskustutkimuksessa KEYNOTE‑775 arvioitiin pembrolitsumabin tehoa yhdistelmänä lenvatinibin kanssa potilailla, joilla oli edennyt endometriumkarsinooma ja jotka olivat saaneet aiemmin ainakin yhtä platinapohjaista solunsalpaajahoitoa missä tahansa tilanteessa, neoadjuvantti- ja adjuvanttihoidot mukaan lukien. Osallistujat olivat voineet saada yhteensä enintään kahta platinapohjaista hoitoa, kunhan yksi tällainen hoito oli annettu neoadjuvantti- tai adjuvanttihoitona. Tutkimuksesta suljettiin pois potilaat, joilla oli endometriumin sarkooma, karsinosarkooma, aiemmin todettu vaikeusasteen ≥ 3 fisteli, kontrolloimaton verenpaine (> 150/90 mmHg), merkittävä kardiovaskulaarisen toiminnan häiriö tai kardiovaskulaaritapahtuma edeltävien 12 kuukauden aikana, ja potilaat, joilla oli aktiivinen autoimmuunisairaus tai immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin MMR-statuksen (dMMR [puutteellinen DNA:n kahdentumisvirheiden korjausmekanismi] tai pMMR [toimiva DNA:n kahdentumisvirheiden korjausmekanismi]) mukaan käyttämällä validoitua IHC-testiä. pMMR-osite stratifioitiin edelleen ECOG-toimintakykyluokan, maantieteellisen alueen ja aiemman lantion alueen sädehoidon mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- pembrolitsumabia 200 mg laskimoon kolmen viikon välein yhdistelmänä lenvatinibin kanssa, joka annettiin 20 mg:n annoksella suun kautta kerran vuorokaudessa
- tutkijalääkärin valinnan mukaan joko doksorubisiinia 60 mg/m2 kolmen viikon välein tai paklitakselia 80 mg/m2 kerran viikossa, hoito 3 viikon ajan / 1 viikon tauko.
Pembrolitsumabi- ja lenvatinibihoitoa jatkettiin BICR:n vahvistamaan RECIST v1.1 ‑kriteerien mukaiseen taudin etenemiseen asti tai kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai pembrolitsumabin osalta enintään 24 kuukauden ajan. Tutkimushoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilasta hoitava tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä, ja potilas sieti hoidon. Yhteensä 121/411 (29 %) pembrolitsumabi- ja lenvatinibihoitoa saaneen potilaan tutkimushoitoa jatkettiin RECIST-kriteerien mukaisen taudin etenemisen jälkeen. Taudin etenemisen jälkeisen hoidon keston mediaani oli 2,8 kuukautta. Kasvaimen tila arvioitiin 8 viikon välein.
Tutkimukseen otettiin yhteensä 827 potilasta, jotka satunnaistettiin saamaan joko pembrolitsumabia yhdistelmänä lenvatinibin kanssa (n = 411) tai tutkijalääkärin valinnan mukaan doksorubisiinia (n = 306) tai paklitakselia (n = 110). Näiden potilaiden tiedot lähtötilanteessa olivat: mediaani-ikä 65 vuotta (vaihteluväli 30–86), potilaista 50 % oli vähintään 65‑vuotiaita; 61 % valkoihoisia, 21 % aasialaisia ja 4 % mustaihoisia; 59 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 41 %:lla ECOG-toimintakykyluokka oli 1, ja 84 %:lla potilaista kasvaimen status oli pMMR ja 16 %:lla dMMR. Histologisia alatyyppejä olivat endometrioidi karsinooma (60 %), seroosinen (26 %), kirkassolukarsinooma (6 %), sekamuotoinen (5 %) ja muu (3 %). Näillä kaikilla 827 potilaalla endometriumkarsinooman hoitoon oli aiemmin annettu systeemistä hoitoa: 69 % potilaista oli saanut aiemmin yhtä, 28 % kahta ja 3 % vähintään kolmea systeemistä hoitoa. 37 % potilaista oli saanut aiemmin ainoastaan neoadjuvantti- tai adjuvanttihoitoa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS) (jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä). Toissijaisiin tehoa mittaaviin lopputulosmuuttujiin kuului objektiivisten vasteiden osuus (ORR), jonka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Etukäteen määritelty välianalyysi tehtiin, kun seuranta-ajan mediaani oli 11,4 kuukautta (vaihteluväli 0,3–26,9 kuukautta). Tällöin tutkimuksessa osoitettiin, että kokonaiselinaika ja elinaika ilman taudin etenemistä olivat tilastollisesti merkitsevästi pidentyneet. Etukäteen määritelty lopullinen kokonaiselinajan analyysi, kun seuranta oli kestänyt noin 16 kuukautta pidempään kuin välianalyysin kohdalla (seuranta-ajan mediaani yhteensä 14,7 kuukautta [vaihteluväli 0,3–43,0 kuukautta]), tehtiin ilman korjausta kerrannaisuuden suhteen. Tehoa koskevat tulokset MMR-alaryhmien mukaan olivat yhdenmukaiset tutkimuksen kokonaistulosten kanssa. Taulukossa 48 on esitetty yhteenveto välianalyysin tuloksista, jotka koskevat elinaikaa ilman taudin etenemistä, objektiivisten vasteiden osuutta ja vasteen kestoa, sekä kokonaiselinaikaa koskevista lopullisen analyysin tuloksista. Kaplan–Meier-kuvaajat kokonaiselinaikaa koskeneelle lopulliselle analyysille ja välianalyysille, joka koski elinaikaa ilman taudin etenemistä, on esitetty kuvissa 48 ja 49.
Taulukko 48: Tehoa koskevat tulokset KEYNOTE‑775-tutkimuksessa
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein Lenvatinibi n = 411 | Solunsalpaajahoito*
n = 416 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 276 (67 %) | 329 (79 %) |
| Mediaani, kk (95 % CI) | 18,7 (15,6, 21,3) | 11,9 (10,7, 13,3) |
| Riskisuhde† (95 % CI) | 0,65 (0,55, 0,77) | |
| p‑arvoÞ | < 0,0001 | |
| PFSß | ||
| Potilaat (%), joilla todettiin tapahtuma | 281 (68 %) | 286 (69 %) |
| Mediaani, kk (95 % CI) | 7,2 (5,7, 7,6) | 3,8 (3,6, 4,2) |
| Riskisuhde† (95 % CI) | 0,56 (0,47, 0,66) | |
| p‑arvo‡ | < 0,0001 | |
| Objektiivisten vasteiden osuusß | ||
| ORR§ % (95 % CI) | 32 % (27, 37) | 15 % (11, 18) |
| Täydellinen vaste | 7 % | 3 % |
| Osittainen vaste | 25 % | 12 % |
| p‑arvo¶ | < 0,0001 | |
| Vasteen kestoß | ||
| Mediaani, kk# (vaihteluväli) | 14,4 (1,6+, 23,7) | 5,7 (0,0+, 24,2+) |
| *Doksorubisiini tai paklitakseli † Perustuu ositettuun Coxin regressiomalliin Þ Lopullisen analyysin yksitahoinen nimellinen p‑arvo ositetun log rank ‑testin perusteella. Etukäteen määritellyssä kokonaiselinajan välianalyysissä, kun seuranta-ajan mediaani oli 11,4 kuukautta (vaihteluväli 0,3–26,9 kuukautta), saavutettiin tilastollisesti merkitsevästi pidempi kokonaiselinaika, kun verrattiin pembrolitsumabin ja lenvatinibin yhdistelmää solunsalpaajahoitoon (riskisuhde 0,62 [95 %:n luottamusväli 0,51, 0,75], p‑arvo < 0,0001). ß Etukäteen määritellyn välianalyysin kohdalla ‡ Yksitahoinen p-arvo ositetun log rank ‑testin perusteella § Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena ¶ Perustuu Miettisen ja Nurmisen menetelmään, ositus MMR-statuksen, ECOG-toimintakykyluokan, maantieteellisen alueen ja aiemman lantion alueen sädehoidon mukaan # Perustuu Kaplan-Meier-arvioon | ||
Kuva 48: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE‑775-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
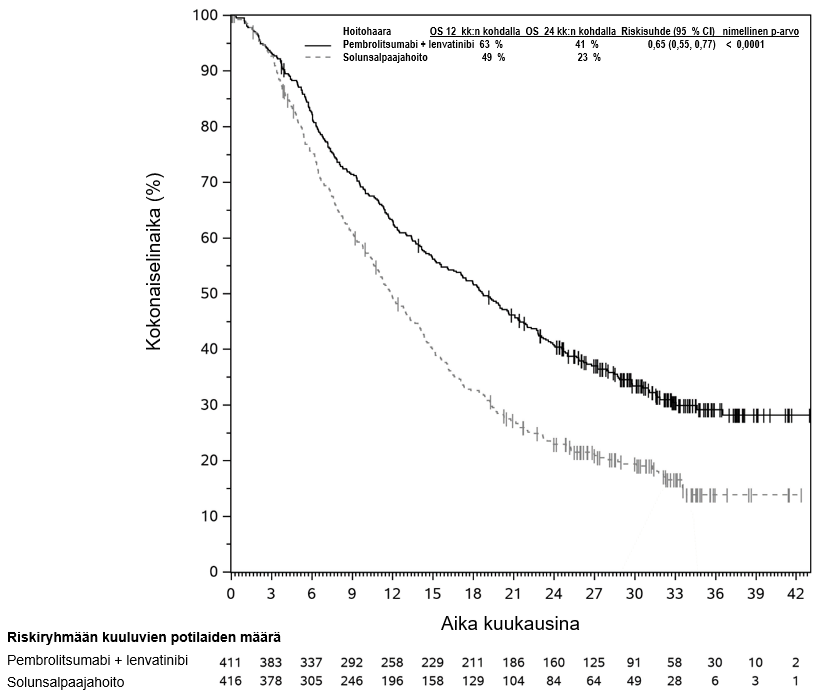
Kuva 49: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑775-tutkimuksessa (hoitoaikeen mukainen potilasjoukko) hoitohaaroittain
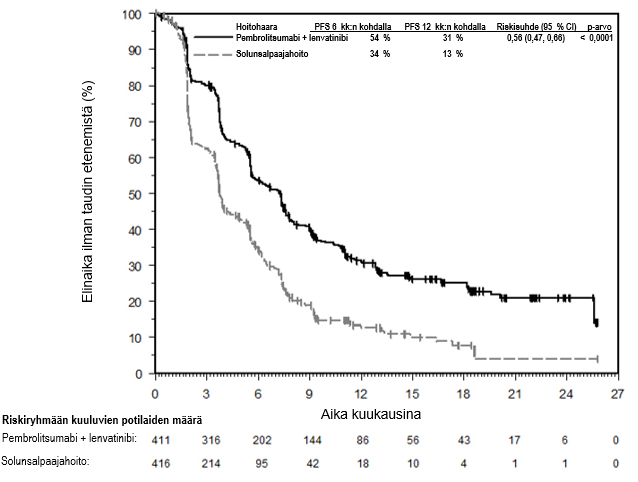
Kohdunkaulan syöpä
KEYNOTE‑A18: Kemosädehoidon kanssa toteutettavaa yhdistelmähoitoa koskeva kontrolloitu tutkimus paikallisesti edennyttä kohdunkaulan syöpää sairastavilla potilailla
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa KEYNOTE‑A18 arvioitiin pembrolitsumabin tehoa yhdistelmänä sisplatiinin ja ulkoisen sädehoidon ja sen jälkeen brakyterapian kanssa. Tutkimukseen otettiin 1 060 potilasta, joilla oli paikallisesti edennyt kohdunkaulan syöpä ja jotka eivät olleet aiemmin saaneet kohdunkaulan syövän hoitoon mitään definitiivistä leikkaushoitoa, sädehoitoa tai systeemistä hoitoa. Tutkimuksessa oli mukana 601 potilasta, joiden tauti oli joko imusolmukepositiivinen tai imusolmukenegatiivinen ja FIGO-luokituksen (International Federation of Gynaecology and Obstetrics, 2014) mukaan levinneisyysastetta III–IVA (emättimen alaosassa kasvain, joka saattaa ulottua lantion sivuseinämään, tai hydronefroosi / toimimaton munuainen tai kasvain on levinnyt viereisiin lantion elimiin), sekä 459 potilasta, joiden tauti oli imusolmukepositiivinen ja FIGO-luokituksen (2014) mukaan levinneisyysastetta IB2–IIB (kasvainleesiot > 4 cm tai kliinisesti nähtävissä olevia leesioita, jotka ovat levinneet kohdun ulkopuolelle mutta eivät ulotu lantion seinämään tai emättimen alakolmannekseen). Potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa 2 vuoden sisällä ennen hoitoa, tai immunosuppressiota edellyttävä sairaus, eivät soveltuneet tutkimukseen. Satunnaistaminen stratifioitiin ulkoisen sädehoidon suunnitellun tyypin (intensiteettimuokattu sädehoito tai intensiteettimuokattu kaarihoito vs. ei intensiteettimuokattua sädehoitoa eikä intensiteettimuokattua kaarihoitoa), kohdunkaulan syövän seulontavaiheessa todetun levinneisyysasteen (FIGO 2014, levinneisyysaste IB2–IIB vs. levinneisyysaste III–IVA) ja suunnitellun kokonaissädehoitoannoksen (ulkoisen sädehoidon ja brakyterapian annosten summa < 70 Gy vs. ≥ 70 Gy EQD2-ekvivalenttiannoksena) mukaan. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- pembrolitsumabia 200 mg laskimoon kolmen viikon välein (5 hoitosykliä) ja samanaikaisesti sen kanssa sisplatiinia 40 mg/m2 laskimoon kerran viikossa (5 hoitosykliä, paikallisen käytännön mukaisesti voitiin antaa valinnainen kuudes infuusio) ja sädehoito (ulkoinen sädehoito ja sen jälkeen brakyterapia) ja sen jälkeen pembrolitsumabia 400 mg laskimoon kuuden viikon välein (15 hoitosykliä)
- lumelääkettä laskimoon kolmen viikon välein (5 hoitosykliä) ja samanaikaisesti sen kanssa sisplatiinia 40 mg/m2 laskimoon kerran viikossa (5 hoitosykliä, paikallisen käytännön mukaisesti voitiin antaa valinnainen kuudes infuusio) ja sädehoito (ulkoinen sädehoito ja sen jälkeen brakyterapia) ja sen jälkeen lumelääkettä laskimoon kuuden viikon välein (15 hoitosykliä).
Hoitoa jatkettiin, kunnes tutkijalääkäri määritti RECIST 1.1 ‑kriteerien mukaan taudin edenneen tai ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä. Kasvaimen tila arvioitiin 12 viikon välein kahden ensimmäisen vuoden ajan, 24 viikon välein vuonna 3 ja sen jälkeen kerran vuodessa.
KEYNOTE‑A18-tutkimukseen otettujen, FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA tautia sairastavien 601 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 51 vuotta (vaihteluväli 22–87), 16 % oli vähintään 65‑vuotiaita; 36 % oli valkoihoisia, 1 % mustaihoisia, 34 % aasialaisia ja 38 % taustaltaan espanjankielisiä tai latinalaisamerikkalaisia; 68 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 32 %:lla ECOG-toimintakykyluokka oli 1. 93 %:lla potilaista CPS-pistemäärä oli ≥ 1; 71 %:lla tauti oli imusolmukepositiivinen lantion imusolmukkeiden ja/tai para-aortaalisten imusolmukkeiden suhteen, 29 %:lla tauti oli imusolmukenegatiivinen sekä lantion että para-aortaalisten imusolmukkeiden suhteen, 86 % oli saanut ulkoisena sädehoitona intensiteettimuokattua sädehoitoa tai intensiteettimuokattua kaarihoitoa, ja 90 %:lla kokonaissädehoitoannos oli ollut ≥ 70 Gy (EQD2). 84 %:lla kasvain oli histologisesti levyepiteelikarsinooma ja 16 %:lla ei-levyepiteeliperäinen.
Tehoa mittaavat ensisijaiset lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS) (jonka arvioi tutkijalääkäri käyttämällä RECIST v1.1 ‑kriteerejä tai joka varmistettiin histopatologisesti) ja kokonaiselinaika. Tutkimuksessa todettiin tilastollisesti merkitsevä pidentyminen elinajassa ilman taudin etenemistä [0,70 (95 %:n luottamusväli 0,55, 0,89; p‑arvo 0,0020)] ensimmäisen etukäteen määritellyn välianalyysin kohdalla ja kokonaiselinajassa [0,67 (95 %:n luottamusväli 0,50, 0,90; p‑arvo 0,0040)] toisen etukäteen määritellyn välianalyysin kohdalla kokonaispopulaatiossa potilailla, jotka oli satunnaistettu saamaan pembrolitsumabia kemosädehoidon kanssa, verrattuna lumelääkettä kemosädehoidon kanssa saaneisiin potilaisiin. Taulukossa 49 on esitetty yhteenveto keskeisistä tehon mittareista FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA tautia sairastavilla potilailla toisen etukäteen määritellyn välianalyysin kohdalla, kun seuranta-ajan mediaani oli 26,6 kuukautta (vaihteluväli 0,9–41,7 kuukautta). Kuvissa 50 ja 51 on esitetty tähän analyysiin perustuvat Kaplan–Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä potilailla, joilla oli FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA tauti.
Taulukko 49: KEYNOTE‑A18-tutkimuksen tehoa koskevat tulokset FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA kohdunkaulan syöpää sairastavilla potilailla
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein ja 400 mg 6 viikon välein ja kemosädehoito n = 296 | Lumelääke ja kemosädehoito n = 305 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 43 (15 %) | 73 (24 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (ei saavutettu, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,57 (0,39, 0,83) | |
| PFS tutkijalääkärin arvioimana | ||
| Potilaat (%), joilla todettiin tapahtuma | 79 (27 %) | 125 (41 %) |
| Mediaani, kk (95 % CI) | Ei saavutettu (ei saavutettu, ei saavutettu) | Ei saavutettu (26,3, ei saavutettu) |
| Riskisuhde* (95 % CI) | 0,57 (0,43, 0,76) | |
*Osittamattoman Coxin verrannollisten riskitiheyksien mallin mukaan
Kuva 50: Kaplan–Meier-kuvaaja kokonaiselinajalle KEYNOTE‑A18-tutkimuksessa hoitohaaroittain FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA kohdunkaulan syöpää sairastavilla potilailla

Kuva 51: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä KEYNOTE‑A18-tutkimuksessa hoitohaaroittain FIGO-luokituksen (2014) mukaan levinneisyysasteen III–IVA kohdunkaulan syöpää sairastavilla potilailla
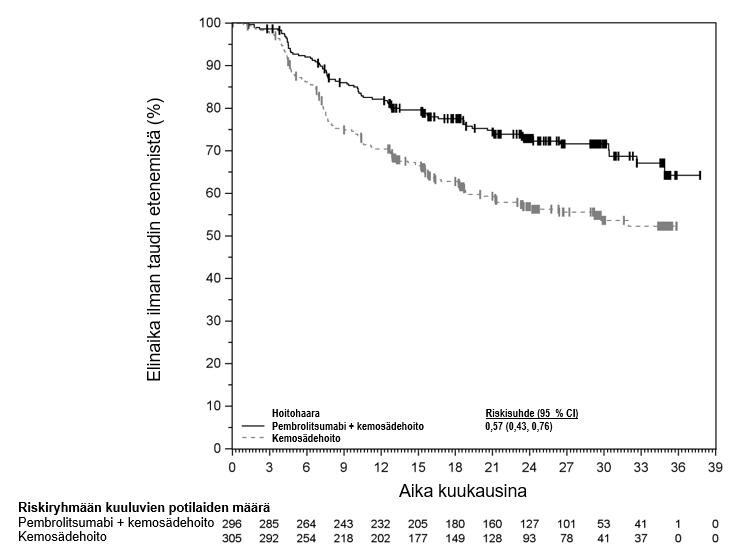
KEYNOTE‑826: Kontrolloitu tutkimus yhdistelmähoidon käytöstä persistoivaa, uusiutunutta tai metastasoitunutta kohdunkaulan syöpää sairastavilla potilailla
Pembrolitsumabihoidon tehoa yhdistettynä paklitakseliin ja sisplatiiniin tai paklitakseliin ja karboplatiiniin (bevasitsumabin kanssa tai ilman bevasitsumabia) selvitettiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑826-monikeskustutkimuksessa, johon otetuilla 617 potilaalla oli persistoiva, uusiutunut tai ensilinjan hoitoon soveltuva metastasoitunut kohdunkaulan syöpä eikä syöpää ollut aiemmin hoidettu solunsalpaajilla muutoin kuin tilanteissa, joissa solunsalpaajahoitoa käytettiin samanaikaisesti sädeherkisteenä. Potilaat otettiin tutkimukseen riippumatta kasvaimen PD‑L1:n ilmentymisstatuksesta. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin alkuperäisen diagnoosiajankohdan metastasointistatuksen, tutkijan tekemän bevasitsumabin käyttöä koskevan päätöksen ja PD‑L1-statuksen mukaan (CPS-pistemäärä < 1 vs. CPS-pistemäärä 1 – < 10 vs. CPS-pistemäärä ≥ 10). Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- hoitohaara 1: pembrolitsumabia 200 mg ja solunsalpaajahoitoa bevasitsumabin kanssa tai ilman bevasitsumabia
- hoitohaara 2: lumelääkettä ja solunsalpaajahoitoa bevasitsumabin kanssa tai ilman bevasitsumabia
Tutkija valitsi jonkin seuraavista neljästä hoidosta ennen satunnaistamista:
- paklitakseli 175 mg/m2 + sisplatiini 50 mg/m2
- paklitakseli 175 mg/m2 + sisplatiini 50 mg/m2 + bevasitsumabi 15 mg/kg
- paklitakseli 175 mg/m2 + karboplatiini AUC 5 mg/ml/min
- paklitakseli 175 mg/m2 + karboplatiini AUC 5 mg/ml/min + bevasitsumabi 15 mg/kg
Kaikki tutkimuslääkitykset annettiin infuusiona laskimoon. Kaikki tutkimushoidot annettiin kunkin 3 viikon pituisen hoitosyklin päivänä 1. Sisplatiini voitiin antaa kunkin 3 viikon pituisen hoitosyklin päivänä 2. Tutkijalääkäri päätti ennen satunnaistamista, käytettäisiinkö bevasitsumabia. Pembrolitsumabihoitoa jatkettiin, kunnes taudin todettiin RECIST 1.1 ‑kriteerien mukaan edenneen, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Pembrolitsumabihoitoa voitiin jatkaa RECIST-kriteerien mukaisen taudin etenemisenkin jälkeen, jos potilaan kliininen tila oli vakaa ja tutkijalääkäri katsoi, että hoidosta oli kliinistä hyötyä. Kasvaimen tila arvioitiin viikolla 9, sen jälkeen 9 viikon välein ensimmäisen vuoden ajan ja tämän jälkeen 12 viikon välein.
Tutkimukseen osallistuneista 617 potilaasta 548:lla (89 %:lla) oli kasvaimia, joissa PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 PD-L1 IHC 22C3 pharmDxTM -testin mukaan. Näistä 548:sta tutkimukseen otetusta potilaasta, joiden kasvaimet ilmensivät PD‑L1-ligandia, 273 potilasta satunnaistettiin saamaan pembrolitsumabia yhdistelmänä solunsalpaajahoidon kanssa ja joko bevasitsumabin kanssa tai ilman bevasitsumabia ja 275 potilasta satunnaistettiin saamaan lumelääkettä yhdistelmänä solunsalpaajahoidon kanssa ja joko bevasitsumabin kanssa tai ilman bevasitsumabia. Näiden 548 potilaan tiedot lähtötilanteessa olivat: mediaani-ikä 51 vuotta (vaihteluväli 22–82), 16 % oli täyttänyt 65 vuotta; 59 % oli valkoihoisia, 18 % aasialaisia ja 1 % mustaihoisia; 37 % oli taustaltaan espanjankielisiä tai latinalaisamerikkalaisia; 56 %:lla potilaista ECOG-toimintakykyluokka oli 0 ja 43 %:lla ECOG-toimintakykyluokka oli 1; 63 % sai tutkimushoitona bevasitsumabia; 21 %:lla kasvain oli histologisesti adenokarsinooma ja 5 %:lla adenoskvamoosi karsinooma; jos kyseessä oli persistoiva tai uusiutunut tauti (riippumatta siitä, liittyikö siihen systeemisiä etäpesäkkeitä vai ei), 39 % oli saanut aiemmin vain kemosädehoitoa ja 17 % oli saanut aiemmin kemosädehoitoa ja leikkaushoitoa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat kokonaiselinaika (OS) ja elinaika ilman taudin etenemistä (PFS), jotka tutkija arvioi RECIST 1.1 -kriteerien perusteella. Toissijaiset lopputulosmuuttujat olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto, jotka tutkija arvioi RECIST 1.1 -kriteerien perusteella. Etukäteen määritellyn välianalyysin kohdalla tutkimus osoitti, että kokonaiselinajat (OS, riskisuhde 0,64; 95 %:n luottamusväli 0,50, 0,81; p‑arvo = 0,0001) ja elinajat ilman taudin etenemistä (PFS, riskisuhde 0,62; 95 %:n luottamusväli 0,50, 0,77; p‑arvo < 0,0001) olivat tilastollisesti merkitsevästi parantuneet potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 ja jotka satunnaistettiin saamaan pembrolitsumabia yhdistelmänä solunsalpaajahoidon ja mahdollisen bevasitsumabihoidon kanssa, verrattuna potilaisiin, jotka saivat lumelääkettä yhdistelmänä solunsalpaajahoidon ja mahdollisen bevasitsumabihoidon kanssa. Tutkimuksessa osoitettiin myös kokonaiselinajan ja elinajan ilman taudin etenemistä pidentyneen tilastollisesti merkitsevästi koko tutkimuspopulaatiossa. Taulukossa 50 on tiivistelmä keskeisistä tehon mittareista KEYNOTE‑826-tutkimuksen lopullisessa analyysissa, jossa seurannan keston mediaani oli 21,3 kuukautta, potilailla, joiden kasvaimet ilmensivät PD‑L1-ligandia ja joilla CPS-pistemäärä oli ≥ 1. Lopulliseen analyysiin perustuvat Kaplan–Meier‑kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä on esitetty kuvissa 52 ja 53.
Taulukko 50: KEYNOTE‑826-tutkimuksen tehoa koskevat tulokset potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
| Päätetapahtuma | Pembrolitsumabi200 mg 3 viikon välein+ solunsalpaajahoito* ja mahdollinen bevasitsumabihoito n = 273 | Lumelääke+ solunsalpaajahoito* ja mahdollinen bevasitsumabihoito
| |
| OS | |||
| Potilaat (%), joilla todettiin tapahtuma | 153 (56 %) | 201 (73 %) | |
| Mediaani, kk (95 % CI) | 28,6 (22,1, 38,0) | 16,5 (14,5, 20,0) | |
| Riskisuhde† (95 % CI) | 0,60 (0,49, 0,74) | ||
| p-arvo‡ | < 0,0001 | ||
| PFS | |||
| Potilaat (%), joilla todettiin tapahtuma | 171 (63 %) | 220 (80 %) | |
| Mediaani, kk (95 % CI) | 10,5 (9,7, 12,3) | 8,2 (6,3, 8,5) | |
| Riskisuhde† (95 % CI) | 0,58 (0,47, 0,71) | ||
| p-arvo‡ | < 0,0001 | ||
| Objektiivisten vasteiden osuus | |||
| ORR¶ % (95 % CI) | 69 % (63, 74) | 51 % (45, 57) | |
| Täydellinen vaste | 26 % | 15 % | |
| Osittainen vaste | 43 % | 36 % | |
| Vasteen kesto | |||
| Mediaani, kk (vaihteluväli) | 19,2 (1,3+, 40,9+) | 10,4 (1,5+, 40,7+) | |
| Kesto ≥ 12 kk#, % | 56 | 45 | |
| Kesto ≥ 24 kk#, % | 48 | 30 | |
| * Solunsalpaajahoito (paklitakseli ja sisplatiini tai paklitakseli ja karboplatiini) † Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan ‡ Nimellinen p-arvo ositetun log rank ‑testin perusteella ¶ Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena # Perustuu Kaplan–Meier‑arvioon | |||
Kuva 52: Kaplan-Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑826-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
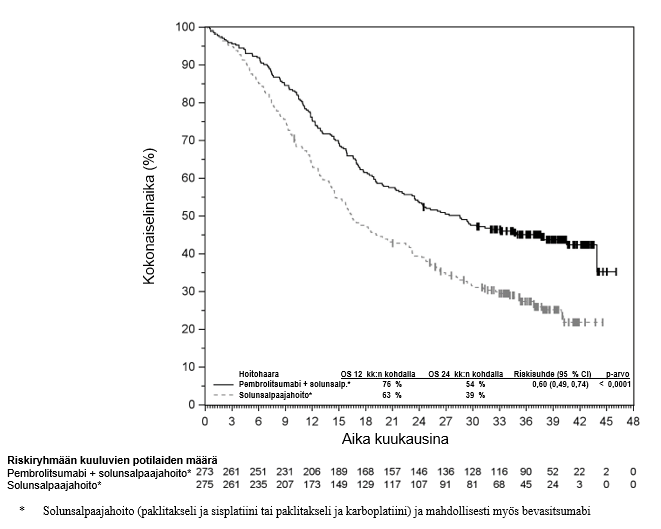
Kuva 53: Kaplan-Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE‑826-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
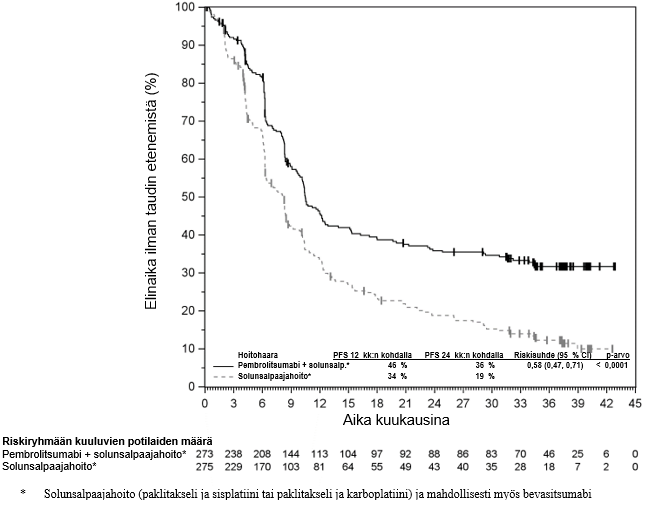
Mahalaukun tai ruokatorvi-mahalaukkurajan adenokarsinooma
KEYNOTE‑811: Kontrolloitu tutkimus yhdistelmähoidon käytöstä paikallisesti edennyttä ja leikkaukseen soveltumatonta tai metastasoitunutta mahalaukun tai ruokatorvi-mahalaukkurajan HER2-positiivista adenokarsinoomaa sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Pembrolitsumabin tehoa yhdistettynä trastutsumabiin ja fluoropyrimidiinin ja platinapohjaisen solunsalpaajahoidon yhdistelmään arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE‑811-monikeskustutkimuksessa, johon otetuilla 698 potilaalla oli HER2-positiivinen edennyt mahalaukun tai ruokatorvi-mahalaukkurajan adenokarsinooma. Potilaat otettiin tutkimukseen riippumatta kasvaimen PD‑L1:n ilmentymisstatuksesta, eivätkä he olleet aiemmin saaneet systeemistä hoitoa metastasoituneeseen tautiin. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus.
Satunnaistaminen stratifioitiin PD‑L1:n ilmentymisen (CPS-pistemäärä ≥ 1 tai < 1), solunsalpaajahoidon (5‑fluorourasiilin ja sisplatiinin yhdistelmä [FP] tai kapesitabiinin ja oksaliplatiinin yhdistelmä [CAPOX]) ja maantieteellisen alueen (Eurooppa/Israel/Pohjois-Amerikka/Australia, Aasia tai muu maailma) perusteella. Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista; kaikki tutkimuslääkitykset suun kautta annettavaa kapesitabiinia lukuun ottamatta annettiin infuusiona laskimoon kerran kunkin 3 viikon pituisen hoitosyklin aikana:
- pembrolitsumabia 200 mg, trastutsumabia 8 mg/kg ensimmäisellä infuusiokerralla ja 6 mg/kg seuraavien hoitosyklien aikana, sen jälkeen tutkijalääkärin valinnan mukaan yhdistelmäsolunsalpaajahoitoa: sisplatiinia 80 mg/m2 enintään kuuden hoitosyklin ajan ja 5‑fluorourasiilia 800 mg/m2 vuorokaudessa 5 päivän ajan (FP) tai oksaliplatiinia 130 mg/m2 enintään 6–8 hoitosyklin ajan ja kapesitabiinia 1 000 mg/m2 kaksi kertaa vuorokaudessa 14 päivän ajan (CAPOX). Pembrolitsumabi annettiin ennen trastutsumabia ja solunsalpaajahoitoa kunkin hoitosyklin päivänä 1.
- lumelääkettä, trastutsumabia 8 mg/kg ensimmäisellä infuusiokerralla ja 6 mg/kg seuraavien hoitosyklien aikana, sen jälkeen tutkijalääkärin valinnan mukaan yhdistelmäsolunsalpaajahoitoa: sisplatiinia 80 mg/m2 enintään kuuden hoitosyklin ajan ja 5‑fluorourasiilia 800 mg/m2 vuorokaudessa 5 päivän ajan (FP) tai oksaliplatiinia 130 mg/m2 enintään 6–8 hoitosyklin ajan ja kapesitabiinia 1 000 mg/m2 kaksi kertaa vuorokaudessa 14 päivän ajan (CAPOX). Lumelääke annettiin ennen trastutsumabia ja solunsalpaajahoitoa kunkin hoitosyklin päivänä 1.
Hoitoa pembrolitsumabilla, trastutsumabilla ja solunsalpaajilla tai lumelääkkeellä, trastutsumabilla ja solunsalpaajilla jatkettiin BICR:n määrittämään RECIST v1.1 ‑kriteerien mukaiseen taudin etenemiseen asti, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Kasvaimen tila arvioitiin 6 viikon välein.
KEYNOTE‑811-tutkimuksessa satunnaistetuista 698 potilaasta 594:llä (85 %:lla) oli kasvaimia, joissa PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 PD‑L1 IHC 22C3 pharmDxTM-testin mukaan. Niiden 594 potilaan, joilla kasvaimen PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, tiedot lähtötilanteessa olivat: mediaani-ikä 63 vuotta (vaihteluväli: 19–85); 43 % vähintään 65‑vuotiaita; 80 % miehiä; 63 % valkoihoisia, 33 % aasialaisia ja 0,7 % mustaihoisia; 42 %:lla ECOG-toimintakykyluokka oli 0 ja 58 %:lla 1. 98 %:lla potilaista oli metastasoitunut tauti (levinneisyysaste IV), ja 2 %:lla oli paikallisesti edennyt ja leikkaukseen soveltumaton tauti. 95 %:lla (n = 562) oli kasvaimia, joihin ei liittynyt mikrosatelliitti-instabiliteettia, 1 %:lla (n = 8) oli kasvaimia, joihin liittyi mikrosatelliitti-instabiliteetti, ja 4 %:lla (n = 24) status oli tuntematon. 85 % potilaista sai CAPOX-hoitoa.
Ensisijaiset tehoa mittaavat lopputulosmuuttujat olivat elinaika ilman taudin etenemistä (PFS), jonka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä, ja kokonaiselinaika (OS). Toissijaisia tehoa mittaavia lopputulosmuuttujia olivat objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DoR), jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Tutkimus osoitti toisessa välianalyysissä, että koko tutkimuspopulaation elinajat ilman taudin etenemistä (PFS) olivat tilastollisesti merkitsevästi parantuneet (riskisuhde 0,72; 95 %:n luottamusväli 0,60, 0,87; p‑arvo 0,0002) potilailla, jotka oli satunnaistettu hoitohaaraan, jossa annettiin pembrolitsumabia yhdistelmänä trastutsumabin ja solunsalpaajahoidon kanssa, verrattuna potilaisiin, jotka olivat saaneet lumelääkettä yhdistelmänä trastutsumabin ja solunsalpaajahoidon kanssa. Tässä välianalyysissä ei todettu tilastollisesti merkitseviä eroja kokonaiselinajoissa. Seuranta-ajan mediaani oli 15,4 kuukautta (vaihteluväli 0,3–41,6 kuukautta). Ensimmäisessä välianalyysissä, jossa olivat mukana koko tutkimuspopulaatiossa satunnaistetut ensimmäiset 264 potilasta (133 potilasta pembrolitsumabihaarassa ja 131 lumehaarassa), havaittiin objektiivisten vasteiden osuuksien tilastollisesti merkitsevä paraneminen (74,4 % vs. 51,9 %, mikä tarkoittaa 22,7 %:n eroa objektiivisten vasteiden osuuksissa [95 %:n luottamusväli 11,2, 33,7]; p‑arvo 0,00006).
Taulukossa 51 on tiivistelmä toisen välianalyysin keskeisistä tehoa koskevista tuloksista etukäteen määrätylle alaryhmälle, jossa potilaiden kasvainten PD‑L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, ja kuvissa 54 ja 55 on esitetty Kaplan–Meier-kuvaajat elinajasta ilman taudin etenemistä ja kokonaiselinajasta.
Taulukko 51: KEYNOTE‑811-tutkimuksen tehoa koskevat tulokset potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
| Päätetapahtuma | Pembrolitsumabi, trastutsumabi ja solunsalpaajahoito n = 298 | Lumelääke, trastutsumabi ja solunsalpaajahoito n = 296 | |
| PFS | |||
| Potilaat (%), joilla todettiin tapahtuma | 199 (67 %) | 215 (73 %) | |
| Mediaani, kk (95 % CI) | 10,8 (8,5, 12,5) | 7,2 (6,8, 8,4) | |
| Riskisuhde* (95 % CI) | 0,7 (0,58, 0,85) | ||
| p‑arvo† | 0,0001 | ||
| OS | |||
| Potilaat (%), joilla todettiin tapahtuma | 167 (56 %) | 183 (62 %) | |
| Mediaani, kk (95 % CI) | 20,5 (18,2, 24,3) | 15,6 (13,5, 18,6) | |
| Riskisuhde* (95 % CI) | 0,79 (0,64, 0,98) | ||
| p‑arvo† | 0,0143 | ||
| Objektiivisten vasteiden osuus | |||
| ORR‡ % (95 % CI) | 73 % (67,7, 78,1) | 58 % (52,6, 64,1) | |
| Täydellinen vaste | 14 % | 10 % | |
| Osittainen vaste | 59 % | 49 % | |
| p‑arvo# | 0,00008 | ||
| Vasteen kesto | |||
| Mediaani, kk (vaihteluväli) | 11,3 (1,1+, 40,1+) | 9,5 (1,4+, 38,3+) | |
| Kesto ≥ 6 kk¶, % | 75 % | 67 % | |
| Kesto ≥ 12 kk¶, % | 49 % | 41 % | |
* Osittamattoman Coxin verrannollisten riskitiheyksien mallin mukaan
† Nimellinen p‑arvo osittamattoman log rank ‑testin perusteella; muodollista testiä ei tehty potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 1).
‡ Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena
# Nimellinen p‑arvo perustuu osittamattomaan Miettisen ja Nurmisen menetelmään; muodollista testiä ei tehty potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 1).
¶ Perustuu Kaplan–Meier-arvioon
Kuva 54: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE‑811-tutkimuksessa potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
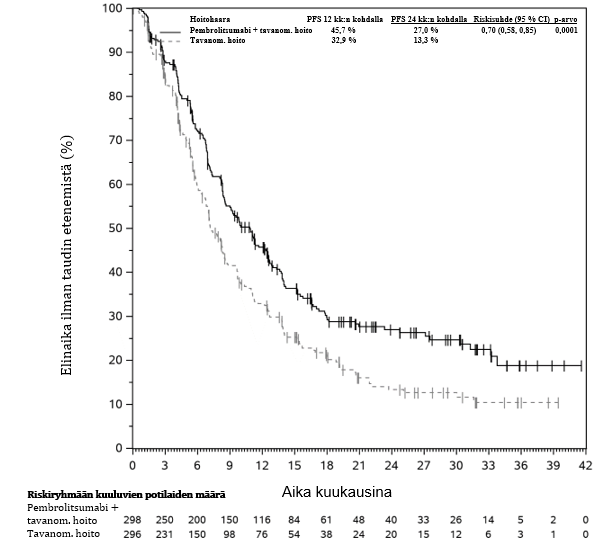
Kuva 55: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑811-tutkimuksessa potilailla, joilla oli todettu PD‑L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
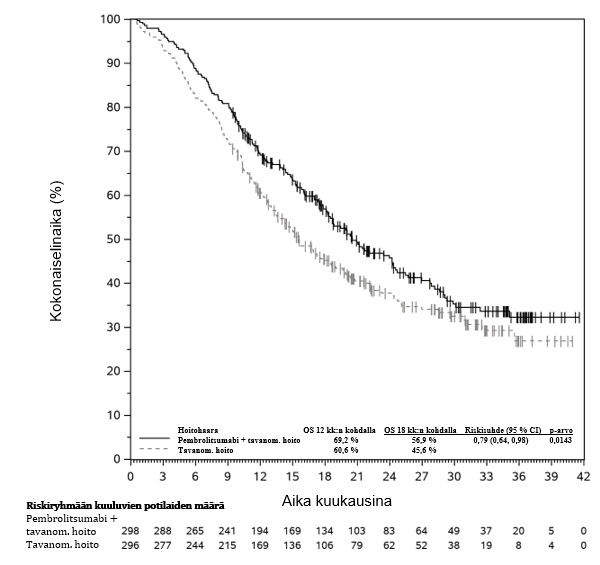
KEYNOTE-859: Kontrolloitu tutkimus yhdistelmähoidon käytöstä paikallisesti edennyttä ja leikkaukseen soveltumatonta tai metastasoitunutta mahalaukun tai ruokatorvi-mahalaukkurajan HER2-negatiivista adenokarsinoomaa sairastavilla potilailla, jotka eivät olleet aiemmin saaneet hoitoa
Pembrolitsumabin tehoa yhdistettynä fluoropyrimidiiniin ja platinasolunsalpaajahoitoon arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE-859-monikeskustutkimuksessa, johon otetuilla 1 579 potilaalla oli HER2-negatiivinen edennyt mahalaukun tai ruokatorvi-mahalaukkurajan adenokarsinooma. Potilaat otettiin tutkimukseen riippumatta kasvaimen PD-L1:n ilmentymisstatuksesta, eivätkä he olleet aiemmin saaneet systeemistä hoitoa metastasoituneeseen tautiin. Aiempi neoadjuvantti- ja/tai adjuvanttihoito sallittiin, jos se oli päättynyt vähintään 6 kuukautta ennen satunnaistamista. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, potilaat, joilla oli immunosuppressiota edellyttävä sairaus, sekä potilaat, joita oli hoidettu aiemmin tarkistuspisteen estäjillä.
Satunnaistaminen stratifioitiin PD-L1:n ilmentymisen (CPS-pistemäärä ≥ 1 tai < 1), solunsalpaajahoidon (5-fluorourasiilin ja sisplatiinin yhdistelmä [FP] tai kapesitabiinin ja oksaliplatiinin yhdistelmä [CAPOX]) ja maantieteellisen alueen (Eurooppa/Israel/Pohjois-Amerikka/Australia, Aasia tai muu maailma) perusteella.
Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista; kaikki tutkimuslääkitykset suun kautta annettavaa kapesitabiinia lukuun ottamatta annettiin infuusiona laskimoon kerran kunkin 3 viikon pituisen hoitosyklin aikana:
- pembrolitsumabia 200 mg ja tutkijalääkärin valinnan mukaan yhdistelmäsolunsalpaajahoitoa: sisplatiinia 80 mg/m2 ja 5-fluorourasiilia 800 mg/m2 vuorokaudessa 5 päivän ajan (FP) tai oksaliplatiinia 130 mg/m2 ja kapesitabiinia 1 000 mg/m2 kaksi kertaa vuorokaudessa 14 päivän ajan (CAPOX) enintään 35 hoitosyklin ajan. Sisplatiini- tai oksaliplatiinihoidon kesto voitiin rajoittaa enintään 6 hoitosykliin paikallisten maakohtaisten suositusten mukaisesti. Pembrolitsumabi annettiin ennen solunsalpaajahoitoa kunkin hoitosyklin päivänä 1.
- lumelääkettä ja tutkijalääkärin valinnan mukaan yhdistelmäsolunsalpaajahoitoa: sisplatiinia 80 mg/m2 ja 5-fluorourasiilia 800 mg/m2 vuorokaudessa 5 päivän ajan (FP) tai oksaliplatiinia 130 mg/m2 ja kapesitabiinia 1 000 mg/m2 kaksi kertaa vuorokaudessa 14 päivän ajan (CAPOX) enintään 35 hoitosyklin ajan. Sisplatiini- tai oksaliplatiinihoidon kesto voitiin rajoittaa enintään 6 hoitosykliin paikallisten maakohtaisten suositusten mukaisesti. Lumelääke annettiin ennen solunsalpaajahoitoa kunkin hoitosyklin päivänä 1.
Hoitoa pembrolitsumabilla ja solunsalpaajilla tai lumelääkkeellä ja solunsalpaajilla jatkettiin BICR:n määrittämään RECIST v1.1 -kriteerien mukaiseen taudin etenemiseen asti, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai enintään 24 kuukauden ajan. Kasvaimen tila arvioitiin 6 viikon välein.
KEYNOTE-859-tutkimuksessa 1 579 potilaasta 1 235:llä (78 %:lla) oli kasvaimia, joissa PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 PD-L1 IHC 22C3 pharmDxTM -testin mukaan. Niiden 1 235 potilaan, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, tiedot lähtötilanteessa olivat: mediaani-ikä 62 vuotta (vaihteluväli: 24–86); 40 % vähintään 65-vuotiaita; 70,4 % miehiä; 55,5 % valkoihoisia ja 33,1 % aasialaisia; 36,5 %:lla ECOG-toimintakykyluokka oli 0 ja 63,5 %:lla 1. 96 %:lla potilaista oli metastasoitunut tauti (levinneisyysaste IV), ja 4 %:lla oli paikallisesti edennyt ja leikkaukseen soveltumaton tauti. 5 %:lla (n = 66) oli kasvaimia, joihin liittyi mikrosatelliitti-instabiliteetti. 86 % potilaista sai CAPOX-hoitoa.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS). Muita toissijaisia tehoa mittaavia lopputulosmuuttujia olivat elinaika ilman taudin etenemistä (PFS), objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DOR), jotka arvioi BICR käyttämällä RECIST 1.1 -kriteerejä.
Tutkimuksessa osoitettiin, että pembrolitsumabin ja solunsalpaajahoidon yhdistelmää saamaan satunnaistettujen potilaiden kokonaiselinajat (riskisuhde 0,78; 95 %:n luottamusväli 0,70, 0,87; p-arvo < 0,0001), elinajat ilman taudin etenemistä (riskisuhde 0,76; 95 %:n luottamusväli 0,67, 0,85; p-arvo < 0,0001) ja objektiivisten vasteiden osuudet (51 % [95 %:n luottamusväli 47,7, 54,8] vs. 42 % [95 %:n luottamusväli 38,5, 45,5]; p-arvo 0,00009) olivat tilastollisesti merkitsevästi paremmat kuin lumelääkkeen ja solunsalpaajahoidon yhdistelmää saaneilla koko tutkimuspopulaatiossa. Seuranta-ajan mediaani oli 12 kuukautta (vaihteluväli: 0,1–45,9 kuukautta). Taulukossa 52 on tiivistelmä keskeisistä tehoa koskevista tuloksista etukäteen määrätylle alaryhmälle, jossa potilaiden kasvainten PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1, ja kuvissa 56 ja 57 on esitetty Kaplan–Meier-kuvaajat kokonaiselinajasta ja elinajasta ilman taudin etenemistä.
Taulukko 52: KEYNOTE-859-tutkimuksen tehoa koskevat tulokset potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
| Päätetapahtuma | Pembrolitsumabi, fluoropyrimidiini ja platinasolunsalpaajahoito n = 618 | Lumelääke, fluoropyrimidiini ja platinasolunsalpaajahoito n = 617 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 464 (75 %) | 526 (85 %) |
| Mediaani, kk* (95 % CI) | 13,0 (11,6, 14,2) | 11,4 (10,5, 12,0) |
| Riskisuhde† (95 % CI) | 0,74 (0,65, 0,84) | |
| p‑arvo‡ | < 0,0001 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 443 (72 %) | 483 (78 %) |
| Mediaani, kk* (95 % CI) | 6,9 (6,0, 7,2) | 5,6 (5,4, 5,7) |
| Riskisuhde† (95 % CI) | 0,72 (0,63, 0,82) | |
| p‑arvo‡ | < 0,0001 | |
| Objektiivisten vasteiden osuus | ||
| ORR§ (95 % CI) | 52 % (48,1, 56,1) | 43 % (38,7, 46,6) |
| Täydellinen vaste | 10 % | 6 % |
| Osittainen vaste | 42 % | 37 % |
| p‑arvo¶ | 0,00041 | |
| Vasteen kesto | ||
| Mediaani, kk* (vaihteluväli) | 8,3 (1,2+, 41,5+) | 5,6 (1,3+, 34,2+) |
| Kesto ≥ 12 kk*, % | 41 % | 26 % |
* Perustuu Kaplan–Meier-arvioon
† Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan
‡ Yksitahoinen p-arvo ositetun log rank ‑testin perusteella
§ Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena
¶ Yksitahoinen p-arvo perustuu ositettuun Miettisen ja Nurmisen menetelmään
Kuva 56: Kaplan–Meier-kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE-859-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
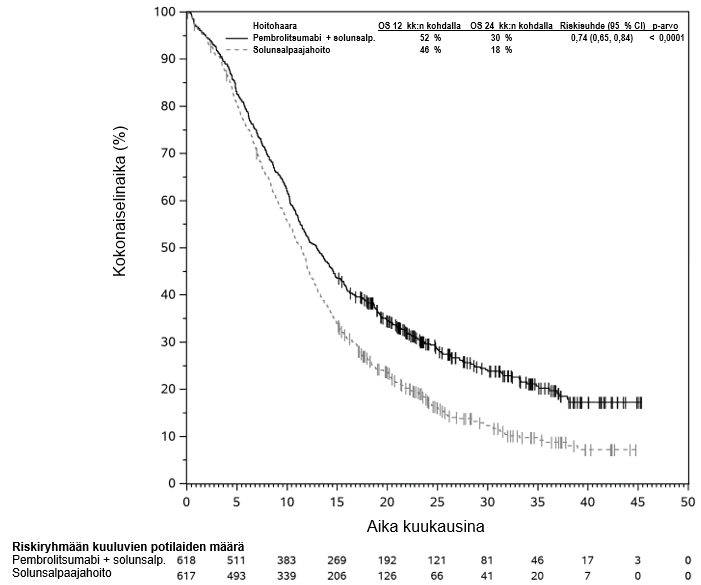
Kuva 57: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE-859-tutkimuksessa potilailla, joilla oli todettu PD-L1:n ilmentyminen (CPS-pistemäärä ≥ 1)
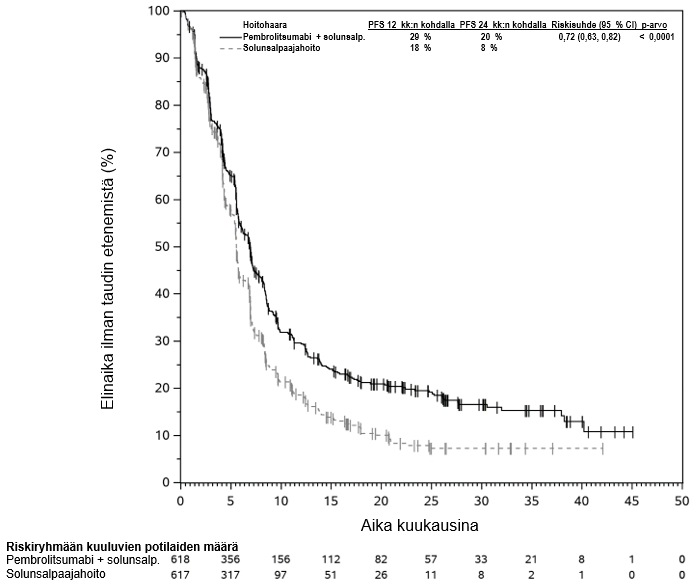
KEYNOTE-859-tutkimuksessa tehtiin analyysi potilailla, joilla kasvaimen PD-L1-ligandin ilmentymisen CPS-pistemäärä oli ≥ 1 – < 10 tai ≥ 10, molemmissa hoitohaaroissa (ks. taulukko 53).
Taulukko 53: KEYNOTE-859-tutkimuksen tehoa koskevat tulokset PD-L1:n ilmentymisen mukaan
| Päätetapahtuma | Pembrolitsumabi-yhdistelmähoito n = 337 | Solunsalpaajahoito n = 345 | Pembrolitsumabi-yhdistelmähoito n = 279 | Solunsalpaajahoito n = 272 |
| CPS ≥ 1 – < 10 | CPS ≥ 10 | |||
| OS:n riskisuhde (95 % CI) | 0,83 (0,70, 0,98)* | 0,65 (0,53, 0,79)† | ||
| PFS:n riskisuhde (95 % CI) | 0,83 (0,70, 0,99)* | 0,62 (0,51, 0,76)† | ||
| ORR§ (95 % CI) | 45 % (39,7, 50,6) | 42 % (37,0, 47,7) | 61 % (54,6, 66,3) | 43 % (37,1, 49,1) |
* Riskisuhde (pembrolitsumabiyhdistelmähoito solunsalpaajahoitoon verrattuna) osittamattoman Coxin verrannollisten riskitiheyksien mallin mukaan
† Riskisuhde (pembrolitsumabiyhdistelmähoito solunsalpaajahoitoon verrattuna) ositetun Coxin verrannollisten riskitiheyksien mallin mukaan
§ Vaste: paras objektiivinen hoitovaste vahvistettuna täydellisenä tai osittaisena vasteena
Sappitiesyöpä
KEYNOTE‑966: Kontrolloitu yhdistelmähoitotutkimus potilailla, joilla oli paikallisesti edennyt ja leikkaukseen soveltumaton tai metastasoitunut sappitiesyöpä
Pembrolitsumabin, gemsitabiinin ja sisplatiinin yhdistelmän tehoa tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa KEYNOTE-966-monikeskustutkimuksessa. Tutkimukseen otettiin 1 069 potilasta, joilla oli paikallisesti edennyt ja leikkaukseen soveltumaton tai metastasoitunut sappitiesyöpä ja jotka eivät olleet aiemmin saaneet systeemistä hoitoa edenneeseen tautiin. Potilaat otettiin tutkimukseen riippumatta kasvaimen PD‑L1:n ilmentymisestä. Potilaiden seerumin bilirubiinipitoisuuden oli oltava hyväksyttävä (≤ 1,5 kertaa ULN tai konjugoitunut bilirubiini ≤ ULN, jos kokonaisbilirubiinipitoisuus on > 1,5 kertaa ULN), ja jos potilaalla oli kliinisesti merkittävä sappitieobstruktio, sen oli korjaannuttava ennen satunnaistamista. Tutkimuksesta suljettiin pois potilaat, joilla oli autoimmuunisairaus, joka oli edellyttänyt systeemistä hoitoa kahden vuoden sisällä hoidosta, tai joilla oli immunosuppressiota edellyttävä sairaus. Satunnaistaminen stratifioitiin maantieteellisen alueen (Aasia vs. ei Aasia), tautitilanteen (paikallisesti edennyt vs. metastasoitunut) ja alkuperäisen kasvaimen sijainnin (sappirakko tai intrahepaattinen tai ekstrahepaattinen kolangiokarsinooma) mukaan.
Potilaat satunnaistettiin (1:1) jompaankumpaan seuraavista hoitohaaroista:
- 200 mg pembrolitsumabia päivänä 1 + 1 000 mg/m2 gemsitabiinia ja 25 mg/m2 sisplatiinia päivänä 1 ja päivänä 8 kolmen viikon välein
- lumelääkettä päivänä 1 + 1 000 mg/m2 gemsitabiinia ja 25 mg/m2 sisplatiinia päivänä 1 ja päivänä 8 kolmen viikon välein.
Kaikki tutkimuslääkitykset annettiin infuusiona laskimoon. Hoitoa jatkettiin, kunnes ilmaantui toksisia vaikutuksia, joita ei voitu hyväksyä, tai taudin etenemiseen asti. Pembrolitsumabihoitoa jatkettiin enintään 35 hoitosyklin ajan tai noin 24 kuukauden ajan. Sisplatiinihoitoa voitiin antaa enintään 8 hoitosykliä, mutta gemsitabiinihoitoa voitiin jatkaa pidempään kuin 8 hoitosykliä. Kasvaimen tila arvioitiin lähtötilanteessa, sen jälkeen 6 viikon välein viikolle 54 asti ja tämän jälkeen 12 viikon välein.
Tutkimuspopulaation tiedot lähtötilanteessa olivat: mediaani-ikä 64 vuotta (vaihteluväli: 23–85); 47 % oli vähintään 65-vuotiaita; 52 % miehiä; 49 % valkoihoisia, 46 % aasialaisia; 46 %:lla ECOG-toimintakykyluokka oli 0 ja 54 %:lla ECOG-toimintakykyluokka oli 1; 31 %:lla oli anamneesissa hepatiitti B ‑infektio ja 3 %:lla oli anamneesissa hepatiitti C ‑infektio.
Ensisijainen tehoa mittaava lopputulosmuuttuja oli kokonaiselinaika (OS). Toissijaisia tehoa mittaavia muuttujia olivat elinaika ilman taudin etenemistä (PFS), objektiivisten vasteiden osuus (ORR) ja vasteen kesto (DOR), jotka arvioi BICR käyttämällä RECIST 1.1 ‑kriteerejä. Tutkimuksen lopullinen analyysi osoitti, että OS piteni tilastollisesti merkitsevästi potilailla, jotka satunnaistettiin saamaan pembrolitsumabia yhdistelmänä solunsalpaajahoidon kanssa, verrattuna potilaisiin, jotka saivat lumelääkettä yhdistelmänä solunsalpaajahoidon kanssa. Taulukossa 54 on tiivistelmä keskeisistä tehon mittareista ja kuvissa 58 ja 59 on esitetty Kaplan–Meier-kuvaajat elinajasta ilman taudin etenemistä ja kokonaiselinajasta lopullisen analyysin perusteella, kun seuranta-ajan mediaani oli 11,6 kuukautta (vaihteluväli: 0,2–37,5 kuukautta).
Taulukko 54: KEYNOTE‑966-tutkimuksen tehoa koskevat tulokset
| Päätetapahtuma | Pembrolitsumabi 200 mg 3 viikon välein + gemsitabiini/sisplatiini n = 533 | Lumelääke + gemsitabiini/sisplatiini n = 536 |
| OS | ||
| Potilaat (%), joilla todettiin tapahtuma | 414 (78 %) | 443 (83 %) |
| Mediaani, kk (95 % CI) | 12,7 (11,5, 13,6) | 10,9 (9,9, 11,6) |
| Riskisuhde* (95 % CI) | 0,83 (0,72, 0,95) | |
| p-arvo† | 0,0034 | |
| PFS | ||
| Potilaat (%), joilla todettiin tapahtuma | 428 (80 %) | 448 (84 %) |
| Mediaani, kk (95 % CI) | 6,5 (5,7, 6,9) | 5,6 (4,9, 6,5) |
| Riskisuhde* (95 % CI) | 0,87 (0,76, 0,99) | |
| p-arvo‡ | 0,0171 | |
| Objektiivisten vasteiden osuus | ||
| ORR % (95 % CI) | 29,3 % (25,4, 33,3) | 28,4 % (24,6, 32,4) |
| Täydellinen vaste | 2,6 % | 1,7 % |
| Osittainen vaste | 26,6 % | 26,7 % |
| p-arvoα | 0,3610 | |
| Vasteen kesto§, ¶ | ||
| Mediaani, kk (vaihteluväli) | 8,3 (1,2+, 33,0+) | 6,8 (1,1+, 30,0+) |
| Kesto ≥ 6 kk¶, % | 65 % | 55 % |
| Kesto ≥ 12 kk¶, % | 38 % | 27 % |
* Ositetun Coxin verrannollisten riskitiheyksien mallin mukaan
† Yksitahoinen p-arvo ositetun log rank ‑testin perusteella. Kokonaiselinajan tuloksessa saavutettiin ennalta määritelty yksitahoinen merkitsevyystaso 0,0200.
‡ Yksitahoinen p-arvo ositetun log rank ‑testin perusteella. PFS-tuloksessa ei saavutettu ennalta määriteltyä yksitahoista merkitsevyystasoa 0,0125.
α Yksitahoinen p-arvo perustuu ositettuun Miettisen ja Nurmisen menetelmään. ORR-tuloksessa ei saavutettu ennalta määriteltyä yksitahoista merkitsevyystasoa 0,0125.
§ Perustuu potilaisiin, joilla saavutettiin objektiivinen vaste (vahvistettu täydellinen vaste tai osittainen vaste).
¶ Perustuu Kaplan–Meierin estimaattiin.
Kuva 58: Kaplan–Meier‑kuvaaja kokonaiselinajalle hoitohaaroittain KEYNOTE‑966-tutkimuksessa
(hoitoaikeen mukainen potilasjoukko)
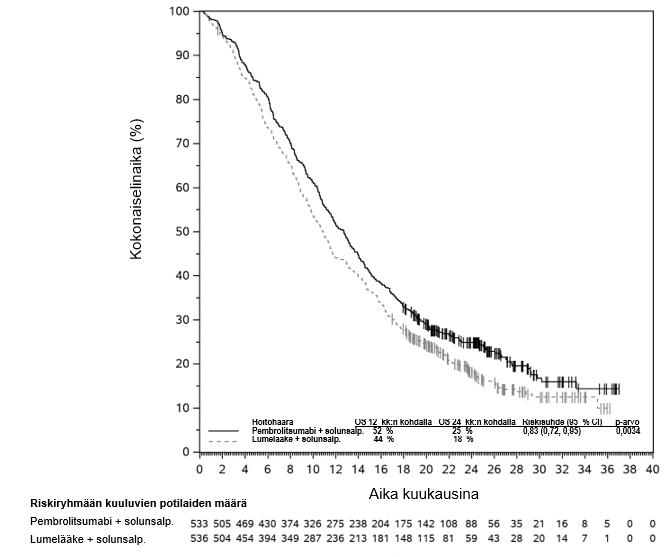
Kuva 59: Kaplan–Meier-kuvaaja elinajalle ilman taudin etenemistä hoitohaaroittain KEYNOTE-966-tutkimuksessa
(hoitoaikeen mukainen potilasjoukko)
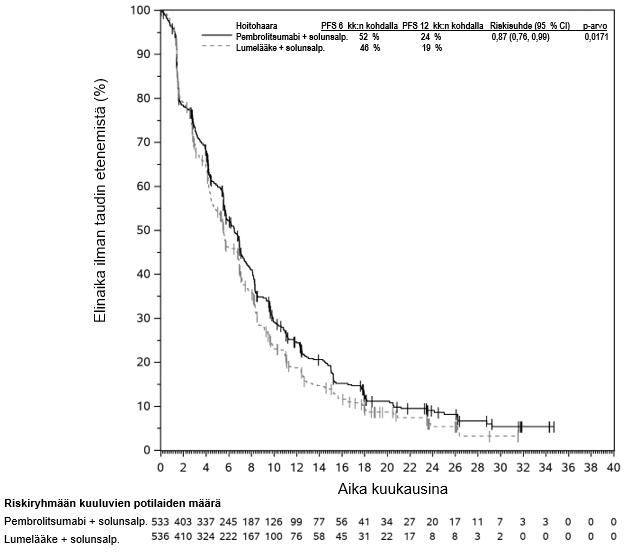
Iäkkäät potilaat
Pembrolitsumabimonoterapiaa saaneiden ≥ 75‑vuotiaiden ja nuorempien potilaiden välillä ei havaittu kokonaiseroja turvallisuudessa. Tietoja turvallisuudesta ≥ 75‑vuotiailla potilailla on saatavilla vain vähän. Saatavilla olevien tietojen perusteella yhdistelmänä solunsalpaajahoidon kanssa annetun pembrolitsumabin siedettävyys oli huonompi ≥ 75‑vuotiailla potilailla kuin nuoremmilla potilailla. Katso tiedot tehosta ≥ 75‑vuotiailla potilailla kunkin käyttöaiheen kohdalta.
Pediatriset potilaat
KEYNOTE-051-tutkimuksessa 161 pediatrista potilasta (62 vähintään 9 kuukauden mutta alle 12-vuoden ikäistä lasta ja 99 iältään 12–17-vuotiasta nuorta), joilla oli edennyt melanooma tai PD-L1-positiivisia edenneitä, relapsoituneita tai refraktorisia kiinteitä kasvaimia tai lymfooma, sai pembrolitsumabia annoksella 2 mg/kg 3 viikon välein. Kaikkien potilaiden saamien pembrolitsumabiannosten mediaani oli 4 annosta (vaihteluväli: 1–35 annosta), ja 138 potilasta (85,7 %) sai pembrolitsumabia vähintään 2 annosta. Osallistujat otettiin mukaan tutkimukseen 28 kasvaintyypin perusteella ensisijaisen diagnoosin mukaan. Yleisimmät histologian mukaan luokitellut kasvaintyypit olivat Hodgkinin lymfooma (13,7 %), glioblastooma multiforme (9,3 %), neuroblastooma (6,2 %), osteosarkooma (6,2 %) ja melanooma (5,6 %). 161 tutkimukseen osallistuneesta potilaasta 137:llä oli kiinteitä kasvaimia, 22 potilaalla oli Hodgkinin lymfooma ja 2 potilaalla jokin muu lymfooma. Potilailla, joilla oli kiinteitä kasvaimia tai muu lymfooma, ORR oli 5,8 %, yhdelläkään potilaalla ei ollut täydellistä vastetta ja 8 potilaalla (5,8 %) oli osittainen vaste. Hodgkinin lymfoomaa sairastavassa (n = 22) potilasjoukossa 11–17‑vuotiaiden potilaiden tiedot lähtötilanteessa olivat: mediaani-ikä 15 vuotta; poikia 64 %; valkoihoisia 68 %; 77 %:lla Lanskyn tai Karnofskyn asteikolla mitattu pistemäärä oli 90–100 ja 23 %:lla 70–80. 86 % oli saanut vähintään kahden aiemman linjan hoitoa, ja 64 %:lla taudin levinneisyysaste oli vähintään 3. Näillä klassista Hodgkinin lymfoomaa sairastavilla pediatrisilla potilailla BICR:n IGW 2007 -kriteerien mukaan arvioima ORR oli 54,5 %, 1 potilaalla (4,5 %) oli täydellinen vaste ja 11 potilaalla (50,0 %) oli osittainen vaste. Lugano 2014 ‑kriteerien mukaan arvioitu ORR oli 63,6 %, 4 potilaalla (18,2 %) oli täydellinen vaste ja 10 potilaalla (45,5 %) oli osittainen vaste. Kliinisissä tutkimuksissa on saatu hyvin vähän tietoja nuorista melanoomaa sairastavista potilaista, ja tehon arvioinnissa on käytetty aikuisista potilaista saatujen tietojen ekstrapolointia. Viisi edennyttä melanoomaa sairastavaa nuorta sai hoitoa KEYNOTE-051-tutkimuksessa. Yksikään nuorista ei saanut täydellistä tai osittaista vastetta, ja yhdellä heistä tauti oli vakaa.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset KEYTRUDA-valmisteen käytöstä Hodgkinin lymfooman hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Pembrolitsumabin farmakokinetiikkaa tutkittiin 2 993 potilaalla, joilla oli metastasoitunut tai leikkaukseen soveltumaton melanooma, ei-pienisoluinen keuhkosyöpä tai karsinooma. Potilaiden saamat annokset olivat 1–10 mg/kg 2 viikon välein, 2–10 mg/kg 3 viikon välein tai 200 mg 3 viikon välein.
Imeytyminen
Pembrolitsumabi annetaan laskimoon, joten sen hyötyosuus on täydellinen ja saavutetaan heti.
Jakautuminen
Koska pembrolitsumabin ekstravaskulaarinen jakautuminen on vähäistä, sen jakautumistilavuus vakaan tilan aikana on pieni (~6,0 litraa; variaatiokerroin (CV): 20 %). Koska pembrolitsumabi on vasta-aine, se ei sitoudu spesifisesti plasman proteiineihin.
Biotransformaatio
Pembrolitsumabi kataboloituu epäspesifisten reittien kautta, eikä metaboloituminen vaikuta sen poistumiseen elimistöstä.
Eliminaatio
Pembrolitsumabin puhdistuma on vakaassa tilassa saavutetun suurimman muutoksen saavuttamisen jälkeen noin 23 % pienempi (geometrinen keskiarvo, 195 ml vuorokaudessa [CV: 40 %]) verrattuna ensimmäiseen annokseen (252 ml vuorokaudessa [CV: 37 %]). Tätä puhdistuman pienenemistä ajan mittaan ei pidetä kliinisesti merkittävänä. Terminaalisen puoliintumisajan geometrinen keskiarvo (CV, %) on vakaassa tilassa 22 vuorokautta (32 %).
Lineaarisuus/ei-lineaarisuus
Huippupitoisuuteen (Cmax) tai pitoisuus-aikakäyrän alle jäävään pinta-alaan (AUC) perustuva pembrolitsumabialtistus suureni suoraan suhteessa annokseen tehokkaalla annosalueella. Pembrolitsumabin vakaan tilan pitoisuus saavutettiin kolmen viikon välein annetuilla toistuvilla annoksilla 16 viikossa, ja systeeminen kumuloituminen oli noin 2,1‑kertainen. Vakaassa tilassa pienimpien pitoisuuksien (Ctrough) mediaani oli suunnilleen 22 mikrog/ml, kun annostus oli 2 mg/kg kolmen viikon välein, ja 29 mikrog/ml, kun annostus oli 200 mg kolmen viikon välein. AUC0–3 viikkoa (pitoisuus-aikakäyrän alle jäävän pinta-alan mediaani, vakaa tila, 3 viikkoa) oli 794 mikrog•vrk/ml, kun annostus oli 2 mg/kg kolmen viikon välein, ja 1 053 mikrog•vrk/ml, kun annostus oli 200 mg kolmen viikon välein.
Kun pembrolitsumabia annettiin 200 mg kolmen viikon välein klassista Hodgkinin lymfoomaa sairastaville potilaille, havaittu vakaan tilan pienimpien pitoisuuksien (Ctrough) mediaani oli enintään 40 % suurempi kuin muilla kasvaintyypeillä käytettäessä samaa hoitoannosta, mutta pienimpien pitoisuuksien (trough) vaihtelualue on samankaltainen. Klassisen Hodgkinin lymfooman ja muiden kasvaintyyppien välillä ei ole huomattavia eroja huippupitoisuuksien (Cmax) mediaanissa. Klassisesta Hodgkinin lymfoomasta ja muista kasvaintyypeistä saatujen turvallisuustietojen perusteella näillä eroilla ei ole kliinistä merkitystä.
Erityisryhmät
Populaatiofarmakokineettisissä analyyseissä arvioitiin eri kovariaattien vaikutuksia pembrolitsumabin farmakokinetiikkaan. Seuraavat tekijät eivät vaikuttaneet kliinisesti merkittävästi pembrolitsumabin puhdistumaan: ikä (ikäjakauma: 15–94 vuotta), sukupuoli, rotu, lievä tai kohtalainen munuaisten vajaatoiminta, lievä tai kohtalainen maksan vajaatoiminta ja kasvaintaakka. Potilaan painon ja puhdistuman välinen yhteys puoltaa joko kiinteän annostuksen tai painoon perustuvan annostuksen käyttöä riittävän ja yhtä hyvän altistustasapainon saavuttamiseksi. Painoon perustuvalla annostuksella 2 mg/kg 3 viikon välein pembrolitsumabialtistus pediatrisilla potilailla (≥ 3–17-vuotiailla) oli verrannollinen pitoisuuksiin aikuisilla samalla annostuksella.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta pembrolitsumabin puhdistumaan arvioitiin populaatiofarmakokineettisissä analyyseissä lievää tai kohtalaista munuaisten vajaatoimintaa sairastavilla potilailla ja potilailla, joiden munuaisten toiminta oli normaalia. Pembrolitsumabin puhdistumassa ei havaittu kliinisesti merkittäviä eroja lievää tai kohtalaista munuaisten vajaatoimintaa sairastavien potilaiden ja niiden potilaiden välillä, joiden munuaistoiminta oli normaalia. Pembrolitsumabia ei ole tutkittu vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta pembrolitsumabin puhdistumaan arvioitiin populaatiofarmakokineettisissä analyyseissä lievää ja kohtalaista maksan vajaatoimintaa sairastavilla potilailla (määritetty Yhdysvaltain syöpäinstituutin maksan toimintahäiriön kriteerien perusteella) ja potilailla, joiden maksan toiminta oli normaalia. Pembrolitsumabin puhdistumassa ei havaittu kliinisesti merkittäviä eroja lievää tai kohtalaista maksan vajaatoimintaa sairastavien potilaiden ja niiden potilaiden välillä, joiden maksan toiminta oli normaalia. Pembrolitsumabia ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidossa (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Pembrolitsumabin turvallisuutta arvioitiin kuukauden ja kuusi kuukautta kestäneissä toistuvan altistuksen toksisuustutkimuksissa jaavanmakakeilla. Jaavanmakakeille annettiin pembrolitsumabia laskimoon 6, 40 tai 200 mg/kg viikon välein kuukauden kestäneessä tutkimuksessa ja kahden viikon välein kuuden kuukauden tutkimuksessa. Tämän jälkeen oli neljän kuukauden hoitotauko. Toksikologisesti merkittäviä löydöksiä ei tullut esiin, ja annos, jolla ei ollut haitallista vaikutusta (NOAEL), oli molemmissa tutkimuksissa ≥ 200 mg/kg. Sen aikaansaama altistus oli 19-kertainen verrattuna ihmisen altistukseen annosta 10 mg/kg käytettäessä ja 94-kertainen verrattuna ihmisen altistukseen annosta 2 mg/kg käytettäessä. Altistus NOAEL-annoksella oli 74-kertainen verrattuna ihmisen altistukseen annoksella 200 mg.
Pembrolitsumabilla ei ole tehty lisääntymistutkimuksia eläimissä. Anti-PD-1/PD-L1-reitin ajatellaan olevan osallisena toleranssin ylläpitämisessä sikiötä kohtaan koko raskauden ajan. Tiineiden hiirten eläinmalleissa PD-L1-signaalinvälityksen salpauksen on osoitettu heikentävän toleranssia sikiötä kohtaan ja lisäävän sikiönmenetyksiä.
Pembrolitsumabilla ei ole tehty hedelmällisyyttä koskevia eläinkokeita. Yhden kuukauden ja kuusi kuukautta kestäneissä apinoilla tehdyissä toistuvan altistuksen toksikologisissa tutkimuksissa ei ollut havaittavissa vaikutuksia urosten ja naaraiden sukupuolielimiin. Monet näihin tutkimukseen osallistuneet eläimet eivät tosin olleet sukupuolikypsiä.
Farmaseuttiset tiedot
Apuaineet
L-histidiini
L-histidiinihydrokloridimonohydraatti
Sakkaroosi
Polysorbaatti 80 (E433)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
2 vuotta.
Infuusion valmistamisen jälkeen
Valmisteen kemiallinen ja fysikaalinen käytönaikainen säilyvyys on osoitettu 42 päivään asti 2 °C – 8 °C:ssa tai 23 °C – 27 °C:ssa.
Mikrobiologiselta kannalta valmiste tulisi laimentamisen jälkeen käyttää heti. Laimennettu liuos ei saa jäätyä. Ellei liuosta käytetä heti, käytönaikainen säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla. Liuosta saa tavallisesti säilyttää enintään 7 päivää 2 °C – 8 °C:ssa tai 12 tuntia huoneenlämmössä, ellei laimennusta ole tehty kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa. Jääkaapissa säilytettyjen injektiopullojen ja/tai infuusiopussien on annettava lämmetä huoneenlämpöisiksi ennen käyttöä.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
KEYTRUDA infuusiokonsentraatti, liuosta varten
25 mg/ml (L:ei) 4 ml (4228,01 €)
PF-selosteen tieto
4 ml konsentraattia 10 ml:n injektiopullossa, joka on kirkasta tyypin I lasia ja jossa on päällystetty harmaa klooributyyli- tai bromobutyylitulppa ja alumiinisuljin sekä tummansininen repäisykansi ja joka sisältää 100 mg pembrolitsumabia.
Pakkauskoot: yksi tai kaksi injektiopulloa pakkauksessa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai hieman opalisoiva, väritön tai kellertävä liuos, pH 5,2–5,8.
Käyttö- ja käsittelyohjeet
Infuusion valmistelu ja antaminen
- Älä ravista injektiopulloa.
- Anna injektiopullon lämmetä huoneenlämpöiseksi (enintään 25 °C).
- Ennen laimentamista nestettä sisältävä injektiopullo voi olla poissa jääkaapista (enintään 25 °C:n lämpötilassa) enintään 24 tuntia.
- Parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti ennen antamista mahdollisten hiukkasten ja värimuutosten havaitsemiseksi. Konsentraatti on kirkasta tai hieman opalisoivaa, väritöntä tai kellertävää liuosta. Hävitä injektiopullo, jos siinä on näkyviä hiukkasia.
- Vedä ruiskuun tarvittava määrä, enintään 4 ml (100 mg), konsentraattia ja ruiskuta se infuusiopussiin, jossa on 9 mg/ml:n (0,9 %) vahvuista natriumkloridiliuosta tai 50 mg/ml:n (5 %) vahvuista glukoosiliuosta. Näin saadun laimennetun liuoksen lopullinen vahvuus on 1–10 mg/ml. Jokaisessa injektiopullossa on 0,25 ml:n ylimäärä (injektiopullon kokonaissisältö 4,25 ml), jotta injektiopullosta saadaan otettua 4 ml konsentraattia. Sekoita laimennettu liuos kääntämällä pussi varovasti ylösalaisin.
- Jääkaapissa säilytettyjen injektiopullojen ja/tai infuusiopussien on annettava lämmetä huoneenlämpöisiksi ennen käyttöä. Laimennetussa liuoksessa voi olla nähtävissä läpikuultavia tai valkoisia proteiinin kaltaisia hiukkasia. Infuusioliuos annetaan laskimoon 30 minuutin aikana käyttäen steriiliä, pyrogeenitonta, heikosti proteiinia sitovaa 0,2–5 µm:n kiinteää (in-line) tai irrallista (add-on) suodatinta.
- Älä anna muita lääkevalmisteita saman infuusioletkun kautta.
- KEYTRUDA on tarkoitettu vain yhtä käyttökertaa varten. Hävitä injektiopulloon käyttämättä jäänyt lääke.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
KEYTRUDA infuusiokonsentraatti, liuosta varten
25 mg/ml 4 ml
- Ei korvausta.
ATC-koodi
L01FF02
Valmisteyhteenvedon muuttamispäivämäärä
17.11.2025
Yhteystiedot
 MSD FINLAND OY
MSD FINLAND OY Keilaniementie 1, PL 46
02151 Espoo
09 804 650
www.msd.fi
info@msd.fi
