XTANDI tabletti, kalvopäällysteinen 40 mg
Vaikuttavat aineet ja niiden määrät
Xtandi – 40 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 40 mg entsalutamidia.
Xtandi – 80 mg kalvopäällysteiset tabletit
Yksi kalvopäällysteinen tabletti sisältää 80 mg entsalutamidia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Xtandi on tarkoitettu:
- niiden aikuisten miespotilaiden hoitoon, jotka sairastavat korkean riskin biokemiallisesti uusiutunutta (BCR) ei-metastasoitunutta hormoniherkkää eturauhassyöpää (nmHSPC) ja joille salvage-sädehoito ei sovi, joko yhdessä androgeenideprivaatiohoidon kanssa tai ilman sitä (ks. kohta Farmakodynamiikka)).
- niiden aikuisten miespotilaiden hoitoon, jotka sairastavat metastaattista hormoniherkkää eturauhassyöpää (mHSPC), yhdessä androgeenideprivaatiohoidon kanssa (ks. kohta Farmakodynamiikka).
- niiden aikuisten miespotilaiden hoitoon, jotka sairastavat korkean riskin ei-metastasoitunutta kastraatioresistenttiä eturauhassyöpää (CRPC) (ks. kohta Farmakodynamiikka).
- niiden aikuisten miespotilaiden hoitoon, jotka sairastavat metastaattista CRPC:tä, ja jotka ovat oireettomia tai lievästi oireilevia androgeenideprivaatiohoidon epäonnistuttua ja joille solunsalpaajahoito ei ole vielä kliinisesti tarpeellista (ks. kohta Farmakodynamiikka)
- niiden aikuisten miespotilaiden hoitoon, jotka sairastavat metastaattista CRPC:tä ja joiden tauti on edennyt dosetakselihoidon aikana tai sen jälkeen.
Annostus ja antotapa
- Entsalutamidihoito tulee aloittaa ja sitä tulee seurata eturauhasen syöpätautien hoitoon erikoistuneen lääkärin valvonnassa.
Annostus
Entsalutamidin suositeltu annos on 160 mg (neljä 40 mg:n kalvopäällysteistä tablettia tai kaksi 80 mg:n kalvopäällysteistä tablettia) kerran päivässä suun kautta.
Kemiallista kastraatiota jollakin luteinisoivaa hormonia vapauttava hormoni (LHRH) -analogilla on jatkettava hoidon aikana sellaisilla CRPC- tai mHSPC-potilailla, joita ei ole kastroitu kirurgisesti.
Potilaille, joilla on korkean riskin BCR nmHSPC, voidaan antaa Xtandi-hoitoa joko LHRH-analogin kanssa tai ilman sitä. Xtandi-hoitoa LHRH-analogin kanssa tai ilman sitä saavien potilaiden hoito voidaan keskeyttää, jos PSA-arvo on havaitsemisrajan alapuolella (< 0,2 ng/ml) 36 viikkoa kestäneen hoidon jälkeen. Hoito tulee aloittaa uudelleen, kun PSA-arvo on suurentunut tasolle ≥ 2,0 ng/ml, jos potilaalle on aiemmin tehty radikaali prostatektomia, tai tasolle ≥ 5,0 ng/ml, jos potilas on aiemmin saanut primaarista sädehoitoa. Jos PSA-arvo on mitattavissa (≥ 0,2 ng/ml) 36 viikkoa kestäneen hoidon jälkeen, hoitoa tulee jatkaa (ks. kohta Farmakodynamiikka).
Jos potilas unohtaa ottaa Xtandi-annoksen normaaliin aikaan, hänen on otettava se niin pian kuin mahdollista. Jos potilaalta jää päiväannos kokonaan ottamatta, hoitoa tulee jatkaa seuraavana päivänä normaalin annostusaikataulun mukaisesti.
Jos potilaalla ilmenee haittavaikutus, joka vastaa toksisuuskriteeristön astetta ≥ 3 tai haittavaikutus on sietämätön, hoito on keskeytettävä viikon ajaksi tai kunnes oireet lievittyvät asteelle ≤ 2, ja jatkettava sitten hoitoa samalla tai pienemmällä annoksella (120 mg tai 80 mg), mikäli se on perusteltua.
Samanaikainen käyttö voimakkaiden CYP2C8-entsyymin estäjien kanssa
Voimakkaiden CYP2C8-entsyymin estäjien samanaikaista käyttöä on mahdollisuuksien mukaan vältettävä. Jos potilaalle on annettava samanaikaisesti voimakasta CYP2C8:n estäjää, entsalutamidiannosta on pienennettävä 80 mg:aan kerran vuorokaudessa. Jos voimakkaan estäjän samanaikainen käyttö lopetetaan, on palattava käyttämään samaa entsalutamidiannosta kuin ennen CYP2C8:n estäjän käyttöä (ks. kohta Yhteisvaikutukset).
Iäkkäät potilaat
Annoksen muuttaminen ei ole tarpeen hoidettaessa iäkkäitä potilaita (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa lievää, keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavia potilaita (Child-Pugh -luokka A, B tai C). Vaikeaa maksan vajaatoimintaa sairastavilla potilailla on kuitenkin havaittu entsalutamidin puoliintumisajan pidentymistä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen hoidettaessa lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavia potilaita (ks. kohta Farmakokinetiikka). Varovaisuutta on noudatettava hoidettaessa vaikeaa tai loppuvaiheen munuaisten vajaatoimintaa sairastavia potilaita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Ei ole asianmukaista käyttää entsalutamidia pediatrisille potilaille, sillä valmiste on tarkoitettu niiden aikuisten miespotilaiden hoitoon, jotka sairastavat CRPC:tä, mHSPC:tä tai korkean riskin BCR nmHSPC:tä.
Nielemisvaikeudet / potilaat, joilla on aiemmin ollut nielemishäiriöitä
Entsalutamidia on saatavana myös tabletteina (40 mg ja 80 mg) potilaille, joiden on vaikea niellä suurikokoisia kapseleita tai joilla on aiemmin ollut nielemishäiriöitä.
Antotapa
Xtandi on tarkoitettu otettavaksi suun kautta. Kalvopäällysteisiä tabletteja ei saa leikata, murskata tai pureskella, vaan ne on nieltävä kokonaisina riittävän vesimäärän kera joko ruokailun yhteydessä tai ilman ruokaa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
Naiset, jotka ovat raskaana tai voivat tulla raskaaksi (ks. kohdat Raskaus ja imetys ja Käyttö- ja käsittelyohjeet).
Varoitukset ja käyttöön liittyvät varotoimet
Epileptisen kohtauksen riski
Entsalutamidin käyttöön on liittynyt epileptisiä kohtauksia (ks. kohta Haittavaikutukset). Päätös hoidon jatkamisesta epileptisiä kohtauksia saavilla potilailla on tehtävä tapauskohtaisesti.
Posteriorinen reversiibeli enkefalopatiaoireyhtymä
Xtandi-valmistetta saaneilla potilailla on harvoin raportoitu posteriorista reversiibeliä enkefalopatiaoireyhtymää (PRES) (ks. kohta Haittavaikutukset). PRES on harvinainen, korjautuva neurologinen häiriö, johon saattaa liittyä nopeasti eteneviä oireita, kuten kouristuksia, päänsärkyä, sekavuutta, sokeutta ja muita näkö- ja neurologisia häiriöitä, joihin saattaa liittyä hypertensio. PRES-oireyhtymän diagnoosin varmistus edellyttää aivojen kuvantamista, mieluiten magneettikuvauksella. Xtandi-valmisteen lopettamista suositellaan potilaille, joille kehittyy PRES.
Toiset primaariset pahanlaatuiset kasvaimet
Toisia primaarisia pahanlaatuisia kasvaimia on raportoitu kliinisissä tutkimuksissa potilailla, joita hoidettiin entsalutamidilla. Vaiheen 3 kliinisissä tutkimuksissa entsalutamidihoitoa saaneilla potilailla useimmiten, ja enemmän kuin lumelääkkeellä, raportoituja tapahtumia olivat virtsarakon syöpä (0,3 %), paksusuolen adenokarsinooma (0,2 %), transitiosellulaarinen karsinooma (0,2 %) ja pahanlaatuinen melanooma (0,2 %).
Potilaita on kehotettava ottamaan välittömästi yhteyttä lääkäriinsä, jos he havaitsevat merkkejä maha-suolikanavan verenvuodosta, makroskooppisesta hematuriasta tai jos heillä esiintyy muita oireita, kuten virtsaamisvaivoja tai virtsapakkoa entsalutamidihoidon aikana.
Samanaikainen käyttö muiden lääkevalmisteiden kanssa
Entsalutamidi on voimakas entsyymi-indusori ja saattaa heikentää useiden yleisesti käytettyjen lääkkeiden tehoa (ks. esimerkkejä kohdasta Yhteisvaikutukset). Samanaikaisesti käytettävät lääkkeet on tästä syystä tarkistettava entsalutamidihoitoa aloitettaessa. Entsalutamidin samanaikaista käyttöä sellaisten lääkevalmisteiden kanssa, jotka ovat monien metaboloivien entsyymien herkkiä substraatteja tai kuljettajia (ks. kohta Yhteisvaikutukset), tulee yleisesti välttää, jos näiden terapeuttisella vaikutuksella on suurta merkitystä potilaalle eikä annoksia pystytä helposti muuttamaan tehon tai plasmapitoisuuden seurannan perusteella.
Samanaikaista käyttöä varfariinin ja kumariinin kaltaisten antikoagulanttien kanssa on vältettävä. Jos Xtandi-valmistetta käytetään samanaikaisesti CYP2C9-entsyymin metaboloiman antikoagulantin (esimerkiksi varfariinin tai asenokumarolin) kanssa, INR (International Normalised Ratio) -arvon lisäseuranta on tarpeen (ks. kohta Yhteisvaikutukset).
Munuaisten vajaatoiminta
Varovaisuutta on noudatettava vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa, sillä entsalutamidin käyttöä ei ole tutkittu tässä potilasryhmässä.
Vaikea maksan vajaatoiminta
Vaikeaa maksan vajaatoimintaa sairastavilla potilailla on todettu entsalutamidin puoliintumisajan pidentymistä, joka mahdollisesti liittyy lisääntyneeseen jakaantumiseen kudoksissa. Tämän havainnon kliinisestä merkityksestä ei ole tietoa. On kuitenkin odotettavissa, että vakaan tilan pitoisuuksien saavuttaminen kestää kauemmin, ja maksimaalisen farmakologisen vaikutuksen saavuttamiseen sekä entsyymi-induktion käynnistymiseen ja estoon kuluva aika (ks. kohta Yhteisvaikutukset) saattaa lisääntyä.
Äskettäin todettu sydän- ja verisuonisairaus
Vaiheen 3 tutkimuksista jätettiin pois potilaat, joilla oli hiljattain (6 kuukauden sisällä) ollut sydäninfarkti tai epästabiili angina pectoris (3 kuukauden sisällä), NYHA (New York Heart Association) -luokan III tai IV sydämen vajaatoiminta (ellei vasemman kammion ejektiofraktio LVEF ollut ≥ 45 %), bradykardia tai huonossa hoitotasapainossa oleva korkea verenpaine. Tämä on otettava huomioon, jos Xtandi-valmistetta määrätään näille potilaille.
Androgeenideprivaatiohoito saattaa pidentää QT-aikaa
Niillä potilailla, joilla on aiemmin todettu QT-ajan pidentymistä tai joilla on tähän altistavia riskitekijöitä ja jotka käyttävät samanaikaisesti sellaista lääkitystä, joka saattaa pidentää QT-aikaa (ks. kohta Yhteisvaikutukset), lääkäreiden tulee ennen Xtandi-hoidon aloittamista arvioida käytön hyöty-riskisuhdetta, mukaan lukien kääntyvien kärkien takykardian mahdollisuutta.
Käyttö kemoterapian kanssa
Xtandi-valmisteen turvallisuutta ja tehoa käytettäessä sitä samanaikaisesti sytotoksisen kemoterapian kanssa ei ole todettu. Samanaikaisesti annetulla entsalutamidilla ei ole kliinisesti merkittävää vaikutusta laskimoon annetun dosetakselin farmakokinetiikkaan (ks. kohta Yhteisvaikutukset); dosetakselin aiheuttaman neutropenian lisääntymistä ei voida silti sulkea pois.
Vaikeat ihoreaktiot
Mahdollisesti henkeä uhkaavia tai kuolemaan johtavia, vaikeita ihoon kohdistuvia haittavaikutuksia (severe cutaneous adverse reaction, SCAR), kuten Stevens-Johnsonin oireyhtymää, on raportoitu entsalutamidihoidon yhteydessä.
Lääkettä määrättäessä potilaille on kerrottava näiden merkeistä ja oireista, ja potilaita on seurattava tarkasti ihoreaktioiden varalta.
Jos tällaiseen reaktioon viittaavia merkkejä ja oireita ilmenee, entsalutamidihoito on lopetettava välittömästi, ja jotakin muuta sopivaa hoitovaihtoehtoa on harkittava.
Yliherkkyysreaktiot
Yliherkkyysreaktioita, jotka voivat ilmetä esimerkiksi - niihin kuitenkaan rajoittumatta – ihottumana tai kasvojen, kielen, huulien tai nielun turvotuksena, on todettu entsalutamidin yhteydessä (ks. kohta Haittavaikutukset).
Xtandi monoterapiana potilailla, joilla on korkean riskin BCR nmHSPC-tauti
EMBARK-tutkimuksen tulokset viittaavat siihen, että Xtandi monoterapiana ja yhdistelmähoitona androgeenideprivaatiohoidon kanssa eivät ole samanarvoisia hoitovaihtoehtoja potilailla, joilla on korkean riskin BCR nmHSPC (ks. kohdat Haittavaikutukset ja Farmakodynamiikka). Xtandi-lääkevalmistetta yhdessä androgeenideprivaatiohoidon kanssa pidetään ensisijaisena hoitovaihtoehtona lukuun ottamatta tapauksia, joissa androgeenideprivaatiohoidon lisääminen voi johtaa toksisuuteen tai riskiin, jota ei voida hyväksyä.
Valmistemuotoon liittyvät nielemishäiriöt
Tapauksia, joissa potilaiden on ollut vaikea niellä Xtandi-valmistetta ja joihin on liittynyt jopa tukehtumisvaara, on raportoitu. Nielemisvaikeuksia ja tapauksia, joihin liittyi tukehtumisvaara, raportoitiin useimmiten kapselimuotoisen valmisteen käytön yhteydessä, mikä saattaa johtua valmisteen suuremmasta koosta. Potilaita on kehotettava nielemään kapselit kokonaisina riittävän vesimäärän kanssa.
Jos potilaalla on vaikeuksia niellä suurikokoisia kapseleita tai hänellä on aiemmin ollut nielemishäiriöitä, on suositeltavaa käyttää kapselien sijasta tablettimuotoista entsalutamidia.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (alle 23 mg) per kalvopäällysteinen tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Mahdollisuus, että muut lääkevalmisteet vaikuttavat entsalutamidiin
CYP2C8-entsyymin estäjät
CYP2C8-entsyymillä on tärkeä merkitys entsalutamidin eliminaatiossa ja entsalutamidin aktiivisen metaboliitin muodostumisessa. Kun voimakasta CYP2C8:n estäjää, gemfibrotsiiliä, annettiin suun kautta (600 mg kahdesti vuorokaudessa) terveille miehille, entsalutamidin AUC-arvo nousi 326 %, kun taas entsalutamidin Cmax-arvo laski 18 %. Yhteensä sitoutumattoman entsalutamidin ja sitoutumattoman aktiivisen metaboliitin AUC-arvot nousivat 77 % ja Cmax-arvot laskivat 19 %. Voimakkaiden CYP2C8:n estäjien (esimerkiksi gemfibrotsiili) käyttöä on vältettävä tai noudatettava varovaisuutta niiden käytössä entsalutamidihoidon aikana. Jos potilaalle on annettava samanaikaisesti voimakkaita CYP2C8:n estäjiä, entsalutamidiannosta on pienennettävä 80 mg:aan kerran päivässä (ks. kohta Annostus ja antotapa).
CYP3A4-entsyymin estäjät
CYP3A4-entsyymin merkitys entsalutamidin metaboliassa ei ole erityisen keskeinen. Kun voimakasta CYP3A4:n estäjää, itrakonatsolia, annettiin suun kautta (200 mg kerran vuorokaudessa) terveille miehille, entsalutamidin AUC-arvo nousi 41 %, mutta Cmax-arvo ei muuttunut. Yhteensä sitoutumattoman entsalutamidin ja sitoutumattoman aktiivisen metaboliitin AUC-arvot nousivat 27 %, kun taas Cmax-arvot pysyivät samana. Annoksen muuttaminen ei ole tarpeen käytettäessä Xtandi-valmistetta samanaikaisesti CYP3A4:n estäjien kanssa.
CYP2C8- ja CYP3A4-entsyymien indusorit
Kun keskivoimakasta CYP2C8:n ja voimakasta CYP3A4:n indusoria, rifampisiinia, annettiin suun kautta (600 mg kerran vuorokaudessa) terveille miehille, entsalutamidin ja aktiivisen metaboliitin AUC-arvo laski 37 %, mutta Cmax-arvo ei muuttunut. Annoksen muuttaminen ei ole tarpeen käytettäessä Xtandi-valmistetta samanaikaisesti CYP2C8:n tai CYP3A4:n indusorien kanssa.
Mahdollisuus, että entsalutamidi vaikuttaa muihin lääkevalmisteisiin
Entsyymi-induktio
Entsalutamidi on voimakas indusori ja lisää monien entsyymien ja kuljettajien synteesiä; tämän vuoksi yhteisvaikutus monien yleisten lääkevalmisteiden kanssa, jotka ovat näiden entsyymien substraatteja tai kuljettajia, on odotettavissa. Plasmapitoisuuksien lasku saattaa olla huomattava ja johtaa kliinisen tehon häviämiseen tai alentumiseen. On myös olemassa riski, että aktiivisten metaboliittien muodostuminen lisääntyy. Entsyymeihin, joihin saattaa liittyä induktiota, lukeutuvat CYP3A maksassa ja suolistossa, CYP2B6, CYP2C9, CYP2C19 ja uridiini-5'-difosfaattiglukuronyylitransferaasientsyymi (UGT - glukuronidi konjugaattientsyymi). Jotkin kuljettajat saattavat myös induktoitua, esim. monilääkeresistenssiin liittyvä proteiini 2 (MRP2) sekä orgaanisten anionien kuljettajapolypeptidi 1B1 (OATP1B1).
In vivo -tutkimukset ovat osoittaneet, että entsalutamidi on CYP3A4:n voimakas indusori ja keskivoimakas CYP2C9:n ja CYP2C19:n indusori. Kun entsalutamidia (160 mg kerran vuorokaudesssa) käytettiin samanaikaisesti kerta-annoksena suun kautta annettujen sensitiivisten CYP-substraattiannosten kanssa eturauhassyöpäpotilaiden hoidossa, midatsolaamin (CYP3A4-substraatti) AUC-arvo laski 86 %, S-varfariinin (CYP2C9-substraatti) AUC-arvo laski 56 % ja omepratsolin (CYP2C19-substraatti) AUC-arvo laski 70 %. UGT1A1-induktiota on saattanut myös esiintyä. Metastaattista kastraatioresistenttiä eturauhassyöpää (CRPC) sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa Xtandi-valmisteella (160 mg kerran vuorokaudessa) ei havaittu kliinisesti merkityksellistä vaikutusta laskimoon annetun dosetakselin (75 mg/m2 infuusiona joka 3. viikko) farmakokinetiikkaan. Dosetakselin AUC-arvo pieneni 12 % [geometristen keskiarvojen suhde (GMR) =0,882 (90 % CI: 0,767; 1,02)] ja Cmax-arvo pieneni 4 % [GMR = 0,963 (90 % CI: 0,834; 1,11)].
Yhteisvaikutuksia on odotettavissa tiettyjen lääkevalmisteiden kanssa, jotka eliminoituvat metaboloitumalla tai aktiivisen kuljetuksen kautta. Jos näiden terapeuttisella vaikutuksella on suurta merkitystä potilaalle eikä annoksia pystytä helposti muuttamaan tehon tai plasmapitoisuuden seurannan perusteella, näitä lääkevalmisteita tulee välttää tai käyttää varoen. Parasetamolin käytön jälkeen ilmenevän maksavaurion riskin epäillään olevan suurempi potilailla, jotka ovat samanaikaisesti saaneet entsyymi-induktoreita.
Lääkevalmisteryhmiin, joihin saattaa olla vaikutusta, sisältyvät seuraavat - näihin kuitenkaan rajoittumatta:
- kipulääkkeet (esimerkiksi fentanyyli, tramadoli)
- antibiootit (esimerkiksi klaritromysiini, doksisykliini)
- syöpälääkkeet (esimerkiksi kabatsitakseli)
- epilepsialääkkeet (esimerkiksi karbamatsepiini, klonatsepaami, fenytoiini, primidoni, valproiinihappo)
- antipsykootit (esimerkiksi haloperidoli)
- antitromboottiset lääkkeet (esimerkiksi asenokumaroli, varfariini, klopidogreeli)
- beetasalpaajat (esimerkiksi bisoprololi, propranololi)
- kalsiumkanavan salpaajat (esimerkiksi diltiatseemi, felodipiini, nikardipiini, nifedipiini, verapamiili)
- sydänglykosidit (esimerkiksi digoksiini)
- kortikosteroidit (esimerkiksi deksametasoni, prednisoloni)
- HIV-viruslääkkeet (esimerkiksi indinaviiri, ritonaviiri)
- unilääkkeet (esimerkiksi diatsepaami, midatsolaami, tsolpideemi)
- immunosuppressantit (esimerkiksi takrolimuusi)
- protonipumpun estäjät (esimerkiksi omepratsoli)
- CYP3A4-entsyymin metaboloimat statiinit (esimerkiksi atorvastatiini, simvastatiini)
- kilpirauhaslääkkeet (esimerkiksi levotyroksiini).
Entsalutamidin täysi induktiopotentiaali saatetaan saavuttaa vasta noin kuukauden kuluttua hoidon alusta, kun entsalutamidin vakaa pitoisuus plasmassa on saavutettu. Indusoivaa vaikutusta saattaa tosin esiintyä jo aiemminkin. Mikäli potilaat käyttävät lääkkeitä, jotka ovat CYP2B6-, CYP3A4-, CYP2C9-, CYP2C19- tai UGT1A1-substraatteja, entsalutamidihoidon ensimmäisen kuukauden aikana on arvioitava, onko farmakologinen teho vähentynyt (tai kasvanut tapauksissa, joissa lääke muodostaa aktiivisia metaboliitteja), ja annoksen muuttamista on tarvittaessa harkittava. Entsalutamidin pitkän puoliintumisajan (5,8 vrk, ks. kohta Farmakokinetiikka) vuoksi entsyymeihin kohdistuvat vaikutukset voivat jatkua jopa yli kuukauden ajan entsalutamidihoidon lopettamisen jälkeen. Samanaikaisesti annetun lääkevalmisteen annoksen asteittainen pienentäminen saattaa olla tarpeen entsalutamidihoitoa lopetettaessa.
CYP1A2- ja CYP2C8-substraatit
Entsalutamidi (160 mg kerran vuorokaudessa) ei aiheuttanut kliinisesti merkittävää kofeiinin (CYP1A2-substraatti) tai pioglitatsonin (CYP2C8-substraatti) AUC- tai Cmax-arvon muutosta. Pioglitatsonin AUC-arvo nousi 20 % ja Cmax-arvo laski 18 %. Kofeiinin AUC-arvo laski 11 % ja Cmax-arvo 4 %. Annoksen muuttaminen ei ole aiheellista, kun CYP1A2- tai CYP2C8-substraattia käytetään samanaikaisesti Xtandi-valmisteen kanssa.
P-gp-substraatit
In vitro -tiedot osoittavat, että entsalutamidi saattaa olla effluksikuljettajaproteiini P-glykoproteiinin (P-gp) estäjä. Entsalutamidilla todettiin vakaassa tilassa lievä P‑gp:n estovaikutus tutkimuksessa, johon osallistuneet eturauhassyöpää sairastavat potilaat saivat suun kautta yhden kerta-annoksen koettimena käytettyä P‑gp:n substraattia, digoksiinia, ennen entsalutamidia ja samanaikaisesti sen kanssa (ennen samanaikaista antoa potilaat olivat saaneet 160 mg entsalutamidia kerran päivässä vähintään 55 päivän ajan). Digoksiinipitoisuudet plasmassa mitattiin validoidulla nestekromatografia-tandem-massaspektrometrisellä määrityksellä. Digoksiinin AUC-arvo suureni 33 %:lla ja Cmax-arvo 17 %:lla. Käytettäessä lääkevalmisteita, joiden terapeuttinen alue on kapea ja jotka ovat P-gp-substraatteja (esimerkiksi kolkisiini, dabigatraanieteksilaatti, digoksiini), on syytä noudattaa varovaisuutta, jos niitä käytetään samanaikaisesti Xtandi-valmisteen kanssa. Annoksen muuttaminen saattaa olla tarpeen, jotta optimaaliset pitoisuudet plasmassa pystytään säilyttämään.
Laboratoriokokeisiin liittyvät häiriöt
Entsalutamidilla hoidetuilla potilailla on havaittu kemiluminesenssi-mikropartikkeli-immunomäärityksen (CMIA) yhteydessä virheellisiä tuloksia kohonneista digoksiinin plasmapitoisuuksista riippumatta siitä, hoidetaanko heitä digoksiinilla. Sen vuoksi CMIA:lla saatuja digoksiinin plasmapitoisuuksien tuloksia on tulkittava varoen, ja ne on vahvistettava toisentyyppisellä määrityksellä ennen toimia digoksiiniannosten suhteen.
BCRP-substraatit
Vakaassa tilassa entsalutamidi ei aiheuttanut kliinisesti merkittäviä muutoksia altistuksessa koettimena käytetylle rintasyövän resistenssiproteinin (BCRP) substraatille, rosuvastatiinille, eturauhassyöpää sairastavilla potilailla, jotka saivat suun kautta yhden kerta-annoksen rosuvastatiinia ennen entsalutamidia ja samanaikaisesti sen kanssa (ennen samanaikaista antoa potilaat olivat saaneet 160 mg entsalutamidia kerran päivässä vähintään 55 päivän ajan). Rosuvastatiinin AUC-arvo pieneni 14 %:lla ja Cmax-arvo suureni 6 %:lla. Annoksen säätäminen ei ole tarpeen, jos BCRP-substraattia annetaan samanaikaisesti Xtandi-valmisteen kanssa.
MRP2-, OAT3- ja OCT1-substraatit
In vitro -tulosten perusteella MRP2:n (ohutsuolessa) sekä orgaanisten anionien kuljettajan 3 (OAT3) ja orgaanisten kationien kuljettajan 1 (OCT1) (systeemisesti) estymistä ei voida sulkea pois. Teoreettisesti näiden kuljettajien induktio on myös mahdollinen, eikä nettovaikutusta tunneta.
Lääkevalmisteet, jotka pidentävät QT-aikaa
Koska androgeenideprivaatiohoito saattaa pidentää QT-aikaa, Xtandi-valmisteen samanaikaista käyttöä sellaisten lääkevalmisteiden kanssa, joiden tiedetään pidentävän QT-aikaa tai jotka voivat aiheuttaa kääntyvien kärkien takykardiaa [kuten luokkaan IA kuuluvat rytmihäiriölääkkeet (esim. kinidiini, disopyramidi) tai luokan III rytmihäiriölääkkeet (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi), metadoni, moksifloksasiini, psykoosilääkkeet jne.], on arvioitava huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ruoan vaikutus entsalutamidiin
Ruoka ei vaikuta kliinisesti merkittävästi entsalutamidiin. Kliinisissä tutkimuksissa Xtandi-valmistetta käytettiin ruokailusta riippumatta.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Xtandi-valmisteen käytöstä ihmisillä raskauden aikana ei ole tietoja, eikä tätä lääkevalmistetta ole tarkoitettu naisille, jotka voivat tulla raskaaksi. Valmiste saattaa aiheuttaa haittaa syntymättömälle lapselle tai raskauden keskeytymisen, jos raskaana olevat naiset käyttävät sitä (ks. kohdat Vasta-aiheet, Prekliiniset tiedot turvallisuudesta ja Käyttö- ja käsittelyohjeet).
Miesten ja naisten ehkäisy
Ei tiedetä, esiintyykö entsalutamidia tai sen metaboliitteja siemennesteessä. Kondomia on käytettävä entsalutamidihoidon aikana ja 3 kuukautta hoidon päättymisen jälkeen, jos potilas on sukupuoliyhteydessä raskaana olevan naisen kanssa. Kondomia ja sen lisäksi toista ehkäisymenetelmää on käytettävä entsalutamidihoidon aikana ja 3 kuukautta hoidon päättymisen jälkeen, jos potilas on sukupuoliyhteydessä sellaisen naisen kanssa, joka voi tulla raskaaksi. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Raskaus
Entsalutamidi ei ole tarkoitettu naisille. Entsalutamidi on vasta-aiheista naisille, jotka ovat raskaana tai saattavat tulla raskaaksi (ks. kohdat Vasta-aiheet, Prekliiniset tiedot turvallisuudesta ja Käyttö- ja käsittelyohjeet).
Imetys
Entsalutamidi ei ole tarkoitettu naisille. Ei ole riittävästi tietoa entsalutamidin erittymisestä ihmisen rintamaitoon. Entsalutamidi ja/tai sen metaboliitit erittyvät rotanmaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Eläinkokeet ovat osoittaneet, että entsalutamidi vaikuttaa urosrottien ja -koirien lisääntymisjärjestelmään (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Xtandilla voi olla kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn, sillä psyykkisiä ja neurologisia haittatapahtumia mukaan lukien epileptinen kohtaus on raportoitu (ks. kohta Haittavaikutukset). Potilaita tulee varoittaa mahdollisesta ajamiseen ja koneiden käyttämisen aikana ilmenevästä psyykkisen tai neurologisen haittatapahtuman riskistä. Tutkimuksia entsalutamidin vaikutuksista ajokykyyn ja koneiden käyttökykyyn ei ole tehty.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat voimattomuus/uupumus, kuumat aallot, korkea verenpaine, murtumat ja kaatumiset. Muita tärkeitä haittavaikutuksia ovat mm. iskeeminen sydänsairaus ja epileptinen kohtaus.
Epileptisiä kohtauksia esiintyi 0,6 %:lla entsalutamidilla hoidetuista, 0,1 %:lla lumelääkkeellä hoidetuista ja 0,3 %:lla bikalutamidilla hoidetuista potilaista.
Entsalutamidilla hoidetuilla potilailla on harvoin raportoitu posteriorista reversiibeliä enkefalopatiaoireyhtymää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Entsalutamidihoidon yhteydessä on raportoitu Stevens-Johnsonin oireyhtymää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Listataulukko haittavaikutuksista
Kliinisten tutkimusten aikana havaitut haittavaikutukset on lueteltu alla yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Kussakin yleisyysryhmässä haittavaikutukset on esitetty vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: Kontrolloiduissa kliinisissä tutkimuksissa ja markkinoille tulon jälkeen havaitut haittavaikutukset
| MedDRA elinjärjestelmä | Haittavaikutus ja yleisyys |
| Veri ja imukudos | Melko harvinainen: leukopenia, neutropenia Tuntematon*: trombosytopenia |
| Immuunijärjestelmä | Tuntematon*: kasvojen turvotus, kielen turvotus, huulten turvotus, nielun turvotus |
| Aineenvaihdunta ja ravitsemus | Tuntematon*: vähentynyt ruokahalu |
| Psyykkiset häiriöt | Yleinen: ahdistuneisuus Melko harvinainen: näköhallusinaatiot |
| Hermosto | Yleinen: päänsärky, muistin heikkeneminen, muistinmenetys, keskittymishäiriö, makuhäiriö, levottomat jalat ‑oireyhtymä, kognitiivinen häiriö Melko harvinainen: epileptinen kohtaus¥ Tuntematon*: posteriorinen reversiibeli enkefalopatiaoireyhtymä |
| Sydän | Yleinen: iskeeminen sydänsairaus† Tuntematon*: QT-ajan pidentyminen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) |
| Verisuonisto | Hyvin yleinen: kuumat aallot, korkea verenpaine |
| Ruoansulatuselimistö | Tuntematon*: nielemishäiriöt∞, pahoinvointi, oksentelu, ripuli |
| Maksa ja sappi | Melko harvinainen: suurentuneet maksaentsyymit |
| Iho ja ihonalainen kudos | Yleinen: kuiva iho, kutina Tuntematon*: erythema multiforme, Stevens-Johnsonin oireyhtymä, ihottuma |
| Luusto, lihakset ja sidekudos | Hyvin yleinen: murtumat‡ Tuntematon*: myalgia, lihasspasmit, lihasheikkous, selkäkipu |
| Sukupuolielimet ja rinnat | Yleinen: gynekomastia, nännikipu#, rinnan arkuus# |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen: astenia, uupumus |
| Vammat, myrkytykset ja hoitokomplikaatiot | Hyvin yleinen: kaatumiset |
| * Spontaanit raportit myyntiluvan myöntämisen jälkeen. ¥ Arvioituna suppean vakioidun MedDRA-kyselyn (Standardised MedDRA Query, SMQ) perusteella hakusanalla ‘Convulsions’ (kouristukset), mihin sisältyvät kouristukset, toonis-klooniset epileptiset kouristuskohtaukset, kompleksiset partiaaliset kohtaukset, partiaaliset kohtaukset ja epileptiset sarjakohtaukset. Tämä sisältää harvinaiset epileptiset kohtaukset, joihin liittyy kuolemaan johtaneita komplikaatioita. † Arvioituna suppean vakiouidun MedDRA-kyselyn perusteella hakusanoilla ’Myocardial Infarction’ (sydäninfarkti) ja ‘Other Ischemic Heart Disease’ (muu iskeeminen sydänsairaus) mukaan luettuina seuraavat suositellut termit, joita havaittiin vähintään kahdella potilaalla satunnaistetuissa lumekontrolloiduissa faasin 3 tutkimuksissa: rasitusrintakipu, sepelvaltimotauti, sydäninfarktit, akuutti sydäninfarkti, akuutti sepelvaltimo-oireyhtymä, epävakaa rasitusrintakipu, sydänlihasiskemia ja sepelvaltimoiden arterioskleroosi. ‡ Sisältää kaikki suositellut termit, joissa on sana luun‘murtuma’. # Entsalutamidin haittavaikutukset monoterapiassa. ∞ Nielemishäiriöitä, mukaan lukien tukehtumisvaaraa, on raportoitu. Molempia tapauksia on raportoitu useimmiten kapselimuotoisen valmisteen käytön yhteydessä, mikä saattaa johtua valmisteen suuremmasta koosta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). | |
Valikoitujen haittavaikutusten kuvaus
Epileptiset kohtaukset
Kontrolloiduissa kliinisissä tutkimuksissa 31:llä (0,6 %) päivittäin 160 mg entsalutamidia saaneesta 5 110:stä potilaasta ilmeni epileptinen kohtaus, kun taas lumelääkettä saaneista neljällä potilaalla (0,1 %) sekä bikalutamidia saaneista yhdellä potilaalla (0,3 %) ilmeni epileptinen kohtaus. Prekliiniset tiedot ja annoseskalaatiotutkimuksesta saadut tiedot osoittavat, että annos on tärkeä kohtausriskiä ennustava tekijä. Kontrolloiduista kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli aiemmin ollut epileptinen kohtaus tai joilla oli epileptisen kohtauksen riskitekijöitä.
Yhden potilasryhmän 9785-CL-0403 (UPWARD) ‑tutkimuksessa arvioitiin epileptisten kohtausten esiintymistiheyttä sellaisilla potilailla, joilla on kohtauksille altistavia tekijöitä (1,6 prosentilla oli aiemmin ollut kohtauksia). Kahdeksan 366:sta (2,2 %) entsalutamidilla hoidetusta potilaasta sai kohtauksen. Hoidon mediaanikesto oli 9,3 kuukautta.
Mekanismia, jonka välityksellä entsalutamidi mahdollisesti alentaa kohtauskynnystä, ei tunneta. Sillä saattaa kuitenkin olla yhteyttä in vitro -tutkimusten tuloksiin, jotka osoittavat, että entsalutamidi ja sen aktiivinen metaboliitti sitoutuvat GABA-reseptoriin ja voivat estää sen aktivoiman kloridikanavan aukeamisen.
Iskeeminen sydänsairaus
Satunnaistetuissa lumekontrolloiduissa kliinisissä tutkimuksissa iskeeminen sydänsairaus esiintyi 3,5 %:lla potilaista, joita hoidettiin entsalutamidilla ja androgeenideprivaatiohoidolla, ja 2 %:lla potilaista, joita hoidettiin lumelääkkeellä ja androgeenideprivaatiohoidolla. Neljällätoista (0,4 %) entsalutamidia ja androgeenideprivaatiohoitoa saaneella potilaalla ja kolmella (0,1 %) lumelääkettä ja androgeenideprivaatiohoitoa saaneella potilaalla ilmeni iskeemisen sydänsairauden tapahtuma, joka johti kuolemaan.
EMBARK-tutkimuksessa iskeeminen sydänsairaus esiintyi 5,4 %:lla potilaista, joita hoidettiin entsalutamidilla ja leuproreliinilla, ja 9 %:lla potilaista, joita hoidettiin pelkällä entsalutamidilla. Yhdelläkään entsalutamidia ja leuproreliinia saaneella potilaalla ei esiintynyt kuolemaan johtanutta iskeemisen sydänsairauden tapahtumaa, ja yhdellä (0,3 %) pelkkää entsalutamidia saaneella potilaalla ilmeni iskeemisen sydänsairauden tapahtuma, joka johti kuolemaan.
Gynekomastia
EMBARK-tutkimuksessa gynekomastiaa (kaikki asteet) todettiin 29 potilaalla 353 potilaasta (8,2 %), joita hoidettiin entsalutamidilla ja leuproreliinilla, ja 159 potilaalla 354 potilaasta (44,9 %), joita hoidettiin pelkällä entsalutamidilla. Asteen 3 tai korkeamman asteen gynekomastiaa ei todettu yhdelläkään entsalutamidi- ja leuproreliinihoitoa saaneella potilaalla, ja sitä todettiin 3 potilaalla (0,8 %), joita hoidettiin pelkällä entsalutamidilla.
Nännikipu
EMBARK-tutkimuksessa nännikipua (kaikki asteet) todettiin 11 potilaalla 353 potilaasta (3,1 %), joita hoidettiin entsalutamidilla ja leuproreliinilla, ja 54 potilaalla 354 potilaasta (15,3 %), joita hoidettiin pelkällä entsalutamidilla. Asteen 3 tai korkeamman asteen nännikipua ei todettu yhdelläkään entsalutamidi- ja leuproreliinihoitoa saaneella potilaalla, tai pelkkää entsalutamidia saaneella potilaalla.
Rinnan arkuus
EMBARK-tutkimuksessa rinnan arkuutta (kaikki asteet) todettiin 5 potilaalla 353 potilaasta (1,4 %), joita hoidettiin entsalutamidilla ja leuproreliinilla, ja 51 potilaalla 354 potilaasta (14,4 %), joita hoidettiin pelkällä entsalutamidilla. Asteen 3 tai korkeamman asteen rinnan arkuutta ei todettu yhdelläkään entsalutamidi- ja leuproreliinihoitoa saaneella potilaalla, tai pelkkää entsalutamidia saaneella potilaalla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Entsalutamidille ei ole olemassa vastalääkettä. Yliannostuksen yhteydessä entsalutamidin käyttö on lopetettava, potilaalle on annettava yleisiä elintoimintoja tukevia hoitoja ja on huomioitava valmisteen puoliintumisaika, joka on 5,8 vrk. Potilaalla voi olla suurentunut epileptisen kohtauksen riski yliannoksen jälkeen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: hormoniantagonistit ja vastaavat valmisteet, antiandrogeenit,
ATC-koodi: L02BB04
Vaikutusmekanismi
Eturauhassyövän tiedetään olevan androgeeniherkkä ja reagoivan androgeenireseptorin signaalivälitystä estävään hoitoon. Vaikka seerumin androgeenipitoisuus olisi niin matala, että sitä olisi jopa mahdoton havaita, tauti jatkaa leviämistään androgeenireseptorin signaalivälityksen kautta. Syöpäsolun kasvuun vaikuttavassa androgeenireseptorisignaloinnissa keskeistä on tumatranslokaatio ja sitoutuminen DNA:han. Entsalutamidi on potentti adrogeenireseptorin signaalivälityksen estäjä, joka salpaa androgeenireseptorin signaalireitin useasta kohdasta. Entsalutamidi estää kilpailevasti androgeenejä sitoutumasta androgeenireseptoreihin, ja siten se estää myös aktivoituneiden reseptorien tumatranslokaatiota ja aktivoidun androgeenireseptorin vaikutusta DNA:han jopa tilanteissa, joissa androgeenireseptori on yli-ilmentynyt, sekä eturauhassyöpäsoluissa, jotka ovat resistenttejä antiandrogeeneille. Entsalutamidi vähentää eturauhassyöpäsolujen kasvua ja voi aiheuttaa solukuolemaa ja kasvaimen regressiota. Prekliinisten tutkimusten mukaan entsalutamidilla ei ole androgeenireseptoriagonistista vaikutusta.
Farmakodynaamiset vaikutukset
Vaiheen III kliiniseen tutkimukseen (AFFIRM) osallistui potilaita, joiden aiempi solunsalpaajahoito (dosetakseli) oli epäonnistunut. Tutkimuksessa potilaiden seerumin PSA-taso aleni vähintään 50 % lähtötilanteesta 54 %:lla entsalutamidia saaneista ja 1,5 %:lla lumelääkettä saaneista potilaista.
Toisessa vaiheen III kliinisessä tutkimuksessa (PREVAIL) tutkittiin potilaita, jotka eivät olleet aiemmin saaneet solunsalpaajahoitoa. PSA-tason määrityksenä oli ≥ 50 %:n aleneminen lähtötilanteesta, ja tämä saavutettiin 78,0 %:lla entsalutamidia saaneista potilaista, mikä oli merkitsevästi parempi vaste kuin lumelääkettä saaneiden potilaiden 3,5 % (ero = 74,5 %, p < 0,0001).
Vaiheen II kliinisessä tutkimuksessa (TERRAIN) tutkittiin potilaita, jotka eivät olleet aiemmin saaneet solunsalpaajahoitoa. PSA-tason määrityksenä oli ≥ 50 %:n aleneminen lähtötilanteesta, ja tämä saavutettiin 82,1 %:lla entsalutamidia saaneista potilaista, mikä oli merkitsevästi parempi vaste kuin bikalutamidia saaneiden potilaiden 20,9 % (ero = 61,2 %, p < 0,0001).
Tutkimuksessa 9785-CL-0410 tutkittiin vain sellaista potilasryhmää, jota oli aiemmin hoidettu vähintään 24 viikkoa abirateronilla (ja prednisonilla). PSA-taso aleni ≥ 50 % lähtötilanteesta 22,4 %:lla potilaista. PSA-taso aleni ≥ 50 % lähtötilanteesta 22,1 %:lla siinä ryhmässä, joka ei aiemmin ollut saanut solunsalpaajahoitoa, ja 23,2 %:lla siinä ryhmässä, joka oli aiemmin saanut solunsalpaajahoitoa.
Kliinisessä tutkimuksessa MDV3100-09 (STRIVE) tutkittiin ei-metastasoitunutta ja metastaattista CRPC:tä. PSA-vasteosuuden määritelmänä oli ≥ 50 %:n aleneminen lähtötilanteesta. Vahvistettu kokonais-PSA-vasteosuus saavutettiin 81,3 %:lla entsalutamidia saaneista potilaista, mikä oli merkitsevästi suurempi kuin bikalutamidia saaneiden potilaiden ryhmässä (31,3 %) (ero = 50,0 %, p < 0,0001).
Kliinisessä tutkimuksessa MDV3100-14 (PROSPER) tutkittiin ei-metastasoitunutta CRPC:tä. PSA-vasteosuuden määritelmänä oli ≥ 50 %:n aleneminen lähtötilanteesta. Vahvistettu PSA-vasteosuus saavutettiin 76,3 %:lla entsalutamidia saaneista potilaista, mikä oli merkitsevästi suurempi kuin lumelääkettä saaneiden potilaiden ryhmässä (2,4 %) (ero = 73,9 %, p < 0,0001).
Kliininen teho ja turvallisuus
Entsalutamidin tehoa selvitettiin kolmessa satunnaistetussa, lumelääkekontrolloidussa vaiheen 3 kliinisessä monikeskustutkimuksessa [MDV3100-14 (PROSPER), CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)], joihin osallistui progressiivista eturauhassyöpää sairastavia potilaita, joilla sairaus oli edennyt androgeenideprivaatiohoidon aikana [LHRH-analogilla tai bilateraalisen orkiektomian jälkeen]. PREVAIL-tutkimukseen otettiin potilaita, joilla oli metastaattinen CRPC, ja jotka eivät aiemmin olleet saaneet kemoterapiaa, kun taas AFFIRM-tutkimukseen otettiin metastaattista CRPC:tä sairastavia, aiemmin dosetakselia saaneita potilaita, ja PROSPER-tutkimukseen otettiin potilaita, joilla oli ei-metastasoitunut CRPC. Tehoa metastaattista hormoniherkkää eturauhassyöpää sairastavilla potilailla selvitettiin yhdessä satunnaistetussa, lumelääkekontrolloidussa vaiheen 3 kliinisessä monikeskustutkimuksessa [9785-CL-0335 (ARCHES)]. Toisessa satunnaistetussa, lumelääkekontrolloidussa, vaiheen 3 kliinisessä monikeskustutkimuksessa [MDV3100‑13 (EMBARK)] varmistettiin teho korkean riskin BCR nmHSPC:tä sairastavilla potilailla. Kaikkia potilaita oli hoidettu LHRH-analogilla tai heille oli tehty bilateraalinen orkiektomia, ellei toisin ole mainittu.
Aktiivisissa hoitohaaroissa Xtandi-valmistetta annettiin suun kautta 160 mg kerran vuorokaudessa. Kaikissa viidessä (EMBARK, ARCHES, PROSPER, AFFIRM ja PREVAIL) kliinisessä tutkimuksessa verrokkihaaran potilaat saivat lumelääkettä, eikä prednisonin käyttöä edellytetty.
Pelkistä seerumin PSA-pitoisuuden muutoksista ei voida aina ennustaa kliinistä hyötyä. Sen vuoksi kaikissa viidessä tutkimuksessa suositeltiin, että potilaat jatkaisivat tutkimushoidossaan siihen asti, että keskeyttämis- tai lopetuskriteerit täyttyisivät. Kaikkien tutkimusten keskeyttämis- tai lopetuskriteerit on lueteltu alla.
MDV3100-13 (EMBARK) -tutkimus (potilaat, joilla oli korkean riskin biokemiallisesti uusiutunut ei-metastasoitunut HSPC)
EMBARK-tutkimukseen otettiin 1 068 potilasta, joilla oli korkean riskin BCR nmHSPC. Heidät satunnaistettiin suhteessa 1:1:1 saamaan 160 mg entsalutamidia suun kautta kerran vuorokaudessa samanaikaisesti androgeenideprivaatiohoidon kanssa (N = 355), 160 mg entsalutamidia suun kautta kerran vuorokaudessa avoimesti monoterapiana (N = 355) tai lumelääkettä suun kautta kerran vuorokaudessa samanaikaisesti androgeenideprivaatiohoidon kanssa (N = 358) (androgeenideprivaatiohoito määriteltiin leuproreliiniksi). Kaikille potilaille oli tehty aikaisemmin parantavaksi aiottu radikaali prostatektomia tai he olivat saaneet parantavaksi aiottua sädehoitoa (lyhytetäisyyksinen mukaan lukien) tai molemmat. Sokkoutetun riippumattoman keskitetyn arvioijatahon (blinded independent central review, BICR) piti vahvistaa ei-metastasoitunut sairaus, ja potilailla oli oltava korkean riskin biokemiallisesti uusiutunut sairaus (määriteltiin PSA:n kahdentumisajaksi ≤ 9 kuukautta). Potilaiden PSA-arvon piti myös olla ≥ 1 ng/ml, jos heille oli tehty aikaisemmin radikaali prostatektomia (sädehoidon kanssa tai ilman sitä) eturauhassyövän primaarihoitona, tai vähintään 2 ng/ml nadir-arvoa suurempi, jos he olivat saaneet aikaisemmin pelkkää sädehoitoa. Tutkimuksesta suljettiin pois potilaat, joille oli tehty aikaisemmin prostatektomia ja jotka soveltuivat tutkijan arvion mukaan saamaan salvage-sädehoitoa.
Potilaiden stratifioinnissa käytettiin seulontavaiheen PSA-arvoa (≤ 10 ng/ml vs. > 10 ng/ml), PSA:n kahdentumisaikaa (≤ 3 kuukautta vs. > 3 – ≤ 9 kuukautta) ja aiempaa hormonihoitoa (aiempi hormonihoito vs. ei aiempaa hormonihoitoa). Jos potilaan PSA-arvo oli havaitsemisrajan alapuolella (< 0,2 ng/ml) viikolla 36, hoito keskeytettiin viikolla 37 ja aloitettiin uudelleen, kun PSA-arvo oli suurentunut tasolle ≥ 2,0 ng/ml, jos potilaalle oli tehty aikaisemmin prostatektomia, tai tasolle ≥ 5,0 ng/ml, jos potilaalle ei ollut tehty aikaisemmin prostatektomiaa. Jos potilaan PSA-arvo oli mitattavissa viikolla 36 (≥ 0,2 ng/ml), hoitoa jatkettiin keskeytyksettä, kunnes hoidon pysyvän lopettamisen kriteerit täyttyivät. Hoito keskeytettiin pysyvästi, kun taudin radiologinen eteneminen vahvistettiin paikallisen arvioinnin jälkeen suoritetussa keskitetyssä arvioinnissa.
Potilaiden demografiset tiedot ja sairautta koskevat lähtötilanteen tiedot olivat kaikissa kolmessa hoitoryhmässä hyvin samankaltaiset. Mediaani-ikä oli satunnaistamisvaiheessa 69 vuotta (vaihteluväli: 49,0–93,0). Suurin osa koko populaation potilaista oli valkoihoisia (83,2 %), 7,3 % oli aasialaisia ja 4,4 % oli mustaihoisia. PSA:n kahdentumisajan mediaani oli 4,9 kuukautta. Potilaista 74 %:lle oli tehty aikaisemmin radikaali prostatektomia definitiivisenä hoitona, 75 % oli saanut aikaisemmin sädehoitoa (lyhytetäisyyksinen mukaan lukien) ja 49 % oli käynyt aikaisemmin läpi molemmat. Potilaista 32 %:lla Gleasonin pistesumma oli ≥ 8. Tutkimukseen ottovaiheessa Eastern Cooperative Oncology Group (ECOG) -toimintakykyluokka oli 92 %:lla potilaista 0 ja 8 %:lla potilaista 1.
Ensisijainen päätetapahtuma oli metastaasivapaa elossaoloaika (MFS) potilailla, jotka oli satunnaistettu saamaan entsalutamidin ja androgeenideprivaatiohoidon yhdistelmää, verrattuna potilaisiin, jotka oli satunnaistettu saamaan lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää. Metastaasivapaa elossaoloaika oli määritelmän mukaan aika satunnaistamisesta radiologiseen etenemiseen tai tutkimuksen aikana tapahtuneeseen kuolemaan, kumpi sitten tapahtuikin ensin.
Tutkimuksessa arvioituja, multiplisiteetin suhteen testattuja toissijaisia päätetapahtumia olivat aika PSA:n etenemiseen, aika uuden antineoplastisen hoidon aloittamiseen sekä kokonaiselossaoloaika. Toinen multiplisiteetin suhteen testattu toissijainen päätetapahtuma oli MFS potilailla, jotka oli satunnaistettu saamaan entsalutamidia monoterapiana, verrattuna potilaisiin, jotka oli satunnaistettu saamaan lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää.
Entsalutamidin ja androgeenideprivaatiohoidon yhdistelmän sekä monoterapian osoitettiin parantavan MFS-aikaa tilastollisesti merkitsevästi enemmän kuin lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmä. Tärkeimmät tehotulokset esitetään taulukossa 2.
Taulukko 2: Yhteenveto tehokkuustuloksista entsalutamidin ja androgeenideprivaatiohoidon yhdistelmää, lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää tai pelkkää entsalutamidia saaneilla potilailla EMBARK-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
| Entsalutamidi ja ADT (N = 355) | Lumelääke ja ADT | Entsalutamidi monoterapiana (N = 355) | |
|---|---|---|---|
| Metastaasivapaa elossaoloaika1 | |||
| Tapahtumien määrä (%)2 | 45 (12,7) | 92 (25,7) | 63 (17,7) |
| Mediaani, kuukausia (95 % CI)3 | NR (NR; NR) | NR (85,1; NR) | NR (NR; NR) |
| Riskisuhde suhteessa lumelääkkeen ja ADT:n yhdistelmään (95 % CI)4 | 0,42 (0,30; 0,61) | -- | 0,63 (0,46; 0,87) |
| P-arvo verrattuna lumelääkkeen ja ADT:n yhdistelmään5 | p < 0,0001 | -- | p = 0,0049 |
| Aika PSA-etenemisen alkamiseen6 | |||
| Tapahtumien määrä (%)2 | 8 (2,3) | 93 (26,0) | 37 (10,4) |
| Mediaani, kuukausia (95 % CI)3 | NR (NR; NR) | NR (NR; NR) | NR (NR; NR) |
| Riskisuhde suhteessa lumelääkkeen ja ADT:n yhdistelmään (95 % CI)4 | 0,07 (0,03; 0,14) | -- | 0,33 (0,23; 0,49) |
| P-arvo verrattuna lumelääkkeen ja ADT:n yhdistelmään5 | p < 0,0001 | -- | p < 0,0001 |
| Aika uuden antineoplastisen hoidon aloittamiseen | |||
| Tapahtumien määrä (%)7 | 58 (16,3) | 140 (39,1) | 84 (23,7) |
| Mediaani, kuukausia (95 % CI)3 | NR (NR; NR) | 76,2 (71,3; NR) | NR (NR; NR) |
| Riskisuhde suhteessa lumelääkkeen ja ADT:n yhdistelmään (95 % CI)4 | 0,36 (0,26; 0,49) | -- | 0,54 (0,41; 0,71) |
| P-arvo verrattuna lumelääkkeen ja ADT:n yhdistelmään5 | p < 0,0001 | -- | p < 0,0001 |
| Kokonaiselossaolo8 | |||
| Tapahtumien määrä (%) | 33 (9,3) | 55 (15,4) | 42 (11,8) |
| Mediaani, kuukausia (95 % CI)3 | NR (NR; NR) | NR (NR; NR) | NR (NR; NR) |
| Riskisuhde suhteessa lumelääkkeen ja ADT:n yhdistelmään (95 % CI)4 | 0,59 (0,38; 0,91) | -- | 0,78 (0,52; 1,17) |
| P-arvo verrattuna lumelääkkeen ja ADT:n yhdistelmään5 | p = 0,01539 | -- | p = 0,23049 |
NR = Not reached (ei saavutettu).
- Seuranta-ajan mediaani 61 kuukautta.
- Perustuu varhaisimpaan sopivaan tapahtumaan (radiologinen eteneminen tai kuolema).
- Perustuu Kaplan-Meierin menetelmän mukaiseen arviointiin.
- Riskisuhde perustuu Coxin regressiomalliin stratifioituna seulontavaiheen PSA-arvolla, PSA:n kahdentumisajalla ja aiemmalla hormonihoidolla.
- Kaksipuolinen P-arvo perustuu seulontavaiheen PSA-arvon, PSA:n kahdentumisajan ja aiemman hormonihoidon suhteen stratifioituun log rank -testiin.
- Perustuu Prostate Cancer Clinical Trials Working Group 2 -kriteerien mukaiseen PSA-etenemiseen.
- Perustuu eturauhassyövän antineoplastisen hoidon ensimmäiseen lähtötilanteen jälkeiseen käyttöön.
- Perustuu ennalta määritettyyn välianalyysiin, jossa tiedonkeruun katkaisupiste oli 31. tammikuuta 2023 sekä seuranta-ajan mediaaniin 65 kuukautta.
- Tulos ei saavuttanut ennalta määritettyä kaksipuolista merkitsevyystasoa p ≤ 0,0001.
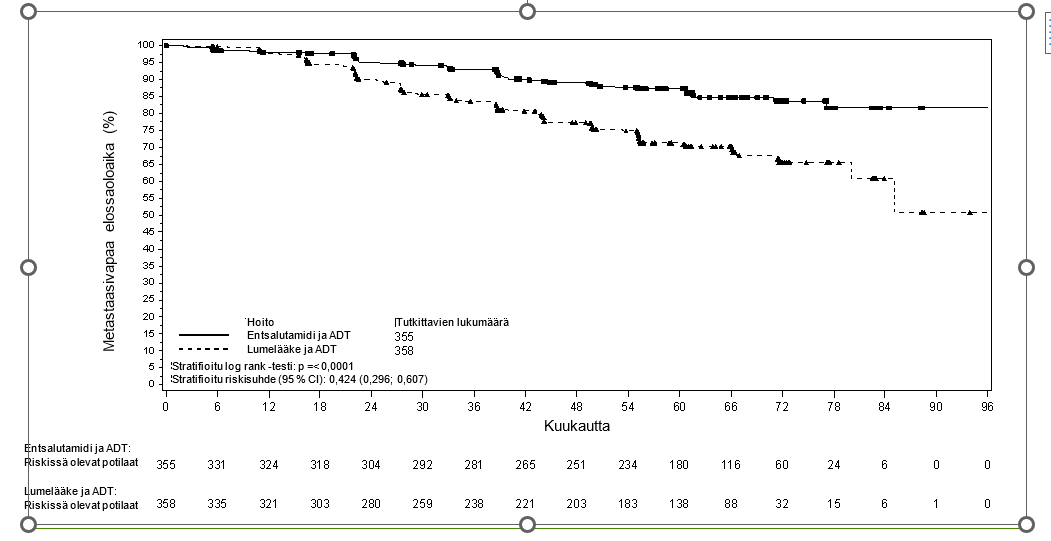
Kuva 1: Kaplan-Meierin menetelmän mukaiset käyrät metastaasivapaasta elossaoloajasta entsalutamidin ja androgeenideprivaatiohoidon yhdistelmää vs. lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää saaneissa hoitohaaroissa EMBARK-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
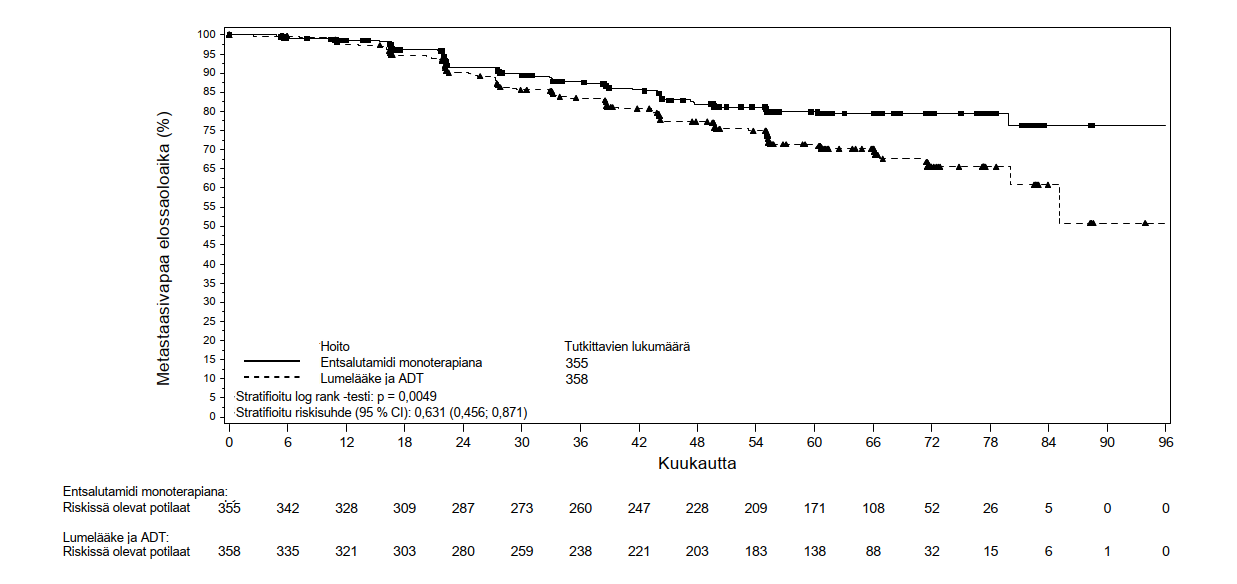
Kuva 2: Kaplan-Meierin menetelmän mukaiset käyrät metastaasivapaasta elossaoloajasta entsalutamidia monoterapiana vs. lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää saaneissa hoitohaaroissa EMBARK-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
Kun androgeenideprivaatiohoitoa annettiin joko entsalutamidin ja androgeenideprivaatiohoidon yhdistelmänä tai lumelääkkeen ja androgeenideprivaation yhdistelmänä, testosteronipitoisuudet pienenivät nopeasti kastraatiotasolle ja pysyivät pieninä, kunnes hoito keskeytettiin 37 viikon kohdalla. Keskeyttämisen jälkeen testosteronipitoisuudet suurenivat vähitellen lähelle lähtöarvoja. Kun hoito aloitettiin uudelleen, arvot pienenivät jälleen kastraatiotasolle. Pelkkää entsalutamidia saaneessa ryhmässä testosteronipitoisuudet suurenivat hoidon aloittamisen jälkeen ja palasivat lähelle lähtöarvoja, kun hoito keskeytettiin. Pitoisuudet suurenivat jälleen, kun entsalutamidihoito aloitettiin uudelleen.
9785-CL-0335 (ARCHES) tutkimus (potilaat, joilla oli metastaattinen HSPC)
ARCHES-tutkimukseen osallistui 1 150 metastaattista hormoniherkkää eturauhassyöpää sairastavaa potilasta, jotka satunnaistettiin suhteessa 1:1 saamaan joko entsalutamidin ja androgeenideprivaatiohoidon yhdistelmää tai lumelääkkeen ja androgeenideprivaatiohoidon yhdistelmää (androgeenideprivaatiohoito määriteltiin LHRH-analogiksi tai bilateraaliseksi orkiektomiaksi). Potilaat saivat 160 mg entsalutamidia (N = 574) tai lumelääkettä (N = 576) kerran vuorokaudessa.
Metastaattista eturauhassyöpää sairastavat potilaat, joilla oli dokumentoitu positiivinen luustokuvaus (metastaaseja luustossa) tai metastaasimuutoksia TT- tai magneettikuvauksessa (pehmytkudoksista) kelpuutettiin tutkimukseen. Potilaat, joilla sairauden levinneisyys oli rajoittunut alueellisesti lantion imusolmukkeisiin eivät olleet kelpoisia tutkimukseen.
Potilaille voitiin antaa korkeintaan 6 hoitosykliä dosetakseli-hoitoa siten, että viimeinen hoitoannos lopetettiin 2 kuukauden sisällä päivästä 1 ja kun sairauden etenemisestä ei ollut todisteita dosetakseli-hoidon aikana tai sen lopettamisen jälkeen. Tutkimuksista suljettiin pois potilaat, joilla tiedettiin tai epäiltiin olevan aivometastaaseja, aktiivinen leptomeningeaalinen sairaus, aiempi epileptinen kohtaus tai mitään kohtauksen ilmaantumiselle myötävaikuttavia tekijöitä.
Potilaiden demografiset tiedot ja sairautta koskevat lähtötilanteen tiedot olivat molemmissa hoitoryhmissä hyvin samankaltaiset. Mediaani-ikä oli satunnaistamisvaiheessa 70 vuotta molemmissa hoitoryhmissä. Suurin osa koko populaation potilaista oli valkoihoisia (80,5 %), 13,5 % oli aasialaisia ja 1,4 % oli mustaihoisia. Tutkimukseen ottovaiheessa Eastern Cooperative Oncology Group (ECOG) ‑toimintakykyluokka oli 78 %:lla potilaista 0 ja 22 %:lla potilaista 1. Potilaat jaoteltiin taudin pieni- versus suuri-volyymisyyden ja eturauhassyövän aikaisemman dosetakselihoidon perusteella. Kolmellakymmenelläseitsemällä prosentilla potilaista oli pieni tautivolyymi ja 63 %:lla potilaista oli suuri tautivolyymi. Kahdeksankymmentäkaksi prosenttia potilaista ei ollut saanut aikaisempaa dosetakselihoitoa, 2 % oli saanut aiemmin 1-5 hoitosykliä ja 16 % oli saanut 6 hoitojaksoa. Tutkimuksenaikaista dosetakselihoitoa ei sallittu.
Ensisijainen päätetapahtuma oli riippumattoman keskitetyn arvioijatahon vahvistama radiologinen etenemisvapaa aika (rPFS) eli aika, joka kului satunnaistamisesta ensimmäiseen objektiiviseen näyttöön taudin radiologisesta etenemisestä tai kuolemaan (mistä tahansa syystä aiheutuvaan kuolemaan, joka tapahtui satunnaistamisen ja tutkimuslääkkeen käytön lopettamista seuraavien 24 viikon välisenä aikana), kumpi sitten tapahtuikin ensin.
Entsalutamidi pienensi tilastollisesti merkitsevästi (61 %) rPFS-tapahtuman riskiä lumelääkkeeseen verrattuna [riskisuhde = 0,39 (95 %:n CI: 0,30; 0,50); p < 0,0001]. Vastaavia rPFS-tuloksia havaittiin suuren tai pienen tautivolyymin potilailla ja potilailla, jotka olivat tai eivät olleet saaneet aiempaa dosetakseli-hoitoa. Mediaaniaikaa rPFS-tapahtumaan ei saavutettu entsalutamidiryhmässä, ja se oli 19,0 kuukautta (95 %:n CI: 16,6; 22,2) lumelääkeryhmässä.
Taulukko 3: Yhteenveto tehokkuustuloksista entsalutamidia tai lumelääkettä saaneilla potilailla ARCHES-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
| Entsalutamidi ja ADT (N = 574) | Lumelääke ja ADT (N = 576) | |
| Radiologinen etenemisvapaa aika | ||
| Tapahtumien määrä (%) | 91 (15,9) | 201 (34,9) |
| Mediaani, kuukausia (95 %:n CI)1 | NR | 19,0 (16,6; 22,2) |
| Riskisuhde (95 %:n CI)2 | 0,39 (0,30; 0,50) | |
| P-arvo2 | p < 0,0001 | |
NR = Not reached (ei saavutettu).
| ||
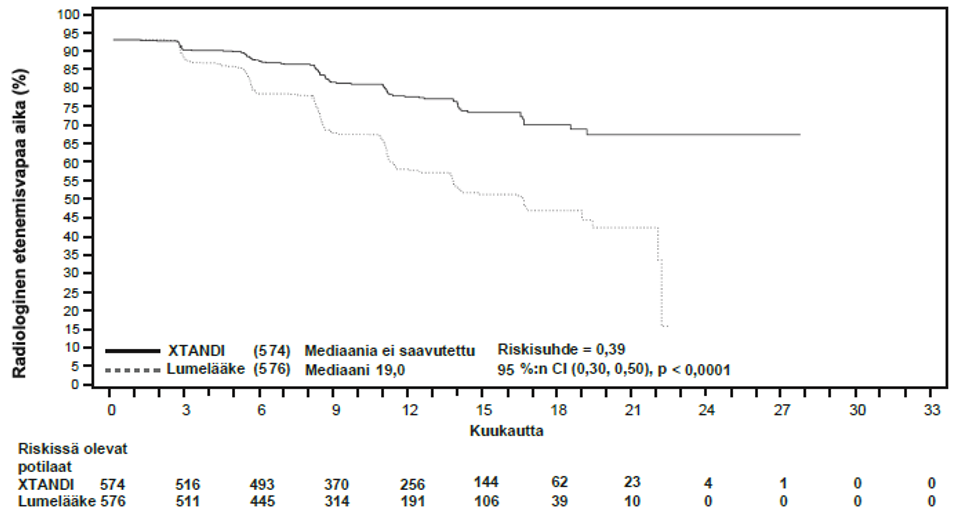
Kuva 3: Kaplan-Meierin menetelmän mukainen käyrä radiologisesta etenemisvapaasta ajasta ARCHES-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
Tärkeimpiä tutkimuksessa arvioituja toissijaisia tehon päätetapahtumia olivat aika PSA:n etenemiseen, aika uuden antineoplastisen hoidon aloittamiseen, havaitsemisrajan alapuolelle jäävä PSA-arvo (lasku tasolle < 0,2 µg/l) ja objektiivinen vasteosuus (RECIST 1.1 pohjautuen riippumattomaan arviointiin). Kaikissa näissä toissijaisissa päätetapahtumissa osoitettiin tilastollisesti merkitsevää paranemista entsalutamidi-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin.
Toinen tärkeä tutkimuksessa arvioitu toissijainen tehon päätetapahtuma oli kokonaiselossaoloaika. Etukäteen määritellyssä kokonaiselossaoloajan lopullisessa analyysissä, joka tehtiin 356 kuoleman toteamisen jälkeen, kuolemanriskin osoitettiin vähentyneen tilastollisesti merkitsevästi 34 %:lla entsalutamidihoitoon satunnaistetuilla potilailla verrattuna potilaisiin, jotka satunnaistettiin saamaan lumelääkettä [riskisuhde (HR) = 0,66; (95 % CI: 0,53; 0,81), p < 0,0001]. Kokonaiselossaoloajan mediaania ei saavutettu kummassakaan hoitoryhmässä. Arvioitu seuranta-ajan mediaani oli kaikilla potilailla 44,6 kuukautta (ks. kuva 4).
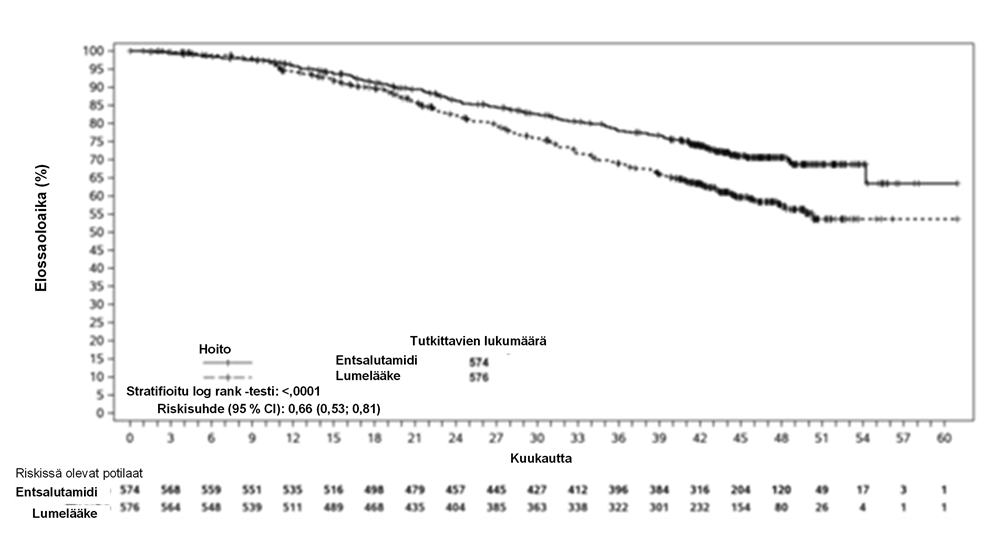
Kuva 4: Kaplan-Meierin menetelmän mukainen käyrä kokonaiselossaoloajasta ARCHES-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
MDV3100-14 (PROSPER) ‑tutkimus (potilaat, joilla oli ei-metastasoitunut CRPC)
PROSPER-tutkimukseen osallistui 1401 potilasta, joilla oli oireeton korkean riskin ei-metastasoitunut CRPC, ja jotka jatkoivat androgeenideprivaatiohoitoa (ADT) LHRH-analogilla, tai joille oli aiemmin tehty bilateraalinen orkiektomia). Potilaiden PSA:n kahdentumisajan piti olla ≤ 10 kuukautta ja PSA-tason ≥ 2 ng/ml, ja sokkoutetun riippumattoman keskitetyn arvioijatahon (blinded independent central review, BICR) piti vahvistaa ei-metastasoitunut sairaus.
Potilaat, joilla oli esiintynyt lievää tai kohtalaista sydämen vajaatoimintaa (NYHA-luokka I tai II), ja potilaat, jotka käyttivät kouristuskynnyksen alenemiseen yhdistettyjä lääkkeitä, voivat osallistua tutkimukseen. Potilaat suljettiin pois tutkimuksesta, jos heillä oli aiemmin ollut kouristuskohtauksia tai sairaus, joka voisi altistaa kouristuskohtaukselle, tai heille oli aiemmin annettu tiettyjä eturauhassyöpähoitoja (esim. kemoterapiaa, ketokonatsolia, abirateroniasetaattia, aminoglutetimidia ja/tai entsalutamidia).
Potilaat satunnaistettiin (suhteessa 2:1) saamaan kerran vuorokaudessa joko 160 mg entsalutamidia (N = 933) tai lumelääkettä (N = 468). Potilaiden stratifioinnissa käytettiin prostataspesifistä antigeeniä (PSA), PSA:n kahdentumisaikaa (PSADT) (< 6 kuukautta tai ≥ 6 kuukautta) ja luukudokseen vaikuttavien aineiden käyttöä (kyllä tai ei).
Potilaiden demografiset tiedot ja sairautta koskevat lähtötilanteen tiedot olivat samankaltaiset hoitoryhmien välillä. Satunnaistamisen aikaan mediaani-ikä oli entsalutamidiryhmässä 74 vuotta ja lumelääkeryhmässä 73 vuotta. Suurin osa tutkimuspotilaista (noin 71 %) oli valkoihoisia, 16 % oli aasialaisia ja 2 % oli mustaihoisia. ECOG-toimintakykyluokka oli kahdeksallakymmenelläyhdellä prosentilla (81 %) potilaista 0 ja 19 %:lla potilaista ECOG-toimintakykyluokka oli 1.
Metastaasivapaa elossaoloaika (MFS) oli ensisijainen päätetapahtuma, joka oli aika satunnaistamisesta radiologiseen etenemiseen tai kuolemaan 112 päivän kuluessa hoidon lopettamisesta ilman näyttöä radiologisesta etenemisestä. Tutkimuksessa arvioituja tärkeitä toissijaisia päätetapahtumia olivat aika PSA-etenemisen alkamiseen, aika uuden antineoplastisen hoidon (TTA) aloittamiseen, kokonaiselossaoloaika (OS). Muita toissijaisia päätetapahtumia olivat aika ensimmäisen sytotoksisen kemoterapian aloittamiseen ja kemoterapiavapaa elossaoloaika. Ks. tulokset alla (taulukko 4).
Entsalutamidihoito vähensi tilastollisesti merkitsevästi (71 %) radiologisen etenemisen tai kuoleman suhteellista riskiä verrattuna lumelääkkeeseen [riskisuhde = 0,29 (95 %:n luottamusväli: 0,24; 0,35), p < 0,0001]. Mediaani MFS oli entsalutamidiryhmässä 36,6 kuukautta (95 % CI: 33,1; NR) ja lumelääkeryhmässä 14,7 kuukautta (95 % CI: 14,2; 15,0). Metastaasivapaata elossaoloaikaa (MFS) koskevat tulokset olivat johdonmukaisia myös kaikissa ennalta määritellyissä potilasryhmissä, mukaan luettuina PSA:n kahdentumisaika (PSADT; < 6 kuukautta tai ≥ 6 kuukautta), demografinen alue (Pohjois-Amerikka, Eurooppa, muu maailma), ikä (< 75 tai ≥ 75), luukudokseen vaikuttavan aineen käyttö (kyllä tai ei) (ks. kuva 5).
Taulukko 4: Yhteenveto PROSPER-tutkimuksen tehokkuustuloksista (hoitoaikeen [intent-to-treat] mukainen analyysi)
| Entsalutamidi (N = 933) | Lumelääke (N = 468) | |
| Ensisijainen päätetapahtuma | ||
| Metastaasivapaa elossaoloaika | ||
| Tapahtumien määrä (%) | 219 (23,5) | 228 (48,7) |
| Mediaani, kuukausia (95 % CI)1 | 36,6 (33,1; NR) | 14,7 (14,2; 15,0) |
| Riskisuhde (95 % CI)2 | 0,29 (0,24; 0,35) | |
| P-arvo3 | p < 0,0001 | |
| Tärkeät toissijaiset tehon päätetapahtumat | ||
| Kokonaiselossaolo4 | ||
| Tapahtumien määrä (%) | 288 (30,9) | 178 (38,0) |
| Mediaani, kuukausia (95 % CI)1 | 67,0 (64,0; NR) | 56,3 (54,4; 63,0) |
| Riskisuhde (95 % CI)2 | 0,734 (0,608; 0,885) | |
| P-arvo3 | p = 0,0011 | |
| Aika PSA-etenemisen alkamiseen | ||
| Tapahtumien määrä (%) | 208 (22,3) | 324 (69,2) |
| Mediaani, kuukausia (95 % CI)1 | 37,2 (33,1; NR) | 3,9 (3,8; 4,0) |
| Riskisuhde (95 % CI)2 | 0,07 (0,05; 0,08) | |
| P-arvo3 | p < 0,0001 | |
| Aika uuden antineoplastisen hoidon aloittamiseen | ||
| Tapahtumien määrä (%) | 142 (15,2) | 226 (48,3) |
| Mediaani, kuukausia (95 % CI)1 | 39,6 (37,7; NR) | 17,7 (16,2; 19,7) |
| Riskisuhde (95 % CI)2 | 0,21 (0,17; 0,26) | |
| P-arvo3 | p < 0,0001 | |
NR = Not reached (ei saavutettu).
| ||
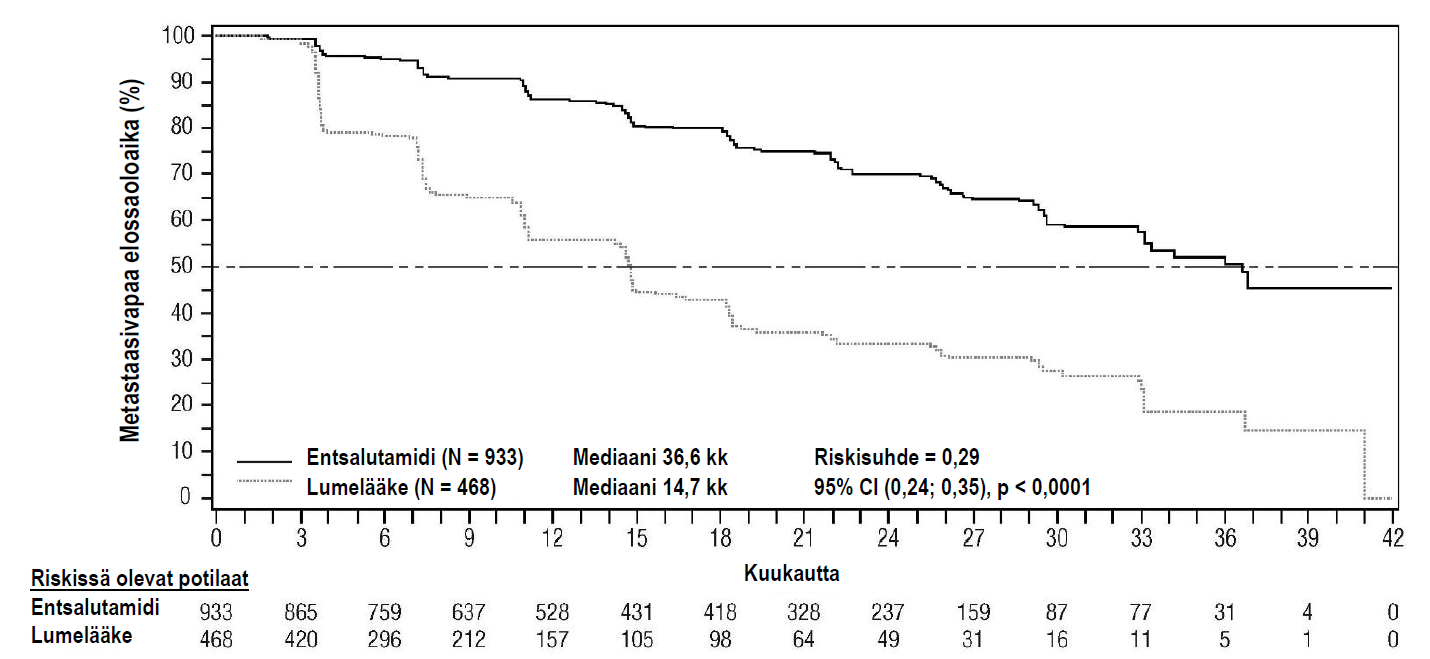
Kuva 5: Kaplan-Meierin menetelmän mukaiset käyrät metastaasivapaasta elossaoloajasta PROSPER-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
Kokonaiselossaoloajan lopullisessa analyysissä, joka tehtiin 466 kuoleman toteamisen jälkeen, kokonaiselossaoloajan osoitettiin pidentyneen tilastollisesti merkitsevästi entsalutamidihoitoon satunnaistetuilla potilailla verrattuna potilaisiin, jotka satunnaistettiin saamaan lumelääkettä. Kuolemanriski väheni 26,6 % [riskisuhde (HR) = 0,734; (95 % CI: 0,608; 0,885), p = 0,0011] (ks. kuva 6). Seuranta-ajan mediaani oli näissä ryhmissä 48,6 kuukautta (entsalutamidiryhmä) ja vastaavasti 47,2 kuukautta (lumelääkeryhmä). 33 % entsalutamidihoitoa saaneista ja 65 % lumelääkettä saaneista potilaista sai myöhemmin vähintään yhtä antineoplastista hoitoa, mikä saattaa pidentää kokonaiselossaoloaikaa.
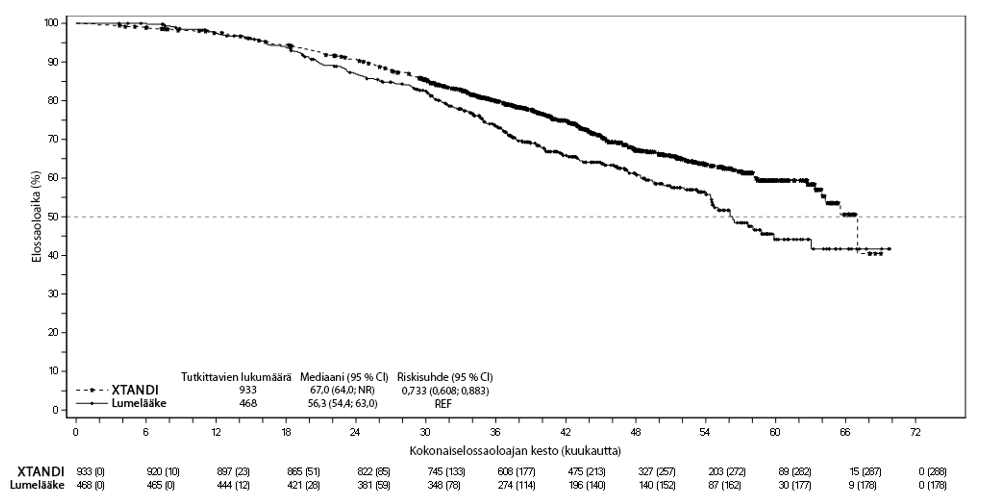
Kuva 6: Kaplan-Meierin menetelmän mukaiset käyrät kokonaiselossaoloajasta PROSPER-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
Entsalutamidi pienensi tilastollisesti merkitsevästi (93 %) PSA-etenemisen suhteellista riskiä lumelääkkeeseen verrattuna [riskisuhde = 0,07 (95 %:n luottamusväli: 0,05; 0,08), p < 0,0001]. Mediaaniaika PSA-etenemiseen oli entsalutamidiryhmässä 37,2 kuukautta (95 % CI: 33,1; NR) ja lumelääkeryhmässä 3,9 kuukautta (95 % CI: 3,8; 4,0).
Entsalutamidi pidensi tilastollisesti merkitsevästi aikaviivettä ennen ensimmäisen uuden antineoplastisen hoidon aloittamista verrattuna lumelääkkeeseen [riskisuhde = 0,21 (95 %:n luottamusväli: 0,17; 0,26), p < 0,0001]. Mediaaniaika ennen uuden antineoplastisen hoidon aloittamista oli entsalutamidiryhmässä 39,6 kuukautta (95 % CI: 37,7; NR) ja lumelääkeryhmässä 17,7 kuukautta (95 % CI: 16,2; 19,7) (ks. kuva 7).
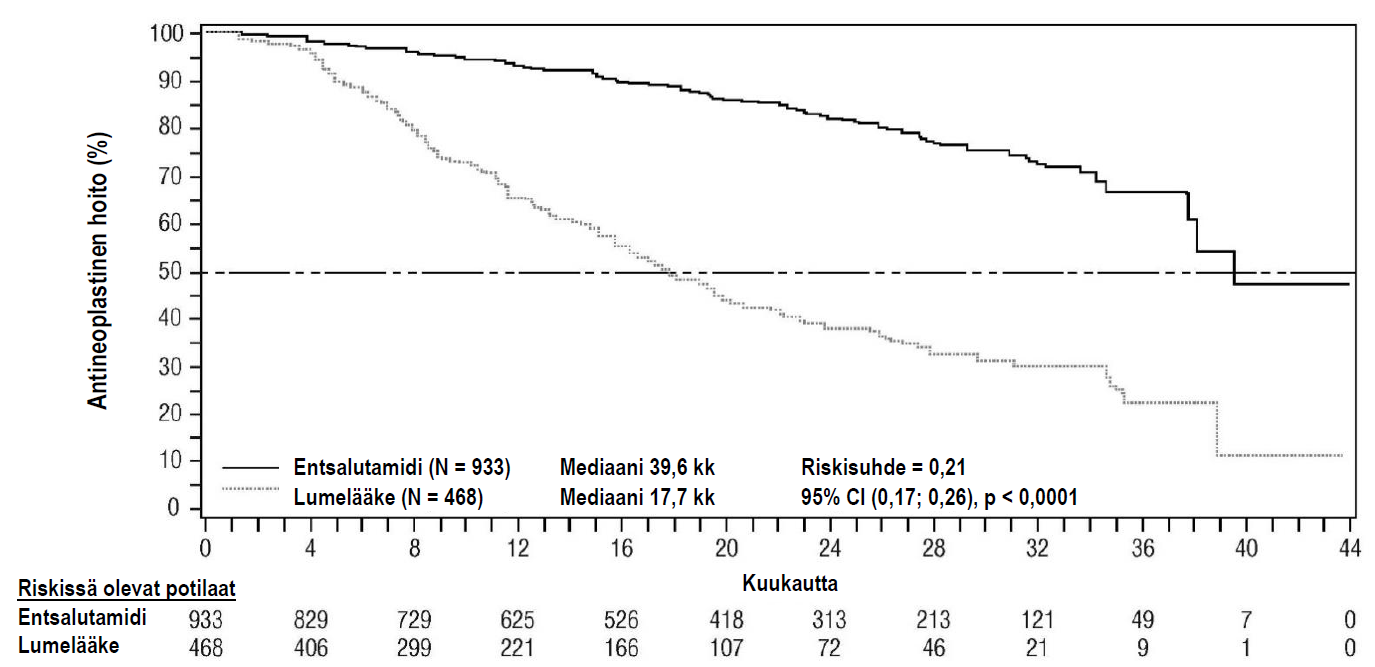
Kuva 7: Kaplan-Meierin menetelmän mukaiset käyrät koskien aikaa ennen ensimmäisen uuden antineoplastisen hoidon aloittamista PROSPER-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
MDV3100-09 (STRIVE) ‑tutkimus (potilaat, jotka eivät aiemmin olleet saaneet kemoterapiaa, ja joilla oli metastaattinen/ei-metastasoitunut CRPC)
STRIVE-tutkimukseen osallistui 396 ei-metastasoitunutta tai metastaattista CRPC:tä sairastavaa potilasta, joilla primääri androgeenideprivaatiohoito ei estänyt serologista tai radiologista sairauden etenemistä, ja jotka satunnaistettiin saamaan kerran vuorokaudessa joko 160 mg entsalutamidia (N = 198) tai 50 mg bikalutamidia (N = 198). Ensisijainen päätetapahtuma oli tautivapaa elossaoloaika (PFS) eli aika, joka kului satunnaistamisesta ensimmäiseen objektiiviseen näyttöön radiologisesta etenemisestä, PSA-etenemiseen tai tutkimuksen aikaiseen kuolemaan. Mediaani PFS oli entsalutamidiryhmässä 19,4 kuukautta (95 % CI: 16,5, ei saavutettu) ja bikalutamidiryhmässä 5,7 kuukautta (95 % CI: 5,6; 8,1) [riskisuhde = 0,24 (95 %:n luottamusväli: 0,18; 0,32), p < 0,0001]. Entsalutamidin johdonmukainen PFS-hyöty bikalutamidiin verrattuna havaittiin kaikissa ennakolta määritetyissä potilasryhmissä. Potilasryhmässä, jossa tauti oli ei-metastasoitunut (N = 139), entsalutamidilla hoidetuista potilaista 19/70 (27,1 %) ja bikalutamidilla hoidetuista potilaista 49/69 (71,0 %) sai PFS-tapahtuman (yhteensä 68 tapahtumaa). Riskisuhde oli 0,24 (95 % CI: 0,14; 0,42), eikä mediaaniaikaa PFS-tapahtumaan saavutettu entsalutamidiryhmässä, kun taas bikalutamidiryhmässä mediaaniaika oli 8,6 kuukautta (ks. kuva 8).
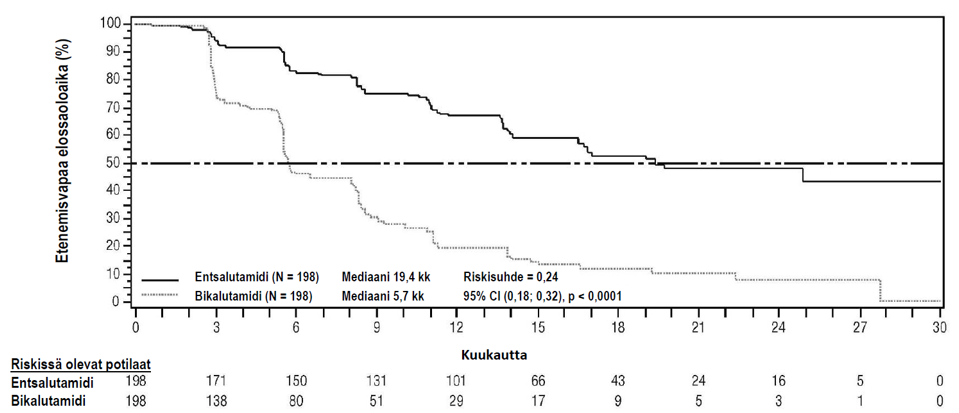
Kuva 8: Kaplan-Meierin menetelmän mukaiset käyrät etenemisvapaasta elossaoloajasta STRIVE-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
9785-CL-0222 (TERRAIN) -tutkimus (potilaat, joilla oli metastaattinen CPRC ja jotka eivät aiemmin olleet saaneet kemoterapiaa)
TERRAIN-tutkimukseen osallistui 375 potilasta, joilla oli metastaattinen CPRC, jotka eivät aiemmin olleet saaneet kemo- tai antiandrogeeniterapiaa, ja jotka satunnaistettiin saamaan kerran vuorokaudessa joko 160 mg entsalutamidia (N = 184) tai 50 mg bikalutamidia (N = 191). PFS:n mediaaniarvo oli entsalutamidipotilailla 15,7 kuukautta ja bikalutamidipotilailla 5,8 kuukautta [riskisuhde = 0,44 (95 %:n luottamusväli: 0,34; 0,57), p < 0,0001]. Tautivapaa elinaika määriteltiin päättyväksi johonkin seuraavista tapahtumista: radiologisesti määritetty taudin eteneminen, jonka arvioi riippumaton keskitetty arvioijataho, luustoon liittyvä tapahtuma, uuden antineoplastisen hoidon aloittaminen tai mistä tahansa syystä aiheutunut kuolema. Tautivapaan elinajan piteneminen havaittiin johdonmukaisesti kaikissa ennalta määritellyissä potilasryhmissä.
MDV3100-03 (PREVAIL) -tutkimus (potilaat, jotka eivät olleet aiemmin saaneet kemoterapiaa, ja joilla oli metastaattinen CRPC)
Yhteensä 1717 oireetonta tai lievästi oireilevaa potilasta, jotka eivät olleet aiemmin saaneet kemoterapiaa, satunnaistettiin (suhteessa 1:1) saamaan joko entsalutamidia suun kautta 160 mg kerran vuorokaudessa (N = 872) tai lumelääkettä suun kautta kerran vuorokaudessa (N = 845). Tutkimukseen saivat osallistua myös potilaat, joilla oli viskeraalinen sairaus, potilaat, joilla oli esiintynyt lievää tai kohtalaista sydämen vajaatoimintaa (NYHA-luokka I tai II) ja epileptisten kohtausten kynnystä alentavia lääkinnällisiä valmisteita käyttävät potilaat. Tutkimuksesta suljettiin pois potilaat, joilla oli aiemmin ollut epileptisiä kohtauksia tai joilla oli jokin mahdollisesti epileptiselle kohtaukselle altistava tila ja potilaat, joilla oli eturauhassyövästä johtuvaa kohtalaista tai vaikeaa kipua. Tutkimushoitoa jatkettiin taudin etenemiseen asti (radiologisesti vahvistettu eteneminen, luustoon liittyvä tapahtuma tai kliininen eteneminen) ja sytotoksisen kemoterapian tai kokeiluasteella olevan lääkehoidon aloittamiseen tai kestämättömien toksisten vaikutusten ilmaantumiseen asti.
Potilaiden demografiset tiedot ja sairautta koskevat lähtötilanteen tiedot olivat samankaltaiset hoitoryhmien välillä. Potilaiden mediaani-ikä oli 71 vuotta (vaihteluväli 42-93) ja potilaiden osuus rodun mukaan jaettuna oli seuraava: 77 % valkoihoisia, 10 % aasialaisia, 2 % mustaihoisia ja 11 % muita tai rotu tuntematon. ECOG-toimintakykyluokka oli kuudellakymmenelläkahdeksalla prosentilla (68 %) potilaista 0 ja 32 %:lla vastaavasti 1. Lähtötilanteen kipuarvio oli 0 ‑ 1 (oireeton) 67 %:lla potilaista ja 2-3 (lievästi oireileva) 32 %:lla potilaista lyhyen BPI-lomakkeen (Brief Pain Inventory) avulla arvioituna (pahin kipu viimeisten 24 tunnin aikana asteikolla 0 - 10). Noin 45 %:lla potilaista oli mitattavissa oleva pehmytkudossairaus tutkimuksen aloitusvaiheessa ja 12 %:lla potilaista oli viskeraalisia etäpesäkkeitä keuhkoissa ja/tai maksassa.
Tutkimuksen ensisijaiset päätetapahtumat olivat kokonaiselossaoloaika ja radiologinen etenemisvapaa aika (rPFS). Ensisijaisten päätetapahtumien lisäksi hoidon hyötyä arvioitiin myös seuraavien kriteerien avulla: aika sytotoksisen kemoterapian aloittamiseen, paras pehmytkudoksen kokonaisvaste, aika ensimmäiseen luustoon liittyvään tapahtumaan, PSA-vaste (≥ 50 %:n lasku lähtötilanteesta), aika PSA-pitoisuuteen perustuvaan etenemiseen ja aika FACT-P:n kokonaispistemäärän heikkenemiseen.
Radiologista etenemistä arvioitiin käyttämällä peräkkäisiä kuvantamistutkimuksia siten kuin on määritelty Prostate Cancer Clinical Trials Working Group 2 (PCWG2) -kriteereissä (luuston osalta) ja/tai Response Evaluation Criteria in Solid Tumors (RECIST v 1.1) -kriteereissä (pehmytkudosleesioiden osalta). rPFS:n analyysissa käytettiin sentraalisesti tarkistettua radiologisesti havainnoidun etenemisen arviointia.
Ennalta määrätty kokonaiselossaoloajan välianalyysi, kun kuolemantapauksia oli todettu 540, osoitti, että entsalutamidihoitoa saaneiden potilaiden kokonaiselossaoloaika oli tilastollisesti merkitsevästi parempi kuin lumelääkettä saaneiden potilaiden. Kuolemanriski väheni 29,4 % [riskisuhde = 0,706; (95 %:n luottamusväli: 0,60; 0,84), p < 0,0001]. Päivitetty elinaika-analyysi tehtiin sen jälkeen, kun kuolemantapauksia oli todettu 784. Tästä analyysista saadut tulokset vastasivat välianalyysin tuloksia (taulukko 5). Päivitetyssä analyysissä 52 % entsalutamidihoitoa saaneista ja 81 % plasebolla hoidetuista potilaista oli saanut jatkohoitoa metastaattiseen kastraatioresistenttiin eturauhassyöpään (CRPC), mikä saattaa pidentää kokonaiselossaoloaikaa.
PREVAIL-tutkimuksesta 5 vuoden aikana kertyneiden tietojen lopullinen analyysi osoitti, että tilastollisesti merkitsevä kokonaiselossaoloajan pidentyminen säilyi entsalutamidihoitoa saaneilla potilailla lumelääkettä saaneisiin potilaisiin verrattuna [riskisuhde = 0,835 (95 %:n CI: 0,75; 0,93); p-arvo = 0,0008] riippumatta siitä, että 28 % lumelääkettä saaneista potilaista siirtyi entsalutamidihoitoon. Viiden vuoden kokonaiselossaoloprosentti oli entsalutamidiryhmässä 26 % ja lumeryhmässä 21 %.
Taulukko 5:Joko entsalutamidi- tai lumelääkehoitoa PREVAIL-tutkimuksessa saaneiden potilaiden kokonaiselossaoloaika (hoitoaikeen [intent-to-treat] mukainen analyysi)
| Entsalutamidi N = 872 | Lumelääke N = 845 | ||
| Ennalta määrätty välianalyysi | |||
| Kuolemantapauksia (%) | 241 (27,6 %) | 299 (35,4 %) | |
| Mediaani elossaoloaika, kuukautta (95 %:n CI) | 32,4 (30,1; NR) | 30,2 (28,0; NR) | |
| P-arvo1 | p < 0,0001 | ||
| Riskisuhde (95 %:n CI)2 | 0,71 (0,60; 0,84) | ||
| Päivitetty eloonjäämisanalyysi | |||
| Kuolemantapauksia (%) | 368 (42,2 %) | 416 (49,2 %) | |
| Mediaani elossaoloaika, kuukautta (95 %:n CI) | 35,3 (32,2; NR) | 31,3 (28,8; 34,2) | |
| p-arvoa | p = 0,0002 | ||
| Riskisuhde (95 %:n CI) b | 0,77 (0,67; 0,88) | ||
| 5 vuoden eloonjäämisanalyysi | |||
| Kuolemantapauksia (%) | 689 (79) | 693 (82) | |
| Mediaani elossaoloaika, kuukautta (95 %:n CI) | 35,5 (33,5; 38,0) | 31,4 (28,9; 33.8) | |
| P-arvo1 | p = 0,0008 | ||
| Riskisuhde (95 %:n CI)2 | 0,835 (0,75; 0,93) | ||
NR= Not reached (ei saavutettu)
| |||
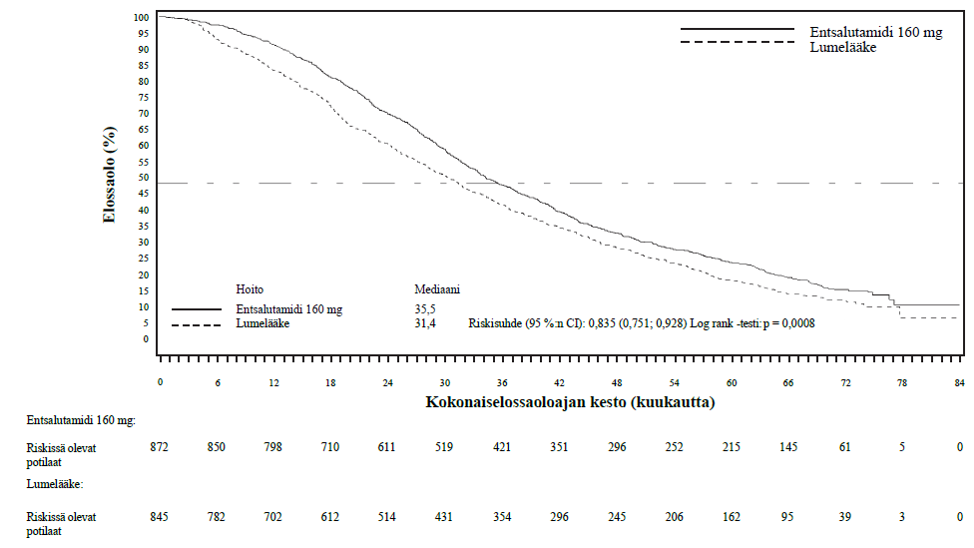
Kuva 9: Kaplan-Meierin menetelmän mukaiset, 5 vuoden kokonaiseloonjäämisanalyysiin perustuvat käyrät kokonaiselinajalle PREVAIL-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
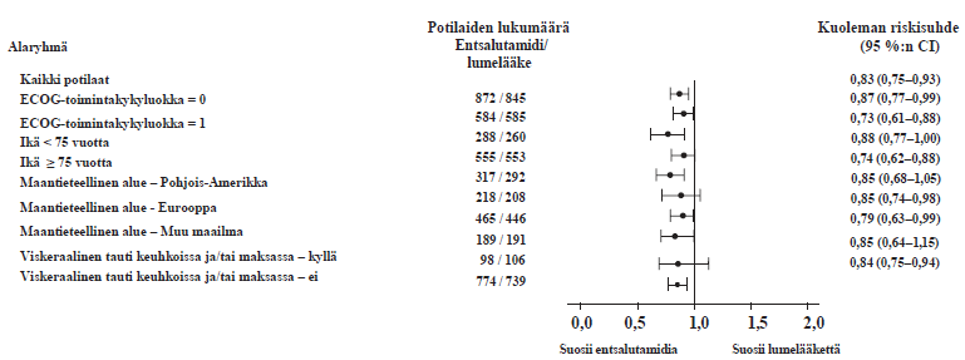
Kuva 10: 5 vuoden analyysi kokonaiselossaoloajasta alaryhmittäin: riskisuhde ja 95 %:n luottamusväli PREVAIL-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
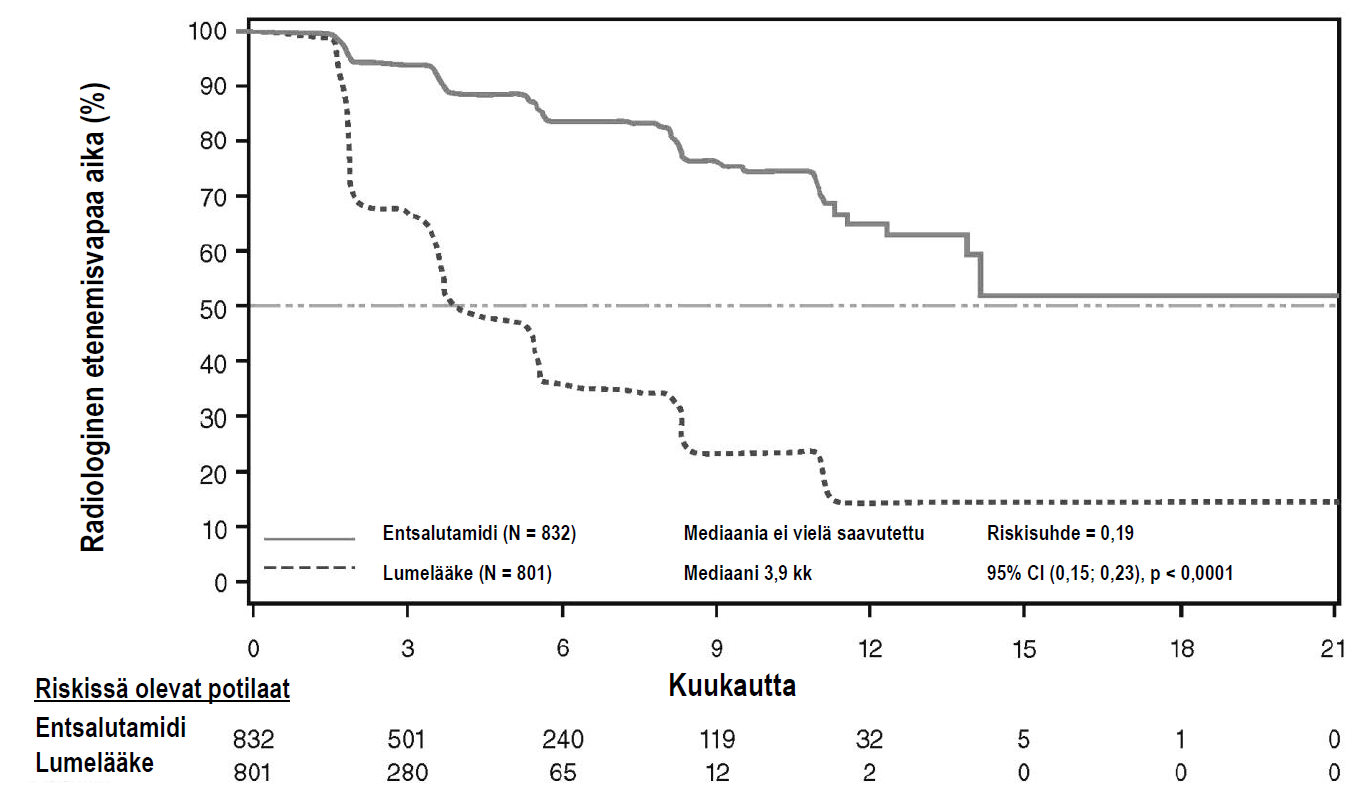
Ennalta määrätty rPFS-analyysi osoitti hoitoryhmien välillä tilastollisesti merkitsevää paranemista: radiologisen etenemisen tai kuoleman riski väheni 81,4 % [riskisuhde = 0,19 (95 %:n luottamusväli: 0,15; 0,23), p < 0,0001]. Entsalutamidihoitoa saaneista potilaista 118:lla (14 %) ja lumelääkettä saaneista 321:lla (40 %) ilmeni jokin tapahtuma. rPFS:n mediaania ei saavutettu (95 %:n luottamusväli: 13,8; ei saavutettu) entsalutamidihoitoa saaneessa ryhmässä ja se oli 3,9 kuukautta (95 %:n luottamusväli: 3,7;5,4; ei saavutettu) lumelääkehoitoa saaneessa ryhmässä (kuva 11). Kaikissa ennalta määrätyissä potilasalaryhmissä (esim. ikä, lähtötilanteen ECOG-toimintakyky, lähtötilanteen PSA ja LDH, Gleasonin pistesumma diagnoosivaiheessa ja viskeraalinen sairaus seulontakäynnillä) havaittiin johdonmukainen rPFS-hyöty. Ennalta määrätyssä rPFS-analyysissa, joka perustui tutkijoiden suorittamaan radiologisen etenemisen arviointiin, todettiin tilastollisesti merkitsevää paranemista hoitoryhmien välillä: radiologisesti havaitun etenemisen tai kuoleman riski väheni 69,3 % [riskisuhde = 0,31 (95 %:n luottamusväli: 0,27; 0,35), p < 0,0001]. rPFS:n mediaani oli 19,7 kuukautta entsalutamidiryhmässä ja 5,4 kuukautta lumelääkeryhmässä.
Ensisijaisen analyysin suorittamishetkellä satunnaistettuja potilaita oli 1633.
Kuva 11: Kaplan-Meierin menetelmän mukaiset, radiologista etenemisvapaata aikaa (rPFS) kuvaavat käyrät (hoitoaikeen [intent-to-treat] mukainen analyysi)
Ensisijaisten tehon päätetapahtumien lisäksi myös seuraavissa prospektiivisesti määritellyissä päätetapahtumissa todettiin tilastollisesti merkitsevää paranemista.
Mediaaniaika sytotoksisen kemoterapian aloittamiseen oli entsalutamidihoitoa saaneilla potilailla 28,0 kuukautta ja lumelääkettä saaneilla potilailla 10,8 kuukautta [riskisuhde = 0,35 (95 %:n luottamusväli: 0,30; 0,40), p < 0,0001].
Niiden entsalutamidihoitoa saaneiden potilaiden, joilla oli lähtötilanteessa mitattavissa oleva sairaus ja jotka saivat objektiivisen pehmytkudosvasteen, osuus oli 58,8 % (95 %:n luottamusväli: 53,8; 63,7), kun lumelääkettä saaneilla vastaava osuus oli 5,0 % (95 %:n luottamusväli: 3,0; 7,7). Objektiivisessa pehmytkudosvasteessa havaittu absoluuttinen ero entsalutamidi- ja lumelääkehaarojen välillä oli 53,9 % (95 %:n luottamusväli: 48,5; 59,1, p < 0,0001). Täydellisiä vasteita raportoitiin 19,7 %:lla entsalutamidilla hoidetuista potilaista, kun vastaava luku lumelääkettä saaneilla potilailla oli 1,0 %, ja osittaisia vasteita raportoitiin 39,1 %:lla entsalutamidilla hoidetuista potilaista, kun vastaava luku lumelääkettä saaneilla potilailla oli 3,9 %.
Entsalutamidi vähensi merkitsevästi ensimmäisen luustoon liittyvän tapahtuman riskiä 28 %:lla [riskisuhde = 0,718 (95 %:n luottamusväli: 0,61; 0,84) p < 0,0001]. Luustoon liittyväksi tapahtumaksi määriteltiin eturauhassyövän vuoksi tehty luun sädehoito tai luukirurgia, patologiset luunmurtumat, selkäytimen kompressio tai luustokivun hoitoon tarkoitetun antineoplastisen hoidon muutokset. Analyysiin sisältyi 587 luustoon liittyvää tapahtumaa, joista 389 tapahtumaa (66,3 %) liittyi luun sädehoitoon, 79 tapahtumaa (13,5 %) selkäytimen kompressioon, 70 tapahtumaa (11,9 %) patologisiin luunmurtumiin, 45 tapahtumaa (7,6 %) luustokivun hoitoon tarkoitetun antineoplastisen hoidon muutoksiin ja 22 tapahtumaa (3,7 %) luukirurgiaan.
Entsalutamidia saavilla potilailla todettiin merkitsevästi korkeampi PSA-pitoisuuden kokonaisvaste (joka määriteltiin ≥ 50 %:n vähenemäksi lähtötilanteesta) verrattuna lumelääkettä saaviin potilaisiin: 78,0 % vs. 3,5 % (ero = 74,5 %, p < 0,0001).
Mediaaniaika PSA-pitoisuuden etenemiseen PCWG-kriteerien mukaisesti oli entsalutamidihoitoa saaneilla potilailla 11,2 kuukautta ja lumelääkettä saaneilla potilailla 2,8 kuukautta [riskisuhde = 0,17 (95 %:n luottamusväli: 0,15; 0,20), p < 0,0001].
Entsalutamidihoito pienensi FACT-P:n heikkenemisen riskiä 37,5 % verrattuna lumelääkkeeseen (p < 0,0001). Mediaaniaika FACT-P:n pienenemiseen oli 11,3 kuukautta entsalutamidiryhmässä ja 5,6 kuukautta lumelääkeryhmässä.
CRPC2 (AFFIRM) -tutkimus (aiemmin kemoterapiaa saaneet potilaat, joilla oli metastaattinen CRPC)
Entsalutamidin tehoa ja turvallisuutta metastaattista CRPC:tä sairastavilla potilailla, jotka olivat saaneet dosetakselia ja käyttivät LHRH-analogia tai joille oli tehty orkiektomia, arvioitiin satunnaistetussa, lumekontrolloidussa, kliinisessä vaiheen III monikeskustutkimuksessa. Yhteensä 1199 potilasta satunnaistettiin (suhteessa 2:1) saamaan joko entsalutamidia suun kautta 160 mg kerran vuorokaudessa (N = 800) tai lumelääkettä kerran vuorokaudessa (N = 399). Potilaat saivat käyttää prednisonia, mutta se ei ollut välttämätöntä (suurin sallittu päivittäinen annos oli 10 mg prednisonia tai vastaavaa valmistetta). Kumpaan tahansa tutkimushaaraan satunnaistettujen potilaiden tuli jatkaa hoitoa, kunnes tauti etenee (etenemiseksi määriteltiin radiologisesti vahvistettu eteneminen tai luustoon liittyvän tapahtuman esiintyminen) ja potilaalle aloitetaan uusi systeeminen antineoplastinen hoito tai kunnes esiintyy haittaavaa toksisuutta tai potilas keskeyttää hoidon.
Seuraavat potilaiden demografiset tiedot ja sairautta koskevat lähtötilanteen tiedot olivat hyvin samankaltaiset hoitoryhmien välillä. Potilaiden mediaani-ikä oli 69 vuotta (vaihteluväli 41–92) ja potilaiden osuus rodun mukaan jaettuna oli seuraava: 93 % valkoihoisia, 4 % mustaihoisia, 1 % aasialaisia ja 2 % muita. ECOG-toimintakykyluokka oli 91,5 %:lla potilaista 0–1 ja 8,5 %:lla potilaista 2. Potilaista 28 %:lla kipu oli BPI (Brief Pain Inventory) -asteikolla arvioituna ≥ 4 (keskiarvo potilaan ilmoittamasta pahimmasta kivusta edellisten 24 tunnin aikana laskettuna seitsemän päivän ajalta ennen satunnaistamista). Useimmilla potilaista (91 %) oli etäpesäkkeitä luustossa ja 23 %:lla oli viskeraalisia etäpesäkkeitä keuhkoissa ja/tai maksassa. Tutkimuksen aloitusvaiheessa 41 %:lla satunnaistetuista potilaista taudin havaittiin edenneen pelkästään PSA-pitoisuuden perusteella ja 59 %:lla todettiin radiologinen löydös taudin etenemisestä. Lähtötilanteessa viisikymmentäyksi prosenttia (51 %) potilaista käytti bisfosfonaatteja.
AFFIRM-tutkimuksesta suljettiin pois potilaat, joilla oli jokin mahdollisesti epileptiselle kohtaukselle altistava tila (ks. kohta Haittavaikutukset) ja lääkkeitä, jonka tiedetään alentavan kohtauskynnystä, tai kliinisesti merkittävä sydän- ja verisuonisairaus, kuten huonossa hoitotasapainossa oleva korkea verenpaine, hiljattain esiintynyt sydäninfarkti tai epästabiili angina pectoris, NYHA (New York Heart Association) -luokan III tai IV sydämen vajaatoiminta (ellei ejektiofraktio ollut ≥ 45 %), kliinisesti merkittävä ventrikulaarinen arytmia tai eteis-kammiokatkos (ilman pysyvää sydämentahdistinta).
Tutkimussuunnitelman ennalta määritetyssä välianalyysissä 520 kuolemantapauksen jälkeen todettiin, että entsalutamidihoitoa saaneiden potilaiden kokonaiselossaoloaika oli tilastollisesti merkitsevästi parempi kuin lumelääkettä saaneiden (taulukko 6 ja kuvat 12 ja 13).
Taulukko 6: Joko entsalutamidiatai lumelääkettä saaneiden potilaiden kokonaiselossaoloaika AFFIRM-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
| Entsalutamidi(N = 800) | Lumelääke (N = 399) | |
| Kuolemantapauksia (%) | 308 (38,5 %) | 212 (53,1 %) |
| Elossaoloajan mediaani (kuukautta) (95 %:n luottamusväli) | 18,4 (17,3; NR) | 13,6 (11,3; 15,8) |
| P-arvo1 | p < 0,0001 | |
| Riskisuhde (HR) (95 %:n luottamusväli)2 | 0,63 (0,53: 0,75) | |
NR = Not reached (ei saavutettu)
| ||
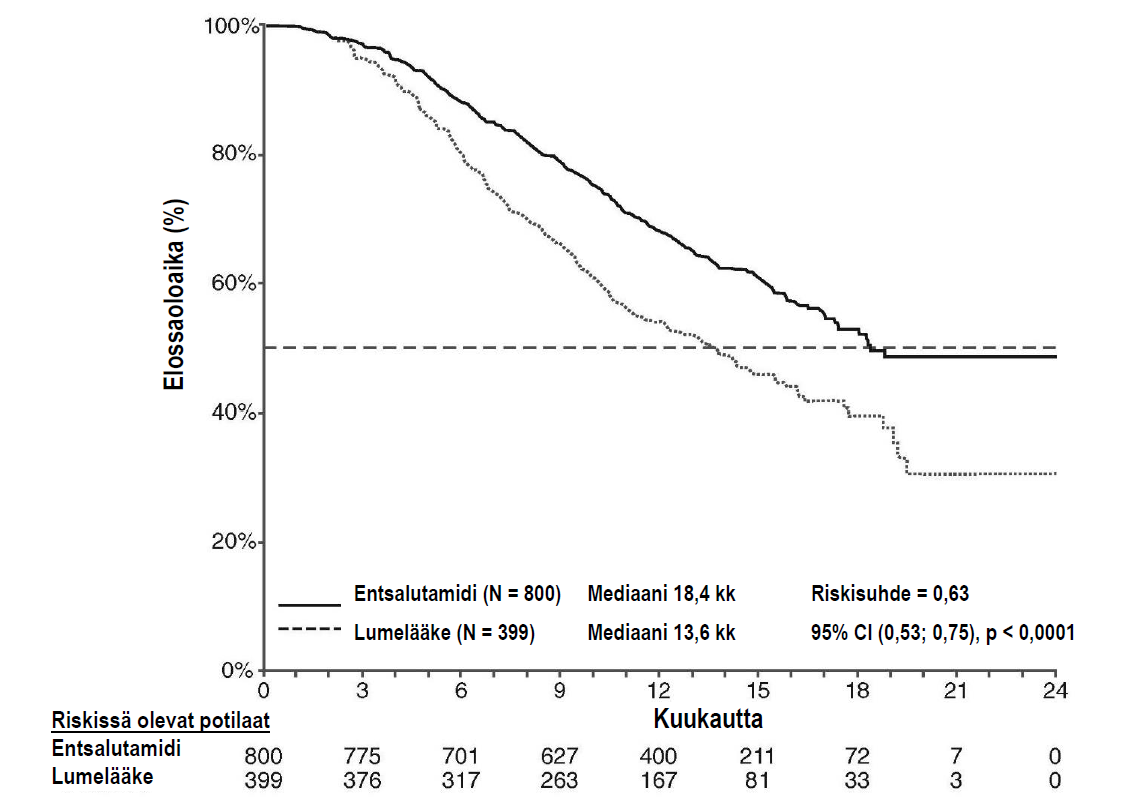
Kuva 12: Kaplan-Meierin menetelmän mukaiset, kokonaiselossaoloaikaa kuvaavat käyrät AFFIRM-tutkimuksessa (hoitoaikeen [intent-to-treat] mukainen analyysi)
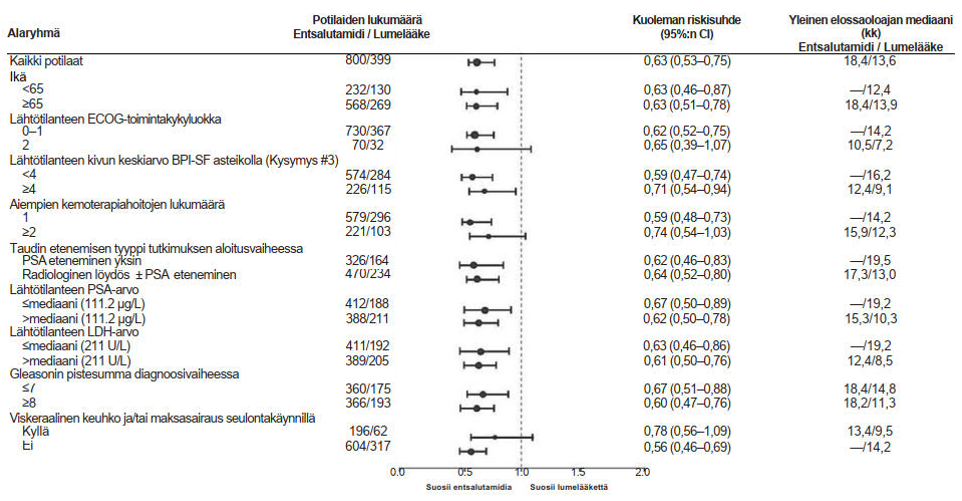
ECOG: Eastern Cooperative Oncology Group; BPI-SF: Brief Pain Inventory-Short Form; PSA: Prostate Specific Antigen
Kuva 13: Kokonaiselossaoloaika alaryhmittäin AFFIRM-tutkimuksessa - riskisuhde ja 95 %:n luottamusväli
Kokonaiselossaoloajan havaitun paranemisen lisäksi tutkimuksen tärkeimmät toissijaiset päätetapahtumat (taudin eteneminen PSA-pitoisuuden perusteella, radiologinen etenemisvapaa aika [rPFS] ja aika ensimmäiseen luustoon liittyvään tapahtumaan) olivat entsalutamidihoidon yhteydessä paremmat ja tilastollisesti merkitsevät monitestausoikaisun jälkeen.
Radiologista etenemisvapaata aikaa arvioitiin pehmytkudosmuutosten osalta RECIST v1.1 ‑kriteereillä (Response Evaluation Criteria in Solid Tumours) ja luuston osalta käyttäen luustokarttatutkimusta (2 tai useampia muutoksia). Entsalutamidihoitoa saaneilla radiologinen etenemisvapaa aika oli 8,3 kuukautta ja lumelääkettä saaneilla 2,9 kuukautta [riskisuhde = 0,40, (95 %:n luottamusväli: 0,35; 0,47); p < 0,0001]. Analyysiin sisältyi 216 kuolemantapausta, joihin ei liittynyt löydöstä taudin etenemisestä ja 645 kuolemantapausta, joihin liittyi löydös taudin etenemisestä. Löydöksistä 303 (47 %) oli pehmytkudosmuutoksia, 268 (42 %) luumuutoksia ja 74 (11 %) sekä pehmytkudos- että luumuutoksia.
Analyysi vahvisti, että PSA-pitoisuus pieneni 50 % tai 90 % entsalutamidia saaneilla potilailla (54 % ja 24,8 %), ja vastaavat luvut lumelääkettä saaneiden ryhmässä olivat 1,5 % ja 0,9 % (p < 0,0001). Mediaaniaika PSA-pitoisuuteen perustuvaan etenemiseen oli entsalutamidihoitoa saaneilla potilailla 8,3 kuukautta ja lumelääkettä saaneilla potilailla 3,0 kuukautta [riskisuhde = 0,25, (95 %:n luottamusväli: 0,20; 0,30); p < 0,0001].
Mediaaniaika ensimmäiseen luustoon liittyvään tapahtumaan oli entsalutamidihoitoa saaneilla potilailla 16,7 kuukautta ja lumelääkettä saaneilla potilailla 13,3 kuukautta [riskisuhde = 0,69 (95 %:n luottamusväli: 0,57; 0,84); p < 0,0001]. Luustoon liittyväksi tapahtumaksi määriteltiin luun sädehoito tai luukirurgia, patologiset luunmurtumat, selkäytimen kompressio tai luustokivun hoitoon tarkoitetun antineoplastisen hoidon muutokset. Analyysiin sisältyi 448 luustoon liittyvää tapahtumaa, joista 277 tapahtumaa (62 %) liittyi luun sädehoitoon, 95 (21 %) selkäytimen kompressioon, 47 (10 %) patologisiin luunmurtumiin, 36 (8 %) luustokivun hoitoon tarkoitetun antineoplastisen hoidon muutoksiin ja 7 (2 %) luukirurgiaan.
9785-CL-0410-tutkimus (entsalutamidia abirateronin jälkeen potilaille, joilla on metastaattinen kastraatioresistentti eturauhassyöpä)
Tutkimuksessa tutkittiin yhtä 214 potilaan ryhmää, jossa potilailla oli etenevä metastaattinen kastraatioresistentti eturauhassyöpä. Potilaat saivat entsalutamidia (160 mg kerran päivässä) vähintään 24 viikon abirateroniasetaatti- ja prednisonihoidon jälkeen. Tutkimukseen ensisijainen päätetapahtuma rPFS:n mediaani oli 8,1 kuukautta (95 % CI: 6,1; 8,3). Kokonaiselossaoloajan mediaania ei saavutettu. PSA-vaste (määrityksenä ≥ 50 %:n aleneminen lähtötilanteesta) oli 22,4 % (95 % CI: 17,0; 28,6). Aiemmin solunsalpaahoitoa saaneiden 69 potilaan rPFS:n mediaani oli 7,9 kuukautta (95 % CI: 5,5; 10,8). PSA-vaste oli 23,2 % (95 % CI: 13,9; 34,9). Niillä 145 potilaalla, jotka eivät aiemmin olleet saaneet solunsalpaajahoitoa, rPFS:n mediaani oli 8,1 kuukautta (95 % CI: 5,7; 8,3). PSA-vaste oli 22,1 % (95 % CI: 15,6; 29,7).
Joillain potilailla entsalutamidihoidon vaste oli abirateronihoidon jälkeen vähäinen, mutta tämän löydöksen syy on vielä tuntematon. Tutkimussuunnitelmassa ei saatu selvitettyä todennäköisesti hyötyviä potilaita, eikä sitä, missä järjestyksessä entsalutamidia ja abirateronia olisi paras antaa.
Iäkkäät potilaat
Kontrolloituihin kliinisiin tutkimuksiin osallistuneesta 5 110:sta entsalutamidia saaneesta potilaasta 3 988 potilasta (78 %) oli iältään 65 vuotta tai vanhempia ja 1 703 potilasta (33 %) oli iältään 75 vuotta tai vanhempia. Yleisluonteisia tehoa ja turvallisuutta koskevia eroja ei havaittu vanhempien ja nuorempien potilaiden välillä.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset entsalutamidin käytöstä eturauhassyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Entsalutamidi liukenee heikosti veteen. Entsalutamidin liukenemista lisäävät kaprylokaproyyli-makrogoliglyseridit, jotka toimivat emulgaattorina/surfaktanttina. Prekliinisissä tutkimuksissa entsalutamidin imeytyminen lisääntyi, kun sitä liuotettiin kaprylokaproyyli-makrogoliglyserideihin.
Entsalutamidin farmakokinetiikkaa on tutkittu eturauhassyöpää sairastavilla potilailla ja terveillä mieshenkilöillä. Entsalutamidin keskimääräinen terminaalinen puoliintumisaika (t1/2) oraalisen kerta-annoksen jälkeen on 5,8 vuorokautta (vaihteluväli 2,8–10,2 vuorokautta), ja vakaa tila saavutetaan noin kuukaudessa. Käytettäessä entsalutamidia päivittäin suun kautta se akkumuloituu noin 8,3‑kertaisesti suhteessa kerta-annokseen. Plasmapitoisuuksien päivittäinen vaihtelu on vähäistä (suurimman ja pienimmän pitoisuuden [peak-to-trough] suhde on 1,25). Entsalutamidin poistuminen tapahtuu pääsääntöisesti maksan kautta metaboloitumalla. Tuloksena oleva aktiivinen metaboliitti on yhtä aktiivinen kuin entsalutamidi ja kiertäessään elimistössä pitoisuus plasmassa on suunnilleen sama kuin entsalutamidilla.
Imeytyminen
Entsalutamidin imeytymistä annettuna suun kautta kalvopäällysteisinä tabletteina arvioitiin terveillä, miespuolisilla vapaaehtoisilla yhden 160 mg:n kalvopäällysteisten Xtandi-tablettien annoksen jälkeen, ja farmakokineettistä mallintamista ja simulaatiota käytettiin ennustamaan farmakokineettinen profiili vakaassa tilassa. Näiden ennusteiden sekä muiden tukevien tietojen perusteella mediaaniaika siihen, että entsalutamidin enimmäispitoisuus plasmassa saavutetaan (Cmax), on kaksi tuntia (alue 0,5‑6 tuntia). Entsalutamidin ja sen aktiivisen metaboliitin vakaan tilan farmakokineettiset profiilit ovat samanlaisia kalvopäällysteissä tableteissa ja Xtandi pehmeä kapseli -muodossa. Pehmeä kapseli -muodon suun kautta ottamisen jälkeen (Xtandi 160 mg päivittäin) potilailla, joilla on metastaattinen kastraatioresistentti eturauhassyöpä, entsalutamidin ja sen aktiivisen metaboliitin vakaan tilan keskimääräiset Cmax–arvot plasmassa ovat 16,6 μg/ml (variaatiokerroin [CV] 23 %) ja 12,7 μg/ml (CV 30 %).
Ihmisillä tehdyn massatasapainotutkimuksen (mass balance study) perusteella suun kautta otetusta entsalutamidista imeytyy vähintään 84,2 %. Entsalutamidi ei ole effluksikuljettajaproteiinien (P-gp tai BCRP) substraatti.
Ruoka ei vaikuta kliinisesti merkittävästi entsalutamidiin. Kliinisissä tutkimuksissa Xtandi-valmistetta käytettiin ruokailusta riippumatta.
Jakautuminen
Entsalutamidin näennäisen jakautumistilavuuden keskiarvo (V/F) oraalisen kerta-annoksen jälkeen on 110 l (CV 29 %). Entsalutamidin jakautumistilavuus on suurempi kuin ihmisen kehossa olevan veden tilavuus, mikä osoittaa suurta ekstravaskulaarista jakautumista. Jyrsijöillä tehdyt tutkimukset viittaavat siihen, että entsalutamidi ja sen aktiivinen metaboliitti voivat läpäistä veri-aivoesteen.
Entsalutamidi sitoutuu plasman proteiineihin (noin 97–98 %), lähinnä albumiiniin. Aktiivinen metaboliitti sitoutuu 95-prosenttisesti plasman proteiineihin. Entsalutamidin ja muiden runsaasti sitoutuvien lääkeaineiden (varfariini, ibuprofeeni ja salisyylihappo) välillä ei havaittu proteiiniin sitoutumisen syrjäyttämistä in vitro.
Biotransformaatio
Entsalutamidi metaboloituu laajasti. Ihmisen plasmassa on havaittu kahta keskeistä metaboliittia: N‑desmetyyli-entsalutamidia (aktiivinen metaboliitti) ja karboksyylihapon johdannaista (inaktiivinen metaboliitti). Entsalutamidi metaboloituu CYP2C8-entsyymin ja vähäisemmässä määrin CYP3A4/5-entsyymin välityksellä (ks. kohta Yhteisvaikutukset). Molemmat entsyymit vaikuttavat aktiivisen metaboliitin muodostumiseen. N-desmetyyli-entsalutamidi metaboloituu in vitro karboksyylihappometaboliitiksi karboksiesteraasi 1:n vaikutuksesta, jolla on vähäinen osuus myös entsalutamidin metaboloitumisessa karboksyylihappometaboliitiksi. N‑desmetyyli-entsalutamidi ei metaboloitunut CYP-entsyymien välityksellä in vitro.
Kliinisissä käyttöolosuhteissa entsalutamidi on CYP3A4:n voimakas indusori ja keskivoimakas CYP2C9:n ja CYP2C19:n indusori. Entsalutamidilla ei ole kliinisesti merkittävää vaikutusta CYP2C8:aan (ks. kohta Yhteisvaikutukset).
Eliminaatio
Entsalutamidin keskimääräinen näennäinen puhdistuma (CL/F) on 0,520–0,564 l/h.
Kun suun kautta annettiin 14C-entsalutamidia, enintään 77 vuorokautta annoksen ottamisesta 84,6 % radioaktiivisuudesta kertyi virtsaan tai ulosteeseen: 71,0 % kertyi virtsaan (pääasiassa inaktiivisena metaboliittina lisäksi jäänteitä entsalutamidista ja aktiivisesta metaboliitista), ja 13,6 % kertyi ulosteeseen (0,39 % annoksesta erittyi muuttumattomana entsalutamidina).
In vitro -tiedot viittaavat siihen, että entsalutamidi ei ole OATP1B1:n, OATP1B3:n tai OCT1:n substraatti ja että N-desmetyyli-entsalutamidi ei ole P-gp:n tai BCRP:n substraatti.
In vitro -tiedot viittaavat siihen, että entsalutamidi ja sen päämetaboliitit eivät kliinisesti merkittävillä pitoisuuksilla estä seuraavia kuljettajaproteiineja: OATP1B1, OATP1B3, OCT2 tai OAT1.
Lineaarisuus
Annossuhteessa ei todettu suuria poikkeamia annosalueella 40–160 mg. Entsalutamidin ja aktiivisen metaboliitin vakaan tilan Cmin-arvot yksittäisillä potilailla pysyivät muuttumattomina yli vuoden jatkuneen hoidon jälkeen. Tämä osoittaa, että entsalutamidin farmakokinetiikka on lineaarinen aikaan nähden, kun vakaa tila on saavutettu.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla ei ole tehty entsalutamidia koskevia virallisia tutkimuksia. Potilaat, joiden seerumin kreatiniiniarvo oli > 177 μmol/l (2 mg/dl), suljettiin pois kliinisistä tutkimuksista. Populaatiofarmakokineettisen analyysin perusteella annoksen muuttaminen ei ole tarpeen, jos potilaan kreatiniinipuhdistuma (CrCL) on ≥ 30 ml/min (arvioituna Cockcroft-Gaultin kaavan avulla). Entsalutamidin käyttöä vaikeaa munuaisten vajaatoimintaa (CrCL < 30 ml/min) tai loppuvaiheen munuaisten vajaatoimintaa sairastavilla potilailla ei ole tutkittu, ja varovaisuutta on noudatettava näitä potilaita hoidettaessa. On epätodennäköistä, että entsalutamidi poistuisi merkittävästi jaksoittaisessa hemodialyysissä tai jatkuvassa vatsakalvodialyysissä.
Maksan vajaatoiminta
Maksan vajaatoiminnalla ei ollut selvää vaikutusta entsalutamidin kokonaisaltistukseen tai sen aktiivisiin metaboliitteihin. Entsalutamidin puoliintumisaika kuitenkin kaksinkertaistui vaikeaa maksan vajaatoimintaa sairastavilla terveisiin verrokkeihin verrattuna (10,4 päivää vs. 4,7 päivää). Tämä liittyy mahdollisesti lisääntyneeseen jakaantumiseen kudoksissa.
Entsalutamidin farmakokinetiikkaa tutkittiin potilailla, joilla oli lähtötilanteessa lievä (N = 6, Child-Pugh-luokka A), keskivaikea (N = 8, Child-Pugh-luokka B) tai vaikea (N = 8, Child-Pugh-luokka C) maksan vajaatoiminta, ja 22:lla verrokkiryhmän kaltaistetulla potilaalla, joiden maksa toimi normaalisti. Suun kautta annetun entsalutamidin 160 mg:n kerta-annoksen jälkeen lievää maksan vajaatoimintaa sairastavilla entsalutamidin AUC-arvo nousi 5 % ja Cmax-arvo 24 % verrattuna terveisiin verrokkihenkilöihin. Vastaavasti keskivaikeaa maksan vajaatoimintaa sairastavilla entsalutamidin AUC-arvo nousi 29 % ja Cmax-arvo laski 11 % terveisiin verrokkihenkilöihin verrattuna. Vaikeaa maksan vajaatoimintaa sairastavilla entsalutamidin AUC-arvo nousi 5 % ja Cmax-arvo laski 41 % terveisiin verrokkihenkilöihin verrattuna. Sitoutumattoman entsalutamidin ja sitoutumattoman aktiivisen metaboliitin AUC- ja Cmax-arvot nousivat yhteensä lievää maksan vajaatoimintaa sairastavilla 14 % ja 19 %. Keskivaikeaa maksan vajaatoimintaa sairastavilla AUC-arvo nousi yhteensä 14 % ja Cmax-arvo laski 17 % terveisiin verrokkeihin nähden.
Vaikeaa maksan vajaatoimintaa sairastavilla AUC-arvo nousi 34 % ja Cmax-arvo laski 27 % terveisiin verrokkeihin nähden.
Rotu
Kontrolloiduissa kliinisissä tutkimuksissa mukana olleista potilaista suurin osa (> 75 %) oli valkoihoisia. Japanilaisilla ja kiinalaisilla eturauhassyöpäpotilailla tehdyistä tutkimuksista saatujen farmakokineettisten tietojen perusteella altistuksessa ei ollut perusjoukkojen välillä kliinisesti merkittäviä eroja. Mahdollisia eroja entsalutamidin farmakokinetiikassa muita rotuja edustavilla potilailla ei voida arvioida, koska tietoja ei ole riittävästi.
Iäkkäät potilaat
Iäkkäiden populaatiofarmakokineettisen analyysin perusteella iällä ei ollut kliinisesti merkittävää vaikutusta entsalutamidin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Tiineiden hiirien entsalutamidihoito lisäsi alkio-/sikiökuolemia, sekä ulkoisia ja luuston muutoksia. Hedelmällisyystutkimuksia ei ole tehty entsalutamidilla, mutta rotilla tehdyissä (4 ja 26 viikon) tutkimuksissa sekä koirilla tehdyissä (4, 13 ja 39 viikon) tutkimuksissa havaittiin lisääntymiselinten atrofiaa, aspermiaa/hypospermiaa ja hypertrofiaa/hyperplasiaa. Tulokset olivat yhdenmukaisia entsalutamidin farmakologisten ominaisuuksien kanssa. Hiirillä (4 viikon tutkimuksissa), rotilla (4 ja 26 viikon tutkimuksissa) ja koirilla (4 13 ja 39 viikon tutkimuksissa) havaitut lisääntymiselinten muutokset, jotka liittyivät entsalutamidin käyttöön, olivat elimen painon väheneminen sekä eturauhasen ja lisäkivesten atrofia. Leydigin solujen hypertrofiaa ja/tai hyperplasiaa havaittiin hiirillä (4 viikon tutkimuksissa) ja koirilla (39 viikon tutkimuksissa). Muita rotilla esiintyneitä lisääntymiselimistön kudosten muutoksia olivat aivolisäkkeen hypertrofia/hyperplasia sekä rakkularauhasen atrofia. Muita koirilla esiintyneitä muutoksia olivat testikulaarinen hypospermia sekä siementiehyiden degeneraatio. Rotan maitorauhasissa havaittiin sukupuolten välisiä eroja (urosrotilla atrofia ja naarasrotilla lobulaarinen hyperplasia). Kummallakin eläinlajilla todetut muutokset lisääntymiselimissä olivat yhdenmukaisia entsalutamidin farmakologisten ominaisuuksien kanssa. Muutokset korjautuivat täysin tai osittain 8 viikon palautumisjakson jälkeen. Kummallakaan eläinlajilla ei esiintynyt kliiniseen patologiaan tai histopatologiaan liittyviä muutoksia minkään muun elinjärjestelmän, mukaan lukien maksan, alueella.
Tiineillä rotilla tehdyt tutkimukset ovat osoittaneet, että entsalutamidi ja/tai sen metaboliitit kulkeutuvat sikiöihin. Kun rotille annettiin suun kautta 30 mg/kg ‑annos (~ 1,9 kertaa ihmisen suurin sallittu annos) radioaktiivisesti merkittyä 14C-entsalutamidia 14. tiineyspäivänä, sikiön radioaktiivisuus oli korkeimmillaan 4 tuntia annon jälkeen, ja se oli alempi kuin emon plasmassa kudos/plasma-suhteen ollessa 0,27. Sikiön radioaktiivisuus väheni niin, että se oli 0,08 kertaa maksimipitoisuus 72 tuntia annon jälkeen.
Imettävillä rotilla tehdyt tutkimukset ovat osoittaneet, että entsalutamidi ja/tai sen metaboliitit erittyvät rotanmaitoon. Kun imettäville rotille annettiin suun kautta 30 mg/kg ‑annos (~ 1,9 kertaa ihmisen suurin sallittu annos) radioaktiivisesti merkittyä 14C-entsalutamidia, maidon radioaktiivisuus oli korkeimmillaan 4 tuntia annon jälkeen, ja se oli jopa 3,54 kertaa korkeampi kuin emon plasmassa. Tutkimustulokset ovat myös osoittaneet, että entsalutamidi ja/tai sen metaboliitit kulkeutuvat rotanpoikasten kudoksiin maidon mukana ja eliminoituvat myöhemmin.
Entsalutamidi ei ollut genotoksinen in vitro- ja in vivo -vakiotestisarjassa. Kuusi kuukautta kestäneessä tutkimuksessa entsalutamidilla ei havaittu karsinogeenistä potentiaalia transgeenisillä rasH2-hiirillä (ei neoplastisia löydöksiä) enintään 20 mg/kg vuorokausiannoksilla (AUC24h ~317 µg · h/ml), mikä vastaa metastaattista CRPC:tä sairastavilla potilailla plasman kliinistä altistusta 160 mg vuorokausiannokselle (AUC24h ~322 µg · h/ml).
Kun rotille annettiin entsalutamidia päivittäin kahden vuoden ajan, neoplastisia löydöksiä ilmeni enemmän. Näihin sisältyi hyvänlaatuinen kateenkorvakasvain, fibroadenooma maitorauhasissa, hyvänlaatuiset välisolukasvaimet kiveksissä ja uroteelin papillooma sekä virtsarakon karsinooma uroksilla; hyvänlaatuinen granuloosasolukasvain naaraiden munasarjoissa ja aivolisäkkeen distaalinen adenooma molemmilla sukupuolilla. Kateenkorvakasvaimen, aivolisäkkeen adenooman ja maitorauhasen fibroadenooman sekä uroteelin papillooman ja virtsarakon karsinooman merkitystä ihmiselle ei voida poissulkea.
Entsalutamidi ei ollut fototoksinen in vitro.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Hypromelloosiasetaattisukkinaatti
Mikrokiteinen selluloosa
Kolloidinen vedetön piidioksidi
Kroskarmelloosinatrium
Magnesiumstearaatti
Tabletin pinnoite
Hypermelloosi
Talkki
Makrogoli (8000)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XTANDI tabletti, kalvopäällysteinen
40 mg (L:ei) 112 fol (2949,38 €)
PF-selosteen tieto
40 mg kalvopäällysteiset tabletit
Pahvinen taittopakkaus, jossa 28 kalvopäällysteistä tablettia sisältävä PVC/PCTFE/alumiini-läpipainopakkaus. Yksi kotelo sisältää 112 kalvopäällysteistä tablettia (4 taittopakkausta).
80 mg kalvopäällysteiset tabletit
Pahvinen taittopakkaus, jossa 14 kalvopäällysteistä tablettia sisältävä PVC/PCTFE/alumiini-läpipainopakkaus. Yksi kotelo sisältää 56 kalvopäällysteistä tablettia (4 taittopakkausta).
Valmisteen kuvaus:
Xtandi – 40 mg kalvopäällysteiset tabletit
Keltaiset, pyöreät, kalvopäällysteiset tabletit, joissa merkintä E 40.
Xtandi – 80 mg kalvopäällysteiset tabletit
Keltaiset, soikeat, kalvopäällysteiset tabletit, joissa merkintä E 80.
Käyttö- ja käsittelyohjeet
Xtandia eivät saa käsitellä muut henkilöt kuin potilas tai hänen hoitajansa. Vaikutusmekanisminsa ja hiirillä todetun alkio- ja sikiötoksisuuden perusteella Xtandi voi vahingoittaa kehittyvää sikiötä. Naisten, jotka ovat raskaana tai voivat tulla raskaaksi, ei pidä käsitellä rikkoutuneita tai vahingoittuneita Xtandi-tabletteja ilman suojavarusteita, esim. suojakäsineitä. Ks. kohta Prekliiniset tiedot turvallisuudesta. Kalvopäällysteisiä tabletteja ei saa pureskella, leikata eikä murskata.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
XTANDI tabletti, kalvopäällysteinen
40 mg 112 fol
- Ylempi erityiskorvaus (100 %). Entsalutamidi: Eturauhassyövän hoito erityisin edellytyksin (1523).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Entsalutamidi: Eturauhassyövän hoito erityisin edellytyksin (3054).
ATC-koodi
L02BB04
Valmisteyhteenvedon muuttamispäivämäärä
05.06.2025
Yhteystiedot
Hatsinanpuisto 8
02600 Espoo
09 8560 6000
www.astellas.fi
