NOVOEIGHT injektiokuiva-aine ja liuotin, liuosta varten 500 IU, 1000 IU, 2000 IU, 3000 IU
Vaikuttavat aineet ja niiden määrät
NovoEight 500 IU injektiokuiva-aine ja liuotin, liuosta varten.
Kukin injektiopullo sisältää nimellisesti 500 IU ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
Liuottamisen jälkeen NovoEight sisältää noin 125 IU/ml ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
NovoEight 1000 IU injektiokuiva-aine ja liuotin, liuosta varten.
Kukin injektiopullo sisältää nimellisesti 1000 IU ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
Liuottamisen jälkeen NovoEight sisältää noin 250 IU/ml ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
NovoEight 2000 IU injektiokuiva-aine ja liuotin, liuosta varten.
Kukin injektiopullo sisältää nimellisesti 2000 IU ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
Liuottamisen jälkeen NovoEight sisältää noin 500 IU/ml ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
NovoEight 3000 IU injektiokuiva-aine ja liuotin, liuosta varten.
Kukin injektiopullo sisältää nimellisesti 3000 IU ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
Liuottamisen jälkeen NovoEight sisältää noin 750 IU/ml ihmisen hyytymistekijä VIII:aa (rDNA), turoktokogi alfaa.
Pitoisuus (IU) määritetään Euroopan Farmakopean (Ph. Eur) kromogeenisella menetelmällä. NovoEight-valmisteen spesifinen aktiivisuus on noin 8 300 IU/mg proteiinia.
Turoktokogi alfa (ihmisen hyytymistekijä VIII (rDNA)) on puhdistettu proteiini, jossa on 1 445 aminohappoa ja jonka molekyylimassa on noin 166 kDA. Se on valmistettu yhdistelmä-DNA-tekniikalla kiinanhamsterin munasarjan soluissa (CHO) siten, että solunviljelyprosessissa, puhdistamisessa tai lopullisessa valmisteessa ei ole käytetty lainkaan ihmisestä tai eläimestä peräisin olevaa proteiinia.
Turoktokogi alfa on rekombinantti ihmisen hyytymistekijä VIII, jonka B-domeeni on lyhennetty (B-domeeni sisältää 21 aminohappoa luonnollisesta, kokopitkästä B-domeenista) ilman muita aminohappojärjestyksen muutoksia.
Apuaine, jonka vaikutus tunnetaan
Tämä lääkevalmiste sisältää liuottamisen jälkeen 30,5 mg natriumia per injektiopullo.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
A-hemofiliapotilaiden (synnynnäinen tekijä VIII -vaje) verenvuotojen hoito ja ennaltaehkäisy.
NovoEight-valmistetta voidaan käyttää kaikille ikäryhmille.
Ehto
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito tulee toteuttaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Hoidon seuranta
Hoidon aikana tekijä VIII -tasojen seuranta on suositeltavaa sopivan annoksen ja injektioiden antotiheyden ohjaamiseksi. Potilaiden yksilöllinen vaste tekijä VIII:lle voi vaihdella, jolloin puoliintumisajat ja saannot vaihtelevat. Kehon painoon perustuvaa annosta voi olla tarpeen säätää, jos potilas on ali- tai ylipainoinen. Aikuisilla potilailla kerta-annoksella tehdyssä farmakokineettisessä tutkimuksessa enimmäisaltistus (Cmax) ja kokonaisaltistus (AUC) suurenivat potilaan painoindeksin suurentuessa, mikä viittaa siihen, että annosta saattaa olla tarpeen säätää. Annosta saattaa olla tarpeen suurentaa alipainoisilla potilailla (painoindeksi < 18,5 kg/m2) ja pienentää lihavilla potilailla (painoindeksi ≥ 30 kg/m2), mutta tietoja ei ole riittävästi täsmällisten annossuositusten antamiseen, ks. kohta Farmakokinetiikka.
Erityisesti suurten leikkausten yhteydessä korvaushoidon tarkka seuranta hyytymistekijämäärityksin (plasman tekijä VIII:n aktiivisuus) on välttämätöntä.
Käytettäessä in vitro -tromboplastiiniaikaan (APTT) perustuvaa yksivaiheista hyytymismääritystä tekijä VIII:n aktiviteetin määrittämiseen potilaiden verinäytteistä sekä APTT-reagenssin tyyppi että käytetty referenssistandardi voivat vaikuttaa merkittävästi plasman tekijä VIII -aktiivisuustuloksiin. APTT:hen perustuvan yksivaiheisen hyytymismäärityksen ja Euroopan farmakopean mukaisen kromogeenisen määrityksen tuloksissa voi myös olla huomattavia eroja. Tällä on merkitystä erityisesti määrityksessä käytettävän laboratorion ja/tai reagenssien vaihtuessa.
Annostus
Korvaushoidon annos ja kesto riippuvat tekijä VIII:n vajeen vaikeusasteesta, vuotokohdasta ja verenvuodon laajuudesta sekä potilaan kliinisestä tilasta.
Tekijä VIII:n annettava yksikkömäärä ilmoitetaan kansainvälisinä yksikköinä (International Unit, IU), mikä on WHO:n tekijä VIII -valmisteiden standardin mukainen. Tekijä VIII:n aktiivisuus plasmassa ilmaistaan joko prosentteina (suhteessa ihmisen normaaliin plasmaan) tai kansainvälisinä yksikköinä (suhteessa plasman tekijä VIII kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) tekijä VIII -aktiivisuutta vastaa tekijä VIII:n määrää millilitrassa ihmisen normaalia plasmaa.
Hoito tarvittaessa
Tarvittavan annoksen laskeminen perustuu empiiriseen havaintoon, että yksi IU tekijä VIII:aa painokiloa kohden nostaa plasman tekijä VIII -aktiivisuutta 2 IU/dl. Tarvittava annos lasketaan käyttämällä seuraavaa kaavaa:
Tarvittava yksikkömäärä = painokilot (kg) x haluttu tekijä VIII:n lisäys (%) (IU/dl) x 0,5 (IU/kg per IU/dl).
Annettavalla annoksella ja annostiheydellä on aina pyrittävä yksilölliseen kliiniseen tehoon.
Seuraavissa verenvuototapahtumissa tekijä VIII -aktiivisuus ei saa laskea alle annetun plasman aktiivisuustason (% normaalista tasosta tai IU/dl) vastaavana ajanjaksona. Seuraavaa taulukkoa voidaan käyttää annostelun ohjeena verenvuodoissa ja leikkauksissa:
Taulukko 1 Annostusohje verenvuodoissa ja leikkauksissa
Verenvuodon aste/kirurgisen toimenpiteen tyyppi | Tarvittava tekijä VIII:n taso (%) (IU/dl) | Annostiheys (tunteja)/hoidon kesto (vuorokausia) |
Verenvuoto | ||
Alkuvaiheen nivelensisäinen, lihaksen tai suun verenvuoto | 20–40 | Toistetaan 12–24 tunnin välein, vähintään 1 vuorokausi, kunnes vuoto ja sen aiheuttama kipu on ohi tai parantunut |
Suurempi nivelensisäinen vuoto, lihasverenvuoto tai verenpurkautuma | 30–60 | Infuusio toistetaan 12–24 tunnin välein 3–4 vuorokauden ajan tai kauemmin, kunnes kipu ja akuutti toimintakyvyttömyys on hävinnyt |
Hengenvaaralliset verenvuodot | 60–100 | Infuusio toistetaan 8–24 tunnin välein, kunnes vaara on ohi |
Leikkaus | ||
Pieni leikkaus, hampaanpoisto mukaan lukien | 30–60 | Joka 24. tunti, vähintään vuorokauden ajan, kunnes potilas on toipunut |
Suuri leikkaus | 80–100 (ennen ja jälkeen leikkauksen) | Infuusio toistetaan 8–24 tunnin välein, kunnes haava on parantunut riittävästi, sitten vielä vähintään 7 vuorokauden ajan, jotta tekijä VIII -aktiivisuus pysyy 30 %–60 %:ssa (IU/dl) |
Ennaltaehkäisy
Vaikeaa A-hemofiliaa sairastavien potilaiden pitkäaikaisessa verenvuotojen ehkäisyssä tavalliset suositellut tekijä VIII -annokset ovat 20–40 IU/kg joka toinen päivä tai 20–50 IU/kg kolme kertaa viikossa. Aikuisille ja nuorille (>12-vuotiaille) voi soveltua pidempi antoväli (40–60 IU/kg joka kolmas päivä tai kaksi kertaa viikossa). Joissain tapauksissa, erityisesti nuorilla potilailla, voivat tätä lyhyemmät annosvälit tai suuremmat annokset olla tarpeen.
Leikkaus
Pediatristen potilaiden leikkaushoidosta on vain vähän kokemusta.
Iäkkäät potilaat
Yli 65-vuotiaiden potilaiden hoidosta ei ole kokemusta.
Pediatriset potilaat
Alle 12-vuotiaiden potilaiden pitkäaikaisessa verenvuotojen ennaltaehkäisyssä suositellaan annoksia 25–50 IU/kg tekijä VIII:aa joka toinen päivä tai 25–60 IU/kg tekijä VIII:aa kolme kertaa viikossa. Yli 12-vuotiaille pediatrisille potilaille annossuositukset ovat samat kuin aikuisille.
Antotapa
Laskimoon.
NovoEight-valmisteen suositeltu infuusionopeus on 1–2 ml/min. Nopeus tulee määritellä siten, ettei injektio aiheuta potilaalle liikaa epämukavuutta.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen liuottamisesta ennen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Aiempi allerginen reaktio hamsterin proteiineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys
Allergiatyyppiset yliherkkyysreaktiot ovat mahdollisia annosteltaessa NovoEight-valmistetta. Valmiste sisältää jäämiä hamsterin proteiineista, mikä voi aiheuttaa joillekin potilaille allergisia reaktioita. Jos yliherkkyysoireita ilmenee, potilaita on neuvottava lopettamaan lääkevalmisteen käyttö välittömästi ja ottamaan yhteyttä lääkäriinsä. Potilaille on kerrottava yliherkkyysreaktioiden ensioireista, joihin kuuluu nokkosihottuma, yleistynyt nokkosihottuma, puristus rinnassa, vinkuva hengitys, matala verenpaine ja anafylaksia.
Mahdollinen sokki hoidetaan normaalin hoitokäytännön mukaisesti.
Inhibiittorit
Tekijä VIII:aa neutraloivien vasta-aineiden (inhibiittoreiden) muodostuminen on A-hemofiliapotilaiden hoidon komplikaatio. Nämä inhibiittorit ovat yleensä IgG-immunoglobuliineja, jotka estävät tekijä VIII:n hyytymistoiminnan ja joiden määrä ilmaistaan Bethesda-yksikköinä (Bethesda Units, BU) plasmamillilitraa kohti käyttäen mukailtua määritystä. Inhibiittoreiden muodostumisen riski riippuu taudin vaikeusasteesta ja altistumisesta tekijä VIII:lle, riskin ollessa suurimmillaan ensimmäisten 50 altistuspäivän aikana. Vaikka inhibiittorien muodostuminen on melko harvinaista, tällainen riski on potilaalla kuitenkin elinikäinen.
Inhibiittorien muodostumisen kliininen merkitys riippuu inhibiittorititteristä. Riittämättömän kliinisen vasteen riski on pienempi, jos potilaalle muodostuu alhaisen titterin inhibiittoreita verrattuna tilanteeseen, jossa potilaalla on korkean titterin inhibiittoreita.
Yleisesti ottaen, kaikkia tekijä VIII:lla hoidettavia potilaita pitää seurata huolellisesti inhibiittoreiden muodostumisen varalta asianmukaisin kliinisin havainnoin ja laboratoriokokein. Inhibiittoreiden muodostuminen täytyy tarkistaa, jos odotettua tekijä VIII -aktiivisuustasoa ei saavuteta tai jos vuotoa ei saada hallintaan sopivalla annoksella. Tekijä VIII -hoito ei ehkä ole tehokas potilailla, joilla on korkeat inhibiittoripitoisuudet, jolloin tulee harkita muita hoitovaihtoehtoja. Sellaisten potilaiden hoito tulee tapahtua hemofilian hoitoon ja tekijä VIII -inhibiittoreihin perehtyneen lääkärin ohjauksessa.
Sydän- ja verisuonitautitapahtumat
Jos potilaalla on sydän- ja verisuonitautitapahtumien riskitekijöitä, korvaushoito tekijä VIII:lla saattaa suurentaa sydän- ja verisuonitautitapahtumien riskiä.
Katetriin liittyvät komplikaatiot
Jos tarvitaan keskuslaskimovälineitä (CVAD), riski keskuslaskimovälineisiin liittyviin komplikaatioihin, mukaan lukien paikalliset tulehdukset, bakteremia ja katetripaikan tromboosi, tulee ottaa huomioon.
Joka kerta kun NovoEight-valmistetta annetaan, suositellaan valmisteen nimen ja eränumeron merkitsemistä muistiin, jotta potilas ja lääkevalmiste-erä voidaan yhdistää toisiinsa.
Pediatriset potilaat
Luetellut varoitukset ja varotoimet koskevat sekä aikuisia että lapsia.
Apuaineeseen liittyviä seikkoja
Tämä lääkevalmiste sisältää liuottamisen jälkeen 30,5 mg natriumia per injektiopullo, mikä vastaa 1,5 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Ihmisen hyytymistekijä VIII (rDNA) ‑valmisteiden ja muiden lääkevalmisteiden välillä ei ole ilmoitettu yhteisvaikutuksia.
Raskaus ja imetys
NovoEight-valmisteella ei ole tehty lisääntymistä koskevia eläinkokeita. Koska A-hemofiliaa esiintyy naisilla vain erittäin harvoin, kokemuksia tekijä VIII:n vaikutuksista raskauteen ja imetykseen ei ole. Tämän vuoksi valmistetta tulee käyttää raskauden ja imetyksen aikana vain, kun valmisteen käyttö on selvästi tarpeellista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
NovoEight-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yliherkkyys- tai allergisia reaktioita (joihin voi kuulua angioedeemaa, infuusiokohdan polttelua ja kirvelyä, vilunväreitä, punoitusta, yleistynyttä nokkosihottumaa, päänsärkyä, nokkosihottumaa, matalaa verenpainetta, uneliaisuutta, pahoinvointia, levottomuutta, sydämen tiheälyöntisyyttä, puristusta rinnassa, kihelmöintiä, oksentelua, vinkuvaa hengitystä), on havaittu harvoin. Nämä oireet voivat joissain tapauksissa johtaa vaikeaan anafylaksiaan (johon liittyy sokki).
Hyvin harvoin on havaittu vasta-aineiden kehittymistä hamsterin proteiineille, mihin liittyy myös yliherkkyysreaktioita.
Neutraloivia vasta-aineita (inhibiittoreita) voi kehittyä hemofilia A -potilaille, jotka saavat tekijä VIII -hoitoa, kuten NovoEight. Jos niitä esiintyy, tila ilmenee kliinisen vasteen riittämättömyytenä. Tällöin suositellaan ottamaan yhteys hemofilian hoitoon erikoistuneeseen hoitopaikkaan.
Taulukoitu haittavaikutusluettelo
Alla oleva taulukko on MedDRA:n elinjärjestelmäluettelon mukainen (SOC (elinjärjestelmäluokka) ja Preferred Term -taso).
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 2 Haittavaikutusten esiintymistiheys kliinisissä tutkimuksissa
Elinjärjestelmäluokka | Esiintymistiheysa (PTP) | Esiintymistiheysa (PUP) | Haittavaikutus |
Veri ja imukudos | Melko harvinainenb | Hyvin yleinenb | Tekijä VIII:n inhibitio |
Psyykkiset häiriöt | Melko harvinainen | Unettomuus | |
Hermosto | Melko harvinainen | Päänsärky, huimaus, polttava tunne | |
Sydän | Melko harvinainen | Sinustakykardia, akuutti sydäninfarkti | |
Verisuonisto
| Melko harvinainen | Hypertensio, lymfedeema, hyperemia | |
| Yleinen | Punastuminen, pinnallinen laskimontukkotulehdus | |
Iho ja ihonalainen kudos |
| Yleinen | Ihottuma, punoittava ihottuma |
| Melko harvinainen | Ihottuma, likenoidi keratoosi, polttava tunne ihossa | ||
Luusto, lihakset ja sidekudos | Melko harvinainen | Lihasten ja luuston jäykkyys, artropatia, raajakipu, lihas- ja luustokipu | |
| Yleinen | Verinivel, lihasverenvuoto | ||
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Yskä | |
Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Pistoskohdan reaktiotc | |
| Yleinen | Kuume, katetripaikan punoitus | ||
Melko harvinainen | Uupumus, kuumotus, raajaturvotus, kuume | ||
Tutkimukset | Yleinen | Maksaentsyymien nousud | |
| Yleinen | Tekijä VIII -vasta-ainetesti positiivinen | ||
| Melko harvinainen | Takykardia | ||
| Ruoansulatuselimistö | Yleinen | Oksentelu | |
Vammat ja myrkytykset | Yleinen | Annostusvirhe | |
| Yleinen | Infuusioon liittyvä reaktio | ||
| Melko harvinainen | Ruhjevamma | ||
| Valmisteeseen liittyvät häiriöt | Yleinen | Tromboosi antolaitteessa |
a Laskettu kaikissa kliinisissä tutkimuksissa olleiden yksittäisten potilaiden kokonaismäärästä (301), joista 242 oli aiemmin hoidettua potilasta (PTP) ja 60 oli aiemmin hoitamatonta potilasta (PUP).
b Yleisyys perustuu kaikilla tekijä VIII -valmisteilla tehtyihin tutkimuksiin, joihin osallistui vaikeaa hemofilia A:ta sairastavia potilaita.
c Pistoskohdan reaktioihin kuuluvat pistoskohdan punoitus, verenvuoto pistoskohdasta ja pistoskohdan kutina.
d Kohonneisiin maksaentsyymeihin sisältyvät alaniiniaminotransferaasi, aspartaattiaminotransferaasi, gamma-glutamyylitransferaasi ja bilirubiini.
Valikoitujen haittavaikutusten kuvaus
Kaikkien NovoEight-valmisteella tehtyjen kliinisten tutkimusten aikana aiemmin hoidetuilla potilailla raportoitiin 35 haittavaikutusta 23:lla NovoEight-valmistetta saaneella potilaalla 242:sta. Useimmin raportoidut haittavaikutukset olivat pistospaikan reaktiot, annostusvirhe ja maksaentsyymien nousu. 35:stä haittavaikutuksesta kaksi raportoitiin yhdellä alle 6-vuotiaalla potilaalla 31:stä, 6 – ≤ 12 vuoden ikäisillä potilailla ei raportoitu yhtään haittavaikutusta, yksi tapahtuma raportoitiin yhdellä potilaalla 24:stä (12 – < 18-vuoden ikäisillä) ja 32 raportoitiin 21:llä aikuisella (≥ 18 vuoden ikäisillä) 155:stä.
Pediatriset potilaat
Kliinisissä tutkimuksissa, joihin osallistui 63 vaikeaa A-hemofiliaa sairastavaa aiemmin hoidettua pediatrista 0–12-vuotiasta potilasta ja 24 nuorta iältään 12–18 vuotta, ei NovoEight-valmisteen turvallisuusprofiilissa huomattu eroa pediatristen potilaiden ja aikuisten välillä.
Aiemmin hoitamattomilla 0–6-vuotiailla potilailla tehdyssä tutkimuksessa raportoitiin yhteensä 46 haittavaikutusta 33:lla 60:stä NovoEight-valmistetta saaneesta potilaasta. Useimmin raportoidut haittavaikutukset olivat tekijä VIII:n inhibitio, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. Korkean riskin geneettisiä mutaatioita todettiin 92,3 %:lla kaikista potilaista ja 93,8 % potilaista, joilla oli vahvistetusti korkean titterin inhibiittoreita. Inhibiittoreiden muodostumiseen ei liittynyt muita merkittäviä tekijöitä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yhdistelmä-DNA-tekniikalla valmistetusta hyytymistekijä VIII:stä ei ole raportoitu yliannostusoireita.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: veren hyytymistekijät, hyytymistekijä VIII, ATC-koodi: B02BD02.
Vaikutusmekanismi
NovoEight sisältää turoktokogi alfaa, ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), jonka B-domeeni on lyhennetty. Tällä glykoproteiinilla on aktivoituna sama rakenne kuin ihmisen tekijä VIII:llä ja sen posttranslationaaliset modifikaatiot ovat samankaltaisia plasmaperäisen molekyylin kanssa. Von Willebrand -tekijän sitoutumisessa tärkeässä Tyr1680:ssa (natiivi täyspitkä) olevan tyrosiinisulfaatiopaikan on huomattu olevan täysin sulfatoitunut turoktokogi alfa -molekyylissä. Kun tekijä VIII:aa annetaan infuusiona hemofiliapotilaalle, se sitoutuu endogeeniseen von Willebrand -tekijään potilaan verenkierrossa. Tekijä VIII/von Willebrand -tekijän kompleksi koostuu kahdesta molekyylistä (tekijä VIII ja von Willebrand -tekijä), joilla on erilaiset fysiologiset toiminnot. Aktivoitu tekijä VIII toimii aktivoidun tekijä IX:n kofaktorina kiihdyttäen tekijä X:n muuttumista aktivoiduksi tekijä X:ksi. Aktivoitu tekijä X muuntaa protrombiinin trombiiniksi. Trombiini puolestaan muuttaa fibrinogeenin fibriiniksi ja hyytymä voi muodostua. A‑hemofilia on sukupuoleen kytkeytynyt perinnöllinen verenhyytymishäiriö, joka johtuu alentuneista tekijä VIII:C:n tasoista ja joka johtaa veren runsaaseen vuotamiseen niveliin, lihaksiin tai sisäelimiin joko itsestään tai vamman tai kirurgisen toimenpiteen seurauksena. Korvaushoidolla tekijä VIII:n plasmatasot nousevat ja näin tekijän vaje voidaan tilapäisesti korjata ja verenvuotoalttiutta hillitä.
On huomattava, että vuosittainen verenvuotojen määrä (annualised bleeding rate, ABR) ei ole verrannollinen eri hyytymistekijäkonsentraattien välillä eikä eri kliinisten tutkimusten välillä.
Kliininen teho
NovoEight-valmisteen turvallisuutta ja tehoa verenvuotojen ehkäisyssä ja hoidossa ja leikkauksen aikana vaikeaa (FVIII:n aktiivisuus ≤ 1 %) A-hemofiliaa sairastavilla potilailla on tutkittu neljässä avoimessa monikeskustutkimuksessa, joissa ei ollut kontrolliryhmää. Kolme näistä tutkimuksista tehtiin aiemmin hoidetuilla potilailla ja neljäs tutkimus aiemmin hoitamattomilla potilailla. Tutkimuksissa oli 298 NovoEight-valmistetta saanutta potilasta; 175 nuorta (12-vuotiaasta lähtien) tai aikuista potilasta, joilla ei ollut inhibiittoreita (≥ 150 altistuspäivää), 63 aiemmin hoidettua alle 12-vuotiasta pediatrista potilasta, joilla ei ollut inhibiittoreita (≥ 50 altistuspäivää) ja 60 aiemmin hoitamatonta alle 6-vuotiasta potilasta.
188 potilasta 238:sta aiemmin hoidetusta potilaasta jatkoi turvallisuustutkimukseen. NovoEight-hoito osoittautui turvalliseksi ja sillä oli haluttu verenvuotoja tyrehdyttävä ja ehkäisevä teho. 298:lla potilaalla raportoitiin yhteensä 3 293 vuototapahtumaa, joista 2 902 (88,1 %) hoitui 1–2:lla NovoEight-infuusiolla.
Taulukko 3 NovoEight-valmisteen käyttö ja hemostaattiset onnistumisasteet aiemmin hoitamattomilla potilailla (PUP) ja aiemmin hoidetuilla potilailla (PTP)
Nuoremmat lapset (0 - <6 vuotta) PUP | Nuoremmat lapset (0 - <6 vuotta) PTP | Vanhemmat lapset (6 - <12 vuotta) PTP | Nuoret (12 - <18 vuotta) PTP | Aikuiset (≥18 vuotta) PTP | Yhteensä | |
Potilasmäärä | 60 | 31 | 32 | 24 | 151 | 298 |
Ennaltaehkäisyyn käytetty annos/ potilas (IU/kg) Keskiarvo (SD) Minimi; maksimi | 45,2 (14,4) 4,5 ; 363,8 | 41,5 (8,1) 3,4 ; 196,3 | 38,4 (9,4) 3,2 ; 62,5 | 28,5 (9,3) 17,4 ; 73,9 | 28,5 (8,3) 12,0 ; 97,4 | 32,8 (10,9) 3,2 ; 363,8 |
Vuodon hoitoon käytetty annos (IU/kg) Keskiarvo (SD) Minimi; maksimi | 43,6 (15,2) 11,9 ; 118,9 | 44,0 (12,6) 21,4 ; 193,8 | 40,4 (10,5) 24,0 ; 71,4 | 29,3 (10,3) 12,4 ; 76,8 | 35,0 (12,3) 6,4 ; 104,0 | 37,5 (13,4) 6,4 ; 193,8 |
Onnistumisastea % | 87,0 % | 92,2 % | 88,4 % | 85,1 % | 89,6 % | 88,9 % |
SD: Standard deviation, keskihajonta
a Onnistuminen on määritelty joko ’Erinomainen’ tai ’Hyvä’.
Ennen myyntiluvan myöntämistä saadut kliiniset tiedot vahvistettiin myyntiluvan myöntämisen jälkeen tehdyssä ei-interventionaalisessa turvallisuustutkimuksessa, jonka tarkoituksena oli saada lisää näyttöä NovoEight-valmisteen immunogeenisuudesta, tehosta ja turvallisuudesta rutiininomaisessa kliinisessä käytännössä. Yhteensä 68 aiemmin hoidettua potilasta (> 150 altistuspäivää), joista 14 oli alle 12-vuotiaita ja 54 oli vähintään 12-vuotiaita, sai hoitoa joko tarvittaessa (N = 5) tai ennaltaehkäisevästi (N = 63) yhteensä 87,8 potilasvuoden ja 8 967 altistuspäivän ajan.
Kirurgiset toimenpiteet
Yhteensä 30 kirurgista toimenpidettä suoritettiin 25:lle potilaalle. Näistä 26 oli suuria leikkauksia ja neljä oli pienempiä. Verenvuodon tyrehtyminen onnistui kaikissa leikkauksissa eikä hoidon epäonnistumisia raportoitu.
Tietoja immunologisen toleranssin induktiosta (ITI) on kerätty A-hemofiliaa sairastavilta potilailta, joilla oli kehittynyt tekijä VIII:n inhibiittoreita. Aiemmin hoitamattomilla potilailla tehdyn kliinisen tutkimuksen aikana 21 potilasta sai ITI-hoitoa ja 18 potilaalla (86 %) inhibiittoritestin tulos oli negatiivinen ITI-hoidon päätyttyä.
Farmakokinetiikka
Kaikki NovoEight-valmisteella tehdyt farmakokineettiset tutkimukset on tehty laskimoon annetun NovoEight-valmisteen annoksella 50 IU/kg aiemmin hoidetuilla potilailla, joilla oli vaikea A-hemofilia (tekijä VIII:aa ≤ 1 %). Plasmanäytteet analysoitiin käyttäen sekä yksivaiheista hyytymiskoetta että kromogeenista määritystä.
NovoEight-valmisteen suoriutumista tutkittiin tekijä VIII:C-määrityksissä ja sitä verrattiin markkinoilla olevan, täyspitkän yhdistelmä-DNA-menetelmällä valmistetun tekijä VIII -valmisteen määrityksiin. Tutkimus osoitti, että molempien valmisteiden tulokset olivat verrannollisia ja yhteneväisiä ja että NovoEight voidaan luotettavasti mitata verestä ilman erillistä NovoEight-standardia.
NovoEight-kerta-annoksen farmakokineettiset parametrit on lueteltu taulukossa 4 (yksivaiheinen hyytymiskoe) ja taulukossa 5 (kromogeeninen määritys).
Taulukko 4 NovoEight-valmisteen kerta-annoksen (50 IU/kg) farmakokineettiset parametrit iän mukaan - yksivaiheinen hyytymiskoe, keskiarvo (SD)
Parametri | 0 - < 6 vuotta | 6 - < 12 vuotta | ≥ 12 vuotta |
n=14 | n=14 | n=33 | |
Inkrementaalinen saanto (IU/dl)/(IU/kg) | 1,8 (0,7) | 2,0 (0,4) | 2,2 (0,4) |
AUC ((IU*h)/dl) | 992 (411) | 1 109 (374) | 1 526 (577) |
CL (ml/h/kg) | 6,21 (3,66) | 5,02 (1,68) | 3,63 (1,09) |
t½ (h) | 7,65 (1,84) | 8,02 (1,89) | 11,00 (4,65) |
Vss (ml/kg) | 56,68 (26,43) | 46,82 (10,63) | 47,40 (9,21) |
Cmax (IU/dl) | 100 (58) | 107 (35) | 123 (41) |
Keskiviipymäaika, MRT (h) | 9,63 (2,50) | 9,91 (2,57) | 14,19 (5,08) |
Lyhenteet: AUC = tekijä VIII:n aktiivisuutta ajan funktiona kuvaavan käyrän alla oleva pinta-ala; CL = puhdistuma; t1/2 = terminaalinen puoliintumisaika; Vss = jakautumistilavuus vakaassa tilassa; Cmax = tekijä VIII:n enimmäisaktiivisuus.
Taulukko 5 NovoEight-valmisteen kerta annoksen (50 IU/kg) farmakokineettiset parametrit iän mukaan - kromogeeninen määritys, keskiarvo (SD)
Parametri | 0 - < 6 vuotta | 6 - < 12 vuotta | ≥ 12 vuotta |
n=14 | n=14 | n=33 | |
Inkrementaalinen saanto (IU/dl)/(IU/kg) | 2,2 (0,6) | 2,5 (0,6) | 2,9 (0,6) |
AUC ((IU*h)/dl) | 1 223 (436) | 1 437 (348) | 1 963 (773) |
CL (ml/h/kg) | 4,59 (1,73) | 3,70 (1,00) | 2,86 (0,94) |
t½ (h) | 9,99 (1,71) | 9,42 (1,52) | 11,22 (6,86) |
Vss (ml/kg) | 55,46 (23,53) | 41,23 (6,00) | 38,18 (10,24) |
Cmax (IU/dl) | 112 (31) | 125 (27) | 163 (50) |
Keskiviipymäaika, MRT (h) | 12,06 (1,90) | 11,61 (2,32) | 14,54 (5,77) |
Lyhenteet: AUC = tekijä VIII:n aktiivisuutta ajan funktiona kuvaavan käyrän alla oleva pinta-ala; CL = puhdistuma; t1/2 = terminaalinen puoliintumisaika; Vss = jakautumistilavuus vakaassa tilassa; Cmax = tekijä VIII:n enimmäisaktiivisuus.
Farmakokineettiset parametrit olivat verrannollisia alle 6-vuotiaiden pediatristen potilaiden ja 6–12-vuotiaiden pediatristen potilaiden välillä. NovoEight-valmisteen farmakokineettisissä parametreissä havaittiin joitain eroja pediatristen ja aikuispotilaiden välillä. A-hemofiliaa sairastavien pediatristen potilaiden aikuispotilaita korkeampi puhdistuma (CL) ja lyhempi puoliintumisaika (t½) voivat osittain johtua nuorempien potilaiden tiedetystä suuremmasta plasmatilavuudesta painokiloa kohden.
Eri painoindeksiluokkiin kuuluville 35 (vähintään 18-vuotiaalle) hemofiliapotilaalle tehtiin farmakokineettinen tutkimus kerta-annoksella (50 IU/kg). Enimmäisaltistus (Cmax) ja kokonaisaltistus (AUC) suurenivat potilaan painoindeksin (BMI) suurentuessa, mikä viittaa siihen, että annosta saattaa olla tarpeen säätää alipainoisilla (BMI < 18,5 kg/m2) ja lihavilla (BMI ≥ 30 kg/m2) potilailla, ks. kohta Annostus ja antotapa.
Taulukko 6 NovoEight-valmisteen kerta-annoksen (50 IU/kg) farmakokineettiset parametrit painoindeksiluokkiena mukaan - yksivaiheinen hyytymiskoe, keskiarvo (SD)
Farmakokineettinen parametri | Alipaino | Normaalipaino | Ylipaino | Lihavuusluokka I | Lihavuusluokka II/III |
Inkrementaalinen saanto (IU/dl)/(IU/kg) | 1,7 (0,2) | 2,0 (0,2) | 2,4 (0,4) | 2,3 (0,3)b | 2,6 (0,3) |
AUC ((IU*h)/dl) | 1 510 (360) | 1 920 (610) | 1 730 (610) | 2 030 (840) | 2 350 (590) |
CL (ml/h/kg) | 3,91 (0,94) | 3,20 (1,00) | 3,63 (1,24) | 3,37 (1,79) | 2,51 (0,63) |
t½ (h) | 11,3 (2,0) | 11,7 (3,5) | 9,4 (2,9) | 11,2 (3,5) | 11,1 (2,7) |
Vss (ml/kg) | 56,8 (5,4) | 44,8 (6,5) | 39,6 (6,0) | 42,0 (9,0) | 35,0 (4,6) |
Cmax (IU/dl) | 100 (11) | 121 (10) | 144 (26) | 140 (21) | 161 (32) |
Keskiviipymäaika (h) | 15,1 (3,0) | 15,3 (4,8) | 11,9 (3,7) | 14,4 (4,6) | 14,6 (3,7) |
a Painoindeksiluokat: alipaino: BMI < 18,5 kg/m2, normaalipaino: BMI 18,5–24,9 kg/m2, ylipaino: BMI 25–29,9 kg/m2, lihavuusluokka I: BMI 30–34,9 kg/m2, lihavuusluokka II/III: BMI ≥ 35 kg/m2.
b Perustuu ainoastaan 6 potilaan tietoihin.
Taulukko 7 NovoEight-valmisteen kerta-annoksen (50 IU/kg) farmakokineettiset parametrit painoindeksiluokkiena mukaan - kromogeeninen määritys, keskiarvo (SD)
Farmakokineettinen parametri | Alipaino | Normaalipaino | Ylipaino | Lihavuusluokka I | Lihavuusluokka II/III |
Inkrementaalinen saanto (IU/dl)/(IU/kg) | 2,2 (0,4) | 2,9 (0,3) | 3,0 (0,5) | 3,2 (0,5) | 3,5 (0,5) |
AUC ((IU*h)/dl) | 1 860 (700) | 2 730 (860) | 2 310 (1 020) | 2 780 (1 210) | 3 050 (730) |
CL (ml/h/kg) | 3,28 (0,87) | 2,25 (0,73) | 2,84 (1,09) | 2,58 (1,56) | 1,94 (0,52) |
t½ (h) | 11,7 (2,4) | 11,5 (3,6) | 9,7 (3,4) | 10,4 (3,2) | 10,5 (2,5) |
Vss (ml/kg) | 49,1 (10,4) | 31,2 (4,5) | 31,6 (5,8) | 28,9 (5,1) | 25,7 (4,0) |
Cmax (IU/dl) | 138 (29) | 185 (24) | 194 (31) | 200 (33) | 227 (32) |
Keskiviipymäaika (h)) | 15,5 (3,2) | 15,2 (4,9) | 12,6 (4,8) | 13,5 (4,6) | 13,9 (3,7) |
a Painoindeksiluokat: alipaino: BMI < 18,5 kg/m2, normaalipaino: BMI 18,5–24,9 kg/m2, ylipaino: BMI 25–29,9 kg/m2, lihavuusluokka I: BMI 30–34,9 kg/m2, lihavuusluokka II/III: BMI ≥ 35 kg/m2.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmiselle.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: Natriumkloridi, L-histidiini, sakkaroosi, polysorbaatti 80, L-metioniini, kalsiumklorididihydraatti, natriumhydroksidi (pH:n säätämiseen), kloorivetyhappo (pH:n säätämiseen)
Liuotin: Natriumkloridi, injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo:
30 kuukautta kun se säilytetään jääkaapissa (2 °C - 8 °C).
Kestoajan aikana valmistetta voidaan säilyttää:
-
huoneenlämmössä (≤ 30 °C) yhtäjaksoisesti enintään yhdeksän kuukautta
tai - huoneenlämpötilan yläpuolella (30 °C - 40 °C) yhtäjaksoisesti enintään kolme kuukautta.
Kun valmiste on otettu pois jääkaapista, sitä ei saa laittaa takaisin jääkaappiin.
Merkitse pakkaukseen säilytyslämpötila ja päivämäärä, jolloin valmiste on siirretty säilytyslämpötilaan.
Liuottamisen jälkeen:
Kemiallinen ja fysikaalinen säilyvyys käytön aikana on osoitettu:
- 24 tuntia säilytettynä 2 °C - 8 °C:ssa
- 4 tuntia säilytettynä 30°C:ssa valmisteelle, joka on säilytetty huoneenlämmössä (≤ 30 °C) yhtäjaksoisesti enintään yhdeksän kuukautta
- 4 tuntia säilytettynä korkeintaan 40 °C:ssa valmisteelle, joka on säilytetty huoneenlämpötilan yläpuolella (30 °C - 40 °C) yhtäjaksoisesti enintään kolme kuukautta.
Mikrobiologiselta kannalta valmiste on käytettävä heti liuottamisen jälkeen. Mikäli valmistetta ei käytetä heti, käytön aikainen säilytysaika ja -olosuhteet ovat käyttäjän vastuulla eivätkä normaalisti saisi ylittää yllä mainittuja aikoja, ellei liuottamista ole tehty kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Käyttämätön, liuotettu lääkevalmiste, jota säilytetään huoneenlämmössä (≤ 30 °C) tai korkeintaan 40 °C:ssa kauemmin kuin 4 tuntia, tulee hävittää.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C).
Ei saa jäätyä.
Säilytä injektiopullo ulkopakkauksessa valolta suojattuna.
Säilytys huoneenlämmössä (≤ 30 °C) tai korkeintaan 40 °C:ssa ja säilytysolosuhteet lääkevalmisteen liuottamisen jälkeen: ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NOVOEIGHT injektiokuiva-aine ja liuotin, liuosta varten
500 IU (L:ei) 1 pakkaus (125 IU/ml) (375,16 €)
1000 IU (L:ei) 1 pakkaus (250 IU/ml) (717,79 €)
2000 IU (L:ei) 1 pakkaus (500 IU/ml) (1384,44 €)
3000 IU (L:ei) 1 pakkaus (750 IU/ml) (2041,77 €)
PF-selosteen tieto
Jokainen NovoEight 500 IU, 1000 IU, 2000 IU ja 3000 IU injektiokuiva-aine- ja liuotinpakkaus sisältää:
- 1 lasinen (tyyppi I) injektiopullo, jossa on kuiva-ainetta ja kumitulppa (klorobutyyliä)
- 1 steriili injektiopulloliitin liuottamista varten
- 1 esitäytetty ruisku, jossa on 4 ml liuotinta ja joka on suljettu polypropeenitulpalla, siinä on kumimäntä (bromobutyylia) ja tulpallinen ruiskunsuojus (bromobutyylia)
- 1 männänvarsi (polypropeeniä).
Valmisteen kuvaus:
Valkoinen tai kellertävä jauhe tai mureneva jauhekakku.
Kirkas ja väritön liuos injektiota varten.
Käyttö- ja käsittelyohjeet
NovoEight annetaan laskimoon sen jälkeen, kun kuiva-aine on liuotettu ruiskussa olevaan liuottimeen. Liuottamisen jälkeen liuos on kirkasta tai hieman opaalinhohtoista. Älä käytä liuosta, joka on sameaa tai jossa on sakkaa.
Tarvitset myös infuusiovälineet (letkun ja siipineulan), steriilejä alkoholilla kostutettuja desinfektiopyyhkeitä, sideharsotyynyjä ja laastareita. Välineet eivät sisälly NovoEight-pakkaukseen.
Käytä aina aseptista tekniikkaa.
Liuottaminen
A) Ota injektiopullo, injektiopulloliitin ja esitäytetty ruisku kotelosta. Jätä männänvarsi vielä koskemattomana koteloon. Lämmitä injektiopullo ja esitäytetty ruisku huoneenlämpöisiksi. Voit tehdä sen pitämällä niitä käsissäsi niin kauan, että ne tuntuvat yhtä lämpimiltä kuin kätesikin. Älä lämmitä injektiopulloa ja esitäytettyä ruiskua millään muulla tavalla. | 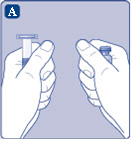 |
B) Poista muovihattu injektiopullosta. Jos muovihattu on irti tai puuttuu, älä käytä pulloa. Pyyhi injektiopullon kumitulppa desinfektiopyyhkeellä ja anna sen kuivua muutama sekunti ennen käyttöä. |  |
C) Poista suojapaperi injektiopulloliittimestä. Jos suojapaperi ei ole kunnolla kiinni tai se on rikkoutunut, älä käytä injektiopulloliitintä. Älä ota liitintä pois suojahatusta. | 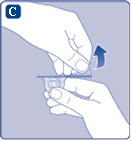 |
D) Käännä suojahattu toisin päin ja napsauta injektiopulloliitin kiinni injektiopulloon. Kun liitin on kiinnitetty injektiopulloon, älä enää poista sitä. | 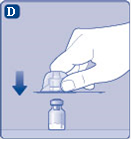 |
E) Purista suojahattua kevyesti peukalolla ja etusormella kuvan mukaisesti. Poista suojahattu injektiopulloliittimestä. | 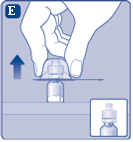 |
F) Ota männänvarren leveästä päästä kiinni ja yhdistä varsi välittömästi ruiskuun kiertämällä sitä myötäpäivään kiinni ruiskun sisällä olevaan mäntään kunnes tunnet vastuksen. | 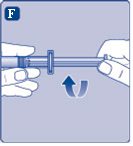 |
G) Poista suojus esitäytetystä ruiskusta taivuttamalla sitä alaspäin kunnes rei’itys murtuu. Älä koske suojuksen alla olevaan ruiskun kärkeen. | 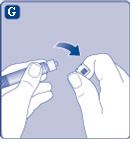 |
H) Kierrä esitäytetty ruisku tiukasti kiinni injektiopulloliittimeen, kunnes tunnet vastuksen. | 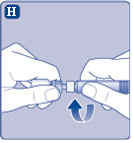 |
I) Pidä esitäytettyä ruiskua hieman kallellaan injektiopullon osoittaessa alaspäin. Paina männänvartta ruiskuttaaksesi kaiken liuottimen injektiopulloon. | 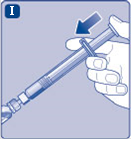 |
J) Pidä männänvartta alas painettuna ja pyöritä injektiopulloa varovasti, kunnes kuiva-aine on kokonaan liuennut. Älä ravista injektiopulloa, koska se voi aiheuttaa vaahtoamista. | 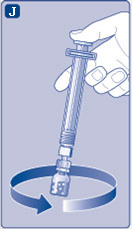 |
NovoEight suositellaan käytettäväksi välittömästi liuottamisen jälkeen. Liuotetun lääkevalmisteen säilytysolosuhteet: ks. kohta Kestoaika.
Jos tarvitset isomman annoksen, toista kohdat A–J uusilla injektiopulloilla, injektiopulloliittimillä ja esitäytetyillä ruiskuilla.
Sekoitetun liuoksen anto
K) Pidä männänvarsi kokonaan sisään painettuna. Käännä ruisku injektiopulloineen ylösalaisin. Lopeta männänvarren painaminen ja anna sen liikkua itsestään takaisinpäin, kun liuotettu liuos täyttää ruiskun. Vedä männänvartta hieman alaspäin vetääksesi liuotetun liuoksen ruiskuun. Jos tarvitse vain osan pullosta, seuraa lääkärin ja sairaanhoitajan ohjeita ja katso ruiskussa olevasta asteikosta kuinka paljon liuotettua liuosta otat. Pidä injektiopulloa ylösalaisin ja napauta ruiskua kevyesti, jotta saisit mahdolliset ilmakuplat nousemaan sen yläosaan. Paina männänvartta hitaasti, kunnes kaikki ilmakuplat on poistettu. | 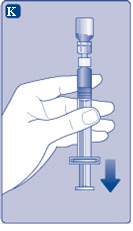 |
L) Kierrä injektiopulloliitin injektiopulloineen irti. NovoEight on nyt valmis injisoitavaksi. Paikallista sopiva injektiokohta ja injisoi NovoEight hitaasti laskimoon 2–5 minuutin aikana. | 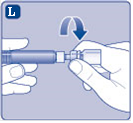 |
Hävittäminen
Injektion jälkeen hävitä kaikki käyttämätön NovoEight-liuos, ruisku ja infuusiovälineet, injektiopullo ja liitin ja muu jäte apteekkihenkilökunnan neuvomalla tavalla.
Älä heitä niitä tavalliseen kotitalousjätteeseen.
Korvattavuus
NOVOEIGHT injektiokuiva-aine ja liuotin, liuosta varten
500 IU 1 pakkaus
1000 IU 1 pakkaus
2000 IU 1 pakkaus
3000 IU 1 pakkaus
- Ylempi erityiskorvaus (100 %). Krooniset hyytymishäiriöt (126).
- Peruskorvaus (40 %).
ATC-koodi
B02BD02
Valmisteyhteenvedon muuttamispäivämäärä
01.10.2020
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
