NUCALA injektioneste, liuos, esitäytetty kynä 100 mg, injektioneste, liuos, esitäytetty ruisku 40 mg, 100 mg
Vaikuttavat aineet ja niiden määrät
Nucala 100 mg injektioneste, liuos, esitäytetty kynä
Yksi 1 ml:n esitäytetty kynä sisältää 100 mg mepolitsumabia.
Nucala 100 mg injektioneste, liuos, esitäytetty ruisku
Yksi 1 ml:n esitäytetty ruisku sisältää 100 mg mepolitsumabia.
Nucala 40 mg injektioneste, liuos, esitäytetty ruisku
Yksi 0,4 ml:n esitäytetty ruisku sisältää 40 mg mepolitsumabia.
Mepolitsumabi on humanisoitu monoklonaalinen vasta-aine, joka tuotetaan yhdistelmä-DNA-tekniikalla kiinanhamsterin munasarjasoluissa (CHO).
Apuaine, jonka vaikutus tunnetaan
Nucala 100 mg injektioneste, liuos, esitäytetty kynä
Yksi 1 ml:n esitäytetty kynä sisältää 0,2 mg polysorbaatti 80:tä.
Nucala 100 mg injektioneste, liuos, esitäytetty ruisku
Yksi 1 ml:n esitäytetty ruisku sisältää 0,2 mg polysorbaatti 80:tä.
Nucala 40 mg injektioneste, liuos, esitäytetty ruisku
Yksi 0,4 ml:n esitäytetty ruisku sisältää 0,08 mg polysorbaatti 80:tä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio)
Kliiniset tiedot
Käyttöaiheet
Vaikea eosinofiilinen astma
Nucala on tarkoitettu lisähoitona vaikean hoitoresistentin eosinofiilisen astman hoitoon aikuisille, nuorille ja vähintään 6-vuotiaille lapsille (ks. kohta Farmakodynamiikka).
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Nucala on tarkoitettu intranasaalisten kortikosteroidien lisähoitona aikuisten vaikean CRSwNP:n hoitoon, kun systeemiset kortikosteroidit ja/tai leikkaushoito eivät tuota riittävää hoitotasapainoa.
Keuhkoahtaumatauti (COPD)
Nucala on tarkoitettu lisähoitona aikuisten keuhkoahtaumataudin (COPD) ylläpitohoitoon, kun tautiin liittyy suurentunut veren eosinofiilimäärä ja kun hoitotasapaino on huono inhaloitavan kortikosteroidin, pitkävaikutteisen beeta2-agonistin (LABA) ja pitkävaikutteisen muskariinireseptorin salpaajan (LAMA) yhdistelmähoidosta huolimatta (ks. kohta Farmakodynamiikka).
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Nucala on tarkoitettu lisähoitona vähintään 6-vuotiaille potilaille, joilla on relapsoiva-remittoiva tai hoitoresistentti eosinofiilinen granulomatoottinen polyangiitti (EGPA).
Hypereosinofiilinen oireyhtymä (HES)
Nucala on tarkoitettu lisähoitona aikuisten hypereosinofiilisen oireyhtymän (HES) hoitoon, kun sen hoitotasapaino on riittämätön eikä sille ole löydetty ei-hematologista sekundaarista syytä (ks. kohta Farmakodynamiikka).
Ehto
Valmistetta saavat määrätä vain käyttöaiheessa mainitun sairauden diagnosointiin ja hoitoon perehtyneet lääkärit.
Annostus ja antotapa
On suositeltavaa, että Nucala-hoitoa määräävät vain vaikean hoitoresistentin eosinofiilisen astman, CRSwNP:n, COPD:n, EGPA:n tai HES:n diagnosointiin ja hoitoon perehtyneet lääkärit.
Annostus
Vaikea eosinofiilinen astma
Aikuiset ja vähintään 12-vuotiaat nuoret
Suositeltu mepolitsumabiannos on 100 mg ihon alle (s.c.) 4 viikon välein.
6–11-vuotiaat lapset
Suositeltu mepolitsumabiannos on 40 mg ihon alle (s.c.) 4 viikon välein.
Nucala on tarkoitettu pitkäaikaishoitoon. Lääkäri arvioi hoidon jatkamisen tarpeellisuuden vähintään vuoden välein taudin vaikeusasteen ja pahenemisvaiheiden perusteella.
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Aikuiset
Suositeltu mepolitsumabiannos on 100 mg ihon alle (s.c.) 4 viikon välein.
Nucala on tarkoitettu pitkäaikaishoitoon. Jos 24 viikkoa jatkuneen CRSwNP-hoidon jälkeen ei todeta vastetta, voidaan harkita muita hoitoja. Joillakin potilailla aluksi saavutettu osittainen vaste saattaa parantua, kun hoitoa jatketaan yli 24 viikon ajan.
Keuhkoahtaumatauti (COPD)
Aikuiset
Suositeltu mepolitsumabiannos on 100 mg ihon alle (s.c.) 4 viikon välein.
Nucala on tarkoitettu pitkäaikaishoitoon. Lääkäri arvioi hoidon jatkamisen tarpeellisuuden vähintään vuoden välein taudin vaikeusasteen ja pahenemisvaiheiden perusteella.
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Aikuiset ja vähintään 12-vuotiaat nuoret
Suositeltu mepolitsumabiannos on 300 mg ihon alle (s.c.) 4 viikon välein.
Mepolitsumabin annostelua EGPA:ta sairastaville 6–17-vuotiaille lapsille ja nuorille tukevat mallinnus- ja simulaatiotiedot (ks. kohta Farmakokinetiikka).
6–11-vuotiaat lapset, joiden paino on ≥ 40 kg
Suositeltu mepolitsumabiannos on 200 mg ihon alle (s.c.) 4 viikon välein.
6–11-vuotiaat lapset, joiden paino on < 40 kg
Suositeltu mepolitsumabiannos on 100 mg ihon alle (s.c.) 4 viikon välein.
Nucala on tarkoitettu pitkäaikaishoitoon. Lääkäri arvioi hoidon jatkamisen tarpeellisuuden vähintään vuoden välein taudin vaikeusasteen ja oireiden perusteella.
Hoidon jatkamisen tarpeellisuutta on arvioitava myös sellaisten potilaiden kohdalla, joille kehittyy henkeä uhkaavia EGPA:n oireita, sillä Nucala-valmistetta ei ole tutkittu tässä potilasryhmässä.
Hypereosinofiilinen oireyhtymä (HES)
Aikuiset
Suositeltu mepolitsumabiannos on 300 mg ihon alle (s.c.) 4 viikon välein.
Nucala on tarkoitettu pitkäaikaishoitoon. Lääkäri arvioi hoidon jatkamisen tarpeellisuuden vähintään vuoden välein taudin vaikeusasteen ja oireiden hallinnan perusteella.
Hoidon jatkamisen tarpeellisuutta on arvioitava myös sellaisten potilaiden kohdalla, joille kehittyy henkeä uhkaavia HES:n oireita, sillä Nucala-valmistetta ei ole tutkittu tässä potilasryhmässä.
Erityisryhmät
Iäkkäät potilaat
Annosta ei tarvitse muuttaa iäkkäitä (≥ 65‑vuotiaita) potilaita hoidettaessa (ks. kohta Farmakokinetiikka).
Munuaisten ja maksan vajaatoiminta
Annosta ei tarvitse muuttaa munuaisten eikä maksan vajaatoiminnassa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Vaikea eosinofiilinen astma
6–11-vuotiaat lapset
Nucala 100 mg injektiokuiva-aine, liuosta varten ja 40 mg injektioneste, liuos, esitäytetty ruisku ovat sopivia valmistemuotoja tälle potilasjoukolle.
Nucala 100 mg injektioneste, liuos, esitäytetty kynä tai 100 mg injektioneste, liuos, esitäytetty ruisku eivät ole tarkoitettu tälle potilasjoukolle.
Alle 6-vuotiaat lapset
Mepolitsumabin turvallisuutta ja tehoa alle 6 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu.
Tietoja ei ole saatavilla.
Krooninen polypoottinen rinosinuiitti (CRSwNP) alle 18-vuotiailla lapsilla
Mepolitsumabin turvallisuutta ja tehoa alle 18 vuoden ikäisten kroonista polypoottista rinosinuiittia sairastavien lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Keuhkoahtaumatauti (COPD) alle 18‑vuotiailla lapsilla
Ei ole asianmukaista käyttää mepolitsumabia pediatrisille (alle 18 vuoden ikäisille) potilaille keuhkoahtaumataudin hoitoon.
Eosinofiilinen granulomatoottinen polyangiitti EGPA alle 6-vuotiailla lapsilla
Mepolitsumabin turvallisuutta ja tehoa alle 6 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Tietoja ei ole saatavilla.
Hypereosinofiilinen oireyhtymä (HES) alle 18-vuotiailla lapsilla
Mepolitsumabin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu.
Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Antotapa
Nucala 100 mg injektioneste, liuos, esitäytetty kynä tai esitäytetty ruisku
Esitäytettyä kynää tai esitäytettyä ruiskua saa käyttää vain injektioon ihon alle (s.c.).
Potilas itse tai potilaasta huolehtiva henkilö voi antaa Nucala-valmisteen, jos potilasta hoitava terveydenhuollon ammattilainen katsoo sen olevan sopivaa ja potilaalle tai potilaasta huolehtivalle henkilölle annetaan koulutus injektiotekniikasta.
Terveydenhuollon ammattilaisen tai koulutetun potilaasta huolehtivan henkilön tulee antaa lääke 6–11-vuotiaille lapsille.
Itseannostelussa suositellut injektiokohdat ovat vatsa tai reisi. Potilaasta huolehtiva henkilö voi antaa injektion myös olkavarteen.
Jos annos vaatii useamman kuin yhden injektion, injektiokohtien väliin on suositeltavaa jäädä vähintään 5 cm.
Yksityiskohtaiset ohjeet Nucala-valmisteen antoon ihon alle esitäytetyllä kynällä tai esitäytetyllä ruiskulla annetaan pakkausselosteen käyttöohjeissa.
Nucala 40 mg injektioneste, liuos, esitäytetty ruisku
Esitäytettyä ruiskua saa käyttää vain injektioon ihon alle (s.c.).
Terveydenhuollon ammattilaisen tai potilaasta huolehtivan henkilön tulee antaa Nucala-valmiste. Sen voi antaa potilaasta huolehtiva henkilö, jos terveydenhuollon ammattilainen katsoo sen olevan sopivaa ja potilaasta huolehtivalle henkilölle annetaan koulutus injektiotekniikasta.
Suositellut injektiokohdat ovat olkavarsi, vatsa tai reisi.
Yksityiskohtaiset ohjeet Nucala-valmisteen antoon ihon alle esitäytetyllä kynällä tai esitäytetyllä ruiskulla annetaan pakkausselosteen käyttöohjeissa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Astman tai keuhkoahtaumataudin (COPD) pahenemisvaiheet
Mepolitsumabia ei saa käyttää astman eikä keuhkoahtaumataudin akuuttien pahenemisvaiheiden hoitoon.
Hoidon aikana voi esiintyä astmaan tai keuhkoahtaumatautiin liittyviä haitallisia oireita tai pahenemisvaiheita. Potilaita on kehotettava hakeutumaan lääkärin hoitoon, elleivät astman tai keuhkoahtaumataudin oireet lievity tai jos ne pahenevat hoidon aloittamisen jälkeen.
Kortikosteroidit
Kortikosteroidien äkillistä lopettamista ei suositella mepolitsumabihoidon aloittamisen jälkeen. Jos kortikosteroidiannosten pienentäminen on tarpeen, se on tehtävä asteittain lääkärin valvonnassa.
Yliherkkyysreaktiot ja lääkkeen antoon liittyvät reaktiot
Mepolitsumabi-injektion antamisen jälkeen on esiintynyt akuutteja ja viivästyneitä systeemisiä reaktioita, mukaan lukien yliherkkyysreaktioita (esim. anafylaksiaa, nokkosihottumaa, angioedeemaa, ihottumaa, bronkospasmeja, verenpaineen laskua). Nämä reaktiot ilmaantuvat yleensä tuntien kuluessa lääkkeen antamisesta, mutta joissakin tapauksissa on esiintynyt viivästyneitä reaktioita (tavallisesti useiden päivien kuluttua). Näitä reaktioita voi ilmaantua ensimmäisen kerran vasta pitkään jatkuneen hoidon jälkeen (ks. kohta Haittavaikutukset). Jos yliherkkyysreaktioita ilmenee, on aloitettava tarvittava asianmukainen hoito.
Loistartunnat
Eosinofiilit saattavat olla osallisena tietyissä loismatoinfektioiden immunologisissa vasteissa. Potilaan mahdolliset loismatoinfektiot on hoidettava ennen mepolitsumabihoidon aloittamista. Jos potilas saa loistartunnan Nucala-hoidon aikana eikä loisinfektioiden hoitoon tarkoitetuilla lääkkeillä saavuteta hoitovastetta, on harkittava Nucala-hoidon tilapäistä keskeyttämistä.
Keuhkoahtaumatautipotilaat, joiden veren eosinofiilimäärä on pieni
Tiedot eivät tue Nucala-valmisteen käyttöä keuhkoahtaumatautipotilailla, joiden veren eosinofiilimäärä on < 150 solua/µl ja joilta ei ole edeltävän 12 kuukauden ajalta näyttöä veren eosinofiilimäärästä ≥ 300 solua/µl.
Henkeä tai elinten toimintaa uhkaava eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Nucala-valmistetta ei ole tutkittu potilailla, joilla on henkeä tai elinten toimintaa uhkaava EGPA (ks. kohta Annostus ja antotapa).
Henkeä uhkaava hypereosinofiilinen oireyhtymä(HES)
Nucala-valmistetta ei ole tutkittu potilailla, joilla HES:ään liittyy henkeä uhkaavia oireita (ks. kohta Annostus ja antotapa).
Apuaineet
Tämä lääkevalmiste sisältää polysorbaatti 80:tä (ks. kohta Vaikuttavat aineet ja niiden määrät). Polysorbaatit saattavat aiheuttaa allergisia reaktioita.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 mg annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Sytokromi P450 ‑entsyymit, uloskuljetus- eli effluksimekanismit ja proteiineihin sitoutuminen eivät vaikuta mepolitsumabipuhdistumaan. Proinflammatoristen sytokiinien (esim. IL-6:n) suurentuneiden pitoisuuksien on havaittu estävän maksasolujen pinnalla olevien vastinreseptorien välityksellä CYP450-entsyymien ja lääkeaineiden kuljetusproteiinien muodostumista. Systeemisten tulehdusmerkkiaineiden lisääntyminen on kuitenkin vähäistä vaikeassa hoitoresistentissä eosinofiilisessa astmassa, eikä ole havaittu viitteitä IL-5-reseptorin alfa-alayksikön ilmentymisestä maksasolujen pinnalla. Siksi mepolitsumabin yhteisvaikutuksia pidetään epätodennäköisinä.
Raskaus ja imetys
Raskaus
Mepolitsumabin käytöstä raskaana oleville naisille on vain vähän tietoja (alle 300 raskaudesta).
Mepolitsumabi läpäisee apinoiden istukan. Eläimillä tehdyissä tutkimuksissa ei ole havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Ei tiedetä, onko mepolitsumabilla ihmissikiöön kohdistuvia haittavaikutuksia.
Varmuuden vuoksi Nucalan käyttöä on suositeltavaa välttää raskauden aikana. Nucalan käyttöä raskauden aikana tulisi harkita vain, jos hoidosta odotettu hyöty äidille on suurempi kuin mahdollinen sikiölle aiheutuva riski.
Imetys
Mepolitsumabin erittymisestä äidinmaitoon ihmisillä ei ole tietoja. Mepolitsumabia erittyi kuitenkin jaavanmakakien maitoon pitoisuuksina, jotka olivat alle 0,5 % plasmassa mitatuista pitoisuuksista.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Nucala-hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ihmisiä koskevia hedelmällisyystietoja ei ole. Eläimillä tehdyissä tutkimuksissa IL-5-vasta-aineiden ei ole todettu vaikuttavan haitallisesti hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nucala-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Tiivistelmä turvallisuustiedoista
Vaikea eosinofiilinen astma
Vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavien aikuisten ja nuorten lumekontrolloiduissa tutkimuksissa yleisimmin raportoidut hoidonaikaiset haittavaikutukset olivat päänsärky (20 %), injektiokohdan reaktiot (8 %) ja selkäkipu (6 %).
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Lumekontrolloidussa tutkimuksessa CRSwNP-potilailla yleisimmin ilmoitetut hoidonaikaiset haittavaikutukset olivat päänsärky (18 %) ja selkäkipu (7 %).
Keuhkoahtaumatauti (COPD)
Kolmessa lumekontrolloidussa tutkimuksessa COPD‑potilailla yleisimmin ilmoitetut hoidonaikaiset haittavaikutukset olivat päänsärky (10 %), selkäkipu (7 %) ja nivelkipu (5 %).
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Lumekontrolloidussa tutkimuksessa EGPA-potilailla yleisimmin ilmoitetut hoidonaikaiset haittavaikutukset olivat päänsärky (32 %), injektiokohdan reaktiot (15 %) ja selkäkipu (13 %). Systeemisiä allergisia reaktioita/yliherkkyysreaktioita ilmoitettiin 4 %:lla EGPA-potilaista.
Hypereosinofiilinen oireyhtymä (HES)
Lumekontrolloidussa tutkimuksessa HES-potilailla yleisimmin ilmoitetut hoidonaikaiset haittavaikutukset olivat päänsärky (13 %), virtsatieinfektio (9 %) sekä injektiokohdan reaktiot ja kuume (kumpikin 7 %).
Haittavaikutustaulukko
Alla olevassa taulukossa on lueteltu haittavaikutukset lumekontrolloiduista vaikean eosinofiilisen astman tutkimuksista, joissa potilaat saivat 100 mg mepolitsumabia ihon alle (n = 263), satunnaistetusta, kaksoissokkoutetusta, lumekontrolloidusta 52 viikkoa kestäneestä tutkimuksesta CRSwNP-potilailla, jotka saivat 100 mg mepolitsumabia ihon alle (n = 206), sekä kolmesta kaksoissokkoutetusta, lumekontrolloidusta 52–104 viikkoa kestäneestä tutkimuksesta COPD‑potilailla, jotka saivat 100 mg mepolitsumabia ihon alle (n = 1 043). Lisäksi taulukossa on lueteltu haittavaikutukset EGPA-potilaista, jotka saivat 300 mg mepolitsumabia ihon alle (n = 68) kaksoissokkoutetussa, lumekontrolloidussa, 32 viikkoa kestäneessä tutkimuksessa, jossa HES-potilaat saivat 300 mg mepolitsumabia ihon alle (n = 54), sekä markkinoilletulon jälkeisistä spontaaneista ilmoituksista. Turvallisuustietoja on myös saatavilla avoimista jatkotutkimuksista vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavilla potilailla (n = 998), joilla hoidon keston mediaani oli 2,8 vuotta (vaihteluväli 4 viikkoa - 4,5 vuotta). Avoimeen, 20 viikkoa kestäneeseen jatkotutkimukseen otetuilla HES-potilailla (n = 102) mepolitsumabin turvallisuusprofiili oli samankaltainen kuin lumekontrolloidussa avaintutkimuksessa.
Haittavaikutusten esiintymistiheys on määritelty seuraavaa käytäntöä noudattaen: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Elinjärjestelmä | Haittavaikutukset | Yleisyys |
| Infektiot | Alahengitystieinfektio Virtsatieinfektio Nielutulehdus Herpes zoster ‑infektio** | Yleinen |
| Immuunijärjestelmä | Yliherkkyysreaktiot (systeemiset allergiset reaktiot)* | Yleinen |
| Anafylaksia** | Harvinainen | |
| Hermosto | Päänsärky | Hyvin yleinen |
| Hengityselimet, rintakehä ja välikarsina | Nenän tukkoisuus | Yleinen |
| Ruoansulatuselimistö | Ylävatsakipu | Yleinen |
| Iho ja ihonalainen kudos | Ekseema | Yleinen |
| Luusto, lihakset ja sidekudos | Selkäkipu Nivelkipu** | Yleinen |
| Yleisoireet ja antopaikassa todettavat haitat | Lääkkeen antoon liittyvät reaktiot (systeemiset, ei-allergiset reaktiot)*** Paikalliset injektiokohdan reaktiot Kuume | Yleinen |
* Vaikeaa eosinofiilista astmaa ja keuhkoahtaumatautia koskeneissa tutkimuksissa systeemisten reaktioiden, myös yliherkkyysreaktioiden, ilmaantuvuus on kokonaisuudessaan ollut verrattavissa lumeryhmässä todettuun ilmaantuvuuteen. Esimerkkejä näiden reaktioiden raportoiduista ilmenemismuodoista ja ilmaantumisajankohdista on kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
** Markkinoinnin jälkeisistä spontaaneista raporteista. Vaikeaa astmaa koskeneissa tutkimuksissa herpes zosteria ilmoitettiin melko harvinaisena.
*** Vaikeaa eosinofiilista astmaa ja keuhkoahtaumatautia koskeneissa tutkimuksissa systeemisten, ei-allergisten, lääkkeen antoon liittyvien reaktioiden yleisimmät ilmenemismuodot olivat ihottuma, kasvojen ja kaulan punoitus, lihassärky ja väsymys. Näitä ilmenemismuotoja raportoitiin satunnaisesti, < 1 %:lla potilaista, jotka saivat mepolitsumabia 100 mg:n annoksina ihon alle.
Valikoitujen haittavaikutusten kuvaus
Krooninen polypoottinen rinosinuiitti ‑potilaiden systeemiset reaktiot, mukaan lukien yliherkkyysreaktiot
Lumekontrolloidussa, 52 viikkoa kestäneessä tutkimuksessa systeemisiä allergisia reaktioita (tyypin I yliherkkyysreaktioita) ilmoitettiin 2 potilaalla (< 1 %) mepolitsumabi 100 mg -ryhmässä, lumeryhmässä ei kenelläkään. Muita systeemisiä reaktioita ei esiintynyt kenelläkään mepolitsumabi 100 mg ‑ryhmässä, kun taas lumeryhmässä niitä esiintyi 1 potilaalla (< 1 %).
Keuhkoahtaumatautipotilaiden systeemiset reaktiot, mukaan lukien yliherkkyysreaktiot
Lumekontrolloidussa, 52–104 viikkoa kestäneessä tutkimuksessa systeemisiä allergisia reaktioita (tyypin I yliherkkyysreaktioita) ilmoitettiin 1 potilaalla (< 1 %) mepolitsumabi 100 mg ‑ryhmässä, lumeryhmässä ei kenelläkään. Muita systeemisiä reaktioita ilmoitettiin 4 potilaalla (< 1 %) mepolitsumabi 100 mg ‑ryhmässä ja 4 potilaalla (< 1 %) lumeryhmässä.
Kahdessa lumekontrolloidussa, 52 viikkoa kestäneessä tutkimuksessa systeemisiä allergisia reaktioita / yliherkkyysreaktioita ilmoitettiin 4 potilaalla (< 1 %) mepolitsumabi 100 mg ‑ryhmissä ja 3 potilaalla (< 1 %) lumeryhmissä. Systeemisiä ei‑allergisia reaktioita ilmoitettiin 7 potilaalla (1 %) mepolitsumabi 100 mg ‑ryhmissä ja 10 potilaalla (2 %) lumeryhmissä.
Eosinofiilinen granulomatoottinen polyangiitti ‑potilaiden systeemiset reaktiot, mukaan lukien yliherkkyysreaktiot
Lumekontrolloidussa, 52 viikkoa kestäneessä tutkimuksessa systeemisiä (allergisia ja ei-allergisia) reaktioita esiintyi 6 %:lla mepolitsumabi 300 mg -ryhmässä ja 1 %:lla lumeryhmässä. Systeemisiä allergisia reaktioita / yliherkkyysreaktioita ilmoitettiin 4 %:lla mepolitsumabi 300 mg -ryhmässä ja 1 %:lla lumeryhmässä. Systeemisiä ei-allergisia reaktioita (angioedeema) ilmoitettiin yhdellä potilaalla (1 %) mepolitsumabi 300 mg -ryhmässä eikä kenelläkään lumeryhmässä.
Hypereosinofiilinen oireyhtymä ‑potilaiden systeemiset reaktiot, mukaan lukien yliherkkyysreaktiot
Lumekontrolloidussa, 32 viikkoa kestäneessä tutkimuksessa mepolitsumabi 300 mg -ryhmän yksi potilas (2 %) ilmoitti systeemisestä reaktiosta (multifokaalinen ihoreaktio), lumeryhmässä ei yksikään.
Paikalliset injektiokohdan reaktiot
Vaikea eosinofiilinen astma
Lumevertailututkimuksissa paikallisia injektiokohdan reaktioita esiintyi 8 %:lla potilaista, jotka saivat mepolitsumabia 100 mg ihon alle, ja 3 %:lla lumeryhmän potilaista. Nämä tapahtumat eivät olleet vakavia, vaan kaikki olivat lieviä tai kohtalaisia ja suurin osa parani muutamassa päivässä. Paikallisia injektiokohdan reaktioita esiintyi pääasiassa hoitoa aloitettaessa ja kolmen ensimmäisen injektion aikana. Myöhempien injektioiden yhteydessä reaktioita raportoitiin harvemmin. Näiden tapahtumien yleisimmin raportoidut ilmenemismuodot olivat kipu, eryteema, turvotus, kutina ja kirvelyn tunne.
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Lumekontrolloidussa tutkimuksessa paikallisia injektiokohdan reaktioita (esim. eryteema, kutina) esiintyi 2 %:lla 100 mg mepolitsumabia saaneista potilaista verrattuna < 1 %:iin lumelääkettä saaneista potilaista.
Keuhkoahtaumatauti (COPD)
Lumekontrolloiduissa tutkimuksissa paikallisia injektiokohdan reaktioita esiintyi 2 %:lla mepolitsumabia 100 mg saaneista potilaista verrattuna 2 %:iin lumelääkettä saaneista potilaista. Yleisimmin raportoidut ilmenemismuodot olivat kipu, turvotus, kutina ja eryteema.
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Lumekontrolloidussa tutkimuksessa paikallisia injektiokohdan reaktioita (esim. kipu, eryteema, turvotus) esiintyi 15 %:lla mepolitsumabia 300 mg saaneista potilaista verrattuna 13 %:iin lumelääkettä saaneista potilaista.
Hypereosinofiilinen oireyhtymä (HES)
Lumekontrolloidussa tutkimuksessa paikallisia injektiokohdan reaktioita (esim. kirvely, kutina) esiintyi 7 %:lla mepolitsumabia 300 mg saaneista potilaista verrattuna 4 %:iin lumelääkettä saaneista potilaista.
Pediatriset potilaat
Vaikea eosinofiilinen astma
Kolmekymmentäseitsemän nuorta (ikä 12–17 v) osallistui neljään 24–52 viikon pituiseen lumekontrolloituun tutkimukseen (25 tutkittavaa sai mepolitsumabia laskimoon tai ihon alle). Kolmekymmentäkuusi pediatrista potilasta (ikä 6–11 v) sai mepolitsumabia ihon alle 12 viikon ajan avoimessa tutkimuksessa. 8 viikon hoitotauon jälkeen 30 näistä potilaista sai mepolitsumabia vielä 52 viikon ajan. Turvallisuusprofiili oli samankaltainen kuin aikuisilla. Uusia haittavaikutuksia ei todettu.
Lisäksi mepolitsumabin pitkäaikaisturvallisuutta arvioitiin 9 nuorella potilaalla (ikä 12–17 v) ja 15 pediatrisella potilaalla (ikä 6–11 v), jotka otettiin avoimeen jatkotutkimukseen (201956). Tutkimuksessa potilaat saivat mepolitsumabia ihon alle keskimäärin 21,5 kuukauden ajan. Uusia haittavaikutuksia ei todettu.
Hypereosinofiilinen oireyhtymä (HES)
Neljä nuorta (ikä 12–17 v) osallistui lumekontrolloituun tutkimukseen 200622, jossa yksi nuorista sai 300 mg mepolitsumabia ja kolme nuorta lumelääkettä 32 viikon ajan. Kaikki neljä nuorta jatkoivat 20 viikkoa kestäneeseen avoimeen jatkotutkimukseen 205203 (ks. kohta Farmakodynamiikka).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisessä tutkimuksessa annettiin laskimoon kerta-annoksia 1 500 mg:aan asti potilaille, joilla oli eosinofiilinen tauti. Viitteitä annokseen liittyvistä toksisista vaikutuksista ei havaittu.
Mepolitsumabin yliannokseen ei ole spesifistä hoitoa. Yliannostapauksissa on suositeltavaa antaa asianmukaista tukihoitoa ja tarvittaessa seurata potilaan tilaa.
Muuta hoitoa on annettava kliinisen tarpeen mukaan tai mahdollisia Myrkytystietokeskuksen suosituksia noudattaen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: ahtauttavien hengitystiesairauksien lääkkeet, muut systeemisesti käytettävät ahtauttavien hengitystiesairauksien lääkkeet, ATC-koodi: R03DX09
Vaikutusmekanismi
Mepolitsumabi on IL‑5‑antagonisti (IgG1, kappa). Mepolitsumabi sitoutuu IL‑5:een ja estää sen biologista aktiivisuutta nanomolaarisina pitoisuuksina estämällä IL‑5:n sitoutumisen solun pinnan IL‑5‑reseptorikompleksin alfa‑alayksikköön. IL‑5 on tärkein eosinofiilien kasvua ja erilaistumista, kudoksiin kertymistä, aktivoitumista ja elinaikaa säätelevä sytokiini. Kun astmaan, CRSwNP:hen, COPD:hen, EGPA:han tai HES:ään liittyy tyypin 2 tulehdus, IL‑5 on keskeinen tekijä patogeneesiin liittyvissä prosesseissa. Myös muut rakennesolu‑ ja tulehdussolutyypit (esim. epiteelisolut, syöttösolut, plasmasolut, basofiilit, tyypin 2 luontaiset lymfosyytit [ILC2], T‑solut, sileälihassolut, neutrofiilit ja fibroblastit) ilmentävät IL‑5‑reseptorin alfa‑alayksikköä. Vaikeassa astmassa ja CRSwNP:ssä IL‑5:n estoon on liittynyt hengitysteiden uudelleenmuovautumisen palautumista joiltain osin. Vaikutusmekanismia näissä soluissa ja eri taudeissa ei ole kuitenkaan täysin selvitetty.
Farmakodynaamiset vaikutukset
Vaikea eosinofiilinen astma
Kun mepolitsumabia annettiin 100 mg ihon alle 4 viikon välein 32 viikon ajan vaikean hoitoresistentin eosinofiilisen astman hoitoon (aikuisille/nuorille), veren eosinofiilimäärän geometrinen keskiarvo, joka oli lähtötilanteessa 290 solua/µl, oli viikolla 32 laskenut tasolle 40 solua/µl (n = 182), mikä oli 84 %:n lasku lumeryhmään verrattuna. Samansuuruinen vaikutus veren eosinofiilimäärän vähenemiseen säilyi vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavilla potilailla (n = 998) avoimissa jatkotutkimuksissa, joissa hoidon keston mediaani oli 2,8 vuotta (vaihteluväli 4 viikkoa - 4,5 vuotta).
Kun 6–11-vuotiaille lapsille annettiin mepolitsumabia ihon alle 4 viikon välein 52 viikon ajan vaikean hoitoresistentin eosinofiilisen astman hoitoon, 40 mg annosta käytettäessä (tutkittavien paino < 40 kg) veren eosinofiilimäärän geometrinen keskiarvo, joka oli lähtötilanteessa 306 solua/µl (n = 16), oli viikolla 52 pienentynyt tasolle 48 solua/µl (n = 15; pienenemä lähtötilanteesta 85 %). 100 mg annosta käytettäessä (tutkittavien paino ≥ 40 kg) veren eosinofiilimäärän geometrinen keskiarvo, joka oli lähtötilanteessa 331 solua/µl, oli viikolla 52 pienentynyt tasolle 44 solua/µl (n = 10; pienenemä lähtötilanteesta 87 %).
Aikuisilla, nuorilla ja lapsilla tämän kokoluokan pienenemä havaittiin 4 hoitoviikon kuluessa.
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Kun mepolitsumabia annettiin 100 mg ihon alle 4 viikon välein 52 viikon ajan CRSwNP-potilaiden hoitoon, veren eosinofiilimäärän geometrinen keskiarvo oli viikolla 52 pienentynyt tasolle 60 solua/µl (n = 126), kun se oli lähtötilanteessa 390 solua/µl (n = 206). Eli geometrinen keskiarvo oli pienentynyt 83 % lumeeseen verrattuna. Tämän kokoluokan pienenemä havaittiin 4 hoitoviikon kuluessa, ja se säilyi koko 52 viikon hoitojakson ajan.
Keuhkoahtaumatauti (COPD)
Kun mepolitsumabia annettiin 100 mg ihon alle 4 viikon välein 52–104 viikon ajan COPD‑potilaiden hoitoon, veren eosinofiilimäärän geometrinen keskiarvo oli pienentynyt tasolle 60 solua/µl viikolla 52 (n = 257) ja viikolla 104 (n = 61), kun se oli lähtötilanteessa 480 solua/µl (n = 403). Eli geometrinen keskiarvo oli pienentynyt 79 % viikolla 52 ja 80 % viikolla 104 lumeeseen verrattuna. Tämän kokoluokan pienenemä havaittiin 4 hoitoviikon kuluessa.
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Kun mepolitsumabia annettiin EGPA-potilaille 300 mg:n annoksina ihon alle 4 viikon välein 52 viikon ajan, veren eosinofiilimäärän geometrinen keskiarvo oli viikolla 52 laskenut tasolle 38 solua/µl (n = 64), kun se oli lähtötilanteessa 177 solua/µl (n = 68). Geometrinen keskiarvo pieneni 83 % lumelääkkeeseen verrattuna. Tämän kokoluokan pienenemä havaittiin 4 hoitoviikon kuluessa.
Hypereosinofiilinen oireyhtymä (HES)
Kun mepolitsumabia annettiin HES-potilaille (aikuiset/nuoret) 300 mg:n annoksina ihon alle 4 viikon välein 32 viikon ajan, veren eosinofiilimäärän väheneminen havaittiin kahden hoitoviikon kuluessa. Veren eosinofiilimäärän geometrinen keskiarvo oli viikolla 32 pienentynyt tasolle 70 solua/µl (n = 48), kun se oli lähtötilanteessa 1 460 solua/µl (n = 54). Eli geometrinen keskiarvo oli pienentynyt 92 % lumeeseen verrattuna. Tämän kokoluokan pienenemä säilyi vielä 20 viikon ajan mepolitsumabihoitoa avoimessa jatkotutkimuksessa jatkaneilla potilailla.
Immunogeenisuus
Vaikea eosinofiilinen astma, krooninen polypoottinen rinosinuiitti (CRSwNP), keuhkoahtaumatauti (COPD), eosinofiilinen granulomatoottinen polyangiitti (EGPA) ja hypereosinofiilinen oireyhtymä (HES)
Koska proteiini- ja peptidilääkkeillä saattaa olla immunogeenisia ominaisuuksia, potilaille voi kehittyä mepolitsumabin vasta-aineita hoidon myötä. Lumevertailututkimuksissa 260 vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavaa aikuista ja nuorta, 196 CRSwNP:tä sairastavaa aikuista ja 381 COPD:tä sairastavaa aikuista sai 100 mg:n annoksia ihon alle, 68 EGPA:ta sairastavaa aikuista sai 300 mg:n annoksia ihon alle ja 53 HES:ää sairastavaa aikuista ja nuorta sai 300 mg:n annoksia ihon alle; astmapotilaista 15:llä (6 %), CRSwNP-potilaista 6:lla (3 %), COPD‑potilaista 9:llä (2 %), EGPA-potilaista yhdellä (< 2 %) ja HES-potilaista yhdellä (2 %) oli havaittavissa mepolitsumabin vasta-aineita, kun he olivat saaneet vähintään yhden mepolitsumabiannoksen.
Mepolitsumabin immunogeenisuusprofiili vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavilla potilailla (n = 998), joilla hoidon keston mediaani oli 2,8 vuotta (vaihteluväli 4 viikkoa - 4,5 vuotta) avoimessa jatkotutkimuksessa, tai HES-potilailla (n = 102), joita hoidettiin jatkotutkimuksessa 20 viikon ajan, oli samanlainen kuin lumevertailututkimuksissa. Immunogeenisuustietoja kerättiin CRSwNP‑potilailta 68 viikon ajan (n = 68), COPD‑potilailta 104 viikon ajan (n = 127) ja EGPA‑potilailta 60 viikon ajan (n = 65).
Kun 6–11-vuotiaille lapsille annettiin vaikean hoitoresistentin eosinofiilisen astman hoitoon mepolitsumabia joko 40 mg ihon alle (tutkittavien paino < 40 kg) tai 100 mg ihon alle (tutkittavien paino ≥ 40 kg), mepolitsumabin vasta-aineita oli havaittavissa 2:lla 35:stä (6 %), kun he olivat saaneet vähintään yhden mepolitsumabiannoksen tutkimuksen lyhyen alkuvaiheen aikana. Yhdelläkään lapsella ei ollut havaittavia anti-mepolitsumabivasta-aineita tutkimuksen pitkäkestoisemmassa vaiheessa.
Neutraloivia vasta-aineita todettiin yhdellä vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavalla aikuispotilaalla eikä yhdelläkään CRSwNP-, COPD-, EGPA- tai HES-potilaista. Suurimmalla osalla potilaista mepolitsumabin vasta-aineet eivät vaikuttaneet havaittavasti mepolitsumabin farmakokinetiikkaan tai farmakodynamiikkaan, eikä vasta-ainetittereiden ja veren eosinofiilipitoisuuden muutoksen välillä havaittu korrelaatiota.
Kliininen teho
Vaikea eosinofiilinen astma
Mepolitsumabin teho arvioitiin vaikean hoitoresistentin eosinofiilisen astman hoidossa yli 12-vuotiailla kolmessa kliinisessä 24–52 viikkoa kestäneessä, satunnaistetussa, kaksoissokko-, rinnakkaisryhmätutkimuksessa. Näiden potilaiden astma joko ei pysynyt hallinnassa (vähintään kaksi vaikeaa pahenemisvaihetta 12 edellisen kuukauden aikana) nykyisellä ylläpitohoidolla, johon kuuluivat vähintään suuret inhaloitavat kortikosteroidiannokset sekä yksi tai useampia muita ylläpitolääkkeitä, tai he olivat riippuvaisia systeemisistä kortikosteroideista. Muita ylläpitolääkkeitä olivat pitkävaikutteiset beeta2-agonistit (LABA), leukotrieeninsalpaajat, pitkävaikutteiset muskariinireseptorien salpaajat (LAMA), teofylliini ja oraaliset kortikosteroidit (OCS).
Kahteen pahenemisvaiheiden tutkimukseen, MEA112997 ja MEA115588, otettiin mukaan yhteensä
1 192 potilasta, joista 60 % oli naisia ja keski-ikä oli 49 vuotta (vaihteluväli 12–82). Oraalisia kortikosteroideja sai ylläpitohoitona 31 % potilaista MEA1122997-tutkimuksessa ja 24 % MEA115588-tutkimuksessa. Valintakriteerinä oli, että potilailla oli ollut 12 edellisen kuukauden aikana vähintään kaksi vaikeaa astman pahenemisvaihetta, jotka vaativat joko oraalista tai systeemistä kortikosteroidihoitoa, ja että lähtötilanteessa keuhkofunktiot olivat alentuneet (FEV1 ennen bronkodilataatiota < 80 % aikuisilla ja < 90 % nuorilla). Pahenemisvaiheiden määrä edellisen vuoden aikana oli 3,6 (keskiarvo), ja FEV1-keskiarvo ennen bronkodilataatiota oli 60 %. Potilaat jatkoivat olemassa olevaa astmalääkitystään tutkimusten aikana.
Oraalisten kortikosteroidien tarvetta kartoittavaan MEA115575-tutkimukseen otettiin mukaan 135 potilasta (55 % naisia, keski-ikä 50 vuotta), jotka käyttivät päivittäin oraalista kortikosteroidia (5–35 mg/vrk) ja suuriannoksista inhaloitavaa kortikosteroidiannosta yhdistettynä lisälääkkeeseen ylläpitohoitona.
Tehoa mittaava annoksenmääritystutkimus MEA112997 (DREAM)
MEA112997 oli monikeskustutkimuksena tehty 52 viikon satunnaistettu, kaksoissokkoutettu, lumevertailu-rinnakkaisryhmätutkimus, jossa oli mukana 616 vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavaa potilasta. Lumevalmisteeseen verrattuna mepolitsumabi vähensi merkitsevästi kliinisesti merkittäviä astman pahenemisvaiheita (joiden kriteerinä oli oraalisia/systeemisiä kortikosteroideja ja/tai sairaalahoitoa ja/tai käyntejä ensiapupoliklinikalla vaativa astman vaikeutuminen), kun mepolitsumabin annos oli 75 mg, 250 mg tai 750 mg annettuna laskimoon (i.v.) (ks. taulukko 1).
Taulukko 1: Kliinisesti merkittävien pahenemisvaiheiden esiintymistiheys tutkimusryhmässä (intent to treat population, ITT-populaatio) viikolla 52.
| Mepolitsumabi laskimoon (i.v.) | Lume | |||
75 mg n = 153 | 250 mg n = 152 | 750 mg n = 56 | n = 155 | |
| Pahenemisvaiheita/vuosi | 1,24 | 1,46 | 1,15 | 2,40 |
| Prosentuaalinen väheneminen | 48 % | 39 % | 52 % | |
| Ilmaantumistiheyksien suhde RR (95 % CI) | 0,52 (0,39–0,69) | 0,61(0,46–0,81) | 0,48 (0,36–0,64) | |
| p-arvo | < 0,001 | < 0,001 | < 0,001 | - |
Pahenemisvaiheiden vähenemistä kartoittava tutkimus MEA115588 (MENSA)
MEA115588 oli monikeskustutkimuksena tehty satunnaistettu, kaksoissokkoutettu, lumevertailu-rinnakkaisryhmätutkimus. Tutkimuksessa arvioitiin mepolitsumabin tehoa ja turvallisuutta, kun sitä annettiin lisähoitona 576 potilaalle, joilla oli vaikea hoitoresistentti eosinofiilinen astma, jonka kriteerinä oli perifeerisen veren eosinofiilimäärä vähintään 150 solua/µl hoitoa aloitettaessa tai vähintään 300 solua/µl edellisten 12 kuukauden aikana.
Potilaat saivat 100 mg mepolitsumabia ihon alle, 75 mg mepolitsumabia laskimoon tai lumevalmistetta 4 viikon välein 32 viikon ajan. Ensisijainen päätetapahtuma oli kliinisesti merkittävien astman pahenemisvaiheiden esiintymistiheys, ja ne vähenivät tilastollisesti merkitsevästi (p < 0,001) molemmissa mepolitsumabia saavissa hoitoryhmissä lumeryhmään verrattuna. Taulukossa 2 ovat ensisijaisten ja toissijaisten päätetapahtumien tulokset potilasryhmissä, jotka saivat mepolitsumabia ihon alle tai lumevalmistetta.
Taulukko 2: Ensisijaisten ja toissijaisten päätetapahtumien tulokset viikolla 32 hoitoaikeen (ITT-populaatio) mukaisessa potilasjoukossa (MEA115588)
Mepolitsumabi 100 mg (ihon alle) (s.c.) N = 194 | Lume N = 191 | |
| Ensisijainen päätetapahtuma | ||
| Kliinisesti merkittävien pahenemisvaiheiden esiintymistiheys | ||
| Pahenemisvaiheita/vuosi | 0,83 | 1,74 |
Prosentuaalinen väheneminen Ilmaantumistiheyksien suhde RR (95 % CI) | 53 % 0,47 (0,35–0,64) | - |
| p-arvo | < 0,001 | |
| Toissijaiset päätetapahtumat | ||
| Sairaalahoitoa / ensiapupoliklinikkakäyntejä vaativien pahenemisvaiheiden esiintymistiheys | ||
| Pahenemisvaiheita/vuosi | 0,08 | 0,20 |
Prosentuaalinen väheneminen Ilmaantumistiheyksien suhde RR (95 % CI) | 61 % 0,39 (0,18–0,83) | _ |
| p-arvo | 0,015 | |
| Sairaalahoitoa vaatineiden pahenemisvaiheiden esiintymistiheys | ||
| Pahenemisvaiheita/vuosi | 0,03 | 0,10 |
Prosentuaalinen väheneminen Ilmaantumistiheyksien suhde RR (95 % CI) | 69 % 0,31 (0,11–0,91) | _ |
| p-arvo | 0,034 | |
| FEV1 (ml) ennen bronkodilataatiota viikolla 32 | ||
| Lähtöarvo (SD) | 1 730 (659) | 1 860 (631) |
| Muutos lähtötasosta, keskiarvo (SE) | 183 (31) | 86 (31) |
| Ero (mepolitsumabi vs. lume) | 98 | |
| 95 % CI | (11–184) | |
| p-arvo | 0,028 | |
| St. George’s Respiratory Questionnaire ‑(SGRQ) pistearvo viikolla 32 | ||
| Lähtöarvo (SD) | 47,9 (19,5) | 46,9 (19,8) |
| Muutos lähtötasosta, keskiarvo (SE) | -16,0 (1,1) | -9,0 (1,2) |
| Ero (mepolitsumabi vs. lume) | -7,0 | |
| 95 % CI | (-10,2 – -3,8) | |
| p-arvo | < 0,001 | |
Pahenemisvaiheiden väheneminen suhteessa eosinofiilimäärään lähtötilanteessa
Taulukossa 3 ovat yhdistetyn analyysin tulokset kahdesta pahenemisvaiheita kartoittaneesta tutkimuksesta (MEA112997 ja MEA115588) veren eosinofiilimäärän lähtöarvojen mukaan. Lumevalmistetta saaneessa haarassa pahenemisvaiheiden määrä oli sitä suurempi mitä suurempi oli lähtötilanteen eosinofiilimäärä. Mepolitsumabihoitoa saaneessa ryhmässä pahenemisvaiheet vähenivät enemmän potilailla, joilla lähtötilanteen eosinofiilimäärä oli suurempi.
Taulukko 3: Yhdistetty analyysi kliinisesti merkittävien pahenemisvaiheiden määrästä lähtötilanteen eosinofiilimäärän mukaan vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavilla potilailla
Mepolitsumabi 75 mg i.v. / 100 mg s.c. (N = 538) | Lume (N = 346) | |
| MEA112997+MEA115588 | ||
| < 150 solua/µl | ||
| n | 123 | 66 |
| Pahenemisvaiheita/vuosi | 1,16 | 1,73 |
| Mepolitsumabi vs. lume | ||
| Ilmaantumistiheyksien suhde RR (95 % CI) | 0,67 (0,46–0,98) | --- |
| 150 – < 300 solua/µl | ||
| n | 139 | 86 |
| Pahenemisvaiheita/vuosi | 1,01 | 1,41 |
| Mepolitsumabi vs. lume | ||
| Ilmaantumistiheyksien suhde RR (95 % CI) | 0,72 (0,47–1,10) | --- |
| 300 – < 500 solua/µl | ||
| n | 109 | 76 |
| Pahenemisvaiheita/vuosi | 1,02 | 1,64 |
| Mepolitsumabi vs. lume | ||
| Ilmaantumistiheyksien suhde RR (95 % CI) | 0,62 (0,41–0,93) | --- |
| ≥ 500 solua/µl | ||
| n | 162 | 116 |
| Pahenemisvaiheita/vuosi | 0,67 | 2,49 |
| Mepolitsumabi vs. lume | ||
| Ilmaantumistiheyksien suhde RR (95 % CI) | 0,27 (0,19–0,37) | --- |
Oraalisten kortikosteroidien tarvetta kartoittava tutkimus MEA115575 (SIRIUS)
MEA115575-tutkimuksessa mepolitsumabia annettiin 100 mg ihon alle vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastaville potilaille ja arvioitiin, pystyykö se vähentämään ylläpitohoitona käytettyjen oraalisten kortikosteroidien määrää heikentämättä astman hoitotasapainoa. Potilaiden veren eosinofiilimäärä oli ≥ 150/µl lähtötilanteessa tai ≥ 300/µl seulontaa edeltävien 12 kuukauden aikana. Potilaille annettiin mepolitsumabia tai lumevalmistetta 4 viikon välein koko hoitojakson ajan. Potilaat jatkoivat aikaisempaa astmalääkitystään tutkimuksen aikana, lukuun ottamatta oraalisia kortikosteroideja, joiden annosta pienennettiin 4 viikon välein kortikosteroidien annoksenpienennysvaiheen aikana (viikot 4–20), mikäli astmaoireet pysyivät hallinnassa.
Tutkimukseen otettiin mukaan yhteensä 135 potilasta: keski-ikä oli 50 vuotta, 55 % oli naisia ja 48 % oli saanut oraalista steroidihoitoa vähintään 5 vuoden ajan. Lähtöannoksen arvioitiin vastaavan suunnilleen prednisoniannosta 13 mg/vrk (keskiarvo).
Ensisijainen päätetapahtuma oli päivittäisen oraalisen kortikosteroidiannoksen prosentuaalinen pieneneminen (viikoilla 20–24) astmaoireiden pysyessä hallinnassa, etukäteen määriteltyjen annoksen pienenemiseen perustuvien luokkien mukaan (ks. taulukko 4). Ylimmässä luokassa oraalisen kortikosteroidiannoksen vähenemä oli 90–100 %, ja alimmassa luokassa ei ollut vähenemää oraalisen kortikosteroidiannoksen käytössä optimointivaiheen päättymisen jälkeen. Mepolitsumabin ja lumevalmisteen ero oli tilastollisesti merkitsevä (p = 0,008).
Taulukko 4: Tutkimuksen MEA115575 ensisijaisen ja toissijaisten päätetapahtumien tulokset
| ITT-populaatio | ||
Mepolitsumabi 100 mg (ihon alle) (s.c.) N = 69 | Lume N = 66 | |
| Ensisijainen päätetapahtuma | ||
| Oraalisen kortikosteroidiannoksen prosentuaalinen pieneneminen lähtötasosta (viikoilla 20–24) | ||
90–100 % 75 – < 90 % 50 – < 75 % > 0 – < 50 % Ei kortikosteroidiannoksen pienenemistä / astma ei hallinnassa / keskeyttänyt hoidon | 16 (23 %) 12 (17 %) 9 (13 %) 7 (10 %) 25 (36 %) | 7 (11 %) 5 (8 %) 10 (15 %) 7 (11 %) 37 (56 %) |
| Kerroinsuhde (Odds ratio, OR) (95 % CI) | 2,39 (1,25–4,56) | |
| p-arvo | 0,008 | |
| Toissijaiset päätetapahtumat (viikot 20–24) | ||
| Oraalisen kortikosteroidiannoksen lasku tasolle 0 mg/vrk | 10 (14 %) | 5 (8 %) |
| Kerroinsuhde (Odds ratio, OR) (95 % CI) | 1,67 (0,49–5,75) | |
| p-arvo | 0,414 | |
| Oraalisen kortikosteroidiannoksen lasku tasolle ≤ 5mg/vrk | 37 (54 %) | 21 (32 %) |
| Kerroinsuhde (Odds ratio, OR) (95 % CI) | 2,45 (1,12–5,37) | |
| p-arvo | 0,025 | |
| Oraalisen kortikosteroidiannoksen laskun mediaani, % (95 % CI) | 50,0 (20,0–75,0) | 0,0 (-20,0–33,3) |
| Ero, mediaani (95 % CI) | -30,0 (-66,7–0,0) | |
| p-arvo | 0,007 | |
Avoimet jatkotutkimukset vaikeassa hoitoresistentissa eosinofiilisessä astmassa MEA115666 (COLUMBA), MEA115661 (COSMOS) ja 201312 (COSMEX).
Mepolitsumabin pitkäaikainen tehokkuusprofiili vaikeaa hoitoresistenttiä eosinofiilista astmaa sairastavilla potilailla (n = 998), joilla hoidon keston mediaani oli 2,8 vuotta (vaihteluväli 4 viikkoa - 4,5 vuotta) avoimissa jatkotutkimuksissa MEA115666, MEA115661 ja 201312, oli yleisesti vastaavanlainen kolmen lumekontrolloidun tutkimuksen kanssa.
Krooninen polypoottinen rinosinuiitti (CRSwNP)
Tutkimus 205687 (SYNAPSE) oli 52 viikon satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus, joka arvioi 407 vähintään 18-vuotiasta CRSwNP-potilasta.
Tutkimukseenoton kriteerejä olivat nenän tukkoisuuden VAS-oirepisteet (Visual Analogue Scale) > 5/10, VAS-kokonaisoirepisteet > 7/10 ja bilateraalisella endoskopialla todetut, nenäpolyyppeja kuvaavat NPS-pisteet ≥ 5/8 (vähimmäispisteet 2 per nenäontelo). Potilailla oli myös oltava anamneesissa vähintään yksi nenäpolyyppileikkaus edeltävien 10 vuoden aikana.
Keskeisimmät lähtötilanteen ominaisuudet sisälsivät endoskopialla todettujen, nenäpolyyppeja kuvaavien NPS-pisteiden keskiarvon 5,5 (1,29), nenän tukkoisuuden VAS-oirepisteiden keskiarvon 9,0 (0,83), VAS-kokonaisoirepisteiden keskiarvon 9,1 (0,74), hajuaistin häviämisen VAS-oirepisteiden keskiarvon 9,7 (0,72) ja Sino-Nasal Outcome -testin (SNOT-22) keskiarvon 64,1 (18,32). Eosinofiilimäärän geometrinen keskiarvo oli 390 solua/µl (95 % CI: 360, 420). Lisäksi 27 %:lla potilaista oli asetyylisalisyylihapolla pahentuva hengityselinsairaus (AERD) ja 48 %:lla potilaista oli vähintään yksi oraalinen kortikosteroidihoitojakso CRSwNP-hoidossa viimeisen 12 kuukauden aikana.
Potilaat saivat taustahoitona intranasaalista kortikosteroidia ja lisänä 100 mg mepolitsumabia tai lumetta ihon alle 4 viikon välein.
Rinnakkaiset ensisijaiset päätetapahtumat olivat endoskooppisten NPS-kokonaispisteiden muutos lähtötilanteesta viikolla 52 ja nenän tukkoisuuden keskimääräisten VAS-pisteiden muutos lähtötilanteesta viikoilla 49–52. Tärkein toissijainen päätetapahtuma oli aika ensimmäiseen nenäpolyyppileikkaukseen viikkoon 52 mennessä (leikkaus määriteltiin minä tahansa toimenpiteenä, jossa tehtiin instrumentein viilto ja poistettiin nenäontelon kudosta [esim. polypektomia]). Mepolitsumabia saaneiden potilaiden endoskooppiset NPS-kokonaispisteet olivat parantuneet (vähentyneet) merkitsevästi viikolla 52 ja nenän tukkoisuuden VAS-pisteet viikoilla 49–52 verrattuna lumeeseen, ja mepolitsumabi oli tilastollisesti merkitsevästi parempi kaikkien toissijaisten päätetapahtumien osalta (ks. taulukko 5 ja kuva 1).
Taulukko 5: Ensisijaisten ja toissijaisten päätetapahtumien yhteenveto ITT-populaatiossa
Lume (N = 201) | Mepolitsumabi 100 mg s.c. (N = 206) | |
| Rinnakkaiset ensisijaiset päätetapahtumat | ||
| Endoskooppiset kokonaispisteet viikolla 52a | ||
| Lähtötilanteen mediaanipisteet (min, max) | 6,0 (0, 8) | 5,0 (2, 8) |
| Mediaanimuutos lähtötilanteesta | 0,0 | -1,0 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -0,73 (-1,11, -0,34) | |
| ≥ 1 pisteen paranema, n (%) | 57 (28) | 104 (50) |
| ≥ 2 pisteen paranema, n (%) | 26 (13) | 74 (36) |
| Nenän tukkoisuus, VAS-pisteet (viikot 49–52)a | ||
| Lähtötilanteen mediaanipisteet (min, max) | 9,14 (5,31, 10,00) | 9,01 (6,54, 10,00) |
| Mediaanimuutos lähtötilanteesta | -0,82 | -4,41 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -3,14 (-4,09, -2,18) | |
| > 1 pisteen paranema, n (%) | 100 (50) | 146 (71) |
| ≥ 3 pisteen paranema, n (%)d | 73 (36) | 124 (60) |
| Tärkein toissijainen päätetapahtuma | ||
| Aika ensimmäiseen nenäpolyyppileikkaukseen | ||
| Leikkauspotilaat | 46 (23) | 18 (9) |
| Riskitiheyssuhde (mepolitsumabi/lume) (95 % CI)e | 0,43 (0,25, 0,76) | |
| p-arvoe | 0,003 | |
| Muut toissijaiset päätetapahtumat | ||
| VAS-kokonaispisteet (viikot 49–52)a | ||
| Lähtötilanteen mediaanipisteet (min, max) | 9,20 (7,21, 10,00) | 9,12 (7,17, 10,00) |
| Mediaanimuutos lähtötilanteesta | -0,90 | -4,48 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -3,18 (-4,10, -2,26) | |
| > 2,5 pisteen paranema (%)f | 40 | 64 |
| SNOT-22-kokonaispisteet viikolla 52a,g | ||
| n | 198 | 205 |
| Lähtötilanteen mediaanipisteet (min, max) | 64,0 (19, 110) | 64,0 (17, 105) |
| Mediaanimuutos lähtötilanteesta | -14,0 | -30,0 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -16,49 (-23,57, -9,42) | |
| ≥ 28 pisteen paranema (%)f | 32 | 54 |
| Systeemisiä kortikosteroideja nenäpolyyppeihin tarvinneet potilaat viikkoon 52 mennessä | ||
| Potilaat, joilla ≥ 1 kuuri | 74 (37) | 52 (25) |
| Kerroinsuhde vs. lume (95 % CI)h | 0,58 (0,36, 0,92) | |
| p-arvoh | 0,020 | |
| Nenäoireiden yhdistetyt VAS-pisteet (viikot 49–52)a,i | ||
| Lähtötilanteen mediaanipisteet (min, max) | 9,18 (6,03, 10,00) | 9,11 (4,91, 10,00) |
| Mediaanimuutos lähtötilanteesta | -0,89 | -3,96 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -2,68 (-3,44, -1,91) | |
| ≥ 2 pisteen paranema (%)f | 40 | 66 |
| Hajuaistin häviäminen, VAS-pisteet (viikot 49–52)a | ||
| Lähtötilanteen mediaanipisteet (min, max) | 9,97 (6,69, 10,00) | 9,97 (0,94, 10,00) |
| Mediaanimuutos lähtötilanteesta | 0,00 | -0,53 |
| p-arvob | < 0,001 | |
| Mediaanien ero (95 % CI)c | -0,37 (-0,65, -0,08) | |
| ≥ 3 pisteen paranema (%)f | 19 | 36 |
a Nenä/sivuonteloleikkaukseen tulevien potilaiden huonoimmat leikkausta edeltävästi todetut pisteet. Jos potilas vetäytyi tutkimuksesta ennen nenä/sivuonteloleikkausta, huomioitiin huonoimmat todetut pisteet ennen vetäytymistä.
b Perustuu Wilcoxonin järjestyssummatestiin.
c Kvantiiliregressio; kovariaatteina hoitoryhmä, maantieteellinen alue, lähtötilanteen pisteet ja veren eosinofiilimäärän log(e) lähtötilanteessa.
d Nenän tukkoisuuden kolmen VAS-pisteen paranemaa pidetään tämän arvioinnin kannalta merkittävänä potilaskohtaisena muutoksena.
e Arvioitu Coxin suhteellisen riskin mallin perusteella; kovariaatteina hoitoryhmä, maantieteellinen alue, endoskooppiset kokonaispisteet lähtötilanteessa (tulkittu keskitetysti), nenän tukkoisuuden VAS-pisteet lähtötilanteessa, veren eosinofiilimäärän log(e) lähtötilanteessa ja aikaisempien leikkausten määrä (1, 2, > 2 ordinaaliasteikolla).
f Paraneman kynnysarvoa pidetään tämän arvioinnin kannalta merkittävänä potilaskohtaisena muutoksena.
g Parannusta havaittiin kaikilla CRSwNP:n oireita ja vaikutuksia kartoittavilla kuudella osa-alueella.
h Analyysi perustuu logistiseen regressiomalliin; kovariaatteina hoitoryhmä, maantieteellinen alue, oraalisten kortikosteroidikuurien määrä nenäpolyyppien hoidossa viimeisten 12 kk aikana (0, 1, > 1 ordinaaliasteikolla), endoskooppiset NPS-kokonaispisteet lähtötilanteessa (tulkittu keskitetysti), nenän tukkoisuuden VAS-pisteet lähtötilanteessa, veren eosinofiilimäärän log(e) lähtötilanteessa.
i Yhdistetyt VAS-pisteet: nenän tukkoisuus, nenän eritevuoto, nielun limaisuus ja hajuaistin häviäminen.
Aika ensimmäiseen nenäpolyyppileikkaukseen
52 viikon hoitojakson aikana mepolitsumabiryhmän potilaiden todennäköisyys joutua nenäpolyyppileikkaukseen oli pienempi kuin lumeryhmän potilalla. Riski joutua leikkaukseen hoitojakson aikana oli merkitsevästi pienempi (57 % pienempi) mepolitsumabiryhmässä kuin lumeryhmässä (riskitiheyssuhde: 0,43; 95 % CI: 0,25, 0,76; p = 0,003).
Kuva 1: Aika ensimmäiseen nenäpolyyppileikkaukseen Kaplan–Meier-käyrällä
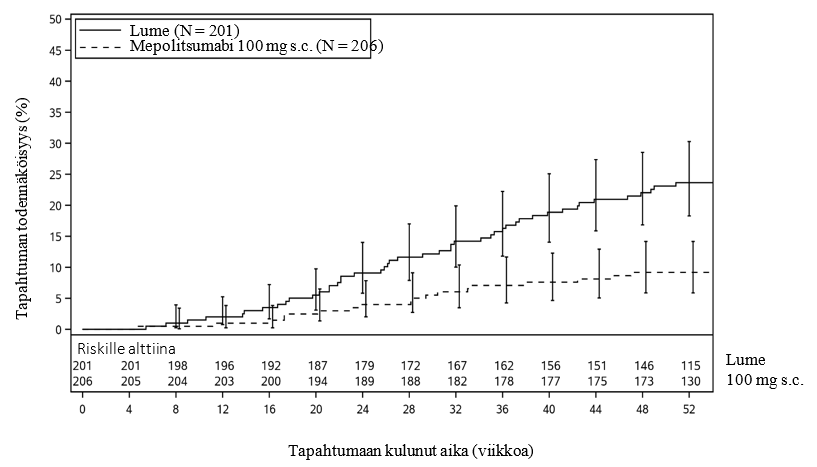
Leikkauspotilaiden osuuden jälkianalyysissa todettiin 61 % vähenemä leikkaushoidon todennäköisyydessä vs. lume (OR 0,39, 95 % CI: 0,21, 0,72; p = 0,003).
Krooninen polypoottinen rinosinuiitti-potilaat, joilla liitännäissairautena astma
Ennalta määritellyissä analyyseissa todettiin rinnakkaisten ensisijaisten päätetapahtumien paranema 289 (71 %) potilaalla, joilla oli liitännäissairautena astma. Tulokset ovat yhdenmukaisia 100 mg mepolitsumabia saaneiden potilaiden kokonaispopulaatiossa vs. lume. Näillä mepolitsumabi 100 mg ‑ryhmän potilailla todettiin myös astman hoitotasapainon merkittävämpi pareneminen lähtötilanteesta viikolla 52 vs. lume arvioituna Asthma Control Questionnaire (ACQ-5) -kyselyllä (mediaanimuutos [Q1, Q3] -0,80 [-2,20, 0,00] ja 0,00 [-1,10, 0,20]).
Keuhkoahtaumatauti (COPD)
Tutkimus 208657 (MATINEE)
Mepolitsumabin (100 mg ihon alle 4 viikon välein) tehoa tavanomaisen hoitona lisänä arvioitiin 804 aikuispotilaalla (ikä ≥ 40 vuotta), joilla oli keuhkoahtaumataudin eosinofiilinen fenotyyppi, 52–104 viikkoa kestäneessä satunnaistetussa lumekontrolloidussa monikeskustutkimuksessa (208657, MATINEE). Tutkimukseenottokriteerinä oli, että potilaiden veren eosinofiilimäärä oli seulontahetkellä ≥ 300 solua/µl ja seulontaa edeltävien 12 kuukauden aikana ≥ 150 solua/µl. Kaikki potilaat saivat koko tutkimuksen ajan kolmoishoitoa (inhaloitava kortikosteroidi, pitkävaikutteinen beeta‑agonisti ja pitkävaikutteinen muskariinireseptorin salpaaja). Tutkimukseen otetut potilaat täyttivät seuraavat kriteerit: keskivaikea, vaikea tai hyvin vaikea uloshengitysvirtauksen hidastuminen (FEV1 bronkodilataation jälkeen 20–80 % viitearvosta); ei astmaa anamneesissa eikä tutkimukseenottohetkellä; anamneesissa pahenemisvaiheita (vähintään 1 vaikea, sairaalahoitoa vaatinut pahenemisvaihe tai 2 keskivaikeaa pahenemisvaihetta, jotka vaativat systeemistä kortikosteroidihoitoa ja mahdollisesti antibioottihoitoa) edeltävien 12 kuukauden aikana huolimatta inhaloitavien kortikosteroidien ja kahden muun ylläpitohoidon säännöllisestä, vähintään 3 kuukautta kestäneestä käytöstä ennen seulontaa.
Tutkimuksen ensisijainen tavoite oli arvioida mepolitsumabin tehoa keskivaikeiden tai vaikeiden pahenemisvaiheiden vuotuiseen määrään. Keskivaikean pahenemisvaiheen määritelmä oli oraalista tai systeemistä kortikosteroidihoitoa ja/tai antibioottihoitoa vaatinut COPD‑oireiden paheneminen ja vaikean pahenemisvaiheen määritelmä oli sairaalahoitoa vaatinut tai kuolemaan johtanut paheneminen. Oireita ja terveyteen liittyvää elämänlaatua arvioitiin seuraavien analyysien perusteella: COPD Assessment Test (CAT) ‑arvioinnissa vasteen (määritelmä ≥ 2 pisteen pienenemä lähtötilanteesta) saavuttaneet; George’s Respiratory Questionnaire (SGRQ) ‑arvioinnissa vasteen (määritelmä ≥ 4 pisteen pienenemä lähtötilanteesta) saavuttaneet; Evaluating Respiratory Symptoms in Chronic Obstructive Pulmonary Disease (E‑RS: COPD) ‑arvioinnissa vasteen (määritelmä ≥ 2 pisteen pienenemä lähtötilanteesta) saavuttaneet.
Potilaiden demografiset tiedot ja ominaisuudet lähtötilanteessa on esitetty taulukossa 6.
Taulukko 6: Demografiset tiedot ja lähtötilanteen ominaisuudet MATINEE‑tutkimuksessa (mITT‑populaatio)
| (N = 804) | |
| Ikä vuosina, keskiarvo (SD) | 66 (8,0) |
| Naisia, n (%) | 253 (31) |
| Valkoihoisia, n (%) | 673 (84) |
| Nykyisin tupakoivia, n (%) | 222 (28) |
| Tupakoinnin kesto askivuosina, keskiarvo (SD) | 43,0 (24,88) |
| COPD:n kesto vuosina, keskiarvo (SD) | 10,0 (6,28) |
| mMRC‑pisteet ≥ 2 [asteikko 0–4], n (%) | 611 (76) |
| Pelkkä emfyseemaa, n (%) | 252 (31) |
| Pelkkä krooninen keuhkoputkitulehdusa, n (%) | 338 (42) |
| Emfyseema ja krooninen keuhkoputkitulehdusa, n (%) | 143 (18) |
| Keskivaikea uloshengitysvirtauksen hidastuminen: ≥ 50 % – < 80 % FEV1‑viitearvosta, n (%) | 349 (43) |
| Vaikea uloshengitysvirtauksen hidastuminen: ≥ 30 % – < 50 % FEV1‑viitearvosta, n (%) | 340 (42) |
| Hyvin vaikea uloshengitysvirtauksen hidastuminen: < 30 % FEV1‑viitearvosta, n (%) | 110 (14) |
| FEV1 bronkodilataation jälkeen, % viitearvosta, keskiarvo (SD) | 48,2 (15,77) |
| FEV1/FVC‑suhde bronkodilataation jälkeen, keskiarvo (SD) | 0,49 (0,124) |
| Keskivaikeiden tai vaikeiden pahenemisvaiheiden määrä edeltävänä vuonna, keskiarvo (SD) | 2,3 (0,94) |
| Vaikeiden pahenemisvaiheiden määrä edeltävänä vuonna ≥ 1, n (%) | 165 (21) |
| CAT‑pisteet, keskiarvo (SD) | 19,2 (6,85) |
| SGRQ‑pisteet, keskiarvo (SD) | 54,6 (17,80) |
| E‑RS: COPD ‑pisteet, keskiarvo (SD) | 13,05 (6,790) |
| Veren eosinofiilimäärä seulontahetkellä, geometrinen keskiarvo, solua/μl (95 % CI) | 480 (470, 490) |
mITT = muokattu hoitoaikeen mukainen, SD = keskihajonta, mMRC = modified Medical Research Council, FEV1 = uloshengityksen sekuntikapasiteetti, FVC = nopea vitaalikapasiteetti, CAT = COPD Assessment Test, SGRQ = St. George’s Respiratory Questionnaire, E‑RS: COPD = Evaluating Respiratory Symptoms in COPD
aCOPD‑tyyppi tutkijan arvion perusteella. Potilaista 544 (68 %) ilmoitti SGRQ‑arvioinnissa kroonisen keuhkoputkitulehduksen oireita.
Pahenemisvaiheet
Mepolitsumabi 100 mg ‑ryhmän potilailla keskivaikeiden tai vaikeiden pahenemisvaiheiden vuotuinen määrä pieneni tilastollisesti merkitsevästi ja keskivaikean tai vaikean pahenemisvaiheen riski oli pienempi lumeryhmään verrattuna. Lisäksi vaikeiden pahenemisvaiheiden vuotuinen määrä pieneni (ks. taulukko 7).
Taulukko 7: COPD:n pahenemisvaiheita koskevat päätetapahtumat MATINEE-tutkimuksessa (mITT‑populaatio)
Mepolitsumabi 100 mg s.c. N = 403 | Lume N = 401 | ||
| Keskivaikeidena tai vaikeidenb pahenemisvaiheiden määrä | |||
| Pahenemisvaiheita/vuosi | 0,80 | 1,01 | |
Prosentuaalinen väheneminen Ilmaantumistiheyksien suhde RR vs. lume (95 % CI) | 21 %
0,79 (0,66, 0,94) | ||
| p‑arvo | 0,011 | ||
| Aika ensimmäiseen keskivaikeaana tai vaikeaanb pahenemisvaiheeseen | |||
| Aika ensimmäiseen pahenemisvaiheeseen, mediaanic, vrk | 419 | 321 | |
Prosentuaalinen riskin pieneneminen Riskitiheyssuhde vs. lume (95 % CI) | 23 %
0,77 (0,64, 0,93) | ||
| p‑arvo | 0,009 | ||
| Vaikeidenb pahenemisvaiheidend määrä | |||
| Pahenemisvaiheita/vuosi | 0,10 | 0,15 | |
Prosentuaalinen väheneminen Ilmaantumistiheyksien suhde RR vs. lume (95 % CI) | 34 %
0,66 (0,43, 1,01) | ||
a Keskivaikean pahenemisvaiheen määritelmä oli oraalista tai systeemistä kortikosteroidihoitoa ja/tai antibioottihoitoa vaatinut COPD-oireiden paheneminen
b Vaikean pahenemisvaiheen määritelmä oli sairaalahoitoa vaatinut tai kuolemaan johtanut paheneminen
c Kaplan–Meier‑estimaatti
d Ensisijaisen päätetapahtuman komponentti, analyysia ei ole korjattu multiplisiteetin suhteen
Keuhkotoiminta
Mepolitsumabi 100 mg ihon alle ‑ryhmän potilailla ei havaittu viikolla 52 suoraa vaikutusta keuhkotoimintaan (FEV1-arvoon ennen bronkodilataatiota) lumeryhmään verrattuna; keskimuutos lähtötilanteesta oli mepolitsumabiryhmässä 30,2 ml ja lumeryhmässä 35,6 ml (ero −5,4 ml; 95 % CI: −56,2, 45,4).
Terveyteen liittyvän elämänlaadun arvioinnit
Oireita ja terveyteen liittyvää elämänlaatua koskeneiden päätetapahtumien (CAT, SGRQ ja E‑RS: COPD) tulokset eivät olleet tilastollisesti merkitseviä. SGRQ‑arvioinnissa vasteen (määritelmä ≥ 4 pisteen pienenemä lähtötilanteesta) saavuttaneiden osuus viikolla 52 oli mepolitsumabi 100 mg ‑ryhmässä 50 % ja lumeryhmässä 46 % (kerroinsuhde 1,17; 95 % CI: 0,87, 1,57).
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
MEA115921oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, 52 viikkoa kestänyt tutkimus, joka arvioi 136 EGPA-aikuispotilasta, joilla oli anamneesissa relapsoiva tai hoitoresistentti tauti ja käytössä vakaa oraalinen kortikosteroidilääkitys (≥ 7,5 – ≤ 50 mg/vrk prednisolonia/prednisonia) ja mahdollisesti vakaa immunosuppressiivinen lääkitys (lukuun ottamatta syklofosfamidia). Muitakin hoitokäytäntöjen mukaisia ylläpitolääkityksiä sai käyttää tutkimuksen aikana. 53 % (n = 72) käytti samanaikaisesti vakaata immunosuppressiivista lääkitystä. MEA115921-tutkimukseen ei otettu potilaita, joilla oli henkeä tai elinten toimintaa uhkaava EGPA. Potilaat saivat taustahoitona prednisolonia/prednisonia ja mahdollisesti immunosuppressiivista hoitoa sekä lisänä joko 300 mg mepolitsumabia tai lumelääkettä ihon alle 4 viikon välein. Oraalisen kortikosteroidin annosta pienennettiin tutkijan harkinnan mukaan.
Remissio
Rinnakkaiset ensisijaiset päätetapahtumat olivat remission kokonaiskesto (määritelmänä Birmingham Vasculitis Activity Score [BVAS] = 0 ja prednisoloni/prednisoniannos ≤ 4 mg/vrk), sekä remission saavuttaneiden potilaiden osuus sekä hoitoviikolla 36 että hoitoviikolla 48. BVAS = 0 tarkoittaa, ettei vaskuliitti ole aktiivinen.
Mepolitsumabi 300 mg -ryhmässä saavutettiin merkitsevästi pidempi remission kokonaiskesto kuin lumeryhmässä. Lisäksi mepolitsumabi 300 mg -ryhmässä merkitsevästi suurempi osuus potilaista saavutti remission sekä viikolla 36 että viikolla 48 lumeeseen verrattuna (ks. taulukko 8).
Kummankin rinnakkaisen ensisijaisen päätetapahtuman osalta havaittiin lumeeseen verrattuna hyötyvaikutus mepolitsumabi 300 mg -hoidon jälkeen riippumatta siitä, saivatko potilaat kortikosteroiditaustahoidon lisäksi immunosuppressiivista hoitoa.
Kun toissijaisena päätetapahtumana oli remissio, jonka määritelmänä oli BVAS = 0 ja prednisolonia/prednisonia ≤ 7,5 mg/vrk, mepolitsumabi 300 mg -ryhmässä saavutettiin myös merkitsevästi pidempi remission kokonaiskesto (p < 0,001) ja suurempi remissiopotilaiden kokonaisosuus sekä viikolla 36 että viikolla 48 (p < 0,001) verrattuna lumeeseen.
Taulukko 8: Rinnakkaisten ensisijaisten päätetapahtumien analyysit
| Potilaiden osuus (%) | ||
Lume N = 68 | Mepolitsumabi 300 mg N = 68 | |
| Remission kokonaiskesto 52 viikon aikana | ||
| 0 | 55 (81) | 32 (47) |
| > 0 – < 12 viikkoa | 8 (12) | 8 (12) |
| 12 – < 24 viikkoa | 3 (4) | 9 (13) |
| 24 – < 36 viikkoa | 0 | 10 (15) |
| ≥ 36 viikkoa | 2 (3) | 9 (13) |
| Kerroinsuhde (OR) (mepolitsumabi/lume) | 5,91 | |
| 95 % CI | --- | 2,68 13,03 |
| p-arvo | --- | < 0,001 |
| Remissiopotilaat viikoilla 36 ja 48 | 2 (3) | 22 (32) |
| Kerroinsuhde (OR) (mepolitsumabi/lume) | 16,74 | |
| 95 % CI | --- | 3,61 77,56 |
| p-arvo | --- | < 0,001 |
| Kerroinsuhde > 1 suosii mepolitsumabia. Remissio: BVAS = 0 ja oraalisen kortikosteroidin annos ≤ 4 mg/vrk. | ||
Relapsi
Lumelääkkeeseen verrattuna aika ensimmäiseen relapsiin oli merkitsevästi pidempi mepolitsumabi 300 mg ‑ryhmässä (p < 0,001). Lisäksi mepolitsumabia saaneilla potilailla relapsien vuotuinen määrä väheni 50 % verrattuna lumeeseen: 1,14 vs 2,27.
Oraalisten kortikosteroidien vähentäminen
Mepolitsumabihoitoa saaneet potilaat käyttivät merkitsevästi pienempää oraalisten kortikosteroidien keskimääräistä vuorokausiannosta viikoilla 48–52 verrattuna lumetta saaneisiin potilaisiin.59 % mepolitsumabia saaneista saavutti viikoilla 48–52 oraalisten kortikosteroidien keskimääräisen vuorokausiannoksen ≤ 7,5mg ja 44 % annoksen ≤ 4 mg, lumeryhmässä vastaavat osuudet olivat 33 % ja 7 %. 18 % mepolitsumabiryhmän potilaista pystyi lopettamaan oraalisten kortikosteroidien käytön asteittain kokonaan, kun vastaava osuus lumeryhmässä oli 3 %.
Asthma Control Questionnaire – 6 (ACQ-6)
Mepolitsumabihoitoa saaneiden potilaiden keskimääräinen ACQ-6-pistemäärä parani merkitsevästi viikoilla 49–52 verrattuna lumelääkettä saaneisiin.
Hypereosinofiilinen oireyhtymä (HES)
Tutkimus 200622 oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, 32 viikkoa kestänyt tutkimus, joka arvioi 108 HES-potilasta (ikä ≥ 12 vuotta). Potilaat jatkoivat HES-hoitoaan ja saivat lisänä 300 mg mepolitsumabia tai lumetta ihon alle 4 viikon välein. Tutkimuksessa 200622 HES:n hoidossa käytettiin mm. oraalisia kortikosteroideja, immunosuppressiivista, sytotoksista hoitoa tai muita oireenmukaisia hoitoja, kuten omepratsolihoitoa.
Tutkimukseen otetuilla potilailla oli esiintynyt vähintään kaksi HES:n pahenemisvaihetta edeltävien 12 kuukauden aikana ja veren eosinofiilimäärä oli seulonnan aikana ≥ 1 000 solua/µl. Tutkimukseen ei otettu mukaan IP1L1-PDGFRα-kinaasipositiivisia potilaita.
Tutkimuksen 200622 ensisijainen päätetapahtuma oli sellaisten potilaiden osuus, joilla esiintyi HES:n pahenemisvaihe 32 viikon hoitojakson aikana. HES:n pahenemisvaiheen määritelmänä oli HES:n kliinisten oireiden ja merkkien paheneminen, joka vaati oraalisten kortikosteroidien annosnostoa; sytotoksisen tai immunosuppressiivisen HES-hoidon aloittamista tai annosnostoa; tai oraalisen kortikosteroidin antoa sokkoutetusti (vähintään kahdesti) veren eosinofiilimäärän lisäännyttyä.
Ensisijaisessa analyysissa verrattiin mepolitsumabiryhmän ja lumeryhmän potilaita, joilla esiintyi HES:n pahenemisvaihe tai jotka vetäytyivät tutkimuksesta. 32 viikon hoitojakson aikana mepolitsumabi 300 mg ‑ryhmän potilaista 50 % harvempi koki HES:n pahenemisvaiheen tai vetäytyi tutkimuksesta verrattuna lumeryhmään; 28 % vs. 56 % (OR 0,28, 95 % CI: 0,12, 0,64) (ks. taulukko 9).
Toissijaiset päätetapahtumat olivat aika ensimmäiseen HES:n pahenemisvaiheeseen, sellaisten potilaiden osuus, joilla esiintyi HES:n pahenemisvaihe viikolla 20–32, HES:n pahenemisvaiheiden määrä ja väsymyksen vaikeusasteen muutos lähtötilanteesta. Kaikki toissijaiset päätetapahtumat olivat tilastollisesti merkitseviä ja tukivat ensisijaista päätetapahtumaa (ks. kuva 2 ja taulukko 10).
Taulukko 9: Ensisijaisen päätetapahtuman analyysin tulokset ITT-populaatiossa (tutkimus 200622)
Mepolitsumabi 300 mg N = 54 | Lume N = 54 | |
| Potilaat, joilla esiintyi HES:n pahenemisvaihe | ||
| Potilaat, joilla ≥ 1 HES:n pahenemisvaihe tai jotka vetäytyivät tutkimuksesta (%) | 15 (28) | 30 (56) |
| Potilaat, joilla ≥ 1 HES:n pahenemisvaihe (%) | 14 (26) | 28 (52) |
| Tutkimuksesta vetäytyneet potilaat, joilla ei HES:n pahenemisvaihetta (%) | 1 (2) | 2 (4) |
| Kerroinsuhde (OR) (95 % CI) | 0,28 (0,12, 0,64) | |
| CMH, p-arvo | 0,002 | |
CMH = Cochran–Mantel–Haenszel
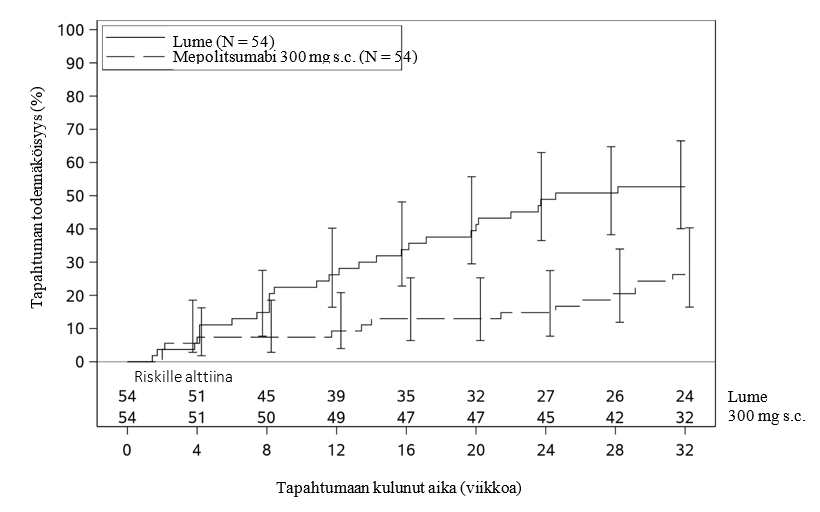
Aika ensimmäiseen pahenemisvaiheeseen
Mepolitsumabi 300 mg -ryhmässä HES:n ensimmäiseen pahenemisvaiheeseen kulunut aika oli merkitsevästi pidempi kuin lumeryhmässä. HES:n ensimmäisen pahenemisvaiheen riski hoitojakson aikana oli 66 % pienempi mepolitsumabia saaneilla kuin lumetta saaneilla (riskitiheyssuhde: 0,34; 95 % CI: 0,18, 0,67; p = 0,002).
Kuva 2: Aika ensimmäiseen HES:n pahenemisvaiheeseen Kaplan–Meier-käyrällä
Taulukko 10: Muiden toissijaisten päätetapahtumien tulokset ITT-populaatiossa (tutkimus 200622)
Mepolitsumabi 300 mg N = 54 | Lume N = 54 | |
| HES:n pahenemisvaiheet viikoilla 20–32 | ||
| Potilaat, joilla ≥ 1 HES:n pahenemisvaihe tai jotka vetäytyivät tutkimuksesta (%) | 9 (17) | 19 (35) |
| Kerroinsuhde (OR) (95 % CI) | 0,33 (0,13, 0,85) | |
| CMH, p-arvo | 0,02 | |
| HES:n pahenemisvaiheiden määrä | ||
| Arvioitu keskimäärä vuodessa | 0,50 | 1,46 |
| Ilmaantumistiheyksien suhde (95 % CI)a | 0,34 (0,19, 0,63) | |
| Wilcoxonin järjestyssummatesti, p-arvo | 0,002 | |
| Väsymyksen vaikeusasteen muutos lähtötilanteesta mitattuna Brief Fatigue Inventory (BFI) -asteikon kohdalla 3 (pahin väsymys edeltävien 24 tunnin aikana) viikolla 32b | ||
| Mediaanimuutos: BFI-asteikon kohta 3 | -0,66 | 0,32 |
| Vertailu (mepolitsumabi vs. lumelääke), Wilcoxonin järjestyssummatesti, p-arvo | 0,036 | |
a Ilmaantumistiheyksien suhde < 1 suosii mepolitsumabia.
b Potilaat, joista puuttuu tietoa: huonoin todettu arvo. BFI-asteikon kohta 3: 0 = ei väsymystä, 10 = pahin mahdollinen väsymys.
CMH = Cochran–Mantel–Haenszel
Avoin jatkotutkimus
Tutkimus 205203 oli 20 viikkoa kestänyt, tutkimuksen 200622 avoin jatkotutkimus. Viikolla 4 alkanutta mepolitsumabiylläpitohoitoa jatkettiin, mutta HES:n hoitoa voitiin muutoin muuttaa paikallisten hoitokäytäntöjen mukaisesti. Tutkimuksessa 200622 raportoitu mepolitsumabihoidon teho HES:n pahenemisvaiheiden vähenemiseen säilyi myös tutkimuksessa 205203 mepolitsumabihoitoa jatkaneilla potilailla; siinä 94 % potilaista (47/50) säästyi pahenemisvaiheilta.
Niistä avoimen jatkotutkimuksen 72 potilaasta, jotka tarvitsivat oraalista kortikosteroidia viikoilla 0–4, 28 % pystyi pienentämään sen keskimääräistä vuorokausiannosta ≥ 50 % viikoilla 16–20.
Pediatriset potilaat
Vaikea hoitoresistentti eosinofiilinen astma
MEA115588-tutkimukseen ja kaksoissokkoutettuun, lumekontrolloituun 200862-tutkimukseen otettiin mukaan 34 nuorta (12–17-vuotiaita). Näistä 34 potilaasta 12 sai lumevalmistetta, yhdeksän sai mepolitsumabia 75 mg laskimoon ja 13 sai mepolitsumabia 100 mg ihon alle. Tutkimusten yhdistetyn analyysin perusteella kliinisesti merkittävät pahenemisvaiheet vähenivät 40 % mepolitsumabia käyttäneillä nuorilla lumetta saaneisiin verrattuna (ilmaantumistiheyksien suhde RR 0,60; 95 % lv: 0,17, 2,10).
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Kliinisiä tietoja ei ole saatavilla 6–17-vuotiaista lapsista ja nuorista.
Hypereosinofiilinen oireyhtymä (HES)
Neljä nuorta (ikä 12–17 v) otettiin mukaan tutkimukseen 200622: yksi nuorista sai 300 mg mepolitsumabia ja kolme nuorta lumetta 32 viikon ajan. Tässä 32-viikkoisessa tutkimuksessa 200622 ainoalla mepolitsumabia saaneella nuorella ei esiintynyt HES:n pahenemisvaihetta. Kaikki tutkimuksen 200622 loppuun suorittanutta neljä nuorta jatkoivat 20 viikon avoimeen jatkotutkimukseen 205203, jossa yhdellä heistä esiintyi yksi HES:n pahenemisvaihe.
Farmakokinetiikka
Astma- ja CRSwNP-potilaille ihon alle annettujen annosten jälkeen mepolitsumabin farmakokinetiikka oli jokseenkin suoraan annoksesta riippuvainen annosalueella 12,5–250 mg. Ihon alle annettujen 300 mg:n mepolitsumabiannosten jälkeen systeeminen altistus oli noin kolminkertainen verrattuna 100 mg:n mepolitsumabiannoksiin. Mepolitsumabin farmakokinetiikka oli yhdenmukainen astma-, CRSwNP-, COPD-, EGPA- ja HES‑potilailla. Terveille tutkittaville annettujen ihonalaisten 100 mg kerta-annosten jälkeen mepolitsumabin systeeminen altistus oli vastaava eri formulaatioilla.
Imeytyminen
Terveille tutkittaville tai astmapotilaille annettujen ihonalaisten annosten jälkeen mepolitsumabi imeytyi hitaasti, ja maksimipitoisuus (Tmax) plasmassa saavutettiin 4–8 vuorokauden (mediaani) kuluttua.
Terveille tutkittaville annettujen ihonalaisten kerta-annosten jälkeen mepolitsumabin absoluuttinen hyötyosuus oli 64 % vatsaan, 71 % reiteen ja 75 % olkavarteen annetun annoksen jälkeen. Astmapotilaille olkavarteen annettujen ihonalaisten annosten jälkeen mepolitsumabin absoluuttinen hyötyosuus oli 74–80 %. Neljän viikon välein annettujen toistuvien ihonalaisten annosten jälkeen kumuloituminen on noin kaksinkertaista vakaan tilan aikana.
Jakautuminen
Astmapotilaille laskimoon annetun kerta-annoksen jälkeen mepolitsumabin jakautumistilavuuden keskiarvo on 55–85 ml/kg.
Biotransformaatio
Mepolitsumabi on humanisoitu monoklonaalinen IgG1-vasta-aine, ja sitä pilkkovat proteolyyttiset entsyymit ovat jakautuneet laajalle elimistössä eivätkä rajoitu vain maksakudokseen.
Eliminaatio
Astmapotilaille laskimoon annetun kerta-annoksen jälkeen systeemisen puhdistuman keskiarvo oli 1,9–3,3 ml/vrk/kg, ja terminaalisen puoliintumisajan keskiarvo oli noin 20 vuorokautta. Ihon alle annettujen mepolitsumabiannosten jälkeen terminaalisen puoliintumisajan (t½) keskiarvo oli 16–22 vuorokautta. Populaatiofarmakokineettisessä analyysissä mepolitsumabin arvioitu systeeminen puhdistuma oli 3,1 ml/vrk/kg.
Erityisryhmät
Iäkkäät (≥ 65-vuotiaat) potilaat
Iäkkäitä (≥ 65-vuotiaita) potilaita koskevat farmakokineettiset tiedot ovat vähäisiä kaikissa kliinisissä tutkimuksissa (n = 90). Populaatiofarmakokineettisessä analyysissä ei kuitenkaan havaittu viitteitä iän vaikutuksista mepolitsumabin farmakokinetiikkaan 12–82-vuotiaiden ikäryhmässä.
Munuaisten vajaatoiminta
Varsinaisia tutkimuksia munuaisten vajaatoiminnan vaikutuksista mepolitsumabin farmakokinetiikkaan ei ole tehty. Populaatiofarmakokineettisten analyysien perusteella annosta ei tarvitse muuttaa, jos potilaan kreatiniinipuhdistuma on 50–80 ml/min. Potilaista, joiden kreatiniinipuhdistuma-arvot ovat < 50 ml/min, on vain vähän tietoja.
Maksan vajaatoiminta
Varsinaisia tutkimuksia maksan vajaatoiminnan vaikutuksista mepolitsumabin farmakokinetiikkaan ei ole tehty. Koska mepolitsumabi pilkkoutuu suurelta osin sellaisten proteolyyttisten entsyymien vaikutuksesta, jotka eivät rajoitu vain maksakudokseen, maksan toiminnan muutokset eivät todennäköisesti vaikuta mepolitsumabin eliminoitumiseen.
Pediatriset potilaat
Vaikea eosinofiilinen astma ja hypereosinofiilinen oireyhtymä (HES)
Saatavana on vain vähän farmakokineettistä tietoa pediatrisista potilaista (59 potilasta, joilla oli eosinofiilinen ruokatorvitulehdus, 55 potilasta, joilla oli vaikea hoitoresistentti eosinofiilinen astma, ja 1 potilas, jolla oli HES).Laskimoon annetun mepolitsumabin farmakokinetiikkaa arvioitiin eosinofiilistä ruokatorvitulehdusta sairastaneiden 2–17-vuotiaiden potilaiden pediatrisesta tutkimuksesta tehdyssä populaatiofarmakokineettisessä analyysissä. Pediatrinen farmakokinetiikka oli suurelta osin ennustettavissa aikuisilla todetun farmakokinetiikan perusteella, kun potilaiden paino otettiin huomioon. Mepolitsumabin farmakokinetiikka oli kolmannen vaiheen tutkimuksiin osallistuneilla vaikeaa hoitoresistenttiä eosinofiilistä astmaa tai HES:ää sairastavilla nuorilla potilailla samanlainen kuin aikuisilla (ks. kohta Annostus ja antotapa).
Ihon alle annetun valmisteen farmakokinetiikkaa tutkittiin 6–11-vuotiailla pediatrisilla potilailla vaikean hoitoresistentin eosinofiilisen astman hoidossa avoimessa, kontrolloimattomassa, 12 viikon pituisessa tutkimuksessa. Pediatrisilla tutkittavilla farmakokinetiikka oli pitkälti yhdenmukainen aikuisten ja nuorten farmakokinetiikan kanssa, kun paino ja biologinen hyötyosuus otettiin huomioon. Ihon alle annetun valmisteen absoluuttinen biologinen hyötyosuus näyttää olevan täydellinen verrattuna aikuisten ja nuorten 76 %:iin. Aikuisten 100 mg annoksen käytön yhteydessä havaittuun altistukseen verrattuna altistus oli 1,32-kertainen, kun valmistetta annettiin ihon alle 40 mg (tutkittavien paino < 40 kg), ja 1,97-kertainen, kun valmistetta annettiin ihon alle 100 mg (tutkittavien paino ≥ 40 kg).
Farmakokineettiseen mallinnukseen ja simulaatioon perustuvassa tutkimuksessa 6–11-vuotiaille, 15–70 kg painaville lapsille annettiin 40 mg valmistetta ihon alle 4 viikon välein. Tulosten perusteella voidaan ennustaa, että kyseisen annostuksen tuottama altistus pysyy keskimäärin tasolla 38 % verrattuna aikuisilla 100 mg annoksen käytön yhteydessä havaittuun altistukseen. Annostuksen katsotaan olevan hyväksyttävä mepolitsumabin suuren terapeuttisen indeksin takia.
Eosinofiilinen granulomatoottinen polyangiitti (EGPA)
Mepolitsumabin farmakokinetiikkaa 6–17-vuotiailla EGPA-potilailla ennustettiin muiden eosinofiilisten sairauksien farmakokinetiikkaan perustuvien mallinnusten ja simulaatioiden avulla, ja sen oletetaan noudattavan vaikeaa eosinofiilista astmaa sairastavien lasten farmakokinetiikkaa. 6–11-vuotiaiden 15–70 kg painavien lasten suositellun annostuksen perusteella voidaan olettaa, että altistus pysyy keskimäärin 26 %:ssa aikuisten altistuksesta 300 mg:n annoksella.
Prekliiniset tiedot turvallisuudesta
Koska mepolitsumabi on monoklonaalinen vasta-aine, genotoksisuus- ja karsinogeenisuustutkimuksia ei ole tehty.
Eläintoksikologia ja/tai ‑farmakologia
Farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien apinoilla tehtyjen konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Apinoille laskimoon ja ihon alle annetut annokset pienensivät perifeerisen veren ja keuhkojen eosinofiilimäärää ja toksikologisia löydöksiä ei havaittu.
Eosinofiilien arvellaan liittyvän joidenkin loisinfektioiden aiheuttamiin immuunireaktioihin. IL-5-vasta-aineita saaneilla hiirillä tai hiirillä, joilla oli geneettinen IL-5:n tai eosinofiilien puutos, ei havaittu viitteitä siitä, että niiden kyky selviytyä loisinfektiosta olisi heikentynyt. Näiden löydösten merkitystä ihmisille ei tunneta.
Hedelmällisyys
Hiirillä tehdyissä hedelmällisyystutkimuksissa ja yleisissä lisääntymistoksisuustutkimuksissa, joissa käytettiin hiiren IL-5-sytokiinin toimintaa estävää samankaltaista vasta-ainetta, ei havaittu hedelmällisyyden heikkenemistä. Tässä tutkimuksessa ei arvioitu poikimista eikä jälkeläisten toiminnallista kehitystä.
Raskaus
Apinoilla tehdyissä tutkimuksissa mepolitsumabi ei vaikuttanut tiineyteen eikä alkion-/sikiönkehitykseen tai jälkeläisten postnataaliseen kehitykseen (ei myöskään immuunijärjestelmän toimintaan). Mahdollisia sisäelinten tai luuston epämuodostumia ei tutkittu. Jaavanmakakeista saadut tiedot osoittavat, että mepolitsumabi läpäisi istukan. Mepolitsumabipitoisuudet olivat noin 1,2–2,4 kertaa suuremmat poikasilla kuin emoilla useiden kuukausien ajan syntymän jälkeen, mutta tämä ei vaikuttanut poikasten immuunijärjestelmän toimintaan.
Farmaseuttiset tiedot
Apuaineet
Sakkaroosi
Dinatriumfosfaattiheptahydraatti
Sitruunahappomonohydraatti
Polysorbaatti 80 (E433)
Dinatriumedetaatti
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Tarvittaessa esitäytetyn kynän tai esitäytetyn ruiskun/esitäytetyt ruiskut voi ottaa jääkaapista ja pitää avaamattomassa pakkauksessa huoneenlämmössä (enintään 30 °C:ssa) enintään 7 vuorokauden ajan, kunhan se säilytetään suojassa valolta. Jos pakkausta on pidetty jääkaapin ulkopuolella yli 7 vuorokauden ajan, se on hävitettävä.
Esitäytetty kynä tai esitäytetty ruisku/esitäytetyt ruiskut on käytettävä 8 tunnin kuluessa pakkauksen avaamisesta. Jos valmistetta ei ole annettu 8 tunnin sisällä, pakkaus on hävitettävä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NUCALA injektioneste, liuos, esitäytetty kynä
100 mg (L:ei) 1 kpl (1 ml, kiinteä neula) (1196,65 €)
NUCALA injektioneste, liuos, esitäytetty ruisku
40 mg (L:ei) 1 kpl (0,4 ml, kiinteä neula, turvasuojus) (498,27 €)
100 mg (L:ei) 1 kpl (1 ml, kiinteä neula, turvasuojus) (1196,65 €)
PF-selosteen tieto
Nucala 100 mg injektioneste, liuos, esitäytetty kynä
1 ml liuosta esitäytetyssä kynässä, jossa on tyypin 1 lasiruisku ja kiinteä neula (ruostumatonta terästä).
Pakkauskoot:
1 esitäytetty kynä
Kerrannaispakkaus, jossa on 3 esitäytettyä kynää (3 x 1 esitäytettyä kynää)
Kerrannaispakkaus, jossa on 9 esitäytettyä kynää (9 x 1 esitäytettyä kynää)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Nucala 100 mg injektioneste, liuos, esitäytetty ruisku
1 ml liuosta tyypin 1 lasiruiskussa, jossa on kiinteä neula (ruostumatonta terästä) ja passiivinen neulan turvasuojus.
Pakkauskoot:
1 esitäytetty ruisku
Kerrannaispakkaus, jossa on 3 esitäytettyä ruiskua (3 x 1 esitäytettyä ruiskua)
Kerrannaispakkaus, jossa on 9 esitäytettyä ruiskua (9 x 1 esitäytettyä ruiskua)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Nucala 40 mg injektioneste, liuos, esitäytetty ruisku
0,4 ml liuosta 1 ml:n tyypin 1 lasiruiskussa, jossa on kiinteä neula (ruostumatonta terästä) ja passiivinen neulan turvasuojus.
Pakkauskoot:
1 esitäytetty ruisku
Kerrannaispakkaus, jossa on 3 esitäytettyä ruiskua (3 x 1 esitäytettyä ruiskua)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai opalisoiva, väritön, vaaleankeltainen tai vaaleanruskea liuos. Liuoksen pH on 6,0–6,6 ja osmolaliteetti 415–615 mOsm/kg.
Käyttö- ja käsittelyohjeet
Ennen antoa liuos on tarkastettava silmämääräisesti. Liuoksen on oltava kirkasta tai opalisoivaa ja väritöntä, vaaleankeltaista tai vaaleanruskeaa. Jos liuos on sameaa, värjäytynyttä tai sisältää partikkeleita, liuosta ei saa käyttää.
Kun esitäytetty kynä tai esitäytetty ruisku/esitäytetyt ruiskut otetaan pois jääkaapista, anna kynän tai ruiskun/ruiskujen lämmetä huoneenlämpöön vähintään 30 minuutin ajan ennen Nucalan injektoimista.
Yksityiskohtaiset ohjeet Nucala-valmisteen antoon ihon alle esitäytetyllä kynällä tai esitäytetyllä ruiskulla annetaan pakkausselosteen lopussa.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NUCALA injektioneste, liuos, esitäytetty kynä
100 mg 1 kpl
NUCALA injektioneste, liuos, esitäytetty ruisku
40 mg 1 kpl
100 mg 1 kpl
- Alempi erityiskorvaus (65 %). Mepolitsumabi: Vaikean eosinofiilisen astman hoito aikuisille ja 6 vuotta täyttäneille lapsille ja nuorille erityisin edellytyksin (297).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Mepolitsumabi: Aikuisten ja 6 vuotta täyttäneiden lasten ja nuorten vaikean eosinofiilisen astman sekä aikuisten vaikean kroonisen polypoottisen rinosinuiitin hoito erityisin edellytyksin (3028).
ATC-koodi
R03DX09
Valmisteyhteenvedon muuttamispäivämäärä
04.02.2026
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
