EMGALITY injektioneste, liuos, esitäytetty kynä 120 mg
Vaikuttavat aineet ja niiden määrät
Yksi esitäytetty kynä sisältää 120 mg galkanetsumabia 1 millilitrassa.
Galkanetsumabi on rekombinantti humanisoitu monoklonaalinen vasta-aine, joka tuotetaan kiinanhamsterin munasarjasoluissa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste).
Kliiniset tiedot
Käyttöaiheet
Emgality on tarkoitettu migreenin estohoitoon aikuisilla, joilla on vähintään 4 migreenipäivää kuukaudessa.
Ehto
Hoidon saa aloittaa migreenin toteamiseen ja hoitoon perehtynyt lääkäri.
Annostus ja antotapa
Hoidon aloittaa migreenin toteamiseen ja hoitoon perehtynyt lääkäri.
Annostus
Suositeltu annos on 120 mg galkanetsumabia injektiona ihon alle kerran kuukaudessa. Ensimmäisenä annetaan 240 mg aloitusannos.
Potilaita on neuvottava pistämään unohtunut annos mahdollisimman pian ja tämän jälkeen palaamaan kuukausittaiseen annosteluun.
Hoidon hyöty on arvioitava 3 kk kuluessa hoidon aloittamisesta. Mahdollisesta hoidon jatkamisesta tämän jälkeen on päätettävä potilaskohtaisesti. Hoidon jatkamistarve on suositeltavaa arvioida säännöllisin välein tämän jälkeen.
Iäkkäät (≥ 65 vuotta)
Galkanetsumabi-valmisteen käytöstä ≥ 65-vuotiailla potilailla on rajallisesti tietoa. Annosta ei tarvitse muuttaa, sillä ikä ei vaikuta galkanetsumabin farmakokinetiikkaan.
Munuaisten/maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta tai maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Galkanetsumabin turvallisuutta ja tehoa 6–18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Ei ole asianmukaista käyttää galkanetsumabia alle 6 vuoden ikäisten lasten migreenin estohoitoon.
Antotapa
Ihon alle.
Potilas voi pistää galkanetsumabin itse noudattamalla käyttöohjeita. Galkanetsumabi pistetään vatsan, reiden, olkavarren takaosan tai pakaran alueen ihon alle. Opetuksen jälkeen potilas voi pistää galkanetsumabin itse, jos terveydenhuollon ammattilainen katsoo sen tarkoituksenmukaiseksi. Pakkausselosteessa on valmisteen antoa koskevat kattavat ohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero on kirjattava selvästi.
Kardiovaskulaariset riskit
Potilaat, joilla oli tiettyjä merkittäviä kardiovaskulaarisairauksia, suljettiin pois kliinisistä tutkimuksista (ks. kohta Farmakodynamiikka). Näistä potilaista ei ole saatavana turvallisuustietoja.
Vakava yliherkkyys
Vakavia yliherkkyysreaktioita, mukaan lukien anafylaksia-, angioedeema- ja nokkosihottumatapauksia, on ilmoitettu (ks. kohta Haittavaikutukset). Vakavia yliherkkyysreaktioita saattaa ilmetä yhden päivän sisällä galkanetsumabin annostelusta. Myös tapauksia, joissa reaktion alku on viivästynyt (vaihtelee yli yhdestä päivästä neljään viikkoon annostelun jälkeen), on ilmoitettu. Joissakin tapauksissa yliherkkyysreaktiot kestivät pitkään. Jos potilaalle kehittyy vakava yliherkkyysreaktio, galkanetsumabin anto on lopetettava heti ja asianmukainen hoito on aloitettava (ks. kohta Vasta-aiheet). Potilaille tulee kertoa viivästyneen yliherkkyysreaktion mahdollisuudesta ja neuvoa ottamaan yhteyttä lääkäriin.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 120 mg annos, eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Lääkkeiden yhteisvaikutustutkimuksia ei ole tehty. Galkanetsumabin ominaisuuksien perusteella farmakokineettisiä lääkeaineinteraktioita ei ole odotettavissa.
Raskaus ja imetys
Raskaus
Galkanetsumabin käytöstä raskaana oleville naisille on vain rajallisesti tietoa. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kappale Prekliiniset tiedot turvallisuudesta). Ihmisen immunoglobuliinin (IgG) tiedetään läpäisevän istukkaesteen. Varmuuden vuoksi galkanetsumabin käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö galkanetsumabi ihmisen rintamaitoon. Ihmisen IgG:n tiedetään erittyvän rintamaitoon ensimmäisten synnytyksen jälkeisten päivien aikana, minkä jälkeen pitoisuudet pienenevät pian matalalle tasolle. Imetettävälle lapselle tämän lyhyen ajanjakson aikana koituvaa riskiä ei siis voida sulkea pois. Tämän jälkeen galkanetsumabin käyttöä imetyksen aikana voidaan harkita vain, jos se on kliinisesti tarpeen.
Hedelmällisyys
Galkanetsumabin vaikutusta ihmisen hedelmällisyyteen ei ole arvioitu. Eläimillä tehdyissä hedelmällisyystutkimuksissa ei ole havaittu viitteitä miesten eikä naisten hedelmällisyyteen kohdistuvista haitallisista vaikutuksista (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Galkanetsumabi voi vaikuttaa vähäisessä määrin ajokykyyn ja koneiden käyttökykyyn. Galkanetsumabin annostelun jälkeen voi esiintyä kiertohuimausta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Galkanetsumabin myyntilupaa tukeneissa, migreenin estohoitoa arvioinneissa tutkimuksissa galkanetsumabille altistui yli 2 500 potilasta. Yli 1 400 potilasta altistui galkanetsumabille lumekontrolloitujen vaiheen 3 tutkimusten kaksoissokkoutetussa vaiheessa. 279 potilasta altistui lääkeaineelle 12 kk ajan.
Ilmoitetut haittavaikutukset (120 mg/240 mg annostuksella) kliinisissä migreenitutkimuksissa olivat injektiokohdan kipu (10,1 %/11,6 %), injektiokohdan reaktiot (9,9 %/14,5 %), kiertohuimaus (0,7 %/1,2 %), ummetus (1,0 %/1,5 %), kutina (0,7 %/1,2 %) ja nokkosihottuma (0,3 %/0,1 %). Useimmat reaktiot olivat vaikeusasteeltaan lieviä tai keskivaikeita. Alle 2,5 % näiden tutkimusten potilaista lopetti tutkimuksen haittavaikutusten vuoksi.
Haittavaikutustaulukko
Taulukko 1. Kliinisissä tutkimuksissa todetut ja markkinoilletulon jälkeen ilmoitetut haittavaikutukset
Arvioitu esiintymistiheys: Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000).
Elinjärjestelmä | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen |
| Immuunijärjestelmä | Anafylaksia Angioedeema | |||
Kuulo ja tasapainoelin | Kiertohuimaus | |||
Ruoansulatuselimistö | Ummetus | |||
Iho ja ihonalainen kudos | Kutina | Nokkosihottuma | ||
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan kipu |
a Yleisimmin ilmoitetut MedDRA-termit (≥ 1 %) olivat: Injektiokohdan reaktio, injektiokohdan punoitus, injektiokohdan kutina, injektiokohdan mustelmanmuodostus, injektiokohdan turvotus.
Tiettyjen haittavaikutusten kuvaus
Injektiokohdan kipu tai reaktiot
Valtaosa injektiokohtaan liittyvistä reaktioista olivat lieviä tai keskivaikeita, ja alle 0,5 % potilaista, jotka altistuivat galkanetsumabille vaiheen 3 tutkimusten aikana, lopetti hoidon injektiokohdan reaktion vuoksi. Valtaosa injektiokohdan reaktioista ilmoitettiin 1 vrk kuluessa, ja ne lievittyivät keskimäärin 5 vrk kuluessa. 86 %:lla potilaista, jotka ilmoittivat injektiokohdan kipua, reaktio ilmeni 1 tunnin kuluessa injektiosta, ja se korjaantui keskimäärin 1 vuorokaudessa. 1 prosentilla potilaista, jotka altistuivat galkanetsumabille vaiheen 3 tutkimuksissa, oli vaikeaa injektiokohdan kipua.
Nokkosihottuma
Nokkosihottuma on melko harvinaista, mutta kliinisissä galkanetsumabitutkimuksissa on ilmoitettu vakavia nokkosihottumatapauksia.
Immunogeenisuus
Kliinisissä tutkimuksissa lääkevasta-aineiden ilmaantuvuus kaksoissokkoutetun hoitovaiheen aikana oli 4,8 % potilailla, jotka saivat galkanetsumabia kerran kuukaudessa (kaikissa paitsi yhdessä tapauksissa havaittiin in vitro neutraloiva vaikutus). 12 hoitokuukauden kuluttua enimmillään 12,5 %:lle galkanetsumabihoitoa saaneista potilaista kehittyi lääkevasta-aineita. Titterit olivat useimmiten pienet, ja neutralisoivan vaikutuksen in vitro -koetulokset positiiviset. Lääkevasta-aineet eivät kuitenkaan vaikuttaneet galkanetsumabin farmakokinetiikkaan, tehoon eivätkä turvallisuuteen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Ihmisille on annettu enintään 600 mg annoksia ihon alle ilman annosta rajoittavaa toksisuutta. Yliannostustapauksessa on suositeltavaa seurata potilaan vointia haittavaikutusten oireiden ja löydösten varalta ja aloittaa viipymättä asianmukainen oireenmukainen hoito.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: analgeetit, kalsitoniinigeeniin liittyvän peptidin (CGRP) antagonistit, ATC-koodi: N02CD02
Vaikutusmekanismi
Galkanetsumabi on humanisoitu monoklonaalinen IgG4-vasta-aine, joka sitoutuu kalsitoniinigeeniin liittyvään peptidiin (CGRP) ja estää siten sen biologista vaikutusta. Suurentuneet veren CGRP-pitoisuudet on yhdistetty migreenikohtauksiin. Galkanetsumabi sitoutuu CGRP:hen suurella affiniteetilla (KD = 31 pM) ja spesifisyydellä (> 10 000-kertainen vs. vastaavat peptidit: adrenomedulliini, amyliini, kalsitoniini ja intermediini).
Kliininen teho ja turvallisuus
Galkanetsumabin tehoa ja turvallisuutta on tutkittu kolmessa vaiheen 3 satunnaistetussa, lumekontrolloidussa, kaksoissokkoutetussa tutkimuksessa aikuispotilailla (N = 2 886). Kahteen episodista migreeniä arvioineeseen tutkimukseen (EVOLVE-1 ja EVOLVE-2) otettiin potilaita, joiden kohdalla aurallisen tai aurattoman migreenin ICHD-kriteerit (International Classification of Headache Disorders) täyttyivät ja joilla oli 4–14 migreenipäänsärkypäivää kuukaudessa. Kroonista migreeniä arvioineeseen tutkimukseen (REGAIN) otettiin potilaita, joiden kohdalla kroonisen migreenin ICHD-kriteerit täyttyivät ja joilla oli ≥ 15 päänsärkypäivää kuukaudessa ja näistä vähintään 8 päivänä päänsäryn piirteet vastasivat migreeniä. Potilaat, joilla oli jokin tuore, akuutti kardiovaskulaaritapahtuma (mm. sydäninfarkti, epästabiili angina pectoris, sepelvaltimoiden ohitusleikkaus, aivohalvaus, syvä laskimotukos) ja/tai potilaat, joilla arvioitiin olevan vakava kardiovaskulaaririski, suljettiin pois kliinisistä galkanetsumabitutkimuksista. Myös yli 65-vuotiaat potilaat suljettiin pois.
Potilaat saivat lumelääkettä, 120 mg/kk galkanetsumabia (aloitusannos 240 mg ensimmäisenä kuukautena) tai 240 mg/kk galkanetsumabia. Lääkkeiden käyttö migreenin akuuttihoitoon oli sallittua. Näissä 3 tutkimuksessa potilaat olivat enimmäkseen naisia (> 83 %), ikäkeskiarvo oli 41 v ja potilaat olivat sairastaneet migreeniä keskimäärin 20–21 vuotta. Noin kolmanneksella potilaista oli kaikissa tutkimuksissa vähintään 1 aiempi migreenin estohoidon epäonnistuminen tehoon liittyvistä syistä, ja noin 16 %:lla potilaista oli kaikissa tutkimuksissa vähintään 2 aiempaa estohoidon epäonnistumista tehoon liittyvistä syistä.
Kaikissa 3 tutkimuksessa ensisijainen tehon muuttuja oli kuukausittaisten migreenipäivien (Migraine Headache Days, MHD) kokonaismuutoksen keskiarvo lähtötilanteesta. Vasteprosentti on niiden potilaiden prosenttiosuuden keskiarvo, jotka saavuttavat määritetyn kynnysarvon kuukausittaisten migreenipäivien vähenemisessä (≥ 50 %, ≥ 75 % ja 100 %) kaksoissokkoutetussa hoitovaiheessa. Migreenin vaikutusta toimintakykyyn arvioitiin MSQ-kyselylomakkeen (Migraine-Specific Quality of Life Questionnaire, versio 2.1) roolitoimintojen rajoittumisen osa-alueella (Role Function-Restrictive domain) sekä MIDAS-kyselylomakkeella (Migraine Disability Assessment). MSQ-kyselyllä mitataan migreenin vaikutusta työhön tai arkitoimiin, ystävyyssuhteisiin ja perhe-elämään, vapaa-aikaan, tuottavuuteen, keskittymiskykyyn, energisyyteen ja väsymykseen. Pisteytys on 0–100, ja suurempi pistemäärä viittaa pienempään toiminnanvajaukseen eli vähäisempään arkitoimien rajoittuneisuuteen. MIDAS-kyselyssä suurempi pistemäärä viittaa suurempaan haitta-asteeseen. Lähtötilanteen MIDAS-pistemäärät vastasivat EVOLVE-1- ja EVOLVE-2-tutkimuksissa vaikeaa migreeniin liittyvää toimintakyvyttömyyttä (keskiarvo 33,1) ja REGAIN-tutkimuksessa hyvin vaikeaa toimintakyvyttömyyttä (keskiarvo 67,2).
Episodinen migreeni
EVOLVE-1- ja EVOLVE-2-tutkimuksissa oli 6 kk pituinen kaksoissokkoutettu, lumekontrolloitu hoitovaihe. Kaksoissokkoutetun vaiheen suoritti loppuun 82,8–87,7 % galkanetsumabia saaneista potilaista.
Sekä galkanetsumabi 120 mg- että 240 mg -hoitoryhmissä havaittiin tilastollisesti merkitsevä ja kliinisesti merkittävä migreenipäivien (keskimuutos) väheneminen lähtötilanteesta lumelääkkeeseen verrattuna (ks. taulukko 2). Galkanetsumabia saaneilla potilailla vasteprosentti oli parempi ja akuuttilääkityksen käyttöön johtaneet kuukausittaiset migreenipäivät vähenivät enemmän kuin lumeryhmässä. Galkanetsumabia saaneiden potilaiden toimintakyky (MSQ-kyselyn roolitoimintojen rajoittumisen pistemäärä) parani enemmän kuin lumelääkettä saaneilla kuukaudesta 1 alkaen. Kliinisesti merkittävä toimintakyvyn paraneminen saavutettiin useammilla galkanetsumabihoitoa saaneilla (vasteprosentti perustuu MSQ-kyselyn roolitoimintojen rajoittumisen osa-alueeseen) kuin lumehoitoa saaneilla. Galkanetsumabihoitoon liittyi tilastollisesti merkitsevästi lumehoitoa parempi toimintakyvyttömyyden väheneminen.
Galkanetsumabihoitoa (120 mg tai 240 mg) saaneilla potilailla kuukausittaisten migreenipäivien keskivähenemä lähtötilanteesta oli merkitsevästi suurempi kuin lumehoitoa saaneilla kk 1 kohdalla ja kaikkina seuraavina kuukausina kk 6 asti (ks. kuva 1). Lisäksi kuukautena 1 galkanetsumabihoitoa (240 mg aloitusannoksen) saaneilla potilailla oli merkitsevästi vähemmän migreenipäiviä viikossa verrattuna lumehoitoa saaneisiin viikon 1 kohdalla ja jokaisena seuraavana viikkona.
Kuva 1. Kuukausittaisten migreenipäivien väheneminen ajan myötä EVOLVE-1- ja EVOLVE-2-tutkimuksissa
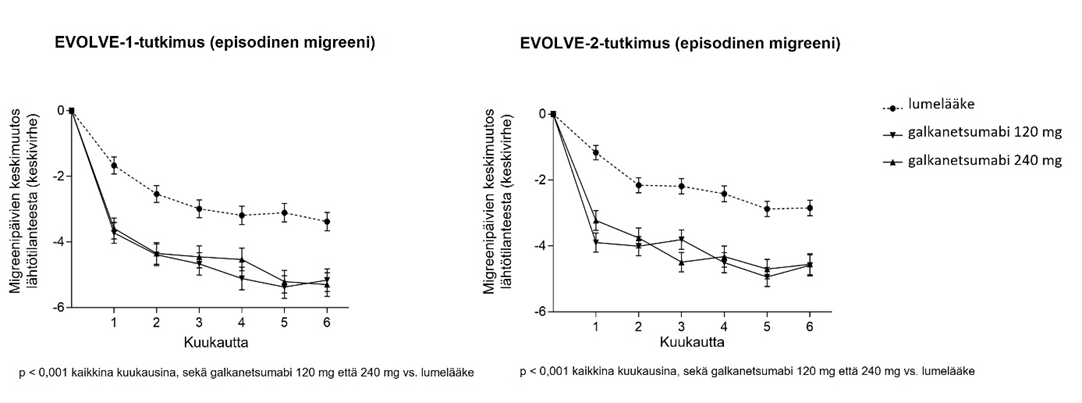
Taulukko 2. Teho ja potilaan raportoimat hoitotulosmittarit
EVOLVE 1 – Episodinen migreeni | EVOLVE 2 - Episodinen migreeni | ||||||||||||
Emgality | Lume | Emgality | Lume | ||||||||||
120 mg | 240 mg | 120 mg | 240 mg | ||||||||||
N = 210 | N = 208 | N = 425 | N = 226 | N = 220 | N = 450 | ||||||||
Tehotulokseta | |||||||||||||
Migreenipäivät (MHD) |
|
|
|
|
| ||||||||
Lähtötilanne | 9,21 | 9,14 | 9,08 | 9,07 | 9,06 | 9,19 | |||||||
Keskimuutos | -4,73 | -4,57 | -2,81 | -4,29 | -4,18 | -2,28 | |||||||
Hoitojen ero | -1,92 | -1,76 | -2,02 | -1,90 | |||||||||
lv95 % | (-2,48, -1,37) | (-2,31, -1,20) | (-2,55, -1,48) | (-2,44, -1,36) | |||||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
≥ 50 % MHD-vaste |
|
|
|
|
|
| |||||||
Prosenttiosuus, % | 62,3 | 60,9 | 38,6 | 59,3 | 56,5 | 36,0 | |||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
≥ 75 % MHD-vaste |
|
|
|
|
|
| |||||||
Prosenttiosuus, % | 38,8 | 38,5 | 19,3 | 33,5 | 34,3 | 17,8 | |||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
100 % MHD-vaste |
|
|
|
|
|
| |||||||
Prosenttiosuus, % | 15,6 | 14,6 | 6,2 | 11,5 | 13,8 | 5,7 | |||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
Akuuttilääkityksen käyttöön johtaneet migreenipäivät | |||||||||||||
Lähtötilanne | 7,42 | 7,34 | 7,38 | 7,47 | 7,47 | 7,62 | |||||||
Keskimuutos | -3,96 | -3,76 | -2,15 | -3,67 | -3,63 | -1,85 | |||||||
Hoitojen ero | -1,81 | -1,61 | -1,82 | -1,78 | |||||||||
lv95 % | (-2,28, -1,33) | (-2,09, -1,14) | (-2,29, -1,36) | (-2,25, -1,31) | |||||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
Potilaan raportoimat hoitotulosmittarit | |||||||||||||
MSQ-kyselyn roolitoimintojen rajoittumisen osa-alueb |
|
|
|
|
|
| |||||||
N | 189 | 184 | 377 | 213 | 210 | 396 | |||||||
Lähtötilanne | 51,39 | 48,76 | 52,92 | 52,47 | 51,71 | 51,35 | |||||||
Keskimuutos | 32,43 | 32,09 | 24,69 | 28,47 | 27,04 | 19,65 | |||||||
Hoitojen ero | 7,74 | 7,40 | 8,82 | 7,39 | |||||||||
lv95 % | (5,20, 10,28) | (4,83, 9,97) | (6,33, 11,31) | (4,88, 9,90) | |||||||||
P-arvo | < 0,001d | < 0,001d |
| < 0,001d | < 0,001d |
| |||||||
Vasteen saaneet, MSQ-kyselyn roolitoimintojen rajoittumisen osa-aluec |
|
|
|
|
|
| |||||||
N | 189 | 184 | 377 | 213 | 210 | 396 | |||||||
Prosenttiosuus, % | 63,5 | 69,6 | 47,2 | 58,2 | 60,0 | 43,4 | |||||||
P-arvo | < 0,001f | < 0,001f |
| < 0,001f | < 0,001f |
| |||||||
MIDAS-kokonaispisteete |
|
|
|
|
|
| |||||||
N | 177 | 170 | 345 | 202 | 194 | 374 | |||||||
Lähtötilanne | 32,93 | 36,09 | 31,84 | 30,87 | 32,75 | 34,25 | |||||||
Keskimuutos | -21,16 | -20,06 | -14,87 | -21,17 | -20,24 | -12,02 | |||||||
Hoitojen ero | -6,29 | -5,19 | -9,15 | -8,22 | |||||||||
lv95 % | (-9,45, -3,13) | (-8,39, -1,98) | (-12,61, -5,69) | (-11,71, -4,72) | |||||||||
P-arvo | < 0,001f | 0,002f |
| < 0,001f | < 0,001f |
| |||||||
N = potilaiden lukumäärä; lv95 % = 95 %:n luottamusväli
a Tehotulokset arvioitiin kuukausilta 1–6.
b Arvioitu kuukausilta 4–6.
c Määritelmänä potilaat, joiden episodinen migreeni koheni ≥ 25 pistettä kuukausina 4–6 (keskiarvo).
d Tilastollisesti merkitsevä monivertailukorjauksen jälkeen.
e Arvioitu kuukauden 6 kohdalla.
f Ei monivertailukorjausta.
EVOLVE-1- ja EVOLVE-2-tutkimusten yhdistettyjen tietojen mukaan potilailla, joilla vähintään yksi estohoito oli epäonnistunut tehoon liittyvistä syistä, hoitojen välinen ero kuukausittaisten migreenipäivien vähentämisessä (keskiarvo) oli galkanetsumabi 120 mg -hoidon ja lumeen välillä -2,69 vrk (p < 0,001) ja galkanetsumabi 240 mg -hoidon ja lumeen välillä -2,78 vrk (p < 0,001). Potilailla, joilla vähintään kaksi estohoitoa oli epäonnistunut, hoitojen välinen ero oli 120 mg -hoidon ja lumeen välillä -2,64 vrk (p < 0,001) ja 240 mg -hoidon ja lumeen välillä -3,04 vrk (p < 0,001).
Krooninen migreeni
REGAIN-tutkimuksessa oli 3 kk pituinen kaksoissokkoutettu, lumekontrolloitu hoitovaihe ja sen jälkeen 9 kk pituinen avoin jatkovaihe. Noin 15 % potilaista jatkoi samanaikaista topiramaatti- tai propranololihoitoa migreenin estohoitoon tutkimussuunnitelman sallimalla tavalla. Galkanetsumabia saaneista potilaista kaksoissokkoutetun vaiheen suoritti loppuun 95,3 %.
Sekä galkanetsumabi 120 mg- että 240 mg -hoitoryhmissä havaittiin tilastollisesti merkitsevä ja kliinisesti merkittävä migreenipäivien keskimuutoksen koheneminen lähtötilanteesta lumelääkkeeseen verrattuna (ks. taulukko 3). Galkanetsumabihoitoa saaneilla vasteprosentti oli suurempi ja akuuttilääkityksen käyttöön johtaneet kuukausittaiset migreenipäivät vähenivät enemmän kuin lumeryhmässä. Galkanetsumabia saaneiden potilaiden toimintakyky (MSQ-kyselyn roolitoimintojen rajoittumisen pistemäärä) koheni enemmän kuin lumelääkettä saaneilla alkaen kuukaudesta 1. Kliinisesti merkittävä toimintakyvyn koheneminen saavutettiin useammilla galkanetsumabihoitoa saaneilla (vasteprosentti perustuu MSQ-kyselyn roolitoimintojen rajoittumisen osa-alueeseen) kuin lumehoitoa saaneilla. 120 mg annos liittyi tilastollisesti merkitsevästi lumehoitoa parempaan toimintakyvyttömyyden lievittymiseen.
Galkanetsumabihoitoa (120 mg tai 240 mg) saaneilla potilailla kuukausittaisten migreenipäivien keskivähenemä lähtötilanteesta oli merkitsevästi suurempi kuin lumehoitoa saaneilla ensimmäisen kuukauden kohdalla ja kaikkina seuraavina kuukausina kk 3 asti (ks. kuva 2). Lisäksi kuukautena 1 galkanetsumabihoitoa (240 mg aloitusannoksen) saaneilla potilailla oli merkitsevästi vähemmän migreenipäiviä viikossa verrattuna lumehoitoa saaneisiin viikon 1 kohdalla ja jokaisena seuraavana viikkona.
Kuva 2. Kuukausittaisten migreenipäivien väheneminen ajan myötä REGAIN-tutkimuksessa
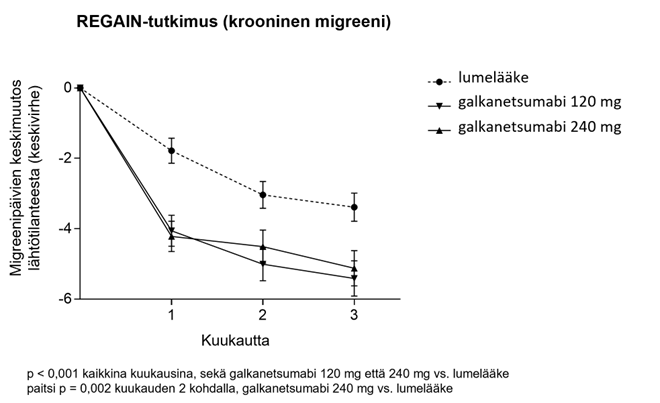
Taulukko 3. Teho ja potilaan raportoimat hoitotulosmittarit
| REGAIN – Krooninen migreeni | ||
Emgality | Lume | ||
120 mg | 240 mg | ||
N = 273 | N = 274 | N = 538 | |
Tehotulokseta | |||
Migreenipäivät (MHD) |
|
|
|
Lähtötilanne | 19,36 | 19,17 | 19,55 |
Keskimuutos | -4,83 | -4,62 | -2,74 |
Hoitojen ero | -2,09 | -1,88 | |
lv95 % | (-2,92, -1,26) | (-2,71, -1,05) | |
P-arvo | < 0,001c | < 0,001c |
|
≥ 50 % MHD-vaste |
|
|
|
Prosenttiosuus, % | 27,6 | 27,5 | 15,4 |
P-arvo | < 0,001c | < 0,001c |
|
≥ 75 % MHD-vaste |
|
|
|
Prosenttiosuus, % | 7,0 | 8,8 | 4,5 |
P-arvo | 0,031d | < 0,001c |
|
100 % MHD-vaste |
|
|
|
Prosenttiosuus, % | 0,7 | 1,3 | 0,5 |
P-arvo | > 0,05d | > 0,05d |
|
Akuuttilääkityksen käyttöön johtaneet migreenipäivät |
|
|
|
Lähtötilanne | 15,12 | 14,49 | 15,51 |
Keskimuutos | -4,74 | -4,25 | -2,23 |
Hoitojen ero | -2,51 | -2,01 | |
lv95 % | (-3,27, -1,76) | (-2,77, -1,26) | |
P-arvo | < 0,001d | < 0,001c |
|
Potilaan raportoimat hoitotulosmittaritb |
|
|
|
MSQ-kyselyn roolitoimintojen rajoittumisen osa-alue |
|
|
|
N | 252 | 253 | 494 |
Lähtötilanne | 39,29 | 38,93 | 38,37 |
Keskimuutos | 21,81 | 23,05 | 16,76 |
Hoitojen ero | 5,06 | 6,29 | |
lv95 % | (2,12, 7,99) | (3,03, 9,55) | |
P-arvo | < 0,001d | < 0,001c |
|
Vasteen saaneet, MSQ-kyselyn roolitoimintojen rajoittumisen osa-alue |
|
|
|
N | 252 | 253 | 494 |
Prosenttiosuus, % | 64,3 | 64,8 | 54,1 |
P-arvo | 0,003e | 0,002e |
|
MIDAS-kokonaispisteet |
|
|
|
N | 254 | 258 | 504 |
Lähtötilanne | 62,46 | 69,17 | 68,66 |
Keskimuutos | -20,27 | -17,02 | -11,53 |
Hoitojen ero | -8,74 | -5,49 | |
lv95 % | (-16,39, -1,08) | (-13,10, 2,12) | |
P-arvo | 0,025e | > 0,05e |
|
N = potilaiden lukumäärä; lv95 % = 95 %:n luottamusväli
a Tehotulokset arvioitiin kuukausilta 1–3.
b Potilaan ilmoittamat hoitotulokset arvioitiin kuukauden 3 kohdalla. Vaste MSQ-kyselyn roolitoimintojen rajoittumisen pistemäärässä määriteltiin kroonisessa migreenissä ≥ 17,14 pisteen kohenemiseksi kuukauden 3 kohdalla.
c Tilastollisesti merkitsevä monivertailukorjauksen jälkeen.
d Ei tilastollisesti merkitsevä monivertailukorjauksen jälkeen.
e Ei monivertailukorjausta.
Potilailla, joilla vähintään yksi estohoito oli epäonnistunut tehoon liittyvistä syistä, hoitojen välinen ero kuukausittaisten migreenipäivien vähentämisessä (keskiarvo) oli galkanetsumabi 120 mg -hoidon ja lumeen välillä -3,54 vrk (p < 0,001) ja galkanetsumabi 240 mg -hoidon ja lumeen välillä -1,37 vrk (p < 0,05). Potilailla, joilla vähintään kaksi estohoitoa oli epäonnistunut, hoitojen välinen ero oli 120 mg -hoidon ja lumeen välillä -4,48 vrk (p < 0,001) ja 240 mg -hoidon ja lumeen välillä -1,86 vrk (p < 0,01).
64 %:lla potilaista oli lähtötilanteessa akuuttipäänsärkylääkityksen liikakäyttöä. Näillä potilailla hoitojen välinen ero migreenipäivien vähentämisessä oli galkanetsumabi 120 mg -hoidon ja lumeen välillä -2,53 vrk (p < 0,001) ja galkanetsumabi 240 mg -hoidon ja lumeen välillä -2,26 vrk (p < 0,001).
Pitkäaikaisteho
Teho säilyi 1 vuoteen asti avoimessa tutkimuksessa, jossa joko episodista tai kroonista migreeniä (lähtötilanteen keskiarvo 10,6 migreenipäivää kuukaudessa) sairastavat potilaat saivat 120 mg/kk (aloitusannoksena 240 mg ensimmäisenä kuukautena) tai 240 mg/kk galkanetsumabia. 77,8 % potilaista suoritti hoitovaiheen loppuun. Kuukausittaisten migreenipäivien kokonaisvähenemän keskiarvo lähtötilanteesta, laskettuna hoitojakson keskiarvona, oli 120 mg -annosryhmässä 5,6 vrk ja 240 mg -annosryhmässä 6,5 vrk. Yli 72 % potilaista, jotka suorittivat tutkimuksen loppuun, ilmoitti kuukauden 12 kohdalla migreenipäivien vähentyneen 50 %. EVOLVE-1- ja EVOLVE-2-tutkimusten yhdistettyjen tietojen mukaan yli 19 %:lla galkanetsumabihoitoa saaneista potilaista ≥ 50 %:n vaste säilyi kuukaudesta 1 kuukauteen 6, kun taas lumeryhmän luku oli 8 % (p < 0,001).
Vaiheen 3 tutkimus potilailla, joiden hoito oli aiemmin epäonnistunut 2-4 migreenin estohoitolääkeryhmällä
CONQUER-tutkimus episodista ja kroonista migreeniä sairastavilla potilailla, joidon hoito oli aiemmin epäonnistunut 2-4 estohoitolääkeaineryhmällä viimeisen 10 vuoden aikana, tuki aiempien migreenitehotutkimusten keskeisiä tuloksia. Galkanetsumabihoito johti kuukausittaisten migreenipäivien (keskiarvo) vähenemiseen (4,1 vrk galkanetsumabiryhmässä verrattuna 1,0 vrk lumelääkeryhmässä; p < 0,0001). Kuukausittaisten migreenipäivien keskimääräinen väheneminen havaittiin myös episodisen migreenin alaryhmässä (2,9 vrk galkanetsumabilla verrattuna 0,3 vrk lumelääkkeellä; p < 0,0001) ja kroonisen migreenin alaryhmässä (5,9 vrk galkanetsumabilla verrattuna 2,2 vrk lumelääkkeellä; p < 0,0001).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset galkanetsumabin käytöstä yhdellä tai useammalla pediatrisella potilasryhmällä migreenin estohoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Populaatiofarmakokineettisen analyysin perusteella 240 mg aloitusannoksen jälkeen galkanetsumabin huippupitoisuus seerumissa (Cmax) oli noin 30 μg/ml (27 % variaatiokerroin), ja huippupitoisuuden saavuttamiseen kulunut aika oli 5 vrk annoksen jälkeen.
Kuukausittaisilla 120 mg annoksilla vakaan tilan Cmax (Cmax, ss) oli noin 28 μg/ml (35 % variaatiokerroin) ja kuukausittaisilla 240 mg annoksilla 54 μg/ml (31 % variaatiokerroin). Galkanetsumabin Cmax, ss kuukausittaisilla 120 mg annoksilla saavutetaan 240 mg:n aloitusannoksen annon jälkeen.
Injektiokohta (vatsa, reisi, pakara tai käsivarsi) ei vaikuttanut merkitsevästi galkanetsumabin imeytymiseen.
Jakautuminen
Populaatiofarmakokineettisen analyysin perusteella galkanetsumabin näennäinen jakautumistilavuus oli 7,3 l.
Biotransformaatio
Galkanetsumabi on humanisoitu monoklonaalinen IgG4-vasta-aine ja hajoaa todennäköisesti pieniksi peptideiksi ja aminohapoiksi kataboliareittien välityksellä samaan tapaan kuin endogeeninen IgG.
Eliminaatio
Populaatiofarmakokineettisen analyysin perusteella galkanetsumabin näennäinen puhdistuma oli noin 0,008 l/h ja puoliintumisaika oli 27 vrk.
Lineaarisuus/ei-lineaarisuus
Galkanetsumabialtistus suurenee suhteessa annokseen.
5–300 mg annoksia arvioineen populaatiofarmakokineettisen analyysin perusteella imeytymisnopeus, näennäinen puhdistuma ja näennäinen jakautumistilavuus olivat annoksesta riippumattomia.
Ikä, sukupuoli, paino, rotu, etninen tausta
Annosta ei tarvitse muuttaa iän (18–65 v), sukupuolen, painon, rodun eikä etnisen taustan perusteella, sillä nämä tekijät eivät vaikuttaneet kliinisesti merkittävästi galkanetsumabin näennäiseen puhdistumaan eivätkä näennäiseen jakautumistilavuuteen.
Munuaisten tai maksan vajaatoiminta
Munuaisten ja maksan vajaatoiminnan vaikutusta galkanetsumabin farmakokinetiikkaan ei ole arvioitu spesifisissä kliinisfarmakologisissa tutkimuksissa. Monoklonaalisten IgG-vasta-aineiden munuaispuhdistuma on vähäistä. Vastaavasti monoklonaaliset IgG-vasta-aineet eliminoituvat lähinnä solunsisäisen katabolian välityksellä, eikä maksan vajaatoiminnan odoteta vaikuttavan galkanetsumabin puhdistumaan. Populaatiofarmakokineettisen analyysin perusteella bilirubiinipitoisuus tai Cockcroft–Gaultin kaavalla laskettu kreatiniinipuhdistuma (vaihteluväli: 24–308 ml/min) ei vaikuttanut merkitsevästi galkanetsumabin näennäiseen puhdistumaan.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta koskevien, rotalla ja jaavanmakakiapinoilla toteutettujen tutkimusten ei-kliiniset tulokset sekä jaavanmakakiapinoilla toteutetut turvallisuusfarmakologiset tutkimukset (altistus noin 10–80-kertainen verrattuna 240 mg saaneiden potilaiden kliiniseen altistukseen) eivät viittaa erityiseen vaaraan ihmisille.
Galkanetsumabin karsinogeenisuutta ja mutageenisuutta ei ole arvioitu ei-kliinisissä tutkimuksissa. Ei ole näyttöä, joka viittaisi syöpäriskin suurentumiseen pitkäaikaisessa galkanetsumabihoidossa, perustuen farmakologisiin tietoihin ja galkanetsumabilla tehtyihin kroonisiin toksisuustutkimuksiin sekä CGRP:tä koskevan kirjallisuuden arviointiin.
Kun rotille annettiin galkanetsumabia (altistus noin 4–20-kertainen verrattuna ihmiselle 240 mg annoksesta aiheutuvaan altistukseen), ei havaittu hedelmällisyysparametreihin kuten kiimakiertoon, siittiöanalyysiin tai paritteluun ja lisääntymiskykyyn kohdistuneita vaikutuksia. Urosten hedelmällisyystutkimuksessa oikean kiveksen paino pienentyi merkitsevästi, kun altistus oli 4-kertainen verrattuna ihmiselle 240 mg annoksesta aiheutuvaan altistukseen.
Tiineyspäivänä 20 rotan alkioiden ja sikiöiden kehitystä ja toksisuutta koskeneessa tutkimuksessa altistuksella, joka vastasi noin 20-kertaisesti ihmiselle 240 mg annoksesta koituvaa altistusta, ilmeni enemmän sikiöitä ja poikueita, joilla oli lyhyitä kylkiluita, ja pienempi luutuneiden häntänikamien keskimäärä. Nämä löydökset havaittiin tasolla, joka ei aiheuttanut emolle toksisuutta. Niitä pidettiin galkanetsumabiin liittyvinä muttei haitallisina.
Kanilla toteutetussa alkion- ja sikiönkehitystä koskeneessa toksisuustutkimuksessa tiineyspäivänä 29 havaittiin kallon poikkeavuus yhdellä urossikiöllä. Emo oli saanut galkanetsumabia altistustasolla, joka vastasi noin 33 kertaa ihmiselle 240 mg annoksesta aiheutuvaa altistusta.
Nuorilla eläimillä toteutetussa toksikologian tutkimuksessa, jossa rotat saivat galkanetsumabia kahdesti viikossa syntymän jälkeisinä päivinä 21–90, systeemiset vaikutukset rajoittuvat korjautuviin, minimaalisiin, ei-haitallisiin vaikutuksiin: luun kokonaismineraalitiheyden ja luuntiheyden pieneneminen, kun altistus vastasi noin 50-kertaisesti ihmiselle 240 mg annoksesta aiheutuvaa altistusta.
Farmaseuttiset tiedot
Apuaineet
L-histidiini
L-histidiinihydrokloridimonohydraatti
Polysorbaatti 80
Natriumkloridi
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Säilytys
Säilytä jääkaapissa (2 °C–8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Emgality voidaan säilyttää huoneenlämmössä enintään 7 päivän ajan korkeintaan 30 °C:n lämpötilassa. Jos nämä olosuhteet ylittyvät, esitäytetty kynä on hävitettävä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EMGALITY injektioneste, liuos, esitäytetty kynä
120 mg (L:ei) 1 kpl (1 ml (120 mg/ml)) (428,50 €)
PF-selosteen tieto
Tyypin I kirkas lasiruisku. Ruisku on pakattu kertakäyttöiseen kerta-annoskynään. Pakkauskoot: 1, 2 tai 3 esitäytettyä kynää. Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
Valmisteen kuvaus:
Liuos on kirkas, väritön tai hiukan kellertävä.
Käyttö- ja käsittelyohjeet
Käyttöohjeet
Pakkausselosteen mukana olevia kynän käyttöohjeita on noudatettava tarkoin. Esitäytetty kynä on tarkoitettu vain kokonaan käytettäväksi.
Esitäytetty kynä on tarkastettava silmämääräisesti ennen lääkkeenantoa. Emgality-valmistetta ei saa käyttää, jos liuos on sameaa tai värjääntynyttä tai sisältää hiukkasia tai jos mikään kynän osa vaikuttaa vahingoittuneelta.
Ei saa ravistaa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
EMGALITY injektioneste, liuos, esitäytetty kynä
120 mg 1 kpl
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Atogepantti, eptinetsumabi, erenumabi, fremanetsumabi, galkanetsumabi ja rimegepantti (migreenin estohoito): Aikuisten migreenin estohoito erityisin edellytyksin (3007).
ATC-koodi
N02CD02
Valmisteyhteenvedon muuttamispäivämäärä
12.01.2026
Yhteystiedot
 OY ELI LILLY FINLAND AB
OY ELI LILLY FINLAND AB Mannerheimintie 117
00280 Helsinki
09 854 5250
www.lilly.com/fi
medinfo_finland@lilly.com
Lääketietopalvelu puh. 0800-140 240
