NOCDURNA tabletti, kylmäkuivattu 25 mikrog, 50 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kylmäkuivattu tabletti sisältää desmopressiiniasetaattia vastaten 25 tai 50 mikrogrammaa desmopressiiniä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kylmäkuivattu.
Kliiniset tiedot
Käyttöaiheet
Sisäsyntyisestä yöllisestä polyuriasta johtuvan nokturian oireenmukainen hoito aikuisilla (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
- Naiset: 25 mikrog päivittäin tuntia ennen nukkumaanmenoa. Tabletti laitetaan kielen alle, jonne se liukenee ilman vettä.
- Miehet: 50 mikrog päivittäin tuntia ennen nukkumaanmenoa. Tabletti laitetaan kielen alle, jonne se liukenee ilman vettä.
Annoksen suurentamista ei suositella 65-vuotiaille tai vanhemmilla potilaille.
Jos alle 65-vuotiaille potilaille harkitaan suurempia annoksia riittämättömän vasteen vuoksi, tulee heillä käyttää jotain muuta oraalista desmopressiini-valmistetta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka)
Mikäli nesteretention ja/tai hyponatremian merkkejä tai oireita (päänsärky, pahoinvointi/oksentelu, painonnousu ja vaikeimmissa tapauksissa kouristukset) esiintyy, on hoito keskeytettävä ja arvioitava uudelleen. Hoitoa uudelleen aloitettaessa nesteiden nauttimiselle asetettuja rajoituksia on noudatettava erittäin tarkasti ja seerumin natriumpitoisuuksia seurattava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nocdurna-hoito pitää keskeyttää, jos seerumin natriumpitoisuudet laskevat alle normaalialueen alarajan (toisin sanoen135 mmol/l).
Erityisryhmät
Iäkkäät (65-vuotiaat ja vanhemmat)
Iäkkäillä potilailla on suurentunut desmopressiinihoitoon liittyvä hyponatremian kehittymisen riski ja heillä saattaa olla myös munuaisten vajaatoiminta. Tämän ikäryhmän kohdalla on tämän vuoksi noudattettava varovaisuutta ja yli 25 mikrogramman (naiset) ja yli 50 mikrogramman (miehet) vuorokausiannoksia ei pidä käyttää. Iäkkäillä potilailla seerumin natriumpitoisuuksien pitää olla normaalialueella sekä ennen hoidon aloitusta, ensimmäisellä hoitoviikolla (4-8 vrk kuluttua aloituksesta), että yhden kuukauden kuluttua. Nocdurna-hoito pitää keskeyttää, jos seerumin natriumpitoisuus laskee alle normaalialueen alarajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Iäkkäiden potilaiden hoidon jatkamista on harkittava tarkoin, jos kolmen kuukauden kuluttua ei ole näyttöä hoidon terapeuttisesta hyödystä.
Munuaisten vajaatoiminta
Nocdurna on vasta-aiheinen potilaille, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta (ks. kohta Vasta-aiheet).
Maksan vajaatoiminta
Annosta ei tarvitse mukauttaa potilaille, joilla on maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Lapset
Nocdurna-valmistetta ei ole tarkoitettu lapsille. Käyttöaihe on sisäsyntyisestä yöllisestä polyuriasta johtuvan nokturian oireenmukainen hoito aikuisille.
Antotapa
Nocdurna-tabletti asetetaan kielen alle. Tablettia ei tarvitse ottaa veden kanssa, vaan se sulaa sellaisenaan kielen alle.
Ruoan nauttiminen voi heikentää desmopressiinin antidiureettisen vaikutuksen voimakkuutta ja kestoa silloin, kun sitä käytetään pieninä annoksina (ks. kohta Farmakokinetiikka).
Vasta-aiheet
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
- Habituaalinen tai psykogeeninen polydipsia (virtsanmuodostus on tällöin yli 40 ml/kg/vrk)
- Aiemmin todettu tai epäilty sydämen vajaatoiminta tai muut tilat, joihin liittyy nesteen kertymistä ja jotka vaativat diureettihoitoa, aiemmat edellä mainitut tilat mukaan lukien.
- Keskivaikea tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 50 ml/min)
- Aiemmin todettu hyponatremia
- Antidiureettisen hormonin epäasianmukaisen erityksen oireyhtymä (SIADH)
Varoitukset ja käyttöön liittyvät varotoimet
Potilaille, erityisesti iäkkäille, pitää tehdä kliininen tutkimus ja haastattelu ennen Nocdurna-hoidon aloittamista, koska yöllinen polyuria voi olla oire sydän- ja verisuonitaudista tai muusta tilasta, johon liittyy nesteen kertymistä. Jos tällaisista samanaikaisista tiloista on minkäänlaista epäilyä, desmopressiinihoitoa ei suositella (ks. myös kohta Vasta-aiheet).
Nesteen saantia on rajoittettava vähintään 1 tunti ennen annostelua ja 8 tuntia annostelun jälkeen. Ellei hoidon aikana noudateta nesteen saannin rajoittamista, seurauksena saattaa olla pitkittynyt nesteretentio ja/tai hyponatremia, johon saattaa liittyä tai olla liittymättä varoittavia merkkejä ja oireita (päänsärky, pahoinvointi/oksentelu, painonnousu ja vakavimmissa tapauksissa kouristukset).
Korkea ikä ja normaalin alarajoilla oleva seerumin natriumpitoisuus voivat altistaa hyponatremialle. Seerumin natriumia on seurattava 65-vuotiailla ja vanhemmilla potilailla sekä ennen hoidon aloitusta, ensimmäisellä hoitoviikolla (4-8 vrk kuluttua), että yhden kuukauden kuluttua (ks. kohta Annostus ja antotapa).
50 mikrogramman annostasolla naisilla saattaa olla suurempi hyponatremian riski kuin miehillä (ks. kohta Farmakodynamiikka). Tämän vuoksi on tärkeää, että noudatetaan sukupuolispesifisiä annossuosituksia.
Nocdurna-hoito pitää lopettaa, jos seerumin natriumpitoisuudet laskevat alle normaalialueen alarajan.
Desmopressiiniä on käytettävä varoen potilaille, joiden tila vaikuttaa neste ja/tai elektrolyyttitasapainoon.
Desmopressiinihoito pitää keskeyttää ja arvioida uudelleen, jos potilaalla ilmenee akuutti sairaus, johon liittyy neste- ja/tai elektrolyyttitasapainon häiriöitä (kuten systeemiset infektiot, kuume ja gastroenteriitti).
Hyponatremian välttämiseksi on noudatettava varovaisuutta, esim. nesterajoituksin ja seerumin natriumpitoisuuden tiheämmällä seurannalla erityisesti, jos samanaikaisesti käytetään hoitona lääkeaineita, joiden tiedetään indusoivan SIADH:ia (antidiureettisen hormonin liikaeritys), esim. trisykliset antidepressantit, selektiiviset serotoniinin takaisinoton estäjät, klooripromatsiini, diureetit ja karbamatsepiini, ja jotkut sulfonyyliurearyhmän diabeteslääkkeet, erityisesti klooripropamidi, ja jos hoitona käytetään samanaikaisesti tulehduskipulääkkeitä (NSAID-valmisteet).
Erityistä varovaisuutta on noudatettava potilaille, jotka käyttävät tiatsidi- tai loop-diureetteja hypertension tai muiden sairauksien hoitoon, joihin ei liity nesteen kertymistä. Näiden potilaiden seerumin natriumpitoisuuksia pitää seurata.
Vaikea rakon toimintahäiriö ja virtsaelinten tukos on huomioitava ennen hoidon aloittamista.
Varovaisuutta pitää noudattaa potilaille, joilla on kystinen fibroosi, sepelvaltimotauti, hypertensio, krooninen munuaissairaus tai pre-eklampsia.
Munuaisperäisen diabetes insipiduksen mahdollisuus on huomioitava, mikäli yöllinen virtsamäärä ei pienene desmopressiinihoidon aloituksen jälkeen.
Erityistä varovaisuutta on noudatettava litiumia käyttävillä potilailla sen varalta, että desmopressiinin annostelu nokturia-käyttöaiheessa saattaa peittää varhaisasteen litiumin indusoiman munuaisperäisen diabetes insipiduksen. Desmopressiiniä ei suositella potilaille, joilla epäillään olevan litiumin aiheuttama munuaisperäinen diabetes insipidus.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Aineet, joiden tiedetään indusoivan SIADH:ia, saattavat suurentaa nesteretention/hyponatremian riskiä (esim. trisykliset antidepressantit, selektiiviset serotoniinin takaisinoton estäjät, klooripromatsiini, diureetit ja karbamatsepiini sekä sulfonyyliurearyhmään kuuluvat diabeteslääkkeet, erityisesti klooripropamidi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Steroideihin kuulumattomat tulehduskipulääkkeet (NSAID-valmisteet) ja oksitosiini saattavat voimistaa desmopressiinin antidiureettista vaikutusta ja indusoida nesteretentiota/hyponatremiaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Litium saattaa heikentää desmopressiinin antidiureettista vaikutusta.
Farmakokineettiset yhteisvaikutukset
Samanaikainen loperamidihoito saattaa kolminkertaistaa suun kautta otetun desmopressiinin pitoisuuden plasmassa, ja tämä saattaa suurentaa nesteretention/hyponatremian riskiä. Myös muilla suolen toimintaa hidastavilla lääkkeillä voi olla samanlainen vaikutus, vaikka tätä ei olekaan tutkittu.
Standardisoitu 27 % rasvaa sisältävä ateria vähensi merkitsevästi desmopressiinitablettien imeytymistä (nopeutta ja laajuutta). Tällä ei ole kuitenkaan havaittu olevan merkitsevää vaikutusta farmakodynaamisiin ominaisuuksiin (virtsaneritys tai osmolaalisuus).
Ruoan nauttiminen voi heikentää antidiureettisen vaikutuksen voimakkuutta ja kestoa, kun desmopressiinitabletteja käytetään pieninä annoksina.
Raskaus ja imetys
Raskaus
Varovaisuutta on noudatettava määrättäessä valmistetta raskaana oleville naisille.
Tiedot rajoitetusta määrästä (n = 53) naisia, joiden diabetes insipidusta on hoidettu desmopressiinillä raskauden aikana, samoin kuin tiedot rajoitetusta määrästä (n = 216) demopressiinillä hoidettuja raskaana olevia naisia, joilla on verenvuotokomplikaatioita, eivät anna viitteitä siitä, että desmopressiinillä olisi haitallista vaikutusta raskauteen tai sikiön/vastasyntyneen lapsen terveyteen. Toistaiseksi mitään muuta relevanttia epidemiologista tietoa ei ole saatavissa. Eläintutkimukset eivät anna mitään viitteitä suorasta tai epäsuorasta haitallisesta vaikutuksesta raskauteen, alkion/sikiön kehitykseen, synnytykseen tai synnytyksenjälkeiseen kehitykseen.
Eläimillä tehdyt lisääntymistutkimukset eivät ole osoittaneet mitään kliinisesti olennaisia vaikutuksia emoon ja jälkeläiseen. In vitro -tutkimukset ihmisen istukkaliuskalla ovat osoittaneet, että desmopressiini ei läpäise istukkaa kun sitä annetaan suositusten mukaisina terapeuttisina annoksina.
Imetys
Tulokset suuria desmopressiiniannoksia (300 mikrog intranasaalisesti) saavien äitien maidon analyyseista ovat osoittaneet, että lapseen mahdollisesti siirtyvät desmopressiinimäärät ovat huomattavasti pienemmät kuin määrät, joilla vaikutetaan diureesiin. Imetyksen lopettamista ei näin ollen pidetä välttämättömänä.
Hedelmällisyys
Eläimillä tehdyt desmopressiinitutkimukset eivät ole osoittaneet merkkejä koiras- tai naarasrottien hedelmällisyyden heikkenemistä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nocdurna-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Nocdurnalla tehdyissä kliinisissä tutkimuksissa nokturia-käyttöaiheessa (miehet 50 mikrog, N = 222, ja naiset 25 mikrog, N = 219) raportoitujen haittavaikutusten tiheyden perusteella yleisimmät hoidon aikana raportoidut haittavaikutukset olivat suun kuivuminen (13 %), päänsärky (3 %), hyponatremia (3 %) ja huimaus (2 %).
Valikoitujen haittavaikutusten kuvaus
Desmopressiinin vakavin haittavaikutus on hyponatremia, johon saattaa liittyä päänsärkyä, pahoinvointia, oksentelua, seerumin natriumpitoisuuden laskua, painon nousua, huonovointisuutta, vatsakipua, lihaskouristuksia, huimausta, sekavuutta, tajunnantilan laskua ja, vaikeissa tapauksissa kouristuksia ja kooma. Hyponatremia on antidiureettinen vaikutus, joka johtuu veden lisääntyneestä uudelleenimeytymisestä munuaistiehyisiin ja plasman osmoottisesta laimenemisesta. Tutkimuksissa, joissa aikuisia hoidettiin nokturian vuoksi, valtaosalla henkilöistä seerumin natriumpitoisuus aleni ensimmäisten hoitopäivien aikana tai liittyen annoksen suurentamiseen. Erityistä huomiota tulee kiinnittää kohdassa Varoitukset ja käyttöön liittyvät varotoimet mainittuihin varotoimiin.
Naisilla on suurempi hyponatremian riski kuin miehillä, mikä saattaa johtua munuaistiehyeiden suuremmasta herkkyydestä vasopressiinille ja sen analogeille. Tämä riski minimoituu käytettäessä naisille suositeltua pienempää annosta. Lisäksi seerumin natriumpitoisuuden seuranta pienentää hyponatremian riskiä yli 65-vuotiaiden ikäryhmässä (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Alla olevassa taulukossa 1 on esitetty raportoitujen haittavaikutusten yleisyys. Yleisyys on määritelty seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100 - < 1/10) ja melko harvinaiset (≥ 1/1000 - < 1/100).
Taulukko 1: Raportoitujen haittavaikutusten yleisyys (vaiheen III tutkimukset ja valmisteen myyntiluvan myöntämisen jälkeiset raportit)
MedDRA-elinjärjestelmäluokka | Hyvin yleiset | Yleiset | Melko harvinaiset |
Aineenvaihdunta ja ravitsemus | Hyponatremia | ||
Hermosto | Päänsärky | ||
Ruoansulatuselimistö | Suun kuivuminen* | Pahoinvointi | Ummetus |
Yleisoireet ja antopaikassa todettavat haitat | Väsymys |
* On huomioitava, että joissain kliinisissä tutkimuksissa tutkittavilta kysyttiin erityisesti suun kuivumisesta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin.
Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www- sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Oireet
Nocdurna-tablettien yliannostelu pidentää vaikutuksen kestoa ja lisää nesteretention ja hyponatremian riskiä.
Hoito
Vaikkakin hyponatremian hoito on yksilöllistä, voidaan seuraavia yleisiä ohjeita antaa:
Desmopressiini-hoito lopetetaan ja nesterajoitus sekä oireenmukainen hoito aloitetaan tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Vasopressiini ja sen kaltaiset yhdisteet.
ATC-koodi: H01BA02
Vaikutusmekanismi
Nocdurna sisältää desmopressiiniä, joka on luonnollisen antidiureettisen hormonin, arginiinivasopressiinin (AVP) synteettinen analogi. Desmopressiini jäljittelee vasopressiinin antidiureettista vaikutusta sitoutuen munuaistiehyiden V2-reseptoreihin, mikä aiheuttaa veden uudelleenimeytymisen elimistöön. Tämä uudelleenimeytyminen puolestaan vähentää yöllistä virtsan tuotantoa. Johtuen sekä suositelluista pienistä sukupuolispesifisistä annoksista (25 mikrog/naiset, 50 mikrog/miehet), että Nocdurnan rajallisesta vaikutuksen kestosta, antidiureettinen vaikutus rajoittuu yölliseen unijaksoon.
Farmakodynaamiset vaikutukset
Tutkimuksessa CS29 painon mukaan korjattu Nocdurna-annos, joka indusoi 50 % suurimmasta saavutettavissa olevasta lääkkeen vaikutuksesta yövirtsamäärään, oli merkitsevästi erilainen miehillä ja naisilla. Identtisen dynaamisen vaikutuksen saavuttamiseksi vaadittu miesten arvioitu altistusarvo oli 2,7 kertaa (95 % CI: 1,3-8,1) suurempi kuin naisten arvo, mikä kuvastaa naisten suurempaa herkkyyttä desmopressiinille. Hyponatremian kehittyminen on annosriippuvaista. Naisilla on suurempi hyponatremian riski kuin miehillä. Hyponatremian ilmaantuvuus kohoaa iän myötä (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Kliininen teho
Nocdurnan teho on osoitettu kahdessa satunnaistetussa plasebokontrolloidussa kaksoissokkotutkimuksessa, joissa 268 naisella (tutkimus CS40, kylmäkuivattu desmopressiini 25 mikrog vs. plasebo) ja 395 miehellä (tutkimus CS41, kylmäkuivattu desmopressiini 50 mikrog ja 75 mikrog vs. plasebo ) oli nokturia, joka määriteltiin keskimäärin vähintään kahtena yöllisenä virtsaamiskertana ja polyuriana 90 %:lla naisista ja 87 %:lla miehistä.
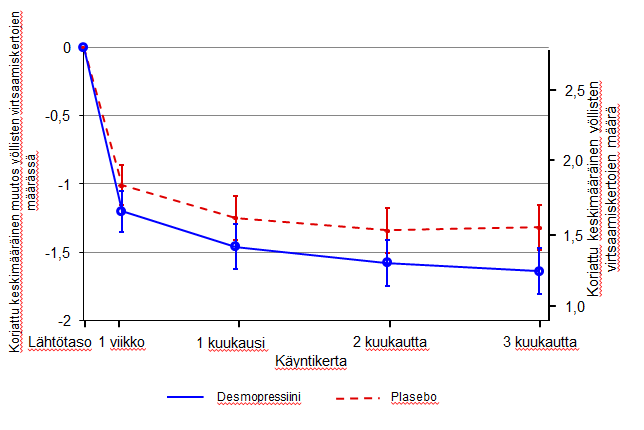
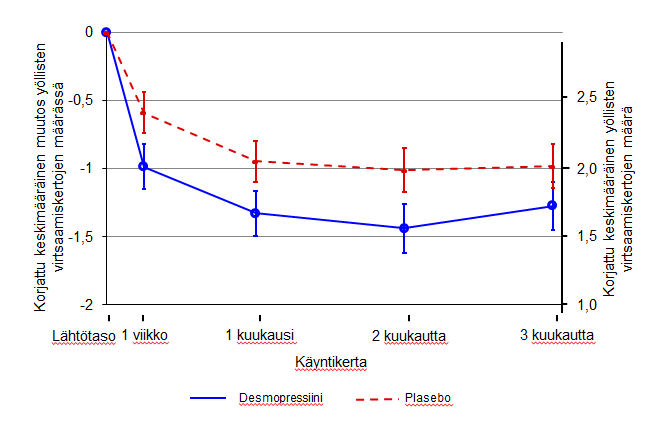
Molemmat tutkimukset saavuttivat kaksi ensisijaista päämuuttujaansa tilastollisesti merkitsevin, kylmäkuivatulle desmopressiini-valmisteelle suotuisin eroin 3 kuukauden jakson aikana. Korjattu keskimääräinen yöllisten virtsaamiskertojen määrä väheni lähtötasosta tilastollisesti merkitsevästi kylmäkuivatulla desmopressiini 25 mikrog valmisteella (-1,46) plaseboon (-1,24) verrattuna tutkimuksessa, johon osallistui naisia (p=0,028) (kuva 1), ja kylmäkuivatulla desmopressiini 50 mikrog valmisteella (-1,25) plaseboon (-0,88) verrattuna tutkimuksessa, johon osallistui miehiä (p=0,0003) (kuva 2). Niiden henkilöiden osuus, joilla keskimääräinen virtsaamiskertojen määrä väheni yli 33% (hoitoon vastanneet), oli merkitsevästi suurempi, lähes kaksinkertainen. OR-luku (odds ratio, ristitulosuhde) yli 33 %:n vähenemiselle kylmäkuivatulla desmopressiini 25 mikrog valmisteella plaseboon verrattuna oli 1,85 (p=0,006) tutkimuksessa, johon osallistui naisia, ja OR-luku yli 33 %:n vähenemiselle kylmäkuivatulla desmopressiini 50 mikrog valmisteella plaseboon verrattuna oli 1,98 (p=0,0009) tutkimuksessa, johon osallistui miehiä.
Koskien toissijaisia päämuuttujia ensimmäinen häiriintymätön unijakso/aika ensimmäiseen virtsaamiskertaan piteni lähtötasosta 3 kuukauden kohdalle siten, että ero ryhmien välillä oli 49 minuuttia tutkimuksessa, johon osallistui naisia ja 39 minuuttia tutkimuksessa, johon osallistui miehiä. Kylmäkuivatulla desmopressiini 25 mikrog valmisteella havaittiin naisilla tilastollisesti merkitsevä elämänlaadun paraneminen (N-QoL-kokonaispisteet 27,24) plaseboon (21,90) (p=0,0226) verrattuna ja kylmäkuivatulla desmopressiini 50 mikrog valmisteella havaittiin miehillä vastaavanlainen parannus (N-QoL-kokonaispisteet 18,37) plaseboon (13,88) (p=0,0385) verrattuna. Molemmissa tutkimuksissa oli voimakas yhteys (p<0,0001) hoitovasteen (yöllisten virtsaamiskertojen määrän väheneminen ja häiriintymättömän unijakson piteneminen) ja potilaan elämänlaadun paranemisen välillä.
Kuva 1. Toinen ensisijainen päämuuttuja: Korjattu keskimääräinen muutos lähtötasosta koskien yöllisten virtsaamiskertojen määrää 3 hoitokuukauden aikana – (Naiset, CS40 täydellinen analyysisarja)
Kuva 2. Toinen ensisijainen päämuuttuja: Korjattu keskimääräinen muutos lähtötasosta koskien yöllisten virtsaamiskertojen määrää 3 hoitokuukauden aikana – (Miehet, CS41 täydellinen analyysisarja)
Kaksoissokossa satunnaistetussa kliinisessä tutkimuksessa kylmäkuivatun desmopressiinivalmisteen ja tolterodiini-depotkapseleiden tehoa ja turvallisuutta tutkittiin yliaktiivisen rakon ja nokturian hoidossa naisilla 3 kuukauden ajan. 49 henkilöä altistettiin Nocdurna (kylmäkuivattu desmopressiini) 25 mikrog ja tolterodiini 4 mg yhdistelmälle. Tässä tutkimuksessa ei havaittu vakavia haittavaikutuksia ja yhdistelmähoidon turvallisuusprofiili vastasi Nocdurna 25 mikrog:n turvallisuusprofiilia. Teho ilmaistuna keskimääräisten virtsaamiskertojen määrän vähenemisenä lähtötasosta 3 hoitokuukauden aikana oli numeerisesti suurempi yhdistelmähoitoryhmässä kuin tolterodiini-monoterapiaryhmässä (ero ryhmien välillä -0,34 virtsaamiskertaa) täydellisessä analyysisarjassa ja ero saavutti tilastollisen merkitsevyyden (p=0,049) siten, että hoidosta saatava hyöty oli -0,41 virtsaamiskertaa tutkimussuunnitelman mukaisessa analyysisarjassa.
Kliinisen turvallisuuden ja tehon erot miehillä ja naisilla
Kliinisessä tutkimuksessa [FE992026 CS029] analysoitiin Nocdurnan annos-vastetta naisilla ja miehillä 10 – 100 mikrog annoksilla: Naisilla farmakodynaaminen vaikutus ei parantunut yli 25 mikrog annoksilla, mikä viittaa siihen, että vakiintunut annos-vaste-taso saavutettiin naisilla 25 mikrog annoksella. Miehillä virtsamäärä pieneni enemmän 50 mikrog annoksella mutta se ei ollut huomattavasti suurempi 100 mikrog annoksella. Naisilla annosten suurentaminen 50 mikrog tasolle ei parantanut enää tehoa mutta miehiin verrattuna siihen liittyi viisinkertainen hyponatremian riski yli 50-vuotiaiden ikäryhmässä (p = 0,015).
Farmakokinetiikka
Imeytyminen
Desmopressiinin keskimääräinen absoluuttinen hyötyosuus kielen alle annosteltuna aiemmissa annostutkimuksissa (200, 400 ja 800 mikrog annokset) on 0,25 % (CI 95 % 0,21 – 0,31 %). Desmopressiinin hyötyosuus vaihtelee kohtalaisesti tai suuresti, sekä yksilöllisesti että henkilöiden välillä. Desmopressiinillä on osoitettu annos-lineaarisuutta koskien AUC- ja Cmax-arvoja 60 – 240 mikrog annosalueella. Alle 60 mikrog annosten hyötyosuutta ei kuitenkaan ole arvioitu.
Jakautuminen
Desmopressiinin jakautumista voidaan parhaiten kuvata kaksiosaisella jakautumismallilla, jossa eliminaatiovaiheen jakautumistilavuus on 0,3-0,5 l/kg.
Biotransformaatio
Desmopressiinin metaboliaa elimistössä ei ole tutkittu. Desmopressiinillä tehdyt ihmisen maksan mikrosomin metaboliatutkimukset in vitro ovat osoittaneet, että maksassa ei metaboloidu merkitsevää määrää desmopressiiniä sytokromi P450 –järjestelmän kautta. Siten ihmisen elimistössä ei todennäköisesti tapahdu maksametaboliaa sytokromi P450 -järjestelmän kautta. Desmopressiinin vaikutus muiden lääkkeiden farmakokinetiikkaan on todennäköisesti minimaalinen, koska se ei estä sytokromi P450 -järjestelmän kautta tapahtuvaa metaboliaa.
Eliminaatio
Laskelmien mukaan desmopressiinin kokonaispuhdistuma on 7,6 l/h. Desmopressiinin terminaalisen puoliintumisajan arvioidaan olevan 2,8 h. Terveillä henkilöillä muuttumattomana erittyvä fraktio on 52 % (44 - 60 %).
Lineaarisuus/ei-lineaarisuus
Desmopressiinin farmakokineettisissä parametreissä ei ole viitteitä ei-lineaarisuudesta.
Erityisryhmien ominaispiirteet
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan asteesta riippuen AUC ja puoliintumisaika suurenevat munuaisten vajaatoiminnan vaikeusasteen myötä. Desmopressiini on vasta-aiheinen potilailla, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 50 ml/min).
Taulukko 2: Farmakokineettiset parametrit eriasteisessa munuaisten vajaatoiminnassa. Tiedot tutkimuksesta: CS001.
Kreatiniinipuhdistuma | Munuaisten toiminta | AUC (h*pg/ml) | T½ (h) | |
Terve | > 80 ml/min | Normaali | 186 | 2,8 |
Lievä | 50-80 ml/min | Lievästi heikentynyt | 281 | 4,0 |
Keskivaikea | 30-49 ml/min | Kohtalaisesti heikentynyt | 453 | 6,7 |
Vaikea | 5-29 ml/min | Vaikeasti heikentynyt | 682 | 8,7 |
Maksan vajaatoiminta
Desmopressiinin farmakokinetiikkaa ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla.
On epätodennäköistä, että desmopressiinillä olisi yhteisvaikutuksia maksametaboliaan vaikuttavien lääkkeiden kanssa, koska ihmisen mikrosomeilla tehdyissä in vitro –tutkimuksissa on osoitettu, että desmopressiini ei läpikäy merkitsevää maksametaboliaa.
Prekliiniset tiedot turvallisuudesta
Ei-kliiniset tiedot eivät paljastaneet mitään erityistä ihmiselle koituvaa riskiä perinteisissä tutkimuksissa, joissa selvitettiin farmakologista turvallisuutta, toistetun annoksen toksisuutta, genotoksisuutta ja lisääntymistoksisuutta. Desmopressiinillä ei ole tehty karsinogeenisyystutkimuksia, koska se on läheistä sukua luonnolliselle peptidihormonille.
Farmaseuttiset tiedot
Apuaineet
Gelatiini
Mannitoli (E 421)
Sitruunahappo, vedetön
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytyslämpötiloja.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Yksittäinen tabletti on käytettävä heti foliopakkauksen avaamisen jälkeen.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NOCDURNA tabletti, kylmäkuivattu
25 mikrog (L:ei) 30 x 1 fol (25,79 €)
50 mikrog (L:ei) 30 x 1 fol (25,79 €)
PF-selosteen tieto
Laminoitu alumiinifoliopakkaus pahvikotelossa.
Pohjalevyn folio ja kansi: PVC/OPA/Alumiini/OPA/PVC-monikerroslaminaatti, lämpösaumaus: lakka/alumiini/PEF/paperi.
Pakkauskoot:
30x1 kylmäkuivattua tablettia
Valmisteen kuvaus:
Nocdurna 25 mikrog:
Valkoinen, pyöreä kylmäkuivattu tabletti, jonka halkaisija on noin 12 mm. Tabletin toisella puolella on merkintä 25.
Nocdurna 50 mikrog:
Valkoinen, pyöreä kylmäkuivattu tabletti, jonka halkaisija on noin 12 mm. Tabletin toisella puolella on merkintä 50.
Käyttö- ja käsittelyohjeet
Ei erityisohjeita.
Kaikki käyttämätön tuote tai lääkejäte tulee hävittää paikallisten vaatimusten mukaisesti.
Korvattavuus
NOCDURNA tabletti, kylmäkuivattu
25 mikrog 30 x 1 fol
50 mikrog 30 x 1 fol
- Peruskorvaus (40 %).
ATC-koodi
H01BA02
Valmisteyhteenvedon muuttamispäivämäärä
05.05.2021
Yhteystiedot
Bertel Jungin aukio 5
02600 Espoo
020 740 1440
info@ferring.fi
etunimi.sukunimi@ferring.com
