INVOKANA tabletti, kalvopäällysteinen 100 mg, 300 mg
Vaikuttavat aineet ja niiden määrät
Invokana 100 mg kalvopäällysteiset tabletit
Yksi tabletti sisältää kanagliflotsiinihemihydraattia määrän, joka vastaa 100 mg:aa kanagliflotsiinia.
Apuaine(et), joiden vaikutus tunnetaan
Yksi tabletti sisältää 39,26 mg laktoosia.
Invokana 300 mg kalvopäällysteiset tabletit
Yksi tabletti sisältää kanagliflotsiinihemihydraattia määrän, joka vastaa 300 mg:aa kanagliflotsiinia.
Apuaine(et), joiden vaikutus tunnetaan
Yksi tabletti sisältää 117,78 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Invokana on tarkoitettu aikuisten ja vähintään 10 vuoden ikäisten lasten riittämättömässä hoitotasapainossa olevan tyypin 2 diabeteksen hoitoon ruokavalion ja liikunnan lisänä
- monoterapiana, kun metformiini ei sovi potilaalle sen siedettävyyden tai vasta-aiheiden perusteella
- lisälääkkeenä muiden diabeteslääkkeiden kanssa.
Tutkimustulokset käytöstä yhdistelmänä muiden hoitojen kanssa, vaikutuksista veren glukoositasapainoon ja kardiovaskulaari- ja munuaistapahtumiin sekä tiedot tutkituista potilasjoukoista, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Suositeltu kanagliflotsiinin aloitusannos on 100 mg kerran vuorokaudessa. Jos potilas sietää kanagliflotsiiniannoksen 100 mg kerran vuorokaudessa ja potilaan glomerulusten laskennallinen suodatusnopeus (eGFR) on ≥ 60 ml/min/1,73 m2 tai CrCl on ≥ 60 ml/min ja tiukempi veren glukoositasapaino on tarpeen, annos voidaan suurentaa 300 mg:aan kerran vuorokaudessa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ks. taulukosta 1 suositukset annoksen muuttamiseen eGFR-arvon mukaan.
Jos potilas on iältään ≥ 75 vuotta, potilaan tiedetään sairastavan sydän- ja verisuonitautia tai jos kanagliflotsiinista hoidon alussa aiheutuva diureesi muutoin aiheuttaa potilaalle riskin, annoksen suurentamisessa on oltava varovainen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos potilaalla on viitteitä volyymivajeesta, tämä tila suositellaan korjaamaan ennen kanagliflotsiinihoidon aloittamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kun kanagliflotsiinitabletteja käytetään lisälääkkeenä insuliinin tai insuliinin eritystä lisäävien lääkkeiden (esim. sulfonyyliurean) kanssa, pienempää insuliinin tai insuliinin eritystä lisäävien lääkkeiden annosta saattaa olla tarpeen harkita hypoglykemiariskin vähentämiseksi (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Erityispotilasryhmät
Iäkkäät potilaat
Munuaisten toiminta ja vähentyneen nestetilavuuden riski on otettava huomioon (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Diabeteksen munuaistaudin hoidossa, kun valmistetta käytetään tavanomaisen hoidon (esim. ACE-estäjät tai ATR:n salpaajat) lisäksi, on käytettävä 100 mg:n kanagliflotsiiniannosta kerran vuorokaudessa (ks. taulukko 1). Koska kanagliflotsiini alentaa veren glukoosipitoisuutta heikommin potilailla, joilla on keskivaikea munuaisten vajaatoiminta, ja teho on todennäköisesti olematon vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla, muiden hyperglykemiaa ehkäisevien lääkeaineiden lisäämistä on harkittava, jos tarvitaan tiukempaa glukoositasapainon hallintaa. Ks. taulukosta 1 suositukset annoksen muuttamiseen eGFR-arvon mukaan.
| Taulukko 1: Suositukset aikuisten ja vähintään 10 vuoden ikäisten lasten annoksen muuttamiseena | |
eGFR (ml/min/1,73 m2) tai CrCl (ml/min) | Kanagliflotsiinin päivittäinen kokonaisannos
|
| ≥ 60 | Aloitetaan 100 mg:n annoksella.
Jos potilas sietää 100 mg:n annoksen ja tiukempi glukoositasapainon hallinta on tarpeen, annos voidaan suurentaa 300 mg:aan. |
| 30 – < 60b | Käytetään 100 mg:n annosta. |
| < 30b, c | Jatketaan 100 mg:n annosta potilailla, jotka jo ottavat Invokana-valmistetta.d
Invokana-hoitoa ei saa aloittaa. |
a Ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka. b Jos tarvitaan tiukempaa glukoositasapainon hallintaa, on harkittava muiden hyperglykemiaa ehkäisevien lääkeaineiden lisäämistä. c Jos virtsan albumiinin ja kreatiniinin suhde on ˃ 300 mg/g. d Annostusta jatketaan dialyysiin tai munuaisensiirtoon asti. | |
Maksan vajaatoiminta
Lievää tai keskivaikeaa maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa.
Kanagliflotsiinihoitoa ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavilla potilailla eikä sitä suositella tälle potilasryhmälle (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Annosta ei tarvitse muuttaa vähintään 10 vuoden ikäisille lapsille tyypin 2 diabeteksen hoitoon (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka). On suositeltavaa noudattaa varovaisuutta < 50 kg painavien lasten hoidossa, kun annos suurennetaan titraamalla 300 mg:aan, koska turvallisuutta koskevia tietoja on vain vähän (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Invokana-valmisteen turvallisuutta ja tehoa alle 10 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Antotapa
Suun kautta.
Invokana otetaan suun kautta kerran vuorokaudessa, mieluiten ennen päivän ensimmäistä ateriaa. Tabletit on nieltävä kokonaisina.
Jos annos unohtuu, potilaan on otettava se heti, kun hän huomaa unohduksen, mutta samana päivänä ei saa ottaa kahta annosta.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
Kanagliflotsiinia ei saa käyttää potilaille, joilla on tyypin 1 diabetes (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet, Diabeettinen ketoasidoosi).
Munuaisten vajaatoiminta
Kanagliflotsiinin teho glukoositasapainon hallinnassa riippuu munuaisten toiminnasta, joten jos potilaalla on keskivaikea munuaisten vajaatoiminta, hoidon teho on heikompi, ja jos potilaalla on vaikea-asteinen munuaisten vajaatoiminta, hoito ei todennäköisesti tehoa (ks. kohta Annostus ja antotapa).
Jos aikuispotilaan eGFR on < 60 ml/min/1,73 m2 tai CrCl on < 60 ml/min, volyymivajeeseen liittyvien haittavaikutusten (esim. asentohuimauksen, ortostaattisen hypotension, hypotension) esiintyvyyden on raportoitu suurentuneen, etenkin 300 mg:n annoksia käytettäessä. Tällä potilasryhmällä raportoitiin lisäksi enemmän suurentuneeseen kaliumpitoisuuteen liittyviä tapahtumia sekä seerumin kreatiniini- ja veren ureatyppipitoisuuksien huomattavampaa suurenemista (ks. kohta Haittavaikutukset
Kanagliflotsiiniannos on siksi rajoitettava 100 mg:aan kerran vuorokaudessa, jos potilaan eGFR on < 60 ml/min/1,73 m2 tai CrCl on < 60 ml/min (ks. kohta Annostus ja antotapa).
Kanagliflotsiinihoitoa saaneiden potilaiden eGFR-arvo pieneni hoidon alussa hoitoa edeltävästä eGFR-arvosta riippumatta ja tasaantui sitten ajan myötä (ks. kohdat Haittavaikutukset ja Farmakodynamiikka).
Munuaisten toimintaa on syytä seurata seuraavasti:
- ennen kanagliflotsiinihoidon aloittamista ja vähintään kerran vuodessa sen jälkeen (ks. kohdat Annostus ja antotapa, Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka)
- ennen sellaisen samanaikaisen lääkityksen aloittamista, joka saattaa heikentää munuaisten toimintaa, ja säännöllisesti sen jälkeen.
Kanagliflotsiinin käytöstä on kokemusta aikuispotilailla sekä sellaisen diabeettisen munuaissairauden hoidossa (eGFR ≥ 30 ml/min/1,73 m2), johon liittyy albuminuriaa, että sellaisen, johon ei liity. Molemmat potilasryhmät hyötyivät, mutta albuminuriapotilaat saattavat hyötyä enemmän kanagliflotsiinihoidosta.
Potilaat, joilla on volyymivajeeseen liittyvien haittavaikutusten riski
Kanagliflotsiini indusoi vaikutusmekanisminsa vuoksi osmoottista diureesia lisäämällä glukoosin erittymistä virtsaan, mikä saattaa pienentää suonensisäistä tilavuutta ja alentaa verenpainetta (ks. kohta Farmakodynamiikka). Volyymivajeeseen liittyvien haittavaikutusten (esim. asentohuimauksen, ortostaattisen hypotension tai hypotension) lisääntymistä esiintyi kanagliflotsiinilla aikuisille tehdyissä kontrolloiduissa kliinisissä tutkimuksissa yleisemmin 300 mg:n annoksen yhteydessä ja niitä esiintyi yleisimmin kolmen ensimmäisen hoitokuukauden aikana (ks. kohta Haittavaikutukset).
Hoidossa on oltava varovainen, jos kanagliflotsiinin aiheuttama verenpaineen aleneminen voi aiheuttaa potilaalle riskin, esim. jos potilaan tiedetään sairastavan sydän- ja verisuonisairautta, potilaan eGFR on < 60 ml/min/1,73 m2, potilas käyttää verenpainelääkkeitä ja hänellä on aiemmin ollut matala verenpaine, potilas käyttää diureetteja tai on iäkäs (≥ 65-vuotias) (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Volyymivajeen vuoksi keskimäärin hieman pienentyneitä eGFR-arvoja todettiin aikuisilla 6 ensimmäisen kanagliflotsiinihoitoviikon aikana. Suonensisäisen tilavuuden edellä kuvattua huomattavammalle pienenemiselle alttiilla potilailla on havaittu toisinaan huomattavampaa eGFR-arvon pienenemistä (> 30 %), joka korjaantui myöhemmin ja jonka vuoksi kanagliflotsiinihoito oli harvinaisissa tapauksissa keskeytettävä (ks. kohta Haittavaikutukset).
Potilaita on kehotettava ilmoittamaan volyymivajeeseen liittyvistä oireista. Kanagliflotsiinia ei suositella potilaille, jotka käyttävät loop-diureetteja (ks. kohta Yhteisvaikutukset) tai joilla on volyymivaje esim. akuutin sairauden (kuten maha-suolikanavan sairauden) seurauksena.
Jos kanagliflotsiinihoitoa saavalla potilaalla on samanaikaisesti muita vähentyneeseen nestetilavuuteen johtavia tiloja (esim. ruoansulatuselimistön sairaus), nestetilavuutta ja seerumin elektrolyyttejä suositellaan seuraamaan tarkoin (esim. lääkärintutkimus, verenpainemittaus, laboratoriokokeet, munuaisten toimintakokeet mukaan lukien). Kanagliflotsiinihoidon keskeyttämistä tilapäisesti voidaan harkita, jos potilaan nestetilavuus pienenee kanagliflotsiinihoidon aikana, kunnes tila on saatu korjatuksi. Jos hoito keskeytetään, glukoosipitoisuuden tiheää seurantaa on harkittava.
Diabeettinen ketoasidoosi
SGLT2:n estäjillä, kanagliflotsiini mukaan lukien, hoitoa saaneilla potilailla on raportoitu harvinaisina tapauksina diabeettista ketoasidoosia. Osa tapauksista on ollut hengenvaarallisia, ja osa on johtanut potilaan kuolemaan. Tilan ilmenemismuoto on ollut monissa tapauksissa epätyypillinen, sillä verensokeripitoisuudet ovat olleet vain kohtalaisesti suurentuneet, alle 14 mmol/l (250 mg/dl). Ei tiedetä, onko diabeettinen ketoasidoosi todennäköisempi suurempien kanagliflotsiiniannosten yhteydessä, mukaan lukien alle 50 kg painavilla lapsilla, koska altistus 300 mg:n annoksella voi olla havaittua aikuisten altistusta suurempi (ks. kohta Annostus ja antotapa). Diabeettisen ketoasidoosin riski vaikuttaa olevan suurempi potilailla, joiden munuaistoiminnan heikkeneminen on vaikeusasteeltaan keskivaikeaa tai vaikeaa ja jotka tarvitsevat insuliinia.
Diabeettisen ketoasidoosin riski pitää ottaa huomioon, jos potilaalla on epäspesifisiä oireita, kuten pahoinvointia, oksentelua, ruokahaluttomuutta, vatsakipua, voimakasta janoa, hengitysvaikeuksia, sekavuutta, epätavallista uupumusta tai uneliaisuutta. Jos tällaisia oireita ilmaantuu, potilas pitää tutkia heti ketoasidoosin selvittämiseksi verensokeripitoisuudesta riippumatta.
Jos potilaalla epäillään tai todetaan diabeettinen ketoasidoosi, Invokana-hoito pitää heti lopettaa.
Jos potilas joutuu sairaalahoitoon vakavan akuutin sairauden vuoksi, hoito pitää keskeyttää. Keskeytä Invokana-hoito, jos mahdollista, sopivaksi ajanjaksoksi (päiviksi) ennen suurta leikkausta, vatsa- tai laihdutusleikkaus mukaan lukien, tai ennen muita invasiivisia toimenpiteitä, joihin liittyy pitkäaikainen paasto. Seerumin ketonien seurantaa suositellaan. Harkitse vaihtoehtoista hyperglykemiaa ehkäisevää lääkitystä, insuliini mukaan lukien.
Ketonipitoisuus kannattaa mitata verestä eikä virtsasta. Invokana-hoidon voi aloittaa uudelleen, kun ketonipitoisuus on normaali ja potilaan tila on saatu vakaaksi.
Potilaalta pitää selvittää ennen Invokana-hoidon aloittamista ketoasidoosille mahdollisesti altistavat aiemmat tekijät.
Diabeettinen ketoasidoosi saattaa joillakin potilailla olla pitkittynyt Invokana-hoidon lopettamisen jälkeen, ts. se voi kestää pidempään kuin mitä kanagliflotsiinin puoliintumisajan plasmassa perusteella on oletettavissa (ks. kohta Farmakokinetiikka). Pitkäkestoisen diabeettisen ketoasidoosin yhteydessä on havaittu pitkittynyttä glukoosivirtsaisuutta. Kanagliflotsiinista riippumattomilla tekijöillä saattaa olla osuutta pitkittyneisiin diabeettisen ketoasidoosin episodeihin. Insuliininpuutos saattaa osaltaan pidentää diabeettista ketoasidoosia, ja varmistettu insuliininpuutos on korjattava.
Potilaalla saattaa olla tavanomaista suurempi ketoasidoosin riski, jos potilaalla on pieni beetasolujen toimintareservi (esim. aikuisen piilevä autoimmuunidiabetes (LADA), tyypin 2 diabetesta sairastavat potilaat, joilla on pieni C-peptidipitoisuus, tai haimatulehdusta aiemmin sairastaneet potilaat), potilaalla on ruoan saantia rajoittava sairaus tai vaikea elimistön nestevajaus, potilaan insuliiniannosta on pienennetty tai potilaalla on lisääntynyt insuliinintarve akuutin sairauden, leikkauksen tai alkoholin väärinkäytön vuoksi. SGLT2:n estäjien käytössä näiden potilasryhmien hoitoon pitää olla varovainen.
SGLT2:n estäjähoidon aloittamista uudelleen ei suositella, jos potilaalla on aiemmin ollut diabeettinen ketoasidoosi SGLT2:n estäjähoidon aikana, paitsi jos tunnistetaan jokin toinen diabeettista ketoasidoosia selvästi edistävä tekijä ja se on hävinnyt.
Kanagliflotsiinin turvallisuutta ja tehoa tyypin 1 diabetesta sairastavien potilaiden hoidossa ei ole varmistettu, joten kanagliflotsiinia ei saa käyttää tyypin 1 diabetesta sairastavien potilaiden hoitoon. Kliinisistä tutkimuksista saadut suppeat tiedot viittaavat siihen, että diabeettista ketoasidoosia esiintyy säännöllisesti SGLT2:n estäjillä hoitoa saavilla tyypin 1 diabetesta sairastavilla potilailla.
Alaraaja-amputaatiot
Pitkäkestoisissa kliinisissä kanagliflotsiinitutkimuksissa, joissa oli mukana tyypin 2 diabetesta sairastavia aikuispotilaita, joilla oli todettu kardiovaskulaaritauti tai vähintään kaksi kardiovaskulaaritautien riskitekijää, Invokana-valmisteeseen liitettiin suurentunut alaraaja-amputaatioiden riski lumelääkkeeseen verrattuna (vastaavasti 0,63 vs. 0,34 tapahtumaa 100 potilasvuotta kohti), ja tämä riskin suureneminen esiintyi pääasiassa varpaissa ja jalkaterän keskiosassa (ks. kohta Haittavaikutukset). Pitkäkestoisessa kliinisessä tutkimuksessa, jossa oli mukana tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavia aikuispotilaita, alaraaja-amputaatioiden riskissä ei havaittu eroja kanagliflotsiinia 100 mg ja lumelääkettä saaneiden potilaiden välillä. Tässä tutkimuksessa noudatettiin alla mainittuja varotoimenpiteitä. Taustalla olevaa mekanismia ei ole varmistettu, joten amputaatioiden riskitekijöitä ei yleisiä riskitekijöitä lukuun ottamatta tunneta.
Potilaan esitiedoista on ennen Invokana-hoidon aloittamista arvioitava tekijät, jotka saattavat lisätä amputaation riskiä. Varotoimenpiteinä on harkittava niiden potilaiden tarkkaa seurantaa, joilla on tavanomaista suurempi amputaatioriski, sekä kertomista ehkäisevän jalkahoidon ja riittävän nesteytyksen huolehtimisen tärkeydestä. Jos potilaalle kehittyy amputaatiota ennakoivia tapahtumia, kuten alaraajan ihohaavauma, infektio, osteomyeliitti tai kuolio, voidaan myös harkita Invokana-hoidon lopettamista.
Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)
Markkinoille tulon jälkeisistä välilihan nekrotisoivan faskiitin (tämä tunnetaan myös nimellä Fournier’n gangreeni) tapauksista on ilmoitettu nais- ja miespotilailla, jotka käyttävät SGLT2:n estäjiä. Tämä on harvinainen, mutta vakava ja mahdollisesti hengenvaarallinen tapahtuma, joka edellyttää kiireellistä leikkausta ja antibioottihoitoa.
Potilaita on kehotettava kääntymään lääkärin puoleen, jos heillä on kipua, aristusta, punoitusta tai turvotusta genitaali- tai perineaalialueella ja tähän liittyy kuumetta tai huonovointisuutta. Huomatkaa, että nekrotisoivaa faskiittia voi edeltää urogenitaali-infektio tai perineaaliabsessi. Jos Fournier’n gangreenia epäillään, Invokanan käyttö on keskeytettävä ja hoito (mukaan lukien antibioottihoito ja puhdistusleikkaus) on aloitettava.
Kohonnut hematokriitti
Kanagliflotsiinihoidon yhteydessä on havaittu kohonneita hematokriittiarvoja (ks. kohta Haittavaikutukset), joten potilasta on seurattava tarkoin, jos hematokriitti on jo ennestään koholla.
Iäkkäät potilaat
Iäkkäillä potilailla saattaa olla suurempi vähentyneen nestetilavuuden riski ja he käyttävät todennäköisemmin diureetteja ja heidän munuaistensa toiminta on todennäköisemmin heikentynyt. Jos potilas on ≥ 75-vuotias, volyymivajeeseen liittyvien haittavaikutusten (esim. asentohuimauksen, ortostaattisen hypotension, hypotension) esiintyvyyden on raportoitu olevan suurempi. Tällä potilasryhmällä raportoitiin lisäksi huomattavammin pienentyneitä eGFR-arvoja (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Sukupuolielinten sieni-infektiot
Kliinisissä kanagliflotsiinitutkimuksissa raportoitiin natrium–glukoosikuljetusjärjestelmä 2:n (SGLT2) estomekanismiin liittyvää lisääntynyttä glukoosin erittymistä virtsaan, ulkosynnytinten kandidiaasia naisilla sekä balaniittia ja balanopostiittia miehillä (ks. kohta Haittavaikutukset). Jos mies- ja naispotilaalla oli aiemmin ollut sukupuolielinten sieni-infektioita, infektion kehittyminen oli todennäköisempää. Balaniittia ja balanopostiittia esiintyi pääasiassa ympärileikkaamattomilla miespotilailla. Joissakin tapauksissa näistä aiheutui fimoosi ja/tai ne johtivat ympärileikkaukseen. Suurin osa sukupuolielinten sieni-infektioista hoidettiin paikallisesti käytettävillä sienilääkkeillä, joko resepti‑ tai itsehoitovalmisteilla, ja Invokana-hoitoa jatkettiin tänä aikana.
Virtsatieinfektiot
Markkinoille tulon jälkeisistä komplisoituneiden virtsatieinfektioiden, myös pyelonefriitin ja urosepsiksen, tapauksista on ilmoitettu kanagliflotsiinihoitoa saavilla potilailla, ja ne ovat usein johtaneet hoidon keskeyttämiseen. Kanagliflotsiinihoidon tilapäistä keskeyttämistä on harkittava, jos potilaalla on komplisoitunut virtsatieinfektio.
Sydämen vajaatoiminta
New York Heart Association (NYHA) ‑luokan III potilaista on vähän kokemusta eikä kanagliflotsiinilla tehdyistä kliinisistä tutkimuksista ole saatu kokemusta NYHA-luokan IV potilaista.
Virtsan laboratoriotutkimukset
Kanagliflotsiinihoitoa saavien potilaiden virtsan glukoosikoe saattaa olla positiivinen valmisteen vaikutusmekanismin vuoksi.
Laktoosi-intoleranssi
Tabletit sisältävät laktoosia.
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkevalmistetta.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Diureetit
Kanagliflotsiini saattaa voimistaa diureettien vaikutusta ja lisätä elimistön kuivumisen ja hypotension riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Insuliini ja insuliinin eritystä lisäävät lääkkeet
Insuliini ja insuliinin eritystä lisäävät lääkkeet, kuten sulfonyyliureat, voivat aiheuttaa hypoglykemiaa. Insuliinin tai insuliinin eritystä lisäävän lääkkeen annosta saattaa olla siksi tarpeen pienentää hypoglykemiariskin pienentämiseksi, jos näitä käytetään yhdistelmänä kanagliflotsiinin kanssa (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Farmakokineettiset yhteisvaikutukset
Muiden lääkevalmisteiden vaikutus kanagliflotsiiniin
Kanagliflotsiini metaboloituu pääasiassa UDP-glukuronyylitransferaasi 1A9- (UGT1A9) ja 2B4- (UGT2B4) ‑välitteisen glukuronidikonjugaation välityksellä. Kanagliflotsiinin kuljettajaproteiineja ovat P-glykoproteiini (P‑gp) ja rintasyövän resistenssiproteiini (BCRP).
Entsyymin induktorit (esim. mäkikuisma [Hypericum perforatum], rifampisiini, barbituraatit, fenytoiini, karbamatsepiini, ritonaviiri, efavirentsi) saattavat pienentää kanagliflotsiinialtistusta. Kun kanagliflotsiinia annettiin yhdessä rifampisiinin (monien aktiivisten kuljettajien ja lääkevalmisteita metaboloivien entsyymien induktorin) kanssa, kanagliflotsiinin systeemisen altistuksen (AUC) havaittiin vähentyneen 51 % ja huippupitoisuuden (Cmax) pienentyneen 28 %. Kanagliflotsiinialtistuksen tällainen pieneneminen saattaa heikentää sen tehoa.
Jos näiden UGT‑entsyymien ja kuljettajaproteiinien yhdistelmäinduktoreja joudutaan antamaan samanaikaisesti kanagliflotsiinihoidon aikana, veren glukoositasapainoa on seurattava sen arvioimiseksi, onko vaste kanagliflotsiinille riittävä. Jos näiden UGT-entsyymien indusoijaa on välttämätöntä käyttää samaan aikaan kanagliflotsiinin kanssa, annoksen suurentamista 300 mg:aan kerran vuorokaudessa saattaa olla syytä harkita, jos potilas parhaillaan sietää kanagliflotsiiniannoksen 100 mg kerran vuorokaudessa, potilaan eGFR on ≥ 60 ml/min/1,73 m2 tai CrCl on ≥ 60 ml/min ja tiukempi veren glukoosipitoisuuden kontrolli on tarpeen. Jos kanagliflotsiinia 100 mg:n annoksina käyttävän potilaan eGFR on 45 ml/min/1,73 m2 – < 60 ml/min/1,73 m2 tai CrCl on 45 ml/min – < 60 ml/min, ja potilas käyttää samaan aikaan UGT-entsyymin indusoijaa ja tiukempi veren glukoosipitoisuuden kontrolli on tarpeen, muiden glukoosipitoisuutta pienentävien lääkkeiden käyttöä on harkittava (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Kolestyramiini saattaa pienentää kanagliflotsiinialtistusta. Kanagliflotsiinin saa ottaa viimeistään 1 tuntia ennen sappihappoja sitovan lääkeaineen ottamista tai aikaisintaan 4–6 tuntia sen ottamisen jälkeen, jotta mahdolliset vaikutukset niiden imeytymiseen voidaan minimoida.
Yhteisvaikutustutkimukset viittaavat siihen, että metformiini, hydroklooritiatsidi, ehkäisytabletit (etinyyliestradioli ja levonorgestreeli), siklosporiini ja/tai probenesidi eivät muuta kanagliflotsiinin farmakokinetiikkaa.
Kanagliflotsiinin vaikutus muihin lääkevalmisteisiin
Digoksiini
Kun kanagliflotsiinia 300 mg kerran vuorokaudessa 7 vuorokauden ajan ja digoksiinikerta-annos 0,5 mg ja sen jälkeen digoksiiniannoksia 0,25 mg vuorokaudessa 6 vuorokauden ajan käytettiin yhdistelmänä, digoksiinin AUC-arvo suureni 20 % ja Cmax-arvo suureni 36 % todennäköisesti P‑gp:n estymisen seurauksena. Kanagliflotsiinin on havaittu estävän P-gp:tä in vitro. Jos potilas käyttää digoksiinia tai muita sydänglykosideja (esim. digitoksiinia), potilasta on seurattava asianmukaisesti.
Litium
SGLT2:n estäjien samanaikainen käyttö litiumin kanssa saattaa pienentää seerumin litiumpitoisuuksia. Seerumin litiumpitoisuutta on seurattava tavallista tarkemmin kanagliflotsiinihoidon aikana, etenkin hoidon alussa ja annosmuutosten yhteydessä.
Dabigatraani
Kanagliflotsiinin (heikko P-gp:n estäjä) samanaikaisen käytön vaikutusta dabigatraanieteksilaattiin (P-gp:n substraatti) ei ole tutkittu. Koska kanagliflotsiini saattaa suurentaa dabigatraanipitoisuuksia, potilasta on seurattava (tarkkailtava verenvuodon tai anemian oireita) dabigatraanin ja kanagliflotsiinin käytössä yhdistelmänä.
Simvastatiini
Kanagliflotsiiniannosten 300 mg kerran vuorokaudessa 6 vuorokauden ajan käyttö yhdistelmänä simvastatiinin (CYP3A4:n substraatti) 40 mg:n kerta-annoksen kanssa johti simvastatiinin AUC-arvon suurenemiseen 12 % ja Cmax-arvon suurenemiseen 9 % sekä simvastatiinihapon AUC-arvon suurenemiseen 18 % ja Cmax-arvon suurenemiseen 26 %. Simvastatiini- ja simvastatiinihappoaltistuksen suurenemisen ei katsota olevan kliinisesti oleellista.
Kanagliflotsiinin BCRP-proteiinia suolistossa estävää vaikutusta ei voida sulkea pois, joten altistus BCRP:n kuljettamille lääkevalmisteille, esim. tietyille statiineille, kuten rosuvastatiinille, ja joillekin syöpälääkevalmisteille, saattaa siksi lisääntyä.
Kanagliflotsiinilla ei yhteisvaikutustutkimuksissa ollut vakaassa tilassa kliinisesti oleellisia vaikutuksia metformiinin, ehkäisytablettien (etinyyliestradiolin ja levonorgestreelin), glibenklamidin, parasetamolin, hydroklooritiatsidin eikä varfariinin farmakokinetiikkaan.
Lääkevalmisteista aiheutuvat häiriöt laboratoriokokeissa
1,5‑AG-määritys
Invokanasta aiheutuva lisääntynyt glukoosin erittyminen virtsaan voi pienentää 1,5‑anhydroglusitolin (1,5‑AG) pitoisuutta virheellisesti, minkä vuoksi 1,5-AG-määritys glukoositasapainon arvioimiseksi on epäluotettava. 1,5‑AG-määritystä ei siksi pidä käyttää kanagliflotsiinihoitoa saavien potilaiden glukoositasapainon arvioimiseen. Lisätietojen saamiseksi saattaa olla tarpeen ottaa yhteyttä 1,5-AG-testin valmistajaan.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja kanagliflotsiinin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Kanagliflotsiinia ei saa käyttää raskauden aikana. Kun raskaus todetaan, kanagliflotsiinihoito on lopetettava.
Imetys
Ei tiedetä, erittyvätkö kanagliflotsiini ja/tai sen metaboliitit ihmisen rintamaitoon. Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet kanagliflotsiinin/metaboliittien erittyvän rintamaitoon samoin kuin farmakologisesti välittyviä vaikutuksia imetettäviin jälkeläisiin ja kanagliflotsiinille altistuneisiin nuoriin rottiin (ks. kohta Prekliiniset tiedot turvallisuudesta). Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. Kanagliflotsiinia ei saa käyttää imetyksen aikana.
Hedelmällisyys
Kanagliflotsiinin vaikutusta ihmisen hedelmällisyyteen ei ole tutkittu. Eläinkokeissa ei havaittu vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Kanagliflotsiinilla ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaalle on kuitenkin kerrottava hypoglykemian riskistä käytettäessä kanagliflotsiinia lisälääkkeenä insuliinin tai insuliinin eritystä lisäävien lääkkeiden kanssa sekä volyymivajeeseen liittyvien haittavaikutusten, kuten asentohuimauksen, lisääntyneestä riskistä (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kanagliflotsiinin turvallisuutta selvitettiin 22 645:llä tyypin 2 diabetesta sairastavalla aikuispotilaalla, joista 13 278 sai kanagliflotsiinia ja 9 367 sai vertailuvalmistetta 15 kaksoissokkoutetussa, kontrolloidussa, vaiheen 3 ja vaiheen 4 kliinisessä tutkimuksessa. Kahdessa erityisessä kardiovaskulaaritutkimuksessa hoitoa sai yhteensä 10 134 aikuispotilasta, ja altistuksen kesto oli keskimäärin 149 viikkoa (CANVAS-tutkimuksessa 223 viikkoa ja CANVAS-R-tutkimuksessa 94 viikkoa). Lisäksi 12 kaksoissokkoutetussa, kontrolloidussa vaiheen 3 ja vaiheen 4 tutkimuksessa hoitoa sai 8 114 aikuispotilasta, ja heillä altistuksen kesto oli keskimäärin 49 viikkoa. Yhdessä erityisessä munuaisiin liittyvien hoitotulosten tutkimuksessa oli yhteensä 4 397 aikuispotilasta, joilla oli tyypin 2 diabetes ja diabeteksen munuaistauti, ja heillä altistuksen kesto oli keskimäärin 115 viikkoa.
Turvallisuuden ja siedettävyyden ensisijainen arvio tehtiin neljän 26 viikkoa kestäneen aikuisille tehdyn lumekontrolloidun kliinisen tutkimuksen (monoterapiana sekä lisälääkkeenä metformiinin, metformiinin ja sulfonyyliurean sekä metformiinin ja pioglitatsonin kanssa) yhdistetyssä analyysissa (n = 2 313). Yleisimmin raportoituja haittavaikutuksia olivat hypoglykemia yhdistelmähoidossa insuliinin tai sulfonyyliurean kanssa, ulkosynnytinten kandidiaasi, virtsatieinfektio ja polyuria tai pollakisuria (eli tiheä virtsaamistarve). Hoidon lopettamiseen ≥ 0,5 %:lla kaikista kanagliflotsiinihoitoa näissä tutkimuksissa saaneista aikuispotilaista johtaneita haittavaikutuksia olivat ulkosynnytinten kandidiaasi (0,7 %:lla naispotilaista) sekä balaniitti tai balanopostiitti (0,5 %:lla miespotilaista). Koko kanagliflotsiiniohjelman tiedoista (lumelääkkeellä ja aktiivisella aineella kontrolloiduista tutkimuksista) tehtiin raportoitujen haittavaikutusten arvioimiseksi lisäksi turvallisuusanalyysit (pitkäaikaistiedot mukaan lukien), jotta haittavaikutukset voitiin tunnistaa (taulukko 2) (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Taulukossa 2 esitetyt haittavaikutustiedot perustuvat edellä kuvattujen lumevalmisteella ja vaikuttavalla aineella kontrolloitujen tutkimusten yhdistettyyn analyysiin. Tässä taulukossa on mukana myös kanagliflotsiinin markkinoille tulon jälkeisessä käytössä maailmanlaajuisesti raportoidut haittavaikutukset. Haittavaikutukset on lueteltu seuraavassa esiintymistiheyden ja elinjärjestelmän mukaan. Esiintymistiheydet on määritelty seuraavan esitystavan mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko 2.Haittavaikutukset lumevalmisteellae ja vaikuttavalla aineella kontrolloiduissa tutkimuksissae sekä valmisteen markkinoille tulon jälkeen
Elinjärjestelmä Esiintyvyys | Haittavaikutus |
| Infektiot | |
| hyvin yleinen | Ulkosynnyttimien ja emättimen kandidiaasib, j |
| yleinen | Balaniitti tai balanopostiittib, k, virtsatieinfektioc (valmisteen markkinoille tulon jälkeen on raportoitu pyelonefriittiä ja urosepsistä) |
| tuntematon | Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)d |
| Immuunijärjestelmä | |
| harvinainen | Anafylaktinen reaktio |
| Aineenvaihdunta ja ravitsemus | |
| hyvin yleinen | Hypoglykemia yhdistelmähoidossa insuliinin tai sulfonyyliurean kanssac |
| melko harvinainen | Elimistön kuivuminena |
| harvinainen | Diabeettinen ketoasidoosib |
| Hermosto | |
| melko harvinainen | Asentohuimausa, synkopeea |
| Verisuonisto | |
| melko harvinainen | Hypotensioa, ortostaattinen hypotensioa |
| Ruoansulatuselimistö | |
| yleinen | Ummetus, janof, pahoinvointi |
| Iho ja ihonalainen kudos | |
| melko harvinainen | Valoherkkyys, ihottumag, nokkosihottuma |
| harvinainen | Angioedeema |
| Luusto, lihakset ja sidekudos | |
| melko harvinainen | Luunmurtumath |
| Munuaiset ja virtsatiet | |
| yleinen | Polyuria tai pollakisuriai |
| melko harvinainen | Munuaisten vajaatoiminta (lähinnä volyymivajeen yhteydessä) |
| Tutkimukset | |
| yleinen | Dyslipidemial, suurentunut hematokriittib, m |
| melko harvinainen | Suurentunut veren kreatiniinipitoisuusb, n, suurentunut veren ureapitoisuusb, o, suurentunut veren kaliumpitoisuusb, p, suurentunut veren fosfaattipitoisuusq |
| Kirurgiset ja lääketieteelliset toimenpiteet | |
| melko harvinainen | Alaraaja-amputaatiot (pääasiassa varpaan ja jalkaterän keskiosan amputaatiot), etenkin potilailla, joilla on suuri sydäntautiriskib |
a Liittyy volyymivajeeseen, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja haittavaikutuksen kuvaus jäljempänä. b Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja haittavaikutuksen kuvaus jäljempänä. c Ks. haittavaikutuksen kuvaus jäljempänä. d Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. e Yksittäisten pivotaalitutkimusten (sisältää keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla, iäkkäämmillä potilailla [≥ 55-vuotiaista ≤ 80-vuotiaisiin], suurentuneen kardiovaskulaarisen tai munuaisriskin potilailla tehdyt tutkimukset) turvallisuustietoprofiilit olivat yleensä yhdenmukaiset tässä taulukossa esitettyjen todettujen haittavaikutusten kanssa. f Jano sisältää termit jano, suun kuivuminen ja polydipsia. g Ihottuma sisältää termit erytematoottinen ihottuma, yleistynyt ihottuma, makulaarinen ihottuma, makulopapulaarinen ihottuma, papulaarinen ihottuma, kutiseva ihottuma ja rakkulainen ihottuma. | |
Valikoitujen haittavaikutusten kuvaukset
Diabeettinen ketoasidoosi
Pitkäkestoisessa munuaisiin liittyvien hoitotulosten tutkimuksessa, jossa oli mukana tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavia aikuispotilaita, diabeettisen ketoasidoosin arvioitujen tapahtumien ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneilla 0,21 (0,5 %, 12/2 200) seurantajakson 100 potilasvuoden aikana ja lumehoitoa saaneilla 0,03 (0,1 %, 2/2 197) seurantajakson 100 potilasvuoden aikana; niistä 14 potilaasta, joilla ilmeni diabeettinen ketoasidoosi, hoitoa edeltävä eGFR-arvo oli 30 – < 45 ml/min/1,73 m2 kahdeksalla potilaalla (seitsemän sai kanagliflotsiinia 100 mg ja yksi lumelääkettä) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Alaraaja-amputaatiot
Integroitu CANVAS-ohjelma koostui kahdesta laajasta pitkäkestoisesta, satunnaistetusta, lumekontrolloidusta tutkimuksesta (CANVAS ja CANVAS-R), ja niissä oli mukana 10 134 aikuispotilasta. Ohjelmassa havaittiin, että potilailla, joilla oli tyypin 2 diabetes ja joilla oli todettu kardiovaskulaaritauti tai vähintään kaksi kardiovaskulaaritaudin riskitekijää, kanagliflotsiiniin liittyi suurentunut alaraaja-amputaatioiden riski. Epäsuhta oli todettavissa jo ensimmäisten 26 hoitoviikon aikana. Potilaiden seuranta-aika oli CANVAS-tutkimuksessa keskimäärin 5,7 vuotta ja CANVAS‑R-tutkimuksessa keskimäärin 2,1 vuotta. Amputaation riski oli suurin potilailla, joille oli tehty amputaatio ennen hoidon aloittamista, joilla oli ääreisverisuonisairaus tai neuropatia, riippumatta siitä, saiko potilas kanagliflotsiinia vai lumevalmistetta. Alaraaja-amputaation riski ei ollut annoksesta riippuvainen. Integroidun CANVAS-ohjelman amputaatiota koskevat tulokset esitetään taulukossa 3.
100 mg:n kanagliflotsiiniannosten käyttöön liittyvässä alaraaja-amputaatioiden riskissä ei ollut eroa lumelääkkeeseen verrattuna (vastaavasti 1,2 vs. 1,1 tapahtumaa 100 potilasvuotta kohti [HR: 1,11; 95 % CI 0,79; 1,56]) CREDENCE-tutkimuksessa, joka oli pitkäkestoinen munuaisiin liittyvien hoitotulosten tutkimus ja jossa oli mukana 4 397 tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavaa aikuispotilasta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Muissa tyypin 2 diabetesta koskeneissa kanagliflotsiinitutkimuksissa potilailla, jotka muodostivat 8 114 aikuispotilaan yleisen diabetespotilasjoukon, alaraaja-amputaation riskissä ei todettu eroa verrokkeihin verrattuna.
| Taulukko 3. Amputaatioiden integroitu analyysi tutkimuksista CANVAS ja CANVAS-R | ||
Lumelääke N = 4344 | kanagliflotsiini N = 5790 | |
| Tutkittavia, joilla tapahtuma, lkm yhteensä, n (%) | 47 (1,1) | 140 (2,4) |
| Ilmaantuvuus (100 potilasvuotta kohden) | 0,34 | 0,63 |
| Riskitiheyssuhde (95 % CI) vs. lumelääke | 1,97 (1,41; 2,75) | |
| Pieni amputaatio, n (%)* | 34/47 (72,3) | 99/140 (70,7) |
| Suuri amputaatio, n (%)† | 13/47 (27,7) | 41/140 (29,3) |
Huom.: Ilmaantuvuus perustuu niiden potilaiden lukumäärään, joille on tehty vähintään yksi amputaatio, eikä amputaatiota koskevien tapahtumien kokonaislukumäärään. Potilaan seuranta-aika lasketaan päivästä 1 ensimmäisen amputaatiota koskevan tapahtuman päivämäärään. Joillekin potilaille tehtiin usempi kuin yksi amputaatio. Pienten ja suurten amputaatioiden prosenttiosuus perustuu kunkin potilaan suurimpaan amputaatioon. * Varvas ja jalkaterän keskiosa | ||
CANVAS-ohjelman tutkittavilla, joille tehtiin amputaatio, yleisimpiä amputaatiokohtia kummassakin hoitoryhmässä olivat varvas ja jalkaterän keskiosa (71 %) (taulukko 3). Useat amputaatiot (toisinaan kummankin alaraajan amputaatioita) olivat harvinaisia ja niiden osuus oli kummassakin hoitoryhmässä samankaltainen.
Kummassakin hoitoryhmässä tavallisimpia amputaatiotarpeeseen liittyneitä tapahtumia olivat alaraajan infektiot, diabeettinen jalkahaavauma, ääreisvaltimotauti ja kuolio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Volyymivajeeseen liittyvät haittavaikutukset
Kaikkien volyymivajeeseen liittyneiden haittavaikutusten (esim. asentohuimauksen, ortostaattisen hypotension, hypotension, elimistön kuivumisen ja synkopeen) ilmaantuvuus neljän 26 viikkoa kestäneen aikuisille tehdyn lumekontrolloidun tutkimuksen yhdistetyssä analyysissä oli 1,2 % kanagliflotsiinia 100 mg:n annoksina saaneilla potilailla, 1,3 % kanagliflotsiinia 300 mg:n annoksina saaneilla potilailla ja 1,1 % lumelääkettä saaneilla potilailla. Kahdessa aktiivisella aineella kontrolloidussa tutkimuksessa ilmaantuvuus oli kanagliflotsiinihoidon yhteydessä samankaltainen kuin vertailuvalmisteita käytettäessä.
Yhdessä erityisessä pitkäkestoisessa kardiovaskulaaritutkimuksessa (CANVAS), jossa aikuispotilaat olivat yleensä iäkkäämpiä ja heillä oli useammin diabeteksen komplikaatioita, volyymivajeeseen liittyvien haittavaikutusten ilmaantuvuus oli 2,3 tapahtumaa 100 potilasvuotta kohden 100 mg:n kanagliflotsiiniannosten yhteydessä, 2,9 tapahtumaa 100 potilasvuotta kohden 300 mg:n kanagliflotsiiniannosten yhteydessä ja 1,9 tapahtumaa 100 potilasvuotta kohden lumelääkkeen yhteydessä.
Näiden haittavaikutusten riskitekijöiden tutkimiseksi tehtiin 13 kontrolloituun vaiheen 3 ja vaiheen 4 tutkimukseen osallistuneiden aikuispotilaiden laajempi yhdistetty analyysi (N = 12 441), jossa oli mukana kanagliflotsiinin kumpikin annostus. Tässä yhdistetyssä analyysissä potilailla, jotka käyttivät loop-diureetteja, lähtötilanteen eGFR oli 30 ml/min/1,73 m2 – < 60 ml/min/1,73 m2 tai ikä oli ≥ 75 vuotta, oli yleensä suurempi näiden haittavaikutusten ilmaantuvuus. Loop-diureetteja käyttäneillä potilailla ilmaantuvuus oli 100 mg:n kanagliflotsiiniannosten yhteydessä 5,0 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannosten yhteydessä 5,7 tapahtumaa 100 potilasvuoden altistusta kohden ja verrokkiryhmässä 4,1 tapahtumaa 100 potilasvuoden altistusta kohden. Jos potilaan eGFR oli lähtötilanteessa 30 ml/min/1,73 m2 – < 60 ml/min/1,73 m2, ilmaantuvuus oli 100 mg:n kanagliflotsiiniannosten yhteydessä 5,2 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannosten yhteydessä 5,4 tapahtumaa 100 potilasvuoden altistusta kohden ja verrokkiryhmässä 3,1 tapahtumaa 100 potilasvuoden altistusta kohden. Jos potilaan ikä oli ≥ 75 vuotta, ilmaantuvuus oli 100 mg:n kanagliflotsiiniannosten yhteydessä 5,3 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannosten yhteydessä 6,1 tapahtumaa 100 potilasvuoden altistusta kohden ja verrokkiryhmässä 2,4 tapahtumaa 100 potilasvuoden altistusta kohden (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Pitkäkestoisessa munuaisiin liittyvien hoitotulosten tutkimuksessa, jossa oli mukana tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavia aikuispotilaita, volyymivajeeseen liittyneiden tapahtumien ilmaantuvuus oli 100 mg:n kanagliflotsiiniannosten yhteydessä 2,84 tapahtumaa 100 potilasvuotta kohti ja verrokkiryhmässä 2,35 tapahtumaa 100 potilasvuotta kohti. Ilmaantuvuuden havaittiin suurenevan eGFR-arvon pienetessä. Tutkittavilla, joiden eGFR-arvo oli 30 ‑ < 45 ml/min/1,73 m2, volyymivajeen ilmaantuvuus oli suurempi kanagliflotsiinia saaneessa ryhmässä (4,91 tapahtumaa 100 potilasvuotta kohti) kuin lumelääkettä saaneessa ryhmässä (2,60 tapahtumaa 100 potilasvuotta kohti); alaryhmissä, joissa eGFR-arvo oli ≥ 45 ‑ < 60 ja 60 ‑ < 90 ml/min/1,73 m2, ilmaantuvuus ryhmien välillä oli kuitenkin vastaava.
Erityisessä kardiovaskulaaritutkimuksessa ja laajemmassa yhdistetyssä analyysissa sekä erityisessä aikuisille tehdyssä munuaisiin liittyvien hoitotulosten tutkimuksessa volyymivajeeseen liittyneiden haittavaikutusten ja siihen liittyneiden vakavien haittavaikutusten vuoksi hoidon keskeyttäneiden määrä ei ollut kanagliflotsiinihoidon yhteydessä suurempi.
Hypoglykemia lisälääkehoidossa insuliinin tai insuliinin eritystä lisäävien lääkkeiden kanssa
Hypoglykemian esiintyvyys oli kummassakin hoitoryhmässä, lumelääke mukaan lukien, vähäistä (noin 4 %) käytettäessä kanagliflotsiinia monoterapiana tai lisälääkkeenä metformiinin kanssa. Kun kanagliflotsiini lisättiin insuliinihoitoon, hypoglykemiaa havaittiin 49,3 %:lla 100 mg:n kanagliflotsiiniannoksia saaneista aikuispotilaista, 48,2 %:lla 300 mg:n kanagliflotsiiniannoksia saaneista ja 36,8 %:lla lumelääkettä saaneista aikuispotilaista, ja vaikea-asteista hypoglykemiaa esiintyi 1,8 %:lla 100 mg:n kanagliflotsiiniannoksia saaneista aikuispotilaista, 2,7 %:lla 300 mg:n kanagliflotsiiniannoksia saaneista ja 2,5 %:lla lumelääkettä saaneista potilaista. Kun kanagliflotsiini lisättiin sulfonyyliureahoitoon, hypoglykemiaa havaittiin 4,1 %:lla 100 mg:n kanagliflotsiiniannoksia saaneista aikuispotilaista, 12,5 %:lla 300 mg:n kanagliflotsiiniannoksia saaneista aikuispotilaista ja 5,8 %:lla lumelääkettä saaneista aikuispotilaista (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset).
Sukupuolielinten sieni-infektiot
Ulkosynnytinten kandidiaasia (vulvovaginiitti ja ulkosynnytinten sieni-infektio mukaan lukien) raportoitiin 10,4 %:lla 100 mg:n kanagliflotsiiniannoksia saaneista aikuisista naispotilaista ja 11,4 %:lla 300 mg:n kanagliflotsiiniannoksia saaneista naispotilaista verrattuna 3,2 %:iin lumelääkettä saaneista naispotilaista. Ulkosynnytinten kandidiaasia raportoitiin useimmiten neljän ensimmäisen kanagliflotsiinihoitokuukauden aikana. 2,3 %:lla kanagliflotsiinihoitoa saaneista naispotilaista esiintyi useampi kuin yksi infektio. Kaikkiaan 0,7 % naispotilaista keskeytti kanagliflotsiinihoidon ulkosynnytinten kandidiaasin vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). CANVAS-ohjelmassa infektion keston mediaani oli kanagliflotsiiniryhmässä pidempi kuin lumehoitoryhmässä.
Candida-peräisen balaniitin tai balanopostiitin esiintyvyys kanagliflotsiinia saaneilla aikuisilla miespotilailla oli 2,98 tapahtumaa 100 potilasvuotta kohden ja lumelääkettä saaneilla miespotilailla 0,79 tapahtumaa 100 potilasvuotta kohden. 2,4 %:lla kanagliflotsiinihoitoa saaneista miespotilaista esiintyi useampi kuin yksi infektio. Miespotilailla oli kanagliflotsiinihoidon lopettamista koskevia tapahtumia Candida-peräisen balaniitin tai balanopostiitin vuoksi 0,37 tapahtumaa 100 potilasvuotta kohden. Fimoosia raportoitiin kanagliflotsiinihoidon yhteydessä 0,39 tapahtumaa 100 potilasvuotta kohden ja lumehoidon yhteydessä 0,07 tapahtumaa 100 potilasvuotta kohden. Ympärileikkauksia oli kanagliflotsiinihoidon yhteydessä 0,31 tapahtumaa 100 potilasvuotta kohden ja lumehoidon yhteydessä 0,09 tapahtumaa 100 potilasvuotta kohden (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Virtsatieinfektiot
Aikuisille tehdyissä kliinisissä tutkimuksissa virtsatieinfektioita raportoitiin yleisemmin 100 mg:n ja 300 mg:n kanagliflotsiiniannosten yhteydessä (5,9 % vs. 4,3 %) verrattuna 4,0 %:iin lumelääkkeen yhteydessä. Infektiot olivat useimmiten lieviä tai keskivaikeita eikä vakavien haittavaikutusten esiintyvyys suurentunut. Näissä tutkimuksissa tavanomainen hoito tehosi tutkittavan jatkaessa kanagliflotsiinihoitoa.
Markkinoille tulon jälkeisistä komplisoituneiden virtsatieinfektioiden, myös pyelonefriitin ja urosepsiksen, tapauksista on kuitenkin ilmoitettu kanagliflotsiinihoitoa saavilla potilailla, ja ne ovat usein johtaneet hoidon keskeyttämiseen.
Luunmurtumat
Kardiovaskulaaritutkimuksessa (CANVAS) 4 327 hoitoa saaneella aikuisella tutkittavalla, joilla oli todettu kardiovaskulaaritauti tai vähintään kaksi sen riskitekijää, kaikkien arvioitujen luunmurtumien ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneilla 1,6 seurantajakson 100 potilasvuoden aikana, 300 mg:n kanagliflotsiiniannoksia saaneilla 1,8 seurantajakson 100 potilasvuoden aikana ja lumehoitoa saaneilla 1,1 seurantajakson 100 potilasvuoden aikana. Epäsuhta murtumissa todettiin hoidon alussa ensimmäisten 26 hoitoviikon aikana.
Kahdessa muussa pitkäkestoisessa aikuisille tehdyssä tutkimuksessa ja aikuisille tehdyissä tutkimuksissa, jotka tehtiin yleisessä diabetespotilasjoukossa, murtumariskissä ei havaittu eroa kanagliflotsiinin ja verrokkien välillä. Toisessa kardiovaskulaaritutkimuksessa (CANVAS-R) 5 807 hoitoa saaneella aikuisilla tutkittavalla, joilla oli todettu kardiovaskulaaritauti tai vähintään kaksi sen riskitekijää, kaikkien arvioitujen luunmurtumien ilmaantuvuus oli kanagliflotsiinia saaneilla 1,1 seurantajakson 100 potilasvuoden aikana ja lumehoitoa saaneilla 1,3 seurantajakson 100 potilasvuoden aikana.
Pitkäkestoisessa munuaisiin liittyvien hoitotulosten tutkimuksessa, jossa oli mukana 4 397 hoitoa saanutta tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavaa aikuispotilasta, kaikkien arvioitujen luunmurtumien ilmaantuvuus oli sekä 100 mg:n kanagliflotsiiniannoksia saaneilla että lumehoitoa saaneilla 1,2 tapahtumaa seurantajakson 100 potilasvuoden aikana. Muissa kanagliflotsiinilla tehdyissä tyypin 2 diabetesta koskevissa tutkimuksissa, joissa oli mukana 7 729 aikuispotilaan yleinen diabetespotilasjoukko ja joissa arvioitiin luunmurtumia, kaikkien arvioitujen luunmurtumien ilmaantuvuus oli kanagliflotsiinia saaneilla 1,2 seurantajakson 100 potilasvuoden aikana ja vertailuryhmässä 1,1 seurantajakson 100 potilasvuoden aikana. Kanagliflotsiini ei vaikuttanut 104 viikon hoidon jälkeen haitallisesti luuntiheyteen.
Erityispotilasryhmät
Iäkkäät potilaat
Iäkkäiden potilaiden kanagliflotsiinia koskeva turvallisuusprofiili oli 13 lumekontrolloidun ja aktiivisella aineella kontrolloidun tutkimuksen yhdistetyssä analyysissa yleensä yhdenmukainen nuorempien potilaiden turvallisuusprofiilin kanssa. Volyymivajeeseen liittyvien haittavaikutusten (kuten asentohuimauksen, ortostaattisen hypotension, hypotension) ilmaantuvuus oli ≥ 75-vuotiailla suurempi, kun ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneilla 5,3 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannoksia saaneilla 6,1 tapahtumaa 100 potilasvuoden altistusta kohden ja vertailuryhmässä 2,4 tapahtumaa 100 potilasvuoden altistusta kohden. 100 mg:n ja 300 mg:n kanagliflotsiiniannoksilla raportoitiin eGFR-arvon pienenemistä (‑3,4 ml/min/1,73 m2 ja ‑4,7 ml/min/1,73 m2) verrattuna vertailuryhmään (‑4,2 ml/min/1,73 m2). Lähtötilanteen eGFR-arvon keskiarvo oli 100 mg:n kanagliflotsiiniannoksia saaneilla 62,5 ml/min/1,73 m2, 300 mg:n kanagliflotsiiniannoksia saaneilla 64,7 ml/min/1,73 m2 ja vertailuryhmässä 63,5 ml/min/1,73 m2 (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta aikuispotilailla, joilla riittämättömässä hoitotasapainossa oleva tyypin 2 diabetes
Jos aikuispotilaan lähtötilanteen eGFR oli < 60 ml/min/1,73 m2, volyymivajeeseen liittyvien haittavaikutusten (esim. asentohuimauksen, ortostaattisen hypotension, hypotension) ilmaantuvuus oli suurempi, sillä ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneessa ryhmässä 5,3 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannoksia saaneessa ryhmässä 5,1 tapahtumaa 100 potilasvuoden altistusta kohden ja lumeryhmässä 3,1 tapahtumaa 100 potilasvuoden altistusta kohden (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla oli suurempi suurentuneiden seerumin kaliumpitoisuuksien kokonaisilmaantuvuus, kun ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneessa ryhmässä 4,9 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannoksia saaneessa ryhmässä 6,1 tapahtumaa 100 potilasvuoden altistusta kohden ja lumeryhmässä 5,4 tapahtumaa 100 potilasvuoden altistusta kohden. Pitoisuuksien suureneminen oli yleensä ohimenevää eikä vaatinut erityistä hoitoa.
Keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla seerumin kreatiniinipitoisuuden suurenemista 9,2 mikromol/l ja veren ureatyppipitoisuuden suurenemista noin 1,0 mmol/l havaittiin kummassakin kanagliflotsiiniannosryhmässä. Milloin tahansa hoidon aikana huomattavammin (> 30 %) pienentyneiden eGFR-arvojen ilmaantuvuus oli 100 mg:n kanagliflotsiiniannoksia saaneilla potilailla 7,3 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannoksia saaneilla 8,1 tapahtumaa 100 potilasvuoden altistusta kohden ja lumelääkettä saaneilla potilailla 6,5 tapahtumaa 100 potilasvuoden altistusta kohden. Tällaisen pitoisuuden pienenemisen ilmaantuvuus viimeisen lähtötilanteen jälkeisen arvon yhteydessä oli 100 mg:n kanagliflotsiiniannoksia saaneessa hoitoryhmässä 3,3 tapahtumaa 100 potilasvuoden altistusta kohden, 300 mg:n kanagliflotsiiniannoksia saaneessa hoitoryhmässä 2,7 tapahtumaa 100 potilasvuoden altistusta kohden ja lumelääkeryhmässä 3,7 tapahtumaa 100 potilasvuoden altistusta kohden (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kanagliflotsiinihoitoa saaneilla potilailla keskimääräinen eGFR-arvo pieneni alkuvaiheessa lähtötilanteen eGFR-arvosta riippumatta. Tämän jälkeen eGFR-arvo pysyi muuttumattomana tai suureni asteittain hoitoa jatkettaessa. Keskimääräinen eGFR-arvo palautui lähtötilanteeseen hoidon lopettamisen jälkeen, mikä viittaa siihen, että hemodynaamiset muutokset voivat olla osallisina tällaisiin munuaisten toiminnan muutoksiin.
Munuaisten vajaatoiminta aikuispotilailla, joilla on diabeteksen munuaistauti ja tyypin 2 diabetes
Pitkäkestoisessa munuaisiin liittyvien hoitotulosten tutkimuksessa, jossa oli mukana tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavia aikuispotilaita, munuaisiin liittyviä tapahtumia ilmeni usein kummassakin ryhmässä mutta harvemmin kanagliflotsiinia saaneessa ryhmässä (5,71 tapahtumaa 100 potilasvuotta kohti) kuin lumelääkettä saaneessa ryhmässä (7,91 tapahtumaa 100 potilasvuotta kohti). Myös vakavia ja vaikeita munuaisiin liittyviä tapahtumia esiintyi vähemmän kanagliflotsiiniryhmässä kuin lumehoitoa saaneessa ryhmässä. Munuaisiin liittyvien tapahtumien ilmaantuvuus oli pienempi kanagliflotsiinia saaneilla kuin lumehoitoa saaneilla kaikissa kolmessa eGFR-arvon mukaisessa ositeryhmässä; munuaisiin liittyvien tapahtumien ilmaantuvuus oli suurin ositeryhmässä, jossa eGFR-arvo oli 0 – < 45 ml/min/1,73 m2 (kanagliflotsiinia saaneilla 9,47 tapahtumaa 100 potilasvuotta kohti vs. lumehoitoa saaneilla 12,80 tapahtumaa 100 potilasvuotta kohti).
Pitkäkestoisessa munuaisiin liittyvien hoitotulosten tutkimuksessa ei todettu eroa seerumin kaliumpitoisuudessa, hyperkalemiatapahtumien lisääntymisessä eikä seerumin kaliumpitoisuuden absoluuttisessa (> 6,5 mEq/l) tai suhteellisessa (> normaalin yläraja ja > 15 %:n suureneminen lähtötilanteesta) suurenemisessa 100 mg:n kanagliflotsiiniannoksia ja lumehoitoa saaneiden välillä.
Yleensä ottaen hoitoryhmien välillä ei todettu epäsuhtaa fosfaattipitoisuuksien poikkeavuuksien suhteen, ei yleisesti eikä kummassakaan eGFR-luokassa (45 – < 60 tai 30 – < 45 ml/min/1,73 m2 [CrCl 45 – < 60 tai 30 – < 45 m/min]).
Pediatriset potilaat
DIA3018-tutkimuksessa hoidettiin 171:tä vähintään 10 vuoden ikäistä tyypin 2 diabetesta sairastavaa lasta: 84 tutkittavaa sai kanagliflotsiinia ja 87 tutkittavaa sai lumelääkettä (ks. kohta Farmakodynamiikka). Kaikkiaan haittavaikutusten yleisyydet, tyypit ja vaikeusasteet vähintään 10 vuoden ikäisillä lapsilla olivat verrannolliset aikuispotilailla havaittuihin. Seuraavia hoidon aikana ilmenneitä haittavaikutuksia ilmeni yleisemmin kanagliflotsiinihoitoa saaaneilla lapsilla lumelääkettä saaneisiin lapsiin verrattuna: päänsärky, nasofaryngiitti, virtsatieinfektio ja oksentelu. Sukupuolielinten sieni-infektioita ja bakteeeri-infektioita ilmoitettiin vähän kanagliflotsiinia saaneilla eikä lainkaan lumelääkettä saaneilla. Yksikään hoidon aikana ilmenneistä haittavaikutuksista ei ollut vaikea tai vakava.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Terveille tutkittaville annetut enimmillään 1600 mg:n kanagliflotsiinikerta-annokset ja tyypin 2 diabetesta sairastaville potilaille 12 viikon ajan annetut 300 mg:n kanagliflotsiiniannokset kaksi kertaa vuorokaudessa siedettiin yleensä hyvin.
Hoito
Yliannoksen yhteydessä kannattaa ryhtyä tavanomaisiin elintoimintoja tukeviin toimenpiteisiin eli poistaa imeytymätön lääkeaine maha-suolikanavasta, seurata potilasta kliinisesti ja aloittaa tarvittaessa kliiniset hoitotoimenpiteet. Kanagliflotsiini poistui elimistöstä 4 tunnin kestoisessa hemodialyysihoidossa vain hyvin vähäisessä määrin. Kanagliflotsiini ei oletettavasti ole dialysoitavissa peritoneaalidialyysillä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, veren glukoosipitoisuutta pienentävät lääkkeet, lukuun ottamatta insuliineja, ATC-koodi: A10BK02.
Vaikutusmekanismi
Proksimaalisissa munuaistubuluksissa ilmentyvä SGLT2-kuljettajaproteiini vastaa pääasiallisesti suodattuneen glukoosin takaisinimeytymisestä tubulusontelosta. Glukoosin takaisinimeytymisen munuaisissa on osoitettu olevan lisääntynyt diabetespotilailla, mikä saattaa edistää pitkäkestoisesti kohonneiden veren glukoosipitoisuuksien esiintymistä. Kanagliflotsiini on suun kautta otettuna aktiivinen SGLT2:n estäjä. Kanagliflotsiini vähentää SGLT2:ta estämällä suodattuneen glukoosin imeytymistä takaisin ja alentaa munuaisen kynnysarvoa glukoosille (RTG) ja lisää siten glukoosin erittymistä virtsaan, mikä pienentää tämän insuliinista riippuvaisen mekanismin avulla tyypin 2 diabetesta sairastavien potilaiden suurentunutta glukoosipitoisuutta plasmassa. SGLT2:n estymisen seurauksena lisääntynyt glukoosin erittyminen virtsaan johtaa osmoottiseen diureesiin, jolloin diureettinen vaikutus johtaa systolisen verenpaineen alenemiseen. Glukoosin lisääntynyt erittyminen virtsaan johtaa kalorien kulutukseen ja siten painon laskuun, mikä on osoitettu tutkimuksissa tyypin 2 diabetesta sairastavilla potilailla.
Kanagliflotsiinin glukoosin erittymistä virtsaan lisäävä ja siten plasman glukoosipitoisuutta suoraan pienentävä vaikutus on riippumaton insuliinista. Kanagliflotsiinilla tehdyissä kliinisissä tutkimuksissa havaittiin homeostaasimallilla toteutetussa arviossa beetasolujen toiminnan (HOMA‑beetasolujen) parantuneen ja insuliinin erityksen beetasoluista lisääntyneen vasteena ateriarasitukseen.
Vaiheen 3 tutkimuksissa 300 mg:n kanagliflotsiiniannoksen antaminen ennen ateriaa pienensi aterianjälkeistä glukoosipitoisuutta enemmän kuin 100 mg:n annosta käytettäessä. Tämä vaikutus 300 mg:n kanagliflotsiiniannosten yhteydessä saattaa johtua osittain SGLT1:n (tärkeä glukoosin kuljettaja suolistossa) paikallisesta estymisestä suolistossa, mikä liittyy tilapäisiin suuriin kanagliflotsiinipitoisuuksiin suolen luumenissa ennen lääkevalmisteen imeytymistä (kanagliflotsiini on SGLT1-kuljettajaproteiinin heikko estäjä). Tutkimuksissa ei ole osoitettu, että kanagliflotsiiniin liittyisi glukoosin imeytymishäiriötä.
Kanagliflotsiini voimistaa natriumin vapautumista distaaliseen tiehyeen estämällä SGLT2-riippuvaisen glukoosin ja natriumin takaisinimeytymistä ja lisäämällä siten tubuloglomerulaarista palautetta, johon on diabeteksen prekliinisissä malleissa ja kliinisissä tutkimuksissa liitetty munuaiskerästen sisäisen paineen pieneneminen ja hyperfiltraation väheneminen.
Farmakodynaamiset vaikutukset
Kerta-annoksina ja toistuvina annoksina tyypin 2 diabetesta sairastaville aikuispotilaille suun kautta annetun kanagliflotsiinin jälkeen havaittiin annosriippuvainen RTG:n aleneminen ja lisääntynyt glukoosin erittyminen virtsaan. Kun lähtötilanteen RTG-arvo vaiheen 1 tutkimuksissa tyypin 2 diabetespotilailla oli noin 13 mmol/l, 24 tunnin aikana mitattu keskimääräinen RTG-arvo pieneni 300 mg:n vuorokausiannosten yhteydessä enimmillään noin pitoisuuteen 4 mmol/l – 5 mmol/l, mikä viittaa siihen, että hoidosta aiheutuvan hypoglykemian riski on pieni. RTG-arvon pieneneminen johti lisääntyneeseen glukoosin erittymiseen virtsaan, kun tyypin 2 diabetesta sairastavat potilaat saivat joko 100 mg tai 300 mg kanagliflotsiinia siten, että annos oli vaiheen 1 tutkimuksissa 77 g/vrk – 119 g/vrk. Havaittu glukoosin erittyminen virtsaan vastasi kalorikulutusta 308 kcal/vrk − 476 kcal/vrk. RTG-arvon pieneneminen ja lisääntynyt glukoosin erittyminen virtsaan säilyvät tyypin 2 diabetesta sairastavien potilaiden 26 viikkoa kestäneen hoitojakson ajan. Virtsan vuorokausitilavuuden havaittiin suurentuneen (yleensä < 400 ml – 500 ml) kohtalaisesti, mikä väheni muutamien seuraavien hoitopäivien aikana. Kanagliflotsiini lisäsi virtsahapon erittymistä virtsaan ohimenevästi (lisäys 19 % päivänä 1 verrattuna lähtötilanteeseen, mikä väheni 6 %:iin päivänä 2 ja 1 %:iin päivänä 13). Tähän liittyi pitkäkestoinen seerumin virtsahappopitoisuuden pieneneminen (noin 20 %).
Tyypin 2 aikuisille diabetespotilailla tehdyssä kerta‑annostutkimuksessa 300 mg:n annos ennen ateriarasitusta hidasti glukoosin imeytymistä suolistossa ja pienensi aterianjälkeistä glukoosipitoisuutta sekä munuaisiin liittyvän että niihin liittymättömän mekanismin kautta.
Kliininen teho ja turvallisuus
Tyypin 2 diabeteksen hoidossa olennaista ovat glukoositasapainon paraneminen sekä kardiovaskulaari- ja munuaistauteihin sairastuvuuden ja niistä aiheutuvan kuolleisuuden väheneminen.
Glykeeminen teho ja turvallisuus aikuispotilailla
Yhteensä 10 501:llä tyypin 2 diabetesta sairastavalla aikuispotilaalla, jotka osallistuivat kymmeneen kaksoissokkoutettuun, kontrolloituun valmisteen tehoa ja turvallisuutta selvittäneeseen kliiniseen tutkimukseen, tutkittiin Invokanan vaikutusta veren glukoositasapainoon. Rotujakauma oli 72 % valkoihoisia, 16 % aasialaisia, 5 % mustaihoisia ja 8 % muita ryhmiä. 17 % potilaista oli hispaanoja. 58 % potilaista oli miehiä. Potilaiden keski-ikä oli 59,5 vuotta (vaihteluväli 21 vuotta – 96 vuotta), ja 3 135 potilasta oli iältään ≥ 65 vuotta ja 513 oli iältään ≥ 75 vuotta. Painoindeksi (BMI) oli 58 %:lla potilaista ≥ 30 kg/m2. Valmisteen kliinisen kehitysohjelman aikana tutkittiin 1 085 potilasta, joiden eGFR oli lähtötilanteessa 30 ml/min/1,73 m2 – < 60 ml/min/1,73 m2.
Lumelääkekontrolloidut tutkimukset
Kanagliflotsiinia tutkittiin monoterapiana, kahdesta lääkkeestä koostuvana hoitona metformiinin kanssa, kahdesta lääkkeestä koostuvana hoitona sulfonyyliurean kanssa, kolmesta lääkkeestä koostuvana hoitona metformiinin ja sulfonyyliurean kanssa, kolmesta lääkkeestä koostuvana hoitona metformiinin ja pioglitatsonin kanssa sekä lisälääkkeenä insuliinin kanssa (taulukko 4). Kanagliflotsiini tuotti yleensä kliinisesti ja tilastollisesti merkittävän (p < 0,001) hoitotuloksen veren glukoositasapainon suhteen lumelääkkeeseen verrattuna, mukaan lukien HbA1c-arvo, HbA1c-arvon < 7 % saavuttaneiden potilaiden prosenttiosuus, plasman glukoosipitoisuuden paastoarvon muutos lähtötilanteesta sekä glukoosipitoisuus 2 tuntia aterian jälkeen. Painon ja systolisen verenpaineen havaittiin lisäksi alentuneen lumelääkkeeseen verrattuna.
Kanagliflotsiinia tutkittiin lisäksi kolmesta lääkkeestä koostuvana hoitona metformiinin ja sitagliptiinin kanssa. Annostus titrattiin siten, että aloitusannos 100 mg titrattiin 300 mg:aan jo viikolla 6, jos potilaan glukoosipitoisuus piti saada parempaan tasapainoon, jos potilaan eGFR oli sopivalla tasolla ja potilas sieti 100 mg:n kanagliflotsiiniannoksen (taulukko 4). Kanagliflotsiinihoito, jonka annos titrattiin, tuotti glukoositasapainon suhteen kliinisesti ja tilastollisesti merkittävän (p < 0,001) hoitotuloksen lumelääkkeeseen verrattuna, mukaan lukien HbA1c-arvo ja plasman glukoosipitoisuuden paastoarvon muutos lähtötilanteesta, sekä tilastollisesti merkitsevän (p < 0,01) paranemisen HbA1c-arvon < 7 % saavuttaneiden potilaiden prosenttiosuudessa. Painon ja systolisen verenpaineen havaittiin lisäksi alentuneen lumelääkkeeseen verrattuna.
| Taulukko 4. Lumekontrolloitujen kliinisten tutkimusten tehon tulokseta | ||||||
| Monoterapia (26 viikkoa) | ||||||
| Kanagliflotsiini | Lumelääke (n = 192) | |||||
100 mg (N = 195) | 300 mg (N = 197) | |||||
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 8,06 | 8,01 | 7,97 | |||
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑0,77 | ‑1,03 | 0,14 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑0,91b (‑1,09; ‑0,73) | ‑1,16b (‑1,34; ‑0,98) | N/Ac | |||
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 44,5b | 62,4b | 20,6 | |||
| Paino | ||||||
| Lähtötilanne (keskiarvo), kg | 85,9 | 86,9 | 87,5 | |||
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑2,8 | ‑3,9 | ‑0,6 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑2,2b (‑2,9; ‑1,6) | ‑3,3b (‑4,0; ‑2,6) | N/Ac | |||
| Kahdesta lääkkeestä koostuva hoito metformiinin kanssa (26 viikkoa) | ||||||
| Kanagliflotsiini + metformiini |
Lumelääke + metformiini (N = 183) | |||||
100 mg (N = 368) | 300 mg (N = 367) | |||||
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 7,94 | 7,95 | 7,96 | |||
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑0,79 | ‑0,94 | ‑0,17 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑0,62b (‑0,76; ‑0,48) | ‑0,77b (‑0,91; ‑0,64) | N/Ac | |||
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 45,5b | 57,8b | 29,8 | |||
| Paino | ||||||
| Lähtötilanne (keskiarvo), kg | 88,7 | 85,4 | 86,7 | |||
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑3,7 | ‑4,2 | ‑1,2 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑2,5b (‑3,1; ‑1,9) | ‑2,9b (‑3,5; ‑2,3) | N/Ac | |||
| Kolmesta lääkkeestä koostuva hoito metformiinin ja sulfonyyliurean kanssa (26 viikkoa) | ||||||
Kanagliflotsiini + metformiini ja sulfonyyliurea |
Lumelääke + metformiini ja sulfonyyliurea (N = 156) | |||||
100 mg (N = 157) | 300 mg (N = 156) | |||||
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 8,13 | 8,13 | 8,12 | |||
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑0,85 | ‑1,06 | ‑0,13 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑0,71b (‑0,90;‑0,52) | ‑0,92b (‑1,11;‑0,73) | N/Ac | |||
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 43,2b | 56,6b | 18,0 | |||
| Paino | ||||||
| Lähtötilanne (keskiarvo), kg | 93,5 | 93,5 | 90,8 | |||
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑2,1 | ‑2,6 | ‑0,7 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑1,4b (‑2,1;‑0,7) | ‑2,0b (‑2,7;‑1,3) | N/Ac | |||
| Lisälääkkeenä insuliinin kanssad (18 viikkoa) | ||||||
| Kanagliflotsiini + insuliini |
Lumelääke + insuliini (N = 565) | |||||
100 mg (N = 566) | 300 mg (N = 587) | |||||
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 8,33 | 8,27 | 8,20 | |||
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑0,63 | ‑0,72 | 0,01 | |||
Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑0,65b (‑0,73; ‑0,56) | ‑0,73b (‑0,82; -0,65) | N/Ac | |||
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 19,8b | 24,7b | 7,7 | |||
| Paino | ||||||
| Lähtötilanne (keskiarvo), kg | 96,9 | 96,7 | 97,7 | |||
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑1,8 | ‑2,3 | 0,1 | |||
| Ero lumelääkkeeseen (korjattu keskiarvo) (97,5 % CI) | ‑1,9b (‑2,2; ‑1,5) | ‑2,4b (‑2,8; ‑2,0) | N/Ac | |||
| Kolmesta lääkkeestä koostuva hoito metformiinin ja sitagliptiinin kanssae (26 viikkoa) | ||||||
Kanagliflotsiini + metformiini ja sitagliptiinig (N = 107) | Lumelääke + metformiini ja sitagliptiini (N = 106) | |||||
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 8,53 | 8,38 | ||||
| Muutos lähtötilanteesta (korjattu keskiarvo) | -0,91 | -0,01 | ||||
Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑0,89b (‑1,19; ‑0,59) | |||||
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 32f | 12 | ||||
| Glukoosipitoisuuden paastoarvo (mg/dl) | ||||||
| Lähtötilanne (keskiarvo) | 186 | 180 | ||||
| Muutos lähtötilanteesta (korjattu keskiarvo) | -30 | -3 | ||||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑27b (‑40; ‑14) | |||||
| Paino | ||||||
| Lähtötilanne (keskiarvo), kg | 93,8 | 89,9 | ||||
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | -3,4 | -1,6 | ||||
| Ero lumelääkkeeseen (korjattu keskiarvo) (95 % CI) | ‑1,8b (‑2,7; ‑0,9) | |||||
a Intent‑to‑treat-potilasjoukko tutkimuksessa tehdyn viimeisimmän havainnon mukaan ennen glykeemistä varalääkitystä. b p < 0,001 verrattuna lumelääkkeeseen. c Ei sovellu. d Kanagliflotsiini lisälääkkeenä insuliinin kanssa (muiden veren glukoosipitoisuutta pienentävien lääkkeiden kanssa tai ilman niitä). e Kanagliflotsiiniannos 100 mg titrattu ylöspäin 300 mg:aan f p < 0,01 lumelääkkeeseen verrattuna g Annos titrattiin 300 mg:aan 90,7 %:lla kanagliflotsiiniryhmän tutkittavista | ||||||
Glykeemistä tehoa seurattiin edellä esitettyjen tutkimusten lisäksi 18 viikkoa kestäneessä osatutkimuksessa kahdesta lääkkeestä koostuvassa hoidossa sulfonyyliurean kanssa sekä 26 viikkoa kestäneessä hoitotutkimuksessa kolmesta lääkkeestä koostuvassa hoidossa metformiinin ja pioglitatsonin kanssa, ja tulokset olivat yleensä verrannollisia muista tutkimuksista saatujen tulosten kanssa.
Aktiivisella aineella kontrolloidut tutkimukset
Kanagliflotsiinia verrattiin glimepiridiin kahdesta lääkkeestä koostuvassa hoidossa metformiinin kanssa sekä sitagliptiiniin kolmesta lääkkeestä koostuvassa hoidossa metformiinin ja sulfonyyliurean kanssa (taulukko 5). 100 mg:n kanagliflotsiiniannos alensi kahdesta lääkkeestä koostuvassa hoidossa metformiinin kanssa HbA1c-arvoa lähtötilanteesta vastaavasti ja 300 mg:n annoksia käytettäessä enemmän (p < 0,05) verrattuna glimepiridiin, mikä osoittaa hoitojen vertailukelpoisuuden (non‑inferiority). 52 viikkoa kestäneen hoidon aikana pienemmällä osalla 100 mg:n kanagliflotsiiniannoksia (5,6 %) ja 300 mg:n kanagliflotsiiniannoksia (4,9 %) saaneista aikuispotilaista esiintyi vähintään yksi hypoglykemiaepisodi/‑tapahtuma verrattuna glimepiridihoitoa saaneeseen ryhmään (34,2 %). Tutkimuksessa, jossa 300 mg:n kanagliflotsiiniannoksia verrattiin 100 mg:n sitagliptiiniannoksiin kolmesta lääkkeestä koostuvassa hoidossa metformiinin ja sulfonyyliurean kanssa, kanagliflotsiinihoidon osoitettiin alentaneen HbA1c-arvoa vertailukelpoisesti (non‑inferior) (p < 0,05) ja paremmin (p < 0,05) verrattuna sitagliptiiniin. Hypoglykemiaepisodien/‑tapahtumien ilmaantuvuus oli 300 mg:n kanagliflotsiiniannoksia saaneilla 40,7 % ja 100 mg:n sitagliptiinihoitoa saaneilla 43,2 %. Myös huomattavaa tilan kohenemista painon ja systolisen verenpaineen alenemisen suhteen havaittiin sekä glimepiridiin että sitagliptiiniin verrattuna.
| Taulukko 5. Aktiivisella aineella kontrolloitujen kliinisten tutkimusten tehon tulokseta | |||
| verrattuna glimepiridiin kahdesta lääkkeestä koostuvassa hoidossa metformiinin kanssa (52 viikkoa) | |||
| Kanagliflotsiini + metformiini | Glimepiridi (titrattu) + metformiini (N = 482) | ||
100 mg (N = 483) | 300 mg (N = 485) | ||
| HbA1c (%) | |||
| Lähtötilanne (keskiarvo) | 7,78 | 7,79 | 7,83 |
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑0,82 | ‑0,93 | ‑0,81 |
| Ero glimepiridiin (korjattu keskiarvo) (95 % CI) | ‑0,01b (‑0,11; 0,09) | ‑0,12b (‑0,22; ‑0,02) | N/Ac |
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 53,6 | 60,1 | 55,8 |
| Paino | |||
| Lähtötilanne (keskiarvo), kg | 86,8 | 86,6 | 86,6 |
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑4,2 | ‑4,7 | 1,0 |
| Ero glimepiridiin (korjattu keskiarvo) (95 % CI) | ‑5,2b (‑5,7; -4,7) | ‑5,7b (‑6,2; ‑5,1) | N/Ac |
| verrattuna sitagliptiiniin kolmesta lääkkeestä koostuvassa hoidossa metformiinin ja sulfonyyliurean kanssa (52 viikkoa) | |||
Kanagliflotsiini 300 mg + metformiini ja sulfonyyliurea (N = 377) | Sitagliptiini 100 mg + metformiini ja sulfonyyliurea (N = 378) | ||
| HbA1c (%) | |||
| Lähtötilanne (keskiarvo) | 8,12 | 8,13 | |
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑1,03 | ‑0,66 | |
| Ero sitagliptiiniin (korjattu keskiarvo) (95 % CI) | ‑0,37b (‑0,50; ‑0,25) | N/Ac | |
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 47,6 | 35,3 | |
| Paino | |||
| Lähtötilanne (keskiarvo), kg | 87,6 | 89,6 | |
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑2,5 | 0,3 | |
| Ero sitagliptiiniin (korjattu keskiarvo) (95 % CI) | ‑2,8d (‑3,3; ‑2,2) | N/Ac | |
a Intent‑to‑treat-potilasjoukko tutkimuksessa tehdyn viimeisimmän havainnon mukaan ennen glykeemistä varalääkitystä. b p < 0,05. c Ei sovellu. d p < 0,001. | |||
Kanagliflotsiini alkuvaiheen yhdistelmähoitona metformiinin kanssa
Kanagliflotsiinia tutkittiin yhdistelmänä metformiinin kanssa tyypin 2 aikuisten diabetespotilaiden alkuvaiheen yhdistelmähoitona, kun ruokavaliosta ja liikunnasta ei ollut apua. Yhdistelmähoito 100 mg:n ja 300 mg:n kanagliflotsiiniannoksilla ja metformiinia säädellysti vapauttavalla lääkevalmisteella tuotti HbA1c-arvon tilastollisesti merkitsevästi suuremman paranemisen verrattuna vastaavien kanagliflotsiiniannosten (100 mg ja 300 mg) tai metformiinia säädellysti vapauttavan lääkevalmisteen käyttöön yksinään (taulukko 6).
| Taulukko 6. Aktiivisella aineella kontrolloitujen 26 viikkoa kestäneiden kliinisten tutkimusten tehoa koskevat tulokset, kun kanagliflotsiinia annettiin alkuvaiheessa yhdistelmänä metformiinin kanssa* | |||||
| Tehon parametri | Metformiinia säädellysti vapauttava lääkevalmiste (N = 237) | Kanagli-flotsiini 100 mg (N = 237) | Kanagli-flotsiini 300 mg (N = 238) | Kanagliflotsiini 100 mg + metformiinia säädellysti vapauttava lääkevalmiste (N = 237) | Kanagliflotsiini 300 mg + metformiinia säädellysti vapauttava lääkevalmiste (N = 237) |
| HbA1c (%) | |||||
| Lähtötilanne (keskiarvo) | 8,81 | 8,78 | 8,77 | 8,83 | 8,90 |
| Muutos lähtötilanteesta (korjattu keskiarvo) | ‑1,30 | ‑1,37 | ‑1,42 | ‑1,77 | ‑1,78 |
| Ero 100 mg:n kanagliflotsiiniannokseen (korjattu keskiarvo) (95 % CI) † | ‑0,40‡ (‑0,59; ‑0,21) | ||||
| Ero 300 mg:n kanagliflotsiiniannokseen (korjattu keskiarvo) (95 % CI) † | ‑0,36‡ (‑0,56; ‑0,17) | ||||
| Ero metformiinia säädellysti vapauttavaan lääkevalmisteeseen (korjattu keskiarvo) (95 % CI) † | ‑0,06‡ (‑0,26; 0,13) | ‑0,11‡ (‑0,31; 0,08) | ‑0,46‡ (‑0,66; ‑0,27) | ‑0,48‡ (‑0,67; ‑0,28) | |
| HbA1c-arvon < 7 % saavuttaneet potilaat (%) | 43 | 39 | 43 | 50§§ | 57§§ |
| Paino | |||||
| Lähtötilanne (keskiarvo), kg | 92,1 | 90,3 | 93,0 | 88,3 | 91,5 |
| Prosenttimuutos lähtötilanteesta (korjattu keskiarvo) | ‑2,1 | ‑3,0 | ‑3,9 | ‑3,5 | ‑4,2 |
| Ero metformiinia säädellysti vapauttavaan lääkevalmisteeseen (korjattu keskiarvo) (95 % CI) † | ‑0,9§§ (‑1,6; ‑0,2) | ‑1,8§ (‑2,6; ‑1,1) | ‑1,4‡ (‑2,1; ‑0,6) | ‑2,1‡ (‑2,9; ‑1,4) | |
* Intent‑to‑treat-potilasjoukko † Kovariaattien suhteen korjatut pienimpien neliöiden keskiarvot, mukaan lukien lähtötilanteen arvo ja ositustekijä ‡ Korjattu p = 0,001 § Korjattu p < 0,01 §§ Korjattu p < 0,05 | |||||
Erityispotilasryhmät
Kolmessa erityispotilasryhmillä tehdyssä tutkimuksessa (iäkkäät potilaat, potilaan eGFR 30 ml/min/1,73 m2 − < 50 ml/min/1,73 m2 ja potilaalla kardiovaskulaaritauti tai suuri kardiovaskulaaritaudin riski) kanagliflotsiini lisättiin potilaan diabeteksen parhaillaan vakaana pitävään hoitoon (ruokavalio, monoterapia tai yhdistelmähoito).
Iäkkäät
Kaksoissokkoutettuun, lumekontrolloituun 26 viikkoa kestäneeseen tutkimukseen osallistui yhteensä 714 potilasta, joiden ikä oli ≥ 55 vuotta – ≤ 80 vuotta (227 potilaan ikä oli 65 vuotta - < 75 vuotta ja 46 potilaan ikä oli 75 vuotta – ≤ 80 vuotta), joiden veren glukoosipitoisuus ei ollut riittävässä hoitotasapainossa senhetkisellä diabeteshoidolla (veren glukoosipitoisuutta pienentävillä lääkevalmisteilla ja/tai ruokavaliolla ja liikunnalla). HbA1c-arvossa havaittiin tilastollisesti merkitsevä (p < 0,001) muutos lähtötilanteesta lumelääkkeeseen verrattuna, ja se oli 100 mg:n annosten yhteydessä ‑0,57 % ja 300 mg:n annosten yhteydessä ‑0,70 % (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Aikuispotilaat, joiden eGFR on < 60 ml/min/1,73 m2
Yhdistetyssä analyysissä aikuispotilaista (N = 721), joiden lähtötilanteen eGFR oli 45 ml/min/1,73 m2 – < 60 ml/min/1,73 m2, kanagliflotsiini pienensi HbA1c-arvoa kliinisesti merkityksellisesti verrattuna lumelääkkeeseen, kun arvo pieneni 100 mg:n kanagliflotsiiniannosten yhteydessä ‑0,47 % ja 300 mg:n kanagliflotsiiniannosten yhteydessä ‑0,52 %. Kun potilaan eGFR oli lähtötilanteessa 45 ml/min/1,73 m2 − < 60 ml/min/1,73 m2, 100 mg:n kanagliflotsiiniannoksia saaneiden potilaiden keskimääräinen prosentuaalinen painonmuutos lumelääkkeeseen verrattuna oli ‑1,8 % ja 300 mg:n kanagliflotsiiniannoksia saaneilla ‑2,0 %.
Yhdistetyssä analyysissä aikuispotilaista (N = 348), joiden lähtötilanteen eGFR oli < 45 ml/min/1,73 m2, kanagliflotsiini pienensi HbA1c-arvoa hieman verrattuna lumelääkkeeseen, kun arvo pieneni 100 mg:n kanagliflotsiiniannosten yhteydessä 0,23 % ja 300 mg:n kanagliflotsiiniannosten yhteydessä 0,39 %.
Suurin osa potilaista, joiden eGFR oli lähtötilanteessa < 60 ml/min/1,73 m2, sai hoitoa insuliinilla ja/tai sulfonyyliurealla. Yhdenmukaisesti hypoglykemian oletetun pahenemisen kanssa silloin, kun insuliini- ja/tai sulfonyyliureahoitoon lisätään lääkevalmiste, johon ei liity hypoglykemiaa, hypoglykemiaepisodien/tapahtumien havaittiin pahenevan myös silloin, kun kanagliflotsiini lisättiin insuliini- ja/tai sulfonyyliureahoitoon (ks. kohta Haittavaikutukset).
Plasman glukoosipitoisuus paastotilassa
Neljässä aikuisille tehdyssä lumekontrolloidussa tutkimuksessa kanagliflotsiinihoito monoterapiana tai lisälääkkeenä yhden tai kahden suun kautta otettavan veren glukoosipitoisuutta pienentävän lääkkeen kanssa johti plasman glukoosipitoisuuden paastoarvon muutokseen lähtötilanteeseen verrattuna keskimäärin ‑1,2 mmol/l – ‑1,9 mmol/l kanagliflotsiinin 100 mg:n annosten yhteydessä ja ‑1,9 mmol/l – ‑2,4 mmol/l kanagliflotsiinin 300 mg:n annosten yhteydessä. Tämä pitoisuusmuutos säilyi koko hoitojakson ajan ja oli lähes suurimmillaan ensimmäisen hoitopäivän jälkeen.
Aterianjälkeinen glukoosipitoisuus
Kanagliflotsiini monoterapiana tai lisälääkkeenä yhden tai kahden suun kautta otettavan veren glukoosipitoisuutta pienentävän lääkkeen kanssa pienensi ateriarasituksessa aterianjälkeistä glukoosipitoisuutta lähtötilanteesta 100 mg:n kanagliflotsiiniannosten yhteydessä ‑1,5 mmol/l – ‑2,7 mmol/l ja 300 mg:n kanagliflotsiiniannosten yhteydessä ‑2,1 mmol/l – ‑3,5 mmol/l lumelääkkeeseen verrattuna, koska ennen ateriaa todetut glukoosipitoisuudet pienenivät ja aterianjälkeiset glukoosipitoisuuden muutokset vähenivät.
Paino
Kanagliflotsiini 100 mg ja 300 mg monoterapiana ja lisälääkkeenä kahdesta tai kolmesta lääkkeestä koostuvassa hoidossa käytettynä alensi 26 viikon hoidon jälkeen painoa prosenttimääräisesti tilastollisesti merkitsevästi lumelääkkeeseen verrattuna. Kahdessa 52 viikkoa kestäneessä aikuisille tehdyssä aktiivisella vertailuaineella kontrolloidussa tutkimuksessa, joissa kanagliflotsiinia verrattiin glimepiridiin ja sitagliptiiniin, kanagliflotsiini alensi keskimääräistä painoa pitkäkestoisesti prosenttimääräisesti tilastollisesti merkitsevästi, kun sitä käytettiin lisälääkkeenä metformiinin kanssa, jolloin paino aleni ‑4,2 % kanagliflotsiinin 100 mg:n annosten yhteydessä ja ‑4,7 % kanagliflotsiinin 300 mg:n annosten yhteydessä verrattuna glimepiridiin ja metformiiniin (1,0 %) sekä ‑2,5 % käytettäessä 300 mg:n kanagliflotsiiniannoksia yhdistelmänä metformiinin ja sulfonyyliurean kanssa verrattuna sitagliptiiniin yhdistelmänä metformiinin ja sulfonyyliurean kanssa (0,3 %).
Aktiivisella aineella kontrolloituun kahdesta lääkkeestä yhdistelmänä metformiinin kanssa koostuvan hoidon tutkimukseen osallistuneessa aikuispotilaiden osajoukossa (N = 208) todettiin, kun potilaille tehtiin kaksienergiainen röntgenabsorptiometria (DXA) ja vatsan tietokonetomografia (TT‑kuvaus) kehon koostumuksen selvittämiseksi, että kanagliflotsiinihoidon yhteydessä tapahtuneesta painon alenemisesta kaksi kolmannesta johtui rasvamassan vähenemisestä, jolloin viskeraalista ja vatsan ihonalaista rasvaa oli vähentynyt yhtä paljon. Iäkkäillä potilailla tehdyssä kliinisessä tutkimuksessa kaksisataayksitoista (211) potilasta osallistui kehon koostumusta selvittävään osatutkimukseen, jossa kehon koostumus analysoitiin DXA:lla. Tässä osoitettiin, että noin kaksi kolmasosaa kanagliflotsiiniin liittyvästä painon laskusta johtui rasvamassan vähenemisestä lumelääkkeeseen verrattuna. Trabekkeli- ja kortikaalialueilla ei todettu merkityksellistä luuntiheyden muutosta.
Verenpaine
Aikuisille tehdyissä lumekontrolloiduissa tutkimuksissa 100 mg:n ja 300 mg:n kanagliflotsiiniannokset alensivat systolista verenpainetta keskimäärin ‑3,9 mmHg (100 mg) ja ‑5,3 mmHg (300 mg) verrattuna lumelääkkeeseen (‑0,1 mmHg), mutta vaikutus diastoliseen verenpaineeseen oli heikompi, jolloin keskimuutos oli 100 mg:n kanagliflotsiiniannoksilla ‑2,1 mmHg ja 300 mg:n kanagliflotsiiniannoksilla ‑2,5 mmHg verrattuna lumelääkkeeseen (‑0,3 mmHg). Sydämen syketaajuudessa ei esiintynyt mainittavia muutoksia.
Potilaat, joiden lähtötilanteen HbA1c oli > 10 % – ≤ 12 %
Aikuispotilaiden osajoukossa, joiden lähtötilanteen HbA1c oli > 10 % – ≤ 12 %, kanagliflotsiini pienensi monoterapiana (ei lumekorjattua) HbA1c-arvoa lähtötilanteesta ‑2,13 % kanagliflotsiinin 100 mg:n annoksia käytettäessä ja ‑2,56 % kanagliflotsiinin 300 mg:n annoksia käytettäessä.
Kardiovaskulaariset hoitotulokset CANVAS-ohjelmassa
CANVAS-ohjelmassa (CANVAS- ja CANVAS-R-tutkimusten integroitu analyysi) selvitettiin kanagliflotsiinin vaikutusta kardiovaskulaaritapahtumiin aikuisilla tyypin 2 diabetesta sairastavilla potilailla, joilla oli todettu kardiovaskulaaritauti tai joilla oli kardiovaskulaaritaudin riski (kaksi tai useampia kardiovaskulaaritaudin riskitekijöitä). Tutkimukset olivat monikansallisia, satunnaistettuja, kaksoissokkoutettuja, rinnakkaisryhmillä tehtyjä monikeskustutkimuksia, joissa sisäänotto- ja poissulkukriteerit sekä potilasjoukot olivat samankaltaiset. CANVAS-ohjelmassa vakavan kardiovaskulaarisen haittatapahtuman riskiä verrattiin kanagliflotsiinin ja lumelääkkeen välillä, kun taustalla käytettiin diabeteksen ja ateroskleroottisen kardiovaskulaaritaudin tavanomaisia hoitoja. Vakavaksi kardiovaskulaariseksi haittavaikutukseksi määriteltiin kardiovaskulaarikuolema, kuolemaan johtamaton sydäninfarkti ja kuolemaan johtamaton aivohalvaus.
CANVAS-tutkimuksessa tutkittavat satunnaistettiin suhteessa 1:1:1 saamaan 100 mg kanagliflotsiinia, 300 mg kanagliflotsiinia tai kaltaistettua lumelääkettä. CANVAS-R-tutkimuksessa tutkittavat satunnaistettiin suhteessa 1:1 saamaan 100 mg kanagliflotsiinia tai kaltaistettua lumelääkettä. Viikon 13 jälkeen annoksen titraaminen 300 mg:aan oli sallittua (siedettävyyden ja glykeemisen tarpeen perusteella). Samanaikaisesti käytettyjä diabetes- ja ateroskleroosilääkkeitä oli sallittua muuttaa näiden sairauksien tavanomaisten hoitokäytäntöjen mukaisesti.
Hoitoa sai yhteensä 10 134 aikuispotilasta (CANVAS-tutkimuksessa 4 327 potilasta ja CANVAS-R-tutkimuksessa 5 807 potilasta; lumehoitoon satunnaistettiin yhteensä 4 344 potilasta ja kanagliflotsiinihoitoon yhteensä 5 790 potilasta), ja altistuksen kesto oli keskimäärin 149 viikkoa (CANVAS-tutkimuksessa 223 viikkoa ja CANVAS-R-tutkimuksessa 94 viikkoa). Vitaalistatus oli tiedossa 99,6 %:sta tutkimusten tutkittavista. Keskimääräinen ikä oli 63 vuotta, ja 64 % oli miehiä. Kuudellakymmenelläkuudella prosentilla tutkittavista oli aiemmin ollut varmistettu kardiovaskulaaritauti, ja 56 %:lla oli aiemmin ollut sepelvaltimotauti, 19 %:lla aivoverisuonitauti ja 21 %:lla ääreisverisuonitauti; 14 %:lla potilaista oli aiemmin ollut sydämen vajaatoimintaa.
Keskimääräinen lähtötilanteen HbA1c-arvo oli 8,2 %, ja diabeteksen keskimääräinen kestoaika oli 13,5 vuotta.
Potilaiden eGFR-arvon täytyi olla > 30 ml/min/1,73 m2 heidän aloittaessaan tutkimuksen. Munuaisten toiminta oli lähtötilanteessa normaali tai lievästi heikentynyt 80 %:lla potilaista ja keskivaikeasti heikentynyt 20 %:lla potilaista (keskimääräinen eGFR 77 ml/min/1,73 m2). Potilaat käyttivät lähtötilanteessa yhtä tai useaa diabeteslääkevalmistetta, mukaan lukien metformiinia (77 %), insuliinia (50 %) ja sulfonyyliureaa (43 %).
CANVAS-ohjelman ensisijainen päätetapahtuma oli aika ensimmäisen vakavan kardiovaskulaarisen haittatapahtuman ilmenemiseen. Toissijaisia päätetapahtumia ehdollisessa hypoteesin testaussarjassa olivat mistä tahansa syystä aiheutunut kuolleisuus ja kardiovaskulaarikuolleisuus.
Vakavien kardiovaskulaaristen haittatapahtumien esiintyvyys oli yhdistettyjen kanagliflotsiiniryhmien potilailla (yhdistetty analyysi 100 mg:n kanagliflotsiiniannoksista, 300 mg:n kanagliflotsiiniannoksista ja 100 mg:sta 300 mg:aan titratuista kanagliflotsiiniannoksista) pienempi lumehoitoon verrattuna: 2,69 vs 3,15 potilasta 100 potilasvuotta kohden (yhdistetyn analyysin riskitiheyssuhde: 0,86; 95 % CI [0,75; 0,97]).
Vakavien kardiovaskulaaristen haittatapahtumien ensimmäistä ilmenemistä kuvaavan Kaplan–Meierin kuvaajan perusteella (jäljempänä) vakavien kardiovaskulaaristen haittatapahtumien havaittiin vähentyneen kanagliflotsiiniryhmässä jo viikolla 26, ja vähenemä säilyi tutkimuksen loppuajan (ks. kuva 1).
Kuva 1. Aika vakavien kardiovaskulaaristen haittatapahtumien ensimmäiseen ilmenemiseen
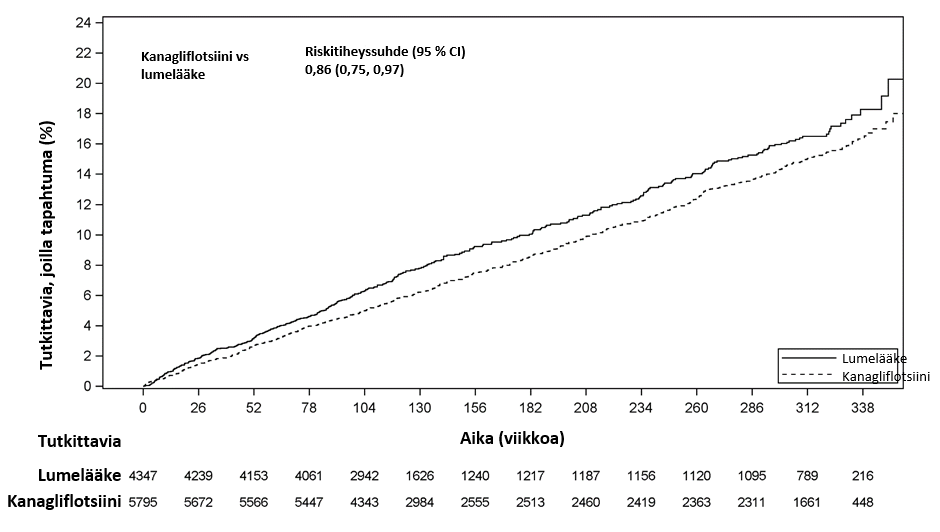
2 011 aikuispotilaan eGFR oli 30 – < 60 ml/min/1,73 m2. Vakavia kardiovaskulaarisia haittatapahtumia koskevat löydökset olivat potilaiden osajoukoissa 30 – < 60 ml/min/1,73 m2, 30 – < 45 ml/min/1,73 m2 ja 45 – < 60 ml/min/1,73 m2 yhdenmukaiset kokonaislöydösten kanssa.
Vakavien kardiovaskulaaristen haittatapahtumien jokainen osa-alue vaikutti osaltaan positiivisesti kokonaistulokseen, kuten kuvassa 2 esitetään. 100 mg:n ja 300 mg:n kanagliflotsiiniannoksia koskevat tulokset olivat yhdenmukaiset yhdistettyjen annosryhmien tulosten kanssa.
Kuva 2. Hoidon teho ensisijaisen yhdistetyn päätetapahtuman ja sen osa-alueiden osalta
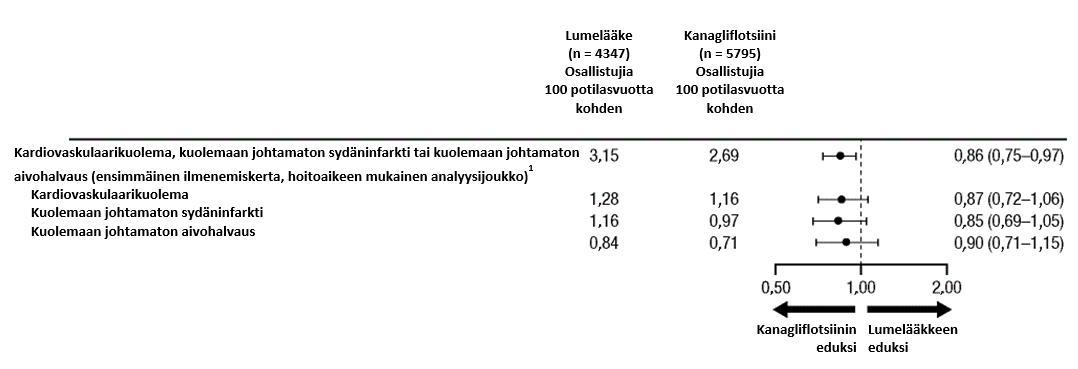
1 paremmuutta osoittava p-arvo (kaksitahoinen) = 0,0158.
Mistä tahansa syystä aiheutunut kuolleisuus CANVAS-ohjelmassa
Mistä tahansa syystä aiheutuneen kuolleisuuden riskitiheyssuhde yhdistetyssä kanagliflotsiiniryhmässä lumehoitoon verrattuna oli 0,87; 95 % CI (0,74; 1,01).
Sairaalahoitoa vaativa sydämen vajaatoiminta CANVAS-ohjelmassa
Kanagliflotsiini vähensi sairaalahoitoa vaativan sydämen vajaatoiminnan riskiä lumelääkkeeseen verrattuna (riskitiheyssuhde: 0,67; 95 % CI (0,52; 0,87)).
Munuaisia koskevat päätetapahtumat CANVAS-ohjelmassa
Aikaa ensimmäiseen merkittävään nefropatiatapahtumaan (seerumin kreatiniinipitoisuuden kaksinkertaistuminen, munuaiskorvaushoidon tarve ja munuaisperäinen kuolema) koskeva riskitiheyssuhde oli 0,53 (95 % CI: 0,33; 0,84) vertailtaessa kanagliflotsiinia (0,15 tapahtumaa 100 potilasvuotta kohden) lumehoitoon (0,28 tapahtumaa 100 potilasvuotta kohden). Potilailla, joilla oli lähtötilanteessa normo- tai mikroalbuminuria, kanagliflotsiini vähensi lisäksi albuminurian etenemistä 25,8 %:lla verrattuna lumehoidon 29,2 %:iin (riskitiheyssuhde: 0,73; 95 % CI: 0,67; 0,79).
Munuaisiin liittyvät hoitotulokset CREDENCE-tutkimuksessa
100 mg:n kanagliflotsiiniannosten vaikutusta munuaistapahtumiin tyypin 2 diabetesta ja diabeteksen munuaistautia sairastavilla aikuisilla, joiden glomerulusten laskennallinen suodatusnopeus (eGFR) oli 30 – < 90 ml/min/1,73 m2 ja joilla oli albuminuria (kreatiniini > 300 – 5000 mg/g), arvioitiin CREDENCE-tutkimuksessa (Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation Trial). Se oli monikansallinen, satunnaistettu, kaksoissokkoutettu, tapahtumalähtöinen, lumekontrolloitu, rinnakkaisryhmillä tehty monikeskustutkimus. CREDENCE-tutkimuksessa diabeteksen munuaistaudin riskiä verrattiin 100 mg:n kanagliflotsiiniannoksen ja lumelääkkeen välillä, kun samalla käytettiin diabeteksen munuaistaudin tavanomaisia hoitoja, kuten angiotensiinikonvertaasin estäjiä (ACE-estäjiä) tai angiotensiinireseptorin salpaajia (ATR:n salpaajia). Diabeteksen munuaistaudiksi määriteltiin loppuvaiheen munuaissairaus, seerumin kreatiniinipitoisuuden kaksinkertaistuminen sekä munuaisperäinen kuolema tai kardiovaskulaarikuolema. Tässä tutkimuksessa ei tutkittu 300 mg:n kanagliflotsiiniannoksia.
CREDENCE-tutkimuksessa tutkittavat satunnaistettiin suhteessa 1:1 saamaan joko 100 mg kanagliflotsiinia tai lumelääkettä ja ositettiin seulonnan eGFR-arvon mukaan (30 – < 45, 45 – < 60 tai 60 – < 90 ml/min/1,73 m2). 100 mg:n kanagliflotsiinihoitoa jatkettiin, kunnes potilaat aloittivat dialyysin tai heille tehtiin munuaisensiirto.
Yhteensä hoitoa sai 4 397 aikuista tutkittavaa, ja altistuksen keskimääräinen kesto oli 115 viikkoa. Keski-ikä oli 63 vuotta, ja 66 % oli miehiä.
Lähtötilanteen HbA1c-arvon keskiarvo oli 8,3 %, ja virtsan albumiinin/kreatiniinin mediaani lähtötilanteessa oli 927 mg/g. Yleisimmin käytetyt hyperglykemiaa ehkäisevät lääkkeet olivat insuliini (65,5 %), biguanidit (57,8 %) ja sulfonyyliureat (28,8 %). Melkein kaikki tutkittavat (99,9 %) saivat ACE-estäjiä tai ATR:n salpaajia satunnaistamisen aikaan. Noin 92 % tutkittavista sai lähtötilanteessa sydän- ja verisuonitauteja ehkäisevää hoitoa (johon ei lasketa ACE-estäjiä tai ATR:n salpaajia): noin 60 % käytti antitromboottista lääkettä (kuten asetyylisalisyylihappoa) ja 69 % käytti statiineja.
Lähtötilanteen eGFR-arvon keskiarvo oli 56,2 ml/min/1,73 m2, ja noin 60 %:lla potilasjoukosta lähtötilanteen eGFR-arvo oli < 60 ml/min/1,73 m2. Niiden tutkittavien osuus, joilla oli aiempi sydän- ja verisuonisairaus, oli 50,4 %; 14,8 %:lla oli aiemmin ollut sydämen vajaatoimintaa.
CREDENCE-tutkimuksen ensisijainen yhdistetty päätetapahtuma oli aika, joka kului loppuvaiheen munuaissairauden (määritelmänä eGFR < 15 ml/min/1,73 m2, kroonisen dialyysin aloitus tai munuaissiirre), seerumin kreatiniinipitoisuuden kaksinkertaistumisen ja munuaisperäisen kuoleman tai kardiovaskulaarikuoleman ensimmäiseen ilmenemiseen.
Kanagliflotsiini 100 mg vähensi merkitsevästi ensisijaisen yhdistetyn päätetapahtuman eli loppuvaiheen munuaissairauden, seerumin kreatiniinipitoisuuden kaksinkertaistumisen ja munuaisperäisen kuoleman tai kardiovaskulaarikuoleman ensimmäisen ilmenemisen riskiä [p < 0,0001; HR: 0,70; 95 % CI: 0,57; 0,84] (ks. kuva 4). Hoitoteho on yhdenmukainen kaikissa alaryhmissä, myös kaikissa kolmessa GFR-arvon mukaisessa ositeryhmässä ja tutkittavilla, joilla joko oli ollut tai ei ollut ollut aiempaa sydän- ja verisuonisairautta.
Aika ensisijaisen yhdistetyn päätetapahtuman ensimmäiseen ilmenemiseen on esitetty alla olevassa Kaplan–Meierin kuvaajassa. Sen perusteella hoitoteho oli ilmeinen viikosta 52 alkaen 100 mg:n kanagliflotsiiniannoksia saaneilla ja säilyi tutkimuksen loppuun asti (ks. kuva 3).
Kanagliflotsiini 100 mg vähensi merkitsevästi toissijaisten kardiovaskulaaristen päätetapahtumien riskiä, kuten kuvassa 4 esitetään.
Kuva 3: CREDENCE-tutkimus: Aika ensisijaisen yhdistetyn päätetapahtuman ensimmäiseen ilmenemiseen
(Tutkimus 28431754-DNE3001: tutkimusaikeen mukainen analyysijoukko)
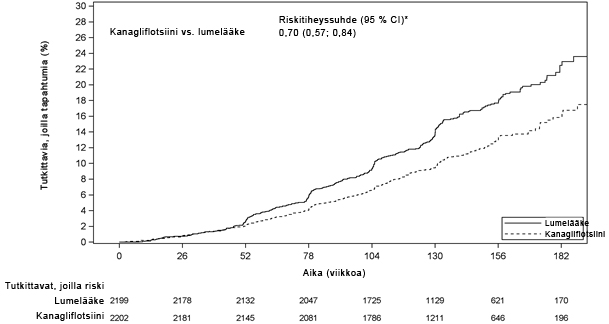
* 95 %:n RCI (toistettu luottamusväli) ensisijaiselle päätetapahtumalle; yhdistetty merkitsevyystaso (FWER) kontrolloi tyypin I virhettä kaksisuuntaisella merkitsevyystasolla 0,05.
Kuva 4: Hoidon teho ensisijaisen yhdistetyn päätetapahtuman ja sen osa-alueiden sekä toissijaisten päätetapahtumien osalta
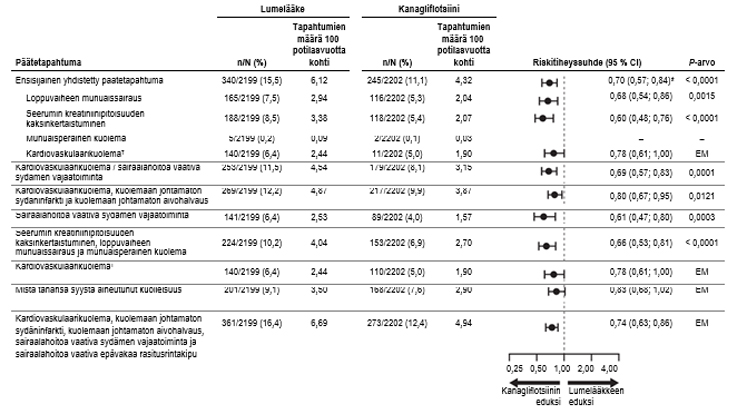
CI, luottamusväli; EM, ei merkitsevä.
* 95 %:n RCI (toistettu luottamusväli) ensisijaiselle päätetapahtumalle; yhdistetty merkitsevyystaso (FWER) kontrolloi tyypin I virhettä kaksisuuntaisella merkitsevyystasolla 0,05.
Ensisijainen tehon päätetapahtuma testattiin kaksisuuntaisen testin alfatasolla 0,022 ja toissijainen tehon päätetapahtuma kaksisuuntaisen testin alfatasolla 0,38.
† Kardiovaskulaarikuolema esitetään sekä ensisijaisen yhdistetyn päätetapahtuman osa-alueena että toisena päätetapahtumana, jolle tehtiin muodollinen hypoteesin testaus.
Kuten kuvassa 5 esitetään, lumehoitoa saaneiden potilaiden eGFR-arvo laski asteittain lineaarisesti ajan myötä; sitä vastoin kanagliflotsiinia saaneella ryhmällä eGFR-arvo laski jyrkästi viikolla 3, minkä jälkeen lasku tasaantui ajan myötä; viikon 52 jälkeen eGFR-arvon laskun pienimmän neliösumman (LS) keskiarvo oli alhaisempi kanagliflotsiinia saaneella ryhmällä kuin lumehoitoa saaneella ryhmällä ja hoitoteho säilyi hoidon loppuun asti.
Kuva 5: eGFR-arvon LS-keskiarvon muutos lähtötilanteesta ajan myötä (hoitoa saaneiden analyysijoukko)
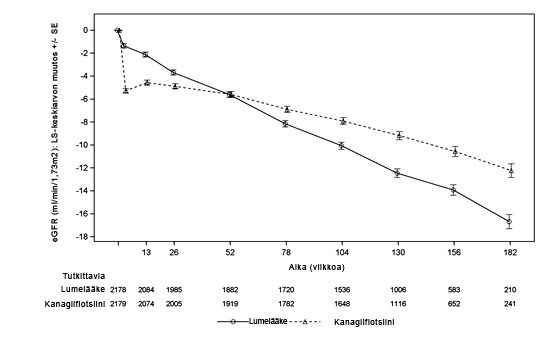
CREDENCE-tutkimuksessa munuaisiin liittyvien haittatapahtumien ilmaantuvuus oli pienempi 100 mg:n kanagliflotsiiniannoksia saaneilla kuin lumehoitoa saaneilla (100 mg:n kanagliflotsiiniannoksia saaneilla 5,71 tapahtumaa 100 potilasvuotta kohti ja lumehoitoa saaneilla 7,91 tapahtumaa 100 potilasvuotta kohti).
Pediatriset potilaat
Glykeeminen teho ja turvallisuus vähintään 10 vuoden ikäisillä lapsilla
DIA3018‑tutkimus oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, rinnakkaisryhmillä tehty monikeskustutkimus, jossa oli kaksi tutkimushaaraa. Tutkimuksen kesto oli 52 viikkoa, ja siihen sisältyi 26 viikon pituinen varsinainen kaksoissokkoutettu hoitojakso ja sitä seuraava 26 viikon pituinen kaksoissokkouttu jatkohoitojakso. Tutkimukseen otettiin vähintään 10 vuoden ikäisiä tyypin 2 diabetesta sairastavia lapsia, joiden veren glukoositasapaino ei ollut riittävästi hallinnassa (HbA1c ≥ 6,5 % to ≤ 11,0 %) ja joiden hoito ennen seulontaa käsitti ainoastaan ruokavalion ja liikunnan tai jotka saivat ruokavalion ja liikunnan lisänä metformiinia vakiintuneina annoksina (insuliinin kanssa tai ilman insuliinia) tai insuliinimonoterapiaa vakiintuneina annoksina. Yhteensä 171 potilasta satunnaistettiin 2 hoitoryhmään (Invokana 100 mg tai lumelääke). Potilaiden keski-ikä oli 14,3 vuotta, ja 47,4 % heistä oli alle 15‑vuotiaita. Invokana-valmistetta saaneista 84 potilaasta 33 potilasta, joiden HbA1c oli ≥ 7,0 % ja eGFR ≥ 60 ml/min/1,73 m2 viikolla 12, satunnaistettiin uudelleen viikolla 13, jolloin 16 potilasta jatkoi annoksella 100 mg ja 17 potilaan annos suurennettiin 300 mg:aan. Lähtötilanteessa HbA1C‑arvon keskiarvo oli 8,0 % (8,3 % lumeryhmässä ja 7,8 % kanagliflotsiinia saaneessa ryhmässä). Ero HbA1c‑arvon korjatun keskiarvon muutoksessa kanagliflotsiinia saaneiden ryhmän (N = 77) ja lumeryhmän (N = 80) välillä viikolla 26 oli -0,76 %, mikä oli kliinisesti merkityksellinen ja tilastollisesti merkitsevä (95 % CI -1,25, -0,27; p = 0,002).
Farmakokinetiikka
Kanagliflotsiinin farmakokinetiikka on olennaisesti samankaltainen terveillä tutkittavilla ja tyypin 2 diabetesta sairastavilla potilailla. Kun terveille tutkittaville annettiin 100 mg:n tai 300 mg:n kerta‑annos kanagliflotsiinia suun kautta, kanagliflotsiini imeytyi nopeasti ja huippupitoisuus plasmassa (Tmax-arvon mediaani) saavutettiin 1–2 tuntia annoksen jälkeen. Kanagliflotsiinin Cmax ja AUC plasmassa suurenivat suhteessa annokseen annoksilla 50 mg – 300 mg. Näennäinen puoliintumisaika (t1/2) (esitystapana keskiarvo ± keskipoikkeama) oli 10,6 ± 2,13 tuntia 100 mg:n annoksen yhteydessä ja 13,1 ± 3,28 tuntia 300 mg:n annoksen yhteydessä. Vakaa tila saavutettiin 4–5 vuorokaudessa kanagliflotsiinikerta‑annoksen 100 mg – 300 mg vuorokaudessa antamisen jälkeen. Kanagliflotsiinin farmakokinetiikka ei ole aikariippuvainen, ja siitä kumuloitui plasmaan toistettujen 100 mg:n ja 300 mg:n annosten jälkeen enimmillään 36 %.
Imeytyminen
Kanagliflotsiinin keskimääräinen absoluuttinen oraalinen hyötyosuus on noin 65 %. Samanaikainen runsasrasvainen ateria kanagliflotsiinin kanssa ei vaikuttanut kanagliflotsiinin farmakokinetiikkaan, joten Invokana voidaan ottaa ruokailun yhteydessä tai tyhjään mahaan. Koska kanagliflotsiini saattaa vähentää aterianjälkeisiä plasman glukoosipitoisuuden muutoksia glukoosin hidastuneen suolesta imeytymisen vuoksi, Invokana suositellaan ottamaan ennen päivän ensimmäistä ateriaa (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Jakautuminen
Kanagliflotsiinin keskimääräinen vakaan tilan jakautumistilavuus terveille tutkittaville laskimoon annetun kertainfuusion jälkeen oli 83,5 litraa, mikä viittaa laajaan jakautumiseen kudoksiin. Kanagliflotsiini sitoutuu voimakkaasti plasman proteiineihin (99 %), pääasiassa albumiiniin. Sitoutuminen proteiineihin ei ole riippuvainen kanagliflotsiinipitoisuudesta plasmassa. Sitoutuminen plasman proteiineihin ei ole merkityksellisesti erilaista, jos potilaalla on munuaisten tai maksan vajaatoimintaa.
Biotransformaatio
Kanagliflotsiinin pääasiallinen metabolinen eliminaatioreitti on O‑glukuronidaatio, sillä kanagliflotsiini glukuronoituu pääasiassa UGT1A9:n ja UGT2B4:n välityksellä kahdeksi inaktiiviseksi O‑glukuronidimetaboliitiksi. Kanagliflotsiinin CYP3A4‑välitteinen (oksidatiivinen) metabolia on ihmisellä vähäistä (noin 7 %).
Kanagliflotsiini ei in vitro ‑tutkimuksissa terapeuttisia pitoisuuksia suuremmilla pitoisuuksilla estänyt sytokromi P450 ‑entsyymejä CYP1A2, CYP2A6, CYP2C19, CYP2D6 eikä CYP2E1, CYP2B6, CYP2C8, CYP2C9 eikä indusoinut entsyymejä CYP1A2, CYP2C19, CYP2B6, CYP3A4. Kliinisesti oleellisia vaikutuksia CYP3A4-entsyymiin ei havaittu in vivo (ks. kohta Yhteisvaikutukset).
Eliminaatio
Kun terveille tutkittaville annettiin suun kautta kerta-annos [14C]kanagliflotsiinia, annetusta radioaktiivisesta annoksesta 41,5 % havaittiin ulosteessa kanagliflotsiinina, 7,0 % hydroksyloituneena metaboliittina ja 3,2 % eräänä O‑glukuronidimetaboliittina. Kanagliflotsiinin enterohepaattinen kierto on hyvin vähäistä.
Noin 33 % annetusta radioaktiivisesta annoksesta erittyi virtsaan, pääasiassa O‑glukuronidimetaboliitteina (30,5 %). Alle 1 % annoksesta erittyi muuttumattomana kanagliflotsiinina virtsaan. Kanagliflotsiiniannosten 100 mg ja 300 mg munuaispuhdistuma oli 1,30 ml/min – 1,55 ml/min.
Kanagliflotsiinin puhdistuma on vähäistä, sillä keskimääräinen systeeminen puhdistuma on terveille tutkittaville laskimoon tapahtuneen annon jälkeen noin 192 ml/min.
Erityispotilasryhmät
Munuaisten vajaatoiminta
Avoimessa kerta‑annostutkimuksessa selvitettiin 200 mg:n kanagliflotsiiniannosten farmakokinetiikkaa aikuisilla tutkittavilla, joilla oli eriasteista munuaisten vajaatoimintaa (luokiteltu Cockroft–Gaultin kaavaan perustuvan CrCl:n perusteella) verrattuna terveisiin tutkittaviin. Tutkimuksessa oli mukana 8 aikuista tutkittavaa, joiden munuaisten toiminta oli normaali (CrCl ≥ 80 ml/min), 8 tutkittavaa, joilla oli lievää munuaisten vajaatoimintaa (CrCl 50 ml/min – < 80 ml/min), 8 tutkittavaa, joilla oli keskivaikea munuaisten vajaatoiminta (CrCl 30 ml/min – < 50 ml/min), ja 8 tutkittavaa, joilla oli vaikea-asteista munuaisten vajaatoimintaa (CrCl < 30 ml/min), sekä 8 tutkittavaa, joilla oli loppuvaiheen munuaissairaus ja jotka saivat hemodialyysihoitoa.
Kanagliflotsiinin Cmax oli hieman suurentunut lievää (13 %), keskivaikeaa (29 %) ja vaikea-asteista (29 %) munuaisten vajaatoimintaa sairastavilla tutkittavilla, mutta ei hemodialyysihoitoa saavilla tutkittavilla. Kanagliflotsiinin AUC plasmassa oli terveisiin tutkittaviin verrattuna suurentunut 17 % lievää, 63 % keskivaikeaa ja 50 % vaikea-asteista munuaisten vajaatoimintaa sairastavilla tutkittavilla, mutta oli samankaltainen loppuvaiheen munuaissairautta sairastavilla ja terveillä tutkittavilla.
Kanagliflotsiini poistuu elimistöstä hemodialyysissä vain hyvin vähäisessä määrin.
Maksan vajaatoiminta
Kanagliflotsiinin Cmax- ja AUC∞-arvojen suhteen geometrinen keskiarvo oli Child–Pugh-luokan A (lievä maksan vajaatoiminta) aikuispotilailla 107 % (Cmax) ja 110 % (AUC∞) ja Child–Pugh-luokan B (keskivaikea maksan vajaatoiminta) potilailla 96 % (Cmax) ja 111 % (AUC∞) verrattuna tutkittaviin, joiden maksan toiminta oli normaali, kun heille annettiin 300 mg:n kerta-annos kanagliflotsiinia.
Näiden erojen ei katsota olevan kliinisesti merkityksellisiä. Child–Pugh-luokan C (vaikea-asteisesta) maksan vajaatoiminnasta ei ole kliinistä kokemusta.
Iäkkäät potilaat
Iällä ei populaatiofarmakokineettisen analyysin perusteella ollut kliinisesti merkityksellistä vaikutusta kanagliflotsiinin farmakokinetiikkaan (ks. kohta Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Pediatriset potilaat
Kanagliflotsiinilla vähintään 10‑vuotiaille tyypin 2 diabetesta sairastaville lapsille ja nuorille tehdyistä vaiheen 1 ja 3 tutkimuksista kerättyjä farmakokineettisia ja farmakodynaamisia tietoja tutkittiin. Vasteet kanagliflotsiinin oraalisen annon jälkeen (100 mg ja 300 mg) olivat yhdenmukaisia aikuisilla potilailla todettujen vasteiden kanssa. Farmakometrinen mallinnus viittaa siihen, että pienipainoisten lasten (< 50 kg) altistus kerran päivässä annetun 300 mg:n annoksen jälkeen voi olla suurempi kuin todettu aikuisten altistus samalla annoksella (ks. myös kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Muut erityispotilasryhmät
Farmakogenetiikka
Sekä UGT1A9:ssä että UGT2B4:ssä esiintyy geneettistä polymorfismia. Kliinisten tietojen yhdistetyssä analyysissä kanagliflotsiinin AUC-arvon todettiin suurentuneen 26 %, jos potilas oli UGT1A9*1/*3-kantaja, ja 18 %, jos potilas oli UGT2B4*2/*2-kantaja. Kanagliflotsiinialtistuksen tällainen suureneminen ei oletettavasti ole kliinisesti oleellista. Homotsygoottisuuden vaikutus (UGT1A9*3/*3, esiintyvyys < 0,1 %) on todennäköisesti suurempi, mutta sitä ei ole tutkittu.
Sukupuoli, rotu/etninen tausta tai painoindeksi eivät populaatiofarmakokineettisen analyysin perusteella vaikuttaneet kliinisesti merkityksellisesti kanagliflotsiinin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta ja genotoksisuutta koskevien konventionaalisten non-kliinisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Kanagliflotsiinilla ei todettu vaikutuksia rotan hedelmällisyyteen eikä alkion varhaiskehitykseen, kun altistus oli enimmillään 19-kertainen ihmiselle suurimmasta suositellusta annoksesta (maximum recommended human dose, MRHD) aiheutuvaan altistukseen nähden.
Systeemisillä altistuksilla, jotka olivat 73 kertaa ja 19 kertaa suurempia kuin kliininen altistus 100 mg:n ja 300 mg:n annoksilla, havaittiin rotilla tehdyssä alkion ja sikiön kehitystä koskevassa tutkimuksessa metatarsaaliluiden luutumisen hidastumista. Ei tiedetä, voiko luutumisen hidastuminen liittyä aikuisilla rotilla havaittuihin kanagliflotsiinin vaikutuksiin kalsiumhomeostaasiin. Luutumisen hidastumista havaittiin myös kanagliflotsiinin ja metformiinin yhdistelmän käytössä, ja tällainen vaikutus oli voimakkaampi kuin pelkkää metformiinia käytettäessä, kun kanagliflotsiinialtistus oli 43 kertaa suurempi kuin kliininen altistus 100 mg:n annoksesta ja 12 kertaa suurempi kuin kliininen altistus 300 mg:n annoksesta.
Pre- ja postnataalista kehitystä koskevassa tutkimuksessa naarasrotille gestaatiopäivästä 6 laktaatiopäivään 20 saakka annettu kanagliflotsiini alensi uros- ja naarasjälkeläisten painoa emolle toksisilla annoksilla > 30 mg/kg/vrk (altistukset ≥ 5,9-kertaiset ihmiselle suurimmasta suositellusta annoksesta aiheutuvaan kanagliflotsiinialtistukseen nähden). Emoon kohdistunut toksisuus rajoittui painokehityksen heikentymiseen.
Kanagliflotsiinia syntymän jälkeen päivästä 21 päivään 90 saakka saaneilla nuorilla rotilla tehdyssä tutkimuksessa ei todettu lisääntynyttä herkkyyttä verrattuna aikuisilla rotilla havaittuihin vaikutuksiin. Munuaisaltaan laajenemista havaittiin kuitenkin tämän suhteen vaikutuksettomilla annoksilla (No Observed Effect Level, NOEL), kun kliiniset altistukset olivat 2,4 kertaa suurempia kuin kliininen altistus 100 mg:n annoksista ja 0,5 kertaa suurempia kuin kliininen altistus 300 mg:n annoksista, eikä se korjautunut täysin noin 1 kuukauden palautumisjakson aikana. Nuorilla rotilla todetut pitkittyneet munuaislöydökset liittyivät todennäköisimmin kehittyvän rotan munuaisten heikompaan kykyyn käsitellä kanagliflotsiinin lisäämiä virtsatilavuuksia, koska rotan munuaisten toiminnallinen kypsyminen jatkuu 6 viikon ikään saakka.
Kanagliflotsiini ei lisännyt kasvainten ilmaantuvuutta uros‑ ja naarashiirille 2 vuotta kestäneessä tutkimuksessa annoksilla 10, 30 ja 100 mg/kg. Suurimmasta annoksesta 100 mg/kg aiheutui AUC-altistuksen perusteella enimmillään 14-kertainen altistus verrattuna kliiniseen 300 mg:n annokseen. Kanagliflotsiini lisäsi urosrotilla kivesten Leydigin solukasvainten ilmaantuvuutta kaikilla tutkituilla annoksilla (10, 30 ja 100 mg/kg). Pienin annos 10 mg/kg on AUC-altistuksen perusteella noin 1,5-kertainen verrattuna kliiniseen 300 mg:n annokseen. Suuremmat uros- ja naarasrotille annetut kanagliflotsiiniannokset (100 mg/kg) suurensivat feokromosytoomien ja munuaisten tubuluskasvainten ilmaantuvuutta. Feokromosytoomien ja munuaisten tubuluskasvainten suhteen vaikutukseton annos (NOEL) 30 mg/kg/vrk on AUC-altistuksen perusteella noin 4,5-kertainen verrattuna altistukseen kliinisellä vuorokausiannoksella 300 mg. Leydigin solukasvainten, munuaisten tubuluskasvainten ja feokromosytoomien katsotaan prekliinisten ja kliinisten mekanististen tutkimusten perusteella olevan rotalle tyypillisiä. Kanagliflotsiinista rotalle aiheutuvat munuaisten tubuluskasvaimet ja feokromosytoomat vaikuttavat johtuvan hiilihydraattien imeytymishäiriöstä rotan suolistossa kanagliflotsiinin aiheuttaman suoliston SGLT1:tä estävän vaikutuksen seurauksena. Ihmisellä ei ole mekanistisissa tutkimuksissa todettu hiilihydraattien imeytymishäiriötä, kun kanagliflotsiinia on annettu enimmillään kaksinkertaisesti suurin kliinisesti suositeltu annos. Leydigin solukasvaimet liittyvät luteinisoivan hormonin (LH) lisääntymiseen, mikä on Leydigin solukasvaimien kehittymistä rotalla tunnetusti lisäävä tekijä. 12 viikkoa kestäneessä kliinisessä tutkimuksessa stimuloimattoman LH:n pitoisuus ei suurentunut kanagliflotsiinihoitoa saaneilla miespotilailla.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Laktoosi
Mikrokiteinen selluloosa (E 460[i])
Hydroksipropyyliselluloosa (E 463)
Kroskarmelloosinatrium (E 468)
Magnesiumstearaatti (E 572)
Kalvopäällyste
Invokana 100 mg kalvopäällysteiset tabletit
Polyvinyylialkoholi (E 1203)
Titaanidioksidi (E 171)
Makrogoli/PEG3350 (E 1521)
Talkki (E 553b)
Keltainen rautaoksidi (E 172)
Invokana 300 mg kalvopäällysteiset tabletit
Polyvinyylialkoholi (E 1203)
Titaanidioksidi (E 171)
Makrogoli/PEG3350 (E 1521)
Talkki (E 553b)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
INVOKANA tabletti, kalvopäällysteinen
100 mg (L:kyllä) 30 x 1 fol (54,85 €), 90 x 1 fol (139,31 €)
300 mg (L:kyllä) 30 x 1 fol (54,85 €), 90 x 1 fol (139,31 €)
PF-selosteen tieto
Perforoitu yksittäispakattu polyvinyylikloridi/alumiiniläpipainopakkaus (PVC/Alu)
Pakkauskoot 10 x 1, 30 x 1, 90 x 1 ja 100 x 1 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Invokana 100 mg kalvopäällysteiset tabletit
Tabletti on keltainen, kapselinmuotoinen, pituudeltaan noin 11 mm, lääkeaineen heti vapauttava ja kalvopäällysteinen, sen toisella puolella on merkintä ”CFZ” ja vastakkaisella puolella on merkintä ”100”.
Invokana 300 mg kalvopäällysteiset tabletit
Tabletti on valkoinen, kapselinmuotoinen, pituudeltaan noin 17 mm, lääkeaineen heti vapauttava ja kalvopäällysteinen, sen toisella puolella on merkintä ”CFZ” ja vastakkaisella puolella on merkintä ”300”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
INVOKANA tabletti, kalvopäällysteinen
100 mg 30 x 1 fol, 90 x 1 fol
300 mg 30 x 1 fol, 90 x 1 fol
- Alempi erityiskorvaus (65 %). Diabetes, muu kuin insuliinihoito (215).
- Peruskorvaus (40 %).
ATC-koodi
A10BK02
Valmisteyhteenvedon muuttamispäivämäärä
22.08.2025
Yhteystiedot
Hitsaajankatu 24
00810 Helsinki
0403 000 760
www.menarini.com, www.berlin-chemie.fi
fi@berlin-chemie.com
Edustaja Suomessa: Berlin-Chemie/A. Menarini Suomi Oy
