DAISYNELLE tabletti 150/20 mikrog, 150/30 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Terveydenhuollon ammattilainen
DAISYNELLE, GESTINYL
DAISYNELLE, GESTINYL
DAISYNELLE, GESTINYL
Vaikuttavat aineet ja niiden määrät
Daisynelle 150 mikrog/20 mikrog tabletti:
Yksi tabletti sisältää
0,15 milligrammaa desogestreeliä (= 150 mikrogrammaa)
0,02 milligrammaa etinyyliestradiolia (= 20 mikrogrammaa)
Apuaine(et), joiden vaikutus tunnetaan:
Sisältää 68,55 mg laktoosia (laktoosimonohydraattina).
Daisynelle 150 mikrog/30 mikrog tabletti:
Yksi tabletti sisältää
0,15 milligrammaa desogestreeliä (= 150 mikrogrammaa)
0,03 milligrammaa etinyyliestradiolia (= 30 mikrogrammaa)
Sisältää 68,54 mg laktoosia (laktoosimonohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Daisynelle-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Daisynelle-valmisteen käytön VTE:n riski on verrattuna muiden hormonaalisten yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Miten Daisynelle-tabletteja käytetään
Tabletit otetaan pakkaukseen merkityssä järjestyksessä joka päivä suunnilleen samaan aikaan. Joka päivä otetaan yksi tabletti 21 peräkkäisenä päivänä. Pakkausten välillä pidetään 7 päivää kestävä tablettitauko, jonka aikana naisella on kuukautisia muistuttava tyhjennysvuoto. Tämä vuoto alkaa yleensä 2 tai 3 päivän kuluttua viimeisen tabletin ottamisesta ja saattaa jatkua vielä, kun seuraava pakkaus aloitetaan.
Daisynelle-tablettien käytön aloittaminen
Ei edeltävää hormonaalisen ehkäisyn käyttöä (edeltävän kuukauden aikana)
Tablettien käyttö aloitetaan normaalin kuukautiskierron 1. päivänä (ts. kuukautisvuodon ensimmäisenä päivänä). Tablettien käytön voi myös aloittaa kierron 2.–5. päivänä, mutta tässä tapauksessa on suositeltavaa käyttää lisäksi jotakin estemenetelmää ensimmäisen kierron ensimmäisten 7 päivän aikana.
Siirtyminen toisesta yhdistelmäehkäisyvalmisteesta (yhdistelmäehkäisytabletti, ehkäisyrengas tai ehkäisylaastari)
Daisynelle-tablettien käyttö tulisi aloittaa edellisen yhdistelmäehkäisytablettivalmisteen viimeisen vaikuttavan (vaikuttavaa ainetta sisältävän) tabletin ottoa seuraavana päivänä, kuitenkin viimeistään tavanomaista tablettitaukoa seuraavana päivänä tai edellisen yhdistelmäehkäisytablettivalmisteen viimeisen lumelääketabletin ottoa seuraavana päivänä.
Jos nainen on käyttänyt ehkäisyrengasta tai ehkäisylaastaria, Daisynelle-tablettien käyttö tulee mieluiten aloittaa renkaan tai laastarin poistopäivänä, mutta viimeistään päivänä, jolloin seuraava rengas tai laastari olisi otettu käyttöön.
Siirtyminen pelkkää progestiinia sisältävästä valmisteesta (pelkkää progestiinia sisältävät ns. minipillerit, ehkäisyruiske, ehkäisykapseli) tai hormonikierukasta
Pelkkää progestiinia sisältävät ns. minipillerit on mahdollista vaihtaa Daisynelle-tabletteihin milloin tahansa. (Siirtyminen ehkäisykapselista tai hormonikierukasta Daisynelle-tabletteihin tapahtuu kapselin tai kierukan poistopäivänä. Siirryttäessä ehkäisyruiskeesta Daisynelle-tabletteihin ensimmäinen tabletti otetaan päivänä, jolloin seuraava ruiske olisi pitänyt ottaa.) Kaikissa näissä tapauksissa on kuitenkin suositeltavaa käyttää lisäehkäisynä jotakin estemenetelmää 7 ensimmäisen tabletinottopäivän ajan.
1. raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Tablettien käyttö tulisi aloittaa välittömästi. Tässä tapauksessa lisäehkäisy ei ole tarpeen.
Synnytyksen tai 2. raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Imettäville äideille – katso kappale Raskaus ja imetys.
Lääkkeen käyttäjää tulee neuvoa aloittamaan tablettien käyttö 21–28 päivää synnytyksen tai 2. raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. Mikäli tablettien käyttö aloitetaan myöhemmin, käyttäjää tulee neuvoa käyttämään lisäehkäisynä jotakin este menetelmää tabletin käytön seitsemän ensimmäisen päivän aikana. Mikäli hän on jo ollut yhdynnässä, raskauden mahdollisuus tulee poissulkea, ennen kuin hän aloittaa tablettien käytön, tai naisen tulee odottaa ensimmäisten kuukautisten alkamista.
Tablettien unohtuminen
Mikäli tabletin ottaminen myöhästyy alle 12 tuntia, ehkäisyteho säilyy ennallaan.
Käyttäjän tulisi ottaa unohtunut tabletti mahdollisimman pian ja jatkaa jäljellä olevien tablettien käyttöä tavanomaiseen tapaan.
Mikäli tabletin ottaminen myöhästyy yli 12 tuntia, ehkäisyteho on saattanut heikentyä.
Seuraavat kaksi perussääntöä tulee ottaa huomioon, mikäli tablettien ottaminen on unohtunut:
- Tablettien käyttöä ei tule koskaan keskeyttää yli 7 päivän ajaksi.
- Hypotalamus-aivolisäke-munasarja-akselin riittävä suppressio edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Tästä syystä voidaan antaa seuraavat käytännön neuvot:
Viikko 1
Käyttäjän tulee ottaa viimeinen unohtunut tabletti mahdollisimman pian, vaikka se tarkoittaisikin sitä, että hänen tulee ottaa 2 tablettia yhtä aikaa. Tämän jälkeen hän jatkaa tablettien ottoa tavanomaiseen aikaan päivästä. Seuraavien 7 päivän ajan hänen tulisi käyttää lisäksi jotakin estemenetelmää, esim. kondomia. Mikäli käyttäjä on ollut yhdynnässä edeltävien 7 päivän aikana, raskauden mahdollisuus tulee ottaa huomioon. Raskauden riski on sitä suurempi, mitä useampi tabletti on unohtunut ja mitä lähempänä tavanomaista tablettitaukoa ne ovat.
Viikko 2
Käyttäjän tulee ottaa viimeinen unohtunut tabletti mahdollisimman pian, vaikka se tarkoittaisikin sitä, että hänen tulee ottaa 2 tablettia yhtä aikaa. Tämän jälkeen hän jatkaa tablettien ottoa tavanomaiseen aikaan päivästä. Lisäehkäisyä ei tarvita, jos tabletit on otettu ohjeiden mukaisesti unohtunutta tablettia edeltäneiden 7 päivän ajan. Mikäli näin ei ole tai mikäli useampia kuin yksi tabletti on unohtunut, käyttäjää tulee neuvoa käyttämään lisäehkäisyä 7 päivän ajan.
Viikko 3
Ehkäisyteho voi vaarantua seuraavan viikon tablettitauon vuoksi.
Tämä riski voidaan kuitenkin välttää muuttamalla tablettien annostusta. Lisäehkäisyä ei tarvita, mikäli nainen noudattaa jompaakumpaa seuraavista vaihtoehdoista ja on ottanut kaikki tabletit ohjeen mukaisella tavalla 7 päivää ennen unohtunutta tablettia. Mikäli näin ei ole, käyttäjää tulisi neuvoa noudattamaan ensimmäistä vaihtoehtoa ja käyttämään samanaikaisesti lisäehkäisyä seuraavien 7 päivän ajan.
- Käyttäjän tulee ottaa viimeinen unohtunut tabletti mahdollisimman pian, vaikka se tarkoittaisikin sitä, että hänen tulee ottaa 2 tablettia yhtä aikaa. Tämän jälkeen hän jatkaa tablettien ottoa tavanomaiseen aikaan päivästä. Seuraava pakkaus aloitetaan välittömästi sen jälkeen, kun viimeinen tabletti nykyisestä pakkauksesta on otettu, eli pakkausten välillä ei pidetä taukoa. Naisella ei välttämättä ole tyhjennysvuotoa ennen kuin toinen pakkaus on käytetty loppuun, mutta hänellä voi esiintyä tiputtelu- tai läpäisyvuotoa jälkimmäisen pakkauksen aikana.
- Käyttäjä voi myös lopettaa tablettien ottamisen nykyisestä pakkauksesta ja aloittaa heti 7 päivän tablettitauon. Taukoon lasketaan mukaan myös päivät, jolloin hän unohti ottaa tabletin. Tämän jälkeen jatketaan seuraavalla pakkauksella tavanomaiseen tapaan.
Raskauden mahdollisuus on otettava huomioon, jos tabletteja on unohtunut eikä ensimmäisen tavanomaisen tablettitauon aikana esiinny tyhjennysvuotoa.
Varotoimet oksentelun tai voimakkaan ripulin yhteydessä
Mikäli nainen oksentaa tai saa voimakkaan ripulin 3–4 tunnin sisällä tabletin ottamisesta, tabletti ei välttämättä ole imeytynyt kokonaan. Tällöin noudatetaan kohdassa Annostus ja antotapa kuvattuja tabletin unohtumista koskevia varotoimenpiteitä. Mikäli käyttäjä ei halua muuttaa tavanomaisia tabletinottoaikojaan, tulee hänen ottaa tarvittavat ylimääräiset tabletit toisesta pakkauksesta.
Tyhjennysvuodon siirtäminen
Kuukautisten siirtämiseksi käyttäjän tulee aloittaa toisen Daisynelle‑pakkauksen käyttö välittömästi edellisen pakkauksen loputtua ja jättää siis tablettitauko pitämättä. Näin voidaan jatkaa haluttaessa aina toisen pakkauksen päättymiseen saakka. Toisen pakkauksen aikana saattaa esiintyä läpäisyvuotoa tai tiputtelua. Tämän jälkeen pidetään tavanomainen 7 päivän tablettitauko ja Daisynelle-tablettien käyttöä jatketaan tavanomaiseen tapaan.
Jos nainen haluaa siirtää kuukautisten alkamispäivää toiselle viikonpäivälle, hän voi lyhentää tulevaa tablettitaukoa niin monella päivällä kuin haluaa. Mitä lyhyempi tauko pidetään, sitä todennäköisempää on, että tyhjennysvuoto jää tulematta ja seuraavan pakkauksen aikana esiintyy läpäisyvuotoa ja tiputtelua (kuten kuukautisia siirrettäessä).
Pediatriset potilaat:
Desogestreelin turvallisuutta ja tehoa alle 18-vuotiailla nuorilla ei ole tutkittu.
Kliinistä tietoa ei ole saatavilla.
Vasta-aiheet
Hormonaalisia yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä. Mikäli jokin niistä ilmenee ensimmäistä kertaa yhdistelmäehkäisytablettien käytön aikana, valmisteen käyttö tulee lopettaa välittömästi.
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia).
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC- resistenssi, (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
valtimotromboembolia tai sen riski
- valtimotromboembolia - tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus - tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia.
- Nykyinen tai aiemmin ilmennyt pankreatiitti, jos siihen on liittynyt vaikea hypertriglyseridemia
- Nykyinen tai aiemmin ilmennyt vaikea maksasairaus, jos maksan toiminta-arvot eivät ole vielä palautuneet normaaleiksi
- Nykyiset tai aiemmin ilmenneet maksakasvaimet (hyvän- tai pahanlaatuiset)
- Todetut tai epäillyt hormoniriippuvaiset syövät (esim. sukuelinten tai rintojen syövät)
- Diagnosoimaton emätinverenvuoto.
- Yliherkkyys Daisynelle ‑tablettien vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
- Ombitasviirin, paritapreviirin, ja ritonaviirin yhdistelmää ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden samanaikainen käyttö Daisynelle-valmisteen kanssa on vasta-aiheista (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
- Verenkiertohäiriöt
Daisynelle-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Daisynelle-valmisteen käyttö keskeyttää.
Laskimotromboembolian (VTE) riski
- Minkä tahansa hormonaalisen yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Daisynelle-valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Daisynelle-valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun hormonaalisen yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
- Noin kahdelle naiselle 10 000:sta, jotka eivät käytä hormonaalista yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
- Arviolta noin 9–12 naiselle[footnoteRef:1] 10 000:sta, jotka käyttävät desogestreelia sisältävää hormonaalista yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana. Levonorgestreelia sisältävää hormonaalista yhdistelmäehkäisyvalmistetta käyttävillä naisilla vastaava luku on 6[footnoteRef:2]. [1: Ilmaantuvuus arvioitiin kaikista epidemiologisista tutkimustuloksista vertaamalla eri valmisteiden suhteellisia riskejä levonorgestreelia sisältäviin yhdistelmäehkäisyvalmisteisiin.] [2: Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.]
- Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
- VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
VTE-tapausten määrä 10 000 naista kohti yhden vuoden aikana
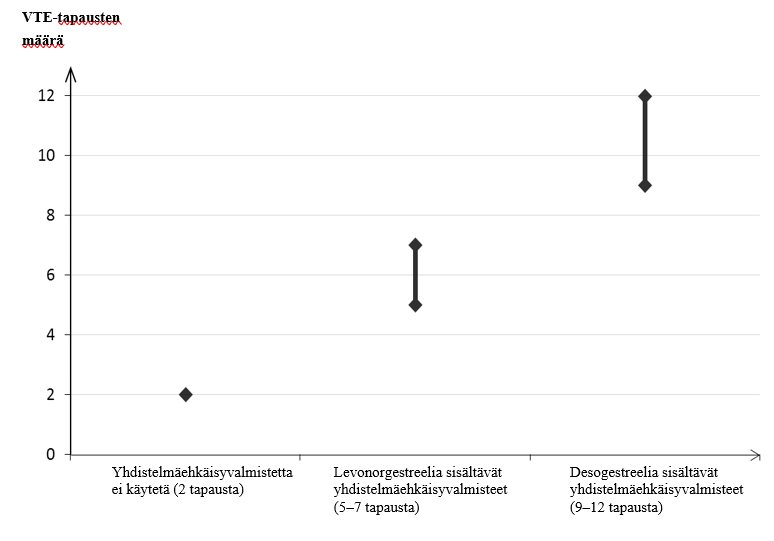
Hormonaalisten yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Hormonaalisten yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Daisynelle-valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, hormonaalista yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin |
noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. | |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma
Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi.
Antitromboottista hoitoa on harkittava, ellei Daisynelle-valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään hormonaalisen yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys "Hedelmällisyys, raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät hormonaalista yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että hormonaalisten yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski hormonaalisen yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Daisynelle-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, hormonaalista yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Hormonaalista yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään hormonaalisen yhdistelmäehkäisyvalmisteen käytöstä |
vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50-vuotiaana). | päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) hormonaalisen yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät hormonaalista yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
2. Kasvaimet
- Joissakin epidemiologisissa tutkimuksissa on havaittu kohdunkaulan syövän riskin suurenemista yhdistelmäehkäisytablettien pitkäaikaisilla käyttäjillä. Toistaiseksi on silti epäselvää, missä määrin tähän vaikuttaa seksuaalinen käyttäytyminen sekä muut tekijät, kuten ihmisen papilloomavirus (HPV).
- 54 epidemiologisesta tutkimuksesta tehty meta-analyysi osoittaa, että rintasyövän suhteellinen riski on hieman suurentunut (RR = 1,24) yhdistelmäehkäisytabletteja käyttävillä naisilla. Tämä lisääntynyt riski häviää asteittain yhdistelmäehkäisytablettien käytön lopettamista seuraavien 10 vuoden aikana. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, todettujen rintasyöpätapausten määrän suureneminen yhdistelmäehkäisytablettien nykyisillä ja aiemmilla käyttäjillä on vähäistä verrattuna naisen elinikäiseen rintasyöpäriskiin. Tutkimuksissa ei ole saatu näyttöä syysuhteesta. Havaittu riskin suureneminen saattaa johtua rintasyövän aiemmasta toteamisesta yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai molemmista. Yhdistelmäehkäisytablettien käyttäjillä todetut rintasyöpätapaukset ovat usein kliinisesti varhaisemmassa vaiheessa kuin ehkäisytabletteja käyttämättömillä naisilla todetut tapaukset.
- Yhdistelmäehkäisytablettien käyttäjillä on esiintynyt hyvin harvoin hyvänlaatuisia maksakasvaimia ja vielä harvemmin pahanlaatuisia maksakasvaimia. Muutamissa tapauksissa nämä kasvaimet ovat johtaneet hengenvaarallisiin intra-abdominaalisiin verenvuotoihin. Maksakasvaimen mahdollisuutta tulisi harkita erotusdiagnostiikassa, kun yhdistelmäehkäisytablettien käyttäjällä esiintyy voimakasta kipua ylävatsassa, maksan suurenemista tai merkkejä intra-abdominaalisesta verenvuodosta.
Kohdun myoomien koko saattaa muuttua yhdistelmäehkäisytablettien käytön aikana.
3. Muut tilat
- Yhdistelmäehkäisytablettien käyttö saattaa suurentaa pankreatiittiriskiä naisilla, joilla on hypertriglyseridemia tai perinnöllinen hypertriglyseridemiataipumus.
- Vaikka lieviä verenpaineen kohoamisia on ilmoitettu yhdistelmäehkäisytabletteja käyttävillä naisilla, verenpaineen kliinisesti merkittävä suureneminen on harvinaista. Yhdistelmäehkäisytablettien käytön välitön lopettaminen on aiheellista vain näissä harvinaisissa tapauksissa. Johdonmukaista suhdetta yhdistelmäehkäisytablettien käytön ja kliinisen hypertension välillä ei ole vahvistettu. Yhdistelmäehkäisytablettien käyttö tulee lopettaa, jos käyttäjällä on ennestään korkea verenpaine ja yhdistelmäehkäisytablettien käytön aikana esiintyy jatkuvasti kohonneita verenpainearvoja tai huomattavaa nousua verenpaineessa eikä verenpainelääkityksellä saavuteta asianmukaista vastetta. Tapauskohtaisesti voidaan harkita ehkäisypillereiden käytön uudelleen aloittamista, mikäli verenpaine saadaan normalisoitumaan verenpainelääkkeiden avulla.
- Seuraavien tilojen esiintymisestä tai pahenemisesta on ilmoitettu sekä raskauden että yhdistelmäehkäisytablettien käytön aikana, mutta on edelleen epäselvää, ovatko ne yhteydessä yhdistelmäehkäisytablettien käyttöön: Kolestaattinen ikterus ja/tai kutina, sappikivet, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroottinen kuulon heikkeneminen, (perinnöllinen) angioedeema.
- Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
- Maksan toiminnan akuutit tai krooniset häiriöt voivat vaatia yhdistelmäehkäisytablettien käytön lopettamista, kunnes maksan toiminta-arvot ovat normalisoituneet. Yhdistelmäehkäisytablettien käyttö tulee lopettaa, jos aiemman raskauden tai aiemman sukupuolihormonien käytön aikana ilmennyt kolestaattinen ikterus ja/tai kolestaasiin liittyvä kutina uusiutuu.
- Vaikka yhdistelmäehkäisytabletit saattavat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon, ei ole viitteitä siitä, että yhdistelmäehkäisytabletteja käyttävien diabeetikkojen hoitoa tulisi muuttaa. Diabeetikkoja tulee kuitenkin seurata tarkkaan yhdistelmäehkäisytablettien käytön aikana.
- Yhdistelmäehkäisytablettien käytön aikana on ilmoitettu endogeenisen masennuksen, epilepsian, Crohnin taudin sekä haavaisen paksusuolitulehduksen pahentumista.
- Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
- Maksaläiskiä saattaa esiintyä satunnaisesti, erityisesti naisilla, joilla niitä on esiintynyt raskauden aikana. Naisten, joilla on taipumusta maksaläiskiin, tulisi välttää altistusta auringonvalolle tai UV-säteilylle yhdistelmäehkäisytablettien käytön aikana.
Daisynelle-tabletit sisältävät laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Lääkärintarkastus/konsultaatio
Ennen Daisynelle-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois.. Naisen verenpaine on mitattava ja hänelle on tehtävä lääkärintarkastus, jossa otetaan huomioon vasta-aiheet (kohta Vasta-aiheet) ja varoitukset (kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Daisynelle-valmisteen käyttöön liittyvään riskiin verrattuna muihin hormonaalisiin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naista on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
Tehon heikkeneminen
Yhdistelmäehkäisytablettien teho saattaa heikentyä, mikäli tabletti unohtuu (kohta Annostus ja antotapa), naisella on oksentelua tai voimakasta ripulia (kohta Annostus ja antotapa) tai hän käyttää samanaikaisesti muita lääkkeitä (kohta Yhteisvaikutukset).
Vuotokontrollin heikkeneminen
Kaikkien yhdistelmäehkäisytablettien käytön yhteydessä saattaa esiintyä epäsäännöllistä vuotoa (tiputtelua ja läpäisyvuotoa), erityisesti ensimmäisten kuukausien aikana. Tästä syystä vuotohäiriöitä on syytä alkaa arvioida vasta noin 3 kiertoa kestävän sopeutumisjakson jälkeen.
Mikäli vuotohäiriöt jatkuvat tai uusiutuvat, vaikka kierto on aiemmin jo muuttunut säännölliseksi, on harkittava ei-hormonaalisia syitä ja ryhdyttävä diagnostisiin varotoimiin syövän tai raskauden poissulkemiseksi. Kohdun kaavinta voi olla tarpeen.
Joillakin käyttäjillä ei esiinny tyhjennysvuotoa tablettitauon aikana. Mikäli yhdistelmäehkäisytabletit on otettu kohdan Annostus ja antotapa ohjeiden mukaisesti, on epätodennäköistä, että käyttäjä on raskaana. Mikäli yhdistelmäehkäisytabletteja ei kuitenkaan ole otettu ohjeiden mukaisesti ennen tyhjennysvuodon ensimmäistä poisjäämistä tai kaksi tyhjennysvuotoa on jäänyt väliin, raskauden mahdollisuus tulee sulkea pois ennen kuin yhdistelmäehkäisytablettien käyttöä jatketaan.
Yhteisvaikutukset
Huom: Samanaikaisesti käytettävien lääkevalmisteiden valmisteyhteenvetoihin tulee tutustua mahdollisten yhteisvaikutusten selvittämiseksi.
Muiden lääkevalmisteiden vaikutus Daisynelle-tabletteihin
Yhteisvaikutuksia saattaa ilmetä mikrosomaalisia entsyymejä, erityisesti sytokromi P450-entsyymiä (CYP) indusoivien lääkkeiden tai kasvirohdosvalmisteiden kanssa, jotka voivat lisätä sukupuolihormonien puhdistumaa, mikä voi johtaa läpäisyvuotoihin ja/tai ehkäisytehon pettämiseen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymi-induktion vaikutus voi kestää noin neljän viikon ajan.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä tai kasvirohdosvalmisteita naisen tulee väliaikaisesti käyttää Daisynelle-valmisteen lisäksi jotakin estemenetelmää tai valita jokin muu ehkäisykeino. Estemenetelmää on käytettävä samanaikaisesti käytettävän lääkityksen ajan sekä lisäksi 28 päivää lääkityksen lopettamisen jälkeen.
Pitkäaikainen hoito
Käytettäessä pitkäkestoisesti maksan entsyymejä indusoivaa lääkitystä suositellaan muun luotettavan ei-hormonaalisen ja entsyymejä indusoimattoman ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia:
Daisynelle-valmisteen puhdistumaa lisäävät aineet (entsyymi-induktio) (entsyymi-induktion aiheuttama yhdistelmäehkäisytablettien tehon heikkeneminen), esim.: fenytoiini, fenobarbitaali, primidoni, bosentaani, karbamatsepiini, rifampisiini, jotkut HIV-proteaasin estäjät (esim. ritonaviiri) ja ei-nukleosidirakenteiset käänteiskopioijaentsyymin estäjät (esim. efavirentsi, nevirapiini) sekä mahdollisesti myös okskarbatsepiini, topiramaatti, rifabutiini, felbamaatti, griseofulviini ja mäkikuismarohdosta sisältävät valmisteet.
Aineet joilla on vaihtelevia vaikutuksia yhdistelmäehkäisytablettien puhdistumaan:
Yhtäaikaisesti hormonaalisten ehkäisyvalmisteiden kanssa käytettynä monet HIV-proteaasin estäjiä (esim. nelfinaviiria) ja ei-nukleosidirakenteisia käänteiskopioijaentsyymin estäjiä (esim. nevirapiinia) sisältävät lääkeyhdistelmätvoivat suurentaa tai pienentää progestiinien, mukaan lukien desogestreelin aktiivisen metaboliitin etonogestreelin, tai estrogeenin pitoisuutta plasmassa. Näiden muutosten kokonaisvaikutus voi joissakin tapauksissa olla kliinisesti merkittävä.
Tämän vuoksi samanaikaisesti käytettyjen HIV/HCV-lääkkeiden valmisteyhteenvetoihin on perehdyttävä mahdollisten yhteisvaikutusten ja niitä koskevien lisäohjeiden osalta. Jos epäillään yhteisvaikutuksen mahdollisuutta, proteaasin estäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää käyttävän naisen pitää käyttää lisäehkäisynä jotain estemenetelmää.
Aineet, jotka vähentävät Daisynelle-valmisteen puhdistumaa (entsyymi-inhibiittorit)
Entsyymi-inhibiittoreiden mahdollisen yhteisvaikutuksen kliinistä merkitystä ei tunneta. Voimakkaiden CYP3A4-entsyymi-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli) tai kohtalaisten CYP3A4-entsyymi-inhibiittoreiden (esim. flukonatsoli) yhtäaikainen käyttö voi nostaa progestiinien, mukaan lukien desogestreelin aktiivisen metaboliitin etonogestreelin, pitoisuutta plasmassa.
Etorikoksibin 60–120 mg päiväannoksen on havaittu nostavan etinyyliestradiolin pitoisuutta plasmassa 1,4–1,6-kertaiseksi käytettäessä samanaikaisesti yhdistelmäehkäisyvalmisteen kanssa, joka sisältää 0,035 mg etinyyliestradiolia.
Troleandomysiinin käyttö samanaikaisesti yhdistelmäehkäisytablettien kanssa voi suurentaa intrahepaattisen kolestaasin riskiä.
Daisynelle-tablettien vaikutus muihin lääkkeisiin
Ehkäisytabletit voivat vaikuttaa tiettyjen muiden lääkkeiden metaboliaan. Plasman ja kudosten lääkepitoisuudet voivat joko suurentua (esim. siklosporiini) tai pienentyä (esim. lamotrigiini).
Kliinisen tutkimustiedon perusteella etinyyliestradioli estää CYP1A2-substraattien puhdistumaa, joka johtaa näiden pitoisuuksien heikkoon (mm. teofylliini) tai kohtalaiseen (mm. titsanidiini) suurenemiseen plasmassa.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet). Tästä syystä Daisynelle-valmisteen käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Daisynelle-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
Laboratoriokokeet
Steroidiehkäisyn käytöllä saattaa olla vaikutusta eräiden laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisen ja munuaisen toimintakokeiden arvoihin, plasman (kantaja)proteiinipitoisuuksiin, esimerkiksi transkortiinin (CBG) pitoisuuksiin ja lipidi/lipoproteiinifraktioihin, sekä hiilihydraattiaineenvaihdunnan parametreihin ja koagulaatio- ja fibrinolyysiarvoihin. Muutokset pysyvät yleensä viitearvojen puitteissa.
Raskaus ja imetys
Raskaus
Daisynelle-tabletteja ei ole tarkoitettu käytettäväksi raskauden aikana.
Mikäli käyttäjä tulee raskaaksi, tulee Daisynelle-tablettien käyttö keskeyttää välittömästi.
Laajat epidemiologiset tutkimukset eivät ole kuitenkaan osoittaneet, että kehityshäiriöiden riski olisi suurentunut, jos lapsen äiti on käyttänyt yhdistelmäehkäisytabletteja ennen raskautta. Yhdistelmäehkäisytablettien tahattoman käytön alkuraskauden aikana ei myöskään ole osoitettu aiheuttaneen teratogeenisuutta.
Imetys
Yhdistelmäehkäisytabletit saattavat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Tästä syystä yhdistelmäehkäisytabletteja ei yleisesti ottaen tulisi suositella ennen kuin imetys on lopetettu kokonaan. Pieniä määriä ehkäisytablettien steroideja ja/tai niiden metaboliitteja saattaa erittyä rintamaitoon yhdistelmäehkäisytablettien käytön aikana. Nämä määrät saattavat vaikuttaa lapseen.
Kun Daisynelle-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Daisynelle-tableteilla ei ole haitallista vaikutusta ajokykyyn eikä koneiden käyttökykyyn.
Haittavaikutukset
Yhdistelmäehkäisytablettien käyttäjillä esiintyneet vakavat haittatapahtumat, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Tiettyjen haittavaikutusten kuvaus
Hormonaalisia yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia.
Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Daisynelle-tablettien tai yhdistelmäehkäisyvalmisteiden käyttäjillä yleensäkin raportoidut, mahdollisesti käyttöön liittyvät haittavaikutukset, on lueteltu alla olevassa taulukossa. Kaikki haittavaikutukset on lueteltu elinjärjestelmän ja esiintymistiheyden mukaan; hyvin yleinen (≥1/10), yleinen (≥1/100), melko harvinainen (≥1/1000, <1/100), harvinainen (<1/1 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
MedDRAn yleisyysluokitus Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, < 1/10)) | Melko harvinainen (≥1/1,000, < 1/100) | Harvinainen (≥ 1/10 000, < 1/1 000) | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
Infektiot | Hiivatulehdus | ||||
Immuunijärjestelmä | Yliherkkyys | Perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | |||
Aineenvaihdunta ja ravitsemus | Nesteen kertyminen elimistöön | ||||
Psyykkiset häiriöt | Masentunut mieliala Mielialan muutokset | Libidon heikkeneminen | Libidon voimistuminen | ||
Hermosto | Päänsärky Huimaus Hermostuneisuus | Migreeni | |||
Silmät | Huono piilolinssien sieto | ||||
Kuulo ja tasapainoelin | Otoskleroosi | ||||
Verisuonisto | Hypertensio | Laskimotromboembolia Valtimotromboembolia | |||
Ruoansulatuselimistö | Pahoinvointi, vatsakipu | Oksentelu | |||
Iho ja ihonalainen kudos | Akne | Ihottuma Nokkosihottuma | Erythema nodosum Erythema multiforme Kutina Hiustenlähtö | ||
Sukupuolielimet ja rinnat | Epäsäännöllinen vuoto | Amenorrea Rintojen arkuus Rintojen kipu Metrorragia | Rintojen suureneminen | Emätinvuoto Eritevuoto rinnoista | |
Yleisoireet ja antopaikassa todettavat haitat | Painonnousu |
Yhdistelmäehkäisytabletteja käyttäneillä naisilla on ilmoitettu seuraavia vakavia haittavaikutuksia, joita käsitellään kohdassa Varoitukset ja käyttöön liittyvät varotoimet:
- tromboemboliset laskimotapahtumat;
- tromboemboliset valtimotapahtumat;
- hypertensio;
- maksakasvaimet;
- seuraavien tilojen kehittyminen tai paheneminen (yhteyttä yhdistelmäehkäisytablettien käyttöön ei ole osoitettu): Crohnin tauti, haavainen paksusuolitulehdus, epilepsia, migreeni, endometrioosi, kohtumyoomat, porfyria, systeeminen lupus erythematosus, herpes gestationis, Sydenhamin korea, hemolyyttis-ureeminen oireyhtymä, kolestaattinen ikterus;
- kloasma.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteenhyöty-haitta –tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Yliannostuksen jälkeen ei ole ilmoitettu vakavia haittavaikutuksia. Yliannostuksen mahdollisia oireita ovat: pahoinvointi, oksentelu ja nuorilla tytöillä vähäinen verenvuoto emättimestä. Yliannostukseen ei ole vasta-ainetta, ja hoidon tulisi olla oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet, ATC-koodi: G03AA09
Yhdistelmäehkäisytablettien ehkäisyteho perustuu useisiin eri tekijöihin, joista tärkeimpiä ovat ovulaation estyminen ja muutokset kohdunkaulan limassa. Raskauden ehkäisyn lisäksi yhdistelmäehkäisytableteilla on monia etuja, jotka on hyvä ottaa huomioon haittojen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) ohella ehkäisymenetelmää valittaessa. Kierto on säännöllisempi ja kuukautiset ovat usein vähemmän kivuliaat ja vuoto on vähäisempää. Jälkimmäinen saattaa vähentää raudanpuutoksen esiintymistä. Suurimmassa monikeskustutkimuksessa (n = 23 258 kiertoa) korjaamattoman Pearlin luvun arvioitiin olevan 0,1 (95 % luottamusväli 0,0–0,3). Lisäksi 4,5 % naisista ilmoitti tyhjennysvuodon poisjäämistä ja 9,2 % epäsäännöllisiä vuotoja 6 hoitokierron jälkeen.
Daisynelle on yhdistelmäehkäisytabletti, joka sisältää etinyyliestradiolia ja desogestreeliä (progestiini).
Etinyyliestradioli on synteettinen estrogeeni, jonka ominaisuudet tunnetaan hyvin.
Desogestreeli on synteettinen progestiini. Suun kautta otettuna sillä on voimakas ovulaatiota estävä vaikutus.
Suuriannoksisten (50 µg etinyyliestradiolia) yhdistelmäehkäisytablettien käyttö pienentää kohtusyövän ja munasarjasyövän riskiä. On edelleen epäselvää, onko myös pieniannoksisilla yhdistelmäehkäisytableteilla samanlainen vaikutus.
Pediatriset potilaat
Kliinisiä tietoja turvallisuudesta ja tehosta alle 18-vuotiailla nuorilla ei ole saatavilla.
Farmakokinetiikka
Desogestreeli
Imeytyminen
Kun Daisynelle-tabletit otetaan suun kautta, desogestreeli imeytyy nopeasti ja muuntuu 3-keto-desogestreeliksi. Plasman huippupitoisuus saavutetaan 1,5 tunnissa. 3-keto-desogestreelin absoluuttinen hyötyosuus on 62–81 %.
Jakautuminen
3-keto-desogestreeli sitoutuu 95,5–99-prosenttisesti plasman proteiineihin, pääasiallisesti albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG). Etinyyliestradiolin aiheuttama SHBG:n induktio vaikuttaa sekä 3-keto-desogestreelin sitoutumiseen että sen jakautumiseen plasmaproteiineissa. Tämän seurauksena 3-keto-desogestreelin pitoisuus nousee vähitellen hoidon aikana, kunnes saavutetaan vakaa tila 3–13 päivän kuluttua.
Biotransformaatio
Desogestreelin metabolian alussa tapahtuu CYP450-entsyymijärjestelmän katalysoima hydroksylaatio ja tämän jälkeen dehydrogenaatio kohdassa C3. Aktiivinen metaboliitti, 3-keto-desogestreeli, pelkistyy edelleen, ja hajoamistuotteet konjugoituvat sulfaatiksi ja glukuronideiksi. Eläinkokeet osoittavat, että enterohepaattisella kierrolla ei ole vaikutusta desogestreelin gestageeniseen tehoon.
Eliminaatio
3-keto-desogestreelin eliminaation puoliintumisaika on keskimäärin noin 31 tuntia (24–38 tuntia) ja sen plasmapuhdistuma 5,0–9,5 l/h. Desogestreeli ja sen metaboliitit poistuvat virtsan ja ulosteen kautta joko vapaina steroideina tai konjugaatteina. Virtsaan ja ulosteeseen tapahtuvan eliminaation suhde on 1,5: 1.
Vakaa tila
Vakaassa tilassa seerumin 3-keto-desogestreelipitoisuus kohoaa kaksin- tai kolminkertaiseksi.
Etinyyliestradioli
Imeytyminen
Etinyyliestradioli imeytyy nopeasti ja plasman huippupitoisuudet saavutetaan 1,5 tunnissa. Presysteemisen konjugaation ja alkureitin metabolian vuoksi absoluuttinen hyötyosuus on 60 %. AUC ja Cmax saattavat suurentua hieman ajan mittaan.
Jakautuminen
Etinyyliestradioli sitoutuu 98,8-prosenttisesti plasman proteiineihin, lähes yksinomaisesti albumiiniin.
Biotransformaatio
Etinyyliestradioli konjugoituu presysteemisesti sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradiolin suorat konjugaatit hydrolysoituvat suolistobakteerien vaikutuksesta etinyyliestradioliksi, joka voi imeytyä uudestaan, ja näin syntyy enterohepaattinen kierto. Etinyyliestradiolin ensisijainen metaboliareitti on CYP450-välitteinen hydroksylaatio, ja sen tärkeimmät metaboliitit ovat 2-OH-EE ja 2-metoksi-EE.
2-OH-EE metaboloituu edelleen kemiallisesti reaktiivisiksi metaboliiteiksi.
Eliminaatio
Etinyyliestradiolin eliminaation puoliintumisaika plasmasta on noin 29 tuntia (26–33 tuntia) ja plasmapuhdistuma 10–30 l/h. Etinyyliestradiolin konjugaatit ja metaboliitit erittyvät virtsaan ja ulosteeseen (suhteessa 1:1).
Vakaa tila
Vakaa tila saavutetaan 3–4 vuorokaudessa, ja seerumin lääkepitoisuus on tällöin noin 30–40 % korkeampi kuin kerta-annoksen jälkeen.
Prekliiniset tiedot turvallisuudesta
Toksikologisissa tutkimuksissa ei ole todettu muita kuin Daisynelle-tablettien hormonaalisen profiilin perusteella selittyviä vaikutuksia.
Farmaseuttiset tiedot
Apuaineet
Perunatärkkelys
Steariinihappo
All-rac-alfatokoferoli (E307)
Laktoosimonohydraatti
Povidoni
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Daisynelle 150 mikrog/20 mikrog tabletti: 30 kuukautta
Daisynelle 150 mikrog/30 mikrog tabletti: 3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DAISYNELLE tabletti
150/20 mikrog (L:kyllä) 3 x 21 fol (13,63 €)
150/30 mikrog (L:kyllä) 3 x 21 fol (19,68 €)
PF-selosteen tieto
21 tabletin PVC/Al-läpipainopakkaus, saatavilla 1 x 21, 3 x 21 ja 6 x 21 tablettia sisältävissä pakkauksissa. Jokainen läpipainopakkaus on pakattu alumiini/polyetyleeni pussiin.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen, kaksoiskupera pyöreä tabletti.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DAISYNELLE tabletti
150/20 mikrog 3 x 21 fol
150/30 mikrog 3 x 21 fol
- Ei korvausta.
ATC-koodi
G03AA09
Valmisteyhteenvedon muuttamispäivämäärä
05.11.2024
Yhteystiedot
Regus Graniittitalo, Jaakonkatu 3B, 7krs.
00100 Helsinki
Suomi
+358 45 159 2554
info@stragen.fi
