FOTIVDA kapseli, kova 890 mikrog, 1340 mikrog
Huomioitavaa
▼Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Fotivda 890 mikrogrammaa kova kapseli
Yksi kova kapseli sisältää tivotsanibihydrokloridimonohydraattia määrän, joka vastaa 890 mikrogrammaa tivotsanibia
Apuaineet, joiden vaikutus tunnetaan
Jokainen kova kapseli sisältää erittäin vähäisen määrän tartratsiinia (E102) (8–12 % keltaisen painomusteen koostumuksesta) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Fotivda 1340 mikrogrammaa kova kapseli
Yksi kova kapseli sisältää tivotsanibihydrokloridimonohydraattia määrän, joka vastaa 1340 mikrogrammaa tivotsanibia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli.
Kliiniset tiedot
Käyttöaiheet
Fotivda on tarkoitettu ensilinjan hoidoksi edennyttä munuaissolukarsinoomaa sairastaville aikuispotilaille sekä aikuispotilaille, joita ei ole ennen hoidettu VEGFR-ja mTOR-estäjillä, silloin kun sairaus on edennyt yhden aiemman sytokiineja sisältäneen, edenneen munuaissolukarsinooman hoitoon tarkoitetun hoidon jälkeen.
Ehto
Valmiste annetaan syövän lääkehoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Fotivda-hoito annetaan syövän lääkehoitoon perehtyneen lääkärin valvonnassa.
Annostus
Tivotsanibin suositusannos on 1340 mikrogrammaa kerran vuorokaudessa 21 vuorokauden ajan, minkä jälkeen on 7 vuorokauden hoitotauko. Tästä muodostuu yksi 4 viikon hoitosykli.
Tätä hoito-ohjelmaa jatketaan niin kauan kunnes sairaus etenee tai hoito joudutaan lopettamaan toksisuuden takia.
Fotivda-valmistetta saa ottaa enintään yhden annoksen vuorokaudessa.
Annoksen muuttaminen
Haittavaikutusten ilmeneminen voi edellyttää tivotsanibihoidon tilapäistä keskeyttämistä ja/tai annoksen pienentämistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Pivotaalitutkimuksessa annosta pienennettiin asteen 3 tapahtumien vuoksi ja hoito lopetettiin asteen 4 tapahtumien vuoksi.
Jos annosta on tarpeen pienentää, tivotsanibiannos voidaan pienentää 890 mikrogrammaan kerran vuorokaudessa noudatettaessa normaalia hoito-ohjelmaa (21 vuorokautta, jolloin annos otetaan, ja sen jälkeen 7 vuorokauden hoitotauko).
Unohtunut annos
Jos annos unohtuu, sitä ei pidä korvata toisella annoksella. Seuraava annos on otettava seuraavana hoito-ohjelman mukaisena ajankohtana.
Jos oksennat, toista annosta ei saa ottaa. Seuraava annos otetaan seuraavana hoito-ohjelman mukaisena ajankohtana.
Erityisryhmät
Pediatriset potilaat
Tivotsanibin turvallisuutta ja tehoa alle lasten ja alle 18–vuotiaiden nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla. Ei ole asianmukaista käyttää tivotsanibia pediatristen potilaiden munuaissolukarsinooman hoitoon.
Iäkkäät
Annosta ei tarvitse muuttaa 65-vuotiaille tai sitä vanhemmille potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa lievää tai kohtalaista munuaisten vajaatoimintaa sairastaville potilaille (ks. kohta Farmakokinetiikka). Potilaille, joilla on vaikea munuaisten vajaatoiminta, valmistetta on vähäisen kokemuksen vuoksi käytettävä varoen. Valmistetta on käytettävä varoen myös dialyysihoitoa saaville potilaille, sillä tivotsanibin käytöstä tälle potilasryhmälle ei ole kokemusta.
Maksan vajaatoiminta
Ennen tivotsanibihoidon aloittamista ja sen kuluessa kaikille potilaille on tehtävä maksan toimintakokeet (mukaan lukien aminotransferaasi (ALAT), aspartaattiaminotransferaasi (ASAT), bilirubiini ja alkalinen fosfataasi) maksan toiminnan arvioimiseksi.
Tivotsanibia ei suositella potilaille, joilla on vaikea maksan vajaatoiminta. Kohtalaista maksan vajaatoimintaa sairastaville potilaille saa antaa vain yhden 1340 mikrogramman kapselin tivotsanibia joka toinen vuorokausi, sillä käytettäessä 1340 mikrogramman annosta päivittäin haittavaikutusten riski voi olla suurentunut annoksen aiheuttaman lisääntyneen altistuksen vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja kohta Farmakokinetiikka). Annosta ei tarvitse muuttaa annettaessa tivotsanibia potilaille, joilla on lievä maksan vajaatoiminta. Potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta, tivotsanibia on käytettävä varoen ja sen siedettävyyttä on seurattava tarkoin.
Antotapa
Fotivda otetaan suun kautta.
Fotivda voidaan ottaa aterian yhteydessä tai tyhjään vatsaan (ks. kohta Farmakokinetiikka). Kapselit pitää niellä kokonaisina veden kera. Kapseleita ei saa avata.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Samanaikainen anto mäkikuismaa (Hypericum perforatum) sisältävien rohdosvalmisteiden kanssa (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Hypertensio
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on ilmennyt hypertensiota (mukaan lukien jatkuva vaikea hypertensio) (ks. kohta Haittavaikutukset). Noin yhdelle kolmasosalle potilaista kehittyi hypertensio ensimmäisten 2 hoitokuukauden aikana. Verenpaineen pitää olla hyvin hoitotasapainossa ennen tivotsanibihoidon aloittamista. Hoidon aikana potilaita on tarkkailtava hypertension varalta ja tarvittaessa hoidettava verenpainelääkkeillä tavanomaisen käytännön mukaisesti. Jos hypertensio hoidosta huolimatta jatkuu, tivotsanibiannosta on kliinisen arvion mukaan joko pienennettävä tai hoito on keskeytettävä ja aloitettava uudelleen pienemmällä annoksella kun verenpaine on saatu hallintaan (ks. kohta Annostus ja antotapa). Hoidon keskeyttämistä on harkittava, jos potilaalla on jatkuva vaikea hypertensio, posteriorinen korjautuva enkefalopatiaoireyhtymä (ks. jäljessä) tai muita verenpaineen komplikaatioita. Verenpainelääkkeitä käyttävien potilaiden tilaa pitää tarkkailla hypotension varalta silloin, kun tivotsanibihoito keskeytetään tai lopetetaan.
Valtimoiden tromboemboliatapahtumat
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on esiintynyt valtimoiden tromboemboliatapahtumia (ks. kohta Haittavaikutukset). Valtimoiden tromboembolioiden riskitekijöitä ovat mm. syöpätauti, yli 65 vuoden ikä, hypertensio, diabetes mellitus, tupakointi, hyperkolesterolinemia ja aiempi tromboembolinen sairaus. Tivotsanibia ei ole tutkittu potilailla, joilla on ollut valtimon tromboembolia kliinisen tutkimuksen aloittamista edeltäneiden 6 kuukauden aikana. Tivotsanibia on käytettävä varoen potilaille, joilla on näiden tapahtumien (esimerkiksi sydänkohtauksen, aivohalvauksen) riski tai joita niitä on ilmennyt aiemmin.
Laskimoiden tromboemboliatapahtumat
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu laskimoiden tromboemboliatapahtumia (VTE), mukaan lukien keuhkoembolia ja syvä laskimotulehdus (ks. kohta Haittavaikutukset). Laskimoiden tromboembolioiden riskitekijöitä ovat mm. suuri leikkaus, useat traumat, aiemmat laskimotromboemboliat, korkea ikä, liikalihavuus, sydämen tai hengityselinten vajaatoiminta ja pitkittynyt liikkumattomuus. Tivotsanibia ei ole tutkittu potilailla, joilla ilmeni laskimotromboembolia kliinisen tutkimuksen aloittamista edeltäneiden 6 kuukauden aikana. Hoitopäätöksen on perustuttava jokaisen potilaan kohdalla yksilölliseen hyöty/riskiarviointiin, etenkin potilailla, joilla on laskimotromboemboliariski.
Sydämen vajaatoiminta
Kliinisissä tutkimuksissa, joissa tivotsanibia käytettiin monoterapiana munuaissolukarsinoomaa sairastaville potilaille, on raportoitu sydämen vajaatoimintaa (ks. kohta Haittavaikutukset). Sydämen vajaatoiminnan löydöksiä ja oireita on seurattava säännöllisesti koko tivotsanibihoidon ajan. Sydämen vajaatoiminnan hoito saattaa edellyttää tivotsanibihoidon keskeyttämistä tilapäisesti tai pysyvästi ja/tai tivotsanibiannoksen pienentämistä sekä sydämen vajaatoiminnan mahdollisten taustasyiden, esim. verenpaineen, hoitoa.
Verenvuoto
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu verenvuototapahtumia (ks. kohta Haittavaikutukset). Tivotsanibia on käytettävä varoen potilaille, joilla on verenvuodon riski tai aiempaa verenvuotoa. Jos verenvuoto vaatii lääketieteellisiä toimenpiteitä, tivotsanibihoito on keskeytettävä tilapäisesti.
Proteinuria
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu proteinuriaa (ks. kohta Haittavaikutukset). Potilaan tilan tarkkailu proteinurian varalta ennen hoidon aloittamista ja säännöllisin väliajoin koko hoidon ajan on suositeltavaa. Potilailla, joille kehittyy asteen 2 (> 1,0-3,4 g/24 tuntia) tai asteen 3 (≥ 3,5 g/24 tuntia) proteinuria (luokituksena National Cancer Institute Common Terminology Criteria for Adverse Events [NCI CTCAE]), tivotsanibiannosta on pienennettävä tai hoito on keskeytettävä tilapäisesti. Jos potilaalle kehittyy asteen 4 proteinuria (nefroottinen oireyhtymä), tivotsanibihoito on lopetettava. Proteinurian riskitekijöihin kuuluu korkea verenpaine.
Maksatoksisuus
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa raportoitiin ALAT-, ASAT- ja bilirubiiniarvojen suurenemista (ks. kohta Haittavaikutukset). Suurimpaan osaan ASAT- ja ALAT-arvojen suurenemisista ei liittynyt bilirubiiniarvon samanaikaista nousua. ASAT-, ALAT-, bilirubiini- ja alkalinen fosfataasi –arvoja on tarkkailtava ennen tivotsanibihoidon aloittamista ja säännöllisin väliajoin tivotsanibihoidon ajan mahdollisen maksatoksisuuden riskin vuoksi (ks. kohta Annostus ja antotapa).
Tivotsanibia ei suositella potilaille, joilla on vaikea maksan vajaatoiminta. Kohtalaista maksan vajaatoimintaa sairastaville potilaille saa antaa vain yhden 1340 mikrogramman kapselin tivotsanibia joka toinen vuorokausi, sillä käytettäessä 1340 mikrogramman annosta päivittäin haittavaikutusten riski voi olla suurentunut annoksen aiheuttaman lisääntyneen altistuksen vuoksi (ks. kohta Farmakokinetiikka). Annosta ei tarvitse muuttaa annettaessa tivotsanibia potilaille, joilla on lievä maksan vajaatoiminta. Potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta, tivotsanibia on käytettävä varoen ja sen siedettävyyttä on seurattava tarkoin.
Posteriorinen korjautuva enkefalopatiaoireyhtymä
Kliinisissä tutkimuksissa todettiin yksi posteriorisen korjautuvan enkefalopatiaoireyhtymän tapaus tivotsanibihoidon jälkeen (ks. kohta Haittavaikutukset). Posteriorinen korjautuva enkefalopatiaoireyhtymä on neurologinen sairaus, jonka yhteydessä voi esiintyä päänsärkyä, kouristuskohtauksia, letargiaa, sekavuutta, sokeutta sekä muita näköaistiin liittyviä ja neurologisia häiriöitä. Posteriorinen korjautuva enkefalopatiaoireyhtymä-diagnoosi on varmistettava magneettikuvauksella. Jos potilaalla on posteriorisen korjautuvan enkefalopatiaoireyhtymän löydöksiä tai oireita, tivotsanibihoito on keskeytettävä tilapäisesti. Tivotsanibihoidon turvallisuutta potilailla, joilla on aiemmin ollut posteriorinen korjautuva enkefalopatiaoireyhtymä, ei tunneta, ja näillä potilailla tivotsanibia saa käyttää vain varovaisuutta noudattaen.
Käsi-jalka-oireyhtymä
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu käsi-jalka-oireyhtymää (palmaaris-plantaarista erytrodysestesiaa). Tutkimuksissa, joissa munuaissolukarsinoomaa hoidettiin monoterapialla, useimmat havaitut tapahtumat olivat CTC-asteen 1 tai 2 tapahtumia (≥ CTC-aste 3 havaittiin < 2 %:lla tivotsanibihoitoa saaneista potilaista) eikä vakavia tapahtumia ollut (ks. kohta Haittavaikutukset) . Käsi-jalka-oireyhtymäpotilaita voidaan hoitaa mm. paikallisesti oireita lievittävillä hoidoilla. Lisäksi hoidon keskeyttämistä tilapäisesti ja/tai hoitoannoksen pienentämistä voidaan harkita, samoin kuin vakavissa tai itsepintaisissa tapauksissa hoidon lopettamista pysyvästi.
QT-ajan piteneminen
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu QT/QTc-ajan pitenemistä (ks. kohta Haittavaikutukset ja kohta Farmakodynamiikka). QT/QTc-ajan piteneminen voi johtaa kammioiden rytmihäiriöriskin suurenemiseen. On suositeltavaa käyttää tivotsanibia varoen potilaille, joiden anamneesissa on QT-ajan piteneminen tai joilla on jokin olemassa oleva relevantti sydänsairaus, sekä potilaille, jotka saavat muita lääkkeitä, joiden tiedetään pidentävän QT-aikaa. On suositeltavaa tarkkailla lähtötilanteessa ja säännöllisin väliajoin, että EKG- ja elektrolyyttiarvot (esim. kalsium, magnesium, kalium) pysyvät normaalien rajojen sisällä.
Ruoansulatuskanavan perforaatio/fisteli
On suositeltavaa, että ruoansulatuskanavan perforaatioihin tai fistelien oireita tarkkaillaan säännöllisin väliajoin koko tivotsanibihoidon ajan. Tivotsanibia on käytettävä varoen potilaille, joilla on ruoansulatuskanavan perforaation tai fistelin riski.
Haavan paranemiseen liittyvät komplikaatiot
Varotoimenpiteenä tivotsanibihoito on suositeltavaa lopettaa tilapäisesti ennen potilaalle tehtävää suurta leikkausta. Tivotsanibihoidon jatkamisesta leikkauksen jälkeen on päätettävä haavan riittävästä parantumisesta tehdyn kliinisen arvion perusteella.
Kilpirauhasen vajaatoiminta (hypotyreoosi)
Tivotsanibilla tehdyissä kliinisissä tutkimuksissa on raportoitu kilpirauhasen vajaatoimintaa (ks. kohta Haittavaikutukset). Kilpirauhasen vajaatoimintaa on havaittu ilmenevän milloin tahansa tivotsanibihoidon aikana, aikaisintaan jo kahden kuukauden kuluttua hoidon aloittamisesta. Kilpirauhasen vajaatoiminnan riskitekijöitä ovat mm. aiempi kilpirauhasen vajaatoiminta ja kilpirauhasen toimintaa estävien lääkkeiden käyttö. Kilpirauhasen toiminta on tarkistettava ennen tivotsanibihoidon aloittamista ja säännöllisin väliajoin sen aikana. Kilpirauhasen vajaatoimintaa hoidetaan tavanomaisen hoitokäytännön mukaisesti.
Iäkkäät
Dysfoniaa, ripulia, uupumusta, painon laskua, ruokahalun vähenemistä ja kilpirauhasen vajaatoimintaa esiintyi yleisemmin ≥ 65-vuoden ikäisillä potilailla. Terveydenhuollon ammattilaisten on muistettava, että iäkkäillä potilailla haittavaikutusten riski voi olla suurentunut.
Tartratsiini
Fotivda 890 mikrogramman kovat kapselit sisältävät tartratsiinia (E102), joka voi aiheuttaa allergisia reaktioita.
Aneurysmat ja valtimon dissekaatiot
VEGF-reitin estäjien käyttö potilailla, joilla on kohonnut verenpaine tai joilla ei ole kohonnutta verenpainetta, saattaa edistää aneurysmien ja/tai valtimon dissekaatioiden muodostumista. Tämä riski on arvioitava tarkoin ennen Fotivda -hoidon aloittamista potilaille, joilla on riskitekijöitä, kuten kohonnut verenpaine tai aikaisempi aneurysma.
Yhteisvaikutukset
Samanaikaisen käytön vasta-aiheisuus
Mäkikuismaa (Hypericum perforatum) sisältävät rohdosvalmisteet ovat vasta-aiheisia. Jos potilas käyttää mäkikuismavalmistetta, sen käyttö on lopetettava ennen tivotsanibihoidon aloittamista. Mäkikuisman indusoiva vaikutus voi jatkua ainakin 2 viikon ajan mäkikuismahoidon lopettamisen jälkeen (ks. kohta Vasta-aiheet).
Voimakkaat CYP3A4:n estäjät
Terveillä vapaaehtoisilla tehdyssä kliinisessä tutkimuksessa 1340 mikrogramman tivotsanibikerta -annoksen antaminen voimakkaan CYP3A4 induktorin kanssa vakaassa tilassa (rifampiini 600 mg kerran vuorokaudessa) lyhensi tivotsanibin keskimääräistä puoliintumisaikaa 121 tunnista 54 tuntiin, mikä liitettiin kerta-annoksen AUC0-∞ -arvon laskuun 48 %lla verrattuna AUC0-∞ -arvoon silloin, kun rifampisiinia ei käytetä. Tämä ei vaikuttanut merkittävästi keskimääräisiin Cmax- ja AUC0-24hr -arvoihin (8 %:n nousu ja vastaavasti 6 %:n lasku). Voimakkaiden CYP3A4:n induktorien kliinisiä vaikutuksia tivotsanibin toistuvaan päivittäiseen antoon ei ole tutkittu, mutta mahdollisesti tivotsanibin vakaan tilan saavuttamiseen kuluva keskimääräinen aika ja keskimääräinen vakaan tilan pitoisuus seerumissa voivat pienentyä puoliintumisajan lyhenemisen vuoksi. On suositeltavaa, että mahdollisessa tivotsanibin samanaikaisessa annossa voimakkaiden CYP3A4:n induktorien kanssa noudatetaan varovaisuutta.
Kohtalaisilla CYP3A4:n induktoreilla ei odoteta olevan kliinisesti merkittävää vaikutusta tivotsanibin altistukseen.
CYP3A4-estäjät
Terveillä vapaaehtoisilla tehdyssä kliinisessä tutkimuksessa tivotsanibin samanaikainen anto voimakkaan CYP3A4-estäjän, ketokonatsolin (400 mg kerran vuorokaudessa), kanssa, ei vaikuttanut tivotsanibin pitoisuuksiin seerumissa (Cmax tai AUC); tästä voidaan päätellä, että CYP3A4-estäjät eivät todennäköisesti muuta tivotsanibin altistusta.
Lääkevalmisteet, joiden suolistoon imeytymistä rajoittaa BCRP-proteiini
Tivotsanibi estää BCRP-kuljetusproteiinia in vitro, mutta tämän löydöksen kliinistä merkitystä ei tunneta (ks. kohta Farmakokinetiikka). Varovaisuutta on noudatettava, jos tivotsanibia annetaan samanaikaisesti rosuvastatiinin kanssa. Vaihtoehtoisesti on harkittava sellaista statiinia, johon suolistoon imeytymistä rajoittava BCRP-proteiini ei vaikuta. Potilaiden, jotka käyttävät sellaista suun kautta otettavaa BCRP:n substraattia, jolla on kliinisesti merkityksellinen effluksiyhteisvaikutus suolistossa, on varmistettava, että tivotsanibin ja BCRP:n substraatin antamisen väliin jää sopiva aikaikkuna (esim. 2 tuntia).
Raskauden ehkäisy
Tällä hetkellä ei tiedetä, vähentääkö tivotsanibi mahdollisesti hormonaalisten ehkäisyvalmisteiden tehoa, minkä vuoksi hormonaalisia ehkäisyvalmisteita käyttävien naisten on lisäksi syytä käyttää jotakin estemenetelmää (ks. kohta Raskaus ja imetys).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy miehillä ja naisilla
Naisten, jotka voivat tulla raskaaksi, on vältettävä raskaaksi tuloa tivotsanibihoidon aikana. Myös tivotsanibihoitoa saavien miespotilaiden kumppanien on vältettävä raskaaksi tuloa. Mies- ja naispotilaiden ja heidän kumppaniensa on käytettävä luotettavia ehkäisymenetelmiä hoidon aikana ja vähintään yhden kuukauden ajan hoidon päättymisen jälkeen. Tällä hetkellä ei tiedetä, vähentääkö tivotsanibi mahdollisesti hormonaalisten ehkäisyvalmisteiden tehoa, minkä vuoksi hormonaalisia ehkäisyvalmisteita käyttävien naisten on lisäksi syytä käyttää jotakin estemenetelmää.
Raskaus
Ei ole olemassa tietoja tivotsanibin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu eläintoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Tivotsanibia ei pidä käyttää raskauden aikana. Jos tivotsanibia käytetään raskauden aikana tai jos potilas tulee raskaaksi tivotsanibihoitoa saadessaan, potilaalle on selitettävä mahdollinen sikiöön kohdistuva riski.
Imetys
Ei tiedetä, erittyykö tivotsanibi ihmisen rintamaitoon, mutta se mahdollisuus on olemassa. Rintaruokittuihin imeväisiin kohdistuvan tivotsanibin välittämien haittavaikutusten riskin vuoksi naisten ei pidä imettää tivotsanibihoitoa saadessaan.
Hedelmällisyys
Eläinkokeet osoittava, että tivotsanibihoito voi vaikuttaa miesten ja naisten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tivotsanibilla saattaa olla vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn. Potilaita on neuvottava olemaan varovaisia autoa ajaessaan tai koneita käyttäessään, jos he havaitsevat tivotsanibihoidon aikana voimattomuutta, uupumusta ja/tai heitehuimausta (ks. kohta Haittavaikutukset).
Haittavaikutukset
Yhteenveto turvallisuustiedoista
Yhdistetyt tiedot 674 potilaasta, joilla oli edennyt munuaissolukarsinooma ja jotka jatkoivat tivotsanibihoidossa tivotsanibin ollessa heidän aloitushoitonsa tässä lääketutkimuksessa, on arvioitu tivotsanibin turvallisuuden ja siedettävyyden yleisarviossa. Yhdistetyt tiedot on saatu viidestä keskeisestä tutkimuksesta, joissa munuaissolukarsinoomaa hoidettiin monoterapialla.
Merkittävin vakava haittavaikutus on hypertensio.
Yleisimpiä haittavaikutuksia kaikissa vaikeusasteissa ovat hypertensio (47,6 %), dysfonia (26,9 %), uupumus (25,8 %) ja ripuli (25,5 %).
Viidessä keskeisessä tutkimuksessa, joissa munuaissolukarsinoomaa hoidettiin monoterapialla, tivotsanibihoito lopetettiin haittavaikutusten vuoksi kaikkiaan 20 potilaalla (3 %). Näistä haittavaikutuksista yleisimmät olivat hypertensio (0,4 %), jatkuva vaikea hypertensio (0,3 %) tai akuutti sydäninfarkti (0,3 %). Yleisimmät tivotsanibiannoksen pienentämiseen / hoidon keskeyttämiseen johtaneet haittavaikutukset olivat hypertensio (4,7 %), ripuli (3,1 %), uupumus (1,8 %).
Tivotsanibia aloitushoitona saaneilla potilailla ilmeni kolme kuolemaan johtanutta haittavaikutusta, joista yksi oli hallitsematon hypertensio epäillyn yliannostuksen yhteydessä (ks. kohta Yliannostus) ja kaksi raportoitiin vain kuolemiksi.
Haittavaikutustaulukko
Potilailla esiintyneet haittavaikutukset yhdistettiin ja on lueteltu jäljessä MedDRA-elinjärjestelmäluokituksen (SOC) ja yleisyyden mukaan. Nämä potilaat jatkoivat tivotsanibihoidossa sen ollessa heidän aloitushoitonsa viidessä tutkimuksessa, joissa munuaissolukarsinoomaa hoidettiin monoterapialla. Yleisyydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) . Haittavaikutukset on esitetty kussakin elinjärjestelmäluokassa vakavimmasta lähtien.
Taulukko 1: Haittavaikutustaulukko (esitetty käyttäen kaikkiin eri syihin liittyviä haittavaikutuksia)
| Elinjärjestelmä | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Tuntematon |
| Infektiot |
| Sieni-infektio Märkärakkulainen ihottuma | |||
| Veri ja imukudos | Anemia | Trombosytopenia Hemoglobiiniarvon nousu | |||
| Umpieritys | Hypotyreoosi | Hypertyreoosi Struuma1 | |||
| Aineenvaihdunta ja ravitsemus | Ruokahalun väheneminen | Ruokahaluttomuus | |||
| Psyykkiset häiriöt | Unettomuus | ||||
| Hermosto | Pääsnsärky | Perifeerinen neuropatia2 Heitehuimaus Dysgeusia3 | Ohimenevä aivoverenkierto-häiriö (TIA) Muistin heikkeneminen4 | Posteriorinen korjautuva enkefalopatia-oireyhtymä (PRES)5 | |
| Silmät | Näön heikkeneminen6 | Lisääntynyt kyynelnesteen eritys | |||
| Kuulo ja tasapainoelin | Huimaus Tinnitus | Korvien tukkoisuus | |||
| Sydän | Sydäninfarkti (akuutti) / iskemia7 Angina pectoris Takykardia8 | Keuhkopöhö Sepelvaltimotauti QT-ajan piteneminen EKG:ssa | |||
| Verisuonisto | Hypertensio | Verenvuoto9 Valtimo-tromboembolia10 Laskimo-tromboembolia11 Pysyvä vaikea hypertensio12 Punoitus13 | Aneurysmat ja valtimon dissekaatiot | ||
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus14 Dysfonia Yskä | Nenäverenvuoto Rinorrea Nenän tukkoisuus | |||
| Ruoansulatuselimistö | Vatsakipu15 Pahoinvointi Ripuli Suutulehdus16 | Haimatulehdus17 Dysfagia18 Oksentelu Ruokatorven refluksitauti Vatsan pingotus Kielitulehdus19 Ientulehdus20 Dyspepsia Ummetus Suun kuivuminen Ilmavaivat | Pohjukaissuoli-haava | ||
| Maksa ja sappi | ALAT-arvon suureneminen / ASAT-arvon suureneminen21 Gamma-glutamyylitransferaasi-arvon suureneminen Veren alkalisen fosfataasin arvon suureneminen | ||||
| Iho ja ihonalainen kudos | Palmaaris-plantaarinen erytrodysestesia / käsi-jalkaoireyhtymä (PPE/HFS) | Ihon hilseily Eryteema22 Kutina23 Alopesia Ihottuma24 Akne25 Ihon kuivuminen | Urtikaria Dermatiitti26 Hyperhidroosi Kseroderma | ||
| Luusto, lihakset ja sidekudos | Selkäkipu | Nivelkipu Lihaskipu Lihaksiin ja luustoon liittyvä rintakipu | Lihasheikkous | ||
| Munuaiset ja virtsatiet | Proteinuria Veren kreatiiniiniarvon nouseminen | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Kipu27 Voimattomuus Uupumus | Rintakipu28 Vilunväristykset29 Kuume Periferaalinen ödeema | Limakalvo-tulehdus | ||
| Tutkimukset | Painon lasku | Amylaasiarvon suureneminen Lipaasiarvon suureneminen Veren kilpirauhasta stimuloivan hormonin suureneminen |
Kliinisistä tutkimuksista peräisin olevat haittavaikutukset on esitetty käyttäen kaikkiin eri syihin liittyviä haittavaikutuksia.
Seuraavat termit on yhdistetty yhdeksi termiksi:
- Struuma mukaan lukien struuma ja toksinen nodulaarinen struuma
- Perifeerinen neuropatia (mukaan lukien hyperestesia, hypestesia, mononeuropatia, periferaalinen sensoraalinen neuropatia ja parestesia)
- Dysgeusia mukaan lukien ageusia, dysgeusia ja hypogeusia
- Muistin heikkeneminen mukaan lukien amnesia ja muistin heikkeneminen
- Posteriorista korjautuvaa enkefalopatiaoireyhtymää (PRES) ei havaittu potilailla, joita hoidettiin tivotsanibilla viidessä munuaissolukarsinoomaa koskeneessa monoterapiatutkimuksessa. AV-951-09-901-tutkimuksessa yhdellä potilaalla ilmeni asteen 4 PRES ja hypertensiota.
- Näön heikkeneminen (mukaan lukien näöntarkkuuden heikkeneminen, näön hämärtyminen ja näkökyvyn heikkeneminen
- Sydäninfarkti (akuutti) / iskemia mukaan lukien akuutti sydäninfarkti, iskemia ja sydäninfarkti
- Takykardia mukaan lukien sinustakykardia, supraventrikulaarinen takykardia, takykardia ja paroksysmaalinen takykardia
- Verenvuodot mukaan lukien lisämunuaisverenvuoto, peräaukon verenvuoto, kohdunkaulan verenvuoto, pohjukaissuolihaavan verenvuoto, ienverenvuoto, hematemeesi, hemoptyysi, verenvuotoinen anemia, verenvuotoinen erosiivinen gastriitti, verenvuotoinen aivohalvaus, suun verenvuoto, keuhkoverenvuoto ja hengitysteiden verenvuoto.
- Valtimotromboembolia mukaan lukien akuutti sydäninfarkti, valtimotromboosi, lonkkavaltimon tukos, aivoverenkiertohäiriö, sydäninfarkti ja ohimenevä aivoverenkiertohäiriö
- Laskimotromboembolia mukaan lukien syvä laskimotulehdus, laskimoembolia ja keuhkoembolia
- Pysyvä vaikea hypertensio mukaan lukien hypertensiivinen kriisi
- Punoitus mukaan lukien punoitus ja kuumat aallot
- Hengenahdistus mukaan lukien hengenahdistus ja rasituksessa ilmenevä hengenahdistus
- Vatsakipu mukaan lukien vatsavaivat, vatsakipu, alavatsakipu, ylävatsakipu ja vatsanpeitteiden jäykkyys
- Suutulehdus mukaan lukien suun vaivat, suusairaus ja suutulehdus
- Haimatulehdus mukaan lukien haimatulehdus ja akuutti haimatulehdus
- Suutulehdus mukaan lukien suun vaivat, suusairaus ja suutulehdus
- Kielitulehdus mukaan lukien kielitulehdus ja kielikipu
- Ientulehdus mukaan lukien ienverenvuoto, iensairaus, ienkipu ja ientulehdus
- Alaniiniaminotransferaasi- (ALAT)-arvon suureneminen / aspartaattiaminotransferaasi (ASAT) -arvon suureneminen mukaan lukien ALAT-arvon suureneminen ja ASAT-arvon suureneminen
- Eryteema mukaan lukien eryteema,yleistynyt eryteema ja palmaarinen eryteema
- Kutina mukaan lukien yleistynyt kutina ja kutina
- Ihottuma mukaan lukien ihottuma, punoittava ihottuma, yleistynyt ihottuma, makulopapulaarinen ihottuma, papulaarinen ihottuma ja kutiava ihottuma
- Akne mukaan lukien akne ja aknetyyppinen dermatiitti
- Dermatiitti mukaan lukien dermatiitti ja rakkulainen dermatiitti
- Rintakipu mukaan lukien rintakipu ja muu kuin sydänperäinen rintakipu
- Kipu mukaan lukien luustokipu, syöpäkipu, kylkikipu, nivuskipu, suukipu, kipu, raajakipu ja kasvainkipu
- Vilunväristykset mukaan lukien vilunväristykset ja hypotermia
Valikoitujen haittavaikutusten kuvaus
Hypertensio
Hypertensiota raportoitiin haittavaikutuksena 47,6 %:lla tivotsanibia aloitushoitona saaneista potilaista, joista 23,0 %:lla hypertension vaikeusaste on CTC-luokituksen mukaan ≥ aste 3. Pysyvä vaikea hypertensio (”hypertensiivinen kriisi”) ilmoitettiin haittavaikutuksena 1,0 %:lla, joista 0,9 %:lla CTC-aste oli 3 tai vaikeampi. Yksi potilas kuoli hallitsemattoman hypertension vuoksi epäillyn yliannostuksen yhteydessä.
Posteriorinen korjautuva enkefalopatiaoireyhtymä
Posteriorinen leukoenkefalopatiaoireyhtymä vahvistettiin yhdellä potilaalla, jolla ei ollut munuaissolukarsinoomaa, noin 8 viikon tivotsanibihoidon jälkeen. Posteriorinen korjautuva enkefalopatiaoireyhtymä on neurologinen sairaus, jonka oireita voivat olla päänsärky, kouristukset, letargia, sekavuus, sokeus ja muut näkö- ja neurologiset häiriöt. Lievää, kohtalaista tai vaikeaa hypertensiota voi esiintyä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Laskimotromboembolia
Viidessä keskeisessä tutkimuksessa, joissa munuaiskarsinoomaa hoidettiin monoterapialla, tivotsanibia aloitushoitona saaneilla potilailla raportoitiin keuhkoembolia (0,7 %), jonka CTC-aste useimmilla oli ≥ 3 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Myös syvä laskimotulehdus (CTC-aste ≥ 3) raportoitiin kahdella tivotsanibia aloitushoitona saaneella potilaalla (0,3 %) joista yhdellä potilaalla (0,1 %) se oli CTC-asteeltaan ≥ 3.
Valtimoiden tromboemboliset tapahtumat
Valtimoiden tromboembolisia haittatapahtumia tivotsanibia aloitushoitona saaneilla potilailla olivat iskeeminen aivohalvaus (1,0 %), sydäninfarkti (0,7 %), ohimenevä aivoverenkiertohäiriö (0,7 %) ja akuutti sydäninfarkti (0,4 %), joista useimpien vaikeusaste oli vähintään CTC-aste 3, sekä lonkkavaltimon tromboosi (0,1 %). Tivotsanibia aloitushoitona saaneilla ei esiintynyt haittatapahtumista johtuneita kuolemantapauksia, mutta yhdellä tivotsanibia toisen linjan hoitona saaneella potilaalla sydäninfarkti johti kuolemaan.
Sydämen vajaatoiminta
Munuaissolukarsinoomaa sairastavilla potilailla tehdyissä viidessä keskeisessä monoterapiatutkimuksessa kahdella tivotsanibia aloitushoitona saaneella potilaalla (0,3 %) raportoitiin keuhkoembolia. Molemmat tapahtumat olivat CTC-asteen 3 tapahtumia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
QT/QT-ajan piteneminen
Tutkimuksessa, jossa selvitettiin tivotsanibin turvallisuutta sydämelle, QT-ajan pitenemistä raportoitiin kahdella potilaalla (CTC-aste 2 ja aste 3); kumpaakaan näistä reaktiosta ei arvioitu vakavaksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja kohta Farmakodynamiikka).
Kilpirauhasen vajaatoiminta
Kilpirauhasen vajaatoiminta raportoitiin haittavaikutuksena 5,6 %:lla potilaista aloitushoidon aikana, ja kaikissa tapauksissa sen vaikeusaste oli CTC-aste 2 tai pienempi. Yhdellä potilaalla sen raportoitiin olevan vakava.
Verenvuoto
Keskeisissä monoterapiatutkimuksissa raportoitiin verenvuotoon liittyneitä haittavaikutuksia aloitushoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kaksi potilasta sai liian suuria tivotsanibiannoksia monoterapiatutkimusten aikana. Potilaalle, jolla oli aiemmin ollut hypertensiota, kehittyi pahentunut hallitsematon hypertensio, joka johti kuolemaan sen jälkeen, kun potilas oli ottanut 1340 mikrogramman tivotsanibiannoksen 3 kertaa yhden päivän aikana (yhteensä 4020 mikrogrammaa). Toisella potilaalla, joka otti 1340 mikrogramman tivotsanibiannoksen 2 kertaa yhden päivän aikana (yhteensä 2680 mikrogrammaa), ei ilmennyt mitään haittavaikutuksia.
Ennen tivotsanibihoidon aloittamista verenpaineen on oltava hyvin hallinnassa. Potilaita on tarkkailtava hypertension varalta hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos epäillään yliannostusta, tivotsanibihoito on lopetettava ja potilaan tilaa tarkkailtava hypertension varalta sekä hoidettava tarvittaessa tavanomaisella verenpainelääkityksellä.
Tivotsanibin yliannostukseen ei ole spesifistä hoitoa eikä vastalääkettä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset lääkeaineet, proteiinikinaasin estäjät, ATC-koodi:
L01EK03
Vaikutusmekanismi
Tivotsanibi on kaikkien kolmen endoteelikasvutekijäreseptorin (VEGFR) voimakas ja selektiivinen estäjä. Sen on osoitettu estävän VEGF-tekijöiden indusoimia eri biokemiallisia ja biologisia vasteita in vitro, mukaan lukien VEGF-ligandin indusoiman VEGFR 1-, 2- ja 3-reseptorin fosforylaatiota ja ihmisen endoteelisolujen proliferaatiota. Seuraava erittäin voimakkaasti estetty kinaasi on c -kit, joka on 8-kertaisesti vähemmän herkkä tivotsanibin aiheuttamalle estolle verrattuna VEGFR 1-, 2- ja 3-reseptoreihin. VEGF on voimakas mitogeeninen tekijä, jolla on keskeinen rooli angiogeneesissä ja kasvainkudosten verisuonten läpäisevyydessä. Estämällä VEGF-tekijöiden indusoiman VEGFR-reseptorin aktivoitumisen, tivotsanibi estää angiogeneesiä ja verisuonten läpäisevyyttä kasvainkudoksissa, johtaen kasvainten kasvun estymiseen in vivo.
Kliininen teho
Tivotsanibin tehoa edenneen munuaissolukarsinooman hoidossa tutkittiin seuraavassa satunnaistetussa kliinisessä tutkimuksessa.
Tutkimus AV-951-09-301
Tämä kontrolloitu kliininen tutkimus oli faasin 3 avoin, kansainvälinen, satunnaistettu monikeskustutkimus, jossa vertailtiin tivotsanibia ja sorafenibiä edennyttä munuaissolukarsinoomaa sairastavilla potilailla. Viisisataaseitsemäntoista (517) potilasta, joilla oli uusiutuva tai metastasoitunut munuaissolukarsinooma, jossa oli kirkassolukomponentti, satunnaistettiin (1:1) saamaan joko 1340 mikrogrammaa tivotsanibia kerran vuorokaudessa hoito-ohjelmassa, johon kuuluu 3 viikkoa hoitoa ja sen jälkeen 1 viikon hoitotauko (ohjelma 3/1) tai 400 mg sorafenibiä kahdesti vuorokaudessa. Tutkimukseen otettiin potilaita, joille oli kaikille aiemmin tehty nefrektomia, ja jotka eivät joko olleet saaneet mitään aiempaa hoitoa tai korkeintaan yhtä aiempaa systeemistä hoitoa metastaasien yhteydessä (immunoterapia/kemoterapia); aiempaa hoitoa VEGF:illä tai mekanismiin perustuvaa Target of Rapamycin (mTOR) –täsmähoitoa ei saanut olla anamneesissa. Sorafenibihoitoa saaneille sallittiin erillisen jatkotutkimuksen tutkimussuunnitelman mukaisesti siirtyminen tivotsanibihaaraan taudin edettyä Response Evaluation Criteria In Solid Tumours (RECIST) –kriteerien mukaisesti.
Tutkimuksen ensisijainen päätetapahtuma oli taudin etenemisestä vapaa elinaika (progression-free survival, PFS) sokkoutettua riippumatonta radiologista tarkastelua käyttäen; tärkeimmät toissijaiset päätetapahtumat olivat kokonaiselinaika (overall survival, OS) ja objektiivisen hoitovasteen saaneiden potilaiden osuus ( objective response rate, ORR) riippumatonta radiologista tarkastelua käyttäen.
Intent-to-treat (ITT) –väestöön kuului 517 potilasta, joista 260 oli satunnaistettu saamaan tivotsanibia ja 257 saamaan sorafenibia. Lähtötilanteen demografiset ja sairauteen liittyvät tiedot olivat yleisesti hyvin tasapainossa tivotsanibi- ja sorafenibihaarojen kesken eri ominaisuuksien suhteen: ikä (keski-ikä 58,2 vs. 58,4 vuotta), sukupuoli (miehiä 71,2 % vs. 73,5%), rotu (valkoisia 95,8 % vs. 96,9 %), maantieteellinen alue (Keski-/Itä-Euroopasta 88,1 % vs. 88,7 %) ja metastasoituneen munuaissolukarsinooman aiempi hoito (hoitoa aiemmin saamattomat 69,6 % vs. 70,8 %). Potilaista 30 % oli saanut aiempaa hoitoa; näillä potilailla pääasiallinen hoito oli ollut interferoni alfa monoterapiana; tätä oli saanut tivotsanibihaarassa 75 potilasta ja sorafenibihaarassa 62 potilasta.
Tivotsanibilla todettiin tilastollisesti merkitsevä muutos parempaan PSF:n (taudin etenemisestä vapaan elinaika) ja ORR:n (objektiivisen hoitovasteen saaneiden potilaiden osuus) suhteen sorafenibiin verrattuna riippumatonta radiologista tarkastelua käyttäen (taulukko 2 ja kuva 1).
Kuva 1: Taudin etenemisestä vapaan elinajan Kaplan-Meier-käyrä perustuen riippumattomaan radiologiseen tarkasteluun (ITT-väestö)
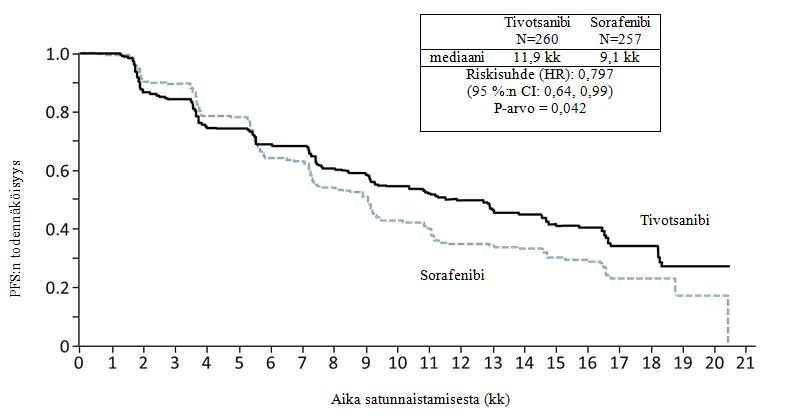
Taulukko 2: Tehon analyysi perustuen riippumattomaan radiologiseen tarkasteluun (ITT-väestö)
| Tivotsanibi | Sorafenibi
| Riskisuhde (HR) (95 %:n CI) | P-arvo (log rank -testi) | ||
Taudin etenemisestä vapaa elinaika [mediaani, kuukautta (95 %:n CI)], ITT-väestö | N=260 | 11,9 (9,3; 14,7) | N=257 | 9,1 (7,3; 9,5) | 0,797 (0,639; 0,993)a | 0,042b |
Objektiivisen hoitovasteen saaneiden potilaiden osuus (95 %:n CI), ITT-väestö | N=260 | 33,1 % (27,4; 39,2) | N=257 | 23,3 % (18,3; 29,0) |
| 0,014c |
Taudin etenemisestä vapaa elinaika, Ei aiempaa hoitoa metastaattiseen munuaissolukarsinoomaan -alaryhmä [mediaani, kuukautta (95 %:n CI)] | N=181 | 12.7 (9,1; 15,0) | N=181 | 9,1 (7,3; 10,8) | 0,756 (0,580; 0,985)d | 0,037e |
Taudin etenemisestä vapaa elinaika, Yksi aiempi hoito metastaattiseen sairauteen -alaryhmä [mediaani, kuukautta (95 %:n CI)] | N=78 | 11,9 (8,0; 16,6) | N=76 | 9,1 (7,2; 11,1) | 0,877 (0,587; 1,309)d | 0,520e |
- Riskisuhde: tivotsanibihaara vs. sorafenibihaara, perustuen ositettuun Coxin verrannollisten riskisuhteiden malliin. Ositustekijöitä ovat aiempien hoitojen lukumäärä (0 tai 1) ja hoidettujen metastaattisten kohtien/elinten lukumäärä (1 tai 2). Kun oletetaan, että riskisuhteet ovat verrannolliset, riskisuhde (HR) > 1 osoittaa riskisuhteen (HR) pienenemistä tivotsanibin eduksi;
- p-arvo perustuen ositettuun log-rank-testiin. Ositustekijöitä ovat aiempien hoitojen lukumäärä (0 tai 1) ja hoidettujen metastaattisten kohtien/elinten lukumäärä (1 tai ≥ 2);
- p-arvo perustuen ositettuihin Cochran-Mantel-Haenszel (CMH) -testeihin. Ositustekijöitä ovat aiempien hoitojen lukumäärä (0 tai 1) ja hoidettujen metastaattisten kohtien/elinten lukumäärä (1 tai ≥ 2);
- Riskisuhde: tivotsanibihaaran vs. sorafenibihaaran alaryhmäanalyysit, perustuen osittamattomaan Coxin verrannollisten riskisuhteiden malliin. Kun oletetaan, että riskisuhteet ovat verrannolliset, riskisuhde > 1 osoittaa riskisuhteen pienenemistä tivotsanibin eduksi;
- alaryhmäanalyysien p-arvo perustuen osittamattomaan log-rank-testiin.
Kokonaiselinaika (OS) oli tärkeä toissijainen päätetapahtuma pivotaalitutkimuksessa ja analyysiin sisältyi dataa kaikilta satunnaistetuilta potilailta, mukaan lukien potilaat, joilla sairaus eteni sorafenibihoidon aikana ja jotka siirtyivät saamaan tivotsanibia osana jatkotutkimusta. ITT-väestössä näiden kahden haaran välillä kokonaiselinajan (OS) suhteen oli pieni lukumääräinen ero. Mediaani kokonaiselinaika oli 28,2 kuukautta (95 %:n CI 22,5; 33,0) tivotsanibihaarassa vs. 30,8 kuukautta (95 % CI 28,4; 33,3) sorafenibihaarassa (HR=1,147, p=0,276
Iäkkäät
Kontrolloidussa kliinisessä tutkimuksessa (AV-951 -09-301), jossa tivotsanibia saaneista potilaista 25 % potilaista oli ≥ 65-vuotiaita, ei havaittu tehon suhteen yleisiä eroja iäkkäiden ja nuorempien potilaiden välillä (ks. kohta Annostus ja antotapa).
Keskeisissä munuaissolukarsinoomatutkimuksissa jotkin haittavaikutukset esiintyivät yleisemmin iäkkäillä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakodynaamiset vaikutukset
Kardiologisessa turvallisuustutkimuksessa, johon osallistui 50 potilasta, joilla oli edenneitä kiinteitä kasvaimia, ja jossa potilaat saivat 1340 mikrogramman tivotsanibiannoksen vuorokaudessa 21 vuorokauden ajan, QTcF-arvon keskimääräinen muutos lähtötilanteesta 21. antopäivänä oli 6,8 ms. QTcF-arvon suurin muutos lähtötilanteesta oli 9,3 ms (90 %:n CI: 5; 13,6), joka esiintyi 2,5 tuntia annon jälkeen 21 päivänä. Suuntauksen keskimuutos kaikkien mitattujen vuorokausien suhteen ja kaikkina ajankohtina oli 2,2 ms. Yhdelläkään tutkimushenkilöllä ei ilmennyt uutta > 500 ms:n muutosta QTcF-arvossa; 2 potilaalla (4 %) oli > 480 ms:n QTcF-arvoja. Yhdellä tutkimushenkilöllä (2 %) QTcF-arvon muutos lähtötilanteesta oli > 60 ms ja 6 tutkimushenkilöllä (12 %) muutos lähtötilanteesta oli 30-60 ms (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja kohta Haittavaikutukset).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset tivotsanibin käytöstä kaikkien pediatristen potilasryhmien edenneen munuaissolukarsinooman hoidossa (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Suun kautta otetun tivotsanibin huippupitoisuudet seerumissa saavutetaan noin 2-24 tunnin kuluttua annosta. 1340 mikrogramman kerta-annoksen jälkeen keskimääräinen Cmax oli 10,2-25,2 ng/ml kaikissa, terveillä tutkimushenkilöillä ja potilailla tehdyissä tutkimuksissa. Kerta-annoksen AUC0-inf terveillä vapaaehtoisilla, jotka saivat 1340 mikrogramman tivotsanibiannoksen, oli 1 950-2 491 ng.hr/ml. Munuaissolukarsinoomapotilailla tehdyissä tutkimuksissa kerran vuorokaudessa 21 tai 28 vuorokauden ajan annetun 1340 mikrogramman tivotsanibiannoksen jälkeen Cmax oli 67,5-94.3 ng/ml ja AUC0-24 oli 1 180-1,641 ng.hr/ml. Altistus on suhteessa annokseen vaihteluvälillä 890-1340 mikrogrammaa ja annosriippuvainen laajalla vaihteluvälillä, 450 mg - 1790 mikrogrammaa. Kumulaatio vakaassa tilassa on noin 6- tai 7-kertainen kerta-annoksilla havaittuun altistukseen verrattuna. Puhdistuma on samanlainen akuutin ja pitkäkestoisen annostuksen välillä eikä pitkäkestoinen annostus osoita aikariippuvaisia muutoksia farmakokinetiikassa.
Arvioitaessa tivotsanibin vaikutusta ruokaan terveillä tutkimushenkilöillä runsasrasvainen ateria alensi huippupitoisuuksia seerumissa (C max) 23,4 %:lla verrattuna tyhjään mahaan. Ruoalla ei ollut vaikutusta kokonaisaltistukseen (AUC). Näiden tietojen perusteella tivotsanibia voidaan antaa aterian yhteydessä tai tyhjään mahaan (ks. kohta Annostus ja antotapa).
Jakautuminen
Proteiinin sitoutumistutkimuksissa in vitro on osoitettu, että tivotsanibi sitoutuu > 99-prosenttisesti plasman proteiineihin. Plasman proteiinien sitoutumisessa ei havaittu riippuvuutta pitoisuudesta vaihteluvälillä 0,1-5 µmol/l tivotsanibia. Ihmisen plasmassa pääasiallinen tivotsanibia sitova komponentti on albumiini. In vitro -tutkimuksissa on osoitettu, ettei tivotsanibi ole monia lääkeaineita ulos soluista pumppaavan P-glykoproteiinin substraatti eikä estäjä. In vitro –tutkimukset viittaavat siihen, että tivotsanibi on suoliston BCRP:n estäjä.
Biotransformaatio
Aineenvaihduntatutkimuksissa in vitro on osoitettu, että CYP3A4 ja CYP1A1 pystyvät metaboloimaan tivotsanibia. Muuttumaton tivotsanibi on molekyylin pääasiallinen verenkierrossa esiintyvä muoto, eikä seerumissa ole havaittu pääasiallisia metaboliitteja altistuksella, joka on suuruudeltaan vähintään 10 % radioaktiivisesta kokonaisaltistuksesta. Koska CYP1A1 ilmentyy pääasiassa maksan ulkopuolella olevissa kudoksissa, kuten esimerkiksi keuhkoissa ja ohutsuolessa, pidettiin epätodennäköisenä, että tämä isoformi osallistuisi laajasti maksan metaboliaan.
In vitro -tutkimuksissa on osoitettu, että tivotsanibin metaboliitit voivat käydä läpi UGT-välitteisen biotransformaation UGT1A1-, UGT1A3-, UGT1A7-, UGT1A8-, UGT1A9- ja UGT1A10-reittien kautta. Tivotsanibin suora N-glukoronidaatio oli pienempi metaboliareitti in vitro.
Eliminaatio
Kun tivotsanibia on annosteltu pitkäkestoisesti munuaissolukarsinoomapotilaille 21 vuorokauden ajan, jonka jälkeen 7 vuorokauden jakson aikana tivotsanibia ei ole annettu, tivotsanibi Cmin–arvo on noin 16,0- 30,9 ng/ml.
Tutkimuksissa, joissa on arvioitu terminaalisen eliminaation vaihetta, tivotsanibin keskimääräinen t½ oli 4,5 – 5,1 vuorokautta. Suun kautta annetun [14C] tivotsanibi-kerta-annoksen jälkeen noin 79 % radioaktiivisuudesta havaittiin ulosteissa ja noin 12 % havaittiin virtsassa metaboliitteina. Virtsassa ei havaittu muuttumatonta tivotsanibia, mikä osoittaa, ettei tivotsanibi poistu munuaisten kautta. [14C] tivotsanibi oli ulosteessa havaittu pääasiallinen lääkeaine [14C]:aa sisältäviä metaboliitteja löytyi ulosteesta enintään 10 % annoksesta.
Erityisryhmät
Ikä, sukupuoli ja rotu
Populaatiofarmakokineettisen analyysin perusteella iällä, sukupuolella tai rodulla ei ole kliinisesti merkittävää vaikutusta tivotsanibin farmakokinetiikkaan.
Maksan vajaatoiminta
Tulokset kerta-annostutkimuksesta, jossa tarkasteltiin tivotsanibin farmakokinetiikkaa, turvallisuutta ja siedettävyyttä maksan vajaatoimintaa sairastavilla potilailla osoittavat, että koko mittausjakson ajan tivotsanibi eliminoitui hitaammin potilailla, joilla oli kohtalainen (Child Pugh -luokka B) tai vaikea (Child Pugh- luokka C) maksan vajaatoiminta. Tivotsanibialtistus oli suurempi potilailla, joilla oli vaikea maksan vajaatoiminta (keskimääräinen AUC0-∞ , 4,0-kertainen) ja potilailla, jolla oli kohtalainen maksan vajaatoiminta (keskimääräinen AUC0-∞, 2,6-kertainen). Altistuksessa ei havaittu merkittävää nousua lievää (Child Pugh -luokka A) maksan vajaatoimintaa sairastavilla potilailla (keskimääräinen AUC0-∞. 1,2-kertainen). Tivotsanibia on käytettävä varoen potilaille ,joilla on kohtalainen maksan vajaatoiminta, ja annos on pienennettävä yhteen 1340 mikrogramman kapseliin, joka otetaan joka toinen päivä. Tivotsanibia ei pidä käyttää potilaille, joilla on vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Tivotsanibia tutkittiin kliinisissä tutkimuksissa munuaissolukarsinoomapotilailla, joiden seerumin kreatiniinipitoisuus oli ≤ 2-kertainen normaaliarvojen ylärajaan verrattuna, mukaan lukien potilaat, joille oli saatettu aiemmin tehdä nefrektomia. Vaikka vielä vaikeamman munuaisten vajaatoiminnan vaikutusta tivotsanibin poistumiseen elimistöstä ei tunneta, eräässä kliinisessä tutkimuksessa todettiin, että muuttumatonta tivotsanibia ei erity virtsaan, mikä osoittaa, ettei tivotsanibi poistu munuaisten kautta. Tivotsanibialtistuksen populaatiofarmakokineettisen analyysin mukaan annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Tivotsanibin käytöstä vaikeaa munuaisten vajaatoimintaa sairastaville potilaille on vain vähän kokemusta ja varovaisuutta on syytä noudattaa.
CY- ja UGT -entsyymejä koskevat in vitro -tutkimukset
Tivotsanibilla tehdyt in vitro –tutkimukset osoittavat, että se ei ole CYP-entsyymin induktori. Ihmisen maksan mikrosomeissa ja hepatosyyteissä tehdyt in vitro -tutkimukset, joissa arvioitiin CYP1A2-, CYP2B6-, CYP2A6-, CYP2C8-, CYP2C9-, CYP2C19-, CYP2D6- ja CYP3A4-entsyymien aktiivisuutta, viittaavat siihen, että tivotsanibi on heikko CYP2B6:n ja CYP2C8:n estäjä. In vitro IC50- ja in vivo sitoutumattoman Cmax-arvon perusteella tivotsanibilla ei todennäköisesti ole kliinisesti merkityksellistä yhteisvaikutusta näiden entsyymireittien kautta metaboloituvien vaikuttavien aineiden kanssa.
In vitro tehdyissä tutkimuksissa on todettu, että tivotsanibi ei ole UGT:n(UDP-glukuronosyylitransferaasin) aineenvaihdunnan estäjä ja että kliinisesti merkittävät lääkkeiden väliset yhteisvaikutukset ovat epätodennäköisiä käytettäessä näiden reittien kautta metaboloituvia lääkevalmisteita.
Kuljettajan tutkimukset in vitro
In vitro -tutkimuksissa on todettu, että tivotsanibi ei ole MDR1- (P-gp), OCT1-, OATP1B1-,OATP1B3- ja BSEP-kuljettajaproteiinien substraatti eikä estäjä. Lisäksi tivotsanibi ei in vitro -tutkimuksissa estänyt OAT1-, OAT3-, OCT2-, MATE1- ja MATE2-K-kuljettajaproteiineja eikä ollut MRP2- ja BCRP- kuljettajaproteiinien substraatti.
In vitro tivotsanibi estää BCRP-kuljettajaproteiinia pitoisuuksilla, jotka todennäköisesti rajoittavat suoliston BCRP:n aktiivisuuden vaikutusta in vivo.
Prekliiniset tiedot turvallisuudesta
Seuraavassa esitellään haittavaikutukset, joita ei ole havaittu kliinisissä tutkimuksissa, mutta joita on havaittu hoitoannoksia vastaavia määriä lääkeainetta saaneilla koe-eläimillä, minkä vuoksi haittavaikutuksilla on mahdollisesti merkitystä kliinisessä käytössä.
Rotilla tehdyssä toistuvan altistuksen toksisuustutkimuksessa havaittiin poikkeavuuksia kasvavissa etuhampaissa (ohuet hauraat hampaat, hampaiden menetys, virhepurennat) annoksilla, jotka olivat noin 2 kertaa suurempia kuin laskettu ihmisen vastaava annos, ja kasvulevyn hypertrofiaa annoksilla, jotka olivat noin 0,7 kertaa suurempia kuin laskettu ihmisen vastaava annos. Cynomolgus-apinoilla tivotsanibin osoitettiin aiheuttavan kasvulevyjen hypertrofiaa, toimivien keltarauhasten puuttumista ja kypsyvien munarakkuloiden puuttumista annostasoilla, joiden tuottamat altistukset vastasivat suositeltujen kliinisten annosten käytön yhteydessä havaittuja altistuksia.
Lisääntyminen, mutageneesi, hedelmällisyyden heikkeneminen
Tivotsanibi saattaa heikentää ihmisen hedelmällisyyttä. Ei-kliinisissä tutkimuksissa, joissa arvioitiin pariutumisen ja hedelmällisyyden muuttujia urosrotilla, ihmiselle suositeltua kliinistä annosta > 2 kertaa suuremmat annokset aiheuttivat lisäkivesten ja kivesten painon nousua, mikä yhdistetään hedelmättömyyteen. Kivesten painon nousua havaittiin annoksella, joka oli 7-kertainen suositeltuun kliiniseen annokseen verrattuna. Naarasrotilla havaittiin elinkelvottomien sikiöiden lisääntymistä annoksella, joka oli 0,7-kertainen suositeltuun kliiniseen annokseen verrattuna, ja annokset, jotka olivat ≥ 2-kertaisia suositeltuun kliiniseen annokseen verrattuna, aiheuttivat hedelmättömyyttä.
Tivotsanibin osoitettiin olevan teratogeeninen, alkiotoksinen ja sikiötoksinen tiineillä rotilla annostasoilla, jotka olivat 5 kertaa pienempiä kuin suositeltu kliininen annos (60 kg painavalla ihmisellä). Tiineillä kaneilla tehdyissä tutkimuksissa ei havaittu vaikutuksia emojen terveyteen tai alkioiden tai sikiöiden kehitykseen annoksilla, jotka olivat noin 0,6-kertaisia verrattuna suositellun annoksen altistukseen.
Karsinogeneesi
Tivotsanibilla ei ole tehty karsinogeenisuustutkimuksia
Farmaseuttiset tiedot
Apuaineet
Fotivda 890 mikrogrammaa kovat kapselit
Kapselin sisältö
Mannitoli
Magnesiumstearaatti
Kapselin kuori
Liivate
Titaanidioksidi (E171)
Indigokarmiini (E132)
Keltainen rautaoksidi (E172)
Painoväri (keltainen)
Shellakka
Propyleeniglykoli
Vahva ammoniakkiliuos
Titaanidioksidi (E171)
Tartratsiinialumiinilakka (E102)
Painoväri (sininen)
Shellakka
Propyleeniglykoli
Vahva ammoniakkiliuos
Indigokarmiinialumiinilakka (E132)
Fotivda 1340 mikrogrammaa kovat kapselit
Kapselin sisältö
Mannitoli
Magnesiumstearaatti
Kapselin kuori
Liivate
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Painoväri (sininen)
Shellakka
Propyleeniglykoli
Vahva ammoniakkiliuos
Indigokarmiinialumiinilakka (E132)
Yhteensopimattomuudet
Ei oleellinen
Kestoaika
5 vuotta
Säilytys
Pidä purkki tiukasti suljettuna. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
FOTIVDA kapseli, kova
890 mikrog (L:ei) 21 kpl (2888,73 €)
1340 mikrog (L:ei) 21 kpl (2888,73 €)
PF-selosteen tieto
Valkoinen HDPE-purkki, jossa on turvasuljin, ja joka sisältää 21 kovaa kapselia.
Kussakin pakkauksessa on 1 purkki.
Valmisteen kuvaus:
Fotivda 890 mikrogrammaa kova kapseli
Kova kapseli, jossa on tummansininen läpinäkymätön kansiosa ja kirkkaankeltainen läpinäkymätön pohjaosa. Kapselin kansiosaan on painettu keltaisella ”TIVZ” ja pohjaosaan tummansinisellä ”LD”.
Fotivda 1340 mikrogrammaa kova kapseli
Kova kapseli, jossa on kirkkaankeltainen läpinäkymätön kansiosa ja kirkkaankeltainen läpinäkymätön pohjaosa. Kapselin kansiosaan on painettu tummansinisellä ”TIVZ” ja pohjaosaan tummansinisellä ”SD”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti
Korvattavuus
FOTIVDA kapseli, kova
890 mikrog 21 kpl
1340 mikrog 21 kpl
- Ei korvausta.
ATC-koodi
L01EK03
Valmisteyhteenvedon muuttamispäivämäärä
04.07.2023
Yhteystiedot
Beechavenue 54
1119PW Schiphol-Rijk
Alankomaat
+44 (0) 3305001144
www.eusapharma.com
