LUMIVELA filmdragerad tablett 150/20 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista
Terveydenhuollon ammattilainen
Tärkeää tietoa yhdistelmäehkäisyvalmisteesta ja veritulppariskistä
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Kvalitativ och kvantitativ sammansättning
21 vita filmdragerade tabletter (aktiva tabletter):
Varje filmdragerad tablett innehåller:
Desogestrel 150 mikrogram
Etinylestradiol 20 mikrogram
Hjälpämnen med känd effekt: laktosmonohydrat 55 mg, sojaolja (högst 0,026 mg).
7 gröna filmdragerade placebotabletter (tablett som inte innehåller aktiva substanser):
Tabletten innehåller inga aktiva substanser.
Hjälpämne med känd effekt: laktosmonohydrat 55 mg.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Filmdragerad tablett.
Kliniska uppgifter
Terapeutiska indikationer
Antikonception.
Vid beslutet om förskrivning av Lumivela ska den enskilda användarens nuvarande riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), liksom risken för VTE med Lumivela jämfört med andra kombinerade hormonella preventivmedel (se avsnitten Kontraindikationer och Varningar och försiktighet).
Dosering och administreringssätt
Hur man tar Lumivela
Tabletterna ska tas varje dag vid ungefär samma tid, vid behov tillsammans med lite vätska, i den ordning som visas på blistret. Tabletterna ska tas kontinuerligt. En tablett tas en gång dagligen 28 dagar i följd. Ett nytt blister påbörjas dagen efter att den sista tabletten i föregående blister tagits. Bortfallsblödningen börjar vanligen 2–3 dagar efter att intaget av placebotabletterna (sista raden) börjat, och den kan pågå tills nästa blister påbörjas.
Hur man börjar med Lumivela
- Inget hormonellt preventivmedel har använts under den senaste månaden:
Tablettintaget måste börja på dag 1 i kvinnans naturliga menstruationscykel (dvs. på den första menstruationsdagen). Det är också möjligt att börja på dag 2–5, men då rekommenderas att en barriärmetod används som tillägg under de första 7 dagarna av tablettintag i den första menstruationscykeln.
- Byte till Lumivela från ett annat kombinerat hormonellt preventivmedel (kombinerade p‑piller, p‑ring eller p‑plåster):
Kvinnan ska helst börja med Lumivela dagen efter intaget av den sista aktiva tabletten (den sista tabletten som innehåller aktiva substanser) av sitt tidigare kombinerade p‑piller, men allra senast dagen efter den vanliga tablettfria perioden eller placebotablettperioden med det tidigare kombinerade orala preventivmedlet.
Om en p‑ring eller ett p‑plåster användes tidigare ska kvinnan helst börja ta Lumivela samma dag som ringen eller plåstret tas bort, men allra senast den dag då en ny ring eller ett nytt plåster skulle ha satts in/applicerats. Den hormonfria perioden får under inga omständigheter överskrida den rekommenderade hormonfria tidsperioden för den tidigare använda preventivmetoden.
Om det tidigare kombinerade hormonella preventivmedlet har använts korrekt och utan avbrott under de senaste sju dagarna, och det med rimlig säkerhet kan antas att användaren inte är gravid, kan ett byte från det tidigare kombinerade hormonella preventivmedlet till Lumivela ske vilken dag som helst i cykeln.
Alla beskrivna preventivmedel (p‑ring, p‑plåster) är inte nödvändigtvis tillgängliga i alla EU‑länder.
- Byte till Lumivela från ett preventivmedel innehållande enbart gestagen (minipiller, p‑spruta, implantat) eller ett gestagenfrisättande intrauterint inlägg (IUS)
Det går att byta när som helst från minipiller till Lumivela (från ett implantat eller IUS på dagen för dess avlägsnande och från en p‑spruta vid tidpunkten för nästa planerade injektion), men i samtliga fall ska kvinnan upplysas om att även använda en barriärmetod som tillägg de första 7 dagarna av tablettintag.
- Användning efter ett missfall/abort i första trimestern
Tablettintaget kan påbörjas omedelbart. I detta fall behövs inga andra preventivmetoder.
- Användning efter en förlossning eller efter ett missfall/abort i andra trimestern
Tabletterna måste börja tas mellan dag 21 och 28 efter en förlossning eller efter ett missfall/abort i andra trimestern. Vid senare start måste ytterligare en preventivmetod användas som tillägg under de första 7 dagarna av tablettintag. Om samlag då redan har ägt rum ska en eventuell graviditet först uteslutas eller följande menstruation inväntas innan användning av kombinerade p-piller inleds.
För ammande kvinnor, se avsnitt Fertilitet, graviditet och amning.
Glömda tabletter
Glömda placebotabletter (sista raden på blistret) behöver inte beaktas. De ska dock kastas bort för att undvika att perioden med placebotabletter förlängs oavsiktligt.
Följande råd gäller endast för glömda aktiva tabletter (raderna 1–3 på blistret):
Om den glömda tabletten tas inom 12 timmar kommer preparatets preventiva effekt inte att bli nedsatt. Den glömda tabletten ska tas så snart som möjligt, och resten av tabletterna ska sedan tas vid ordinarie tidpunkt.
Om det har gått mer än 12 timmar sedan en glömd tablett skulle ha tagits kan den preventiva effekten vara nedsatt. Följande två grundregler gäller vid glömd tablett:
- Tablettuppehållet får aldrig överskrida 7 på varandra följande dagar.
- Tablettintag 7 dagar i följd är nödvändigt för att uppnå tillräcklig hämning av hypotalamus‑hypofys‑ovarial-axeln.
Således kan följande praktiska råd ges:
- Vecka 1
Den senast glömda tabletten ska tas så snart som möjligt, även om detta innebär att två tabletter måste tas vid samma tidpunkt. Därefter tas resten av tabletterna vid ordinarie tidpunkt. Dessutom ska en barriärmetod, såsom kondom, användas som tillägg under de följande 7 dagarna. Om samlag har ägt rum under de föregående 7 dagarna ska en möjlig graviditet beaktas. Ju fler tabletter som har glömts och ju närmare de är placebotablettfasen, desto större är risken för graviditet.
- Vecka 2
Den senast glömda tabletten ska tas så snart som möjligt, även om detta innebär att två tabletter måste tas vid samma tidpunkt. Därefter tas tabletterna vid ordinarie tidpunkt. Under förutsättning att alla tabletter har tagits enligt anvisningarna under de 7 dagar som föregick den första glömda tabletten behövs inget ytterligare skydd. Om så inte är fallet, eller om fler än 1 tablett har glömts, ska kvinnan upplysas om att hon behöver använda extra skydd under de följande 7 dagarna.
- Vecka 3
Risken för minskad tillförlitlighet är överhängande på grund av den nära förestående 7 dagar långa placebotablettfasen. Genom att justera schemat för tablettintaget går det emellertid att fortfarande förhindra att den preventiva effekten minskar. Om ett av nedanstående alternativ följs behövs inget extra skydd, under förutsättning att kvinnan har tagit alla tabletter på rätt sätt under de 7 dagar som föregick den första glömda tabletten. Om så inte har varit fallet måste det första av de två nedanstående alternativen följas och extra skydd användas under de kommande 7 dagarna.
- Den senast glömda tabletten ska tas så snart som möjligt, även om detta innebär att två tabletter måste tas vid samma tidpunkt. Därefter tas tabletterna vid ordinarie tidpunkt tills alla aktiva tabletter är slut. De 7 tabletterna (placebotabletterna) på sista raden ska kasseras. Nästa blister måste påbörjas omedelbart. Användaren kommer troligtvis inte att få någon bortfallsblödning förrän alla aktiva tabletter i den andra förpackningen är slut, men stänkblödningar eller genombrottsblödning kan uppträda under de dagar då tabletterna tas.
- Kvinnan kan också rådas att sluta ta aktiva tabletter från den aktuella blisterförpackningen. Hon ska då ta tabletter från den sista raden (placebotabletter) i upp till 7 dagar, inräknat de dagar då en aktiv tablett glömts. och därefter fortsätta med nästa blisterförpackning.
Om kvinnan glömt att ta tabletter och bortfallsblödningen sedan uteblir under placebotablettperioden ska möjlig graviditet beaktas.
Anvisningar i händelse av gastrointestinala rubbningar
Om svåra gastrointestinala rubbningar (t.ex. kräkningar eller diarré) förekommer kan absorptionen vara ofullständig, och då ska en kompletterande preventivmetod användas. Vid kräkningar inom 3–4 timmar efter intag av en aktiv tablett ska anvisningarna om glömda tabletter i avsnitt ”Glömda tabletter” följas. Om kvinnan inte vill ändra sitt vanliga schema för tablettintaget måste hon ta den extra tabletten (de extra tabletterna) som behövs från en annan förpackning.
Att skjuta upp menstruationen eller permanent flytta startdagen för menstruationen
Att skjuta upp menstruationen är inte en indikation för preparatet. För att i undantagsfall skjuta upp en menstruation ska kvinnan direkt fortsätta med ett nytt blister med Lumivela utan att ta placebotabletterna på det föregående blistret. Menstruationen kan skjutas upp så länge som önskas, tills de aktiva tabletterna i den andra förpackningen är slut. Under tiden som den andra förpackningen används kan en genombrottsblödning eller stänkblödningar förekomma. Intaget av Lumivela fortsätter som normalt efter placebotablettperioden.
För att flytta den första menstruationsdagen till en annan veckodag än den nuvarande kan kvinnan rådas att förkorta nästkommande placebotablettperiod med önskat antal dagar. Ju kortare uppehåll, desto större är risken att bortfallsblödningen uteblir och att genombrottsblödning och stänkblödningar förekommer under intaget av tabletter från den efterföljande förpackningen (på samma sätt som vid förskjutning av menstruationen).
Pediatrisk population
Säkerhet och effekt för Lumivela för ungdomar yngre än 18 år har ännu inte fastställts.
Kontraindikationer
Kombinerade hormonella preventivmedel ska inte användas vid nedanstående tillstånd. Om något av dessa tillstånd uppkommer för första gången under användningen av kombinerade p‑piller ska användningen upphöra omedelbart:
-
Förekomst av eller risk för venös tromboembolism (VTE)
- venös tromboembolism – pågående VTE (patienten använder antikoagulantia) eller VTE i anamnesen (t.ex. djup ventrombos [DVT] eller lungemboli)
- känd ärftlig eller förvärvad predisposition för VTE, t.ex. APC‑resistens (inklusive Faktor V Leiden), antitrombin III‑brist, protein C‑brist, protein S‑brist
- stor operation som medför långvarig immobilisering (se avsnitt Varningar och försiktighet)
- hög risk för VTE på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet).
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
- arteriell tromboembolism – pågående ATE eller ATE i anamnesen (t.ex. hjärtinfarkt) eller prodromalsymtom (t.ex. angina pectoris)
- cerebrovaskulär sjukdom – pågående stroke, stroke i anamnesen eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
- känd ärftlig eller förvärvad predisposition för ATE, t.ex. hyperhomocysteinemi och fosfolipidantikroppar (kardiolipinantikroppar, lupusantikoagulant)
- migrän med fokala neurologiska symtom i anamnesen
- hög risk för ATE på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller förekomst av en allvarlig riskfaktor, såsom:
- diabetes med vaskulära symtom
- svår hypertoni
- svår dyslipoproteinemi.
- Pågående eller tidigare pankreatit, om den är/varit associerad med svår hypertriglyceridemi.
- Pågående eller tidigare svår leversjukdom, så länge leverfunktionsvärdena inte återgått till det normala.
- Nuvarande eller tidigare förekomst av benign eller malign levertumör.
- Kända eller misstänkta könshormonberoende tumörer (t.ex. i genitalier eller bröst)
- Endometriehyperplasi.
- Vaginalblödning av okänd orsak.
- Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
- Allergi mot jordnötter eller soja.
- Lumivela är kontraindicerat vid användning av kombinationen ombitasvir/paritaprevir/ritonavir och läkemedelspreparat som innehåller dasabuvir, läkemedelspreparat som innehåller kombinationen glecaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Interaktioner).
Varningar och försiktighet
Varningar
Om kvinnan uppvisar något av de tillstånd eller någon av de riskfaktorer som anges nedan ska lämpligheten av Lumivela diskuteras med henne.
Om något av tillstånden eller någon av riskfaktorerna förvärras eller uppträder för första gången ska kvinnan rådas att kontakta läkare, som då beslutar huruvida användningen av Lumivela måste avbrytas.
Cirkulationsrubbningar
Risk för venös tromboembolism (VTE)
Användning av vilket kombinerat hormonellt preventivmedel som helst ökar risken för venös tromboembolism (VTE) jämfört med icke‑användning. Preparat som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Denna risk kan vara upp till dubbelt så stor med andra preparat såsom t.ex. Lumivela. Beslutet att använda ett annat preparat än det med den lägsta risken för VTE får fattas först efter en diskussion med kvinnan som överväger användningen. Detta för att säkerställa att hon känner till risken för VTE med Lumivela, hur hennes nuvarande riskfaktorer påverkar den här risken, och att risken för VTE är störst under det första året som hon använder kombinerade hormonella preventivmedel. Det finns också vissa belägg för att risken är större när användningen av ett kombinerat hormonellt preventivmedel återupptas efter ett uppehåll på 4 veckor eller längre.
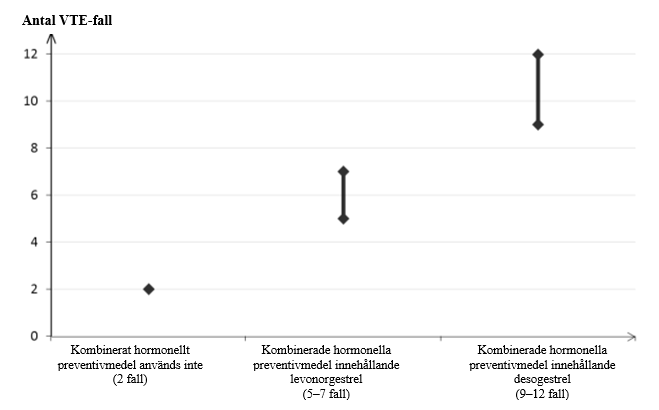
Bland kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla VTE under en period om ett år. Hos enskilda kvinnor kan denna risk dock vara betydligt högre, beroende på deras underliggande riskfaktorer (se nedan).
Uppskattningsvis 9–123 av 10 000 kvinnor som använder ett kombinerat hormonellt preventivmedel innehållande desogestrel kommer att utveckla VTE under en period om ett år. Bland de kvinnor som använder ett kombinerat hormonellt preventivmedel som innehåller levonorgestrel är motsvarande siffra 64.
3 Incidensen uppskattades från samtliga epidemiologiska studiedata genom att jämföra relativa risker för de olika preparaten med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
4 Mittpunkten i intervallet 5–7 per 10 000 kvinnoår, baserat på en relativ risk med användning av kombinerade hormonella preventivmedel innehållande levonorgestrel jämfört med icke-användning, varvid risken är cirka 2,3–3,6.
I båda fallen är antalet VTE‑fall per år färre än det antal fall som förväntas under graviditet eller under postpartumperioden.
VTE kan leda till dödsfall i 1–2 % av fallen.
Antal VTE‑fall per 10 000 kvinnor under ett år
I mycket sällsynta fall har trombos rapporterats förekomma i andra blodkärl (t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer) hos användare av kombinerade hormonella preventivmedel.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt om kvinnan har andra riskfaktorer, framför allt om riskfaktorerna är flera (se tabell).
Lumivela är kontraindicerat hos kvinnor som har flera riskfaktorer som medför en hög risk för VTE (se avsnitt Kontraindikationer). Om en kvinna har fler än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om nytta‑riskförhållandet anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
| Riskfaktor | Kommentar |
| Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
Långvarig immobilisering, stor operation, alla operationer i ben eller bäckenområde, neurokirurgi eller omfattande trauma Observera: tillfällig immobilisering, även flygresor > 4 timmar, kan också vara en riskfaktor för VTE, särskilt hos kvinnor som också har andra riskfaktorer | I dessa situationer är det tillrådligt att göra ett uppehåll i användningen av p‑plåstret/p‑pillret/p‑ringen (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän kvinnan haft full rörelseförmåga i två veckor. En annan preventivmetod måste användas för att undvika oönskad graviditet. Antitrombotisk behandling ska övervägas om Lumivela inte har satts ut i förväg. |
| Positiv familjeanamnes (nuvarande eller tidigare förekomst av VTE hos syskon eller förälder, särskilt i relativt unga år, t.ex. före 50 års ålder) | Om hereditär predisposition misstänks ska kvinnan remitteras till en specialist för undersökningar innan beslut fattas om användning av någon form av kombinerade hormonella preventivmedel. |
| Andra sjukdomar som förknippas med VTE | Cancer, systemisk lupus erythematosus, hemolytiskt‑uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecellanemi |
| Stigande ålder | Framför allt en ålder över 35 år. |
Det råder inte enighet om det eventuella sambandet mellan varicer samt ytlig tromboflebit och uppkomst eller progression av ventrombos.
Den ökade risken för tromboembolism under graviditet och framför allt under de första cirka 6 veckorna efter förlossningen måste beaktas (se mer information i avsnitt Fertilitet, graviditet och amning).
Symtom på VTE (djup ventrombos och lungemboli)
Om symtom uppkommer ska kvinnorna rådas att omedelbart söka läkare och berätta att de använder ett kombinerat hormonellt preventivmedel.
Symtomen på djup ventrombos (DVT) kan omfatta:
- ensidig svullnad av ben och/eller fot eller svullnad längs en ven i benet
- smärta eller ömhet i benet, vilket kanske endast känns vid stående eller gående
- ökad värmekänsla i det drabbade benet, med missfärgning eller rodnad av huden på benet.
Symtomen på lungemboli kan omfatta:
- plötslig debut av oförklarlig dyspné eller snabb andning
- plötslig hosta som kan vara förknippad med hemoptys
- stickande bröstsmärta
- svår svimningskänsla eller yrsel
- snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. dyspné, hosta) är ospecifika och kan feltolkas som mer vanliga eller mindre svåra händelser (t.ex. luftvägsinfektioner).
Andra tecken på trombos kan vara bl.a. plötslig smärta, svullnad och en blåskiftande missfärgning av en extremitet.
Om en trombos uppkommer i ögat kan symtomet vara t.ex. smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för ATE (hjärtinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack [TIA], stroke). Arteriella tromboemboliska händelser kan leda till dödsfall.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel är högre hos kvinnor med riskfaktorer (se tabell). Lumivela är kontraindicerat om kvinnan har antingen en allvarlig riskfaktor eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om en kvinna har fler än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om nytta‑riskförhållandet anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
| Riskfaktor | Kommentar |
| Stigande ålder | Framför allt en ålder över 35 år. |
| Rökning | Kvinnor som använder ett kombinerat hormonellt preventivmedel ska rådas att inte röka. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
| Hypertoni | |
| Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt när det gäller kvinnor som också har andra riskfaktorer. |
| Positiv familjeanamnes (nuvarande eller tidigare förekomst av ATE hos syskon eller förälder, särskilt i relativt unga år, före 50 års ålder). | Om hereditär predisposition misstänks ska kvinnan remitteras till en specialist för undersökningar innan beslut fattas om användning av någon form av kombinerade hormonella preventivmedel. |
| Migrän | En ökning av migränens frekvens eller svårighetsgrad (vilket kan vara prodromalsymtom på en cerebrovaskulär händelse) under användning av kombinerade hormonella preventivmedel kan vara ett skäl för omedelbart utsättande av preventivmedlet. |
| Andra sjukdomar som förknippas med negativa vaskulära händelser | Diabetes, hyperhomocysteinemi, hjärtklaffsjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus (SLE). |
Symtom på ATE
Om symtom uppkommer ska kvinnorna rådas att omedelbart söka läkare och berätta att de använder ett kombinerat hormonellt preventivmedel.
Symtomen på cerebrovaskulär händelse kan omfatta:
- plötslig domning eller svaghet i ansikte, armar eller ben (särskilt endast på en sida av kroppen)
- plötsliga problem med att gå, yrsel, förlorad balans eller koordination
- plötslig förvirring, svårigheter att tala eller förstå
- plötslig synnedsättning i ena ögat eller i båda ögonen
- plötslig, kraftig eller långvarig huvudvärk utan känd orsak
- medvetslöshet eller svimning med eller utan krampanfall.
Övergående symtom tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtomen på hjärtinfarkt kan omfatta:
- smärta, obehagskänsla, tryckkänsla, tyngdkänsla, känsla av sammanpressning eller fyllnadskänsla i bröstet, armen eller bakom bröstbenet
- obehagskänsla som strålar mot ryggen, käken, halsen, armen och/eller buken
- mättnadskänsla, känsla av matsmältningsbesvär eller kvävning
- svettningar, illamående, kräkningar eller yrsel
- extrem svaghetskänsla, ångest, eller dyspné
- snabba eller oregelbundna hjärtslag.
Tumörer
- Epidemiologiska studier har visat att långtidsanvändning (> 5 år) av p‑piller ökar risken för cervixcancer hos kvinnor som har en infektion med humant papillomvirus (HPV). Det är dock fortfarande oklart i vilken utsträckning denna observation påverkas av störfaktorer (t.ex. skillnader i antalet sexpartner eller skillnader i användning av barriärmetoder).
- En metaanalys från 54 epidemiologiska studier visade på en något ökad relativ risk (RR = 1,24) för bröstcancer hos kvinnor som för närvarande använder kombinerade p‑piller. Den ökade risken försvinner gradvis under loppet av 10 år efter avslutad användning av p‑pillren. Eftersom bröstcancer är sällsynt hos kvinnor under 40 års ålder är det ökade antalet fall av diagnostiserad bröstcancer hos kvinnor som för närvarande använder eller nyligen använt kombinerade p‑piller litet i jämförelse med den totala risken för bröstcancer. Dessa studier ger inga bevis för något kausalförhållande. Det observerade mönstret för ökad risk kan bero på att bröstcancer diagnostiseras tidigt hos kvinnor som använder kombinerade p‑piller, på de biologiska effekterna av kombinerade p‑piller eller på en kombination av dessa. Bröstcancer som diagnostiseras hos dem som någon gång använt p‑piller tenderar att vara i ett tidigare stadium när diagnosen ställs än bröstcancerfallen hos personer som aldrig använt p‑piller.
- I sällsynta fall har benigna levertumörer, och ännu mer sällan maligna levertumörer, konstaterats hos användare av kombinerade p‑piller. I enstaka fall har dessa tumörer lett till livshotande intraabdominella blödningar. Levertumör bör övervägas som differentialdiagnos när svår smärta i övre delen av buken, leverförstoring eller tecken på intraabdominell blödning uppträder hos kvinnor som använder kombinerade p‑piller.
Övriga tillstånd
- Kvinnor med hypertriglyceridemi eller sådan i familjeanamnesen kan ha en förhöjd risk för pankreatit vid användning av kombinerade p‑piller.
- Även om små förhöjningar av blodtrycket har rapporterats hos många kvinnor som använder kombinerade p‑piller är kliniskt betydelsefulla blodtryckshöjningar sällsynta. Något samband mellan användning av kombinerade p‑piller och klinisk hypertoni har inte kunnat fastställas. Om en långvarig och kliniskt betydelsefull blodtryckshöjning uppkommer under användning av kombinerade p‑piller ska läkaren avbryta användningen av preparatet och behandla hypertonin. Användningen av preparatet kan återupptas om normala blodtrycksvärden uppnås med antihypertensiva läkemedel.
- Följande sjukdomstillstånd har rapporterats förekomma eller förvärras både i samband med graviditet och användning av kombinerade p‑piller, men det finns inte övertygande bevis för ett samband mellan dem och användning av kombinerade p‑piller: kolestatisk ikterus och/eller pruritus relaterad till kolestas, gallstensbildning, porfyri, SLE, hemolytiskt‑uremiskt syndrom, Sydenhams korea, herpes gestationis, otosklerosrelaterad hörselnedsättning.
- Användning av östrogener kan inducera eller förvärra symtomen av hereditärt eller förvärvat angioödem.
- Akut eller kronisk hepatisk dysfunktion kan göra det nödvändigt att göra ett uppehåll i användningen av kombinerade p‑piller tills leverfunktionsvärdena återgått till det normala. Recidiv av kolestatisk ikterus och/eller kolestasrelaterad pruritus som uppträtt första gången under en graviditet eller förekommit under tidigare användning av könshormoner gör det nödvändigt att avbryta användningen av kombinerade p‑piller.
- Även om kombinerade p‑piller kan påverka den perifera insulinresistensen eller glukostoleransen finns det inga bevis för att det är nödvändigt att justera dosen av antidiabetika för diabetiker som använder kombinerade p‑piller (innehållande < 0,05 mg etinylestradiol). Diabetiker som använder kombinerade p‑piller ska dock stå under noggrann läkarkontroll.
- Crohns sjukdom och ulcerös kolit har associerats med användning av kombinerade p‑piller.
- Kloasma kan ibland förekomma, särskilt hos kvinnor som haft kloasma under en graviditet. Kvinnor med benägenhet för kloasma ska undvika solexponering och exponering för ultraviolett strålning under användningen av kombinerade p‑piller.
- Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depression kan vara allvarligt och är en välkänd riskfaktor för självdestruktivt beteende och självmord. Kvinnor ska rådas att kontakta sin läkare om de upplever humörförändringar och depressiva symtom, också kort efter inledd behandling.
- Detta läkemedel innehåller 55 mg laktos per vit tablett och 55 mg laktos per grön tablett. Patienter som håller en laktosfri diet och som uppvisar något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos‑galaktosmalabsorption.
Informationen som ges ovan ska beaktas vid valet av preventivmedel.
Läkarundersökning
Innan användning av Lumivela påbörjas eller återupptas ska en fullständig anamnes (inklusive familjeanamnes) tas och graviditet uteslutas. Blodtrycket ska mätas och en läkarundersökning utföras, med beaktande av kontraindikationerna (se avsnitt Kontraindikationer) och varningarna (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Lumivela jämfört med andra kombinerade hormonella preventivmedel, symtomen på venösa och arteriella tromboser, de kända riskfaktorerna samt vad hon ska göra om hon misstänker en trombos.
Kvinnan ska också uppmanas att noggrant läsa igenom bipacksedeln och följa anvisningarna i den. Frekvensen och typen av uppföljningsbesök ska baseras på vedertagna behandlingsriktlinjer och anpassas individuellt efter kvinnans kliniska behov.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hivinfektioner (AIDS) eller andra sexuellt överförbara sjukdomar.
Minskad effekt
Effekten av kombinerade p-piller kan försvagas i händelse av glömda tabletter (se avsnitt Dosering och administreringssätt ”Glömda tabletter”), gastrointestinala störningar (se avsnitt Dosering och administreringssätt ”Anvisningar i händelse av gastrointestinala rubbningar”) eller vid samtidig användning av läkemedel som minskar plasmakoncentrationerna av etinylestradiol och/eller etonogestrel, den aktiva metaboliten av desogestrel (se avsnitt Interaktioner).
Naturläkemedel som innehåller johannesört (Hypericum perforatum) ska inte tas samtidigt med Lumivela, eftersom det finns en risk för minskade plasmakoncentrationer och försämrad klinisk effekt av Lumivela (se avsnitt Interaktioner).
Försämrad cykelkontroll
Alla kombinerade hormonella preventivmedel kan orsaka oregelbundna blödningar (stänkblödningar eller genombrottsblödning), särskilt under de första månaderna av användning. Därför är utredning av eventuella oregelbundna blödningar meningsfullt först efter en anpassningsperiod på cirka tre cykler.
Om blödningsrubbningarna kvarstår eller om de uppträder efter tidigare regelbundna cykler ska icke‑hormonella orsaker övervägas. Adekvata diagnostiska åtgärder (eventuellt också skrapning av livmodern) är indicerade för att utesluta malignitet eller graviditet.
Ibland kan bortfallsblödningen utebli under placebotablettfasen. Om p‑pillren har tagits enligt anvisningarna i avsnitt Dosering och administreringssätt är kvinnan sannolikt inte gravid. Har preparatet däremot inte tagits enligt anvisningarna före den första uteblivna bortfallsblödningen, eller om två bortfallsblödningar uteblivit, måste graviditet uteslutas innan kvinnan fortsätter använda p‑pillren.
Interaktioner
Interaktioner
Observera: Produktresuméerna för andra samtidigt använda läkemedel ska konsulteras för att identifiera potentiella interaktioner.
Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glecaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt Kontraindikationer).
Därför måste användare av Lumivela byta till en annan preventivmetod (t.ex. preventivmedel med enbart gestagen eller icke‑hormonella metoder) innan dessa kombinationsbehandlingar påbörjas. Användningen av Lumivela kan återupptas 2 veckor efter att dessa kombinationsbehandlingar avslutats.
Andra läkemedels inverkan på Lumivela
Interaktioner kan uppkomma med läkemedel eller växtbaserade läkemedel som inducerar mikrosomala enzymer, speciellt cytokrom P450-enzymer (CYP), och som kan öka clearance av könshormoner, vilket kan leda till genombrottsblödningar och/eller graviditet.
Behandling
Enzyminduktion kan observeras redan efter några dagars behandling. Maximal enzyminduktion uppträder vanligtvis inom några veckor. Efter avslutad läkemedelsbehandling kan effekten av enzyminduktionen kvarstå i cirka fyra veckor.
Korttidsbehandling
Kvinnor som får behandling med enzyminducerande läkemedel eller växtbaserade läkemedel ska temporärt använda en barriärmetod eller en annan form av preventivmedel som komplement till det kombinerade p-pillret. Barriärmetoden måste användas under hela den samtidiga läkemedelsbehandlingen och i ytterligare 28 dagar efter avslutad behandling.
Om läkemedelsbehandlingen fortsätter efter det att de aktiva tabletterna på blistret med p‑piller tagit slut måste placebotabletterna kasseras och följande blister påbörjas omedelbart.
Långtidsbehandling
För kvinnor som står på långtidsbehandling med enzyminducerande läkemedel ska en alternativ tillförlitlig, icke-hormonell preventivmetod som inte påverkas av enzyminducerande läkemedel övervägas.
Följande interaktioner har rapporterats i litteraturen
Exempel på ämnen som ökar clearance av Lumivela (minskar effekten av kombinerade p‑piller genom enzyminduktion):
Fenytoin, fenobarbital, primidon, bosentan, karbamazepin, rifampicin, vissa hiv-proteashämmare (t.ex. ritonavir), och icke-nukleosida hämmare av omvänt transkriptas (t.ex. nevirapin, efavirenz) samt eventuellt även felbamat, griseofulvin, oxkarbazepin, topiramat, rifabutin och växtbaserade läkemedel som innehåller johannesört (Hypericum perforatum).
Ämnen med varierande effekter på clearance av Lumivela
Många kombinationer av hiv-proteashämmare (t.ex. nelfinavir) och icke-nukleosida hämmare av omvänt transkriptas (t.ex. nevirapin) och/eller kombinationer med hepatit C-virushämmare (HCV-hämmare) (t.ex. boceprevir, telaprevir) kan öka eller minska plasmakoncentrationen av gestagener, inklusive etonogestrel eller östrogen, vid samtidig användning av hormonella preventivmedel. Den totala effekten av dessa förändringar kan vara kliniskt betydelsefull i vissa fall.
Därför ska produktresumén för samtidigt administrerade hiv‑/HCV‑läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella tillhörande rekommendationer. Om en interaktion misstänks kunna uppkomma ska en barriärmetod användas som tillägg av kvinnor som får behandling med en proteashämmare eller icke‑nukleosid hämmare av omvänt transkriptas.
Ämnen som minskar clearance av Lumivela (enzymhämmare)
Den kliniska relevansen av potentiella interaktioner med enzymhämmare är fortfarande okänd.
Samtidig administrering av starka (t.ex. ketokonazol, itrakonazol, klaritromycin) eller måttliga (t.ex. flukonazol, diltiazem, erytromycin) CYP3A4‑hämmare kan öka serumkoncentrationerna av östrogener eller gestagener, inklusive etonogestrel.
Etoricoxibdoser på 60 mg till 120 mg/dag har visat sig öka plasmakoncentrationerna av etinylestradiol 1,4 gånger respektive 1,6 gånger, när etoricoxib tas samtidigt med ett kombinerat hormonellt preventivmedel innehållande 0,035 mg etinylestradiol.
Lumivelas inverkan på andra läkemedel
P‑piller kan störa metabolismen av andra läkemedel, vars koncentration i plasma och vävnad därmed antingen kan öka (t.ex. ciklosporin) eller minska (t.ex. lamotrigin).
Kliniska data tyder på att etinylestradiol hämmar clearance av CYP1A2-substrat, vilket leder till en liten (t.ex. teofyllin) eller måttlig (t.ex. tizanidin) ökning av deras plasmakoncentrationer.
Laboratorievärden
Användning av steroider för antikonception kan påverka vissa laboratorievärden, såsom biokemiska parametrar för lever-, sköldkörtel-, binjure- och njurfunktion, plasmakoncentrationer av (bärar)proteiner (exempelvis kortikosteroidbindande globulin och lipid-/lipoproteinfraktioner), parametrar för kolhydratmetabolism och parametrar för koagulation och fibrinolys. Dessa förändringar ligger vanligtvis inom normalområdet.
Fertilitet, graviditet och amning
Graviditet
Lumivela är inte indicerat under graviditet. Om kvinnan blir gravid under användningen av Lumivela ska läkemedlet omedelbart sättas ut. De flesta epidemiologiska studierna har dock inte påvisat någon förhöjd risk för medfödda missbildningar hos barn födda av kvinnor som använde kombinerade p‑piller före graviditeten och inte heller på någon risk för teratogena effekter när kombinerade p‑piller använts i ett tidigt skede av graviditeten.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Lumivela (se avsnitten Dosering och administreringssätt och Varningar och försiktighet).
Amning
Amningen kan påverkas av kombinerade p‑piller eftersom dessa kan minska mängden bröstmjölk och ändra dess sammansättning. Därför ska kombinerade p‑piller enligt rekommendationen i regel inte användas förrän den ammande kvinnan har avvant barnet. Små mängder kontraceptiva steroider och/eller deras metaboliter kan utsöndras i bröstmjölk, men det finns inga bevis för att detta påverkar spädbarns hälsa negativt.
Effekter på förmågan att framföra fordon och använda maskiner
Inga effekter på förmågan att framföra fordon eller använda maskiner har observerats.
Biverkningar
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och tromboemboliska händelser, bl.a. hjärtinfarkt, stroke, transitoriska ischemiska attacker (TIA), venös trombos och lungemboli, har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket beskrivs mer i detalj i avsnitt Varningar och försiktighet.
Liksom med alla kombinerade p‑piller kan förändringar i blödningsmönstret förekomma också med detta preparat, särskilt under de första månaderna som det används. Dessa kan innefatta förändringar i blödningarnas frekvens (obefintliga, mer sällan, mer frekventa eller kontinuerliga), intensitet (minskad eller ökad mängd) eller varaktighet.
Biverkningar som har rapporterats hos användare av Lumivela eller kombinerade p‑piller i allmänhet och som eventuellt är relaterade till användningen anges i tabellen nedan1: Alla biverkningar är listade enligt organklass och frekvens: vanliga (≥ 1/100), mindre vanliga (≥ 1/1 000, <1/100), sällsynta (<1/1 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
| Organsystem | Vanliga
| Mindre vanliga
| Sällsynta
| Ingen känd frekvens |
|---|---|---|---|---|
| Immunsystemsjukdomar | Överkänslighet | Förvärrade symtom på hereditärt eller förvärvat angioödem | ||
| Metabolism och nutrition | Vätskeretention | |||
| Psykiatriska sjukdomar | Depression Humörsvängningar | Minskad libido | Ökad libido | |
| Centrala och perifera nervsystemet | Huvudvärk
| Migrän | ||
| Ögon | Svårighet att använda kontaktlinser | |||
| Vaskulära sjukdomar | Venös tromboembolism (VTE) Arteriell tromboembolism (ATE) | |||
| Magtarmkanalen | Illamående Buksmärta | Kräkningar, diarré | ||
| Sjukdomar i hud och subkutan vävnad | Utslag Urtikaria | Erythema nodosum Erythema multiforme
| ||
| Sjukdomar i fortplantningssystem och bröst | Ömhet i brösten Smärta i brösten | Bröstförstoring
| Vaginal flytning Bröstsekretion | |
| Utredningar | Viktökning | Viktminskning |
1 Den vanligaste lämpliga MedDRA‑termen som beskriver en viss biverkning listas i tabellen. Synonymer eller besläktade tillstånd listas inte men ska också beaktas.
Vissa biverkningar som rapporterats av personer som använder kombinerade p‑piller beskrivs i detalj i avsnitt Varningar och försiktighet, däribland hypertoni, hormonberoende tumörer (t.ex. lever- eller brösttumörer) och kloasma.
Interaktioner
Interaktioner mellan andra läkemedel (enzyminducerare) och p‑piller kan orsaka genombrottsblödningar och/eller minskad preventiv effekt (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta‑riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns inga rapporter om allvarliga biverkningar vid överdosering.
Symtom som kan förekomma är: illamående, kräkningar samt lätt vaginalblödning hos unga flickor. Det finns ingen antidot, och den fortsatta behandlingen ska vara symtomatisk.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: gestagener och östrogener, ATC‑kod: G03AA09
Den preventiva effekten av kombinerade hormonella preventivmedel bygger på interaktioner av olika faktorer, varav de viktigaste är ovulationshämning och förändringar i livmoderhalssekretet. Vid sidan av skydd mot graviditet har användning av kombinerade hormonella preventivmedel många andra fördelar som, tillsammans med nackdelarna (se avsnitten Varningar och försiktighet och Biverkningar), är viktiga att beakta vid valet av preventivmetod. Menstruationscyklerna blir mer regelbundna och menstruationerna ofta mindre smärtsamma, samtidigt som blödningsmängden minskar. Det senare resulterar i minskad förekomst av järnbristanemi. Dessutom har man vid användning av kombinerade p‑piller i höga doser (50 µg etinylestradiol) sett indikationer på att risken för fibrocystiska brösttumörer, ovariecystor, bäckeninflammation, ektopisk graviditet, endometriecancer och ovarialcancer minskar. Om detta även gäller för kombinerade p‑piller i låg dos har ännu inte bekräftats.
Pediatrisk population
Kliniska data om säkerhet och effekt hos ungdomar under 18 år är inte tillgängliga.
Farmakokinetiska egenskaper
Desogestrel
Absorption
Efter oral administrering av Lumivela absorberas desogestrel snabbt och omvandlas till etonogestrel. Maximal plasmakoncentration, cirka 2 ng/ml, uppnås cirka 1,5 timmar efter intag av en enkeldos. Den absoluta biotillgängligheten för 3‑keto‑desogestrel är 62–81 %.
Distribution
Etonogestrel binder till serumalbumin och till könshormonbindande globulin (SHBG). Endast 2–4 % av de totala serumkoncentrationerna av läkemedlet är närvarande som fri steroid; 40–70 % är specifikt bundet till SHBG. Den etinylestradiolinducerade ökningen av SHBG påverkar distributionen mellan serumproteiner och orsakar en ökning av den SHBG‑bundna fraktionen och en minskning av den albuminbundna. Distributionsvolymen för desogestrel är 1,5 l/kg.
Metabolism
Etonogestrel metaboliseras fullständigt via de kända vägarna för steroidmetabolism. Metabolt clearance från serum är cirka 2 ml/minut/kg. Ingen interaktion upptäcktes med samtidigt administrerat etinylestradiol.
Eliminering
Serumnivåerna av etonogestrel minskar i två faser. Den terminala fasen karakteriseras av en halveringstid på cirka 30 timmar. Desogestrel och dess metaboliter utsöndras via urin och galla med en kvot på cirka 6:4.
Steady state
Farmakokinetiken för etonogestrel påverkas av SHBG-nivåerna, vilka ökar trefaldigt av etinylestradiol. Efter dagligt intag ökar serumnivåerna av läkemedlet ungefär två- till trefaldigt, och steady state uppnås under den andra hälften av behandlingscykeln.
Etinylestradiol
Absorption
Oralt administrerat etinylestradiol absorberas snabbt och fullständigt. Maximal serumkoncentration, cirka 80 pg/ml, uppnås inom 1–2 timmar efter intag av en dos. Den absoluta biotillgängligheten är cirka 60 % och är ett resultat av presystemisk konjugering och förstapassagemetabolism.
Distribution
Etinylestradiol är i hög grad, men icke-specifikt, bundet till serumalbumin (cirka 98,5 %) och inducerar en ökning av serumkoncentrationerna av SHBG. En skenbar distributionsvolym på omkring 5 l/kg har fastställts.
Metabolism
Etinylestradiol genomgår presystemisk konjugering i såväl tunntarmens slemhinna som i levern. Etinylestradiol metaboliseras primärt genom aromatisk hydroxylering, men ett stort antal olika hydroxylerade och metylerade metaboliter bildas, och dessa är närvarande som fria metaboliter och som glukuronid- och sulfatkonjugat. Metabolt clearance är cirka 5 ml/min/kg.
In vitro är etinylestradiol en reversibel hämmare av CYP2C19, CYP1A1 och CYP1A2 samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Eliminering
Serumnivåerna av etinylestradiol minskar i två faser. Den terminala fasen karakteriseras av en halveringstid på cirka 24 timmar. Inget oförändrat läkemedel utsöndras; metaboliterna av etinylestradiol utsöndras via urin och galla med en kvot på 4:6. Halveringstiden för utsöndringen av metaboliterna är cirka 1 dag.
Steady state
Steady state‑koncentrationer uppnås efter 3–4 dagar, när serumnivåerna av etinylestradiol är 30–40 % högre än efter en enkeldos.
Prekliniska säkerhetsuppgifter
Prekliniska studier av etinylestradiol och desogestrel visade inte några särskilda risker för människa, när kombinerade p-piller användes enligt anvisningarna. Denna slutsats baserar sig på gängse studier avseende allmäntoxicitet, gentoxicitet, karcinogenicitet och reproduktionseffekter. Man ska dock ha i åtanke att könshormoner kan främja tillväxten av vissa hormonberoende vävnader och tumörer.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Aktiva filmdragerade tabletter (vita):
-
Tablettkärna:
Laktosmonohydrat
Majsstärkelse
Povidon K‑30 (E1201)
RRR‑α‑tokoferol (E307)
Sojaolja
Hydratiserad kolloidal kiseldioxid (E551)
Vattenfri, kolloidal kiseldioxid (E551)
Stearinsyra (E570) -
Tablettens filmdragering:
Hypromellos 2910 (E464)
Makrogol 400
Titanidioxid (E171)
Filmdragerade placebotabletter (gröna):
-
Tablettkärna:
Laktosmonohydrat
Majsstärkelse
Povidon K‑30 (E1201)
Vattenfri, kolloidal kiseldioxid (E551)
Magnesiumstearat (E572) -
Tablettens filmdragering:
Hypromellos 2910 (E464)
Triacetin (E1518)
Polysorbat 80
Titanidioxid (E171)
Indigokarmin‑aluminiumlack (E132)
Gul järnoxid (E172)
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 ºC. Förvaras i originalförpackningen. Ljuskänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
LUMIVELA tabletti, kalvopäällysteinen
150/20 mikrog (L:kyllä) 3 x 28 fol (14,45 €)
PF-selosteen tieto
Blister med ett bakre skikt av aluminium och en klar eller lätt ogenomskinlig PVC/PVDC‑film.
Förpackningsstorlekar:
1 x 21 + 7 filmdragerade tabletter (21 aktiva tabletter och 7 placebotabletter)
3 x 21 + 7 filmdragerade tabletter (21 aktiva tabletter och 7 placebotabletter)
6 x 21 + 7 filmdragerade tabletter (21 aktiva tabletter och 7 placebotabletter)
13 x 21 + 7 filmdragerade tabletter (21 aktiva tabletter och 7 placebotabletter)
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Aktiva tabletter: vit, rund filmdragerad tablett med en diameter på 5 mm. Tabletten är märkt med ”C” på ena sidan och med ”5” på andra sidan.
Placebotabletter: grön, rund, filmdragerad tablett med en diameter på 5 mm.
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
LUMIVELA tabletti, kalvopäällysteinen
150/20 mikrog 3 x 28 fol
- Ei korvausta.
Atc-kod
G03AA09
Datum för översyn av produktresumén
04.11.2024
Yhteystiedot
Strandvägen 7 A
114 56 Stockholm
Sweden
