WAKIX tabletti, kalvopäällysteinen 4,5 mg, 18 mg
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Wakix 4,5 mg kalvopäällysteinen tabletti
Kukin tabletti sisältää pitolisanttihydrokloridia määrän, joka vastaa 4,45 mg:aa pitolisanttia.
Wakix 18 mg kalvopäällysteinen tabletti
Kukin tabletti sisältää pitolisanttihydrokloridia määrän, joka vastaa 17,8 mg:aa pitolisanttia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti
Kliiniset tiedot
Käyttöaiheet
Wakix on tarkoitettu aikuisten, nuorten ja vähintään 6-vuotiaiden lasten narkolepsia-katapleksian tai narkolepsian ilman katapleksiaa hoitoon (ks. myös kohta Farmakodynamiikka).
Ehto
Hoito on aloitettava unihäiriöiden hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito on aloitettava unihäiriöiden hoitoon perehtyneen lääkärin valvonnassa.
Annostus
Aikuiset
Wakix-valmistetta pitää käyttää pienimpänä tehokkaana annoksena potilaan yksilöllisen vasteen ja sietokyvyn mukaan. Annosta voidaan titrata suuremmaksi seuraavasti ylittämättä kuitenkaan 36 mg:n vuorokausiannosta:
- Viikko 1: aloitusannos 9 mg (kaksi 4,5 mg:n tablettia) vuorokaudessa.
- Viikko 2: annos voidaan suurentaa 18 mg:aan (yhteen 18 mg:n tablettiin) vuorokaudessa tai pienentää 4,5 mg:aan (yhteen 4,5 mg:n tablettiin) vuorokaudessa.
- Viikko 3: annos voidaan suurentaa 36 mg:aan (kahteen 18 mg:n tablettiin) vuorokaudessa.
Annosta voidaan missä tahansa vaiheessa pienentää (4,5 mg:aan saakka vuorokaudessa) tai suurentaa (enintään 36 mg:aan vuorokaudessa) hoitavan lääkärin arvion ja potilaan hoitovasteen mukaan.
Koko vuorokausiannos otetaan yhtenä kerta-annoksena aamiaisen yhteydessä.
Tehon säilyminen
Pitkäaikaistehoa koskevaa tietoa on vähän (ks. kohta Farmakodynamiikka), joten lääkärin pitää arvioida hoidon tehoa jatkuvasti säännöllisin väliajoin.
Erityisryhmät
Iäkkäät
Iäkkäitä koskevia tietoja on saatavilla vähän. Tämän vuoksi iäkkäiden potilaiden annosta pitää säätää yksilöllisesti maksan ja munuaisten toiminnan mukaan.
Munuaisten vajaatoiminta
Suurin vuorokausiannos munuaisten vajaatoimintaa sairastaville potilaille on 18 mg.
Maksan vajaatoiminta
Keskivaikeaa maksan vajaatoimintaa (Child–Pugh B) sairastavien potilaiden annosta voidaan suurentaa kaksi viikkoa hoidon aloittamisen jälkeen, mutta vuorokausiannos ei saa ylittää 18 mg:n enimmäisannosta (ks. kohta Farmakokinetiikka).
Pitolisantti on vasta-aiheista potilaille, joilla on vaikeaa maksan vajaatoimintaa (Child–Pugh C) (ks. kohta Vasta-aiheet).
Lievää maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa.
Pediatriset potilaat
Wakix-valmisteen optimaalinen annos riippuu potilaan yksilöllisestä vasteesta ja sietokyvystä, , mutta ei saa ylittää annosta 36 mg/vrk (alle 40 kg:n painoisilla lapsilla 18 mg/vrk). Titrausohjelma:
- Viikko 1: aloitusannos 4,5 mg (yksi 4,5 mg:n tabletti) vuorokaudessa.
- Viikko 2: annos voidaan suurentaa 9 mg:aan (kaksi 4,5 mg:n tablettia) vuorokaudessa.
- Viikko 3: annos voidaan suurentaa 18 mg:aan (yksi 18 mg:n tabletti) vuorokaudessa.
- Viikko 4: vähintään 40 kg painavien lasten annos voidaan suurentaa 36 mg:aan (kaksi 18 mg:n tablettia) vuorokaudessa.
Annosta voidaan milloin tahansa pienentää (4,5 mg:aan vuorokaudessa saakka) tai suurentaa (vähintään 40 kg painavilla lapsilla enintään 36 mg:aan vuorokaudessa tai alle 40 kg painavilla lapsilla 18 mg:aan päivässä) lääkärin arvion ja potilaan vasteen mukaan.
Koko vuorokausiannos pitää ottaa kerta-annoksena aamuisin aamupalan yhteydessä.
Hitaat metaboloijat
Hitailla CYP2D6-metaboloijilla on havaittu nopeita CYP2D6-metaboloijia suurempi (suurimmillaan kolminkertainen) systeeminen altistus. Suurempi altistus pitää ottaa huomioon titrattaessa annosta suuremmaksi.
Antotapa
Suun kautta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainitulle apuaineille.
Vaikea maksan vajaatoiminta (Child-Pugh C).
Imetys (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Psyykkiset häiriöt
Pitolisantin käytössä pitää olla varovainen, jos potilaalla on aiemmin ollut psyykkisiä häiriöitä, kuten vaikeaa ahdistuneisuutta tai vaikeaa masennusta, johon on liittynyt itsemurha-ajatusten riski. Pitolisantilla hoidetuilla potilailla, joilla on anamneesissa psyykkisiä häiriöitä, on raportoitu itsemurha-ajatuksia.
Maksan tai munuaisten vajaatoiminta
Pitolisantin käytössä pitää olla varovainen, jos potilaalla on joko munuaisten vajaatoimintaa tai keskivaikeaa maksan vajaatoimintaa (Child–Pugh B), ja annostelussa on noudatettava kohdassa Annostus ja antotapa annettuja ohjeita.
Ruoansulatuselimistön häiriöt
Pitolisantin käyttöön on raportoitu liittyneen mahalaukun häiriöitä, joten sen käytössä pitää olla varovainen, jos potilaalla on mahan happovaivoja (ks. kohta Haittavaikutukset) tai jos potilas käyttää samanaikaisesti mahalaukkua ärsyttäviä lääkkeitä, kuten kortikosteroideja tai tulehduskipulääkkeitä (NSAIDeja).
Ravitsemus
Pitolisanttia pitää antaa varoen vaikeasti lihaville tai vaikeaa anoreksiaa sairastaville potilaille (ks. kohta Haittavaikutukset). Jos potilaan paino muuttuu merkittävästi, lääkärin pitää arvioida hoito uudelleen.
Sydänhäiriöt
Kahdessa QT-aikaa selvittäneessä tutkimuksessa supraterapeuttisten pitolisanttiannosten (3–6 kertaa hoitoannosta suurempi annos, ts. 108–216 mg) käytössä havaittiin lievää tai kohtalaista QTc-ajan pitenemistä (10–13 ms). Kliinisissä tutkimuksissa pitolisantin hoitoannosten käytössä ei havaittu erityisiä sydämeen liittyviä turvallisuussignaaleja. Tästä huolimatta potilasta on seurattava tarkasti (ks. kohta Yhteisvaikutukset), jos hänellä on sydänsairaus, samanaikainen toinen QT-aikaa pidentävä tai repolarisaatiohäiriöiden riskiä tunnetusti suurentava lääkitys tai samanaikainen lääkitys, jonka tiedetään suurentavan merkittävästi pitolisantin huippupitoisuuden (Cmax) ja altistuksen (AUC) suhdetta (ks. kohta Yhteisvaikutukset), tai jos potilaalla on vaikeaa munuaisten vajaatoimintaa tai keskivaikeaa maksan vajaatoimintaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epilepsia
Eläinmalleissa on raportoitu kouristuksia suurten annosten yhteydessä (ks. kohta Prekliiniset tiedot turvallisuudesta). Kliinisissä tutkimuksissa yhden potilaan epilepsia paheni. Vaikea-asteista epilepsiaa sairastavien potilaiden hoidossa pitää olla varovainen.
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään 21 vuorokauden ajan hoidon päättymisen jälkeen (perustuu pitolisantin/metaboliittien puoliintumisaikaan). Pitolisantti saattaa heikentää hormonaalisen ehkäisyn tehoa. Tämän vuoksi hormonaalista ehkäisyä käyttävien naispotilaiden on käytettävä vaihtoehtoista tehokasta ehkäisymenetelmää (ks. kohdat Yhteisvaikutukset ja Raskaus ja imetys).
Lääkkeiden yhteisvaikutukset
Pitolisantin käyttöä yhdessä CYP3A4:n substraattien kanssa, joiden terapeuttinen marginaali on kapea, pitää välttää (ks. kohta Yhteisvaikutukset).
Rebound-vaikutus
Kliinisissä tutkimuksissa ei raportoitu rebound-vaikutuksia. Hoidon lopettamista pitää kuitenkin seurata.
Lääkkeiden väärinkäyttö
Kliinisten tietojen mukaan pitolisantin väärinkäyttöä ei todettu tai todettiin vähän (ihmisillä esiintyvää väärinkäyttöä koskeva spesifinen tutkimus aikuisilla annoksilla 36–216 mg ja havaitut väärinkäyttöön liittyvät haittavaikutukset vaiheen 3 tutkimuksissa).
Yhteisvaikutukset
Masennuslääkkeet
Tri- tai tetrasykliset masennuslääkkeet (esim. imipramiini, klomipramiini ja mirtatsapiini) saattavat heikentää pitolisantin tehoa, koska niillä on histamiini-H1-reseptoria antagonisoivia ominaisuuksia, ja kumota hoidon aivoissa vapauttaman endogeenisen histamiinin vaikutuksen.
Antihistamiinit
Veri-aivoesteen läpäisevät antihistamiinit (H1-reseptorin antagonistit, esim. feniramiinimaleaatti, kloorifeniramiini, difenhydramiini, prometatsiini, mepyramiini ja doksylamiini) saattavat heikentää pitolisantin tehoa.
QT-aikaa pidentävät aineet ja aineet, joiden tiedetään suurentavan repolarisaatiohäiriöiden riskiä
Yhdistelmähoitoa pitolisantin kanssa pitää seurata tarkasti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset
Pitolisantin metaboliaan vaikuttavat lääkevalmisteet
- Entsyymi-induktorit
Pitolisantin anto usein samanaikaisesti rifampisiinin kanssa pienentää merkittävästi pitolisantin keskimääräistä Cmax- (39 %) ja AUC-arvon (50 %) suhdetta. Pitolisantin ja voimakkaiden CYP3A4:n induktorien (esim. rifampisiini, fenobarbitaali, karbamatsepiini ja fenytoiini) samanaikaisessa annossa pitää siksi olla varovainen. Mäkikuismalla (Hypericum perforatum) on voimakas CYP3A4:ää indusoiva vaikutus, joten sen ja pitolisantin samanaikaisessa käytössä pitää olla varovainen. Kliininen seuranta on tarpeen, jos näitä vaikuttavia aineita käytetään yhdistelmänä, ja annosta on mahdollisesti muutettava yhdistelmäkäytön aikana ja viikoksi induktorihoidon päättymisen jälkeen.
Kliinisessä moniannostutkimuksessa pitolisantin ja probenesidin yhdistelmä pienensi pitolisantin AUC-arvoa noin 34 %.
- CYP2D6:n estäjät
Pitolisantin ja paroksetiinin samanaikainen käyttö suurentaa merkittävästi pitolisantin keskimääräistä Cmax- (noin 47 %) ja AUC0—72h-suhdetta (noin 105 %). Koska pitolisanttialtistus suurenee kaksinkertaiseksi, CYP2D6:n estäjien (esim. paroksetiini, fluoksetiini, venlafaksiini, duloksetiini, bupropioni, kinidiini, terbinafiini ja sinakalseetti) samanaikaisessa käytössä pitää olla varovainen. Annoksen muuttamista yhdistelmähoidon aikana voidaan harkita.
Lääkevalmisteet, joiden metaboliaa pitolisantti saattaa muuttaa
- CYP3A4:n ja CYP2B6:n substraatit
In vitro -tietojen perusteella pitolisantti ja sen päämetaboliitit saattavat terapeuttisina pitoisuuksina indusoida CYP3A4- ja CYP2B6-entsyymejä sekä ekstrapolaation perusteella myös CYP2C:tä, UGT:tä ja P-glykoproteiinia (P-gp). Tämän yhteisvaikutuksen voimakkuudesta ei ole kliinisiä tietoja saatavilla. Näin ollen pitolisantin käyttöä yhdistelmänä pitää välttää CYP3A4:n substraattien kanssa, joiden terapeuttinen marginaali on kapea (esim. immunosuppressiiviset lääkevalmisteet, dosetakseli, kinaasin estäjät, sisapridi, pimotsidi ja halofantriini) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Muiden CYP3A4:n, CYP2B6:n (esim. efavirentsi ja bupropioni), CYP2C:n (esim. repaglinidi, fenytoiini ja varfariini), P-gp:n (esim. dabigatraani ja digoksiini) tai UGT:n (esim. morfiini, parasetamoli ja irinotekaani) substraattien käytössä pitää olla varovainen ja näiden tehon kliininen seuranta on tarpeen.
Suun kautta otettavat ehkäisyvalmisteet: yhdistelmäkäyttöä pitolisantin kanssa pitää välttää, ja lisäksi on käytettävä muuta luotettavaa ehkäisymenetelmää.
- OCT1:n substraatit
Pitolisantin on havaittu estävän OCT1:n (orgaanisten kationien kuljettaja 1:n) toimintaa yli 50 % pitoisuutena 1,33 mikroM. Pitolisantin ekstrapoloitu IC50-arvo on 0,795 mikroM.
Vaikka tämän vaikutuksen kliinistä merkitystä ei ole varmistettu, pitolisantin käytössä yhdessä OCT1:n substraatin kanssa (esim. metformiini [biguanidit]) kehotetaan olemaan varovainen (ks. kohta Farmakokinetiikka).
Pitolisantin käyttöä yhdistelmänä modafiniilin tai natriumoksibaatin kanssa terapeuttisina annoksina narkolepsian tavanomaiseen hoitoon arvioitiin terveillä vapaaehtoisilla. Kliinisesti oleellisia lääkkeiden yhteisvaikutuksia modafiniilin tai natriumoksibaatin kanssa ei todettu.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään 21 vuorokauden ajan hoidon lopettamisen jälkeen (perustuu pitolisantin/metaboliittien puoliintumisaikaan). Pitolisantti saattaa / metaboliitit saattavat heikentää hormonaalisten ehkäisyvalmisteiden tehoa. Hormonaalista ehkäisyä käyttävien naisten pitää siksi käyttää tehokasta vaihtoehtoista ehkäisyä (ks. kohta Yhteisvaikutukset).
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja pitolisantin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta, mukaan lukien teratogeenisuutta. Pitolisantin/ metaboliittien havaittiin läpäisevän rottien istukan (ks. kohta Prekliiniset tiedot turvallisuudesta).
Pitolisanttia ei pidä käyttää raskauden aikana, ellei mahdollinen hyöty ole sikiölle aiheutuvaa mahdollista riskiä suurempi.
Imetys
Eläinkokeissa on osoitettu, että pitolisantti erittyy / metaboliitit erittyvät maitoon. Tämän vuoksi imettäminen on vasta-aiheista pitolisanttihoidon aikana (ks. kohta Vasta-aiheet).
Hedelmällisyys
Eläinkokeissa on havaittu vaikutuksia siemennesteen parametreihin, mutta ei merkittävää vaikutusta urosten lisääntymissuoritukseen eikä elävien sikiöiden prosenttiosuuteen hoidetuilla naarailla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Pitolisantilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Pitolisanttia käyttäville potilaille, joilla on poikkeavaa uneliaisuutta, pitää kertoa, että heidän vireystilansa ei välttämättä palaudu normaaliksi. Potilaiden, joilla on päiväaikaista uneliaisuutta, mukaan lukien pitolisanttia käyttävien potilaiden, uneliaisuus pitää arvioida uudelleen tihein väliajoin, ja heitä pitää tarvittaessa kehottaa välttämään ajamista tai muuta mahdollisesti vaarallista toimintaa.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät aikuisilla raportoidut pitolisantin haittavaikutukset olivat unettomuus (8,4 %), päänsärky (7,7 %), pahoinvointi (4,8 %), ahdistuneisuus (2,1 %), ärtyneisyys (1,8 %), heitehuimaus (1,4 %), masennus (1,3 %), vapina (1,2 %), unihäiriöt (1,1 %), uupumus (1,1 %), oksentelu (1,0 %), kiertohuimaus (vertigo) (1,0 %), dyspepsia (1,0 %), painonnousu (0,9 %) ja ylävatsakipu (0,9 %). Vakavimmat haittavaikutukset olivat poikkeava painonlasku (0,09 %) ja keskenmeno (0,09 %).
Haittavaikutustaulukko
Seuraavia haittavaikutuksia on raportoitu pitolisantilla tehtyjen narkolepsiaa ja muita käyttöaiheita koskeneiden kliinisten tutkimusten aikana, ja ne luetellaan jäljempänä MedDRA-elinjärjestelmän suositeltujen termien ja esiintymistiheyden mukaan: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
MedDRA- elinjärjestelmäluokka | Yleinen | Melko harvinainen | Harvinainen |
Aineenvaihdunta ja ravitsemus |
| Heikentynyt ruokahalu Lisääntynyt ruokahalu Nesteen kertyminen elimistöön | Ruokahaluttomuus Ylensyöminen Syömishäiriöt |
Psyykkiset häiriöt | Unettomuus Ahdistuneisuus Ärtyneisyys Masennus Unihäiriöt | Agitaatio Hallusinaatiot Näkö- ja kuuloharhat Affektilabiilius Epänormaalit unet Dyssomnia Yöllinen heräily Nukahtamisvaikeudet Liian varhainen herääminen Hermostuneisuus Jännittyneisyys Apatia Painajaiset Levottomuus Paniikkikohtaukset Heikentynyt libido Voimistunut libido Itsemurha-ajatukset | Poikkeava käytös Sekavuustila Alakuloisuus Ärtyvyys Pakkoajatukset Epämiellyttävä olo Hypnopompiset hallusinaatiot Masennusoireet Hypnagogiset hallusinaatiot Mielenterveyden heikkeneminen |
Hermosto | Päänsärky Heitehuimaus Vapina | Pakkoliikkeet Tasapainohäiriöt Katapleksia Keskittymiskyvyn häiriöt Dystonia ”On-off”-ilmiö Hypersomnia Migreeni Psykomotorinen ylivilkkaus Levottomat jalat ‑oireyhtymä Uneliaisuus Epilepsia Hidasliikkeisyys Parestesia | Tajunnan menetys Jännityspäänsärky Muistin heikkeneminen Huono unen laatu |
Silmät |
| Heikentynyt näöntarkkuus Blefarospasmi |
|
Kuulo ja tasapainoelin | Kiertohuimaus (vertigo) | Tinnitus |
|
Sydän |
| Lisälyönnit Bradykardia |
|
Verisuonisto |
| Hypertensio Hypotensio Kuumat aallot |
|
Hengityselimet, rintakehä ja välikarsina |
| Haukottelu |
|
Ruoansulatuselimistö | Pahoinvointi Oksentelu Dyspepsia | Suun kuivuminen Vatsakivut Ripuli Epämukavat tuntemukset vatsassa Ylävatsakipu Ummetus Ruokatorven refluksitauti Mahatulehdus Maha-suolikanavan kivut Liikahappoisuus Suun parestesia Epämukavat tuntemukset mahassa | Vatsan pingottuneisuus Nielemisvaikeus Ilmavaivat Nielemiskipu Enterokoliitti |
Iho ja ihonalainen kudos |
| Ihon punoitus Kutina Ihottuma Liikahikoilu Hikoilu | Toksinen ihottuma Valoyliherkkyys |
Luusto, lihakset ja sidekudos |
| Nivelkipu Selkäkipu Lihasjäykkyys Lihasheikkous Luusto- ja lihaskipu Lihaskipu Raajakipu | Niskakipu Muskuloskeletaalinen kipu rintakehässä |
Munuaiset ja virtsatiet |
| Tiheävirtsaisuus |
|
Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat |
|
| Keskenmeno |
Sukupuolielimet ja rinnat |
| Metrorragia |
|
Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Voimattomuus Kipu rintakehässä Epänormaali olo Huonovointisuus Turvotus Raajojen turvotus | Kipu Yöhikoilu Paineen tunne |
Tutkimukset |
| Painonnousu Painonlasku Maksaentsyymipitoisuuden suureneminen QT-ajan piteneminen EKG:ssä Sydämen sykkeen kiihtyminen Gammaglutamyylitransferaasi-pitoisuuden suureneminen | Kreatiinifosfokinaasipitoisuuden suureneminen Poikkeava fyysinen yleiskunto Sydänsähkökäyrässä havaittava poikkeava repolarisaatio Sydänsähkökäyrässä havaittava T-aallon inversio |
Valittujen haittavaikutusten kuvaus
Päänsärky ja unettomuus
Kliinisissä tutkimuksissa on raportoitu päänsärky- ja unettomuusjaksoja (7,7–8,4 %). Suurin osa näistä haittavaikutuksista oli lieviä tai keskivaikeita. Jos oireet jatkuvat pitkään, annoksen pienentämistä tai hoidon keskeyttämistä pitää harkita.
Mahalaukun häiriöt
Kliinisissä tutkimuksissa on raportoitu liikahappoisuudesta johtuvia mahalaukun häiriötä 3,5 %:lla pitolisanttia saaneista potilaista. Suurin osa näistä vaikutuksista oli lieviä tai keskivaikeita. Jos oireet jatkuvat pitkään, voidaan aloittaa korjaava hoito protonipumpun estäjillä.
Pediatriset potilaat (6–17-vuotiaat)
Pediatrisia potilaita on tutkittu satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa; yhteensä 73 lasta ja nuorta, joilla oli narkolepsia-katapleksia tai narkolepsia ilman katapleksiaa, sai pitolisanttihoitoa 8 viikon ajan.
Lapsilla ja nuorilla esiintyneiden haittavaikutusten esiintymistiheys, tyyppi ja vaikeusaste olivat samankaltaiset kuin aikuisilla. Yleisimmät tässä potilasjoukossa raportoidut hoitoon liittyneet haittavaikutukset olivat päänsärky (11 %), unettomuus (5,5 %), hypertensio (2,7 %).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Wakix-valmisteen yliannoksen oireita voivat olla päänsärky, unettomuus, ärtyneisyys, pahoinvointi ja vatsakipu.
Hoito
Yliannostapauksissa suositellaan sairaalahoitoa ja vitaalitoimintojen seurantaa. Vastalääkettä ei ole selkeästi tunnistettu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut hermostoon vaikuttavat lääkeaineet, ATC-koodi: N07XX11.
Vaikutusmekanismi
Pitolisantti on voimakas, suun kautta otettuna aktiivinen histamiini-H3-reseptorin antagonisti/käänteinen agonisti, joka histamiinin autoreseptoreita salpaamalla lisää aivojen histaminergisten hermosolujen aktiivisuutta. Nämä hermosolut ovat osa tärkeää laaja-alaisesti koko aivoihin projisoituvaa vireystilaa säätelevää järjestelmää. Lisäksi pitolisantti muuntaa hermoston eri välittäjäainejärjestelmiä ja siten lisää asetyylikoliinin, noradrenaliinin ja dopamiinin vapautumista aivoissa. Pitolisantin käytön yhteydessä ei ole kuitenkaan havaittu striatumin (mukaan lukien nucleus accumbens) dopamiinierityksen lisääntymistä.
Farmakodynaamiset vaikutukset
Pitolisantti pidentää sekä narkolepsia-katapleksiaa että narkolepsiaa ilman katapleksiaa sairastavilla potilailla valveillaolon kestoa ja parantaa päiväaikaista vireystilaa, mitä arvioitiin valveillaolon säilymistä (esim. MWT-testi [Maintenance of Wakefulness]) ja vireystilaa (esim. SART-testi [Sustained Attention to Response Task]) objektiivisesti mittaavilla testeillä.
Kliininen teho ja turvallisuus
Aikuiset potilaat
Narkolepsia (narkolepsia-katapleksia tai narkolepsia ilman katapleksiaa) on krooninen sairaus. Pitolisantin teho narkolepsia-katapleksian ja narkolepsian ilman katapleksiaa hoidossa enintään 36 mg:n annoksina kerran vuorokaudessa osoitettiin kahdessa 8 viikon satunnaistetussa, kaksoissokkoutetussa rinnakkaisryhmillä tehdyssä lumekontrolloidussa pääasiallisessa tutkimuksessa (Harmony I ja Harmony CTP). Samanlaisella koeasetelmalla tehdyssä Harmony Ibis -tutkimuksessa annos rajoitettiin 18 mg:aan kerran vuorokaudessa. Wakix-valmisteen pitkäaikaista turvallisuutta koskevat tiedot tässä käyttöaiheessa ovat saatavilla avoimessa HARMONY III ‑pitkäaikaistutkimuksessa.
Pivotaalitutkimukseen (Harmony I), joka koostui kaksoissokkoutetuista, satunnaistetuista lumelääkkeeseen ja modafiniiliin (400 mg/vrk) vertailevista joustavat annosmuutokset mahdollistavista rinnakkaisryhmätutkimuksista, osallistui yhteensä 94 potilasta (joista 31 sai pitolisanttihoitoa, 30 lumelääkettä ja 33 modafiniilia). Aloitusannos oli 9 mg kerran vuorokaudessa, ja annosta suurennettiin tehon vasteen ja sietokyvyn mukaan 18 mg:aan tai 36 mg:aan kerran vuorokaudessa yhden viikon välein. Suurin osa potilaista (60 %) saavutti annoksen 36 mg kerran vuorokaudessa. Pitolisantin tehon arvioimiseksi päiväaikaisen uneliaisuuden hoitoon ensisijainen tehon kriteeri oli Epworth-uneliaisuuskyselyn (Epworth Sleepiness Scale, ESS) pistemäärä. Pitolisanttihoidon tulokset olivat merkittävästi lumeryhmän tuloksia parempia (keskimääräinen ero ‑3,33; 95 %:n luottamusväli [‑5,83 – ‑0,83]; p < 0,05), mutta ne eivät eronneet merkittävästi modafiniiliryhmän tuloksista (keskimääräinen ero: 0,12; 95 %:n luottamusväli [‑2,5 – 2,7]). Kummallakin vaikuttavalla aineella todettiin samankaltainen teho valveillaoloon (kuva 1).
Kuva 1. Epworth-uneliaisuuskyselyn (Epworth Sleepiness Scale, ESS) pisteiden (keskiarvo ± keskimääräinen keskivirhe) muutokset Harmony I -tutkimuksen lähtötilanteesta viikkoon 8.
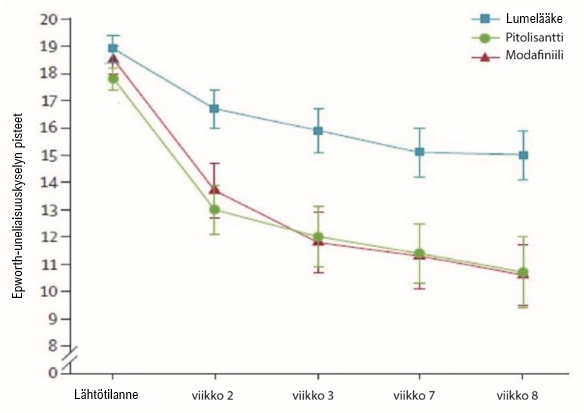
Vaikutuksia Epworth-uneliaisuuskyselyn pisteisiin tukivat kaksi vireystilan ja huomiokyvyn laboratoriotestiä (MWT [Maintenance of Wakefulness Test] [p = 0,044] ja SART [Sustained Attention to Response] [p = 0,053, lähes tilastollisesti merkitsevä]).
Potilailla, joilla oli katapleksiakohtauksia, tämän oireen esiintyvyystiheys väheni pitolisanttia saaneiden ryhmässä (-65 %) lumeryhmään (‑10 %) verrattuna merkitsevästi (p = 0,034). Päivittäisten katapleksiakohtausten määrä (geometrinen keskiarvo) oli pitolisanttiryhmässä lähtötilanteessa 0,52 ja loppukäynnillä 0,18, kun lumeryhmässä se oli lähtötilanteessa 0,43 ja loppukäynnillä 0,39; esiintyvyyssuhde rR = 0,38 [0,16; 0,93] (p = 0,034).
Toiseen pivotaalitutkimukseen (Harmony Ibis) osallistui 165 potilasta (67 sai pitolisanttihoitoa, 33 lumelääkettä ja 65 modafiniilia). Koeasetelma oli samankaltainen kuin Harmony I ‑tutkimuksessa, paitsi että 75 %:lla potilaista pitolisantin enimmäisannokseksi muodostui 18 mg Harmony I ‑tutkimuksen 36 mg:n sijaan. Tämän merkittävän epätasapainon vuoksi tuloksia analysoitiin sekä tutkimuskeskuksia ryhmitellen että ilman ryhmittelyä. Konservatiivisimman arvion mukaan todettiin, ettei pitolisantin aiheuttama Epworth-uneliaisuuskyselyn pistemäärän pieneneminen ollut merkitsevä lumelääkkeeseen verrattuna (pitolisantti-lumelääke = ‑1,94; p = 0,065). Katapleksiakohtausten määrää koskevat tulokset annoksella 18 mg kerran vuorokaudessa eivät olleet yhdenmukaiset ensimmäisen pivotaalitutkimuksen (36 mg kerran vuorokaudessa) tuloksiin nähden.
Valveillaoloa ja keskittymiskykyä koskevien objektiivisten testien (MWT ja SART) tulokset paranivat pitolisanttiryhmässä (p = 0,009) merkitsevästi verrattuna lumeryhmään (p = 0,002), mutta ero modafiniiliryhmään (pitolisantti p = 0,713 ja modafiniili p = 0,294) ei ollut merkitsevä.
Harmony CTP ‑tutkimus oli pitolisantin ja lumelääkkeen vertailua tukeva kaksoissokkoutettu, satunnaistettu rinnakkaisryhmillä tehty tutkimus, joka suunniteltiin varmistamaan pitolisantin teho potilailla, joiden narkolepsiaan liittyi suuri katapleksiakohtauksien esiintyvyys. Tutkimuksen ensisijainen tehon päätetapahtuma oli katapleksiakohtausten keskimääräisen viikoittaisen lukumäärän muutos kahden viikon lähtötilanteen ja tutkimuksen lopussa neljän viikon vakaan tutkimusjakson välillä. Tutkimukseen osallistui 105 narkolepsiapotilasta, joilla oli lähtötilanteessa katapleksiakohtausten suuri viikoittainen esiintyvyys (54:lle annettiin pitolisanttia, 51:lle lumelääkettä). Aloitusannos oli 4,5 mg kerran vuorokaudessa, jota suurennettiin tehon vasteen ja sietokyvyn mukaan yhden viikon väliajoin 9 mg:aan, 18 mg:aan tai 36 mg:aan kerran vuorokaudessa saakka. Suurin osa potilaista (65 %) saavutti annostuksen 36 mg vuorokaudessa.
Ensisijaisen tehon päätetapahtuman, joka oli katapleksiaepisodien viikoittainen lukumäärä (Weekly Rate of Cataplexy episodes, WRC), tulokset olivat pitolisanttia saaneiden ryhmässä merkitsevästi parempia kuin lumehoitoryhmässä (p < 0,0001) ja episodit vähenivät lähtötilanteesta progressiivisesti 64 % hoidon päättymiseen mennessä (kuva 2). Katapleksiaepisodien viikoittaisen lukumäärän geometrinen keskiarvo lähtötilanteessa oli lumeryhmässä 7,31 (mediaani = 6,5 [4,5; 12]) ja pitolisanttiryhmissä 9,15 (mediaani = 8,5 [5,5; 15,5]). Vakaan jakson aikana (hoidon loppuun mennessä) katapleksiaepisodien viikoittaisen lukumäärän geometrinen keskiarvo pieneni lumeryhmässä 6,79:ään (mediaani = 6 [3; 15]) ja pitolisanttiryhmissä 3,28:aan (mediaani = 3 [1,3; 6] niillä potilailla, joilla oli ollut vähintään yksi katapleksiaepisodi. Pitolisanttiryhmässä havaittu katapleksiaepisodien viikoittainen lukumäärä oli noin puolet lumeryhmän vastaavasta määrästä: pitolisantin vaikutuksen suuruutta lumelääkkeeseen verrattuna kuvastaa esiintyvyyssuhteen arvo rR (pitolisantti/lumelääke), rR = 0,512; 95 %:n luottamusväli [0,435–0,603]; p < 0,0001). Pitolisantin vaikutuksen suuruus lumelääkkeeseen verrattuna perustuu katapleksiaepisodien viikoittaisen lukumäärän malliin, joka perustuu lähtötilanteen havaintoon (baseline observation carried forward, BOCF), jossa tutkimuspaikka katsottiin kiinteäksi vaikutukseksi ja oli 0,581, 95 %:n luottamusväli [0,493–0,686]; p < 0,0001.
Kuva 2. Katapleksiaepisodien viikoittaisten lukumäärien muutokset (geometrinen keskiarvo) Harmony CTP ‑tutkimuksen lähtötilanteesta viikkoon 7.
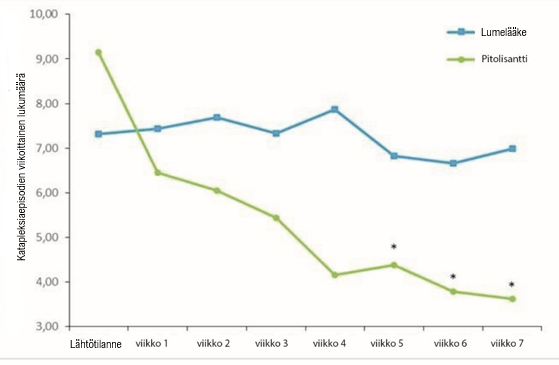
*p < 0,0001 vs. lumelääke
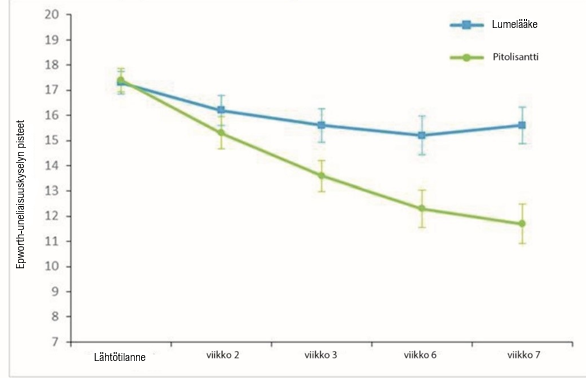
Tässä potilasjoukossa arvioitiin pitolisantin tehoa Epworth-uneliaisuuskyselyn pisteiden perusteella myös päiväaikaiseen uneliaisuuteen. Epworth-uneliaisuuskyselyn pisteet olivat pienentyneet lähtötilanteen ja hoidon loppumisen välillä pitolisanttia saaneiden ryhmässä merkitsevästi enemmän kuin lumeryhmässä, sillä havaittu keskimääräinen muutos oli lumeryhmässä -1,9 ± 4,3 (keskiarvo ± keskihajonta) ja pitolisanttia saaneiden ryhmässä ‑5,4 ± 4,3, (p < 0,0001) (kuva 3). MWT (Maintenance of Wakefulness Test) ‑testin tulokset varmistivat tämän vaikutuksen päiväaikaiseen uneliaisuuteen. Suhteiden geometrinen keskiarvo (MWTFinal/MWTBaseline) oli 1,8 (95 %:n luottamusväli 1,19; 2,71, p = 0,005). Pitolisanttiryhmän MWT-arvo oli 80 % suurempi kuin lumeryhmän arvo.
Kuva 3. Epworth-uneliaisuuskyselyn (Epworth Sleepiness Scale, ESS) muutokset (keskiarvo ± keskimääräinen keskivirhe) Harmony CTP -tutkimuksen lähtötilanteesta viikkoon 7.
Avoimessa vaiheen III pitkäaikaistutkimuksessa (HARMONY III) arvioitiin pitolisantin pitkäaikaista turvallisuutta yli 12 kuukauden ajan ja jatkotutkimuksessa enintään 5 vuoden ajan potilailla, joilla on narkolepsia (narkolepsia-katapleksia tai narkolepsia ilman katapleksiaa). 12 kuukauden seurantajaksoon otettiin mukaan 102 narkolepsiapotilasta, joilla oli narkolepsia-katapleksia tai narkolepsia ilman katapleksiaa. Ensimmäisen 12 kuukauden jakson ajan mukana oli 68 potilasta. 2 vuoden seurantajakson ajan mukana oli 45 potilasta, 3 vuoden seurantajakson ajan 38 potilasta, 4 vuoden seurantajakson ajan 34 potilasta ja 5 vuoden seurantajakson ajan 14 potilasta.
Suurin tutkimuksen aikana saatu annos oli 85 %:lla potilaista 36 mg/vrk. 12 kuukauden hoidon jälkeen päiväaikaisen uneliaisuuden vähenemistä arvioitiin Epworth-uneliaisuuskyselyn pisteiden perusteella ja se oli mukana vielä olevilla potilailla samansuuruista kuin muissa narkolepsiapotilailla tehdyissä tutkimuksissa oli havaittu. Vuoden kuluttua keskimääräiset Epworth-uneliaisuuskyselyn pisteet (keskihajonta) olivat pienentyneet -3,62 (4,63).
12 kuukauden pitolisanttihoidon jälkeen oireiden, kuten tahattoman nukahtelun, unihalvausten, katapleksian ja aistiharhojen, esiintymistiheys on vähentynyt.
Vakavia turvallisuutta koskevia huolenaiheita ei tunnistettu. Havaitut turvallisuutta koskevat tulokset olivat samankaltaisia kuin aikaisemmissa tutkimuksissa on raportoitu annettaessa pitolisanttia 36 mg kerran vuorokaudessa enintään 3 kuukauden ajan.
Pediatriset potilaat
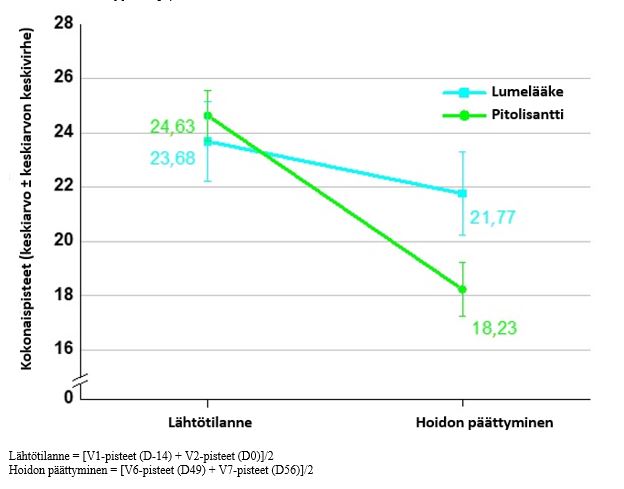
Pitolisanttiannosten enintään 36 mg kerran vuorokaudessa tehoa narkolepsia-katapleksian tai narkolepsian ilman katapleksiaa hoitoon lapsilla (iältään 6-vuotiaista alle 18-vuotiaisiin) on tutkittu 8 viikon mittaisessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, rinnakkaisryhmillä tehdyssä monikeskustutkimuksessa. Siinä oli mukana 110 potilasta (72 potilasta pitolisanttiryhmässä, 38 lumelääkeryhmässä). Anto aloitettiin 4,5 mg:lla kerran vuorokaudessa, ja annosta suurennettiin viikon välein saadun vasteen ja siedettävyyden mukaan 18 mg:aan tai 36 mg:aan kerran vuorokaudessa. Alle 40 kg:n painoisten potilaiden enimmäisannos oli 18 mg. Suurin osa potilaista (60 %) saavutti annoksen 36 mg kerran vuorokaudessa. 35 potilasta (31,8 %) oli iältään 6–11-vuotiaita, ja 75 potilasta (68,2 %) oli iältään 12- < 18-vuotiaita. Pitolisantin tehoa päiväaikaiseen uneliaisuuteen ja katapleksiaan arvioitiin käyttämällä ensisijaisena tehon kriteerinä Ullanlinnan narkolepsia-asteikon kokonaispistemäärää, jota arvioitiin muutoksena lähtötilanteesta kaksoissokkojakson loppuun. Estimaatti pienimmän neliösumman keskiarvojen erosta (keskivirhe) [95 %:n luottamusväli] Ullanlinnan narkolepsia-asteikon pistemäärässä hoitoryhmien välillä (pitolisantti miinus lumelääke) oli -3,69 (1,37) [-6,38; -0,99], p = 0,0073. Toissijaisia päätetapahtumia olivat lasten päiväaikaista uneliaisuutta kuvastava asteikko, Ullanlinnan narkolepsia-asteikon katapleksiaa kuvastava ala-asteikko ja katapleksiakohtausten viikoittainen määrä. Estimaatti pienimmän neliösumman keskiarvojen erosta (keskivirhe) [95 %:n luottamusväli] lasten päiväaikaista uneliaisuutta kuvastavalla asteikolla hoitoryhmien välillä (pitolisantti miinus lumelääke) oli -3,41 (1,07) [-5,52; -1,31], p = 0,0015. Tyypin 1 narkolepsiaa sairastavien potilaiden alaryhmässä, jossa tutkimukseen mukaan ottamiseen ei liittynyt vaatimusta katapleksiakohtausten vähimmäismäärästä (N = 61 pitolisanttiryhmässä; N = 29 lumelääkeryhmässä), estimaatti pienimmän neliösumman keskiarvojen erosta (keskivirhe) [95 %:n luottamusväli] Ullanlinnan narkolepsia-asteikon katapleksiaa kuvastavan ala-asteikon pistemäärässä hoitoryhmien välillä (pitolisantti miinus lumelääke) oli ‑1,77 (0,78) [‑3,29; ‑0,24], p = 0,0229, ja katapleksiakohtausten viikoittaisten määrien suhde pitolisanttiryhmän ja lumelääkeryhmän välillä lähtötilanteella korjattuna oli pitolisanttiryhmässä parempi (0,42 [95 %:n luottamusväli: 0,18; 1,01], p = 0,0540).
Taulukko 1 Tehon tulokset 8 viikon hoidon jälkeen vaiheen 3 tutkimuksessa pediatrisilla potilailla
| Lumelääke (n = 38) | Pitolisantti (n = 72) | |
| Ullanlinnan narkolepsia-asteikko (UNS) | ||
| Kokonaispisteet | ||
Keskiarvo lähtötilanteessa (keskihajonta) Keskiarvo hoidon päättyessä (keskihajonta) Pienimmän neliösumman keskiarvo (keskivirhe) – muutos lähtötilanteesta Estimaatti, 95 %:n luottamusväli p-arvo | 23,68 (9,08) 21,77 (9,25) -2,60 (1,35)
| 24,63 (7,80) 18,23 (8,14) -6,29 (1,14) -3,69 (-6,38; -0,99) 0,0073 |
| Lasten päiväaikaista uneliaisuutta kuvastava asteikko | ||
Keskiarvo lähtötilanteessa (keskihajonta) Keskiarvo hoidon päättyessä (keskihajonta) Pienimmän neliösumman keskiarvo (keskivirhe) – muutos lähtötilanteesta Estimaatti, 95 %:n luottamusväli p-arvo | 20,00 (3,49) 17,96 (5,60) -2,11 (0,89)
| 20,16 (3,64) 14,57 (5,37) -5,53 (0,66) -3,41 (-5,52; -1,31) 0,0015 |
| Lumelääke (n = 29) | Pitolisantti (n = 61) | |
| Ullanlinnan narkolepsia-asteikon katapleksiaa kuvastava ala-asteikko* | ||
Keskiarvo lähtötilanteessa (keskihajonta) Keskiarvo hoidon päättyessä (keskihajonta) Pienimmän neliösumman keskiarvo (keskivirhe) – muutos lähtötilanteesta Estimaatti, 95 %:n luottamusväli p-arvo | 9,03 (4,33) 8,07 (4,62) -1,12 (0,64)
| 8,93 (3,96) 6,02 (4,00) -2,88 (0,44) -1,77 (-3,29; -0,24) 0,0229 |
| Katapleksiakohtausten viikoittainen määrä* | ||
Keskiarvo lähtötilanteessa (keskihajonta) Pienimmän neliösumman keskiarvo (keskivirhe) Estimaatti, 95 %:n luottamusväli p-arvo | 13,44 (26,92) 5,05 (0,37)
| 8,63 (17,73) 2,14 (0,27) 0,42 (0,18; 1,01) 0,0540 |
*mitattu vain potilailta, joilla on tyypin I narkolepsia
Keskiarvo lähtötilanteessa (keskihajonta)
Keskiarvo hoidon päättyessä (keskihajonta)
Pienimmän neliösumman keskiarvo (keskivirhe) – muutos lähtötilanteesta
Estimaatti, 95 %:n luottamusväli
p-arvo
Kuva 4 Ullanlinnan narkolepsia-asteikon keskimääräisen kokonaispistemäärän (keskiarvo ± keskiarvon keskivirhe) muutos lähtötilanteesta hoidon loppuun (täydellinen analyysisarja)
Farmakokinetiikka
Terveiden vapaaehtoisten altistumista pitolisantille arvioitiin tutkimuksissa, joihin osallistui yli 200 tutkittavaa. He saivat pitolisanttia enimmillään 216 mg:n kerta-annoksina enintään 28 päivän ajan.
Imeytyminen
Pitolisantti imeytyy hyvin ja nopeasti. Sen huippupitoisuus plasmassa saavutetaan noin 3 tuntia annon jälkeen.
Jakautuminen
Pitolisantti sitoutuu voimakkaasti seerumin proteiineihin (> 90 %) ja jakautuu lähes tasaisesti veren punasoluihin ja plasmaan.
Biotransformaatio
Pitolisantin metabolia ihmisillä tunnetaan hyvin. Tärkeät konjugoitumattomat metaboliitit ovat useissa eri kohdissa hydroksyloituneita johdannaisia ja pitolisantin pilkottuja muotoja, jotka johtavat virtsassa ja seerumissa havaittaviin merkittäviin inaktiivisiin karboksyylihappometaboliitteihin. Ne muodostuvat CYP3A4- ja CYP2D6-entsyymien vaikutuksesta. Useita konjugoituneita metaboliitteja on tunnistettu, ja näistä tärkeimpiä (inaktiivisia) ovat pitolisantin happometaboliitin kaksi glysiinikonjugaattia ja monohydroksidesaturoituneen pitolisantin ketonimetaboliitin glukuronidi.
Pitolisantti ja sen tärkeimmät metaboliitit eivät estä maksan mikrosomeissa merkittävästi sytokromien CYP1A2, CYP2C9, CYP2C19, CYP2C8, CYP2B6, CYP2E1, CYP3A4 ja uridiinidifosfaattiglukuronosyylitransferaasien isomuotojen UGT1A1, UGT1A4, UGT1A6, UGT1A9 ja UGT2B7 aktiivisuutta pitoisuuksiin 13,3 mikroM saakka, mikä on huomattavasti suurempi pitoisuus kuin hoitoannoksilla saavutettavat pitoisuudet. Pitolisantti on kohtalaisen voimakas CYP2D6:n estäjä (IC50 = 2,6 mikroM).
Pitolisantti indusoi CYP3A4:ää, CYP1A2:ta ja CYP2B6:tta in vitro. Kliinisesti oleellisia yhteisvaikutuksia esiintyy oletettavasti CYP3A4:n ja CYP2B6:n substraattien kanssa ja ekstrapolaation perusteella UGT-entsyymien, CY2C:n ja P-gp:n substraattien kanssa (ks. kohta Yhteisvaikutukset).
In vitro -tutkimukset osoittavat, että pitolisantti ei ole ihmisen P-glykoproteiinin eikä rintasyöpäresistenssiproteiinin (BCRP) substraatti eikä estäjä. Pitolisantti ei ole OATP1B1:n eikä OATP1B3:n substraatti. Pitolisantti ei ole testatuilla pitoisuuksilla OAT1:n, OAT3:n, OCT2:n, OATP1B1:n, OATP1B3:n, MATE1:n tai MATE2K:n merkittävä estäjä. Pitolisantilla on havaittu yli 50 % estävä vaikutus OCT1:een (orgaanisten kationien kuljettajaproteiiniin 1) pitoisuutena 1,33 mikroM. Pitolisantin ekstrapoloitu IC50-arvo on 0,795 mikroM (ks. kohta Yhteisvaikutukset).
Eliminaatio
Pitolisantin puoliintumisaika plasmassa on 10–12 tuntia. Toistuvassa annostelussa vakaa tila saavutetaan noin 5–6 päivän kuluttua annosta, ja pitoisuus seerumissa suurenee noin 100 %. Yksilöiden välinen vaihtelu on melko suurta, ja joillakin vapaaehtoisilla koehenkilöillä on havaittu poikkeavan korkeita pitoisuuksia (ilman siedettävyyteen liittyviä ongelmia).
Eliminaatio tapahtuu pääosin virtsaan (noin 63 %), inaktiivisena konjugoitumattomana metaboliittina (BP2.951) ja glysiiniin konjugoituneena metaboliittina. 25 % annoksesta poistuu uloshengitysilmassa ja hyvin pieni osa (< 3 %) ulosteeseen, jossa on havaittu vain mitättömän pieniä määriä pitolisanttia tai BP2.951:tä.
Lineaarisuus/ei-lineaarisuus
Pitolisanttiannoksen kaksinkertaistuessa 27 mg:sta 54 mg:aan AUC0-∞-arvo suurenee noin 2,3-kertaiseksi.
Erityisryhmät
Iäkkäät
68–80-vuotiailla potilailla pitolisantin farmakokinetiikka ei ollut erilainen nuorempiin (18–45-vuotiaisiin) potilaisiin verrattuna. Yli 80-vuotiailla kinetiikka muuttuu hieman, mutta ei kliinisesti oleellisesti. Iäkkäistä on vähän tietoja saatavissa. Tämän vuoksi annostusta pitää säätää potilaan maksan ja munuaisten toiminnan mukaan (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla (asteet 2–4 kroonisen munuaistaudin kansainvälisessä luokittelussa, ts. kreatiniinipuhdistuma 15–89 ml/min) Cmax- ja AUC-arvot suurenivat yleisesti 2,5-kertaisiksi vaikuttamatta puoliintumisaikaan (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Lievää maksan vajaatoimintaa (Child-Pugh A) sairastavilla potilailla farmakokinetiikassa ei havaittu merkittäviä muutoksia terveisiin vapaaehtoisiin verrattuna. Keskivaikeaa maksan vajaatoimintaa (Child-Pugh B) sairastavilla potilailla AUC-arvo suureni 2,4-kertaiseksi ja puoliintumisaika piteni kaksinkertaiseksi (ks. kohta Annostus ja antotapa). Pitolisantin farmakokinetiikkaa ei ole vielä arvioitu toistuvia annoksia saaneilla maksan vajaatoimintaa sairastavilla potilailla.
Hitaat CYP2D6-metaboloijat
Pitolisantille altistuminen oli hitailla CYP2D6-metaboloijilla suurempaa kerta-annoksen jälkeen ja vakaassa tilassa; Cmax- ja AUC(0-tau)-arvo olivat ensimmäisenä päivänä noin 2,7-kertaisesti ja 3,2-kertaisesti suurempia ja seitsemäntenä päivänä 2,1-kertaisia ja 2,4-kertaisia. Pitolisantin puoliintumisaika seerumissa oli hitailla CYP2D6-metaboloijilla pitempi kuin nopeilla metaboloijilla.
Etninen tausta
Etnisen taustan vaikutusta pitolisantin farmakokinetiikkaan ei ole tutkittu.
Pediatriset potilaat
18 mg:n pitolisanttiannosten farmakokinetiikkaa narkolepsiaa sairastavilla lapsilla (iältään 6-vuotiaista alle 18-vuotiaisiin) on tutkittu kerta-annoksia koskeneessa monikeskustutkimuksessa. Populaatiofarmakokineettisessä analyysissa käytettiin ruumiinpainosta riippuvaista mallia; siinä arvioitiin systeemisen pitolisanttialtistuksen 18 mg:n annosten yhteydessä olevan Cmax- ja AUC0-10h-arvojen perusteella alle 40 kg:n painoisilla lapsilla noin 3-kertainen ja yli 40 kg:n painoisilla nuorilla noin 2-kertainen aikuisten potilaiden altistukseen verrattuna. Annostitraus pitää näin ollen aloittaa pienimmällä eli 4,5 mg:n annoksella, ja alle 40 kg:n painoisten lasten annos pitää rajoittaa 18 mg:aan (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Kun valmistetta oli annettu 1 kuukauden ajan hiirille, 6 kuukauden ajan rotille ja 9 kuukauden ajan apinoille, suurimmat haitattomat annokset (NOAEL) suun kautta olivat 75 mg/kg/vrk (hiiret), 30 mg/kg/vrk (rotat) ja 12 mg/kg/vrk (apinat), jolloin turvamarginaalit olivat 9, 1 ja 0,4 verrattuna ihmisille annettavasta hoitoannoksesta saatavaan lääkealtistukseen. Rotilla havaittiin huippupitoisuuden (Tmax) yhteydessä ohimeneviä ja palautuvia kouristusepisodeja, jotka saattavat kuitenkin liittyä tällä lajilla, mutta ei ihmisillä, runsaana esiintyvään metaboliittiin. Apinoilla raportoitiin suurimmilla annoksilla ohimeneviä keskushermostoon liittyviä kliinisiä oireita, mukaan lukien oksentelua, vapinaa ja kouristuksia. Apinoilla ei havaittu suurimmilla annoksilla histopatologisia muutoksia. Rotilla ilmeni joissakin elimissä (maksa, pohjukaissuoli, kateenkorva, lisämunuainen ja keuhkot) vähäisiä histopatologisia muutoksia.
Pitolisantti ei ollut genotoksinen eikä karsinogeeninen.
Pitolisantilla havaittiin teratogeeninen vaikutus emolle toksisilla annoksilla (teratogeenisuuden turvamarginaalit rotilla ja kaniineilla < 1). Suuret pitolisanttiannokset aiheuttivat morfologisia poikkeavuuksia siittiöihin ja vähensivät niiden liikkuvuutta ilman merkittäviä vaikutuksia urosrottien hedelmällisyysindekseihin. Naarasrotilla ne pienensivät elävien hedelmöityneiden munasolujen prosenttiosuutta ja lisäsivät implantaation jälkeisten keskenmenojen määrää (turvamarginaali = 1). Pitolisantti hidasti syntymänjälkeistä kehitystä (turvamarginaali = 1).
Pitolisantin / pitolisantin metaboliittien on havaittu läpäisevän eläinten istukkaesteen.
Rotilla tehdyissä nuoruusiän toksisuustutkimuksissa suurten pitolisanttiannosten havaittiin aiheuttavan annosriippuvaista kuolleisuutta ja kouristusepisodeja, jotka saattoivat kuitenkin liittyä rotilla, mutta ei ihmisillä, runsaasti esiintyvään metaboliittiin.
Terapeuttisia pitoisuuksia suuremmalla IC50 -arvolla pitolisantti salpasi hERG-kanavan ja aiheutti koirille vähäistä QTc-ajan pidentymistä.
Lääkeriippuvuuden ja lääkkeen väärinkäytön todennäköisyyttä tutkittiin prekliinisissä tutkimuksissa hiirillä, apinoilla ja rotilla. Sietokykyä, riippuvuutta ja itseannostelua koskevien tutkimusten perusteella ei kuitenkaan voitu tehdä varmoja johtopäätöksiä.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Selluloosa, mikrokiteinen
Krospovidoni tyyppi A
Talkki
Magnesiumstearaatti
Piidioksidi, kolloidinen, vedetön
Tabletin päällyste
Poly(vinyylialkoholi)
Titaanidioksidi (E171)
Makrogoli 3350
Talkki
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Wakix 4,5 mg tabletti
3 vuotta
Wakix 18 mg tabletti
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
WAKIX tabletti, kalvopäällysteinen
4,5 mg (L:ei) 30 kpl (300,32 €)
18 mg (L:ei) 30 kpl (300,32 €)
PF-selosteen tieto
Suurtiheyspolyeteenipurkki (HDPE), jossa turvasinetillinen ja lapsiturvallinen polypropeenikierrekorkki, johon on kiinnitetty kuivausainetta (silikageeliä).
Purkissa 30 tai 90 kalvopäällysteistä tablettia.
Wakix 4,5 mg
Saatavana pakkauksina, jotka sisältävät yhden 30 tabletin purkin.
Wakix 18 mg
Saatavana pakkauksina, jotka sisältävät yhden 30 tabletin purkin tai yhden 90 tabletin purkin, tai kerrannaispakkauksina, jotka sisältävät 90 tablettia (kolme 30 tabletin purkkia).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Wakix 4,5 mg kalvopäällysteinen tabletti
Valkoinen, pyöreä, kaksoiskupera, kalvopäällysteinen tabletti, jonka läpimitta on 3,7 mm ja jossa on toisella puolella merkintä ”5”.
Wakix 18 mg kalvopäällysteinen tabletti
Valkoinen, pyöreä, kaksoiskupera, kalvopäällysteinen tabletti, jonka läpimitta on 7,5 mm ja jossa on toisella puolella merkintä ”20”.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
WAKIX tabletti, kalvopäällysteinen
4,5 mg 30 kpl
18 mg 30 kpl
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Pitolisantti ja solriamfetoli: Aikuisten narkolepsian hoito erityisin edellytyksin (3035).
ATC-koodi
N07XX11
Valmisteyhteenvedon muuttamispäivämäärä
24.02.2023
Yhteystiedot
Medicon Village
223 81 Lund
Sweden
+46 (0) 10 33 50 800
