DARZALEX infuusiokonsentraatti, liuosta varten 20 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Terveydenhuollon ammattilainen
Verikeskuksille: Tietoa daratumumabin vaikutuksista veren yhteensopivuustestaukseen ja toimenpiteet näiden vaikutusten vähentämiseen
Daratumumabin vaikutus veren yhteensopivuustestaukseen
Vaikuttavat aineet ja niiden määrät
Yksi 5 ml:n injektiopullo sisältää 100 mg daratumumabia (20 mg daratumumabia per ml).
Yksi 20 ml:n injektiopullo sisältää 400 mg daratumumabia (20 mg daratumumabia per ml).
Daratumumabi on ihmisen monoklonaalinen IgG1κ-vasta-aine CD38-antigeenia vastaan. Se tuotetaan rekombinantti-DNA-tekniikalla nisäkässolulinjassa (kiinanhamsterin munasarja).
Apuaine, jonka vaikutus tunnetaan
Yksi 5 ml:n injektiopullo infuusionestettä, liuosta, sisältää 273,3 mg sorbitolia (E420).
Yksi 20 ml:n injektiopullo infuusionestettä, liuosta, sisältää 1 093 mg sorbitolia (E420).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Darzalex on tarkoitettu
- yhdistelmänä lenalidomidin ja deksametasonin tai bortetsomibin, melfalaanin ja prednisonin kanssa äskettäin diagnosoidun multippelin myelooman hoitoon aikuispotilaille, jotka eivät sovellu autologiseen kantasolusiirtoon
- yhdistelmänä bortetsomibin, talidomidin ja deksametasonin kanssa äskettäin diagnosoidun multippelin myelooman hoitoon aikuispotilaille, jotka soveltuvat autologiseen kantasolusiirtoon
- yhdistelmänä lenalidomidin ja deksametasonin tai bortetsomibin ja deksametasonin kanssa multippelin myelooman hoitoon aikuispotilaille, jotka ovat saaneet vähintään yhtä aiempaa hoitoa
- monoterapiana relapsoituneen ja hoitoon reagoimattoman multippelin myelooman hoitoon aikuispotilaille, joiden aiempi hoito on sisältänyt proteasomin estäjää ja immunomodulatiivista ainetta ja joiden taudin on osoitettu edenneen viimeisimmän hoidon aikana.
Ehto
Valmisteen saa antaa kokenut terveydenhuollon ammattilainen hoitopaikassa, jossa on elvytysvälineistö saatavissa.
Annostus ja antotapa
Darzalex-valmisteen saa antaa terveydenhuollon ammattilainen hoitopaikassa, jossa on elvytysvälineistö saatavissa.
Potilaalle pitää antaa ennen infuusiota ja sen jälkeen lääkehoitoa daratumumabi-infuusioon liittyvien reaktioiden riskin vähentämiseksi. Ks. jäljempänä Samanaikaisesti suositellut lääkevalmisteet, Infuusioon liittyvien reaktioiden hoito ja kohta Varoitukset ja käyttöön liittyvät varotoimet.
Annostus
Hoitoaikataulu yhdistelmähoidossa lenalidomidin ja deksametasonin kanssa (4 viikon hoitosyklit) ja monoterapiassa
Suositeltu Darzalex-annos on 16 mg/painokg infuusiona laskimoon taulukossa 1 esitetyn hoitoaikataulun mukaisesti.
| Taulukko 1:Darzalex-hoitoaikataulu yhdistelmähoidossa lenalidomidin ja deksametasonin (Rd) kanssa (neljän viikon hoitosykli) ja monoterapiassa | |
| Viikot | Ajankohta |
| Viikot 1–8 | viikoittain (yhteensä 8 annosta) |
| Viikot 9–24a | joka toinen viikko (yhteensä 8 annosta) |
| Viikosta 25 alkaen, kunnes tauti eteneeb | joka neljäs viikko |
a Siirryttäessä joka toinen viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 9 b Siirryttäessä joka neljäs viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 25 | |
Deksametasonia annetaan 40 mg/viikko (tai > 75-vuotiaille potilaille pienennetty annos 20 mg/viikko).
Darzalex-infuusioliuoksen kanssa annettavien lääkevalmisteiden annos ja hoitoaikataulu, ks. kohta Farmakodynamiikka ja kyseisen valmisteen valmisteyhteenveto.
Hoitoaikataulu yhdistelmähoidossa bortetsomibin, melfalaanin ja prednisonin kanssa (6 viikon hoitosyklit)
Suositeltu Darzalex-annos on 16 mg/painokg infuusiona laskimoon taulukossa 2 esitetyn hoitoaikataulun mukaisesti.
| Taulukko 2: Darzalex-hoitoaikataulu yhdistelmähoidossa bortetsomibin, melfalaanin ja prednisonin kanssa ([VMP]; kuuden viikon hoitosykli) | |
| Viikot | Ajankohta |
| Viikot 1–6 | viikoittain (yhteensä 6 annosta) |
| Viikot 7–54a | joka kolmas viikko (yhteensä 16 annosta) |
| Viikosta 55 alkaen, kunnes tauti eteneeb | joka neljäs viikko |
| a Siirryttäessä joka kolmas viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 7 b Siirryttäessä joka neljäs viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 55 | |
Bortetsomibia annetaan ensimmäisen 6 viikon hoitosyklin aikana kaksi kertaa viikossa viikoilla 1, 2, 4 ja 5, minkä jälkeen seuraavien kahdeksan 6 viikon hoitosyklin aikana bortetsomibia annetaan kerran viikossa viikoilla 1, 2, 4 ja 5. Lisätietoja Darzalex-valmisteen kanssa annettavan VMP-hoidon annoksesta ja hoitoaikataulusta, ks. kohta Farmakodynamiikka.
Hoitoaikataulu käytettäessä yhdistelmänä bortetsomibin, talidomidin ja deksametasonin kanssa (neljän viikon hoitosyklit) äskettäin diagnosoidun multippelin myelooman hoitoon potilaille, jotka soveltuvat autologiseen kantasolusiirtoon
Suositeltu Darzalex-annos on 16 mg/painokg infuusiona laskimoon taulukossa 3 esitetyn hoitoaikataulun mukaisesti.
| Taulukko 3: Darzalex-hoitoaikataulu käytettäessä yhdistelmänä bortetsomibin, talidomidin ja deksametasonin kanssa ([VTd]; neljän viikon hoitosykli) | ||
| Hoitovaihe | Viikot | Ajankohta |
| Induktio | Viikot 1–8 | viikoittain (yhteensä 8 annosta) |
| Viikot 9–16a | joka toinen viikko (yhteensä 4 annosta) | |
| Lopeta suuriannoksisen solunsalpaajahoidon ja autologisen kantasolusiirron ajaksi | ||
| Konsolidaatio | Viikot 1–8b | joka toinen viikko (yhteensä 4 annosta) |
a Siirryttäessä joka toinen viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 9 b Jatkettaessa hoitoa autologisen kantasolusiirron jälkeen joka toinen viikko tapahtuvan annostelun ensimmäinen annos annetaan viikolla 1 | ||
Deksametasonia annetaan 40 mg hoitosyklien 1 ja 2 päivinä 1, 2, 8, 9, 15, 16, 22 ja 23. Hoitosykleissä 3-4 annetaan 40 mg päivinä 1–2 ja 20 mg seuraavina antopäivinä (päivät 8, 9, 15, 16). Hoitosykleissä 5 ja 6 deksametasonia annetaan 20 mg päivinä 1, 2, 8, 9, 15 ja 16.
Darzalex-valmisteen kanssa annettavien lääkevalmisteiden annokset ja hoitoaikataulut, ks. kohta Farmakodynamiikka ja kyseisten valmisteiden valmisteyhteenvedot.
Hoitoaikataulu käytettäessä yhdistelmänä bortetsomibin ja deksametasonin kanssa (kolmen viikon hoitosykli)
Suositeltu Darzalex-annos on 16 mg/painokg infuusiona laskimoon taulukossa 4 esitetyn hoitoaikataulun mukaisesti.
| Taulukko 4: Darzalex-hoitoaikataulu käytettäessä yhdistelmänä bortetsomibin ja deksametasonin (Vd) kanssa (kolmen viikon hoitosykli) | |
| Viikot | Ajankohta |
| Viikot 1–9 | viikoittain (yhteensä 9 annosta) |
| Viikot 10–24a | joka kolmas viikko (yhteensä 5 annosta) |
| Viikosta 25 alkaen, kunnes tauti eteneeb | joka neljäs viikko |
a Siirryttäessä joka kolmas viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 10 b Siirryttäessä joka neljäs viikko tapahtuvaan annosteluun ensimmäinen annos annetaan viikolla 25 | |
Deksametasonia annetaan 20 mg bortetsomibihoidon ensimmäisten kahdeksan hoitosyklin päivinä 1, 2, 4, 5, 8, 9, 11 ja 12 tai pienennetty annos 20 mg/viikko, jos potilas on > 75-vuotias tai alipainoinen (painoindeksi < 18,5), potilaalla on huonossa hoitotasapainossa oleva diabetes mellitus tai potilas ei ole aiemmin sietänyt steroidihoitoa.
Darzalex-infuusioliuoksen kanssa annettavien lääkevalmisteiden annos ja hoitoaikataulu, ks. kohta Farmakodynamiikka ja kyseisen valmisteen valmisteyhteenveto.
Infuusionopeus
Kun Darzalex-infuusioliuos on laimennettu, se pitää antaa laskimoon aloitusnopeudella, joka mainitaan jäljempänä taulukossa 5. Infuusionopeuden lisäämistä voidaan harkita vain, jos potilaalle ei ole ilmaantunut infuusioreaktioita.
Ensimmäinen viikolla 1 annettavaksi määrätty annos 16 mg/kg voidaan annon helpottamiseksi jakaa kahdelle peräkkäiselle päivälle eli 8 mg/kg päivänä 1 ja 8 mg/kg päivänä 2, ks. taulukko 5 jäljempänä.
| Taulukko 5: Darzalex-infuusion (16 mg/kg) antonopeudet | ||||
| Laimennustilavuus | Aloitusnopeus (ensimmäinen tunti) | Nopeuden lisäysa | Maksiminopeus | |
| Viikon 1 infuusio | ||||
| Vaihtoehto 1 (kerta-infuusio) | ||||
| Viikko 1, päivä 1 (16 mg/kg) | 1000 ml | 50 ml/tunti | 50 ml/tunti joka tunti | 200 ml/tunti |
| Vaihtoehto 2 (jaettu infuusioannos) | ||||
| Viikko 1, päivä 1 (8 mg/kg) | 500 ml | 50 ml/tunti | 50 ml/tunti joka tunti | 200 ml/tunti |
| Viikko 1, päivä 2 (8 mg/kg) | 500 ml | 50 ml/tunti | 50 ml/tunti joka tunti | 200 ml/tunti |
| Viikon 2 (16 mg/kg) infuusiob | 500 ml | 50 ml/tunti | 50 ml/tunti joka tunti | 200 ml/tunti |
| Seuraavat (viikosta 3 lähtien, 16 mg/kg) infuusiotc | 500 ml | 100 ml/tunti | 50 ml/tunti joka tunti | 200 ml/tunti |
a Infuusionopeuden lisäämistä voidaan harkita vain, jos potilaalle ei ole ilmaantunut infuusioreaktioita. b Laimennustilavuutta 500 ml voidaan käyttää annoksen 16 mg/kg yhteydessä vain, jos potilaalle ei ole ilmaantunut edellisellä viikolla infuusioon liittyneitä reaktioita. Muussa tapauksessa käytetään laimennustilavuutta 1000 ml. c Muutettua infuusionopeutta (100 ml/tunti) tulisi käyttää seuraavien infuusioiden yhteydessä (eli viikosta 3 eteenpäin) vain, jos potilaalle ei ole ilmaantunut edellisten infuusioiden yhteydessä infuusioon liittyneitä reaktioita. Muussa tapauksessa hoitoa jatketaan noudattamalla taulukossa viikon 2 infuusionopeutta koskevia ohjeita. | ||||
Infuusioon liittyvien reaktioiden hoito
Potilaalle pitää antaa ennen Darzalex-infuusiota esilääkitys, jotta infuusioon liittyvien reaktioiden riskiä voidaan vähentää.
Jos potilaalle ilmaantuu minkä tahansa graduksen/vakavuusasteen infuusioon liittyvä reaktio, Darzalex-infuusion antaminen pitää heti keskeyttää ja oireet hoitaa.
Infuusioon liittyvien reaktioiden hoito saattaa edellyttää myös infuusionopeuden hidastamista tai Darzalex-hoidon lopettamisen, kuten jäljempänä esitetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Gradus 1–2 (lievä tai keskivaikea): Kun reaktion oireet häviävät, infuusiota pitää jatkaa vähintään puolta hitaammalla antonopeudella siihen infuusionopeuteen nähden, jolla infuusioon liittyvä reaktio ilmaantui. Jos potilaalle ei ilmaannu muita infuusioon liittyvän reaktion oireita, infuusionopeutta voidaan lisätä kliinisesti sopivin lisäyksin ja väliajoin enintään nopeuteen 200 ml/tunti (taulukko 5).
- Gradus 3 (vaikea-asteinen): Kun reaktion oireet häviävät, infuusion aloittamista uudelleen voidaan harkita vähintään puolta hitaammalla antonopeudella siihen infuusionopeuteen nähden, jolla infuusioon liittyvä reaktio ilmaantui. Jos potilaalle ei ilmaannu lisäoireita, infuusionopeutta voidaan taas lisätä sopivin lisäyksin ja väliajoin (taulukko 5). Jos graduksen 3 oireet uusiutuvat, edellä mainitut toimenpiteet pitää toistaa. Jos graduksen ≥ 3 infuusioreaktio ilmaantuu kolmannen kerran, Darzalex-hoito pitää lopettaa pysyvästi.
- Gradus 4 (hengenvaarallinen): Lopeta Darzalex-hoito pysyvästi.
Annoksen antamatta jääminen
Jos suunniteltu Darzalex-annos jää antamatta, annos pitää antaa mahdollisimman pian ja hoitoaikataulua pitää muuttaa vastaavasti siten, että annosväli säilyy ennallaan.
Annosmuutokset
Darzalex-annoksen pienentämistä ei suositella. Jos potilaalla on hematologista toksisuutta, annoksen antamista saattaa olla tarpeen siirtää myöhempään ajankohtaan, jotta verisolujen määrät voivat korjautua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tiedot Darzalex-infuusioliuoksen kanssa yhdistelmänä annettavista lääkevalmisteista, ks. kyseisen valmisteen valmisteyhteenveto.
Samanaikaisesti suositellut lääkevalmisteet
Ennen infuusiota annettava lääkitys
Kaikille potilaille pitää antaa 1–3 tuntia ennen jokaista Darzalex-infuusiota lääkitys infuusioon liittyvien reaktioiden riskin vähentämiseksi seuraavasti:
-
kortikosteroidia (pitkä- tai keskipitkävaikutteista)
- Monoterapia:
100 mg metyyliprednisolonia tai tätä vastaavaa laskimoon. Kortikosteroidiannosta voidaan pienentää (60 mg metyyliprednisolonia suun kautta tai laskimoon) toisen infuusion jälkeen. - Yhdistelmähoito:
20 mg deksametasonia (tai vastaavaa) ennen jokaista Darzalex-infuusiota. Kun deksametasoni on peruslääkityksenä käytettävä runkohoitospesifinen kortikosteroidi, deksametasonihoidon annos toimii esilääkityksenä Darzalex-infuusion antopäivinä (ks. kohta Farmakodynamiikka).
Deksametasoni annetaan ennen ensimmäistä Darzalex-infuusiota laskimoon, ja seuraavien infuusioiden yhteydessä voidaan harkita sen antamista suun kautta. Jos potilas on saanut deksametasonia esilääkityksenä, Darzalex-infuusion antopäivinä ei pidä ottaa lisäksi peruslääkityksenä runkohoitospesifistä kortikosteroidia (esim. prednisonia).
- Monoterapia:
- antipyreettejä (650–1 000 mg parasetamolia suun kautta).
- antihistamiinia (25–50 mg difenhydramiinia suun kautta tai laskimoon tai vastaavaa).
Infuusion jälkeen annettava lääkitys
Infuusion jälkeen on annettava lääkitystä viivästyneiden infuusioon liittyvien reaktioiden riskin vähentämiseksi seuraavasti:
-
Monoterapia:
Kortikosteroidia suun kautta (20 mg metyyliprednisolonia tai vastaava annos keskipitkä- tai pitkävaikutteista kortikosteroidia paikallisen hoitokäytännön mukaan) kahtena infuusion jälkeisenä päivänä (infuusion antoa seuraavasta päivästä alkaen). -
Yhdistelmähoito:
Harkitse pientä metyyliprednisoloniannosta suun kautta (≤ 20 mg) tai vastaavaa Darzalex-infuusion jälkeisenä päivänä. Jos Darzalex-infuusion jälkeisenä päivänä annetaan peruslääkityksenä runkohoitospesifistä kortikosteroidia (esim. deksametasonia, prednisonia), muuta infuusion jälkeen annettavaa lääkitystä ei välttämättä tarvita (ks. kohta Farmakodynamiikka).
Jos potilaalla on aiemmin ollut krooninen ahtauttava keuhkosairaus, lyhyt- ja pitkävaikutteista keuhkoputkia laajentavaa lääkitystä ja inhaloitavia kortikosteroideja pitää lisäksi harkita osaksi infuusion jälkeistä lääkitystä. Jos potilaalle ei neljän ensimmäisen infuusion jälkeen ilmaannu vakavia infuusioon liittyviä reaktioita, infuusion jälkeen käytettyjen inhaloitavien lääkevalmisteiden käyttö voidaan lääkärin harkinnan mukaan lopettaa.
Herpes zoster ‑viruksen reaktivaation estohoito
Herpes zoster ‑viruksen reaktivaation estämiseksi pitää harkita estohoitoa viruslääkkeillä.
Erityiset potilasryhmät
Munuaisten vajaatoiminta
Daratumumabin käyttöä munuaisten vajaatoimintaa sairastaville potilaille ei ole tutkittu varsinaisissa tutkimuksissa. Populaatiofarmakokineettisten analyysien perusteella munuaisten vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Daratumumabin käyttöä maksan vajaatoimintaa sairastaville potilaille ei ole tutkittu varsinaisissa tutkimuksissa.
Populaatiofarmakokineettisten analyysien perusteella maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Iäkkäät
Annosmuutoksia ei katsota tarpeellisiksi (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Darzalex-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Tietoja ei ole saatavilla.
Antotapa
Darzalex on tarkoitettu annettavaksi laskimoon. Se annetaan infuusiona laskimoon sen jälkeen, kun se on laimennettu 0,9-prosenttisella (9 mg/ml) natriumkloridiliuoksella. Ks. kohdasta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infuusioon liittyvät reaktiot
Darzalex voi aiheuttaa vakavia infuusioon liittyviä reaktioita, mukaan lukien anafylaktisia reaktioita (ks. kohta Haittavaikutukset). Nämä reaktiot voivat olla henkeä uhkaavia, ja kuolemaan johtaneita reaktioita on raportoitu.
Kaikkia potilaita pitää seurata koko infuusion ajan infuusioon liittyvien reaktioiden havaitsemiseksi. Jos potilaalle ilmaantuu minkä tahansa graduksen infuusioon liittyvä reaktio, seurantaa jatketaan infuusion jälkeen, kunnes oireet häviävät.
Infuusioon liittyviä reaktioita raportoitiin kliinisissä tutkimuksissa noin puolella kaikista Darzalex-hoitoa saaneista potilaista.
Suurin osa infuusioon liittyneistä reaktioista ilmaantui ensimmäisen infuusion yhteydessä, ja niiden vaikeusaste oli gradus 1–2 (ks. kohta Haittavaikutukset). Neljälle prosentille potilaista ilmaantui infuusioon liittynyt reaktio useammin kuin yhden infuusion yhteydessä. Vaikea-asteisia reaktioita, kuten bronkospasmia, hypoksiaa, hengenahdistusta, hypertensiota, kurkunpään turvotusta, keuhkoedeemaa ja silmiin liittyviä haittavaikutuksia (mukaan lukien silmän suonikalvon effuusiota, akuuttia likitaittoisuutta ja akuuttia ahdaskulmaglaukoomaa), on esiintynyt. Oireita olivat pääasiassa nenän tukkoisuus, yskä, kurkun ärsytys, vilunväristykset, oksentelu ja pahoinvointi. Harvinaisempia oireita olivat hengityksen vinkuminen, allerginen nuha, kuume, epämukavat tuntemukset rintakehässä, kutina, hypotensio ja hämärtynyt näkö (ks. kohta Haittavaikutukset).
Potilaille pitää antaa ennen Darzalex-hoitoa esilääkityksenä antihistamiineja, antipyreettejä ja kortikosteroideja, jotta infuusioon liittyvien reaktioiden riskiä voidaan vähentää. Jos potilaalle ilmaantuu minkä tahansa vaikeusasteen infuusioon liittyvä reaktio, Darzalex-infuusion antaminen pitää keskeyttää, ja infuusioon liittyvään reaktioon pitää tarvittaessa aloittaa hoito tai tukitoimenpiteet. Kun infuusion antamista jatketaan potilaalle, jolle on ilmaantunut graduksen 1, 2 tai 3 infuusioon liittyvä reaktio, infuusionopeutta pitää hidastaa. Jos potilaalle ilmenee anafylaktinen reaktio tai hengenvaarallinen (gradus 4) infuusioon liittyvä reaktio, asianmukaiset kiireelliset elvytystoimenpiteet pitää käynnistää heti. Darzalex-hoito pitää lopettaa heti ja pysyvästi (ks. kohdat Annostus ja antotapa ja Vasta-aiheet).
Potilaille pitää antaa Darzalex-infuusion jälkeen kortikosteroideja suun kautta viivästyneiden infuusioon liittyvien reaktioiden riskin vähentämiseksi. Infuusion jälkeistä lääkitystä (esim. inhaloitavia kortikosteroideja, lyhyt- ja pitkävaikutteisia keuhkoputkia laajentavia lääkkeitä) pitää lisäksi harkita mahdollisten hengityselinkomplikaatioiden hoitoon, jos potilaalla on aiemmin ollut krooninen ahtauttava keuhkosairaus. Jos potilaalle ilmaantuu silmäoireita, keskeytä Darzalex-infuusio ja pyydä heti silmälääkärin arvio ennen kuin Darzalex-hoitoa jatketaan (ks. kohta Annostus ja antotapa).
Neutropenia/trombosytopenia
Darzalex saattaa lisätä runkohoidosta aiheutuvaa neutropeniaa ja trombosytopeniaa (ks. kohta Haittavaikutukset).
Täydellistä verenkuvaa pitää seurata hoidon aikana säännöllisin väliajoin runkohoitoon kuuluvien valmisteiden valmistetietojen mukaisesti. Neutropeenisia potilaita pitää tarkkailla infektion oireiden havaitsemiseksi. Darzalex-hoidon siirtäminen myöhempään ajankohtaan saattaa olla tarpeen, jotta verisolujen määrät voivat korjautua. Darzalex-annoksen pienentämistä ei suositella. Harkitse verensiirtoja tai kasvutekijöitä tukihoitona.
Vaikutukset epäsuoraan antiglobuliinikokeeseen (epäsuoraan Coombsin kokeeseen)
Daratumumabi sitoutuu CD38-proteiiniin, jota on pieninä pitoisuuksina veren punasolujen pinnalla, ja se saattaa aiheuttaa epäsuoran Coombsin kokeen positiivisen testituloksen. Epäsuoran Coombsin kokeen tulokset voivat olla daratumumabin vaikutuksesta positiivisia enimmillään kuuden kuukauden ajan viimeisen daratumumabi-infuusion jälkeen. On syytä huomioida, että veren punasoluihin sitoutunut daratumumabi saattaa häiritä minor-antigeeneihin kohdistuvien vasta-aineiden havaitsemista potilaan seerumista. Potilaan ABO- ja Rh-veriryhmien määritys ei häiriinny.
Potilaalle pitää tehdä tyypitys ja seulonta ennen daratumumabihoidon aloittamista. Ennen daratumumabihoidon aloittamista pitää harkita fenotyypitystä paikallisen käytännön mukaisesti. Daratumumabi ei vaikuta veren punasolujen genotyypitykseen, joten se voidaan tehdä milloin tahansa.
Jos potilaalle suunnitellaan verensiirtoa, veripalveluyksikölle pitää kertoa epäsuorien antiglobuliinitestien tällaisesta häiriintymisestä (ks. kohta Yhteisvaikutukset). Jos verensiirto on tarpeen hätätilanteessa, voidaan antaa ABO/RhD-yhteensopivia punasoluja ilman sopivuuskoetta paikallisen veripalveluyksikön käytännön mukaan.
Täydellisen vasteen määrittämisen häiriintyminen
Daratumumabi on ihmisen monoklonaalinen IgG-kappa-vasta-aine, joka voidaan havaita sekä seerumin proteiinielektroforeesi- (SPE) että immunofiksaatio- (IFE) määrityksellä, joita käytetään endogeenisen M-proteiinin kliiniseen seurantaan (ks. kohta Yhteisvaikutukset). Tämä voi häiritä täydellisen vasteen ja taudin etenemisen määrittämistä joillakin potilailla, joilla on IgG-kappamyeloomaproteiinia.
Hepatiitti B -viruksen (HBV) reaktivaatio
Darzalex-hoitoa saaneilla potilailla on raportoitu hepatiitti B -viruksen reaktivaatiota, joka on joissakin tapauksissa johtanut potilaan kuolemaan. Kaikille potilaille pitää tehdä hepatiitti B -viruksen seulonta ennen Darzalex-hoidon aloittamista.
Jos potilas todetaan serologisesti HBV-positiiviseksi, seuraa hepatiitti B -viruksen reaktivaatioon viittaavia kliinisiä oireita ja laboratoriokoetuloksia Darzalex-hoidon aikana ja vähintään kuuden kuukauden ajan hoidon päättymisen jälkeen. Hoida potilasta voimassa olevien kliinisten ohjeistojen mukaisesti. Harkitse hepatiittiin perehtyneen asiantuntijan konsultoimista kliinisen tarpeen mukaan.
Jos potilaalle kehittyy hepatiitti B -viruksen reaktivaatio Darzalex-hoidon aikana, keskeytä Darzalex-hoito, ja aloita tilanteen edellyttämä hoito. Darzalex-hoidon jatkamisesta potilailla, joilla hepatiitti B -viruksen reaktivaatio on riittävästi hallinnassa, pitää keskustella sellaisen lääkärin kanssa, jolla on asiantuntemusta hepatiitti B -virusinfektion hoitamisesta.
Apuaineet
Tämä lääkevalmiste sisältää sorbitolia (E420). Potilaille, joilla on perinnöllinen fruktoosi-intoleranssi (HFI), ei saa antaa tätä lääkevalmistetta, ellei se ole ehdottoman välttämätöntä.
Kunkin potilaan yksityiskohtaiset HFI-oireisiin liittyvät esitiedot on selvitettävä ennen tämän lääkevalmisteen antoa.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Daratumumabi on monoklonaalinen IgG1қ-vasta-aine, joten erittyminen munuaisten kautta tai maksaentsyymivälitteinen metabolia eivät ole muuttumattoman daratumumabin todennäköisiä pääasiallisia eliminaatioreittejä. Lääkkeitä metaboloivissa entsyymeissä esiintyvän vaihtelun ei sinänsä oleteta vaikuttavan daratumumabin eliminaatioon. Daratumumabi sitoutuu suurella affiniteetilla CD38-proteiinin yksilölliseen epitooppiin, joten se ei oletettavasti muuta lääkkeitä metaboloivia entsyymejä.
Daratumumabin sekä lenalidomidin, pomalidomidin, talidomidin, bortetsomibin ja deksametasonin yhdistelmän kliininen farmakokineettinen arviointi ei osoittanut kliinisesti oleellisia yhteisvaikutuksia daratumumabin ja näiden pienimolekyylisten lääkevalmisteiden välillä.
Vaikutukset epäsuoraan antiglobuliinikokeeseen (epäsuoraan Coombsin kokeeseen)
Daratumumabi sitoutuu veren punasolujen pinnalla CD38-proteiiniin ja häiritsee yhteensopivuustestausta, vasta-aineiden seulonta ja veriryhmien sopivuuskoe (ristikoe) mukaan lukien (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Daratumumabin testejä häiritsevää vaikutusta voidaan vähentää mm. käsittelemällä reagenssin punasolut ditiotreitolilla (DTT), jotta daratumumabin sitoutuminen häiriintyy, tai muilla paikallisesti validoiduilla menetelmillä. Koska Kell-veriryhmäjärjestelmä on myös herkkä DTT-käsittelylle, potilaalle pitää antaa Kell-negatiivisia yksikköjä sen jälkeen, kun allovasta-aineet on suljettu pois tai tunnistettu DTT-käsiteltyjen punasolujen avulla. Vaihtoehtoisesti voidaan harkita myös fenotyypitystä tai genotyypitystä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vaikutukset seerumin proteiinielektroforeesi- ja immunofiksaatiokokeisiin
Daratumumabi voidaan havaita sekä seerumin proteiinielektroforeesi- (SPE) että immunofiksaatio (IFE) ‑määrityksellä, joita käytetään sairauden monoklonaalisten immunoglobuliinien (M-proteiinin) seurantaan. Se voi aiheuttaa SPE- ja IFE-määritysten virheellisesti positiivisen tuloksen, jos potilaalla on IgG-kappamyeloomaproteiinia, mikä vaikuttaa International Myeloma Working Group (IMWG) ‑kriteerien mukaiseen täydellisen vasteen arviointiin. Jos potilaalla on pitkään erittäin hyvä osittainen vaste ja daratumumabin epäillään häiritsevän määritystä, on harkittava validoitua daratumumabispesifistä immunofiksaatiomääritystä, jotta daratumumabi ja potilaan seerumissa mahdollisesti jäljellä oleva endogeeninen M-proteiini voidaan erottaa toisistaan ja täydellinen vaste saadaan siten paremmin määritetyksi.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / raskauden ehkäisy
Naisten, jotka voivat tulla raskaaksi, pitää käyttää tehokasta ehkäisyä daratumumabihoidon aikana ja kolmen kuukauden ajan hoidon päättymisen jälkeen.
Raskaus
Daratumumabin käytöstä raskaana oleville naisille ei ole olemassa tietoja tai on vain vähän tietoja. Eläimillä tehdyistä tutkimuksista saadut tiedot eivät riitä lisääntymistoksisuuden selvittämiseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Darzalex-valmisteen käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö daratumumabi ihmisillä äidinmaitoon.
Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Darzalex-hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Daratumumabista miehen tai naisen hedelmällisyyteen mahdollisesti aiheutuvien vaikutusten arvioimiseksi ei ole tietoja saatavissa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Darzalex-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Daratumumabia käyttäneillä potilailla on kuitenkin raportoitu uupumusta, mikä pitää ottaa huomioon autoa ajettaessa ja koneita käytettäessä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimpiä minkä tahansa vaikeusasteen haittavaikutuksia (≥ 20 %:lla potilaista) olivat infuusioreaktiot, uupumus, pahoinvointi, ripuli, ummetus, kuume, hengenahdistus, yskä, neutropenia, trombosytopenia, anemia, raajojen turvotus, astenia, perifeerinen neuropatia, ylähengitysteiden infektio, muskuloskeletaalinen kipu ja Covid-19-tauti. Vakavia haittavaikutuksia olivat sepsis, keuhkokuume, keuhkoputkitulehdus, ylähengitysteiden infektio, keuhkoedeema, influenssa, kuume, elimistön kuivuminen, ripuli ja eteisvärinä.
Haittavaikutustaulukko
Taulukossa 6 esitetään yhteenveto Darzalex-hoitoa saaneilla potilailla esiintyneistä haittavaikutuksista. Tiedot kuvastavat Darzalex-altistusta (16 mg/kg) 2 066:lla multippelia myeloomaa sairastavalla potilaalla, joista 1 910 potilasta sai Darzalex-infuusioliuosta yhdistelmänä peruslääkitysten kanssa ja 156 potilasta sai Darzalex-infuusioliuosta monoterapiana. Myös markkinoille tulon jälkeiset haittavaikutukset mainitaan taulukossa.
Tutkimuksessa MMY3006 CD34+-solusaaliin määrä oli D-VTd-ryhmässä numeerisesti pienempi kuin VTd-ryhmässä (mediaani: D-VTd: 6,3 x 106/kg; VTd: 8,9 x 106/kg) sekä niillä, joilla solut saatiin mobilisoitua, useampi D-VTd-ryhmän potilas sai pleriksaforia verrattuna VTd-ryhmän potilaisiin (D-VTd: 21,7 %; VTd: 7,9 %). Siirteen kiinnittyminen ja hematopoieesin elpyminen oli D-VTd- ja VTd-ryhmien siirteen saaneilla tutkittavilla yhtä yleistä (D-VTd: 99,8 %; VTd: 99,6 %; mikä mitattiin ilman verensiirtoa seuraavilla solumäärillä: neutrofiilit > 0,5 x 109/l, leukosyytit > 1,0 x 109/l, ja trombosyytit > 50 x 109/l).
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (> 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Taulukko 6: Haittavaikutukset Darzalex-hoitoa annoksella 16 mg/kg saaneilla multippelia myeloomaa sairastavilla potilailla | ||||
| Elinjärjestelmä | Haittavaikutus | Esiintyvyys | Ilmaantuvuus (%) | |
| Kaikki gradukset | Gradus 3−4 | |||
| Infektiot | Ylähengitystieinfektioa | Hyvin yleinen | 46 | 4 |
| Covid-19-tautia,d | 23 | 6 | ||
| Keuhkokuumea | 19 | 11 | ||
| Keuhkoputkitulehdusa | 17 | 2 | ||
| Virtsatieinfektio | Yleinen | 8 | 1 | |
| Sepsisa | 4 | 4 | ||
| Sytomegalovirusinfektioa | 1 | < 1* | ||
| Hepatiitti B -viruksen reaktivaatiob | Melko harvinainen | - | - | |
| Veri ja imukudos | Neutropeniaa | Hyvin yleinen | 44 | 39 |
| Trombosytopeniaa | 31 | 19 | ||
| Anemiaa | 27 | 12 | ||
| Lymfopeniaa | 14 | 11 | ||
| Leukopeniaa | 12 | 6 | ||
| Immuunijärjestelmä | Hypogammaglobulinemiaa | Yleinen | 3 | < 1* |
| Anafylaktinen reaktiob | Harvinainen | - | - | |
| Aineenvaihdunta ja ravitsemus | Heikentynyt ruokahalu | Hyvin yleinen | 12 | 1 |
| Hypokalemiaa | 10 | 3 | ||
| Hyperglykemia | Yleinen | 7 | 3 | |
| Hypokalsemia | 6 | 1 | ||
| Elimistön kuivuminen | 3 | 1* | ||
| Psyykkiset häiriöt | Unettomuus | Hyvin yleinen | 16 | 1* |
| Hermosto | Perifeerinen neuropatiaa | Hyvin yleinen | 35 | 4 |
| Päänsärky | 12 | < 1* | ||
| Parestesiat | 11 | < 1 | ||
| Heitehuimaus | 10 | < 1* | ||
| Pyörtyminen | Yleinen | 2 | 2* | |
| Sydän | Eteisvärinä | Yleinen | 4 | 1 |
| Verisuonisto | Hypertensioa | Hyvin yleinen | 10 | 5 |
| Hengityselimet, rintakehä ja välikarsina | Yskäa | Hyvin yleinen | 25 | < 1* |
| Hengenahdistusa | 21 | 3 | ||
| Keuhkoedeemaa | Yleinen | 1 | < 1 | |
| Ruoansulatuselimistö | Ummetus | Hyvin yleinen | 33 | 1 |
| Ripuli | 32 | 4 | ||
| Pahoinvointi | 26 | 2* | ||
| Oksentelu | 16 | 1* | ||
| Vatsakipua | 14 | 1 | ||
| Haimatulehdusa | Yleinen | 1 | 1 | |
| Iho ja ihonalainen kudos | Ihottuma | Hyvin yleinen | 13 | 1* |
| Kutina | Yleinen | 7 | < 1* | |
| Luusto, lihakset ja sidekudos | Muskuloskeletaalinen kipua | Hyvin yleinen | 37 | 4 |
| Nivelsärky | 14 | 1 | ||
| Lihasspasmit | 14 | < 1* | ||
| Yleisoireet ja antopaikassa todettavat haitat | Raajojen turvotusa,e | Hyvin yleinen | 27 | 1 |
| Uupumus | 26 | 4 | ||
| Kuume | 23 | 2 | ||
| Astenia | 21 | 2 | ||
| Vilunväristykset | Yleinen | 9 | < 1* | |
| Vammat, myrkytykset ja hoitokomplikaatiot | Infuusioon liittyvät reaktiotc | Hyvin yleinen | 40 | 4 |
* Ei gradus 4 a Viittaa termien yhdistelmään b Markkinoille tulon jälkeinen haittavaikutus c Infuusioon liittyvät reaktiot sisältävät myös tutkijan infuusioon liittyviksi määrittelemät termit, ks. jäljempänä d Ilmaantuvuus perustuu niiden potilaiden alaryhmään, jotka saivat tutkimuksissa MMY3003, MMY3006, MMY3008 ja MMY3013 vähintään yhden tutkimushoitoannoksen 1. helmikuuta 2020 tai sen jälkeen (covid-19-pandemian alku) sekä kaikkiin tutkimuksissa MMY3014, MMY3019 ja SMM3001 daratumumabihoitoa saaneisiin potilaisiin (N = 1 177). e Muskuloskeletaalinen kipu sisältää seuraavat: selkäkipu, kylkikipu, nivuskipu, muskuloskeletaalinen rintakipu, muskuloskeletaalinen kipu, muskuloskeletaalinen jäykkyys, lihaskipu, niskakipu, ei-sydänperäinen rintakipu ja raajakipu. | ||||
Valikoitujen haittavaikutusten kuvaus
Infuusioon liittyvät reaktiot
Infuusioon liittyvien reaktioiden minkä tahansa graduksen ilmaantuvuus kliinisissä tutkimuksissa (monoterapia ja yhdistelmähoidot; N = 2 066) oli ensimmäisen Darzalex-infuusion (16 mg/kg, viikko 1) yhteydessä 37 %, viikon 2 infuusion yhteydessä 2 % ja seuraavien infuusioiden yhteydessä kumulatiivisesti 6 %. Alle 1 %:lla potilaista oli graduksen 3/4 infuusioon liittynyt reaktio viikon 2 tai sitä myöhempien infuusioiden yhteydessä.
Ajan mediaani reaktion ilmaantumiseen oli 1,5 tuntia (vaihteluväli: 0–72,8 tuntia). Infuusioiden muuttamisprosentti reaktioiden vuoksi oli 36 %. Infuusion (16 mg/kg) kestoajan mediaani oli ensimmäisen viikon infuusion yhteydessä noin 7 tuntia, toisen viikon infuusion yhteydessä noin 4 tuntia ja seuraavien infuusioiden yhteydessä noin 3 tuntia.
Vaikea-asteisia infuusioon liittyneitä reaktioita olivat bronkospasmi, hengenahdistus, kurkunpään turvotus, keuhkoedeema, silmiin liittyvät haittavaikutukset (mukaan lukien silmän suonikalvon effuusio, akuutti likitaittoisuus ja akuutti ahdaskulmaglaukooma), hypoksia ja hypertensio. Muita infuusioon liittyneitä reaktioita olivat nenän tukkoisuus, yskä, vilunväristykset, kurkun ärsytys, hämärtynyt näkö, oksentelu ja pahoinvointi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Darzalex-hoito keskeytettiin autologisen kantasolusiirron yhteydessä (tutkimus MMY3006) 3,75 kuukaudeksi (mediaani) (vaihteluväli: 2,4; 6,9 kuukautta), ja kun Darzalex-hoitoa jatkettiin, infuusioon liittyvien reaktioiden ilmaantuvuus autologisen kantasolusiirron jälkeen annetun ensimmäisen infuusion yhteydessä oli 11 %. Hoitoa jatkettaessa käytettiin samaa infuusionopeutta / laimennettua tilavuutta, jota käytettiin viimeisessä Darzalex-infuusiossa ennen hoidon keskeyttämistä autologisen kantasolusiirron vuoksi. Darzalex-hoitoa autologisen kantasolusiirron jälkeen jatkettaessa infuusioon liittyvät reaktiot olivat oireiltaan ja vaikeusasteeltaan (gradus 3/4: < 1 %) yhdenmukaisia aiemmissa tutkimuksissa viikolla 2 tai sen jälkeen annettujen infuusioiden yhteydessä raportoitujen reaktioiden kanssa.
Tutkimuksessa MMY1001 daratumumabiyhdistelmähoitoa saaville potilaille (n = 97) annettiin viikolla 1 ensimmäinen daratumumabiannos 16 mg/kg kahdelle päivälle jaettuna eli 8 mg/kg päivänä 1 ja 8 mg/kg päivänä 2. Infuusioon liittyvien reaktioiden minkä tahansa graduksen ilmaantuvuus oli 42 %, ja 36 %:lle potilaista ilmaantui infuusioon liittynyt reaktio viikon 1 päivänä 1, 4 %:lle potilaista viikon 1 päivänä 2 ja 8 %:lle potilaista seuraavien infuusioiden yhteydessä. Ajan mediaani reaktion ilmaantumiseen oli 1,8 tuntia (vaihteluväli: 0,1–5,4 tuntia). Infuusiohoidon keskeytti reaktioiden vuoksi 30 % potilaista. Infuusion kestoajan mediaani oli viikon 1 päivän 1 infuusion yhteydessä 4,2 tuntia, viikon 1 päivän 2 infuusion yhteydessä 4,2 tuntia ja seuraavien infuusioiden yhteydessä 3,4 tuntia.
Infektiot
Darzalex-yhdistelmähoitoa saaneilla potilailla raportoitiin graduksen 3 tai 4 infektioita seuraavasti:
Tutkimukset potilailla, joilla oli relapsoitunut tai hoitoon reagoimaton tauti: DVd: 21 %, Vd: 19 %; DRd: 28 %, Rd: 23 %; DPd: 28 %.
Tutkimukset potilailla, joilla oli äskettäin diagnosoitu tauti: D-VMP: 23 %, VMP: 15 %; DRd: 32 %, Rd: 23 %; D-VTd: 22 %, VTd: 20 %.
Kaikissa tutkimuksissa yleisimmin raportoitu vaikea-asteinen (gradus 3 tai 4) infektio oli keuhkokuume. Vaikuttavalla aineella kontrolloiduissa tutkimuksissa 1–4 % potilaista keskeytti hoidon infektioiden vuoksi. Kuolemaan johtaneita infektioita olivat lähinnä keuhkokuume ja sepsis.
Kuolemaan johtaneita (gradus 5) infektioita raportoitiin Darzalex-yhdistelmähoitoa saaneilla potilailla seuraavasti:
Tutkimukset potilailla, joilla oli relapsoitunut tai hoitoon reagoimaton tauti: DVd: 1 %, Vd: 2 %; DRd: 2 %, Rd: 1 %; DPd: 2 %.
Tutkimukset potilailla, joilla oli äskettäin diagnosoitu tauti: D-VMP: 1 %, VMP: 1 %; DRd: 2 %, Rd: 2 %; DVTd: 0 %, VTd: 0 %.
Lyhenteet: D = daratumumabi; Vd = bortetsomibi-deksametasoni; Rd = lenalidomidi-deksametasoni; Pd = pomalidomidi-deksametasoni; VMP = bortetsomibi-melfalaani-prednisoni; VTd = bortetsomibi-talidomidi-deksametasoni.
Hemolyysi
Hemolyysin riski on teoriassa olemassa. Tätä turvallisuutta koskevaa signaalia seurataan jatkuvasti kliinisissä tutkimuksissa ja valmisteen markkinoille tulon jälkeisistä turvallisuutta koskevista tiedoista.
Muut erityispotilasjoukot
Vaiheen III tutkimuksessa MMY3007 verrattiin D-VMP-hoitoa VMP-hoitoon potilailla, joilla oli äskettäin diagnosoitu multippeli myelooma ja jotka eivät soveltuneet autologiseen kantasolusiirtoon. Hoidon turvallisuutta koskeva analyysi niiden potilaiden alaryhmästä, joiden ECOG-toimintakykyluokka oli 2 (D-VMP: n = 89, VMP: n = 84), oli yhdenmukainen koko potilasjoukon kanssa (ks. kohta Farmakodynamiikka).
Iäkkäät potilaat
Suositeltuja Darzalex-annoksia saaneista 2 459 potilaasta 38 % oli 65–75-vuotiaita ja 15 % oli 75-vuotiaita tai vanhempia. Tehossa ei yleisesti havaittu ikään liittyviä eroja. Vakavien haittavaikutusten ilmaantuvuus oli iäkkäillä potilailla suurempi kuin nuoremmilla potilailla. Relapsoitunutta ja hoitoon reagoimatonta multippelia myeloomaa sairastavilla potilailla (n = 1 213) yleisimmät vakavat haittavaikutukset, jotka olivat yleisempiä iäkkäillä (≥ 65-vuotiailla), olivat keuhkokuume ja sepsis. Äskettäin diagnosoitua multippelia myeloomaa sairastavilla potilailla, jotka eivät soveltuneet autologiseen kantasolusiirtoon (n = 710), yleisin vakava haittavaikutus, joka oli yleisempi iäkkäillä (≥ 75-vuotiailla), oli keuhkokuume.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet ja löydökset
Yliannostuksesta ei ole kliinisiin tutkimuksiin perustuvaa kokemusta. Kliinisissä tutkimuksissa on annettu laskimoon annoksia 24 mg:aan/kg saakka.
Hoito
Daratumumabiyliannoksen hoitoon ei tunneta spesifistä vastalääkettä. Yliannoksen yhteydessä potilasta on seurattava haittavaikutusten oireiden ja löydösten havaitsemiseksi ja oireiden tarkoituksenmukainen hoito on aloitettava heti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, monoklonaaliset vasta-aineet ja vasta‑ainekonjugoidut lääkkeet, ATC-koodi: L01FC01.
Vaikutusmekanismi
Daratumumabi on ihmisen monoklonaalinen IgG1κ-vasta-aine, joka sitoutuu CD38-proteiiniin. CD38-proteiini ilmentyy suurina pitoisuuksina multippelin myelooman kasvainsolujen pinnalla sekä eri pitoisuuksina muissa solutyypeissä ja kudoksissa. CD38-proteiinilla on useita tehtäviä, kuten reseptorivälitteinen adheesio, signaalinvälitys ja entsymaattinen aktiivisuus.
Daratumumabin on osoitettu estävän in vivo tehokkaasti CD38-proteiinia ilmentävien kasvainsolujen kasvua. Daratumumabi saattaa in vitro ‑tutkimusten perusteella hyödyntää useita efektoritoimintoja, jotka aiheuttavat immuunivälitteisen kasvainsolukuoleman. Nämä tutkimukset viittaavat siihen, että daratumumabi voi komplementtiriippuvaisen sytotoksisuuden, vasta-aineriippuvaisen soluvälitteisen sytotoksisuuden ja vasta-aineriippuvaisen solujen fagosytoosin kautta indusoida kasvainsolulyysin CD38-proteiinia ilmentävissä syöpäkasvaimissa. Daratumumabivälitteinen solulyysi vähentää joidenkin myelooisten suppressorisolujen (CD38+MDSCs), säätelijä-T-solujen (CD38+Tregs) ja ‑B-solujen (CD38+Bregs) määrää. Myös T-solujen (CD3+, CD4+ ja CD8+) tiedetään kehitysvaiheesta ja aktivaatiotasosta riippuen ilmentävän CD38-proteiinia. Daratumumabihoidon havaittiin lisäävän huomattavasti ääreisosien kokoveressä ja luuytimessä olevaa T-solujen (CD4+ ja CD8+) absoluuttista määrää ja lymfosyyttien prosenttiosuutta. T-solureseptorien DNA-sekvensointi varmisti lisäksi, että daratumumabihoito lisäsi T-solujen klonaalisuutta. Tämä osoittaa, että daratumumabivalmisteella on immuniteettia muuntavia vaikutuksia, jotka saattavat edistää kliinisen vasteen saamista.
Daratumumabi indusoi in vitro apoptoosia Fc‑välitteisen silloittumisen (cross-linking) jälkeen. Daratumumabi muunsi lisäksi CD38-proteiinin entsymaattista aktiivisuutta. Se esti siten syklaasientsyymin aktiivisuutta ja stimuloi hydrolaasin aktiivisuutta. Näiden in vitro ‑vaikutusten kliininen merkitys ja merkitys kasvaimen kasvun kannalta tunnetaan huonosti.
Farmakodynaamiset vaikutukset
Luonnolliset tappajasolut (NK-solut) ja T-solumäärä
NK-solujen tiedetään ilmentävän suuria CD38-proteiinipitoisuuksia ja olevan herkkiä daratumumabivälitteiselle solulyysille. Daratumumabihoidon havaittiin vähentävän kaikkien NK-solujen (CD16+CD56+) sekä aktivoitujen NK-solujen (CD16+CD56dim) absoluuttista määrää ja prosenttiosuutta sekä ääreisosien kokoveressä ja luuytimessä. Lähtötilanteen NK-solupitoisuudella ei kuitenkaan osoitettu olevan yhteyttä kliiniseen vasteeseen.
Immunogeenisuus
Laskimoon annettavaa daratumumabihoitoa kliinisissä tutkimuksissa saaneista potilaista alle 1 %:lle kehittyi hoidon aikana daratumumabin vasta-aineita.
Kliininen teho ja turvallisuus
Äskettäin diagnosoitu multippeli myelooma
Lenalidomidista ja deksametasonista koostuva yhdistelmähoito potilaille, jotka eivät sovellu autologiseen kantasolusiirtoon
Tutkimus MMY3008 oli avoin, satunnaistettu, aktiivisella aineella kontrolloitu vaiheen III tutkimus, jossa Darzalex-hoitoa annoksina 16 mg/kg yhdistelmänä lenalidomidin ja pienen deksametasoniannoksen kanssa (DRd) verrattiin hoitoon lenalidomidin ja pienen deksametasoniannoksen yhdistelmällä (Rd) äskettäin diagnosoitua multippelia myeloomaa sairastavilla potilailla. Lenalidomidi (25 mg kerran päivässä suun kautta toistettujen 28 päivän [4 viikon] hoitosyklien päivinä 1–21) annettiin yhdessä suun kautta tai laskimoon annetun pienen deksametasoniannoksen 40 mg/viikko kanssa (tai pienennetyn annoksen 20 mg/viikko kanssa, jos potilas oli > 75-vuotias tai jos potilaan painoindeksi [body mass index, BMI] oli < 18,5). Darzalex-infuusiopäivinä deksametasoniannos annettiin infuusion esilääkityksenä. Lenalidomidin ja deksametasonin annosta muutettiin valmistajan valmistetietojen mukaisesti. Hoitoa jatkettiin kummassakin hoitoryhmässä, kunnes tauti eteni tai ilmaantui toksisuutta, joka ei ollut hyväksyttävissä.
Yhteensä 737 potilasta satunnaistettiin: 368 potilasta satunnaistettiin DRd-ryhmään, ja 369 potilasta satunnaistettiin Rd-ryhmään. Lähtötilanteen demografiset ja taudin ominaisuudet olivat näissä kahdessa hoitoryhmässä samankaltaiset. Potilaiden iän mediaani oli 73 vuotta (vaihteluväli: 45–90), ja 44 % potilaista oli ≥ 75-vuotiaita. Suurin osa potilaista oli valkoihoisia (92 %) ja miehiä (52 %). ECOG-toimintakykyluokka (Eastern Cooperative Oncology Group) oli 34 %:lla potilaista 0, 49,5 %:lla potilaista 1 ja 17 %:lla potilaista ≥ 2. International Staging System (ISS) ‑levinneisyysluokkaan I kuului 27 %, ISS-levinneisyysluokkaan II 43 % ja ISS-levinneisyysluokkaan III 29 %. Hoidon tehoa arvioitiin IMWG-kriteerien (International Myeloma Working Group) mukaisella etenemättömyysajalla (Progression Free Survival, PFS) ja kokonaiselossaololla (Overall Survival, OS).
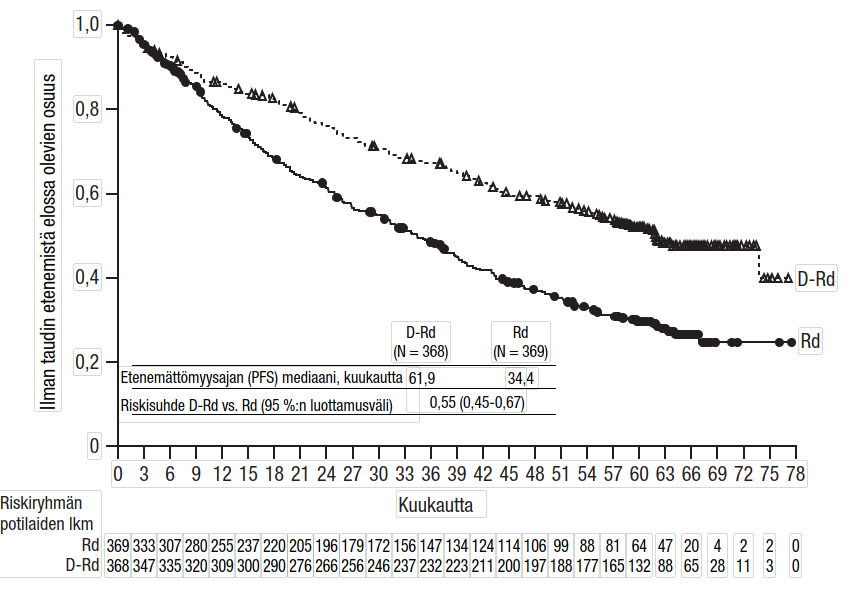
Tutkimuksessa MMY3008 etenemättömyysajan ensisijainen analyysi osoitti 28 kuukauden (mediaani) seurannan jälkeen etenemättömyysajan pidentyneen DRd-ryhmässä Rd-ryhmään verrattuna; etenemättömyysajan mediaania ei ollut saavutettu DRd-ryhmässä ja Rd-ryhmässä se oli 31,9 kuukautta (riskisuhde [HR] = 0,56; 95 %:n luottamusväli: 0,43; 0,73; p < 0,0001), mikä tarkoittaa, että DRd-hoitoa saaneiden potilaiden taudin etenemisen tai kuoleman riski väheni 44 %. Tulokset 64 kuukauden (mediaani) seuranta-ajan jälkeen päivitetystä etenemättömyysajan analyysista osoittivat edelleen, että etenemättömyysaika oli pidentynyt DRd-ryhmän potilailla verrattuna Rd‑ryhmään. Etenemättömyysajan mediaani oli DRd-ryhmässä 61,9 kuukautta ja Rd-ryhmässä 34,4 kuukautta (riskisuhde = 0,55; 95 %:n luottamusväli: 0,45; 0,67).
Kuvio 1: Tutkimuksen MMY3008 etenemättömyysajan (PFS) Kaplan–Meier-käyrä
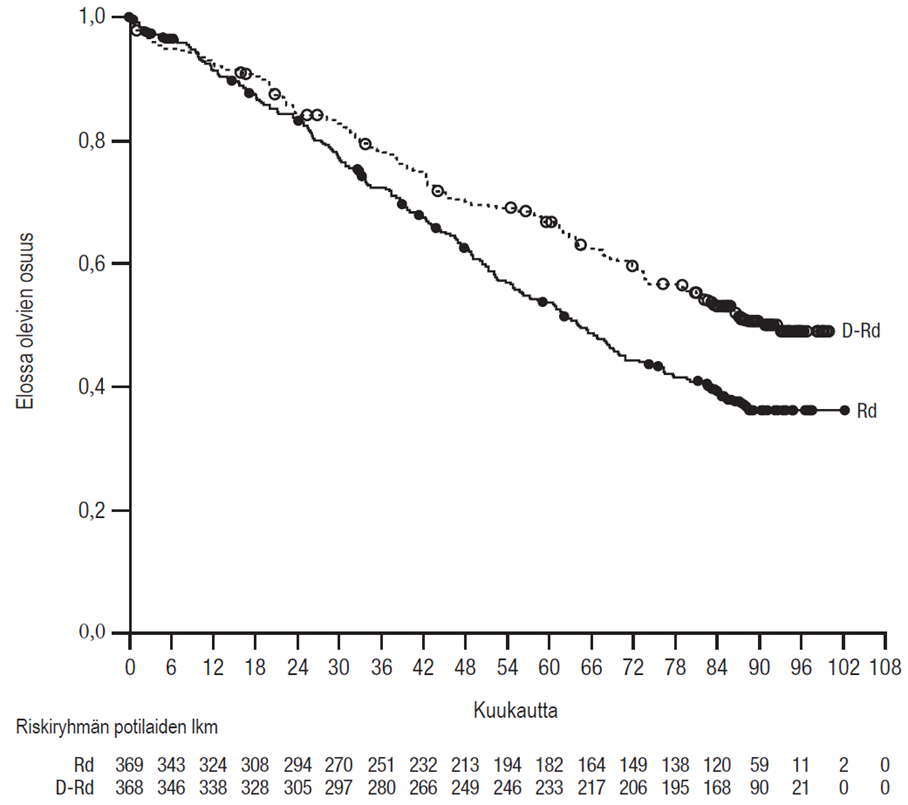
56 kuukauden (mediaani) seurannan jälkeen DRd-ryhmässä todettiin pidempi kokonaiselossaolo kuin Rd-ryhmässä (riskisuhde = 0,68; 95 %:n luottamusväli: 0,53; 0,86; p = 0,0013). Tulokset 89 kuukauden (mediaani) jälkeen päivitetystä kokonaiselossaolon analyysista osoittivat edelleen, että kokonaiselossaolo oli DRd-ryhmän potilailla pidentynyt verrattuna Rd-ryhmään. Kokonaiselossaolon mediaani oli DRd-ryhmässä 90,3 kuukautta, ja Rd-ryhmässä se oli 64,1 kuukautta (riskisuhde = 0,67; 95 %:n luottamusväli: 0,55, 0,82).
Kuvio 2: Tutkimuksen MMY3008 kokonaiselossaolon (OS) Kaplan–Meier-käyrä
Tutkimuksen MMY3008 muut tehoa koskevat tulokset esitetään alla olevassa taulukossa 7.
| Taulukko 7: Tutkimuksen MMY3008 muut tehoa koskevat tulokseta | ||
| DRd (n = 368) | Rd (n = 369) | |
| Kokonaisvasteluku (sCR+CR+VGPR+PR) n (%)a | 342 (92,9 %) | 300 (81,3 %) |
| p-arvob | < 0,0001 | |
| Täydellinen vaste lisäehdoin (stringent complete response, sCR) | 112 (30,4 %) | 46 (12,5 %) |
| Täydellinen vaste (complete response, CR) | 63 (17,1 %) | 46 (12,5 %) |
| Erittäin hyvä osittainen vaste (very good partial response, VGPR) | 117 (31,8 %) | 104 (28,2 %) |
| Osittainen vaste (partial response, PR) | 50 (13,6 %) | 104 (28,2 %) |
| Täydellinen vaste tai parempi (sCR + CR) | 175 (47,6 %) | 92 (24,9 %) |
| p-arvob | < 0,0001 | |
| Erittäin hyvä osittainen vaste tai parempi (sCR + CR + VGPR) | 292 (79,3 %) | 196 (53,1 %) |
| p-arvob | < 0,0001 | |
| MRD-negatiivisten lukumääräa,c n (%) | 89 (24,2 %) | 27 (7,3 %) |
| 95 %:n luottamusväli (%) | (19,9 %; 28,9 %) | (4,9 %; 10,5 %) |
| Kerroinsuhde, 95 %:n luottamusvälid | 4,04 (2,55; 6,39) | |
| p-arvoe | < 0,0001 | |
DRd = daratumumabi-lenalidomidi-deksametasoni; Rd = lenalidomidi-deksametasoni; MRD = minimaalinen jäännöstauti (minimal residual disease) a Perustuu hoitoaikeen mukaiseen potilasjoukkoon (intent-to-treat population). b Cochran-Mantel-Haenszelin khiin neliötestiin perustuva p-arvo. c Perustuu raja-arvoon 10-5. d Osittamattomissa taulukoissa käytetään kerroinsuhteen Mantel-Haenszelin estimaattia. Kerroinsuhde > 1 osoittaa etua DRd-hoidon suhteen. e Fisherin eksaktiin testiin perustuva p-arvo. | ||
Vasteen saaneilla tutkittavilla ajan mediaani vasteeseen oli DRd-ryhmässä 1,05 kuukautta (vaihteluväli: 0,2–12,1 kuukautta) ja Rd-ryhmässä 1,05 kuukautta (vaihteluväli: 0,3–15,3 kuukautta). Vasteen keston mediaania ei ollut saavutettu DRd-ryhmässä ja Rd-ryhmässä se oli 34,7 kuukautta (95 %:n luottamusväli: 30,8; ei arvioitavissa).
Bortetsomibista, melfalaanista ja prednisonista (VMP) koostuva yhdistelmähoito potilaille, jotka eivät sovellu autologiseen kantasolusiirtoon
Tutkimus MMY3007 oli avoin, satunnaistettu, aktiivisella aineella kontrolloitu vaiheen III tutkimus, jossa Darzalex-hoitoa annoksina 16 mg/kg yhdistelmänä bortetsomibin, melfalaanin ja prednisonin kanssa (D-VMP) verrattiin VMP-hoitoon äskettäin diagnosoitua multippelia myeloomaa sairastavilla potilailla. Bortetsomibi annettiin ensimmäisen 6 viikon hoitosyklin aikana (sykli 1; 8 annosta) injektioina ihon alle kehon pinta-alaan suhteutettuina annoksina 1,3 mg/m2 kaksi kertaa viikossa viikoilla 1, 2, 4 ja 5, minkä jälkeen annoksia annettiin kerran viikossa viikoilla 1, 2, 4 ja 5 vielä kahdeksan 6 viikon hoitosykliä (syklit 2–9; 4 annosta per sykli). Melfalaaniannoksia 9 mg/m2 ja prednisoniannoksia 60 mg/m2 annettiin suun kautta yhdeksän 6 viikon hoitosyklin (syklit 1–9) päivinä 1–4. Darzalex-hoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisuutta, joka ei ollut hyväksyttävissä.
Yhteensä 706 potilasta satunnaistettiin: 350 potilasta satunnaistettiin D-VMP-ryhmään, ja 356 potilasta satunnaistettiin VMP-ryhmään. Lähtötilanteen demografiset ja taudin ominaisuuksia koskevat parametrit olivat näissä kahdessa hoitoryhmässä samankaltaiset. Potilaiden iän mediaani oli 71 vuotta (vaihteluväli: 40–93 vuotta), ja 30 % potilaista oli ≥ 75-vuotiaita. Suurin osa potilaista oli valkoihoisia (85 %) ja naisia (54 %). ECOG-toimintakykyluokka oli 25 %:lla potilaista 0, 50 %:lla potilaista 1 ja 25 %:lla potilaista 2. Potilailla oli eri myeloomatyyppejä seuraavasti: IgG 64 %, IgA 22 % ja kevytketjumyelooma 10 %. International Staging System (ISS) -levinneisyysluokkaan I kuului 19 %, ISS-levinneisyysluokkaan II 42 % ja ISS-levinneisyysluokkaan III 38 % potilaista. 84 % kuului tavanomaisen riskin sytogeneettiseen kategoriaan. Hoidon tehoa arvioitiin IMWG-kriteerien mukaisella etenemättömyysajalla ja kokonaiselossaololla.
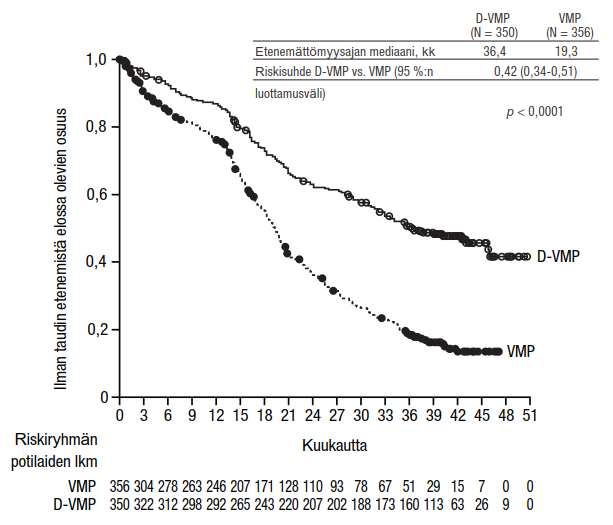
Tutkimuksessa MMY3007 etenemättömyysajan ensisijainen analyysi osoitti 16,5 kuukauden (mediaani) seurannan jälkeen etenemättömyysajan pidentyneen D-VMP-ryhmässä verrattuna VMP-ryhmään; etenemättömyysajan mediaania ei ollut saavutettu D-VMP-ryhmässä ja VMP-ryhmässä se oli 18,1 kuukautta (riskisuhde = 0,5; 95 %:n luottamusväli: 0,38; 0,65; p < 0,0001). Tulokset 40 kuukauden (mediaani) seuranta-ajan jälkeen päivitetystä etenemättömyysajan analyysista osoittivat edelleen, että etenemättömyysaika oli pidentynyt D-VMP-ryhmässä verrattuna VMP-ryhmään. Etenemättömyysajan mediaani oli D-VMP-ryhmässä 36,4 kuukautta ja VMP-ryhmässä 19,3 kuukautta (riskisuhde = 0,42; 95 %:n luottamusväli: 0,34; 0,51; p < 0,0001), mikä tarkoittaa, että D-VMP-hoitoa saaneiden potilaiden taudin etenemisen tai kuoleman riski oli vähentynyt 58 %.
Kuvio 3: Tutkimuksen MMY3007 etenemättömyysajan (PFS) Kaplan–Meier-käyrä
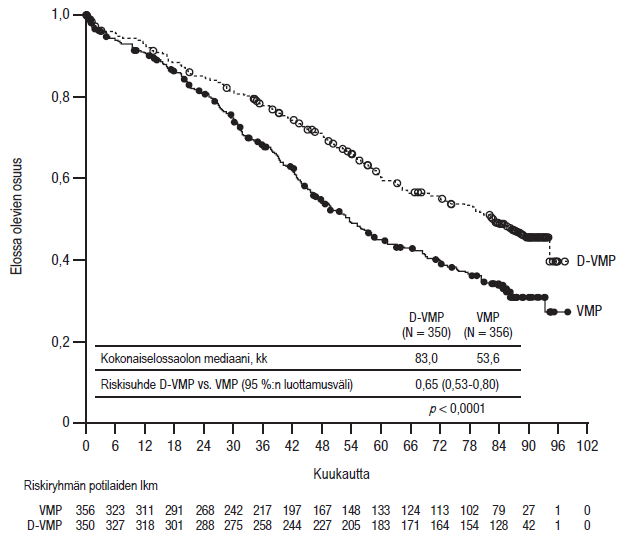
Kokonaiselossaolon todettiin olleen 40 kuukauden (mediaani) seurannan jälkeen D-VMP-ryhmässä VMP-ryhmää parempi (riskisuhde = 0,60; 95 %:n luottamusväli: 0,46; 0,80; p = 0,0003), mikä tarkoittaa, että D-VMP-hoitoa saaneen ryhmän potilaiden kuoleman riski väheni 40 %. Kokonaiselossaolon mediaani oli 87 kuukauden (mediaani) seurannan jälkeen D‑VMP‑ryhmässä 83 kuukautta (95 %:n luottamusväli: 72,5; ei arvioitavissa) ja VMP‑ryhmässä 53,6 kuukautta (95 %:n luottamusväli: 46,3; 60,9).
Kuvio 4: Tutkimuksen MMY3007 kokonaiselossaolon (OS) Kaplan–Meier-käyrä
Tutkimuksen MMY3007 muut tehoa koskevat tulokset esitetään alla olevassa taulukossa 8.
| Taulukko 8: Tutkimuksen MMY3007 muut tehoa koskevat tulokseta | ||
| D-VMP (n = 350) | VMP (n = 356) | |
| Kokonaisvasteluku (sCR+CR+VGPR+PR) [n (%)] | 318 (90,9) | 263 (73,9) |
| p-arvob | < 0,0001 | |
| Täydellinen vaste lisäehdoin (stringent complete response, sCR) [n (%)] | 63 (18,0) | 25 (7,0) |
| Täydellinen vaste (complete response, CR) [n (%)] | 86 (24,6) | 62 (17,4) |
| Erittäin hyvä osittainen vaste (very good partial response, VGPR) [n (%)] | 100 (28,6) | 90 (25,3) |
| Osittainen vaste (partial response, PR) [n (%)] | 69 (19,7) | 86 (24,2) |
| MRD-negatiivisten lukumäärä (95 %:n luottamusväli) c (%) | 22,3 (18,0; 27,0) | 6,2 (3,9; 9,2) |
| Kerroinsuhde, 95 %:n luottamusvälid | 4,36 (2,64; 7,21) | |
| p-arvoe | < 0,0001 | |
D-VMP = daratumumabi-bortetsomibi-melfalaani-prednisoni; VMP = bortetsomibi-melfalaani-prednisoni; MRD = minimaalinen jäännöstauti (minimal residual disease) a Perustuu hoitoaikeen mukaiseen potilasjoukkoon (intent-to-treat population). b Cochran-Mantel-Haenszelin khiin neliötestiin perustuva p-arvo. c Perustuu raja-arvoon 10-5. d Ositetuissa taulukoissa käytetään yleisten kerroinsuhteiden Mantel-Haenszelin estimaattia. Kerroinsuhde > 1 osoittaa etua D-VMP-hoidon suhteen. e Fisherin eksaktiin testiin perustuva p-arvo. | ||
Vasteen saaneilla tutkittavilla ajan mediaani vasteeseen oli D-VMP-ryhmässä 0,79 kuukautta (vaihteluväli: 0,4–15,5 kuukautta) ja VMP-ryhmässä 0,82 kuukautta (vaihteluväli: 0,7–12,6 kuukautta). Vasteen keston mediaania ei ollut saavutettu D-VMP-ryhmässä ja VMP-ryhmässä se oli 21,3 kuukautta (vaihteluväli: 18,4 - ei arvioitavissa).
Alaryhmäanalyysi tehtiin seuraavista potilasryhmistä: vähintään 70-vuotiaat; 65–69-vuotiaat, joiden ECOG-toimintakykyluokka oli 2; alle 65-vuotiaat, joilla on samanaikaisesti muita merkittäviä sairauksia tai ECOG-toimintakykyluokka 2 (D-VMP: n = 273, VMP: n = 270). Hoidon tehoa koskevat tulokset olivat tutkittavien tässä alaryhmässä yhdenmukaiset koko potilasjoukon kanssa. Tutkittavien tässä osajoukossa etenemättömyysajan mediaania ei saavutettu D-VMP-ryhmässä ja VMP-ryhmässä se oli 17,9 kuukautta (riskisuhde = 0,56; 95 %:n luottamusväli: 0,42; 0,75; p < 0,0001). Kokonaisvasteluku oli D-VMP-ryhmässä 90 % ja VMP-ryhmässä 74 % (erittäin hyvän osittaisen vasteen (VGPR) osuus: D-VMP-ryhmässä 29 % ja VMP-ryhmässä 26 %; täydellisen vasteen (CR) osuus: D-VMP-ryhmässä 22 % ja VMP-ryhmässä 18 %; täydellisen vasteen lisäehdoin (sCR) osuus: D-VMP-ryhmässä 20 % ja VMP-ryhmässä 7 %). Myös hoidon turvallisuutta koskevat tulokset olivat tässä tutkittavien osajoukossa yhdenmukaiset koko potilasjoukon kanssa. Lisäksi hoidon turvallisuutta koskeva analyysi potilaiden osajoukosta, jonka ECOG-toimintakykyluokka oli 2 (D-VMP: n = 89, VMP: n = 84), oli myös yhdenmukainen koko potilasjoukon kanssa.
Bortetsomibista, talidomidista ja deksametasonista (VTd) koostuva yhdistelmähoito potilaille, jotka soveltuvat autologiseen kantasolusiirtoon
Tutkimus MMY3006 on kaksiosainen, avoin, satunnaistettu, aktiivisella aineella kontrolloitu vaiheen III tutkimus. Ensimmäisessä osassa Darzalex-induktio- ja -konsolidaatiohoitoa annoksina 16 mg/kg yhdistelmänä bortetsomibin, talidomidin ja deksametasonin kanssa (D-VTd) verrattiin hoitoon bortetsomibin, talidomidin ja deksametasonin yhdistelmällä (VTd) äskettäin diagnosoitua multippelia myeloomaa sairastavilla potilailla, jotka soveltuivat autologiseen kantasolusiirtoon. Hoidon konsolidaatiovaihe alkoi aikaisintaan 30 päivän kuluttua autologisesta kantasolusiirrosta, kun potilaat olivat toipuneet riittävästi ja siirre oli täysin kiinnittynyt. Toisessa osassa tutkittavat, jotka olivat saaneet vähintään osittaisen vasteen (PR) kantasolusiirron jälkeen päivään 100 mennessä, satunnaistettiin uudelleen suhteessa 1:1 daratumumabiylläpitohoitoon tai pelkkään tarkkailuun. Tästä eteenpäin kuvataan vain ensimmäisen osan tuloksia.
Bortetsomibia annettiin injektioina ihon alle tai injektioina laskimoon kehon pinta-alaan suhteutettuina annoksina 1,3 mg/m2 kaksi kertaa viikossa kahden viikon ajan (päivinä 1, 4, 8 ja 11) 28 päivän (4 viikon) pituisina toistettuina induktiohoitosykleinä (syklit 1–4) sekä syklin 4 jälkeen tehdyn autologisen kantasolusiirron jälkeen kahtena konsolidaatiosyklinä (syklit 5 ja 6). Talidomidia annettiin kuuden bortetsomibisyklin aikana suun kautta 100 mg:n vuorokausiannoksina. Deksametasonia (suun kautta tai laskimoon) annettiin 40 mg:n annoksina syklien 1 ja 2 päivinä 1, 2, 8, 9, 15, 16, 22 ja 23 sekä sykleissä 3–4 annoksina 40 mg päivinä 1–2 ja annoksina 20 mg seuraavina hoitopäivinä (päivät 8, 9, 15, 16). Deksametasonia annettiin 20 mg:n annoksina syklien 5 ja 6 päivinä 1, 2, 8, 9, 15, 16. Darzalex-infuusion antopäivinä deksametasoniannos annettiin laskimoon infuusion esilääkityksenä. Bortetsomibin, talidomidin ja deksametasonin annosmuutokset tehtiin valmistajan valmistetietojen mukaisesti.
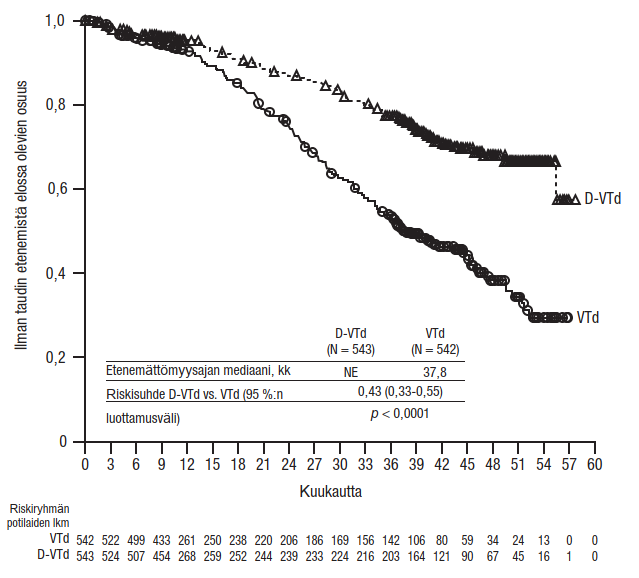
Yhteensä 1 085 potilasta satunnaistettiin: 543 potilasta satunnaistettiin D-VTd-ryhmään, ja 542 potilasta satunnaistettiin VTd-ryhmään. Lähtötilanteen demografiset ja taudin ominaisuudet olivat näissä kahdessa hoitoryhmässä samankaltaiset. Potilaiden iän mediaani oli 58 vuotta (vaihteluväli: 22–65 vuotta). Kaikki potilaat olivat ≤ 65-vuotiaita: 43 % kuului ikäryhmään ≥ 60–65 vuotta, 41 % kuului ikäryhmään ≥ 50–60 vuotta ja 16 % oli alle 50-vuotiaita. Suurin osa potilaista oli miehiä (59 %). ECOG-toimintakykyluokka oli 48 %:lla potilaista 0, 42 %:lla potilaista 1 ja 10 %:lla potilaista 2. International Staging System (ISS) -levinneisyysluokkaan I kuului 40 %, ISS-levinneisyysluokkaan II 45 % ja ISS-levinneisyysluokkaan III 15 % potilaista.
Tehon arviointi perustui täydellisen vasteen lisäehdoin (sCR) saaneiden potilaiden lukumäärään 100 päivää kantasolusiirron jälkeen sekä etenemättömyysaikaan.
| Taulukko 9: Tutkimuksen MMY3006 tehoa koskevat tulokseta | |||
| D-VTd (n = 543) | VTd (n = 542) | p-arvob | |
| Vasteen arviointi 100 päivää kantasolusiirron jälkeen | |||
| Täydellinen vaste lisäehdoin (sCR) | 157 (28,9 %) | 110 (20,3 %) | 0,0010 |
| Täydellinen vaste tai parempi (sCR+CR) | 211 (38,9 %) | 141 (26,0 %) | < 0,0001 |
| Erittäin hyvä osittainen vaste tai parempi (sCR+CR+VGPR) | 453 (83,4 %) | 423 (78,0 %) | |
| MRD-negatiivisuusc, d, n (%) | 346 (63,7 %) | 236 (43,5 %) | < 0,0001 |
| 95 %:n luottamusväli (%) | (59,5 %; 67,8 %) | (39,3 %; 47,8 %) | |
| Kerroinsuhde, 95 %:n luottamusvälie | 2,27 (1,78; 2,90) | ||
| MRD-negatiivisuus sekä täydellinen vaste tai parempic, n (%) | 183 (33,7 %) | 108 (19,9 %) | < 0,0001 |
| 95 %:n luottamusväli (%) | (29,7 %; 37,9 %) | (16,6 %; 23,5 %) | |
| Kerroinsuhde, 95 %:n luottamusvälie | 2,06 (1,56; 2,72) | ||
D-VTd = daratumumabi-bortetsomibi-talidomidi-deksametasoni; VTd = bortetsomibi-talidomidi-deksametasoni; MRD = minimaalinen jäännöstauti (minimal residual disease) a Perustuu hoitoaikeen mukaiseen potilasjoukkoon (intent-to-treat population). b Cochran-Mantel-Haenszelin khiin neliötestiin perustuva p-arvo. c Perustuu raja-arvoon 10-5. d IMWG-kriteerien mukaisesta vasteesta riippumatta. e Ositetuissa taulukoissa käytetään yleisten kerroinsuhteiden Mantel-Haenszelin estimaattia. | |||
Etenemättömyysajan ensisijainen analyysi tehtiin 18,8 kuukauden (mediaani) seurannan jälkeen sensuroimalla potilaat, jotka satunnaistettiin toisessa satunnaistamisessa daratumumabiylläpitohoitoon; tulokset toisen satunnaistamisen päivämääränä olivat: riskisuhde = 0,50; 95 %:n luottamusväli: 0,34; 0,75; p = 0,0005. Etenemättömyysajan päivitetty analyysi tehtiin 44,5 kuukauden (mediaani) seurannan jälkeen ja siinä sensuroitiin potilaat, jotka satunnaistettiin toisessa satunnaistamisessa daratumumabiylläpitohoitoon. Päivitetyn analyysin tulokset olivat: riskisuhde = 0,43; 95 %:n luottamusväli: 0,33; 0,55; p < 0,0001. Etenemättömyysajan mediaania ei saavutettu D-VTd-ryhmässä ja VTd-ryhmässä se oli 37,8 kuukautta.
Kuvio 5: Tutkimuksen MMY3006 etenemättömyysajan (PFS) Kaplan–Meier-käyrä
Relapsoitunut tai hoitoon reagoimaton multippeli myelooma
Monoterapia:
Darzalex‑monoterapian kliininen teho ja turvallisuus relapsoitunutta ja hoitoon reagoimatonta multippelia myeloomaa sairastaville aikuispotilaille, joiden aiempaan hoitoon kuului jokin proteasomin estäjä ja jokin immunomodulatiivinen aine ja joiden taudin osoitettiin edenneen viimeisimmän hoidon aikana, osoitettiin kahdessa avoimessa tutkimuksessa.
Tutkimuksessa MMY2002 oli mukana 106 relapsoitunutta ja hoitoon reagoimatonta multippelia myeloomaa sairastavaa potilasta, ja he saivat Darzalex-hoitoa annoksina 16 mg/kg, kunnes tauti eteni. Potilaiden iän mediaani oli 63,5 vuotta (vaihteluväli 31–84 vuotta), potilaista 11 % oli ≥ 75-vuotiaita, miehiä oli 49 % potilaista, ja valkoihoisia 79 %. Potilaat olivat saaneet viisi (mediaani) aiempaa hoitolinjaa. Kahdeksankymmentä prosenttia potilaista oli saanut aiemmin autologisen kantasolusiirron. Potilaat olivat saaneet aiempina hoitoina bortetsomibia (99 %), lenalidomidia (99 %), pomalidomidia (63 %) ja karfiltsomibia (50 %). Lähtötilanteessa 97 %:lla potilaista tauti ei reagoinut viimeisimpään hoitoon, 95 %:lla tauti ei reagoinut proteasomin estäjähoitoon eikä immunomodulatiiviseen lääkehoitoon, 77 %:lla tauti ei reagoinut alkyloiviin aineisiin, 63 %:lla tauti ei reagoinut pomalidomidiin ja 48 %:lla tauti ei reagoinut karfiltsomibiin.
Riippumattoman arviointikomitean (Independent Review Committee, IRC) arvioon perustuvan etukäteen suunnitellun välianalyysin tehoa koskevat tulokset esitetään jäljempänä taulukossa 10.
| Taulukko 10: Riippumattoman arviointikomitean arvio tutkimuksen MMY2002 tehoa koskevista tuloksista | |
| Tehon päätetapahtuma | Darzalex 16 mg/kg N = 106 |
| Kokonaisvasteluku1 (Overall response rate, ORR: sCR+CR+VGPR+PR) [n (%)] | 31 (29,2) |
| 95 %:n luottamusväli (%) | (20,8; 38,9) |
| Täydellinen vaste lisäehdoin (stringent complete response, sCR) [n (%)] | 3 (2,8) |
| Täydellinen vaste (complete response, CR) [n] | 0 |
| Erittäin hyvä osittainen vaste (very good partial response, VGPR) [n (%)] | 10 (9,4) |
| Osittainen vaste (partial response, PR) [n (%)] | 18 (17,0) |
| Kliinistä hyötyä osoittava luku (ORR+MR) [n (%)] | 36 (34,0) |
| Vasteen keston mediaani [kuukautta (95 %:n luottamusväli)] | 7,4 (5,5; NE) |
| Ajan mediaani vasteeseen [kuukautta (vaihteluväli)] | 1 (0,9; 5,6) |
1 Ensisijainen tehon päätetapahtuma (International Myeloma Working Groupin kriteerit) NE = ei arvioitavissa (not estimable); MR = vähäinen vaste (minimal response) | |
Tutkimuksen MMY2002 kokonaisvasteluku (ORR) oli samankaltainen myelooman aiemmasta hoidosta riippumatta.
14,7 kuukauden (mediaani) seurannan jälkeen tehdyssä elossaolon päivityksessä kokonaiselossaolon mediaani oli 17,5 kuukautta (95 %:n luottamusväli; 13,7; ei arvioitavissa).
Tutkimuksessa GEN501 oli mukana 42 relapsoitunutta ja hoitoon reagoimatonta multippelia myeloomaa sairastavaa potilasta, jotka saivat Darzalex-hoitoa annoksina 16 mg/kg, kunnes tauti eteni. Potilaiden iän mediaani oli 64 vuotta (vaihteluväli 44–76 vuotta), miehiä oli 64 % potilaista, ja valkoihoisia 76 %. Tutkimuksen potilaat olivat saaneet neljä (mediaani) aiempaa hoitolinjaa. Seitsemänkymmentäneljä prosenttia potilaista oli saanut aiemmin autologisen kantasolusiirron. Potilaat olivat saaneet aiempina hoitoina bortetsomibia (100 %), lenalidomidia (95 %), pomalidomidia (36 %) ja karfiltsomibia (19 %). Lähtötilanteessa 76 %:lla potilaista tauti ei reagoinut viimeisimpään hoitoon, 64 %:lla tauti ei reagoinut proteasomin estäjähoitoon eikä immunomodulatiiviseen lääkehoitoon, 60 %:lla tauti ei reagoinut alkyloiviin aineisiin, 36 %:lla tauti ei reagoinut pomalidomidiin ja 17 %:lla tauti ei reagoinut karfiltsomibiin.
Ennalta suunniteltu välianalyysi osoitti, että annoksina 16 mg/kg annetun daratumumabihoidon kokonaisvasteluku oli 36 % ja että täydellisen vasteen sai 5 % ja erittäin hyvän osittaisen vasteen sai 5 % potilaista. Ajan mediaani vasteen saamiseen oli 1 kuukausi (vaihteluväli: 0,5–3,2). Vasteen kestoajan mediaania ei saavutettu (95 %:n luottamusväli: 5,6 kuukautta; ei arvioitavissa).
15,2 kuukauden (mediaani) seurannan jälkeen tehdyssä elossaolon päivityksessä kokonaiselossaolon mediaania ei saavutettu (95 %:n luottamusväli: 19,9 kuukautta; ei arvioitavissa), ja 74 % tutkittavista oli edelleen elossa.
Yhdistelmähoito lenalidomidin kanssa
Tutkimus MMY3003 oli avoin, satunnaistettu, aktiivisella aineella kontrolloitu vaiheen III tutkimus, jossa Darzalex-hoitoa annoksina 16 mg/kg yhdistelmänä lenalidomidin ja matala-annoksisen deksametasonin kanssa (DRd) verrattiin hoitoon lenalidomidilla ja matala-annoksisella deksametasonilla (Rd) relapsoitunutta tai hoitoon reagoimatonta multippelia myeloomaa sairastavilla potilailla, jotka olivat saaneet vähintään yhtä aiempaa hoitoa. Lenalidomidi (25 mg kerran päivässä suun kautta 28 päivän [4 viikon] pituisten toistuvien syklien päivinä 1–21) annettiin yhdessä matala-annoksisen deksametasonin 40 mg/viikko (tai pienennetty annos 20 mg/viikko, jos potilas oli > 75-vuotias tai potilaan painoindeksi [BMI] oli < 18,5) kanssa. Darzalex-infuusion antopäivinä annettiin ennen infuusiota 20 mg:n deksametasoniannos ja loput annettiin infuusion jälkeisenä päivänä. Hoitoa jatkettiin kummassakin hoitoryhmässä, kunnes tauti eteni tai ilmaantui toksisuutta, joka ei ollut hyväksyttävissä.
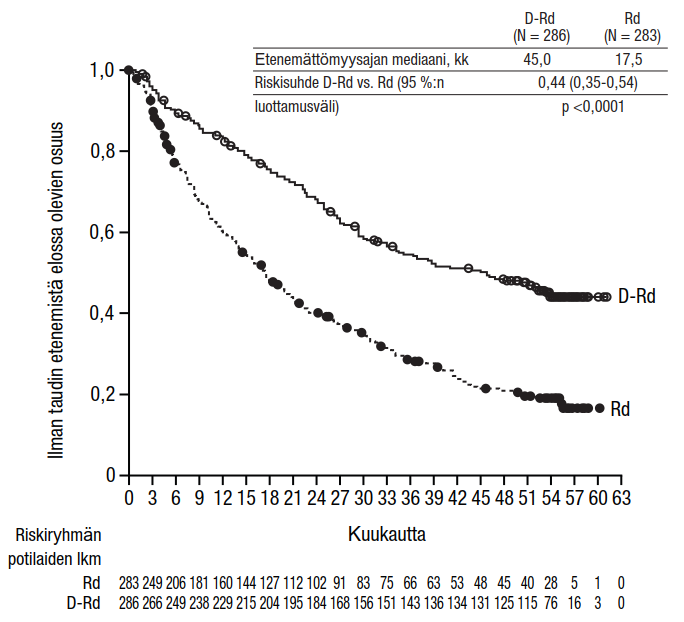
Yhteensä 569 potilasta satunnaistettiin; 286 satunnaistettiin DRd-ryhmään ja 283 satunnaistettiin Rd-ryhmään. Lähtötilanteen demografiset ja taudin ominaisuuksia koskevat tiedot olivat Darzalex-ryhmässä ja vertailuryhmässä samankaltaiset. Potilaiden iän mediaani oli 65 vuotta (vaihteluväli 34−89 vuotta), ja 11 % potilaista oli ≥ 75-vuotiaita. Suurin osa potilaista (86 %) oli saanut aiemmin jotakin proteasomin estäjää, 55 % potilaista oli saanut aiemmin jotakin immunomodulatiivista lääkehoitoa, ja näistä potilaista 18 % oli saanut aiemmin lenalidomidia, ja 44 % oli saanut aiemmin sekä jotakin proteasomin estäjää että immunomodulatiivista lääkehoitoa. Lähtötilanteessa 27 % potilaista ei ollut reagoinut viimeiseen hoitolinjaan. Kahdeksantoista prosenttia (18 %) potilaista ei ollut reagoinut pelkästään johonkin proteasomin estäjään, ja 21 % potilaista ei ollut reagoinut bortetsomibiin. Lenalidomidihoitoon reagoimattomia potilaita ei otettu tutkimukseen mukaan.
Tutkimuksessa MMY3003 etenemättömyysajan ensisijainen analyysi osoitti 13,5 kuukauden (mediaani) seurannan jälkeen etenemättömyysajan pidentyneen DRd-ryhmässä Rd-ryhmään verrattuna; etenemättömyysajan mediaania ei saavutettu DRd-ryhmässä, ja se oli Rd-ryhmässä 18,4 kuukautta (riskisuhde = 0,37; 95 %:n luottamusväli: 0,27; 0,52; p < 0,0001). Etenemättömyysajan päivitetyn analyysin tulokset osoittivat 55 kuukauden (mediaani) seurannan jälkeen edelleen, että etenemättömyysaika oli pidentynyt DRd-ryhmässä verrattuna Rd-ryhmään. Etenemättömyysajan mediaani oli DRd-ryhmässä 45,0 kuukautta ja Rd-ryhmässä 17,5 kuukautta (riskisuhde = 0,44; 95 %:n luottamusväli: 0,35; 0,54; p < 0,0001), mikä tarkoittaa, että DRd-hoitoa saaneiden potilaiden taudin etenemisen tai kuoleman riski väheni 56 % (ks. kuvio 6).
Kuvio 6: Tutkimuksen MMY3003 etenemättömyysajan (PFS) Kaplan–Meier-käyrä
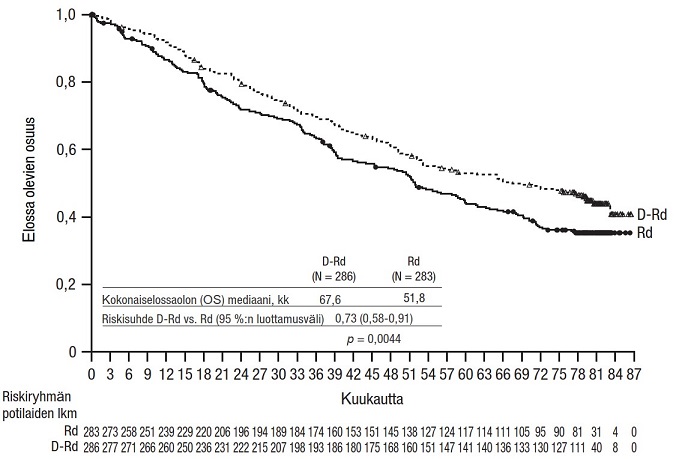
80 kuukauden (mediaani) seurannan jälkeen DRd-ryhmässä todettiin pidempi kokonaiselossaolo kuin Rd-ryhmässä (riskisuhde = 0,73; 95 %:n luottamusväli: 0,58; 0,91; p = 0,0044). Kokonaiselossaolon mediaani oli DRd-ryhmässä 67,6 kuukautta ja Rd-ryhmässä 51,8 kuukautta.
Kuvio 7: Tutkimuksen MMY3003 kokonaiselossaolon Kaplan–Meier-käyrä
Tutkimuksen MMY3003 muut tehoa koskevat tulokset esitetään jäljempänä taulukossa 11.
| Taulukko 11: Tutkimuksen MMY3003 muut tehoa koskevat tulokset | ||
| Arvioitavissa olleiden potilaiden lukumäärä | DRd (n = 281) | Rd (n = 276) |
| Kokonaisvaste (sCR+CR+VGPR+PR) n(%) | 261 (92,9) | 211 (76,4) |
| p-arvoa | < 0,0001 | |
| Täydellinen vaste lisäehdoin (sCR) | 51 (18,1) | 20 (7,2) |
| Täydellinen vaste (CR) | 70 (24,9) | 33 (12,0) |
| Erittäin hyvä osittainen vaste (VGPR) | 92 (32,7) | 69 (25,0) |
| Osittainen vaste (PR) | 48 (17,1) | 89 (32,2) |
| Ajan mediaani vasteeseen [kuukautta (95 %:n luottamusväli)] | 1,0 (1,0; 1,1) | 1,3 (1,1; 1,9) |
| Vasteen keston mediaani [kuukautta (95 %:n luottamusväli))] | NE (NE; NE) | 17,4 (17,4; NE) |
| MRD-negatiivisten lukumäärä (95 %:n luottamusväli) b (%) | 21,0 (16,4; 26,2) | 2,8 (1,2; 5,5) |
| Kerroinsuhde, 95 %:n luottamusvälic | 9,31 (4,31; 20,09) | |
| P-arvod | < 0,0001 | |
DRd = daratumumabi-lenalidomidi-deksametasoni; Rd = lenalidomidi-deksametasoni; MRD = minimaalinen jäännöstauti (minimal residual disease); NE = ei arvioitavissa (not estimable). a Cochran Mantel-Haenszelin khiin neliötestin p-arvo. b Perustuu hoitoaikeen mukaiseen potilasjoukkoon (intent-to-treat population) ja raja-arvoon 10-5. c Yleisen kerroinsuhteen Mantel-Haenszelin estimaatin mukaan. Kerroinsuhde > 1 viittaa etuun DRd-hoidon suhteen. d p-arvo perustuu Fisherin eksaktiin testiin. | ||
Yhdistelmähoito bortetsomibin kanssa
Tutkimus MMY3004 oli avoin, satunnaistettu, aktiivisella aineella kontrolloitu vaiheen III tutkimus, jossa Darzalex-hoitoa annoksina 16 mg/kg yhdistelmänä bortetsomibin ja deksametasonin kanssa (DVd) verrattiin bortetsomibin ja deksametasonin yhdistelmään (Vd) relapsoitunutta tai hoitoon reagoimatonta multippelia myeloomaa sairastavilla potilailla, jotka olivat saaneet vähintään yhtä aiempaa hoitoa. Bortetsomibi annettiin injektiona ihon alle tai injektiona laskimoon kehon pinta-alaan perustuvina annoksina 1,3 mg/m2 kaksi kertaa viikossa kahden viikon ajan 21 päivän (kolmen viikon) pituisten toistuvien hoitosyklien (päivinä 1, 4, 8 ja 11) ajan yhteensä 8 hoitosykliä. Deksametasoni annettiin suun kautta annoksina 20 mg kunkin kahdeksan bortetsomibihoitosyklin (80 mg/viikko kahdessa kolmesta bortetsomibihoitosyklistä) päivinä 1, 2, 4, 5, 8, 9, 11 ja 12 tai pienennettyinä annoksina 20 mg/viikko, jos potilas oli > 75-vuotias tai potilaan painoindeksi (BMI) oli < 18,5, potilaalla oli huonossa hoitotasapainossa oleva diabetes mellitus tai potilas ei ollut aiemmin sietänyt steroidihoitoa. Darzalex-infuusion antopäivinä annettiin ennen infuusiota 20 mg:n annos deksametasonia. Darzalex-hoitoa jatkettiin, kunnes tauti eteni tai ilmaantui toksisuutta, joka ei ollut hyväksyttävissä.
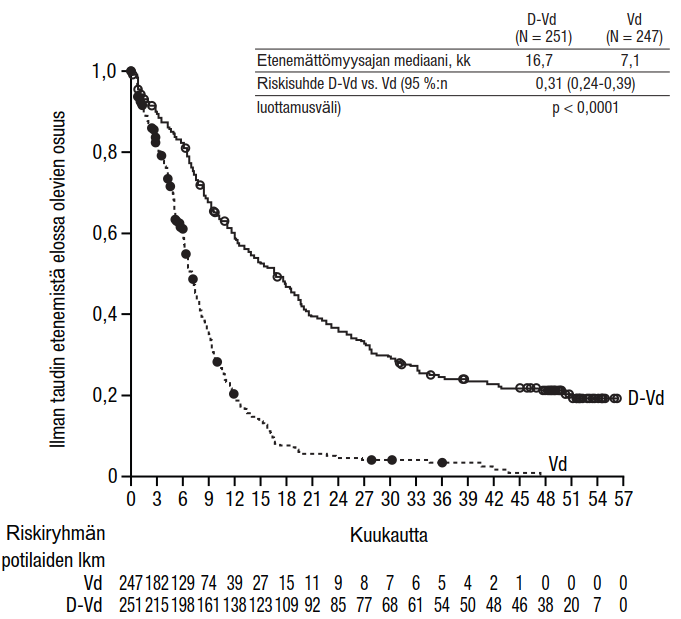
Yhteensä 498 potilasta satunnaistettiin; 251 satunnaistettiin DVd-ryhmään, ja 247 satunnaistettiin Vd-ryhmään. Lähtötilanteen demografiset ja taudin ominaisuuksia koskevat tiedot olivat Darzalex-ryhmässä ja vertailuryhmässä samankaltaiset. Potilaiden iän mediaani oli 64 vuotta (vaihteluväli 30−88 vuotta), ja 12 % oli ≥ 75-vuotiaita. Kuusikymmentäyhdeksän prosenttia (69 %) potilaista oli aiemmin saanut jotakin proteasomin estäjää (66 % oli saanut bortetsomibia) ja 76 % potilaista oli saanut jotakin immunomodulatiivista lääkehoitoa (42 % oli saanut lenalidomidia). Lähtötilanteessa 32 % potilaista ei ollut reagoinut viimeiseen hoitolinjaan. Kolmekymmentäkolme prosenttia (33 %) potilaista ei ollut reagoinut immunomodulatiiviseen lääkehoitoon, ja 28 % ei ollut reagoinut lenalidomidiin. Bortetsomibihoitoon reagoimattomia potilaita ei otettu tutkimukseen mukaan.
Tutkimuksessa MMY3004 etenemättömyysajan ensisijainen analyysi osoitti 7,4 kuukauden (mediaani) seurannan jälkeen etenemättömyysajan pidentyneen DVd-ryhmässä Vd-ryhmään verrattuna; etenemättömyysajan mediaania ei saavutettu DVd-ryhmässä, ja se oli Vd-ryhmässä 7,2 kuukautta (riskisuhde [95 %:n luottamusväli]: 0,39 [0,28; 0,53]; p-arvo < 0,0001). Etenemättömyysajan päivitetyn analyysin tulokset osoittivat 50 kuukauden (mediaani) seurannan jälkeen edelleen, että etenemättömyysaika oli pidentynyt DVd-ryhmässä verrattuna Vd-ryhmään. Etenemättömyysajan mediaani oli DVd-ryhmässä 16,7 kuukautta ja Vd-ryhmässä 7,1 kuukautta (riskisuhde [95 %:n luottamusväli]: 0,31 [0,24; 0,39]; p-arvo < 0,0001), mikä tarkoittaa, että DVd-hoitoa saaneiden potilaiden taudin etenemisen tai kuoleman riski väheni 69 % Vd-hoitoon verrattuna (ks. kuvio 8).
Kuvio 8: Tutkimuksen MMY3004 etenemättömyysajan (PFS) Kaplan–Meier-käyrä
73 kuukauden (mediaani) seurannan jälkeen DVd-ryhmässä todettiin pidempi kokonaiselossaolo kuin Vd-ryhmässä (riskisuhde = 0,74; 95 %:n luottamusväli: 0,59; 0,92; p = 0,0075). Kokonaiselossaolon mediaani oli DVd-ryhmässä 49,6 kuukautta ja Vd-ryhmässä 38,5 kuukautta.
Kuvio 9: Tutkimuksen MMY3004 kokonaiselossaolon Kaplan–Meier-käyrä
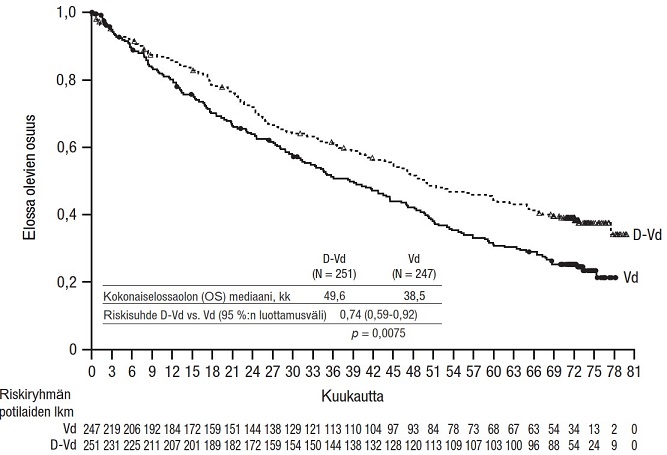
Tutkimuksen MMY3004 muut tehoa koskevat tulokset esitetään jäljempänä taulukossa 12.
| Taulukko 12: Tutkimuksen MMY3004 muut tehoa koskevat tulokset | ||
| Arvioitavissa olleiden potilaiden lukumäärä | DVd (n = 240) | Vd (n = 234) |
| Kokonaisvaste (sCR+CR+VGPR+PR) n(%) | 199 (82,9) | 148 (63,2) |
| P-arvoa | < 0,0001 | |
| Täydellinen vaste lisäehdoin (sCR) | 11 (4,6) | 5 (2,1) |
| Täydellinen vaste (CR) | 35 (14,6) | 16 (6,8) |
| Erittäin hyvä osittainen vaste (VGPR) | 96 (40,0) | 47 (20,1) |
| Osittainen vaste (PR) | 57 (23,8) | 80 (34,2) |
| Ajan mediaani vasteeseen [kuukautta (vaihteluväli)] | 0,9 (0,8; 1,4) | 1,6 (1,5; 2,1) |
| Vasteen keston mediaani [kuukautta (95 %:n luottamusväli)] | NE (11,5; NE) | 7,9 (6,7; 11,3) |
| MRD-negatiivisten lukumäärä (95 %:n luottamusväli)b | 8,8 % (5,6 %; 13,0 %) | 1,2 % (0,3 %; 3,5 %) |
| Kerroinsuhde, 95 %:n luottamusvälic | 9,04 (2,53; 32,21) | |
| P-arvod | 0,0001 | |
DVd = daratumumabi-bortetsomibi-deksametasoni; Vd = bortetsomibi-deksametasoni; MRD = minimaalinen jäännöstauti (minimal residual disease); NE = ei arvioitavissa (not estimable). a Cochran Mantel-Haenszelin khiin neliötestin p-arvo. b Perustuu hoitoaikeen mukaiseen potilasjoukkoon (intent-to-treat population) ja raja-arvoon 10-5. c Yleisen kerroinsuhteen Mantel–Haenszelin estimaatin mukaan. Kerroinsuhde > 1 viittaa etuun DVd-hoidon suhteen. d p-arvo perustuu Fisherin eksaktiin testiin. | ||
Sydämen elektrofysiologia
Daratumumabi on suurikokoinen proteiini, joten yhteisvaikutukset suoran ionikanavan kanssa ovat epätodennäköisiä. Avoimessa tutkimuksessa (GEN501), jossa oli mukana 83 relapsoitunutta ja hoitoon reagoimatonta multippelia myeloomaa sairastavaa potilasta, tutkittiin daratumumabin vaikutusta QTc-aikaan daratumumabi-infuusioiden (4–24 mg/kg) jälkeen. Lineaariset farmakokineettiset ja farmakodynaamiset seka-analyysit eivät osoittaneet daratumumabin huippupitoisuuksilla (Cmax) keskimääräisen QTcF-ajan merkittävää pidentymistä (eli yli 20 ms).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Darzalex-valmisteen käytöstä multippelin myelooman hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Daratumumabin farmakokinetiikkaa tutkittiin laskimoon annoksina 0,1–24 mg/kg annetun daratumumabimonoterapian jälkeen potilailla, jotka sairastivat relapsoitunutta tai hoitoon reagoimatonta multippelia myeloomaa.
Seerumin huippupitoisuus (Cmax) suureni annoksia 1–24 mg/kg saaneissa kohorteissa ensimmäisen annoksen jälkeen lähes suhteessa annokseen, ja jakautumistilavuus oli yhdenmukainen alkuvaiheen plasmatilaan jakautumisen kanssa. Cmax suureni viimeisen viikoittaisen infuusion jälkeen enemmän kuin suhteessa annokseen, mikä on yhdenmukaista lääkkeen kohdevälitteisen jakautumisen (target mediated drug disposition, TMDD) kanssa. AUC suureni enemmän kuin suhteessa annokseen, ja puhdistuma väheni, kun annosta suurennettiin. Nämä havainnot viittaavat siihen, että CD38 saattaa saturoitua suuremmilla annoksilla, minkä jälkeen kohteeseen sitoutuneen aineen puhdistuman vaikutus minimoituu ja daratumumabin puhdistuma on suunnilleen sama kuin endogeenisen IgG1:n lineaarinen puhdistuma. Puhdistuma vähenee myös toistuvien annosten yhteydessä, mikä saattaa liittyä kasvaintaakan vähenemiseen.
Terminaalinen puoliintumisaika pitenee, kun annoksia suurennetaan ja annetaan toistuvasti. Daratumumabin keskimääräinen (keskihajonta) arvioitu terminaalinen puoliintumisaika oli ensimmäisen annoksen 16 mg/kg jälkeen 9 (4,3) vuorokautta. Daratumumabin arvioitu terminaalinen puoliintumisaika viimeisen daratumumabiannoksen 16 mg/kg jälkeen piteni, mutta luotettavan arvion tekemiseksi ei ole riittävästi tietoa. Epäspesifiseen lineaariseen eliminaatioon liittyvä keskimääräinen (keskihajonta) puoliintumisaika oli populaatiofarmakokineettisen analyysin perusteella noin 18 (9) vuorokautta. Terminaalisen puoliintumisajan voidaan siten olettaa olevan tämänpituinen lääkkeen kohdevälitteisen puhdistuman saturoituessa täydellisesti samoin kuin annettaessa daratumumabia toistuvasti.
Monoterapian suositellulla hoitoaikataululla annoksina 16 mg/kg viikoittain annetun hoidon päättyessä seerumin keskimääräinen (keskihajonta) Cmax-arvo oli 915 (410,3) mikrogrammaa/ml, mikä on noin 2,9-kertainen ensimmäisen infuusion jälkeiseen arvoon verrattuna. Keskimääräinen (keskihajonta) pitoisuus seerumissa ennen annoksen antamista (pienin pitoisuus) oli viikoittain annetun hoidon päättyessä 573 (331,5) mikrogrammaa/ml.
Daratumumabin farmakokineettisten ominaisuuksien kuvaamiseksi ja daratumumabin jakautumiseen liittyvien kovariaattien vaikutuksen arvioimiseksi multippelia myeloomaa sairastavilla potilailla tehtiin neljä populaatiofarmakokineettistä analyysiä: analyysi 1 (n = 223) tehtiin Darzalex-monoterapiaa saavista potilaista, kun taas analyysi 2 (n = 694), analyysi 3 (n = 352) ja analyysi 4 (n = 355) tehtiin multippelia myeloomaa sairastavista potilaista, jotka saivat daratumumabia sisältäviä yhdistelmähoitoja. Analyysissa 2 oli mukana 694 potilaan tiedot (n = 326 lenalidomidin ja deksametasonin yhdistelmä, n = 246 bortetsomibin ja deksametasonin yhdistelmä, n = 99 pomalidomidin ja deksametasonin yhdistelmä, n = 11 bortetsomibin, melfalaanin ja prednisonin yhdistelmä ja n = 12 bortetsomibin, talidomidin ja deksametasonin yhdistelmä), analyysissa 3 oli mukana 352 potilaan tiedot (bortetsomibin, melfalaanin ja prednisonin yhdistelmä), ja analyysissa 4 oli mukana 355 potilaan tiedot (lenalidomidin ja deksametasonin yhdistelmä).
Daratumumabin vakaa tila saavutetaan daratumumabimonoterapian populaatiofarmakokineettisen analyysin (analyysi 1) perusteella neljän viikon hoitojaksojen yhteydessä noin 5 kuukaudessa (21. infuusioon mennessä). Vakaan tilan Cmax-arvon ja ensimmäisen annoksen jälkeisen Cmax-arvon keskimääräinen (keskihajonta) suhde oli 1,6 (0,5). Keskustilan keskimääräinen (keskihajonta) jakautumistilavuus on 56,98 (18,07) ml/kg.
Multippelia myeloomaa sairastavista potilaista, jotka saivat daratumumabia yhdistelmähoitoina, tehtiin kolme populaatiofarmakokineettistä lisäanalyysia (analyysi 2, analyysi 3 ja analyysi 4). Daratumumabin pitoisuus-aikakäyrät olivat monoterapiassa ja yhdistelmähoidoissa samankaltaiset. Yhdistelmähoidossa lineaariseen puhdistumaan liittyvä keskimääräinen arvioitu terminaalinen puoliintumisaika oli noin 15–23 vuorokautta.
Kehon paino todettiin näiden neljän populaatiofarmakokineettisen analyysin (analyysit 1–4) perusteella daratumumabin puhdistuman tilastollisesti merkitseväksi kovariaatiksi. Sen vuoksi multippelia myeloomaa sairastaville potilaille sopiva annos perustuu painoon.
Daratumumabin farmakokinetiikka mallinnettiin kaikilla suositelluilla annostuksilla 1 309 multippelia myeloomaa sairastavalla potilaalla. Simulaation tulokset vahvistivat, että kerta-annosten ja jaettujen annosten farmakokinetiikka on samankaltainen, ensimmäisen hoitopäivän farmakokineettistä profiilia lukuun ottamatta.
Erityiset potilasryhmät
Ikä ja sukupuoli
Iällä (vaihteluväli: 31–93 vuotta) ei daratumumabimonoterapiaa tai erilaisia yhdistelmähoitoja (analyysit 1–4) saaneiden potilaiden neljän eri populaatiofarmakokineettisen analyysin (analyysit 1–4) perusteella ollut kliinisesti merkittävää vaikutusta daratumumabin farmakokinetiikkaan. Daratumumabialtistus oli samankaltainen nuoremmilla (ikä < 65 vuotta, n = 518) ja vanhemmilla (ikä ≥ 65 – < 75 vuotta, n = 761; ikä ≥ 75 vuotta, n = 334) potilailla.
Sukupuoli ei vaikuttanut populaatiofarmakokineettisissä analyyseissä kliinisesti merkittävästi daratumumabialtistukseen.
Munuaisten vajaatoiminta
Daratumumabin käyttöä munuaisten vajaatoimintaa sairastaville potilaille ei ole tutkittu varsinaisissa tutkimuksissa. Neljä populaatiofarmakokineettistä analyysiä perustui etukäteen saatavissa olleisiin tietoihin daratumumabimonoterapiahoitoa tai erilaisia yhdistelmähoitoja (analyysit 1–4) saavien potilaiden munuaisten toiminnasta. Analyyseissä oli mukana tiedot yhteensä 441 potilaasta, joiden munuaisten toiminta oli normaali (kreatiniinipuhdistuma [CRCL] ≥ 90 ml/min), 621 potilaasta, joilla oli lievää munuaisten vajaatoimintaa (CRCL < 90, mutta ≥ 60 ml/min), 523 potilaasta, joilla oli keskivaikeaa munuaisten vajaatoimintaa (CRCL < 60, mutta ≥ 30 ml/min), ja 27 potilaasta, joilla oli vaikeaa munuaisten vajaatoimintaa tai loppuvaiheen munuaissairaus (CRCL < 30 ml/min). Daratumumabialtistuksessa ei havaittu kliinisesti merkittäviä eroja sen mukaan, sairastiko potilas munuaisten vajaatoimintaa vai oliko potilaan munuaisten toiminta normaali.
Maksan vajaatoiminta
Daratumumabin käyttöä maksan vajaatoimintaa sairastaville potilaille ei ole tutkittu varsinaisissa tutkimuksissa. Maksan toiminnan muutokset eivät todennäköisesti vaikuta daratumumabin eliminaatioon, koska IgG1-molekyylit, kuten daratumumabi, eivät metaboloidu maksareittien kautta.
Daratumumabimonoterapiaa tai erilaisia yhdistelmähoitoja saaneista potilaista tehtiin neljä erillistä populaatiofarmakokineettistä analyysia (analyysit 1–4). Analyyseissa oli mukana tiedot yhteensä 1 404 potilaasta, joiden maksan toiminta oli normaali (kokonaisbilirubiinipitoisuus ja aspartaattiaminotransferaasipitoisuus [ASAT] ≤ normaalin ylärajan [upper limit of normal, ULN]), 189 potilaasta, joilla oli lievää maksan vajaatoimintaa (kokonaisbilirubiinipitoisuus 1,0x – 1,5x ULN tai ASAT > ULN), ja 8 potilaasta, joilla oli keskivaikeaa (kokonaisbilirubiinipitoisuus > 1,5x – 3,0x ULN; n = 7) tai vaikeaa (kokonaisbilirubiinipitoisuus > 3,0x ULN; n = 1) maksan vajaatoimintaa. Niiden potilaiden välillä, joilla oli maksan vajaatoimintaa tai joiden maksan toiminta oli normaali, ei havaittu daratumabialtistuksessa kliinisesti merkittäviä eroja.
Rotu
Daratumumabimonoterapiaa tai erilaisia yhdistelmähoitoja saaneista potilaista tehtyjen neljän erillisen populaatiofarmakokineettisen analyysin (analyysit 1–4) perusteella altistus daratumumabille oli samankaltainen valkoihoisilla (n = 1 371) ja muilla kuin valkoihoisilla (n = 242) tutkittavilla.
Prekliiniset tiedot turvallisuudesta
Toksikologiset tiedot on saatu simpansseilla tehdyistä daratumumabitutkimuksista sekä cynomolgus-apinoiden korvaavasta anti-CD38-vasta-aineesta. Kroonista toksisuutta ei ole tutkittu.
Karsinogeenisuus ja mutageenisuus
Daratumumabin mahdollista karsinogeenisuutta ei ole selvitetty eläinkokeissa.
Lisääntymistoksikologia
Daratumumabin mahdollisia vaikutuksia lisääntymiseen ja kehitykseen ei ole tutkittu eläinkokeissa.
Hedelmällisyys
Mahdollisia vaikutuksia urosten ja naaraiden hedelmällisyyteen ei ole tutkittu eläinkokeissa.
Farmaseuttiset tiedot
Apuaineet
L‑histidiini
L‑histidiinihydrokloridimonohydraatti
L‑metioniini
Polysorbaatti 20 (E432)
Sorbitoli (E420)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Laimentamisen jälkeen
Valmiste pitää mikrobiologiselta kannalta käyttää heti, paitsi jos injektiopullo on avattu / valmiste on laimennettu sellaisella menetelmällä, joka sulkee pois mikrobikontaminaation riskin. Jos valmistetta ei käytetä heti, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saisi ylittää 24 tuntia jääkaapissa (2 °C – 8 °C) valolta suojattuna ja sen jälkeen 15 tuntia (infuusion kesto mukaan lukien) huoneenlämmössä (15 °C – 25 °C) ja huonevalaistuksessa. Anna jääkaapissa säilytetyn liuoksen lämmetä vallitsevaan lämpötilaan ennen antoa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DARZALEX infuusiokonsentraatti, liuosta varten
20 mg/ml (L:ei) 5 ml (100 mg/5 ml) (640,39 €), 20 ml (400 mg/20 ml) (2390,72 €)
PF-selosteen tieto
5 ml konsentraattia tyypin I lasisessa injektiopullossa, jossa elastomeerisuljin ja alumiinisinetti sekä irtinapsautettava suojalevy ja joka sisältää 100 mg daratumumabia. Pakkauskoko 1 injektiopullo.
20 ml konsentraattia tyypin I lasisessa injektiopullossa, jossa elastomeerisuljin ja alumiinisinetti sekä irtinapsautettava suojalevy ja joka sisältää 400 mg daratumumabia. Pakkauskoko 1 injektiopullo.
DARZALEX-valmistetta on saatavana myös 11 injektiopullon (6 x 5 ml:n injektiopulloa + 5 x 20 ml:n injektiopulloa) aloituspakkauksina.
Valmisteen kuvaus:
Liuos on väritön tai keltainen, sen pH on 5,5 ja osmolaalisuus on 310–370 mOsm/kg.
Käyttö- ja käsittelyohjeet
Tämä lääkevalmiste on yhtä käyttökertaa varten.
Valmista infuusioliuos aseptista tekniikkaa noudattaen seuraavasti:
- Laske annos (mg), tarvittava Darzalex-liuoksen kokonaistilavuus (ml) ja tarvittava Darzalex-injektiopullojen lukumäärä potilaan painon perusteella.
- Tarkista, että Darzalex-liuos on väritöntä tai keltaista. Älä käytä liuosta, jos siinä on havaittavissa läpinäkymättömiä hiukkasia, värimuutoksia tai muita vierashiukkasia.
- Ota aseptista tekniikkaa noudattaen infuusiopussista/pakkauksesta 9 mg/ml (0,9 %) natriumkloridi-injektionestettä tilavuus, joka vastaa tarvittavaa Darzalex-liuoksen tilavuutta.
- Vedä tarvittava määrä Darzalex-liuosta ja laimenna sopivaan tilavuuteen lisäämällä se 9 mg/ml (0,9 %) natriumkloridi-injektionestettä sisältävään infuusiopussiin/pakkaukseen (ks. kohta Annostus ja antotapa). Infuusiopussien/pakkausten pitää olla valmistettu polyvinyylikloridista (PVC), polypropeenista (PP), polyeteenistä (PE) tai polyolefiiniseoksesta (PP+PE). Laimenna aseptisesti. Hävitä injektiopulloon käyttämättä jäävä lääke.
- Sekoita liuos kääntelemällä pussia/pakkausta varovasti. Ei saa ravistaa.
- Tarkista parenteraalisesti annettavat lääkevalmisteet silmämääräisesti ennen antoa, ettei niissä ole havaittavissa hiukkasia eikä värimuutoksia. Laimennettuun liuokseen saattaa muodostua hyvin pieniä, läpikuultavia tai valkoisia proteiinipitoisia hiukkasia, sillä daratumumabi on proteiini. Älä käytä liuosta, jos siinä näkyy läpinäkymättömiä hiukkasia, värimuutoksia tai muita vierashiukkasia.
- Darzalex ei sisällä säilytysainetta, joten laimennettu liuos pitää käyttää 15 tunnin kuluessa (infuusion kesto mukaan lukien) huoneenlämmössä (15 °C – 25 °C) ja huonevalaistuksessa.
- Jos laimennettua liuosta ei käytetä heti, sitä voidaan säilyttää ennen antoa enintään 24 tuntia jääkaapissa (2 °C – 8 °C) valolta suojattuna. Ei saa jäätyä. Anna jääkaapissa säilytetyn liuoksen lämmetä vallitsevaan lämpötilaan ennen antoa.
- Anna laimennettu liuos infuusiona laskimoon käyttämällä infuusionantolaitetta, jossa on virtauksensäädin ja letkun sisällä steriili, pyrogeeniton, niukasti proteiineja sitova polyeetterisulfonisuodatin (PES) (huokoskoko 0,22 tai 0,2 mikrometriä). Käytettävän antolaitteen pitää olla valmistettu polyuretaanista (PU), polybutadieenista (PBD), PVC:stä, PP:stä tai PE:stä.
- Älä infusoi Darzalex‑valmisteen kanssa saman letkun kautta muita aineita laskimoon.
- Älä säilytä käyttämättä jäävää infuusioliuosta myöhempää käyttöä varten. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DARZALEX infuusiokonsentraatti, liuosta varten
20 mg/ml 5 ml, 20 ml
- Ei korvausta.
ATC-koodi
L01FC01
Valmisteyhteenvedon muuttamispäivämäärä
18.09.2025
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
