EMPLICITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 300 mg, 400 mg
Vaikuttavat aineet ja niiden määrät
Empliciti 300 mg kuiva‑aine välikonsentraatiksi infuusionestettä varten, liuos
Yksi kuiva-ainetta sisältävä injektiopullo sisältää 300 mg elotutsumabia*.
Empliciti 400 mg kuiva‑aine välikonsentraatiksi infuusionestettä varten, liuos
Yksi kuiva-ainetta sisältävä injektiopullo sisältää 400 mg elotutsumabia.
Käyttökuntoon saatetun liuoksen pitoisuus on 25 mg/ml elotutsumabia.
* Elotutsumabi on tuotettu NS0‑soluissa yhdistelmä‑DNA‑tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva‑aine välikonsentraatiksi infuusionestettä varten, liuos (kuiva‑aine välikonsentraattia varten)
Kliiniset tiedot
Käyttöaiheet
Empliciti on tarkoitettu yhdessä lenalidomidin ja deksametasonin kanssa multippelin myelooman hoitoon aikuisille potilaille, jotka ovat saaneet aikaisemmin vähintään yhtä hoitoa (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Empliciti on tarkoitettu yhdessä pomalidomidin ja deksametasonin kanssa uusiutuneen ja refraktaarisen multippelin myelooman hoitoon aikuisille potilaille, jotka ovat saaneet aikaisemmin vähintään kahta hoitoa, mukaan lukien lenalidomidi ja proteasomin estäjä, ja joilla sairaus eteni viimeisimmän hoidon aikana (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Ehto
Hoito tulee aloittaa ja sitä tulee seurata multippelin myelooman (MM) hoitoon perehtyneiden lääkäreiden valvonnassa.
Annostus ja antotapa
Elotutsumabi‑hoidon aloittaa ja sitä valvoo multippelin myelooman hoitoon perehtynyt lääkäri.
Esilääkitys infuusioon liittyvien reaktioiden (IRR) estämiseksi
Potilaille pitää annostella seuraava esilääkitys 45‑90 minuuttia ennen Empliciti‑infuusiota (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet):
- Deksametasonia 8 mg laskimoon.
- H1‑reseptorin salpaaja: difenhydramiinia (25‑50 mg suun kautta tai laskimoon) tai vastaavaa H1‑reseptorin salpaajaa.
- H2‑reseptorin salpaaja: ranitidiinia (50 mg laskimoon tai 150 mg suun kautta) tai vastaavaa H2‑reseptorin salpaajaa.
- Parasetamolia (650‑1 000 mg suun kautta).
Infuusioon liittyvien reaktioiden hoito
Jos Empliciti-valmisteen annostelun aikana ilmaantuu ≥ asteen 2 infuusioon liittyvä reaktio, infuusio pitää keskeyttää. Reaktion lieventyessä ≤ asteeseen 1 Empliciti on aloitettava uudelleen nopeudella 0,5 ml/min ja voidaan nostaa vähitellen nopeudella 0,5 ml/min 30 minuutin välein siedon mukaan siihen nopeuteen asti, missä infuusioon liittyvä reaktio ilmeni. Jos infuusioon liittyvä reaktio ei uusiudu, nostamista voidaan jatkaa (ks. taulukot 3 ja 4).
Infuusioon liittyvän reaktion saaneiden potilaiden elintoimintoja on tarkkailtava 30 minuutin välein 2 tunnin ajan Empliciti‑infuusion lopettamisen jälkeen. Jos infuusioon liittyvä reaktio uusiutuu, Empliciti‑infuusio pitää lopettaa, eikä sitä saa aloittaa uudelleen saman päivänä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Hyvin vakavat infuusioon liittyvät reaktiot (≥ aste 3) saattavat vaatia Empliciti‑hoidon lopettamista ja ensiapua.
Annostus yhdessä lenalidomidin ja deksametasonin kanssa
Jokaisen hoitosyklin kesto on 28 päivää. Katso annosaikataulu taulukosta 1.
Hoitoa tulee jatkaa, kunnes tauti etenee tai ilmaantuu ei‑hyväksyttävää toksisuutta.
Suositeltu Empliciti‑annos on 10 mg painokiloa (painokg) kohti laskimoon kerran viikossa päivinä 1, 8, 15 ja 22 kahden ensimmäisen hoitosyklin ajan ja tämän jälkeen joka toinen viikko päivinä 1 ja 15.
Suositeltu lenalidomidiannos on 25 mg suun kautta kerran päivässä päivinä 1‑21 toistuvien 28 päivän syklien aikana, Empliciti‑infuusiopäivinä vähintään 2 tunnin kuluttua infuusiosta.
Deksametasonin annostus:
- Empliciti-valmisteen antopäivinä deksametasonia pitää antaa 28 mg suun kautta kerran päivässä 3‑24 tuntia ennen Empliciti-valmisteen annostelua sekä 8 mg laskimoon 45–90 minuuttia ennen Empliciti-valmistetta 28 päivän mittaisten toistuvien syklien päivinä 1, 8, 15 ja 22.
- Niinä päivinä, jolloin Empliciti-valmistetta ei anneta, mutta deksametasoniannos on suunniteltu (päivät 8 ja 22 syklissä 3 ja kaikissa sitä seuraavissa sykleissä), deksametasonia pitää antaa 40 mg suun kautta.
Taulukko 1: Suositeltu annosaikataulu, Empliciti yhdessä lenalidomidin ja deksametasonin kanssa
Sykli | Syklit 1 & 2 (28 päivän sykli) | Syklit 3+ (28 päivän sykli) | ||||||
Syklin päivä | 1 | 8 | 15 | 22 | 1 | 8 | 15 | 22 |
Esilääkitys | √ | √ | √ | √ | √ | √ |
| |
Empliciti (mg/painokg) laskimoon | 10 | 10 | 10 | 10 | 10 | 10 | ||
Lenalidomidi (25 mg) suun kautta | päivät 1‑21 | päivät 1‑21 | ||||||
Deksametasoni (mg) suun kautta | 28 | 28 | 28 | 28 | 28 | 40 | 28 | 40 |
Syklin päivä | 1 | 8 | 15 | 22 | 1 | 8 | 15 | 22 |
Lisätietoa lenalidomidista ja deksametasonista, ks. kyseisen valmisteen valmisteyhteenveto.
Annostus yhdessä pomalidomidin ja deksametasonin kanssa
Jokaisen hoitosyklin kesto on 28 päivää. Katso annosaikataulu taulukosta 2.
Hoitoa pitää jatkaa, kunnes tauti etenee tai ilmaantuu ei‑hyväksyttävää toksisuutta.
Suositeltu Empliciti-annos on 10 mg/painokg laskimoon kerran viikossa päivinä 1, 8, 15 ja 22 kahden ensimmäisen hoitosyklin ajan ja tämän jälkeen 20 mg/painokg päivänä 1 joka syklissä tästä eteenpäin.
Suositeltu pomalidomidiannos on 4 mg suun kautta kerran päivässä päivinä 1–21 toistuvien 28 päivän syklien aikana, Empliciti‑infuusiopäivinä vähintään 2 tunnin kuluttua infuusiosta.
Deksametasonin annostus ≤ 75-vuotiaille ja > 75-vuotiaille aikuisille
- Empliciti-valmisteen antopäivinä ≤ 75‑vuotiaille potilaille annetaan deksametasonia 28 mg suun kautta 3–24 tuntia ennen Empliciti-valmistetta ja lisäksi 8 mg laskimoon 45–90 minuuttia ennen Empliciti-valmistetta ja > 75‑vuotiaille potilaille annetaan deksametasonia 8 mg suun kautta 3–24 tuntia ennen Empliciti-valmistetta ja lisäksi 8 mg laskimoon 45–90 minuuttia ennen Empliciti-valmistetta.
- Niinä päivinä, jolloin Empliciti-valmistetta ei anneta, mutta deksametasoniannos on suunniteltu (päivät 8, 15 ja 22 syklissä 3 ja kaikissa sitä seuraavissa sykleissä), deksametasonia annetaan ≤ 75‑vuotiaille potilaille 40 mg suun kautta ja > 75‑vuotiaille potilaille 20 mg suun kautta.
Taulukko 2: Suositeltu annosaikataulu, Empliciti yhdessä pomalidomidin ja deksametasonin kanssa
Sykli | Syklit 1 ja 2 (28 päivän sykli) | Syklit 3+ (28 päivän sykli) | ||||||
Syklin päivä | 1 | 8 | 15 | 22 | 1 | 8 | 15 | 22 |
Esilääkitys | √ | √ | √ | √ | √ |
|
|
|
Empliciti (mg/painokg) laskimoon | 10 | 10 | 10 | 10 | 20 |
|
|
|
Pomalidomidi (4 mg) suun kautta | päivät 1–21 | päivät 1–21 | ||||||
Deksametasoni (mg) laskimoon | 8 | 8 | 8 | 8 | 8 |
|
|
|
Deksametasoni (mg) suun kautta ≤ 75‑vuotiaille | 28 | 28 | 28 | 28 | 28 | 40 | 40 | 40 |
Deksametasoni (mg) suun kautta > 75‑vuotiaille | 8 | 8 | 8 | 8 | 8 | 20 | 20 | 20 |
Syklin päivä | 1 | 8 | 15 | 22 | 1 | 8 | 15 | 22 |
Lisätietoa pomalidomidista ja deksametasonista, ks. kyseisen valmisteen valmisteyhteenveto.
Ohjeet infuusionopeuksista, ks. Antotapa.
Annoksen viivästyminen, annostelun keskeyttäminen tai lopettaminen
Jos hoitoon kuuluvan yhden lääkkeen annos on viivästynyt, annostelu on keskeytetty tai lopetettu, hoito muilla lääkevalmisteilla voi jatkua aikataulun mukaan. Kuitenkin, jos suun kautta tai laskimoon annettavan deksametasonin annostelu on viivästynyt tai lopetettu, Empliciti-valmisteen annostelun itää perustua kliiniseen arvioon (mm. yliherkkyysriski) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityisryhmät
Iäkkäät
Empliciti‑annosta ei tarvitse muuttaa yli 65‑vuotiaille potilaille (ks. kohta Farmakokinetiikka). Empliciti-valmisteen turvallisuus‑ ja tehokkuustietoja on erittäin vähän ≥ 85‑vuotiaista potilaista. Pomalidomidin kanssa käytettävän deksametasonin annos säädetään potilaan iän mukaan. Ks. Deksametasonin annostus ≤ 75-vuotiaille ja > 75-vuotiaille aikuisille.
Munuaisten vajaatoiminta
Empliciti‑annosta ei tarvitse muuttaa potilaille, joilla on lievä (kreatiniinipuhdistuma = 60 ‑ 89 ml/min), kohtalainen (kreatiniinipuhdistuma = 30‑59 ml/min) tai vaikea‑asteinen (kreatiniinipuhdistuma < 30 ml/min) munuaisten vajaatoiminta tai dialyysihoitoa vaativa loppuvaiheen munuaissairaus (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Empliciti‑annosta ei tarvitse muuttaa potilaille, joilla on lievä maksan vajaatoiminta (kokonaisbilirubiini (TB) normaaliarvon (ULN) ylärajalla tai sitä matalampi ja aspartaattiaminotransferaasi (ASAT) korkeampi kuin ULN tai TB alle 1–1,5-kertainen ULN‑arvoon tai mihin tahansa ASAT‑arvoon verrattuna). Empliciti-valmisteen käyttöä ei ole tutkittu potilailla, joilla on kohtalainen (TB yli 1,5–3‑kertainen ULN‑arvoon tai mihin tahansa ASAT‑arvoon verrattuna) tai vaikea‑asteinen (TB yli 3‑kertainen ULN‑arvoon tai mihin tahansa ASAT‑arvoon verrattuna) maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Empliciti-valmisteen käyttö multippelin myelooman hoitoon pediatrisille potilaille ei ole aiheellista.
Antotapa
Empliciti on tarkoitettu vain laskimonsisäiseen käyttöön.
Empliciti‑valmisteen infuusionopeus annoksella 10 mg/painokg
Käyttökuntoon saatetun ja laimennetun liuoksen annostelu pitää aloittaa infuusionopeudella 0,5 ml/min. Jos infuusio on hyvin siedetty, infuusionopeutta voidaan nostaa asteittain taulukon 3 mukaisesti. Infuusionopeus ei saa ylittää 5 ml/min.
Taulukko 3: Empliciti‑valmisteen infuusionopeus annoksella 10 mg/painokg
Sykli 1, annos 1 | Sykli 1, annos 2 | Sykli 1, annokset 3 ja 4 ja kaikki sitä seuraavat syklit | ||
Aikaväli | Nopeus | Aikaväli | Nopeus | Nopeus |
0‑30 min | 0,5 ml/min | 0 ‑ 30 min | 3 ml/min | 5 ml/min* |
30‑60 min | 1 ml/min | ≥ 30 min | 4 ml/min* | |
≥ 60 min | 2 ml/min* | ‑ | ‑ | |
* Jatka tällä nopeudella, kunnes infuusio loppuu.
Empliciti‑valmisteen infuusionopeus annoksella 20 mg/painokg
Käyttökuntoon saatetun ja laimennetun liuoksen annostelu pitää aloittaa infuusionopeudella 3 ml/min. Jos infuusio on hyvin siedetty, infuusionopeutta voidaan nostaa asteittain taulukon 4 mukaisesti. Infuusionopeus ei saa ylittää 5 ml/min.
Jos potilaan 10 mg/painokg ‑annos on muutettu nopeuteen 5 ml/minuutissa, nopeus pitää hidastaa 3 ml:aan/minuutissa, kun annetaan ensimmäinen 20 mg/painokg ‑infuusio.
Taulukko 4: Empliciti‑valmisteen infuusionopeus annoksella 20 mg/painokg
Annos 1 | Annos 2 ja kaikki sitä seuraavat annokset | |
Aikaväli | Nopeus | Nopeus |
0–30 min | 3 ml/min | 5 ml/min* |
≥ 30 min | 4 ml/min* | |
* Jatka tällä nopeudella, kunnes infuusio loppuu.
Empliciti-valmisteen käyttökuntoon saattaminen ja laimennus ennen annostelua, ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Empliciti-valmisteen kanssa käytettävien lenalidomidin, pomalidomidin ja deksametasonin valmisteyhteenvetoihin on tutustuttava ennen hoidon aloittamista.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infuusioon liittyvät reaktiot
Elotutsumabia saavilla potilailla on raportoitu infuusioon liittyviä reaktioita (ks. kohta Haittavaikutukset).
Ennen Empliciti‑infuusiota (ks. kohta Annostus ja antotapa Esilääkitys) pitää antaa deksametasonista, H1‑reseptorin salpaajasta, H2‑reseptorin salpaajasta ja parasetamolista koostuva esilääkitys. Infuusioon liittyviä reaktioita oli merkittävästi enemmän potilailla, jotka eivät saaneet esilääkitystä.
Jos Empliciti-valmisteen annostelun aikana ilmaantuu ≥ asteen 2 infuusioon liittyvän reaktion oireita, nfuusio pitää keskeyttää ja aloittaa asianmukainen hoito. Potilaiden elintoimintoja on seurattava 30 minuutin välein 2 tunnin ajan Empliciti‑infuusion lopettamisen jälkeen. Reaktion lievennyttyä (oireet ≤ aste 1) Empliciti voidaan aloittaa uudestaan infuusion aloitusnopeudella 0,5 ml/min. Jos oireet eivät uusiudu, infuusionopeutta voidaan nostaa asteittain 30 minuutin välein enimmäisnopeuteen 5 ml/min (ks. kohta Annostus ja antotapa Antotapa).
Hyvin vakavat infuusioon liittyvät reaktiot saattavat vaatia Empliciti‑hoidon lopettamista ja pikaista hoitoa. Potilaille, joilla on lievä tai kohtalainen infuusioon liittyvä reaktio, voidaan antaa Empliciti-valmistetta hitaammalla infuusionopeudella ja tarkassa seurannassa ks. kohta Annostus ja antotapa Antotapa).
Empliciti-valmisteen kanssa yhdessä käytettäviin lääkevalmisteisiin liittyvät ehdot
Empliciti-valmistetta käytetään yhdessä muiden lääkevalmisteiden kanssa. Siksi näiden lääkevalmisteiden käyttöön liittyviä rajoituksia sovelletaan myös yhdistelmähoitoon. Jokaisen yhdessä Empliciti-valmisteen kanssa käytettävän lääkevalmisteen valmisteyhteenvetoon on tutustuttava ennen hoidon aloittamista.
Infektiot
Multippelia myeloomaa sairastavilla potilailla tehdyissä kliinisissä kokeissa infektioiden esiintyvyys, pneumonia mukaan lukien, oli suurempaa Empliciti‑hoitoa saavilla potilailla (ks. kohta Haittavaikutukset). Potilaita on seurattava ja infektiot hoidettava vakiokäytäntöjen mukaisesti.
Sekundaarimaligniteetit (SPM)
Multippelia myeloomaa sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa, jossa verrattiin Empliciti-valmisteen ja lenalidomidin sekä deksametasonin yhdistelmähoitoa lenalidomidin ja deksametasonin yhdistelmään (CA204004), sekundaarimaligniteetteja, etenkin kiinteitä tuumoreita ja muita ihosyöpiä kuin melanoomaa, esiintyi enemmän Empliciti-valmistetta saaneilla potilailla (ks. kohta Haittavaikutukset). Sekundaarimaligniteeteilla tiedetään olevan yhteys lenalidomidialtistukseen, jonka kesto oli pidempi potilailla, jotka saivat Empliciti-valmisteen ja lenalidomidin sekä deksametasonin yhdistelmähoitoa verrattuna lenalidomidin ja deksametasonin yhdistelmään. Hematologisten maligniteettien esiintyvyys oli sama kummassakin tutkimusjoukossa. Potilaita on seurattava sekundaarimaligniteettien kehittymisen varalta.
Apuaineet
Tämä lääkevalmiste sisältää 3,92 mg natriumia per 300 mg:n injektiopullo ja 5,23 mg natriumia per 400 mg:n injektiopullo, joka vastaa 0,2 %:a (300 mg:n annos) ja 0,3 %:a (400 mg:n annos) WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Farmakokineettisiä yhteisvaikutustutkimuksia ei ole tehty. Empliciti on humanisoitu monoklonaalinen vasta‑aine eikä sytokromi P450‑entsyymien (CYP) tai muiden lääkeaineita metaboloivien entsyymien odoteta metaboloivan sitä. Samanaikaisesti annettavien lääkeaineiden aiheuttama näiden entsyymien inhibitio tai induktio ei oletettavasti vaikuta Empliciti-valmisteen farmakokinetiikkaan.
Empliciti näkyy myeloomapotilaiden seerumin proteiinien elektroforeesissa ja seerumin immunofiksaatiossa, mikä voi vaikuttaa vasteen oikeaan luokitteluun. Potilaan seerumissa oleva elotutsumabi voi aiheuttaa elektroforeesissa pienen gamma‑alueen alun huipun joka on seerumin immunofiksaation IgGƙ. Tämä interferenssi voi vaikuttaa täydellisen vasteen ja mahdollisen relapsin määrittämiseen potilailla, joiden myeloomaproteiini on IgG‑kappa.
Jos seerumin immunofiksaatiossa havaitaan ylimääräisiä huippuja, biklonaalisen gammapatian mahdollisuus on suljettava pois.
Empliciti-valmisteen kanssa käytettävien lenalidomidin, pomalidomidin ja deksametasonin valmisteyhteenvetoihin on tutustuttava ennen hoidon aloittamista.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi/Miesten ja naisten raskaudenehkäisy
Empliciti-valmistetta ei pidä käyttää sellaisten naisten hoitoon, jotka voivat tulla raskaaksi, ellei potilaan kliininen tilanne edellytä hoitoa elotutsumabilla. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 120 päivän ajan hoidon päättymisen jälkeen.
Miespotilaiden on käytettävä tehokasta ehkäisyä hoidon aikana ja 180 päivän ajan hoidon päättymisen jälkeen, jos partneri on raskaana tai voi tulla raskaaksi eikä käytä tehokasta ehkäisyä.
Raskaus
Elotutsumabin käytöstä raskauden aikana ei ole kokemusta. Elotutsumabin kanssa annetaan lenalidomidia, joka on vasta‑aiheista raskauden aikana. Ei ole olemassa lisääntymistoksisuuteen liittyviä eläinkoetietoja, sillä sopiva eläinkoemalli puuttuu. Empliciti-valmistetta ei pidä käyttää raskauden aikana, ellei potilaan kliininen tilanne edellytä hoitoa elotutsumabilla.
Jokaisen yhdessä Empliciti-valmisteen kanssa käytettävän lääkevalmisteen valmisteyhteenvetoon on tutustuttava ennen hoidon aloittamista. Kun Empliciti-valmistetta käytetään yhdessä lenalidomidin tai pomalidomidin kanssa, on olemassa näihin lääkevalmisteisiin liittyvä sikiövaurioiden vaara, hengenvaaralliset synnynnäiset epämuodostumat mukaan lukien. Siksi vaatimuksia raskauden välttämisestä tulee noudattaa, mukaan lukien raskaustestit ja ehkäisyn käyttö. Lenalidomidia tai pomalidomidia esiintyy sitä käyttävien potilaiden veressä ja siemennesteessä. Siemennesteeseen kulkeutumiseen liittyvät ehkäisyvaatimukset ja lisätiedot, ks. valmisteyhteenveto. Empliciti-valmistetta yhdessä lenalidomidin tai pomalidomidin kanssa saavien potilaiden on sitouduttava lenalidomidin edellyttämään raskauden ehkäisyyn.
Imetys
Elotutsumabi ei oletettavasti erity ihmisen rintamaitoon. Elotutsumabin kanssa annetaan lenalidomidia tai pomalidomidia. Rintaruokinta on lopetettava lenalidomidin tai pomalidomidin käytön vuoksi.
Hedelmällisyys
Tutkimuksia elotutsumabin vaikutuksesta hedelmällisyyteen ei ole tehty. Siksi elotutsumabin vaikutus naisten ja miesten hedelmällisyyteen on tuntematon.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Raportoitujen haittavaikutusten perusteella Empliciti-valmisteen ei oleteta vaikuttavan ajokykyyn tai koneidenkäyttökykyyn. Infuusioon liittyvän reaktion saaneita potilaita on neuvottava välttämään auton ajamista ja koneiden käyttöä, kunnes oireet häviävät.
Haittavaikutukset
Tiivistelmä turvallisuusprofiilista
Elotutsumabin turvallisuustiedot perustuvat arvioon yhteensä 682 multippelia myeloomaa sairastavasta potilaasta, jotka saivat elotutsumabia yhdessä lenalidomidin ja deksametasonin kanssa (451 potilasta), bortetsomibin ja deksametasonin kanssa (103 potilasta) tai pomalidomidin ja deksametasonin kanssa (128 potilasta) yhteensä 8 kliinisessä tutkimuksessa. Suurin osa haittavaikutuksista oli lieviä tai kohtalaisia (asteen 1 tai 2).
Vakavin elotutsumabihoidon aikana mahdollisesti ilmenevä haittavaikutus on pneumonia.
Yleisimmät elotutsumabihoidon aikana ilmenevät haittavaikutukset (> 10 % potilaista) ovat infuusioon liittyvät reaktiot, ripuli, herpes zoster, nasofaryngiitti, yskä, pneumonia, ylähengitystieinfektio, lymfosytopenia ja painon lasku.
Haittavaikutustaulukko
Taulukossa 5 on esitetty haittavaikutukset, joita raportoitiin 8 kliinisessä tutkimuksessa 682 multippelia myeloomaa sairastavalla potilaalla, jotka saivat elotutsumabihoitoa.
Haittavaikutukset on esitetty elinjärjestelmän ja yleisyysluokan mukaan. Haittavaikutukset on määritelty seuraavasti: hyvin yleiset (≥ 1/10); yleiset (≥ 1/100, < 1/10); melko harvinaiset (≥ 1/1 000, < 1/100); harvinaiset (≥ 1/10 000, < 1/1 000); hyvin harvinaiset(< 1/10 000); ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on lueteltu kussakin yleisyysryhmässä vakavimmasta lähtien.
Taulukko 5: Haittavaikutukset Empliciti-valmistetta saaneilla multippelia myeloomaa sairastavilla potilailla
Elinjärjestelmä | Haittavaikutus | Yleisyys | Asteen 3/4 yleisyys |
Infektiot | Pneumoniaa | Hyvin yleinen | Yleinen |
Herpes zosterb | Yleinen | Melko harvinainen | |
| Ylähengitystieinfektio | Hyvin yleinen | Yleinen | |
Nasofaryngiitti | Hyvin yleinen | Tuntematon | |
Veri ja imukudos | Lymfosytopeniac | Hyvin yleinen | Yleinen |
| Leukopenia | Yleinen | Yleinen | |
Immuunijärjestelmä | Anafylaktinen reaktio | Melko harvinainen | Melko harvinainen |
Yliherkkyys | Yleinen | Melko harvinainen | |
Psyykkiset häiriöt | Mielialanvaihtelut | Yleinen | Tuntematon |
Hermosto | Päänsärky | Hyvin yleinen | Melko harvinainen |
Hypestesia | Yleinen | Melko harvinainen | |
Verisuonisto | Syvä laskimotukos | Yleinen | Yleinen |
Hengityselimet, rintakehä ja välikarsina | Yskäd | Hyvin yleinen | Melko harvinainen |
Suunielun kipu | Yleinen | Tuntematon | |
Ruoansulatuselimistö | Ripuli | Hyvin yleinen | Yleinen |
Iho ja ihonalainen kudos | Yöllinen hikoilu | Yleinen | Tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | Rintakipu | Yleinen | Yleinen |
Uupumus | Hyvin yleinen | Yleinen | |
Kuume | Hyvin yleinen | Yleinen | |
Tutkimukset | Painon lasku | Hyvin yleinen | Melko harvinainen |
Vammat ja myrkytykset | Infuusioon liittyvät reaktiot | Yleinen | Melko harvinainen |
a Käsite pneumonia viittaa seuraaviin: pneumonia, atyyppinen pneumonia, bronkopneumonia, lohkopneumonia, bakteeripneumonia, sienipneumonia, influenssan aiheuttama pneumonia ja pneumokokkipneumonia.
b Käsite herpes zoster viittaa seuraaviin: vyöruusu, huuliherpes ja herpesvirusinfektio.
c Käsite lymfosytopenia viittaa seuraaviin: lymfosytopenia ja lymfosyyttimäärän väheneminen.
d Käsite yskä viittaa seuraaviin: yskä, produktiivinen yskä ja ylähengitysteihin liittyvä yskä.
Tutkimuksessa CA204004 havaitut altistumisen perusteella mukautetut haittavaikutusten lukumäärät (kaikki asteet ja asteen 3/4 haittavaikutukset) ovat taulukossa 6. Kliinisessä tutkimuksessa multippelia myeloomaa sairastavilla potilailla verrattiin Empliciti‑hoitoa lenalidomidin ja deksametasonin yhdistelmällä (N = 318) hoitoon lenalidomidilla ja deksametasonilla (N = 317).
Taulukko 6:Tutkimuksessa CA204004 altistumisen perusteella mukautetut haittavaikutusten lukumäärät Empliciti-valmistetta saaneilla potilailla verrattuna lenalidomidia ja deksametasonia saaneisiin potilaisiin (sisältää kaikilla hoidetuilla potilailla kaikki havaitut tapaukset) | ||||||||
Empliciti + lenalidomidi ja deksametasoni N = 318 | lenalidomidi ja deksametasoni N = 317 | |||||||
Kaikki asteet | Aste 3/4 | Kaikki asteet | Aste 3/4 | |||||
Haittavaikutus | Tapauksia yhteensä | Yleisyys (esiintyvyys/100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys/100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys/100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys/100 potilasvuotta) |
Ripuli | 303 | 59,2 | 19 | 3,7 | 206 | 49,3 | 13 | 3,1 |
Kuume | 220 | 43,0 | 8 | 1,6 | 116 | 27,7 | 10 | 2,4 |
Uupumus | 205 | 40,0 | 33 | 6,4 | 145 | 34,7 | 26 | 6,2 |
Yskäa | 170 | 33,2 | 1 | 0,2 | 85 | 20,3 | ‑ | ‑ |
Nasofaryngiitti | 151 | 29,5 | ‑ | ‑ | 116 | 27,7 | ‑ | ‑ |
Ylähengitystieinfektio | 129 | 25,2 | 2 | 0,4 | 95 | 22,7 | 4 | 1,0 |
Lymfosytopeniab | 90 | 17,6 | 65 | 12,7 | 57 | 13,6 | 31 | 7,4 |
Päänsärky | 88 | 17,2 | 1 | 0,2 | 40 | 9,6 | 1 | 0,2 |
Pneumoniac | 80 | 15,6 | 54 | 10,5 | 54 | 12,9 | 34 | 8,1 |
| Leukopenia | 70 | 13,7 | 19 | 3,7 | 65 | 15,5 | 21 | 5,0 |
Herpes zosterd | 51 | 10,0 | 5 | 1,0 | 24 | 5,7 | 3 | 0,7 |
Suunielun kipu | 45 | 8,8 | ‑ | ‑ | 17 | 4,1 | ‑ | ‑ |
Painon lasku | 44 | 8,6 | 4 | 0,8 | 20 | 4,8 | ‑ | ‑ |
Yöllinen hikoilu | 31 | 6,1 | ‑ | ‑ | 12 | 2,9 | ‑ | ‑ |
Rintakipu | 29 | 5,7 | 2 | 0,4 | 12 | 2,9 | 1 | 0,2 |
Syvä laskimotukos | 26 | 5,1 | 18 | 3,5 | 12 | 2,9 | 7 | 1,7 |
Hypestesia | 25 | 4,9 | 1 | 0,2 | 12 | 2,9 | ‑ | ‑ |
Mielialan vaihtelut | 23 | 4,5 | ‑ | ‑ | 8 | 1,9 | ‑ | ‑ |
Yliherkkyys | 10 | 2,0 | ‑ | ‑ | 4 | 1,0 | 1 | 0,2 |
a Käsite yskä viittaa seuraaviin: yskä, produktiivinen yskä ja ylähengitysteihin liittyvä yskä.
b Käsite lymfosytopenia viittaa seuraaviin: lymfosytopenia ja lymfosyyttimäärän väheneminen.
c Käsite pneumonia viittaa seuraaviin: pneumonia, atyyppinen pneumonia, bronkopneumonia, lohkopneumonia, bakteeripneumonia, sienipneumonia, influenssan aiheuttama pneumonia ja pneumokokkipneumonia.
d Käsite herpes zoster viittaa seuraaviin: vyöruusu, huuliherpes ja herpesvirusinfektio.
Tutkimuksessa CA204125 havaitut altistumisen perusteella mukautetut haittavaikutusten lukumäärät (kaikki asteet ja asteen 3/4 haittavaikutukset) ovat taulukossa 7. CA204125 on kliininen tutkimus multippelia myeloomaa sairastavilla potilailla, ja siinä verrattiin Empliciti‑hoitoa pomalidomidin ja deksametasonin yhdistelmällä (N = 60) hoitoon pomalidomidilla ja deksametasonilla (N = 55).
Taulukko 7: Tutkimuksessa CA204125 altistumisen perusteella mukautetut haittavaikutusten lukumäärät Empliciti-valmistetta saaneilla potilailla verrattuna pomalidomidia ja deksametasonia saaneisiin potilaisiin (sisältää kaikilla hoidetuilla potilailla havaitut kaikki tapaukset) | ||||||||
| Empliciti + | pomalidomidi ja deksametasoni | ||||||
| Kaikki asteet | Aste 3/4 | Kaikki asteet | Aste 3/4 | ||||
Haittavaikutus | Tapauksia yhteensä | Yleisyys (esiintyvyys /100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys /100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys /100 potilasvuotta) | Tapauksia yhteensä | Yleisyys (esiintyvyys /100 potilasvuotta) |
Yskäa | 12 | 25,2 | 1 | 2,1 | 9 | 26,2 | - | - |
Nasofaryngiitti | 12 | 25,2 | - | - | 10 | 29,1 | - | - |
Ylähengitystieinfektio | 9 | 18,9 | - | - | 10 | 29,1 | 1 | 2,9 |
Leukopenia | 13 | 27,3 | 9 | 18,9 | 3 | 8,7 | 2 | 5,8 |
Lymfosytopeniab | 10 | 21,0 | 6 | 12,6 | 1 | 2,9 | 1 | 2,9 |
Pneumoniac | 6 | 12,6 | 4 | 8,4 | 9 | 26,2 | 8 | 23,3 |
Herpes zosterd | 5 | 10,5 | - | - | 3 | 8,7 | - | - |
Infuusioon liittyvät reaktiot | 2 | 4,2 | 1 | 2,1 | 1 | 2,9 | - | - |
Rintakipu | 2 | 4,2 | - | - | 1 | 2,9 | - | - |
Yöllinen hikoilu | 1 | 2,1 | - | - | - | 0,0 | - | - |
Hypestesia | 1 | 2,1 | - | - | 1 | 2,9 | - | - |
Mielialanvaihtelut | 1 | 2,1 | - | - | 1 | 2,9 | - | - |
a Käsite yskä viittaa seuraaviin: yskä, produktiivinen yskä ja ylähengitysteihin liittyvä yskä.
b Käsite lymfosytopenia viittaa seuraaviin: lymfosytopenia ja lymfosyyttimäärän väheneminen.
c Käsite pneumonia viittaa seuraaviin: pneumonia, atyyppinen pneumonia, bronkopneumonia, lohkopneumonia, bakteeripneumonia, sienipneumonia, influenssan aiheuttama pneumonia ja pneumokokkipneumonia.
d Käsite herpes zoster viittaa seuraaviin: vyöruusu, huuliherpes, herpesvirusinfektio ja silmän alueen vyöruusu.
Valikoitujen haittavaikutusten kuvaus
Infuusioon liittyvät reaktiot
Multippelia myeloomaa sairastavilla potilailla tehdyissä kliinisissä tutkimuksissa infuusioon liittyviä reaktioita raportoitiin noin 10 %:lla esilääkitystä saaneista potilaista, joita hoidettiin Empliciti-valmisteen ja lenalidomidin ja deksametasonin yhdistelmällä (N = 318), ja 3 %:lla esilääkitystä saaneista potilaista, joita hoidettiin Empliciti-valmisteen ja pomalidomidin ja deksametasonin yhdistelmällä (N = 60) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Lieviä tai kohtalaisia infuusioon liittyviä reaktioita oli > 50 %:lla potilaista, jotka eivät saaneet esilääkitystä. Kaikki raportoidut infuusioon liittyvät reaktiot olivat ≤ asteen 3 reaktioita. Asteen 3 infuusioon liittyviä reaktioita esiintyi 1 %:lla potilaista. Tutkimuksessa CA204004 infuusioon liittyvän reaktion yleisimmät oireet olivat kuume, palelu ja hypertensio. Viidellä prosentilla (5 %) potilaista Empliciti-valmisteen annostelu jouduttiin keskeyttämään (mediaani 25 minuutin ajaksi) infuusioon liittyvän reaktion takia ja prosentilla (1 %) potilaista hoito lopetettiin infuusioon liittyvien reaktioiden takia. Infuusioon liittyvän reaktion saaneista potilaista 70 % (23/33) sai reaktion ensimmäisen annoksen aikana. Tutkimuksessa CA204125 kaikki raportoidut infuusioon liittyvät reaktiot tapahtuivat ensimmäisen hoitosyklin aikana ja olivat ≤ astetta 2.
Infektiot
Infektioiden esiintyvyys, pneumonia mukaan lukien, oli suurempi Empliciti-valmistetta saaneiden keskuudessa kuin kontrolliryhmässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Multippelia myeloomaa sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa (CA204004) infektioita raportoitiin 81,4 %:lla potilaista, jotka saivat Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää (N = 318) ja 74,4 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista (N = 317). Asteen 3–4 infektioita havaittiin 28 %:lla Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 24,3 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista. Kuolemaan johtaneet infektiot olivat harvinaisia, ja niitä raportoitiin 2,5 %:lla Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 2,2 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista. Pneumonian esiintyvyys oli suurempi Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneiden potilaiden joukossa, 15,1 % (kuolemaan johtaneita 0,6 %), kuin lenalidomidia ja deksametasonia saaneiden potilaiden joukossa, 11,7 % (kuolemaan johtaneita 0 %).
Multippelia myeloomaa sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa (CA204125) infektioita raportoitiin 65 %:lla potilaista, jotka saivat Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmää (N = 60), ja 65,5 %:lla pomalidomidin ja deksametasonin yhdistelmää saaneista potilaista (N = 55). Asteen 3–4 infektioita havaittiin 13,3 %:lla Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 21,8 %:lla pomalidomidin ja deksametasonin yhdistelmää saaneista potilaista. Kuolemaan johtaneita infektioita (eli asteen 5 infektioita) raportoitiin 5 %:lla Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 3,6 %:lla pomalidomidin ja deksametasonin yhdistelmää saaneista potilaista.
Sekundaarimaligniteetit
Sekundaarimaligniteettien esiintyvyys oli suurempi Empliciti-valmistetta saaneiden keskuudessa kuin kontrolliryhmässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Multippelia myeloomaa sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa (CA204004) invasiivisia sekundaarimaligniteetteja raportoitiin 6,9 %:lla potilaista, jotka saivat Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää (N = 318) ja 4,1 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista (N = 317). Sekundaarimaligniteeteilla tiedetään olevan yhteys lenalidomidialtistukseen, jonka kesto oli pidempi potilailla, jotka saavat Empliciti-valmisteen ja lenalidomidin sekä deksametasonin yhdistelmähoitoa verrattuna lenalidomidin ja deksametasonin yhdistelmään. Hematologisten maligniteettien esiintyvyys oli sama kummassakin tutkimusjoukossa (1,6 %). Kiinteitä tuumoreita raportoitiin 2,5 %:lla Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 1,9 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista. Muita ihosyöpiä kuin melanoomaa raportoitiin 3,1 %:lla Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista ja 1,6 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista.
CA20415-tutkimuksessa ei raportoitu yhtään sekundaarimaligniteettitapausta Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmää saaneilla potilailla (N = 60). Pomalidomidin ja deksametasonin yhdistelmää saaneiden potilaiden ryhmässä (N = 55) tapauksia oli 1 (1,8 %).
Syvä laskimotukos
Multippelia myeloomaa sairastavilla potilailla tehdyssä kliinisessä tutkimuksessa (CA204004) syviä laskimotukoksia raportoitiin 7,2 %:lla potilaista, jotka saivat Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää (N = 318) ja 3,8 %:lla lenalidomidin ja deksametasonin yhdistelmää saaneista potilaista (N = 317). Aspiriinilla hoidetuilla potilailla raportoitiin syviä laskimotukoksia 4,1 %:lla potilaista, jotka saivat Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää (E‑Ld) ja 1,4 %:lla potilaista, jotka saivat lenalidomidin ja deksametasonin yhdistelmää (Ld). Syvien laskimotukosten määrä tutkimusryhmien välillä oli samankaltainen sekä potilailla jotka saivat ennaltaehkäisevästi pienimolekyylistä hepariinia (2,2 % kummassakin tutkimusjoukossa), että potilailla jotka saivat K‑vitamiinin antagonistia (määrät olivat 0 % potilailla joiden hoitona oli E‑Ld ja 6,7 % potilailla joiden hoitona oli Ld).
Immunogeenisuus
Kuten kaikkiin terapeuttisiin proteiineihin, Empliciti-valmisteeseen voi liittyä immunogeenisuutta.
Neljään kliiniseen tutkimukseen osallistuneista 390 potilaasta, jotka saivat Empliciti-valmistetta ja joilta voitiin arvioida lääkevasta‑aineen vasta‑aineiden esiintyvyys, 72 potilaalla (18,5 %) testitulos oli sähkökemiallista luminesenssia mittaavalla testillä (ECL) positiivinen hoidon aiheuttamien vasta‑aineen vasta‑aineiden osalta. Neutraloivia vasta‑aineita havaittiin 19 potilaalla 299:stä CA204004‑tutkimuksessa. Suurimmalla osalla potilaista immunogeenisuutta ilmeni hoidon alkuvaiheessa ja se oli ohimenevää 2–4 kuukaudessa. Populaatiofarmakokineettisten ja altistus‑vaste‑analyysien perusteella farmakokinetiikan, tehon tai toksisuusprofiilin vaihtelussa ja lääkevasta‑aineen vasta‑aineiden kehittymisen välillä ei ollut selvää kausaalista yhteyttä.
CA204125‑tutkimukseen osallistuneista 53 potilaasta, jotka saivat Empliciti-valmistetta ja joilta voitiin arvioida vasta‑aineiden esiintymistä lääkevasta‑aineelle, 19 potilaalla (36 %) testitulos oli sähkökemiallista luminesenssia mittaavalla testillä (ECL) positiivinen lääkehoidon aiheuttamalle vasta‑ainemuodostukselle. Näistä 1 potilaan testitulos oli yhtämittaisesti positiivinen. Näillä 19 potilaalla vasta‑aineita lääkevasta‑aineelle esiintyi 2 ensimmäisen kuukauden sisällä Empliciti‑hoidon aloituksesta. Näistä 19 potilaasta 18:lta (95 %) vasta‑ainemuodostus lääkevasta‑aineelle hävisi 2–3 kuukauden kuluessa. Neutraloivia vasta‑aineita havaittiin 2 potilaalla 53:stä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen ‑hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yhdellä potilaalla raportoitiin yliannostus elotutsumabiannoksella 23,3 mg/kg yhdistettynä lenalidomidiin ja deksametasoniin. Potilas oli oireeton, yliannostus ei vaatinut hoitoa ja elotutsumabihoitoa voitiin jatkaa.
Yliannostustapauksessa potilasta on seurattava tarkasti haittavaikutusten löydösten ja oireiden varalta ja asianmukainen oireenmukainen hoito aloitettava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, monoklonaaliset vasta‑aineet ja vasta‑ainekonjugoidut solunsalpaajat, muut monoklonaaliset vasta‑aineet ja vasta-ainekonjugoidut solunsalpaajat. ATC‑koodi: L01FX08.
Vaikutusmekanismi
Elotutsumabi on immuunijärjestelmää stimuloiva humanisoitu monoklonaalinen IgG1‑vasta‑aine, joka sitoutuu spesifisesti SLAMF7‑proteiiniin (signaling lymphocyte activation molecule family member 7). SLAMF7 ilmentyy voimakkaasti multippelia myeloomaa sairastavien potilaiden maligneissa soluissa, riippumatta sytogeneettisistä poikkeavuuksista. SLAMF7 ilmentyy myös luonnollisissa tappajasoluissa, normaaleissa plasmasoluissa sekä muissa immuunisoluissa, kuten tietyissä T‑solujen alaluokissa, monosyyteissä, B‑soluissa, makrofageissa ja plasmasytoidisissa dendriittisoluissa, mutta sitä ei havaita normaaleissa kiinteissä kudoksissa tai hematopoeettisissa kantasoluissa.
Elotutsumabi aktivoi suoraan luonnollisia tappajasoluja sekä SLAMF7‑reitin että Fc‑reseptorien kautta voimistaen immunologista vaikutusta multippelia myeloomaa vastaan in vitro. Elotutsumabi sitoutuu myös myeloomasolujen SLAMF7‑proteiiniin ja spesifisten immuunisolujen Fc-reseptorien vuorovaikutuksen välityksellä edistää myeloomasolujen tuhoamista vasta-aineesta riippuvaisen luonnollisten tappajasolu-välitteisen solutuhon (ADCC) avulla ja vasta-aineesta riippuvaisen makrofagi-välitteisen solunsyönnin (ADCP) avulla. Non‑kliinisissä malleissa elotutsumabi on osoittanut synergististä aktiivisuutta yhdistettynä lenalidomidiin, pomalidomidiin tai bortetsomibiin.
Kliininen teho ja turvallisuus
Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmä (CA204004)
Satunnaistetussa avoimessa CA204004‑tutkimuksessa arvioitiin Empliciti-valmisteen ja lenalidomidin sekä deksametasonin yhdistelmän (E‑Ld) tehoa ja turvallisuutta multippelia myeloomaa sairastavilla aikuisilla potilailla, jotka ovat saaneet yhtä tai useampaa aiempaa hoitoa. Kaikilla potilailla tauti oli tutkitusti edennyt viimeisimmän hoidon jälkeen. Mukaan ei otettu lenalidomidihoidolle refraktaareja potilaita. 6 % potilaista oli aiemmin saanut lenalidomidihoitoa. Potilaiden oli täytynyt toipua kantasolusiirrosta vähintään 12 viikkoa autologisen kantasolusiirron ja 16 viikkoa allogeenisen kantasolusiirron jälkeen. Tutkimukseen ei otettu mukaan potilaita, joilla oli sydänamyloidoosi tai plasmasoluleukemia.
Tutkimukseen sopivat potilaat satunnaistettiin suhteessa 1:1 saamaan joko Empliciti-valmistetta yhdistelmänä lenalidomidin ja deksametasonin kanssa tai pelkkää lenalidomidia ja deksametasonia (Ld). Hoitoa annettiin neljän viikon sykleissä, kunnes tauti eteni tai ilmaantui ei‑hyväksyttävää toksisuutta. Elotutsumabia annettiin viikoittain 10 mg/painokg laskimoon kahden ensimmäisen syklin ajan ja sen jälkeen kahden viikon välein. Ennen Empliciti‑infuusiota deksametasonia annettiin jaettuna annoksena, 28 mg suun kautta ja 8 mg laskimoon. Kontrolliryhmässä ja viikkoina, jolloin ei annettu Empliciti-valmistetta, deksametasonia annettiin viikoittain 40 mg suun kautta yksittäisenä annoksena. Lenalidomidia annettiin päivittäin 25 mg suun kautta kunkin syklin kolmen ensimmäisen viikon ajan. Tuumorivaste arvioitiin neljän viikon välein.
Yhteensä 646 potilasta satunnaistettiin saamaan hoitoa: 321 potilasta sai Empliciti-valmistetta yhdistelmänä lenalidomidin ja deksametasonin kanssa ja 325 potilasta pelkkää lenalidomidia ja deksametasonia.
Demografiset tekijät ja lähtötilanteen ominaisuudet olivat samankaltaiset tutkimuksen hoitohaarojen välillä. Mediaani‑ikä oli 66 vuotta (vaihteluväli 37–91 vuotta); 57 % potilaista oli yli 65‑vuotiaita. 60 % potilaista oli miehiä. Valkoihoisia oli 84 % potilasjoukosta, aasialaisia 10 % ja mustaihoisia 4 %. International Staging System (ISS) ‑riskiluokkaan I kuului 43 %, luokkaan II 32 % ja luokkaan III 21 % potilaista. Potilaista 32 % kuului korkean riskin sytogeneettiseen kategoriaan del17p ja 9 % kategoriaan t(4;14). Aiempien hoitojen mediaanilukumäärä oli 2. Potilaista 35 % oli refraktääreja (tauti eteni hoidon aikana tai 60 päivän sisällä viimeisimmästä hoidosta), ja tauti uusi 65 %:lla potilaista (tauti eteni 60 päivän jälkeen viimeisimmästä hoidosta). Aiempia hoitoja olivat kantasolusiirto (55 %), bortetsomibi (70 %), melfalaani (65 %), talidomidi (48 %) ja lenalidomidi (6 %).
Ensisijaiset päätetapahtumat eli riskisuhteen perusteella arvioitu etenemisvapaa elinaika (PFS) ja kokonaisvasteosuus (ORR) määritettiin sokkoutetun riippumattoman arviointikomitean (Independent Review Committee, IRC) arviointien perusteella. Tulokset tehon suhteen esitetään taulukossa 8 sekä kuvassa 1. Hoitosyklien mediaanimäärä oli Empliciti-valmistetta saaneessa tutkimushaarassa 19 ja vertailevassa tutkimushaarassa 14.
Toissijainen päätetapahtuma oli kokonaiselinaika (OS), jonka ennalta suunniteltu loppuanalyysi oli suoritettava vähintään 427 kuolemantapauksen jälkeen.
Taulukko 8:Tutkimuksen CA204004 tehoa koskevat tulokset | ||
| E-Ld N = 321 | Ld N = 325 |
PFS (ITT) | ||
Riskisuhde [97,61 % CI] | 0,68 [0,55—0,85] | |
Ositetun log‑rank‑testin p‑arvoa | 0,0001 | |
Yhden vuoden PFS‑arvo (%) [95 % CI] | 68 [63, 73] | 56 [50, 61] |
Kahden vuoden PFS‑arvo (%) [95 % CI] | 39 [34, 45] | 26 [21, 31] |
Kolmen vuoden PFS‑arvob (%) [95 % CI] | 23 [18, 28] | 15 [10, 20] |
PFS‑mediaani kuukausina [95 % CI] | 18,5 [16,5, 21,4] | 14,3 [12,0, 16,0] |
Vaste | ||
Kokonaisvaste (ORR)c n (%) [95 % CI] | 252 (78,5) [73,6; 82,9] | 213 (65,5) [60,1; 70,7] |
p‑arvod | 0,0002 | |
Täydellinen vaste (CR + sCR)e n (%) | 14 (4,4)f | 24 (7,4) |
Erittäin hyvä osittainen vaste (VGPR) n (%) | 91 (28,3) | 67 (20,6) |
Osittainen vaste (RR/PR) n (%) | 147 (45,8) | 122 (37,5) |
Yhdistetyt vasteet (CR+sCR+VGPR) n (%) | 105 (32,7) | 91 (28,0) |
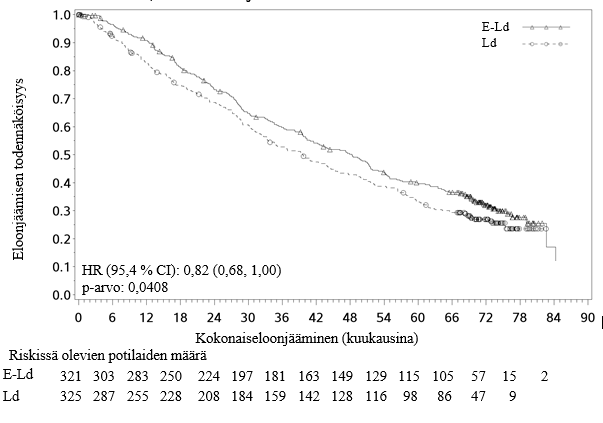
Kokonaiseloonjääminen (OS)g | ||
Riskisuhde [95 % CI] | 0,82 [0,68; 1,00] | |
Ositetun log‑rank‑testin p‑arvo | 0,0408h | |
OS‑mediaani kuukausina [95 % CI] | 48,30 [40,34; 51,94] | 39,62 [33,25; 45,27] |
a p‑arvo perustuen B2‑mikroglobuliineilla (< 3,5 mg/l vs. ≥ 3,5 mg/l), aiempien hoitojen lukumäärällä (1 vs. 2 tai 3) ja aiemmalla immunomodulatorisella hoidolla (ei lainkaan vs. aiempi talidomidi vs. muu hoito) ositettuun log‑rank‑testiin.
b Kolmen vuoden PFS‑arvon etukäteen määritelty analyysi suoritettiin perustuen 33 kuukauden minimiseuranta‑aikaan.
c EMBT‑kriteeri (European Group for Blood and Marrow Transplantation).
d p‑arvo perustuen B2‑mikroglobuliineilla (< 3,5 mg/l vs. ≥ 3,5 mg/l), aiempien hoitojen lukumäärällä (1 vs. 2 tai 3) ja aiemmalla immunomodulatorisella hoidolla (ei lainkaan vs. aiempi talidomidi vs. muu hoito) ositettuun Cochran‑Mantel‑Haenszelin khi‑neliö‑testiin.
e Täydellinen vaste (CR) + täydellinen vaste lisäehdoin (sCR).
f Täydellisen vasteen määrät Empliciti‑ryhmässä saatetaan aliarvioida, sillä elotutsumabin monoklonaalinen vasta‑aine aiheuttaa häiriötä immunofiksaatiossa ja seerumin proteiinien elektroforeesissa.
g Etukäteen määritelty kokonaiselinajan (OS) loppuanalyysi suoritettiin vähintään 427 kuolemantapauksen ja 70,6 kuukauden minimiseuranta‑ajan perusteella.
hKokonaiselinajan loppuanalyysi täytti protokollassa määritetyn tilastollisen merkitsevyyden rajan (p ≤ 0,046).
CI: luottamusväli
Kuva 1:CA204004, etenemisvapaa elinaika
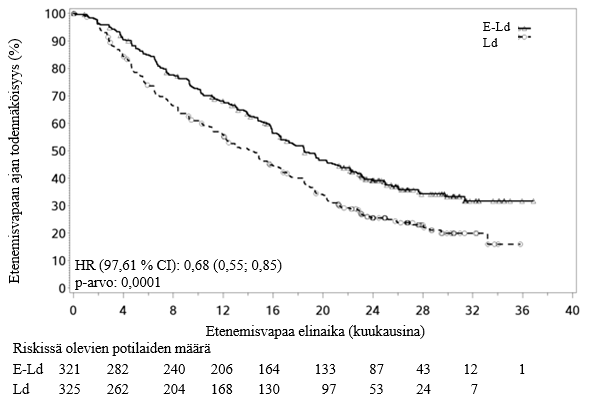
Havaitut etenemisvapaan elinajan paranemiset olivat yhdenmukaisia kaikissa alaryhmissä eivätkä ne olleet iästä (< 65 vs. ≥ 65), riskitilasta, sytogeenisista kategorioista del 17p tai t(4;14), ISS‑riskiluokasta, aiempien hoitojen lukumäärästä, aiemmasta immunomodulatorisesta altistumisesta, aiemmasta altistumisesta bortetsomibille, taudin uusiutumisesta, vasteen puuttumisesta tai munuaisten toiminnasta riippuvaisia, ks. taulukko 9.
Taulukko 9:CA204004, alaryhmien tehoa koskevat tulokset | |||
E‑Ld N = 321 | Ld N = 325 | ||
Alaryhmän kuvaus | PFS‑mediaani kuukausina [95 % CI] | PFS‑mediaani kuukausina [95 % CI] | HR [95 % CI] |
Ikä | |||
< 65 vuotta | 19,4 [15,9, 23,1] | 15,7 [11,2, 18,5] | 0,74 [0,55, 1,00] |
≥ 65 vuotta | 18,5 [15,7, 22,2] | 12,9 [10,9, 14,9] | 0,64 [0,50, 0,82] |
Riskitekijät | |||
Korkea riski | 14,8 [9,1, 19,6] | 7,2 [5,6, 11,2] | 0,63 [0,41, 0,95] |
Vakioriski | 19,4 [16,5, 22,7] | 16,4 [13,9, 18,5] | 0,75 [0,59, 0,94] |
Sytogeeninen kategoria | |||
del17p todettu | 19,6 [15,8; NE] | 14,9 [10,6, 17,5] | 0,65 [0,45, 0,93] |
del17p ei todettu | 18,5 [15,8, 22,1] | 13,9 [11,1, 16,4] | 0,68 [0,54, 0,86] |
t(4;14) todettu | 15,8 [8,4, 18,4] | 5,5 [3,1, 10,3] | 0,55 [0,32, 0,98] |
t(4;14) ei todettu | 19,6 [17,0, 23,0] | 14,9 [12,4, 17,1] | 0,68 [0,55, 0,84] |
ISS‑riskiluokka | |||
I | 22,2 [17,8, 31,3] | 16,4 [14,5, 18,6] | 0,61 [0,45, 0,83] |
II | 15,9 [9,5, 23,1] | 12,9 [11,1, 18,5] | 0,83 [0,60, 1,16] |
III | 14,0 [9,3, 17,3] | 7,4 [5,6, 11,7] | 0,70 [0,48, 1,04] |
Aiemmat hoidot | |||
Aiemmat hoitolinjat = 1 | 18,5 [15,8, 20,7] | 14,5 [10,9, 17,5] | 0,71 [0,54, 0,94] |
Aiemmat hoitolinjat = 2 or 3 | 18,5 [15,9, 23,9] | 14,0 [11,1, 15,7] | 0,65 [0,50, 0,85] |
Aiempi talidomidialtistus | 18,4 [14,1, 23,1] | 12,3 [9,3, 14,9] | 0,61 [0,46, 0,80] |
Ei aiempaa immunomodulatorista altistumista | 18,9 [15,8, 22,2] | 17,5 [13,0, 20,0] | 0,78 [0,59, 1,04] |
Aiempi bortetsomibialtistus | 17,8 [15,8, 20,3] | 12,3 [10,2, 14,9] | 0,67 [0,53, 0,84] |
Ei aiempaa bortetsomibialtistusta | 21,4 [16,6; NE] | 17,5 [13,1, 21,3] | 0,70 [0,48, 1,00] |
Hoitovaste | |||
Uusinut | 19,4 [16,6, 22,2] | 16,6 [13,0, 18,9] | 0,75 [0,59, 0,96] |
Refraktääri | 16,6 [14,5, 23,3] | 10,4 [6,6, 13,3] | 0,55 [0,40, 0,76] |
Munuaistoiminta | |||
Lähtötilanne kreatiinipuhdistuma < 60 mL/min | 18,5 [14,8, 23,3] | 11,7 [7,5, 17,4] | 0,56 [0,39, 0,80] |
Lähtötilanne CrCl ≥ 60 mL/min | 18,5 [15,9, 22,2] | 14,9 [12,1, 16,7] | 0,72 [0,57, 0,90] |
Empliciti-valmisteen, lenalidomidin ja deksametasonin yhdistelmää saaneilla yhden vuoden kokonaiselinaika oli 91 %, kahden vuoden 73 %, kolmen vuoden 60 %, neljän vuoden 50 % ja viiden vuoden 40 %, kun vastaavasti pelkkää lenalidomidia ja deksametasonia saaneilla yhden vuoden kokonaiselinaika oli 83 %, kahden vuoden 69 %, kolmen vuoden 53 %, neljän vuoden 43 % ja viiden vuoden 33 % (ks. taulukko 2).
Etukäteen suunniteltu kokonaiselinajan (OS) loppuanalyysi suoritettiin 212 kuolemantapauksen jälkeen E‑Ld‑tutkimushaarassa ja 225 kuolemantapauksen jälkeen Ld‑tutkimushaarassa. Minimiseuranta-aika oli 70,6 kuukautta. E‑Ld‑tutkimushaaran potilaiden kokonaiselinajassa havaittiin tilastollisesti merkitsevä hyöty Ld‑tutkimushaaran potilaisiin verrattuna. Kokonaiselinajan mediaani E‑Ld‑tutkimushaarassa oli 48,30 kuukautta ja Ld‑tutkimushaarassa 39,62 kuukautta. E‑Ld-tutkimushaaran potilaiden kuolemanriski pieneni 18 % Ld‑tutkimushaaran potilaisiin verrattuna (HR = 0,82; 95,4 %:n luottamusväli: 0,68, 1,00; p‑arvo = 0,0408). Katso taulukko 8 ja kuva 2.
Kuva 2:CA204004, kokonaiseloonjääminen
Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmä (CA204125)
Satunnaistetussa avoimessa CA204125‑tutkimuksessa arvioitiin Empliciti-valmisteen, pomalidomidin ja deksametasonin yhdistelmän (E‑Pd) tehoa ja turvallisuutta uusiutunutta ja/tai refraktaarista multippelia myeloomaa sairastavilla potilailla, jotka olivat saaneet vähintään kahta aiempaa hoitoa, mukaan lukien lenalidomidi ja proteasomin estäjä (PI) ja joilla sairaus eteni viimeisimmän hoidon aikana tai 60 päivän kuluessa sen jälkeen. Potilaiden sairaus oli refraktaarinen, jos se eteni lenalidomidin ja PI:n yhdistelmähoidon aikana tai 60 päivän kuluessa sen jälkeen ja viimeisimmän hoidon aikana tai 60 päivän kuluessa sen jälkeen, tai uusiutunut ja refraktaarinen, jos potilaat olivat saaneet ainakin osittaisen vasteen edelliseen lenalidomidin ja PI:n yhdistelmähoitoon, mutta heidän sairautensa eteni 6 kuukauden kuluessa ja heille kehittyi etenevä tauti viimeisimmän hoidon aikana tai 60 päivän kuluessa sen lopettamisen jälkeen. Tutkimukseen (E‑Pd) ei otettu mukaan potilaita, joilla oli asteen 2 tai vakavampi perifeerinen neuropatia.
Yhteensä 117 potilasta satunnaistettiin suhteessa 1:1 saamaan hoitoa: 60 potilasta sai elotutsumabia yhdistettynä pomalidomidiin ja deksametasoniin (E‑Pd), ja 57 potilasta sai pomalidomidia ja deksametasonia (Pd). Hoitoa annettiin neljän viikon sykleissä (28 päivän sykli), kunnes tauti eteni tai ilmaantui ei‑hyväksyttävää toksisuutta. Elotutsumabia annettiin viikoittain 10 mg/painokg laskimoon kahden ensimmäisen syklin ajan ja sen jälkeen 20 mg/painokg neljän viikon välein.
Deksametasonia annettiin päivinä 1, 8, 15 ja 22 joka syklissä. Niinä viikkoina, kun Empliciti infusoitiin, deksametasoni annosteltiin ennen Empliciti-valmistetta jaettuina annoksina: ≤ 75‑vuotiaille tutkittaville 28 mg suun kautta ja 8 mg laskimoon ja > 75-vuotiaille tutkittaville 8 mg suun kautta ja 8 mg laskimoon. Niinä viikkoina, kun Empliciti-valmistetta ei infusoitu, sekä kontrolliryhmässä deksametasonia annettiin ≤ 75-vuotiaille tutkittaville 40 mg suun kautta ja > 75‑vuotiaille tutkittaville 20 mg suun kautta. Tuumorivaste arvioitiin neljän viikon välein.
Demografiset piirteet ja lähtötilanteen ominaisuudet olivat samankaltaiset tutkimuksen hoitohaarojen välillä. Mediaani‑ikä oli 67 vuotta (vaihteluväli 36–81 vuotta); 62 % potilaista oli yli 65‑vuotiaita. 57 % potilaista oli miehiä. Potilaista valkoihoisia oli 77 %, aasialaisia 21 % ja mustaihoisia 1 %. International Staging System (ISS) ‑riskiluokkaan I kuului 50 %, luokkaan II 38 % ja luokkaan III 12 % potilaista. FISH-menetelmällä määritetyistä kromosomipoikkeavuuksista del 17p esiintyi 5 %:lla, t(4;4) esiintyi 11 %:lla ja t(14;16) esiintyi 7 %:lla. Yhdellätoista (9,4 %) potilaalla oli suuren riskin myelooma. Aiempien hoitojen mediaanilukumäärä oli 3. 87 % potilaista oli refraktaareja lenalidomidille, 80 % oli refraktaareja PI:lle ja 70 % oli refraktaareja sekä lenalidomidille että PI:lle. Aiempia hoitoja olivat kantasolusiirto (55 %), bortetsomibi (100 %), lenalidomidi (99 %), sykofosfamidi (66 %), melfalaani (63 %), karfiltsomibi (21 %), iksatsomibi (6 %) ja daratumumabi (3 %).
Hoitosyklien mediaanimäärä oli E‑Pd-tutkimushaarassa 9 ja Pd‑tutkimushaarassa 5.
Ensisijainen päätetapahtuma oli tutkijan arvioima etenemisvapaa elinaika (PFS) muokatuilla International Myeloma Working Group -työryhmän (IMWG) kriteereillä arvioituna. Etenemisvapaan elinajan (PFS) mediaani hoitoaikeen mukaisessa ITT-populaatiossa oli 10,25 kuukautta (95 %:n luottamusväli: 5,59; ei arvioitavissa (non-estimable, NE)) E‑Pd‑tutkimushaarassa ja 4,67 kuukautta (95 %:n luottamusväli: 2,83; 7,16) Pd‑tutkimushaarassa. Myös IRC (riippumaton arviointikomitea) arvioi etenemisvapaan elinajan ja kokonaisvasteosuuden.
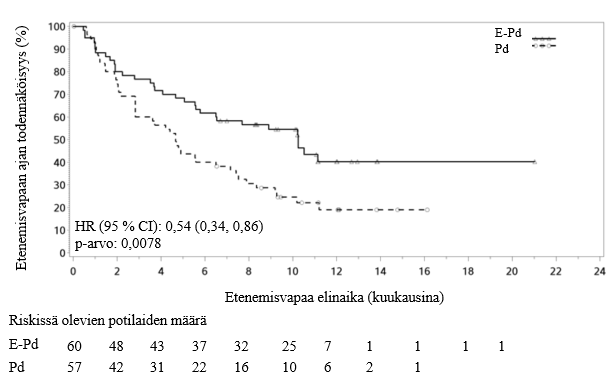
Etenemisvapaan elinajan (PFS) tulokset tutkijan ja IRC:n arvioimina on esitetty taulukossa 10 (minimiseuranta‑aika 9,1 kuukautta). Kuvassa 3 on esitetty tutkijan arvioima etenemisvapaa elinaika Kaplan–Meier‑kuvaajana.
Taulukko 10: CA204125, etenemisvapaa elinaika ja kokonaisvaste | ||||
| Tutkijan arvioima | IRC‑arviointif | ||
| E-Pd | Pd | E-Pd | Pd |
PFS (ITT) |
|
| ||
Riskisuhde [95 % CI] | 0,54 [0,34, 0,86] | 0,51 [0,32, 0,82] | ||
Ositetun log‑rank‑testin p‑arvoa | 0,0078 | 0,0043 | ||
PFS‑mediaani kuukausina [95 % CI] | 10,25 [5,59, NE] | 4,67 [2,83 7,16] | 10,25 [6,54, NE] | 4,70 [2,83, 7,62] |
Vaste |
|
|
|
|
Kokonaisvaste (ORR)b n (%) [95 % CI] | 32 (53,3) [40,0, 66,3] | 15 (26,3) [15,5, 39,7] | 35 (58,3) [44,9, 70,9] | 14 (24,6) [14,1, 37,8] |
p‑arvoc | 0,0029 | 0,0002 | ||
Täydellinen vaste (CR + sCR)d n (%) | 5 (8,3)e | 1 (1,8) | 0 (0,0)e | 0 (0,0) |
Erittäin hyvä osittainen vaste (VGPR) n (%) | 7 (11,7) | 4 (7,0) | 9 (15,0) | 5 (8,8) |
Osittainen vaste (RR/PR) n (%) | 20 (33,3) | 10 (17,5) | 26 (43,3) | 9 (15,8) |
Yhdistetyt vasteet (CR+sCR+VGPR) n (%) | 12 (20,0) | 5 (8,8) | 9 (15,0) | 5 (8,8) |
a p-arvo perustuen taudin asteella tutkimuksen sisäänottovaiheessa (International Staging System I–II vs III) ja aiempien hoitolinjojen lukumäärällä (2–3 vs ≥ 4) randomointivaiheessa ositettuun log‑rank‑testiin.
b muokatut International Myeloma Working Group -työryhmän (IMWG) kriteerit.
c p‑arvo perustuen taudin asteella tutkimuksen sisäänottovaiheessa (International Staging System I–II vs III) ja aiempien hoitolinjojen lukumäärällä (2–3 vs ≥ 4) randomointivaiheessa ositettuun Cochran–Mantel–Haenszelin chi‑neliö‑testiin.
d Täydellinen vaste (CR) + täydellinen vaste lisäehdoin (sCR).
e Täydellisen vasteen määrät Empliciti‑ryhmässä saatetaan aliarvioida, sillä elotutsumabin monoklonaalinen vasta‑aine aiheuttaa häiriötä immunofiksaatiossa ja seerumin proteiinien elektroforeesissa.
f IRC‑arviointi tehtiin jälkikäteen post-hoc-analyysinä.
NE: ei arvioitavissa
Kuva 3: CA204125, etenemisvapaa elinaika tutkijan määrittelemänä
Etenemisvapaa elinaika (PSF) tutkijan arviomana analysoitiin hoitoaikeen mukaisesta ITT-populaatiosta useassa eri alaryhmässä, mukaan lukien ikä (< 65 vs. ≥ 65), rotu, ISS‑luokka, aiemmat hoidot, siirrännäiset, riskiluokka, ECOG‑status, kreatiniinipuhdistuma ja sytokiinien poikkeavuudet. Etenemisvapaa elinaika (PFS) oli yleisesti yhdenmukainen eri hoitoryhmien hoitoaikeen mukaisessa ITT‑populaatiossa havaittujen PFS‑lukujen kanssa riippumatta arvioidusta alaryhmästä. Kuitenkin tuloksiin on suhtauduttava varauksella, koska eri alaryhmien hyvin vähäinen potilasmäärä hankaloitti vaikutuksen yhdenmukaisuuden arviointia ryhmissä.
Kokonaiselinaika (OS) oli tutkimuksen tärkein toissijainen päätetapahtuma. Etukäteen suunniteltu kokonaiselinajan loppuanalyysi suoritettiin vähintään 78 kuolemantapauksen jälkeen. Minimiseuranta‑aika oli 45,0 kuukautta. Loppuanalyysin kokonaiselinaikatulokset olivat tilastollisesti merkitseviä. E‑Pd‑tutkimushaaran potilaiden kokonaiselinajassa havaittiin merkitsevä pidentyminen Pd‑tutkimushaaran potilaisiin verrattuna (HR = 0,59; 95 %:n luottamusväli: 0,37, 0,93; p‑arvo 0,0217). E‑Pd‑haaran potilaiden kuolemanriski oli 41 % pienempi. Tulokset tehon suhteen on esitetty taulukossa 11 sekä kuvassa 4.
Taulukko 11: CA204125, kokonaiselinajan tulokset
| E‑Pd | Pd |
Kokonaiselinaika (OS)** |
|
|
Riskisuhde [95 % CI] | 0,59 [0,37; 0,93] | |
Ositetun log‑rank‑testin p‑arvo* | 0,0217*** | |
OS‑mediaani kuukausina [95 % CI] | 29,80 [22,87; 45,67] | 17,41 [13,83; 27,70] |
* p‑arvo perustuen taudin asteella tutkimuksen sisäänottovaiheessa (International Staging System I–II vs III) ja aiempien hoitolinjojen lukumäärällä (2–3 vs ≥ 4) randomointivaiheessa ositettuun log‑rank‑testiin.
** Etukäteen määritelty kokonaiselinajan loppuanalyysi suoritettiin vähintään 78 kuolemantapauksen perusteella (45,0 kuukauden minimiseuranta‑aika).
*** Kokonaiselinajan loppuanalyysin p-arvo alitti etukäteen määritellyn tilastollisen merkitsevyyden alfarajan (p ≤ 0,20) sekä tiukemman p-arvorajan 0,05.
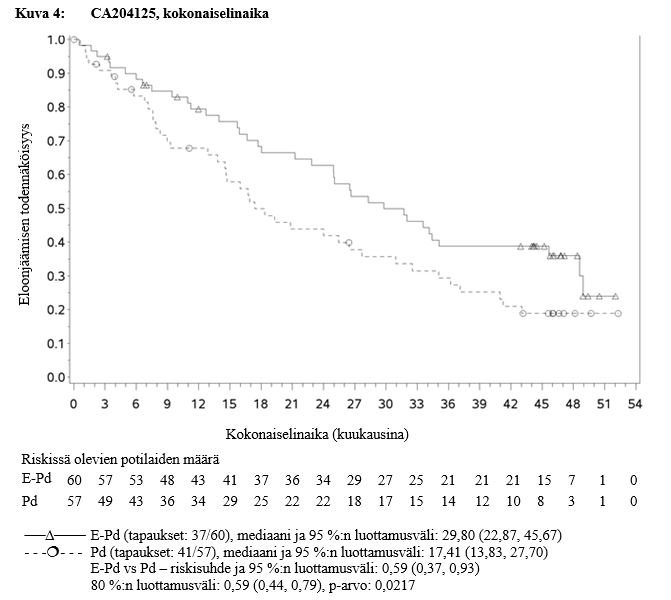
Mukautettu alfataso = 0,2.
Symbolit edustavat sensuroituja havaintoja.
Ryhmitelty taudin asteella tutkimuksen sisäänottovaiheessa (International Staging System I–II vs III) ja aiempien hoitolinjojen lukumäärällä (2–3 vs ≥ 4) randomointivaiheessa.
Pediatriset potilaat
Euroopan lääkevirasto ei vaadi kaikkien alajoukkojen tuloksia multippelin myelooman hoitoa pediatrisilla potilailla käsitelleestä tutkimuksesta (lisätietoja käytöstä pediatrisilla potilailla, ks. kohta Annostus ja antotapa).
Farmakokinetiikka
Elotutsumabin farmakokinetiikkaa tutkittiin multippelia myeloomaa sairastavilla potilailla. Elotutsumabin farmakokinetiikka on epälineaarinen, ja sen puhdistuma pienenee, kun annos nousee 0,5–20 mg/painokg:aan.
Imeytyminen
Elotutsumabi annostellaan laskimoon, joten se on välittömästi biologisesti täysin käytettävissä.
Jakautuminen
Elotutsumabin keskimääräinen geometrinen jakautumistilavuus suositellulla annostusohjeella yhdistelmähoidossa lenalidomidin/deksametasonin kanssa on vakaassa tilassa 5,7 l (variaatiokerroin (CV): 23 %) ja pomalidomidin/deksametasonin kanssa vakaassa tilassa 5,6 l (CV: 21 %).
Biotransformaatio
Elotutsumabin aineenvaihduntatietä ei ole kuvattu. Elotutsumabi on monoklonaalinen IgG‑vasta‑aine, jonka oletetaan hajoavan pieniksi peptideiksi ja aminohapoiksi katabolisissa prosesseissa.
Eliminaatio
Elotutsumabin geometrisen kokonaispuhdistuman keskiarvo on 10 mg/painokg:n nnoksella (yhdistelmähoidossa lenalidomidin ja deksametasonin kanssa) vakaassa tilassa 0,194 l/vuorokausi (CV: 62,9 %). Elotutsumabin, lenalidomidin ja deksametasonin yhdistelmähoidon tai elotutsumabin, pomalidomidin ja deksametasonin yhdistelmähoidon loppuessa elotutsumabin pitoisuudet pienenevät 3 kuukaudessa noin 3 %:iin (washout noin 97 %, arvioituna viiden puoliintumisajan kuluessa) populaatiossa ennustetun seerumin vakaan tilan enimmäispitoisuudesta.
Erityisryhmät
440 potilaalla tehtyjen populaatiofarmakokineettisten analyysien perusteella elotutsumabin puhdistuma lisääntyy ruumiinpainon mukana, mikä tukee painoon perustuvaa annosta. Populaatiofarmakokineettisten analyysien perusteella seuraavilla tekijöillä ei ollut kliinisesti merkittävää vaikutusta elotutsumabin puhdistumaan: ikä, sukupuoli, rotu, laktaattidehydrogenaasi (LDH) lähtötilanteessa, albumiini, munuaisten vajaatoiminta, lievä maksan vajaatoiminta ja yhtäaikainen lenalidomin/deksametasonin tai pomalidomidin/deksametasonin anto. Elotutsumabin kohdevälitteinen puhdistuma lisääntyi seerumin M‑proteiinin pitoisuuden kasvaessa.
Munuaisten vajaatoiminta
Avoin tutkimus (CA204007) arvioi elotutsumabin farmakokinetiikkaa yhdessä lenalidomidin sekä deksametasonin kanssa multippelia myeloomaa sairastavilla potilailla, joilla oli vaihtelevan tasoinen munuaisten vajaatoiminta (luokittelu kreatiniinipuhdistuman CrCl‑arvoihin perustuen). Elotutsumabin farmakokinetiikkaa arvioitiin potilailla, joiden munuaistoiminta oli normaali (kreatiniinipuhdistuma > 90 ml/min; n = 8), potilailla joilla oli vaikea‑asteinen munuaisten vajaatoiminta, joka ei edellyttänyt dialyysia (kreatiniinipuhdistuma < 30 ml/min; n = 9), ja potilailla, joilla oli dialyysia vaativa loppuvaiheen munuaisten vajaatoiminta (kreatiniinipuhdistuma < 30 ml/min; n = 9). Elotutsumabin farmakokinetiikassa ei havaittu kliinisesti merkitseviä eroja niiden potilaiden välillä, joilla oli vaikea‑asteinen munuaisten vajaatoiminta (ei dialyysia tai dialyysi) ja niiden, joiden munuaistoiminta oli normaali (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Empliciti on monoklonaalinen IgG1‑vasta‑aine, joka pääasiassa puhdistuu katabolisesti. Siksi maksan vajaatoiminta ei todennäköisesti vaikuta sen puhdistumaan. Maksan vajaatoiminnan vaikutusta Empliciti-valmisteen puhdistumaan arvioitiin populaatiofarmakokineettisissä analyyseissa potilailla, joilla oli lievä maksan vajaatoiminta (TB ULN-arvon ylärajalla tai sitä matalampi ja ASAT korkeampi kuin ULN tai TB alle 1–1,5-kertainen ULN-arvoon tai mihin tahansa ASAT-arvoon verrattuna; n = 33). Empliciti-valmisteen puhdistumassa ei havaittu kliinisesti merkitseviä eroja niiden potilaiden välillä, joilla oli lievä maksan vajaatoiminta ja niiden, joilla maksan toiminta oli normaali. Elotutsumabia ei ole tutkittu potilailla, joilla on kohtalainen (TB yli 1,5–3 kertainen ULN‑arvoon tai mihin tahansa ASAT‑arvoon verrattuna) tai vaikea‑asteinen (TB yli 3‑kertainen ULN‑arvoon tai mihin tahansa ASAT‑arvoon verrattuna) maksan vajaatoiminta (ks. kohta Annostus ja antotapa).
Prekliiniset tiedot turvallisuudesta
Elotutsumabi tunnistaa vain ihmisperäisen SLAMF7‑proteiinin. Koska elotutsumabi ei tunnista ei‑ihmisperäisiä SLAMF7‑proteiineja, in vivo ‑turvallisuustiedot eläinkokeista ovat irrelevantteja. Samasta syystä ei ole tietoja elotutsumabin karsinogeenisuudesta eläimillä eikä hedelmällisyys‑ tai sikiötoksisuustutkimuksia ole tehty. Ei‑kliiniset turvallisuustiedot koostuvat pääosin rajoitetuista in vitro ‑tutkimuksista ihmissoluilla/‑kudoksella, tutkimuksissa ei tullut ilmi turvallisuuteen liittyviä löytöjä.
Farmaseuttiset tiedot
Apuaineet
sakkaroosi, natriumsitraatti, sitruunahappomonohydraatti, polysorbaatti 80 (E433)
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
4 vuotta.
Käyttökuntoon saattamisen ja laimentamisen jälkeen
Käyttökuntoon saatettu liuos tulee välittömästi siirtää injektiopullosta infuusiopussiin.
Käyttökuntoon saatetun ja laimennetun liuoksen kemiallinen ja fysikaalinen stabiilius on osoitettu 24 tunnin ajan 2‑8°C:ssa valolta suojattuna.
Mikrobiologiselta kannalta infuusioneste pitäisi käyttää välittömästi. Jos liuosta ei käytetä välittömästi, käytönaikainen säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä normaalisti saa ylittää 24 tuntia 2‑8°C:ssa valolta suojattuna. Käyttökuntoon saatettua tai laimennettua liuosta ei saa pakastaa. Infuusionestettä voi säilyttää 24 tunnista korkeintaan 8 tuntia 20−25°C:ssa huoneenvalossa. Tämä 8 tunnin jakso sisältää valmisteen annosteluajan.
Säilytys
Säilytä jääkaapissa (2°C ‑ 8°C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EMPLICITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
300 mg (L:ei) 1 kpl (1621,82 €)
400 mg (L:ei) 1 kpl (2128,03 €)
PF-selosteen tieto
20 ml tyypin I lasipullo, joka sisältää 300 mg tai 400 mg elotutsumabia, suljettu harmaalla butyylitulpalla ja alumiinisulkimella, jossa on kääntämällä irrotettava polypropyleenikorkki. Kääntämällä irrotettava korkki on 300 mg:n pakkauksessa luonnonvalkoinen ja 400 mg:n pakkauksessa sininen.
Yksi pakkaus sisältää yhden injektiopullon.
Valmisteen kuvaus:
Kuiva‑aine on valkoinen tai melkein valkoinen kokonainen tai rikkoutunut kakku.
Käyttö- ja käsittelyohjeet
Annoksen laskeminen
Laske annos (mg) ja määritä annosta (10 mg/kg tai 20 mg/kg) varten tarvittavien injektiopullojen määrä potilaan painoon perustuen. Kokonaisannosta varten saatetaan tarvita enemmän kuin yksi injektiopullo Empliciti-valmistetta.
- Elotutsumabin kokonaisannos on milligrammoina vastaava kuin potilaan paino kiloina kerrottuna elotutsumabin annoksella (10 tai 20 mg/kg, ks. kohta Annostus ja antotapa).
Injektiopullon käyttökuntoon saattaminen
Saata jokainen Empliciti‑pullo aseptisesti käyttökuntoon, käytä oikeankokoista ruiskua ja koon 18 tai pienempää neulaa, ks. Taulukko 12. Injektionesteisiin käytettävän veden annostelun yhteydessä saattaa normaalisti ilmetä lievää takaisinvirtausta.
Taulukko 12:Ohjeet käyttökuntoon saattamiseksi
Vahvuus | Käyttökuntoon saattamiseksi tarvittava injektionesteisiin käytettävä vesi | Käyttökuntoon saatetun Empliciti-valmisteen lopullinen tilavuus injektiopullossa (sis. korvautuneen kuiva‑aineen tilavuus) | Pitoisuus käyttökuntoon saattamisen jälkeen |
300 mg:n injektiopullo | 13,0 ml | 13,6 ml | 25 mg/ml |
400 mg:n injektiopullo | 17,0 ml | 17,6 ml | 25 mg/ml |
Pidä injektiopulloa pystyasennossa ja pyöritä sitä, jotta kylmäkuivattu kuiva‑aine liukenisi liuokseen. Käännä sen jälkeen pulloa ylösalaisin muutaman kerran, jotta pullon yläosassa tai tulpassa mahdollisesti oleva kuiva‑aine liukenisi. Vältä voimakasta sekoittamista, ÄLÄ RAVISTA. Kuiva‑aineen pitäisi liueta alle 10 minuutissa.
Kun kaikki kuiva‑aine on täysin liuennut, anna liuoksen seistä 5‑10 minuuttia. Käyttökuntoon saatettuna liuos on väritön tai kellertävä, kirkas tai erittäin opalisoiva. Empliciti pitää tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa. Jos liuoksessa näkyy hiukkasia tai värimuutoksia, sitä ei saa antaa.
Infuusionesteen valmistaminen
Laimenna käyttökuntoon saatettu liuos joko 9 mg/ml (0,9 %) natriumkloridi‑injektionesteellä tai 5 % glukoosi‑injektionesteellä saadaksesi lopullisen pitoisuuden infuusiolle välille 1 mg/ml ja 6 mg/ml. Natriumkloridi‑injektionesteen 9 mg/ml (0,9 %) tai glukoosi‑injektionesteen 5 % tilavuus pitää säätää siten, ettei se millään Empliciti‑annoksella ylitä 5 ml:aa/painokilo.
Laske tarvittavan liuottimen (joko natriumkloridi‑injektioneste 9 mg/ml (0,9 %) tai 5 %glukoosi‑injektioneste) tilavuus (ml) valmistaaksesi potilaan infuusionesteen.
Ota laskettuun annokseen tarvittava määrä kustakin injektiopullosta, enintään 16 ml 400 mg:n pullosta ja 12 ml 300 mg:n pullosta. Jokainen injektiopullo on hieman ylitäytetty, jotta varmistetaan siitä saatava riittävä tilavuus.
Siirrä kaikista tarvittavista injektiopulloista saatavat potilaskohtaisen lasketun annoksen mukaiset määrät yhteen polyvinyylikloridista tai polyolefiinistä tehtyyn infuusiopussiin, joka sisältää lasketun määrän liuotinta. Sekoita infuusio varovasti käsin pyörittelemällä. Älä ravista.
Empliciti on tarkoitettu vain kerta-annoksena annettavaksi. Käyttämättä jäänyt injektiopullon sisältö on hävitettävä.
Annostelu
Koko Empliciti‑infuusio on annosteltava infuusiotarvikkeilla ja steriilillä, ei‑pyrogeenisella, vähän proteiineja sitovalla suodattimella (huokoskoko 0,2−1,2 mikrom) käyttäen automaattista infuusiopumppua.
Empliciti‑infuusio on yhteensopiva seuraavien kanssa:
- PVC‑ ja polyolefiinisäiliöt
- PVC‑infuusiotarvikkeet
- polyeetterisulfoniset ja nailoniset linjasuodattimet, joiden huokoskoko on 0,2‑1,2 mikrom.
10 mg/painokg ‑annoksen Empliciti‑infuusio on aloitettava infuusionopeudella 0,5 ml/min ja 20 mg/painokg ‑annoksen infuusio nopeudella 3 ml/min. Jos infuusio on hyvin siedetty, infuusionopeutta voidaan nostaa asteittain taulukoiden 3 ja 4 mukaisesti (ks. kohta Annostus ja antotapa Antotapa). Infuusionopeus ei saa ylittää 5 ml:aa/min.
Empliciti infuusioliuos tulee käyttää välittömästi. Jos liuosta ei käytetä välittömästi, käytönaikainen säilytysaika ja olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä normaalisti saa ylittää 24 tuntia 2‑8°C:ssa valolta suojattuna. Käyttökuntoon saatettua tai laimennettua liuosta ei saa pakastaa. Infuusionestettä voi säilyttää 24 tunnista korkeintaan 8 tuntia 20−25°C:ssa huoneenvalossa. Tämä 8 tunnin jakso sisältää valmisteen annosteluajan.
Hävittäminen
Älä säilytä käyttämätöntä infuusioliuosta uudelleenkäyttöä varten. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
EMPLICITI kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
300 mg 1 kpl
400 mg 1 kpl
- Ei korvausta.
ATC-koodi
L01FX08
Valmisteyhteenvedon muuttamispäivämäärä
25.09.2025
Yhteystiedot
09 2512 1244
www.bms.com/fi
medinfo.finland@bms.com
