INNOVAIR NEXTHALER inhalationspulver 100/6 mikrog/annos
Kvalitativ och kvantitativ sammansättning
En uppmätt dos av 10 mg inhalationspulver innehåller:
100 mikrogram beklometasondipropionat (vattenfritt) och 6 mikrogram formoterolfumaratdihydrat.
Detta motsvarar en avgiven dos (den dos som lämnar munstycket) om 81,9 mikrogram beklometasondipropionat och 5,0 mikrogram formoterolfumaratdihydrat.
Hjälpämne med känd effekt:
varje inhalation innehåller 9,9 mg laktosmonohydrat.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Inhalationspulver.
Kliniska uppgifter
Terapeutiska indikationer
Astma
Innovair nexthaler är indicerad för regelbunden behandling av astma, när kombinationsbehandling (inhalerad kortikosteroid och långverkande beta2-agonist) är lämplig för:
- patienter som inte uppnår adekvat symtomkontroll med inhalerad kortikosteroid och vidbehovsmedicinering med inhalerad snabbverkande beta2-agonist
- patienter som redan har adekvat symtomkontroll med inhalerad kortikosteroid och långverkande beta2-agonist.
Innovair Nexthaler är indicerad för vuxna.
Kroniskt obstruktiv lungsjukdom (KOL)
Symtomatisk behandling av patienter med svår KOL (FEV1 < 50 % av referensvärdet) och tidigare upprepade exacerbationer och som har signifikanta symtom trots regelbunden behandling med långverkande bronkdilaterare.
Dosering och administreringssätt
Innovair nexthaler är avsedd för inhalation.
ASTMA
Innovair nexthaler är inte avsedd för initial astmabehandling. Doseringen av Innovair nexthaler är individuell och ska anpassas efter sjukdomens svårighetsgrad. Detta ska beaktas både vid insättande av kombinationspreparat och när dosen justeras. Om enskilda patienter skulle behöva en doskombination utöver vad som finns tillgängligt i kombinationsinhalatorn, ska lämplig dos av beta2-agonist och/eller kortikosteroid i separata inhalatorer förskrivas.
Till följd av en extrafin fördelning av partikelstorleken krävs en dosjustering när patienter byter till Innovair nexthaler inhalationspulver från en formulering med en inte lika extrafin fördelning av partikelstorlek. Då ska det beaktas att den rekommenderade totala dagliga dosen av beklometasondipropionat för Innovair nexthaler är lägre än för beklometasondipropionathaltiga, inte lika extrafina läkemedel och ska anpassas efter den specifika patientens behov. Patienter som överförs till Innovair nexthaler inhalationspulver från Innovair inhalationsspray, lösning behöver dock inte dosjustering.
Det finns två behandlingssätt:
A. Underhållsbehandling: Innovair nexthaler används som underhållsbehandling med en separat snabbverkande bronkdilaterare vid behov.
B. Underhålls- och vidbehovsbehandling: Innovair nexthaler används som regelbunden underhållsbehandling men även som vidbehovsbehandling av astmasymtom.
A. Underhållsbehandling
Patienter ska instrueras att alltid ha en separat snabbverkande bronkdilaterare tillgänglig för symtomlindring.
Rekommenderad dosering för vuxna 18 år och äldre:
En eller två inhalationer två gånger dagligen.
Den maximala dygnsdosen är 4 inhalationer.
B. Underhålls- och vidbehovsbehandling
Patienten tar en daglig underhållsdos av Innovair nexthaler och som tillägg tas Innovair nexthaler vid behov för symtomlindring. Patienter ska instrueras att alltid ha sin Innovair nexthaler tillgänglig för symtomlindring.
Innovair nexthaler underhålls- och vidbehovsbehandling bör särskilt övervägas för patienter med:
- otillfredsställande astmakontroll och som ofta är i behov av symtomlindring
- tidigare episoder av exacerbationer som krävt medicinsk intervention.
Patienter som ofta inhalerar ett stort antal vidbehovsdoser Innovair nexthaler ska följas noggrant med avseende på dosrelaterade biverkningar.
Rekommenderad dosering för vuxna från 18 års ålder:
Rekommenderad underhållsdos är 1 inhalation två gånger dagligen (en dos på morgonen och en på kvällen).
Patienter bör ta 1 extra inhalation vid behov för symtomlindring. Ytterligare 1 inhalation bör tas om symtomen kvarstår efter några minuter.
Den maximala dygnsdosen är 8 inhalationer.
De patienter som behöver symtomlindring flera gånger per dag bör rekommenderas att kontakta läkare. Astman bör utvärderas på nytt och underhållsbehandlingen omvärderas.
Rekommenderad dosering för barn och ungdomar under 18 år:
Säkerhet och effekt för Innovair nexthaler för barn och ungdomar under 18 år har inte fastställts. Innovair nexthaler ska inte ges till barn i åldern 5 till 11 år av säkerhetsmässiga skäl. Tillgängliga data för denna åldersgrupp finns sammanfattat i avsnitt Farmakodynamiska egenskaper och Farmakokinetiska egenskaper. Tillgängliga kliniska data för ungdomar i åldern 12 till 17 år finns sammanfattat i avsnitt Biverkningar och Farmakodynamiska egenskaper, men ingen rekommendation gällande dosering kan ges.
Patienten ska regelbundet kontrolleras av läkare så att doseringen av Innovair nexthaler förblir optimal och endast ändras enligt läkares rekommendation. Dosen ska titreras till den lägsta dos vid vilken effektiv symtomkontroll uppnås. När symtomkontroll bibehålls med den lägsta rekommenderade doseringen kan nästa steg vara ett försök med enbart inhalerad kortikosteroid. Patienten ska instrueras att använda Innovair nexthaler dagligen, även vid symtomfrihet.
KRONISKT OBSTRUKTIV LUNGSJUKDOM (KOL)
Rekommenderad dosering för vuxna 18 år och äldre:
Två inhalationer två gånger dagligen.
Särskilda patientgrupper:
Dosjustering för äldre är inte nödvändig.
Det finns inga tillgängliga data för behandling med Innovair nexthaler hos patienter med nedsatt lever- eller njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Administreringssätt
Nexthaler är en inandningsdriven inhalator. Patienter med måttlig till svår astma respektive KOL har visats kunna producera tillräckligt med inspiratoriskt flöde för att aktivera dosfrisättning från nexthaler (se avsnitt Farmakodynamiska egenskaper). Dosfrisättningen från Innovair nexthaler är oberoende av inspiratoriskt flöde genom inhalatorn inom det flödesspann som är aktuellt för patientpopulationen.
Korrekt användning av nexthaler-inhalatorn är nödvändig för en framgångsrik behandling. Patienten ska uppmanas att läsa bipacksedeln noggrant och följa bruksanvisningen i denna. För att underlätta för förskrivaren finns dessa instruktioner nedan.
Antalet doser som visas i dosräknarens fönster minskar inte vid stängning av locket om patienten inte har inhalerat genom inhalatorn.
Patienten ska instrueras att endast öppna inhalatorns lock före administrering. Om patienten har öppnat inhalatorn, men inte inhalerat och locket stängs, så flyttas dosen tillbaka till pulverreservoaren inuti inhalatorn och den påföljande dosen kan inhaleras säkert.
Patienten ska skölja munnen, gurgla med vatten eller borsta tänderna efter inhalation (se avsnitt Varningar och försiktighet).
BRUKSANVISNING FÖR INNOVAIR NEXTHALER-INHALATOR
Innovair finns tillgängligt i två inhalatorstorlekar:
- en inhalator med 120 inhalationer
- en inhalator med 180 inhalationer
A. Förpackningens innehåll
För information om förpackningens innehåll, se avsnitt Förpackningstyp och innehåll.
Om innehållet i förpackningen avviker mot beskrivningen i 6.5, returnera inhalatorn och byt ut den mot en ny.
B. Allmänna varningar och försiktighetsåtgärder
Ta inte ut inhalatorn ur påsen förrän du är redo att börja använda den.
- Använd inhalatorn enligt instruktionerna i denna anvisning.
- Håll skyddslocket stängt tills du behöver ta en dos.
- Förvara inhalatorn på ett rent och torrt ställe när den inte används.
- Försök aldrig ta isär nexthaler‑inhalatorn.
C. Nexthaler-inhalatorns viktigaste delar
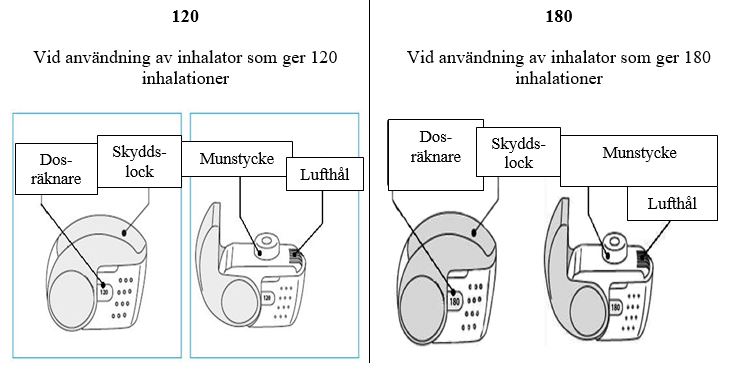
Att ta en dos från nexthaler‑inhalatorn kräver endast tre enkla steg: öppna, inhalera och stäng.
D. Innan du börjar använda en ny nexthaler‑inhalator
-
Öppna påsen och ta ut inhalatorn ur påsen.
- Använd inte inhalatorn om förseglingen har brutits eller om påsen är sönder. Returnera inhalatorn och byt ut den mot en ny.
- Notera datumet du öppnade påsen på ytterkartongen.
-
Inspektera inhalatorn.
- Om inhalatorn visar tecken på skada eller är trasig, returnera den och byt ut den.
-
Kontrollera dosräknaren. Om inhalatorn är oanvänd ska dosräknaren visa 120 eller 180.
- Om siffran är mindre än 120 eller 180 ska du inte använda inhalatorn – returnera den och skaffa en ny.
120 Vid användning av inhalator som ger 120 inhalationer
| 180 Vid användning av inhalator som ger 180 inhalationer
|
E. Så här använder du nexthaler-inhalatorn
- Kontakta läkare eller apotekspersonal om du inte är säker på att du får dosen rätt.
- Om du är osäker på om dosräknaren räknat ner efter inhalationen, vänta till nästa doseringstillfälle och ta då dosen som vanligt. Ta inte extradoser.
E.1 Öppna
- Håll inhalatorn upprätt.
-
Kontrollera antalet återstående doser: om siffran är mellan 1 och 120 eller 180 så finns det doser kvar.
- Om dosräknaren visar 0 så finns det inga doser kvar. Kassera inhalatorn och skaffa en ny.
-
Öppna skyddslocket helt och hållet.
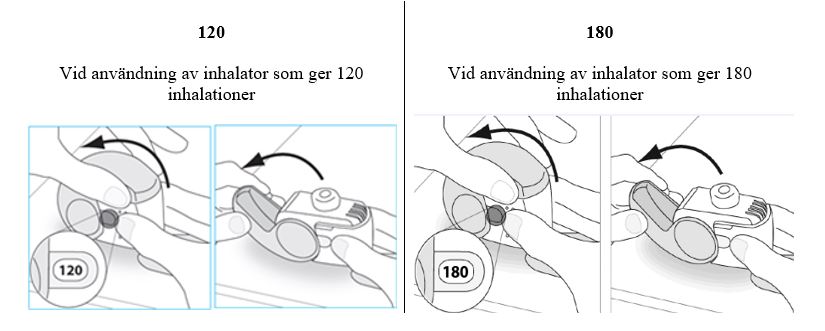
-
Andas ut så länge som det känns bra före inhalationen.
- Andas inte ut genom inhalatorn.
E.2 Inhalera
Stå eller sitt upprätt då du inhalerar om detta är möjligt.
-
Håll upp inhalatorn och för den till munnen, slut läpparna om munstycket.
- Täck inte för lufthålet när du håller i inhalatorn.
- Andas inte in genom lufthålet.
-
Andas in kraftigt och djupt genom munnen.
- Du kan känna en smak i munnen när du inhalerar.
- Du kan höra eller känna ett klick när du tar din dos.
- Andas inte in genom näsan.
- Avlägsna inte inhalatorn från munnen under inhalationen.
- Ta ut inhalatorn ur munnen.
- Håll andan i 5–10 sekunder eller så länge som det känns bra.
-
Andas ut långsamt.
- Andas inte ut genom inhalatorn.
E.3 Stäng
- Håll inhalatorn upprätt och stäng skyddslocket helt.
-
Kontrollera att dosräknaren har räknat ner med en.
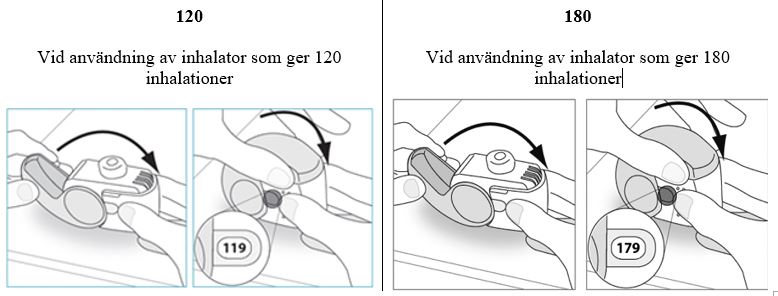
- Om du behöver ta en till dos, upprepa steg E.1–E.3.
F. Rengöring
- Inhalatorn behöver vanligen inte rengöras.
-
Vid behov kan inhalatorn torkas med en torr trasa eller pappershandduk efter användning.
- Använd inte vatten eller annan vätska för rengöring. Håll inhalatorn torr.
G. Förvaring och kassering
För information om förvaring och kassering se avsnitt Särskilda förvaringsanvisningar och Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot beklometasondipropionat, formoterolfumaratdihydrat eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Det rekommenderas att behandling trappas ut när behandlingen avbryts, behandlingen får inte avslutas abrupt.
Behandlingsstrategin av astma följer vanligen ett stegvis program och patientens svar ska övervakas kliniskt och genom lungfunktionstester.
Om patienten upplever att behandlingen inte ger tillräcklig effekt ska patienten kontakta läkaren. Ökad vidbehovs-användning av bronkdilaterare indikerar en försämring av den underliggande sjukdomen och en utvärdering av astmabehandlingen är befogad. Plötsligt och progressivt försämrad kontroll av astma är potentiellt livshotande och patienten ska därför söka akut medicinsk bedömning. Ökad dosering av kortikosteroid bör övervägas, antingen som inhalation eller oralt, eller behandling med antibiotika vid misstanke om infektion.
Behandling med Innovair nexthaler ska inte påbörjas under en exacerbation eller vid en markant eller akut försämring av astman. Allvarliga astmarelaterade biverkningar och exacerbationer kan inträffa under behandling med Innovair nexthaler. Patienter ska uppmanas att fortsätta behandlingen men samtidigt rådgöra med läkare om astmasymtomen kvarstår eller försämras efter initiering av behandling med Innovair nexthaler.
Som vid annan inhalationsterapi kan paradoxal bronkospasm inträffa med ökad väsande andning, hosta och andnöd omedelbart efter dosering. Detta ska omedelbart behandlas med en snabbverkande bronkdilaterare för inhalation. Innovair nexthaler ska sättas ut omedelbart, patienten bedömas och alternativ terapi ges om det är nödvändigt.
Innovair nexthaler är inte avsedd för initial astmabehandling.
Patienten ska instrueras att alltid ha sin snabbverkande bronkdilaterare tillgänglig för behandling av akuta astmaanfall, antingen Innovair nexthaler (för patienter som använder Innovair nexthaler som underhålls- och vidbehovsbehandling) eller en separat snabbverkande bronkdilaterare (för patienter som endast använder Innovair nexthaler som underhållsbehandling).
Patienten ska påminnas om att dagligen ta Innovair nexthaler enligt ordination även vid symtomfrihet. Vidbehovsdoser med Innovair nexthaler ska tas till följd av astmasymtom, inte som regelbunden förebyggande behandling, t.ex. före ansträngning. För sådan användning bör en separat snabbverkande bronkdilaterare övervägas.
När symtomen är under kontroll kan man överväga en gradvis nedtrappning av dosen Innovair nexthaler. Regelbunden uppföljning av patienterna under nedtrappningen är viktigt. Den lägsta effektiva dosen av Innovair nexthaler ska användas (se avsnitt Dosering och administreringssätt).
Pneumoni hos patienter med KOL
En ökning av incidensen av pneumoni, inklusive pneumoni som kräver inläggning på sjukhus, har observerats hos patienter med KOL som får kortikosteroider för inhalation. Det finns viss evidens för en ökad risk för pneumoni vid höjningar av steroiddosen, men detta har inte slutgiltigt påvisats i alla studier.
Det finns ingen slutgiltig klinisk evidens för skillnader inom klassen inhalerade kortikosteroider när det gäller pneumoniriskens storleksordning.
Läkare bör vara fortsatt vaksamma när det gäller möjlig utveckling av pneumoni hos patienter med KOL eftersom de kliniska tecknen på sådana infektioner överlappar symtomen på KOL-exacerbationer.
Riskfaktorer för pneumoni hos patienter med KOL inkluderar nuvarande rökning, hög ålder, lågt kroppsmasseindex (BMI) och allvarlig KOL.
Systempåverkan kan förekomma vid inhalationsbehandling med kortikosteroider, särskilt vid höga doser vid längre behandlingsperioder. Det är dock betydligt mindre sannolikt att dessa effekter uppträder jämfört med oral behandling med kortikosteroider. Eventuella systembiverkningar inkluderar Cushings syndrom, Cushingliknande symtombild, binjuresuppression, hämmad längdtillväxt hos barn och ungdomar, minskad bentäthet, katarakt, glaukom och mer sällsynt en rad psykologiska störningar eller beteendestörningar som omfattar psykomotorisk hyperaktivitet, sömnstörningar, oro, depression eller aggression (särskilt hos barn). Det är därför viktigt att dosen av inhalerade kortikosteroider trappas ned till lägsta möjliga dos som ger systemkontroll av astman.
Långtidsbehandling med höga doser inhalerade kortikosteroider kan resultera i binjuresuppression och akut binjurekris hos patienten. Barn och ungdomar under 16 år som använder högre doser än rekommenderat av inhalerat beklametasondipropionat löper särskild hög risk. Situationer som möjligen kan utlösa akut binjurekris inkluderar trauma, kirurgi, infektion eller hastig minskning av dosen. Symtomen är oftast vaga och kan innefatta anorexi, buksmärta, viktminskning, trötthet, huvudvärk, illamående, kräkningar, hypotoni, minskad medvetandegrad, hypoglykemi och kramper. Tillägg av systemisk kortikosteroid ska övervägas vid perioder av stress eller vid elektiva kirurgiska ingrepp.
Hos patienter som överförs från orala till inhalerade kortikosteroider finns risk för kvardröjande nedsatt binjurereserv under avsevärd tid. Patienter som tidigare krävt höga doser av kortikosteroider i akuta situationer eller fått långvarig behandling med höga doser av inhalerad kortikosteroid kan också vara i riskzonen. Denna risk för kvardröjande nedsättning ska alltid uppmärksammas vid akuta och elektiva situationer som kan framkalla stress och lämplig kortikosteroidbehandling ska övervägas. Omfattningen av binjurefunktionens nedsättning kan kräva rådgivning med specialist före elektiva ingrepp.
Innovair nexthaler ska administreras med försiktighet till patienter med aktiv eller inaktiv lungtuberkulos, svamp- eller virusinfektion i luftvägarna.
Innovair nexthaler ska användas med försiktighet (vilket kan innebära övervakning) hos patienter med hjärtarytmier, särskilt AV-block III och takyarytmier, idiopatisk subvalvulär aortastenos, hypertrofisk obstruktiv kardiomyopati, ischemisk hjärtsjukdom, allvarlig hjärtinsufficiens, allvarlig arteriell hypertension eller aneurysm.
Försiktighet ska även iakttas vid behandling av patienter med känt eller misstänkt förlängt QTc-intervall, antingen medfött eller läkemedelsinducerat (QTc > 0,44 sekunder). Formoterol kan orsaka förlängning av QTc-intervallet.
Försiktighet krävs även när Innovair nexthaler används av patienter med tyreotoxikos, diabetes mellitus, feokromocytom och obehandlad hypokalemi.
Potentiellt allvarlig hypokalemi kan uppstå vid beta2-agonistterapi. Särskild försiktighet rekommenderas vid svår astma eftersom denna effekt kan förstärkas vid hypoxi. Hypokalemi kan också förstärkas av samtidig behandling med andra läkemedel som kan inducera hypokalemi t.ex. xantinderivat, steroider och diuretika (se avsnitt Interaktioner). Försiktighet rekommenderas också vid instabil astma när ett flertal doser av snabbverkande bronkdilaterare eventuellt används. Rekommendationen är att övervaka serumkaliumnivån vid dessa omständigheter.
Inhalation av formoterol kan orsaka en ökning av blodglukosnivåerna. Av denna anledning ska blodglukos noggrant övervakas hos patienter med diabetes.
Om anestesi med halogenerade anestetika planeras ska det säkerställas att Innovair nexthaler inte administreras minst 12 timmar innan anestesi påbörjas på grund av risken för hjärtarytmier.
Patienten ska ges rådet att skölja munnen, gurgla med vatten eller borsta tänderna efter inhalering av den förskrivna dosen för att minimera risken för candidanfektion i munhåla och svalg.
Detta läkemedel innehåller laktos. Laktos innehåller en liten andel mjölkprotein, vilket kan orsaka allergiska reaktioner. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Synrubbning
Synrubbning kan rapporteras vid systemisk och topisk användning av kortikosteroider. Om en patient inkommer med symtom, såsom dimsyn eller andra synrubbningar, ska patienten remitteras till en oftalmolog för utredning av möjliga orsaker. Dessa kan innefatta katarakt, glaukom eller sällsynta sjukdomar, såsom central serös korioretinopati (CSCR), som har rapporterats efter användning av systemiska och topiska kortikosteroider.
Interaktioner
Farmakokinetiska interaktioner
Beklometasondipropionat genomgår en mycket snabb metabolism via esterasenzym.
Beklometason är mindre beroende av CYP3A-metabolism än vissa andra kortikosteroider och interaktioner är i allmänhet osannolika. Risken för systemiska effekter vid samtidig användning av starka CYP3A-hämmare (t.ex. ritonavir, kobicistat) kan dock inte uteslutas, och därför rekommenderas försiktighet och lämplig övervakning vid samtidig användning med sådana läkemedel.
Farmakodynamiska interaktioner
Betablockerare (inklusive ögondroppar) ska undvikas hos astmapatienter. Om betablockare används i tvingande fall kommer effekten av formoterol att minska eller utebli helt.
Samtidig användning av andra beta-adrenerga läkemedel kan potentiellt ha additiva effekter och därför krävs försiktighet när teofyllin eller andra beta-adrenerga medel förskrivs samtidigt som formoterol.
Samtidig behandling med kinidin, disopyramid, prokainamid, fentiaziner, vissa antihistaminer (t.ex. terfenadin), monoaminoxidashämmare (MAO-hämmare) och tricykliska antidepressiva kan förlänga QTc-intervallet och öka risken för ventrikulära arytmier.
Dessutom kan levodopa, levotyroxin, oxytocin och alkohol orsaka nedsatt hjärttolerans för beta2-sympatomimetika.
Samtidig behandling med MAO-hämmare inklusive substanser med liknande effekter såsom furazolidon och prokarbazin kan leda till hypertensiva reaktioner.
Det finns en ökad risk för arytmier hos patienter som ges samtidig anestesi med halogenerade kolväten.
Samtidig behandling med xantin-derivat, steroider eller diuretika kan förstärka en möjlig risk för hypokalemisk effekt av beta2-agonister (se avsnitt Varningar och försiktighet). Hypokalemi kan öka benägenheten för hjärtarytmi hos patienter som behandlas med digitalisglykosider.
Fertilitet, graviditet och amning
Fertilitet
Det finns inga data avseende fertilitet hos människa. I djurstudier på råttor associerades höga doser av beklametasondipropionat i kombinationen med en försämrad fertilitet hos honor och embryotoxicitet (se avsnitt Prekliniska säkerhetsuppgifter).
Graviditet
Det finns inga kliniskt relevanta data från behandling med Innovair nexthaler hos gravida kvinnor. Djurstudier med beklametasondipropionat och formoterol i kombination har visat foster- och reproduktionstoxikologiska effekter efter hög systemisk exponering (se avsnitt Prekliniska säkerhetsuppgifter). Höga doser kortikosteroider som administreras till dräktiga djur är kända för att orsaka abnormaliteter i fosterutveckling inklusive gomspalt och intrauterin tillväxthämning. På grund av de tokolytiska effekterna av beta2-sympatomimetika ska särskild försiktighet utövas inför förlossning. Formoterol rekommenderas inte för användning under graviditet, särskilt inte i slutet av graviditeten eller under förlossningsarbetet såvida det inte finns något annat (säkrare) etablerat alternativ.
Innovair nexthaler ska endast användas under graviditet om den förväntade nyttan överväger tänkbara risker.
Amning
Det finns inga kliniskt relevanta data från behandling med Innovair nexthaler hos ammande kvinnor.
Även om djurdata saknas är det rimligt att förmoda att beklametasondipropionat, liksom andra kortikosteroider utsöndras i bröstmjölk.
Det är okänt om formoterol utsöndras i bröstmjölk hos människa, men det har påvisats i mjölk hos diande djur.
Innovair nexthaler ska endast användas under amning om den förväntade nyttan överväger de potentiella riskerna. Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med Innovair nexthaler efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Effekter på förmågan att framföra fordon och använda maskiner
Innovair nexthaler har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Den vanligaste biverkningen är tremor. I en klinisk studie på 12 veckor med Innovair nexthaler observerades tremor endast vid den högsta doseringen på 2 inhalationer 2 gånger dagligen och förekom mer frekvent vid behandlingsstart och med mild intensitet. Ingen patient avslutade studien på grund av tremor.
Erfarenheten från kliniska studier hos astmapatienter
Säkerheten av Innovair nexthaler bedömdes utifrån aktivt kontrollerade och placebokontrollerade kliniska studier med 719 patienter över 12 års ålder med astma av varierande allvarlighetsgrad som exponerades för läkemedel. Incidensen av biverkningarna härrör från astmapatienter över 12 års ålder och baseras på säkerhetsdata i två pivotala kliniska studier där Innovair nexthaler administrerades med dosrekommendationen i enlighet med denna produktresumé under en period på 8–12 veckor. Inga psykiska störningar observerades under de kliniska prövningarna med Innovair nexthaler men är inkluderade i tabellen nedan som en potentiell klasseffekt av inhalerade kortikosteroider.
Biverkningar relaterade till beklametasondipropionat och formoterol administrerade som en fast kombination (Innovair nexthaler) redovisas nedan enligt organklass. Frekvenserna definieras enligt: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (≤1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Organklass | Biverkning | Frekvens |
Infektioner och infestationer | Nasofaryngit | Mindre vanliga |
Oral candidainfektion | Mindre vanliga | |
Pneumoni (hos KOL-patienter) | Vanliga | |
Metabolism och nutrition | Hypertriglyceridemi | Mindre vanliga |
Psykiska störningar | Psykomotorisk hyperaktivitet, sömnstörningar, oro, depression, aggression, beteendestörningar (särskilt hos barn). | Ingen känd frekvens |
Ögon | Dimsyn (se även avsnitt Varningar och försiktighet) | Ingen känd frekvens |
Centrala och perifera nervsystemet | Tremor | Vanliga |
Huvudvärk | Mindre vanliga | |
Hjärtat | Takykardi | Mindre vanliga |
Sinusbradykardi | Mindre vanliga | |
Angina pectoris | Mindre vanliga | |
Myokardisk ischemi | Mindre vanliga | |
Andningsvägar, bröstkorg och mediastinum | Halsirritation, astmaexacerbationer | Mindre vanliga |
Dyspné | Mindre vanliga | |
Orofaryngeal smärta | Mindre vanliga | |
Dysfoni | Mindre vanliga | |
Hosta | Mindre vanliga | |
Magtarmkanalen | Illamående | Mindre vanliga |
Allmänna symtom och/eller symtom vid administreringsstället | Fatigue | Mindre vanliga |
Lättretlighet | Mindre vanliga | |
Undersökningar | Förlängt QT-intervall i EKG | Mindre vanliga |
Minskning av fritt kortisol i urin | Mindre vanliga | |
Minskning av kortisol i blodet | Mindre vanliga | |
Minskade kaliumnivåer i blodet | Mindre vanliga | |
Ökad blodglukosnivå | Mindre vanliga | |
EKG; svag R-vågsprogression | Mindre vanliga |
Av de observerade biverkningarna associeras formoterol typiskt med: tremor, huvudvärk, takykardi, sinusbradykardi, angina pectoris, myokardisk ischemi och förlängt QT-intervall.
Av de observerade biverkningarna associeras beklometasondipropionat typiskt med: nasofaryngit, oral candida, dysfoni, halsirritation, lättretlighet, minskning av fritt kortisol i urin, minskning av kortisol i blodet, ökad blodglukosnivå.
Ytterligare biverkningar som inte observerats kliniskt för Innovair nexthaler men som vanligen associeras med inhalerad administrering av beklometasondipropionat är andra orala svampinfektioner och pneumoni. Smakstörningar har ibland rapporterats vid behandling med inhalerade kortikosteroider.
Se avsnitt Varningar och försiktighet för försiktighetsmått för att minska uppkomsten av svampinfektion, oral candida och dysfoni.
Systemiska effekter av inhalerade kortikosteroider (t.ex. beklometasondipropionat) kan framför allt uppkomma vid höga doser förskrivna under längre perioder; dessa kan omfatta Cushings syndrom, Cushingliknande symtombild, binjuresuppression, minskad bentäthet, tillväxthämning hos barn och ungdomar, katarakt och glaukom (se även avsnitt Varningar och försiktighet).
Ytterligare biverkningar som inte observerats kliniskt för Innovair nexthaler i terapeutiska doser, men som vanligen associeras med administrering av beta2-agonister, såsom formoterol, är palpitationer, förmaksflimmer, ventrikulära extrasystoli, takykardarytmi, potentiellt allvarlig hypokalemi och ökning / minskning av blodtrycket. Insomni, yrsel, rastlöshet och oro har ibland rapporterats vid inhalationsbehandling med formoterol. Formoterol kan också inducera muskelkramper och myalgi.
Överkänslighetsreaktioner inklusive utslag, urtikaria, pruritus, erytem och ödem i ögon, ansikte, läppar och hals (angioödem) har även rapporterats.
Som vid annan inhalationsterapi kan paradoxal bronkospasm inträffa med ökad väsande andning, hosta och andnöd omedelbart efter dosering (se även avsnitt Varningar och försiktighet).
Pediatrisk population
Tillgängliga farmakokinetiska data stödjer inte säkerheten för Innovair nexthaler hos barn i åldern 5–11 år. Det finns begränsad klinisk information hos ungdomar i åldern 12–17 år (se avsnitt Dosering och administreringssätt, Farmakodynamiska egenskaper och Farmakokinetiska egenskaper). I en 12-veckors randomiserad klinisk studie hos vuxna och ungdomar fick 162 ungdomar i åldrarna 12–17 år med måttlig till svår astma Innovair nexthaler eller motsvarande inhalationsspray, 1 eller 2 inhalationer två gånger dagligen; frekvensen, typen och svårighetsgraden av biverkningar skiljde sig inte åt hos ungdomar jämfört med vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Den högsta rekommenderade dosen av Innovair nexthaler vid en enda administrering är 2 inhalationer. Fyra kumulativa inhalationer av Innovair nexthaler (totalt 400 mikrogram beklometasondipropionat, 24 mikrogram formoterol givet som en singeldos) har studerats hos astmapatienter. Den kumulativa behandlingen orsakade inte onormal, kliniskt relevant effekt på vitala tecken och ej heller svåra eller allvarliga biverkningar observerades (se även avsnitt Biverkningar).
Inhalerade doser på upp till tolv kumulativa doseringar (totalt 1200 mikrogram beklometasondipropionat och 72 mikrogram formoterol) av inhalationsspray har studerats hos astmatiska patienter. De kumulativa behandlingarna orsakade inte onormal effekt på vitala tecken och ej heller svåra eller allvarliga biverkningar observerades.
Överdriven dosering av formoterol kan leda till effekter som är typiska för beta2-adrenerga agonister: illamående, kräkningar, huvudvärk, tremor, somnolens, hjärtklappning, takykardi, ventrikulära arytmier, förlängning av QTc-intervallet, metabolisk acidos, hypokalemi, hyperglykemi.
Vid överdosering av formoterol är det indicerat med understödjande och symptomatisk behandling. Allvarliga fall ska läggas in på sjukhus. Användning av kardioselektiva betablockerare kan övervägas, men endast med extrem försiktighet eftersom användningen av betablockerande läkemedel kan ge upphov till bronkospasm. Serumkalium ska övervakas.
Akut inhalering med doser av beklometasondipropionat överstigande de rekommenderade kan leda till tillfällig supersession av binjurefunktionen. Detta kräver inte akuta åtgärder eftersom binjurefunktionen återhämtar sig inom några dagar vilket har verifierats med mätningar av plasmakortisol. Hos dessa patienter ska behandlingen fortsätta med en dos som är tillräcklig för att kontrollera astman.
Kronisk överdosering av inhalerad beklometasondipropionat: risk för suppression av binjurefunktion (se avsnitt Varningar och försiktighet.). Övervakning av binjurefunktionen kan vara nödvändigt. Behandlingen ska fortsätta i en dos som är tillräcklig för astmakontroll.
Enstaka supraterapeutiska doser upp till 800 mikrogram beklometasondipropionat, 48 mikrogram formoterol, administrerade som Innovair nexthaler är i allmänhet säkra och vältolererade.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Adrenergika, inhalationer: formoterol och övriga medel vid obstruktiva luftvägssjukdomar.
ATC-kod R03AK08.
Verkningsmekanism och farmakodynamisk effekt
Innovair nexthaler innehåller beklometasondipropionat och formoterol som pulver vilket resulterar i en extrafin aerosol med en genomsnittlig massmedian av aerodynamisk diameter (”MMAD”) på cirka 1,4–1,5 mikrometer och samdeposition av de två komponenterna. Aerosolpartiklarna i Innovair nexthaler är i genomsnitt mycket mindre än de partiklar som erhålls med icke-extrafina formuleringar.
I en studie med radioaktivt läkemedel, studerades depositionen hos vuxna astmapatienter, visade en hög andel av läkemedlet (uppskattad 42 % av den nominella dosen) deponeras i lungan, med en homogen deponering genom luftvägarna. Dessa karaktäristiska egenskaper stödjer användningen av en låg dos kortikosteroid med förbättrade lokala farmakodynamiska effekter, vilka har påvisats vara ekvivalenta med motsvarande inhalationsspray (se Klinisk erfarenhet).
Dessa två aktiva substanser i Innovair nexthaler har olika verkningsmekanism. I likhet med andra kombinationer av inhalationskortikosteroider och beta2-agonister har additiva effekter visats med avseende på reduktion av astmaexacerbationer.
Beklometasondipropionat
Beklometasondipropionat given som inhalation i rekommenderade doser har en glukokortikoid antiinflammatorisk effekt i lungorna, vilket resulterar i minskade astmasymtom och exacerbationer med färre biverkningar än vid systemisk administrering av kortikosteroider.
Formoterol
Formoterol är en selektiv beta2-agonist, som ger en avslappning av den glatta muskulaturen i bronkerna hos patienter med reversibel luftvägsobstruktion. Den bronkdilaterande effekten är snabb med ett effekttillslag inom 1–3 minuter efter inhalation och har en varaktighet om 12 timmar efter administrering av dos.
Klinisk erfarenhet
Effekten av de två komponenterna av Innovair nexthaler inhalationspulver har utvärderats i tre separata studier jämfört med 100 mikrogram/6 mikrogram inhalationsspray hos patienter med måttlig till svår persistent astma. Sammantaget förväntas effekten av de två inhalatorerna vara ekvivalent i klinisk praxis vid både 1 och 2 inhalationer två gånger dagligen.
I en studie var det primära målet att utvärdera av effekten av den inhalerade kortikosteroiden mätt på bronkdilatation (”predos FEV1”). En kliniskt signifikant förbättring av predos FEV1 sågs hos 696 patienter med måttlig till svår astma i slutet av en behandlingsperiod på 3 månader jämfört med utgångsvärdet, med 1 inhalation respektive 2 inhalationer två gånger dagligen av bägge formuleringarna. En genomsnittlig ökning (FEV1) med minst 250 ml observerades. Det fanns ingen relevant klinisk skillnad i predos FEV1 mellan Innovair nexthaler inhalationspulver och inhalationsspray vid endera doseringen. En signifikant dosrespons observerades för morgon-PEF. Statistisk signifikans för dosrespons i predos FEV1 nåddes inte. Astmakontroll mättes som symtompoäng som uppskattades varje morgon och kväll och med andelen dagar utan symtom, vilka signifikant förbättrades från utgångsvärdena till slutet av behandlingsperioden, särskilt för de två högre doserna av respektive formulering.
I den andra studien var det primära målet att utvärdera effekten av den långverkande beta2-agonisten i Innovair nexthaler. I denna studie uppmättes bronkdilatation vid början och upp till 12 timmar efter administrering av singeldoser genom spirometriska utvärderingar av FEV1 (FEV1 AUC över åtminstone 80 % av formoterols verkningstid). Jämfört med placebo förbättrade Innovair nexthaler givet som en inhalation samt fyra inhalationer av de båda aktiva substanserna signifikant FEV1 AUC0-12. Bägge doseringarna av Innovair nexthaler inhalationspulver var non-inferior i jämförelse med motsvarande dos av inhalationssprayen. En statistiskt signifikant dosrespons hittades med båda formuleringarna mellan den lägre respektive högre doseringen.
Den tredje studien hade en startperiod på 4 veckor med fast kombination av beklometasondipropionat/formoterol inhalationsspray, 1 inhalation två gånger dagligen till 755 patienter med stabil astma. Därefter randomiserades de vidare till en 8 veckors behandling där de fortsatte med samma produkt som under startperioden, Innovair inhalationspulver eller inhalationsspray som innehöll beklometasondipropionat 100 mikrogram per dos, alla givet som 1 inhalation två gånger dagligen. Den primära variabeln var förändringen från utgångsvärdet i genomsnittligt peak exspiratoriskt flöde på morgonen (PEF) över hela behandlingsperioden. Efter 8 veckors behandling var det ingen skillnad i det primära effektmåttet mellan de två kombinationsprodukterna, vilka båda var signifikant bättre än beklometasondipropionat i monoterapi. Inga skillnader noterades mellan de två kombinationsinhalatorerna mätt som symtom i ett frågeformulär på astmakontroll och antalet dagar som ej krävde behandling med snabbverkande läkemedel.
En öppen placebo-studie genomfördes för att verifiera att det inspiratoriska flödet genererat av patienten genom nexthaler-inhalatorn ej påverkades av patientens ålder, sjukdom respektive svårighetsgrad, så aktiveringen och läkemedelsleverans från inhalatorn kan uppnås hos alla patienter. Det primära effektmåttet var andelen patienter i respektive ålders- och sjukdomsgrupp som kunde aktivera inhalatorn. 89 patienter i åldersspannet 5–84 år inkluderades med måttlig och svår astma (FEV1 >60 % respektive ≤60 % av det förväntade) respektive patienter med måttlig respektive svår KOL (FEV1 ≥50 % och <50 % av det förväntade) deltog i studien. Alla patienter, oberoende av ålder, sjukdom respektive svårighetsgrad kunde generera tillräckligt inspiratoriskt flöde för att aktivera nexthaler-inhalatorn.
I ytterligare en öppen placebo-studie demonstrerades det genom att bedöma inspirationsprofilen för patienter med mild, måttlig eller svår KOL via Innovair nexthaler, att dessa oaktat funktionell begränsning kunde effektivt aktivera och använda inhalatorn.
Pediatrisk population
Det finns väldigt begränsade kliniska data för användningen av Innovair nexthaler hos barn i åldern 5–11 år. Administrering av en singeldos av en fast experimentell dosformulering innehållande samma extrafina aktiva innehållsämnen som Innovair nexthaler, men med en lägre styrka (50 µg BPD och 6 µg FF), i jämförelse med en ekvivalent dos av fri kombination med godkända produkter innehållande beklometasondipropionat (vattenfritt) (BDP) och formoterol (FF), resulterade i en märkbart högre systemisk biotillgänglighet för båda komponenterna (se avsnitt Farmakokinetiska egenskaper).
Den högre systemiska biotillgängligheten var associerad med en statistiskt signifikant minskning av kalium i plasma (punktskattning 0,94, 95 % KI [0,92; 0,96]) och ökning av tidsgenomsnittliga hjärtfrekvensen (punktskattning 1,06, 95 % KI [1,01;1,10]). Dessutom observerades en tendens av kortisolminskning och ökning av uringlukosvärden hos barn i testgruppen jämfört med referensbehandlingen.
Hos ungdomar erhölls endast begränsad information. I en 3-månaders randomiserad klinisk studie fick 162 försökspersoner i åldern 12–17 år med en diagnos av måttlig till svår astma antingen Innovair nexthaler eller motsvarande inhalationsspray, 1 eller 2 inhalationer två gånger dagligen. Förändringen i predos FEV1 var större hos ungdomar än hos vuxna vid behandlingens slut.
Se även avsnitt Dosering och administreringssätt, Biverkningar och Farmakokinetiska egenskaper för information om pediatrisk användning.
Farmakokinetiska egenskaper
Beklometasondipropionat
Beklometasondipropionat är en prodrug med svag glukokortikoidreceptorbindande affinitet som hydrolyseras via esterasenzym till en aktiv metabolit, beklometason-17-monopropionat, vilken har en kraftigare topikal antiinflammatorisk aktivitet jämfört med beklometasondipropionat som prodrug.
Absorption, distribution och metabolism
Inhalerat beklometasondipropionat absorberas snabbt via lungorna; före absorption sker en omfattande omvandling till dess aktiva metabolit beklometason-17-monopropionat via esterasenzym som finns i de flesta vävnader. Det systemiska upptaget av den aktiva metaboliten sker från lungorna och från gastrointestinal absorption av den svalda dosen. Biotillgängligheten av svalt beklometasondipropionat är emellertid försumbar, försystemisk omvandling till beklometason-17-monopropionat resulterar i att en del av dosen absorberas som aktiv metabolit.
Ökningen av systemisk exponering är ungefär linjär i förhållande till inhalerad dos.
Den absoluta biotillgängligheten efter inhalation från en inhalationsspray är ca 2 % respektive 62 % av den nominella dosen för oförändrat beklometasondipropionat respektive beklometason-17-monopropionat.
Efter intravenös administrering karakteriseras dispositionen av beklometasondipropionat och dess aktiva metabolit av hög plasmaclearance (150 respektive 120 l/h) med en liten distributionsvolym vid steady state för beklometasondipropionat (20 l) och högre vävnadsdistribution för den aktiva metaboliten (424 l). Metabolisk disposition av beklometasondipropionat resulterar huvudsakligen (82 %) i dess aktiva metabolit beklometason-17-monopropionat.
Plasmaproteinbindningen är medelhög (87 %).
Eliminering
Beklometasondipropionat elimineras huvudsakligen via faeces, till största delen som polära metaboliter. Den renala elimineringen av beklometasondipropionat och dess metaboliter är försumbar. De terminala halveringstiderna för eliminering är 0,5 h respektive 2,7 h för beklometasondipropionat respektive beklometason-17-monopropionat.
Särskilda patientgrupper
Farmakokinetiken för beklometasondipropionat hos patienter med nedsatt njur- eller leverfunktion har inte studerats; men eftersom beklometasondipropionat genomgår en mycket snabb metabolism via esterasenzym som finns i tarmvätska, serum, lungor och lever, varvid de mer polära produkterna beklometason-21-monopropionat, beklometason-17-monopropionat och beklometason bildas, förväntas inte nedsatt leverfunktion påverka farmakokinetiken och säkerhetsprofilen för beklometasondipropionat.
Eftersom beklometasondipropionat eller dess metaboliter inte har detekterats i urin, förväntas ingen ökning av systemisk exponering hos patienter med nedsatt njurfunktion.
Formoterol
Absorption och distribution
Efter inhalation absorberas formoterol från både lungor och magtarmkanal. Fraktionen inhalerad dos som sväljs efter administrering med dosinhalator kan variera mellan 60 % och 90 %. Minst 65 % av den svalda fraktionen absorberas från magtarmkanalen. Maximal plasmakoncentration av oförändrad substans inträffar inom 0,5–1 timme efter oral administrering. Plasmaproteinbindningen av formoterol är 61–64 % med 34 % bundet till albumin. Bindningsmättnad uppnåddes inte i det koncentrationsintervall som nåddes med terapeutiska doser. Halveringstiden för eliminering efter oral administrering är 2–3 timmar. Absorption av formoterol är linjär efter inhalation av 12–96 µg formoterolfumarat.
Metabolism
Formoterol metaboliseras till stor del och den viktigaste metaboliseringsvägen medför direkt konjugering vid fenol-hydroxyl-gruppen. Glukuronidsyrakonjugatet är inaktivt. En annan viktig metaboliseringsväg medför O-demetylering följt av konjugering av fenol-2’-hydroxylgruppen. Cytokrom P450-isoenzymen CYP2D6, CYP2C19 och CYP2C9 är involverade i O-demetyleringen av formoterol. Huvuddelen av metabolismen verkar ske i levern. Formoterol hämmar inte CYP450-enzym vid terapeutiskt relevanta koncentrationer.
Eliminering
Kumulativ renal utsöndring av formoterol efter en enstaka inhalation från pulverinhalator ökade linjärt i doseringsintervallet 12–96 µg. I genomsnitt utsöndrades 8 % respektive 25 % av dosen som oförändrad substans respektive total formoterol. Baserat på uppmätta plasmakoncentrationer hos 12 friska försökspersoner efter inhalation av en enstaka dos på 120 µg fastställdes den genomsnittliga halveringstiden för eliminering till 10 timmar. R,R- respektive S,S-enantiomererna representerade ca 40 % respektive 60 % av oförändrad substans i urinen. Det relativa förhållandet av de två enantiomererna förblev konstant för det studerade doseringsintervallet och det visades ingen relativ ackumulering av den ena eller andra enantiomeren efter upprepad dosering.
Efter oral administrering (40 till 80 µg) hos friska försökspersoner återfanns 6–10 % av dosen oförändrad i urin; upp till 8 % av dosen återfanns som glukuronid.
Totalt 67 % av en oral dos formoterol utsöndras i urin (huvudsakligen som metaboliter) och resten i faeces. Renalt clearance av formoterol är 150 ml/min.
Särskilda patientgrupper
Nedsatt lever-/njurfunktion: Formoterols farmakokinetik har inte studerats hos patienter med nedsatt lever- eller njurfunktion.
Pediatrisk population
I farmakokinetiska singeldosstudier hos astmatiska barn i åldrarna 5 till 11 år, jämfördes två pediatriska experimentella fastdos-formuleringar innehållande samma extrafina aktiva innehållsämnen som Innovair nexthaler, men med lägre dosstyrka (A: 50 µg BDP och 6 µg FF = 50/6; B: 35 µg BDP och 4 µg FF = 35/4), med ekvivalenta doser av fri kombination med produkter innehållande BDP och FF. På grund av avsaknad av block med aktivt kol användes endast systemisk exponering som mått på att fastställa säkerheten. Jämfört med den fria kombinationen resulterade BPD/FF 50/6 i en högre systemisk exponering (AUC0t) och högsta koncentrationen (Cmax) av alla tre analyterna, modersubstansen BDP, den aktiva metaboliten beklometason-17-monopropionat (B17MP) och formoterol. Efterföljande minskning av dosens styrka med 30 % till BPD/FF 35/4 resulterade fortfarande i påtagligt högre AUC0t av B17MP (punktskattning 152,5, 90 % KI [141,1 164,8]) och modersubstansen BPD (punktskattning 188,6, 90 % KI [163,8 217,1]). AUC0t för formoterol var inom och Cmax något över bioekvivalensintervallet 80–125 %.
Klinisk erfarenhet
Den systemiska exponeringen för beklometasondipropionat och formoterol i kombinationen har jämförts med de enskilda komponenterna. Det finns inga tecken på farmakokinetiska eller farmakodynamiska (systemiska) interaktioner mellan beklometasondipropionat och formoterol.
Farmakokinetiken för Innovair nexthaler inhalationspulver har jämförts med motsvarande inhalationsspray. Analysen av steroidkomponenten fokuserade på beklometason-17-monopropionat, som är den huvudsakliga aktiva metaboliten av beklometasondipropionat.
Systemisk absorption och metabolism av beklometasondipropionat var snabb och Cmax uppnåddes 5 min efter doseringen för bägge behandlingarna men var högre (+68 %) med Innovair nexthaler inhalationspulver. AUCt var ungefär 3 gånger högre efter inandning av Innovair nexthaler genom inhalatorn jämfört med inhalationssprayen. Den huvudsakliga aktiva metaboliten beklometason-17-monopropionat som representerar cirka 82 % av den totala blodnivån uppnådde Cmax i genomsnitt efter 30 min och 15 min med nexthaler och inhalationsprayen. Plasmakoncentrationen av beklometason-17-monopropionat var lägre (Cmax -49 % och AUCt -29 %) efter inhalation av inhalationspulvret än med inhalationssprayen. Efter inhalation av Innovair nexthaler uppnåddes toppkoncentrationen (Cmax) av formoterol inom 5 minuter och var högre (+ 47 %) för inhalationspulvret, medan den totala exponeringen (AUCt) var jämförbar i de båda behandlingar.
I en studie undersöktes den relativa depositionen i lungorna genom att använda en så kallad ”kolblockad” för att utesluta läkemedelsabsorption från magtarmkanalen samt genom att administrera referensprodukten (inhalationsspray) med en godkänd andningsbehållare (AeroChamber Plus®). I detta upplägg visade sig nexthaler och inhalationsspray vara ekvivalenta för AUCt för både beklometason-17-monopropionat och formoterol (förhållandet inhalationspulver/inhalationsspray, 90 % konfidensintervall var inom 80-125 %); Cmax av beklometason-17-monopropionat var emellertid lägre (-38 %) efter inhalation från nexthaler.
Prekliniska säkerhetsuppgifter
Gängse studier för de enskilda komponenterna i Innovair nexthaler avseende säkerhetsfarmakologi och allmäntoxicitet visade inte några särskilda risker för människa. Kombinationen har en toxicitetsprofil som liknar den för båda substanserna var för sig och ingen ökning av toxicitet eller oväntade fynd har observerats.
Reproduktionsstudier i råttor har visat dosberoende effekter. Närvaro av beklometasondipropionat i höga doser associerades med minskad fertilitet hos honråttor, implantationsförluster och embryofetal toxicitet. Det är känt att höga doser kortikosteroider till dräktiga djur kan ge upphov till missbildningar vid fosterutvecklingen, såsom gomspalt och intrauterin tillväxthämning, det är sannolikt att effekterna som visats med kombination av beklometasondipropionat/formoterol orsakats av beklometasondipropionat. Dessa effekter noterades endast vid hög systemisk exponering för den aktiva metaboliten beklometason-17-monopropionat (200 gånger den förväntade plasmanivån hos patienter). Vidare har förlängd gestation och förlossning visats i djurstudier, effekter som är associerade till den kända tokolytiska effekten av beta2-sympatomimetika. Dessa effekter noterades när formoterols plasmanivåer hos hondjuret var lägre än de som förväntas hos patienter behandlade med Innovair nexthaler.
Gentoxicitetsstudier utförda med kombinationen beklometasondipropionat/formoterol indikerar inte mutagen potential. Karcinogenicitetsstudier har inte utförts med den föreslagna kombinationen. Emellertid har djurdata för de individuella substanserna inte indikerat någon potentiell risk för karcinogenicitet hos människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Laktosmonohydrat (som innehåller små mängder mjölkprotein)
Magnesiumstearat
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Läkemedlet ska användas inom sex månader efter öppnandet av påsen.
Särskilda förvaringsanvisningar
Förvaras i originalförpackningen. Fuktkänsligt.
Ta inhalatorn ur foliepåsen strax före det första doseringstillfället.
Före öppnande av påsen:
Inga särskilda temperaturanvisningar.
Efter öppnande av påsen:
Förvaras vid högst 25 °C.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
INNOVAIR NEXTHALER inhalaatiojauhe
100/6 mikrog/annos (L:kyllä) 120 annosta (40,19 €), 3 x 120 annosta (113,68 €)
PF-selosteen tieto
Varje förpackning innehåller 1, 2 eller 3 nexthaler-inhalatorer, fyllda med antingen 1,50 g eller 2,22 g inhalationspulver för att ge 120 inhalationer respektive 180 inhalationer. Varje inhalator återfinns i en värmeförseglad skyddspåse (folieförpackning) tillverkad av PET/Al/PE eller PA/Al/PE.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innovair nexthaler är en multidosinhalator. Inhalatorn består av en nedre del med ett fönster som visar antalet kvarvarande doser, samt ett integrerat skyddslock. När skyddslocket öppnas blottas munstycket genom vilket läkemedlet inhaleras. Öppnandet av skyddslocket driver även dosräknaren. Den nedre delen och munstycket är gjorda av akrylnitrilbutadienstyren och skyddslocket är tillverkat av polypropen.
Läkemedlets utseende:
Multidosinhalatorn innehåller ett vitt eller nästan vitt pulver.
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
INNOVAIR NEXTHALER inhalaatiojauhe
100/6 mikrog/annos 120 annosta, 3 x 120 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
Atc-kod
R03AK08
Datum för översyn av produktresumén
01.09.2022
Yhteystiedot
Klara Norra Kyrkogata 34
111 22 Stockholm
Sverige
(+46) 8 753 35 20
www.chiesi.fi
infonordic@chiesi.com